Спосіб кількісного визначення суми флаваноїдів у хмелі
Номер патенту: 116419
Опубліковано: 25.05.2017
Автори: Чередниченко Єлизавета Всеволодівна, Бельтюкова Світлана Вадимівна, Теслюк Ольга Іванівна
Формула / Реферат
Спосіб кількісного визначення суми флавоноїдів у хмелі, що включає відбір проби, екстракцію органічним розчинником, взаємодію проби з хімічними реагентами у розчині і вимірювання аналітичного сигналу, який відрізняється тим, що пробу піддають взаємодії з іонами прію (IIІ) і цитрат-іонами в присутності бичачого сироваткового альбуміну, буферного розчину гексаметилентетраміну 40 %-вого.
Текст
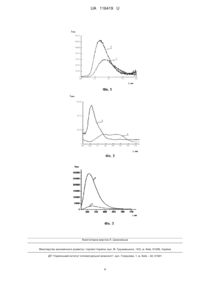
Реферат: Спосіб кількісного визначення суми флавоноїдів у хмелі включає відбір проби, екстракцію органічним розчинником, взаємодію проби з хімічними реагентами у розчині і вимірювання аналітичного сигналу. Крім цього пробу піддають взаємодії з іонами прію (IIІ) і цитрат-іонами в присутності бичачого сироваткового альбуміну, буферного розчину гексаметилентетраміну 40 %-вого. UA 116419 U (12) UA 116419 U UA 116419 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до аналітичної хімії, зокрема до способу визначення суми флавоноїдів у хмелі. Відомий спосіб кількісного визначення фенольних сполук в лікарській сировині методом високоефективної рідинної хроматографії [Р. Венетис, И. Радушене, В. Якштас, В. Янулис, Г. Пуоджюнене, А. Милашюс. Количественное определение фенольних соединений в лекарственном сырье тысячелистника обыкновенного методом ВЭЖХ // Химикофармацевтический журнал. - 2008. - Т. 42, № 3. - С. 51-54]. Спосіб включає використання хроматографічної системи Waters 2690 Alliance з УФ/ВИД детектором і детектором на діодній матриці. Хроматографічне розділення проводять на колонці Ascetis RP-Amide, крім того застосовують передколонку. Розділення проводять методом зворотно-фазової ВЕРХ. Ідентифікацію піків проводять, порівнюючи час утримання піків досліджуваних і стандартних зразків. Кількісне визначення проводять із застосуванням методу зовнішнього стандарту, використовуючи градуювальні графіки. Однак, цей спосіб потребує складного апаратурного оформлення та наявності дорогих стандартних зразків складу. Найбільш близьким до корисної моделі, що заявляється, є спосіб кількісного визначення суми флавоноїдів в екстрактах з рослинної сировини [Лобанова A.А., Будаева В.В. Сакович Г.В. Исследование биологически активных флавоноидов в экстрактах из растительного сырья // Химия растит, сырья. - 2004. - №1. - С. 47-52]. Спосіб заснований на вимірюванні оптичної щільності розчинів комплексів флавоноїдів з хлоридом алюмінію в водно-етанольних розчинах. Визначення проводять наступним чином. У мірну колбу місткістю 25 мл, попередньо зважену, переносять за допомогою піпетки аліквоту аналізованого екстракту, рівну 1 мл, і знову зважують. У колбу за допомогою піпетки додають 4 мл 5 % розчину хлориду алюмінію. Дію приготування розчину порівняння в другу колбу місткістю 25 мл за допомогою піпетки переносять аліквоту (1 мл) аналізованого екстракту, після чого об'єм обох колб доводять до мітки 60 % спиртом і залишають на 30 хв. У разі помутніння розчинів їх фільтрують через паперові фільтри в чисті склянки. Оптичну густину вимірюють в інтервалі 408-616 нм на довжині хвилі максимуму поглинання в кюветах з товщиною поглинаючого шару 1 см, в робочу кювету поміщають розчин з доданим хлоридом алюмінію, в кювету порівняння - розчин порівняння. Якщо максимум поглинання розташований в області 408-420 нм, як стандарт використовують ДСЗ рутину. Для побудови калібрувального графіка залежності оптичної щільності від кількості рутину в розчині точну наважку ДСЗ рутину близько 0,05 г кількісно переносять в мірну колбу місткістю 50 мл, додають 40 мл 60 % водного спирту, нагрівають до 50-60 °C до розчинення рутину, потім охолоджують до кімнатної температури і доводять до мітки 60 % етиловим спиртом. Для приготування комплексу з хлоридом алюмінію в мірні колби А і Б місткістю 25 мл переносять по аліквоті розчину рутину і обробляють аналогічно зазначеному вище, отримуючи при цьому розчин з комплексом і розчин порівняння. Вимірюють оптичну щільність при довжині хвилі 415 нм в кюветі з товщиною поглинаючого шару 1 см; в робочу кювету поміщають розчин А, в кювету порівняння - розчин Б. Калібрувальний графік залежності оптичної щільності (D) від кількості рутину в розчині, що аналізують, має вигляд прямої лінії, що проходить через початок координат. Масову частку суми Р-активних флавоноїдів в досліджуваних екстрактах розраховують в перерахунку на рутин. Аналогічно проводять визначення при розташуванні максимуму поглинання в області 421435 нм. Як стандартний зразок використовують ДСЗ кверцетину. Це рішення вибрано прототипом. Прототип і корисна модель, що заявляється, мають такі спільні операції: 1) відбір проби; 2) екстракція органічним розчинником; 3) взаємодія проби з хімічними реагентами у розчині; 4) вимірювання аналітичного сигналу. Однак, спосіб за прототипом має суттєві недоліки. 1) Визначення проводять по градуювальному графіку, який необхідно будувати щодня, що значно збільшує час проведення аналізу та витрату реактивів. 2) Розчини для побудови градуювального графіку та розчини, що аналізуються, готують в 60 %-му етанолі. 3) Як розчини порівняння використовують дві стандартні речовини - рутин і кверцетин в залежності від максимумів поглинання комплексів розчинів, що аналізуються (λmax=408-420 нм та λmax=421-431 нм відповідно). Все це ускладнює виконання аналізу. 1 UA 116419 U 5 10 15 20 25 30 35 40 45 50 55 60 В основу корисної моделі поставлено задачу розробити спосіб кількісного визначення суми флавоноїдів у хмелі, в якому, за рахунок застосування реакції взаємодії флавоноїдів з іонами ітрію (III), цитрат-іонами в присутності бичачого сироваткового альбуміну, забезпечити спрощення аналізу, скорочення часу проведення аналізу і зниження межі визначення фенольних сполук. Поставлена задача вирішена тим, що в способі кількісного визначення суми флавоноїдів у хмелі, що включає відбір проби, екстракцію флавоноїдів органічним розчинником, взаємодію флавоноїдів з хімічними реагентами у розчині і вимір аналітичного сигналу, згідно з корисною моделлю, флавоноїди піддають взаємодії з іонами ітрію (IIІ) і з цитрат-іонами в присутності бичачого сироваткового альбуміну і буферного розчину гексаметилентетраміну 40 %-вого. Причинно-наслідковий зв'язок між сукупністю ознак, що заявляються, та технічним результатом полягає в наступному. Спрощення і скорочення часу виконання аналізу стало можливим завдяки наступним прийомам: 1) використанню власної люмінесценції флавоноїдів, посиленої при комплексоутворюванні з іонами ітрію і цитрат-іонами в присутності бичачого сироваткового альбуміну і гексаметилентетраміну; 2) використання люмінесцентних властивостей різнолігандних комплексів флавоноїдів з іонами ітрію і цитрат-іонами в присутності бичачого сироваткового альбуміну дозволило: а) знизити межу виявлення через те, що чутливість люмінесцентної реакції вища, ніж спектрофотометричної; б) використати як стандарт одну речовину - рутин, так як максимуми люмінесценції комплексів флавоноїдів і рутину з іонами ітрію (III), цитрат-іонами в присутності БСА однакові; в) використати водні розчини аналітичних форм, тому що максимальна Ілюм. комплексів флавоноїдів спостерігається у водних розчинах. Водні розчини флавоноїдів при опроміненні УФ-світлом проявляють дуже слабкі люмінесцентні властивості, які при комплексоутворюванні з іонами ітрію значно зростають за рахунок того, що збільшується жорсткість молекули і зменшуються внутрішньо молекулярні втрати енергії збудження. Як поліфенольний стандарт, згідно з літературними даними [Алексеева М.А., Эллер КМ., Арзамасцев А.П. Определение полифенольных компонентов хмеля с помощью обращеннофазовой ВЭЖХ // Хим.-фарм. журн. - 2004. - Т. 38, № 12. - С. 39-41.], використовували рутин, за допомогою якого були вибрані оптимальні умови проведення аналізу. Інтенсивність люмінесценції рутину, так само як і флавоноїдів, в розчині невелика, вона зростає при комлексоутворюванні з іонами ітрію (III). Експериментально встановлено, що в присутності цитрат-іонів Ілюм комплексу Y(ІІІ)-рутин значно зростає. Спектр люмінесценції комплексу Y (III) рутин має максимум при випр. = 570 нм (Фіг. 1), в присутності цитрату натрію Ілюм комплексу Y(III)-рутин зростає та максимум люмінесценції зсувається в короткохвильову область спектра (випр. = 522 нм), що може свідчити про утворення різнолігандного комплексу. Полідентатний ліганд - цитрат-іон - координується іоном Y(III) по карбоксильній та гідроксильній групам, що призводить до витіснення молекул води з внутрішньої сфери комплексу і, як наслідок, до збільшення Ілюм. Утворення різнолігандного комплексу в розчині підтверджується й спектрами збудження. В спектрі збудження комплексу в присутності цитрат-іону спостерігається одна інтенсивна смуга з збудж. = 280 нм, в той час як в спектрі збудження комплексу Y(III)-рутин є широка, розмита смуга в області 290-380 нм з максимумами при випр. 315 нм і 355 нм (Фіг. 2). Інтенсивність люмінесценції комплексу також збільшується на порядок в присутності бичачого сироваткового альбуміну (БСА), який належить до глобулярних білків (Фіг. 3). Можна припустити, що в даному випадку відбувається солюбілізація рутину в мікрофазу глобулярного білка за рахунок електростатичних та гідрофобних взаємодій, що обумовлює екранізацію флуорофору від гасіння молекулами води, що знижує безвипромінювальні втрати енергії. При цьому характер спектрів збудження та люмінесценції не змінюється, збільшується тільки їх інтенсивність, максимуми смуг не зміщуються та не розщеплюються, що може бути доказом того, що молекули БСА не входять у внутрішню сферу комплексу. Максимальна Ілюм. комплексу Y(III)-рутин-цитрат в присутності БСА спостерігається при рН 6,5-7,5, що створювали в розчині за допомогою гексаметилентетраміну. Експериментально . -3 встановлено, що найбільша Ілюм. спостерігається при концентрації Y(III) - 5 10 моль/л, рутину . -3 . -3 5 10 моль/л, цитрату - 2 10 моль/л. Дані концентрації реагентів були використані для подальших досліджень. Показано, що етанольні розчини флавоноїдів, отримані екстракцією за методикою [Алексеева М.А., Эллер К.И., Арзамасцев АЛ. Определение полифенольных компонентов хмеля с помощью обращенно-фазовой ВЭЖХ // Хим.-фарм. журн. - 2004. - Т. 38, 2 UA 116419 U 5 10 15 20 25 30 № 12. - С. 39-41.], взаємодіють подібно рутину з іонами ітрію (III), цитрат-іонами, їх інтенсивність збільшується в присутності БСА. Лінійна залежність інтенсивності люмінесценції комплексу від концентрації рутину, який використовують як стандартну речовину, спостерігається в діапазоні концентрацій рутину 0,030,95 мкг/мл. Визначення суми флавоноїдів проводили у гранульованому хмелі. Спосіб ілюструється графічними матеріалами, де: фіг. 1 - спектр люмінесценції комплексу Yt - рутин у відсутності (1) та у присутності (2) цитрат-іонів; фіг. 2 - спектр збудження комплекса Y(III) - рутин (1) та Y(DI) - рутин-цитрат (2); фіг. 3 - спектр люмінесценції комплексу Yt-рутин-цитрат у відсутності (1) та в присутності (2) БСА. Приклад 1. Визначення суми флавоноїдів у хмелі сорту Strisselspalt. Флавоноїди екстрагували з молотого хмелю (1г) кип'ятінням в етанолі (45 мл) зі зворотним холодильником протягом 60 хвилин. Надосадову рідину зливали у мірну колбу ємністю 100 мл і екстракцію в етанолі (45 мл) повторювали знову протягом 30 хвилин. Об'єднану суміш охолоджували, фільтрували, етиловим спиртом доводили об'єм до 100 мл. Отримані етанольні екстракти флавоноїдів перед аналізом попередньо розбавляли в 2 рази етанолом. У три пробірки поміщали по 0,1 мл . -2 розбавленого розчину, що аналізують, по 0,1 мл розчину цитрату натрію з концентрацією 1 10 . моль/л, у дві з них додавали по 0,1 та 0,1 мл стандартного розчину рутину з концентрацією 1 10 3 . моль/л. Далі в усі три пробірки додавали по 0,5 мл розчину хлориду ітрію з концентрацією 1 10 2 моль/л, по 1 мл 1 %-го розчину БСА, по 0,1 мл уротропіну 40 %-го. Розчини доводили до 10 мл дистильованою водою, змішували, залишали на 20 хвилин та реєстрували Ілюм. при =522 нм. Концентрацію флавоноїдів розраховували за методом добавок. Результати визначення флавоноїдів у хмелі гранульованому сорту Strisselspalt (Франція) приведені в таблиці 1. Отримані результати перевірені методом "введено-знайдено" та спектрофотометричним методом з АІСІ3 [Беликов В.В. Методы анализа флавоноидньїх соединений // Фармация. -1970. - №1. - С. 68.] (табл. 1 i 2). Приклад 2 здійснювали аналогічно прикладу 1, але у хмелі сорту Hersbrucker Spat (Німеччина). Результати наведеш в таблиці 2. Таблиця 1 Результати визначення суми флавоноїдів (мг/мл) у хмелі гранульованому Slrisselspalt методом "введено-знайдено" Введено 0,00 0,02 0,03 Знайдено 0,045 0,063 0,074 Sr 0,052 0,043 0,047 Таблиця 2 Результати визначення суми флавоноїдів (мг/г) у хмелі гранульованому (n=5; Р = 0,95) № зразка 1 2 Зразок хмелю Strisselspalt Hersbrucker Spat Люмінесцентний метод, що пропонується вміст флавоноїдів Sr 4,57 0,052 4,19 0,046 Спектрофотометричний метод вміст флавоноїдів 4,15 4,48 Sr 0,047 0,043 35 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 Спосіб кількісного визначення суми флавоноїдів у хмелі, що включає відбір проби, екстракцію органічним розчинником, взаємодію проби з хімічними реагентами у розчині і вимірювання аналітичного сигналу, який відрізняється тим, що пробу піддають взаємодії з іонами прію (IIІ) і цитрат-іонами в присутності бичачого сироваткового альбуміну, буферного розчину гексаметилентетраміну 40 %-вого. 3 UA 116419 U Комп’ютерна верстка Л. Ціхановська Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 21/78, G01N 21/75
Мітки: хмелі, визначення, спосіб, флаваноїдів, кількісного, суми
Код посилання
<a href="https://ua.patents.su/6-116419-sposib-kilkisnogo-viznachennya-sumi-flavanodiv-u-khmeli.html" target="_blank" rel="follow" title="База патентів України">Спосіб кількісного визначення суми флаваноїдів у хмелі</a>
Попередній патент: Пристрій для контролю ресурсу комутаційних апаратів
Наступний патент: Композиція інгредієнтів для виробництва зеленого горіхового соусу
Випадковий патент: Пристрій для волого-теплової обробки швейних виробів