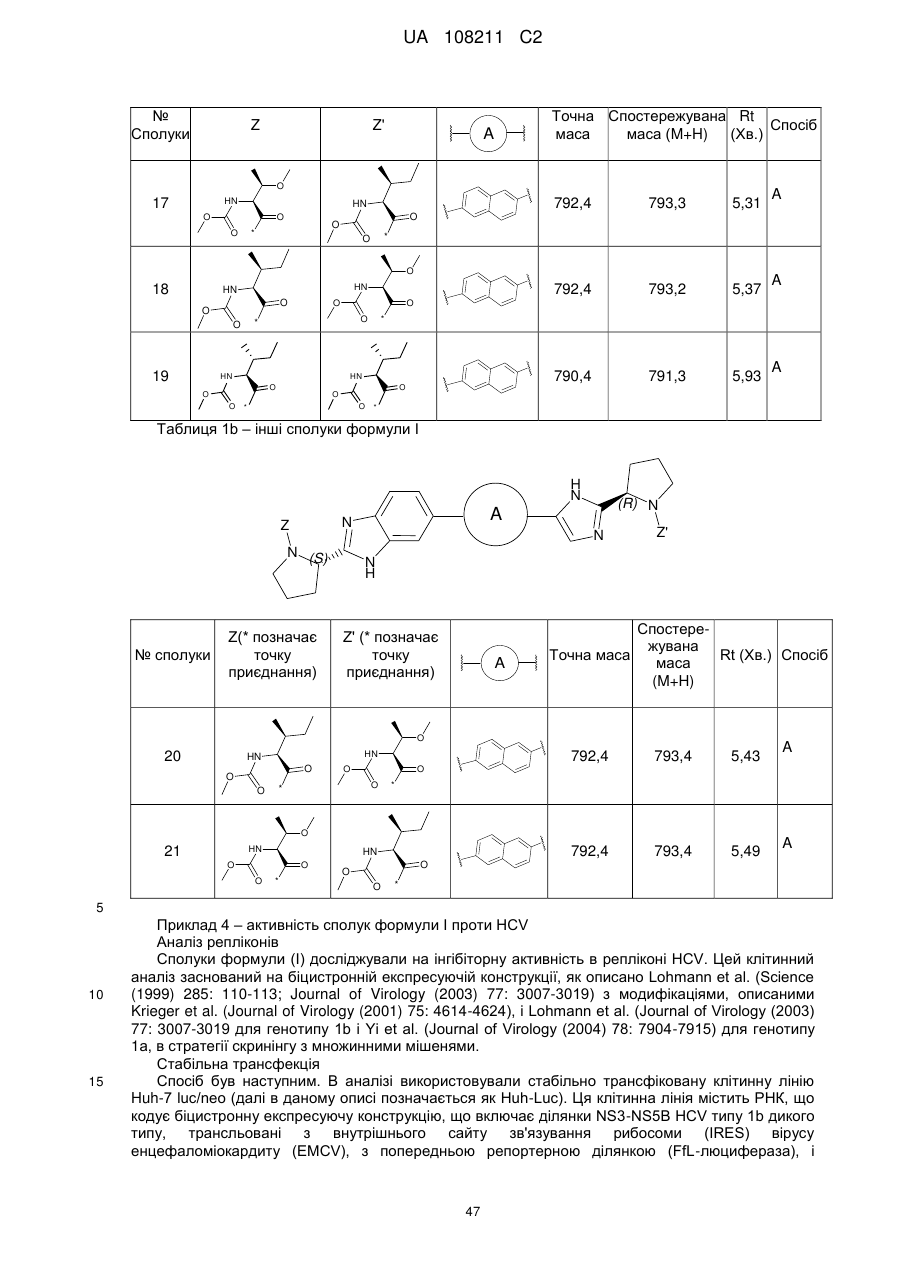
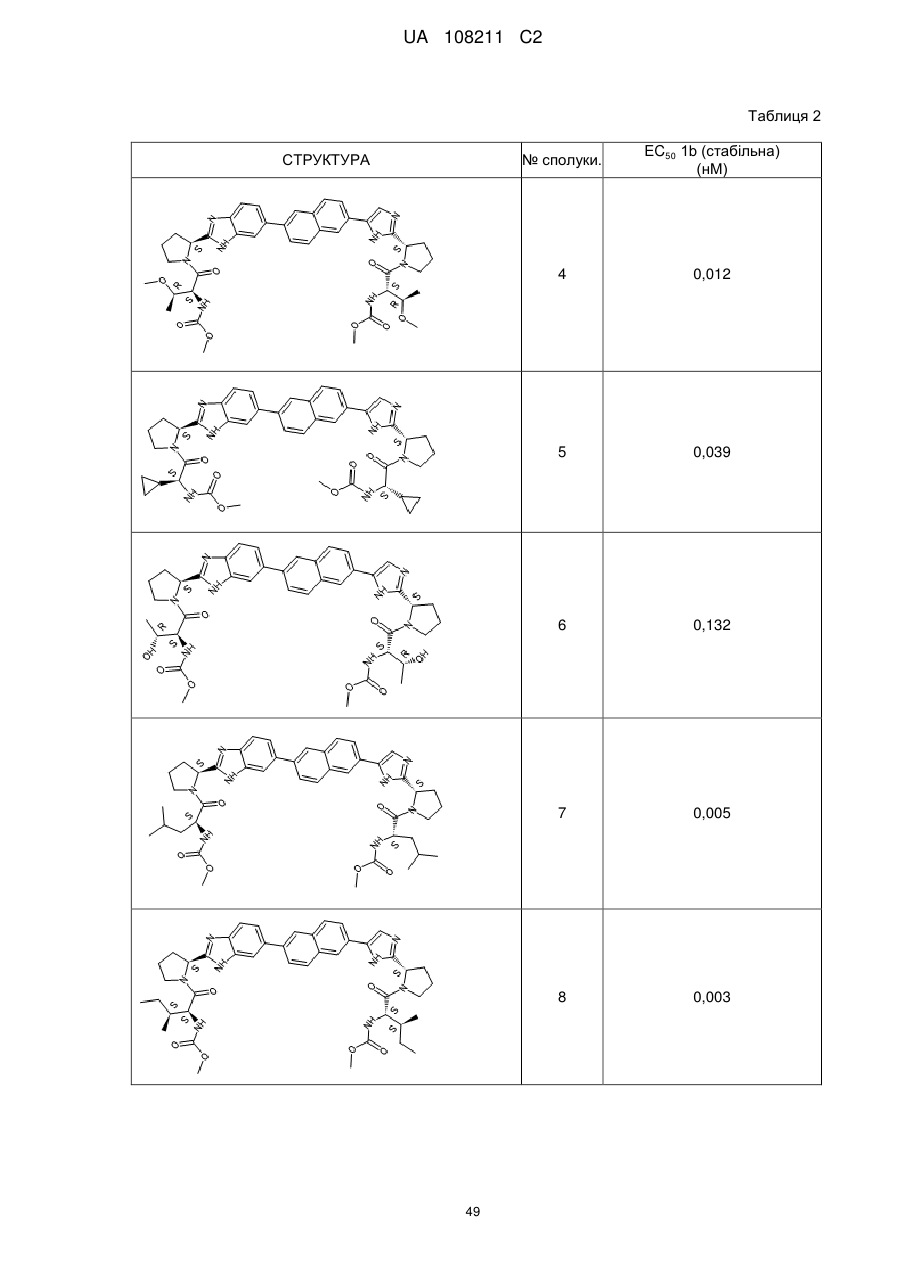
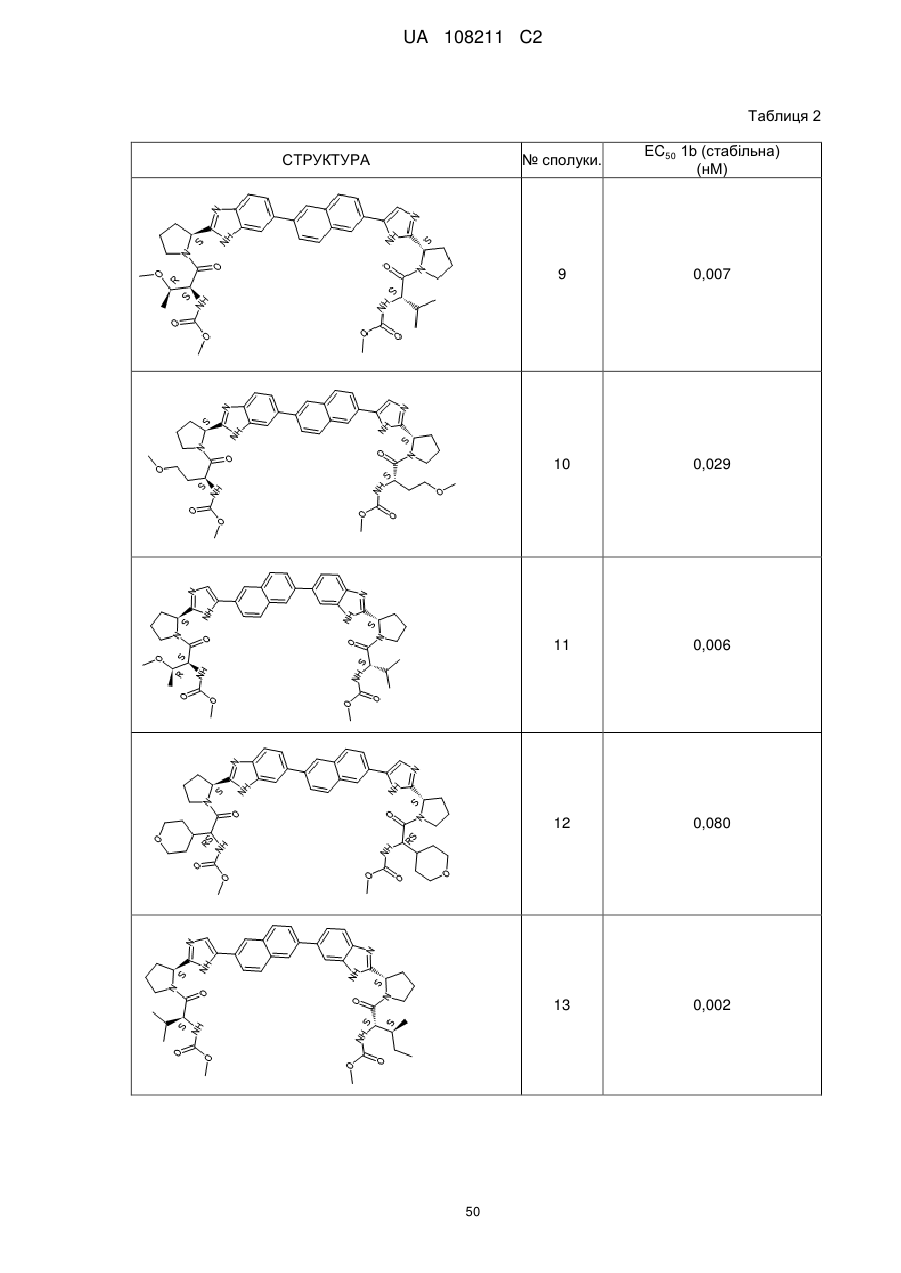
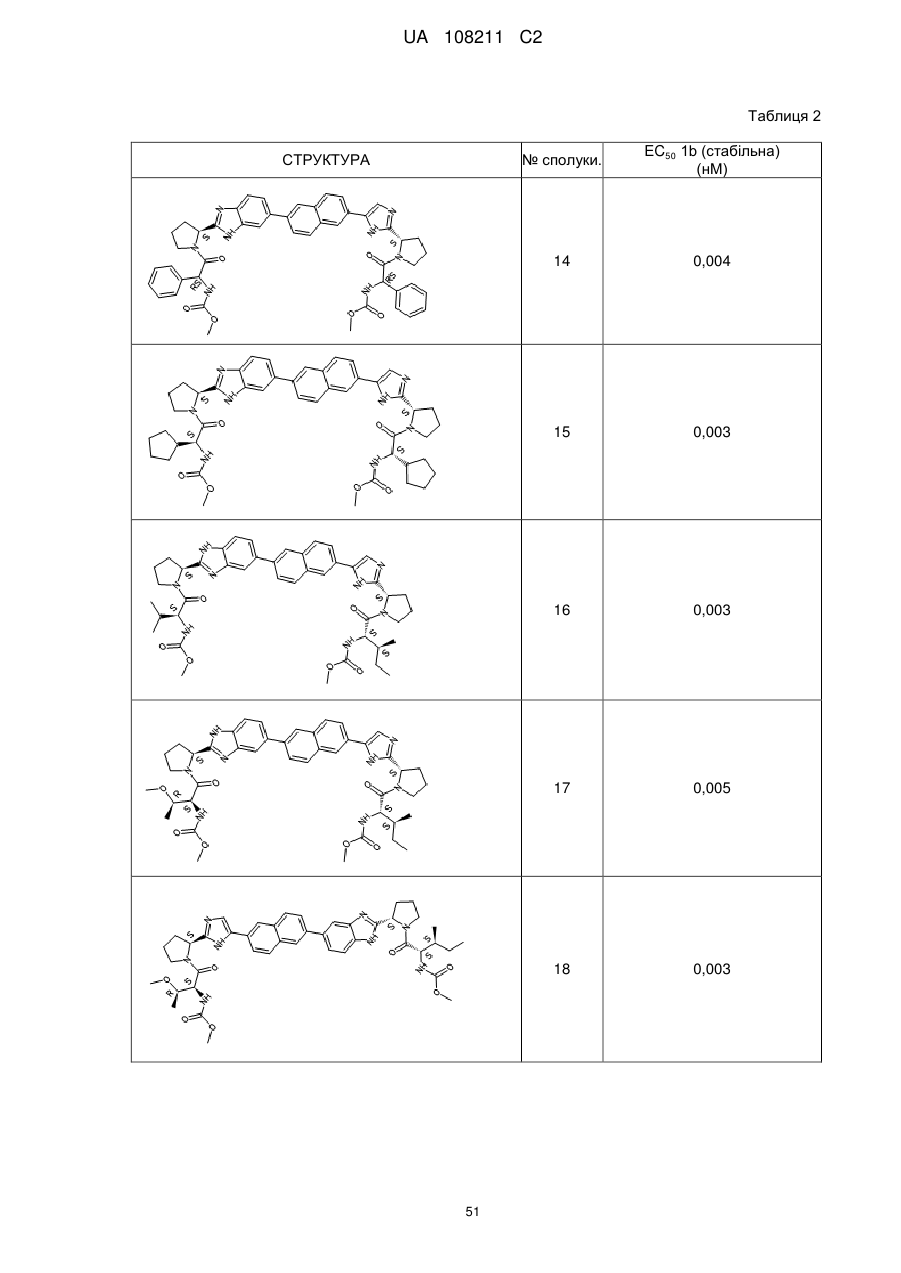
Бензімідазолімідазольні похідні
Номер патенту: 108211
Опубліковано: 10.04.2015
Автори: Вандік Кун, Ласт Стефаан Жюльєн, Хупіс Іоанніс Ніколаос, Рабуассон П'єр Жан-Марі Бернар
Формула / Реферат
1. Сполука формули І
 I
I
або її стереоізомерна форма, де:
А є феніленом або нафтиленом, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або С1-3алкілу;
кожен з R і R' незалежно є -CR1R2R3, арилом, гетероарилом або гетероС4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де
R1 є воднем;
С1-4алкілом, необов'язково заміщеним метокси, гідрокси або диметиламіно;
фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, С1-4алкокси і трифторметокси;
1,3-бензодіоксоланілом;
бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси;
С3-6циклоалкілом;
гетероарилом;
гетероС4-6циклоалкілом або
гетероарилметилом;
R2 є воднем, гідроксилом, аміно, моно- або ді-С1-4алкіламіно, С1-4алкілкарбоніламіно, С1-4алкілоксикарбоніламіно, С1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом;
R3 є воднем;
або R1 і R3 разом утворюють оксогрупу або циклопропільну групу;
або R2 і R3 утворюють оксо;
або її фармацевтично прийнятна сіль або сольват.
2. Сполука за п. 1 де:
R1 є воднем;
С1-4алкілом, необов'язково заміщеним метокси або диметиламіно;
фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, С1-4алкокси і трифторметокси;
1,3-бензодіоксоланілом;
бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси;
С3-6циклоалкілом;
гетероарилом;
гетероС4-6циклоалкілом або
гетероарилметилом.
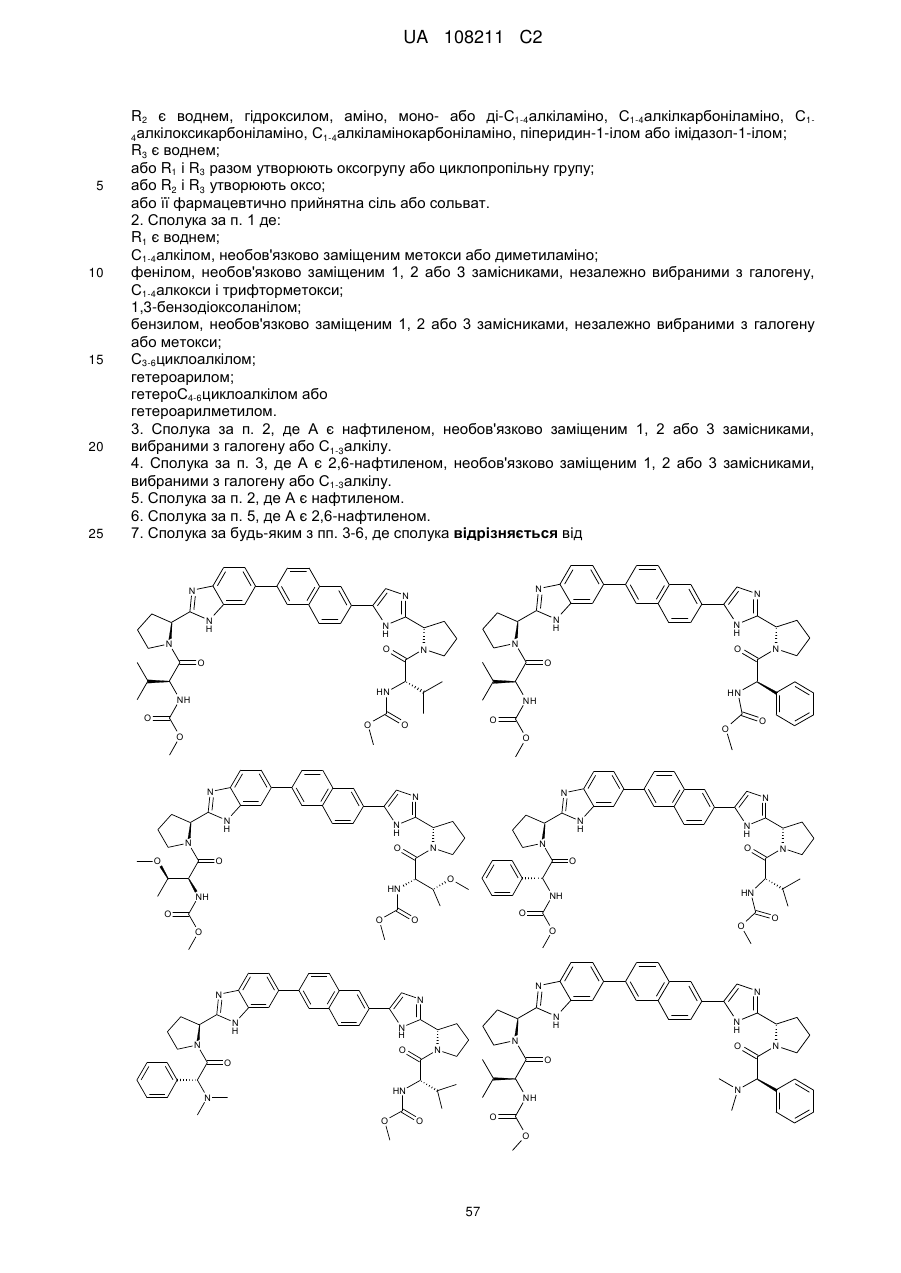
3. Сполука за п. 2, де А є нафтиленом, необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або С1-3алкілу.
4. Сполука за п. 3, де А є 2,6-нафтиленом, необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або С1-3алкілу.
5. Сполука за п. 2, де А є нафтиленом.
6. Сполука за п. 5, де А є 2,6-нафтиленом.
7. Сполука за будь-яким з пп. 3-6, де сполука відрізняється від






8. Сполука за будь-яким з пп. 3-6, де R1 відрізняється від незаміщеного 2-пропілу, і, коли R1 в R є 1-метоксіетилом, то R1 в R' відрізняється від 1-метоксіетилу.
9. Сполука за будь-яким з пп. 3-6, де
R1 відрізняється від 2-пропілу, коли R2 є метоксикарбоніламіно; і
R1 в R' відрізняється від 1-метоксіетилу, коли R2 в R' є метоксикарбоніламіно.
10. Сполука за будь-яким з пп. 1-9, де R і R' відрізняються один від одного.
11. Сполука за будь-яким з пп. 1-9, де R і R' є однаковими.
12. Сполука за будь-яким з пп. 1-11, де кожен з R і R' незалежно є -CR1R2R3.
13. Сполука за п. 12, де кожен R2 незалежно є С1-4алкілкарбоніламіно або С1-4алкілоксикарбоніламіно.
14. Сполука за п. 12, де кожен R2 незалежно є метоксикарбоніламіно.
15. Сполука за будь-яким з пп. 12-14, де кожен R1 незалежно вибраний з розгалуженого С3-4алкілу, метоксіС2-3алкілу, циклопентилу або фенілу.
16. Сполука за будь-яким з пп. 12-14, де R1 в R є 1-метилпропілом, 2-метилпропілом, 2-метоксіетилом, циклопентилом або фенілом; і R1 в R' є 1-метилетилом, 1-метилпропілом, 2-метилпропілом, 1-метоксіетилом, циклопентилом або фенілом.
17. Сполука за будь-яким з пп. 12-16, де обидва атома вуглецю в R і R', що несуть замісник R1, R2 і R3, мають S-конфігурацію.
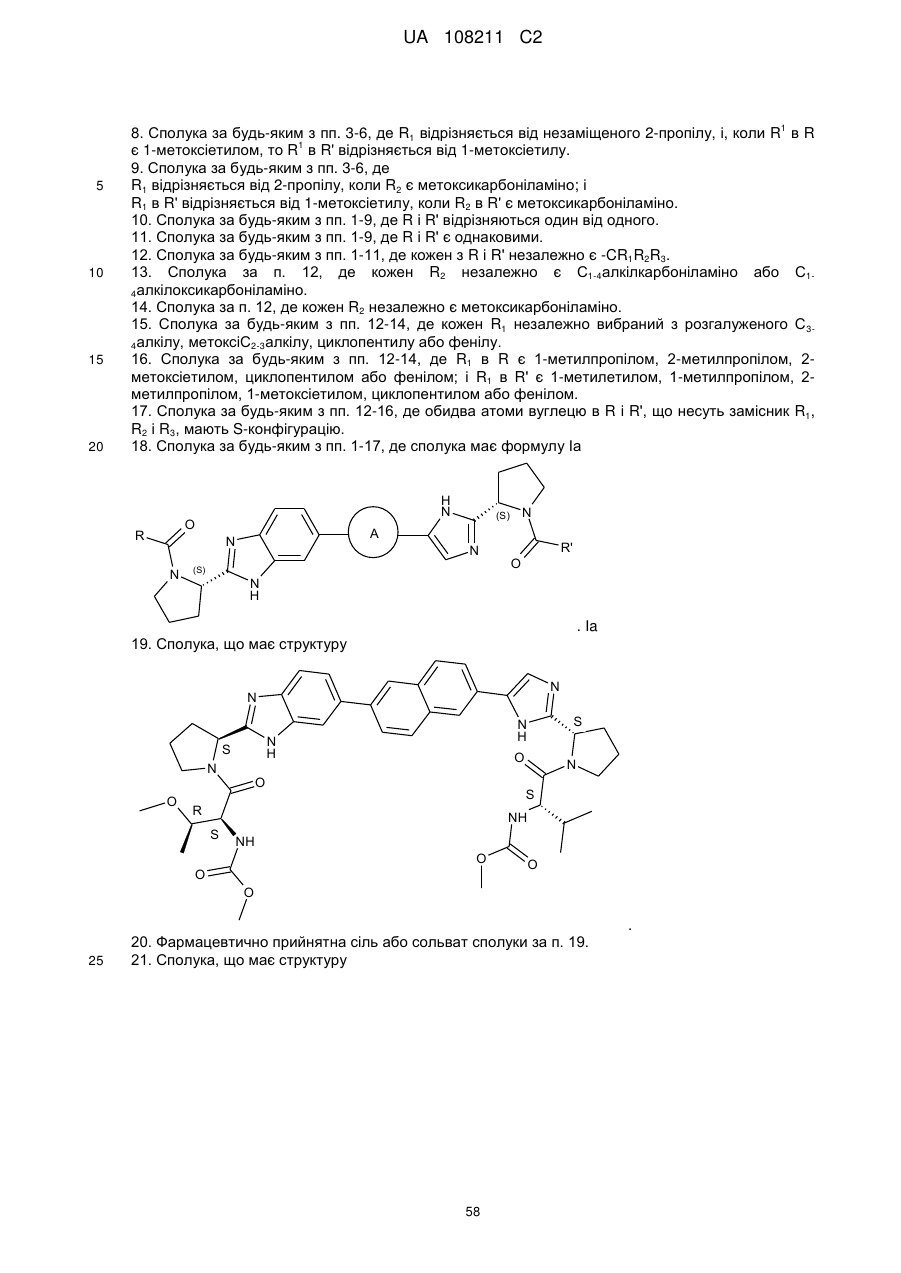
18. Сполука за будь-яким з пп. 1-17, де сполука має формулу Іа
 . Іa
. Іa
19. Сполука, що має структуру
 .
.
20. Фармацевтично прийнятна сіль або сольват сполуки за п. 19.
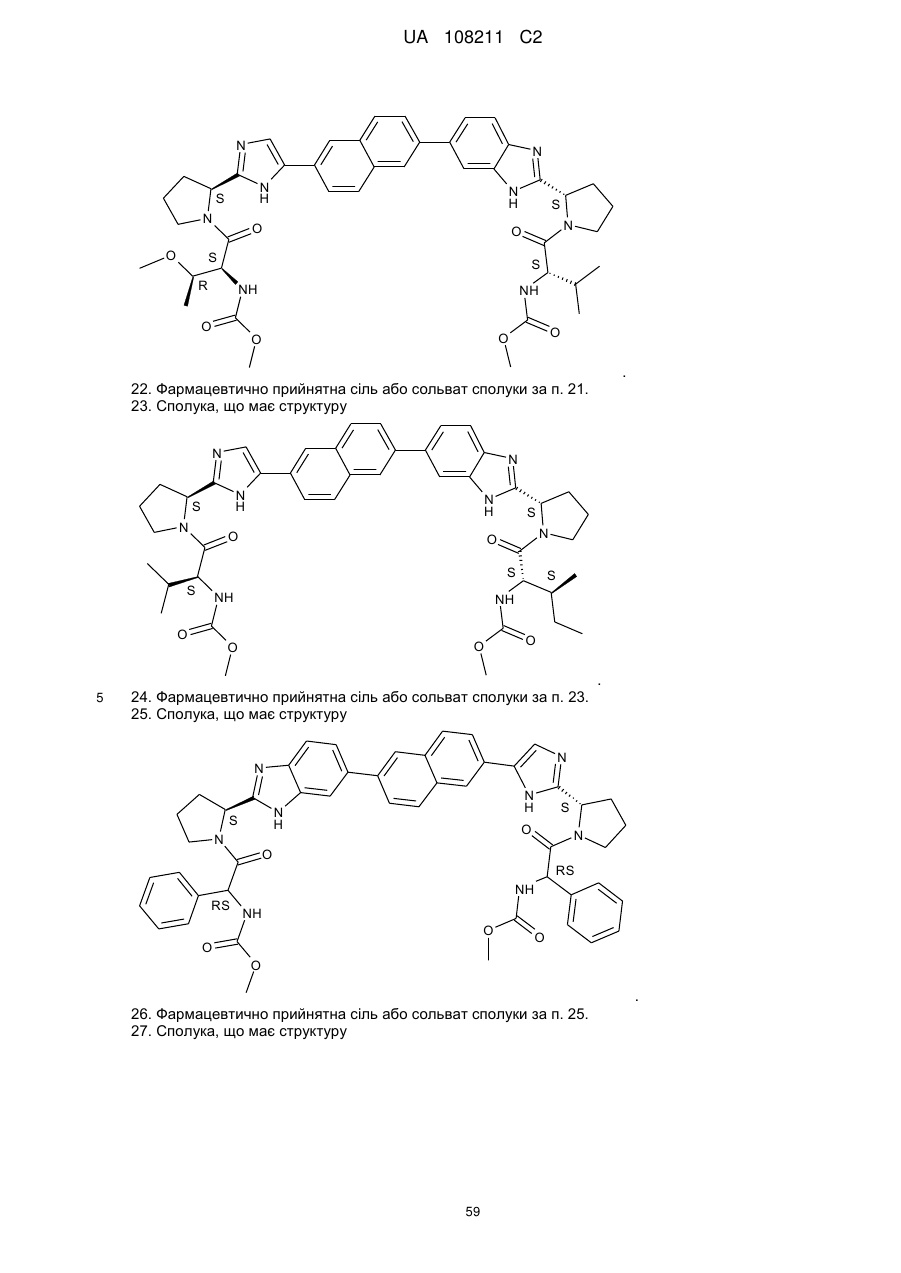
21. Сполука, що має структуру
 .
.
22. Фармацевтично прийнятна сіль або сольват сполуки за п. 21.
23. Сполука, що має структуру
 .
.
24. Фармацевтично прийнятна сіль або сольват сполуки за п. 23.
25. Сполука, що має структуру
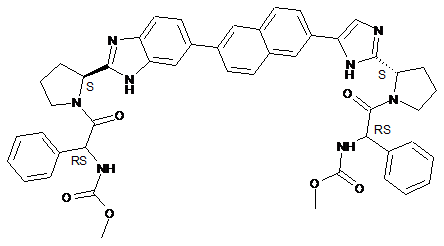 .
.
26. Фармацевтично прийнятна сіль або сольват сполуки за п. 25.
27. Сполука, що має структуру
 .
.
28. Фармацевтично прийнятна сіль або сольват сполуки за п. 27.
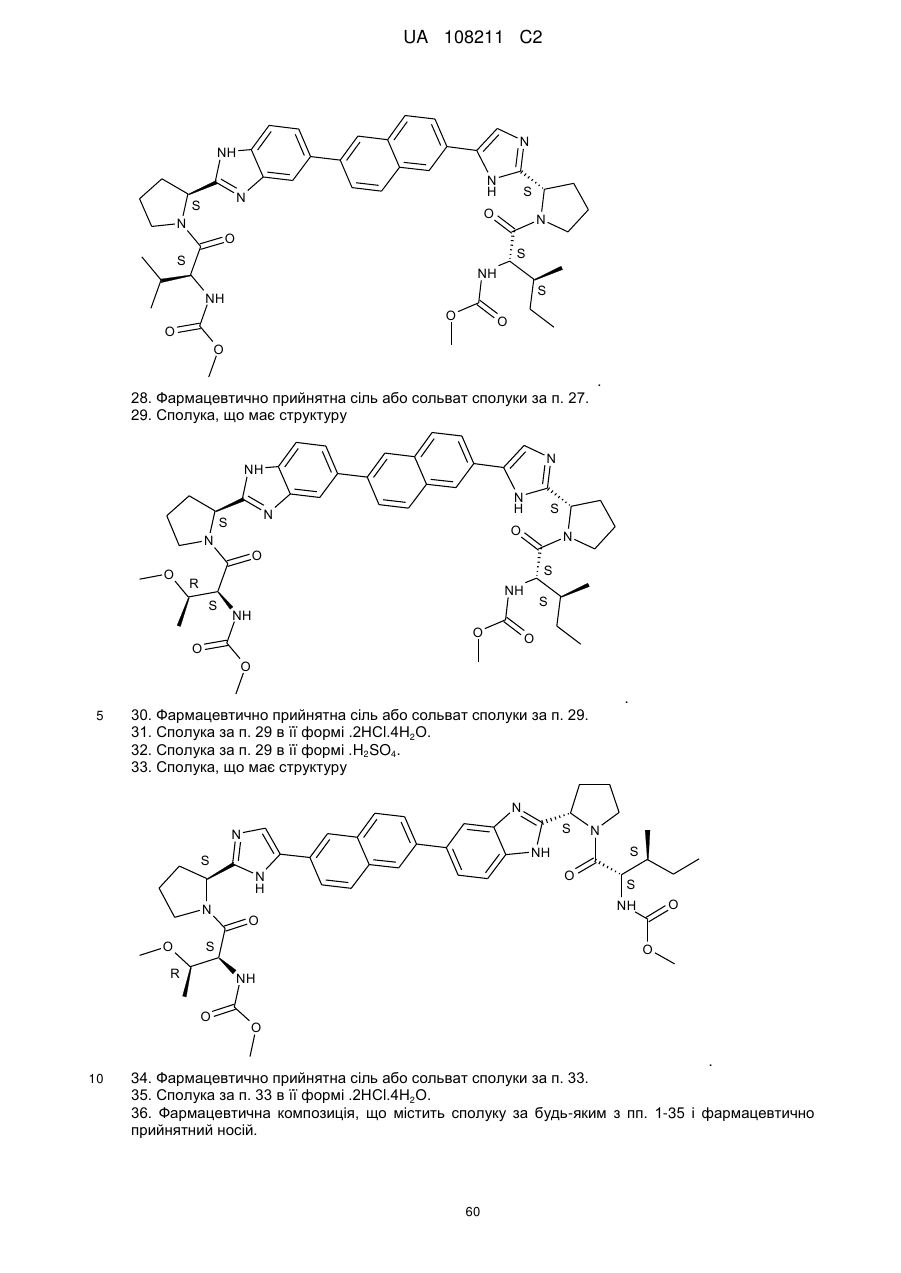
29. Сполука, що має структуру
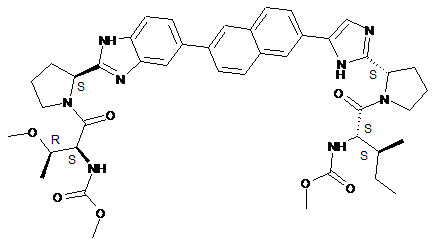 .
.
30. Фармацевтично прийнятна сіль або сольват сполуки за п. 29.
31. Сполука за п. 29 в її формі .2НСl.4Н2О.
32. Сполука за п. 29 в її формі .H2SO4.
33. Сполука, що має структуру
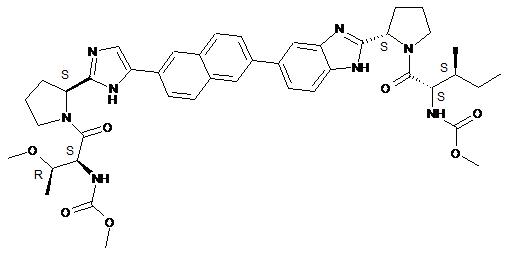 .
.
34. Фармацевтично прийнятна сіль або сольват сполуки за п. 33.
35. Сполука за п. 33 в її формі .2НСl.4Н2О.
36. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-35 і фармацевтично прийнятний носій.
37. Сполука за будь-яким з пп. 1-35 або фармацевтична композиція за п. 36 для застосування для профілактики або лікування інфекції HCV у ссавця.
38. Продукт, що містить (а) сполуку, як визначено в будь-якому з пп. 1-35, і (b) інший інгібітор HCV, як комбінований препарат для одночасного, окремого або послідовного застосування для лікування інфекцій HCV.
39. Продукт за п. 38, де інший інгібітор HCV є інгібітором протеази HCV.
40. Продукт за п. 39, де інгібітор протеази HCV вибраний з групи, що складається з телепревіру (VX-950), боцепревіру (SCH-503034), нарлапревіру (SCH-900518), ITMN-191 (R-7227), ТМС435350 (ТМС435), МK-7009, ВІ-201335, ВІ-2061 (цилупревір), BMS-650032, АСH-1625, АСП-1095, GS 9256, VX-985, 1DX-375 (інгібітор кофактора протеази HCV NS4A), VX-500, VX-813, РНХ-1766, РНХ2054, IDX-136, IDX-316, АВТ-450, ЕР-013420 (і споріднені сполуки) і VBY-376.
41. Продукт за п. 39, де інгібітор протеази HCV вибраний з групи, що складається з ТМС435350 (ТМС435), МK-7009 або ITMN-191 (R-7227).
42. Продукт за п. 38, де інший інгібітор HCV є нуклеозидним або ненуклеозидним інгібітором полімерази НCV.
43. Продукт за п. 42, де інгібітор полімерази HCV вибраний з групи, що складається з R7128, PSI-7851, PSI 7977, IDX-189, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938, PSI-879, HCV-796, HCV-371, VCH-759, VCН-916, VCH-222, ANA-598, МK-3281, АВТ-333, АВТ-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728, GL-60667, АВТ-072, AZD-2795 і 16,16-діоксиду 13-циклогексил-3-метокси-17,23-диметил-7Н-10,6-(метаноімінотіоіміноетаноксіетанімінометан)індол[2,1-а][2]бензазепін-14,24-діону.
44. Продукт за п. 42, де інгібітор полімерази HCV є PSI-6130 або його проліками.
45. Продукт за п. 42, де інгібітор полімерази HCV є
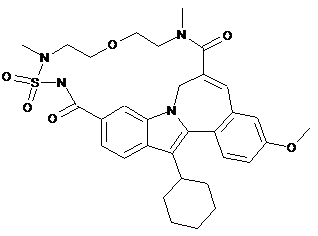
або його фармацевтично прийнятною сіллю або сольватом.
46. Продукт, що містить (а) сполуку за будь-яким з пп. 1-35, і (b) імуномодулюючий засіб, як комбінований препарат для одночасного, окремого або послідовного застосування при лікуванні інфекцій HCV.
Текст
Реферат: Запропоновані інгібітори реплікації HCV формули (І), що включають його стереохімічно ізомерні форми, солі і сольвати, де кожен з R і R' незалежно є -CR1R2R3, арилом, гетероарилом або гетероС4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу. Також даний винахід стосується способу отримання вказаних сполук, фармацевтичних композицій, що містять їх, і їх застосування в терапії HCV. R O N A N N H H N N N O R' UA 108211 C2 (12) UA 108211 C2 UA 108211 C2 5 10 15 20 25 Область техніки Цей винахід відноситься до бензімідазол-імідазольних похідних, які є інгібіторами вірусу гепатиту C (HCV), їх синтезу і їх застосуванню для лікування або профілактики HCV. Рівень техніки HCV є одноланцюговим позитивним РНК-вірусом, що відноситься до родини вірусів Flaviviridae роду hepacivirus. Геном вірусу транслюється в єдину відкриту рамку зчитування, яка кодує безліч структурних і неструктурних білків. Білок NS5A HCV розташований нижче білка NS4B і вище білка NS5B. Після посттрансляційного розщеплення вірусною сериновою протеазою NS3/4A, NS5A дозріває в цинковмісний фосфопротеїн з трьох доменів, який існує або у вигляді гіпофосфорильованої (56кДа, p56), або гіперфосфорильованої форми (58-кДа, p58). NS5A HCV залучений до безлічі аспектів життєвого циклу вірусу, включаючи реплікацію вірусу і збірку інфекційних частинок, а також модуляцію оточуючого середовища його клітини-господаря. Хоча цьому білку не приписується ферментативна функція, описано, що він взаємодіє з багаточисельними вірусними і клітинними факторами. У ряді патентів і патентних заявок описані сполуки з інгібуючою активністю відносно HCV, зокрема, націлені на NS5A. В WO2006/133326 описані похідні стилбену, а в WO2008/021927, WO2008/021928, WO2009102325 та WO2009/102318 описані біфенільні похідні, що володіють активністю інгібування NS5A HCV. В US2009/0202483 описані сполучені містковим зв'язком біфенільні похідні. В WO2008/048589 описані похідні 4-(фенілетиніл)-1H-піразолу і їх противірусне застосування. В WO2008/070447 описано широкий діапазон інгібуючих HCV сполук, що включають бензімідазольну частину. В WO2010/065668, WO2010/065674 та WO2010/065681 описані бензімідазол-імідазольні похідні в якості інгібіторів HCV NS5A. Наприклад, сполуки, що мають наступну структуру і номер хімічної реферативної служби, описані в таблиці 1 WO2010/065674: Таблиця A Номер хімічної реферативної служби (CAS), назва CAS і ідентифікаційний номер в WO 2010/065674 Структура WO2010/065674 N CAS 1242087-93-9 - Сполука 174 Метиловий ефір N-[(1S)-1-[[(2S)-2-[5-[6[2-[(2S)-1-[(2S)-2[(метоксикарбоніл)аміно]-3-метил-1оксобутил]-2-піролідиніл]-1Hбензімідазол-6-іл]-2-нафталеніл]-1Hімідазол-2-іл]-1-піролідиніл]карбоніл]-2метилпропіл]карбамінової кислоти N N H N H N O N O HN NH O O O O N N H N H N O O CAS 1242087-95-1 - сполука 176 Метиловий ефір N-[(1S, 2R)-2-метокси1-[[(2S)-2-[5-[6-[2-[(2S)-1-[(2S, 3R)-3метокси-2-[(метоксикарбоніл)аміно]-1оксобутил]-2-піролідиніл]-1Hбензімідазол-6-іл]-2-нафталеніл]-1Hімідазол-2-іл]-1піролідиніл]карбоніл]пропіл] карбамінової кислоти N N O O HN NH O O O O 1 UA 108211 C2 N CAS 1228552-40-6 - сполука 177 Метиловий ефір N-[(1S)-1-[[(2S)-2-[5-[6[2-[(2S)-1-[(2R)-2-(диметиламіно)-2фенілацетил]-2-піролідиніл]-1Hбензімідазол-6-іл]-2-нафталеніл]-1Hімідазол-2-іл]-1-піролідиніл]карбоніл]-2метилпропіл]карбамінової кислоти N N H N H N O N O HN N O O N N N H N H N O Сполука 179 N O HN NH O O O O N N N H N H N O Сполука 181 N O NH O O HN N CAS 1228552-49-5 - сполука 182 Метиловий ефір N-[(1S)-1-[[(2S)-2-[6-[6[2-[(2S)-1-[(2R)-2-(диметиламіно)-2фенілацетил]-2-піролідиніл]-1Hімідазол-5-іл]-2-нафталеніл]-1Hбензімідазол-2-іл]-1піролідиніл]карбоніл]-2метилпропіл]карбамінової кислоти N N H N O O N H O N O NH N O O 5 10 15 Після первинної гострої інфекції у більшості інфікованих індивідів розвивається хронічний гепатит, оскільки HCV реплікується переважно в гепатоцитах, але не є безпосередньо цитопатичним. Зокрема, відсутність інтенсивної Т-лімфоцитарної відповіді і висока здатність вірусу до мутацій, певно, забезпечують високий рівень хронічної інфекції. Хронічний гепатит може прогресувати в печінковий фіброз, що призводить до цирозу, захворювання печінки кінцевої стадії, і в HCC (печінково-клітинну карциному), що робить його основною причиною трансплантацій печінки. Існує шість основних генотипів HCV і більше 50 підтипів, які географічно розподілені порізному. HCV 1 типу є переважаючим генотипом в Європі і США. Виражена генетична гетерогенність HCV має високе діагностичне і клінічне значення, що є можливим поясненням труднощів у розробці вакцини і відсутності відповіді на сучасну терапію. HCV може передаватися через контакт із зараженою кров'ю або продуктами крові, наприклад після переливання крові або внутрішньовенного вживання наркотиків. Впровадження діагностичних тестів, які використовують для скринінгу крові, викликало тенденцію до зниження зустрічальності посттрансфузійного зараження HCV. Проте, враховуючи повільний прогрес в захворювання печінки кінцевої стадії, існуючі інфекції будуть залишатися серйозною медичною і економічною проблемою протягом десятиліть. 2 UA 108211 C2 5 10 15 20 Сучасні способи лікування HCV засновані на (пегильованому) інтерфероні-альфа (IFN-α) в поєднанні з рибавірином. Така комбінована терапія призводить до сповільненої вірусологічної відповіді більш ніж у 40 % пацієнтів, інфікованих вірусами 1 генотипу і приблизно у 80 % пацієнтів, інфікованих 2 і 3 генотипами. Окрім обмеженої ефективності відносно HCV 1 типу, така комбінована терапія має значні побічні ефекти, включаючи грипоподібні симптоми, гематологічні порушення і нейропсихіатричні симптоми. Таким чином, для подолання недоліків сучасної терапії HCV, таких як побічні ефекти, обмежена ефективність, виникнення стійкості і недотримання пацієнтом режиму лікування, а також для покращення відповіді у вигляді постійного вірусного навантаження, існує необхідність в більш ефективних, більш зручних і таких що краще переносяться способах лікування. Даний винахід відноситься до групи бензімідазол-імідазольних похідних, здатних інгібувати цикл реплікації HCV. Сполуки за винаходом також є привабливими унаслідок того факту, що вони демонструють більш високу ефективність інгібування циклу реплікації HCV в порівнянні з їх здатністю інгібувати реплікацію ВІЛ. ВІЛ-інфіковані пацієнти часто страждають від коінфекцій, таких як HCV. Лікування таких пацієнтів інгібітором HCV, який також інгібує ВІЛ, може призвести до небажаної появи стійких до ВІЛ штамів. Опис винаходу В одному аспекті даний винахід відноситься до сполук, які можуть бути представлені формулою I: R O A N N H N N N O N H R' (I) 25 30 35 40 45 або їх стереоізомерних форм, де: A є феніленом або нафталіном, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; кожен з R і R' незалежно є –CR1R2R3, арилом, гетероарилом або гетероC4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси, гідрокси або диметиламіно; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; R3 є воднем або R1 і R3 разом утворюють оксогруппу або циклопропільну групу; або їх фармацевтично прийнятних солей та/або сольватів. В іншому аспекті даний винахід відноситься до сполук, які можуть бути представлені наступними сполуками формули (I-PR): R O N A N N H H N N N O R' (I-PR) 3 UA 108211 C2 5 10 15 20 25 або їх стереоізомерних форм, де: A є феніленом або нафталіном, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; кожен з R і R' незалежно є –CR1R2R3, арилом, гетероарилом або гетероC4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси або диметиламіно; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C1алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; 4 R3 є воднем або R1 і R3 разом утворюють оксогруппу або циклопропільну групу; або їх фармацевтично прийнятних солей та/або сольватів. В іншому аспекті даний винахід відноситься до сполук, які можуть бути представлені формулою (I-COR): R O N A N N H H N N N O R' (I-COR) 30 35 40 45 50 і їх стереоізомерних форм, де: A є феніленом або нафталіном, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; кожен з R і R' незалежно є CR1R2R3, арилом, гетероарилом або гетероC 4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси, гідрокси або диметиламіно; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; R3 є воднем або R1 і R3 разом утворюють циклопропільну групу; або R2 і R3 утворюють оксо; і їх фармацевтично прийнятних солей і сольватів. В іншому аспекті даний винахід відноситься до сполук, які можуть бути представлені формулою (I-PR-COR): 4 UA 108211 C2 R O A N N H N N N N H R' O (I-PR-COR) 5 10 15 20 25 або їх стереоізомерних форм, де: A є феніленом або нафталіном, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; кожен з R і R' є незалежно, –CR1R2R3, арилом, гетероарилом або гетероC4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси або диметиламіно; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; R3 є воднем або R1 і R3 разом утворюють циклопропільну групу; або R2 і R3 утворюють оксо; і їх фармацевтично прийнятних солей і сольватів. В іншому аспекті даний винахід відноситься до сполук, які можуть бути представлені наступними сполуками формули (I-PR): R O N A N N H H N N N O R' (I-PR) 30 35 40 45 або їх стереоізомерних форм, де: A є феніленом або нафталіном, кожен з яких може бути необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; кожен з R і R' незалежно є –CR1R2R3, арилом, гетероарилом або гетероC4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси або диметиламіно; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; 5 UA 108211 C2 5 10 15 20 25 30 35 40 R3 є воднем або R1 і R3 разом утворюють оксогруппу або циклопропільну групу; або їх фармацевтично прийнятних солей та/або сольватів; за умови, що сполука відрізняється від будь-якої з 6 сполук, приведених в таблиці A. Коли використовується в рамках даного винаходу, термін "сполуки формули I", "дані сполуки", "сполуки за даним винаходом" або підгрупи сполук формули (I), такі як підгрупи, визначені в даному описі за допомогою різних варіантів здійснення, а також "сполуки формули (I-PR)", "сполуки формули (I-COR)", "сполуки формули (I PR-COR)" або схожі терміни, включають сполуки формули I або кожну з підгрупу, включаючи можливі стереоізомерні форми, і їх фармацевтично прийнятні солі і сольвати, якщо немає інших вказівок. В наступному аспекті винахід відноситься до застосування сполук формули I або їх підгруп, як вказано в даному описі, для інгібування циклу реплікації HCV. Альтернативно передбачено застосування вказаних сполук для виготовлення лікарського засобу для інгібування циклу реплікації HCV. Варіанти здійснення даного винаходу відносяться до сполук формули (I) або будь-якої їх підгрупи, як визначено в даному описі за допомогою різних варіантів здійснення, де може застосовуватися одне або декілька визначень для A, R, R', R 1, R2 і R3, як описано в даному описі. Варіант здійснення даного винаходу відноситься до сполук формули I, або будь-якої їх підгрупи, де R і R' незалежно є –CR1R2R3 або необов'язково заміщеним 5-членним гетероарилом; зокрема, де R і R' незалежно є -CR1R2R3; конкретніше, де R і R' є -CR1R2R3 і є однаковими; альтернативно R і R' є -CR1R2R3 і відрізняються. Інший варіант здійснення даного винаходу відноситься до сполук формули I, або будь-якої їх підгрупи, де R2 є гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно або C14алкілоксикарбоніламіно; зокрема, R2 є C1-4алкілкарбоніламіно або C1-4алкілоксикарбоніламіно; або, R2 є C1-4алкілоксикарбоніламіно. Конкретніше, R2 є метоксикарбоніламіно. Інший варіант здійснення даного винаходу відноситься до сполук формули I або будь-якої їх підгрупи, де R1 вибраний з C1-4алкілу; фенілу, необов'язково заміщеного 1 або 2 замісниками, незалежно вибраними з галогену, метилу, метокси; 1,3-бензодіоксоланілу; і гетероарилу. Зокрема, R1 вибраний з розгалуженого C3-4алкілу; фенілу, необов'язково заміщеного галогеном або метилом; і гетероарилу. Конкретніше, R1 вибраний з розгалуженого C3-4алкілу; фенілу, необов'язково заміщеного галогеном. Інакше, R1 є розгалуженим C3-4алкілом. Альтернативно в іншому конкретному варіанті здійснення, R1 вибраний з C1-4алкілу, необов'язково заміщеного метокси. Інший варіант здійснення даного винаходу відноситься до сполук формули I або будь-якої їх підгрупи, де R1 вибраний з C1-4алкілу; фенілу, необов'язково заміщеного 1 або 2 замісниками, незалежно вибраними з галогену, метокси; 1,3-бензодіоксоланілу; і гетероарилу. Зокрема, R1 вибраний з розгалуженого C3-4алкілу; фенілу, необов'язково заміщеного галогеном; і гетероарилу. Інший варіант здійснення даного винаходу відноситься до сполук формули I або будь-якої їх підгрупи, де R-(C=O)- і R'-C(=O)- незалежно є -(C=O)-CR1R2R3, вибраними з O O O O O * O * O , HN HN O O , OH H N HN HN O O * O O * O , O * O , , O O HN HN HN HN O O O * O , O O O * HN , O O * O O , O * O O і, O * , де 45 * позначає точку приєднання до азоту піролідину. Зокрема, R-(C=O)- і R'-C(=O)- незалежно є –(C=O)-CR1R2R3, вибраними з 6 UA 108211 C2 O HN HN HN O O O O * HN , O O * O , O O O O O * і * . Інший варіант здійснення даного винаходу відноситься до сполук формули I або будь-якої їх 5 10 15 20 25 30 35 40 45 50 підгрупи, де A є феніленом, зокрема де A є 1,4-феніленом структури , де пунктирна лінія вказує на точки приєднання до іншої частини молекули. Інший варіант здійснення даного винаходу відноситься до сполук формули I або будь-якої їх підгрупи, де A є нафталіном, зокрема де A є 2,6-нафталіном структури , де пунктирна лінія вказує на точки приєднання іншої частини молекули. Інший варіант здійснення даного винаходу відноситься до сполук формули (I) або будь-якої їх підгрупи, де A є нафталіном, який необов'язково може бути заміщений 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу; R1 є таким, як визначено для сполук формули (I), але відрізняється від незаміщеного 2-пропілу, і коли R1 в R є 1-метоксиетилом, то R1 в R' відрізняється від 1-метоксиетилу. Зокрема, даний винахід відноситься до сполук формули (IPR), де A є нафталіном, який необов'язково може бути заміщеним 1, 2 або 3 замісниками, вибраними з галогену або C1-3алкілу, конкретніше A є нафталіном, ще конкретніше A є 2,6нафталіном; кожен з R і R' незалежно є CR1R2R3, арилом, гетероарилом або гетероC 4-6циклоалкілом, причому арил і гетероарил можуть бути необов'язково заміщеними 1 або 2 замісниками, вибраними з галогену і метилу; і де R1 є воднем; C1-4алкілом, необов'язково заміщеним метокси або диметиламіно, але що відрізняється від незаміщеного 2-пропілу; фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену, C1-4алкокси і трифторметокси; 1,3-бензодіоксоланілом; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероарилом; гетероC4-6циклоалкілом; або гетероарилметилом; R2 є воднем, гідроксилом, аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно, C1-4алкіламінокарбоніламіно, піперидин-1-ілом або імідазол-1-ілом; R3 є воднем або R1 і R3 разом утворюють оксогруппу або циклопропільну групу; або їх фармацевтично прийнятних солей та/або сольватів; за умови, що коли R1 в R є 1-метоксиетилом, тоді R1 в R' відмінний від 1-метоксиетилу. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де A є нафталіном; кожен з R і R' незалежно є CR1R2R3, де кожен R1 незалежно є C1-4алкілом, необов'язково заміщеним метокси або гідрокси; циклопентилом; або фенілом; кожен R2 незалежно є аміно, моно- або ди-C1-4алкіламіно, C1-4алкілкарбоніламіно, C14алкілоксикарбоніламіно або C1-4алкіламінокарбоніламіно; і кожен R3 є воднем за умови, що: R1 відмінний від 2-пропілу, коли R2 є метоксикарбоніламіно; і R1 вR" відмінний від 1-метоксиетилу, коли R2 в R" є метоксикарбоніламіно; і їх фармацевтично прийнятних солей і сольватів. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, таких 7 UA 108211 C2 як сполуки формули (I-PR), де A є 2,6-нафталіном структури . 5 10 15 20 і де сполуки в цьому варіанті здійснення відрізняються від будь-якої з 6 сполук, приведених в таблиці A. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де R і R' відрізняються один від одного. Інший варіант здійснення відноситься до сполук формули (I), де кожен R 2 незалежно є C14алкілкарбоніламіно або C1-4алкілоксикарбоніламіно. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де кожен R2 незалежно є метоксикарбоніламіно. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де кожен R1 незалежно вибраний з розгалуженого C3-4алкілу, метоксиC2-3алкілу, циклопентилу або фенілу. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де R1 в R є 1-метилпропілом, 2-метилпропілом, 2-метоксиетилом, циклопентилом або фенілом; R1 в R' є 1-метилетилом, 1-метилпропілом, 2-метилпропілом, 1-метоксиетилом, циклопентилом або фенілом. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де R і R' незалежно є –CR1R2R3, причому обидва атома вуглецю, що несуть замісник R 1, R2 і R3, мають S-конфігурацію. Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, такої як сполуки формули (I-PR), де сполука має формулу Ia 25 O R A N N (S) N H H N (S) N N O R' Ia 30 35 40 45 50 Інший варіант здійснення відноситься до сполук формули (I) або будь-якої їх підгрупи, де сполука є однією з наступних сполук, представлених в таблиці 1a: сполука 9, сполука 11, сполука 13, сполука 14, сполука 16, сполука 17 або сполука 18, або їх фармацевтично прийнятна сіль. В наступному аспекті даний винахід відноситься до сполук формули I і їх фармацевтично прийнятних солей і сольватів для застосування для лікування або профілактики (або виготовлення лікарського засобу для лікування або профілактики) інфекції HCV. Типові генотипи HCV в контексті лікування або профілактики відповідно до даного винаходу включають генотип 1b (переважаючий в Європі) або 1a (переважаючий у Північній Америці). Даний винахід також відноситься до способу лікування або профілактики інфекції HCV, зокрема інфекції HCV генотипу 1a або 1b. Чисті стереоізомерні форми сполук і проміжних сполук, що згадуються в даному описі, визначають як ізомери, по суті вільні від інших енантіомерних або діастереомерних форм тієї ж основної молекулярної структури вказаних сполук або проміжних сполук. Зокрема, термін "стереоізомерно чистий" відноситься до сполук або проміжних сполук, що мають стереоізомерний надлишок щонайменше 80 % (тобто мінімум 90 % одного ізомеру і максимум 10 % інших можливих ізомерів) аж до стереоізомерного надлишку 100 % (тобто 100 % одного ізомеру і відсутність іншого ізомеру), конкретніше, сполуки або проміжні сполуки, що мають стереоізомерний надлишок від 90 % аж до 100 %, ще конкретніше мають стереоізомерний надлишок від 94 % аж до 100 % і що найконкретніше мають стереоізомерний надлишок від 97 % аж до 100 %. Терміни "енантіомерно чистий" і "діастереомерно чистий" слід розуміти аналогічно, але розглядаючи енантіомерний надлишок і діастереомерний надлишок, відповідно, даній суміші. 8 UA 108211 C2 5 Діастереомерні рацемати сполук формули I можна отримувати окремо загальноприйнятими способами. Відповідними способами фізичного розділення, які можна переважно використовувати, є, наприклад, селективна кристалізація і хроматографія, наприклад, колонкова хроматографія або надкритична рідинна хроматографія. Сполуки формули I мають декілька центрів хіральності. Інтерес представляють стереогенні центри піролідинового кільця на 2 атомі вуглецю. Конфігурація в цьому положенні може бути конфігурацією, що відповідає L-проліну, тобто R' O O R H N H N N N (S) (S) та/або або конфігурацією, що відповідає D-проліну, тобто N N , R' O O R H N H N N N (R) 10 15 (R) N та/або Також інтерес представляють стереогенні центри, що знаходяться в частинах -CR1R2R3 сполук формули I. Варіанти здійснення даного винаходу, таким чином, відносяться до сполук формули I або будь-якої їх підгрупи, де атом вуглецю C в -CR1R2R3 має його S-конфігурацію, зокрема, коли R1 є C1-4алкілом, необов'язково заміщеним метокси, гідрокси або диметиламіно; бензилом, необов'язково заміщеним 1, 2 або 3 замісниками, незалежно вибраними з галогену або метокси; C3-6циклоалкілом; гетероC4-6циклоалкілом; або гетероарилметилом. Конкретними N O HN O O прикладами частин –(C=O)-CR1R2R3 сполук формули I з вказаною стереохімією є O O * O , O O O * O O O , HN HN HN O O , OH H N HN * O * O O , * , HN O O O * O , O O * , O HN HN O O 25 30 35 O O * * , і , де * позначає точку приєднання до іншої частини молекули. Фармацевтично прийнятні аддитивні солі включають терапевтично активні нетоксичні форми кислотних і основних аддитивних солей сполук формули (I) або будь-якої їх підгрупи. Інтерес представляють вільні, тобто несольові форми сполук формули I або будь-якої їх підгрупи. Фармацевтично прийнятні кислотно-аддитивні солі можна зручним чином отримувати шляхом обробки основної форми такою відповідною кислотою. Відповідні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад хлористоводнева або бромистоводнева кислота, сірчана, азотна, фосфорна кислоти і т.п.; або органічні кислоти, наприклад, такі як оцтова, пропіонова, гідроксиоцтова, молочна, піровиноградна, щавлева (тобто етандіова), малонова, янтарна (тобто бутандіова кислота), малеїнова, фумарова, яблучна (тобто гідроксилбутандіова кислота), виннокамінна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, паміносаліцилова, памова кислоти і т.п. Навпаки, вказані сольові форми можна перетворювати обробкою відповідною основою у форму вільної основи. Сполуки формули (I), що містять кислотний протон, також можна перетворювати на їх O 20 HN O O O O 9 UA 108211 C2 5 10 15 20 25 30 35 40 45 50 55 основно-аддитивні солі, зокрема, аддитивні сольові форми металів або амінів, шляхом обробки відповідними органічними і неорганічними основами. Придатні сольові форми включають, наприклад, солі амонію, солі лужних і лужноземельних металів, наприклад солі літію, натрію, калію, магнію, кальцію і т.п., солі з органічними основами, наприклад бензатин, N-метил-Dглюкамін, солі гідрабаміну і солі з амінокислотами, наприклад, такими як аргінін, лізин і т.п. Термін "сольвати" охоплює будь-які фармацевтично прийнятні сольвати, які сполуки формули I, а також їх солі, здатні утворювати. Такі сольвати є, наприклад, гідратами, алкоголятами, наприклад етанолятами, пропанолятами і т.п. Деякі із сполук формули I також можуть існувати в таутомерних формах. Наприклад, таутомерними формами амідних (-C(=O)-NH-) груп є іміноспирти (-C(ОН)=N). Мається на увазі, що таутомерні форми, хоча і не вказані явно в структурних формулах, представлених в даному описі, включені в об'єм даного винаходу. Як використовують в рамках даного винаходу, "C1-4алкіл" як група або частини групи визначає насичені прямі або розгалужені вуглеводневі групи, що мають від 1 до 4 атомів вуглецю, наприклад, такі як метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-1-пропіл, 2-метил-2-пропіл. Для цілей даного винаходу серед C1-4алкілів інтерес представляють C34алкіли, тобто прямі або розгалужені вуглеводневі групи, що мають 3 або 4 атоми вуглецю, такі як 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-1-пропіл, 2-метил-2-пропіл. Особливий інтерес може представляти розгалужений C3-4алкіл, такий як 2-пропіл, 2-бутил, 2-метил-1-пропіл, 2метил-2-пропіл. Термін "C3-6циклоалкіл" є загальним терміном для циклопропілу, циклобутилу, циклопентилу і циклогексилу. Аналогічно, "C4-6циклоалкіл" є загальною назвою для циклобутилу, циклопентилу і циклогексилу. "C1-4алкокси" як група або частини групи означає групу формули -O-C1-4алкіл, де C1-4алкіл є таким, як визначено вище. Прикладами C1-4алкокси є метокси, етокси, н-пропокси, ізопропокси. Термін "галоген" є загальним терміном для фтору, хлору, брому і йоду. Як використовують в рамках даного винаходу, термін "(=O)" або "оксо" формує карбонільну частину, коли він приєднаний до атома вуглецю. Слід зазначити, що атом може бути заміщений лише оксогрупою, коли валентність цього атома допускає це. Як використовують в рамках винаходу, "арил" є загальним терміном для фенілу і нафтилу. Як використовують в рамках винаходу, термін "гетероарил" означає ароматичну кільцеву структуру, що має від 5 до 10 атомів кільця, в якому щонайменше один атом кільця вибраний з N, O і S, зокрема з N і O. Як використовують в рамках винаходу, термін "гетероC 4-6циклоалкіл" означає насичену циклічну вуглеводневу групу, як визначено для "C 4-6циклоалкілу", де щонайменше один атом вуглецю замінений гетероатомом, вибраним з N, O і S, зокрема, з N і O. Приклади гетероC 46циклоалкілу включають тетрагідро-2H-піраніл, піперидиніл, тетрагідрофураніл і піролідиніл. Там, де положення групи на молекулярній частині не вказано (наприклад замісник на фенілі) або представлено за допомогою плаваючого зв'язку, така група може бути розташована на будь-якому атомі такої частини, за умови що отримана структура є хімічно стабільною. Коли яка-небудь змінна присутня в молекулі більше одного разу, кожне визначення є незалежним. Сполуки за даним винаходом можна синтезувати з використанням наступних методик синтезу. Скорочення, як використовують у рамках винаходу, мають наступне значення: "CDI" означає N, N’-карбонілдиімідазол. "dppf" означає 1,1'-біс(дифенілфосфіно)фероцен "4-DMAP" означає 4-диметиламінопіридин "DMSO" означає диметилсульфоксид "HMPT" означає триамід гексаметилфосфору "DIPEA" означає N, N-диізопропілетиламін "DMF" означає диметилформамід "THF" означає тетрагідрофуран "TEMPO" означає 2,2,6,6-тетраметил-1-піперидинілокси DBU означає 1,8-діазабіцикло[5.4.0]ундец-7-ен HATU означає гексафторфосфат O-(7-азабензотріазол-1-іл)-N, N,N',N'-тетраметилуронію TBTU означає тетрафторборат 2-(1H-бензотріазол-1-іл)-N, N,N',N'-тетраметилуронію Схема 1 2) циклізація 1) PG-пролін, зв'язуючий реагент, 10 UA 108211 C2 A O NH2 1) PG-Proline, coupling reagent X NH2 X 2) cyclisation H N B B O O B O O N II H N III R PG H N X N N H N N II IV R O O H N B PG N NH N B X PG N O R O OH X H N O N N V O N N VI 5 10 15 20 25 30 35 На схемі 1 описано синтез сполук з II по VI. На першій стадії утворюється амідний зв'язок з використанням PG-проліну і 4-галогенбензол-1,2-діаміну, де X є Cl, Br або I, в присутності придатного зв'язуючого реагенту для ацилування аміногрупи, наприклад, такого як CDI. Як використовують в рамках винаходу, PG є захисною групою на азоті піролідину, наприклад, такою як карбамат-зазахисна група, такою як бензилоксикарбоніл, або трет-бутоксикарбоніл, або, альтернативно PG може бути R-C(=O)-, де R має значення, як визначено для сполук формули I. Отриману таким чином проміжну сполуку далі піддають циклізації з отриманням бензімідазольної похідної формули II. Таку циклізацію можна проводити шляхом обробки кислотою, наприклад, такою як оцтова кислота, в діапазоні температур від 0 до 150 °C, конкретніше від 80 °C до 120 °C. Проміжну сполуку формули II можна конвертувати в бороновий складний ефір формули III в умовах, каталізуємих Pd, наприклад, у присутності Pd(dppf)Cl 2, біс(пінаколато)дібору і основи, наприклад ацетату калію. Сполуку IV (схема 1B) можна отримувати після селективного видалення захисної групи PG з азоту піролідину проміжної сполуки II, в придатних умовах, наприклад, таких як використання HCl в ізопропанолі, коли PG є трет-бутоксикарбонілом. Потім отриману проміжну сполуку IV можна конвертувати в проміжну сполуку формули V шляхом ацилування відповідною кислотою формули R-C(=O)-OH, де R має значення, як визначено для сполук формули I. Вказане ацилування можна проводити шляхом реакції вихідних матеріалів у присутності зв'язуючого агенту або шляхом конвертації карбоксильної функціональної групи в активну форму, таку як активний складний ефір, змішаний ангідрид або хлорид або бромід карбонової кислоти. Загальний опис таких реакцій приєднання і реагентів, що в них використовуються, може бути знайдений в звичайних довідниках по хімії пептидів, наприклад, M. Bodanszky, "Peptide Chemistry", 2nd rev. ed., Springer-Verlag, Berlin, Німеччина (1993). Приклади реакцій приєднання для ацилування аміногрупи або утворення амідного зв'язку включають азидний спосіб, спосіб змішаного ангідриду вугільно-карбонова кислота (ізобутилхлорформіат), спосіб карбодііміду (дициклогексилкарбодіімід, диізопропілкарбодіімід, або розчинний у воді карбодіімід, такий як N-етил-N'-[3-(диметиламіно)пропіл]карбодіімід), спосіб активного складного ефіру (наприклад п-нітрофеніл, п-хлорфеніл, трихлорфеніл, пентахлорфеніл, пентафторфеніл, імідоефіри і схожі складні ефіри N-гідроксибурштинової кислоти), спосіб з реагентом K Вудворда, спосіб з 1,1-карбонілдіімідазолом, спосіб з фосфорними реагентами або окислювально-відновні способи. Деякі з цих способів можуть бути посилені додаванням придатних каталізаторів, наприклад, в способі з карбодіімідом, шляхом додавання 1-гідроксибензотріазолу або 4-DMAP. Іншими зв'язуючими агентами є гексафторфосфат (бензотріазол-1-ілокси)-трис-(диметиламіно)фосфонію, або сам по собі, або у присутності 1-гідроксибензотріазолу або 4-DMAP; або тетрафторборат 2-(1H-бензотріазол-1-іл)N, N,N',N'-тетраметилуронію (TBTU) або гексафторфосфат O-(7-азабензотріазол-1-іл)-N, N,N',N'-тетраметилуронію (HATU). Ці реакції приєднання можна проводити або в розчині (рідка 11 UA 108211 C2 5 10 15 фаза), або в твердій фазі. Для цілей даного винаходу переважним способом для проведення ацилування є спосіб з використанням HATU. Реакції приєднання переважно проводять в інертному розчиннику, такому як галогеновані вуглеводні, наприклад дихлорметан, хлороформ, біполярні апротонні розчинники, такі як ацетонітрил, диметилформамід, диметилацетамід, DMSO, HMPT, прості ефіри, такі як тетрагідрофуран (THF). В багатьох випадках реакції приєднання проводять у присутності придатної основи, такої як третинний амін, наприклад триетиламін, диізопропілетиламін (DIPEA), N-метилморфолін, Nметилпіролідин, 4-DMAP або 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU). Температура реакції може знаходитися в діапазоні від 0 °C до 50 °C і час реакції може знаходитися в діапазоні від 15 хв до 24 год. Потім проміжну сполуку V можна конвертувати в бороновий складний ефір VI в умовах, каталізуємих Pd в присутності біс(пінаколато)дібору, подібно до того, як при конвертації з проміжної сполуки II в проміжну сполуку III. Схема 2 Метанол PG A HO O A X N 1) O H N A X VII O A X H N A VIII PG HO PG N NH2 2) NH4OAc O B O N N PG N IX N 1) O X 2) NH4OAc VIIa B A X H N N N H N A X N H N PG X H N A XI X VIII O B O H N A N N O R' N N XII O R' C HO PG N O PG N Me2S.BH3 HO THF NBS Br NH PG N TEMPO, NaBr NaClO O O O NH4OH, methanol NH PG N N PG N N XIII 20 Інші конструктивні елементи, що використовуються в синтезі сполук формули I, описані на схемі 2. α-амінокетон VII (схема 2A), де A має те ж значення, як і для сполук формули I, і X є галогеном, зв'язують з придатним чином захищеним проліном, де PG є захисною групою на азоті піролідину, переважно трет-бутоксикарбонілом або бензилоксикарбонілом, у присутності зв'язуючого реагенту для ацилування аміногрупи, як описано вище для конвертації проміжної 12 UA 108211 C2 5 10 15 20 сполуки IV в проміжну сполуку V, переважно з HATU у присутності DIPEA. Отриману таким чином проміжну сполуку піддають циклізації в імідазольні проміжні сполуки загальної формули VIII шляхом обробки ацетатом амонію, переважно в діапазоні температур від 0 °C до 150 °C, конкретніше від 80 °C до 150 °C. Альтернативну проміжну сполуку VIII можна отримувати зв'язуванням α-галогенкетону VIIa, де кожний X незалежно є атомом галогену, з придатним чином захищеним проліном, де PG є захисною групою на азоті піролідину, переважно третбутоксикарбонілом або бензилоксикарбонілом, у присутності придатної основи, наприклад DIPEA, з подальшою циклізацією в імідазольну проміжну сполуку VIII, як описано вище, переважно в толуолі або ксилолі. Цю сполуку можна далі перетворювати на проміжну сполуку формули IX, аналогічно перетворенню проміжної сполуки II на проміжну сполуку III. Альтернативно з проміжної сполуки VIII можна видаляти захисну групу, наприклад, шляхом обробки HCl в ізопропанолі у випадку, коли PG є трет-бутоксикарбонілом, з отриманням проміжної сполуки X (схема 2B) і далі перетворювати на проміжну сполуку XI, з використанням умов, схожих з умовами, що використовували для перетворення проміжної сполуки IV на проміжну сполуку V. Бороновий складний ефір XII отримують з проміжної сполуки XI з використанням умов, схожих з умовами, що використовували для конвертації проміжної сполуки II в проміжну сполуку III. Імідазол XIII можна синтезувати за 4 стадії, починаючи з PG-проліну (схема 2C), де PG є захисною групою на азоті піролідину, переважно трет-бутоксикарбонілом, як описано на схемі 2C. Імідазол XIII' можна синтезувати з використанням I NH PG N N XIII' 25 по тій же методиці, за виключенням останніх стадій, де в імідазол вносять йод замість брому, що можна забезпечити шляхом дийодування за допомогою I 2/NaOH з подальшим видаленням одного йодиду за допомогою Na2SO3. Схема 3 O O B NH PG N X A X X' A H N O O B PG N A H N XIV N N N XVI XV III PG N Інші можливі проміжні сполуки описані на схемі 3. Тут використовують дигалогенід XIV X 30 35 A X' формули , де A має значення, як визначено для сполук формули I, та X і X' є галогенами; незалежно вибраними з йоду, хлору і брому. Альтернативно X і X' можуть бути трифлатом, що використовується в комбінації з галогеном. Проміжну сполуку III зв'язують з проміжною сполукою XIV, в умовах Сузукі-Майяра з використанням одного або декількох еквівалентів проміжної сполуки XIV. Отриману проміжну сполуку XV далі перетворюють на XVI в умовах, схожих з умовами, описаними для конвертації проміжної сполуки II в проміжну сполуку III. У випадку, коли PG є R-C(=O), де R має значення, як визначено для сполук формули I, проміжна сполука III є такою ж, як і проміжна сполука VI. Схема 4 X O O B H N PG N A H N N PG N PG N VIII N 40 A N N H XVII III 13 H N N N PG UA 108211 C2 5 10 15 Як проілюстровано на схемі 4, зв'язування боронового складного ефіру III і галогеніду або трифлату VIII, де X є галогеном або трифлатом, в умовах Сузукі-Майяра призводить до утворення проміжної сполуки XVII. Аналогічно зв'язування відповідних проміжних сполук, описаних на схемах 1-3 з використанням умов Сузукі-Майяра може також призводити до утворення проміжних сполук XVII. Наприклад, бромід II і бороновий складний ефір IX можна зв'язувати з отриманням проміжної сполуки XVII, як описано для проміжних сполук III і VIII. Альтернативно сполуки формули I можна отримувати, як проілюстровано на схемі 5. Бороновий складний ефір формули XVI зв'язують з бромідом формули XIII або Йодидом формули XIII', з отриманням проміжної сполуки XVII. Після видалення захисної групи азоту піролідину у відповідних умовах, наприклад, таких як використання HCl в ізопропанолі, у випадку коли PG є трет-бутоксикарбонілом, утворюється проміжна сполука XVIII. Зв'язування з кислотами загальної формули R-C(=O)-OH або R'-C(=O)-OH, де R і R' мають значення, як визначено для сполук формули I, в умовах, як описано для конвертації проміжної сполуки IV в проміжну сполуку V, призводить до утворення сполуки формули I, де R-C(=O)- і R'-C(=O)- є ідентичними. Схема 5 ХІІІ або ХІІІ' O O B A H N PG N XIII or XIII' PG N N N H N H N A N PG N XVII XVI O H N H N A N N H (') R OH N H N O R A N N H N N R' N O N H I XVIII 20 25 30 Для способів, проілюстрованих на схемі 4 і 5, де PG є R-C(=O)- або R'-C(=O)-, проміжна сполука XVII насправді є сполукою формули I. У випадку, коли лише одна PG в проміжній сполуці XVII є R-C(=O)- або R'-C(=O)-, а інша є захисною групою, наприклад такою як третбутоксикарбоніл, можливе селективне видалення захисної групи, подібно до того, як показано для конвертації проміжної сполуки XIX (схема 6) на проміжну сполуку XX, або проміжної сполуки XXI на проміжну сполуку XXII. Потім проміжні сполуки XX і XXII можна конвертувати в сполуку формули I, як описано для конвертації проміжних сполук XVIII в сполуки формули I, як проілюстровано на схемі 5. Схема 6 O A N R N H N O N PG N N N H A N R A N XX H N N H N R' N O N H A N H N N R' N O N H XXII XXI 35 N H N N H XIX PG N H N Способи, проілюстровані на схемі 4 і на першій стадії схеми 5, також можна 14 UA 108211 C2 5 10 використовувати для отримання проміжної сполуки XXV (схема 7), де групи піролідину ортогонально захищені захисними групами PG і PG', що відрізняються, тим самим забезпечуючи селективне видалення захисної групи з отриманням або сполуки XXVI, або сполуки XXVII, і подальшого ацилування відповідними групами R'-C(=O)- або R-C(=O)-, із отриманням сполуки XXI або XIX', відповідно (див. схему 7). На наступній стадії другу захисну групу видаляють селективно і азот піролідину ацилують з отриманням сполуки формули I. Наприклад, для цілей даного винаходу, таке ортогональне внесення захисних груп можна забезпечувати з використанням групи t-Boc на одному піролідині в комбінації з бензилоксикарбонілом (Cbz) на іншому піролідині. Схема 7 A N PG N H N N PG' N N H XXV PG N PG N A N N H N N H N H H N N N H N O R O R' N XXI A N H N XXVI A N H N N N PG' XXVII A N H N H N N N PG' N H XIX' I 15 20 25 30 Методики синтезу, представлені вище в схемах 1-7, можна виконувати з використанням рацемічних похідних проліну, похідних L-проліну або похідних D-проліну. Таким чином, можна отримувати сполуки формули I з альтернативною стереохімією. В наступному аспекті даний винахід відноситься до фармацевтичної композиції, що включає терапевтично або профілактично ефективну кількість сполуки формули I, як описано в даному описі, і фармацевтично прийнятний носій. Профілактично ефективна кількість в цьому контексті є кількістю, достатньою для попередження інфекції HCV в індивідуумів, що мають ризик бути інфікованими. Терапевтично ефективна кількість в даному випадку є кількістю, достатньою для стабілізації інфекції HCV, для зменшення інфекції HCV або для усунення інфекції HCV в інфікованих індивідуумів. В наступному аспекті, цей винахід відноситься до способу отримання фармацевтичної композиції, як описано в даному описі, який включає змішування в однорідну суміш фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки формули I, як описано в даному описі. Таким чином, для введення сполуки за даним винаходом або будь-яку їх підгрупу можна виготовити у вигляді різних фармацевтичних форм. В якості придатних композицій можна назвати всі композиції, які звичайно використовувують для системного введення лікарських засобів. Для отримання фармацевтичних композицій за даним винаходом, ефективну кількість конкретної сполуки, необов'язково у формі аддитивної солі або комплексу з металом, в якості активного інгредієнту змішують в однорідну суміш з фармацевтично прийнятним носієм, який 15 UA 108211 C2 5 10 15 20 25 30 35 40 45 50 55 60 може знаходитися в різних формах залежно від бажаної форми препарату для введення. Бажано, щоб такі фармацевтичні композиції були представлені в одиничній дозованій формі, зокрема, для перорального, ректального, підшкірного введення, або для парентеральної ін'єкції. Наприклад, для отримання композицій в пероральній дозованій формі, можна використовувати будь-яке звичайне фармацевтичне середовище, наприклад, таке як вода, гліколі, масла, спирти і т.п. у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні речовини, зв'язуючі речовини, дезінтегруючі речовини і т.п. у випадку порошків, пілюль, капсул і пігулок. Внаслідок простоти введення, пігулки і капсули є найбільш переважними пероральними одиничними дозованими формами, у випадку яких звичайно використовують тверді фармацевтичні носії. У випадку парентеральних композицій, носій, як правило, містить, стерильну воду, що складає щонайменше більшу його частину, хоча в нього можуть бути включені інші інгредієнти, наприклад, для забезпечення розчинності. Наприклад, можна отримувати ін'єкційні розчини, в яких носій містить сольовий розчин, розчин глюкози або суміш сольового розчину і розчину глюкози. Також можна отримувати ін'єкційні суспензії, у випадку яких можна використовувати придатні рідкі носії, суспендуючі речовини і т.п. Також передбачені препарати в твердій формі, які необхідно перетворювати, безпосередньо перед застосуванням, у препарати в рідкій формі. В композиціях, придатних для черезшкірного введення, носій необов'язково містить речовину, що підсилює проникність, та/або придатну змочуючу речовину, необов'язково у поєднанні з придатними добавками будь-якої структури в невеликих пропорціях, які не чинять значних несприятливих ефектів на шкіру. Сполуки за даним винаходом також можна вводити за допомогою оральної інгаляції або інсуффляції у формі розчину, суспензії або сухого порошку з використанням будь-якої з відомих в даній області системи для доставки. Особливо переважним є об'єднання згаданих вище фармацевтичних композицій в одиничну дозовану форму для простоти введення і однаковості дозування. Як використовують в даному описі, одинична дозована форма відноситься до фізично дискретних одиниць, придатних в якості одиничних доз, де кожна одиниця включає певну кількість активного інгредієнту, обчислену для забезпечення необхідного терапевтичного ефекту, спільно з необхідним фармацевтичним носієм. Прикладами таких одиничних дозованих форм є пігулки (включаючи шорсткі або покриті пігулки), капсули, пілюлі, супозиторії, пакети з порошком, вафлі, ін'єкційні розчини або суспензії і т.п., та окремі їх типи. Сполуки формули I є активними в якості інгібіторів циклу реплікації HCV і їх можна використовувати для лікування або профілактики інфекції HCV або захворювань, обумовлених з HCV. Захворювання, обумовлені HCV, включають прогресуючий фіброз печінки, запалення і некроз, що ведуть до цирозу, захворювання печінки кінцевої стадії і печінково-клітинну карциному. Більш того, про деякі сполуки за даним винаходом відомо, що вони є активними по відношенню до мутантних штамів HCV. Противірусну активність сполук формули I по відношенню до HCV in vitro можна тестувати в клітинній системі з репліконом HCV на основі Lohmann et al. (1999) Science 285:110-113, з додатковими модифікаціями, описаними Krieger et al. (2001) Journal of Virology 75: 4614-4624, які далі проілюстровані в розділі "Приклади". Не дивлячись на те, що ця модель не є повною моделлю інфекції HCV, ця модель широко поширена як найбільш надійна і ефективна модель автономної реплікації РНК HCV, доступна на даний час. Буде зрозуміло, що важливо відрізняти сполуки, які специфічно перешкоджають функціонуванню HCV, від сполук, які спричиняють цитотоксичні або цитостатичні ефекти в моделі реплікона HCV, і внаслідок цього призводять до зниження РНК HCV або концентрації зв'язаного з нею репортерного ферменту. В даній області відомі способи аналізу для оцінки клітинної цитотоксичності на основі, наприклад, активності мітохондріальних ферментів з використанням флуорогенних окислювально-відновних барвників, таких як резазурин. Більш того, існують способи скринінгу з підрахунком клітин, для оцінки неселективного інгібування активності зв'язаного репортерного гена, такого як гена люциферази світляків. Придатні типи клітин можна адаптувати за допомогою стабільної трансфекції репортерним геном люциферази, експресія якого залежить від конститутивно активного промотора гену, і такі клітки можна використовувати в якості способу скринінгу з підрахунком для усунення неселективних інгібіторів. Внаслідок властивостей, направлених проти HCV, сполуки формули I або їх підгрупи, як описано в даному описі, є придатними для інгібування циклу реплікації HCV, зокрема, для лікування теплокровних тварин, зокрема, людей, інфікованих HCV, і для профілактики інфекцій HCV. Більш того, даний винахід відноситься до способу лікування теплокровної тварини, зокрема людини, інфікованої HCV, або маючої ризик інфікування HCV, причому вказаний спосіб включає введення терапевтично або профілактично ефективної кількості сполуки формули I. 16 UA 108211 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, сполуки формули I, як описано в даному описі, можна використовувати в якості лікарського засобу, зокрема, в якості лікарського засобу для лікування або профілактики інфекції HCV. Вказане застосування в якості лікарського засобу або спосіб лікування включає системне введення інфікованим HCV індивідуумам або сприйнятливим до інфекції HCV індивідуумам кількості, ефективної для боротьби зі станами, асоційованими з інфекцією, або кількості, ефективної для попередження інфекції HCV. Даний винахід також відноситься до застосування сполук за даним винаходом для виготовлення лікарського засобу для лікування або профілактики інфекції HCV. Головним чином, передбачається, що ефективна противірусна добова кількість може складати від приблизно 0,01 до приблизно 50 мг/кг, або від приблизно 0,02 до приблизно 30 мг/кг маси тіла. Може бути придатним введення необхідної дози в якості однієї, двух, трьох, чотирьох або більше субдоз через відповідні інтервали протягом доби. Вказані субдози можна виготовляти у вигляді одиничних дозованих форм, наприклад, таких що містять від приблизно 1 до приблизно 500 міліграмів, або від приблизно 1 до приблизно 100 міліграмів, або від приблизно 2 до приблизно 50 міліграмів активного інгредієнту на одиничну дозовану форму. Даний винахід також відноситься до комбінацій сполук формули (I) або будь-якої їх підгрупи, як вказано в даному описі, з іншими засобами проти HCV. Термін "комбінація" може відноситися до продукту або набору, що містить (a) сполуку формули I, як вказано вище, і (b) щонайменше одну іншу сполуку, здатну лікувати інфекцію HCV (що позначається в даному описі як засіб проти HCV), в якості комбінованого препарату для одночасного, окремого або послідовного застосування при лікуванні інфекцій HCV. В одному варіанті здійснення винахід відноситься до комбінації сполук формули (I) або будь-якої їх підгрупи щонайменше з одним засобом проти HCV. В конкретному варіанті здійснення винахід відноситься до комбінації сполук формули (I) або будь-якої їх підгрупи щонайменше з двома засобами проти HCV. В конкретному варіанті здійснення, винахід відноситься до комбінації сполук формули (I) або будь-якої їх підгрупи щонайменше з трьома засобами проти HCV. В конкретному варіанті здійснення, винахід відноситься до комбінації сполук формули (I) або будь-якої їх підгрупи щонайменше з чотирма засобами проти HCV. Комбінацію раніше відомих засобів проти HCV, таких як інтерферон-α (IFN-α), пегільований інтерферон-α, рибавірин або їх комбінація, і, сполук формули (I) або будь-якої їх підгрупи можна використовувати в якості лікарського засобу в комбінованій терапії. Засоби, які можна комбінувати зі сполуками за даним винаходом, включають, наприклад, нуклеозидні і ненуклеозидні інгібітори полімерази HCV, інгібітори протеази, інгібітори хелікази, інгібітори NS4B і засоби, які функціонально інгібують ділянку внутрішньої посадки рибосоми (IRES) та інші засоби, які інгібують прикріплення HCV до клітини або проникнення вірусу всередину, трансляцію РНК HCV, транскрипцію РНК HCV, реплікацію або дозрівання HCV, збирання або вивільнення вірусу. Конкретні сполуки в цих класах включають інгібітори протеази HCV, такі як телапревір (VX-950), боцепревір (SCH-503034), нарлапревір (SCH-900518), ITMN191 (R-7227), TMC435350 (TMC435), MK-7009, BI-201335, BI-2061 (цилупревір), BMS-650032, ACH-1625, ACH-1095, GS 9256, VX-985, IDX-375 (інгібітор кофактора протеази NS4A HCV), VX500, VX-813, PHX-1766, PHX2054, IDX-136, IDX-316, ABT-450, EP-013420 (і родинні сполуки) і VBY-376; нуклеозидні інгібітори полімерази HCV, придатні для винаходу, включають R7128, PSI7851, PSI 7977, IDX-189, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938 і PSI-879 і різні інші аналоги нуклеозидів і нуклеотидів та інгібітори HCV, включаючи інгібітори, отримані в якості 2'-C-метил-модифікованих нуклеозидів, 4'-аза-модифікованих нуклеозидів, і 7'-деазамодифікованих нуклеозидів, наприклад 4-аміно-1-[5-азидо-4-гідрокси-5-гідроксиметил-3метилтетрагідрофуран-2-іл]піримідин-2(1H)-он (посилання 1) і його біс-2-метилпропаноатний складний ефір. Ненуклеозидні інгібітори полімерази HCV, придатні для винаходу, включають HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, MK-3281, ABT-333, ABT-072, PF00868554, BI-207127, GS-9190, A-837093, JKT-109, GL-59728, GL-60667, ABT-072, AZD-2795 і 13-циклогексил-3-метокси-17,23-диметил-7H-10,6(метанoімінотіоіміноетанооксиетаноімінометано)індоло[2,1-а][2]бензазепін-14,24-діону 16,16діоксид. Інші засоби проти HCV охоплюють засоби, вибрані з інгібіторів полімерази HCV, R-7128, MK0608, ABT-333, VCH759, PF-868554, GS9190, NM283,VCH-222, VCH-916, BI207217, ABT-072, IDX-102, PSI-7851, PSI-938, валопіцитабіну, PSI-6130, XTL-2125, NM-107, R7128 (R4048), GSK625433, R803, R-1626, BILB-1941, HCV-796, JTK-109 і JTK-003, ANA-598, IDX-184, MK-3281, MK-1220, похідних бензимідазолу, похідних бензо-1,2,4-тіадіазину, похідних фенілаланіну, A-831 і A-689; інгібіторів протеаз HCV (NS2-NS3 і NS3-NS4A), сполук WO02/18369 (див., наприклад, стор. 273, рядки 9-22, та зі стор. 274, рядок 4, по стор. 276, рядок 11), BI-1335, TMC435, MK7009, 17 UA 108211 C2 5 10 15 20 25 30 35 40 45 50 ITMN-191, MK-7009, BI-201335, SCH900518, VX-813, ABT-450, VBY376, PHX-1766, ACH-1625, BILN-2061, VX-950, BILN-2065, BMS-605339, VX-500, SCH 503034; інгібітори інших мішеней в життєвому циклі HCV, включаючи інгібітори хелікази і металопротеїнази, ISIS-14803; імуномодулюючі засоби, такі як α-, β-, і γ-інтерферони, такі як rIFN-α 2b, rIFN-α 2ba, консенсусний IFN-α (інферген), ферон, реаферон, інтермакс α, rIFN-α, інферген + актимун, IFNомега з DUROS, альбуферон, локтерон, ребіф, пероральний IFN-α, IFN-α 2b XL, AVI-005, пегільований інферген, пегільовані сполуки-похідні інтерферону-α, такі як пегільований rIFN-α 2b, пегільований rIFN-α 2a, пегільований IFN-β, сполуки, які стимулюють синтез інтерферону в клітинах, інтерлейкіни, агоністи Toll-подібного рецептора (TLR), сполуки, які підсилюють розвиток відповіді хелперних T-клітин типу 1 і тимозин; інші противірусні засоби, такі як рибавірин, аналоги рибавірину, такі як ребетол, копегус і вірамідин (тарибавірин), амантадин і телбувідин, інгібітори внутрішньої посадки рибосоми, інгібітори альфа-глюкозидази 1, такі як MX-3253 (целгосивір) і UT-231B, гепатопротектори, такі як IDN-6556, ME-3738, LB-84451 і MITOQ, вірусні інгібітори широкого спектру, такі як інгібітори IMPDH (наприклад, сполуки US5807876, US6498178, US6344465, US6054472, WO97/40028, WO98/40381, WO00/56331, мікофенолова кислота та її похідні, і включаючи, але не обмежуючись ними, VX-497, VX-148, і VX-944); та інші лікарські засоби для лікування HCV, такі як задаксин, нітазоксанід, BIVN-401 (віростат), PYN-17 (алтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, сивасир, GI-5005, ANA-975, XTL-6865, ANA-971, NOV-205, тарвацин, EHC-18, NIM811, DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавітуксимаб і оглуфанід; або комбінації будь-якого з вказаних вище. Може бути корисною розробка визначених із згаданих вище засобів проти HCV в їх формі проліків, зокрема, інгібітору полімерази HCV з нуклеозидним аналогом. Прикладами таких пролікарських форм можуть бути фосфати, фосфорамідати або форми складних ефірів, що включають складні моноефіри і складні діефіри. Такі проліки вимагають перетворення in vivo на вільний нуклеозид, наприклад, в стінці травного каналу або в печінці, перед внутрішньоклітинним фосфорилюванням в активні форми. Таким чином, для боротьби з інфекціями HCV або їх лікування, сполуки формули (I) або будь-які їх підгрупи можна вводити спільно в комбінації, наприклад, з інтерфероном-α (IFN-α), пегільованим інтерфероном-α, рибавірином або їх комбінацією, а також з терапевтичними засобами на основі антитіл, направлених проти епітопів HCV, малими інтерфіруючими РНК (мі РНК), рибозимами, ДНК-зимами, антизмістовною РНК, низькомолекулярними антагоністами, наприклад, протеази NS3, хелікази NS3 і полімерази NS5B. Комбінації за даним винаходом можна використовувати в якості лікарських засобів. Таким чином, даний винахід відноситься до застосування сполук формули (I) або будь-якої їх підгрупи, як визначено вище, для виготовлення лікарського засобу, придатного для інгібування активності HCV у ссавця, інфікованого вірусами HCV, де вказаний лікарський засіб використовують в комбінованій терапії, причому комбінована терапія, зокрема, включає сполуки формули (I) і щонайменше один інший засіб проти HCV, наприклад IFN-α, пегільований IFN-α, рибавірин або їх комбінацію. В переважному варіанті здійснення, комбінація сполук формули (I) або будь-якої їх підгрупи з іншим засобом, який змінює реплікацію вірусу HCV, може діяти синергічно. Взаємодії сполук можна аналізувати різними механістичними і емпіричними способами. Одним підходом для аналізу таких комбінацій є тривимірні графіки і синергетичні об'ємні обчислення, що проводяться MacSynergyTM II на основі модулі Bliss Independency model (Dr. Mark Pritchard, University of Alabama, Tuscaloosa, AL). По суті, сполуки за даним винаходом в комбінації з іншим засобом, який змінює реплікацію вірусу HCV, називають такими, що діють синергічно або що мають синергетичний ефект, коли величини, виражені в нМ2 % (об'єм синергії) складають від 25 до 50 нМ2 % (невелика але значима величина синергії), від 50 до 100 нМ2 % (помірна синергія) або більше 100 нМ2 % (сильна синергія). Наступні приклади призначені для ілюстрації винаходу і їх не слід тлумачити як обмеження його об'єму. ПРИКЛАДИ Приклад 1 – синтез сполук формули XVIIIa (A= ) 1.1. Отримання проміжної сполуки IIa (PG=Boc; X=Br) 55 18 UA 108211 C2 5 10 До розчину Boc-L-проліну (2669 міліграм, 12,4 ммоль) в суміші піридин/DMF (30 мл, 1/1) додавали ди-(1H-імідазол-1-іл) кетон (2205 міліграм, 13,6 ммоль). Суміш перемішували при 45 °C протягом 2 годин. Додавали 4-бромбензол-1,2-діамін (2319 міліграм, 12,4 ммоль) і суміш перемішували при температурі оточуючого середовища протягом ночі. Розчинник видаляли і осад нагрівали в оцтовій кислоті (15 мл) при 100 °C протягом 30 хвилин. Після концентрації осаду суміш розподіляли між етилацетатом і насиченим розчином бікарбонату натрію. Органічну фазу відділяли і промивали водою, суміш сушили над Na 2SO4, і фільтрували, і фільтрат концентрували у вакуумі. Отриманий осад очищали флеш-хроматографією з використанням CH2Cl2/EtOAc від 90/10 до 50/50, з отриманням сполуки IIa (3,146 г, 69 %). 1.1а Отримання проміжної сполуки IIb (PG=Cbz; X=Br) 15 20 25 До перемішуваного розчину N-бензилоксикарбоніл-L-проліну (39,9 г, 160,4 ммоль) в сухому THF (300 мл) додавали CDI (28,6 г, 176,4 ммоль). Реакційну суміш перемішували при 45 °C протягом 2 годин. Додавали 4-бром-1,2-диамінобензол (30 г, 160,4 ммоль) і реакційну суміш далі перемішували протягом 16 годин при кімнатній температурі. Розчинник видаляли при зниженому тиску, осад розчиняли в оцтовій кислоті (100 мл) і перемішували в заздалегідь нагрітому колбонагрівачі при 100 °C протягом 40 хвилин. Потім розчинник видаляли при зниженому тиску. Отриманий осад розчиняли в дихлорметані (500 мл) і воді (300 мл). Органічний шар відділяли від водного шару, промивали 0,5 Н HCl (300 мл), а потім насиченим розчином NaHCO3 (300 мл). Після висушування за допомогою MgSO 4 і концентрування у вакуумі, продукт очищали колонковою хроматографією (градієнтне елюювання дихлорметаном до 10 % EtOAc в дихлорметані) з отриманням сполуки IIb (17,1 г, 25 %). 1.2 Отримання проміжної сполуки IIIa (PG=Boc) O Br H N N Boc N O B B O O O O B Boc NH (S) Pd(dppf)Cl2, KOAc N N IIIa IIa 30 35 До суміші IIa (200 г, 546 ммоль), ацетату калію (160,8 г, 1,64 моль) і 4,4,4',4',5,5,5',5'октаметил-2,2'-біс(1,3,2-диоксаборолану) (416 г, 1,64 моль) в DMF (3 л) додавали Pd(dppf) Cl 2 (20 г) в газоподібному азоті. Реакційну суміш перемішували при 85 °C протягом 15 годин. Суміш розбавляли етилацетатом, промивали водою і розсолом, сушили над сульфатом магнію, тверді речовини видаляли фільтрацією і розчинники фільтрату видаляли при зниженому тиску. Осад очищали колонковою хроматографією на кремнеземі (петролейний ефір: етилацетат від 10:1 до 2:1) з отриманням 125 г IIIa у вигляді білої твердої речовини (містить 15 % боронової кислоти). 1.3 Отримання проміжної сполуки VIIIa (PG=Boc, X=Br; A= Стадія 1 40 19 ) UA 108211 C2 NH2 Boc O O O HO (S) (S) Boc N Br O N N H HATU, DIEA DMF Br 5 10 15 20 25 30 35 XXIII До суміші амінометил-(4-бромфеніл)кетону (50 г, 0,2 mol), 2-(1H-7-азабензотриазол-1-іл)1,1,3,3-тетраметилуронію гексафторфосфату метанамінію (HATU; 53 г, 0,21 моль), N-Boc-Lпроліну (43,0 г, 0,2 моль) в DMF (600 мл) краплинно додавали N, N-диізопропілетиламін (80,0 г, 0,62 моль) протягом 30 хвилин. Реакційну суміш перемішували при 5 °C протягом 1 години. Більшість летких компонентів видаляли у вакуумі і отриманий осад розподіляли між етилацетатом (600 мл) і водою (300 мл). Органічний шар промивали насиченим водним NaHCO3 (500 мл) і розсолом (500 мл), сушили над MgSO 4, тверді речовини видаляли фільтрацією і розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали колонковою хроматографією (силікагель, петролейний ефір/етилацетат від 3:1 до 1:1) з отриманням 60 г (62 %) проміжної сполуки XXIII у вигляді світло-жовтої твердої речовини. 1 H NMR: (CDCl3 400 MHz): δ 7,85 (d, J=8,4 Hz, 2H), 7,66 (d, J=8,4 Hz, 2H), 4,67-4,80 (m, 2H), 4,33-4,41 (m, 1H), 3,42-3,53 (m, 2H), 2,19-2,31 (m, 2H), 1,90-2,00 (m, 2H), 1,50 (s, 9H) Стадія 2 Суміш проміжної сполуки XXIII (60 г, 0,14 моль) і ацетату амонію (89 г, 1,4 моль) в ксилолі (800 мл) нагрівали при кип'ятінні із зворотним холодильником протягом 16 годин. Реакційну суміш розподіляли між етилацетатом (700 мл) і насиченим розчином NaHCO 3 (500 мл). Шари розділяли і водний шар екстрагували додатковим етилацетатом (2 × 300 мл). Органічні шари об'єднували, промивали розсолом (500 мл), сушили над MgSO 4, тверді речовини видаляли фільтрацією і розчинники фільтрату випарювали при зниженому тиску. Отриманий матеріал перекристалізовували з суміші етилацетат/петролейний ефір з отриманням жовтої твердої речовини, VIIIa, 25 г (43 %). 1 H NMR: (CD3OD 400 MHz): δ 7,62 (d, J=8,4 Hz, 2H), 7,51 (d, J=8,4 Hz, 2H), 7,31-7,36 (m, 1H), 4,93-4,98 (m, 1H), 3,66-3,70 (m, 1H), 3,48-3,54 (m, 1H), 2,29-2,41 (m, 1H), 1,93-2,17 (m. 3H), 1,48 (s, 3H), 1,27 (s, 6H). 1.4 Отримання проміжної сполуки XVIIa (PG=Boc, A= ) До VIIIa (1138 міліграм, 2,90 ммоль) і тетракис(трифенілфосфін)паладію (140 міліграм, 0,121 ммоль) в толуолі в атмосфері азоту додавали 2 M Na2CO3 (2,5 мл, 5,0 ммоль) і сполуку IIIa (1,0 г, 2,42 ммоль) в метанолі. Енергійно перемішувану суміш нагрівали до 80 °C ватмосфері азоту і перемішували при цій температурі протягом ночі. Після охолодження до кімнатної температури, додавали CH 2Cl2 (15 мл), а потім воду (10 20 UA 108211 C2 мл). Органічний шар відділяли і водний шар екстрагували CH 2Cl2. Об'єднані органічні шари сушили над Na2SO4 і після фільтрації концентрували до сухого стану при зниженому тиску з отриманням коричневого осаду. Цей осад очищали колонковою хроматографією з від CH2Cl2 до CH2Cl2/метанол 90/10 в якості елюенту з отриманням сполуки XVIIa (878 міліграм, 61 %). 5 1.5 Отримання проміжної сполуки XVIIIa (A= O N N (S) N N O HCl N (S) N H N H ) H N (S) N O N H N H .x HCl (S) HN O XVIIIa XVIIa 10 До розчину XVIIa (878 міліграм, 1,47 ммоль) в ізопропанолі (5 мл) додавали HCl (5-6 M в ізопропанолі, 15 мл). Суміш перемішували при кімнатній температурі протягом ночі. Розчинник випарювали, отриману тверду речовину XVIIIa сушили у вакуумі і використовували як є на наступній стадії. Приклад 2 – синтез сполук формули XVIIIb (A= 2.1 Отримання L-boc-пролінолу ) 15 Boc Boc HO (S) N . Me2S BH3 O 20 25 (S) N HO Комплекс боран-метилсульфід (180 мл, 1,80 моль) краплинно додавали до розчину N-Boc-Lпроліну (300 г, 1,39 моль) в безводому THF (3,0 л), який охолоджували до 0 °C. Коли виділення газу припинялося, крижану лазню видаляли і розчин перемішували при 10 °C протягом 18 годин. Тонкошарова хроматографія (TLC) показала, що вихідного матеріалу не залишилося і що утворювався бажаний продукт. Розчин охолоджували до 0 °C і повільно додавали метанол (2,4 л). Розчинники видаляли при зниженому тиску. Осад розбавляли в дихлорметані (1 л), промивали NaHCO3 (500 мл, насичений, водний) і розсолом (500 мл), сушили над MgSO 4, тверді речовини видаляли фільтрацією і розчинники фільтрату видаляли при зниженому тиску з отриманням білої твердої речовини, 260 г (93 %), що використовувався на наступній стадії без подальшого очищення. 2.2 Отримання L-boc-проліналю Boc Boc (S) 30 35 40 HO N TEMPO, NaBr NaClO (S) N O До розчину L-boc-пролінолу (100 г, 500 ммоль) в CH2Cl2 (1,5 л) при 0 °C послідовно додавали при енергійному перемішуванні 2,2,6,6-тетраметилпіперидин-1-оксил (TEMPO; 1,56 г, 10 ммоль) і NaBr (5,14 г, 50 ммоль). До отриманої суміші краплинно додавали а розчин NaHCO3 (6,3 г, 75 ммоль) і 6 % NaClO в активному хлорі (750 мл, 750 ммоль) при 0 °C протягом 1 години. TLC показала, що вихідного матеріалу не залишилося і що утворився бажаний продукт. Суміш швидко екстрагували дихлорметаном (2 × 1,5 л). Органічні шари об'єднували, промивали NaHSO4 (10 %, 1 л) і KI (4 %, 200 мл), потім Na2S2O3 (10 %, 1 л) і розсолом (1,5 л), сушили над MgSO4, тверді речовини видаляли фільтрацією, і розчинники упарювали з отриманням жовтого масла, L-boc-проліналю, (89 г, 92 %), що використовувався на наступній стадії без подальшого очищення. 2.3 Отримання проміжної сполуки XXIV 21 UA 108211 C2 5 10 До розчину L-boc-проліналю (89 г, 0,44 моль) і гліоксалю (183 мл, 40 % у воді) в метанолі (1 л) краплинно додавали водний розчин аміаку (25-28 %, 200 мл). Реакційну суміш закривали і піддавали реакції при 10 °C. Через 16 годин додавали додатковий гліоксаль (20 мл) і водний розчин аміаку (20 мл) і піддавали реакції протягом додаткових 6 годин. Розчинники видаляли при зниженому тиску і неочищену речовину розбавляли етилацетатом (1,0 л), промивали водою і розсолом, сушили над MgSO4, тверді речовини видаляли фільтрацією і розчинники видаляли при зниженому тиску. Неочищену речовину очищали колонковою хроматографією (силікагель, від дихлорметану до суміші метанол/дихлорметан 1:70) з отриманням 73 г (70 %) проміжної сполуки XXIV у вигляді білої твердої речовини. 1 H NMR: (CD3OD 400 MHz) δ 6,95 (s, 2H), 4,82-4,94 (m, 1H), 3,60-3,70 (m, 1H), 3,41-3,50 (m, 1H), 2,20-2,39 (m, 1H), 1,91-2,03 (m, 3H), 1,47 (s, 3H), 1,25 (s, 6H) 2.4 Отримання проміжної сполуки XIIIa (PG=Boc) 15 O H N O N (S) N O NBS CH2Cl2 Br 25 H N (S) H N O 1) NaOH, I2 2) Na2SO3 N O I H N (S) N N XXIV 40 O (S) N 35 XIIIa До охолодженого (лазня з крижаним етанолом -10 °C) розчину XXIV (63,0 г, 0,26 моль) в CH2Cl2 (1,5 л) порційно додавали N-бромсукцинімід (47,2 г, 0,26 моль) протягом 1 години і перемішували при схожій температурі протягом 2 годин. Реакційну суміш концентрували у вакуумі і осад очищали препаративною ВЕРХ з отриманням 25,3 г (30 %) XIIIa у вигляді світложовтої твердої речовини. 1 H NMR: CD3OD 400Mhz δ 6,99-7,03 (s, 1H), 4,77-4,90 (m, 1H), 3,61-3,68 (m, 1H), 3,42-3,50 (m, 1H), 2,20-2,39 (m, 1H), 1,89-2,05 (m, 3H), 1,47 (s, 3H), 1,27 (s, 6H). 2.4а Отримання проміжної сполуки XIII'a (PG=Boc) O 30 N N XXIV 20 O XIII'a До розчину йоду (43,3 г, 170,5 ммоль, 2 екв.) в хлороформі (210 мл) в круглодонній колбі (1 л) додавали суспензію XXIV (20 г, 84,3 ммоль) у водному розчині NаOH (2 M, 210 мл). Суміш перемішували при кімнатній температурі протягом 15 годин. До отриманої реакційної суміші додавали насичений водний розчин Na2S2O3 (100 мл) і органічний шар відділяли. Водний шар екстрагували хлороформом (4 × 150 мл). Органічні шари об'єднували, промивали водою і сушили над сульфатом магнію. Тверді речовини відфільтровували і розчин упарювали до сухого стану з отриманням дийодиду (38,61 г, 89 %). Описану вище проміжну сполуку дийодид (2,24 г, 4,58 ммоль) і сульфіт натрію (4,82 г, 38 ммоль) поміщали в круглодонну колбу (100 мл) і суспендували в суміші 30 % EtOH/вода (80 мл). Отриману суміш кип'ятили із зворотним холодильником протягом 40 годин. Розчинник видаляли і після додавання H2O (20 мл) суміш перемішували при кімнатній температурі протягом ночі. Тверді речовини відфільтровували, промивали водою і сушили у вакуумній печі з отриманням сполуки XIII'a (1,024 г, 61 %). 22 UA 108211 C2 1 H NMR (400 MHz, DMSO-d6) δ ppm 1,16 і 1,38 (2x br. s., 9 H), 1,68-2,02 (m, 3 H), 2,02-2,27 (m, 1 H), 3,18-3,38 (m, 1 H), 3,38-3,59 (m, 1 H), 4,53-4,88 (m, 1 H), 6,81 (m ~0,1 H), 7,05-7,28 (m ~0,9 H), 11,90-12,20 (m ~0,9 H), 12,22-12,40 (m ~0,1 H) 2.5 Отримання проміжної сполуки XVb (X=Br; A= , PG=Boc) 5 Br O O H N H N B Br (S) N IIIa 10 15 20 25 O N (S) Br N O NaHCO3, (dppf)PdCl2 O N O XVb 2,6-дибромнафталін (6,92 г, 24,2 ммоль), бороновий складний ефір IIIa (2 г, 4,84 ммоль), NaHCO3 (813 міліграми, 9,68 ммоль), (dppf) PdCl2 (710 міліграм, 0,968 ммоль) розчиняли в толуолі (75 мл). Додавали воду (1 мл) і суміш нагрівали протягом 7 годин при кип'ятінні із зворотним холодильником. Тверді речовини видаляли фільтрацією над дикалітом і фільтрат випарювали до сухого стану на кремнеземі. Осад очищали колонковою хроматографією елююванням градієнтом від гептану до етилацетату. Відповідні фракції об'єднували і розчинник видаляли при зниженому тиску. Осад (1,89 г, 79 %) використовували як є на наступній стадії. 2.6 Отримання проміжної сполуки XVIb (A= KF, (dppf)PdCl2, толуол , PG=Boc) Бромід XVb (1890 міліграм, 3,83 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-біс(1,3,2диоксаборолан) (2437 міліграм, 9,59 ммоль), KF (390 міліграм; 6,71 ммоль) і (dppf) PdCl 2 (281 міліграм, 0,384 ммоль) розчиняли в толуолі (50 мл) і нагрівали протягом 3 діб при кип'ятінні із зворотним холодильником. Тверді речовини видаляли фільтрацією через дикаліт і фільтрат випарювали до сухого стану на діоксиді кремнію. Осад очищали колонковою хроматографією з використанням градієнта від гептану до етилацетату. Фракції, що містять продукт, об'єднували і розчинник видаляли при зниженому тиску. Осад (1,22 г, 59 %) використовували як є в наступній реакції. 2.6а Альтернативне отримання проміжної сполуки XVIb (A= 30 23 , PG=Boc) UA 108211 C2 5 10 15 20 25 В атмосфері азоту, IIIa (25 г, 60,5 ммоль), 6-бромнафталін-2-іл трифторметансульфонат (20 г, 56,7 ммоль), K3PO4 (36,65 г, 173 ммоль) і (PPh3)4Pd (717 міліграм, 0,62 ммоль) перемішували в THF (60 мл) і воді (15 мл) в колбонагрівачі при 85 °C (кип'ятіння із зворотним холодильником) протягом 2 годин. Додавали CH2Cl2 (50 мл) і водний шар відділяли. Органічний шар сушили над MgSO4 і після фільтрації фільтрат концентрували із отриманням клейкої твердої речовини. Осад очищали колонковою хроматографією (петролейний ефір/етилацетат від 15/1 до 1/1) з отриманням XVb (20 г; 40,6 ммоль). Сполуку XVb (1 г, 2,0 ммоль), ацетат калію (0,5 г, 5,0 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-біс(1,3,2-диоксаборолан) (1,29 г, 5,0 ммоль), і Pd(dppf)Cl2 (0,1 г) перемішували в DMF (15 мл) в атмосфері аргону. Суміш нагрівали при 60 °C протягом 5 годин. Після охолодження додавали CH2Cl2 (50 мл) і суміш промивали насиченими NaHCO 3. Водний шар відділяли і екстрагували CH2Cl2. Органічні шари об'єднували і сушили над MgSO4. Після фільтрації розчинник видаляли і продукт очищали колонковою хроматографією (елюювання градієнтом петролейний ефір/етилацетат від 10/1 до 1/1) з отриманням XVIb (0,7 г, 1,3 ммоль, 65 %) у вигляді світло-жовтої твердої речовини. 2.6b Отримання проміжної сполуки VIIIb(X=Br; A= Стадія 1 , PG=Boc) 6-бром-2-нафтойну кислоту (72,3 г, 282 ммоль, 1,0 экв.) суспендували в дихлорметані (600 мл) і додавали DMF (каталітичний, 5 крапель). Порційно додавали оксалілхлорид (71,6 г, 564 ммоль, 2,0 екв.) протягом 1 години. Реакційну суміш перемішували протягом ночі з сушильною трубкою з CaCl2, розміщеною в колбі. Відбувалося повне розчинення. Реакційну суміш концентрували, додавали дихлорметан (100 мл) і розчинник знов випарювали з отриманням 6бром-2-нафтоілхлориду (76,1 г, 100 %) у вигляді масла, яке використовували на наступній стадії. Стадія 2 O NH Br Cl Br N K2CO3 CH2Cl2/H2O 1:1 O O O 30 35 Гідрохлорид N, O-диметилгідроксиламіну (41,3 г, 423 ммоль, 1,5 екв.) розчиняли у дистильованій воді (200 мл), і порційно додавали карбонат калію (117 г, 3,0 екв.) (виділення CO2). Додавали воду (300 мл) і дихлорметан (200 мл) і до цієї суміші при перемішуванні додавали розчин 6-бром-2-нафтоілхлориду (76,1 г, 282 ммоль, 1,00-екв.) в дихлорметані (300 мл). Реакційну суміш перемішували протягом 1 години. Органічний шар відділяли, сушили над сульфатом натрію, фільтрували, концентрували і сушили у вакуумі протягом ночі з отриманням 6-бром-N-метокси-N-метил-2-нафтаміду (82,9 г, 100 %) у вигляді коричневої твердої речовини. Стадія 3 Br 1) MeMgBr, THF N O Br 2) HCl O O 40 45 6-бром-N-метокси-N-метил-2-нафтамід (82,9 г, 282 ммоль, 1 екв.) розчиняли в тетрагідрофурані (600 мл) в колбі з 4 шийками в атмосфері азоту. Реакційну суміш охолоджували на крижаній лазні і краплинно додавали метилмагнійбромід (3,2 M в метилтетрагідрофурані, 197 мл, 2,2 екв.) протягом 1 години при підтриманні температури реакційної суміші між 10-15 °C. Реакційну суміш перемішували протягом 30 хвилин на крижаній 24 UA 108211 C2 5 лазні. Потім при охолоджуванні на крижаній лазні обережно краплинно додавали водний розчин хлористоводневої кислоти (2 M, 100 мл). Органічний розчинник випарювали і осаджений продукт екстрагували дихлорметаном (500 мл). Розчин сушили над сульфатом натрію, фільтрували і концентрували. Твердий осад сушили у вакуумі при 40 °C з отриманням 1-(6бромнафталін-2-іл)етанону (70,6 г, 99 %). Альтернативна методика отримання 1-(6-бромнафталін-2-іл)етанону Ацетилхлорид 10 15 20 Суміш 2-бромнафталіну (41,4 г, 200 ммоль), ацетилхлориду (11,3 мл, 160 ммоль), нітробензолу (250 мл) і AlCl3 (28g, 210 ммоль) перемішували протягом 4 годин при 100 °C (температура масляної лазні). Отриману реакційну суміш охолоджували, виливали в лід/воду (100 мл) і фільтрували. Фільтрат промивали водою (100 мл). Розчинник (нітробензол) видаляли дистиляцією. Отриманий осад кристалізували з гексану з отриманням 18 г бажаного продукту (вихід 36 %). 1 1-(6-бромнафталін-2-іл)етанон: H NMR (400 MHz, АЦЕТОНІТРІЛ-d3) δ ppm 2,66 (s, 3 H) 7,66 (dd, J=8,8, 2,0 Hz, 1 H) 7,86 (d, J=8,8 Hz, 1 H) 7,94 (d, J=8,8 Hz, 1 H) 8,02 (dd, J=8,8, 1,8 Hz, 1 H) 8,13 (d, J=2,0 Hz, 1 H) 8,53 (d, J=1,8 Hz, 1 H). Стадія 4 1) Br2, CH2Cl2 Br Br 2) (EtO)2P(O)H, NEt3 O 25 30 35 Br O 1-(6-бромнафталін-2-іл)етанон (55,6 г, 223 ммоль, 1,0 екв.) розчиняли в дихлорметані (1,3 л). Краплинно додавали дибром (78,3 г, 490 ммоль, 2,2 екв.) протягом 30 хвилин. Реакційну суміш перемішували протягом 1 години і концентрували з отриманням 2,2-дибром-1-(6бромнафталін-2-іл)етанону у вигляді твердої речовини, яку використовували як є на наступній стадії. 2,2-дибром-1-(6-бромнафталін-2-іл)етанон (90,0 г, 221 ммоль, 1,00) розчиняли в тетрагідрофурані (800 мл), додавали триетиламін (27,67 мл, 199 ммоль, 0,9 екв.), а потім диетилфосфат (45,8 г, 332 ммоль, 1,50 екв.). Реакційну суміш перемішували протягом ночі. Реакційну суміш фільтрували і розчинник видаляли у вакуумі. Отриманий осад розчиняли в етилацетаті (1,2 л) і промивали водою. Органічний шар відділяли, сушили над сульфатом натрію, фільтрували і концентрували із отриманням неочищеного 2-бром-1-(6-бромнафталін-2іл)етанону (70,3 г). Перекристалізація з ацетонітрилу дала 30 г (перша партія) і 6,5 г (друга партія) 2-бром-1-(6-бромнафталін-2-іл)етанону (50 %). Стадія 5 40 45 2-бром-1-(6-бромнафталін-2-іл)етанон (4,9 г, 14,9 ммоль, 1 екв.) суспендували в ацетонітрилі (150 мл) при 20°. Додавали (L) -Boc-пролін (3,22 г, 14,9 ммоль, 1 екв.), а потім Nетил-N-ізопропілпропан-2-амін (2,83 мл, 16,4 ммоль, 1,10 екв.). Реакційну суміш перемішували при 20 °C протягом 30 хвилин. Реакційну суміш концентрували. Осад розчиняли в дихлорметані і промивали послідовно водним розчином хлористоводневої кислоти (1 %, 100 мл) і водним розчином NaHCO3. Після висушування над сульфатом натрію, фільтрації і концентрації, 25 UA 108211 C2 5 залишкове масло (6,52 г, 94 %) використовували як є на наступній стадії. До сполуки, отриманої, як описано вище (6,52 г, 14,1 ммоль, 1,00 екв.), розчиненої в толуолі (150 мл) додавали ацетат амонію (16,3 г, 212 ммоль, 15 екв.) і суміш кип'ятили із зворотним холодильником протягом ночі. Реакційну суміш концентрували і осад кристалізували з ацетонітрилу (100 мл). Кристали фільтрували і сушили у вакуумі при 40 °C з отриманням VIIIb (3,2 г, 51 %). 2.6с Отримання проміжної сполуки IXb (A= , PG=Boc) 10 15 VIIIb (3,076 г, 6,95 ммоль), біспінаколатодибор (2,648 г, 10,43 ммоль), ацетат калію (1,365 г, 13,91 ммоль) і PdCl2(dppf) (254 міліграми, 0,348 ммоль) розчиняли в толуолі (30 мл) і нагрівали протягом 17 годин при 85 °C в атмосфері аргону. Реакційну суміш охолоджували до кімнатної температури, додавали дихлорметан (50 мл) і суміш промивали насиченим розчином NaHCO 3. Органічну фазу сушили над MgSO4, фільтрували, концентрували у вакуумі і очищали колонковою хроматографією на силікагелі (градієнтне елюювання від 20 до 50 % EtOAc в гептані) з отриманням IXb (2,63 г, 77 %). Продукт може бути осаджений з суміші гексан/i-Pr2O (3/2). 2.6d Отримання проміжної сполуки VIIIc (X=Br, A= , PG=Cbz) 20 25 30 35 40 До розчину 2-бром-1-(6-бромнафталін-2-іл)етанону (57,7 г, 175,9 ммоль, чистий на 80 %) в ацетонітрилі (1 L), додавали L-Cbz-пролін (43,8 г, 175,9 ммоль), а потім диізопропілетиламін (33,4 мл, 193,5 ммоль) і реакційну суміш перемішували протягом 40 хвилин при кімнатній температурі. Потім розчинник видаляли при зниженому тиску і отриманий осад перерозчиняли в дихлорметані (500 мл), промивали 1 % HCl (500 мл) і насиченим водним розчином NaHCO 3 (500 мл). Органічну фазу сушили за допомогою MgSO 4, фільтрували і розчинник видаляли при зниженому тиску з отриманням коричневого маслянистого осаду (80 г), який використовували як є на наступній стадії. Частина вказаного вище осаду (69,8 г, 140,6 ммоль) і ацетату амонію (162,6 г, 2,11 моль) перемішували в толуолі і кип'ятили із зворотним холодильником протягом ночі. Реакційну суміш охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Отриманий осад перемішували в суміші дихлорметану і води (1/1, 1500 мл) для осадження сполуки VIIIc. Після фільтрації і промивання водою отримували сполуку VIIIc (61,3 г, 92 %) у вигляді білого порошку. 1 H NMR (400 MHz, DMSO-d6) δ ppm 1,84 – 2,38 (m, 4 H), 3,42-3,56 (m, 1 H), 3,58-3,73 (m, 1 H), 4,84-5,20 (m, 3 H), 6,97-7,46 (m, 5 H), 7,54-7,60(m, 1 H), 7,63-7,71 (m, 1 H), 7,83-7,91 (m, 2 H), 7,95-8,05 (m, 1 H), 8,10-8,16 (m, 1 H), 8,22-8,37 (m, 1 H), 11,92-12,44 (m, 1 H). 2.7 Отримання проміжної сполуки XVIIb (A= , PG=Boc) 26 UA 108211 C2 5 10 15 20 25 30 До боронового складного ефіру XVIb (1,22 г, 2,26 ммоль), броміду XIIIa (1072 міліграми, 3,39 ммоль), бікарбонату натрію (380 міліграм, 4,52 ммоль), Pd(dppf)Cl2 (166 міліграм, 0,226 ммоль) в толуолі (50 мл), додавали воду (1 мл). Отриману суміш нагрівали при кип'ятінні із зворотним холодильником протягом ночі. Реакційну суміш фільтрували, упарювали до сухого стану і очищали колонковою хроматографією за допомогою елюювання градієнтом від гептана до етилацетату. Зібрані фракції, що містять продукт, об'єднували і леткі речовини видаляли при зниженому тиску. Осад (960 міліграм, 65 %) використовували як є в наступній реакції. 2.7а Альтернативна методика отримання проміжної сполуки XVIIb (A= , PG=Boc) XVIb (10 г, 18,5 ммоль), XIII'a (8,76 г, 24 ммоль), NaHCO 3 (9,32 г, 111 ммоль) і Pd(dppf)Cl2 (1 г) перемішували в суміші діоксан/вода (140 мл, 6/1) в атмосфері аргону. Суміш нагрівали до 85 °C протягом 15 годин. Додавали розсол (100 мл) і суміш екстрагували CH 2Cl2, після висушування над MgSO4, фільтрації і упарювання розчинника, осад очищали колонковою хроматографією за допомогою елюювання градієнтом від CH 2Cl2 до EtOAc з отриманням XVIIb (7 г, 58 %). 2.7b Альтернативна методика отримання проміжної сполуки XVIIb (A= , PG=Boc) До перемішуваного дезоксигенованого розчину VIIIb (20,0 г, 45,2 ммоль, 1,00 екв.), IIIa (20,6 г, 49,7 ммоль, 1,1 екв.) і бікарбонату натрію (11,4 г, 136 ммоль, 3,0 екв.) в суміші 1,4діоксан/вода (500 мл, 5:1) в атмосфері азоту додавали комплекс 1,1'біс(дифенілфосфіно)фероцен-паладій(II)дихлориду з дихлорметаном (2,50 г, 4,52 ммоль, 0,1 екв.). Суміш нагрівали при 80 °C в атмосфері аргону протягом 15 годин і охолоджували до кімнатної температури. Реакційну суміш розбавляли дихлорметаном (500 мл) і промивали розсолом (2 × 150 мл), сушили над сульфатом магнію; фільтрували і упарювали до сухого стану з отриманням темно-коричневої піни (43 г). Піну очищали з використанням колонкової хроматографії на силікагелі (елюювання градієнтом 0-6 % MеOH в CH2Cl2) з отриманням XVIIb 27 UA 108211 C2 (19,52 г, 65 %) у вигляді не зовсім білого порошку. 2.8 Отримання проміжної сполуки XVIIIb (A= H N N (S) N N H O N (S) (S) O H N N HCl N O ) NH N H N H x.HCl XVIIb O (S) N XVIIIb 5 До розчину XVIIb (960 міліграм, 1,48 ммоль) в CH 2Cl2 (25 мл) додавали HCl (5-6 M в ізопропанолі, 5 мл). Суміш перемішували при кімнатній температурі протягом ночі. Розчинник випарювали, отриману тверду речовину сушили у вакуумі і використовували як є на наступній стадії. 10 2.8а Альтернативна методика отримання проміжної сполуки XVIIIb (A= H N N (S) N O 15 20 (S) N N H O O (S) O H N N HCl N ) NH (S) N N H N H x.HCl XVIIb XVIIIb XVIIb (19,52 г, 30,1 ммоль, 1,00 екв.) розчиняли в дихлорметані (200 мл) і додавали HCl в ізопропанолі (5-6 Н, 300 мл). Реакційну суміш перемішували протягом 1 години при кімнатній температурі. До суспензії додавали tBuOMe (1000 мл) і суспензію перемішували при кімнатній температурі протягом 30 хвилин. Відфільтровану тверду речовину ополіскували tBuOMe (2 × 100 мл) і сушили у вакуумі протягом ночі з отриманням XVIIIb у вигляді порошку (15,2 г). 1 H NMR (400 MHz, MeOD-d4) δ ppm 2,15-2,37 (m, 2 H), 2,37-2,52 (m, 2 H), 2,52-2,69 (m, 2 H), 2,69-2,88 (m, 2 H), 3,56-3,71 (m, 4 H), 5,19-5,41 (m, 2 H), 7,90-8,02 (m, 3 H), 8,05 (dd, J=8,6, 1,6 Hz, 1 H), 8,10-8,25 (m, 4 H), 8,30 (d, J=1,4 Hz, 1 H), 8,47 (d, J=1,2 Hz, 1 H). Приклад 2a – синтез сполук формули XXVI і XXVII (A= 2a.1 Отримання проміжної сполуки XXVb (A= ) ; PG=Cbz; PG’= Boc) 25 30 До IXb (2,63 г, 5,37 ммоль), IIb (2,80 г, 6,99 ммоль), PdCl2(dppf) (298 міліграм, 0,537 ммоль) і натрійбікарбонату (1,354 г, 16,12 ммоль), додавали суміш диоксан/вода (50 мл, 5/1). Реакційну суміш нагрівали протягом 13 годин при 80 °C в атмосфері аргону. Реакційну суміш охолоджували до кімнатної температури, розбавляли дихлорметаном і додавали розсол, суміш фільтрували через декаліт і органічну фазу відділяли. Органічну фазу сушили за допомогою MgSO4, розчинник видаляли при зниженому тиску і очищали колонковою хроматографією (градієнт від 0 до 3 % метанолу в CH2Cl2) з отриманням XXVb (2,086 г, 57 %). 28
ДивитисяДодаткова інформація
Автори англійськоюVandyck, Koen, Last, Stefaan Julien, Houpis, Ioannis Nicolaos, Raboisson, Pierre Jean-Marie Bernard
Автори російськоюВандик Кун, Ласт Стефаан Жюльен, Хупис Иоаннис Николаос, Рабуассон Пьер Жан-Мари Бернар
МПК / Мітки
МПК: C07D 403/14, A61P 31/12, A61K 31/4184
Мітки: бензімідазолімідазольні, похідні
Код посилання
<a href="https://ua.patents.su/63-108211-benzimidazolimidazolni-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Бензімідазолімідазольні похідні</a>
Попередній патент: Спосіб і установка для термічної обробки квасного сусла
Наступний патент: Композиції і способи регулювання ооміцетних грибкових патогенів