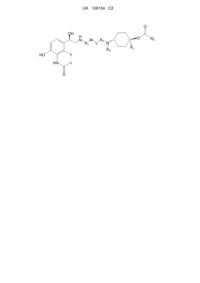
Похідні циклогексиламіну, що мають агоністичну активність по відношенню до b2 адренергічного рецептора і антагоністичної активності по відношенню до m3 мускаринового рецептора
Номер патенту: 108104
Опубліковано: 25.03.2015
Автори: Фонкерна Поу Сільвія, Лумерас Амадор Венсеслао, Катурла Хавалоес Хуан Франсіско, Айгуаде Боск Хосе, Пуіг Дуран Карлос, Прат Кіньонес Марія
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятні солі або сольвати, або дейтеровані похідні:
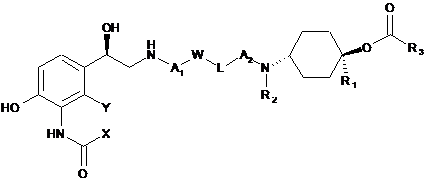 ,
,
Формула (І)
в якій:
обидва X і Y означають атом водню, або
X разом з Y утворюють групу -СН=СН-, -СН2-О- або -S-, де у випадку -СН2-О- метиленова група зв'язана з атомом вуглецю амідного замісника, що містить X, і атом кисню зв'язаний з атомом вуглецю фенільного кільця, що містить Y,
R1 і R2 незалежно означають атом водню або С1-С4-алкільну групу,
R3 означає групу формули:
і) 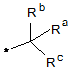 або ii)
або ii) 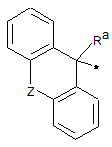 ,
,
в якій:
Ra означає атом водню, гідроксигрупу, гідроксиметильну групу або С1-С4-алкільну групу,
Rb і Rc незалежно означають тієнільну групу, фенільну групу, бензильну групу або С4-С6-циклоалкільну групу,
Z означає безпосередній зв'язок або атом кисню, і
* означає положення приєднання R3 до частини молекули формули (І), що залишилася,
А1 і А2 незалежно означають С1-С6-алкіленову групу, необов'язково заміщену однією або більше С1-С4-алкільними групами,
L означає безпосередній зв'язок, групу -О-, -NH(CO)-, -(CO)NH- або -NH(CO)O-, де у випадку -NH(CO)O- атом азоту зв'язаний з замісником W і атом кисню зв'язаний з замісником А2; і
W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або більше замісників, вибраних з групи, що включає атом галогену, С1-С4-алкільну групу, С1-С4-алкоксигрупу і ціаногрупу.
2. Сполука за п. 1, в якій X разом із Y утворює групу -СН = СН- або -СН2-О-, бажано X разом з Y утворює групу -СН=СН-.
3. Сполука за п. 1 або п. 2, в якій R1 і R2 незалежно означають атом водню або метильну групу, бажано обидва R1 і R2 означають атоми водню.
4. Сполука за п. 1 або п. 2, в якій R1 означає атом водню і R2 означає метильну групу.
5. Сполука за будь-яким з пп. 1-4, в якій R3 означає групу формули (іі), в якій Z означає атом кисню і Ra вибраний з атома водню, гідроксигрупи і метильної групи.
6. Сполука за будь-яким з пп. 1-4, в якій R3 означає групу формули (і), в якій:
Ra означає атом водню, гідроксигрупу або метильну групу, бажано Ra означає гідроксигрупу,
Rb і Rc незалежно означають тієнільну групу, циклопентильну групу або фенільну групу, бажано обидва Rb і Rc означають тієнільні групи.
7. Сполука за будь-яким з попередніх пунктів, у якій А1 і А2 незалежно означають С1-С6-алкіленову групу, необов'язково заміщену однією або двома метильними групами.
8. Сполука за будь-яким з попередніх пунктів, у якій L означає групу -О-, -NH(CO)- або -NH(CO)O-, де у випадку -NH(CO)О- атом азоту зв'язаний з замісником W і атом кисню зв'язаний з замісником А2; бажано L означає -О- або -NH(CO)-.
9. Сполука за будь-яким з попередніх пунктів, у якій W означає феніленову групу, яка необов'язково містить один або два замісники, вибрані з групи, що включає атом хлору, метильну групу, метоксигрупу і ціаногрупу, переважно феніленова група містить два замісники, вибрані з групи, що включає атом хлору, метильну групу, метоксигрупу і ціаногрупу.
10. Сполука за п. 1, в якій
X разом з Y утворює групу -СН=СН- або -СН2-О-,
R1 означає атом водню або метильну групу,
R2 означає атом водню або метильну групу,
R3 означає групу формули (і), в якій Ra означає гідроксигрупу і Rb і Rc незалежно вибрані з фенільної групи, циклопентильної групи і тієнільної групи, або R3 означає групу формули (іі), в якій Ra означає метильну групу і Z означає атом кисню,
А1 і А2 незалежно означають С1-С6-алкіленову групу, необов'язково заміщену однією або двома метальними групами,
L вибраний з групи, що включає безпосередній зв'язок, групи -О-, -NH(CO)- і -NH(CO)O-, і
W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або два замісники, вибрані з атома хлору, атома фтору, метоксигрупи і ціаногрупи.
11. Сполука за п. 10, в якій
X разом з Y утворює групу -СН=СН-,
R1 означає атом водню,
R2 означає атом водню або метильну групу,
R3 означає групу формули (і), в якій Ra означає гідроксигрупу і обидва Rb і Rc означають тієнільну групу,
А1 і А2 незалежно означають С1-С6-алкіленову групу, необов'язково заміщену однією або двома метильними групами,
L вибраний з безпосереднього зв'язку, групи -О-, -NH(CO)- і -NH(CO)O-, і
W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або два замісники, вибрані з атома хлору, метоксигрупи і ціаногрупи.
12. Сполука за п. 11, в якій R2 означає атом водню, L вибраний з групи -О-, -NH(CO)- і -NH(CO)O-, і W означає феніленову групу, яка містить два замісники, вибрані з атома хлору, метильної групи, метоксигрупи і ціаногрупи.
13. Сполука за п. 11, в якій R2 означає метильну групу, L вибраний з групи -О-, -NH(CO)- і -NH(CO)O-, і W означає феніленову групу, яка містить два замісники, вибрані з атома хлору, метильної групи, метоксигрупи і ціаногрупи.
14. Сполука за п. 1, вибрана з групи:
мурашина кислота - транс-4-[(9-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}ноніл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (2:1);
мурашина кислота - транс-4-[{2-[4-(2-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}етил)феноксі]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (1:1);
мурашина кислота - транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}етил)фенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (1:1);
транс-4-[{2-[(6-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)-етил]аміно}гексил)оксі]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-[{3-[(6-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)-етил]аміно}гексил)окси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
мурашина кислота - транс-4-[{3-[4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат (1:1);
транс-4-[{2-[4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)феноксі]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}пропіл)фенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-((3-(2-хлор-4-(((2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)-5-метоксифеніламіно)-3-оксопропіл)-(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-((3-(2-хлор-4-(((2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)феніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-[{3-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)оксі]етил}(метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид;
транс-4-[(3-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]-1-метилциклогексилгідрокси(ди-2-тієніл)ацетат;
транс-4-[(3-{[4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[(4-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}-4-оксобутил)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат;
транс-4-[(3-{[2-фтор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат;
транс-4-[(3-{[4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-3-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[(3-{[2,5-дифтор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[(3-{[2-фтор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[(3-{[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}етил)-5-метоксифеніл]аміно}-3-оксопропіл)-(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[{3-[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}етил)-5-метоксифенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[{2-[({[2-ціано-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)-оксі]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[{2-[({[2,5-дифтор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)феніл]аміно}карбоніл)оксі]етил}-(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[(3-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}-2,2-диметил-3-оксопропіл)-(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат;
транс-4-[{4-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифенокси]бутил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату гідрофторид (1:2);
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(5-гідроксі-3-оксо-3,4-дигідро-2Н-1,4-бензоксазин-8-іл)етил]аміно}метил)-5-метоксифеніл]аміно}-карбоніл)оксі]етил}(метил)аміно]циклогексилгідрокси(ди-2-тісніл)ацетат;
транс-4-[(9-{[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}ноніл)(метил)аміно]циклогексил-9-метил-9Н-ксантен-9-карбоксилат;
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)оксі]етил}(метил)аміно]циклогексил-(2R)-циклопентил(гідрокси)фенілацетат і
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)оксі]етил}(метил)аміно]циклогексил-(2S)-циклопентил(гідрокси)-2-тієнілацетат,
або її фармацевтично прийнятні солі або сольвати, або дейтеровані похідні.
15. Сполука за будь-яким з пп. 1-14, призначена для лікування організму людини або тварини за допомогою терапії.
16. Сполука за будь-яким з пп. 1-14, призначена для застосування для лікування патологічного стану або захворювання, що піддається поліпшенню внаслідок впливу одночасно агоніста β2 адренергічного рецептора і антагоніста мускаринового рецептора, де стан або захворювання переважно вибрано з групи, що включає захворювання легень, передчасні пологи, глаукому, неврологічні порушення, порушення серцевої діяльності, запалення і шлунково-кишкові порушення і більш переважно астму і хронічне або обструктивне захворювання легень.
17. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-14 разом із фармацевтично прийнятним розріджувачем або носієм.
18. Застосування сполуки за будь-яким з пп. 1-14 для приготування лікарського засобу, призначеного для лікування патологічного стану або захворювання, визначеного в п. 16.
19. Спосіб лікування суб'єкта, страждаючого від патологічного стану або захворювання, визначеного в п. 16, який включає введення зазначеному суб'єкту сполуки за будь-яким з пп. 1-14 в ефективній кількості.
20. Комбінований продукт, що містить (і) сполуку за будь-яким з пп. 1-14; і (іі) іншу сполуку, вибрану з кортикостероїду та інгібітору PDE4.
Текст
Реферат: Даний винахід належить до нових сполук, які мають подвійну активність - агоністичну по відношенню до β2 адренергічних рецепторів і антагоністичну по відношенню до М3 мускаринових рецепторів, до фармацевтичних композицій, що містять їх, до способу їх отримання та їх застосування для лікування респіраторних захворювань. UA 108104 C2 (12) UA 108104 C2 O OH H N A1 W L A2 O N R2 HO Y HN X O R1 R3 UA 108104 C2 5 10 15 20 25 30 35 40 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Цей винахід належить до нових сполук, які мають подвійну активність - агоністичну по відношенню до β2 адренергічних рецепторів і антагоністичну по відношенню до M3 мускаринових рецепторів. Даний винахід також належить до фармацевтичних композицій, що містить їх, до способу їх отримання та їх застосування для лікування респіраторних захворювань. РІВЕНЬ ТЕХНІКИ Бронхорозширюючі засоби відіграють дуже важливу роль в лікуванні респіраторних порушень, таких як ХОЗЛ і астма. Бета-адренергічні агоністи і холінергічні антагоністи є загальноприйнятими бронхорозширювальними засобами і широко використовуються в клінічній практиці. Бета-адренергічні агоністи, що застосовуються в даний час шляхом інгаляції, включають засоби короткочасної дії, такі як салбутамол (чотири рази на добу) або тербуталін (три рази на добу) та засоби тривалої дії, такі як салметерол і формотерол (два рази на добу). Ці засоби забезпечують розширення бронхів шляхом стимулювання адренергічних рецепторів, що знаходяться в гладких м'язах дихальних шляхів, звертаючи бронхозвужуючу дію різних медіаторів, таких як ацетилхолін. Застосовувані в даний час вдихувані мускаринові антагоністи включають такі, що мають короткотривалу дію іпратропійбромід або оксітропійбромід (чотири рази на добу) і мають тривалу дію тіотропій (один раз на добу). Ці засоби забезпечують розширення бронхів шляхом зменшення вагусного холінергічного тонусу гладких м'язів дихальних шляхів. На додаток до поліпшення функції легень ці засоби також покращують якість життя і послаблюють загострення. У клінічній літературі є цілий ряд досліджень, переконливо показують, що введення комбінації бета-2 агоністу і M3 антагоністу ефективніше для лікування ХОЗЛ, ніж використання компонентів окремо (наприклад, van Noord, JA, et al., Eur.Respir.J., 26, 214-222). Фармацевтичні композиції, що містять комбінацію обох типів бронхорозширюючих засобів, також відомі в даній галузі техніки стосовно до лікування респіраторних захворювань. В якості прикладу в WO2009013244 розкрита лікувальна композиція, що містить салметерол в якості бета-адренергічного агоністичного засобу і тіотропій в якості антимускаринового засобу. Одна молекула, що має подвійну активність по відношенню до мускаринових M3 і адренергічних b2 рецепторів (MABA), бажана з точки зору ефективності та зменшення побічних ефектів при лікуванні ХОЗЛ. Вона також краща з точки зору приготування препарат у порівнянні з двокомпонентною комбінацією. Її також легше готувати разом з іншими терапевтичними засобами, такими як вдихувані протизапальні засоби для проведення потрійної терапії. Таким чином, необхідні нові сполуки, одночасно мають агоністичну активність по відношенню до β2 рецептору і антагоністичну по відношенню до мускаринових рецепторів, які застосовні для лікування респіраторних захворювань, таких як астма і ХОЗЛ. КОРОТКИЙ ВИКЛАД СУТНОСТІ ВИНАХОДУ Даний винахід належить до нових сполук, які одночасно мають агоністичну активність по відношенню до β2 рецептору і антагоністичну по відношенню до мускаринових рецепторів. У відповідності з цим даний винахід належить до сполуки формули (I) або до його фармацевтично прийнятних солей або N-оксидів, або сольватів, або дейтерованих похідних: O OH H N A1 W L A2 O R2 HO R3 N R1 Y HN X O 45 Формула (I) в якій: - обидва X і Y означають атом водню або, - X разом з Y утворюють групу –CH=CH-, -CH2-O- або -S-, де у випадку CH2-O- метиленова група зв'язана з атомом вуглецю амідного замісника, що містить X, і атом кисню зв'язаний з атомом вуглецю фенільного кільця, що містить Y, 1 UA 108104 C2 - R1 і R2 незалежно позначають атом водню або C1-C4-алкільну групу, - R3 означає групу формули: 5 10 15 20 25 30 35 40 45 50 в якій: a R означає атом водню, гідроксигрупу, гідроксиметильну групу або C1-C4-алкільну групу, b c R і R незалежно означають тієнільну групу, фенільну групу, бензильну групу або C 4-C6циклоалкільну групу, Z означає безпосередній зв'язок або атом кисню, і * означає положення приєднання R3 до решти частини молекули формули (I), - A1 і A2 незалежно означають C1-C6-алкіленову групу, необов'язково заміщену однією або більше C1-C4-алкільних груп, - L означає безпосередній зв'язок, -O-, -NH(CO)-, -(CO)NH- або NH(CO)O-, де у випадку NH(CO)O- атом азоту зв'язаний з замісником W і атом кисню зв'язаний з замісником A2; та - W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або більше замісників, вибраних з групи, що включає атом галогену, C 1-C4-алкільну групу, C1-C4алкоксигрупу і цианогрупу. Даний винахід також належить до фармацевтичної композиції, що включає сполуку, запропоновану в цьому винаході, і фармацевтично прийнятний носій. Даний винахід також належить до комбінацій, що включають сполуку, запропоновану в цьому винаході, і один або більше інших терапевтичних засобів, і до фармацевтичних композицій, що включають такі комбінації. Даний винахід також відноситься до способу лікування захворювання чи патологічного стану, пов'язаного з подвійною активністю b2 адренергічного рецептора і мускаринового рецептора (наприклад, захворювання легень, такого як астма або хронічне обструктивне захворювання легень, для затримки передчасних пологів, лікування глаукоми, неврологічного порушення, порушення серцевої діяльності, запалення, урологічних порушень, таких як нетримання сечі, і шлунково-кишкових порушень, таких як синдром подразненої товстої кишки або спастичний коліт) у ссавця, який включає введення ссавцю сполуки, що пропонується в цьому винаході, в терапевтично ефективній кількості. Даний винахід також належить до способу лікування, що включає введення комбінації сполуки, що пропонується в цьому винаході, спільно з одними або більше інших терапевтичних засобів у терапевтично ефективній кількості. В інших і особливих варіантах здійснення даний винахід також відноситься до способів синтезу і проміжних продуктів, описаних в цьому винаході, які застосовні для отримання сполук, пропонованих в цьому винаході. Даний винахід також належить до сполуки, пропонованої в цьому винаході, описаному в цьому винаході в якості призначеного для застосування в терапії, а також до застосування сполуки, що пропонується в цьому винаході, для приготування препарату або лікарського засобу, призначеного для лікування захворювання чи патологічного стану, пов'язаного з подвійною активністю b2 адренергічного рецептора і мускаринового рецептора (наприклад, захворювання легень, такого як астма або хронічне обструктивне захворювання легень, для затримки передчасних пологів, лікування глаукоми, неврологічного порушення, порушення серцевої діяльності, запалення, урологічних порушень, таких як нетримання сечі, і шлунковокишкових порушень, таких як синдром подразненої товстої кишки або спастичний коліт) у ссавця. ДОКЛАДНИЙ ОПИС ВИНАХОДУ При описі сполук, композицій і способів, пропонованих в цьому винаході, наведені нижче терміни мають зазначені значення, якщо не вказано інше. При використанні в даному винаході термін C1-C4-алкіл включає лінійні або розгалужені радикали, що містять від 1 до 4 атомів вуглецю. Приклади включають метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил або трет-бутил. При використанні у цьому винаході термін C1-C6-алкілен включає двовалентні алкільні 2 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагменти, зазвичай містять від 1 до 6 атомів вуглецю, переважно від 1 до 4 атомів вуглецю. Приклади C1-C6-алкіленових радикалів включають метиленовий, етиленовий, пропіленовий, бутиленовий, пентіленовий і гексіленовий радикали. Зазначена необов'язково заміщена алкіленова група зазвичай є незаміщеною або містить 1, 2 або 3 замісника, які можуть бути однаковими або різними. При використанні у цьому винаході термін C1-C4-алкоксигрупа (або алкілоксигрупа) включає необов'язково заміщені лінійні або розгалужені що містять оксигрупу радикали, кожен з яких включає алкільні фрагменти, що містять від 1 до 4 атомів вуглецю. Приклади C1-C4алкоксильних радикалів включають метоксигрупу, етоксигрупу, н-пропоксигрупу, ізопропоксігрупу, н-бутоксігрупу, втор-бутоксігрупу і трет-бутоксігрупу. Алкоксігрупа зазвичай є незаміщеною або містить 1, 2 або 3 замісника, які можуть бути однаковими або різними. При використанні у цьому винаході термін C4-C6-ціклоалкільна група включає насичені моноциклічні або поліциклічні карбоциклічні радикали, що містять від 4 до 6 атомів вуглецю, переважно від 4 до 5 атомів вуглецю. Приклади включають циклопропіл, циклобутил, циклопентил і циклогексил. Переважними є циклопропіл, циклобутил і циклопентил. При використанні у цьому винаході термін атом галогену включає атоми хлору, фтору, брому і йоду, зазвичай атом фтору, хлору або брому. Термін галоген при використанні в якості префікса має такі ж значення. Термін "терапевтично ефективна кількість" означає кількість, достатню для проведення лікування при введенні пацієнту, потребуючому в лікуванні. Термін "лікування" при використанні в цьому винаході означає лікування захворювання чи патологічного стану у людини, що включає: (a) попередження виникнення захворювання чи патологічного стану, тобто профілактичне лікування пацієнта; (b) полегшення протікання захворювання чи патологічного стану, тобто стимулювання регресії захворювання чи патологічного стану у пацієнта; (c) придушення захворювання чи патологічного стану, тобто уповільнення розвитку захворювання чи патологічного стану у пацієнта; або (d) ослаблення симптомів захворювання чи патологічного стану у пацієнта. Вираз "захворювання або патологічний стан, пов'язаний з активністю b2 адренергічного рецептора і мускаринового рецептора" включає всі захворювання і / або патологічні стани, для яких відомо в даний час або для яких у майбутньому буде встановлено, що вони пов'язані з активністю і b2 адренергічного рецептора, і мускаринового рецептора. Такі патологічні стани включають, але не обмежуються тільки ними, захворювання легенів, такі як астма та хронічне обструктивне захворювання легенів (включаючи хронічний бронхіт та емфізему), а також неврологічні порушення і порушення серцевої діяльності. Також відомо, що активність b2 адренергічного рецептора пов'язана з передчасними пологами (див. патентну заявку WO98/09632), глаукомою і деякими типами запалення (див. патентну заявку WO99/30703 і публікацію заявки на патент EP1078629). З іншого боку, активність рецептора M3 пов'язана з порушеннями шлунково-кишкового тракту, такими як синдром подразненої товстої кишки (СРК) (див. наприклад, US5397800), виразки шлунково-кишкового тракту, спастичний коліт (див. наприклад, US4556653); із порушеннями сечових шляхів, такими як нетримання сечі (див. наприклад, J.Med.Chem., 2005, 48, 6597-6606), полакіурія; морська хвороба і викликана блукаючим нервом синусова брадикардія. Термін "фармацевтично прийнятна сіль" означає сіль, отриману з основи або кислоти, яка застосовна для введення пацієнтові, такому як ссавець. Такі солі можна отримати з фармацевтично прийнятних неорганічних або органічних основ і з фармацевтично прийнятних неорганічних або органічних кислот. Солі, одержані з фармацевтично прийнятних кислот, включають солі оцтової, бензолсульфонової, бензойної, камфорсульфонової, лимонної, етансульфонової, мурашиної, фумарової, глюконової, глутамінової, бромистоводневої, хлористоводневої, фтористоводневої, молочної, малеїнової, яблучної, мигдальної, метансульфонової, слізової, азотної, пантотенової, фосфорної, бурштинової, сірчаної, винної, п-толуолсульфонової, ксінафоевої (1-гідрокси-2нафтойної), нападісилової (1,5-нафталіндісульфонова кислота) тріфенілоцтової кислоти і т.п. Особливо переважними є солі, одержані з мурашиної, фумарової, бромистоводневої, хлористоводневої, фтористоводневої, оцтової, сірчаної, метансульфонової, ксінафоевої, винної, малеїнової, бурштинової, нападісилової кислоти. Солі, одержані з фармацевтично прийнятних неорганічних основ, включають солі алюмінію, амонію, кальцію, міді, заліза (III), заліза (II), літію, магнію, марганцю (III), марганцю (II), калію, 3 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 натрію, цинку і т. п. Особливо переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, одержані з фармацевтично прийнятних органічних основ, включають солі первинних, вторинних і третинних амінів, включаючи заміщені аміни, циклічні аміни, природні аміни і т.п., такі як аргінін, бетаїн, кофеїн, холін, N, N'-дібензілетілендіамін, діетиламін, 2-діетіламіноетанол, 2-діметіламіноетанол, етаноламін, етилендіамін, N-етилморфоліном, N-етілпіперідін, Глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламінна, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, тріпропіламін, трометамін і т.п. Термін "сольват" означає комплекс або агрегат, утворений однією або більше молекул розчиненої речовини, тобто сполуки, що пропонується в цьому винаході, або його фармацевтично прийнятної солі та однієї або більше молекул розчинника. Такі сольвати зазвичай є кристалічними твердими речовинами, що мають в основному постійне молярне співвідношення розчиненої речовини і розчинника. Типові розчинники включають, наприклад, воду, метанол, етанол, ізопропанол, оцтову кислоту і т.п. Якщо розчинником є вода, то утворений сольват є гідратом. При використанні у цьому винаході термін сольват означає сполуку, що додатково включає стехіометричну або нестехіометричну кількість розчинника, такого як вода, ацетон, етанол, метанол, дихлорметан, 2-пропанол і т.п., зв'язаного з допомогою нековалентних міжмолекулярних сил. Якщо розчинником є вода, то замість терміну сольват використовують термін гідрат. При використанні у цьому винаході термін дейтеровані похідні включає сполуки, пропоновані в цьому винаході, в яких в певному положенні щонайменше один атом водню замінений на 2 дейтерій. Дейтерій (D або H) є стабільним ізотопом водню, вміст якого в природі складає 0,015. %. Реакція обміну водню на дейтерій (введення дейтерію) є хімічною реакцією, при якій зв'язаний ковалентним зв'язком атом водню замінюється на атом дейтерію. Така реакція обміну (введення) може протікати повністю або частково. Зазвичай дейтероване похідне сполуки, що пропонується в цьому винаході, має коефіцієнт ізотопного збагачення (відношення вмісту ізотопу до змісту цього ізотопу в природі, тобто виражений у відсотках вміст дейтерію, введеного замість водню в певне положення в молекулі) для кожного що міститься атома дейтерію, знаходиться в положенні, позначеному, як можливе положення дейтерування в сполуці, що дорівнює не менше 3500 (вміст дейтерію дорівнює 52,5 %). У бажаному варіанті здійснення коефіцієнт ізотопного збагачення дорівнює не менше 5000 (вміст дейтерію дорівнює 75 %). У більш бажаному варіанті здійснення коефіцієнт ізотопного збагачення дорівнює не менше 6333,3 (вміст дейтерію дорівнює 95 %). У найбільш бажаному варіанті здійснення коефіцієнт ізотопного збагачення дорівнює не менше 6633,3 (вміст дейтерію дорівнює 99,5 % дейтерій). Слід розуміти, що коефіцієнт ізотопного збагачення для кожного що міститься атома дейтерію, що знаходиться в положенні, позначеному, як положення дейтерування, не залежить від дейтерування в інших положеннях. Коефіцієнт ізотопного збагачення можна визначити з використанням звичайних аналітичних методик, відомих фахівцеві в даній галузі техніки, включаючи мас-спектрометрію (МС) і ядерний магнітний резонанс (ЯМР). Термін "захисна група аміногрупи" означає захисну групу, придатну для виключення небажаних реакцій по амінному атому азоту. Типові захисні групи аміногрупи включають, але не обмежуються тільки ними, форміл; ацильні групи, наприклад, алканоільні групи, такі як ацетил; алкоксікарбонільні групи, такі як трет-бутоксікарбоніл (Boc); арілметоксікарбонільні групи, такі як бензілоксікарбоніл (Cbz) і 9 - флуоренілметоксікарбоніл (Fmoc); арилметільні групи, такі як бензил (Bn), тритій (Tr) та 1,1-ди-(4'-метоксифеніл) метил; силільні групи, такі як триметілсиліл (ТМС) та трет-бутилдіметилсиліл (ТБС), і т.п. Термін "захисна група гідроксигрупи" означає захисну групу, придатну для виключення небажаних реакцій за гідроксигрупою. Типові захисні групи гідроксігрупи включають, але не обмежуються тільки ними, алкільні групи, такі як метил, етил і трет-бутил; ацильні групи, наприклад, алканоільні групи, такі як ацетил; арилметильні групи, такі як бензил (Bn), пметоксібензіл (ПМБ), 9-флуоренілметіл (Fm), і діфенілметіл (бензгідріл, ДФМ); силільні групи, такі як тріметілсіліл (ТМС) та трет-бутілдіметілсіліл (ТБС), і т.п. Сполуки, пропоновані в цьому винаході, містять щонайменше один хіральний центр. Якщо міститься більше одного хірального центру, то в обсяг цього винаходу входять окремі діастереоізомери і суміші діастереоізомерів, в яких всі діастереоізомери можуть міститися в однакових кількостях або які можуть бути збагачені одним або більше діастереоізомерів. 4 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зазвичай X разом з Y утворюють групу -CH=CH- або -CH2-O-. Бажано, якщо X разом з Y утворюють групу -CH=CH-. Зазвичай R1 і R2 незалежно означають атом водню або метильну групу; переважно, якщо R 1 означає водень і R2 означає метильну групу, R1 і R2 обидва означають метильні групи або обидва R1 і R2 означають атоми водню. В особливо бажаному варіанті здійснення R1 означає атом водню і R2 означає метильну групу. a Зазвичай R3 означає групу формули ii), в якій Z означає атом кисню і R вибраний з групи, що включає атом водню, гідроксигрупу і метильну групу. Зазвичай R3 означає групу формули i) в якій: a a - R означає атом водню, гідроксигрупу або метильну групу, переважно, якщо R означає гідроксигрупу, b c - R і R незалежно означають тієнільну групу, циклопентильну групу або фенільну групу; b c переважно тієнільну групу або фенільну групу; та більш переважно обидва R і R означають тіенільні групи. Зазвичай A1 і A2 незалежно означаютьC1-C6-алкіленову групу, необов'язково заміщену однією або двома метильними групами. Зазвичай L вибраний із групи, що включає групи -O-, -NH(CO)- і NH(CO)O-, де у випадку-NH (CO) O-атом азоту зв'язаний з замісником W і атом кисню зв'язаний з замісником A2. Переважно, якщо L вибраний з групи, що включає групи-O-і -NH(CO)-. Для виключення сумнівів відзначимо, що права частина фрагментів, позначених в якості можливих груп L, приєднана до A2 і ліва частина позначених фрагментів приєднана до W. Зазвичай W означає феніленову групу, яка необов'язково містить один або два замісники, вибраних з групи, що включає атом хлору, метильну групу, метоксигрупу і ціаногрупу, переважно феніленова група містить два замісники, вибрані з атома хлору, метильної групи, метоксигрупи і ціаногрупи. В одному варіанті здійснення даного винаходу X разом з Y утворює групу-CH=CH-або -CH2O-, R1 означає атом водню або метильну групу, R2 означає атом водню або метильну групу, R3 a b c означає групу формули (i), в якій R означає гідроксигрупу і R і R незалежно вибрані з фенільної групи, циклопентильної групи і тіенільної групи, або R 3 означає групу формули (ii), в a якій R означає метильну групу і Z означає атом кисню, A1 і A2 незалежно означають C1-C6алкіленову групу, необов'язково заміщену однією або двома метильними групами, L вибраний з безпосереднього зв'язку, групи-O-,-NH (CO) - і NH (CO) O-, та W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або два замісники, вибрані з атома хлору, атома фтору, метоксигрупи і ціаногрупи. Переважно, якщо X разом з Y утворює групу CH=CH-, R1 означає атом водню, R2 означає атом водню або метильну групу, R3 означає групу a b c формули (i), в якій R означає гідроксигрупу і обидва R і R означають тієнільну групу, A1 і A2 незалежно означають C1-C6-алкіленову групу, необов'язково заміщену однією або двома метильними групами, L вибраний з безпосереднього зв'язку, групи O-,-NH (CO) - і-NH (CO) O-, та W означає безпосередній зв'язок або феніленову групу, яка необов'язково містить один або два замісники, вибрані з атома хлору, метоксигрупи і ціаногрупи. Більш переважно, якщо R 2 означає атом водню, L вибраний із групи -O-, NH(CO)- і -NH(CO)O-, і W означає феніленову групу, яка містить два замісники, вибрані з атома хлору, метилу, метоксигрупи або ціаногрупи. У бажаному варіанті здійснення X разом з Y утворює групу -CH=CH-, R1 означає атом a водню, R2 означає метильну групу, R3 означає групу формули (i), в якій R означає гідроксигрупу b c і обидва R і R означають тієнільну групу, A1 і A2 незалежно означають C1-C6-алкіленову групу, необов'язково заміщену однією або двома метильними групами, L вибраний з групи-O-,-NH (CO) - і NH (CO) O-і W означає феніленову групу, яка містить два замісники, вибраних з атома хлору, метилу, метоксигрупи або ціаногрупи. Бажані окремі сполуки, пропоновані в цьому винаході, включають наступні сполуки: мурашина кислота - транс-4-[(9-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}ноніл)(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат (2:1); мурашина кислота - транс-4-[{2-[4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін5-іл)етил]аміно}етил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат (1:1); мурашина кислота - транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін5-іл)етил]аміно}етил)фенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (1:1); транс-4-[{2-[(6-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}гексил)окси]етил}(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат гідрофторид; транс-4-[{3-[(6-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5 5 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)етил]аміно}гексил)окси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат гідрофторид; мурашина кислота - транс-4-[{3-[4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)фенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (1:1); транс-4-[{2-[4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)-ацетат гідрофторид; транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}пропіл)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)-ацетат гідрофторид, транс-4-((3-(2-хлор-4-(((2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно)метил)-5-метоксифеніламіно)-3-оксопропіл)(метил)аміно)-циклогексилгідрокси(ди2-тієніл)ацетат гідрофторид; транс-4-((3-(2-хлор-4-(((2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно)метил)феніламіно)-3-оксопропіл)(метил)-аміно)циклогексилгідрокси-(ди-2тієніл)ацетат гідрофторид; транс-4-[{3-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифенокси]пропіл}(метил)-аміно]циклогексилгідрокси-(ди-2тієніл)ацетат гідрофторид; транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат гідрофторид, транс-4-[(3-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]-1метилциклогексилгідрокси(ди-2-тієніл)ацетат, транс-4-[(3-{[4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[(4-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-4-оксобутил)(метил)аміно]-циклогексилгідрокси(ди2-тієніл)ацетат, транс-4-[(3-{[2-фтор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди2-тієніл)ацетат, транс-4-[(3-{[4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-3-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]циклогексилгідрокси(ди2-тієніл)ацетат гідрофторид (1:2), транс-4-[(3-{[2,5-дифтор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[(3-{[2-фтор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)феніл]аміно}-3-оксопропіл)-(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[(3-{[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)-5-метоксифеніл]аміно}-3-оксопропіл)-(метил)аміно]циклогексилгідрокси(ди2-тієніл)ацетат гідрофторид (1:2), транс-4-[{3-[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)-5-метоксифенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[{2-[({[2-циано-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат гідрофторид (1:2), транс-4-[{2-[({[2,5-дифтор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)феніл]аміно}карбоніл)окси]етил}-(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[(3-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-2,2-диметил-3оксопропіл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат, транс-4-[{4-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифенокси]бутил}(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), 6 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(5-гідрокси-3-оксо-3,4-дигідро-2H-1,4-бензоксазин8-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат, транс-4-[(9-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}ноніл)(метил)аміно]циклогексил-9-метил-9H-ксантен-9-карбоксилат, транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)-окси]етил}(метил)-аміно]циклогексил-(2R)циклопентил(гідрокси)фенілацетат, і транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)-окси]етил}(метил) аміно]циклогексил-(2S)циклопентил(гідрокси)2-тієнілацетат. Особливий інтерес представляють сполуки: мурашина кислота - транс-4-[(9-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}ноніл)(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат (2:1); мурашина кислота - транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін5-іл)етил]аміно}етил)фенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (1:1); транс-4-[{3-[(6-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}гексил)окси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат гідрофторид; мурашина кислота - транс-4-[{3-[4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)фенокси]пропіл}(метил)-аміно]циклогексилгідрокси-(ди-2-тієніл)ацетат (1:1); транс-4-((3-(2-хлор-4-(((2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно)метил)-5-метоксифеніламіно)-3-оксопропіл)-(метил)аміно)-циклогексилгідрокси(ди2-тієніл)ацетат гідрофторид, транс-4-[{3-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифенокси]пропіл}(метил)-аміно]циклогексилгідрокси-(ди-2тієніл)ацетат гідрофторид, транс-4-[(3-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]-1метилциклогексилгідрокси(ди-2-тієніл)ацетат, транс-4-[(4-{[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-4-оксобутил)(метил)аміно]-циклогексилгідрокси(ди2-тієніл)ацетат, транс-4-[(3-{[2-фтор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]-циклогексилгідрокси(ди2-тієніл)ацетат, транс-4-[(3-{[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)-5-метоксифеніл]аміно}-3-оксопропіл)(метил)аміно]-циклогексилгідрокси(ди2-тієніл)ацетат гідрофторид (1:2), транс-4-[{3-[2-хлор-4-(2-{[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)-5-метоксифенокси]пропіл}(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), транс-4-[{2-[({[2-циано-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)-окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат гідрофторид (1:2), транс-4-[{4-[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифенокси]бутил}(метил)-аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид (1:2), і транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(5-гідрокси-3-оксо-3,4-дигідро-2H-1,4-бензоксазин8-іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат, і транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)-5-метоксифеніл]аміно}карбоніл)-окси]етил}(метил)-аміно]циклогексил-(2R)циклопентил(гідрокси)фенілацетат. В одному варіанті здійснення даного винаходу фармацевтична композиція додатково включає одне або більше інших терапевтичних засобів в терапевтично ефективних кількості, переважно один або більше лікарських засобів, вибраних з групи, що включає кортикостероїди та інгібітори PDE4. Варіантом здійснення цього винаходу також є фармацевтична композиція, приготовлена для введення шляхом інгаляції. Сполуки, пропоновані в цьому винаході, визначені вище в цьому винаході, також можна 7 UA 108104 C2 5 10 15 20 25 30 35 40 45 об'єднувати з одним або більше інших терапевтичних засобів, переважно з одним або більше лікарських засобів, вибраних з групи, що включає кортикостероїди та інгібітори PDE4. Даний винахід також належить до сполук формули (I), призначених для застосування для лікування патологічного стану або захворювання, пов'язаного одночасно з активностями b2 адренергічного рецептора і мускаринового рецептора, такого як захворювання легенів. Зокрема, захворюванням легень є астма або хронічне обструктивне захворювання легень. Пропоновані сполуки, в обсязі цього винаходу також можна застосовувати для лікування захворювання чи патологічного стану, вибраного з групи, що включає передчасні пологи, глаукому, неврологічні порушення, порушення серцевої діяльності і запалення, урологічні порушення, такі як нетримання сечі, и шлунково-кишкові порушення, такі як синдром подразненої товстої кишки або спастичний коліт. Даний винахід також належить до застосування сполук формули (I) для приготування лікарського засобу, призначеного для лікування захворювання чи патологічного стану, пов'язаного з активністю b2 адренергічного рецептора або мускаринового рецептора або їх обох, такого як захворювання легенів, переважно астма або хронічне обструктивне захворювання легенів, передчасні пологи, глаукоми, неврологічних порушень, захворювань серця, запалення, урологічних порушень і шлунково-кишкових порушень. Даний винахід також належить до способу лікування цих захворювань, який включає введення терапевтично ефективної кількості фармацевтичної композиції, що містять подвійні агоністи b2 адренергічного рецептора і антагоністи мускаринового рецептора, пропоновані в цьому винаході. Спосіб додатково включає введення терапевтично ефективної кількості одного або більшої кількості інших терапевтичних засобів, вибраних з групи, що включає кортикостероїд і інгібітор PDE4. Даний винахід також належить до способу модулювання активності b2 адренергічного рецептора і / або рецептора M3, спосіб включає стимулювання b2 адренергічного рецептора і / або блокування рецептора M3 з допомогою модулюючої кількості сполук формули (I). ЗАГАЛЬНІ методики СИНТЕЗУ Сполуки, пропоновані в цьому винаході, можна отримати з використанням методик та процедур, описаних у цьому винаході, або з використанням аналогічних методик і процедур. Слід розуміти, що, якщо вказані типові або переважні умови здійснення способу (тобто температура, тривалість реакції, молярні співвідношення реагентів, розчинники, тиск і т.п.), то, якщо не вказано інше, можна використовувати інші умови здійснення способу. Оптимальні умови проведення реакції можуть змінюватися в залежності від конкретних використовуються реагентів або розчинника, але такі умови фахівець у даній галузі техніки може встановити за допомогою стандартних методик оптимізації. Крім того, як повинно бути зрозуміло фахівцям в даній галузі техніки, для захисту деяких функціональних груп від вступу в небажані реакції може знадобитися використання звичайних захисних груп. Вибір захисної групи, підходящої для конкретної функціональної групи, а також відповідних умов запровадження та видалення захисної групи добре відомий в даній галузі техніки. Наприклад, численні захисні групи і їх введення та видалення описані в публікації T. W. Greene і G. M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999, и в цитованій в ній літературі. Способи отримання сполук, пропонованих в цьому винаході, є іншими варіантами здійснення цього винаходу і проілюстровані за допомогою наведених нижче методик. Один з найбільш підходящих шляхів отримання сполук формули (I) наведено на схемі 1. 8 UA 108104 C2 Схема 1 OP1 H N O P2 Y X P3O HN X1 + O W A A1 L 2 N R2 R3 R1 (II) O (III) + O R0 O O O W A2 A0 L N R2 OH H N R3 R1 HO (IV) O Y HN X O R3 R1 (I) O X1 P3O O Y X HN OP1 W A A1 L 2 N R2 O + H2N A1W L A2 N R3 R1 R2 (V) (VI) 5 10 15 20 25 30 Сполуки формули (I) можна отримати за реакцією проміжних продуктів формули (II), в якій X1 означає відщеплювану групу, таку як атом галогену або активний складний ефір, такий як мезилат або тозілат, з проміжними продуктами формули (III), в якій P 1 і P3 незалежно означають атом водню або захисну групу кисню, таку як силілова або бензилова проста ефірна група і P 2 означає атом водню або захисну групу азоту, таку як, наприклад, бензільну групу. Цю реакцію найкраще проводити в апротонному полярному розчиннику, такому як ДМФ (диметилформамід), 1-метил-2-піролідон або ДМСО (диметилсульфоксид), в діапазоні температур від кімнатної температури до 200 °C, в присутності поглинача кислоти, такого як гідрокарбонат натрію або третинний амін. Альтернативно, сполуки формули (I) можна отримати за реакцією проміжних продуктів формули (V) з проміжними продуктами формули (VI), в якій X1, P1 і P3 мають такі ж значення, як вказано вище, за тією ж методикою синтезу, яка розкрита вище; з подальшим видаленням будьякої захисної групи, що міститься в проміжному продукті, з отриманням сполуки формули (I). Такі реакції видалення захисних груп включають, наприклад, реакцію десилілування з використанням триетиламінтригідрофторида, ТБАФ (тетрабутіламмоній фторид), хлориду водню або інших кислих реагентів в інертному розчиннику, такому як ТГФ (тетрагідрофуран), в діапазоні температур від 0 до 50 °C. Видалення захисної групи також можна провести за реакцією дебензилування, наприклад, гідруванням сполуки в присутності каталізатора, такого як паладій на деревному вугіллі, в інертному розчиннику, такому як етанол або ТГФ або суміш розчинників. Цю реакцію зазвичай проводять при тиску водню, рівному від 10 до 60 фунт2 сила/дюйм , і в діапазоні температур від кімнатної температури до 50 °C. В іншому альтернативному шляху сполуки формули (I) також можна отримати з реакції проміжних продуктів формули (IV), у якій A0 означає групу, яка разом із знову утвореною сусідньою метиленовою групою дає групу A1, де R0 означає водень або C1-C4-алкільну групу, з проміжними продуктами формули (III). Цю реакцію найкраще проводити в розчиннику або суміші розчинників, таких як ТГФ, метанол, дихлорметан або ДМСО, при температурі від 0 до 60 °C з використанням гідриду, такого як борогідрід натрію або тріацетоксіборогідріда натрію в якості відновного реагенту. Проміжні продукти формули (II) можна отримати з наявних у продажі вихідних речовин і реагентів за добре відомим методикам, як це показано на схемі 2. 35 9 UA 108104 C2 Схема 2 P4 OH N R2 R1 O O + O P4 R3 (XI) (XII) O N R2 R3 R1 (X) O H X1 W A A1 L 2 X3 N R2 O R3 R1 HO (VIII) (IXb) W A A1 L 2 X 3 (IXa) O O X1 O W A A1 L 2 N R2 R3 HO R1 10 15 20 25 30 R3 R1 (VII) (II) 5 O W A A1 L 2 N R2 Проміжні продукти формули (II) можна отримати з похідних спирту формули (VII) шляхом ацилювання сульфонілгалогенідами в присутності поглинача кислоти або галогенуванням різними галогенуючими реагентами. Проміжні продукти формули (VII) можна отримати прямим алкілуванням аміну формули (VIII) відповідним алкілуючим фрагментом (IXa), в якому X 3 означає відщеплювану групу, таку як атом галогену або активний складний ефір, такий як мезилат або тозілат, у присутності поглинача кислоти, такого як третинний амін. Альтернативно, проміжні продукти формули (II) можна прямо одержати з проміжних продуктів формули (VIII) і проміжних продуктів (IXb), в яких X1 і X3 є такими, як зазначено вище. Складноефірні похідні амінів формули (VIII) можна отримати шляхом видалення захисної групи зі сполук формули (X), в якій P4 означає захисну групу, наприклад, шляхом видалення трет-бутоксикарбонільної групи (BOC) у присутності кислих середовищ, таких як хлорид водню в ТГФ. Проміжні продукти формули (X) краще всього отримувати за реакцією переетеріфікаціі з використанням в якості вихідних речовин відомих з літератури похідних аміноспиртів формули (XII) і складного метилового ефіру формули (XI), зазвичай у присутності основи, такої як гідрид натрію, и шляхом зміщення рівноваги за допомогою відгонки розчинника, такого як толуол. Проміжні продукти формули (III) докладно описані в літературі (див. наприклад, US2004242622, приклад 6; WO2008149110, проміжний продукт 65; US2007249674, приклад 3B), і можна отримати за тими ж методиками синтезу, які описані в цій літературі. Проміжні продукти формули (IV) можна отримати шляхом окислення проміжних продуктів формули (XIII) окислювальним реагентом, таким як діоксид марганцю або реагент ДессаМартіна, або прямим алкілуванням проміжного продукту формули (VIII) алкілуючим реагентом формули (XIV) у присутності поглинача кислоти. Сполуки (IV) також можна отримати шляхом гомологізаціі альдегідів (XVIII) за реакцією з метоксиметилтрифенілфосфіном у присутності основи, такої як біс (триметилсиліл) амід літію, з наступним кислотним гідролізом проміжного простого ефіру енолу або шляхом окислення вінілпохідних (XX), в свою чергу, отриманих алкілуванням (VIII) проміжними продуктами (XIX). Це окислення можна провести за допомогою безлічі різних реагентів, таких як тетраоксид осмію, у присутності N-метилморфолін-N-оксиду. 10 UA 108104 C2 Схема 3 R0 HO O A0 W L A2 R3 O R1 N R2 (XIII) O R0 O R0 W A0 H A2 L N R2 X1 O R3 O R1 (XIV) O A0 W L A2 O R1 N R2 (VIII) R3 (IV) H O O A0 W L A2 R3 O R1 N R2 (XVIII) R0 O R0 W A0 H A2 L X1 R3 N R2 A0 W O R1 (XIX) O L A2 O R1 N R2 (VIII) R3 (XX) 5 Проміжні продукти формули (V) можна отримати з їх захищених по атому N гомологів (XV) за допомогою специфічної реакції видалення захисної групи, такої як обробка N-BOC-похідного кислими середовищами, такими як хлорид водню в ТГФ. Схема 4 P5 H N A1 W L A3 O O (XVII) + or P5 H N A1 W L A2 H O N R2 R3 R1 (VIII) X1 (XVI) O O H2N 10 15 W A1 L A2 O N R2 R3 P5 R1 H N O W A2 A1 L N R2 R3 R1 (XV) (V) Проміжні продукти формули (XV), у свою чергу, одержують з проміжних продуктів формули (VIII) за методиками, добре відомими в даній галузі техніки, такими як методики алкілування проміжними продуктами формули (XVI) у присутності поглинача кислоти, такої як третинний амін, або проміжними продуктами формули (XVII), в якій A3 і ще 3 додаткових атома вуглецю дають A2. 11 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПРИКЛАДИ Загальні положення. Наявні в продажі реагенти, вихідні речовини і розчинники використовували в тому вигляді, в якому вони були придбані. Концентрування означає випарювання у вакуумі з використанням роторного випарника Büchi. Продукти реакції при необхідності очищали за допомогою флеш-хроматографії на силікагелі (40-63 мкм) з використанням зазначеної системи розчинників або за допомогою препаративної ВЕРХ (високоефективна рідинна хроматографія) (див. нижче опис двох використаних систем). Спектроскопічні дані отримували на спектрометрі Varian Gemini 300. ВЕРХ-МС (високоефективна рідинна хроматографія-мас-спектроскопія) проводили на приладі Gilson, забезпеченому поршневим насосом Gilson 321, вакуумним дегазуючим пристроєм Gilson 864, пристроєм для маніпуляцій з рідинами Gilson 215, інжекційним блоком Gilson 189, Gilson Valvemate 7000, пристроєм ділення проб 1/1000, підкачуючим насосом Gilson 307, детектором з діодною матрицею Gilson 170 і детектором Thermoquest Finnigan aQa. Система ВЕРХ 1: Колонка C-18 з діоксидом кремнію з оберненою фазою, що випускається фірмою MERCK, суміші вода / ацетонітрил в якості елюентів [забуферені за допомогою 0,1 % об. / об. форміату амонію] в градієнтному режимі від 0 до 100 %. Система ВЕРХ 2: Колонка C-18 з діоксидом кремнію з оберненою фазою, що випускається фірмою MERCK, суміші вода / ацетонітрил (без буфера) в якості елюентів в градієнтному режимі від 0 до 100 %. Проміжний продукт 1 - трет-Бутил-(транс-4-гідроксициклогексил)-карбамат До розчину (1R, 4R)-4-аміноціклогексанолу (15 г, 0,13 моля) в ацетонітрилі (240 мл) порціями додавали ди-трет-бутилдикарбонат (31,2 г, 0,14 моля). Суміш перемішували протягом ночі при кімнатній температурі. Отриманий осад промивали сумішшю гексан / етилацетат (3:1) і гексаном і отримували шукану сполуку у вигляді білої твердої речовини (83 %). 1 H ЯМР (300 МГц, хлороформ-d) част./млн 1,17 (br. s., 2 H) 1,44 (br. s., 9 H) 1,32-1,40 (m, 2 H) 1,99 (br. s., 4 H) 3,44 (br. s., 1 H) 3,61 (br. s., 1 H) 4,38 (br. s., 1 H) Проміжний продукт 2 - транс-4-(Метиламіно) циклогексанол До суміші алюмогідриду літію (9 г, 0,23 моля) з тетрагідрофураном (425 мл) повільно додавали трет-бутил-(транс-4-гідроксициклогексил) карбамат (проміжний продукт 1, 10 г, 0,046 моля). Суміш кип'ятили зі зворотним холодильником протягом ночі. Після охолодження суміші до кімнатної температури обережно і послідовно по краплях додавали 9 мл води, 9 мл 4 н. розчину NaOH і 18 мл води. Органічний розчинник видаляли при зниженому тиску і отриману неочищену речовину розчиняли хлороформом і сушили над сульфатом магнію. Фільтрат випарювали насухо і випарювали з гексаном і отримували шукану сполуку у вигляді білої твердої речовини (89 %). Цей проміжний продукт також описаний в публікації JMC, 1987, 30(2), p313. 1 H ЯМР (300 МГц, хлороформ-d) част./млн 1,04-1,20 (m, 2 H) 1,25-1,40 (m, 2 H) 1,97 (br. s., 4 H) 2,27-2,40 (m, 1 H) 3,57-3,70 (m, 1 H) Проміжний продукт 3 - трет-Бутил-(транс-4-гідроксициклогексил)-метилкарбамат До розчину транс-4-(метіламіно) циклогексанолу (проміжний продукт 2, 5,3 г, 0,04 моля) в ацетонітрилі (92 мл) порціями додавали ди-трет-бутилдикарбонат (9,9 г, 0,04 моля). Суміш перемішували протягом ночі при кімнатній температурі. Розчинник видаляли при зниженому тиску і неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 75:1 до 4:1)) і отримували шукану сполуку у вигляді безбарвного масла (87 %). 1 H ЯМР (300 МГц, хлороформ-d) част./млн 1,34-1,43 (m, 2 H) 1,46 (s, 9 H) 1,49-1,57 (m, 2 H) 1,70 (d, J=9,89 Гц, 2 H) 2,03 (br. s., 3 H) 2,71 (br. s., 3 H) 3,57 (br. s., 1 H) Проміжний продукт 4 транс-4-[(трет-Бутоксикарбоніл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат До розчину метілгідроксі (ди-2-тієніл) ацетату (5,8 г, 0,02 моля) (отримували відповідно до Acta Chemica Scandinavica 24 (1970) 1590-1596) в безводному толуолі (95 мл) спочатку додавали розчин (проміжний продукт 3; 6 г, 0,02 моля) в безводному толуолі (95 мл) і потім гідрид натрію (60 %, 0,45 г, 0,01 моля). Через кілька хвилин суміш нагрівали при 155 °C і розчинник відганяли і одночасно заміняли. Цю процедуру проводили протягом 1,5 г. Суміш охолоджували до кімнатної температури і розбавляли ефіром (300 мл). Органічний шар промивали бікарбонатом натрію 4 % (2'200 мл) і розсолом, сушили, фільтрували і випарювали при зниженому тиску і отримували шукану сполуку у вигляді жовтої твердої речовини (69 %), що використовували на наступній стадії без додаткового очищення. + МСНР (мас-спектрометрія низького вирішення) (m/z): 452 (M+1) . 12 UA 108104 C2 5 10 15 20 25 30 35 Проміжний продукт 5 - транс-4-(Метиламіно)циклогексилгідрокси-(ди-2-тієніл)ацетат До розчину транс-4-[(трет-бутоксикарбоніл)(метил)аміно]циклогексил-гідрокси(ди-2тієніл)ацетату (проміжний продукт 4; 8,1 г, 0,01 моля) в діоксані (13,5 мл) додавали 4M розчин хлориду водню в діоксані (27 мл). Суміш перемішували при кімнатній температурі протягом 24 год. Отриманий осад відфільтровували і промивали ефіром. Неочищену речовину розчиняли у воді і додавали карбонат калію до pH=8-9. Продукт екстрагували етилацетатом і органічний шар промивали розсолом, сушили і випарювали насухо і отримували шукану сполуку у вигляді білої твердої речовини (78 %). + МСНР (m/z): 352 (M+1) . 1 H ЯМР (300 МГц, хлороформ-d) част./млн 1,14-1,30 (m, 2 H) 1,42-1,57 (m, 2 H) 1,88-2,11 (m, 4 H) 2,36-2,48 (m, 1 H) 3,71 (s, 3 H) 4,82-4,95 (m, 1 H) 6,94-7,00 (m, 2 H) 7,14-7,19 (m, 2 H) 7,25-7,30 (m, 2 H) Проміжний продукт 6 - транс-4-[(9-Бромноніл)(метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетат Транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетат (проміжний продукт 5, 0,5 г, 0,001 моля), 1,9-дибромнонан (2,9 мл, 0,01 моля) і триетиламін (0,44 мл, 0,003 моля) змішували в атмосфері азоту і перемішували при 70 °C протягом 94 год. Реакційну суміш випарювали і очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 100 до 4:1) і отримували шукану сполуку у вигляді коричневого масла (55 %). + МСНР (m/z): 556, 558 (1Br) (M, M+2) . Проміжний продукт 7 - транс-4-[(9-{[(2R)-2-{[трет-Бутил(диметил)-силіл]окси}-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етил]аміно}ноніл)-(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат Суміш транс-4-[(9-бромноніл)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)-ацетату (проміжний продукт 6; 0,44 г, 0,79 моля), 5-((1R)-2-аміно-1-{[трет-бутил(диметил)силіл]окси}етил)-8-гідроксихінолін-2(1H)-ону (отримували відповідно до синтезу 8 у US20060035931) (0,26 г, 0,79 моля) і бікарбонату натрію (0,08 г, 0,95 моля) в диметилацетаміді (9 мл) перемішували протягом ночі при 60 °C. Органічний розчинник видаляли при зниженому тиску і неочищену речовину піддавали розподілу між етилацетатом і водою. Органічний шар промивали водою і розсолом, сушили, фільтрували і випарювали і отримували неочищену речовину, яку очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 15:1 до 4:1) і отримували шукану сполуку у вигляді жовтого масла (25 %). + МСНР (m/z): 811 (M+1) . Приклад 1 - транс-4-[(9-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}ноніл)(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат-форміат (2:1) OH H N N O O S O HO O H HN OH H OH OH S O 40 45 50 До розчину транс-4-[(9-{[(2R)-2-{[трет-бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етил]аміно}ноніл)(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 7; 0,8 г, 0,13 моля) в тетрагідрофурані (5,1 мл) в атмосфері азоту додавали триетиламінтригідрофториду (0,14 мл, 0,89 моля). Реакційну суміш перемішували при кімнатній температурі протягом 20 г. Неочищену реакційну суміш розбавляли метиленхлоридом і органічний шар промивали бікарбонатом натрію і розсолом, сушили, фільтрували і випарювали. Неочищений продукт очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 1) і отримували шукану сполуку у вигляді безбарвної твердої речовини (61 %). + МСНР (m/z): 696 (M+1) . 1 H ЯМР (400 МГц, ДМСО-d6) δ част./млн 1,24 (s, 10 H) 1,36 (br. s., 6 H) 1,53 (br. s., 4 H) 1,71 (br. s., 2 H) 1,92 (br. s., 2 H) 2,14 (s, 3 H) 2,31-2,46 (m, 4 H) 2,69-2,80 (m, 2 H) 2,81-2,94 (m, 2 H) 5,23 (dd, J=8,79, 3,71 Гц, 1 H) 6,51 (d, J=10,16 Гц, 1 H) 6,95-7,00 (m, 3 H) 7,07 (dd, J=3,71, 1,37 Гц, 2 H) 7,09 (d, J=8,21 Гц, 1 H) 7,46 (dd, J=5,08, 1,17 Гц, 2 H) 8,19 (d, J=9,77 Гц, 1 H) 8,39 (br. s., 2 H, x2HCOOH) 13 UA 108104 C2 5 10 15 20 25 30 35 40 Проміжний продукт 8-2-[4-(2-Брометокси)феніл]етанол До розчину 4-(2-гідроксиетил)фенолу (5 г, 0,035 моля) в ацетоні (50 мл) додавали 1,2диброметан (15,6 мл, 1,3 моля) і карбонат калію (13 г, 0,09 моля). Суміш перемішували при 80 °C протягом 48 год. Солі відфільтровували і суміш випарювали. Отриману неочищену речовину піддавали розподілу в системі етилацетат / вода. Органічний шар промивали гідроксідом натрію 2 н., водою і розсолом, сушили, фільтрували та розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді білої твердої речовини (73 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 246 (M+1) . Проміжний продукт 9 транс-4-[{2-[4-(2-Гідроксиетил)фенокси]етил}(метил)аміно]циклогексилгідрокси-(ди-2-тієніл)ацетат. Одержували у вигляді безбарвного масла (57 %) із транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5; 0,35 г, 0,001 моля), 2-[4-(2брометокси)феніл]етанолу (проміжний продукт 8; 0,36 г, 0,0015 моля) і триетиламіну (0,27 мл, 0,002 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (от 75:1 до 25:1) + МСНР (m/z): 516 (M+1) . Проміжний продукт 10 транс-4-{Метил[2-(4-{2-[(метилсульфоніл)окси]етил}фенокси)етил]аміно}-циклогексилгідрокси(ди-2-тієніл)ацетат. До суміші транс-4-[{2-[4-(2-гідроксиетил)фенокси]етил}(метил)аміно]циклогексилгідрокси(ди2-тієніл)ацетату (проміжний продукт 9; 0,22 г, 0,44 моля) в хлороформі (3 мл) і триетиламіну (0,09 мл, 0,66 моля) при 0 °C протягом 15 хв додавали метансульфонілхлорид (0,03 мл, 0,5 моля), потім суміш перемішували при кімнатній температурі протягом 24 год. Суміш розбавляли хлороформом і промивали 4 % бікарбонатом натрію, водою і розсолом, сушили і фільтрували. Розчинник видаляли при зниженому тиску і отримували неочищену речовину, яку очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 50:1. Шукану сполуку отримували у вигляді жовтого масла (70 %). + МСНР (m/z): 594(M+1) . Проміжний продукт 11. транс-4-[{2-[4-(2-{[(2R)-2-{[трет-Бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етил]аміно}етил)фенокси]етил}(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат. Отримували у вигляді коричневого масла (33 %) із транс-4-{метил[2-(4-{2[(метилсульфоніл)окси]етил}-фенокси)етил]аміно}циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 10; 0,16 г, 0,27 моля), 5-((1R)-2-аміно-1-{[третбутил(диметил)силіл]окси}етил)-8-гідроксихінолін-2(1H)-ону (отримували відповідно до синтезу 8 у US20060035931) (0,09 г, 0,27 моля) і бікарбонату натрію (0,03 г, 0,33 моля) за експериментальною методикою, описаною для проміжного продукту 7, і отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 833(M+1) . Приклад 2 - транс-4-[{2-[4-(2-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат-форміат (1:1). 45 OH H N HO O O HN H N O S O OH O OH S 50 Отримували у виглядібілої твердої речовини (25 %) з транс-4-[{2-[4-(2-{[(2R)-2-{[третбутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 11, 0,25 г, 0,09 моля) і триетиламінтригідрофториду (0,25 мл, 1,53 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою 14 UA 108104 C2 5 10 15 20 25 30 препаративної ВЕРХ з оберненою фазою (система 1). + МСНР (m/z): 717(M+1) . Проміжний продукт 12 транс-4-[{3-[4-(2-Гідроксиетил)фенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді безбарвного масла (41 %) з 2-(4-(3-бромпропокси)феніл)етанол (отримували у відповідності з проміжним продуктом 26 у WO2008096127)(1,1 г, 0,004 моля), транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5; 1 г, 0,003 моля) і триетиламіну (0,78 мл, 0,005 моля) за експериментальною методикою, описаної для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 15:1. + МСНР (m/z): 530(M+1) . Проміжний продукт 13 транс-4-{Метил[3-(4-{2-[(метилсульфоніл)окси]етил}фенокси)пропіл]аміно}-циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді безбарвного масла (83 %) з транс-4-[{3-[4-(2гідроксиетил)фенокси]пропіл}-(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 12; 0,63 г, 0,001 моля), триетиламіну (0,14 мл, 0,001 моля) і метансульфонілхлориду (0,1 мл, 0,001 моля) за експериментальною методикою, описаної для проміжного продукту 10 (тривалість реакції: 3 год.), потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 50:1 до 15:1). + МСНР (m/z): 608 (M+1) . Проміжний продукт 14 транс-4-[{3-[4-(2-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етил]аміно}етил)фенокси]пропіл}-(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат. Отримували у вигляді коричневого масла (25 %) з транс-4-{метил[3-(4-{2[(метилсульфоніл)окси]етил}-фенокси)пропіл]аміно}циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 13; 0,6 г, 0,9 моля), 5-((1R)-2-аміно-1-{[трет-бутил(диметил)силіл]окси}етил)8-гідроксихінолін-2(1H)-ону (отримували відповідно до синтезу 8 у US20060035931) (0,3 г, 0,9 моля) і бікарбонату натрію (0,1 г, 1,2 моля) за експериментальною методикою, описаною для проміжного продукту 7 (тривалість реакції: 32 год.). Отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 847 (M+1) . Приклад 3 - транс-4-[{3-[4-(2-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}етил)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетатформіат (1:1). 35 S O OH H OH O O HO OH O H N S N HN O 40 45 50 Отримували у вигляді білої твердої речовини (27 %) з транс-4-[{3-[4-(2-{[(2R)-2-гідрокси-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}етил)фенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 14; 0,87 г, 0,25 моля) і триетиламінтригідрофториду (0,84 мл, 5,19 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 1) та ліофілізували. + МСНР (m/z): 742(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,29 (br. s., 4 H) 1,64 (br. s., 2 H) 1,72 (br. s., 2 H) 1,85 (br. s., 2 H) 2,09 (s, 3 H) 2,11 (br. s., 2 H) 2,33 (br. s., 1 H) 2,63 (br. s., 2 H) 2,73 (br. s., 3 H) 3,86 (br. s., 2 H) 4,62 (br. s., 2 H) 5,02 (br. s., 1 H) 6,44 (d, J=9,89 Гц, 1 H) 6,76 (br. s., 3 H) 6,83-6,95 (m, 3 H) 6,95-7,07 (m, 4 H) 7,40 (br. s., 2 H) 8,09 (d, J=9,89 Гц, 1 H) 8,26 (s, 1 H, HCOOH) Проміжний продукт 15-13,13,14,14-Тетраметил-1-феніл-2,5,12-триокса-13-силапентадекан. До суміші 2-(бензилокси)етанолу (1,8 мл, 0,01 моля), (6-бромгексилокси)(третбутил)диметилсілану (7,18 мл, 0,02 моля) і тетрабутиламонійброміду (0,23 г, 0,71 моля) по краплях додавали гідроксід натрію (32 % мас. / об., 9,6 мл, 0,07 моля). Суміш енергійно 15 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 перемішували протягом ночі при 70 °C. До суміші додавали воду (200 мл) і неочищену речовину екстрагували гексаном (2'100 мл), об'єднані органічні шари промивали водою, сушили, фільтрували і випарювали насухо. Отриману неочищену олію очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (від 50:1 до 5:1) і отримували шукану сполуку у вигляді безбарвного масла (85 %). + МСНР (m/z): 367(M+1) . Проміжний продукт 16-2-[(6-{[трет-Бутил(диметил)силіл]окси}-гексил)окси]етанол. До розчину 13,13,14,14-тетраметил-1-феніл-2,5,12-триокса-13-силапентадекану (проміжний продукт 15; 3,1 г, 0,008 моля) в метанолі (74 мл) додавали паладій на деревному вугіллі (10 %, 0,3 г). Суміш перемішували протягом ночі при кімнатній температурі в атмосфері водню (під тиском з балону). Каталізатор відфільтровували і фільтрат випарювали при зниженому тиску і отримували неочищену речовину, яку очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (від 9:1 до 4:1) і отримували шукану сполуку у вигляді безбарвного масла (77 %). 1 H ЯМР (300 МГц, хлороформ-d) δ част./млн 0,02 (s, 3H) 0,85 (s, 9 H) 1,31 (ddd, J=7,35, 3,98, 3,78 Гц, 4 H) 1,42-1,57 (m, 2 H) 1,97 (t, J=6,18 Гц, 2 H) 3,43 (t, J=6,59 Гц, 2 H) 3,46-3,51 (m, 2 H) 3,56 (t, J=6,45 Гц, 2 H) 3,68 (dt, J=5,84, 4,64 Гц, 2 H) Проміжний продукт 17-2-[(6-{[трет-Бутил(диметил)силіл]окси}гексил)окси]етилметансульфонат. Отримували у вигляді безбарвного масла (92 %) з 2-[(6-{[трет-бутил(диметил)силіл]окси}гексил)-окси]етанолу (проміжний продукт 16; 2 г, 0,007 моля), триетиламіну (3,52 мл, 0,02 моля) і метансульфонілхлориду (1,2 мл, 0,01 моля) за експериментальною методикою, описаною для проміжного продукту 10, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (от 5:1 до 3:1) 1 H ЯМР (300 МГц, хлороформ-d) δ част./млн 0,05 (s, 6 H) 0,89 (s, 9 H) 1,30-1,42 (m, 4 H) 1,58 (br. s., 4 H) 3,06 (s, 3 H) 3,48 (t, J=6,59 Гц, 2 H) 3,60 (t, J=6,45 Гц, 2 H) 3,69 (d, J=4,67 Гц, 2 H) 4,37 (d, J=4,39 Гц, 2 H) Проміжний продукт 18 транс-4-[{2-[(6-{[трет-Бутил(диметил)силіл]окси}гексил)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді масла (31 %) з 2-[(6-{[трет-бутил(диметил)силіл]окси}гексил)окси]етилметансульфонату (проміжний продукт 17; 0,45 г, 1,28 моля), транс-4(метиламіно)-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5, 0,3 г, 0,85 моля) і триетиламіну (0,2 мл, 1,71 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (от 50/1 до 25/1). + МСНР (m/z): 610(M+1) . Проміжний продукт 19 транс-4-[{2-[(6-Гідроксигексил)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. До розчину транс-4-[{2-[(6-{[трет-бутил(диметил)силіл]окси}гексил)-окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 18; 0,1 г, 0,28 моля) в тетрагідрофурані (2,4 мл) додавали хлористоводневу кислоту (1M, 1,13 мл). Суміш перемішували при кімнатній температурі протягом 1 год. Суміш нейтралізовували насиченим розчином бікарбонату натрію і неочищену речовину екстрагували етилацетатом, сушили, фільтрували і випарювали насухо. Шукану сполуку отримували у вигляді безбарвного масла (85 %). + МСНР (m/z): 496(M+1) . Проміжний продукт 20 транс-4-{Метил[2-({6-[(метилсульфоніл)окси]гексил}окси)етил]аміно}циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді масла (88 %) з транс-4-[{2-[(6-гідроксигексил)окси]-етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 19; 0,1 г, 0,31 моля), триетиламіну (0,09 мл, 0,64 моля)) і метансульфонілхлориду (0,042 мл, 0,54 моля) за експериментальною методикою, описаною для проміжного продукту 10, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 50:1 до 25:1). + МСНР (m/z): 574(M+1) . Проміжний продукт 21 - транс-4-[[(12R)-12-(8-Гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)14,14,15,15-тетраметил-3,13-діокса-10-аза-14-силагексадец-1іл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді коричневого масла (16 %) з транс-4-{метил[2-({6[(метилсульфоніл)окси]гексил}-окси)етил]аміно}циклогексилгідрокси(ди-2-тієніл)ацетату 16 UA 108104 C2 5 (проміжний продукт 20; 0,16 г, 0,28 моля), 5-((1R)-2-аміно-1-{[третбутил(диметил)силіл]окси}етил)-8-гідроксихінолін-2(1H)-ону (отримували відповідно до синтезу 8 в US20060035931) (0,09 г, 0,28 моля) і бікарбонату натрію (0,029 г, 0,35 моля) за експериментальною методикою, описаною для проміжного продукту 7, отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 811(M+1) . Приклад 4 - транс-4-[{2-[(6-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}гексил)окси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)-ацетатгідрофторид. HO H N O HF HO 15 20 25 30 35 40 45 50 55 O O HN 10 N S OH S O Отримували у вигляді білої твердої речовини (39 %) з транс-4-[[(12R)-12-(8-гідрокси-2-оксо1,2-дигідрохінолін-5-іл)-14,14,15,15-тетраметил-3,13-діокса-10-аза-14-силагексадец-1іл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 20, 0,24 г, 0,05 моля) і триетиламінтригідрофториду (0,25 мл, 1,53 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2) та ліофілізували. + МСНР (m/z): 699(M+1) . Проміжний продукт 22-14,14,15,15-Тетраметил-1-феніл-2,6,13-триокса-14-силагексадекан. Отримували у вигляді безбарвного масла (67 %) з 3-(бензилокси)пропан-1-ола (2 мл, 0,01 моля), (6-бромгексилокси)(трет-бутил)диметилсілан (7,1 мл, 0,02 моля), тетрабутиламонійброміду (0,24 г, 0,0007 моля) і гідроксиду натрію (32 % мас./об., 9,5 мл) за експериментальною методикою, описаною для проміжного продукту 15, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат 10:1. + МСНР (m/z): 381(M+1) . Проміжний продукт 23-3-[(6-{[трет-Бутил(диметил)силіл]окси}-гексил)окси]пропан-1-ол. Отримували у вигляді безбарвного масла (95 %) з 14,14,15,15-тетраметил-1-феніл-2,6,13триокса-14-силагексадекану (проміжний продукт 22; 3,3 г, 0,008 моля) і палладія на деревному вугіллі (10 %, 0,3 г) за експериментальною методикою, описаною для проміжного продукту 16, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат 7/1. 1 H ЯМР (300 МГц, хлороформ-d) δ част./млн 0,01 (s, 6 H) 0,85 (s, 9 H) 1,26-1,35 (m, 4 H) 1,421,59 (m, 4 H) 1,80 (d, J=5,49 Гц, 2 H) 3,38 (t, J=6,59 Гц, 2 H) 3,52-3,61 (m, 4 H) 3,69-3,78 (m, 2 H) Проміжний продукт 24-3-[(6-{[трет-Бутил(диметил)силіл]окси}гексил)окси]пропілметансульфонат. Отримували у вигляді масла (94 %) з 3-[(6-{[трет-бутил(диметил)силіл]окси}гексил)окси]пропан-1-ола (проміжний продукт 23; 1 г, 0,003 моля), триетиламін (1,7 мл, 0,01 моля) і метансульфонілхлориду (0,29 мл, 0,003 моля) за експериментальною методикою, описаною для проміжного продукту 10, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (от 100 % до 50 %). 1 H ЯМР (300 МГц, хлороформ-d) δ част./млн 0,01 (s, 6 H) 0,85 (br. s., 9 H) 1,31 (br. s., 4 H) 1,43-1,59 (m, 4 H) 1,97 (br. s., 2 H) 2,98 (s, 3 H) 3,38 (br. s., 3 H) 3,48 (br. s., 2 H) 3,57 (br. s., 2 H) 4,31 (br. s., 2 H). Проміжний продукт 25 транс-4-[{3-[(6-{[трет-Бутил(диметил)силіл]окси}гексил)окси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді коричневого масла (52 %) з 3-[(6-{[третбутил(диметил)силіл]окси}гексил)окси]пропілметансульфонату (проміжний продукт 24; 0,74 г, 0,001 моля), транс-4-(метиламіно)-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5, 0,76 г, 0,002 моля) і триетиламіну (0,6 мл, 0,004 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 20/1. + МСНР (m/z): 624(M+1) . Проміжний продукт 26 транс-4-[{3-[(6-Гідроксигексил)окси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. 17 UA 108104 C2 5 10 15 20 25 Отримували у вигляді коричневої твердої речовини (98 %) з транс-4-[{3-[(6-{[третбутил(диметил)силіл]окси}-гексил)окси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетату (проміжний продукт 25; 0,7 г, 0,001 моля) і хлористоводневої кислоти (1M, 4,3 мл) за експериментальною методикою, описаною для проміжного продукту 19, отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 510(M+1) . Проміжний продукт 27 транс-4-{Метил[3-({6-[(метилсульфоніл)окси]гексил}окси)пропіл]аміно}циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді масла (78 %) з транс-4-[{3-[(6-гідроксигексил)окси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 26; 0,57 г, 0,001 моля), триетиламіну (0,22 мл, 0,0012 моля) і метансульфонілхлориду (0,1 мл, 0,001 моля) за експериментальною методикою, описаною для проміжного продукту 10, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 20/1. + МСНР (m/z): 588(M+1) . Проміжний продукт 28 - транс-4-[[(13R)-13-(8-Гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)15,15,16,16-тетраметил-4,14-діокса-11-аза-15-силагептадец-1іл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді коричневого масла (10 %) з транс-4-{метил[3-({6[(метилсульфоніл)окси]гексил}окси)-пропіл]аміно}циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 27; 0,5 г, 0,83 моля), 5-((1R)-2-аміно-1-{[третбутил(диметил)силіл]окси}етил)-8-гідроксихінолін-2(1H)-ону (отримували відповідно до синтезу 8 у US20060035931) (0,27 г, 0,83 моля) і бікарбонату натрію (0,09 г, 1,15 моля) за експериментальною методикою, описаною для проміжного продукту 7, отриману неочищену речовину використовували на наступній стадії без додаткової обробки. + МСНР (m/z): 827(M+1) . Приклад 5 - транс-4-[{3-[(6-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}гексил)окси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетатгідрофторид. 30 S HO O HF HO OH O H N N O S HN O 35 40 45 50 Отримували у вигляді твердої речовини (16 %) з транс-4-[[(13R)-13-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)-15,15,16,16-тетраметил-4,14-діокса-11-аза-15-силагептадец-1іл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 28; 0,35 г, 0,09 моля) і триетиламінтригідрофториду (0,46 мл, 2,82 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2). + МСНР (m/z): 712(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,27 (br. s., 4 H) 1,36 (br. s., 2 H) 1,41-1,61 (m, 4 H) 1,69 (br. s., 4 H) 1,91 (br. s., 4 H) 2,12 (s, 3 H) 2,38 (br. s., 2 H) 2,64 (br. s., 3 H) 2,78 (br. s., 2 H) 3,21-3,30 (m, 4 H) 4,69 (br. s., 1 H) 5,10 (br. s., 1 H) 6,52 (d, J=9,89 Гц, 1 H) 6,92 (d, J=8,24 Гц, 1 H) 6,97 (dd, J=5,08, 3,71 Гц, 2 H) 7,07 (dd, J=3,57, 1,37 Гц, 2 H) 7,07-7,10 (m, 1 H) 7,46 (dd, J=5,08, 1,24 Гц, 2 H) 8,17 (d, J=10,16 Гц, 1 H) Проміжний продукт 29 транс-4-[[3-(4-Формілфенокси)пропіл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді жовтого масла (66 %) з 4-(3-бромпропокси)бензальдегіду (отримували відповідно до прикладу 53 у WO2008096127) (0,25 г, 0,001 моля), транс-4(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетат (проміжний продукт 5; 0,25 г, 0,0007 моля) і триетиламін (0,19 мл, 0,001 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомог колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 50/1. + МСНР (m/z): 514(M+1) . 18 UA 108104 C2 5 10 15 Проміжний продукт 30 - транс-4-[{3-[4-({[(2R)-2-{[трет-Бутил(диметил)силіл]окси}-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат До розчину транс-4-[[3-(4-формілфенокси)пропіл](метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетату (проміжний продукт 29; 25 мг, 0,05 моля) в тетрагідрофурані (0,7 мл) додавали (2R)-2-{[трет-бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етанамінійацетат (отримували відповідно до синтезу 8 у US20060035931) (24 мг, 0,06 моля). Суміш перемішували в атмосфері азоту при 60 °C протягом 6 г. Реакційну суміш охолоджували до 0 °C і тріацетоксіборогідриду натрію (32 мг, 0,15 моля) додавали. Суміш перемішували при кімнатній температурі протягом ночі. У посудину з реакційною сумішшю додавали 4 % розчин бікарбонату натрію (2 мл) (pH=8) і неочищену речовину екстрагували етилацетатом. Органічний шар промивали водою і розсолом, сушили, фільтрували та розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді масла (99 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 833(M+1) . Приклад 6 - транс-4-[{3-[4-({[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетатформіат (1:1) S OH O OH O NH HN 20 25 30 35 40 45 50 O O HO H S N OH O Отримували у вигляді блідо-жовтої твердої речовини (54 %) з транс-4-[{3-[4-({[(2R)-2-{[третбутил(диметил)-силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]-пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 30; 0,21 г, 0,21 моля) і триетиламінтригідрофториду (0,12 мл, 0,77 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 1). + МСНР (m/z): 718(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,37 (br. s., 4 H) 1,61-2,01 (m, 6 H) 2,17 (s, 3 H) 2,352,45 (m, 2 H) 2,54 (br. s., 1 H) 2,72 (br. s., 2 H) 3,77 (br. s., 2 H) 3,96 (br. s., 2 H) 4,69 (br. s., 1 H) 5,11 (br. s., 1 H) 6,48 (d, J=9,89 Гц, 1 H) 6,83-6,89 (m, 2 H) 6,92 (d, J=7,97 Гц, 2 H) 6,98 (br. s., 2 H) 7,03-7,12 (m, 3 H) 7,25 (d, J=8,51 Гц, 2 H) 7,46 (d, J=6,32 Гц, 1 H) 8,09 (d, J=9,89 Гц, 1 H) 8,27 (s, 1 H, HCOOH) Проміжний продукт 31-4-(2-Брометокси)бензальдегід. До розчину 4-гідроксибензальдегіду (3 г, 0,024 моля) в етанолі (30 мл) додавали карбонат калію (6,6 г, 0,047 моля) і 1,2-диброметан (21 мл, 0,24 моля). Реакційну суміш перемішували при 70 °C протягом 20 г. Солі відфільтровували і фільтрат концентрували. Неочищену речовину розчиняли в етилацетаті і органічний шар промивали водою, гідроксидом натрію 2 н. і розсолом, сушили і фільтрували. Органічний розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді жовто-оранжевої твердої речовини (88 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 230(M+1) . Проміжний продукт 32 транс-4-[[2-(4-Формілфенокси)етил](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат Отримували у вигляді твердої речовини (60 %) з 4-(2-брометокси)бензальдегіду (проміжний продукт 31; 0,5 г, 0,002 моля), транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5, 0,5 г, 0,001 моля) і триетиламіну (0,39 мл, 0,002 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (от 50:1 до 25:1). + МСНР (m/z): 500(M+1) . 19 UA 108104 C2 5 10 Проміжний продукт 33 - транс-4-[{2-[4-({[(2R)-2-{[трет-Бутил(диметил)силіл]окси}-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді жовтої твердої речовини (89 %) з транс-4-[[2-(4формілфенокси)етил](метил)-аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 32; 0,39 г, 0,79 моля), (2R)-2-{[трет-бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)-етанамінийацетату (отримували відповідно до синтезу 8 у US20060035931) (0,37 г, 0,96 моля) і триацетоксиборогідриду натрію (0,5 г, 2,38 моля) за експериментальною методикою, описаною для проміжного продукту 30, отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 819(M+1) . Приклад 7 транс-4-[{2-[4-({[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}метил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетатгідрофторид. 15 OH NH HF HO O 30 35 40 45 50 S OH S O 25 O O HN 20 N Отримували у вигляді блідо-жовтої твердої речовини (44 %) з транс-4-[{2-[4-({[(2R)-2-{[третбутил-(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)фенокси]етил}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 33; 0,6 г, 0,71 моля) і триетиламінтригідрофториду (0,36 мл, 2,22 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2). + МСНР (m/z): 705(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,30-1,47 (m, 4 H) 1,74 (br. s., 2 H) 1,93 (br. s., 2 H) 2,25 (s, 3 H) 2,42-2,48 (m, 4 H) 2,76 (br. s., 4 H) 3,84 (s, 1 H) 3,98 (t, J=5,91 Гц, 2 H) 4,71 (br. s., 1 H) 5,17 (br. s., 1 H) 6,49 (d, J=9,89 Гц, 1 H) 6,84-6,94 (m, 3 H) 6,98 (dd, J=5,36, 3,98 Гц, 2 H) 7,07 (br. s., 4 H) 7,30 (d, J=8,24 Гц, 2 H) 7,47 (d, J=4,94 Гц, 1 H) 8,12 (d, J=9,89 Гц, 1 H) Проміжний продукт 34-1-[4-(3-Бромпропокси)феніл]ацетон. До розчину 1-(4-гідроксифеніл)пропан-2-ону (2,2 г, 0,01 моля) в диметилформаміді (10 мл) додавали 1,3-дибромпропан (7,6 мл, 0,07 моля), карбонат калію (2,3 г, 0,01 моля) і йодид калію (0,7 г, 0,004 моля). Суміш перемішували при кімнатній температурі протягом 72 год. У посудину з реакційною сумішшю додавали воду і неочищену речовину екстрагували етилацетатом. Органічний шар промивали водою і розсолом, сушили, фільтрували і випарювали насухо. Отриману неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (від 100 % до 10 %) і отримували шукану сполуку (54 %). + МСНР (m/z): 272(M+1) . Проміжний продукт 35 транс-4-(Метил{3-[4-(2оксопропіл)фенокси]пропіл}аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді коричнево-жовтого масла (84 %) з 1-[4-(3бромпропокси)феніл]ацетону (проміжний продукт 34;1 г, 0,003 моля), транс-4(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5, 0,6 г, 0,002 моля) і триетиламіна (0,5 мл, 0,004 моля) за експериментальною методикою, описаною для проміжного продукту 6, потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 25:1. + МСНР (m/z): 542(M+1) . Проміжний продукт 36 - транс-4-[{3-[4-(2-{[(2R)-2-{[трет-Бутил(диметил)силіл]окси}-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}пропіл)фенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді жовтої спіненої речовини (57 %) з транс-4-(метил{3-[4-(2оксопропіл)фенокси]-пропіл}аміно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 35; 0,4 г, 0,72 моля), (2R)-2-{[трет-бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етанамінийацетату (отримували відповідно до синтезу 8 в US20060035931) 20 UA 108104 C2 5 (0,34 г, 0,87 моля) і триацетоксиборогідриду натрію (0,4 г, 1,84 моля) за експериментальною методикою, описаною для проміжного продукту 30, отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 861(M+1) . Приклад 8 - транс-4-[{3-[4-(2-{[(2R)-2-Гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}пропіл)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетатгідрофторид. OH HO S H N HF HN OH S O O N O O 10 15 20 25 30 35 40 45 50 Отримували у вигляді жовтої спіненої речовини (50 %) з транс-4-[{3-[4-(2-{[(2R)-2-{[третбутил(диметил)-силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етил]аміно}пропіл)фенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 36; 0,37 г, 0,0002 моля) і триетиламінтригідрофториду (1 мл, 0,01 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2) і ліофілізували. + МСНР (m/z): 746(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 0,96 (br. s., 4 H) 1,36 (br. s., 3 H) 1,61-1,97 (m, 5 H) 2,18 (br. s., 5 H) 2,43 (br. s., 4 H) 2,86 (br. s., 2 H) 3,03 (br. s., 1 H) 3,93 (br. s., 2 H) 4,68 (br. s., 1 H) 5,15 (br. s., 1 H) 6,53 (d, J=9,89 Гц, 1 H) 6,81 (br. s., 2 H) 6,86-7,00 (m, 3 H) 7,06 (br. s., 4 H) 7,25 (br. s., 1 H) 7,46 (br. s., 2 H) 8,20 (br. s., 1 H) Проміжний продукт 37 - Етил-4-аміно-5-хлор-2-метоксибензоат. Розчин 4-аміно-5-хлор-2-метоксибензойної кислоти (6,6 г, 0,031 моля) в розчині хлориду водню 1,25 M в етанолі (250 мл, 0,31 моля) перемішували в посудині високого тиску протягом 6 год. при 65 °C. Реакційну суміш підлужували гідроксидом натрію 2 н. і екстрагували метиленхлоридом. Органічний шар промивали водою, сушили і фільтрували. Розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді білої твердої речовини (78 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 230(M+1) . Проміжний продукт 38 - (4-Аміно-5-хлор-2-метоксифеніл)метанол. До розчину алюмогідриду літію (0,96 г, 0,025 моля) в тетрагідрофурані (100 мл) при кімнатній температурі по краплях додавали розчин етил-4-аміно-5-хлор-2-метоксібензоата (проміжній продукт 37; 4,4 г, 0,019 моля) в тетрагідрофурані (25 мл). Потім суміш кип'ятили зі зворотним холодильником протягом 2 год. Надлишок гідриду розкладали шляхом послідовного додавання 1 мл води, 1 мл 4 н. розчину NaOH і 2 мл води, фільтрували через целіт і промивали етилацетатом. Органічний розчинник випаровували і додавали гексан. Суміш охолоджували при 0 °C протягом 1 год. і потім осад відфільтровували і промивали гексаном. Шукану сполуку отримували у вигляді блідо-жовтої твердої речовини (80 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 188(M+1) . Проміжний продукт 39-4-({[трет-Бутил(диметил)силіл]окси}метил)-2-хлор-5-метоксианілін. До розчину (4-аміно-5-хлор-2-метоксифеніл)метанолу (проміжний продукт 38; 1,5 г, 0,008 моля) в диметилформаміді (35 мл) додавали імідазол (1,7 г, 0,02 моля). Суміш охолоджували до 0 °C і по краплях додавали хлор (ізопропіл) диметилсілан (2,5 г, 0,01 моля). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Розчинник видаляли і неочищену речовину піддавали розподілу між водою і гексаном, органічний шар промивали водою, 4 % розчином бікарбонату натрію і розсолом, сушили, фільтрували і випарювали насухо. Отриману неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан / етилацетат (від 8/1 до 4/1). Шукану сполуку отримували у вигляді жовтої твердої речовини (58 %). + МСНР (m/z): 302(M+1) . Проміжний продукт 40-N-[4-({[трет-Бутил(диметил)силіл]окси}метил)-2-хлор-5метоксифеніл]-акриламід. 21 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 До розчину 4-({[трет-бутил(диметил)силіл]окси}метил)-2-хлор-5-метоксианіліну (проміжний продукт 39; 0,2 г, 0,68 моля) в метиленхлориді (2 мл) і діетилізопропіламіном (0,17 мл, 1,02 моля) по краплях додавали розчин акрилоілхлориду (0,07 мл, 0,91 моля) в метиленхлориді (1 мл). Суміш перемішували при кімнатній температурі протягом 2 год. Суміш розбавляли метиленхлоридом і промивали 4 % розчином бікарбонату натрію і водою, розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді твердої речовини (94 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 356(M+1) . Проміжний продукт 41 - транс-4-((3-(4-((трет-Бутил(диметил)силілокси)метил)-2-хлор-5метоксифеніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. Суміш N-[4-({[трет-бутил(диметил)силіл]окси}метил)-2-хлор-5-метоксифеніл]-акриламіду (проміжний продукт 40; 0,9 г, 0,002 моля) і транс-4-(метиламіно)циклогексилгідрокси(ди-2тієніл)ацетату (проміжний продукт 5; 0,7 г, 0,002 моля) в метиленхлориді (20 мл) перемішували при 75 °C в закритій посудині протягом 64 год. Розчинник випарювали і отриману неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол (від 50/1 до 25/1) і отримували шукану сполуку у вигляді білястожовтої твердої речовини (49 %). + МСНР (m/z): 707(M+1) . Проміжний продукт 42 - транс-4-((3-(2-хлор-4-(Гідроксиметил)-5-метоксифеніламіно)-3оксопропіл)-(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. До розчину транс-4-((3-(4-((трет-бутил(диметил)силілокси)метил)-2-хлор-5метоксифеніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)-ацетату (проміжний продукт 41; 0,76 мг, 1,08 моля) в тетрагідрофурані (19 мл) додавали 1M хлористоводневу кислоту (3,25 мл, 3,25 моля). Суміш перемішували при кімнатній температурі протягом 3 год. Реакційну суміш нейтралізовували насиченим розчином бікарбонату натрію і екстрагували етилацетатом. Отриману неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ / метанол 50/1 та отримували шукану сполуку у вигляді масла (84 %). + МСНР (m/z): 593(M+1) . Проміжний продукт 43 транс-4-((3-(2-хлор-4-Форміл-5-метоксифеніламіно)-3оксопропіл)(метил)-аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. До розчину транс-4-((3-(2-хлор-4-(гідроксиметил)-5-метоксифеніламіно)-3оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 42; 0,4 г, 0,68 моля) в хлороформі (8,1 мл) порціями додавали оксиду марганцю (IV) (0,62 мг, 7,2 моля). Гетерогенну суміш перемішували при 45 °C протягом 3 г. Суміш фільтрували та розчинник видаляли при зниженому тиску і отримували шукану сполуку у вигляді жовтої твердої речовини (88 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 592(M+1) . Проміжний продукт 44 - транс-4-((3-(4-(((R)-2-(трет-Бутилдиметилсилілокси)-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)-2-хлор-5-метоксифеніламіно)-3оксопропіл)(метил)-аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді блідо-жовтої твердої речовини (84 %) з транс-4-((3-(2-хлор-4-форміл5-метоксифеніламіно)-3-оксопропіл)(метил)аміно)-циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 43; 0,5 г, 0,87 моля), (2R)-2-{[трет-бутил(диметил)-силіл]окси}-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етанамінійацетату (отримували відповідно до синтезу 8 в US20060035931) (0,5 г, 1,3 моля) і триацетоксиборогидридц натрію (0,66 г, 3,15 моля) за експериментальною методикою, описаною для проміжного продукту 30, отриману неочищену речовину використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 910(M+1) . Приклад 9 - транс-4-((3-(2-Хлор-4-(((2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно)метил)-5-метоксифеніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид. 22 UA 108104 C2 OH O H N H N N Cl O HF HO O O S OH S HN O 5 10 15 20 25 30 35 40 45 50 Отримували у вигляді білої твердої речовини (19 %) з транс-4-((3-(4-(((R)-2-(третбутилдиметилсилілокси)-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)-2-хлор-5метоксифеніламіно)-3-оксопропіл)(метил)-аміно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 44; 0,89 г, 0,74 моля) і триетиламінтригідрофториду (0,48 мл, 2,98 моля) за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2) і ліофілізували. + МСНР (m/z): 796(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,42 (br. s., 4 H) 1,76 (br. s., 2 H) 1,94 (br. s., 2 H) 2,27 (s, 3 H) 2,45-2,50 (m, 1 H) 2,59 (br. s., 2 H) 2,72 (br. s., 4 H) 3,64-3,76 (m, 5 H) 4,69 (br. s., 1 H) 5,06 (br. s., 1 H) 6,48 (d, J=9,89 Гц, 1 H) 6,87-6,94 (m, 2 H) 6,97 (dd, J=5,08, 3,71 Гц, 2 H) 7,07 (dd, J=3,71, 1,24 Гц, 2 H) 7,33 (s, 1 H) 7,47 (dd, J=5,08, 1,24 Гц, 2 H) 7,79 (s, 1 H) 8,12 (d, J=9,89 Гц, 1 H) 10,67 (s, 1 H) Проміжний продукт 45 - (4-Аміно-3-хлорфеніл)метанол. Отримували у вигляді світло-коричневої твердої речовини (76 %) з використанням в якості вихідних речовин наявного в продажу метил-4-аміно-3-хлорбензоату (4 г; 0,021 моля) і алюмогідриду літію (1,09 г; 0,028 моля) в 144 мл тетрагідрофурану за експериментальною методикою, описаною для проміжного продукту 38. + МСНР (m/z): 158(M+1) . Проміжний продукт 46-4-({[трет-Бутил(диметил)силіл]окси}метил)-2-хлоранілін. Отримували у вигляді світло-оранжевого масла (87 %) з використанням в якості вихідних речовин (4-аміно-3-хлорфеніл) метанолу (проміжній продукт 45; 2,72 г, 0,016 моля), 4,94 г (0,033 моля) хлор (трет-бутил)-диметилсілану і 3,35 г (0,049 моля) імідазолу в 68 мл ДМФ і за експериментальною методикою, описаною для проміжного продукту 39. + МСНР (m/z): 272(M+1) . Проміжний продукт 47-N-[4-({[трет-Бутил(диметил)силіл]окси}-метил)-2хлорфеніл]акриламід. Отримували у вигляді білої кристалічної твердої речовини (77 %) з використанням в якості вихідних речовин 4 - ({[трет-бутил (диметил) сіліл]-окси} метил)-2-хлораніліни (проміжній продукт 46; 2 г; 7,36 моля), акрилоілхлориду (0,78 мл; 9, 56 моля) і діетілізопропіламіна (1,92 мл, 11,04 моля) за експериментальною методикою, описаною для проміжного продукту 40. + МСНР (m/z): 326(M+1) . Проміжний продукт 48 транс-4-((3-(4-((трет-Бутил(диметил)-силілокси)метил)-2хлорфеніламіно)-3-оксопропіл)(метил)аміно)-циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді бежевої твердої речовини (45 %) з використанням в якості вихідних речовин N-[4-({[трет-бутил(диметил)силіл]окси}-метил)-2-хлорфеніл]-акриламіду (проміжний продукт 47; 0,56 г, 1,73 моля) і транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5; 0,5 г, 1,42 моля) в 14 мл дихлорметану і за експериментальною методикою, описаною для проміжного продукту 41. + МСНР (m/z): 677(M+1) . Проміжний продукт 49 транс-4-((3-(2-хлор-4-(Гідроксиметил)-феніламіно)-3оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді бежевої спіненої речовини (91 %) з використанням в якості вихідних речовин транс-4-((3-(4-((трет-бутил(диметил)-силілокси)метил)-2-хлорфеніламіно)-3оксопропіл)(метил)аміно)-циклогексилгідрокси-(ди-2-тієніл)ацетату (проміжний продукт 48; 433 мг, 0,64 моля) і 1M хлористоводневої кислоти (1,9 мл; 1,9 моля) в тетрагідрофурані (12 мл) за експериментальною методикою, описаною для проміжного продукту 42. + МСНР (m/z): 563(M+1) . Проміжний продукт 50 транс-4-((3-(2-хлор-4-Формілфеніламіно)-3оксопропіл)(метил)аміно)-циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді світло-коричневого масла (94 %) з використанням в якості вихідних речовин транс-4-((3-(2-хлор-4-(гідроксиметил)феніламіно)-3 23 UA 108104 C2 5 10 15 оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)-ацетату (проміжний продукт 49; 0,06 г, 0,11 моля) і оксиду марганцю(IV) (0,098 мг, 1,13 моля) в хлороформі (1,4 мл) за експериментальною методикою, описаною дляпроміжного продукту 43. + МСНР (m/z): 561(M+1) . Проміжний продукт 51 - транс-4-((3-(4-(((R)-2-(трет-Бутилдиметилсилілокси)-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)-2-хлорфеніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді білої твердої речовини (65 %) з використанням в якості вихідних речовин транс-4-((3-(2-хлор-4-формілфеніламіно)-3оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 50; 54 мг, 0,10 моля), (2R)-2-{[трет-бутил(диметил)-силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етанамінийацетату (отримували відповідно до синтезу 8 у US20060035931) (57 мг, 0,14 моля) і триацетоксиборогідриду натрію (77 мг, 0,35 моля) за експериментальною методикою, описаною для проміжного продукту 30, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (від CHCl3 до CHCl3/MeOH 95:5). + МСНР (m/z): 879(M+1) . Приклад 10 - транс-4-((3-(2-Хлор-4-(((2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно)метил)феніламіно)-3-оксопропіл)(метил)-аміно)циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид 20 Cl OH H N H N N O HO O O S OH S HN O 25 30 35 40 45 50 Отримували у вигляді майже білої твердої речовини (20 %) з транс-4-((3-(4-(((R)-2-(третбутилдиметилсилілокси)-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил)-2хлорфеніламіно)-3-оксопропіл)(метил)аміно)циклогексилгідрокси(ди-2-тієніл)-ацетату (проміжний продукт 50; 55 мг, 0,06 моля) і триетиламінтригідрофториду (0,04 мл, 0,25 моля) в 3 мл ТГФ за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2) і ліофілізували. + МСНР (m/z): 765(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,42 (br. s., 4 H) 1,80 (br. s., 2 H) 1,94 (br. s., 2 H) 2,27 (s, 3 H) 2,45-2,50 (m, 1 H) 2,59 (br. s., 2 H) 2,76 (br. s., 4 H) 3,64-3,76 (m, 2 H) 4,69 (br. s., 1 H) 5,31 (br. s., 1 H) 6,54 (d, J=9,89 Гц, 1 H) 6,92-6,97 (m, 2 H) 6,98-7,12 (m, 5 H) 7,25 (s, 1 H) 7,44 (dd, J=5,08, 1,24 Гц, 2 H) 7,65 (s, 1 H) 9,08 (br.s., 1 H) 10,47 (s, 1 H) Проміжний продукт 52-5-Хлор-4-гідрокси-2-метоксибензойна кислота. До суспензії 4-аміно-5-хлор-2-метоксибензойної кислоти (25 г; 0,12 моля) в 125 мл води додавали тетрафторборну кислоту (40,5 мл 48 % водного розчину). Потім білий осад на фільтрі охолоджували до 0 °C і по краплях додавали NaNO2 (9,41 г в 75 мл H2O) і суміш перемішували при цій температурі протягом 30 хв. Білий осад збирали фільтруванням. Сіль діазонію суспендували в крижаній AcOH (1250 мл) і отриману суспензію перемішували при 100 °C протягом 1 год. (вона перетворювалася в коричневий розчин). Її витримували при КТ протягом ще 2 год. Розчинник видаляли при зниженому тиску і коричневий маслоподібний залишок суспендованих в розсолі (1250 мл) і екстрагували за допомогою EtOAc (3 × 400 мл). Об'єднані органічні шари сушили над сульфатом магнію, фільтрували і випарювали при зниженому тиску і отримували коричневе масло. Очищення за допомогою препаративної ВЕРХ з оберненою фазою (від Et2O/EtOH 0/100 до 40/60) давало 3,0 г (13 %) червоної твердої речовини. + МСНР (m/z): 203(M+1) . Проміжний продукт 53 - Метил-5-хлор-4-гідрокси-2-метоксибензоат. До розчину 5-хлор-4-гідрокси-2-метоксибензойної кислоти (проміжний продукт 52; 4,17 г; 13,69 моля) в 123 мл безводного метанолу додавали 2,2 мл ацетилхлориду. Розчин перемішували при 60 °C в атмосфері азоту протягом 18 г. Розчин випарювали при зниженому тиску і залишок очищали за допомогою препаративної ВЕРХ з оберненою фазою (Cl2CH2/EtOAc від 100/0 до 80/20), і отримували 2,2 г (75 %) червоної твердої речовини. + МСНР (m/z): 217(M+1) . 24 UA 108104 C2 5 10 15 20 25 30 35 40 45 Проміжний продукт 54-2-Хлор-4-(гідроксиметил)-5-метоксифенол. Розчин метил-5-хлор-4-гідрокси-2-метоксибензоату (проміжний продукт 53; 204 мг; 0,94 моля) в 4,6 мл безводного ТГФ перемішували при зовнішньому охолодженні в бані з води з льодом. По краплях додавали розчин 1M LiAlH4 в ТГФ (1,9 мл; 1,9 моля). Через 5 хв зовнішню баню видаляли і перемішування продовжували протягом ще 3 год. при зовнішньому охолодженні додавали 0,072 мл води, потім 0,072 мл 4 н. розчину NaOH і ще 0,144 мл води. Після фільтрування осад на фільтрі ретельно промивали за допомогою ТГФ і фільтрати концентрували і отримували шукану сполуку з 34 % вихід. + МСНР (m/z): 189(M+1) . Проміжний продукт 55 - [4-(3-Бромпропокси)-5-хлор-2-метоксифеніл]метанол. Суміш 2-хлор-4-(гідроксиметил)-5-метоксифенолу (проміжний продукт 54; 0,5 г, 2,61 моля), 1,3-дибромпропану (1,61 мл; 15,71 моля) і карбонату калію (737 мг; 5,23 моля) в 12 мл ацетону нагрівали при 75 °C в герметичному посуді і перемішували протягом 16 год. Тверді речовини відфільтровували і промивали ацетоном і об'єднані фільтрати концентрували досуха і очищали за допомогою препаративної ВЕРХ з оберненою фазою (гексан / EtOAc від 0 до 40 %), і отримували шукану сполуку (80 %) у вигляді світло-жовтої масла. + МСНР (m/z): 309(M+1) . Проміжний продукт 56 транс-4-[{3-[2-Хлор-4-(гідроксиметил)-5метоксифенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Суміш [4-(3-бромпропокси)-5-хлор-2-метоксифеніл]метанолу (проміжний продукт 55; 386 мг; 1,25 моля), транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5; 438 мг, 1,25 моля) і триетиламіну 0,345 мл; 2,49 моля) в 12 мл ацетонітрилу и 8,7 мл ТГФ перемішували при 70 °C протягом 16 год. Додавали додаткову кількість проміжного продукту 5 (219 мг; 0,62 % моля) і нагрівання продовжували протягом 24 год. Розчинник випарювали у вакуумі і залишок очищали за допомогою препаративної ВЕРХ з оберненою фазою (гексан / EtOAc від 0 до 40 %) і отримували шукану сполуку (80 %) у вигляді світло-жовтого масла. + МСНР (m/z): 309(M+1) . Проміжний продукт 57 транс-4-[[3-(2-Хлор-4-форміл-5метоксифенокси)пропіл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат Суміш транс-4-[{3-[2-хлор-4-(гідроксиметил)-5-метоксифенокси]пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 56; 418 мг, 0,70 моля) і оксида марганцю(IV) (755 мг; 7,38 моля) в 9 мл хлороформу перемішували при 45 °C протягом 3 год. Тверді речовини відфільтровували і промивали хлороформом і фільтрат концентрували досуха і отримували шукану сполуку у вигляді безбарвного масла (97 %). + МСНР (m/z): 307(M+1) . Проміжний продукт 58 - транс-4-[{3-[4-({[(2R)-2-{[трет-Бутил(диметил)силіл]окси}-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-2-хлор-5метоксифенокси]пропіл}(метил)аміно]-циклогексилгідрокси(ди-2-тієніл)ацетат. Отримували у вигляді безбарвного масла (73 %) з транс-4-[[3-(2-хлор-4-форміл-5метоксифенокси)пропіл](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 57; 401 мг; 0,69 моля), (2R)-2-{[трет-бутил(диметил)-силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етанамінійацетату (отримували відповідно до синтезу 8 в US20060035931) (346 мг, 0,88 моля) і триацетоксиборогідриду натрію (557 мг, 2,50 моля) за експериментальною методикою, описаною для проміжного продукту 30, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (от CHCl3 до CHCl3/MeOH 95:5). + МСНР (m/z): 896(M+1) . Приклад 11 - транс-4-[{3-[2-Хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін5-іл)етил]аміно}метил)-5-метоксифенокси]пропіл}-(метил)аміно]циклогексилгідрокси(ди-2тієніл)ацетат гідрофторид. 50 Cl O OH H N O S O O HO N OH S HN O Отримували у вигляді майже білої твердої речовини (72 %) з транс-4-[{3-[4-({[(2R)-2-{[трет 25 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 бутил(диметил)силіл]окси}-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}-метил)-2хлор-5-метоксифенокси]-пропіл}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 58; 59 мг, 0,06 моля) і триетиламінтригідрофториду (0,04 мл, 0,28 моля) в 3 мл ТГФ за експериментальною методикою, описаною в прикладі 1, потім очищали за допомогою препаративної ВЕРХ з оберненою фазою (система 2) і ліофілізували. + МСНР (m/z): 782(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,36 (m., 4H); 1,70 (b.s., 2H); 1,82 (m., 2H); 1,89 (b.s.; 2H); 2,17 (s., 3H); 2,37 (b.s., 1H); 2,54 (m., 2H); 2,63 (m., 2H); 3,17 (b.s., 1H); 3,52 (m., 2H); 3,76 (s., 3H); 4,09 (t., 2H); 4,68 (b.s., 1H); 5,01 (m., 1H); 6,47 (d., 1H); 6,7 (s., 1H); 6,90 (d., 1H); 6,93-7,09 (c.s., 5H); 7,24 (s., 1H); 7,46 (d., 1H); 8,11 (d., 1H). Проміжний продукт 59 трет-Бутил[(5-хлор-4-ізоціанато-2метоксибензил)окси]диметилсілан. Розчин 4-({[трет-бутил(диметил)силіл]окси}метил)-2-хлор-5-метоксианіліну (проміжний продукт 39; 300 мг, 1 моля) в 4 мл дихлорметану охолоджували зовні в бані з льодом і в цей час по краплях додавали розчин тріфосгена (108 мг; 0,36 моля) в 5 мл дихлорметан. Повільно додавали тріетіламін (0,28 мл; 2,01 моля) і систему перемішували при кімнатній температурі протягом 3 год. Потім половину розчинника випарювали у вакуумі та додавали 25 мл пентану. Білий осад сечовин відфільтровували і фільтрат випарювали насухо і отримували 311 мг шуканого сполуки, що використовували без додаткового очищення на наступній стадії. Проміжний продукт 60 транс-4-[(2-Гідроксиетил)(метил)аміно]-циклогексилгідрокси(ди-2тієніл)ацетат. Суміш транс-4-(метиламіно)циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 5; 300 мг; 0,85 моля), 2-брометанола (0,145 мл; 2,05 моля) і триетиламіну (0,36 мл; 2,58 моля) в 4,5 мл ацетонітрилу і 3,5 мл ТГФ перемішували при 80 °C в герметичній посудині протягом 16 год. Додавали додаткові кількості брометанола (0,145 мл; 2,05 моля), триетиламіну (0,36 мл; 2,58 моля), ацетонітрилу (3,5 мл) і ТГФ (3, 5 мл) і перемішування і нагрівання продовжували протягом ще 24 год. Розчини випарювали насухо, розчиняли в дихлорметані, промивали розсолом, сушили і концентрували. Очищення за допомогою препаративної ВЕРХ з оберненою фазою (Cl3CH/MeOH від 1:0 до 9:1) давала 76 % шуканого продукту у вигляді безбарвного масла. + МСНР (m/z): 396(M+1) . Проміжний продукт 61 - транс-4-[{2-[({[4-({[трет-Бутил(диметил)силіл]окси}метил)-2-хлор-5метоксифеніл]аміно}карбоніл)-окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат Розчин транс-4-[(2-гідроксиетил)(метил)аміно]циклогексилгідрокси(ди-2-тієніл)-ацетату (проміжний продукт 60; 290,6 мг; 0,73 моля) в 5 мл ТГФ при перемішуванні при кімнатній температурі по краплях додавали до розчину трет-бутил[(5-хлор-4-ізоцианато-2метоксибензил)окси]диметилсілана (проміжний продукт 59; 311 мг; 0,87 моля) в 5 мл ТГФ. Додавали триетиламін (0,228 мл; 1,31 моля) і перемішування продовжували протягом 16 год. при 60 °C і протягом ще 4 год. при 80 °C. Розчини концентрували і очищали за допомогою препаративної ВЕРХ з оберненою фазою (CH2Cl2/ізопропанол від 10:0 до 9:1) і отримували 66 % шуканої сполуки. + МСНР (m/z): 723(M+1) . Проміжний продукт 62 транс-4-[{2-[({[2-Хлор-4-(гідроксиметил)-5метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат. До розчину транс-4-[{2-[({[4-({[трет-бутил(диметил)силіл]окси}метил)-2-хлор-5метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетату (проміжний продукт 61; 315 мг; 0,44 моля) в 6 мл ТГФ додавали 1,31 мл (1,31 моля) 1M водного розчина HCl і систему перемішували при кімнатній температурі протягом 2,5 год. Розчини підлужували 4 % водним розчином гідрокарбоната натрію і тричі екстрагували етилацетатом. Органічні екстракти промивали розсолом, сушили і концентрували. Залишок очищали за допомогою препаративної ВЕРХ з оберненою фазою (CH2Cl2/ізопропанол від 10:0 до 9:1) і отримували 78 % шуканої сполуки. + МСНР (m/z): 609(M+1) . Проміжний продукт 63 транс-4-[[2-({[(2-Хлор-4-форміл-5метоксифеніл)аміно]карбоніл}окси)етил](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Транс-4-[{2-[({[2-хлор-4-(гідроксиметил)-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат (проміжний продукт 62; 200 мг; 0,33 моля) розчиняли в 8 мл дихлорметану і перемішували при кімнатній температурі в інертній атмосфері. 3 Порціями додавали реагент Десса-Мартіна (170 мг; 0,40 моля) і реакційну суміш перемішували протягом 30 хв. Додавали дихлорметан (15 мл), розчин промивали 4 % 26 UA 108104 C2 5 10 15 20 25 водним розчином бікарбонату натрію і енергійно перемішували протягом 1 год. Тверду речовину відфільтровували та органічну фазу фільтрату промивали розсолом, сушили і концентрували і отримували 197 міліграм шуканої сполуки, достатньо чистої для використання на наступній стадії. + МСНР (m/z): 607(M+1) . Проміжний продукт 64 - транс-4-[{2-[({[4-({[(2R)-2-{[трет-Бутил(диметил)силіл]окси}2-2(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етил]аміно}метил)-2-хлор-5метоксифеніл]аміно}карбоніл)окси]етил}-(метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетат. Розчин транс-4-[[2-({[(2-хлор-4-форміл-5-метоксифеніл)аміно]карбоніл}окси)етил](метил)аміно]циклогексилгідрокси(ди-2-тієніл)ацетату (проміжний продукт 63; 195 мг; 0,28 моля) и (2R)-2-{[трет-бутил(диметил)-силіл]окси}-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етанамінійацетату (отримували відповідно до синтезу 8 в US20060035931) (119 мг, 0,36 моля) в 5 мл ТГФ перемішували при 65 °C протягом 20 г. Після охолодження реакційної суміші в бані з льодом порціями додавали тріацетоксиборогідриду натрію (195 мг; 0,92 моля). Перемішування продовжували протягом 15 хв при 5 °C і протягом 45 хв при кімнатній температурі. Розчини концентрували до половини об'єму і додавали 15 мл води і 15 мл 4 % водного розчину бікарбонату натрію. Суміш тричі екстрагували етилацетатом, промивали розсолом, сушили і концентрували. Залишок очищали за допомогою препаративної ВЕРХ з оберненою фазою (CHCl3/ізопропанол від 10:0 до 9:1) і отримували 47 % шуканої сполуки. + МСНР (m/z): 925(M+1) . Приклад 12 транс-4-[{2-[({[2-Хлор-4-({[(2R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етил]аміно}метил)-5метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетат гідрофторид. HO Cl OH H N O H N O N S O S O O HO HN O 30 35 40 45 50 До розчину транс-4-[{2-[({[4-({[(2R)-2-{[трет-бутил(диметил)силіл]окси}2-2(8-гідрокси-2-оксо1,2-дигідрохінолін-5-іл)етил]аміно}метил)-2-хлор-5-метоксифеніл]аміно}карбоніл)окси]етил}(метил)аміно]циклогексил-гідрокси(ди-2-тієніл)ацетату (проміжний продукт 63; 125 мг; 0,14 моля) в 5 мл ТГФ додавали триетиламінтригідрофториду (0,04 мл, 0,28 моля). Після перемішування протягом 20 год. рідкий шар відкидали і залишок перемішували ще з 5 мл ТГФ протягом 1 год. і відкидали. Потім додавали ацетонітрил (15 мл) і перемішування продовжували протягом 1 год. Тверду речовину відфільтровували і промивали ацетонітрилом і діізопропіловим ефіром. Отримували чисту шукану сполуку (67 %). + МСНР (m/z): 811(M+1) . 1 H ЯМР (300 МГц, ДМСО-d6) δ част./млн 1,06 (d., J=6 Гц, 2H); 1,39 (m., 3H); 1,75 (m., 2H); 1,93 (m., 2H); 2,24 (s., 3H); 2,44 (b.s., 1H); 2,67 (m., 2H); 2,76 (m., 2H); 3,78 (m., 5H); 4,13 (m., 2H); 4,72 (b.s., 1H); 5,14 (t., 1H); 6,52 (d., J=12 Гц, 1H); 6,90-7,03 (m., 3H); 7,09 (m., 3H); 7,23 (s., 1H); 7,28 (b.s., 1H); 7,40 (s., 1H); 7,49 (d., J=6 Гц; 1H); 8,15 (d., J=12 Гц, 1H); 9,01 (s., 1H); 10,39 (b.s., 1H). Проміжний продукт 65-N, N-Дибензил-1,4-діоксаспіро[4.5]декан-8-амін дибензил(1,4діоксаспіро[4.5]дец-8-іл)амін. До розчину 1,4-діоксаспіро[4.5]декан-8-ону (25 г, 0,16 моля) в 1,2-дихлоретану (396 мл) в атмосфері азоту додавали дибензиламін (32,3 мл, 0,16 моля) і отриманий розчин перемішували протягом 2 год. при кімнатній температурі. Потім порціями додавали тріацетоксиборогідриду натрію (55,4 г, 0,25 моля) і реакційну суміш перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали суміш бікарбонату і дихлорметан (1:1) і її примушували протягом 30 хв, потім органічну фазу екстрагували і промивали бікарбонатом і розсолом, сушили, фільтрували і органічний розчинник випарювали при зниженому тиску. Отримане масло облягали гексаном і отримували шукану сполуку у вигляді білої твердої речовини (80 %), що 27 UA 108104 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовували на наступній стадії без додаткової обробки. + МСНР (m/z): 338 (M+1) . Проміжний продукт 66-4-(Дибензиламіно)циклогексанон N, N-Дибензил-1,4-діоксаспіро[4.5]декан-8-амін дибензил(1,4-діоксаспіро[4.5]дец-8-іл)-амін (проміжний продукт 65; 43,6 г, 0,13 моля) суспендували в хлористоводневій кислоті (35 %, 49,4 мл, 0,59 моля), отриману суміш перемішували при 100 °C протягом 8 год. Суміш охолоджували льодом з водою і підлужували до pH ~ 8 карбонатом калію, потім екстрагували хлороформом. Органічний шар випарювали насухо і отримували масло, що очищали за допомогою колонкової хроматографії на силікагелі при елююванні за допомогою гексан: етилацетат (від 98/2 до 90/10) і отримували шукану сполуку у вигляді жовтої твердої речовини (72 %). + МСНР (m/z): 294 (M+1) . Проміжний продукт 67 - транс-4-(Дибензиламіно)-1-метилциклогексанол. До розчину 4-(дибензиламіно) циклогексанону (проміжний продукт 66; 10 г, 32 моля) в безводному тетрагідрофурані в атмосфері аргону при -78 °C повільно додавали 1,6 M розчин метиллітію в діетиловому ефірі (30 мл, 48 моля) і отриману суміш перемішували при -78 °C протягом 4 г. Потім додавали насичений розчин хлориду амонію і суміш перемішували протягом ночі при кімнатній температурі. Органічний розчинник випарювали і отриману неочищену речовину обробляли водою і хлороформом. Органічний шар сушили над сульфатом натрію, фільтрували і випарювали і отримували масло, що очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан: етилацетат (від 0 % гексану до 31 % етилацетату) і отримували дві різні фракції. Перша відповідала цис-продукту і друга транспродукту у вигляді білої твердої речовини, що було шуканою сполукою (55 %). + МСНР (m/z): 310 (M+1) . Проміжний продукт 68 - транс-4-Аміно-1-метилциклогексанол. До розчину транс-4-(дибензиламіно)-1-метилциклогексанолу (проміжний продукт 67; 5,7 г, 17,68 моля) в безводному етанолі (125 мл) в атмосфері азоту додавали гідроксид палладію (1,7 г, 2,44 моля). Реакційну суміш енергійно перемішували в атмосфері водню протягом ночі при кімнатній температурі. Суміш фільтрували через целіт і промивали етанолу. Розчинник випарювали при зниженому тиску і отримували шукану сполуку у вигляді білої твердої речовини (98 %), що використовували на наступній стадії без додаткового очищення. + МСНР (m/z): 130 (M+1) . Проміжний продукт 69 - трет-бутил-(транс-4-Гідрокси-4-метилциклогексил)карбамат. До суспензії транс-4-аміно-1-метілціклогексанола (проміжній продукт 68; 2,3 г, 18,27 моля) в ацетонітрилі (33 мл) в атмосфері аргону додавали ди-трет-бутилдикарбонат (4,3 г, 20,11 моля). Суміш енергійно перемішували протягом ночі при кімнатній температурі. Осад відфільтровували і промивали сумішшю гексан: етилацетат (3:1) і отримували тверду речовину, що очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю гексан: етилацетат (від 0 % до 100 % етилацетату). Шукану сполуку отримували у вигляді білої твердої речовини (90 %). 1 H ЯМР (300 МГц, хлороформ-d) Проміжний продукт 70 - транс-1-Метил-4-(метиламіно)-циклогексанол. трет-Бутил-(транс-4-гідрокси-4-метилциклогексил)карбамат (проміжний продукт 69; 3,6 г, 16,09 моля) при кімнатній температурі додавали до суспензії алюмогідріда літію (3,1 г, 82,21 моля) в безводному тетрагідрофуран. Потім суміш кип'ятили зі зворотним холодильником протягом ночі. Суміш охолоджували до кімнатної температури і надлишок гідриду розкладали і фільтрували. Розчинник видаляли при зниженому тиску і отримували масло, що твердне. Шукану сполуку отримували у вигляді твердої речовини (98 %). 1 H ЯМР (300 МГц, хлороформ-d) Проміжний продукт 71 - трет-Бутил-(транс-4-гідрокси-4-метилциклогексил)метилкарбамат. Отримували у вигляді білої твердої речовини (78 %) з транс-1-метил-4(метиламіно)циклогексанолу (проміжний продукт 71; 2,5 г, 17,4 моля) і ди-третбутилдикарбонату (4,1 г, 19,2 моля) за експериментальною методикою, описаною для проміжного продукту 69 (тривалість реакції: 2 г), потім очищали за допомогою колонкової хроматографії на силікагелі при елююванні сумішшю хлороформ/метанол (1:1). 1 H ЯМР (300 МГц, хлороформ-d) Проміжний продукт 72 транс-4-[(трет-Бутоксикарбоніл)(метил)-аміно]-1метилциклогексилоксо(2-тієніл)ацетат. До розчину 2-оксо-2-(тиофен-2-іл) оцтової кислоти (2,13 г, 13,64 моля) в хлороформі, стабілізувати аміленом (25 мл) і двома краплями безводного диметилформамід, при низькій температурі за краплю додавали розчин оксалілхлориду (1,78 мл, 20,47 моля) в суміші 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNew cyclohexylamine derivatives having b2 adrenergic agonist and m3 muscarinic antagonist activities
Автори англійськоюPrat Quinones, Maria, Fonquerna Pou, Silvia, Puig Duran, Carlos, Lumeras Amador, Wenceslao, Aiguade Bosch, Jose, Caturla Javaloyes, Juan Francisco
Автори російськоюПрат Кинонес Мария, Фонкерна Поу Сильвия, Пуиг Дуран Карлос, Лумерас Амадор Венсеслао, Айгуаде Боск Хосе, Катурла Хавалоес Хуан Франсиско
МПК / Мітки
МПК: C07D 409/14, A61K 31/4709, A61P 11/00
Мітки: рецептора, циклогексиламіну, агоністичну, активності, мускаринового, відношенню, антагоністичної, активність, мають, похідні, адренергічного
Код посилання
<a href="https://ua.patents.su/67-108104-pokhidni-ciklogeksilaminu-shho-mayut-agonistichnu-aktivnist-po-vidnoshennyu-do-b2-adrenergichnogo-receptora-i-antagonistichno-aktivnosti-po-vidnoshennyu-do-m3-muskarinovogo-recepto.html" target="_blank" rel="follow" title="База патентів України">Похідні циклогексиламіну, що мають агоністичну активність по відношенню до b2 адренергічного рецептора і антагоністичної активності по відношенню до m3 мускаринового рецептора</a>
Попередній патент: Спосіб підвищення однорідності температури в нагрівальній печі типу нагрівального колодязя
Наступний патент: Азотовмісні гетероарильні сполуки
Випадковий патент: Ендоваскулярний опорний пристрій, що саморозширюється в радіальному напрямку, для хірургічного лікування аневризм черевної аорти