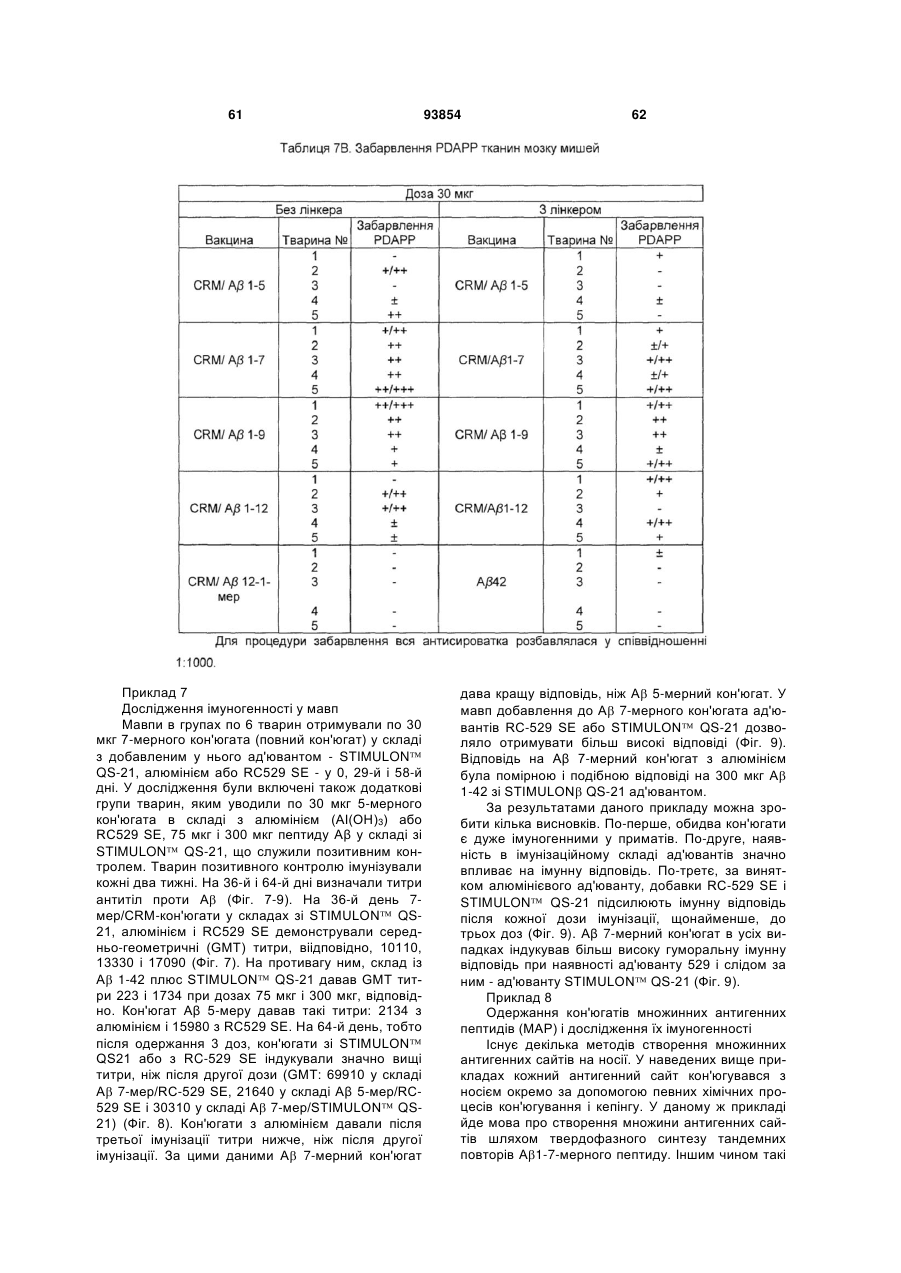
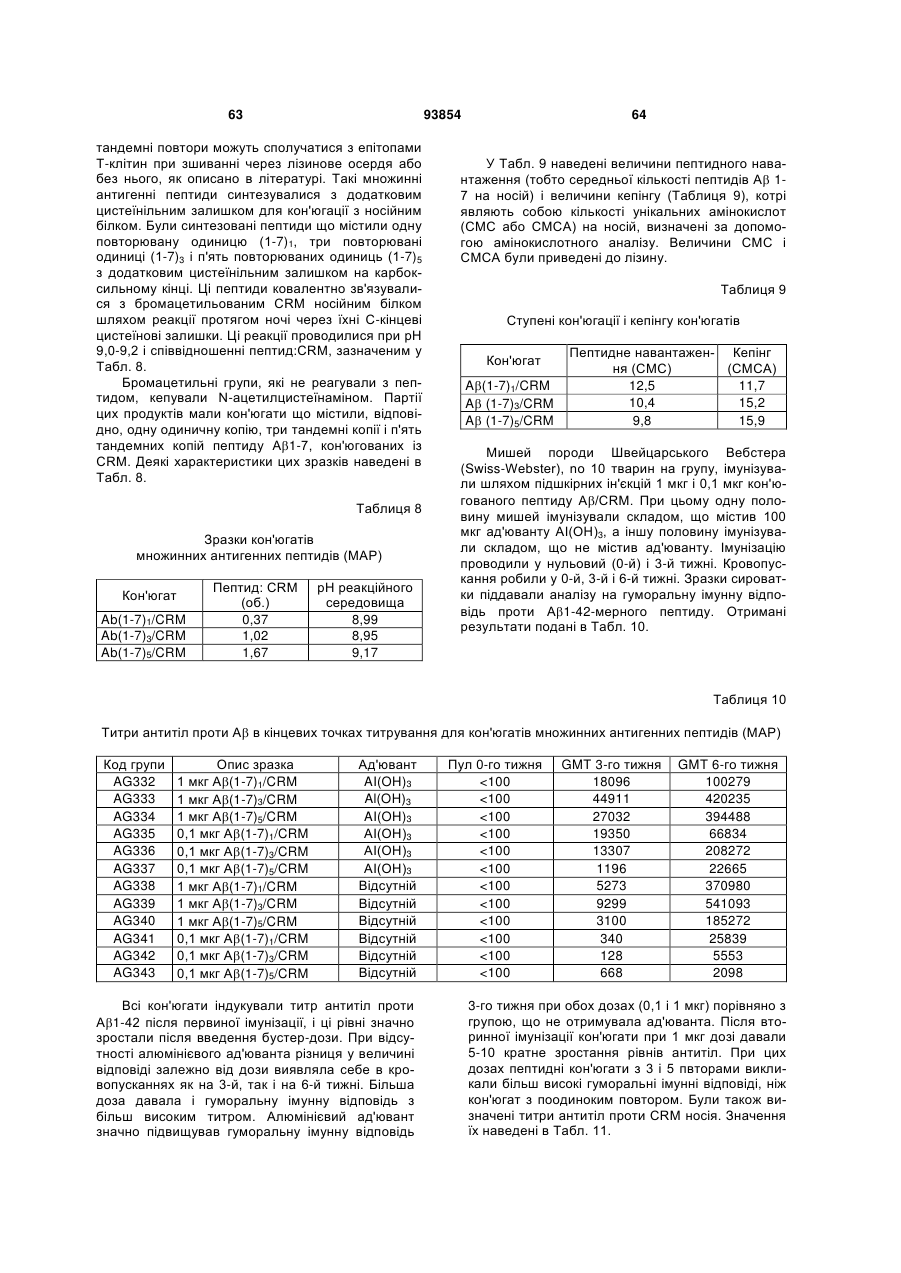
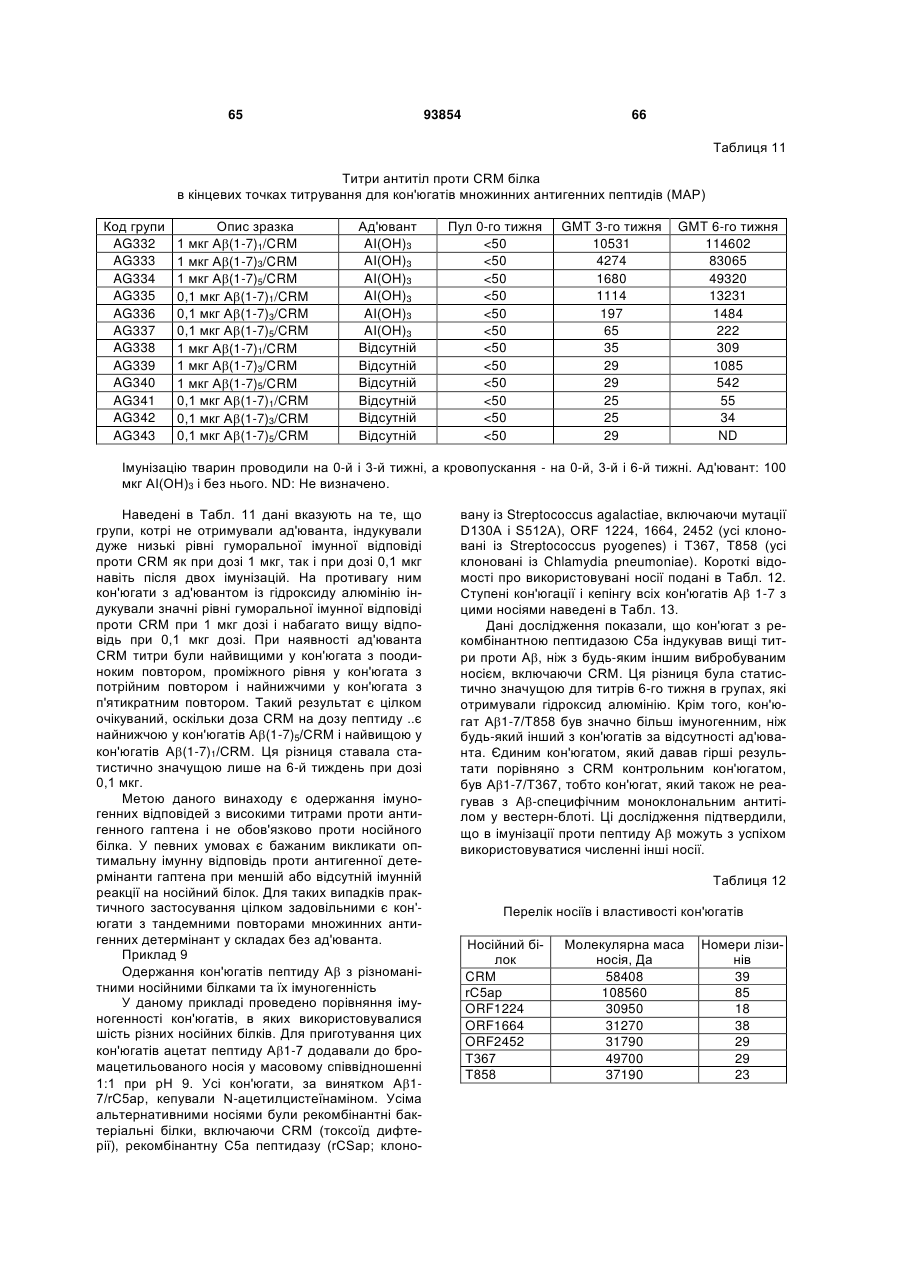
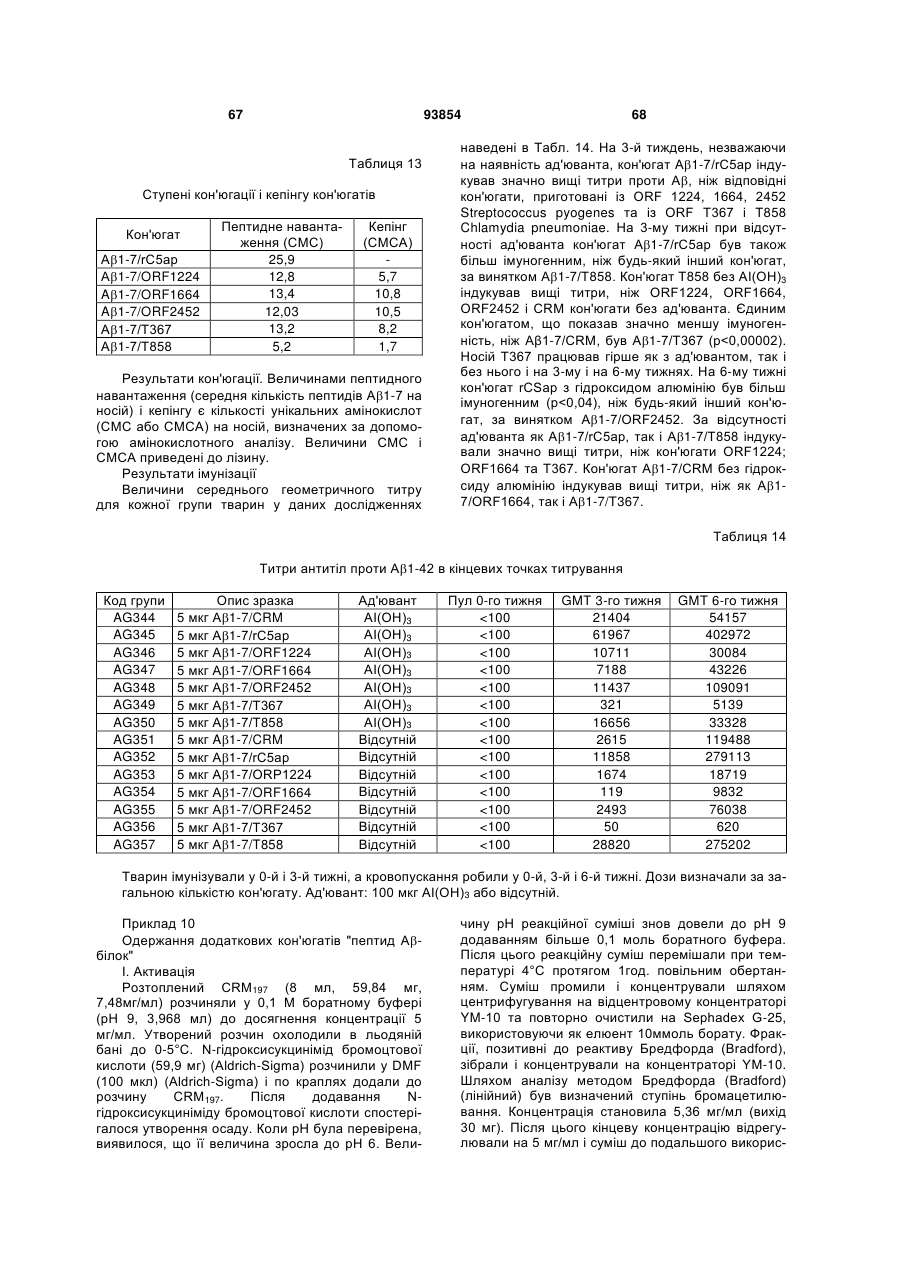
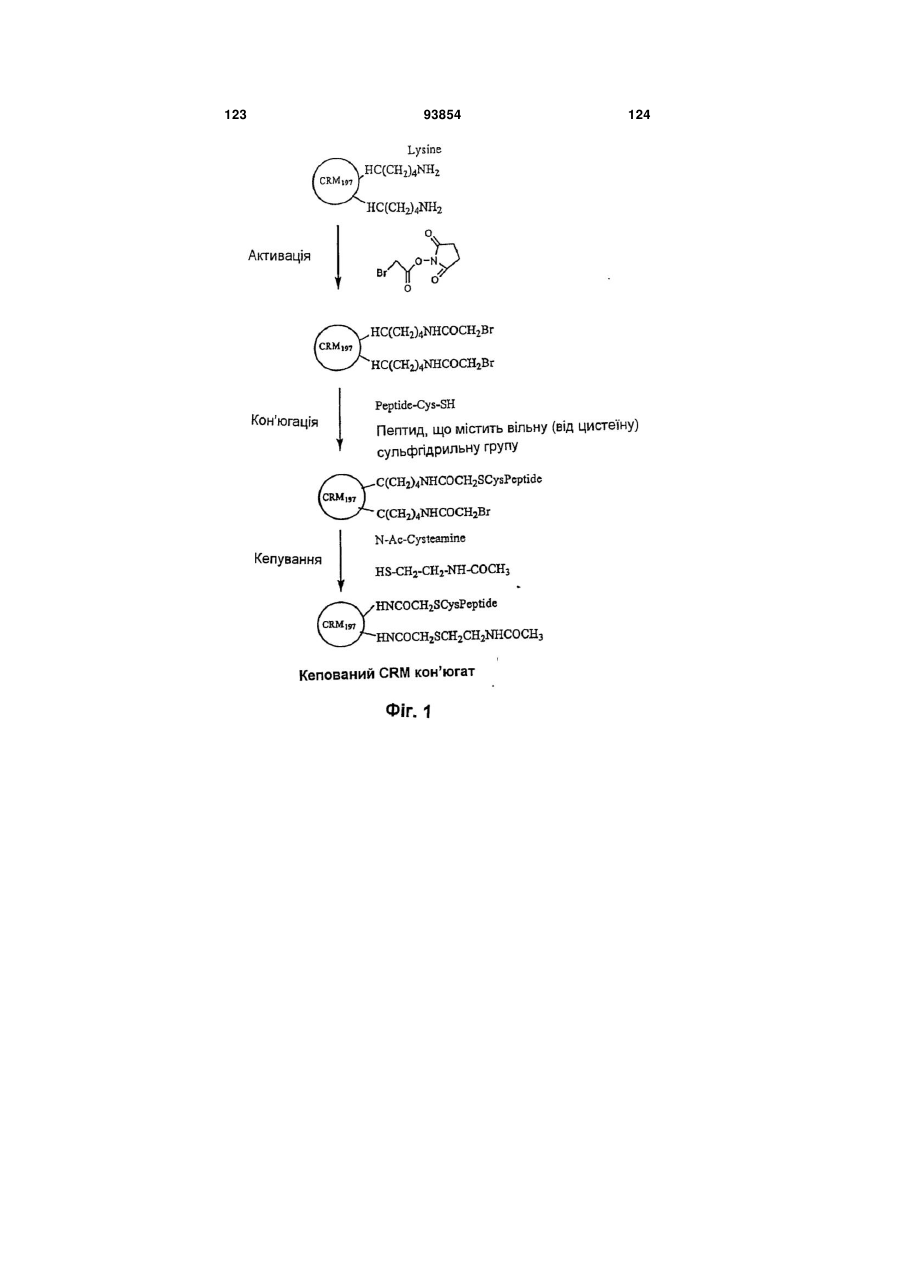
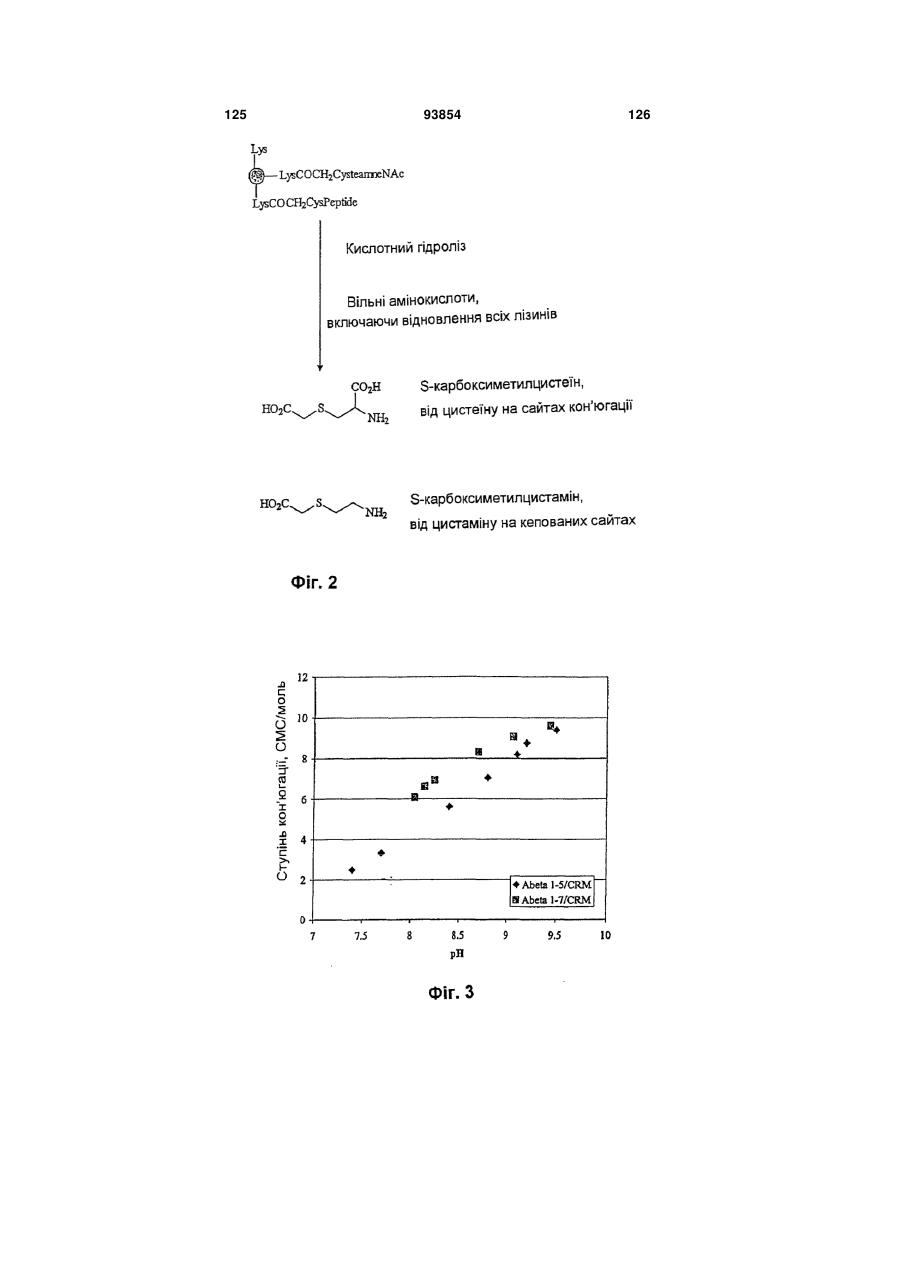
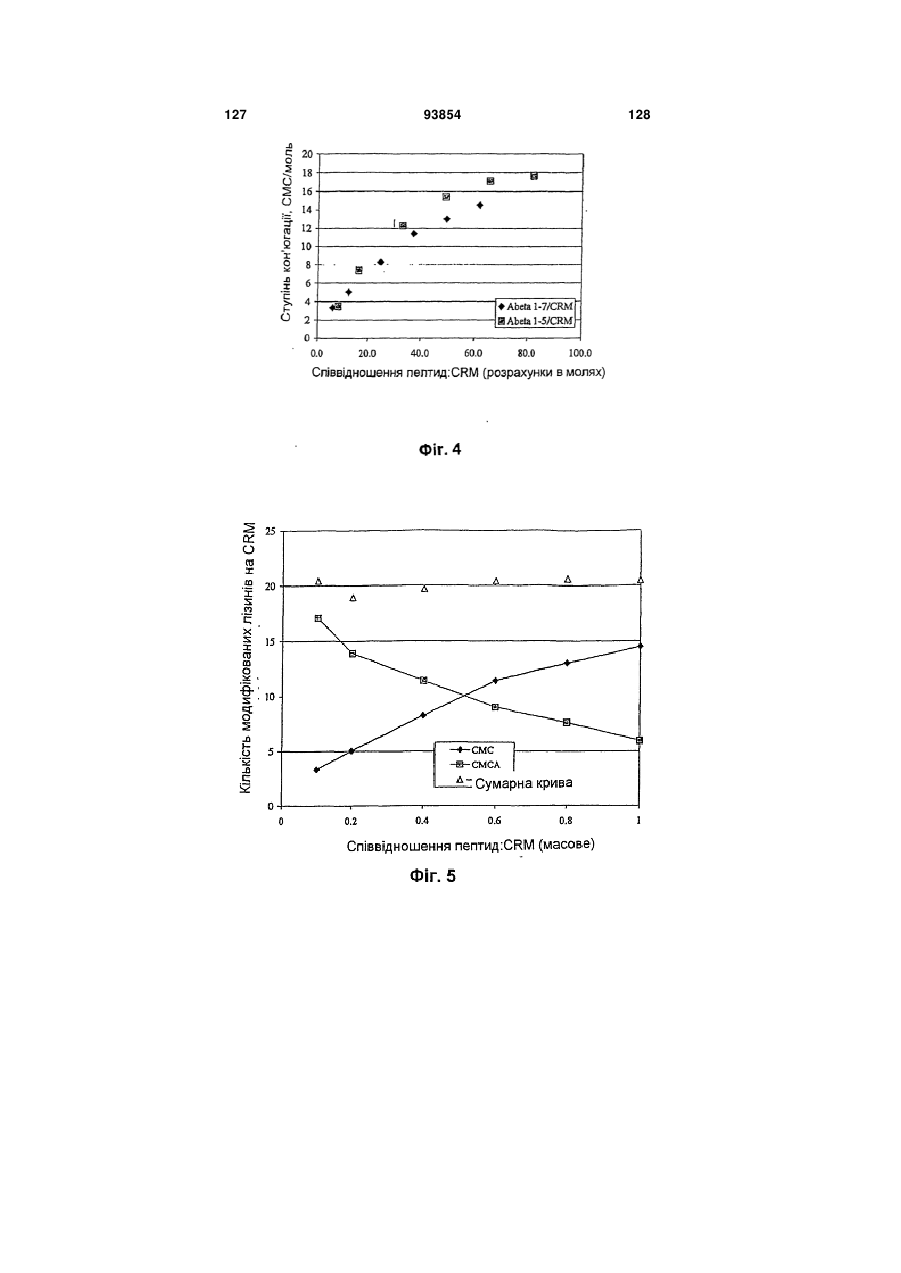
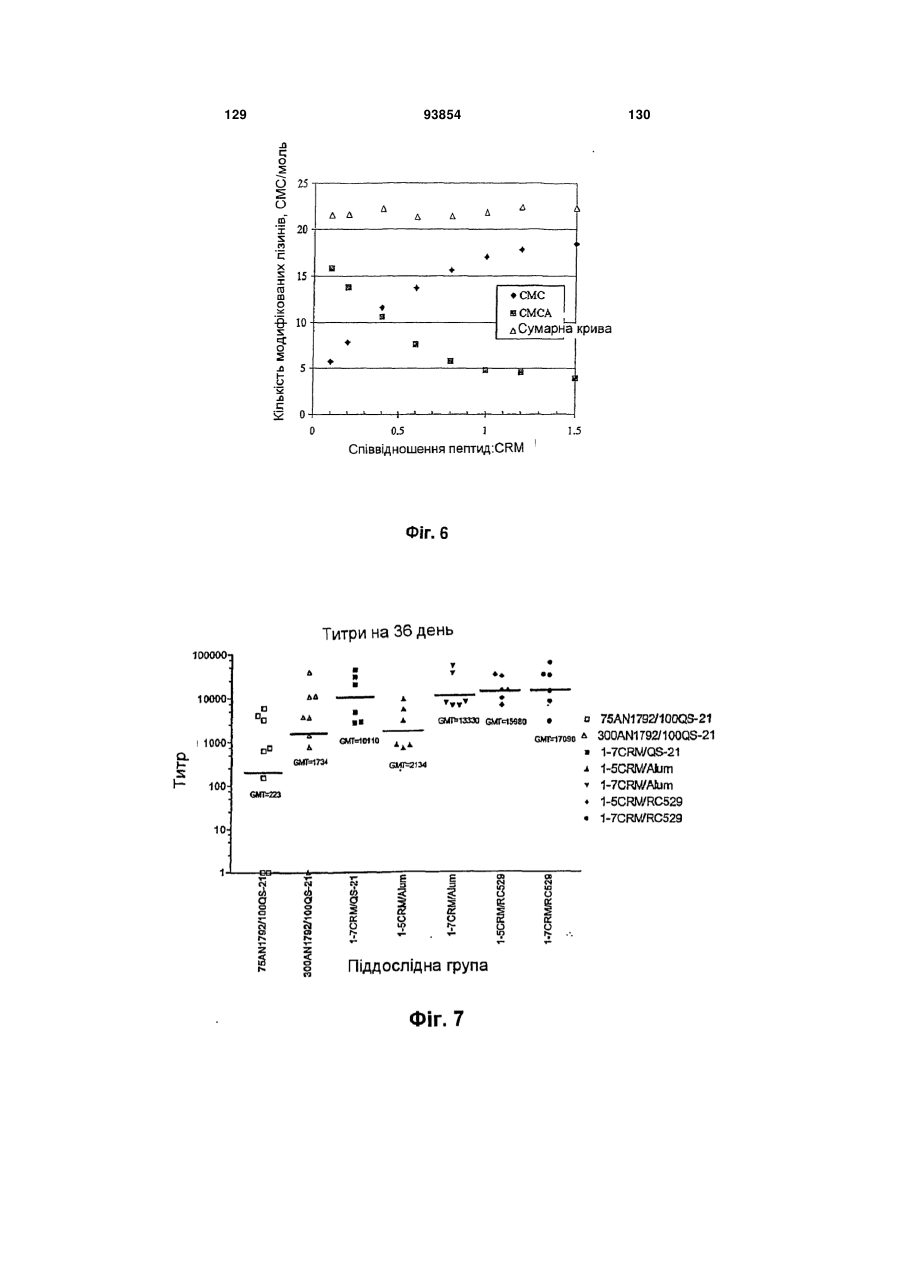
Імуногенний кон’югат та спосіб його одержання
Формула / Реферат
1. Спосіб одержання імуногенного кон’югата, який включає у себе стадії:
(а) введення реактивної групи у пептидний імуноген;
(b) дериватизації однієї чи більше функціональних груп білка-носія для створення активованої функціональної групи на білку-носії, де білок-носій вибирають із групи, що складається з білка CRM197, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664, Streptococcus pyogenes ORF2452 та Chlamydia pneumoniae ORF T858;
(с) проведення реакції пептидного імуногена за стадією (а) з білком-носієм за стадією (b) в таких умовах, щоб утворити кон'югат, де реактивна група пептидного імуногена ковалентно зв'язана з активованою функціональною групою на білку-носії; і
(d) проведення подальшої реакції кон’югата за стадією (с) з кепінг-реагентом для того, щоб інактивувати будь-яку з решти активованих функціональних груп на білку-носії, щоб створити імуногенний кон'югат,
де кон'югат має формулу:
,
де C є білком/білком-носієм, Xd є дериватизованою функціональною групою амінокислотного залишку білка/білка-носія, Р є пептидним імуногеном, R є кепінг-молекулою, n є ціле число більше 0, але не більше 38, і р є ціле число більше 0, але не більше 38.
2. Спосіб за п. 1, який відрізняється тим, що білком-носієм є CRM197.
3. Спосіб за п. 1, який відрізняється тим, що пептидний імуноген вибирають із групи, що складається із бактеріального білка, вірусного білка, грибкового білка, паразитного білка і еукаріотичного білка.
4. Спосіб за п. 1, який відрізняється тим, що функціональна група однієї або більше амінокислотних молекул білка-носія дериватизована за допомогою зшивального реагенту.
5. Спосіб за п. 4, який відрізняється тим, що функціональна група дериватизована з галоїдацетилювальним реагентом.
6. Спосіб за п. 1, який відрізняється тим, що кепінг-реагент, який використовують для дезактивації будь-якої функціональної групи активованого білка-носія, вибирають із групи реагентів, що складається із цистеїнаміну, N-ацетилцистеїнаміну й етаноламіну, гідроксиду натрію, карбонату натрію, бікарбонату амонію і аміаку.
7. Спосіб за п. 1, який відрізняється тим, що стадія введення реактивної групи у пептидний імуноген містить додавання амінокислотного залишку, що має реактивну групу.
8. Спосіб за п. 7, який відрізняється тим, що амінокислотний залишок є цистеїновим залишком, в якому реактивна група містить -SH, або амінокислотний залишок є аргініновим залишком, і реактивна група містить гуанідильну групу, амінокислотний залишок є глутаматом або аспартатним залишком, і реактивна група містить -COOH, або амінокислотний залишок є лізиновим залишком, і реактивна група містить -NH2.
9. Спосіб за п. 7, який відрізняється тим, що амінокислотний залишок вводиться в пептидний імуноген додаванням під час пептидного синтезу.
10. Спосіб за п. 1, який відрізняється тим, що стадія введення реактивної групи у пептидний імуноген містить бічну тіолову групу на амінокислотному залишку, що піддається такій модифікації через реагент тіолування.
11. Спосіб за п. 10, який відрізняється тим, що реагент тіолування містить N-ацетилгомоцистеїновий тіолактон.
12. Спосіб за пп. 7, 9 або 10, який відрізняється тим, що амінокислотний залишок розташовується на амінокінці пептидного імуногена або на карбоксильному кінці пептидного імуногена.
13. Спосіб за п. 1, який відрізняється тим, що білок-носій, крім того, містить один або більше поліпептидних лінкерів, ковалентно прикріплених до білка-носія, і де одна або більше функціональних груп містять замісники одного або більше поліпептидних лінкерів.
14. Імуногенний кон'югат, що містить пептидний імуноген, ковалентно з'єднаний з білком-носієм, де імуногенний кон’югат має формулу:
,
де
C є білком-носієм, який вибирають із групи, що складається з білка CRM197, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664, Streptococcus pyogenes ORF2452 і Chlamydia pneumoniae ORF T858,
Xd є дериватизованою функціональною групою амінокислотного залишку білка-носія,
Р є пептидним імуногеном, ковалентно з'єднаним через реактивну групу амінокислотного залишку пептидного імуногена з дериватизованою функціональною групою амінокислотного залишкубілка-носія,
R є кепінг-молекулою, ковалентно з'єднаною з дериватизованою функціональною групою амінокислотного залишку білка-носія,
n є ціле число більше 0, але не більше 38, і
р є ціле число більше 0, але менше ніж 38.
15. Імуногенний кон'югат за п. 14, який відрізняється тим, що білком-носієм є CRM197.
16. Імуногенний кон'югат за п. 14, який відрізняється тим, що пептидний імуноген вибирають із групи, що складається із бактеріального білка, вірусного білка, грибкового білка, паразитного білка і еукаріотичного білка.
17. Імуногенний кон'югат за п. 14, який відрізняється тим, що реактивна група амінокислотного залишку пептидного імуногена містить вільну сульфгідрильну групу.
18. Імуногенний кон'югат за п. 17, який відрізняється тим, що вільна сульфгідрильна група є бічним ланцюгом цистеїнового залишку, або бічним ланцюгом тіолування лізинового залишку.
19. Імуногенний кон'югат за п. 14, який відрізняється тим, що реактивна група амінокислотного залишку пептидного імуногена містить гуанідильну групу, карбоксильну групу або ε-амінну групу.
20. Імуногенний кон'югат за п. 14, який відрізняється тим, що білок-носій, крім того, містить поліпептидний лінкер, ковалентно з'єднаний з білком-носієм, і де функціональна група містить замісник поліпептидного лінкера.
21. Імуногенний кон'югат за п. 14, який відрізняється тим, що амінокислотний залишок пептидного імуногена, що містить реактивну групу, розташований на амінному кінці пептидного імуногена або на карбоксильному кінці пептидного імуногена.
22. Імуногенна композиція, яка містить імуногенний кон’югат за будь-яким з п.п. 14-21 разом з одним або більше фармацевтично прийнятними ексципієнтами, розчинниками, ад’ювантами і/або агентами, що посилюють імунну відповідь.
23. Імуногенна композиція за п. 22, яка відрізняється тим, що один або більше ад’ювантів і/або агентів, що посилюють імунну відповідь, вибирають із групи, що складається GM-CSF, 529 SE, IL-12, фосфату алюмінію, гідроксиду алюмінію, Mycobacterium tuberculosis, Bordetella pertussis, бактеріальних ліпополісахаридів, аміноалкілглюкозамінфосфатних сполук, MPL™ (3-O-деацетильованого монофосфорильного ліпіду A), поліпептиду, Quil A, STIMULON™ QS-21, токсину коклюшу (PT), термолабільного токсину E. coli (LT), IL-1α, IL-1β, IL-2, IL-4, IL-5, ІL-6, ІL-7, IL-8, IL-10, IL-13, IL-14, EL-15, IL-16,1L-17, IL-18, інтерферону-α, інтерферону-β, інтерферону-γ, G-CSF, TNF-α і TNF-β.
Текст
1. Спосіб одержання імуногенного кон’югата, який включає у себе стадії: (а) введення реактивної групи у пептидний імуноген; (b) дериватизації однієї чи більше функціональних груп білка-носія для створення активованої функціональної групи на білку-носії, де білок-носій вибирають із групи, що складається з білка CRM197, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664, Streptococcus pyogenes ORF2452 та Chlamydia pneumoniae ORF T858; (с) проведення реакції пептидного імуногена за стадією (а) з білком-носієм за стадією (b) в таких умовах, щоб утворити кон'югат, де реактивна група пептидного імуногена ковалентно зв'язана з активованою функціональною групою на білкуносії; і (d) проведення подальшої реакції кон’югата за стадією (с) з кепінг-реагентом для того, щоб інактивувати будь-яку з решти активованих функціональних груп на білку-носії, щоб створити імуногенний кон'югат, де кон'югат має формулу: 2 (19) 1 3 амінокислотний залишок є лізиновим залишком, і реактивна група містить -NH2. 9. Спосіб за п. 7, який відрізняється тим, що амінокислотний залишок вводиться в пептидний імуноген додаванням під час пептидного синтезу. 10. Спосіб за п. 1, який відрізняється тим, що стадія введення реактивної групи у пептидний імуноген містить бічну тіолову групу на амінокислотному залишку, що піддається такій модифікації через реагент тіолування. 11. Спосіб за п. 10, який відрізняється тим, що реагент тіолування містить Nацетилгомоцистеїновий тіолактон. 12. Спосіб за пп. 7, 9 або 10, який відрізняється тим, що амінокислотний залишок розташовується на амінокінці пептидного імуногена або на карбоксильному кінці пептидного імуногена. 13. Спосіб за п. 1, який відрізняється тим, що білок-носій, крім того, містить один або більше поліпептидних лінкерів, ковалентно прикріплених до білка-носія, і де одна або більше функціональних груп містять замісники одного або більше поліпептидних лінкерів. 14. Імуногенний кон'югат, що містить пептидний імуноген, ковалентно з'єднаний з білком-носієм, де імуногенний кон’югат має формулу: 93854 4 , де C є білком-носієм, який вибирають із групи, що складається з білка CRM197, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664, Streptococcus pyogenes ORF2452 і Chlamydia pneumoniae ORF T858, Xd є дериватизованою функціональною групою амінокислотного залишку білка-носія, Р є пептидним імуногеном, ковалентно з'єднаним через реактивну групу амінокислотного залишку пептидного імуногена з дериватизованою функціональною групою амінокислотного залишку білканосія, R є кепінг-молекулою, ковалентно з'єднаною з дериватизованою функціональною групою амінокислотного залишку білка-носія, n є ціле число більше 0, але не більше 38, і р є ціле число більше 0, але менше ніж 38. 15. Імуногенний кон'югат за п. 14, який відрізняється тим, що білком-носієм є CRM197. 16. Імуногенний кон'югат за п. 14, який відрізняється тим, що пептидний імуноген вибирають із групи, що складається із бактеріального білка, вірусного білка, грибкового білка, паразитного білка і еукаріотичного білка. 17. Імуногенний кон'югат за п. 14, який відрізняється тим, що реактивна група амінокислотного залишку пептидного імуногена містить вільну сульфгідрильну групу. 18. Імуногенний кон'югат за п. 17, який відрізняється тим, що вільна сульфгідрильна група є бічним ланцюгом цистеїнового залишку, або бічним ланцюгом тіолування лізинового залишку. 19. Імуногенний кон'югат за п. 14, який відрізняється тим, що реактивна група амінокислотного залишку пептидного імуногена містить гуанідильну групу, карбоксильну групу або ε-амінну групу. 20. Імуногенний кон'югат за п. 14, який відрізняється тим, що білок-носій, крім того, містить поліпептидний лінкер, ковалентно з'єднаний з білкомносієм, і де функціональна група містить замісник поліпептидного лінкера. 21. Імуногенний кон'югат за п. 14, який відрізняється тим, що амінокислотний залишок пептидного імуногена, що містить реактивну групу, розташований на амінному кінці пептидного імуногена або на карбоксильному кінці пептидного імуногена. 22. Імуногенна композиція, яка містить імуногенний кон’югат за будь-яким з пп. 14-21 разом з одним або більше фармацевтично прийнятними ексципієнтами, розчинниками, ад’ювантами і/або агентами, що посилюють імунну відповідь. 23. Імуногенна композиція за п. 22, яка відрізняється тим, що один або більше ад’ювантів і/або агентів, що посилюють імунну відповідь, вибирають із групи, що складається GM-CSF, 529 SE, IL12, фосфату алюмінію, гідроксиду алюмінію, Mycobacterium tuberculosis, Bordetella pertussis, бактеріальних ліпополісахаридів, аміноалкілглюкозамінфосфатних сполук, MPL™ (3-Oдеацетильованого монофосфорильного ліпіду A), поліпептиду, Quil A, STIMULON™ QS-21, токсину коклюшу (PT), термолабільного токсину E. coli (LT), IL-1α, IL-1β, IL-2, IL-4, IL-5, ІL-6, ІL-7, IL-8, IL10, IL-13, IL-14, EL-15, IL-16,1L-17, IL-18, інтерферону-α, інтерферону-β, інтерферону-γ, G-CSF, TNF-α і TNF-β. Перехресні посилання на споріднені заявки Дана заявка згідно зі Зводом законів США [35 U.S.С. § 119(е) of U.S.] претендує на корисний ефект попередньої заявки на патент США сер. № 60/530,480, поданої 17 грудня, 2003 p., яка включена тут шляхом посилання в усій її повноті і для всіх цілей. Рівень техніки Набутий імунітет є не що інше, як здатність організму реагувати на наявність в ньому чужорідних субстанцій і виробляти компоненти (антитіла і клі тини), спроможні специфічним чином взаємодіяти з ними і захищати хазяїна від їх інвазії. "Антиген" або "імуноген" являє собою субстанцію, здатну викликати імунну відповідь цього типу, а також взаємодіяти із сенсибілізованими клітинами й антитілами, виробленими проти нього. Антигени або імуногени, зазвичай, є макромолекулами, що містять чіткі антигенні сайти або "епітопи", які розпізнаються різними компонентами імунної системи і взаємодіють з ними. Вони можуть існувати у формі індивідуальних молекул, що 5 складаються із синтетичних органічних хімічних речовин, білків, ліпопротеїдів, глікопротеїдів, РНК, ДНК, полісахаридів, або ж можуть бути частинами клітинних структур (бактерій або грибків) або вірусів [Harlow і Lane 1988 a, b, c; Male et al., 1987]. Малі молекули подібно коротким пептидам, хоча вони, зазвичай, є здатними взаємодіяти з продуктами імунної відповіді, часто не можуть викликати відповідь самостійно. Такі пептидні імуногени або, як їх часто звуть, "гаптени" фактично є неповними антигенами і, хоча самостійно вони не є здатними викликати імуногенність або добиватися вироблення антитіл, вони можуть бути зроблені імуногенними шляхом сполучання їх з відповідним носієм. Носіями, зазвичай, є білкові антигени більшої молекулярної маси, що є здатними викликати імунологічну відповідь при їх уведенні в організм-хазяїн in vivo. При імунній відповіді антитіла виробляються і виділяються В-лімфоцитами у взаємодії з Тклітинами-хелперами (ТН). У більшості систем типу гаптен-носій S-клітини виробляють антитіла, що є специфічними як для гаптена, так і для носія. У цих випадках Т-лімфоцити мають на носії домени специфічного зв'язування, але не розпізнають самі лише гаптени (тобто без носія). В- і Т-клітини, об'єднуючи свої дії в синергічному ефекті, викликають гаптен-специфічну гуморальну імунну відповідь. Після такої імунної відповіді, якщо хазяїн слідом за нею стимулюється самим лише гаптеном, то звичайно він відповідає виробленням гаптенспецифічних антитіл із клітин пам'яті, утворених після початкової імунізації. Синтетичні гаптени, що імітують деякі критичні епітопні структури на більш великих макромолекулах, часто кон'югують з носіями, створюючи імунну відповідь на більш велику, "батьківську", молекулу. Наприклад, короткі пептидні сегменти можуть бути синтезовані із відомої послідовності білка і сполучені з носієм для індукування імуногенності до нативного білка. Цей тип синтетичного підходу до вироблення імуногена став основою для багатьох сучасних досліджень зі створення вакцин. Проте, в багатьох випадках одне лише генерування гуморальної імунної відповіді шляхом використання синтетичних кон'югатів пептид-носій, хоча і добре сконструйованих, не завжди гарантує повний захисний імунітет проти інтактного антигена. Імунна відповідь, генерована коротким пептидним епітопом із більш великої вірусної частки або бактеріальної клітини, може бути достатньою лише для генерування пам'яті на рівні В-клітин. Стосовно цих випадків існує сучасна загальноприйнята думка, що цитотоксична Т-клітинна реакція є більш важливим індикатором захисного імунітету. Сьогодні одним із найбільш цікавих об'єктів досліджень у галузі імунології є проектування пептидних імуногенів з належними епітопними сайтами зв'язування для розпізнавання як В-клітинами, так і Тклітинами. Підхід до збільшення імуногенності малих або слабоімуногенних молекул шляхом кон'югування цих молекул з великими молекулами "носіїв" з успіхом використовувався протягом десятиріч [Goebel et al. (1939) J. Exp. Med. 69: 53]. Напри 93854 6 клад, було описано багато імуногенних складів, в яких очищені капсульовані полімери кон'югувалися з носійними білками, утворюючи більш ефективні імуногенні склади, що використовували цей "ефект носія" [Schneerson et al., (1984) Infect. Immun. 45: 582-591]. Було також показано, що кон'югація шунтує слабку гуморальну імунну відповідь, що звичайно спостерігається у дітей при їх імунізації вільним полісахаридом [Anderson et al., J. Pediatr. 107: 346 (1985); Insel et al., J. Exp. Med. 158: 294 (1986)]. Кон'югати гаптен-носій з успіхом генерувалися при використанні різноманітних зшивальних та зв'язувальних реагентів, включаючи гомобіфункціональні, гетеробіфункціональні та лінкери нульової довжини. Багато з цих методів сьогодні використовується для сполучання сахаридів, білків і пептидів з пептидними носіями. Більшість з таких методів дозволяє створювати амінні, амідні, уретанові, ізотіосечовинні та дисульфідні зв'язки, а в деяких випадках - тіоетери. Недоліком використання зв'язувальних реагентів, які вводять хімічно активні сайти в бічні ланцюги хімічно активних амінокислотних молекул в молекулах носія і/або гаптена, полягає в тому, що активні сайти, якщо вони не нейтралізовані, можуть вільно реагувати з будь-якою небажаною молекулою чи то in vitro (несприятливо цим впливаючи на функціональність або стабільність кон'югата (чи кон'югатів), чи то in vivo (створюючи цим потенційний ризик виникнення несприятливих подій у людей або тварин, імунізованих даними препаратами). На такі надмірно активні сайти можна впливати шляхом проведення з ними хімічних реакцій або шляхом іх "кепування" таким чином, щоб їх дезактивувати, використовуючи різноманітні відомі хімічні ракції, але з іншого боку ці реакції можуть бути руйнівними для функціональності зазначених кон'югатів. Це може ставати особливо проблематичним при спробах створити кон'югат шляхом уведення хімічно активних сайтів в молекулу носія, оскільки більш великі розміри та більш складна структура останньої (порівняно з гаптеном) може зробити її більш уразливою для руйнівних ефектів хімічної обробки. Підтвердженням цьому є також відсутність прикладів застосування методів, за допомогою яких кон'югат одержують, застосовуючи спочатку активацію носія, потім реакцію кон'югування його з гаптеном і, наприкінець, "кепінгування" (або "кепування") решти хімічно активних сайтів, зберігаючи при цьому здатність отримуваного кон'югата функціонувати як імуногенний склад, що має бажаний "носійний ефект". Суть винаходу Метою даного винаходу є створення процесів для одержання імуногенного кон'югата пептидного імуногена з білковим або поліпептидним носієм, де пептидний імуноген сполучається в кон'югаті з носієм через дериватизовані функціональні групи амінокислотних залишків носія, таких як лізини, і де будь-які некон'юговані, дериватизовані функціональні групи амінокислотних залишків дезактивуються шляхом кепінгу для запобігання реакції їх з іншими молекулами, включаючи білки та поліпептиди, і тим самим зберігається функціональність 7 носія, який в результаті залишається спроможним добиватися бажаних імунних відповідей проти даного пептидного імуногена, генерування котрих без носія було б неможливим. Крім того, винахід стосується кон'югатів, що одержуються за допомогою вищезазначених процесів, та імуногенних складів, що включають у себе такі кон'югати. В одному з варіантів його здійснення даний винахід спрямований на перший процес для кон'югації пептидного імуногена через хімічно активну групу амінокислотного залишку пептидного імуногена з білковим або поліпептидним носієм, що має одну або більше функціональних груп, де даний процес включає у себе стадії: (а) дериватизації однієї чи більше функціональних груп білкового або поліпептидного носія для створення дериватизованих молекул з хімічно активними сайтами; (b) проведення реакції дериватизованого білкового або поліпептидного носія стадії (а) з хімічно активною групою амінокислотного залишку пептидного імуногена в таких умовах, що даний пептидний імуноген кон'югується з дериватизованим білковим або поліпептидним носієм через функціональні групи; і (с) проведення подальшої реакції кон'югата з кепінг-реагентом для дезактивації вільних, хімічно активних функціональних груп активованого білкового або поліпептидного носія, захищаючи цим функціональність носія від пептидного імуногена, що без носія було б неможливим. В одному з варіантів здійснення винаходу білковий або поліпептидний носій вибирають із групи, що складається із альбуміну сироватки людини, гемоціаніну лімфи слимака, молекул імуноглобуліну, тироглобуліну, овальбуміну, гемаглютиніну грипу, PAN-DR зв'язувального пептиду (PADRE поліпептиду), циркумспорозитного (CS) білка малярії, поверхневого антигена гепатиту В (HBSAg1928), білка теплового шоку (HSP) 65, Bacillus Calmette-Guerin (BCG), токсину холери, мутантів токсину холери зі зниженою токсичністю, токсину дифтерії, білка CRM197, щоє перехреснореактивним з токсином дифтерії, рекомбінантної стрептококової С5а пептидази, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664, Streptococcus pyogenes ORF 2452, Chlamydiapneumoniae ORF T367, Chlamydiapneumoniae ORF T858, правцевого токсоїду, ВІЛ gp120 T1, компонентів, що розпізнають молекули адгезивної матриці мікробної поверхні (MSCRAMMS), факторів і гормонів росту, цитокінів і хемокінів. В іншому варіанті здійснення винаходу білковий або поліпептидний носій містить Т-клітинний епітоп. Передбачений також варіант здійснення винаходу, в якому білковим або поліпептидним носієм є бактеріальний токсоїд, такий як правцевий токсоїд, токсин холери або мутант токсину холери, як зазначено вище. У кращому варіанті білковим або поліпептидним носієм є CRM197. У ще одному варіанті здійснення винаходу білковим або поліпептидним носієм може бути гемаглютинін грипу, PADRE поліпептид, CS білок маляріїї, поверхневий антиген гепатиту В (HSBAg19-28), 93854 8 білок теплового шоку 65 (HSP 65) або поліпептид із Mycobacterium tuberculosis (BCG). У кращому варіанті білковий або поліпептидний носій вибирають серед стрептококової rC5а пептидази, Streptococcus pyogenes ORF1224, Streptococcus pyogenes ORF1664 або Streptococcus pyogenes ORF2452, Chlamydiapneumoniae ORF T367 і Chlamydiapneumoniae ORF T858. В одному з варіантів здійснення винаходу білковим або поліпептидним носієм є фактор або гормон росту, який стимулює або підсилює імунну відповідь і який вибирають з групи, що складається із IL-1, IL-2, -інтерферону, IL-10, GM-CSF, МІР1, MIP-1 i RANTES. В одному з варіантів здійснення винаходу пептидний імуноген вибирають серед бактеріального білка, вірусного білка й еукаріотного білка. В іншому варіанті здійснення винаходу пептидний імуноген виводять із бактеріального білкового антигена родів Streptococcus pneumoniae, Staphylococcus aureus, Staphlylococcus epidermidis, Neisseria meningitidis, Neisseria gonorrheae, Haemophilus influemae, Esherichia coli, Klebsietta enterobacter, Listeria monocytogenes, Vibrio cholerae, Chstridiumperfiingens, Clostriditm botulinum, виду Pseudomonas, Salmonella typhimurium, Borrelia burgdorferi, Shigellaflexneri, Shigetta boydii, Shigella dysentriae, Alloiococcus otitidis і стрептококів групи В. Передбачений варіант здійснення винаходу, де пептидний імуноген виводять із білкового антигена від вірусу, вибраного із групи, що складається із вірусу імунодефіциту людини (ВІЛ), вірусу простого герпесу (HSV), вірусу папіломи людини (HPV), вірусу парагрипу (PIV), вірусу везикулярного стоматиту (VSV), респіраторно-синцитіального вірусу (RSV), вірусу Епштейна-Бара (EBV), коронавірусу, вірусу вісповакцини, ротавірусу, вірусу сказу, вірусу гепатиту С (HCV) і вірусу гепатиту В (HBV). Передбачений також варіант здійснення винаходу, в якому пептидний імуноген виводять із білкового антигена із грибка, вибраного серед родів Candida, Cryptococcus, Coccidioides, Histoplasma й Aspergillus. В іншому варіанті здійснення винаходу пептидний імуноген виводять із білкового антигена із паразита, вибраного серед плазмодію, трипаносоми, шистосоми і лейшманії. В іншому варіанті здійснення винаходу пептидний імуноген виводять із білкового антигена із еукаріота. У кращому варіанті еукаріотом є людина. У ще одному кращому варіанті здійснення винаходу пептидний імуноген від людини виводять зі злоякісної пухлини. У ще кращому варіанті пептидний імуноген є із антигена пухлини із гіпернефроїдної пухлини нирки, карциноми молочної залози, меланоми і карциноми простати. В іншому кращому варіанті пептидний антиген виводять із антигена пухлини, канцероембріонального антигена (СЕА). Відповідно до одного з аспектів даного винаходу пропонується пептидний імуноген, що містить А пептид або фрагменти А пептиду чи його ана 9 логів, що викликають імуногенну відповідь проти деяких епітопів усередині А. До числа імуногенних пептидів за даним винаходом входять імуногенні гетерологічні пептиди. У деяких імуногенних пептидів Α фрагмент зшивають з носієм, утворюючи імуногенний гетерологічний пептид, а потім цей гетерологічний пептид зшивають з носієм у відповідності з процесом за даним винаходом, отримуючи кон'югат. Відповідно до іншого аспекту даного винаходу пептидним імуногеном є поліпептид що містить Nкінцевий сегмент, що складається принаймні із залишків 1-5 пептиду А, де першим залишком пептиду А є N-кінцевий залишок даного поліпептиду, де цей поліпептид не має С-кінцевого сегмента пептиду А. Відповідно до ще одного аспекту даного винаходу пептидним імуногеном є поліпептид що містить N-кінцевий сегмент пептиду А, де цей сегмент починається на залишках 1-3 пептиду А, а закінчується на залишках 7-11 пептиду А. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є речовина, що викликає імуногенну відповідь проти N-кінцевого сегмента пептиду А, де цей сегмент починається на залишках 1-3 пептиду А, а закінчується на залишках 7-11 пептиду А не викликаючи імуногенної відповіді проти епітопу в інтервалі залишків 12-43 пептиду А43. Відповідно до ще одного аспекту даного винаходу пептидним імуногеном є гетерологічний поліпептид, що містить сегмент пептиду А, зшитий з гетерологічною амінокислотною послідовністю, що індукує відповідь Т-клітинхелперів проти гетерологічної амінокислотної послідовності, а отже і відповідь В-клітин проти Nкінцевого сегмента. У деяких пептидних імуногенах N-кінцевий сегмент пептиду А зшитий принаймні на його С-кінці з гетерологічним поліпептидом. У деяких пептидних імуногенів N-кінцевий сегмент пептиду А зшитий принаймні на його N-кінці з гетерологічним поліпептидом. У деяких пептидних імуногенів Nкінцевий сегмент пептиду А зшитий принаймні на його N і С кінцях з першим і другим гетерологічними поліпептидами. У деяких пептидних імуногенів N-кінцевий сегмент пептиду А зшитий принаймні на його N-кінці з гетерологічним поліпептидом, а на його С-кінці принаймні з однією додатковою копією N-кінцевого сегмента. У деяких пептидних імуногенів поліпептид містить від N-кінця до Скінця N-кінцевий сегмент пептиду А, множину додаткових копій N-кінцевого сегмента і гетерологічний амінокислотний сегмент. У деяких із вищезгаданих пептидних імуногенів поліпептид містить також щонайменше одну додаткову копію N-кінцевого сегмента. У деяких із вищезгаданих пептидних імуногенів зазначений фрагмент не має, щонайменше, 5 С-кінцевих амінокислот в А43. У деяких варіантах вищеописаних пептидних імуногенів зазначений фрагмент містить до 10 суміжних амінокислот із А. Відповідно до іншого аспекту даного винаходу пропонується пептидний імуноген, що містить пептид А або фрагменти пептиду А чи його анало 93854 10 гів, що викликають імуногенну відповідь проти деяких епітопів усередині А, і може мати конфігурацію, відому як конфігурація множинного антигенного пептиду (МАР). У деяких вищеописаних аспектах даного винаходу пептидний імуноген є із N-кінцевої половини пептиду А. У деяких вищеописаних аспектах даного винаходу пептидний імуноген є фрагментом пептиду А, вибраним із групи, що складається із Α1-3, 1-4, 1-5, 1-6, 1-7, 1-10, 1-11, 1-12, 1-16, 3-6 і 3-7. У деяких вищеописаних аспектах даного винаходу пептидний імуноген є із внутрішньої ділянки пептиду А. У деяких вищеописаних аспектах даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А13-28, 15-24, 17-28 і 25-35. Відповідно до деяких вищеописаних аспектів даного винаходу пептидний імуноген є із С-кінцевої частини пептиду А. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент А, вибраний із групи, що складається із А33-42, 35-40 і 35-42. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А1-3, 14, 1-5, 1-6, 1-7, 1-10, 1-11, 1-12, 1-16, 1-28, 3-6, 3-7, 13-28, 15-24, 17-28, 25-35, 33-42, 35-40 і 35-42. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А1-5, А1-7, А1-9 і А1-12. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із пептиду A1-5-L, A1-7-L, A1-9-L і A1-12-L, де L є лінкер. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із A15-L-C, A1-7-L-C, A1-9-L-C i A1-12-L-C, де С є цистеїновий амінокислотний залишок. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А16-22, А16-23, А17-23, А17-24, А18-24 i А18-25 Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А16-22-С, А1623-С, А17-23-С, А17-24-С, А18-24-С i А18-25С, де С є цистеїновий амінокислотний залишок Відповідно до інших аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із С-А16-22, С-А1623, С-А17-23, С-А17-24, С-А18-24 i С-А18-25, де С є цистеїновий амінокислотний залишок. У деяких із вищезгаданих пептидних імуногенів гетерологічний поліпептид вибирають із групи, що складається із пептидів, які мають Т-клітинний епітоп, В-клітинний епітоп та їх комбінації. В одному з варіантів здійснення винаходу функціональну групу однієї чи більше амінокилотних молекул білкового або поліпептидного носія або приєднаного в разі потреби поліпептидного лінкера дериватизують за допомогою зшивального реагента. В іншому варіанті здійснення винаходу агентом дериватизації є зшивальний реагент 11 нульової довжини. В іншому варіанті здійснення винаходу агентом дериватизації є гомобіфункціональний зшивальний реагент. Передбачений також варіант здійснення винаходу, в якому агентом дериватизації є а гетеробіфункціональний зшивальний реагент. У кращому варіанті здійснення винаходу гетеробіфункціональним реагентом є реагент, що реагує з первинною або -амінною функціональною групою однієї чи більше амінокислотних молекул білкового або поліпептидного носія i з бічною тіоловою групою однієї чи більше амінокислотних молекул пептидного імуногена. В одному з варіантів здійснення винаходу гетеробіфункціональним реагентом є N-сукцинімідилбромацетат. В іншому варіанті здійснення винаходу первинною або -амінною функціональною групою є лізин. Передбачений також варіант здійснення винаходу, в якому дериватизація первинної або амінної функціональної групи лізину білкового або поліпептидного носія N-сукцинімідилбромацетатом має результатом бромацетилювання первинних або -амінних залишків у лізинових молекул білкового або поліпептидного носія. У ще кращому варіанті бічною тіоловою групою є цистеїновий залишок пептидного імуногена, який може бути локалізований на амінному кінці пептидного імуногена, на карбоксильному кінці пептидного імуногена або усередині пептидного імуногенна. В іншому варіанті здійснення винаходу реагентом тіолування, таким як Νацетилгомоцистеїнтіолактон, реагент Трота (Traut) (2-імінотілан), SATA (N-сукцинімідил-Sацетилтіоацетат), SMPT (4сукцинімідилоксикарбонілметил-2піридилтіотолуол), сульфо-LS SPDP (сульфосукцинімідилпіридилдитіопропіонамідгексаноат), SPDP (сукцинімідилпіридилдитіопропіонат) створюється бічна тіолова група. У кращому варіанті кепінг-реагент, який використовують для дезактивації вільної, хімічно активної функціональної групи активованого білкового або поліпептидного носія, вибирають із групи реагентів, що складається із цистеїнаміну, N-ацетилцистаміну й етаноламіну. В особливо кращому варіанті здійснення винаходу кепінг-реагент, який використовують для дезактивації вільної, хімічно активної функціональної групи активованого білкового або поліпептидного носія, вибирають із групи реагентів, що складається із гідроксиду натрію, карбонату натрію, бікарбонату амонію й аміаку. В одному з варіантів здійснення винаходу хімічно активною групою амінокислотного залишку пептидного імуногена є вільна сульфгідрильна група. В іншому варіанті здійснення винаходу одна або більше функціональних груп є на лінкері, який у разі потреби є приєднаним до білкового або поліпептидного носія. У кращому варіанті лінкером є пептидний лінкер. У ще кращому варіанті пептидним лінкером є полілізин. В іншому варіанті його здійснення даний винахід спрямований на другий процес для кон'югування пептидного імуногена із білка або поліпептиду з 93854 12 білковим або поліпептидним носієм, який має таку структуру: де С є білковий або поліпептидний носій, а X є перетворюваною функціональною групою амінокислотного залишку в білковому або поліпептидному носії або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де m є ціле число більше 0, але не більше 85, причому даний процес включає у себе стадії: (a) дериватизації однієї чи більше функціональних груп білкового або поліпептидного носія або приєднаної в разі потреби молекули лінкера для створення дериватизованих молекул з хімічно активними сайтами; (b) проведення реакції дериватизованого білкового або поліпептидного носія стадії (а) з хімічно активною групою амінокислотного залишку пептидного імуногена з утворенням ковалентно зв'язаного кон'югата пептидного імуногена з білковим або поліпептидним носієм; і (c) проведення реакції вищезазначеного кон'югата з кепінг-реагентом для дезактивації вільної, хімічно активної функціональної групи в активованому білковому або поліпептидному носії таким чином, щоб кеповані групи не могли реагувати з іншими молекулами, включаючи білки та поліпептиди, і цим зберігалася функціональність носія та його здатність викликати бажані імунні відповіді проти даного пептидного імуногена, що без носія було б неможливим, у результаті чого утворюється кепований кон'югат пептидного імуногена з білковим або поліпептидним носієм, який описується такою формулою: де С є білковий або поліпептидний носій, a Xd є дериватизована функціональна група амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де Ρ є пептидна імуногенна молекула, ковалентно приєднана до дериватизованої функціональної групи амінокислотного залишку білкового носія або, в разі потреби, амінокислотниого залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія; R є кепінгмолекула, ковалентно приєднана до дериватизо 13 ваної функціональної групи амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотниого залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія; n є ціле число більше 0, але не більше 85, а р є ціле число більше 0, але не більше 85. Подані вище детальні описи варіантів здійснення першого процесу є правомірними також для кон'югатів, що одержуються за допомогою другого процесу. В одному з варіантів його здійснення даний винахід спрямований на кон'югати пептидного імуногена з білковим або поліпептидним носієм, де білковий або поліпептидний носій має таку формулу: де С є білковий або поліпептидний носій, а X є перетворювана функціональна група амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де m є ціле число більше 0, але не більше 85, а також де кепований кон'югат пептидного імуногена з білковим або поліпептидним носієм має таку формулу: де С є білковий або поліпептидний носій, a Xd є дериватизована функціональна група амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де Ρ є пептидна імуногенна молекула, ковалентно приєднана до дериватизованої функціональної групи амінокислотного залишку білкового носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, R є кепінг-молекула, ковалентно приєднана до дериватизованої функціональної групи амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, захищаючи цим функціональність носія таким чином, що він зберігає свою здатність викликати бажані імунні відповіді від пептидного імуногена, що без носія було б неможливим, n є ціле число 93854 14 більше 0, але не більше 85, а р є ціле число більше 0, але не більше 85. Поданий вище детальний опис варіантів здійснення першого і другого процесів є правомірним також для описаних вище кон'югатів. В іншому варіанті здійснення винаходу пропонуються кон'югати пептидного імуногена з білковим або поліпептидним носієм, які створені за допомогою другого процесу згідно з даним винаходом і мають таку формулу: де С є білковий або поліпептидний носій, a Xd є дериватизована функціональна група амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де Ρ є молекула пептидного імуногена, ковалентно приєднана до дериватизованої функціональної групи амінокислотного залишку білкового носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, R є кепінг-молекула, ковалентно приєднана до дериватизованої функціональної групи амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, амінокислотного залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, захищаючи цим функціональність носія таким чином, що він зберігає свою здатність викликати бажані імунні відповіді від пептидного імуногена, що без носія було б неможливим, n є ціле число більше 0, але не більше 85, а р є ціле число більше 0, але не більше 85. Поданий вище детальний опис варіантів здійснення другого процесу є правомірним також для кон'югатів, створених за допомогою другого процесу, як описано вище. В іншому варіанті здійснення винаходу пропонуються імуногенні склади, що містять кон'югат пептидного імуногена з білковим або поліпептидним носієм, створений за допомогою другого процесу за даним винаходом, разом з одним чи більше фармацевтично прийнятними ексципієнтами, розріджувачами та ад'ювантами. Поданий вище детальний опис варіантів здійснення другого процесу і створених за його допомогою кон'югатів є правомірним також для імуногенних складів, що містять ці кон'югати згідно з описаним вище. В іншому варіанті здійснення винаходу пропонується процес для індукування імунної відповіді у ссавця, який включає у себе введення ссавцю ефективної кількості імуногенного складу за даним винаходом. Подані вище детальні описи варіантів здійснення імуногенного складу, що містить кон'югат за даним винаходом, є правомірними також до варіа 15 нтів здійснення даного винаходу стосовно процесу для використання такого імуногенного складу. Перелік фігур креслення Фіг. 1. Блок-схема процесу кон'югації фрагментів пептиду А з білковим або поліпептидним носієм CRM197 для утворення кон'югата A/CRM-197. Фіг. 2. Блок-схема процесу кислотного гідролізу, що використовується для визначення кількості S-карбоксиметилцистеїну і Sкарбоксиметилцистеїнаміну при оцінці ступеню злиття кон'югатів пептидного імуногена з білком або поліпептидом, таких, як кон'югат A/CRM197. Фіг. 3. Ілюстрація рН-залежності реакції кон'югації А пептиду з білком CRM. Фіг. 4. Ілюстрація залежності реакції кон'югації А пептиду з білком CRM від співвідношення пептид:CRM. Фіг. 5. Перевірка кепінг-процесу в кон'югації A1-7/CRM. Величина рН реакційної суміші складала 9,15. Тривалість реакції з пептидом складала 16 годин. Кепінг N-ацетилцистеїнаміном тривав 8 годин. Фіг. 6. Кон'югація і кепінг пептидом при різних співвідношеннях пептид:CRM. Величина рН реакційної суміші складала 9.0. Тривалість реакції з 93854 16 пептидом складала 16 годин. Кепінг Nацетилцистеїнаміном тривав 8 годин. Фіг. 7. Титри сироваток приматів на 36 день після імунізації приматів кон'югатами пептиду А з різними ад'ювантами. Фіг. 8. Титри сироваток приматів на 64 день після імунізації приматів кон'югатами пептиду А з різними ад'ювантами. Фіг. 9. Титри приматів по днях і групах імунізації. Примати імунізувалися кон'югатами А1-7 або А1-5 з CRM197 з галуном або 529 як ад'ювантами, а титри антитіл проти А виміряли на 29, 36, 57 і 54 дні. Фіг. 10. Пептид-білкові кон'югати характеризувалися за допомогою аналізу методом SDS-PAGE (електрофорез у поліакриламідному гелі з додецилсульфатом натрію) вестерн-блотінгу з тристрициновим гелем промислового виготовлення. Смугами на фото є: маркер (смуга 1); L-28375 24/01 (смуга 2); L-28375 24/02 (смуга 3); L-28375 24/03 (смуга 4); L-28375 24/04 (смуга 5); L-28375 24/05 (смуга 6); L-28375 24/06 (смуга 7); L-28375 24/07 (смуга 8); L-28375 24/08 (смуга 9); L-28375 24/09 (сурогат) (смуга 10); і BrAcCRM197 (смуга 11). 17 93854 18 19 Докладний опис винаходу Даний винахід стосується процесів для створення кон'югатів типу пептидний імуноген-носій, де непрореаговані активні функціональні групи носія, що створюються під час активації, дезактивуються за допомогою кепінг-реагентів і, зокрема, Nацетилцистеїнаміну для відвертання їх від подальшого реагування. Винахід стосується також кепованих кон'югатів типу носій-пептидний імуноген, створених за допомогою запропонованих процесів, та імуногенних складів, що містять зазначені кон'югати. Підхід до збільшення імуногенності малих або слабоімуногенних молекул таких, як сахариди, шляхом кон'югації з успіхом використовувався протягом десятиріч [Goebel et al., (1939) J. Exp. Med. 69: 53], і було описано багато імуногенних складів, в яких очищені капсульовані полімери кон'югувалися з носійними білками, утворюючи більш ефективні імуногенні склади, що використовували цей "ефект носія". Наприклад, Шнірсон зі співробітниками [Schneerson et al. J. Exp. Med. 152: 361-376, 1980] описують кон'югати "Haemophilus influenzae b полісахаридний білок", які надають імунітет до інвазійних хвороб, викликаних цим мікроорганізм. Кон'югати PRP (полірибосилрибітолфосфату, капсульованого полімеру мікроорганізму Н. influenzae b) виявили свою більш високу ефективність, ніж імуногенні склади на основі лише полісахариду [Chu et al., (1983) Infect. Іmmun. 40: 245; Schneerson et al. (1984), Infect. Immun. 45: 582-591]. Було також показано, що кон'югація шунтує слабку гуморальну імунну відповідь, що звичайно спостерігається у дітей при їх імунізації вільним полісахаридом [Anderson et al., J. Pediatr. 107: 346 (1985); Insel et at., J. Exp. Med. 158: 294 (1986)]. Ще однією перевагою використання бактеріального токсину або токсоїду як білкового носія порівняно з імунізацією людей (наприклад, від правця або дифтерії) у стандартній практиці є те, що бажаний імунітет до токсину або токсоїду індукується разом з імунітетом проти патогенів, пов'язаних з даним капсульованим полімером. Для вироблення високоспецифічних моноклональних антитіл, здатних розпізнавати дискретні 93854 20 хімічні епітопи на зв'язаному гаптені використовуються також кон'югати типу "антигенна детермінанта/гаптен-носій". Одержані за їх допомогою моноклональні антитіла часто використовуються в дослідженнях епітопної структури і взаємодій між нативними білками. У багатьох випадках такі сполучення антигенних детермінант з гаптенами, що використовуються для створення цих моноклональних антитіл, є малими пептидними сегментами, які являють собою ключові антигенні сайти на поверхні більш великих білків. Критеріями для добору носія, підходящого для застосування у створенні кон'югата "антигенна детермінанта/гаптенносій" є його потенційна імуногенність, наявність у ньому підходящої функціональної групи для кон'югації із субстанцією "антигенна детермінанта/гаптен", прийнятна розчинність навіть після дериватизації і відсутність токсичності in vivo. Цим критеріям задовольняють кон'югати, створені за допомогою процесів згідно з даним винаходом. Підходящими є будь-які стабільні кон'югати "пептидний імуноген-носій", створені за допомогою описаного тут процесу кон'югації. Ці кон'югати одержують, застосовуючи процес згідно з даним винаходом, де білковий або поліпептидний носій, який має структуру ковалентно зв'язується з білковим або поліпептидним носієм, де С є білковий або поліпептидний носій, а X є перетворювана функціональна група на амінокислотному залишку білкового або поліпептидного носія або, в разі потреби, на амінокислотному залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, і де m є ціле число більше 0, але не більше 85, ковалентно зв'язується з пептидним імуногеном і де кон'югат пептидного імуногена з білковим або поліпептидним носієм має таку формулу: 21 93854 де: С є білковий або поліпептидний носій, a Xd є дериватизована функціональна група на амінокислотному залишку білкового або поліпептидного носія або, в разі потреби, на амінокислотному залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, Ρ є пептидний імуноген, ковалентно зв'язаний з дериватизованою функціональною групою амінокислотного залишку білкового або поліпептидного носія або, в разі потреби, на амінокислотному залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, R є кепінг-молекула, ковалентно приєднана до дериватизованої функціональної групи на амінокислотному залишку білкового або поліпептидного носія або, в разі потреби, амінокислотниого залишку пептидного лінкера, ковалентно приєднаного до білкового або поліпептидного носія, захищаючи цим функціональність носія таким чином, що він зберігає свою здатність викликати бажані імунні відповіді від пептидного імуногена, що без носія було б неможливим, n є ціле число більше 0, але не більше 85, а р є ціле число більше 0, але не більше 85. Добір носіїв Гемаглютинін грипу: НА307-319 PAN-DR Пептид (PADRE пептид) CS білок малярії: епітоп Т3 Поверхневий антиген гепатиту В: HBsAg19-28 Білок 65 теплового шоку: hsp65153-171 Bacillus Calmette-Guerin (BCG) Правцевий токсоїд: TT830-844 Правцевий токсоїд: TT947-967 ВІЛ gp120 T1: CRM197 Фрагмент альбуміну 22 Деякі пептидні імуногени містять відповідний епітоп для індукування імунної відповіді, але є занадто малими для того, щоб бути імуногенними. У зв'язку з цим, пептидні імуногени об'єднують з підходящим носієм для сприяння індукції імунної відповіді. У поданій вище схематичній уяві кон'югата "пептидний імуноген-носій", створеного за допомогою процесу згідно з даним винаходом, С є білковий або поліпептидний носій, з яким пептидні імуногени кон'юговані безпосередньо через дериватизовані функціональні групи на амінокислотних залишках самого носія або непрямо, через дериватизовані функціональні групи на пептидних лінкерах, ковалентно зв'язаних з цими носіями. Підходящими білковими або поліпептидними носіями можуть бути, наприклад, альбумін (включаючи альбумін людської сироватки), гемоціанін лімфи слимака, молекули імуноглобуліну, тироглобуліну, овальбуміну, правцевий токсоїд або токсоїд від інших патогенних бактерій, що мають знижену токсичність, включаючи таких мутантів, як дифтерія, Е. coli, холера, Н. pylori, або пригнічена похідна токсину. Одним з таких носіїв є, наприклад, білок CRM197 (SEQ ID NO: 40), що володіє перехресною реактивністю з токсином дифтерії. Підходящими носіями можуть бути також епітопи Т-клітин, що зв'язуються з множинними алелями головного комплексу гістосумісності (МНС), наприклад, щонайменше 75% всіх алелей МНС людини. Такі носії іноді називають "універсальними епітопами Т-клітин". Нижче наведені типові носії з універсальними епітопами Т-клітин. PKYVKQNTLKLAT (SEQ ID NO: 11) AKXVAAWTLKAAA (SEQ ID NO: 12) EKKIAKMEKASSVFNV (SEQ ID NO: 13) FELLTRlUn (SEQ ID NO: 14) QSIGDLIAEAMDKVGNEG (SEQ ID NO: 15) QVHFQPLPPAWKL (SEQ ID NO: 16) QYIKANSKFIGITEL (SEQ ID NO: 17) NNFTVSFWLRVPKVSASHLE (SEQ ID NO: 18) KQIINMWQEVGKAMY (SEQ ID NO: 19) Див. Скорочений опис послідовностей (SEQ ID NO: 40) ISQAVHAAHAEINEAGR (SEQ ID NO: 41) До носіїв, які є підходящими для стимулювання або підсилення імунної відповіді і з якими може бути кон'югований пептидний імуноген або гаптен, належать також цитокіни, наприклад, IL-1, IL-1 і пептиди, IL-2, lNF, IL-10, GM-CSF, і хемокіни, наприклад, МІР 1 і , і RANTES. Імуногенні пептиди можна також зв'язувати з білковими або пептидними носіями, що підсилюють транспортування через тканини, як описано в заявках [O'Mahony, WO 97/17163, WO 97/17614], включених тут в усій їхній повноті і для всіх цілей шляхом посилання. Серед підходящих носіїв можна назвати також рекомбінантну стрептококову С5а пептидазу, Streptococcus pyogenes ORF 1224, 1664 і 2452, Chlamydia pnewrioniae ORF T367 і Т858, фактори і гормони росту. В одному з кращих варіантів здійснення даного винаходу носійним білком є CRM197, нетоксичний мутант токсину дифтерії із заміною однієї амі нокислоти в його первинній послідовність Гліцин у положенні амінокислоти 52 молекули заміщується на глутамінову кислоту внаслідок заміни одного нуклеїнокислотного кодону. У результаті цієї заміни білок втрачає ADP-рибозилтрансферазну активність і стає нетоксичним. Він має молекулярну масу 58408 Da. Білок CRM197 виробляється у великих кількостях шляхом рекомбінантної експресії у відповідності з [U.S. Patent 5,614,382], включеним тут шляхом посилання. Кон'югування сахаридів, а також пептидів з білком CRM197 здійснюють шляхом зв'язування через -аміногрупи лізинових залишків. На декількох промислових продуктах було добре встановлено, що білок CRM197 є чудовим і безпечним носієм для епітопів В-клітин. Імуногенні пептиди Використовуваний тут термін "пептидний імуноген" або "гаптен" означає будь-яку білкову або субблочну структуру, її фрагмент або виведений з 23 неї її аналог, що може викликати, полегшувати або індукуватися до вироблення імунної відповіді при введенні її (або його) ссавцю. Цей термін, зокрема, використовується для позначення поліпептидної антигенної детермінанти із будь-якого джерела (бактерії, вірусу або еукаріота), яка може бути зв'язана з носієм за допомогою описаного тут процесу. Такі поліпептидні імуноген/антигенні детермінанти можуть походити із вірусних, бактеріальних або еукаріотних клітин. До числа пептидних імуногенів із бактеріальних клітин належать такі, що є виведеними із поверхні бактеріальних клітин або секретованих білків, які можуть використовуватися в імуногенних складах на основі білків. Серед підходящих для цього типових бактеріальних штамів можна назвати Streptococcus pneumoniae, Staphylococcus aureus, Neisseria meningitidis, Haemophilus influenzae, види Klebsiella, види Pseudomonas, види Salmonella, види Shigella, Alloiococcus otiditis і стрептококи групи В. Підходящі типові пептидні імуногени із вірусів виводять, наприклад, із вірусу імунодефіциту людини (ВІЛ), вірусу простого герпесу (HSV), вірусу папіломи людини (HPV), вірусу парагрипу (PIV), вірусу везикулярного стоматиту (VSV), респіраторно-синцитіального вірусу (RSV), вірусу ЕпштейнаБара (Epstein-Barr) (EBV), коронавірусу, вірусу вісповакцини, ротавірусу, вірусу сказу, вірусу гепатиту С (HCV) і вірусу гепатиту В (HBV). Серед підходящих пептидних імуногенів грибкового походження можна назвати, наприклад, такі, що виводять із штамів Candida albicans, Cryptococcus neoformans, виду Coccidoides, виду Histoplasma і виду Aspergillus. Підходящими паразитичними антигенами є виведені, наприклад, із виду плазмодію, виду трипаносоми, виду шистосоми, виду лейшманії і т.п. Типовими еукаріотними пептидними імуногенами, які можуть бути кон'юговані з носієм для використання їх як імунотерапевтичних засобів у відвертанні, лікуванні, профілактиці або поліпшенні симптомів різноманітних захворювань людей, є такі, що пов'язані з пухлинними клітинами, імуногени, виведені із пептиду А, пептид із 39-43 амінокислот, краще - із 42 амінокислот, що є принциповим компонентом характеристичних бляшок хвороби Альцгеймера (AD) [US 4,666,829; Glenner & Wong (l9S4) Biochem. Biophys. Res. Commun. l2Q: 7131, Hardy (1984) TINS 20: 1131; Hardy (1977) TINS 20: 154], імуногени, виведені із амілоїдних пептидів аміліну, поліпептидний матеріал, вироблений клітинами панкреатичних острівців, що були залучені до діабету II типу, пептиди, виведені із генних продуктів ліпопротеїнів низької густини, які були залучені до атеросклерозу, та антигенні пептиди, виведені із запальних цитокінів і факторів росту таких, як інтерлейкін 6 (DL-6), фактор росту пухлин (TNF-) і GDF-8. Такі еукаріотні пептидні імуногени можуть включати у себе Т-клітинний (CTL) або В-клітинний епітоп. "CTL епітоп" отримують із вибраних епітопних ділянок потенційних антигенів-мішеней, наприклад, антигенів, пов'язаних з пухлинами, включаючи карциному клітин нирок, рак молочної залози, 93854 24 канцероембріональні антигени, антигени меланоми (MAGE) і специфічні антигени раку простати, наприклад, специфічний мембранний антиген простати (PSMA) й антиген стовбурових клітин простати (PSCA), антигени гепатиту С. Пептид А, відомий також як -амілоїдний пептид або пептид А4, див. [US 4,666,829; Glenner & Wong, Biochem. Biophys. Res. Com/mm., 120, 1131 (1984)], складається із 39-43 амінокислот і є головним компонентом характеристичних бляшок хвороби. Пептид А створюють шляхом процесінгу білка АРР більшої величини двома ферментами, що звуться - і -секретазами [Hardy, TESTS 20,154 (1997)]. Відомі мутації в АРР, пов'язані з хворобою Альцгеймера, виникають поблизу сайта - або -секретази або усередини A. Наприклад, положення 717 є сусіднім до сайта розщеплення АРР -секретазою при його переробці на А, а положення 670/671 є сусідніми до сайта розщеплення -секретазою. Вважається, що ці мутації викликають хворобу Альцгеймера шляхом взаємодії з реакціями розщеплення, в результаті яких утворюється пептид А, збільшуючи таким чином кількість амінокислотної форми 42/43 генерованого пептиду А. Пептид А має ту незвичайну властивість, що він може закріплювати й активувати як класичні, так і почергові шляхи активації комплемента. Зокрема, він зв'язується з Clq і, кінець кінцем, з С3bі. Це об'єднання полегшує зв'язування з макрофагами, що веде до активації B клітин. Крім того, С3bі розщеплюється дали і потім зв'язується з CR2 на В-клітинах залежним від Т-клітин чином, у результаті чого відбувається 10000-кратне збільшення активації цих клітин. Цей механізм спонукає пептид А до генерування імунної відповіді у більшій кількості порівняно з іншими антигенами. Пептид А має декілька природних форм. Людські форми пептиду А позначаються як А39, А40, А41, А42 і А43. Послідовністі цих пептидів та їх взаємозв'язок з АРР попередником ілюстровані на Фіг. 1 із [Hardy et al., TINS 20,155-158 (1997)]. Наприклад, А42 має таку послідовність: Форми А41, А40 і А39 відрізняються від А42 пропуском залишків Ala, Ala-lle і Ala-lle-Val, відповідно, від С-кінця. А43 відрізняються від А42 наявністю треонінового залишку на С-кінці. Пептидні імуногени, що є фрагментами пептиду А, мають для застосування в запропонованих процесах декілька переваг у порівнянні з інтактними молекулами. По-перше, оскільки корисну імуногенну відповідь для лікування хвороби Альцгеймера індукують лише деякі епітопи в пептиді A, однакові масові дози їх фрагментів, що містять такі епітопи, дають більшу молярну концентрацію корисного імуногенного епітопу, ніж інтактний A. По-друге, деякі пептидні імуногени пептиду А 25 генерують імуногенну відповідь проти амілоїдних депозитів, але не дають суттєвої імуногенної відповіді проти білка АРР, із якого виведений пептид А. По-третє, пептидні імуногени пептиду A завдяки їхньому меншому розміру є більш простими у виготовленні, ніж інтактний А. По-четверте, пептидні імуногени А не агрегуються таким самим чином, як інтактний А, спрощуючи цим приготування кон'югатів з носіями. Деякі пептидні імуногени А мають послідовності, щонайменше, із 2, 3, 5, 6, 10 або 20 суміжних амінокислот із природного пептиду. Деякі пептидні імуногени мають не більше, ніж 10, 9, 8, 7, 5 або 3 суміжні залишки із А. У кращому варіанті для одержання кон'югатів використовуються пептидні імуногени із N-кінцевої половини пептиду А. До числа кращих пептидних імуногенів належать А1-5, 1-6, 1-7, 1-10, 1-11, 3-7, 1-3 і 1-4. Наприклад, позначення А1-5 стосується N-кінцевого фрагмента, включаючи залишки 1-5 пептиду А. Особливо підходящими є А фрагменти, що починаються на N-кінці і закінчуються одним із залишків ділянки 7-11 пептиду А. Можна використовувати також фрагмент А1-12, але він є менш підходящим. У деяких процесах таким фрагментом є N-кінцевий фрагмент, відмінний від А1-10. Прийнятними є також фрагменти А13-28, 15-24, 1-28, 25-35, 3540, 35-42 та інші внутрішні і С-кінцеві фрагменти. Деякі пептиди А за даним винаходом є імуногенними, і після їх введення людини або тварині вони генерують антитіла, що специфічно зв'язуються з одним чи більше епітопами на ділянці між залишками 16 і 25 пептиду А. Кращими при цьому є фрагменти Α16-22, 16-23, 17-23, 17-24, 18-24 і 18-25. Антитіла, що специфічно зв'язуються з епітопами на ділянці між залишками 16 і 25, специфічно зв'язуються з розчинним пептидом А, але не зв'язуються з бляшками пептиду А. Антитіла цих типів можуть специфічно зв'язуватися з розчинним А у кровообігу людини або тварини, не зв'язуючись специфічно з бляшковими відкладеннями пептиду А в мозку людини або тварини. Специфічне зв'язування антитіла з розчинним А інгібує вбудовування А у бляшки, становлячись, таким чином, перешкодою для розвинення бляшок у пацієнта та гальмуючи подальше зростання розміру і густини бляшок, якщо останні до початку лікування вже досягли помітного рівня розвитку. Бажано, щоб уведений фрагмент пептиду А не мав епітопу, здатного генерувати Т-клітинну імунну реакцію на цей фрагмент. У загальному випадку Т-клітинні епітопи мають довжину більше 10 суміжних амінокислот. Отже, кращі фрагменти пептиду A мають розмір 5-10, краще 7-10 суміжних амінокислот, а найкраще 7 суміжних амінокислот, тобто довжину, достатню для генерування гуморальної імунної відповіді, не викликаючи Тклітинної імунної реакції. Умова відсутності Тклітинних епітопів зумовлена тим, що ці епітопи не є потрібними для імуногенної активності фрагментів і можуть викликати небажану запальну реакцію у певних підгруп пацієнтів [Anderson et al., (2002) J. 93854 26 Immunol. 168, 3697-3701; Senior (2002) Lancet Neurol. 1,3]. Фрагмент A15-25 і субфрагменти із 7-8 його суміжних амінокислот є кращими, оскільки ці пептиди безумовно генерують високу імуногенну відповідь на пептид А. До числа цих фрагментів належать А16-22, А16-23, А16-24, А17-23, А1724, А18-24 і А18-25. Особливо підходящими субфрагментами А15-25 є такі, що мають довжину із 7 суміжних амінокислот. Наприклад, записом А15-21 позначається фрагмент, який включає у себе залишки 15-21 пептиду А і не має інших залишків цього пептиду. У кращому варіанті такі фрагменти мають довжину із 7-10 суміжних амінокислот. Такі фрагменти можуть генерувати гуморальну імунну відповідь, яка включає антитіла з кінцевою специфічністю. Пептидний імуногени пептидів А потрібно добирати за їхньою активністю в очищенні або відвертанні амілоїдних відкладень, див. заявку [WO 00/72880], включену тут в усій її повноті і для всіх цілей шляхом посилання. Введення N-кінцевих фрагментів пептиду А викликає вироблення антитіл, які розпізнають А-відкладення in vivo та in vitro. У деяких процесах використовуються фрагменти, які не містять щонайменше однієї, а іноді щонайменше 5 або 10 С-кінцевих амінокислот, наявних у природних формах пептиду А. Наприклад, фрагмент, що не має 5 амінокислот від Скінця пептиду А43, містить перші 38 амінокислот від N-кінця пептиду А. Якщо не зазначено іншого, то позначенням А охоплюються всі згадані вище людські амінокислотні послідовності, а також їх аналоги, включаючи алельні, видові та індуковані варіанти. Аналоги, звичайно, відрізняються від пептидів природного походження за одним, двома або кількома положеннями, часто в силу консервативних заміщень. Аналоги, звичайно, демонструють щонайменше 80 або 90% ідентичність послідовністей з натуральними пептидами. Деякі аналоги містять також штучні амінокислоти або модифікації N- чи С-кінцевих амінокислот в одному, двох або декількох положеннях. Наприклад, залишок неприродної аспартанової кислоти в положеннях 1 і/або 7 пептиду А може бути заміщений на ізоаспартанову кислоту. Амінокислотами неприродного походження можуть бути, наприклад, D, альфа, альфадвозаміщені амінокислоти, N-алкільні амінокислоти, молочна кислота, 4-гідроксипролін, гаммакарбоксиглутамат, епсилон-N,N,N-триметиллізин, епсилон-N-ацетиллізин, О-фосфосерин, Nасетилсерин, N-формілметіонін, 3-метилгістидин, 5-гідроксилізин, омега-N-метиларгінін, -аланін, орнітин, норлейцин, норвалін, гідроксипролін, тироксин, гамма-аміномасляна кислота, гомосерин, цитрулін та ізоаспартанова кислота. До числа імуногенних пептидів належать також аналоги пептиду А та їх фрагменти. Деякими терапевтичними засобами згідно з даним винаходом є all-D пептид, e.g., all-D Aft all-D А фрагмент, або аналоги повністю-D-пептиду А або фрагмента повністю-Dпептиду А. Фрагменти та аналоги можуть добиратися за профілактичною або терапевтичною ефек 27 тивністю шляхом випробувань на трансгенних тваринних моделях у порівнянні з необробленими або плацебо контрольними зразками, як описано в заявці WO 00/72880. До числа пептидних імуногенів належать також поліпептиди більшої довжини, наприклад, імуногенний поліпептид пептиду А, разом з іншими амінокислотами. Кращими імуногенними пептидами є, наприклад, злиті білки, що містять сегмент пептиду А, приєднаний до гетерологічної амінокислотної послідовність що індукує Т-хелперклітинну відповідь проти гетерологічної амінокислотної послідовності і цим самим гуморальну імунну відповідь проти сегмента А. Такі поліпептиди можуть добиратися за профілактичною або терапевтичною ефективністю шляхом випробувань на трансгенних тваринних моделях у порівнянні з необробленими або плацебо контрольними зразками, як описано в заявці WO 00/72880. Пептид А, його аналог, імуногенний фрагмент або інший поліпептид може вводитися пацієнту як у дизагрегатованій, так і в агрегатованій формі. Дизагрегатований пептид А або його фрагменти є мономерними пептидними блоками. Дизагрегатований пептид A або його фрагменти у загальному випадку є розчинними і здатними самоагрегатуватися з утворенням розчинних олігомерів, протофібрил і ADDL. Олігомери пептиду А та їх фрагменти зазвичай є розчинними й існують переважно у формі альфа-спіралей або випадкових клубків. Агрегованим пептидом А або його фрагменти є олігомери пептиду А або його фрагментів, що зібралися в нерозчинні бета-листові скупчення. Агрегованим пептидом А або його фрагментами є також фібрилярні полімери. Фібрили зазвичай є нерозчинними. Деякі антитіла зв'язують або розчинний пептид А чи його фрагменти, або і агрегований пептид А чи його фрагменти. Деякі антитіла зв'язують як розчинний пептид А чи його фрагменти, так і агрегований пептид А чи його фрагменти. До числа імуногенних пептидів належать також мультимери мономерних імуногенних пептидів. Імуногенні пептиди, відмінні від пептидів А, повинні індукувати імуногенну відповідь проти одного чи більше із вищеперелічених кращих фрагментів пептиду А (наприклад, А1-3, 1-7, 1-10 і 37). Імуногенні пептиди за даним винаходом сполучаються з носієм у відповідності із запропонованим процесом, утворюючи кон'югат. Для створення кон'югата імуногенний пептид може бути приєднаний до носія своїм амінним кінцем, карбоксильним кінцем або обома кінцями. У разі потреби в кон'югаті можуть бути наявними множинні повтори імуногенного пептиду. N-кінцевий фрагмент пептиду А може бути приєднаний його С-кінцем до носійного пептиду з 93854 28 утворенням кон'югата. У таких кон'югатів Nкінцевий залишок фрагмента пептиду А утворює собою N-кінцевий залишок кон'югата. Завдяки цьому такі кон'югати є ефективними в індукуванні антитіл, що зв'язуються з епітопом, якому потребується N-кінцевий залишок пептиду А для того, щоб бути у вільній формі. Деякі імуногенні пептиди за даним винаходом містять множину повторів Nкінцевого сегмента пептиду А, зв'язаного на Скінці з однією чи більше копіями носійного пептиду, утворюючи кон'югат. N-кінцевий фрагмент пептиду А, вбудованого в такі кон'югати, іноді починається на А1-3 і кінцях на А7-11. Кращими N-кінцевими фрагментами пептиду А є А1-7, 1-3, 1-4, 1-5 і 37. Деякі кон'югати містять різні N-кінцеві сегменти пептиду А в тандемі. Наприклад, той чи інший кон'югат може містити А1-7, за яким йде А1-3, приєднаний до носія. У деяких кон'югатів N-кінцевий сегмент пептиду А приєднаний до носійного пептиду принаймні на його N-кінці. Таке саме різноманіття N-кінцевих сегментів пептиду А може використовуватися в С-кінцевому зв'язку. Деякі кон'югати містять носійний пептид, приєднаний до N-кінця N-кінцевого сегмента пептиду А, який, у свою чергу, приєднаний до одного чи більше додаткових N-кінцевих сегментів пептиду А у тандемі. У кращому варіанті такі імуногенні А-фрагменти, кон'юговані з відповідним носієм, індукують імуногенну відповідь, специфічно спрямовану на даний А-фрагмент, не спрямовуючись при цьому на інші фрагменти пептиду А. Імуногенними пептидами за даним винаходом можуть бути також імуногенні гетерологічні пептиди. У деяких імуногенних пептидів фрагмент пептиду А приєднаний до носія, утворюючи імуногенний гетерологічний пептид. Цей гетерологічний пептид приєднується до носія у відповідності з процесом за даним винаходом і утворює кон'югат. Деякі з таких імуногенних гетерологічних пептидів містять фрагменти пептиду А, зв'язані з епітопами правцевого токсоїду такими, як описано в [US 5,196,512, ЕР 378,881 і ЕР 427,347]. В разі потреби імуногенний пептид може бути з'єднаний з однією чи багатьма копіями носія, наприклад, обома кінцями - N і С носія, утворюючи імуногенний гетерологічний пептид. Інші з таких імуногенних гетерологічних пептидів містять фрагменти пептиду А, з'єднані з носійними пептидами, описаними в [US 5,736,142]. Наприклад, імуногенний гетерологічний пептид може містити, А1-7, за ним - А1-3, а за ним - носій. Як приклади таких імуногенних гетерологічних пептидів можна назвати: 29 93854 30 31 93854 32 Деякі імуногенні гетерологічні пептиди містять мультимер із імуногенних пептидів, що описуються формулою 2х, де x є ціле число від 1 до 5. У кращому варіанті число χ дорівнює 1, 2 або 3, серед яких число 2 є найкращим. Якщо x є 2, то такий мультимер має чотири імуногенні пептиди, зв'язані у кращій конфігурації під назвою МАР4 [US 5,229,490]. Такі імуногенні пептиди з'єднуються далі з носієм у відповідності з процесом за даним винаходом, утворюючи кон'югат. МАР4 конфігурація показана нижче. У цій конфігурації розгалужені структури одержуються шляхом ініціації пептидного синтезу як на N-кінці, так і на амінах лізину бічних ланцюгів. Залежно від того, скільки разів лізин вбудовується в цю послідовність і дозволяє на розгалуження, стільки N-кінців має утворювана в результаті структура. В ілюстрованому тут прикладі утворено чотири ідентичні N-кінці на розгалуженому лізинвмісному центрі. Така множинність значно підсилює реактивність спорідненої В-клітини. Пептид А, його аналог, активний фрагмент або інший поліпептид може вводитися пацієнту в асоційованій чи мультимерній формі, або у дисоційованій формі. Терапевтичними засобами можуть бути також мультимери із мономерних імуногенних засобів. Засоби, відмінні від пептидів А повинні викликати імуногенну відповідь проти одного чи більше із кращих фрагментів пептиду А, перелічених вище (наприклад, 1-10, 1-7, 1-3 і 3-7), і можуть бути також кон'юговані з носієм у відповідності з процесом за даним винаходом. У кращому варіанті здійснення винаходу такі засоби, кон'юговані з відповідним носієм, індукують імуногенну відповідь, що є специфічно спрямованою на один із цих фрагментів, не будучи при цьому спрямованою на інші фрагменти пептиду А. Для полегшення кон'югації пептидного імуногена з носієм до кінців антигенних детермінант можуть приєднуватися додаткові амінокислоти. Такі додаткові зали шки можуть також використовуватися для модифікації фізичних або хімічних властивостей пептидного імуногена. Амінокислоти, наприклад, тирозин, цистеїн, лізин, глутамінова або аспартанова кислота і т.п. можуть приєднуватися до С- або N-кінця пептидного імуногена. Крім того, можуть вводитися також пептиді лінкери, що містять такі амінокислоти, як гліцин та аланін. Антигенні детермінанти можуть відрізнятися від природної послідовністі і бути модифікованими ацилюванням їхніх кінцевих NH2-груп, наприклад, шляхом ацетилювання алканоїлом (С1-С20) або тіогліколілом, амідуванням карбоксильного кінця, наприклад, аміаком, метиламіном, тощо. У деяких випадках ці модифікації можуть давати сайти для зв'язування з основою або іншою молекулою. Пептидні імуногени для створення кон'югатів згідно з даним винаходом за допомогою описаного тут процесу можуть об'єднуватися в комбінації 33 шляхом зв'язування з утворенням полімерів (мультимерів), або в склади без зв'язування, наприклад, шляхом змішування. Там, де пептид з'єднується з ідентичним пептидом у гомополімер, наявними є численні повтори епітопних блоків. Наприклад, за допомогою методу множинних антигенних пептидів (МАР), можна конструювати полімери, що містять як CTL, так і гуморальні пептиди і поліпептиди. Якщо пептиди є різними, наприклад, у суміші із різних вірусних субтипів, то для цього передбачені різні епітопи в межах субтипу, різні унікальні специфічності (контрольовані унікальною специфічністю головного комплексу гістосумісності (HLA)), або пептиди, що містять Тхелпер епітопи, гетерополімери з повторами блоків. Окрім ковалентних зв'язків, передбачаються також нековалентні зв'язки, здатні утворювати міжмолекулярні та внутрішньоструктурні з'єднання. Такого типу пептидні імуногени та їх аналоги виготовляються шляхом твердофазного пептидного синтезу або рекомбінантної експресії, або ж одержуються із природних джерел. Промисловістю і, зокрема, фірмою Biosystems, м. Фостер, шт. Каліфорнія, виробляються підходящі для цього автоматичні синтезатори пептидів. Рекомбінантна експресія може здійснюватися в бактеріальних клітинах (наприклад, E. coli), дріжджах, клітинах комах або клітинах ссавців. Методи рекомбінантної експресії описані, наприклад, у [Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press, NY, 2nd ed., 1989)]. Деякі імуногенні пептиди можуть бути придбані також комерційним шляхом (від таких виробників, наприклад, як American Peptides Company, Inc., Sunnyvale, CA, і California Peptide Research, Inc., Napa, CA). Підходящі пептидні імуногени можуть бути добрані також шляхом скринінгу статистичних бібліотек пептидів або інших сполук. Для багатьох типів сполук, які можуть синтезуватися в поступових процесах, можна створювати комбінаторні бібліотекі. До таких сполук належать поліпептиди, бетавиткові міметики, гормони, олігомерні N-заміщені гліцини, олігокарбамати і т.п. Великі комбінаторні бібліотекі сполук можуть бути сконструйовані методом кодованих синтетичних бібліотек (ESL), описаним у заявках [WO 95/12608, WO 93/06121, WO 94/08051, WO 95/35503 і WO 95/30642], кожна з яких включена тут для всіх цілей шляхом посилання. Пептидні бібліотеки можуть бути виготовлені також методами відображення фагів, як описано, наприклад, у [Devlin, WO 91/18980]. Дериватизація і кон'югація імуногенного пептиду для білкового носія Сайт приєднання пептидного імуногена до білкового або поліпептидного носія і природа зшивального агента, використовуваного для приєднання пептидного імуногена до носія є обидва важливими факторами специфічності генерованих проти нього антитіл. Для правильного розпізнавання пептидний імуноген повинен бути з'єднаний з носієм у відповідній орієнтації. Для наступного за цим розпізнавання антитілом вільних пептидних імуногенів без носія кон'югат пептидного імуногена з білковим або поліпептидним носієм повинен пред 93854 34 ставляти пептидні імуногени у відкритій і доступній формі. Оптимальна орієнтація часто досягається шляхом спрямування реакції зшивання на специфічні сайти пептидних імуногенів. Одним зі шляхів для досягнення цього пептидним імуногеном є приєднання кінцевого цистеїнового залишку під час пептидного синтезу. У результаті створюється сульфгідрильна група на одному кінці пептиду для кон'югації його з носієм. Зшиванням через цю групу забезпечується приєднання пептидного імуногена лише на одному кінці і, отже, його узгоджена орієнтація. Метою кон'югації пептидного імуногена з носієм є не підримання природного стану або стабільності носія, а представлення гаптена у якомога кращий спосіб імунній системі. Для здійснення цього використовують хімію кон'югації, яка дозволяє визначати отримувані в результаті титр, афінність і специфічність антитіл, вироблених проти цього гаптена. У деяких випадках може бути важливим провести правильний добір зшивального агента, що містить достатньо довгу спейсерну групу для представлення даного антигена нерестриктованим чином. Може бути важливим також регулювати густину пептидного імуногена на поверхні носія. Заміщення занадто малим пептидним імуногеном може призвести до слабкої відповіді і навіть до її відсутності. З іншого боку, занадто велика густина пептидного імуногена фактично може викликати імунологічну супресію і зниження відповіді. Крім того, зшивальний агент сам може викликати небажану імунну відповідь. Ці наслідки потрібно брати до уваги при доборі не тільки відповідних зшивальних реагентів, але також відповідного кількісного співвідношення між білковим або поліпептидним носієм і пептидним імуногеном. Для приєднання білкових або пептидних носіїв до пептидних імуногенів можуть використовуватися найрізноманітніші засоби. Іонні взаємодії є можливими через кінці або через -аміногрупи лізину. Можливим є також водневий зв'язок між бічними групами залишків і пептидним імуногеном. І нарешті, підвищити стабільність приєднання можуть конформаційні взаємодії між білковими або пептидними носіями й імуногенним пептидом. Кон'югати "пептидний імуноген - носій" з успіхом створювалися при використанні різноманітних зшивальних агентів, включаючи зшивальні агенти нульової довжини, гомобіфункціональні та гетеробіфункціональні зшивальні агенти. Найменшими серед доступних реагентів для біокон'югації є так звані "крос-лінкери нульової довжини". Ці сполуки опосередковують кон'югацію двох молекул шляхом формування зв'язку, що не містить додаткових атомів. Таким чином, один атом молекули є спейсером. У багатьох схемах кон'югації у кінцевому комплексі складові зв'язуються між собою завдяки хімічним компонентам, які додають чужорідну структуру речовинам, що зшиваються. У деяких випадках практичного застосування наявність цих доданих лінкерів може ставати шкідливим чинником для цільового використання. Наприклад, при одержанні кон'югатів "пептидний імуноген - носій" цей комплекс утворюється з метою генерації імунної відповіді на приєднаний гаптен. Іноді частина 35 антитіла, виробленого цією відповіддю, має специфічність до зшивального агента, використовуваного в кон'югації. Зшивальні агенти нульової довжини виключають можливість виникнення перехресної реактивності цього типу завдяки тому, що вони опосередковують прямий зв'язок між двома речовинами. Гомобіфункціональні реагенти, які були першими зшивальними агентами, що використовувалися для модифікування і кон'югації макромолекул, складалися із біреактивних сполук, що містили однакові функціональні групи на обох кінцях [Hartman і Wold, 1966]. Ці реагент могли зв'язувати один білок з іншим ковалентного реагування з однаковими загальними групами в обох молекулах. Отже, -аміни лізину або N-кінцеві аміни одного білка могли зшиватися з однаковими функціональними групами в обох білках просто шляхом змішування їх двох разом при наявності гомобіфункціонального реагента. Гетеробіфункціональні реагенти кон'югації містять дві різні реактивні групи, які можуть з'єднуватися з двома різними функціональними мішенями в білках та інших макромолекулах. Наприклад, одна частина крос-лінкера може містити амінну реактивну групу, у той час як інша його частина може складатися із сульфгідрильної реактивної групи. У результаті виникає здатність спрямовувати реакцію зшивання на цільові частини молекулмішеней і, таким чином, створюється можливість краще керувати процесом кон'югації. Гетеробіфункціональні реагенти використовуються для зшивання білків та інших молекул у двоабо триступінчастому процесі, який обмежує ступінь полімеризації, яка часто виникає при використанні гомобіфункціональних крос-лінкерів. Сьогодні відомо багато методів зв'язування пептидних імуногенів з білковими або поліпептидними носіями за допомогою гомобіфункціональних або гетеробіфункціональних крос-лінкерів нульової довжини. Більшість з цих методів спрямована на створення амінних, амідних, уретанових, ізотіосечовинних та дисульфідних зв'язків або в деяких випадках - тіоетерів. У найбільш загальному методі св'язування білків або пептидів з пептидами використовуються біфункціональні зшивальні реагенти. Це є малі спейсер-молекули, які мають активні групи на кожному кінці. Ці спейсер-молекули можуть мати на своїх кінцях ідентичні або різні активні групи. Найбільш загальними активними функціональними групами, зв'язувальними групами й утворюваними зв'язками є: 1. Альдегід - аміно вторинний амін 2. Малеімід - сульфгідрил тіоетер 3. Сукцинімід - аміно амід 4. Імідатні естери - аміно амід 5. Фенілазиди - аміно феніламін 6. Галоїдацил - сульфгідрил тіоетер 7. Піридилдисульфіди - сульфгідрил дисульфід 8. Ізотіоціанат - аміно ізотіосечовина. Реактивність даного носійного білка з погляду його здатності до модифікації зшивальним агентом таким чином, щоб він був кон'югований з пептидним імуногеном, визначається його амінокис 93854 36 лотним складом і місцем індивідуальних амінокислот у послідовності у тримірній структурі цих молекул, а також амінокислотним складом пептидного імуногена. У тих випадках, коли лінкери ("L") розташовуються між білковими або пептидними носіями та іншими пептидами (наприклад, між білковими або пептидними носіями і пептидним імуногеном), спейсери, звичайно, вибирають серед Ala, Gly або інших нейтральних спейсерів неполярних амінокислот або нейтральних полярних амінокислот. У деяких варіантах здійснення винаходу нейтральним спейсером є Ala. Цілком зрозуміло, що наявному, в разі потреби, спейсеру не обов'язково складатися із таких самих залишків і, таким чином, ним може бути гетеро- або гомоолігомер. Типовими спейсерами є, наприклад, гомоолігомери аланіну (Ala). У разі наявності спейсера він, зазвичай, складається принаймні з одного чи двох, а частіше - із трьох-шести залишків. В інших варіантах здійснення винаходу білковий або поліпептидний носій є кон'югований з пептидним імуногеном таким чином, що носій займає положення на амінному кінці. Пептид може сполучатися за посередництвом нейтрального лінкера, наприклад, АІа-АІа-АІа і т.п., а в кращому варіанті, крім того, містить ліпідний залишок, наприклад, пальмітинову кислоту i т.п., що приєднується до альфа- й епсилон-аміногруп Lys залишку ((PAM)2Lys), приєднаного до амінного кінця даного пептидного кон'югата, звичайно, SerSer містком i т.п. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із A1-5-L, A17-L, A1-9-L i A1-12-L Відповідно до деяких аспектів даного винаходу містком є GAGA (SEQ ID NO: 10). Для полегшення кон'югації пептидного імуногена з носієм можуть добавлятися додаткові амінокислоти на кінцях антигенних детермінант. Додаткові залишки можуть використовуватися також для модифікації фізичних або хімічних властивостей пептидного імуногенна. Такі амінокислоти, як тирозин, цистеїн, лізин, глутамінова або аспартанова кислота i т.п., можуть приєднуватися до Сабо N-кінця пептидного імуногенна. Крім того, вводитися можуть також пептидні лінкери, що містять таку амінокислоту, як гліцин та аланін. У додаток до вищезазначеного, антигенні детермінанти можуть відрізнятися від природної послідовності модифікаціями шляхом ацилювання кінцевих NH2груп, наприклад, алканоілом (C1-C20) або тіогліколілом, амідування карбоксильних кінців, наприклад, аміаком, метиламіном, i т.д. У деяких випадках ці модифікації можуть надавати сайти для зв'язування з основою або іншою молекулою. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із А1-5-С, А17-С, А1-9-С i А1-12-С, де С є цистеїновий амінокислотний залишок. Відповідно до деяких аспектів даного винаходу пептидним імуногеном є фрагмент пептиду А, вибраний із групи, що складається із A1-5-L-C, Α1-7-L-C, A1-9-L-C і А1-12-LC. 37 Пептидний імуноген приєднується до білкового або пептидного носія або безпосередньо або за посередництвом лінкера на амінному кінці або на карбоксильному кінці пептидного імуногена. Амінний кінець пептидного імуногена або білкового чи пептидного носія може бути ацетильований. Крім того, кон'югат пептидного імуногена з білковим чи пептидним носієм може бути з'єднаний з певними алканоільними (С1-С20) ліпідами за посередництвом одного чи більше зшивальних залишків, наприклад, Gly, Gly-Gly, Ser, Ser-Ser, як описано нижче. Як ліпідна частина використовуватися можуть також холестерин, жирні кислоти i т.п. Пептидний імуноген можe з'єднуватися з носієм шляхом хімічного зшивання. Зшивання імуногена з носієм може здійснюватися методом утворення дисульфідних містків, використовуючи Nсукцинімідил-3-(2-піридил-тіо)пропioнат (SPDP) [Carlsson, J. et al. (1978) Biochem. J., 173: 723] i сукцинімідил 4-(N-малеімідметил)циклогексан-1карбоксилат (SMCC) (якщо пептид не має сульфгідрильної групи, вона може бути створена шляхом додавання цистеїнового залишку до гаптена). Ці реагенти створюють дисульфідний місток між собою і цистеїновими залишками пептиду на одному білку й амідний місток через -аміногрупу лізину або іншу вілльну аміногрупу іншої амінокислоти. Різноманітні реагенти, що дозволяють створювати такі дисульфідні та амідні сполучення, опиані в [Immune. Rev. 62: 85 (1982)]. Інші біфункціональні зв'язувальні агенти утврюють тіоетерні, а не дисульфідні містки. До числа таких агентів належать реактивний естер 6-малеімідкапронової кислоти, 2-бромоцтової кислоти і 2-йодооцтової кислоти, 4(N-малеімідометил)циклогексан-1-карбонової кислоти. Карбоксильні групи можуть активуватися шляхом об'єднання їх із сукцинімідом або 1гідроксил-2-нітро-4-сульфоновою кислотою, сіллю натрію. Найчастіше лізинові залишки є найбільш численними серед амінокислотних залишків, що складають носійні білки. Отже, саме ці залишки модифікуються за допомогою зшивальних реагентів для створення нуклеофільних сайтів, які після цього сполучаються з гаптеном. Це сполучання здійснюється через будь-який із гідрофільних бічних ланцюгів у гаптенових молекулах, що є хімічно активними. До їх числа входять, принаймні, гуанідильна група аргініну, (карбоксильні групи глутамату й аспартанової кислоти, сульфгідрильна група цистеїну і -аміногрупа лізину. Модифікування білків таким чинм, щоб вони могли сполучатися з іншими частинами, здійснюється за допомогою зшивальних реагентів, які реагують з одним із бічних ланцюгів у молекулах білкового носія або гаптена. У відповідності з одним із аспектів даного винаходу носійний білок з молекулою лінкера або без неї функціоналізують (дериватизують) реагентом, який уводить реактивні сайти у молекули носійного білка, що піддаються подальшому модифікуванню з метою введення нуклеофільних груп. В одному з варіантів здійснення винаходу проводять реакцію носія з галоїдацетилувальним реагентом, який реагує переважно з множиною таких функці 93854 38 ональних груп в амінокислотних залишках білків, як сульфгідрильна група цистеїну, первинна амінна група лізинового залишку, -кінець амінів, тіоетер метіоніну та обидва азоти імідазоїльних бічних ланцюгів гістидину [Gurd, 1967]. У кращому варіанті первинні 6-амінні групи лізинових залишків носійного білка є дериватизованими b N-гідроксисукцинімідилбромацетатом для створення бромацетильованого носія. Кон'югацію пептидного імуногена з активованим білковим носієм проводили шляхом повільного додавання активованого носія до розчину, що містив пептидний імуноген. За допомогою процесу згідно з даним винаходом пептидні імуногени, розглянуті вище, в розділі В, можуть сполучатися в кон'югатах з будь-яким із носіїв, розглянутих вище, в розділі А. Кон'югати, вироблені за допомогою процесу згідно з винаходом, можуть використовуватися як імуногени для генерації антитіла проти А для застосування як у пасивній, так і в активній імунотерапії. Крім того, пептид А або його фрагмент, з'єднані з носієм, можуть вводитися лабораторній тварині для вироблення моноклональних антитіл проти пептиду А. У відповідності з одним із аспектів даного винаходу запропонований кон'югат вибирають із групи, що складається із A1-7-CRM197, (Α1-7 x 3)CRM197 і (A1-7 x 5)-CRM197. У відповідності з одним із аспектів даного винаходу запропонований кон'югат вибирають із групи, що складається із CRM197-A/1-5, CRM197- A1-7, CRM197-A1-9 і CRM197. У відповідності з іншим аспектом даного винаходу запропонований кон'югат вибирають із групи, що складається із A1-5-C-CRM197, A1-7-CCRM197, A1-9-C-CRM197 і A1-12-C-CRM197, A1623-C-CRM197, A17-24-C-CRM197, A18-25-CCRM197, CRM197-C-A16-23, CRM197-C-A17-24, CRM197-C-A18-25, A16-22-C-CRM197, A17-23-CGRM197, A18-24-C-CRM197, CRM197-C-A16-22, CRM197-C-A17-23 і CRM197-C-A18-24. У відповідності з ще одним аспектом даного винаходу запропонований кон'югат вибирають із групи, що складається із A1-5-L-C-CRM197, A1-7-L-CCRM197, A1-9-L-C-CRM197 і А1-12-L-C-CRM197. Кепінг Недоліком застосування реагентів сполучання, що вводять хімічно активні сайти у бічні ланцюги хімічно активних молекул амінокислот носія і/або молекул гаптена, є те, що хімічно активні сайти, якщо вони не нейтралізовані, можуть вільно реагувати з будь-якими небажаними молекулами як in vitro, так і in vivo. Згідно з процесом за даним винаходом, кепінг непрореагованих функціональних груп здійснюють шляхом реакції кон'югатів, що містять вільні реактивні групи, з реагентами, які дезактивують або "кепують" хімічно активні групи. До числа типових реагентів дезактивації або кепінгу для застосування в кон'югації згідно з даним винаходом є цистеїнамін, N-ацетилцистеїнамін, та етаноламін. Іншим чином кепінг проводять за допомогою реакції з аміаком або бікарбонатом амонію, які є здатними перетворювати галоїдацетильні групи на аміноацетильні групи. Кепінг здійснюють також при лужній рН (9,0-9,8) за допо 39 могою гідроксиду натрію або карбонату натрію, котрі перетворюють галоїдацетильні групи на гідроксиацетильні групи. Однією із потенційних переваг перетворення галоїдацетильних груп на аміноацетильні або гідроксиацетильні групи, на противагу реакції з цистеїнаміновими сполуками, етаноламіном і т.п., є можливість уводити функціональні групи відносно малих розмірів шляхом реакції з аміаком або гідроксидом чи карбонатом. Отримувані в результаті таких перетворень кеповані функціональні групи, наприклад аміноацетил або гідроксиацетил, привносять відносно мало збурень у білкову частину носія кон'югата. Кепований "пептидний імуноген - носійний білок" очищають у відповідності з потребою відомими методами, включаючи хроматографію (гель-фільтраційну, іонообмінну, на основі гідрофобної взаємодії або афінності), діаліз, надфільтрацію-діафільтрацію, селективну преципітацію сульфатом амоню або спиртом, і т.п. Імуногенні кон'югати і композиції Кеповані кон'югати "пептидний імуноген - носійний білок" вводять в імуногенній композиції ссавцям і, зокрема, людям у профілактичних і/або терапевтичних цілях. Кон'югати за даним винаходом використовуються для викликання і/або підсилення імунних відповідей проти імуногенів. Наприклад, кон'югати CTL-носій використовуються у лкуванні і/або профілактиці вірусноінфекційних захворювань, амілоїдогенних захворювань, раку і т.д. Як альтернатива використовуються також кон'югати типу "поліпептидний імуноген - носій", які викликають гуморальні імунні відповіді. Лікувати за допомогою кон'югатів за даним винаходом можна різноманітні бактеріально-інфекційні стани, вірусні інфекційні стани, грибкові інфекційні стани, стани, викликані паразитичною інфекцією, і рак. При терапевтичному застосуванні кон'югат за даним винаходом уводять пацієнту, що вже страждає на амілоїдогенну хворобу, наприклад, на хворобу Альцгеймера, рак, або є інфікований патогенним мікроорганізмом. Пацієнтів стан яких є у фазі інкубації або в гострій фазі захворювання, можна, в разі потреби, лікувати за допомогою запропонованих кон'югатів як відокремлено, так і водночас з іншими курсами лікування. При терапевтичному застосуванні композицію за даним винаходом уводять пацієнту в кількості, достатній для ефективної CTL (ЦТЛ) відповіді або гуморальної відповіді на мікроорганізм, амілоїдну бляшку або на пухлинний антиген, експресований на раковій клітині, і для лікування або, щонайменше, часткового припинення розвитку хвороби, симптомів і/або ускладнень. Кількість композиції, потрібна для здійснення цього, зветься "терапевтично ефективною дозою". Ефективні кількості частково залежать від композиції пептиду, способу введення, стадії розвитку і тяжкості даного захворювання, маси тіла і загального стану здоров'я пацієнта, а також від власної думки лікаря, що призначає лікування. Терапевтично ефективні кількості імуногенних композицій за даним винаходом у загальному випадку лежать в інтервалі, що відповідає початковій імунізації для терапевтичного або профілактично 93854 40 го призначення, тобто приблизно від 0,1 мкг до 10000 мкг пептиду для пацієнта з масою тіла 70 кг, зазвичай приблизно від 0,1 до 8000 мкг, краще приблизно від 0,1 до 5000 мкг, і найкраще - приблизно від 0,1 до 1000 мкг. Слідом за цими дозами призначаються бустер-дози приблизно від 0,1 мкг до 1000 мкг пептиду відповідно до режиму ревакцінації протягом курсу лікування від декількох тижнів до декількох місяців, залежно від реакції пацієнта та його стану за даними вимірювань специфічних імунних відповідей. У профілактичних цілях даний винахід використовується для відвертання і/або поліпшення хворого стану від бактеріальної інфекції, вірусної інфекції, грибкової інфекції, паразитичної інфекції, амілоїдогенного стану або раку. Ефективні кількості при цьому є такими, як зазначено вище. Крім того, для фахівця в даній галузі не буде складним вирішити питання регулювання або пристосування профілактичного лікування до конкретних умов, наприклад, шляхом ревакцінації і регулювання доз та режимів їх прийому. Терапевтичний курс лікування можна починати при перших ознаках хвороби або при виявленні чи хірургічному видаленні пухлин, або ж невдовзі після поставлення діагнозу у випадку гострого інфекційного захворювання. Слідом за цим застосовують бустер-дози до тих пір, поки розвинення хвороби не буде зупинено або повернено назад, або поки симптоми не будуть ґрунтовно послаблені, і протягом певного періоду часу після цього. При хронічних інфекційних захворюваннях призначають початкові високі дози, після чого можуть потребуватися бустер-дози. Інфікування інфікованих пацієнтів композиціями за даним винаходом може прискорити пригнічення інфекційного процесу у пацієнтів з гострим запаленням. Для пацієнтів, сприйнятливих (або схильних) до розвинення хронічних інфекційних захворювань, дані склади є особливо корисними в курсах запобігання розвитку хронічної інфекції від гострого до хронічного стану. У тих випадках, коли сприйнятливість пацієнта встановлюється до інфікування або під час нього, наприклад, як показано в даному описі, склад згідно з винаходом може бути пристосований спеціально для них і мінімально вживатися більш широким колом хворих. Кон'югати за даним винаходом призначаються також для лікування хронічних інфекційних хвороб і для стимулювання імунної системи на ліквідацію вірус-інфікованих клітин у пацієнтів з латентною інфекцією. При цьому важливо забезпечити кількість імуногенного композиції за даним винаходом у препараті і режим введення, достатні для ефективного вироблення і/або підсилення імунної відповіді. Отже, для лікування хронічної інфекційної хвороби, типові дози лежать в інтервалі приблизно від 0,1 мкг до 10000 мкг пептиду, зазвичай приблизно від 0,1 до 8000 мкг, краще - приблизно від 0,1 до 5000 мкг, і найкраще - приблизно від 0,1 до 1,000 мкг на дозу для пацієнта з масою тіла 70 кг. Слідом за імунізаційними дозами вводять бустердози в заданих інтервалах часу, наприклад, від одного до чотирьох тижнів, у відповідності з потребою, можливо протягом тривалого періоду для 41 ефективної імунізації пацієнта. У випадку хронічної інфекції введення складу повинно тривати доти, поки щонайменше клінічні симптоми або лабораторні тести не покажуть, що вірусна інфекція ліквідована або ґрунтовно пригнічена, і протягом певного періоду часу після цього. Імуногенні композиції за даним винаходом у терапевтичних або профілактичних цілях можуть уводитися пацієнту за допомогою засобів парентерального, місцевого, внутрішньовенного, перорального, підшкірного, внутрішньоартеріального, інтракраніального, інтраперитонеального, інтраназального або внутрішньом'язового введення для профілактичного і/або терапевтичного лікування. Одним із типових шляхів уведення імуногенного агента є підшкірний, хоча так само ефективними можуть бути також інші способи. Іншим поширеним способом уведення є внутрішньом'язові ін'єкції. Ін'єкції цього типу найчастише роблять у м'язи рук або ніг. У деяких способах, наприклад, інтракраніальні ін'єкції лікувальних засобів роблять безпосередньо в тканину, де акумулювалося відкладення. Внутрішньом'язові ін'єкції або внутрішньовенні вливання є кращими для введення антитіл. У деяких способах терапевтичні антитіла спеціального призначення вводять шляхом ін'єкцій безпосередньо в череп. Відмінна легкість введення імуногенних композицій за даним винаходом робить їх особливо підходящими для перорального способу введення. Винаходом передбачені також імуногенні композиції для парентерального введення, які містять розчини пептидів або кон'югатів, розчинених або суспендованих у підходящому носії, яким у кращому варіанті є вода. У композиціях за даним винаходом можуть використовуватися найрізноманітніші розчинники, ексципієнти i буфери, включаючи, наприклад, воду, буферизовану воду, буферизований фосфатом фізіологічний розчин 0,3% гліцин, палуронову кислоту i т.п. Стерилізація запропонованих композицій може здійснюватися за допомогою звичайних добре відомих методів i засобів або стерилізаційних фільтрів. Отримувані в результаті такої обробки водні розчини можуть пакуватися для застосування в їх незмінному стані або піддаватися ліофілізації, а ліофілізовані препарати перед їх уведенням об'єднуватися зі стерильним розчином. Композиції можуть містити фармацевтично прийнятні допоміжні речовини у відповідності з потребою наблизитися до фізіологічних умов. Такими речовинами можуть бути буферні агенти, агенти регулювання тонусу, змочувальні агенти i т.п., наприклад, ацетат натрію, лактат натрію хлорид натрію, хлорид калію, хлорид кальцію, монолаурат сорбіту, триетаноламінолеат i т.д. У твердих композиціях можуть використовуватися звичайні нетоксичні тверді носії, а саме, наприклад, фармацевтичні сорти маніту, лактози, крохмалю, стеарату магнію, натрійсахарин, тальк, целюлоза, глюкоза, сахароза, карбонат магнію i т.п. Для перорального введення фармацевтично прийнятну нетоксичну композицію готують шляхом об'єднання будь-яких звичайно використовуваних ексципієнтів, наприклад, вищеперелічених носіїв, i 93854 42 в загальному випадку 10-95% активного інгредієнта, тобто одного чи більше кон'югатів за даним винаходом, концентрація яких у кращому варіанті становить 25-75% Концентрація імуногенних композицій за даним винаходом фармацевтичних препаратах може варіювати в широких межах, тобто від менш, ніж приблизно 0,1%(мас.), зазвичай при або, щонайменше, приблизно 2%(мас.) до 20%(мас.)50%(мас.) або більше i вибирається у першу чергу залежно від об'єму рідини, в'язкості i тд у відповідності з вибраним способом введення. Кон'югати за даним винаходом можуть уводитися також за посередництвом ліпосом, які постачають кон'югати в цільові тканини, наприклад, лімфоідну тканину або селективно в інфіковані клітини, а також збільшують період напіввиведення пептидного складу. Ліпосоми можуть мати форму емульсій, пінки, міцел, нерозчинних моношарів, рідких кристалів, фосфоліпідних дисперсій, ламелярних шарів і т.п. У цих препаратах призначена для постачання композиція вбудована у формі частини ліпосомм відокремлено або у сполученні з молекулою, що зв'язується, наприклад, з рецептором, який превалює в лімфоїдних клітинах. Такими молекулами можуть бути моноклональні антитіла, що зв'язуються з антигеном CD45 або з іншими терапевтичними чи імуногенними складами. Отже, ліпосоми наповнені бажаною композицією згідно з даним винаходом можуть бути спрямовані в місце розташування лімфоїдних клітин, куди ліпосоми після цього постачають розміщені в них терапевтичні та імуногенні пептидні композиції. Ліпосоми для застосування в даному винаході готують зі стандартних ліпідів, що утворюють везикули, тобто в загальному випадку - із нейтральних і негативно заряджених фосфоліпідів і стерину, наприклад, холестерину. При виборі ліпіду в загальному випадку керуються міркуваннями розміру ліпосом, кислотостійкості і стабільності ліпосом у кровотоку. Для готування ліпосом існують численні методи, описані, наприклад, у [Szoka, et al., Ann. Rev. Biophys. Bioeng. 9:467 (1980), U.S. Pat №№. 4,235,871, 4,501,728, 4,837,028, 5,019,369], включених тут шляхом посилання. Для націляння на імунні клітини лігандом, що вбудовується в ліпосому, може бути антитіло або його фрагменти, специфічні для поверхневих детермінант бажаних клітин імунної системи. Ліпосомна суспензія, що містить склад за даним винаходом, може вводитися внутрішньовенним, локальним, місцевим та іншими способами з дозою, яка залежить, поряд з іншим, від способу введення, композиції, що постачається, і стадії хвороби, що підлягає лікуванню. Для аерозольного введення композиції за даним винаходом постачаються переважним чином у тонко розподіленій формі разом з поверхневоактивною речовиною і пропелентом. Типовий вміст композиції в аерозольній суміші лежить в інтервалі 0,01-20%(мас.), а в кращому варіанті 1-10%. Зрозуміло, що поверхнево-активна речовина повинна бути нетоксичною і, бажано, розчинною в пропеленті. Типовими матеріалами для таких агентів є 43 естери або часткові естери жирних кислот, що містять від 6 до 22 атомів вуглецю, тобто таких, як капронова, октанова, лауринова, пальмітинова, стеаринова, лінолева, ліноленова, олестеринова та олеїнова кислоти з аліфатичним полігідридним спиртом або його циклічним ангідридом. Можуть використовуватися змішані естери, наприклад, змішані або природні гліцериди. Поверхневоактивна речовина може становити 0,1-20%(мас.), а в кращому варіанті 0,25-5% складу. Рештою композиції зазвичай є пропелент. У разі потреби до композиції може входити також носій, наприклад, лецитин для інтраназального постачання. Композиції за даним винаходом можуть використовуватися також для вироблення моноклональних антитіл. Такі антитіла можуть використовуватися як потенційні діагностичні або терапевтичні засоби. Композиції за даним винаходом можуть знаходити застосування також як діагностичні реагенти. Наприклад, композиції за даним винаходом можуть використовуватися для визначення сприйнятливості того чи іншого пацієнта режиму лікування, в якому застосовуються поліпептидні імуногени, і таким чином можуть допомагати в модифікації існуючої програми лікування або у прогнозуванні результатів лікування для даного пацієнта. Крім того, композиції за даним винаходом можуть застосовуватися у прогнозуванні того, які пацієнти наражаються на суттєвий ризик розвинення в них інфекційної хвороби. Кон'югати за даним винаходом, в разі потреби, можуть уводитися в комбінації з іншими засобами, які є принаймні частково ефективними в лікуванні і/або поліпшенні хворого стану і/або його симптомів. У випадках хвороби Альцгеймера і синдрому Дауна, що супроводжуються амілоїдними відкладеннями в мозку, кон'югати за даним винаходом можуть уводитися пацієнту в сполученні з іншими засобами, що збільшують проходження засобів за даним винаходом через гематоенцефалічний бар'єр. Імуногенна композиція згідно з винаходом, звичайно, містить ад'ювант. Ад'ювантом є речовина, що підсилює імунну відповідь при введенні її разом з імуногеном або антигеном. Було показано, що чимало цитокінів або лімфокінів мають імуномодуляційну активність і, таким чином, можуть використовуватися як ад'юванти; до них належать, наприклад, інтерлейкіни 1-, 1-, 2, 4, 5, 6, 7, 8, 10, 12 див., наприклад, [U.S. Patent No. 5,723,127], 13, 14, 15, 16, 17 і 18 (та їхні мутантні форми), інтерферони , і , колонієстимулювальний фактор гранулоцитів і макрофагів, див, наприклад, [U.S. Patent No. 5,078,996], колонієстимулювальний фактор макрофагів, колонієстимулювальний фактор гранулоцитів (GSF), а також фактор і некрозу пухлин. Серед інших ад'ювантів, що можуть використовуватися в даному винаходу, слід згадати хемокіни, включаючи без обмеження, МСР-1, ΜΙΡ1, ΜΙΡ-1 і RANTES. У ролі ад'ювантів можуть використовуватися також молекули адгезії, наприклад, селектин, а саме L-селектин, Р-селектин і Еселектин. Серед інших корисних ад'ювантів можна назвати, без обмеження, муциноподібні молекули, 93854 44 наприклад, CD34, GlyCAM-1 і Μ ad САМ-1, членів сімейства інтегринів, наприклад, LFA-1, VLA-1, Мас-1 і р150.95, членів надсімейства імуноглобулінів, наприклад, РЕСАМ, ІСАМ, зокрема, ІСАМ-1, ІСАМ-2 та ІСАМ-3, CD2 і LFA-3, співстимуляторні молекули, наприклад, CD40 і CD40L, фактори росту, включаючи судинний фактор росту, фактор росту нервів, фактор росту фібробластів, епідермальний фактор росту, В7.2, PDGF, BL-1 та судинний ендотеліальний фактор росту, рецепторні молекули, включаючи Fas, TNF рецептор, Fit, Apo1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2 і DR6. Крім того, молекулою ад'юванту може служити також Каспаза Caspase (ICE). Див. також [International Patent Publication №№ WO98/17799, WO99/43839], включені тут в усій їхній повноті і для всіх цілей шляхом посилання. Ад'ювантами, підходящими для підсилення імунної відповіді, є, наприклад, MPL (3-Одеацетильований монофосфорильний ліпід A; Corixa, Hamilton, MT), описаний у [U.S. Patent № 4,912,094], включений тут для всіх цілей шляхом посилання. Підходящими для застосування як ад'юванти є також синтетичні аналоги ліпіду А або аміноалкілглюкозамінофосфатні сполуки (AGP), їх похідні та аналоги, що виробляються фірмою Corixa (Hamilton, MT) і описані в [U.S. Patent № 6,113,918], включеному тут шляхом посилання. Однією з таких AGP сполук є 2-[(R)-3тетрадеканоїлокситетрадканоїламіно]етил-2деокси-4-O-фосфон-3-O-[(S)-3тетрадеканоїлокситетрадканоїл]-2[(глікопіранозид, відомий також під позначенням 529 (а також під маркою RC529; Соrіха). Цей 529 ад'ювант виробляють у формі водного розчину (529 AF) або стабільної емульсії (529 SE). До числа підходящих ад'ювантів входять також мінеральні масла і водні емульсії, солі кальцію, наприклад, фосфат кальцію, солі алюмінію, наприклад, гідроксид алюмінію, фосфат алюмінію і т.д., Амфіген, Авридин, L121/сквален, D-лактидполілактид/глікозид, плюронові кислоти, поліоли, дипептид мурамілу, умертвлена Bordetella, сапоніни, наприклад, Stimulon QS-21 (Antigenics, Framingham, MA), описані в [U.S. Patent № 5,057,540], включеному тут шляхом посилання, і створені з них частки, наприклад, ISCOMS (імуностимуляційні комплекси), Mycobacterium tuberculosis, бактеріальні ліпополісахариди, синтетичні полінуклеотиди, наприклад, олігонуклеотиди, що містять мотив CpG [U.S. Patent № 6,207,646], включений тут шляхом посилання, токсин коклюшу (РТ), або термолабільний токсин Е. coli (LT), зокрема LT-K63, LT-R72, РТ-K9/G129; див., наприклад, [International Patent Publication №№ WO 93/13302 і WO 92/19265], включені тут для всіх цілей шляхом посилання. Корисними для даного винаходу ад'ювантами є також токсини холери та їх мутанти, включаючи описані в публікації міжнародної заявки [International Patent Application № WO 00/18434] (де глутамінова кислота в положенні 29 амінокислотної послідовності заміщена на іншу амінокислоту (відмінну від аспартанової кислоти, у кращо 45 му варіанті на гістидин). Подібні СТ токсини та їх мутанти описані в публікації міжнародної заявки [International Patent Application № WO 02/098368] (де ізолейцин у положенні 16 амінокислотної послідовності заміщений на іншу амінокислоту відокремлено або в комбінації із заміщенням серину в положенні 68 на іншу амінокислоту; і/або де валін заміщений на іншу амінокислоту в положенні 72 амінокислотної послідовності). Інші варіанти СТ токсинів описані в публікації міжнародної заявки [International Patent Application number WO 02/098369 (де аргінін заміщений на іншу амінокислоту у положенні 25 амінокислотної послідовності; і/або амінокислота вставлена в положення 49 амінокислотної послідовності; і/або де дві амінокислоти вставлені в положення 35 і 36 амінокислотної послідовності). Цілком зрозумілло, що зроблені в даному описі посилання на ту чи іншу теорію для пояснення поданих результатів не мають метою обмежити об'єм даного винаходу. Незалежно від способу застосування даного винаходу описані тут результати і переваги можуть бути досягнуті при втіленні даного винаходу, в тому числі, відповідно до розглянутих нижче прикладів його здійснення. Для фахівця в даній галузі цілком зрозуміло, що поданий опис не виключає змін і модифікацій, які можуть бути внесені в нього, не виходячи за межі ідеї та об'єму, визначені доданою тут Формулою винаходу. Усі цитовані тут публікації, патенти і патентні заявки включені в даний опис в усій їхній повноті і для всіх цілей шляхом посилання в тій самій мірі, як і тоді, коли б ці публікації, патенти і патентні заявки були окремо та індивідуально позначені як такі, що включені в даний опис шляхом посилання. Приклад 1 Кон'югація CRM197 з пептидом А Кон'югацію гаптенів та антигенних пептидів здійснювали за допомогою реакції активованого носія CRM197, який має тридцять дев'ять лізинових залишків, з гаптеном або антигенним пептидом, що мають вільну бічну тіолову групу, дотримуючись при цьому процесу, описаного нижче (Фіг. 1). Усі А пептиди містили цистеїновий залишок на карбоксильному кінці для полегшення їх кон'югування через цистеїніл-сульфгідрильну групу з носійним білком. Ці пептиди були одержані шляхом твердофазного синтезу. І. Активація Вільні аміногрупи носія CRM197 піддавали бромацетилюванню шляхом їх реакції з узятою з надлишком ЛМідроксисукцинімідним естером бромоцтової кислоти (Sigma Chemical Co., St. Louis, MO) [Bematowicz і Matsueda, 1986]. До охолодженого на льоду розчину CRM197 (приблизно 15 мг), 10%(об.) додали 1,0 моль NaHCO3 (pH 8,4). NГідроксисукцинімідний естер бромоцтової кислоти, взятий у такій самій масовій кількості, що і використовуваний носій CRM197, розчинили у 200 мкл диметилформаміду (DMF), повільно додали до 93854 46 CRM197 і повільно перемішали при кімнатній температурі в темноті протягом 1 години. Утворений бромацетильований (активований) білок промили перепусканням через знесолювальну колонку (P6DG), використовуючи як елюент фізіологічний розчин з фосфатним буфером (PBS) і 1 ммоль етилендіамінтетраоцтової кислоти (EDTA) (рН 7,0). Після очистки були зібрані фракції, що відповідали активованому CRM197, і була оцінена концентрація білка шляхом ВСА аналізу на білок. Аміногрупи білка як перед обробкою N-гідроксисукцинімідним естером бромоцтової кислоти, так і після неї були прореаговані з 2,4,6тринітробензолсульфокислотою (TNBSA), яка служила індикатором бромацетилювання [Means et al., 1972]. II. Кон'югування Перед кон'югуванням пептиди піддавалися реакції з 5,5'-дитіо-біс(2-нітробензойною кислотою) (реагентом Ельмана (Ellman's)) для перевірки вмісту вільної SH групи (знижений на 62-88%). В експерименті з першими чотирма А-пептидами (амінокислоти 1-7 без лінкера, амінокислоти 1-12 з GAGAC-лінкером, амінокислоти 1-9 з GAGACлінкером і амінокислоти 1-7 з GAGAC-лінкером) приблизно 8,0-10,0 мг пептиду розчинили у стерильній дистильованій воді до концентрації приблизно 20 мг/мл. До охолодженого активованого CRM197 повільно додали пептид у масовому співвідношенні 1:1, і рН суміші встановили приблизно на 7,0-7,2 додаванням 20-36 мкл 1 н. розчину NaOH. Утворену суміш повільно перемішували протягом ночі при температурі 4°С в темноті, після цього провели її діаліз в темноті при двох 1 л замінах PBS, рН 7,2. В експерименті з наступними чотирма А-пептидами (амінокислоти 1-5 без лінкера, амінокислоти 1-9 без лінкера, амінокислоти 112 без лінкера й амінокислоти 1-5 з лінкером) для перевірки вільних SH-груп застосовувалися реакції з реагентом Ельмана (Ellman). CRM197 був підданий бромацетилюванню, очищанню і реакції з TNBSA, як описано вище. Величину рН кожного пептиду відрегульовували на рівень 7,0 додаванням 0,1 моль NaPO4 (рН 8,5) при 2,2 об'єми розчиненого пептиду. Пептид повільно додавали до охолодженого активованого CRM197 у співвідношенні 1:1, і суміш залишали реагувати протягом ночі при температурі 4°С в темноті. Утворений у результаті матеріал піддавали діалізу. Остаточний контрольний пептид (1-12-мер у зворотній орієнтації) кон'югували з CRM197, як зазначено вище, а після цього модифікували. Замість регулювання рН пептиду на рівень 7,0, рН активованого носія CRM197 устанавлювали приблизно на 7,5 додаванням 20%(об.) 0,5 моль NaPO4 (рН 8,0). Після діалізу кожний із кон'югатів переносили до стерильної 15 мл поліпропіленової пробірки, обгортали алюмінієвою фольгою і зберігали при температурі 4°С. Після цього послідовно, за допомогою масспектрометрії, перевіряли активацію хімічно активних амінних залишків носія. 47 Кон'югат A1-5-C-CRM197 А1-7-C-CRM197 Імуногенний пептид DAEFR-C (SEQ. ID. NO: 1) DAEFRHD-C (SEQ. ID NO: 2) DAEFRHDSG-C (SEQ ID NO: A1-9-C-CRM197 3) DAEFRHDSGYEV-C (SEQ ID A1-12-C-CRM197 NO: 4) DAEFR-GAGA-C (SEQ ID NO: A1-5-L-C-CRM197 5) DAEFRHD-GAGA-C (SEQ ID A1-7-L-C-CRM197 NO: 6) DAEFRHDSG-GAGA-C (SEQ A1-9-L-C-CRM197 ID NO: 7) DAEFRHDSGYEV-GAGA-C A1-12-L-C-CRM197 (SEQ ID NO: 8) A12-1-C-CRM197 VEYGSDHRFEAD-C (SEQ ID NO: 9) (-VE CONTROL) L=лінкер (GAGA) (SEQ ID NO: 10) Приклад 2 Одержання кон'югата "пептид Αβ-CR197" і очистка його надфільтрацією Бромацетилювання носія CRM197 Носій CRM197 (100 мг) у 0,01 Μ фосфатнатрієвому буфері, 0,9% NaCI, pH 7,0, піддали реакції з N-гідроксисукцинімідним естером бромоцтової кислоти (розчиненим до 20 мг/мл у DMSO) у масовому співвідношення 1:1 в атмосфері аргону. Реакційну суміш в разі потреби титрували для підтримання величини рН 7,0. Суміш перемішували в темноті протягом 1,5 години при кімнатній температурі. Реакційну суміш перепустили через 1,2 мкм фільтр у резервуар для зберігання системи UF/DF (Millipore Labscale TFF, Billerica, ΜΑ). Очистку проводили, використовуючи 10К або 30K UF мембрану, шляхом діафільтрації (30-кратно) проти 0,01 Μ фосфатнатрієвого буферу/0,9% NaCI, pH 7,0. Бромацетильований CRM197 фільтрували перепусканням через 0,2 мкм фільтр. Був визначений ступінь бромацетилювання шляхом реакції активованого CRM197 з цистеїном і наступного амінокислотного аналізу та кількісної оцінки одержаного в результаті карбоксиметилцистеїну (CMC). Кон'югування пептиду А з бромацетильованим CRM197 і кепінг N-ацетилцистеїнаміном Бромацетильований CRM197 (50 мг) перенесли до реакційної посудини. До перемішуваного розчину, який підтримували при температурі 2-8°С, додали 1 Μ карбонат/бікарбонат натрію. Суміш титрували до досягнення цільової рН 9,0 в атмосфері аргону. Окремо наважили 50 мг пептиду А i розчинили у воді для ін'єкцій (WFI) до 20 мг/мл. До цього розчину додали 1 Μ карбонат/бікарбонат натрію до досягнення рН 9,0. Цей пептидний розчин додали до бромацетильованого розчину CRM197, і суміш перемішували при температурі 28°С протягом 14-18 годин. Решту бромацетильних груп кепували взятим з 20-кратним молярним надлишком N-ацетилцистеїнаміном протягом 3-6 годин при 2-8°С. Реакційну суміш перепустили через 1,2 мкм фільтр у резервуар для зберігання системи UF/DF 93854 48 (Millipore XL), і кон'югат промили при кімнатній температурі шляхом 30-кратної діафільтрації на 10K або 30K MWCO мембрані (Millipore) шляхом діафільтрування проти 0,01 Μ фосфатнатрієвого буферу/0,9% NaCI, pH 7,0. Утримуваний продукт зібрали, перепустили чере 0,2 мкм фільтр та аналізували на вміст білка (колориметричний аналіз методом Лоурі (Lowry) або Micro-ВСА), піддали SDS-PAGE аналізу, амінокислотному аналізу та аналізу на імуногенність у мишей. Приклад 3 Перетворення шляхом кепінгу непрореагованих бромацетильованих груп на аміноацетильні групи Бромацетильований CRM197 (50 мг), приготований так, як описано вище, у Прикладі 2, перенесли до реакційної посудини. До перемішуваного розчину, який підтримували при температурі 28°С, додали 1 Μ карбонат/бікарбонат натрію. Суміш титрували до досягнення цільової рН 9,0 в атмосфері аргону. Окремо наважили 50 мг пептиду А і розчинили у воді для ін'єкцій до 20 мг/мл. До цього розчину додали 1 Μ карбонат/бікарбонат натрію до досягнення рН 9,0. Цей пептидний розчин додали до розчину бромацетильованого CRM197, і суміш перемішували при 2-8°С протягом 14-18 годин. Решту бромацетильних груп кепували, використовуючи 8% розчин бікарбонату амонію, протягом 4 годин при температурі 2-8°С. Реакційну суміш перепустили через 1,2 мкм фільтр у резервуар для зберігання системи UF/DF (Millipore XL), і кон'югат очистили при кімнатній температурі шляхом 30-кратної діафільтрації на 10K і 30K MWCO мембрані шляхом діафільтрації з 0,01 Μ фосфатнатрієвим буфером і 0,9% NaCI, рН 7,0. Фільтрат зібрали, перепустили через 0,2 мкм фільтр і піддавали аналізу на вміст білка (колориметричний аналіз методом Лоурі (Lowry) або Micro-BCA), SDS-PAGE аналізу, амінокислотному аналізу та аналізу на імуногенність у мишей. Приклад 4 Кількісний аналіз S-карбоксиметилцистеїну і Sкарбоксиметилцистеїнаміну для оцінки ступеню кон'югації і кепінгу кон'югатів "пептидний імуногенбілок/поліпептид" Шляхом кислотного гідролізу білок-пептидних кон'югатів, створених за допомогою хімічного процесу активації бромацетилу, були одержані кислотостійкий S-карбоксиметилцистеїн (CMC) із цистеїнів у кон'югованих сайтах і кислотостійкий Sкарбоксиметилцистеїнамін (СМСА) із цистеїнаміну в кепованих сайтах (Фіг. 2). Усі кон'юговані і кеповані лізини були піддані зворотному перетворенню на лізин і проаналізовані в цьому стані. Усі інші амінокислоти були піддані зворотному гідролізу на вільні амінокислоти, за винятком триптофану і цистеїну, які були зруйновані умовами гідролізу. Аспарагін і глутамін були перетворені, відповідно, на аспартанову кислоту і глутамінову кислоту. Зразки кон'югатів розбавили деіонізованою водою до загальної концентрації білка менше 1 мг/мл. Дві 10 мкг аліквоти кожного кон'югата просушили і повторно суспендували в 100 мкл 6 н. розчину НСІ [Pierce], 5 мкл розплавленого фенолу [Sigma-Aldrich] і 1 мкл 2-меркаптоетанолу [Sigma 49 93854 Aldrich]. Після цього зразки витримували в термостаті під вакуумом (100 мТ) при 110°С протягом 22 годин. Отримані в результаті гідролізати просушили, повторно суспендували у 250 мкл Na-S цитратнатрієвого буферу Бекмана (Beckman) для розбавляння зразків (рН 2,2) [Beckman Instruments, Inc., Fullerton, CA] і профільтрували через 0,2 мкм нейлонові фільтри Ватмана (Whatman) кінцівок шприців і 1 мл шприци. Після цього кожний зі зразків завантажували в петлю зразка амінокислотного аналізатора Бекмана Beckman 6300 і поміщали в аналізатор. Аміно 50 кислоти кожного гідролізованого зразка і контрольного зразка розділяли за допомогою іонообмінної хроматографії і наступної реакції з розчином нінгідрину NinRX Бекмана (Beckman) при температурі 135°С. Далі дериватизовані амінокислоти виявляли у видимому діапазоні спектра на хвилях 570 нм і 440 нм (Табл. 1). У кожній групі аналізу разом зі зразками і контролями через аналізатор перепускали стандартний комплект амінокислот [Pierce Amino Acid Standard H], що містив 500 пікомоль кожної амінокислоти. До стандарту додавали S-карбоксиметилцистеїн (Sigma-Aldrich). Таблиця 1 Час витримування амінокислот за Градієнтною програмою 1 в амінокислотному аналізаторі Бекмана Beckman 6300 Час витримування, хв. 8,3 9,6 11,3 12,2 15,8 18,5 21,8 23,3 29,0 32,8 35,5 36,8 40,5 42,3 45,4 48,8 53,6 70,8 Амінокислоти Карбоксиметилцистеїн Аспартанова кислота й аспарагін Треонін Серин Глутамінова кислота і глутамін Пролін Гліцин Аланін Валін Метіонін Ізолейцин Лейцин Тирозин Фенілаланін Карбоксиметилцистеїнамін Гістидин Лізин Аргінін Площа кожного стандартного піка приймалася за кількісний еквівалент для пропорційної оцінки кожного зразка. Пролін був визначений із 440 нм і перетворений на еквівалент у 570 нм, використовуючи глутамінову кислоту, тобто найближчу амінокислоту. Кожне з цих значень в пікомолях було перетворене на молярне співвідношення амінокислотних залишків шляхом порівняння значень у пікомолях лізину на теоретичне значення лізину, наявне в даному білку. Лізин був вибраний для цієї оцінки з погляду його ковалентного зв'язування з цистеїном і цистеїнаміном, а також очікуваного подібного гідролізу. Отримані кількості молей амінокислот були приведені у порівняння з амінокислотним складом білка і подані разом з величинами для CMC і СМСА. Величина для CMC використовувалася безпосередньо для оцінки ступеню кон'югації, а величина для СМСА використовувалася безпосередньо для оцінки ступеню кепінгу. Приклад 5 Характеризація й оптимізація пептидних кон'югатів А-CRM197 Для контролю кон'югації всі кон'югати пептидСRМ197 піддавалися амінокислотному аналізу і мас-спектрометричному аналізу методом MALDI CMC Asx Thr Ser Glx Pro Gly Ala Val Met He Leu Туr Phe CMCA His Lys Arg Довжина хвилі при детектуванні 570 570 570 570 570 і 440 440 570 570 570 570 570 570 570 570 570 570 570 570 TOF (matrix-assisted laser desorption ionization-time of flight) матричної мас-спектрометрії з лазерною десорбцією і часо-пролітною іонізацією. Для кожного кон'югата кількість молей пептиду, кон'югованих з кожним молем CRM197, визначали за допомогою амінокислотного аналізу (за кількістю Sкарбоксиметилцистеїнових залишків) і масспектрометрії методом MALDI-TOF. Величини, отримані тим та іншим методом, в цілому збігалися. І. Гель-хроматографія Зразки партій концентрату видобували із резервуара для зберігання і залишали відігріватися до кімнатної температури. Зразок А-пептидного кон'югата повільно перемішували до одержання гомогенного препарату. Зразок А-пептидного кон'югата піддавали центрифугуванню в мікроцентрифузі Епендорфа (Eppendorf) для видалення з нього всіх часток. Супернатант видобували і піддавали гель-хроматографії на колонці TosoHaas TSK-Gel G3000SW (TosoHaas, Stuttgart, Germany). Колонку TosoHaas TSK-Gel G3000SW сполучали з HPLC-хроматографом (рідинної хроматографії високої розрізнювальної спроможності) і межу тиску встановлювали на рівень 1,4 МПа. Колонку зрівноважували щонайменше 30 мл PBS буфера (10 51 ммоль фосфату натрію, 150 мМ Nad, рН 7,2±0,1) при витраті 0,75 мл/хв. Зразок А-пептидного кон'югата завантажували в колонку TosoHaas TSKGel G3000SW при таких параметрах: Концентрація зразка А-пептидного кон'югата sample: 1,5±1,0 мг/мл Витрата: 0,75 мл/хв Об'єм зразка: 0,1 мл Час утримання: 30 хвилин Моніторинг поглинання проводили як на 280 нм, так і на 210 нм. У випадках тривалого зберігання колонку TosoHaas TSK-Gel G3000SW зрівноважували щонайменше 50 мл 20% етанолу при витраті 0,5-1,0 мл/хв. II. PAGE (електрофорез у поліакриламідному гелі) Активований (бромацетильований) CRM197 і А-пептид-CRM197 кон'югати досліджувалися в гелях з додецилсульфатом натрію (SDS) методом NuPAGE Bis-Tris електрофорезу (Novex, Frankfurt, Germany) при нейтральному рН, у системі передформованого поліакриламідного мінігеля і NuPAGE MES SDS Running Buffer. Аліквоту 8 мкг кожного активованого CRM або кон'югата змішували з відновним буфером для зразка і гріли при 100°С протягом 5 хвилин. Кон'югати і стандарти молекулярної маси (MW) (Invitrogen, Carlsbad, CA) поміщали на 10% (мас./об., акриламід) NuPage гель (Novex) на основі буферизованої Bis-Tris-HCI системи і піддавали електрофорезу з розділяльним буфером MES SDS Running Buffer-PAGE (Laemmli). Після SDS-PAGE електрофорезу гель забарвлювали блакитним Pierce Gel Code Blue (Pierce, Rockford, IL). Кон'югат A-пептид-CRM197 був представлений головною смугою навколо 66 кДа, вище смуги природного CRM і смуги димеру навколо 120 кДа, разом з несуттєвими смужками мультимерів (не показані). III. Mac-спектрометричний аналіз пептидCRM197 кон'югатів методом MALDI-TOF Для негайної апроксимації ступеню кон'югування використовували мас-спектрометрію. Відповідні аліквоти зразків активованого CRM197 і кон'югата піддавали мас-спектрометричному аналізу методом MALDI-TOF, використовуючи як матрицю 3,5-диметокси-4-гідроксикоричну кислоту (синапінову кислоту). Молекулярна маса активованого CRM197, визначена за допомогою MALDI-TOF масспектрометрії на приладі (Finnigan MAT Lasermat 2000 Mass Spectrometer, Ringoes, NY), була розподілена навколо 60,5 кДа, а у кон'югатів вона лежала в інтервалі від 65 кДа до 74 кДа залежно від ступеню кон'югування (результати аналізу не подані). До 22 лізинів (~50%) у CRM197 виявилися модифікованими у співвідношенні 1:1. IV. Експерименти з оптимізації Ступені активації і кон'югації є функцією співвідношення реагент: білок, температури реакції і величини рН реакційного буфера. Нижче наведено 93854 52 декілька прикладів, що ілюструють оптимальні умови кон'югації, здійснених для визначення оптимального рН з метою отримання відтворюваних параметрів реакцій кон'югації. Одержані результати (Фіг. 3) показали, що реакція кон'югації з А 5мером (DAEFRC) (SEQ ID NO: 1), а також із А 7мером (DAEFRHDC) (SEQ ID NO: 2) залежить від рН і дає більший ступінь модифікації та кон'югації, коли рН реакції підвищується. Використовуючи сіль TFA 5-мерних і 7-мерних пептидів, був оцінений ступінь кон'югаці при рН 9,0 і різних кількостях завантаженого пептиду (Фіг. 4). Із цих результатів з очевидністю випливає, що пептидні кон'югати з визначеною кількістю пептидних копій на молекулу CRM можуть створюватися шляхом варіювання співвідношення пептид:активований CRM під час процесу кон'югації. Аналогічні експерименти були проведені при використанні ацетату 7-мерного пептиду А. Стосовно кон'югації A1-7/CRM кепінг-процес був оцінений шляхом порівняння кількості молей СМСА на моль CRM з кількістю молей CMC на моль CRM. Оскільки загальна кількість CMC і СМСА була постійною при кожному співвідношенні пептид:CRM у даному тесті, вважалося, що кепінгпроцес відбувався повністю (Фіг. 5). Загальна модифікація в кон'югаті лежала в межах від 19 до 21, що були порівняними з кількістю бромацетильованих лізинів (Фіг. 5). Ці експерименти проводилися з TFA як з протиіоном для даного пептиду. Кон'югацію Α1-7/CRM повторювали, використовуючи замість солі TFA ацетат пептиду; результати цього експерименту показані на Фіг. 5 і 6. Кепінг-процес демонстрував своє повне завершення і давав загальні кількості CMC і СМСА по кожній точці в інтервалі від 20 до 22. Умови реакції A-CRM кон'югації були оптимізовані при рН 9,0, а ступінь кон'югації регулювали співвідношенням між пептидом і CRM у реакційному середовищі. Шляхом варіювання цього співвідношення в межах від 0,1 до 1,5 можна було змінювати ступінь кон'югаці (Фіг. 6). Ступені активації та кон'югації є функцією співвідношення реагент:білок, температури реакції і рН реакційного буфера. Ступінь модифікації (кон'югації) для кожного кон'югата обчислювали відніманням значення маси активованого CRM197 із значень маси кожного кон'югата і діленням отриманої різниці на масу пептиду, використовуваного в одержанні кон'югата. Значення ступеня модифікації (кон'югації) для всіх кон'югатів подані в Табл. 2. Було проведено також порівняння ступеня кон'югації з величинами, отриманими при оцінці кількості утворених S-карбоксиметилцистеїнових залишків на моль CRM197 (також наведені в Табл. 2). 53 93854 54 Таблиця 2 Ступінь модифікації: порівняння даних мас-спектрометрії методом MALDI-TOF і даних амінокислотного аналізу Зразок CRM197 BrAc-CRM A1-7/CRM Α1-7/CRM A1-5/CRM A1-5/CRM Дальтони (за даними масспектрометрії) 58408 60752 74463 72375 75425 71690 Ступінь кон'югації (за даними мас-спектрометрії) 19 14 12 20 15 Приклад 6 Дослідження імуногенності A-пептидних кон'югатів Пептиди, замкнені між N-кінцевими залишками 1-5, 1-7, 1-9 і 1-12 пептиду А (з лінкерною послідовністю GAGAC і без неї) і пептид, що відповідав N-кінцю пептиду А у зворотній послідовності від дванадцятої амінокислоти до першої амінокислоти (1-12-мер у зворотній послідовності), кожний з яких був кон'югований з CRM197, використовувалися для імунізації мишей разом з некон'югованим А 112-мерним пептидом у препараті зі Стимулоном (STIMULON QS-21). Усі групи мишей імунізували підшкірними ін'єкціями з дозами 30 мкг або 5 мкг зразків, складених з 20 мкг ад'юванту STIMULON QS-21, на початку досліджень (тиждень 0) і після цього - на 3-й і 6-й тижні. Протокол досліджень поданий у Табл. 3. Як показано в Табл. 3, пептиди, замкнені між N-кінцевими залишками 1-5, 1-7, 1-9 і 1-12 пептиду А (з лінкерною послідовністю GAGAC і без неї) і пептид, що відповідав N-кінцю пептиду А у зворотній послідовності від дванадцятої амінокислоти до першої амінокислоти (1-12-мер у зворотній послідовності), кон'юговані з CRM197, використовувалися для імунізації мишей разом з некон'югованим А 1-12-мерним пептидом у препараті з QS-21. Мишей усіх груп імунізували підшкірними ін'єкціями з дозами 30 мкг або 5 мкг зразків, складених з 20 мкг ад'юванту QS-21, на початку досліджень (тиждень 0) і після цього - на 3-й і 6-й тижні. В дослідженнях використовувалися миші породи Швейцарського Вебстера (Swiss Webster), пo 5 тварин у кожній групі. Об'єм ін'єкції становив 100 мкл; В = кровопускання; V = вакцинація; Ε = знекровлення. Титри антитіл проти А виміряли шляхом твердофазного імуноферментного аналізу (ELISA) Ступінь кон'югації (заданими СМС-амінокислотного аналізу) 15 14 21 18 проти А і CRM197, як описано нижче. Коротко, 96лункові планшети Costar (№ 3591) протягом ночі при кімнатній температурі покривали 2 мкг/мл А142 у стерильному карбонат/бікарбонатному буфері, рН 9,6. Планшети спорожнювали і блокували протягом двох годин при кімнатній температурі 200 мкл/лунку 0,05% розчину альбуміну бичачої сироватки (BSA) в 1х PBS/0,05% Tween 20. Блоковані планшети спорожнювали і промивали засобом для мийки планшетів, що містив TBS, 0,1% промивного буфера Brij-35 (без азиду). Усі первинні антисироватки послідовно промивали 0,05% розчином BSA в 1х PBS (забуференому фосфатом фізіологічному розчині), що містив 0,05% Tween 20/0,02% азиду. Після цього по 100 мкл кожного розчину переносили у відповідні лунки й інкубували при кімнатній температурі протягом 2 годин. Далі планшети спорожнювали і промивали, як описано вище. Кон'юговане з лужною фосфатазою вторинне антитіло IgG кози проти миші від Southern Biotech розбавили у співвідношенні 1:1000 0,05% розчином BSA у PBS, що містив 0,05% Tween 20/0,02% азид, додали по 100 мкл до кожної лунки та інкубували при кімнатній температурі протягом 1 години. Після цього планшети спорожнили, промили, як описано вище, і наприкінець інкубували при кімнатній температурі протягом 1 години зі 100 мкл/лунку 1 мг/мл розчину рнітрофенілфосфатного субстрату, приготованого в суміші діетаноламіну з МgСІ2, рН 9,8. Еволюцію кольору припиняли додаванням 50 мкл/лунку 3 н. розчину NaOH. Планшети зчитували на хвилі 405 нм з 690 нм еталоном. Кінцеві титри обчислювали при O.D. 0,1 довільних одиниць. 55 93854 56 Таблиця 3 Протокол досліджень з імунізації мишей Код групи АЕ488 АЕ489 АЕ490 АЕ491 АЕ492 АЕ493 АЕ494 АЕ495 АЕ496 АЕ497 АЕ498 АЕ499 AE500 AE501 АЕ502 АЕ503 АЕ504 АЕ505 АЕ506 АЕ507 АЕ508 АЕ509 АЕ510 АЕ511 Опис Доза, мкг Тижд. 0 CRM/1-7 без лінкера 30 B,V CRM/1-12 з лінкером 30 B,V CRM/1-9 з лінкером 30 B,V CRM/1-7 з лінкером 30 B,V CRM/1-5 без лінкера 30 Β,V CRM/1-9 без лінкера 30 Β,V CRM/1-12 без лінкера 30 Β,V CRM/1-5 з лінкером 30 Β,V CRM/1-7 без лінкера 5 Β,V CRM/1-12 з лінкером 5 Β,V CRM/1-9 з лінкером 5 Β,V CRM/1-7 з лінкером 5 Β,V CRM/1-5 без лінкера 5 B,V CRM/1-9 без лінкера 5 B,V CRM/1-12 без лінкера 5 B,V CRM/1-5 з лінкером 5 B,V CRM197C1-6151 30 B,V CRM197C1-6151 5 B,V CRM/12-1-мер 30 Β,V CRM/12-1-мер 5 Β,V 1-12-мерний пептид 30 Β,V 1-12-мерний пептид 5 Β,V Аb 30 Β,V Аb 5 Β,V Твердофазний імуноферментний аналіз CRM197 Планшети Грейнера (Greiner) на 96 лунок (№ 650011) покривали при температурі 37°С протягом 90 хвилин 5,0 мкд/мл (100 мкл/лунку) білка CRM197 у стерильному карбонат/бікарбонатному буфері, рН 9,6. Планшети спорожнювали і промивали засобом для мийки планшетів, що містив 1х TBS, 0,1% промивного буфера Brij-35. Усі первинні антисироватки послідовно промивали 1х PBS, що містив 0,3% Tween 20/EDTA. Після цього по 100 мкл кожного розчину переносили у відповідні лунки й інкубували при 37°С протягом 1 години. Далі планшети спорожнювали і промивали, як описано вище. Кон'юговане з лужною фосфатазою вторинне антитіло IgG кози проти миші від Southern Biotech розбавили у співвідношенні 1:1000 розчином 1х PBS, що містив 0,05% Tween 20/0,02% азид, і по 100 мкл додали до кожної лунки та інкубували при 37°С протягом 1 години. Після цього планшети спорожнили, промили, як описано вище, і наприкінець інкубували при кімнатній температурі протягом 1 години зі 100 мкл/лунку 1 мг/мл розчину р-нітрофенілфосфатного субстрату, приготованого в суміші діетаноламіну з МgСІ2, рН 9,8. Еволюцію кольору припиняли додаванням 50 мкл/лунку 3 н. розчину NaOH. Планшети зчитували на хвилі 405 нм з 690 нм еталоном. Кінцеві титри обчислювали при O.D. 0,1 довільних одиниць. У Табл. 4-6 наведені визначені методом ELISA кінцеві титри проти А. Після первинної імунізації всі вісім кон'югатів (за винятком негативного контролю) викликали відчутні IgG імунні відповіді проти Тижд. 3 Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V B,V B,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Тижд. 6 Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V B,V B,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Β,V Тижд. 8 Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Β Тижд. 13 Тижд. 16 Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε Β Ε А. Проте, 30 мкг доза, а не 5мкг доза, пептиду А давала позитивну відповідь на 3-й тиждень після первинної імунізації. Серед усіх кон'югатів пептид А 1-7, кон'югований без лінкера, демонстрував здатність викликати таку ж хорошу або навіть кращу відповідь, ніж інші досліджені кон'югати. При 5 мкг дозі пептид А 1-5С діяв краще в період 8-16 тижнів. Пептид А 1-7С давав найкращі результати при дозі 30 мкг. Аналіз титрів антитіл після другої та третьої імунізації як з дозою 5 мкг, так і з дозою 30 мкг показав, що максимальна імунна відповідь на А для більшості кон'югатів спостерігалася після другої імунізації. Третя імунізація, принаймні у мишей, не супроводжувалася підсиленням імунної відповіді. Проте, пептид А для досягнення максимальної імунної відповіді проти нього потребував проводити три імунізації з дозою 30 мкг (Табл. 5). Що стосується послаблення антитіл з плином часу, то рівень антитіл із групи тварин, імунізованих кон'югатами, знижувався у 2-3 рази порівняно з максимальним рівнем у цій групі. Окремі зразки 6-го і 8-го тижнів були проаналізовані для обчислення GMT титрів проти А по кожній із груп (Табл. 6) і, таким чином, встановлення того, чи є серед груп, що отримували кон'югати, яка-небудь група, набагато краще інших. Статистичний аналіз титрів 6-го тижня від кон'югатів А15С, А1-7С і А1-9С показав, що кон'югат А 1-7 продемонстрував значно вищий титр. Із цього експерименту є очевидним також, що лінкерна послідовність GAGAC не зробила внеску в підсилення імунної відповіді на даний пептид. 57 93854 58 Таблиця 4 Група 1-5С 1-7С 1-9С 1-12С 1-5LC 1-7LC 1-9LC 1-12LC CRM197 1-42 1-12 12-1С
ДивитисяДодаткова інформація
Назва патенту англійськоюImmunogenic peptide carrier conjugates and methods of producing same
Автори англійськоюArumugham Rasappa G, Prasad A Krishna
Назва патенту російськоюИммуногенный конъюгат и способ его получения
Автори російськоюАрумугхам Расаппа Дж., Прасад A. Кришна
МПК / Мітки
МПК: C07K 17/00, A61K 39/385, A61P 37/00
Мітки: кон'югат, одержання, імуногенний, спосіб
Код посилання
<a href="https://ua.patents.su/67-93854-imunogennijj-konyugat-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Імуногенний кон’югат та спосіб його одержання</a>
Попередній патент: Способи продукування аполіпопротеїнів у трансгенних рослинах
Наступний патент: Вакцина, що сприяє росту, яка базується на нейтралізуючому епітопі
Випадковий патент: Спосіб і пристрій для підготовки сировини при виготовленні паперу, картону або волокнистих плит