Похідні l-(піперидин-4-іл)-піразолу як gpr119-модулятори
Номер патенту: 101110
Опубліковано: 25.02.2013
Автори: Макклур Кім Френсіс, Вей-Шунґ Кунґ Даніель, Денінно Майкл Пол, Маскітті Вінсент, Мунчгоф Майкл Джон, Лефкер Брюс Аллен, Робінсон Джр., Ральф Пелтон, Футацуґі Кентаро
Формула / Реферат
1. Сполука формули І:
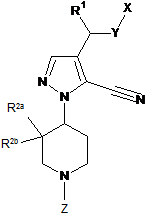 , I
, I
де:
Х є 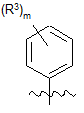 або
або 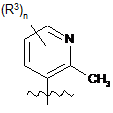 ;
;
Y є О, CH(R5) або NR5;
Z є -C(О)-O-R6 або піримідином, заміщеним С1-С4алкілом, CF3, галогеном, ціано, С3-С6циклоалкілом або С3-С6циклоалкілом, в якому один атом карбону, згаданого циклоалкільного залишку, необов'язково має як замісник метил або етил;
m є 1, 2 або 3;
n є 0, 1 або 2;
R1 є гідрогеном, С1-С4алкілом або С3-С6циклоалкілом;
R2a є гідрогеном, флуором або С1-С4алкілом;
R2b є гідрогеном або флуором, за умови, що, коли R2a є С1-С4алкілом, R2b є гідрогеном;
кожен R3 є окремо вибраним з групи, що складається з: гідрокси, галогену, ціано, С1-С4алкілу, С1-С4алкокси, С1-С4галогеналкілу, С1-С4галогеналкокси, -SO2-R7, -P(O)(OR8)(OR9), -C(O)-NR8R9, -N(СН3)-СО-О-(С1-С4)алкілу, -NН-СО-О-(С1-С4)алкілу, -NH-CO-(С1-С4)алкілу, -N(СН3)-СО-(С1-С4)алкілу, -NH-(CH2)2-OH та 5-6-членної гетероарильної групи, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену, нітрогену або сульфуру, де атом карбону, згаданої герероарильної групи, необов'язково має замісник R4a або атом нітрогену, згаданої герероарильної групи, необов'язково має замісник R4b;
R4a є гідрогеном, С1-С4алкілом, С1-С4алкокси, С1-С4галогеналкілом або галогеном, де згаданий алкіл є необов'язково заміщеним гідрокси або С1-С4алкокси;
R4b є гідрогеном, С1-С4алкілом, -СН2-С1-С3галогеналкілом, -С2-С4алкіл-ОН або -СН2-С1-С4алкокси;
R5 є гідрогеном або, коли R1 є гідрогеном, тоді R5 є гідрогеном або С1-С4алкілом;
R6 є С1-С4алкілом або С3-С6циклоалкілом, де один атом карбону, згаданого циклоалкільного залишку, необов'язково має як замісник метил або етил;
R7 є С1-С4алкілом, С3-С6циклоалкілом, NH2 або -(СН2)2-ОН;
R8 є гідрогеном або С1-С4алкілом;
R9 є гідрогеном, С1-С4алкілом, С3-С6циклоалкілом, -(СН2)2-ОН, -(СН2)2-О-СН3, -(СН2)3-ОН, -(СН2)3-О-СН3, 3-оксетанілом або 3-гідроксициклобутилом;
або, коли R3 є -C(O)-NR8R9, R8 та R9 можуть разом з атомом нітрогену, до якого вони приєднані, утворювати азетидинове, піролідинове, піперидинове або морфолінове кільце;
або її фармацевтично прийнятна сіль.
2. Сполука за пунктом 1, де
Х є 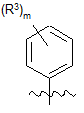 ;
;
Y є О;
m є 1 або 2;
Z є -C(О)-O-R6;
R1 є гідрогеном;
R2a є гідрогеном;
R2b є гідрогеном;
кожен R3 незалежно є гідрокси, галогеном, ціано, CF3, OCF3, С1-С4алкілом, С1-С4алкокси, SO2-R7, -P(O)(OR8)(OR9), -CO-NR8R9 або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбону, згаданої герероарильної групи, необов'язково має замісник R4a або атом нітрогену, згаданої герероарильної групи, необов'язково має замісник R4b.
3. Сполука за пунктом 1, де
Х є 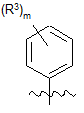 ;
;
Y є О;
m є 1 або 2;
Z є -C(O)-O-R6;
R1 є гідрогеном;
R2a є флуором;
R2b є гідрогеном;
кожен R3 незалежно є гідрокси, галогеном, ціано, CF3, OCF3, С1-С4алкілом, С1-С4алкокси, SO2-R7, -P(O)(OR8)(OR9), -CO-NR8R9 або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбону, згаданої герероарильної групи, необов'язково має замісник R4a або атом нітрогену, згаданої герероарильної групи, необов'язково має замісник R4b.
4. Сполука за пунктом 1 або 2, де кожен R3 незалежно є флуором, метилом, ціано, -C(O)NR8R9, -SO2-R7, тетразолом, піразолом, імідазолом або триазолом.
5. Сполука за будь-яким з пунктів 1, 2 або 4, де
кожен R3 незалежно є флуором, метилом, ціано, -C(O)NR8R9, -SO2-R7,
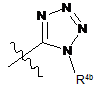 ,
, 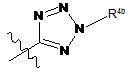 або
або 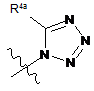 ;
;
R4a і R4b кожен незалежно є гідрогеном, С1-С4алкілом або С2-С4алкіл-ОН.
6. Сполука за пунктом 1, де
Х є  ;
;
Y є О або NH;
Z є -C(O)-O-R6;
n є 0 або 1;
R1 є гідрогеном;
R2a є гідрогеном;
R2b є гідрогеном;
R3, якщо присутній, є С1-С4алкілом або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбону, згаданої герероарильної групи, необов'язково має замісник R4a або атом нітрогену, згаданої герероарильної групи, необов'язково має замісник R4b.
7. Сполука за пунктом 1, де
Х є  ;
;
Y є О або NH;
Z є -C(O)-O-R6;
n є 0 або 1;
R1 є гідрогеном;
R2a є флуором;
R2b є гідрогеном;
R3, якщо присутній, є С1-С4алкілом або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбону, згаданої герероарильної групи, необов'язково має замісник R4a або атом нітрогену, згаданої герероарильної групи, необов'язково має замісник R4b.
8. Сполука за будь-яким з пунктів 1-7, де R6 є ізопропіл або 1-метилциклопропіл.
9. Сполука, вибрана з групи:
1-метилциклопропіл-4-{4-[(4-карбамоїл-3-флуорфенокси)метил]-5-ціано-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-{4-[(4-карбамоїл-2-флуорфенокси)метил]-5-ціано-1Н-піразол-1-іл}піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[4-(1Н-піразол-1-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
1-метилциклопропіл-4-{5-ціано-4-[(2,3-дифлуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-{5-ціано-4-[(2,5-дифлуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-{5-ціано-4-[(2,3,6-трифлуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({2-флуор-4-[1-(2-гідроксіетил)-1Н-тетразол-5-іл]фенокси}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({2-флуор-4-[2-(2-гідроксіетил)-2Н-тетразол-5-іл]фенокси}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(1-метил-1Н-імідазол-2-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
1-метилциклопропіл-4-{5-ціано-4-[(4-ціанофенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-{4-[(4-карбамоїлфенокси)метил]-5-ціано-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-(5-ціано-4-{[4-(1-метил-1Н-тетразол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
1-метилциклопропіл-4-(5-ціано-4-{[2-флуор-4-(1-метил-1Н-тетразол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(1-метил-1Н-імідазол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-{5-ціано-4-[(2,3,6-трифлуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
ізопропіл-4-{5-ціано-4-[(2,4-дифлуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
1-метилциклопропіл-4-(5-ціано-4-{[(2-метилпіридин-3-іл)окси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({[2-метил-6-(1Н-1,2,4-триазол-1-іл)піридин-3-іл]окси}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({[2-метил-6-(1Н-1,2,4-триазол-1-іл)піридин-3-іл]аміно}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({[2-метил-6-(метилсульфоніл)піридин-3-іл]аміно}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-{5-ціано-4-[(2-метилфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(1-метил-1Н-тетразол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(2-метил-2Н-тетразол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[(2-метилпіридин-3-іл)аміно]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{1-[(2-метилпіридин-3-іл)оксі]етил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({[2-флуор-4-(метилсульфоніл)феніл]аміно}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{1-[2-флуор-4-(метилсульфоніл)феноксі]етил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{2-[2-флуор-4-(метилсульфоніл)феніл]пропіл}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(1Н-тетразол-5-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{2-[2-флуор-4-(метилсульфоніл)феніл]етил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-{5-ціано-4-[(4-ціано-2-флуорфенокси)метил]-1Н-піразол-1-іл}піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[4-(диметоксифосфорил)-2-флуорфенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[(2-метилпіридин-3-іл)окси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-[5-ціано-4-({2-флуор-4-[(2-гідроксіетил)сульфоніл]фенокси}метил)-1Н-піразол-1-іл]піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(1Н-тетразол-1-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[4-(1Н-тетразол-1-іл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
ізопропіл-4-(5-ціано-4-{[2-флуор-4-(метилсульфоніл)фенокси]метил}-1Н-піразол-1-іл)піперидин-1-карбоксилат;
або її фармацевтично прийнятна сіль.
10. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1-9, присутню в терапевтично ефективній кількості, в суміші з щонайменше одним фармацевтично прийнятним наповнювачем.
11. Композиція за пунктом 10, що додатково містить щонайменше один додатковий фармацевтичний агент, вибраний з групи, що складається з агента проти ожиріння та антидіабетичного агента.
12. Композиція за пунктом 11, де згаданий агент проти ожиріння вибраний з групи, що складається з дирлотапіду, мітратапіду, імплітапіду, R56918 (CAS No. 403987), CAS No. 913541-47-6, лоркасерину, цетилістату, PYY3-36, налтрексону, олеоїл-естрону, обінопептиду, прамлінтиду, тезофензину, лептину, ліраглутиду, бромокриптину, орлістату, ексенатиду, AOD-9604 (CAS No. 221231-10-3) та сибутраміну.
13. Композиція за пунктом 11, де згаданий антидіабетичний агент вибраний з групи, що складається з метформіну, ацетогексаміду, хлорпропаміду, діабінезу, глібенкламіду, гліпізиду, глібуриду, глімепіриду, гліклазиду, гліпентиду, гліквідону, глізоламіду, толазаміду, толбутаміду, тендамістату, трестатину, акарбози, адипозину, каміглібозу, еміглітату, міглітолу, воглібозу, прадиміцину-Q, сальбостатину, балаглітазону, циглітазону, дарглітазону, енглітазону, ізаглітазону, піоглітазону, розиглітазону, троглітазону, ексендину-3, ексендину-4, тродусквеміну, резерватролу, екстракту морської губки Hyrtios, ситагліптину, вілдагліптину, алогліптину та саксагліптину.
14. Спосіб лікування діабету, за яким пацієнту, що цього потребує, вводять ефективну кількість сполуки за будь-яким з пунктів 1-9.
15. Спосіб лікування метаболічних або метаболічно-пов'язаних захворювань, станів або розладів, що містить стадію, на якій пацієнту вводять терапевтично ефективну кількість сполуки за будь-яким з пунктів 1-9.
16. Спосіб лікування станів, вибраних з групи, що складається з гіперліпідемії, діабету типу І, цукрового діабету типу II, ідіопатичного діабету типу І (тип Іb), прихованого аутоімунного діабету у дорослих (LADA), діабету типу II з раннім початком (EOD), атипового діабету з початком у молодому віці (YOAD), діабету молоді з початком у зрілому віці (MODY), діабету, пов'язаного з недостатністю харчування, гестаційного діабету, коронарної хвороби серця, ішемічного інсульту, рестенозу після судинної пластики, захворювань периферійних судин, переміжної кульгавості, інфаркту міокарда (наприклад, некроз та апоптоз), дисліпідемії, ліпемії після їжі, станів з пониженою толерантністю до глюкози (IGT), станів з пониженим рівнем глюкози в плазмі натщесерце, метаболічного ацедозу, кетозу, артриту, ожиріння, остеопорозу, гіпертензії, застійної серцевої недостатності, гіпертрофії лівого шлуночка, захворювань периферійних артерій, діабетичної ретинопатії, дегенерації жовтої плями, катаракти, діабетичної нефропатії, гломерулосклерозу, хронічної ниркової недостатності, діабетичної нейропатії, метаболічного синдрому, синдрому X, передменструального синдрому, коронарної хвороби серця, стенокардії, тромбозу, атеросклерозу, інфаркту міокарда, транзиторної ішемічної атаки, інсульту, судинного рестенозу, гіперглікемії, гіперінсулінемії, гіперліпідемії, гіпертригліцеридемії, несприйняття інсуліну, зниженого метаболізму глюкози, станів зі зниженою толерантністю до глюкози, станів зі зниженим рівнем глюкози в плазмі натщесерце, ожиріння, еректильної дисфункції, розладів шкіри та сполучної тканини, діабетичної стопи та виразкового коліту, ендотеліальної дисфункції та зниженої пластичності судин, гіперапо-В-ліпопротеїнемії, хвороби Альцгеймера, шизофренії та зниженої пізнавальної здатності, запальних захворювань кишечнику, неспецифічного виразкового коліту, хвороби Крона, синдрому подразненого кишечнику, за яким вводять ефективну кількість сполуки за будь-яким з пунктів 1-9.
17. Спосіб лікування метаболічних або метаболічно-пов'язаних захворювань, станів або розладів, що містить стадію, на якій пацієнту, що потребує такого лікування, вводять дві окремих фармацевтичних композиції
(і) першу композицію за пунктом 12; та
(іі) другу композицію, що містить щонайменше один додатковий фармацевтичний агент, вибраний з групи, що складається з агента проти ожиріння та антидіабетичного агента, та щонайменше один фармацевтично прийнятний носій.
18. Спосіб за пунктом 17, де згадану першу композицію та згадану другу композицію вводять одночасно.
19. Спосіб за пунктом 17, де згадану першу композицію та згадану другу композицію вводять послідовно та в будь-якому порядку.
20. Застосування сполуки за будь-яким з пунктів 1-9 у виробництві лікарського засобу для лікування захворювання, стану або розладу, що модулює активність G-протеїн кон'югованого рецептора GPR119.
21. Застосування сполуки за будь-яким з пунктів 1-9 у виготовленні лікарського засобу для лікування діабету або захворювань, пов'язаних зі згаданими діабетами.
Текст
Реферат: Винахід стосується сполук формули І, що модулюють активність рецептора, кон'югованого з Gпротеїном, GPR119, та їх застосування в лікуванні захворювань, пов'язаних з модуляцією рецептора, кон'югованого з G-протеїном, GPR119, у тварин. UA 101110 C2 (12) UA 101110 C2 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Представлений винахід стосується нового класу ціанопіразолів, фармацевтичних композицій, що містять ці сполуки, та їх застосування для модуляції активності рецептору кон'югованого з G-протеїном, GPR119. Передумови винаходу Цукровий діабет є розладом, при якому спостерігаються високі рівні глюкози в крові, як наслідок анормального гомеостазу глюкози. Найбільш загальними формами цукрового діабету є тип I (до того ж віднесений до інсулін залежного цукрового діабету) та діабет типу II (до того ж віднесений до не інсулін залежного цукрового діабету). Діабет типу II, що нараховують близько 90 % від всіх випадків діабету, є серьозним прогресуючим захворюванням, що в результаті призводить до мікросудинних ускладнень (включаючи ретинопатію, нейропатію та нефропатію) а також макросу динних ускладнень (включаючи прогресуючий атеросклероз, коронарна хвороба серця та інсульт). На даний момент, дібет невиліковний. Стандартні способи лікування захворювання обмежені і зосереджені на регулюванні рівнів глюкози в крові, щоб довести до мінімуму або уповільнити розвиток ускладнень. Сучасні способи лікування спрямовані на або несприйняття інсуліну (метформін, тіазолідіндіоні), або вивільнення інсуліну бета-клітинами (сульфонілсечовини, ексенатид). Сульфонілсечовини та інші сполуки, що діють через деполяризацію бета-клітин, сприяють гіпоглікемії, так як вони стимулюють секрецію інсуліну незалежно від концентрацій циркулюючої глюкози. Один затверджений лікарський засіб, ексенатид, стимулює секрецію інсуліну тільки в присутності високого рівня глюкози, однак його необхідно вводити ін'єкційно через відсутність біодоступності при пероральному введенні. Сітагліптин, інгібітор дипептидил пептидази IV, є новим лікарським засобом, що підвищує в крові рівні інкретин гормонів, які можуть підвищувати секрецію інсуліну, знижувати секрецію глюкагону та проявляють інші менш добре визначені дії. Однак, сітагліптин та інші інгібітори дипептидил пептидази IV можуть також впливати на рівні інших гормонів та пептидів в тканинах, та довгострокові наслідки такої більш широкої дії повністю не дослідили. При діабеті типу II клітини м'язів, жирові клітини та клітини печінки перестають нормально реагувати на інсулін. Цей стан (несприйняття інсуліну) може виникати через зменшення кількостей клітинних рецепторів інсуліну, розриву клітинного сигнального шляху, або обох. Поперше, бета-клітини компенсують несприйняття підвищенням вироблення інсуліну. В кінці кінців, однак, бета-клітини стають нездатними до вироблення достатньої кількості інсуліну, щоб підтримувати нормальні рівні глюкози (нормоглікемія), демонструючи прогресування діабету типу II. При діабеті типу II, гіперглікемія натщесерце відбувається через несприйняття інсуліну поєднане з дисфункцією бета-клітин. Існує два аспекти дисфункції бета-клітин: 1) підвищене вивільнення базального інсуліну (зустрічається при низьких нестимулюючих концентраціях глюкози). Спостерігається у страждаючих на ожиріння, на інсулінрезистентних переддіабетичних стадіях, а також при діабеті типу ІІ, та 2) у відповідь на гіперглікімічну стимуляцію, нездатну підвищити вивільнення інсуліну над вже підвищеним базальним рівнем. Це не відбувається на переддіабетичних стадіях та може сигналізувати про перехід від нормоглікемічних інсулінрезистентних стадій до явного діабету типу ІІ. Сучасні терапії для лікування останнього аспекту включають інгібітори бета-клітинного АТФ-чутливого калійного каналу, щоб ініціювати вивільнення ендогенного резерву інсуліну та введення екзогенного інсуліну. Ні те ні інше не дає точної нормалізації рівнів глюкози в крові та обидва несуть ризик викликаної гіпоглікемії. Таким чином, існує велика зацікавленість у розробці агентів, які діють глюкозозалежним способом. Фізіологічні сигнальні шляхи, які функціонують в цьому напрямку є добре відомими, включаючи пептиди GLP-1 та GIP кишковика. Ці гормони сигналізують через схожі рецептори, кон'юговані з G-протеїном (GPCR) для стимуляції вироблення цАМФ (циклічного аденозин монофосфату) в панкреатичних бета-клітинах. Підвищений цАМФ ймовірно не призводить в результаті до стимуляції вивільнення інсуліну під час стану натщесерце або перед обідом. Однак, число біохімічних мішеней цАМФ, включаючи АТФ-чутливий калієвий канал, потенціалчутливі калієві канали та екзоцитотичну систему, модулюють так, що секреція інсуліну, завдяки після обіденній глюкозній стимуляції, значно підвищується. Тому, модулятори агоністу нового, подібного за функцією до GPCR бета-клітин, включаючи GPR119, також стимулювали б вивільнення ендогенного інсуліну та сприяли б нормалізації рівнів глюкози у пацієнтів з діабетом типу ІІ. До того ж, показано, що підвищений цАМФ, наприклад як результат GLP-1 стимуляції, сприяє проліферації бета-клітин, інгібує смерть бета-клітин та, таким чином, 1 UA 101110 C2 5 10 покращує острівкову масу. Цей позитивний вплив на масу бета-клітин був би корисним для діабету типу ІІ, при якому виробляється недостатньо інсуліну Добре відомо, що метаболічні захворювання мають негативний вплив на інші фізіологічні системи та часто існує спільна наявність різноманітних станів захворювання (наприклад, діабет типу І, діабет типу ІІ, неадекватна толерантність до глюкози, несприйняття інсуліну, гіперглікемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеролемія, дисліпідемія, ожиріння або серцево-судинне захворювання в "Синдромі X") або вторинних захворювань, які виникають вторинно до діабету, такі як захворювання нирок та периферична. Таким чином, лікування діабетичного стану було б корисним для таких взаємопов'язаних станів захворювання. Суть винаходу У відповідності з представленим винаходом виявлено новий клас GPR 119 модуляторів. Ці сполуки можуть бути представлені формулою І, як показано нижче: X R1 Y N N N R2a R2b N Z 15 I, де: (R3)m (R3)n N CH3 20 25 30 35 40 Xє або ; 5 5 Y є O, CH(R ), або NR ; 6 Z є –C(O)-O-R або піримідином, заміщеним C1-C4алкілом, CF3, галогеном, ціано, C3C6циклоалкілом або C3-C6циклоалкілом, в якому гідроген біля одного з атомів карбону необов'язково може бути заміщений метилом або етилом; m є 1, 2, або 3; n є 0, 1 або 2; 1 R є гідрогеном, C1-C4алкілом, або C3-C6циклоалкілом; 2a R є гідрогеном, флуором або C1-C4алкілом; 2b 2a 2b R є гідрогеном або флуором, за умови, що коли R є C1-C4алкілом, R є гідрогеном; 3 кожен R є окремо вибраним з групи, що складається з: гідрокси, галогену, ціано, C17 C4алкілу, C1-C4алкокси, C1-C4галогеналкілу, C1-C4галогеналкокси, -SO2-R , 8 9 8 9 -P(O)(OR )(OR ), -C(O)-NR R , -N(CH3)-CO-O-(C1-C4)алкілу, -NH-CO-O-(C1-C4)алкілу, -NH-CO(C1-C4)алкілу, -N(CH3)-CO-(C1-C4)алкілу, -NH-(CH2)2-OH та 5-6-членної гетероарильної гоупи, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену, нітрогену або 4a сульфуру, де атом карбону, згаданої гетероарильної групи, необов'язково має замісник R або 4b атом нітрогену, згаданої гетероарильної групи, необов'язково має замісник R ; 4a R є гідрогеном, C1-C4алкілом, C1-C4алкокси, C1-C4галогеналкілом, або галогеном, де згаданий алкіл є необов'язково заміщеним гідрокси або C1-C4алкокси; 4b R є гідрогеном, C1-C4алкілом, -CH2-C1-C3галогеналкілом, -C2-C4алкіл-OH або -CH2-C1C4алкокси; 5 1 5 R є гідрогеном або коли R є гідрогеном, тоді R є гідрогеном або C1-C4алкілом; 6 R є C1-C4алкілом або C3-C6циклоалкілом, де гідроген одного з атомів карбону, згаданого циклоалкільного залишку, необов'язково може бути заміщеним метилом або етилом; 2 UA 101110 C2 7 5 10 15 20 25 30 35 40 45 50 55 R є C1-C4алкілом, C3-C6циклоалкілом, NH2, або -(CH2)2-OH; 8 R є гідрогеном або C1-C4алкілом; та 9 R є гідрогеном, C1-C4алкілом, C3-C6циклоалкілом, -(CH2)2-OH, -(CH2)2-O-CH3, -(CH2)3-OH, (CH2)3-O-CH3, 3-оксетанілом, або 3-гідроксициклобутилом; 3 8 9 8 9 або коли R є -C(O)-NR R , R і R можуть разом з нітрогеном, до якого вони приєднані, утворювати азетидинове, піролідинове, піперидинове або морфолінове кільце; або їх фармацевтично прийнятні солі. До того ж, представлений винахід стосується сполук: 1-метилциклопропіл 4-{4-[(4-карбамоїл-3-флуорфенокси)метил]-5-ціано-1H-піразол-1іл}піперидин-1-карбоксилату; 1-метилциклопропіл 4-{4-[(4-карбамоїл-2-флуорфенокси)метил]-5-ціано-1H-піразол-1іл}піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[4-(1H-піразол-1-іл)фенокси]метил}-1H-піразол-1-іл)піперидин-1карбоксилату; 1-метилциклопропіл 4-{5-ціано-4-[(2,3-дифлуорфенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; 1-метилциклопропіл 4-{5-ціано-4-[(2,5-дифлуорфенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; 1-метилциклопропіл 4-{5-ціано-4-[(2,3,6-трифлуорфенокси)метил]-1H-піразол-1-іл}піперидин1-карбоксилату; ізопропіл 4-[5-ціано-4-({2-флуор-4-[1-(2-гідроксіетил)-1H-тетразол-5-іл]фенокси}метил)-1Hпіразол-1-іл]піперидин-1-карбоксилату; ізопропіл 4-[5-ціано-4-({2-флуор-4-[2-(2-гідроксиетил)-2H-тетразол-5-іл]фенокси}метил)-1Hпіразол-1-іл]піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(1-метил-1H-імідазол-2-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; 1-метилциклопропіл 4-{5-ціано-4-[(4-ціанофенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; 1-метилциклопропіл 4-{4-[(4-карбамоїлфенокси)метил]-5-ціано-1H-піразол-1-іл}піперидин-1карбоксилату; 1-метилциклопропіл 4-(5-ціано-4-{[4-(1-метил-1H-тетразол-5-іл)фенокси]метил}-1H-піразол1-іл)піперидин-1-карбоксилату; 1-метилциклопропіл 4-(5-ціано-4-{[2-флуор-4-(1-метил-1H-тетразол-5-іл)фенокси]метил}-1Hпіразол-1-іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(1-метил-1H-імідазол-5-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-{5-ціано-4-[(2,3,6-трифлуорфенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; ізопропіл 4-{5-ціано-4-[(2,4-дифлуорфенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; 1-метилциклопропіл 4-(5-ціано-4-{[(2-метилпіридин-3-іл)окси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-[5-ціано-4-({[2-метил-6-(1H-1,2,4-триазол-1-іл)піридин-3-іл]окси}метил)-1Hпіразол-1-іл]піперидин-1-карбоксилату; ізопропіл 4-[5-ціано-4-({[2-метил-6-(1H-1,2,4-триазол-1-іл)піридин-3-іл]аміно}метил)-1Hпіразол-1-іл]піперидин-1-карбоксилату; ізопропіл 4-[5-ціано-4-({[2-метил-6-(метилсульфоніл)піридин-3-іл]аміно}метил)-1H-піразол-1іл]піперидин-1-карбоксилату; ізопропіл 4-{5-ціано-4-[(2-метилфенокси)метил]-1H-піразол-1-іл}піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(1-метил-1H-тетразол-5-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(2-метил-2H-тетразол-5-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[(2-метилпіридин-3-іл)аміно]метил}-1H-піразол-1-іл)піперидин-1карбоксилату; ізопропіл 4-(5-ціано-4-{1-[(2-метилпіридин-3-іл)окси]етил}-1H-піразол-1-іл)піперидин-1карбоксилату; ізопропіл 4-[5-ціано-4-({[2-флуор-4-(метилсульфоніл)феніл]аміно}метил)-1H-піразол-1іл]піперидин-1-карбоксилату; 3 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізопропіл 4-(5-ціано-4-{1-[2-флуор-4-(метилсульфоніл)фенокси]етил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{2-[2-флуор-4-(метилсульфоніл)феніл]пропіл}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(1H-тетразол-5-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{2-[2-флуор-4-(метилсульфоніл)феніл]етил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-{5-ціано-4-[(4-ціано-2-флуорфенокси)метил]-1H-піразол-1-іл}піперидин-1карбоксилату; ізопропіл 4-(5-ціано-4-{[4-(диметоксифосфорил)-2-флуорфенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[(2-метилпіридин-3-іл)окси]метил}-1H-піразол-1-іл)піперидин-1карбоксилату; ізопропіл 4-[5-ціано-4-({2-флуор-4-[(2-гідроксіетил)сульфоніл]фенокси}-метил)-1H-піразол-1іл]піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(1H-тетразол-1-іл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; ізопропіл 4-(5-ціано-4-{[4-(1H-тетразол-1-іл)фенокси]метил}-1H-піразол-1-іл)піперидин-1карбоксилату; ізопропіл 4-(5-ціано-4-{[2-флуор-4-(метилсульфоніл)фенокси]метил}-1H-піразол-1іл)піперидин-1-карбоксилату; або її фармацевтично прийнятної солі. Сполуки формули I модулюють активність рецептору, кон'югованого з G-протеїном. Зокрема, сполуки модулюють GPR119. По суті, згадані сполуки придатні для лікування захворювань, таких як діабет, в яких активність GPR119 сприяє патології або симптомам захворювання. Приклади таких станів включають гіперліпідемію, діабет типу І, цукровий діабет типу ІІ, ідіоматичний діабет типу І (тип Ib), прихований аутоімуний діабет у дорослих (LADA), діабет типу ІІ з раннім початком (EOD), атиповий діабет з початком у молодому віці (YOAD), діабет молоді з початком у зрілому віці (MODY), діабет, пов'язаний з недостатністю харчування, гестаційний діабет, коронарна хвороба серця, ішемічний інсульт, рестеноз після судинної пластики, захворювання периферійних судин, переміжна кульгавість, інфаркт міокарду (наприклад, некроз та апоптоз), дисліпідемія, ліпемія після їжі, стани з пониженою толерантністю до глюкози (IGT), стани з пониженим рівнем глюкози в плазмі натщесерце, метаболічний ацидоз, кетоз, артрит, ожиріння, остеопороз, гіпертензія, застійна серцева недостатність, гіпертрофія лівого шлуночка, захворювання периферійних артерій, діабетична ретинопатія, дегенерація жовтої плями, катаракта, діабетична нефропатія, гломерулосклероз, хронічна ниркова недостатність, діабетична нейропатія, метаболічний синдром, синдром X, перед менструальний синдром, коронарна хвороба серця, стенокардія, тромбоз, атеросклероз, транзиторна ішемічна атака, інсульт, судинний рестеноз, гіперглікемія, гіперінсулінемія, гіперліпідемія, гіпертригліцеридемія, несприйняття інсуліну, знижений метаболізм глюкози, стани зі зниженою толерантністю до глюкози, стани зі зниженим рівнем глюкози в плазмі натщесерце, ожиріння, еректильна дисфункція, розлади шкіри та сполучної тканини, діабетична стопа та виразковий коліт, ендотеліальна дисфункція та знижена пластичність судин. Сполуки можуть бути застосовані для лікування неврологічних розладів, таких як хвороба Альцгеймера, шизофренія та знижена пізнавальна здатність. Сполуки також будуть корисними при шлунковокишкових захворюваннях, таких як запальні захворювання кишечника, неспецифічний виразковий коліт, хвороба Крона, синдром подразненого кишечника, тощо. Як зазначалося вище, сполуки також можуть застосовувати для стимуляції втрати ваги у пацієнтів з ожирінням, особливо тих, хто страждає на діабет. В наступному втіленні винахід стосується фармацевтичних композицій, що містять сполуку формули (І). Такі рецептури, як правило, містять сполуку формули (І) в суміші з щонайменше одним фармацевтично прийнятним наповнювачем. Такі рецептури також можуть містити щонайменше один додатковий фармацевтичний агент. Приклади таких агентів включають агенти проти ожиріння та/або антидіабетичні агенти. Додаткові аспекти винаходу стосуються застосування сполук формули (І) у виробництві лікарських засобів для лікування діабету та споріднених станів як описано тут. Зрозуміло, що як вищезазначена суть винаходу так і наступний детальний опис є лише ілюстративними і пояснювальними та не обмежують винахід, як заявлено. Детальний опис винаходу 4 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід може бути краще зрозумілим з посиланнями на наступний детальний опис проілюстрованих втілень винаходу та включених сюди прикладів. Зрозуміло, що даний винахід не обмежується конкретними синтетичними способами створення, що звичайно можуть варіювати. Також слід розуміти, що термінологія, використана в цьому документі, має за мету тільки опис окремих втілень та не призначені для обмеження. Множина й однина повинні розглядатися як взаємозамінні, крім випадків, де зазначено число: a. "галоген" означає атом хлору, флуору, йоду або брому. b. "C1-C5алкіл" означає розгалужений або лінійний ланцюг алкільної групи, що містить від 1 до 5 атомів карбону, такий як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, пентил, тощо. c. "C1-C5алкокси" означає розгалужений або лінійний ланцюг алкокси групи, що містить від 1 до 5 атомів карбону, такий як метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, пентокси, тощо. d. "C3-C6циклоалкіл" означає неароматичне кільце, яке є повністю гідрогенованим та існує як одинарне кільце. Приклади таких карбоциклічних кілець включають циклопропіл, циклобутил, циклопентил та циклогексил. e. "5-10-членний гетероарил" означає карбоциклічну ароматичну систему, що загально має від 5 до 10 атомів та, що містить один, два, три або чотирі гетероатоми, незалежно вибрані з оксисену, нітрогену та сульфуру, та, що має одне, два або три кільця, де такі кільця можуть бути анельовані. Термін "анельовані" означає, що друге кільце є присутнє (тобто приєднане або утворене) при наявності двох суміжних атомів загальних (тобто, спільних) з першим кільцем. Термін "анельоване" є еквівалентним терміну "конденсоване". Термін "гетероарил" включає ароматичні радикали, такі як піридин, піридазин, піразин, піримідин, імідазо[1,2-a]піридин, імідазо[1,5-a]піридин, [1,2,4]триазолo[4,3-a]піридин, [1,2,4]триазолo[4,3-b]піридазин, [1,2,4]триазолo[4,3-a]піримідин, та [1,2,4]триазолo[1,5-a]піридин. f. "Терапевтично ефективна кількість" означає кількість сполуки за представленим винаходом, що (i) лікує або попереджує певні захворювання, стани або розлади, (ii) послаблює, покращує або усуває один або більше симптомів певного захворювання, стану або розладу, або (iii) попереджує чи призупиняє виникнення одного або більше симптомів певного захворювання, стану або розладу, описаного тут. g. "Пацієнт" стосується теплокровних тварин, таких як, наприклад морські свинки, миші, щури, пісчанки, коти, кролики, собаки, мавпи, шимпанзе та людей. h. "Лікувати" включає як превентивне, тобто профілактичне, так і паліативне лікування, тобто полегшення, зниження або уповільнення прогресування захворювання (або стану) у пацієнта або будь-якого пошкодження тканини, пов'язаного із захворюванням. i. Терміни "модульований", "модулюючий", або "модулює(ють)”, як використано тут, якщо не зазначено іншого, стосуються активації рецептора, кон'югованого з G-протеїном, GPR119 сполуками за представленим винаходом. j. "Фармацевтично прийнятний" означає, що речовина або композиція повинні бути хімічно та/або токсикологічно сумісними з іншими інгредієнтами, які містить рецептура, та/або зі ссавцями, яких лікують за допомогою їх. k. "Солі" вживається стосовно фармацевтично прийнятних солей та солей придатних для застосування в промислових процесах, таких як виробництво сполуки. l. "Фармацевтично прийнятні солі" вживається стосовно або "фармацевтично прийнятних кислотних адитивних солей" або "фармацевтично прийнятних основних адитивних солей" в залежності від фактичної структури сполуки. m. "Фармацевтично прийнятні кислотні адитивні солі" поширюється на будь-яку нетоксичну органічну чи неорганічну кислотну адитивну сіль основної сполуки за формулою І або будь-який її напівпродукт. Приклади неорганічних кислот, що утворюють прийняттні солі, включають гідрогенхлоридну, гідрогенбромідну, сульфатну та фосфатну кислоти та кислотні солі металів, такі як натрію моногідрогенортофосфат та калію гідрогенсульфат. Приклади органічних кислот, які утворюють прийнятні солі включають моно-, ди- та трикарбонові кислоти. Ілюстрацією таких кислот є, наприклад, оцтова, гліколева, молочна, піровиноградна, малонова, бурштинова, глутарова, фумарова, малеїнова, винна, лимонна, аскорбінова, яблучна, гідроксияблучна, бензойна, гідроксибензойна, фенілоцтова, корична, саліцилова, 2-феноксибензойна, п-толуїлсульфонова кислота, та сульфонові кислоти, такі як метансульфонова кислота та 2-гідроксиетансульфонова кислота. Такі солі можуть існувати в або гідратованій або в значній мірі безводній формі. В основному, кислотні адитивні солі цих сполук є розчинними у воді та різних гідрофільних органічних розчинниках. n. "Фармацевтично прийнятні основні адитивні солі" поширюється на будь-яку нетоксичну органічну чи неорганічну основну адитивну сіль сполук за формулою І або будь-який її 5 UA 101110 C2 5 10 15 20 25 напівпродукт. Приклади основ, які утворюють прийнятні солі включають гідроксиди лужних металів або лужно-земельних металів, такі як гідроксиди натрію, калію, кальцію, магнію або барію; амоній, та аліфатичні, аліциклічні або ароматичні органічні аміни, такі як метиламін, диметиламін, триметиламін та піколін. o. "Сполука формули (І)”, "сполуки за винаходом" та "сполуки" використовують взаємозамінно по всій заявці та слід розглядати як синоніми. p. "Ізомер" означає "стереоізомер" та "геометричний ізомер ” як визначено нижче. "Стереоізомер" означає сполуки, що мають один або більше хіральних центрів і кожен центр може існувати в R або S конфігурації. Стереоізомери включають всі діастереомерні, енантіомерні та епімерні форми, а також рацемати та їх суміші. "Геометричні ізомери" означає сполуки, що можуть існувати в цис, транс, анті, син, напроти (E), та разом (Z) формах, а також їх суміші. Частина зі сполук формули (I) можуть існувати як геометричні ізомери. Сполуки формули (I) можуть мати один або більше асиметричних центрів, таким чином, існуючи як дві або більше стереоізомерні форми. Представлений винахід включає всі індивідуальні стереоізомери та геометричні ізомери сполуки формули (I) та їх суміші. Індивідуальні енантіомери можуть бути одержані способом хірального розділення або використовуючи релевантний енантімер в синтезі. До того ж, сполуки за представленим винаходом можуть існувати в несольватованих, а також сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол, тощо. Зазвичай, сольватовані форми розглядають еквівалентими до несольватованих форм за задумом представленого винаходу. Сполуки можуть також існувати в одному або більше кристалічних станів, тобто як співкристали, поліморфи, або можуть існувати як амофні тверді речовини. Всі такі форми включені у винахід та формулу винаходу. В одному з втілень в сполуках за даним винаходом, (R3)m 30 35 Xє ; Y є O; m є 1 або 2; 6 Z є –C(O)-O-R ; 1 R є гідрогеном; 2a R є гідрогеном; 2b R є гідрогеном; та 3 кожен R незалежно є гідрокси, галогеном, ціано, CF3, OCF3, C1-C4алкілом, C1-C4алкокси, 7 8 9 8 9 SO2-R , -P(O)(OR )(OR ), -CO-NR R ,або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбона 4a згаданої гетероарильної групи необов'язково має замісник R або атом нітрогену згаданої 4b гетероарильної групи необов'язково має замісник R . В іншому втіленні в сполуках за даним винаходом, (R3)m 40 45 Xє ; Y є O; m є 1 або 2; 6 Z є –C(O)-O-R ; 1 R є гідроген; 2a R є флуор; 2b R є гідроген; та 3 кожен R незалежно є гідрокси, галогеном, ціано, CF3, OCF3, C1-C4алкілом, C1-C4алкокси, 7 8 9 8 9 SO2-R , -P(O)(OR )(OR ), -CO-NR R ,або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом карбону 6 UA 101110 C24a 5 згаданої гетероарильної групи необов'язково має замісник R або атом нітрогену згаданої 4b гетероарильної групинеобов'язково має замісник R . 3 В іншому втіленні в сполуках за даним винаходом, кожен R незалежно є флуором, 8 9 7 метилом, ціано, -C(O)NR R , -SO2-R , тетразолом, піразолом, імідазолом або триазолом. 3 В іншому втіленні в сполуках за даним винаходом, кожен R незалежно є флуором, N 8 9 7 N N N R4b , N N R4b N N метилом, ціано, -C(O)NR R , -SO2-R , , або та 4a 4b R і R кожен незалежно є гідрогеном, C1-C4алкілом або C2-C4алкіл-OH. В іншому втіленні в сполуках за даним винаходом, (R3)n R4a N N N N ; N CH3 10 15 20 Xє ; Y є O або NH; 6 Z є –C(O)-O-R ; n є 0 або 1; 1 R є гідрогеном; 2a R є гідрогеном; 2b R є гідрогеном; та 3 R , якщо присутній, є C1-C4алкілом або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом 4a карбону згаданої гетероарильної групи необов'язково має замісник R або атом нітрогену 4b згаданої гетероарильної групи необов'язково має замісник R . В іншому втіленні в сполуках за даним винаходом, (R3)n N CH3 25 30 35 Xє ; Y є O або NH; 6 Z є –C(O)-O-R ; n є 0 або 1; 1 R є гідрогеном; 2a R є флуором; 2b R є гідрогеном; та 3 R , якщо присутній, є C1-C4алкілом або 5-6-членною гетероарильною групою, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з оксигену або нітрогену, де атом 4a карбону згаданої гетероарильної групи необов'язково має замісник R або атом нітрогену 4b згаданої гетероарильної групи необов'язково має замісник R . 6 В іншому втіленні в сполуках за даним винаходом, R є ізопропілом або 1метилциклопропілом. В іншому втіленні йдеться про композиції за даним винаходом, більш того композиція включає щонайменш один додатковий фармацевтичний агент, вибраний з групи, що складається з агентів проти ожиріння та антидіабетичних агентів. Приклади агентів проти ожиріння включають дірлотапід, мітратапід, імплітапід, R56918 (CAS No. 403987), CAS No. 7 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 913541-47-6, лоркасерин, цетилістат, PYY3-36, налтрексон, олеоїл-естрон, обінопептид, прамлінтид, тезофензин, лептин, ліраглутид, бромокріптин, орлістат, ексенатид, AOD-9604 (CAS No. 221231-10-3) та сибутрамін. Приклади антидіабетичних агентів включають метформін, ацетогексамід, хлорпропамід, діабінез, глібенкламід, гліпізид, глібурид, глімепірид, гліклазид, гліпентид, гліквідон, глізоламід, толазамід, толбутамід, тендамістат, трестатін, акарбоза, адипозин, каміглібоз, еміглітат, міглітол, воглібоз, прадиміцин-Q, сальбостатин, балаглітазон, циглітазон, дарглітазон, енглітазон, ізаглітазон, піоглітазон, розіглітазон, троглітазон, ексендин3, ексендин-4, тродусквемін, резерватрол, екстракт морської губки hyrtios, сітагліптин, вілдагліптин, алогліптин та саксагліптин. В іншому втіленні йдеться про спосіб за даним винаходом, сполуки або композиції за даним винаходом можуть вводити в ефективних кількостях для лікування станів, вибраних з групи, що складається з гіперліпідемії, діабету типу І, цукрового діабету типу ІІ, ідіопатичного діабету типу І (тип Ib), прихований аутоімуний діабет у дорослих (LADA), діабет типу ІІ з раннім початком (EOD), атиповий діабет з початком у молодому віці (YOAD), діабет молоді з початком у зрілому віці (MODY), діабет, пов'язаний з недостатністю харчування, гестаційний діабет, коронарна хвороба серця, ішемічний інсульт, рестеноз після судинної пластики, захворювання периферійних судин, переміжна кульгавість, інфаркт міокарду (наприклад, некроз та апоптоз), дисліпідемія, ліпемія після їжі, стани з пониженою толерантністю до глюкози (IGT), стани з пониженим рівнем глюкози в плазмі натщесерце, метаболічний ацедоз, кетоз, артрит, ожиріння, остеопороз, гіпертензія, застійна серцева недостатність, гіпертрофія лівого шлуночка, захворювання периферійних артерій, діабетична ретинопатія, дегенерація жовтого пятна, катаракта, діабетична нефропатія, гломерулосклероз, хронічна ниркова недостатність, діабетична нейропатія, метаболічний синдром, синдром X, перед менструальний синдром, коронарна хвороба серця, стенокардія, тромбоз, атеросклероз, інфаркт міокарду, транзиторна ішемічна атака, інсульт, судинний рестеноз, гіперглікемія, гіперінсулінемія, гіперліпідемія, гіпертригліцеридемія, несприйняття інсуліну, знижений метаболізм глюкози, стани зі зниженою толерантністю до глюкози, стани зі зниженим рівнем глюкози в плазмі натщесерце, ожиріння, еректильна дисфункція, розлади шкіри та сполучної тканини, діабетична стопа та виразковий коліт, ендотеліальна дисфункція та знижена пластичніст судин, гіпер апо В ліпопротеїнемія, хвороба Альцгеймера, шизофренія та знижена пізнавальна здатність, запальні захворювання кишечника, неспецифічний виразковий коліт, хвороба Крона, синдром подразненого кишечника. В наступному втіленні, спосіб до того ж включає введення другої композиції, що містить щонайменш один додатковий фармацевтичний агент, вибраний з групи, що складається з агенту проти ожиріння та антидіабетичного агенту, та щонайменш одного фармацевтично прийнятного наповнювача. Цей спосіб можуть застосовувати для введення композицій одночасно або послідовно та в будь-якому порядку. В ще іншому втіленні сполуки за даним винаходом є придатними у виробництві лікарських засобів для лікування захворювань, станів або розладів, що модулюють активність рецептора, кон'югованого з G-протеїном, GPR119. Більш того, сполуки є придатними у виготовленні лікарських засобів для лікування діабету або захворювань, пов'язаних зі згаданим діабетом. Синтез Для ілюстрації задумів, зображені нижче схеми реакцій передбачають можливі шляхи синтезу сполук за даним винаходом, а також ключових проміжних сполук. Для більш детального опису окремих стадій реакції дивись розділ приклади нижче. Кваліфікованим фахівцям в даній галузі буде зрозуміло, що інші синтетичні шляхи можуть бути використані для синтезу сполук за винаходом. Хоча конкретні вихідні матеріали та реагенти зображені в схемах та обговорюються нижче, інші вихідні матеріали та реагенти можуть бути легко замінені, щоб забезпечити різноманітність похідних та/або умов реакцій. До того ж, велика кількість сполук, що виготовляють за способами, описаними нижче, може бути далі модифікована в аспекті даного розкриття, використовуючи традиційну хімію добре відому кваліфікованому фахівцю в даній галузі з рівня техніки. Сполуки за винаходом можуть бути синтезовані синтетичними шляхами, що включають процеси аналогічні до добре відомих з рівня техніки в хімії, особливо в аспекті опису, включеного сюди. Вихідні матеріали зазвичай є доступними з комерційних джерел, таких як Aldrich Chemicals (Milwaukee, WI) або легко одержуються, використовуючи способи, відомі кваліфіковагому фахівцю в даній галузі з рівня техніки (наприклад, одержані за способами в цілому описаними в Louis F. Fieser та Mary Fieser, Reагенти for Organic Synthesis, v. 1-19, Wiley, New York (1967-1999 ed.), або Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. SpringerVerlag, Berlin, включаючи доповнення (також доступними через Beilstein онлайн базу даних). 8 UA 101110 C2 5 Сполуки формули (I) можуть бути одержані, використовуючи способи аналогічно відомим з рівня техніки для виготовлення етерів. Увагу читачів звертаємо на посібники, такі як: 1) Hughes, D. L.; Organic Reactions 1992, 42 Hoboken, NJ, United States; 2) Tikad, A.; Routier, S.; Akssira, M.; Leger, J.-M.l; Jarry, C.; Guillaumet, G. Synlett 2006, 12, 1938-42; та 3) Loksha, Y. M.; Globisch, D.; Pedersen, E. B.; La Colla, P.; Collu, G.; Loddo, R. J. Het. Chem. 2008, 45, 1161-6, які описують такі реакції детально. Схема 1 Стадія 2 Стадія 1 Стадія 3 Стадія 4 Стадія 5 E Стадія 6 Стадія 9 Стадія 7 L Стадія 10 Стадія 8 Стадія 11 10 2b Сполуки формули (I), де R є H, можуть бути одержані як показано на схемі 1. На стадії 1, сполуки формули C можуть бути одержані реакцією конденсації сполук формули A та комерційної сполуки B (Sigma-Aldrich) в різноманітних розчинниках, включаючи, але не обмежуючись, етанол, толуол та ацетонітрил в температурному діапазоні від 22ºC до 130ºC в 9 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 залежності від розчинника, що використовується, протягом періоду від 1 до 72 годин. У випадку, коли сполуки формули A є солі гідрогенхлориду або трифлуороцтової кислоти, основний модифікатор, такий як натрію ацетат або натрію бікарбонат, можуть додавати в кількості від одного до трьох еквівалентів для нейтралізації солі. Реакцію можуть проводити в полярних протонних розчинниках, таких як метанол та етанол, в температурному діапазоні від 22ºC до 85ºC. Типові умови для цього перетворення включають використання 3 еквівалентів натрію ацетату в етанолі нагріванням при 85ºC протягом 3 годин. Сполуки формули A можуть бути одержані за чотирьохстадійною методикою, починаючи із заміщеного або незаміщеного 4-піперидинону гідрогенхлоридних солей (J. Med. Chem. 2004, 47, 2180). По-перше, ці солі обробляють відповідним алкілхлорформіатом або біс(алкіл)дикарбонатом в присутності надлишку основи для утворення відповідного алкілкарбамату. Кетонну групу потім конденсують з трет-бутоксикарбоніл гідразидом для утворення відповідної похідної, захищеної N-(трет-бутокси)карбоніл (BOC). Далі відновлюють до відповідної BOC захищеної похідної гідразину, застосовуючи відновлюючі агенти, такі як натрію ціаноборгідрид або натрію триацетоксиборгідрид. В заключення N-(трет-бутокси)карбонільну групу знімають за кислих умов, таких як в присутності трифлуороцтової кислоти або гідрогенхлоридної кисоти, щоб одержати сполуки формули A, які, зазвичай, виділяють та застосовують як відповідні солі (наприклад, дигідрохлоридна сіль). На стадії 2, сполуки формули D можуть бути одержані зі сполуки формули C через утворення проміжних солей діазонію за реакцією Зендмеєра (Sandmeyer) (Comp. Org. Synth., 1991, 6, 203). Ці солі можуть бути одержані діазотуванням сполуки формули C з нітритом натрію та водними розчинами кислот, таких як гідрогенхлоридна, гідрогенбромідна, сульфатна, нітратна, фосфатна та оцтова самостійно або в комбінаціях. Дану реакцію зазвичай виконують у воді при температурі від 0ºC до 100ºC. Альтернативно, безводні умови можуть використовувати при застосуванні алкілнітритів, таких як трет-бутилнітрит, з розчинниками, такими як ацетонітрил (J. Med. Chem. 2006, 49, 1562) в температурному діапазоні від 0ºC до 95ºC. Ці проміжні сполуки діазонію потім можуть реагувати з солями купруму, такими як купруму (ІІ) бромід, купруму (І) бромід, або з трибромметаном з утворенням сполук формули D. Типові умови для даного перетворення включають використання трет-бутилнітриту, купруму (II) броміду в ацетонітрилі при 65ºC протягом 30 хвилин. На стадії 3, сполуки формули E можуть одержувати зі сполук формули D, застосовуючи відновлюючі агенти, такі як літію алюмогідрид, натрію боргідрид, літію боргідрид, борандиметилсульфід, боран-тетрагідрофуран в полярних апротонних розчинниках, таких як тетрагідрофуран, діетиловий етер, 1,4-діоксан або 1,2-диметоксиетан в температурному діапазоні від 0ºC до 110ºC протягом 1 до 24 годин. Типові умови включають застосування боран-диметилсульфіду в тетрагідрофурані при 70ºC протягом 14 годин. Для того щоб одержати сполуки формули F зі сполук формули E, необхідно ввести ціано групу (Стадія 4). Це можна досягнути застосовуючи ряд умов. За одним способом введення ціано групи може відбуватисяз використаннямсолі купруму, такої як купруму ціанід в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), N-метилпіролідинон (N-МП), N, N-диметилацетамід (ДМА) в температурному діапазоні від 22ºC до 200ºC протягом 1 до 24 годин. Нагрівання купруму ціаніду в N, N-диметилформаміді при 165ºC протягом 5 годин є стандартним протоколом для даного перетворення. Альтернативно на стадії 4, ціанідні солі лужних металів, такі як калію або натрію ціанід, можуть використовувати в кон'югації з каталізаторами, такими як 18-краун-6 (US2005020564) та/або тетрабутиламонію бромідом (J. Med. Chem. 2003, 46, 1144) в полярних апротонних розчинниках, таких як ацетонітрил та диметилсульфоксид, в температурному діапазоні від 22ºC до 100ºC для приєднання ціаногрупи до цього темплату. На завершення, використання каталізу металами є загальним для перетворення, зображеного на стадії 4. Взагалі ціанідні солі, використані в каталітичних методиках, включають цинку ціанід, купруму ціанід, натрію ціанід та калію гексаціаноферат (II). Металічні каталізатори можуть бути мідними каталізаторами, такими як купруму йодид, та/або паладієвими каталізаторами, такими як тріс(дибензиліденацетон)дипаладію (Pd 2(dba)3), паладію тетра(трифенілфосфін) (Pd(PPh3)4), або дихлоро(дифенілфосфінфероцен)-паладію (Pd(dppf)Cl2). Дані каталізатори можуть застосовувати самостійно або в будь-якій комбінації з будь-якими вищезазначеними ціанідними солями. До цих реакцій можуть додавати ліганди, такі як 1,1'-біс(дифенілфосфін)фероцен (dppf) або добавки металів, таких металів як цинк або купрум. Реакції проводять в полярних апротонних розчинниках, таких як N-МП, ДМФ, ДМА з або без води, як добавки. Реакції проводять в температурному діапазоні від 22ºC до 150ºC за традиційного нагрівання або нагрівання під дією мікрохвильового випромінення протягом 1 до 10 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 48 годин та може проводитись в запаяному або незапаяному сосуді. Типові умови для стадії 4 включають використання цинку ціаніду, Pd2(dba)3, dppf, та цинкового пилу в ДМА при нагріванні 120ºC під дією мікрохвильового випромінення протягом 1 години (J. Med. Chem. 2005, 48, 1132). 2a На стадії 5, сполуки формули G, де X, Z та R є такими, як визначено для сполук формули (I), можуть бути синтезовані зі сполук формули F за реакцією Міцунобу (Міцунобу). Реакція Міцунобу розглянута в літературі по синтезу (наприклад, Chem. Asian. J. 2007, 2, 1340; Eur. J. Org. Chem. 2004, 2763; S. Chem. Eur. J. 2004, 10, 3130), та багато протоколів синтезу, що наведені в цих оглядах, можуть бути використані. Використання протоколів реакції Міцунобу, застосовуючи азодикарбоксилати, такі як діетилазодикарбоксилат (DEAD), ди-трет-бутилазодикарбоксилат (TBAD), діізопропілазодикарбоксилат (DIAD) та реагенти фосфіну, такі як трифенілфосфін (PPh3), трибутилфосфін (PBu3) та трифенілфосфін на полімері (PS-PPh3), об'єднують зі сполукамиформули F та сполукамизагальної структури X-OH, де X є таким, як визначено для сполуки формули (I). Використані в даній реакції розчинники можуть включати апротонні розчинники, такі як толуол, бензол, ТГФ, 1,4-діоксан та ацетонітрил, в температурному діапазоні від 0ºC до 130ºC в залежності від розчинника та азодикарбоксилатів, що використовуються. Типовими умовами для цього перетворення є використання DEAD з PSPPh3 в 1,4-діоксані при 22ºC протягом 15 годин. 2a Альтернативою до реакції Міцунобу для одержання сполук формули G, де X, Z, та R є такими, як визначено для сполук формули (I), є перетворення сполук формули F у відповідні похідні метансульфонату або пара-толуїлсульфонату, використовуючи метансульфонілхлорид або пара-толуїлсульфонілхлорид, відповідно, в присутності основи, такої як триетиламін або піридин. Проміжні сульфонатні естери потім сполучають зі сполуками загальної формули X-OH, де X є таким, як визначено для сполуки формули (I), в присутності основи, такої як калію карбонат, натрію гідрид або калію трет-бутоксид, для одержання сполук формули G, де X, Z та 2a R є такими як визначено для сполук формули I. 1 2a Сполуки формули K, де R є C1-C4алкілом або C3-C6циклоалкілом і X, Z та R є такими, як визначено для сполук формули I, можуть бути одержані зі сполукформули F в три стадії: 1) окиснення первинного спирту до відповідного альдегіду формули H (стадія 6, схема 1), 2) 1 реакція проміжного альдегіду формули H з металорганічним реагентом формули R M, де M є галогенідом літію (Li) або магнію (MgCl, MgBr або MgI) для одержання вторинного спирту 1 формули J, де R є C1-C4алкілом або C3-C6циклоалкілом (стадія 7), та 3) реакція вторинного спирту формули J з фенолом формули X-OH, де X є таким, як визначено для сполук формули I, за умовами реакції Міцунобу (стадія 8). На стадії (схема 1), сполуки формули H можуть утворюватися за методикою окиснення, що включає застосування 1-20 еквівалентів активованого мангану діоксиду в розчинниках, включаючи, але не обмежуючись цим, дихлорметан, ацетонітрил, гексан або ацетон самостійно або в комбінаціях протягом 1 до 72 годин при 22ºC до 80ºC. Альтернативно, дане окиснення можуть проводити з 1-3 еквівалентами трихлорізоціансечової кислоти в присутності від 0,1 до 1 еквіваленту 2,2,6,6-тетраметилпіперидин-1-оксилу (TEMПO) в дихлорметані або хлороформі в температурному діапазоні від 0ºC до 22ºC протягом 0,1 до 12 годин. Типовими умовами для даного перетворення є використання трихлорізоціансечової кислоти в присутності 0,1 еквіваленту TEMПO в дихлорметані при 22ºC протягом 1 години. 5 Одержання сполуки формули I, де Y є NR , також показано на схемі 1. Сполуки формули L, 2a 5 де X, Z, R і R є такими, як визначено для сполук формули I можуть бути одержані з проміжної 5 5 сполуки формули H (схема 1) реакцією з аміносполукою формули X-NH-R , де X і R є такими, як визначено для сполук формули I, за умов відновного амінування (стадія 9) (J. Org. Chem., 1 1996, 61, 3849; Org. React. 2002, 59, 1). Подібні сполуки формули N, де R є C1-C4алкілом або 2a 5 C3-C6циклоалкілом та X, Z, R і R є такими, як визначено для сполук формули I, можуть 1 одержувати в дві стадії з проміжної сполуки формули J, де R є C1-C4алкілом або C3C6циклоалкілом, 1) окисненням відповідного кетону формули M (стадія 10), і 2) реакцією кетону 5 5 формули M з аміносполукою формули X-NH-R , де X і R є такими, як визначено для сполук формули I, за умов відновного амінування (стадія 11). Альтернативно, сполуки формули L і 5 5 формули N, де R є C1-C4алкілом можуть одержувати з відповідної сполуки формули L, де R є 5 H, або відповідної сполуки формули N, де R є H, алкілуванням галогеналкілом формули (C1C4)-Cl, (C1-C4)-Br або (C1-C4)-I в присутності основи. 5 2b Сполуки формули I, де Y є CHR і R є гідрогеном можуть одержувати як показано на 2a схемах 2 і 3. Сполуки формули R, де X, Z і R є такими, як визначено для сполук формули I, можуть одержувати як показано на схемі 2. Схема 2 11 UA 101110 C2 Стадія 1 Стадія 2 Стадія 3 5 10 15 20 25 На стадії 1 схеми 2, сполуки формули O можуть утворюавтися з альдегідів формули H (дивись також схему 1) із застосуванням або диметил(діазометил)-фосфонату або диметил-1діазо-2-оксопропілфосфонату та основ, таких як калію карбонат або калію трет-бутоксид, в розчинниках, включаючи метанол, етанол або тетрагідрофуран, в температурному діапазоні від -78ºC до 22ºC протягом 0.1 до 24 годин. Типові умови для даного перетворення включають застосування диметил-1-діазо-2-оксопропілфосфонату та 2 еквівалентів калію карбонату в метанолі при 22ºC протягом 0.75 години. На стадії 2, сполуки формули Q можуть утворюавтися зі сполуки формули O за методикою сполучення Соногашира (Sonagashira), що каталізується металом, зі сполуками загальної структури X-P, де X є таким, як визначено для сполук формули I та P є галоген або трифлуорметсульфонат (трифлат). Реакція Соногашира в значній мірі розглянута (Chem. Rev. 2007, 107, 874; Angew. Chem. Int. Ed. 2007, 46, 834; Angew. Chem. Int. Ed. 2008, 47, 6954), та велика кількість протоколів синтезу, наведених в цих оглядах, може бути використана для синтезу сполуки формули Q. Зазвичай, в даній реакції застосовують метали як каталізатори, які можуть бути мідними каталізаторами, такими як купруму йодид та/або паладієвими каталізаторами, такими як Pd2(dba)3, Pd(PPh3)4, Pd(dppf)Cl2 або Pd(PPh3)2Cl2. Ці каталізатори можуть використовувати самостійно або в будь-якій комбінації. Зазвичай в даній реакції використовують основні добавки, які можуть включати амінні основи, такі як діетиламін, триетиламін, діізопропілетиламін або піролідин або неорганічні основи, такі як калію карбонат або калію флуорид. Реакції виконують в розчинниках, таких як дихлорметан, хлороформ, ацетонітрил, ДМФ, толуол або 1,4-діоксан з або без води, як добавки. Реакцію проводять в температурному діапазоні від 0ºC до 150ºC в залежності відрозчинника протягом часового діапазону від 0.1 до 48 годин. Типові умови для даного перетворення включають використання CuI та Pd(PPh3)2Cl2 в ДМФ при 90ºC протягом 2 годин. 2a На завершення, на стадії 3 сполуки формули R, де X, Z і R є такими, як визначено для сполук формули I, можуть утворюавтися зі сполуки формули Q гідрогенізацією в присутності каталізаторів – перехідних металів. Загалом каталізатори включають застосування 5-20 % паладію на вугіллі або 5-20 % паладію гідроксиду на вугіллі. Дані реакції можуть проводити в 12 UA 101110 C2 5 10 шейкерному обладнанні компанії Parr або в проточному реакторі для гідрогенізації компании H2 Cube (ThalesNano, U.K.) під тиском гідрогену в діапазоні від 1 до 50 фунт/дюйм в полярному розчиннику, такому як тетрагідрофуран, етилацетат, метанол або етанол при температурах від 22ºC до 50ºC протягом часового діапазону від 0.1 до 24 годин. Типові умови для стадії 3 включають використання сполуки формули Q в етилацетаті при швидкості потоку 1 мл/хв через картридж 10 % паладію на вугіллі в H-Cube проточному апаратному наборі при "заповненому гідрогеном" протіканні. 2a 5 Схема 3 показує способи одержання сполуки формули W, де X, Z, R і R є такими, як визначено для сполук формули I. Схема 3 Стадія 5 Стадія 1 Стадія 3 Стадія 4 Стадія 2 15 20 25 30 На стадії 1 схеми 3, сполуки формули F (дивись також схему 2) можуть обробляти реагентами, такими як фосфору трибромід або карбону тетрабромід, та трифенілфосфін, щоб одержати сполуки формули S. На стадії 2, сполуки формули S далі можуть реагувати з трифенілфосфіном в розчинниках, таких як дихлорметан, хлороформ, толуол, бензол, тетрагідрофуран (ТГФ) або ацетонітрил, щоб одержати солі трифенілфосфонію формули T. 5 Солі формули T, далі сполучають з карбонільними сполуками формули U, де X і R є такими, як визначено для сполук формули I, в присутності основ, таких як н-бутиллітій, натрію біс(триметилсиліл)амід, літію біс(триметилсиліл)амід, калію біс(триметилсиліл)амід або літію діізопропіламід в розчинниках, таких як ТГФ, діетиловий етер або 1,4-діоксан, щоб одержати алкенові сполуки формули V, які зазвичай виділяють як суміш E та Z геометричних ізомерів (стадія 3). Дану реакцію, загалом відому як реакцію олефінізації Віттіга (Wittig), в значній мірі розглянуто в літературі (Chem. Rev. 1989, 89, 863; Modern Carbonyl Olefination 2004, 1-17; Liebigs Ann.Chem. 1997, 1283). 2a 5 На стадії 4, сполуки формули W, де X, Z, R і R є такими, як визначено для сполук формули I, утворюються зі сполук формули V гідрогенізацією в присутності каталізаторів – перехідних металів. Загалом каталізатори включають викорстання 5-20 % паладію на вугіллі або 5-20 % паладію гідроксиду на вугіллі. Дані реакції можуть проводити подібним способом як описано для стадії 3 схеми 2. 13 UA 101110 C2 2a 5 10 15 20 25 30 35 40 Альтернативно, сполуки формули W, де X, Z, і R є такими, як визначено для сполук формули I, можуть одержувати з альдегідів формули H за реакцією Віттіга з солями трифенілфосфонію формули AA (стадія 5, схема 3). Як і на стадії 3, за даною реакцією одержують алкенільні сполуки формули V, які знову, зазвичай, виділяють як суміш E та Z 2a 5 геометричних ізомерів, та можуть перетворювати в сполуки формули W, де X, Z, R і R є такими, як визначено для сполук формули I, гідрогенезацією. Солі формули AA одержують подібним способом до того, що використовували для одержання солей формули T перетворенням відповідного спирту у бромід з подальшою реакцією з трифенілфосфіном. 1 2a Сполуки формули BB показані нижче, де X, Z, R і R є такими, як визначено для сполук формули I, можуть одержувати з вторинних спиртів формули J (дивись схему 2) або кетонів формули M (дивись схему 2) послідовністю реакцій подібних до тих, що показані на схемі 3. Перетворення сполук формули J у відповідні броміди, з наступною олефінізацією за Віттігом з альдегідами загальної формули X-CHO, де X є таким, як визначено для сполук формули I, забезпечує одержання алкенів формули CC. Алкени формули CC також можуть одержувати за + реакцією Віттіга з кетонів формули M зі солями загальної структури X-CH2-PPh3 Br . Алкени 1 2a формули CC далі перетворюють в сполуки формули BB, де X, Z, R і R є такими, як визначено для сполук формули I, гідрогенізацією. В певних окремих випадках можливо змінити порядок стадій, показаних на схемах 1, 2 та 3. Наприклад, на схемі 1, іноді можливо вводити ціаногрупу в піразольне кільце на останній стадії, тобто, міняючи порядок, за яким виконують стадії 4 та 5. Також, в певних випадках, більш 3 3 прийнятним є пізніше введення або заміна замісників R на групу X (де R і X є такими, як 3 визначено для сполук формули I) в синтезі, як раз на останній стадії. Наприклад, коли R є 7 7 SO2R , SO2R група може бути утворена на останній стадії окисненням відповідної сполуки, яка 7 має замісник загальної формули S-R . 2a 2b Сполуки формули I, де R і R є флуор, можуть бути одержані відповідно до послідовностей аналогічних тим, що показані на схемах 1, 2 і 3, виходячи з 1,1диметилетилового естеру 3,3-дифлуор-4,4-дигідрокси-1-піперидинкарбонової кислоти (WO 2008121687). В способі подібному до того, що описаний для одержання проміжних сполук формули A на схемі 1, дану речовину можуть перетворити в похідні гідразину формули DD, які далі застосовують подібно до проміжних сполук формули A на схемі 1 для одержання сполуки 2a 2b формули I, де R і R є флуором. Як безсумнівно є очевидним для кваліфікованого фахівця в даній галузі з рівня техніки, захист віддаленої функціональної групи (наприклад, первинний або вторинний амін) проміжних сполук може бути необхідним. Необхідність такого захисту буде змінюватись в залежності від природи віддаленої функціональної групи та умов способів одержання. Прийнятні аміно-захисні групи (NH-Pg) включають ацетил, трифлуорацетил, трет-бутоксикарбоніл (BOC), бензилоксикарбоніл (CBZ) та 9-флуорметиленоксикарбоніл (Fmoc). Подібно щодо "гідроксизахисної групи", яка є замісником при гідрокси групі, що блокує або захищає гідрокси функціональну групу. Прийнятні гідрокси- захисні групи (O-Pg) включають, наприклад аліл, ацетил, силіл, бензил, пара-метоксибензилl, тритіл, тощо. Необхідність такого захисту легко 14 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначить кваліфікований фахівець в даній галузі. Для загального опису захисних груп та їх застосування, дивись T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991. Як зазначено вище, деякі зі сполук за даним винаходом є кислотними та утворюють солі з фармацевтично прийнятними катіонами. Деякі зі сполук за даним винаходом є основними та утворюють солі з фармацевтично прийнятними аніонами. Всі такі солі знаходяться в межах даного винаходу та можуть бути одержані стандартними способами, такими як сполучення кислотних та основних названих сполук, зазвичай в стехіометричному співвідношенні, у водному, неводному або частково водному середовищі, як відповідному. Солі знову одержують або фільтрацією, осадженням з розчинником, в якому дана сіль є нерозчинною, з наступною фільтрацією, випаровуванням розчинника, або у випадку водних розчинів, ліофілізацією, відповідно. Сполуки одержують в кристалічній формі відповідно до методик, відомих з рівня техніки, таких як розчинення у відповідному розчиннику(ах), таких як етанол, гексани або сумішей вода/етанол. Як зазначено вище, деякі сполуки існують як ізомери. Ці суміші ізомерів можуть бути розділені на їх індивідуальні ізомери ґрунтуючись на їх різниці в фізико-хімічних властивостях способами добре відомими кваліфікованому фахівцю в даній галузі з рівня техніки, такими як хроматографія та/або фракційна кристалізація. Енантіомери можуть бути розділені перетворенням суміші енетіомерів у суміш діастереомерів реакцією з відповідною оптично активною сполукою (наприклад, хіральною допоміжною, такою як хіральний спирт або хлорангідридот кислоти Мошера (Mosher)), розділенням діастереомерів та перетворенням (наприклад, гідролізом) індивідуальних діастереомерів до відповідних чистих енентіомерів. Енентіомери також можуть бути розділені застосуванням хоральної ВЕРХ колонки. Альтернативно, конкретні стереоізомери можуть синтезувати, використовуючи оптично активну вихідну речовину асиметричним синтезом, використовуючи оптично активні реагенти, субстрати, каталізатори або розчинники, або перетворенням одного стереоізомеру в інший асиметричною трансформацією Представлений винахід також охоплює, мічені ізотопами сполуки за представленим винаходом, які є ідентичними до перелічених тут, але фактично, в яких один або більше атомів замінені на атом, що має атомну масу або масовий номер, який відрізняється від атомної маси або масового номеру зазвичай знайденого в природі. Приклади ізотопів, що можуть бути введені в сполуки за винаходом включають ізотопи гідрогену, карбону, нітрогену, оксигену, 2 3 11 13 14 13 15 15 17 18 фосфору, сульфуру, флуору, йоду та хлору, такі як H, H, C, C, C, N, N, O, O, O, 31 32 35 18 123 125 36 P, P, S, F, I, I та Cl, відповідно. 3 14 Певні мічені ізотопами сполуки за представленим винаходом (наприклад, мічені H і C) є корисними в аналізі сполуки та/або субстрату тканини. Певні мічені ізотопами ліганди, 14 35 125 включаючи тритій, C, S та I, могли б застосовувати в аналізі радіолігандного зв'язування. 3 14 Перевага надається міченим ізотопами тритію (тобто, H) і карбону-14 (тобто, C) через легкість їх одержання та здатність до виявлення. Більш того, заміщення важчими ізотопами, такими як 2 дейтерій (тобто, H) можуть давати певні терапевтичні переваги, що є результатом більш високої метаболічної стабільності (наприклад, підвищений in vivo період напіврозпаду або знижене необхідне дозування) і як наслідок може надатися перевага в деяких випадках. 15 13 11 18 Позитрон випромінюючі ізотопи, такі як O, N, C, і F є придатними для позитрон випромінюючих томографічних (PET) досліджень для вивчення зайнятості рецептора. Мічені ізотопами сполуки за представленим винаходом загалом можуть одержувати за наступними методиками, аналогічними до тих, що розкриті на схемах та/або в прикладах, наведених нижче, заміняючи немічений ізотопами реагент на мічений ізотопами реагент. Певні сполуки за представленим винаходом можуть існувати більш ніж в одній кристалічній формі (зазвичай згадують як "поліморфи"). Поліморфи можуть одержувати кристалізацією за різних умов, наприклад, застосовуючи різні розчинники або різні суміші розчинників для перекристалізації; кристалізацією при різних температурах; та/або різними способами охолодження, в діапазоні від дуже швидкого до дуже повільного охолодження під час кристалізації. Поліморфи також можуть одержувати нагріванням або плавленням сполуки за представленим винаходом з наступним поступовим або швидким охолодженням. Наявність полі морфів можуть визначати твердо фазною ЯМР спектроскопією, ІЧ спектроскопією, диференціально скануючою калориметрією, рентгенофазовим аналізом або такими іншими способами. Медичне застосування Сполуки за даним винаходом модулюють активність рецептору, кон'югованого з Gпротеїном, GPR119. По суті, згадані сполуки є придатними для профілактики та лікування 15 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювань, таких як діабет, при яких активність GPR119 сприяє патології або симптомам захворювання. Тому, інший аспект представленого винаходу включає спосіб лікування метаболічного захворювання та/або пов'язаного з метаболізмом розладу в особи, який включаєвведення особі, що потребує такого лікування, терапевтично ефективної кількостісполуки за винаходом, солі згаданої сполуки або фармацевтичної композиції, що містить таку сполуку. Метаболічні захворювання та пов'язані з метаболізмом розлади, вибрані з, але цим не обмежені, гіперліпідемії, діабету типу І, цукрового діабету типу ІІ, ідіопатичного діабету типу І (тип Ib), прихований аутоімуний діабет у дорослих (LADA), діабет типу ІІ з раннім початком (EOD), атиповий діабет з початком у молодому віці (YOAD), діабет молоді з початком у зрілому віці (MODY), діабет, пов'язаний з недостатністю харчування, гестаційний діабет, коронарна хвороба серця, ішемічний інсульт, рестеноз після судинної пластики, захворювання периферійних судин, переміжна кульгавість, інфаркт міокарду (наприклад, некроз та апоптоз), дисліпідемія, ліпемія після їжі, стани з пониженою толерантністю до глюкози (IGT), стани з пониженим рівнем глюкози в плазмі натщесерце, метаболічний ацедоз, кетоз, артрит, ожиріння, остеопороз, гіпертензія, застійна серцева недостатність, гіпертрофія лівого шлуночка, захворювання периферійних артерій, діабетична ретинопатія, дегенерація жовтого пятна, катаракта, діабетична нефропатія, гломерулосклероз, хронічна ниркова недостатність, діабетична нейропатія, метаболічний синдром, синдром X, перед менструальний синдром, коронарна хвороба серця, стенокардія, тромбоз, атеросклероз, інфаркт міокарду, транзиторна ішемічна атака, інсульт, судинний рестеноз, гіперглікемія, гіперінсулінемія, гіперліпідемія, гіпертригліцеридемія, несприйняття інсуліну, знижений метаболізм глюкози, стани зі зниженою толерантністю до глюкози, стани зі зниженим рівнем глюкози в плазмі натщесерце, ожиріння, еректильна дисфункція, розлади шкіри та сполучної тканини, виразки стопи, ендотеліальна дисфункція, гіпер апо В ліпопротеїнемія та знижена пластичніст судин. До того ж, сполуки можуть бути застосовані для лікування неврологічних розладів, таких як хвороба Альцгеймера, шизофренія та знижена пізнавальна здатність. Сполуки також будуть корисними при шлунковокишкових захворюваннях, таких як запальні захворювання кишечника, неспецифічний виразковий коліт, хвороба Крона, синдром подразненого кишечника, тощо. Як зазначалося вище, сполуки також можуть застосовувати для стимуляції втрати ваги у пацієнтів з ожирінням, особливо тих, хто страждає на діабет. Відповідно до вищезгаданого, представлений винахід, крім того, передбачає спосіб для попередження або покращення симптомів за будь-яким захворюванням або розладом, описаним вище, у суб'єкта, якщо на це є необхідність, спосіб який включає введення суб'єкту терапевтично ефективної кількості сполуки за представленим винаходом. Наступні аспекти винаходу включають виготовлення лікарських засобів для лікування діабету та пов'язаних з ним супроводжуючих захворювань. З метою продемонструвати описані вище терапевтичні властивості, сполуки необхідно вводити в кількості достатній для модуляції активації G-протеїн кон'югованого рецептору GPR119. Ця кількість може варіювати в залежності від особливостей захворювання/стану, пацієнта, окремої сполуки, що вводять, шляху введення, наявності інших нижченаведених хворобливих станів у пацієнта, тощо. Коли введення систематичне, сполука, як правило, демонструє свою ефективність в діапазоні дозування від близько 0,1 мг/кг/день до близько 100 мг/кг/день для будь-якого із захворювань або станів, наведених вище. Введення, яке повторюється щоденно, може бути бажаним та буде варіювати відповідно до станів окреслених вище. Сполуки за представленим винаходом можуть вводити низкою шляхів. Їх можуть вводити перорально. Сполуки також можуть вводити парентерально (тобто, підшкірно, внутрішньовенно, внутрішньом'язово, внутрішньочеревно, або внутрішньоорганно), ректально, або місцево. Спільне введення Сполуки за данним винаходом можуть також застосовувати в поєднанні з іншими фармацевтичними агентами для лікування захворювань, станів та/або розладів, описаних тут. Тому винахід також стосується способів лікування, що включають введення сполук за представленим винаходом в поєднанні з іншими фармацевтичними агентами. Прийнятні фармацевтичні агенти, що можуть застосовувати в поєднанні зі сполуками за представленим винаходом, включають агенти проти ожиріння (включаючи ті, що пригнічують апетит), антидіабетичні агенти, антигіперглікемічні агенти, агенти, що знижують рівень ліпідів, та антигіпертензивні агенти. Прийнятні антидіабетичні агенти включають інгібітор ацетил-CoA карбоксилази-2 (ACC-2), інгібітор діацилгліцеролу O-ацилтрансферази 1 (DGAT-1), інгібітор фосфодіестерази (PDE)-10, сульфонілсечовина (наприклад, ацетогексамід, хлорпропамід, діабінез, глібенкламід, гліпізид, 16 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 глібурид, глімепірид, гліклазид, гліпентид, гліквідон, глізоламід, толазамід, та толбутамід), мелглітинід, інгібітор α-амілази (наприклад, тендамістат, трестатин та AL-3688), інгібітор αглюкозид гідролази (наприклад, акарбоза), інгібітор α-глюкозидази (наприклад, адипозин, каміглібоз, еміглітат, міглітол, воглібоз, прадиміцин-Q, та сандостатин), агоніст PPARγ (наприклад, балаглітазон, циглітазон, дарглітазон, енглітазон, ізаглітазон, піоглітазон, розіглітазон та троглітазон), агоніст PPAR α/γ (наприклад, CLX-0940, GW-1536, GW-1929, GW2433, KRP-297, L-796449, LR-90, MK-0767 та SB-219994), бігуанід (наприклад, метформін), агоніст глюкагон-подібного пептиду 1 (GLP-1) (наприклад, ексендин-3 та ексендин-4), інгібітор протеїн тірозин фосфатази-1B (PTP-1B) (наприклад, тродусквемін, екстрат морської губки hyrtios, та сполуки розкриті Zhang, S., et al., Drug Discovery Today, 12(9/10), 373-381 (2007)), інгібітор SIRT-1 (наприклад, резерватол), інгібітор дипептидил пептидази IV (DPP-IV) (наприклад, сітагліптин, вілдагліптин, алогліптин та саксагліптин), стимулятор секреції інсуліну, інгібітор окиснення жирних кислот, антагоніст A2, інгібітор c-jun амінотермінальної кінази (JNK), інсулін, міметики інсуліну, інгібітор глікоген фосфорилази, агоніст рецептору VPAC2, та інгібітори SGLT2 (інгібітор натрій залежного транспортеру глюкози, такий як дапагліфлозин, тощо). Перевага надається наступним антидіабетичним агентам: метформіну та інгібіторам DPP-IV (наприклад, сітагліптину, вілдагліптину, алогліптину та саксагліптину). Прийнятні агенти проти ожиріння включають інгібітори 11-гідроксистероїд дегідрогенази-1 (11-HSD тип 1), інгібітор стеароїл-CoA десатурази-1 (SCD-1), агоністи MCR-4, агоністи холецистокініну-A (CCK-A), інгібітори пере-введення моноаміну (такі як сибутрамін), симпатоміметичні агенти, 3 адренергічні агоністи, агоністи допаміну (такі як бромокріптин), аналоги меланоцит стимулюючого гормону, агоністи 5HT2c, антагоністи меланін концентруючого гормону, лептин (OB протеїн), аналоги лептину, агоністи лептину, антагоністи галаніну, інгібітори ліпази (такі як тетрагідроліпстатин, тобто орлістат), агенти, що знижують апетит (такі як агоніст бомбезину), антагоністи нейропептиду-Y (наприклад, NPY Y5 антагоністи), PYY3-36 (включаючи їх аналоги), тироміметичні агенти, дегідроепіандростерон або його аналог, агоністи або антагоністи глюкокортикоїду, антагоністи орексину, агоністи глюкагон подібного пептиду-1, циліарні нейротрофічні фактори (такі як Axokine™ доступний від компанії Regeneron Pharmaceuticals, Inc., Tarrytown, NY та Procter & Gamble Company, Cincinnati, OH), інгібітори агути залежного протеїну (AGRP), антагоністи греліну, гістамін 3 антагоністи або оборотні агоністи, агоністи нейромедину U, інгібітори MTP/ApoB (наприклад, кишково-селективні MTP інгібітори, такі як дирлотапід), опіоїдний антагоніст, антагоніст орексину, тощо. Переважні агенти проти ожиріння для застосування в поєднанні зі сполуками за представленим винаходом включають кишково-селективні MTP інгібітори (наприклад, дирлотапід, мітратапід та імплітапід, R56918 (CAS No. 403987) та CAS No. 913541-47-6), агоністи CCKa (наприклад, N-бензил-2-[4-(1H-індол-3-ілметил)-5-оксо-1-феніл-4,5-дигідро2,3,6,10b-тетраазабензо[e]азулен-6-іл]-N-ізопропілацетамід, описаний в публікації PCT No. WO 2005/116034 або публікації US No. 2005-0267100 A1), агоністи 5HT2c (наприклад, лорказерин), агоніст MCR4 (наприклад, сполуки, описані в US 6,818,658), інгібітор ліпази (наприклад, цетилістат), PYY3-36 (як використано тут "PYY3-36" включає аналоги, такі як пегильований PYY3-36 наприклад, такий як описано в публікації US 2006/0178501), опіоїдні антагоністи (наприклад, налтрексон), олеоїл-естрон (CAS No. 180003-17-2), обінопептид (TM30338), прамлінтид (Симлін® (Symlin®)), тезофензин (NS2330), лептин, ліраглутид, бромокріптин, орлістат, ексенатид (Баєта® (Byetta®)), AOD-9604 (CAS No. 221231-10-3) та сибутрамін. Переважно, сполуки за представленим винаходом та комбіновані терапії вводять в поєднанні з вправами та чутливою дієтою. Всі зазначені вище патенти США та публікації входять тут до переліку посилань. Фармацевтичні рецептури Представлений винахід охоплює фармацевтичні композиції, які містять терапевтично ефективну кількість сполуки або її фармацевтично прийнятної солі в суміші з щонайменш одним фармацевтично прийнятним наповнювачем. Композиції включають ті, які є в формі придатній для перорального, місцевого та парентерального застосування, та можуть застосовуватися для лікування діабету та пов'язаних з ним станів, як описано вище. Композиції можуть розробляти для введення будь-яким з добрк відомих з рівня техніки шляхів, таких як підшкірний, інгаляційний, пероральний, місцевий, парентеральний, тощо. Композиції можуть існувати в будь-якій формі, відомій з рівня техніки, включаючи, але не обмежуючись цим, таблетки, капсули, порошки, гранули, таблетки для розсмоктування, або рідкі препарати, такі як пероральні або стерильні парентеральні розчини або суспензії. Таблетки та капсули для перорального введення можуть бути в одиничній дозованій представленій формі та можуть містити стандартні ексципієнти, такі як зв'язуючі агенти, 17 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 наприклад патоку, камедь, желатин, сорбітол, трагакантову камедь, або полівінилпіролідон; наповнювачі, наприклад лактозу, цукор, кукурудзяний крохмаль, кальцію фосфат, сорбітол або гліцин; лубриканти для таблетування, наприклад магнію стеарат, тальк, поліетиленгліколь або силікагель; розпушувачі, наприклад картопляний крохмаль; або прийнятні зволожуючі агенти, такі як натрію лаурилсульфат. Таблетки можуть покривати відповідно до способів добре відомих у звичайнійфармацевтичній практиці. Пероральні рідкі лікарські препарати можуть існувати в формі, наприклад, водних або олійних суспензій, розчинів, емульсій, сиропів або елексирів, або можутьбути представлені як сухий продукт, який розбавляється водою або іншим прийнятним розчинником перед вживанням. Такі рідкі лікарські препарати можуть містити стандартні добавки, такі як суспендуючі агенти, наприклад сорбітол, метилцелюлозу, сироп глюкози, желатин, гідроксиетилцелюлозу, карбоксиметилцелюлозу, гель стеарату алюмінію або гідрогенізований їстівний жир, емульгуючі агенти, наприклад лецитин, сорбітан моноолеат, або камедь; неводні розчинники (які можуть включати їстівні олії), наприклад мигдалева олія, олійні естери, такі як гліцеринові, пропілeнгліколеві, або етиловий спирт; консерванти, наприклад метил або пропіл пгідроксибензоат або сорбінова кислота, та, за бажанням, стандартний ароматизатор або барвник. Для парентерального введення, рідинні одиничні дозовані форми одержують, використовуючи сполуку та стерильну основу, перевага надається воді. Сполука, в залежності від основи та концентрації, що використовують, може бути або суспендована, або розчинена в основі або іншому прийнятному розчиннику. При виготовленні розчинів, сполука можуть розчиняти у воді для ін'єкцій та проводять стерилізуючу фільтрацію перед розливом у прийнятні флакони та ампули та запаюють. Переважно, агенти, такі як місцеві анестетики, консерванти та буферні агенти, тощо, можуть розчиняти в основі. Для покращення стабільності, композицію можуть заморожувати після розливу у флакони та воду видаляють в вакуумі. Сухий ліофілізований порошок далі запаюють у флаконі та супроводжують флаконом з водою для ін'єкцій, який можуть поставляти для відновлення до рідкої форми перед застосуванням. Парентеральні суспензії виготовляють, по суті, за таким же способом за виключенням того, що сполуку суспендують в флаконі замість розчинення та стерилізація не може виконуватись фільтрацією. Сполуку можуть стерилізувати, піддаючи її дії етилен оксиду перед суспендуванням в стерильній основі. Переважно, поверхнево-активну речовину (сурфактант) або зволожуючий агент включають в композицію для полегшення однорідного розапділення сполуки. Композиції можуть містити, наприклад, від близько 0,1 % до близько 99 % за масою, активної речовини, в залежності від способу введення. У випадках, коли композиції містять дозовані одиниці, кожна одиниця буде містити, наприклад, від близько 0,1 до 900 мг активного інгредієнту, більш типово від 1 мг до 250 мг. Сполуки за винаходом можуть бути сформульовані для введення будь-яким прийнятним шляхом для застосування в медицині або ветеринарії за аналогією з іншими антидіабетичними агентами. Такі способи є відомими з рівня техніки та підсумовані вище. Для більш детального обговорення стосовно виготовлення таких рецептур, звертаємо увагу читача на видання st Remington's Pharmaceutical Sciences, 21 Edition, by University of the Sciences in Philadelphia. Втілення за представленим винаходом проілюстровані наступними прикладами. Однак, зрозуміло, що втілення за винаходом не обмежуються конкретними деталями цих прикладів, так як інші відхилення будуть відомі або очевидні у світлі даного розкриття для кожного зі звичайних кваліфікованих спеціалістів в даній галузі з рівня техніки. Приклади Якщо не вказано інше, вихідні речовини загалом є доступними з комерційних джерел, таких як Aldrich Chemicals Co. (Milwaukee, WI), Lancaster Synthesis, Inc. (Windham, NH), Acros Organics (Fairlawn, NJ), Maybridge Chemical Company, Ltd. (Cornwall, England), Tyger Scientific (Princeton, NJ), та AstraZeneca Pharmaceuticals (London, England), Mallinckrodt Baker (Phillipsburg NJ); EMD (Gibbstown, NJ). Загальні експериментальні методики ЯМР спектри записували на Varian Unity™ 400 (DG400-5 датчик) або 500 (DG500-5 датчик – обидва є доступними від компанії Varian Inc., Palo Alto, CA) при кімнатній температурі, 400 МГц або 500 МГц, відповідно, для протонного аналізу. Хімічний зсув виражено в мільйонних частках (дельта) відносно до залишку розчинника як внутрішнього стандарту. Форми сигналу відмічають наступним чином: с, синглет; д, дублет; дд, дублет деблету; т, триплет; кв, квартет; м, мультиплет; шс, уширений синглет; 2с, два синглети. 18 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хімічно іонізаційні мас спектри при атмосферному тиску (АТХІ) одержували на спектрометрі Waters™ (Micromass ZMD, газ-носій: азот) (доступний від компанії Waters Corp., Milford, MA, USA) зі швидкістю потоку 0,3 мл/хвилину та, застосувуючи елюєнтну систему 50:50 вода/ацетонітрил. Електроспрей іонізаційні мас спектри (ЕС) одержували на рідинному хроматографі мас спектрометрі Waters™ (Micromass ZQ або ZMD прилад (газ-носій: азот) (Waters Corp., Milford, MA, USA) використовуючи градієнт 95:5-0:100 води в ацетонітрилі з додаванням 0.01 % мурашиної кислоти до кожного розчинника. В цих приладах виккористовували колонку Varian Polaris 5 C18-A20 × 2.0 мм (Varian Inc., Palo Alto, CA) зі швидкістю потоку 1 мл/хвилину для 3,75 хвилин або 2 мл/хвилину для 1,95 хвилини. Колоночну хроматографію виконували, використовуючи сілікагель з або колонками Flash 40 Biotage™ (ISC, Inc., Shelton, CT), або Biotage™ SNAP картриджем KPsil, або Redisep Rf сілікагелем (від Teledyne Isco Inc) під тиском азоту. Препаративну ВЕРХ виконували, використовуючи Waters FractionLynx систему з фотодіодною матрицею (Waters 2996) та схемами реєстрації мас спектрометру (Waters/Micromass ZQ). Аналітичну ВЕРХ роботу проводять на Waters 2795 Alliance ВЕРХ або Waters ACQUITY УЕРХ з фотодіодною матрицею, одиничною квадрупольною масою та схемами реєстрації розсіяння світла випаровувань. Концентрація в вакуумі стосується випаровування розчинника під зниженим тиском, використовуючи роторний випаровувач. Якщо не зазначено інше, хімічні реакції проводять при кімнатній температура (близько 23 градусів за Цельсієм). Також, якщо не зазначено інше, хімічні реакції проводять в атмосфері азоту. Фармакологічні дані Практичне застосування винаходу для лікування захворювань, що регулюються активацією агоністу G-протеїн кон'югованого рецептору GPR119 зі сполуками за винаходом, може бути підтвердженим активністю в одній або більше з функціональних проб, описаних тут нижче. Джерело поставки наводиться в дужках. Функціональні Проби In-Vitro ß-лактамаза: Аналіз GPR119 агоністів використовує клітинний (hGPR119 HEK293-CRE бета-лактамаза) структурний компонент репортеру, де активація агоністу GPR119 людини поєднана з продукуванням бета-лактамази через циклічний АМФ відповідний елемент (CRE). Активність GPR119 далі вимірюють, використовуючи FRET-дозволений субстрат бета-лактамази, CCF4-AM (Live Blazer FRET-B/G Loading kit, Invitrogen cat # K1027). Зокрема, hGPR119-HEK-CRE- бета7 лактамазні клітини (Invitrogen 2.5 × 10 /мл) виймали з рідкого азоту, де вони зберігалися, та розбавляли в середовищі для чашок Петрі (модифікована за способом Дульбекко (Dulbecco) в середовищі Ігл з високим рівнем глюкози (DMEM; Gibco Cat # 11995-065), 10 % термоінактивована ембріональна бича сироватка (HIFBS; Sigma Cat # F4135), 1X MEM замінні амінокислоти (Gibco Cat # 15630-080), 25 мМ HEPES pH 7.0 (Gibco Cat # 15630-080), 200 нМ калію клавуланат (Sigma Cat # P3494)). Концентрацію клітин регулювали, використовуючи 4 клітинне середовище для чашок Петрі, та 50 мкл цієї клітинної суспензії (12.5 × 10 життєздатних клітин) додавали в кожну лунку з чорним прозорим дном, полі-d-лізин покритого планшету з 384-лунками (Greiner Bio-One cat# 781946) та інкубували при 37 градусах за Цельсієм у вологому середовищі, що містить 5 % діоксиду карбону. Через 4 години середовище для чашок Петрі видаляли та замінювали на 40 мкл середовища проби (середовище проби є середовищем для чашок Петрі без калію клавуланату та HIFBS). Для тестування, варіюючи концентраціями кожної сполуки, далі додавали в об'єм 10 мкл (кінцевого ДМСО ≤ 0.5 %) та клітини інкубували протягом 16 годин при 37 градусах за Цельсієм у вологому середовищі, що містить 5 % діоксиду карбону. Планшети видаляли з інкубатору та давали врівноважитись до кімнатної температури протягом близько 15 хвилин. 10 мкл 6 X CCF4/AM робочого розчину барвника (приготовленого відповідно до інструкцій Live Blazer FRET-B/G Loading kit, Invitrogen cat # K1027) додавали до кожної лунки та інкубували при кімнатній температурі протягом 2 годин в темноті. Флуоресценцією вимірювали на EnVision флуориметричному рідері планшетів, збудження 405 нм, емісія 460 нм/535 нм. Визначення EC50 робили за кривими агоніст – відповідь, аналізували апроксимацію кривої програмою, що використовує 4-параметричне логістичне доза-відповідь рівняння. цАМФ: Активність GPR119 агоністу також визначали клітинним аналізом, використовуючи HTRF (гомогенну флуоресценцію розділену за часом) набір цАМФ реєстрації (цАМФ активний 2 набір проб; Cis Bio cat # 62AM4PEC), що вимірює рівні цАМФ в клітині. Спосіб є конкуруючим імуноаналізом між природно виробленим клітинами цАМФ та цАМФ, міченим барвником d2. 19 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зв'язані мічені візуалізують Mab мічені анти-цАМФ кріптатом. Характерний сигнал (тобто перенос енергії) є обернено пропорційним до концентрації цАМФ в або стандарті, або зразку. 7 Зокрема, hGPR119 HEK-CRE бета-лактамазні клітини (Invitrogen 2,5 × 10 /мл; в беталактамазній пробі використовували такуж лінію клітин, як описано вище) виймали з кріогенного сховища та розбавляли в середовищі для зрощування (модифікована за способом Дульбекко (Dulbecco) у середовищі Ігл з високим рівнем глюкози (DMEM; Gibco Cat #11995-065), 1 % декстран з вугільним пилом, оброблений ембріональною бичею сироваткою (CD сироватка; HyClone Cat # SH30068.03), 1x MEM замінні амінокислоти (Gibco Cat # 15630-080) та 25 мМ 5 HEPES pH 7,0 (Gibco Cat # 15630-080)). Концентрацію клітин доводять до 1,5 × 10 клітин/мл та 30 мл цієї суспензії додавали до T-175 колби та інкубували при 37 градусах за Цельсієм у вологому середовищі з 5 % діоксиду карбону. Через 16 годин (всю ніч), клітини видаляли з Tх 175 колби (розколочуванням колби зі сторони в сторону), центрифугували при 800 g та потім знову суспендували в середовищі проби (1x HBSS+CaCl2+MgCl2 (Gibco Cat # 14025-092) та 25 5 мМ HEPES pH 7,0 (Gibco Cat # 15630-080)). Концентрацію клітин доводили до 6.25 × 10 клітин/мл середовищем проби та 8 мкл цієї суспензії (5000 клітин) додавали до кожної лунки білого планшету Greiner з 384-лунками, низьким об'ємом проби (VWR cat # 82051-458). Варіюючи концентрації кожної сполуки для тестування, їх розбавляли в буфері проби, що містить 3-ізобутил-1-метилксантин (IBMX; Sigma cat # I5879) та додавали до проб в лунках планшету в об'ємі 2 мкл (кінцева IBMX концентрація становила 400 мкМ та кінцева концентрація ДМСО становила 0,58 %). Наступні 30 хвилин інкубували при кімнатній температурі, 5 мкл міченого d2 цАМФ та 5 мкл анти-цАМФ антитіла (обидва розбавляли 1:20 в буфері лізису клітин; як описано у виробничих протоколах аналізу) додавали до кожної лунки планшету з пробами. Планшети далі інкубували при кімнатній температурі та через 60 хвилин, зміни в HTRF сигналі реєстрували на Envision 2104 мультиміченому планшетному рідері, використовуючи збудження на 330 нм та емісію на 615 і 665 нм. Необроблені данні конвертували у нМ цАМФ інтерполяцією цАМФ стандартної кривої (як описано у виробничому протоколі аналізу) та визначення EC50 робили за кривими агоніст – відповідь, аналізували апроксимацію кривої програмою, що використовує 4-параметричне логістичне доза-відповідь рівняння. Очевидно, що цАМФ відповіді завдяки активації GPR119 могло б виникати в клітинах інших ніж конкретна лінія клітин, використана тут. ß-Аррестін: Активність агоністу GPR119 також визначали клітинним аналізом, використовуючи DiscoverX PathHunter ß-аррестін технологію аналізу клітин та їх U2OS hGPR119 ß-аррестін лінію клітин (DiscoverX Cat # 93-0356C3). В цьому аналізі активацію агоністу визначають вимірюванням агоніст-індукованою взаємодією β-аррестіну з активованим GPR119. Маленький, 42 амінокислотний ензим ний фрагмент, який називають ProLink, прикріпляли до C-кінця GPR119. Аррестін зливали конденсували до більшого ензимного фрагменту, що називають EA (ензим ний акцептор). Активація GPR119 стимулює зв'язування аррестіну та сили комплементації двох ензим них фрагментів, що в результаті призводить до утворення функціонального ензиму β-галактозидази здатного до гідролізу субстрату та генеруючого хемілюмінесцентний сигнал. 7 Зокрема, U2OS hGPR119 ß-аррестін клітини (DiscoverX 1 × 10 /мл) виймали з кріогенного сховища та розбавляли в середовищі для зрощування (мінімально збагачене середовище (MEM; Gibco Cat # 11095-080), 10 % термоінактивована ембріональна бича сироватка (HIFBS; Sigma Cat # F4135-100), 100 мМ натрію пірувата (Sigma Cat # S8636), 500 мкг/мл G418 (Sigma Cat # G8168) та 250 мкг/мл гігроміцину B (Invitrogen Cat # 10687-010). Концентрацію клітин 5 доводили до1.66 × 10 клітин/мл та 30 мл цієї суспензії додавали до T-175 колби та інкубували при 37 градусах за Цельсієм у вологому середовищі з 5 % діоксиду карбону. Через 48 годин, клітини видаляли з колби T-175 буфером дисоціації клітин вільним від ензимів (Gibco cat # 13151-014), центрифугували при 800 об/хв та далі суспендували знову в середовищі для чашок Петрі (Opti-MEM I (Invitrogen/BRL Cat # 31985-070)) та 2 % декстрані з вугільним пилом, обробленим ембріональною бичею сироваткою (CD сироватка; HyClone Cat # SH30068.03). 5 Концентрацію клітин доводили до 2.5 × 10 клітин/мл середовищем для чашок Петрі та 10 мкл цієї суспензії клітин (2500 клітини) додавали до кожної лунки білого планшету Greiner з 384лунками, з низьким об'ємом проби (VWR cat # 82051-458) та планшети інкубували при 37 градусах за Цельсієм і вологому середовищі з 5 % діоксину карбону. Через 16 годин (всю ніч) планшети з пробами виймали з інкубатору та, варіюючи концентраціями кожної сполуки для тестування (розбавлені в буфері проби (1x HBSS+CaCl2+MgCl2 (Gibco Cat # 14025-092), 20 мМ HEPES pH 7,0 (Gibco Cat # 15630-080) та 0,1 % BSA (Sigma Cat # A9576)), додавали до проб в лунках планшету в об'ємі 2,5 мкл (кінцева концентрація ДМСО становила 0,5 %). Після 90 хвилинної інкубації при 37 градусах за Цельсієм 20 UA 101110 C2 5 10 15 20 25 30 35 40 45 50 55 60 у вологому середовищі з 5 % діоксидом карбону, 7,5 мкл Galacton Star субстрату β-галактозидази (PathHunter Реєстрація Kit (DiscoveRx Cat # 93-0001); приготовленого як описано в виробничих протоколах аналізу) додавали до кожної лунки планшету з пробами. Планшети інкубували при кімнатній температурі та через 60 хвилин, зміни в люмінесценції реєстрували на Envision 2104 мультиміченому планшетному рідері за 0,1 секунди на лунку. Визначення EC50 проводили за кривими агоніст – відповідь, аналізували апроксимацію кривої програмою, що використовує 4-параметричнелогістичне доза-відповідь рівняння. Експресія GPR119 застосовуючи систему BacMam та GPR119 аналіз зв'язування Немутантний тип GPR119 людини (Фігура 1) ампліфікували через ланцюгову реакцію полімерази (PCR) (Pfu Turbo Mater Mix, Stratagene, La Jolla, CA), використовуючи pIRES-purohGPR119 як темплату та наступні праймери: hGPR119 BamH1, Верхній 5’-TAAATTGGATCCACCATGGAATCATCTTTCTCATTTGGAG-3’ (вносять BamHI сайт на 5" кінці) hGPR119 EcoRI, Нижній 5’-TAAATTGAATTCTTATCAGCCATCAAACTCTGAGC-3’ (вносять EcoRI сайт на 3" кінці) Ампліфікований продукт очищували (Qiaquick Kit, Qiagen, Valencia, CA) та обробляли BamH1 та EcoRI (New England BioLabs, Ipswich, MA) відповідно до виробничих протоколів. Вектор pFB-VSVG-CMV-poly (Фігура 2) обробляли BamHI та EcoRI (New England BioLabs, Ipswich, MA). Оброблені ДНК розділяли електрофорезом на 1 % агарозному гелі; фрагменти вирізали з гелю та очищували (Qiaquick Kit, Qiagen, Valencia, CA). Вектор та фрагменти генів зліплювали (Rapid Ligase Kit, Roche, Pleasanton, CA) та перетворювали в одноразово секвентовані DH5альфа T1R клітини (Invitrogen, Carlsbad, CA). Вісім ампіцилін резистентних колоній ("клони 1-8") вирощували для мініприготування (Qiagen Miniprep Kit, Qiagen, Valencia, CA) та секвентували для підтвердження ідентичності та коректної внутрішньої орієнтації. Модель pFB-VSVG-CMV-poly-hGPR119 (клон #1) перетворювали в одноразово секвентовані DH10Bac клітини (Invitrogen, Carlsbad, CA) відповідно до виробничих протоколів. Вісім позитивних (тобто білих) колоній пересіяли штрихами для підтвердження як "позитивності" так і наступного вирощення для виділення бакміди. Рекомбінантну hGPR119 бакміду виділяють за модифікованою методикою лужного лізису, використовуючи буфери від Qiagen Miniprep Kit (Qiagen, Valencia, CA). Коротко, гранульовані клітини розчиняли в буфері P1, нейтралізували в x буфері P2, та осаджували буфером N3. Осад гранулювали центрифугуванням (17,900 g протягом 10 хвилин) та супернатант об'єднували з ізопропанолом для осадження ДНК. ДНК x гранулювали центрифугуванням (17,900 g протягом 30 хвилин), промивали одноразово 70 % етанолом, та знову суспендували в 50 мкл буферу EB (Тріс-HCl, pH 8,5). Ланцюгову реакцію полімерази (PCR) з комерційно доступними праймерами (M13F, M13R, Invitrogen, Carlsbad, CA) використовували для підтвердження наявності hGPR119 вставки в бакміді. Розмноження hGPR119 Рекомбінантного Бакуловірусу Створення P0 вихідного розчину вірусу Суспензію адаптованих Sf9 клітин, вирощених в Sf900II середовищі (Invitrogen, Carlsbad, CA), трансфектували 10 мкл hGPR119 ДНК бакміди відповідно до виробничих протоколів (Cellfectin, Invitrogen, Carlsbad, CA). Після п'яти днів інкубації, кондиційоноване середовище (тобто "P0" вихідний розчин вірусу) центри-фугували та фільтрували через 0,22 мкм фільтр (Steriflip, Millipore, Billerica, MA). Створення замороженого вихідного розчину вірусу (BIIC) Для довготривалого зберігання вірусу та генерації робочих (тобто "P1") вірусних вихідних розчинів, створювали заморожені BIIC (клітини внутрішньо інфіковані бакуловірусом) вихідні розчини, як навудуно далі: суспензію адаптованих Sf9 клітин вирощували в середовищі Sf900II (Invitrogen, Carlsbad, CA) та інфікували hGPR119 P0 вихідним розчином вірусу. Після 24 годин x вирощування, інфіковані клітини обережно центрифугували (близько 100 g), знову суспендували в середовищі для заморожування (10 % ДМСО, 1 % альбуміну в Sf900II 7 середовищі) до кінцевої густини 1 × 10 клітин/мл та заморожували відповідно до стандартних протоколів заморожування в 1 мл аліквотах. Створення робочого вихідного розчину ("P1") Суспензію адаптованих Sf9 клітин, вирощених в Sf900II середовищі (Invitrogen, Carlsbad, CA) інфікували 1:100 розбавленим відтанувшим hGPR119 BIIC вихідним розчином та інкубували протягом декількох днів (27 градусів за Цельсієм зі струшуванням). Коли життєздатність клітин досягала 70 %, кондиційоноване середовище збирали центрифугуванням та титр вірусу визначали ELISA (BaculoElisa Kit, Clontech, Mountain View, CA) 21 UA 101110 C2 5 10 15 20 25 30 35 40 Гіперекспресія hGPR119 в суспензії адаптованих HEK 293FT клітин HEK 293FT клітини (Invitrogen, Carlsbad, CA) вирощували в колбі, що струшували, в 293Freestyle середовищі (Invitrogen) доповненим 50мкг/мл неоміцину та 10мМ HEPES (37C, 8 % x діоксиду карбону, при струшуванні). Клітини обережно центрифугували (близько 500 g, протягом 10 хвилин) та гранули суспендували знову в суміші Дульбекко PBS(без Mg++/-Ca++) доповненій 18 % ембріональною бичою сироваткою (Sigma Aldrich) та P1 вірус за умови щоб 6 множинність інфікування (MOI) становила 10 та кінцева густина клітин становила 1,3 × 10 /мл (загальний об'єм 2,5 літри). Клітини переносили до 5 літрового Wave біореактору Wavebag (Wave Technologies, MA) та інкубували протягом 4 годин при 27 градусах за Цельсієм (17 качань/хв, 7 градусний кут платформи); в кінці інкубаційного періоду, до рівних об'ємів (2,5 літри) 293Freestyle середовища додатково додавали 30мМ натрію бутирату (Sigma Aldrich) (кінцева концентрація = 15 мМ), та клітини вирощували протягом 20 годин (37 градусів за Цельсієм, 8 % CO2 [0,2 л/хв}, 25 качань/хв, 7 градусний кут платформи). Клітини збирали x центрифугуванням (3,000 g, 10 хвилин), одноразово промивали DPBS (без Ca++/Mg++), знову суспендували в 0,25 M цукрози, 25 мМ HEPES, 0,5 мМ EDTA, pH 7,4 та заморожували при -80 градусах за Цельсієм. Приготування мембран для радіолігандних аналізів зв'язування x Заморожені клітини відтавали на кризі та центрифугували при 700 g (1400 об./хв.) протягом 10 хвилин при 4 градусах за Цельсієм. Клітинний гранулят пересуспендували в 20 мл фосфатного буферного сольового розчину, та центрифугували при 1400 об./хв. протягом 10 хвилин. Далі клітинний гранулят знову суспендували в гомогенізаційному буфері (10 мМ HEPES (Gibco #15630), pH 7,5, 1 мМ EDTA (BioSolutions, #BIO260-15), 1 мМ EGTA (Sigma, #E-4378), 0,01 мг/мл бензамідину (Sigma #B 6506), 0,01 мг/мл бацитрацину (Sigma #B 0125), 0,005 мг/мл леупептину (Sigma #L 8511), 0,005 мг/мл апротиніну (Sigma #A 1153)) та інкубували на кризі протягом 10 хвилин. Потім клітини розчиняли 15 обережними постукуваннями щільноx підігнаного скляного гомогенізатору Dounce. Гомогенат центрифугували при 1000 g (2200 об./хв.) протягом 10 хвилин при 4 градусах за Цельсієм. Супернатант переносили в чисті центрифужні пробірки на кризі. Клітинний гранулят знову суспендували в гомогенізаційному x буфері та центрифугували при 1000 g (2200 об./хв.) протягом 10 хвилин при 4 градусах за Цельсієм, після чого супернатант видаляють та гранулят знову суспендують в гомогенізаційному буфері. Цей процес повторюють тричі, після чого супернатанти об'єднують, додають бензоназу (Novagen # 71206) та MgCl2 (Fluka #63020) до кінцевих концентрацій 1 од./мл та 6 мМ, відповідно, й інкубують на кризі протягом однієї години. Далі розчин x центрифугують при 25000 g (15000 об./хв.) протягом 20 хвилин при 4 градусах за Цельсієм, супернатант відкидали, та гранулят знову суспендували в свіжому гомогенізаційному буфері x (без бензонази і MgCl2). Після повторної стадії центрифугування при 25000 g, кінцевий мембранний гранулят знову суспендували в гомогенізаційному буфері та заморожували при -80 градусах за Цельсієм. Концентрацію протеїну визначали, використовуючи набір Пірс BCA для протеїнового аналізу (Pierce reагенти A #23223 та B #23224). 3 Синтез та очищення [ H]-сполуки A газ тритій Сполука А (каталізатор Крабті) [3Н]-Сполука А Сполуку A (ізопропіл4-(1-(4-(метилсульфоніл)феніл)-3a, 7a-дигідро-1H-піразолo[3,4d]піримідин-4-ілокси)піперидин-1-карбоксилат, як показано вище) (4 мг, 0.009 ммоль) розчиняли 22 UA 101110 C2 5 в 0.5 мл дихлорметану, та одержаний в результаті розчин обробляли (1,5циклооктадієн)(піридин)(трициклогексилфосфін)ірідій(I) гексафлуорфосфат (J. Organometal. Chem. 1979, 168, 183) (5 мг, 0.006 ммоль). Реакційну ємність запаювали та розчин струшували в атмосфері газу тритію протягом 17 годин. Розчинник реакції видаляли при зниженому тиску та 3 одержаний в результаті залишок розчиняли в етанолі. Очищення сирого [ H]-сполуки A виконували способом препаративної ВЕРХ, використовуючи наступні умови. Колонка: Atlantis, 4,6 × 150мм, 5мкм Рухома Фаза A: вода / ацетонітрил / мурашина кислота (98 / 2 / 0.1) Рухома Фаза B: ацетонітр ил Градієнт: Час перебігу: Час утримання: Швидкість потоку: Об'єм ін'єк.: Розчинник ін'єк.: Реєстрація: Час 0.00 1.00 13.00 16 хв 5 хв 1.5 мл/хвилину 20~50 мкл ДМСО УФ 210 нм та 245 нм %B 30.0 30.0 80.0 3 10 Специфічну активність очищенної [ H]-сполуки A визначали методом мас-спектроскопії, що становила 70 куб.дюйм/ммоль. 3 Альтернативно, аналіз зв'язування можуть виконувати з [ H]-сполукою B. 3 Синтез та очищення [ H]-сполуки B газ тритій Сполука В 15 20 каталізатор Крабтрі [3Н]-Сполука В Сполуку B (трет-бутил 4-(1-(4-(метилсульфоніл)феніл)-1H-піразолo[3,4-d]піримідин-4ілокси)піперидин-1-карбоксилат, як показано вище)(5 мг, 10.6 мкмоль) розчиняли в 1,0 мл дихлорметану та одержаний в результаті розчин обробляли каталізатором Крабтрі (Crabtree) (5 мг, 6,2 мкмоль). Реакційну ємність запаювали та розчин струшували в атмосфері газу тритію протягом 17 годин. Розчинник реакції видаляли при зниженому тиску та одержаний в результаті 3 залишок розчиняли в етанолі. Очищення сироі [ H]-сполуки B виконували способом силікагель флеш колоночної хроматографії, елююючи 70 % гексану / 30 % етилацетату, з наступною силікагель флеш колоночної хроматографії елююючи 60 % петролейний етер / 40 % етилацетат. 23 UA 101110 C2 3 5 10 15 20 25 30 Специфічну активність очищенної [ H]-сполуки B визначали методом мас-спектроскопії, що становила 57.8 куб./ммоль. GPR119 Радіолігандний аналіз зв'язування Сполуки, що випробовують, серійно розбавляли в 100 % ДМСО (J.T. Baker #922401). 2 мкл кожного розбавлення додавали до відповідних лунок 96-лункового планшету (кожної концентрації в трьох повтореннях). Немічену сполуку A (або сполуку B), в кінцевій концентрації 10 мкМ, використовували для визначення неспецифічного зв'язування. 3 3 [ H]-сполуку A (або [ H]-сполуку B) розбавляли в буфері зв'язування (50 мМ Тріс-HCl, pH 7,5, (Sigma #T7443), 10 мМ MgCl2 (Fluka 63020), 1 мМ ЕДТА (BioSolutions #BIO260-15), 0,15 % бичого сироваткового альбуміну (Sigma #A7511), 0,01 мг/мл бензамідину (Sigma #B 6506), 0,01 мг/мл бацитрацину (Sigma #B 0125), 0,005 мг/мл леупептину (Sigma #L 8511), 0,005 мг/мл апротиніну (Sigma #A 1153)) до концентрації 60 нМ, та 100 мкл додавали до кожної лунки 96-лункового планшету (Nalge Nunc # 267245). Мембрани експресуючого GPR119 розморожували та розбавляли до кінцевої концентрації 20 мкг/100 мкл на лунку в буфері зв'язування, та 100 мкл розбавлених мембран додавали до кожної лунки 96-лункового планшету. Планшет інкубували протягом 60 хвилин, струшуючи при кімнатній температурі (близько 25 градусів за Цельсієм). Аналіз завершували вакуумним фільтруванням через GF/C фільтрувальні пластини (Packard # 6005174) попередньо замочені в 0,3 % поліетиленаміні, використовуючи Packard харвестер. Далі фільтри промивали шість разів, використовуючи буфер для промивання (50 мМ Тріс-HCl, pH 7,5, що зберігався при 4 градусах за Цельсієм). Далі фільтрувальні пластини сушили на повітрі при кімнатній температурі протягом ночі. 30 мкл сцинтиллюючої рідини (Ready Safe, Beckman Coulter #141349) додавали до кожної лунки, пластини запаювали та вимірювали радіоактивність зв'язування з кожним фільтром, використовуючи Wallac Trilux MicroBeta, сцинтилляційний лічильник для планшетів. 3 3 Kd для [ H]-сполуки A (або [ H]-сполуки B) визначали виконанням насиченості зв'язування, з данними аналізу за нелінійною регресією, апрксимованою до односайтової гіперболи (Graph Pad Prism). IC50 визначення здійснювали з конкуруючих кривих, аналізували апроксимацію кривої спеціалізованою програмою (SIGHTS) та 4-параметричним логістичним доза-відповідь рівнянням. Значення Ki розраховували зі значень IC50, використовуючи рівняння ЧенгПрусоффа (Cheng-Prusoff). Наступні результати одержали функціональними аналізами для бета-лактамази та бетаарестину: β-лактамаза β -лактамаза β -арестин β -арестин Притаманна Притаманна Число функціональне Число функціональне Активність* Активність * Приклад функціональних EC50 (нМ) функціональних EC50 (нМ) (%) (%) серій людини серій людини Приклад 1 68 100 1 2 122 101 Приклад 1 17 93 2 2 17 84 3 9 100 Приклад 1 8 98 1 4 111 3 2 11 105 3 6 96 Приклад 1 15 97 4 2 16 95 Приклад 1 250 100 5 2 227 88 3 395 104 Приклад 1 6 31 6 Приклад 1 622 98 7 24 UA 101110 C2 β-лактамаза β -лактамаза β -арестин β -арестин Притаманна Притаманна Число функціональне Число функціональне Активність* Активність * Приклад функціональних EC50 (нМ) функціональних EC50 (нМ) (%) (%) серій людини серій людини Приклад 1 20 100 1 16 80 8 2 39 102 3 64 94 Приклад 1 56 98 9 2 89 93 Приклад 1 34 100 10 2 38 94 Приклад 1 782 98 11 Приклад 1 5200 100** 12 Приклад 1 217 119 13 Приклад 1 495 109 14 Приклад 1 63 104 15 Приклад 1 472 87 16 2 420 100** Приклад 1 161 67 17 Приклад 1 4000 100** 19 2 4810 100** Приклад 1 61 107 20 2 131 100** Приклад 1 688 100 21 2 201 96 Приклад 1 141 103 1 52 129 24 Приклад 1 1870 102 27 2 3400 100 Приклад 1 5 27 28 2 3 22 Приклад 1 3010 100** 29 Приклад 1 136 113 30 2 166 76 Приклад 1 155 92 31 Приклад 1 281 86 32 Приклад 1 1330 100** 33 25 UA 101110 C2 β-лактамаза β -лактамаза β -арестин β -арестин Притаманна Притаманна Число функціональне Число функціональне Активність* Активність * Приклад функціональних EC50 (нМ) функціональних EC50 (нМ) (%) (%) серій людини серій людини Приклад 1 270 102 34 Приклад 1 76 83 35 2 125 101 Приклад 1 848 100 36 Приклад 1 328 114 37 2 805 105 *Притаманна активність є відсотком від максимальної активності сполуки, що випробовується, відносно активності стандартного агоністу GPR119, ізопропілового естеру 4-[[6-[(2-флуор-4 метилсульфонілфеніл)аміно]піримідин-4-іл]окси]піперидин-1-карбонової кислоти (WO2005121121), в кінцевій концентрації of 10 мкМ. **криву екстраполювали до 100 % за розрахунком EC50. Наступні результати одержали для цАМФ та аналізів зв'язування: Приклад Приклад 1 цАМФ Число функціональних серій цАМФ Притаманна функціональне Активність * (%) EC50 (нМ) людини Число серій зв'язування Зв'язування Ki (нМ) людини 37 2 45 1 29 60 1 19 29 27 63 60 2 3 4 5 6 13 40 10 10 10 1 13 86 1 5 214 239 152 11 91 74 79 84 2 3 10 37 1 10 80 1 5 9 60 1 442 39 1 939 650 34 2 1710 1 >10000 17 1 >6100 2 Приклад 7 180 2 Приклад 6 47 2 Приклад 5 1 2 3 4 5 Приклад 4 56 2 3 Приклад 3 217 2 Приклад 2 1 >6100 225 80 1 293 2 3 Приклад 8 1 256 169 74 85 2 283 1 9 89 1 1 2 6 75 2 58 26 UA 101110 C2 цАМФ Число функціональних серій 3 цАМФ Притаманна функціональне Активність * (%) EC50 (нМ) людини 74 Приклад 9 Приклад 10 Зв'язування Ki (нМ) людини 3 4 5 43 47 14 1 7 Число серій зв'язування 35 2 Приклад 42 Приклад 530 98 154 74 62 1 >10000 31 1 1700 1 180 95 1 149 112 87 1 436 74 1 723 494 78 1 198 102 1 268 106 129 112 131 2 160 1 204 105 165 316 102 119 1 39 95 26 91 1 67 80 1 153 69 75 1 4480 100** 1 >6100 4550 99 2 >6100 1 59 123 1 41 90 107 2 144 1 44 33 1 58 32 57 31 34 2 128 1 147 29 1 159 161 29 1 1640 100** 1 150 2 Приклад 24 1 2 Приклад 23 61 2 3 Приклад 22 163 2 Приклад 21 1 2 Приклад 20 30 2 Приклад 19 2 2Приклад 18 57 2 3 Приклад 17 98 2 3 Приклад 16 28 2 Приклад 15 1 2 Приклад 14 62 2 3 Приклад 12 Приклад 13 87 2 Приклад 11 1 1470 100** 1 27 111 1 54 2 1 29 57 100 88 1 418 27 UA 101110 C2 цАМФ Число функціональних серій цАМФ Притаманна функціональне Активність * (%) EC50 (нМ) людини Число серій зв'язування Зв'язування Ki (нМ) людини 1 1640 2 528 1 >6100 2 Приклад >6100 25 2 Приклад 26 Приклад 27 Приклад 28 Приклад 29 111 114 1 254 62 1 394 27 1 >10000 5 3380 1 256 68 1 2020 245 60 1 56 107 1 462 52 109 1 66 66 1 514 64 58 78 60 1 244 85 274 92 1 55 94 1 87 70 78 1 18 76 1 31 31 66 2 29 1 281 51 1 521 2 Приклад 37 2 2 Приклад 36 33 2 Приклад 35 648 2 Приклад 34 1550 2 3 Приклад 33 1 2 Приклад 32 27 2 Приклад 31 >10000 2 Приклад 30 1 256 76 2 1450 1 1160 56 1 416 *Притаманна активність є відсотком від максимальної активності сполуки, що випробовується, відносно активності стандартного агоністу GPR119, ізопропілового естеру 4-[[6[(2-флуор-4-метилсульфонілфеніл)аміно]піримідин-4-іл]окси]піперидин-1-карбонової кислоти (WO2005121121), в кінцевій концентрації 10 мкМ. **криву екстраполювали до 100 % за розрахунком EC50. Одержання вихідних речовин Одержання 1: Ізопропіл 4-гідразинопіперидин-1-карбоксилат дигідрохлоридна сіль H2N H N O N O 10 Ізопропіл 4-{2-(трет-бутоксикарбоніл)гідразиніл}піперидин-1-карбоксилат (одержаний як описано в WO2008137436) (20,2 г, 67,02 ммоль), розчиняли в абсолютному етанолі (250 мл), та розчин струшували в атмосфері азоту при кімнатній температурі. Повільно добавили концентровану водну гідрогенхлоридну кислоту (27,9 мл, 335 ммоль). Розчин струшували в 28
ДивитисяДодаткова інформація
Назва патенту англійськоюL-(piperidin-4-yl)-pyrazole derivatives as gpr119 modulators
Автори англійськоюMascitti, Vincent, McClure, Kim Francis, Munchhof, Michael, John, Robinson Jr., Ralph Pelton, WEI-SHUNG KUNG Daniel, Deninno Michael Paul, Lefker Bruce Allen, Futatsugi Kentaro
Назва патенту російськоюПроизводные l-(пиперидин-4-ил)-пиразола как gpr 119-модуляторы
Автори російськоюМаскитти Винсент, МакКлур Ким Френсис, Мунчгоф Майкл Джон, Робинсон Джр., Ральф Пелтон, Вей-Шунг Кунг Даниэль, Денинно Майкл Пол, Лефкер Брюс Аллен, Футацуги Кентаро
МПК / Мітки
МПК: C07D 401/14, C07D 401/04, A61K 31/454, A61P 3/10, A61K 31/4545
Мітки: l-(піперидин-4-іл)-піразолу, похідні, gpr119-модулятори
Код посилання
<a href="https://ua.patents.su/68-101110-pokhidni-l-piperidin-4-il-pirazolu-yak-gpr119-modulyatori.html" target="_blank" rel="follow" title="База патентів України">Похідні l-(піперидин-4-іл)-піразолу як gpr119-модулятори</a>
Попередній патент: Механічний захоплюючий пристрій
Наступний патент: Багатошаровий фільтр для очищення води
Випадковий патент: Спосіб визначення вміщення вуглекислого газу у альвеолярному повітрі












