Похідні піридину, придатні як активатори глюкокінази
Номер патенту: 100532
Опубліковано: 10.01.2013
Автори: Байєр Норберт, Бургдорф Ларс Торе, Гляйтц Йоханнес, Харон Крістін, Краво Даніел
Формула / Реферат
1. Сполука, вибрана із групи
№
назва і/або структура
"А1"
(5-бромпіридин-2-іл)-(4-метилтіазол-2-іл)-амін
"А2"
(4-бромметилтіазол-2-іл)-(5-бромпіридин-2-іл)-амін
"A3"
(5-бромпіридин-2-іл)-(4-імідазол-1-ілметилтіазол-2-іл)-амін
"A4"
етиловий ефір 2-(5-бромпіридин-2-іламіно)-тіазол-4-карбонової кислоти
"А5"
2-(5-бромпіридин-2-іламіно)-тіазол-4-ілметиловий ефір оцтової кислоти
"А6"
[2-(5-бромпіридин-2-іламіно)-тіазол-4-іл]-метанол
"А7"
[4-(2-аміноетилсульфанілметил)-тіазол-2-іл]-(5-бромпіридин-2-іл)-амін
"A8"
(5-феноксипіридин-2-іл)-тіазол-2-іламін
"A9"
2-(5-фенокси-піридин-2-іламіно)-тіазол-4-ілметиловий ефір оцтової кислоти
"А10"
[2-(5-феноксипіридин-2-іламіно)-тіазол-4-іл]-метанол
"А12"
(5-фенілсульфанілпіридин-2-іл)-тіазол-2-іламін
"А13"
(5-фенілсульфінілпіридин-2-іл)-тіазол-2-іламін
"А14"
(5-фенілсульфонілпіридин-2-іл)-тіазол-2-іламін
"А20"
[3-(2-метоксіетокси)-5-феноксипіридин-2-іл]-тіазол-2-іламін
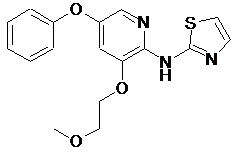
"A21"
(3-циклопентилокси-5-феноксипіридин-2-іл)-тіазол-2-іламін
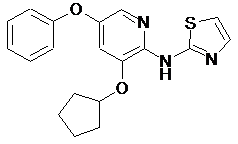
"A28"
[3-(2-метокси-1-метилетокси)-5-феноксипіридин-2-іл]-тіазол-2-іламін
"A28a"
[3-((R)-2-метокси-1-метилетокси)-5-феноксипіридин-2-іл]-тіазол-2-іламін
"A28b"
[3-((S)-2-метокси-1-метилетокси)-5-феноксипіридин-2-іл]-тіазол-2-іламін
"A29"
(3-циклопентилметокси-5-феноксипіридин-2-іл)-тіазол-2-іламін
"A30"
(5-бензилоксипіридин-2-іл)-тіазол-2-іламін
"A31"
[3-(2-метоксіетокси)-5-(піридин-3-ілокси)-піридин-2-іл]-тіазол-2-іламін
"A32"
[5-(4-метансульфонілфенокси)-3-(2-метоксіетокси)-піридин-2-іл]-тіазол-2-іламін
"A33"
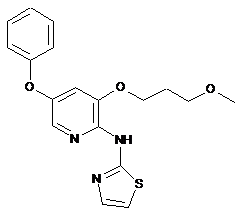
"A34"
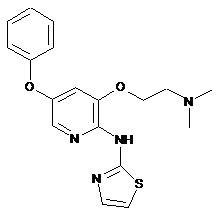
"A35"
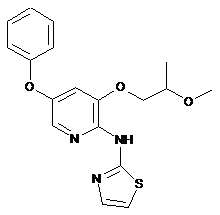
"A36"
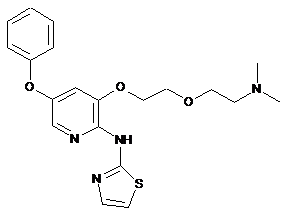
"A37"
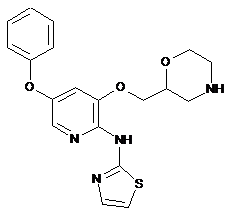
"A38"
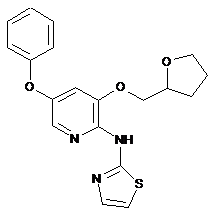
"A39"
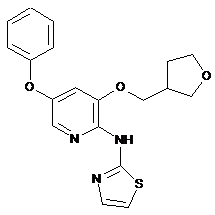
"A40"
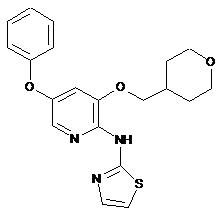
"A41"
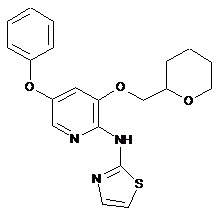
"A42"
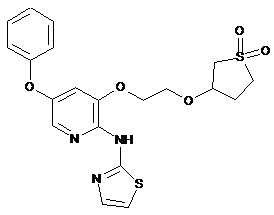
"A43"
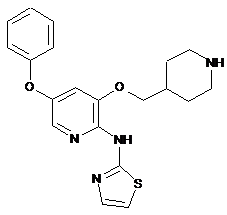
"A44"
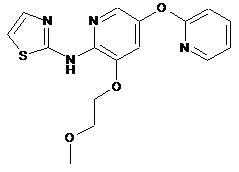
"A45"
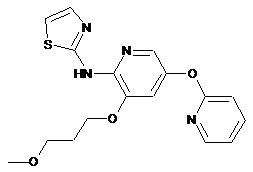
"A46"
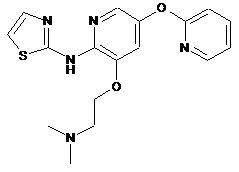
"A47"
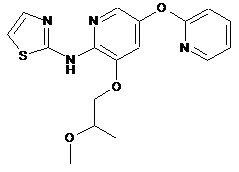
"A48"
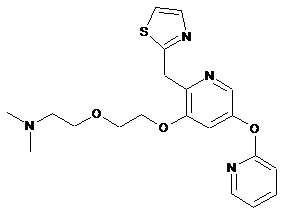
"A49"
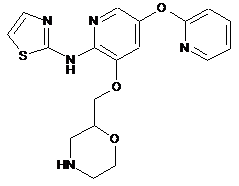
"A50"
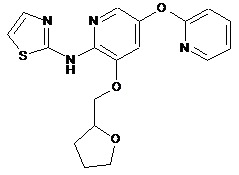
"A51"
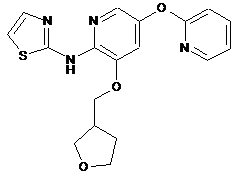
"A52"
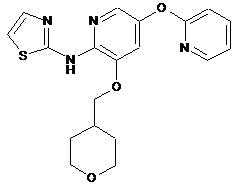
"A53"
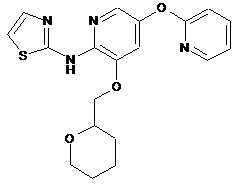
"A54"
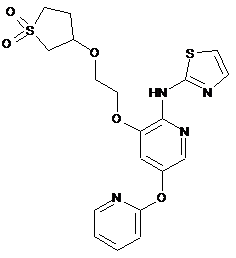
"A55"
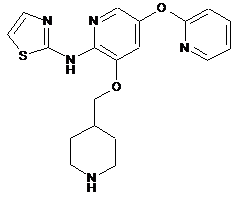
"A56"
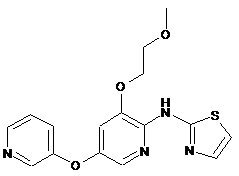
"A57"
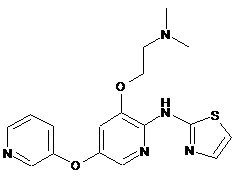
"A58"
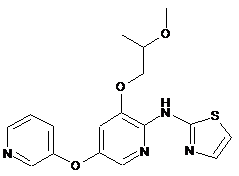
"A59"
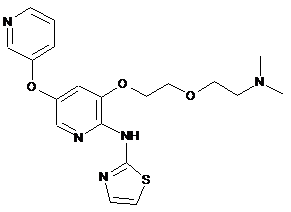
"A60"
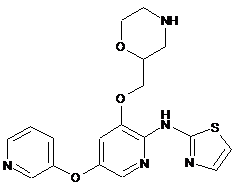
"A61"
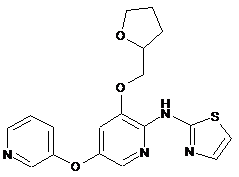
"A62"
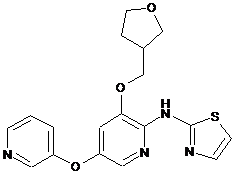
"A63"
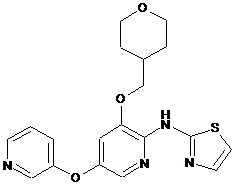
"A64"
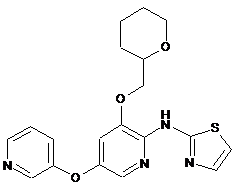
"A69"
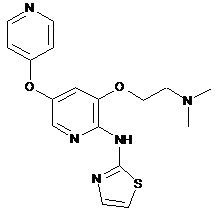
"A70"
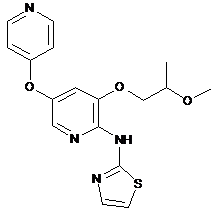
"A71"
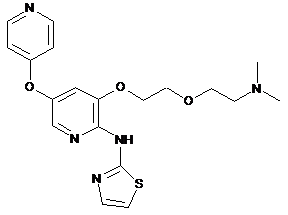
"A72"
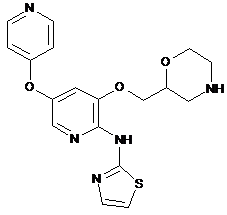
"A73"
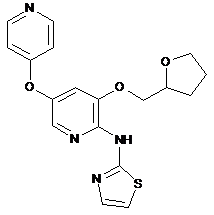
"A74"
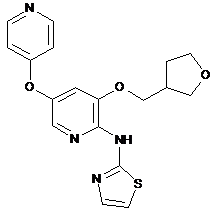
"A75"
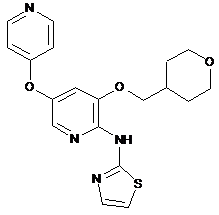
"A76"
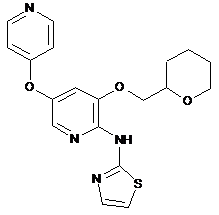
"A77"

"A78"
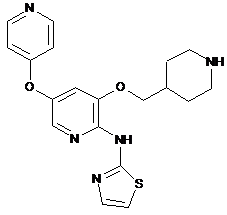
"A79"

"A80"

"A81"

"A82"
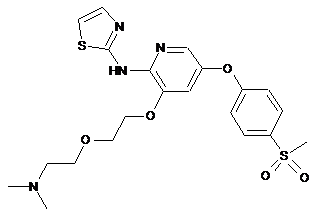
"A83"

"A84"

"A85"

"A86"

"A87"

"A88"
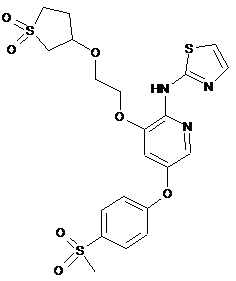
"A89"

або її фармацевтично придатні солі й стереоізомери, включаючи їх сумішіу всіх співвідношеннях.
2. Лікарський засіб, що містить щонайменше одну сполуку відповідно до пункту 1 і/або її фармацевтично придатні солі й стереоізомери, включаючи їх суміші у всіх співвідношеннях, і необов'язково наповнювачі і/або допоміжні речовини.
3. Застосування сполуки відповідно до п. 1 або її фармацевтично придатних солей і стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювання або стану, що виникає внаслідок недостатньої активності глюкокінази або який можна лікувати шляхом активації глюкокінази.
4. Застосування відповідно до п. 3, де захворювання або стан являє собою інсулінозалежний цукровий діабет, інсулінонезалежний цукровий діабет, ожиріння, невропатію і/або нефропатію.
5. Лікарський засіб, що містить щонайменше одну сполуку відповідно до п. 1 і/або її фармацевтично придатні солі й стереоізомери, включаючи їх суміші у всіх співвідношеннях, і щонайменше один додатковий активний компонент лікарського засобу.
6. Комплект (набір), що складається з окремих пакетів
а) ефективної кількості сполуки відповідно до п. 1 і/або її фармацевтично придатних солей і стереоізомерів, включаючи їх суміші у всіх співвідношеннях,
і
б) ефективної кількості додаткового активного компонента лікарського засобу.
Текст
Реферат: Нові гетероциклічні сполуки формули І R R 3 R 4 2 R N N H 1 D , 1 2 3 4 у якій R , R , R , R і D мають значення, зазначені в пункті 1, є активаторами глюкокінази й можуть застосовуватися для запобігання і/або лікування діабету 1 і 2 типу, ожиріння, невропатії і/або нефропатії. UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 Передумови створення винаходу Об'єктом винаходу є виявлення нових сполук, що володіють коштовними властивостями, зокрема такими, які можуть використовуватися для приготування лікарських засобів. Даний винахід належить до сполук, які придатні для лікування і/або запобігання захворювань, опосередкованих недостатніми рівнями активності глюкокінази, таких як цукровий діабет, і способам приготування таких сполук. Також забезпечуються способи лікування захворювань і порушень, які характеризуються недостатньою активністю глюкокінази або які можна лікувати шляхом активації глюкокінази, які включають уведення ефективної кількості сполуки згідно із даним винаходом. Таким чином, є бажаним ідентифікувати невеликі сполуки, які специфічно активують, регулюють і/або модулюють передачу сигналів глюкокіназою і це є метою даного винаходу. Крім того, метою даного винаходу є приготування нових сполук для запобігання і/або лікування діабету 1 і 2 типу, ожиріння, невропатії і/або нефропатії. Несподівано нами було виявлено, що гетероарил аміно піридини активують глюкокіназу; отже, ці сполуки надзвичайно придатні для запобігання й лікування діабету 1 і 2 типу, ожиріння, невропатії і/або нефропатії. Було виявлено, що сполуки відповідно до винаходу і їх солі мають надзвичайно коштовні фармакологічні властивості, а також гарну переносимість. Особливо, вони виявляють активуючий вплив на глюкокіназу. Таким чином, даний винахід відноситься до сполук відповідно до винаходу в якості лікарських засобів і/або активних компонентів лікарських засобів для лікування і/або профілактики зазначених захворювань і до застосування сполук відповідно до винаходу для приготування фармацевтичного препарату для лікування і/або профілактики зазначених захворювань, а також до способу лікування зазначених захворювань, який включає введення одної або декількох сполук відповідно до винаходу пацієнтові, що потребує такого уведення. Хазяїн або пацієнт може належати до будь-якого виду ссавців, наприклад, види примат, зокрема люди; гризуни, включаючи мишей, пацюків і хом'ячків; кролики; коні, велика рогата худоба, собаки, коти і т.д. Тваринні моделі представляють інтерес для експериментальних досліджень, де вони забезпечують модель для лікування захворювання людини. Цукровий діабет (DM) є прогресуючим захворюванням, часто пов'язаним з ожирінням, яке характеризується недостатністю інсуліну й резистентністю до інсуліну або обома явищами. Рівень глюкози в крові як натщесерце, так і після приймання їжі підвищений, що викликає в пацієнта гострі й хронічні ускладнення (мікро- і макро-судинні), що приводять до сліпоти, ниркової недостатності, серцевої недостатності, удару й ампутаціям. Показано, що поліпшення глікемічного контролю знижує ризик цих ускладнень. Внаслідок прогресуючої природи захворювання, для підтримки глікемічного контролю необхідна революціонізуюча стратегія лікування. Існує дві форми цукрового діабету: 1 тип, або ювенільний діабет або інсулінозалежний цукровий діабет (IDDM), і 2 тип, або придбаний діабет або інсулінонезалежний цукровий діабет (NIDDM). Пацієнти з діабетом 1 типу мають абсолютну недостатність інсуліну внаслідок імунологічного руйнування β клітин підшлункової залози, які синтезують і секретують інсулін. Діабет 2 типу є більш комплексним по етіології й характеризується відносною недостатністю інсуліну, зменшеною дією інсуліну й резистентністю до інсуліну. NIDDM, що починається рано або діабет зрілого віку в молодих (MODY) має багато характеристик найпоширенішої форми NIDDM, яка починає проявлятися в середньому віці (Rotter і ін. 1990). Для MODY установлена очевидна схема спадкування (аутосомна домінантна). У сімействах MODY було ідентифіковано щонайменше 3 різні мутації (Bell і ін. 1996). Важливість глюкокінази (GK) у гомеостазі глюкози була показана за допомогою GK мутантів із цукровим діабетом у людей (MODY-2) і шляхом зміни метаболізму глюкози в трансгенних мишей і мишей з «виключеним» геном (Froguel і ін., 2003; Bali і ін., 1995, Postic і ін., 1999). GK, також відома як гексокіназа IV або D, є однією із чотирьох ізоферментів гексокіназ, які метаболізують глюкозу до глюкозо-6-фосфату [Wilson, 2004]. Відомо, що GK експресується в нейронні/нейроендокринних клітинах, гепатоцитах і клітинах підшлункової залози й виконує центральну роль у гомеостазі всього організму [Matschinsky і ін. 1996; 2004]. GK виконує важливу роль як сенсор глюкози для контролювання гомеостазу глюкози в плазмі крові шляхом посилення секреції інсуліну β-клітинами підшлункової залози й метаболізму глюкози в печінці, але також і шляхом підвищення секреції GLP1 L-клітинами. β-клітки, чутливі до глюкози в дугоподібному (ARC) ядрі гіпоталамуса, можуть залежати від GK для визначення підвищення глюкози й полегшення індукованою глюкозою секреції інсуліну. Різні механізми дії дозволяють припустити, що активатори GK будуть проявляти їхні біологічні дії в пацієнтів з діабетом і ожирінням шляхом поліпшення поінформованості про загальний рівень глюкози в організмі, що забезпечує обґрунтовані очікування того, що 1 UA 100532 C2 5 10 15 20 25 оптимізована активність GK буде новою терапевтичною стратегією для метаболічних порушень. Вважається, що активатори GK будуть відновлювати цільові гормони підшлункової залози й секрецію інсуліну, у комбінації із придушенням утворення глюкози в печінці без індукування важкої гіпоглікемії. Рівень техніки Інші похідні амінопіридину описані в якості активаторів глюкокінази в WO 2007/053345 A1, WO 2007/117381 і WO 2007/089512 A1. Інші сполуки з гетероциклічними залишками описано в: US2006019967, WO2002050071, WO2004060305, WO2004103959, US2006019967, WO2007010273, WO2003013523, WO9618616, WO9618617, WO2006078621, WO200230358, WO2003027085, WO9616650, WO200196307, WO2006028958. У наступних патентних заявках (не для GK) описані інші гетероциклічні сполуки WO2007023382, WO2005021529, WO200117995, US2005227989, US2004157845, WO2006101740, JP07285962, WO2007016228. Бібліографія Wilson JE: The hexokinase gene family. In Glucokinase and Glycemic Disease: From Basics to Novel Therapeutics. Front Diabetes. тому 16. Matschinsky FM, Magnuson MA, ред. Basel, Karger, 2004 Matschinsky, F. M. Diabetes 1996, 45, 223-41. Matschinsky F.M.; Magnuson M.A. ред. Glucokinase and Glycemic Disease: From Basics to Novel Therapeutics. Basel:Karger, 2004 Rotter і ін. Diabetes mellitus (1990): Theory and practice Rifkin and Porte (ред) NY, 378-413 Bell і ін. 1996 Froguel і ін. 2003 Bali і ін. 1995 Postic і ін. 1999 Сутність винаходу Винахід відноситься до сполук формули I R2 R3 R1 N R4 30 35 I у якій 1 2 R ,R , 3 4 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, Hal, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 12 10 11 10 10 11 10 11 [C(R )2]mO[C(R )2]mR , S(O)nR , NR R , NO2, CN, COOR , CONR R , NR COR , 10 10 11 10 11 10 10 11 10 11 10 11 NR CONR R , NR SOnR , COR , SO3H, SOnNR R , O-Alk-NR R , O-Alk-O-Alk-NR R , O12 12 10 11 10 11 12 12 Alk-O-R , O[C(R )2]mCONR R , O-Alk-NR COR , O[C(R )2]mHet, O[C(R )2]mAr, 12 12 S(O)n[C(R )2]mHet або S(O)n[C(R )2]mAr, D являє собою 5 40 N H D 6 R ,R , 7 8 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 12 12 10 11 10 10 11 10 11 [C(R )2]mOCOA, [C(R )2]mO[C(R )2]mR , S(O)nR , NR R , CN, COOR , CONR R , NR COR , 2 UA 100532 C2 10 5 10 15 20 25 30 35 40 45 10 11 10 11 S { 50 10 10 11 10 11 12 10 11 NR CONR R , NR SOnR , COR , SO3H, SOnNR R , O-Alk-NR R , O[C(R )2]mCONR R , 10 11 12 12 12 12 O-Alk-NR COR , O[C(R )2]mHet, O[C(R )2]mAr, S(O)n[C(R )2]mHet або S(O)n[C(R )2]mAr, 9 12 10 10 11 10 10 11 12 R являє собою H, A, S(O)n[C(R )2]mR , CONR R , COR , SOnNR R , [C(R )2]mAr або 12 [C(R )2]mHet, 10 11 R , R кожний, незалежно друг від друга, являє собою H, A, Ar або Het, A являє собою нерозгалужений або розгалужений алкіл, що містить 1-10 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S, SO, SO 2, NH, NA', Nar, NНet і/або -CH=CH- групами і/або додатково 1-7 атомів водню можуть бути замінені F, Cl, Br, =S, 12 =NR і/або =O або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, який незаміщений або одно-, двоабо тризаміщений =O, F, Cl, OH, OA', OAr', OHet', SO nA', SOnAr', SOnHet', NH2, NHA', NA'2, NHAr' і/або NHHet' A' являє собою нерозгалужений або розгалужений алкіл, що містить 1- 6 атомів вуглецю, у якому 1- 7 атомів водню можуть бути замінені F і/або Cl, Alk являє собою нерозгалужений або розгалужений алкілен, що містить 1, 2, 3 або 4 атомів вуглецю, Ar являє собою феніл, нафтил або біфеніл, кожний з яких незаміщений або одно-, дво-, 12 12 12 12 трьох-, чотирьох- або п'яти-заміщений A, Hal, [[C(R )2]mAr', [C(R )2]mHet', O[C(R )2]mR , 12 12 12 12 12 S(O)nR , NH2, NHA', NA'2, NHAr', NHHet', NO2, CN, COOR , CON(R )2, NR COR , 12 12 12 12 12 12 12 12 12 NR CON(R )2, NR SOnR , COR , SO3H, SOnN(R )2, O-Alk-N(R )2, O[C(R )2]mCON(R )2, O12 12 12 12 12 12 Alk-NR COR , O[C(R )2]mHet', O[C(R )2]mAr', S(O)n[C(R )2]mHet' і/або S(O)n[C(R )2]mAr', Het являє собою моно- або біциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути одно-, дво- або 12 12 12 12 тризаміщений Hal, A, [C(R 2]mAr', [C(R )2]mHet', O[C(R 2]mAr', O[C(R )2]mHet', 12 12 12 12 12 12 12 [C(R )2]mциклоалкилом, [C(R )2]mOR , [C(R )2]mN(R )2, NO2, CN, [C(R )2]mCOOR , 12 12 12 12 12 12 12 12 12 O[C(R )2]mCOOR , [C(R )2]mCON(R )2, [C(R )2]mCONR N(R )2, O[C(R )2]mCON(R )2, 12 12 12 12 12 12 12 12 12 12 O[C(R )2]mCONR N(R )2, [C(R )2]mNR COA, NR CON(R )2, [C(R )2]mNR SO2A, COR , 12 2 SO2N(R )2, S(O)mA, =S, =NR і/або =O (карбонільним киснем), Ar' являє собою феніл, нафтил або біфеніл, кожний з яких незаміщений або одно-, дво- або 12 12 12 12 12 12 12 тризаміщений Hal, A, OR , N(R )2, NO2, CN, COOR , CON(R )2, NR COA, NR CON(R )2, 12 12 12 12 12 12 12 NR SO2A, COR , SO2N(R )2, S(O)nA, [C(R )2]mCOOR і/або O[C(R )2]mCOOR , Het' являє собою моно- або біциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути одно-, дво- або 12 12 12 12 12 12 12 тризаміщений Hal, A, OR , N(R )2, NO2, CN, COOR , CON(R )2, NR COA, NR SO2A, COR , 12 12 SO2N(R )2 S(O)nA, =S, =NR і/або =O (карбонільним киснем), 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, Hal являє собою F, Cl, Br або I, m являє собою 0, 1, 2, 3 або 4, n являє собою 0, 1 або 2, 1 за умови, що якщо D являє собою тіазол, то R не являє собою OCH2Ar або OCH2Het, і їх фармацевтично придатним солям і стереоізомерам, включаючи їх суміші у всіх співвідношеннях. Винахід відноситься до сполук формули I і їх солям і до способу одержання сполук формули I і їх фармацевтично придатних солей і стеріоізомерів, який характеризується тим, що а) де D являє собою R5 , N R6 характеризується тим, що сполуки формули II 3 UA 100532 C2 R2 R3 R1 S N R4 II NH2 N H у якій 1 2 3 4 R , R , R і R мають значення, зазначені в пункті 1, піддають реакції із сполукою формули III R5 R6 III L 5 10 O у якій L являє собою Cl, Br, I або вільну або реакційноздатну функціонально модифіковану OH групу й 5 6 R і R мають значення, зазначені в пункті 1, або б) де R7 R8 { , D являє собою N N R9 характеризується тим, що сполуки формули IV R2 R3 R1 IV 15 N R4 Hal у якій 1 2 3 4 R , R , R , R і Hal мають значення, зазначені в пункті 1, піддають реакції із сполукою формули V D-NH2 V R7 R8 { 20 у якій D являє собою , N N R9 7 25 8 9 і R , R і R мають значення, зазначені в пункті 1, або 6 6 в) у сполуки формули I, радикал R перетворюють в інший радикал R шляхом i) перетворення галогенової групи в ароматичний гетероцикл; ii) перетворення складноефірної групи у спиртову групу і/або основу або кислоту формули I перетворюють в одну з її солей. 4 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки формули I також охоплюють їх фармацевтично прийнятні похідні і їх сольвати. Винахід також відноситься до стеріоізомерів (E, Z ізомерам) і гідратам і сольватам цих сполук. Під сольватами сполук мають на увазі аддукти молекул інертного розчинника на сполуках, які утворюються завдяки їхній силі взаємного притягання. Сольвати являють собою, наприклад, моно- або дигідрати або алкоголяти. Під фармацевтично придатними похідними розуміють, наприклад, солі сполук відповідно до винаходу, а також так звані проліки сполук. Під похідними проліків розуміють сполуки формули I, які є модифікованими, наприклад, алкільною або ацильною групами, цукрами або олігопептидами і які швидко розщеплюються в організмі з утворенням активних сполук відповідно до винаходу. Це поняття також включає похідні біорозкладаємих полімерів сполук відповідно до винаходу, як описано, наприклад, в Int. J. Pharm. 115, 61-67 (1995). Вираження "ефективна кількість" означає кількість лікарського засобу або фармацевтичного активного компонента, яка викликає в тканині, системі, тварині або людині біологічну або медичну відповідну реакцію, яку припускає або бажає одержати, наприклад, дослідник або лікар. Додатково, вираження "терапевтично ефективна кількість" позначає та кількість, яка має наступні наслідки в порівнянні з відповідним суб'єктом, який не одержував цієї кількості: поліпшення лікування, лікування, запобігання або елімінацію захворювання, синдрому, стану, скарги, розладу або запобігання побічних дій або також зменшення прогресування захворювання, стану, розладу або побічних дій або також зменшення прогресування захворювання, стани або розлади. Вираження “терапевтично ефективна кількість” також охоплює кількості, які ефективні для підвищення нормальної фізіологічної функції. Винахід також відноситься до сумішей сполук формули I відповідно до винаходу, наприклад, сумішам дво діастереомерів, наприклад, у співвідношенні 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 або 1:1000. Особливо кращими є суміші стереоізомерних сполук. Для всіх радикалів, які зустрічаються більш одного разу, їх значення є незалежними друг від друга. 1 2 3 4 Вище й нижче, радикали й параметри R , R , R , R і D мають значення, зазначені для формули I, якщо спеціально не зазначено інше. A являє собою алкіл, є нерозгалуженим (лінійним) або розгалуженим, і має 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 атомів вуглецю. A переважно являє собою метил, крім того, етил, пропил, ізопропіл, бутив, ізобутил, втор-бутил або тре-бутил, крім того, також пентил, 1-, 2- або 3- метилбутил, 1,1, 1,2- або 2, 2-диметилпропіл, 1- етилпропіл, гексил, 1-, 2-, 3- або 4- метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- або 3, 3-диметилбутил, 1- або 2- етилбутил, 1 етил-1--метилпропіл, 1 етил-2-метилпропіл, 1,1,2- або 1,2, 2-триметилпропіл, більш переважно, наприклад, трифторметил. A найбільше переважно являє собою алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю, переважно метил, етил, пропив, ізопропіл, бутив, ізобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторетил або 1,1, 1-трифторетил. Крім того, A переважно являє собою нерозгалужений або розгалужений алкіл, що містить 110 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S і/або NH і/або додатково 1- 7 атомів водню можуть бути замінені F, Cl і/або Br, або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, який незаміщений або однозаміщений =O. Циклоалкіл переважно являє собою циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Alk переважно являє собою CH2 або CH2CH2. 1 12 12 10 11 R переважно являє собою H, O[C(R )2]mHet, O[C(R )2]mAr, O-Alk-NR R , O-Alk-O-Alk10 11 12 12 12 12 1 NR R , O-Alk-O-R або [C(R )2]mO[C(R )2]mR ; R более предпочтительно представляет 12 12 10 11 10 11 12 собой H, O[C(R )2]mHet, O[C(R )2]mAr, O-Alk-NR R , O-Alk-O-Alk-NR R , O-Alk-O-R або 12 12 12 [C(R )2]mO[C(R )2]mR , де 10 11 R , R кожний, незалежно друг від друга, являє собою H або A, 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, незаміщений або однозаміщений за допомогою =O, Alk являє собою нерозгалужений або розгалужений алкілен, що містить 1, 2, 3 або 4 атомів вуглецю, Het являє собою моноциклічний насичений гетероцикл, що містить 1 - 2 атома N, O і/або S, 5 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 який може бути незаміщений або одно- або двозаміщений A і/або =O (карбонільним киснем), m являє собою 0, 1 або 2. 2 R переважно являє собою H. 3 12 12 12 12 12 R переважно являє собою Hal, [C(R )2]mAr, [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, 12 12 O[C(R )2]mAr або S(O)n[C(R )2]mAr. 3 12 12 12 12 12 R більш переважно являє собою Hal, [C(R )2]mAr, [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, 12 12 O[C(R )2]mAr або S(O)n[C(R )2]mAr, де 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю, 12 12 12 Ar являє собою феніл, який незаміщений або однозаміщений O[C(R )2]mR , S(O)nR або 12 SOnN(R )2, Het являє собою моноциклічний ароматичний гетероцикл, що містить 1 - 2 атома N, O і/або S, m являє собою 0, 1 або 2, n являє собою 0, 1 або 2. 3 R особливо переважно являє собою F, Cl, Br, фенокси, бензилокси, фенілсульфаніл, фенілсульфініл, фенілсульфоніл, аміносульфоніл-фенокси, піридилокси, карбамоїл-піридилметокси, метоксибензил, метокси, етокси, пропокси або метокси-етокси; найбільше переважно 3 R являє собою Br, фенокси, бензилокси, метокси, етокси, пропокси або 2-метокси-етокси. 4 R переважно являє собою H. 5 R переважно являє собою H. 6 12 12 12 R переважно являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, [C(R )2]mOCOA, 12 12 12 12 [C(R )2]mO[C(R )2]mR або COOR . 6 12 12 R особливо переважно являє собою H, A, [C(R )2]mHet, [C(R )2]mOCOA, 12 12 12 12 [C(R )2]mO[C(R )2]mR або COOR , де 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю, A являє собою нерозгалужений або розгалужений алкіл, що містить 1- 10 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S і/або NH і/або додатково 1- 7 атомів водню можуть бути замінені F, Cl і/або Br, Het являє собою моноциклічний ароматичний гетероцикл, що містить 1 - 2 атома N, O і/або S, m являє собою 0, 1 або 2. 7 R переважно являє собою H. 8 R переважно являє собою H. 9 12 9 R переважно являє собою H, A або [C(R )2]mHet. R більш переважно являє собою H, A або 12 [C(R )2]mHet., де 12 R являє собою H, A являє собою нерозгалужений або розгалужений алкіл, що містить 1- 6 атомів вуглецю, Het являє собою моноциклічний ароматичний гетероцикл, що містить 1 - 2 атома N, O і/або S, m являє собою 0, 1 або 2. Ar являє собою, наприклад, феніл, , о-, м- або п-толіл, о-, м- або п-етилфеніл, о-, м- або п-пропілфеніл, о-, м- або п-ізопропілфеніл, о-, м- або п-трет.-бутилфеніл, о-, м- або п-гідроксифеніл, о-, м- або п-нітрофеніл, о-, м- або п-амінофеніл, о-, м- або п-(Nметиламіно)феніл, о-, м- або п-(N-метиламінокарбоніл)феніл, о-, м- або п-ацетамідофеніл, о-, мабо п-метоксифеніл, о-, м- або п-етоксифеніл, о-, м- або п-етоксикарбонілфеніл, о-, м- або п-(N,N-диметиламіно)феніл, о-, м- або п-(N,N-диметиламінокарбоніл)феніл, о-, м- або п-(Nетиламіно)феніл, о-, м- або п-(N,N-діетиламіно)феніл, о-, м- або п-фторфеніл, о-, м- або п-бромфеніл, о-, м- або п- хлорфеніл, о-, м- або п-(метилсульфонамідо)феніл, о-, м- або п-(метилсульфоніл)феніл, о-, м- або п-ціанофеніл, о-, м- або п-уреїдофеніл, о-, м- або п-формілфеніл, о-, м- або п-ацетилфеніл, о-, м- або п-аміносульфонілфеніл, о-, м- або п-карбоксифеніл, о-, м- або п-карбоксиметилфеніл, о-, м- або п-карбоксиметоксифеніл, крім того краще 2,3-, 2,4-, 2,5-, 2,6-, 3,4- або 3,5-дифторфеніл, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- або 3,5дихлорфеніл, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- або 3,5-дибромфеніл, 2,4- або 2,5-динітрофеніл, 2,5- або 3,4-диметоксифеніл, 3-нітро-4-хлорфеніл, 3-аміно-4-хлор-, 2-аміно-3-хлор-, 2-аміно-4-хлор-, 2-аміно-5-хлор- або 2-аміно-6-хлорфеніл, 2-нітро-4-N,N-диметиламіно- або 3-нітро-4-N,Nдиметиламінофеніл, 2,3-диамінофеніл, 2,3,4-, 2,3,5-, 2,3,6-, 2,4,6- або 3,4,5-трихлорфеніл, 2,4,6 6 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 триметоксифеніл, 2-гідрокси-3,5-дихлорфеніл, п-йодфеніл, 3,6-дихлор-4-амінофеніл, 4-фтор-3хлорфеніл, 2-фтор-4-бромфеніл, 2,5-дифтор-4-бромфеніл, 3-бром-6-метоксифеніл, 3-хлор-6метоксифеніл, 3-хлор-4-ацетамідофеніл, 3-фтор-4-метоксифеніл, 3-аміно-6-метилфеніл, 3-хлор4-ацетамідофеніл або 2,5-диметил-4-хлорфеніл. Ar переважно являє собою, наприклад, феніл, який незаміщений або однозаміщений 12 12 12 12 O[C(R )2]mR , S(O)nR або SOnN(R )2. Ar особливо переважно являє собою, наприклад, феніл, який незаміщений або однозаміщений OCH3, SO2CH3 або SO2NH2. Ar' переважно являє собою, наприклад, феніл, який незаміщений або одно-, дво- або тризаміщений Hal, A, OH, OA, SO2A, COOA або CN, найбільше переважно феніл, який незаміщений або одно-, дво- або тризаміщений Hal і/або A. Незалежно від подальших заміщень, Het являє собою, наприклад, 2- або 3- фурил, 2- або 3тієніл, 1-, 2- або 3- піроліл, 1-, 2, 4- або 5- імідазоліл, 1-, 3-, 4- або 5- піразоліл, 2-, 4- або 5оксазоліл, 3-, 4- або 5- ізоксазоліл, 2-, 4- або 5- тіазоліл, 3-, 4- або 5- ізотіазоліл, 2-, 3- або 4піридил, 2-, 4-, 5- або 6- піримідиніл, більш переважно 1,2,3- триазол-1-, -4- або 5-іл, 1,2,4триазол-1-, -3- або 5-іл, 1- або 5- тетразоліл, 1,2,3 оксадіазол-4- або 5-іл, 1,2,4 оксадіазол-3- або 5-іл, 1,3,4- тіадіазол-2- або 5-іл, 1,2,4-тіадіазол-3- або-5, 1,2,тіадіазол-4 або 5-іл, 3- або 4піридазиніл, піразиніл, 1-, 2-, 3-, 4-, 5-, 6- або 7- індоліл, 4- або 5- ізoіндоліл, 1-, 2-, 4- або 5бензімідазоліл, 1-, 2-, 3-, 4-, 5-, 6- або 7- індазоліл, 1-, 3-, 4-, 5-, 6- або 7- бензопіразоліл, 2-, 4-, 5-, 6- або 7- бензоксазоліл, 3-, 4-, 5-, 6- або 7- бензизоксазоліл, 2-, 4-, 5-, 6- або 7- бензотіазоліл, 2-, 4-, 5-, 6- або 7- бензизотіазоліл, 4-, 5-, 6- або бенз-2,1, 3-оксадіазоліл, 2-, 3-, 4-, 5-, 6-, 7- або 8- хіноліл, 1-, 3-, 4-, 5-, 6-, 7- або 8- ізохіноліл, 3-, 4-, 5-, 6-, 7- або 8- -іннолинил, 2-, 4-, 5-, 6-, 7або 8- хіназолиніл, 5- або 6- хіноксалініл, 2-, 3-, 5-, 6-, 7- або 8-2 H-бензо-1, 4-оксазиніл, крім того переважно 1,3-бензодіоксол-5-іл, 1,4-бензодіоксан-6-іл, 2,1,3-бензотіадіазол-4- або -5-іл або 2,1, 3-бензоксадіазол- 5-іл. Гетероциклічні радикали також можуть бути частково або повністю гідровані. Таким чином, Het також може являти собою, наприклад, 2,3-дигідро-2-, -3-, -4- або -5-фурил, 2,5-дигідро-2-, -3-, -4- або 5-фурил, тетрагідро-2- або 3--фурил, 1, 4-іл, тетрагідро-2- або 3-тієніл, 2,3-дигідро-1-, -2-, -3-, -4- або 5--піроліл, 2,5-дигідро-1-, -2-, -3-, -4- або 5--піроліл, 1-, 2або 3- піролідиніл, тетрагідро-1-, -2- або 4--імідазоліл, 2,3-дигідро-1-, -2-, -3-, -4- або 5--піразоліл, тетрагідро-1-, -3- або 4--піразоліл, 1,4-дигідро-1-, -2-, -3- або 4--піридил, 1,2,3,4- тетрагідро-1-, -2-, -3-, -4-, -5- або 6--піридил, 1-, 2-, 3- або 4- піперидиніл, 2-, 3- або 4- морфолініл, тетрагідро-2, -3- або 4--піраніл, 1, 4-діоксаніл, 1,3-діоксан-2-, -4- або 5-іл, гексагідро-1-, -3- або 4-піридазиніл, гексагідро-1-, -2-, -4- або 5--піримідиніл, 1-, 2- або 3- піперазиніл, 1,2,3,4тетрагідро-1-, -2-, -3-, -4-, -5-, -6-, -7- або 8--хіноліл, 1,2,3, тетрагідро-1-,-2-,-3-, -4-, -5-, -6-, -7- або 8--ізохіноліл, 2-, 3-, 5-, 6-, 7- або 8- ізохіноліл, 2-, 3-, 5-, 6-, 7- або 8- 3,4-дигідро-2H-бензо-1, 4оксазиніл, крім того переважно 2,3-метилендіоксифеніл, 3,4-метилендіоксифеніл, 2,3етилендіоксифеніл, 3,4-етилендіоксифеніл, 3,4-(дифторметилендіокси)феніл, 2,3дигідробензофуран-5- або 6-іл, 2,3-(2-оксометилендіокси)феніл або також 3,4-дигідро-2H-1,5бензодіоксепин-6- або 7-іл, більш переважно 2,3-дигідробензофураніл або 2, 2-дигідро-2оксофураніл. Het переважно являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути незаміщений або одно12 12 або двозаміщений A, C(R )2]mCON(R )2 і/або =O (карбонільним киснем). Het особливо переважно являє собою фурил, тієніл, піроліл, імідазоліл, піридил, піримідиніл, піразоліл, тіазоліл, піролідиніл, піперидиніл, морфолініл, тетрагідропіраніл, тетрагідрофураніл, тетрагідротієніл або піперазиніл, кожний з яких незаміщений або одно- або 12 12 двозаміщений A, C(R )2]mCON(R )2 і/або =O (карбонільним киснем). Het' переважно являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить 1 - 2 атома N і/або O, який може бути незаміщений або одно-, дво- або тризаміщений A, Hal, OH і/або OA. Het' особливо переважно являє собою моноциклічний насичений гетероцикл, що містить 1 2 атома N і/або O, який може бути незаміщений або одно- або двозаміщений A. В подальшому варіанті здійснення, Het' найбільше переважно являє собою піролідиніл, піперидиніл Незалежно від подальших заміщень, Het являє собою, наприклад, 2- або 3- фурил, 2- або 3- тієніл, 1-, 2- або 3- піроліл, 1-, 2, 4- або 5- імідазоліл, 1-, 3-, 4- або 5- піразоліл, 2-, 4або 5- оксазоліл, 3-, 4- або 5- ізоксазоліл, 2-, 4- або 5- тіазоліл, 3-, 4- або 5- ізотіазоліл, 2-, 3- або 4- піридил, 2-, 4-, 5- або 6- піримідиніл, більш переважно 1,2,3- триазол-1-, -4- або 5-іл, 1,2,4триазол-1-, -3- або 5-іл, 1- або 5- тетразоліл, 1,2,3 оксадіазол-4- або 5-іл, 1,2,4 оксадіазол-3- або 5-іл, 1,3,4- тіадіазол-2- або 5-іл, 1,2,4-тіадіазол-3- або-5, 1,2,тіадіазол-4 або 5-іл, 3- або 4 7 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 піридазиніл, піразиніл, 1-, 2-, 3-, 4-, 5-, 6- або 7- індоліл, 4- або 5- ізoіндоліл, 1-, 2-, 4- або 5бензімідазоліл, 1-, 2-, 3-, 4-, 5-, 6- або 7- індазоліл, 1-, 3-, 4-, 5-, 6- або 7- бензопіразоліл, 2-, 4-, 5-, 6- або 7- бензоксазоліл, 3-, 4-, 5-, 6- або 7- бензизоксазоліл, 2-, 4-, 5-, 6- або 7- бензотіазоліл, 2-, 4-, 5-, 6- або 7- бензизотіазоліл, 4-, 5-, 6- або бенз-2,1, 3-оксадіазоліл, 2-, 3-, 4-, 5-, 6-, 7- або 8- хіноліл, 1-, 3-, 4-, 5-, 6-, 7- або 8- ізохіноліл, 3-, 4-, 5-, 6-, 7- або 8- -іннолинил, 2-, 4-, 5-, 6-, 7або 8- хіназолиніл, 5- або 6- хіноксалініл, 2-, 3-, 5-, 6-, 7- або 8-2 H-бензо-1, 4-оксазиніл, крім того переважно 1,3-бензодіоксол-5-іл, 1,4-бензодіоксан-6-іл, 2,1,3-бензотіадіазол-4- або -5-іл або 2,1, 3-бензоксадіазол- 5-іл. Гетероциклічні радикали також можуть бути частково або повністю гідровані. Таким чином, Het також може являти собою, наприклад, 2,3-дигідро-2-, -3-, -4- або -5-фурил, 2,5-дигідро-2-, -3-, -4- або 5-фурил, тетрагідро-2- або 3--фурил, 1, 4-іл, тетрагідро-2- або 3-тієніл, 2,3-дигідро-1-, -2-, -3-, -4- або 5--піроліл, 2,5-дигідро-1-, -2-, -3-, -4- або 5--піроліл, 1-, 2або 3- піролідиніл, тетрагідро-1-, -2- або 4--імідазоліл, 2,3-дигідро-1-, -2-, -3-, -4- або 5--піразоліл, тетрагідро-1-, -3- або 4--піразоліл, 1,4-дигідро-1-, -2-, -3- або 4--піридил, 1,2,3,4- тетрагідро-1-, -2-, -3-, -4-, -5- або 6--піридил, 1-, 2-, 3- або 4- піперидиніл, 2-, 3- або 4- морфолініл, тетрагідро-2, -3- або 4--піранил, 1, 4-діоксаніл, 1,3-діоксан-2-, -4- або 5-іл, гексагідро-1-, -3- або 4-піридазиніл, гексагідро-1-, -2-, -4- або 5--піримідиніл, 1-, 2- або 3- піперазиніл, 1,2,3,4тетрагідро-1-, -2-, -3-, -4-, -5-, -6-, -7- або 8--хіноліл, 1,2,3, тетрагідро-1-,-2-,-3-, -4-, -5-, -6-, -7- або 8--ізохіноліл, 2-, 3-, 5-, 6-, 7- або 8- ізохіноліл, 2-, 3-, 5-, 6-, 7- або 8- 3,4-дигідро-2H-бензо-1, 4оксазиніл, крім того переважно 2,3-метилендіоксифеніл, 3,4-метилендіоксифеніл, 2,3етилендіоксифеніл, 3,4-етилендіоксифеніл, 3,4-(дифторметилендіокси)феніл, 2,3дигідробензофуран-5- або 6-іл, 2,3-(2-оксометилендіокси)феніл або також 3,4-дигідро-2H-1,5бензодіоксепин-6- або 7-іл, більш переважно 2,3-дигідробензофураніл або 2, 2-дигідро-2оксофураніл. Het переважно являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути незаміщений або одно12 12 або двозаміщений A, C(R )2]mCON(R )2 і/або =O (карбонільним киснем). Het особливо переважно являє собою фурил, тієніл, піроліл, імідазоліл, піридил, піримідиніл, піразоліл, тіазоліл, піролідиніл, піперидиніл, морфолініл, тетрагідропіраніл, тетрагідрофураніл, тетрагідротієніл або піперазиніл, кожний з яких незаміщений або одно- або 12 12 двозаміщений A, C(R )2]mCON(R )2 і/або =O (карбонільним киснем). Het' переважно являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить 1 - 2 атома N і/або O, який може бути незаміщений або одно-, двух- або тризаміщений A, Hal, OH і/або OA. Het' особливо переважно являє собою моноциклічний насичений гетероцикл, що містить 1 2 атома N і/або O, який може біути незаміщений або одно- або двозаміщений A. В подальшому варіанті здійснення, Het' переважно являє собою піролидиніл, піперидиніл, морфолініл або піперазиніл. В подальшому варіанті здійснення, Het' особливо переважно являє собою фурил, тієніл, піроліл, імідазоліл, піридил, піримідиніл, піразоліл, тіазоліл, індоліл, піролідиніл, піперидиніл, морфолініл або піперазиніл, кожний з яких незаміщений або одно-, дво- або тризаміщений A, Hal, OH і/або OA. Моно- або біциклічний насичений, ненасичений або ароматичний гетероцикл являє собою, наприклад, 2- або 3- фурил, 2- або 3- тієніл, 1-, 2- або 3- піроліл, 1-, 2, 4- або 5- імідазоліл, 1-, 3-, 4- або 5- піразоліл, 2-, 4- або 5- оксазоліл, 3-, 4- або 5- ізоксазоліл, 2-, 4- або 5- тіазоліл, 3-, 4або 5- ізотіазоліл, 2-, 3- або 4- піридил, 2-, 4-, 5- або 6- піримідиніл, більш переважно 1,2,3триазол-1-, -4- або 5-іл, 1,2,4- триазол-1-, -3- або 5-іл, 1- або 5-тетразоліл, 1,2,3-оксадіазол-4або 5-іл, 1,2,4- оксадіазол-3- або 5-іл, 1,3,4-тіадіазол-2- або 5-іл, 1,2,4-тіадіазол-3- або -5-іл, 1,2, тіадіазол-4- або 5-іл, 3- або 4- піридазиніл, пиразиніл, 1-, 2-, 3-, 4-, 5-, 6- або 7- індоліл, 4- або 5ізoіндоліл, 1-, 2-, 4- або 5- бензімідазоліл, 1-, 2-, 3-, 4-, 5-, 6- або 7-індазоліл, 1-, 3-, 4-, 5-, 6- або 7- бензопіразоліл, 2-, 4-, 5-, 6- або 7- бензоксазоліл, 3-, 4-, 5-, 6- або 7- бензизоксазоліл, 2-, 4-, 5-, 6- або 7- бензотіазоліл, 2-, 4-, 5-, 6- або 7- бензизотіазоліл, 4-, 5-, 6- або 7-бенз-2,1, 3оксадіазоліл, 2-, 3-, 4-, 5-, 6-, 7- або 8- хіноліл, 1-, 3-, 4-, 5-, 6-, 7- або 8- ізохіноліл, 3-, 4-, 5-, 6-, 7або 8- циннолініл, 2-, 4-, 5-, 6-, 7- або 8- хіназолиніл, 5- або 6- хіноксалініл, 2-, 3-, 5-, 6-, 7- або 8-2H-бензо-1, 4-оксазиніл, крім того переважно 1,3-бензодіоксол-5-іл , 1,4-бензодіоксан-6-іл, 2,1,3-бензотіадіазол-4- або 5-іл або 2,1,3- бензоксадіазол-5-іл, крім того, 2,3-дигідро-2-, -3-, -4або 5--фурил, 2,5- дигідро-2-, -3-, -4- або 5- фурил, тетрагідро-2- або 3-фурил, 1,3-диоксолан-4іл, тетрагідро-2- або 3--тієніл, 2,3-дигідро-1-, -2-, -3-, -4- або -5-піроліл, 2,5-дигідро-1-, -2-, -3-, -4або -5-піроліл, 1-, 2- або 3-піролідиніл, тетрагідро-1-, -2- або -4-імідазоліл, 2,3-дигідро-1-, -2-, -3-, -4- або -5-піразоліл, тетрагідро-1-, -3- або -4-піразоліл, 1,4-дигідро-1-, -2-, -3- або -4-піридил, 8 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 1,2,3,4-тетрагідро-1-, -2-, -3-, -4-, -5- або -6-піридил, 1-, 2-, 3- або 4-піперидиніл, 2-, 3- або 4-морфолініл, тетрагідро-2-, -3- або -4-піранил, 1,4-диоксаніл, 1,3-діоксан-2-, -4- або -5-іл, гексагідро-1-, -3- або -4-піридазиніл, гексагідро-1-, -2-, -4- або -5-піримідиніл, 1-, 2- або 3-піперазиніл, 1,2,3,4-тетрагідро-1-, -2-, -3-, -4-, -5-, -6-, -7- або -8-хіноліл, 1,2,3,4-тетрагідро-1-, 2-, -3-, -4-, -5-, -6-, -7- або -8-ізохіноліл, 2-, 3-, 5-, 6-, 7- або 8- 3,4-дигідро-2H-бензо-1,4-оксазиніл, 2,3-метиленіоксифеніл, 3,4-метилендиоксифеніл, 2,3-етилендиоксифеніл, 3,4етилендіоксифеніл, 3,4-(дифторметилендіокси)феніл, 2,3-дигідробензофуран-5- або 6-іл, 2,3-(2оксометилендіокси)феніл або також 3,4-дигідро-2H-1,5-бензодиоксепін-6- або -7-іл, крім того, 2,3-дигідробензофураніл або 2,3-дигідро-2-оксофураніл. Сполуки формули I можуть мати один або декілько хіральних центрів і тому можуть зустрічатися в різних стереоізомерних формах. Формула I охоплює всі ці форми. Таким чином, винахід відноситься, зокрема, до сполук формули I, у яких щонайменше один із зазначених радикалів має одне із кращих значень, зазначених вище. Деякі кращі групи сполук можуть бути представлені наступними подформулами Ia - It, які відповідають формулі I і в яких значення радикалів суттєво не відрізняються від значень, наведених для формули I, але в яких 1 2 в Ia R , R , 3 4 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, Hal, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 12 12 12 10 11 [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, O[C(R )2]mAr, S(O)n[C(R )2]mHet, O-Alk-NR R , O-Alk-O10 11 12 12 Alk-NR R , O-Alk-O-R або S(O)n[C(R )2]mAr; 1 12 12 10 11 10 11 в Ib R являє собою H, O[C(R )2]mHet, O[C(R )2]mAr, O-Alk-NR R , O-Alk-O-Alk-NR R , O12 12 12 12 Alk-O-R або [C(R )2]mO[C(R )2]mR ; 2 в Ic R являє собою H; 3 12 12 12 12 12 12 в Id R являє собою Hal, [C(R )2]mAr, [C(R )2]mHet, [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, 12 12 12 O[C(R )2]mAr, S(O)n[C(R )2]mHet або S(O)n[C(R )2]mAr; 3 12 12 12 12 12 12 в Ie R являє собою Hal, [C(R )2]mAr, [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, O[C(R )2]mAr 12 абоS(O)n[C(R )2]mAr; 4 в If R являє собою H; 5 6 в Ig R , R , 7 8 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 12 12 [C(R )2]mOCOA, [C(R )2]mO[C(R )2]mR або COOR 5 в Ih R являє собою H; 6 12 12 12 12 12 12 в Ii R являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, [C(R )2]mOCOA, [C(R )2]mO[C(R )2]mR 12 або COOR ; 7 в Ij R являє собою H; 8 в Ik R являє собою H; 9 12 в Il R являє собою H, A або [C(R )2]mHet 10 11 в Im R , R кожний, незалежно друг від друга, являє собою H або A; в In A являє собою нерозгалужений або розгалужений алкіл, що містить 1- 10 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S і/або NH і/або додатково 1- 7 атомів водню можуть бути замінені F, Cl і/або Br, або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, який незаміщений або однозаміщений =O; 12 12 12 в Io Ar являє собою феніл, який незаміщений або однозаміщений O[C(R )2]mr , S(O)nr або 12 Sonn(R )2; в Ip Het являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути незаміщений або одно- або 12 12 двозаміщений A, C(R )2]mCON(R )2 і/або =O (карбонільним киснем); в Iq Het являє собою фурил, тієніл, піроліл, імідазоліл, піридил, піримідиніл, піразоліл, тіазоліл, піролідиніл, піперидиніл, морфолініл, тетрагідропіраніл, терагідрофураніл, тетрагідротієніл або піперазиніл, кожний з яких незаміщений або одно- або двозаміщений A, 12 12 [C(R )2]mCON(R )2 і/або =O (карбонільним киснем); 1 2 в Ir R , R , 3 4 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, Hal, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 10 11 [C(R )2]mO[C(R )2]mR , O-Alk-NR R , 10 11 12 12 12 12 O-Alk-O-Alk-NR R , O-Alk-O-R , O[C(R )2]mHet, O[C(R )2]mAr, S(O)n[C(R )2]mHet або 12 S(O)n[C(R )2]mAr,D являє собою 9 UA 100532 C2 5 5 10 15 20 25 30 6 R ,R , 7 8 12 12 R , R кожний, незалежно друг від друга, являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, 12 12 12 12 12 [C(R )2]mOCOA, [C(R )2]mO[C(R )2]mR або COOR , 9 12 R являє собою H, A або [C(R )2]mHet, 10 11 R , R кожний, незалежно друг від друга, являє собою H або A, A являє собою нерозгалужений або розгалужений алкіл, що містить 1- 10 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S і/або NH і/або додатково 1- 7 атомів водню можуть бути замінені F, Cl і/або Br, або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, який незаміщений або однозаміщений =O, Alk являє собою нерозгалужений або розгалужений алкілен, що містить 1, 2, 3 або 4 атомів вуглецю, 12 12 12 Ar являє собою феніл, який незаміщений або однозаміщений [C(R )2]mR , S(O)nR або 12 SOnN(R )2, Het являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути незаміщений або одно- або двозаміщений A, 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, незаміщений або однозаміщений за допомогою =O, Hal являє собою F, Cl, Br або I, m являє собою 0, 1, 2, 3 або 4, n являє собою 0, 1 або 2, 1 12 12 10 11 10 11 в Is R являє собою H O[C(R )2]mHet, O[C(R )2]mAr, O-Alk-NR R , O-Alk-O-Alk-NR R , 12 12 12 12 O-Alk-O-R або[C(R )2]mO[C(R )2]mR , 2 R являє собою H, 3 12 12 12 12 12 12 R являє собою Hal[C(R )2]mAr, [C(R )2]mO[C(R )2]mR , O[C(R )2]mHet, O[C(R )2]mAr або 12 S(O)n[C(R )2]mAr, 4 R являє собою H, D являє собою 10 UA 100532 C2 R7 S { R5 N R8 { , , N N R6 R9 N { , N { èëè { N N N 5 5 10 15 20 25 30 35 40 R являє собою H, 6 12 12 12 12 12 12 R являє собою H, A, [C(R )2]mAr, [C(R )2]mHet, [C(R )2]mOCOA, [C(R )2]mO[C(R )2]mR або 12 COOR , 7 R являє собою H, 8 R являє собою H, 9 12 R являє собою H, A або [C(R )2]mHet, 10 11 R , R кожний, незалежно друг від друга, являє собою H або A, A являє собою нерозгалужений або розгалужений алкіл, що містить 1- 10 атомів вуглецю, у якому одна або дві несуміжні CH2 групи можуть бути замінені O, S і/або NH і/або додатково 1- 7 атомів водню можуть бути замінені F, Cl і/або Br, або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, який незаміщений або однозаміщений =O, Alk являє собою нерозгалужений або розгалужений алкілен, що містить 1, 2, 3 або 4 атомів вуглецю, 12 12 12 Ar являє собою феніл, який незаміщений або однозаміщений O[C(R )2]mR , S(O)nR або 12 SOnN(R )2, Het являє собою моноциклічний насичений, ненасичений або ароматичний гетероцикл, що містить від 1 до 4 атомів N, O і/або S, який може бути незаміщений або одно- або двозаміщений A, 12 R являє собою H або нерозгалужений або розгалужений алкіл, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю або являє собою циклоалкіл, що містить 3-7 атомів вуглецю, незаміщений або однозаміщений за допомогою =O, Hal являє собою F, Cl, Br або I, m являє собою 0, 1, 2, 3 або 4, n являє собою 0, 1 або 2; 12 в It R являє собою H; 1 за умови, що якщо D являє собою тіазол, те R не являє собою OCH2Ar або OCH2Het; і їх фармацевтично придатні солі й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Сполуки відповідно до винаходу, а також вихідні речовини для їхнього одержання можуть, крім того, бути отримані за допомогою методів, відомих per se, як описано в літературі (наприклад, у стандартних роботах, таких як Hоuben-Weyl, Methoden der organischen Chemie [Методи органічної хімії], Georg-Thieme-Verlag, Штутгарт), відповідно до умов реакцій, які відомі й прийнятні для зазначених реакцій. Також при цьому можна застосовувати різноманітні модифікації, які відомі per se, але про яких тут докладно не згадується. Якщо це є бажаним, вихідні речовини також можуть утворюватися in situ шляхом не виділення їх з реакційної суміші, але замість цього вони потім відразу перетворюються в сполуки відповідно до винаходу. Вихідні сполуки, як правило, відомі. Однак, якщо вони є новими, то вони можуть бути отримані за допомогою способів, відомих per se. 45 11 UA 100532 C2 Сполуки формули I, де S { D являє собою R5 , N R6 5 10 15 20 25 30 переважно можуть бути отримані шляхом взаємодії сполуки формули II зі сполукою формули III. У сполуках формули III L являє собою Cl, Br, OH або реакційно-здатну естерифіковану OH групу. Якщо L являє собою реакційно-здатну естерифіковану OH групу, то вона переважно являє собою алкілсульфонілокси, що містить 1-6 атомів вуглецю (переважно метилсульфонілокси) або арилсульфонілокси, що містить 6-10 атомів вуглецю (переважно феніл- або п- толілсульфонілокси, і також 2-нафталінсульфонілокси). Реакцію здійснюють за допомогою методів, які відомі фахівцеві в даній галузі техніки. Звичайно реакцію здійснюють в інертному розчиннику. Вихідні речовини формул II і III у деяких випадках відомі. Якщо вони не є відомими, то вони можуть бути отримані за допомогою способів, відомих per se. Підходящими інертними розчинниками є, наприклад, вуглеводні, такі як гексан, петролейний ефір, бензол, толуол або ксилол; хлоровані вуглеводні, такі як трихлоретилен, 1, 2-дихлоретан, четирихлористий вуглець, хлороформ або дихлорметан; спирти, такі як метанол, етанол, ізопропанол, н-пропанол, н-бутанол або тре-бутанол; прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, тетрагідрофуран (ТГФ) або діоксан; гліколеві ефіри, такі як етиленглікольмонометиловий або моноетиловий ефір, етиленглікольдиметиловий ефір (диглим); кетони, такі як ацетон або бутанон; аміди, такі як ацетамід, диметилацетамід або диметилформамід (ДМФА); нітрили, такі як ацетонітрил; сульфоксиди, такі як диметилсульфоксид (ДMСО); сірковуглець, карбонові кислоти, такі як мурашина кислота або оцтова кислота, нітросполуки, такі як нітрометан або нітробензол; складні ефіри, такі як етилацетат, або суміші зазначених розчинників. Залежно від застосовуваних умов, тривалість реакції перебуває в інтервалі від декількох хвилин до 14 днів, температура реакції перебуває в інтервалі приблизно від -30° до 140, звичайно в інтервалі від -10° до 110, більш переважно від приблизно 20° до приблизно 100°. Сполуки формули I, де R7 R8 { D являє собою , N N R9 35 40 45 переважно можуть бути отримані шляхом взаємодії сполуки формули IV зі сполукою формули V. Реакцію переважно здійснюють у присутності каталізатора, такого як трис-( дибензилиденацетон)-дипаладій і BINAP (2,2'-біс(дифенілфосфіно)-1,1'-бінафтил). BINAP є лігандом для каталізатора. Іншими кращими лігандами є три-( o-толіл)-фосфін, дициклогексилфосфіно2',4',6'-триізопропілбіфеніл, дициклогексилфосфіно-2',6'-диметокси-1,1'-біфеніл, 2-( ди-третбутилфосфіно)біфеніл або хлор( ди-2-норборнілфосфіно)( 1-іл)паладій (II). Звичайно реакцію здійснюють у присутності речовини, що зв'язує кислоту, переважно гідроксиду лужного або лужноземельного металу, карбонату або бікарбонату або іншої солі слабкої кислоти лужних або лужноземельних металів, переважно калію, натрію, кальцію або цезію. Додавання органічної основи, такої як триетиламін, диметиланілін, піридин або хінолін також може бути сприятливим. Особливо кращими є трет-бутилат натрію або трет-бутилат калію. Вихідні речовини формул IV і V у деяких випадках відомі. Якщо вони не є відомими, то вони можуть бути отримані за допомогою способів, відомих per se. Більш докладно, реакцію сполук формул IV і V здійснюють у присутності або відсутності інертного розчинника й при температурах, як описано вище. 12 UA 100532 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, представляється можливим перетворювати радикал R у сполуки формули I в 6 інший радикал R шляхом, наприклад, перетворення галогенової групи в ароматичний гетероцикл або перетворення складноефірної групи у спиртову групу. Інші радикали можуть бути перетворені шляхом відновлення нітрогруп (наприклад, шляхом гідрування на нікелі Ренея або Pd/куті в інертному розчиннику, такому як метанол або етанол) до аміногруп або гідролізу ціано груп до COOH груп. Крім того, вільні аміногрупи можуть бути ацилюванні загальноприйнятим способом, використовуючи хлорангідрид кислоти або ангідрид або алкілування, використовуючи незаміщений або заміщений алкілгалогенід, сприятливо в інертному розчиннику, такому як дихлорметан або ТГФ, і/або в присутності основи, такого як триетиламін або піридин, при температурах в інтервалі від –60 до +30°. Складні ефіри можуть бути омилені, наприклад, використовуючи NaОН або KOH у воді, воді/ТГФ або воді/діоксані при температурах в інтервалі від 0 до 100°. Карбонові кислоти можуть бути перетворені, наприклад, використовуючи тіонілхлорид, у відповідні хлориди карбонових кислот, і ці хлориди можуть бути перетворені в карбоксаміди. При видаленні з них води загальновідомим способом одержують карбонітрили. Фармацевтичні солі й інші форми Сполуки, розкриті у винаході, можуть використовуватися у своїй заключній, несольовій формі. З іншого боку, даний винахід також відноситься до застосування таких сполук у формі їх фармацевтично прийнятних солей, які можуть бути отримані за допомогою різноманітних органічних і неорганічних кислот і основ у відповідності зі способами, добре відомими в даній галузі техніки. Фармацевтично прийнятні форми солей сполук формули I готовлять, головним чином, при використанні традиційних способів. У випадку, якщо сполуки формули I містять групу карбонової кислоти, то його прийнятна сіль може бути утворена за допомогою реакції сполуки із прийнятною основою для одержання відповідної солі приєднання основи. Прикладами таких основ є гідроксиди лужних металів, включаючи гідроксид калію, гідроксид натрію й гідроксид літію; гідроксиди лужноземельних металів, такі, як гідроксид барію й гідроксид кальцію; алкоксиди лужних металів, наприклад, етанолят калію й пропанолят натрію; а також різні органічні основи, такі, як піперидин, діетанолaмін і N-метилглутамін. Сюди також включені солі алюмінію сполук формули I. Для деяких сполук формули I солі приєднання кислоти можуть бути утворені шляхом обробки зазначених сполук фармацевтично прийнятними органічними й неорганічними кислотами, наприклад, гідрогалогенідами, такими, як гідрохлорид, гідробромід або гідройодид; іншими мінеральними кислотами, і їх відповідними солями такими, як, сульфат, нітрат або фосфат, і ін.; і алкіл- і моноарилсульфонатами, такими, як етансульфонат, толуолсульфонат і бензолсульфонат; і іншими органічними кислотами, їх відповідними солями, такими, як ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат, aскорбат і ін. Таким чином, фармацевтично прийнятні солі приєднання кислоти сполук формули I включають наступні солі, але не обмежуються тільки ними: ацетат, адипат, aльгінат, aргінат, аспартат, бензоат, бензолсульфонат (безилат), бісульфат, бісульфіт, бромід, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропіонат, диглюконат, дигідрофосфат, динітробензоат, додецилсульфат, етансульфонат, фумарат, галактерат ( зі слизевої кислоти), галактуронат, глюкогептаноат, глюконат, глутамат, гліцерофосфат, гемісукцинат, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, йодид, ізетіонат, ізобутират, лактат, лактобіонат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногідрофосфат, 2-нафталинсульфонат, нікотинат, нітрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенілацетат, 3-фенілпропіонат, фосфат, фосфонат, фталат. Крім того, основні солі сполук відповідно до винаходу включають, але не обмежуються тільки ними, солі алюмінію, амонію, кальцію, міді, заліза (III), заліза (II), літію, магнію, марганцю (III), марганцю (II), калію, натрію й цинку. Кращими серед перерахованих вище солей є амонійні; солі лужних металів натрію й калію; і солі лужноземельних металів кальцію й магнію. Солі сполук формули I, які мають походження від фармацевтично прийнятних органічних нетоксичних основ, включають, але не обмежуються тільки ними, солі первинних, вторинних і третинних амінів, заміщених амінів, також включаючи природні заміщені аміни, циклічні аміни й основні іонообмінні смоли, наприклад, аргінін, бетаїн, кофеїн, хлорпрокаїн, холін, N, N'дибензилетилендіамін (бензатин), дициклогексиламін, діетаноламін, діетиламін, 2діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лідокаїн, лізин, меглумін, N-метил-D-глюкамін, морфолін, піперазин, піперидин, поліаміні смоли, прокаїн, пурини, теобромін, триетаноламін, триетиламін, триметиламін, трипропіламін і трис 13 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 (гідроксиметил)метиламін (трометамін). Сполуки відповідно до даного винаходу, які включають основні, що містять азот групи, можуть бути кватернізувані за допомогою таких агентів, як (C1- C4)алкілгалогеніди, наприклад, метил-, етил-, ізопропіл- і тре-бутилхлориди, броміди і йодиди; ди(C1- C4)алкілсульфати, наприклад, диметил-, діетил- і діамілсульфати; (C10- C8)алкілгалогеніди, наприклад, децил-, додецил-, лауріл-, міристил- і стеарил хлориди, броміди і йодиди; і арил(C 1- C4)алкілгалогеніди, наприклад, бензилхлорид і фенетилбромід. Зазначені солі дозволяють одержувати як розчинні у воді, так і розчинні в маслі сполуки відповідно до винаходу. Кращі фармацевтичні солі, зазначені вище, включають, але не обмежуються тільки ними, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемісукцинат, гіпурат, гідрохлорид, гідробромід, ізетіонат, манделат, меглумін, нітрат, олеат, фосфонат, півалат, фосфат натрію, стеарат, сульфат, сульфосаліцилат, тартрат, тіомалат, тозилат і трометамін. Кислотно-адитивні солі основних сполук формули I одержують шляхом приведення в контакт форми вільних основ з достатньою кількістю бажаної кислоти для одержання солі традиційним способом. Вільна основа можна регенерувати шляхом приведення в контакт форми солі з основою й виділення вільної основи традиційним способом. Форми вільної основи до деякої міри відрізняються від своїх відповідних форм солей своїми певними фізичними властивостями, такими, як розчинність у полярних розчинниках, однак у всім іншому солі є еквівалентними своїм відповідним до форм вільних основ для цілей даного винаходу. Як було зазначено, фармацевтично прийнятні солі приєднання основи сполук формули I утворюються з металами або амінами, такими, як лужні метали й лужноземельні метали або органічні аміни. Кращі метали являють собою натрій, калій, магній і кальцій. Кращі органічні аміни являють собою N,N'-дибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, етилендіамін, N-метил-D-глюкамін і прокаїн. Солі приєднання основи кислих сполук відповідно до винаходу одержують шляхом приведення в контакт форми вільної кислоти з достатньою кількістю бажаного основи для одержання солі традиційним способом. Форма вільної кислоти може бути регенерована шляхом приведення в контакт форми солі з кислотою й виділення форми вільної кислоти відомим способом. Форми вільної кислоти до деякої міри відрізняються від своїх відповідних форм солей певними фізичними властивостями, такими, як розчинність у полярних розчинниках, однак у всім іншому солі є еквівалентними своїм відповідним до форм вільних кислот для цілей даного винаходу. Якщо сполуки відповідно до винаходу включає більш ніж одну групу, яка здатна до утвору фармацевтично прийнятних солей цього типу, то винахід також охоплює складові солі. Приклади типових складених форм солей включають, але не обмежуються тільки ними, бітартрат, діацетат, дифумарат, димеглумін, дифосфат, динатрій і тригідрохлорид. У світлі описаного вище можна побачити, що вираження «фармацевтично прийнятна сіль» у контексті даної заявки призначене для позначення активного компонента, яке включає сполуки формули I у формі своєї солі, особливо в тому випадку, якщо зазначена форма солі забезпечує зазначеному активному компоненту поліпшені фармакокінетичні властивості в порівнянні з вільною формою зазначеного активного компонента або іншою сіллю зазначеного активного компонента, які використовувалися раніше. Фармацевтично прийнятна форма солі активного компонента може також спочатку забезпечувати бажану фармакокінетичну властивість зазначеному активному компоненту, яких він раніше не мав, а також може навіть позитивно впливати на фармакодинаміку зазначеного активного компонента у відношенні його терапевтичної активності в організмі. Сполуки формули I відповідно до винаходу можуть бути хіральними завдяки їхній молекулярній структурі й, відповідно, можуть зустрічатися в різних енантіомерних формах. Тому вони можуть існувати в рацемічній або в оптично активній формі. Тому що фармацевтична активність рацематів або стеріоізомерів сполук відповідно до винаходу може відрізнятися, то може бути бажаним використання енантіомерів. У цих випадках, кінцевий продукт або навіть проміжні продукти можуть бути розділені на енантіомерні сполуки хімічними або фізичними способами, відомими фахівцеві в даній галузі техніки, або навіть використовуватися як такі в синтезі. У випадку рацемічних амінів, діастереомери виділяють із суміші реакцією з оптично активним розділяючим агентом. Прикладами підходящих розділяючих агентів є оптично активні кислоти, такі як R і S форми винної кислоти, діацетилвінної кислоти, дибензоїлвінної кислоти, мигдальної кислоти, яблучної кислоти, молочної кислоти, підходящих N-захищених амінокислот (наприклад, N-бензоїлпроліну або N-бензолсульфонілпроліну), або різні оптично активні камфорсульфонові кислоти. Також кращим є хроматографічний поділ енантіомерів за 14 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою оптично активного розділяючого агента (наприклад, динітробензоїлфенілгліцину, триацетату целюлози або інших похідних вуглеводнів або хірально модифікованих полімерів метакрилату, іммобілізованих на силікагелі). Підходящими для цієї мети елюентами є водні або спиртові суміші розчинників, такі як, наприклад, гексан/ізопропанол/ацетонітрил, наприклад, у відношенні 82:15:3. Винахід також відноситься до застосування сполук і/або їх фізіологічно прийнятних солей для приготування лікарського засобу (фармацевтичної композиції), зокрема, за допомогою нехімічних методів. Вони можуть бути перетворені в підходящу дозовану форму разом із щонайменше одним твердим, рідким і/або напіврідким наповнювачем або допоміжною речовиною й, при необхідності, у комбінації з одним або декількома іншими активними компонентами. Винахід, крім того, відноситься до лікарських засобів, що містять щонайменше одну сполуки відповідно до винаходу і/або його фармацевтично придатні солі й стереоізомери, включаючи їх суміші у всіх співвідношеннях, і, необов'язково, наповнювачі і/або допоміжні речовини. Лікарські препарати можуть уводитися у вигляді дозованих одиниць, які містять заздалегідь установлену кількість активного компонента на дозовану одиницю. Така одиниця може включати, наприклад, від 0,5 мг до 1 г, переважно від 1 мг до 700 мг, більш переважно від 5 мг до 100 мг, сполуки відповідно до винаходу, залежно від хворобливого стану, що зазнає лікування, способу введення, а також віку, ваги тіла й стану пацієнта, або фармацевтичні композиції можуть уводитися у вигляді дозованих одиниць, які містять заздалегідь установлену кількість активного компонента на дозовану одиницю. Кращими дозованими одиницями лікарських препаратів є ті, які містять добову дозу або частину добової дози, як зазначено вище, або відповідну порцію їх активного компонента. Лікарські засоби цього типу також можуть бути отримані способом, який добре відомий в галузі фармацевтики. Лікарські препарати можуть адаптуватися для введення за допомогою будь-якого підходящого способу, наприклад, шляхом перорального (включаючи букальне або під'язичне), ректального, назального, місцевого (включаючи букальне, під'язичне або трансдермальне), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне або внутрішньошкірне) уведення. Такі препарати можуть бути приготовлені за допомогою будьякого способу, відомого в галузі фармацевтики, наприклад, шляхом об'єднання активного компонента з наповнювачем(ями) або допоміжним(ими) речовиною(ами). Лікарські препарати, адаптовані для перорального введення, можуть уводитися у вигляді окремих одиниць, таких як, наприклад, капсули або таблетки; порошки або гранули; розчини або суспензії у водних або неводних рідинах; харчових пін або пінистих харчових продуктів; або рідких емульсій масло-в-воді або рідких емульсій вода-у-маслі. Так, наприклад, у випадку перорального введення у вигляді таблетки або капсули, активний компонент може бути об'єднаний з пероральним, нетоксичним і фармацевтично прийнятним інертним наповнювачем, таким як, наприклад, етанол, гліцерин, вода й т.п. Порошки одержують шляхом здрібнювання сполуки до підходящого невеликого розміру й змішування її з фармацевтичним наповнювачем, здрібненим аналогічним способом, таким як, наприклад, харчовий вуглеводень, такий як, наприклад, крохмаль або маніт. Також можна додавати ароматизатор, консервант, диспергувальну речовину й барвник. Капсули одержують шляхом приготування порошкової суміші, як описано вище, і заповнюють нею желатинові капсули певної форми. Перед заповненням капсул до порошкової суміші можна додавати ковзні й змащувальні речовини, такі як, наприклад, високо дисперсна кремнієва кислота, тальк, стеарат магнію, стеарат кальцію або поліетиленгліколь у твердій формі. Для поліпшення доступності лікарського засобу, укладеного в капсулу, також можна додавати дезінтегрувальну речовину або солюбілізатор, такий як, наприклад, агар-агар, карбонат кальцію або карбонат натрію. Додатково, якщо це є бажаним або необхідним, у суміш також можна додавати підходящі зв’язуючі , що змазують речовини, дезінтегратори, а також барвники. Підходящими сполучними є крохмаль, желатин, природні цукри, такі як, наприклад, глюкоза або бета-лактоза, підсолоджувателі , приготовлені з кукурудзи, природніх і синтетичних гум, таких як, наприклад, аравійська камедь, трагакантова камедь або альгінат натрію, карбоксиметилцелюлоза, поліетиленгліколь, воски й т.п. Змащувальні речовини, які можуть застосовуватися в таких дозованих формах, включають олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію й т.п. Дезінтегратори включають, але не обмежуються тільки ними, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь і т.п. Лікарські засоби у вигляді таблеток одержують, наприклад, шляхом приготування порошкової суміші, гранулювання або сухого пресування суміші, додавання змащувальної речовини й 15 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 дезінтегратора й пресування отриманої суміші в таблетки. Порошкову суміш готовлять шляхом змішування сполуки, здрібненого підходящим чином, з розріджувачем або основою, як описано вище, і необов'язково зі зв'язуючим , таким як, наприклад, карбоксиметилцелюлоза, альгінат, желатин або полівінілпіролідон, сповільнювачем розчинення, таким як, наприклад, парафін, підсилювачем поглинання, таким як, наприклад, четвертинна сіль, і/або абсорбентом, таким як, наприклад, бентоніт, каолін або дикальційфосфат. Порошкову суміш можна гранулювати шляхом змочування зі зв'язуючем, таким як, наприклад, сироп, крохмальна паста, слиз акації або розчини целюлози або полімерних речовин і пресування її через сито. У якості альтернативи грануляції, порошкову суміш можна пропускати через таблетувальну машину, одержуючи шматки неправильної форми, які розпадаються, утворюючи гранули. Гранули можна замаслювати шляхом додавання стеаринової кислоти, стеарата, тальку або мінерального масла для запобігання злипання в таблетувальній ливарній формі. Після цього змазану суміш спресовують, одержуючи таблетки. Сполуки відповідно до винаходу також можна поєднувати із сипучим інертним наповнювачем і потім піддавати прямому пресуванню, одержуючи таблетки без здійснення стадій грануляції або сухого пресування. Таблетки також можна покривати прозорим або світлонепроникним захисним шаром, що складається із запечатуючого шелакового шару, шару цукру або полімерної речовини й глянсового шару воску. До цих покриттів також можна додавати барвники для можливості розрізнення між різними дозовними одиницями. Рідини для перорального введення, такі як, наприклад, розчин, сиропи й еліксири, можуть бути приготовлені у вигляді дозовних одиниць таким чином, щоб вони містили заздалегідь установлену кількість сполук. Сиропи можуть бути отримані шляхом розчинення сполуки у водяному розчині з підходящим ароматизатором, тоді як еліксири готовлять із застосуванням нетоксичного спиртового наповнювача. Суспензії можуть бути приготовлені шляхом диспергування сполуки в нетоксичному наповнювачі. Також можна додавати солюбілізатори й емульсифікатори, такі як, наприклад, етоксиліровані ізостеарилові спирти й поліоксіетиленові ефіри сорбіту, консерванти, ароматичні добавки, такі як, наприклад, масло м'яти перцевої, або натуральні замінники цукру або сахарин, або інші штучні замінники цукру й т.п. Лікарські препарати для перорального введення у вигляді дозованих одиниць можуть бути інкапсульовані в мікрокапсули, якщо це є бажаним. Також лікарський препарат може бути приготовлений таким чином, щоб пролонгувати або сповільнити вивільнення, наприклад, шляхом застосування покриттів або забивання необхідної речовини в полімери, віск і т.п. Сполуки відповідно до винаходу і їх солі, сольвати й фізіологічно функціональні похідні також можуть уводитися у вигляді ліпосомних систем доставки, таких як, наприклад, невеликі одношарові пухирці, більші одношарові пухирці й багатошарові пухирці. Ліпосоми можуть бути утворені за допомогою різних фосфоліпідів, таких як, наприклад, холестерин, стеариламін або фосфатидилхоліни. Сполуки відповідно до винаходу і їх солі, сольвати й фізіологічно функціональні похідні також можуть доставлятися за допомогою моноклональних антитіл як індивідуальних носіїв, до яких приєднані молекули сполуки. Сполуки також можуть бути з'єднані з розчинними полімерами в якості націліючих носіїв, лікарських засобів. Такими полімерами можуть бути полівінілпіролідон, співполімер пірану, полігідроксипропілметакриламідофенол, полігідроксиетиласпартамідофенол або поліетиленоксид полілізину, заміщений пальмітоїловими радикалами. Крім того, сполуки можна зв'язувати з біорозкладаємими полімерами, які придатні для забезпечення контрольованого вивільнення лікарського засобу, наприклад полімолочною кислотою, полі-епсилон-капролактоном, полігідроксимасляною кислотою, поліортоефірами, поліацеталями, полідигідроксипіранами, поліціаноакрилатами й перехресно-зшитими або амфіпатичними блок-співполімерами гідрогелів. Лікарські препарати, адаптовані для трансдермального введення, можуть уводитися у вигляді незалежних пластирів для подовженого, тісного контакту з епідермісом реципієнта. Таким чином, наприклад, активний компонент може доставлятися із пластиру шляхом іонофорезу, як у загалі описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтичні композиції, адаптовані для місцевого введення, можуть бути приготовлені у вигляді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, спреєв, аерозолів або масел. Для лікування очей або інших зовнішніх тканин, наприклад рота й шкіри, переважно застосовуються лікарські препарати у вигляді місцевої мазі або крему. Для приготування лікарського препарату у вигляді мазі активний компонент може застосовуватися з парафіновою або мазевою основою, що змішується з водою. Альтернативно, для одержання крему активний компонент може бути приготовлений з основою для крему типу масло-в-воді або основою вода 16 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 у-маслі. Лікарські препарати, адаптовані для місцевого введення в очі, включають очні краплі, у яких активний компонент розчинений або суспендований у підходящому носії, переважно у водному розчиннику. Лікарські препарати, адаптовані для місцевого введення в порожнину рота, включають коржа, пастилки й рідини для полоскання рота. Лікарські препарати, адаптовані для ректального введення, можуть уводитися у вигляді супозиторіїв або клізм. Лікарські препарати, адаптовані для інтраназального введення, у яких носій являє собою тверду речовину, включають крупний порошок, що має розмір часточок, наприклад, в інтервалі 20-500 мікронів, який уводиться шляхом вдихання, тобто шляхом швидкого вдиху через ніс із контейнера, що містить порошок, який притримують біля носа. Підходящі лікарські препарати для введення у вигляді інтраназального аерозолю або носових крапель із рідиною в якості носія включають розчини активної речовини у воді або в маслі. Лікарські препарати, адаптовані для введення шляхом інгаляції, включають тонкоподрібнені часточки у вигляді пилу або туману, які можуть бути отримані за допомогою різних диспергувальних обладнань під тиском з аерозолями, розпилювачами або інсуфляторами. Лікарські препарати, адаптовані для вагінального введення, можуть уводитися у вигляді песаріїв, тампонів, кремів, гелів, паст, пін або аерозолів. Лікарські препарати, адаптовані для парентерального введення, включають водні або неводні стерильні розчини для ін'єкцій антіоксиданти, що містять, буфери, бактеріостатичні речовини й розчинені речовини, за допомогою яких лікарський засіб підтримується ізотонічним стосовно крові реципієнта, що зазнає лікування; і водні або неводні стерильні суспензії, які можуть містити суспензійне середовище й загусники. Лікарські препарати можуть уводитися за допомогою ємностей для одноразового або багаторазового введення, наприклад, запечатаних ампул і флаконів, і зберігатися в ліофілізованому стані, при цьому безпосередньо перед уведенням необхідно тільки додати стерильну рідину-носій, наприклад, воду для ін'єкцій. Розчини й суспензії для ін'єкцій, приготовлені згідно з рецептурою, можуть бути приготовлені зі стерильних порошків, гранул і таблеток. Також є очевидним, що додатково до кращих вищеописаних складових, лікарські препарати також можуть містити інші речовини, які використовуються в даній галузі для конкретних типів лікарських засобів; наприклад, лікарські препарати, придатні для перорального введення, можуть містити ароматизатори. Терапевтично ефективна кількість сполуки відповідно до винаходу залежить від багатьох факторів, включаючи, наприклад, вік і вагу людини або тварини, певний хворобливий стан, який необхідно лікувати, і його тяжкість, природу лікарського засобу й спосіб уведення, і в остаточному підсумку воно може бути визначене лікарем або ветеринаром. Проте, ефективна кількість сполуки відповідно до винаходу, як правило, перебуває в інтервалі від 0,1 до 100 мг/кг ваги тіла реципієнта (ссавця) на добу й переважно звичайно перебуває в інтервалі від 1 до 10 мг/кг ваги тіла на добу. Отже добова кількість, що діє, для дорослого ссавця вагою 70 кг звичайно може становити від 70 до 700 мг, причому ця кількість може вводитися у вигляді окремої дози один раз на день або звичайно у вигляді циклів часткових доз (таких як, наприклад, два, три, чотири, п'ять або шість раз) на день, таким чином, що загальна добова доза є аналогічною. Ефективна кількість її солі або сольвату або фізіологічно функціонального похідного може бути визначене у вигляді частки ефективної кількості сполуки відповідно до винаходу per se. Також передбачається, що подібні дози придатні для лікування інших станів, зазначених у даній заявці. Крім того, винахід відноситься до лікарських засобів, що містять щонайменше одну сполуку відповідно до винаходу і/або її фармацевтично придатні солі й стереоізомери, включаючи їх суміші у всіх співвідношеннях, і щонайменше один додатковий активний компонент лікарського засобу. Винахід також відноситься до комплекту (набору), що складається з окремих пакетів (а) ефективної кількості сполуки відповідно до винаходу і/або її фармацевтично придатних солей і стеріоізомерів, включаючи їх суміші у всіх співвідношеннях, і (б) ефективної кількості додаткового активного компонента лікарського засобу. Комплект включає підходящі ємності, такі як коробки, індивідуальні пляшки, пакети або ампули. Комплект може включати, наприклад, окремі ампули, кожна з яких містить ефективну кількість сполуки відповідно до винаходу і/або її фармацевтично придатних солей і стеріоізомерів, включаючи їх суміші у всіх співвідношеннях, 17 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 і ефективна кількість додаткового активного компонента лікарського засобу в розчиненій або ліофілізованої формі. Застосування Сполуки згідно даному винаходу придатні в якості фармацевтичних активних компонентів для ссавців, зокрема для людей, для лікування діабету 1 і 2 типу, ожиріння, невропатії і/або нефропатії. Таким чином, винахід відноситься до застосування сполук відповідно до пункту 1 і їх фармацевтично прийнятних солей і стеріоізомерів, включаючи їх суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування діабету 1 і 2 типу, ожиріння, невропатії і/або нефропатії. Сполуки згідно із даним винаходом можуть застосовуватися в якості профілактичних або терапевтичних засобів для лікування захворювань або порушень, опосередкованих недостатніми рівнями активності глюкокінази або які можна лікувати шляхом активації глюкокінази, включаючи, але не обмежуються тільки ними, цукровий діабет, порушення толерантності до глюкози, IFG (порушення засвоювання глюкози натщесерце) і IFG (порушена глікемія натщесерце), а також інших захворювань і порушень, таких які обговорюються нижче. Крім того, сполуки згідно із даним винаходом також можуть застосовуватися для запобігання прогресування суміжного типу, порушення толерантності до глюкози, IFG (порушення засвоювання глюкози натщесерце) або IFG (порушеної глікемії натщесерце) до цукрового діабету. Сполуки згідно із даним винаходом також можуть застосовуватися в якості профілактичних або терапевтичних засобів ускладнень діабету, таких як, але не обмежуються тільки ними, невропатія, нефропатія, ретинопатія, катаракта, макроангіопатія, остеопенія, діабетична гіперосмолярна кома), інфекційні захворювання (наприклад, інфекція дихальних шляхів, інфекція сечовивідних шляхів, інфекція шлунково-кишкового тракту, інфекція дермальних м'яких тканин, інфекція нижніх кінцівок і ін.), діабетична гангрена, сухість у роті, зниження слуху, порушення мозкового кровообігу, порушення периферичного кровообігу й ін. Сполуки згідно із даним винаходом також можуть застосовуватися в якості профілактичних або терапевтичних засобів для лікування захворювань і порушень, таких як, але не обмежуються тільки ними, ожиріння, метаболічний синдром (синдром X), гіперінсулінемія, втрата чутливості, індукована гіперінсулінемією, дисліпопротеїнемія (аномальне поширення ліпопротеїнів у крові), включаючи діабетичну дисліпідемію, гіперліпідемію, гіперліпопротеїнемію (надлишок ліпопротеїнів у крові), включаючи тип I, Il-a (гіперхолестеринемію), Il-b, III, IV (гіпертригліцеридемію) і V (гіпертригліцеридемію), низькі рівні ЛВП, високі рівні ЛНП, атеросклероз і його наслідок, рестеноз судин, нейродегенеративне захворювання, депресія, розлади ЦНС, стеатоз печінки, остеопороз, підвищений кров'яний тиск, захворювання бруньок (наприклад, діабетична нефропатія, гломерулонефрит, гломерулосклероз, нефротичний синдром, гіпертонічний нефросклероз, термінальний бруньковий розлад і ін.), інфаркт міокарда, стенокардія, і порушення мозкового кровообігу (наприклад, ішемічний інсульт, апоплексія мозку). Сполуки згідно із даним винаходом також можуть застосовуватися в якості профілактичних або терапевтичних засобів для лікування захворювань і порушень, таких як, але не обмежуються тільки ними, остеопороз, жирова інфільтрація печінки, підвищений кров'яний тиск, синдром резистентності до інсуліну, запальні захворювання (наприклад, хронічний ревматоїдний артрит, що деформує спондиліт, остеоартрит, люмбаго, подагра, післяопераційне або травматичне запалення, ремісія набряклості, невралгія, фаринголарингіт, цистит, гепатит (включаючи неалкогольний стеатогепатит), запалення легенів, запальний коліт, неспецифічний виразковий коліт), панкреатит, синдром вісцерального ожиріння, кахексія (наприклад, ракова кахексія, туберкульозна кахексія, діабетична кахексія, кахексія при захворюванні крові, ендокринопатична кахексія, інфекційна кахексія, кахексія, викликана синдромом набутого імунодефіциту), синдром полікістозу яєчників, м'язова дистрофія, пухлина (наприклад, лейкоз, рак молочної залози, рак передміхурової залози, рак шкіри й ін.), синдром роздратованої товстої кишки, гостра або хронічна діарея,деформуючий спондиліт, остеоартрит, ремісія набряклості, невралгія, фаринголарингіт, цистит, синдром раптової дитячої смерті, і інші. Сполуки згідно із даним винаходом можуть застосовуватися в комбінації з одним або декількома додатковими лікарськими засобами, як описано нижче. Доза другого лікарського засобу приблизно може бути обрана на основі клінічно застосовуваної дози. Співвідношення сполуки формули I і другого лікарського засобу приблизно може бути визначено відповідно до суб'єкта, якому вводять, способом уведення, цільовим захворюванням, клінічним станом, комбінацією й іншими факторами. У тих випадках, коли суб'єктом, якому вводять, є людина, то, 18 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, другий лікарський засіб можна використовувати в кількості від 0,01 до 100 масової частки щодо масової частки сполуки формули I. Друга сполука складу фармацевтичної комбінації або схеми лікування переважно доповнює активність сполуки формули I, у такий спосіб вони не мають несприятливий вплив один на одного. Такі лікарські засоби підходяще перебувають у комбінації в кількостях, які ефективні для даної мети. Відповідно, в іншому аспекті даного винаходу забезпечується композиція, яка містить сполуки формули I, або його сольват, метаболіт, або фармацевтично прийнятну сіль або пролекарство, у комбінації із другим лікарським засобом, таким як описано в даній заявці. Сполуки формули I і додатковий (і) фармацевтично активний (і) засіб (и) може (можуть) уводитися разом в одній фармацевтичній композиції або окремо й, у випадку роздільного введення воно може здійснюватися одночасно або послідовно в будь-якому порядку. Таке роздільне введення може бути близьким у часі або віддаленим у часі. Кількості сполуки формули I і другого (их) засобу (засобів) і тимчасові проміжки введення вибирають для досягнення бажаної комбінованої терапевтичної дії. Комбінована терапія може забезпечувати "синергізм" і демонструвати "синергійну", тобто досягаєму дію при спільному використанні активних компонентів перевищує суму дій, що виникають при роздільному використанні сполук. Синергійна дія досягається, якщо активні компоненти: (1) спільно приготовлені й уводяться або доставляються одночасно в комбінованому, одиничному дозованому препараті; (2) доставляються шляхом чергування або паралельного введення у вигляді роздільних препаратів; або (3) шляхом деяких інших режимів. Якщо доставка здійснюється шляхом терапії, що чергується, то синергійна дія може бути досягнута, коли сполуки вводять або доставляються послідовно, наприклад, шляхом різних ін'єкцій у різних шприцах. У цілому, при здійсненні терапії, що чергується, ефективну дозу кожного активного компонента вводять послідовно, тобто, серійно, тоді як при комбінованій терапії, ефективні дози двох або більш активних компонентів уводять спільно. Сполуки згідно із даним винаходом можуть застосовуватися, наприклад, у комбінації з додатковим (і) лікарським (і) засобом (ами), таким як лікарський засіб для лікування цукрового діабету, і/або лікарський засіб для лікування ускладнень діабету, як визначено вище. Приклади відомих лікарських засобів для лікування цукрового діабету, які можна використовувати в комбінації із сполукою формули I, включають препарати інсуліну (наприклад, препарати тваринного інсуліну, екстраговані з підшлункової залози великої рогатої худоби або свиней; препарати інсуліну людину, синтезовані за допомогою генно-інженерних методик, використовуючи Escherichia coli або дріжджі), фрагмент або його похідні (наприклад, Ins-i), засобу для поліпшення резистентності до інсуліну (наприклад, піоглітазон гідрохлорид, троглітазон, росиглітазон або його малеат, GI-262570, JTT-50 1, MCC-555, YM-440, KRP-297, Csoil, FK-614), інгібітори альфа-глюкозидази (наприклад, воглібоза, акарбоза, міглітол, еміглімат), бігуаніди (наприклад, фенформін, метформін, бутформін, підсилювачі секреції інсуліну [сульфоніл сечовини (наприклад, толбутамід, глібенкламід, гліклазид, хлорпропамід, толазамід, ацетогексамід, гліклопірамід, глімепірид, гліпізид, глібузол), репаглінід, натеглінід, мітиглінід або гідрат його кальцієвої солі, GLP-1J, інгібітори дипептидилпептидази IV (наприклад, NVP-DPP278, PT-100), агоністи бета-3 (наприклад, CL-3 16243, SR-58611-A, UL-TG-307, SB-226552, AJ9677, Bms-l96085, AZ-40140, і ін.), агоністи аміліну (наприклад, прамлінтид), інгібітори фосфотирозин-фосфатази (наприклад, ванадієва кислота), інгібітори глюконеогенезу (наприклад, інгібітори глікоген-фосфорилази, інгібітори глюкоза-6-фосфатази, антагоністи глюкагону), інгібітори SGLT ( до-транспортер натрій-глюкоза) (наприклад, T-1095), і інші. Прикладами відомих лікарських засобів для лікування ускладнень діабету є інгібітори альдозо-редуктази (наприклад, толрестат, епаїрестат, зенарестат, зопобестат, мінаїрестат, фідарестат (SNK-860), Ct-i 12), нейротрофічні фактори (наприклад, NGF, NT-3, BDNF), промотори секреції продукції нейротрофічних факторів, інгібітори PKC (наприклад, LY-333531), інгібітори AGE (наприклад, ALT946, пімагедин, піратоксантин, N-фенацилтіазолий бромід (ALT766), EXO-226), уловлювачі активного кисню (наприклад, ліпоєва кислота), і церебральні судинорозширювальні засоби (наприклад, типурид, мексилетин). Сполуки згідно із даним винаходом також можуть застосовуватися, наприклад, у комбінації з антигіперліпідемічними засобами. Згідно з епідеміологічними даними, гіперліпідемія розглядається в якості первинного фактора ризику виникнення серцевосудинних захворювань (CСЗ) внаслідок атеросклерозу. Останнім часом, увагу було зосереджено на зниженні рівня холестерину в плазмі, і, зокрема, холестерину низької щільності, у якості істотного етапу запобігання CСЗ. Серцевосудинні захворювання широко поширені в пацієнтів з діабетом, щонайменше частково внаслідок наявності множинних незалежних факторів ризику в цій популяції. Таким 19 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 чином, успішне лікування гіперліпідемії в загальній популяції, і в пацієнтів з діабетом, зокрема, є дуже важливою медичною проблемою. Прикладами антигіперліпідемічних засобів є сполуки статину, які є інгібіторами синтезу холестерину (наприклад, церивастатин, правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, ітавастатин або їх солі й ін.), інгібітори синтезу сквалену або сполуки фібрату (наприклад, безафібрат, клофібрат, симфібрат, клінофібрат), що володіють знижуючою дією на рівні тригліцеридів, і інші. Сполуки згідно із даним винаходом також можуть використовуватися, наприклад, у комбінації з гіпотензивними засобами. Підвищений кров'яний тиск пов'язаний з підвищеними рівнями інсуліну в крові, стан, відоме як гіперінсулінемія. Інсулін, пептидний гормон, первинними діями якого є сприяння засвоєнню глюкози, синтезу білка й формуванню й секреції нейтральних ліпідів, але також його дія полягає, вчастності, у стимуляції росту клітин судин і підвищенні втримання натрію в нирках. Ці останні функції можуть здійснюватися без впливу на рівні глюкози і є відомими причинами підвищеного кров'яного тиску. Ріст периферичної судинної мережі може викликати, наприклад, звуження периферичних капілярів, тоді як утримуваний натрій підвищує обсяг циркулюючої крові. Таким чином, зниження рівня інсуліну в людей з гіперінсулінемією може запобігати аномальному росту судин і втриманню натрію нирками, викликане високими рівнями інсуліну, і, таким чином, полегшує підвищений кров'яний тиск. Прикладами гіпотензивних засобів є інгібітори ангіотензин-перетворюючого ферменту (наприклад, каптоприл, еналаприл, делаприл), антагоністи ангіотензину II (наприклад, кандесартан цилексетил, лосартан, епросартан, валсартан, термісартан, ірбесартан, тазосартан), антагоністи кальцію (наприклад, манідипін, ніфедипін, нікардипін, амлодипін, ефонідипін), і клонідин. Сполуки згідно із даним винаходом можна використовувати в комбінації із засобами для лікування ожиріння. Термін "ожиріння" охоплює надлишок жирової тканини. Ожиріння є добре відомим фактором ризику розвитку багатьох розповсюджених захворювань, таких як діабет, атеросклероз і підвищений кров'яний тиск. Деякою мірою апетит контролюється певними ділянками гіпоталамуса: центр голоду у вентролатеральному ядрі гіпоталамуса (VLH) і центр ситості у вентромедіальному гіпоталамусі (VMH). У кору головного мозку надходять позитивні сигнали із центру голоду, які стимулюють харчування, а центр ситості модулює той процес шляхом відправлення інгібуючих імпульсів у центр голоду. Деякі регуляторні процеси можуть впливати на ці гіпоталамічні центри. Центр ситості може активуватися при підвищених концентраціях глюкози в плазмі крові і/або інсуліну, які виникають після споживання їжі. Прикладами засобів для лікування ожиріння є засоби для лікування ожиріння, які діють на центральну нервову систему (наприклад, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, анфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс), інгібітори ліпази підшлункової залози (наприклад, орлістат), бета-3 агоністи (наприклад, CL-3 16243, SR-5861 1-A, UL-TG-307, SB-226552, AJ-9677, BMS-196085, AZ-40l40), аноректичені пептиди (наприклад, лептін, CNTF (циліарний нейротрофічний фактор) і агоністи холецистокініну (наприклад, лінтитрипт, FPL-1 5849). Дослідження Скринінгове дослідження активації глюкокінази GK активність (фермент людини або пацюка) вимірювали за допомогою сполученого ферментного аналізу, використовуючи піруваткіназу (PK) і лактатдегідрогеназу (LDH) у якості сполучених ферментів. GK активність розраховували на основі зниження NADH, за яким спостерігали фотометрично, в аналізаторі для титраційного мікропланшета (MТР) при 340 нм. Для скринінгу, GK аналіз проганяли звичайним способом у форматі 384-MТР, у загальному обсязі 33 мкл/лунку. 10 мкл AТР-регенераційного розчину (в HEPES - буфері*, pН 7,0, 6,73 ед./мл піруваткінази, 6,8 ед./мл лактатдегідрогенази) і 10 мкл розчину глюкокіназа-/глюкоза (15 мкг/мл, 6,6 мМ глюкоза в HEPES-буфері*, pН 7,0 ; концентрація маткового розчину глюкози становила 660 мМ в Millipore H 2O) змішували разом з 3 мкл 10 % розчину ДМСО (в HEPESбуфері*, pН 7,0) утримуючого 3,3-кратні кількості сполук для досягнення фінальної концентрації в інтервалі від 1 нМ до 30 мкМ (іноді 300 мкМ) у досліджуваному розчині (див. нижче). Розчини змішували протягом 5 секунд, і після центрифугування при 243xg протягом 5 хвилин, розчини попередньо інкубували протягом 25 хвилин при кімнатній температурі. Реакцію запускали шляхом додавання 10 мкл розчину NADH-/АТР (4,29 мМ NADH, 4,95 мМ АТР, в HEPES-буфері*). MТР струшували протягом 5 секунд, і потім, безупинно аналізували абсорбцію при 340 нм на MТР-аналізаторі (TECAN Spectro fluor plus) протягом наступних 27 хвилин (із заданим часом циклу MТР 199 секунд). Кінцеві концентрації різних компонентів були наступними: 49,5 мМ Hepes, pН 7,0, 1,49 мМ PEP,1,3 мМ NADH, 49,5 мМ KСl, 4,96 мМ MgСl 2, 1,5 мМ Mg-АТР, 1,98 мМ DTT, 2,04 ед./мл піруваткінази, 2,06 ед./мл лактатдегідрогенази, 0,91 % 20 UA 100532 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДМСО, 0,15мкг/лунку глюкокінази, і сполуки, що тестуються, в інтервалі від 1 нМ до 300 мкМ. Зміна оптичної щільності (ΔOD340 nm) у присутності сполуки виражали відносно ΔOD 340 nm, ctrl контрольного інкубування (у присутності 2 мМ глюкози й 0,91 % ДМСО), беручи до уваги оптичну щільність холостої проби (інкубування при відсутності 2 мМ глюкози). Для визначення напівмаксимальної ефективної концентрації (EC50), %- Ctrl-значення представляли на графіку в напівлогарифмічному масштабі відносно конц. сполуки, що представляє інтерес. Базові координати пристосовували до функції S-подібної кривої (f(x) = ((%-Ctrlmax - %-Ctrlmin)/(1 – n(Hill) (EC50/x** )) + %-Ctrlmin)) за допомогою нелінійного регресійного аналізу. Hepes-Буфер (50 мМ Hepes,, pН 7,0, 5 мМ MgСl2, 50 мМ KСl, 1,5 мМ PEP, 0,1% BSA). DTT додавали до Hepes-буферу з 200X маткового розчину (в Millipore H2O), свіжоприготовленого щодня. Кінцева концентрація DTT в HEPES-буфері становила 2 мМ. Культура INS-1 клітин підшлункової залози INS-1 клітини культивували в повному середовищі, RPMI1640 , що містить 1 мМ піруват натрію, 50 мкМ 2-меркаптоетанолу, 2 мМ глутаміну, 10 мМ HEPES, 100 МЕ/мл пеніциліну, і 100 мкг/мл стрептоміцину (CM), доповненою 10 мМ глюкози, і 10% (об./об.) інактивованої нагріванням фетальної телячої сироватки (FCS), як описано Asfari і ін. (Endocrinology 130: 167178, 1992). Дослідження секреції інсуліну INS-1 висівали й культивували в планшетах на 48 лунках. Після культивування протягом 2 днів, середовище видаляли й клітини культивували протягом 24 годин із середовищем, заміненим на 5 мМ глюкози, 1% FCS. Потім клітини промивали із Кребс-Рингер бікарбонат HEPES буфером (KRBH; 135 мМ NaСl; 3,6 мМ KСl; 5 нМ NaНСО 3; 0,5 нМ NaН2PO4; 0,5 мМ MgСl2; 1,5 мМ CaСl2 і 10 мМ HEPES; pН 7,4) 0,1% BSA, що містить 2,8 мМ глюкози й попередньо інкубували протягом 30 хвилин при 37°C у тому ж буфері. Потім клітини промивали два рази й інкубували протягом 1 години на KRBH 0,1% BSA, що містить 2,8 або 4,2 мМ глюкози й різні концентрації молекули, що тестуються. Концентрації інсуліну в зібраних супернатантах вимірювали за допомогою ELISA, використовуючи антитіла до інсуліну пацюків (Insulin Rat Elit PLUS, посилання каталогу 10-1145-01). Для ілюстрації винаходу, включені наступні приклади. Проте, слід враховувати, що ці приклади не обмежують винахід і призначені тільки для вказівки методу практичного здійснення винаходу. Для фахівців у даній галузі техніки буде очевидним, що описані хімічні реакції легко можуть бути адаптовані для приготування різних інших активаторів глюкокінази згідно з винаходом, і альтернативні методи приготування сполук згідно із даним винаходом розглядаються як охоплювані обсягом даного винаходу. Наприклад, синтез сполук відповідно до винаходу, не представлених у прикладах, легко може бути здійснений за допомогою модифікацій, відомих для фахівців у даній галузі техніки, наприклад, за допомогою відповідно захищених протидіючих груп, шляхом використання інших підходящих реагентів, відомих у даній галузі, що відрізняються від описаних у даній заявці, і/або шляхом здійснення загальноприйнятих модифікацій умов реакцій. Альтернативно, інші реакції, описані в даній заявці або відомі в даній галузі техніки, розглядаються як придатні для приготування інших сполук згідно з винаходом. Вище й нижче, уся температура зазначена в градусах Цельсія °C. У наступних прикладах, “звичайна обробка” позначає: при необхідності, додають воду, значення pН установлюють, при необхідності, в інтервалі від 2 до 10, залежно від складу кінцевого продукту, суміш екстрагують етилацетатом або дихлорметаном, фази розділяють, органічну фазу висушують над сульфатом натрію й випаровують, і продукт очищають шляхом хроматографії на силікагелі і/або шляхом кристалізації. Rf значення на силікагелі; елюент: етилацетат/метанол 9:1. Мас-спектрометрія (MС): EI (іонізація + електронним ударом) M FAB (бомбардування швидкими атомами) + (M+H) ESI (електророзпилювальна іонізація) + (M+H) (якщо спеціально не зазначене інакше) Точки плавлення (tпл.): точки плавлення визначали за допомогою BÜCHI Melting Point B-540 Умови ЖХ-MС і ВЕЖХ У наступних прикладах зазначені дані маси отримані при вимірах ЖХ-MС іон, що відповідає + + (M+H або M+Na ) представлений у вигляді m/z: Система Hewlett Packard серії HP 1100 з наступними характеристиками: Джерело іонів: Електророзпилювання (позитивний режим); Сканування: 100-1000 m/z; Напруга фрагментації: 60 В; Температура газу: 300°C, DAD: 220 нм. 21 UA 100532 C2 5 10 Швидкість потоку: 2,4 мл/хв. Використовуваний розподільник зменшував швидкість потоку для МС після DAD до 0,75 мл/хв. Колонка: Chromolith Speed ROD RP-18e 50-4.6 Розчинник: LiСhrosolv категорія від компанії Merck Kgaa Розчинник A: H2O (0,01% ТФУ) Розчинник B: ACN (0,01% ТФУ) Метод A: За 2,8 хв. від 80 % A до 100 % B, потім за 0,2 хв. 100 % B і 1 хв. 80 %A; Метод B: Градієнт за 3 хв. від 95 % A до 100 %B, потім за 0,8 хв. 95 % A; Метод C: За 2 хв. від 90 % A до 100 % B, потім за 3 хв. 100 % B і 1 хв. 90 % A; Метод D: 1 хв. 100 % A. За 2,5 хв. від 100 % A до 100 % B, потім за 1,5 хв. 100 % B і 1 хв. 100 % A. Приклад 1 Приготування (2-іл)-(2-іл)-аміну ("A1") Br S N 15 20 25 30 Амонійтіоціанат (76 ммоль, 1,2 екв.) розчиняли в ацетоні (75 мл) і по краплях додавали бензоїлхлорид (1 екв.). Після перемішування протягом 20 хв. при КТ, реакцію нагрівали в колбі зі зворотним холодильником. Додавали 2-аміно-5-бромпіридин (71 ммоль) в ацетоні (50 мл) і нагрівали протягом 30 хв. у колбі зі зворотним холодильником. Після цього реакційний розчин виливали в лід. Осад фільтрували й промивали водою/метанолом (1:1). Осад розчиняли в 2M NaОН (120 мл) при 80 °C і перемішували 10 хвилин при 80 °C. Розчин вливали в HСl розчин (5 %) при 0°C. pН розчину доводили до 8 за допомогою насиченого розчину Na 2CO3. Отриманий осад фільтрували й промивали водою. (5-Бром-піридин-2-іл)-тіосечовину ("1") одержували після висушування у вакуумі при 40 °C у вигляді світло-жовтої твердої речовини з виходом 63 %. + ВЕЖХ (метод C): 1,43 хв.; ЖХ-МС (метод A): 1,062 хв., 231,95 (MH ). (5-Бром-піридин-2-іл)-тіосечовину (1 ммоль) розчиняли в ДМФА (2 мл) і додавали 1-хлорпропан-2-он (1 екв.) у ДМФА (2 мл) і перемішували протягом 2 годин при 70 °C. Після охолодження до КТ реакційний розчин вливали у воду й отриманий осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. (5-Бром-піридин-2-іл)-( 4-метил-тіазол-2-іл)-амін одержували у вигляді безбарвного порошку з виходом 86 %; t пл. 241,5+ 1 242,6 °C; ВЕЖХ (метод C): 1,55 хв., 269,95 (M+H ) ; ЖХ-МС (метод A): 1,432 хв.; H-ЯМР (ДМСОd6, 400 МГц): [част. на млн.] 11,314 (s, 1H), 8,363 (d, 1H, J=2,9 Гц), 7,865 (dd, 1H, J=2,9 Гц, J=8,9 Гц), 7,037 (d, 1H, J=8,9 Гц), 6,578 (s, 1H), 2,242 (s, 3H). Приклад 2 Приготування (4-бромметил-тіазол-2-іл)-(5-бром-піридин-2-іл)-аміну ("A2") Br S N 35 40 N N H N H N Br (5-Бром-піридин- 2-іл)-тіосечовину (2,5 ммоль) розчиняли в ДМФА (5 мл) і додавали 1,3дибромацетон (1 екв.) і перемішували протягом 2 годин при 70 °C. Після охолодження до КТ, реакційний розчин вливали у воду й отриманий осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. Після здійснення колонкової хроматографії (етилацетат/метанол(4-бромметил-тіазол-2-іл)-(5-бром-піридин-2-іл)-амін одержували у вигляді безбарвного порошку з виходом 16 %. ВЕЖХ (метод C): 1,92 хв.; ЖХ-МС (метод A): 1,977 хв., + 1 347,95 (M+H ); H-ЯМР (ДМСО-d6, 300 МГц): [част. на млн.] 11,583 (s, 1H), 8,391 (d, 1H, J= 2,4 Гц), 7,902 (dd, 1H, J=2,4 Гц, J=8,9 Гц), 7,119 (s, 1H), 7,023 (d, 1H, J=8,9 Гц), 4,622 (s, 2H). 22 UA 100532 C2 Приклад 3 Приготування (5-бром-піридин-2-іл)-( 4-імідазол-1-ілметил-тіазол-2-іл)-аміну ("A3") N N Br N N 5 10 N H (4-бромметил-тіазол-2-іл)-( 5-бром-піридин-2-іл)-амін (64 мкмоль, 1 екв.), імідазол (1 екв.), K2CO3 (3 екв.) і йодид калію (0,1 екв.) розчиняли в ацетонітрилі (1 мл) і нагрівали в колбі зі зворотним холодильником протягом 3 годин. Продукт очищали шляхом колонкової хроматографії: "A3" виділяли у вигляді безбарвного порошку (вихід 49 %). ВЕЖХ (метод C): 1,55 + хв., ЖХ-МС (метод A): 1,062 хв., 335,95 (M+H ). Приклад 4 Приготування етилового ефіру 2-(5-бром-піридин-2-іламіно)-тіазол-4- карбонової кислоти ("A4") Br 20 35 O (5-бром-піридин-2-іл)-тіосечовину (1 ммоль ) розчиняли в ДМФА (2 мл) і додавали етиловий ефір оксо-пропіонової кислоти (1 екв.) і перемішували протягом 2 годин при 70 °C. Суспензію розчиняли за допомогою ДМФА (2 мл). Після охолодження до КТ реакційний розчин вливали у воду й отриманий осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. "A4" одержували у вигляді безбарвного порошку з виходом 78 %; t пл. 299,8+ 300,8 °C; ВЕЖХ (метод C): 2,01 хв.; ЖХ-МС (метод A): 2,002 хв., 327,95 (M+H ); 1 H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,868 (s, 1H), 8,421 (d, 1H, J=2,3 Гц), 7,926 (dd, 1H, J=8,8 Гц, J=2,3 Гц), 7,891 (s, 1H), 6,991 (d, 1H, J=8,8 Гц), 4,265 (q, 2H, J=7,2 Гц), 1,297 (t, 3H, J=7,2 Гц). Приклад 5 Приготування 2-( 5-бром-піридин-2-іл аміно)-тіазол-4-ілметилового ефіру оцтової кислоти ("A5") S N 30 N N H Br 25 O S N 15 S N N H O O (5-бром-піридин-2-іл)-тіосечовину (1 ммоль) розчиняли в ДМФА (2 мл) і додавали 3-хлор-2оксо-пропіловий ефір оцтової кислоти (1 екв.) і перемішували протягом 2 годин при 70 °C. Після охолодження до КТ реакційний розчин вливали у воду й отриманий осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. "A5" одержували у вигляді безбарвного порошку з виходом 82 %; t пл. 200,9-201,6 °C; ВЕЖХ (метод C): 1,80 хв.; ЖХ+ 1 МС (метод A): 1,800 хв., 327,95 (M+H ); H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,516 (s, 1H), 8,391 (d, 1H, J=2,4 Гц), 7,892 (dd, 1H, J=8,9 Гц, J=2,4 Гц), 7,020 (d, 1H, J=8,9 Гц), 6,998 (s, 1H), 5,015 (s, 2H), 2,062 (s, 3H). Приклад 6 Приготування [2-(5-бром-піридин-2-іламіно)-тіазол-4-іл]- метанолу ("A6") Br S N N H N OH 2-(5-бром-піридин-2-іл аміно)-тіазол-4-ілметиловий ефір оцтової кислоти (0,29 ммоль) суспендували в етанолі (1 мл) і додавали 1 M NaОН (1 мл). Суспензію перемішували при КТ 23 UA 100532 C2 5 протягом 75 хвилин. Осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. "A6" одержували у вигляді безбарвного порошку з виходом 56 %; t пл. 207,0+ 209,0 °C; ВЕЖХ (метод C): 1,41 хв.); ЖХ-МС (метод A): 1,222 хв., 285,95 (M+H ); 1 (ДМСО-d6, 300 МГц): [част. на млн.] 11,335 (s, 1H), 8,372 (d, 1H, J=2,4 Гц), 7,870 (dd, 1H, J=8,9 Гц, J=2,4 Гц), 7,041 (d, 1H, J=8,9 Гц), 6,755 (s, 1H), 5,105 (s, 1H), 4,449 (s, 2H). Приклад 7 Приготування [4-(2-аміно-етилсульфанілметил)-тіазол-2-іл]-(5-бром-піридин-2-іл)-аміну ("A7") Br S N 10 15 20 N H N S (4-Бромметил-тіазол-2-іл)-( 5-бром-піридин-2-іл)-амін (177 мкмоль, 1 екв.), 2-аміно-тіо етанол (1,1 екв.) і K2CO3 (1,1 екв.) розчиняли в етанолі (3 мл) і перемішували протягом 1 години при КТ. Розчинник видаляли у вакуумі й залишок розчиняли в 0,5 M HСl і екстрагували етилацетатом. Водну фазу доводили до pН 12-14 за допомогою 32% NaОН і екстрагували етилацетатом. Органічні шари поєднували, екстрагували соляним розчином і висушували над сульфатом натрію. Продукт очищали шляхом препаративної колонкової хроматографії з оберненою фазою (вода/ацетоннітрил). "A7" одержували у вигляді безбарвного порошку з + 1 виходом 21 %; ВЕЖХ (метод C): 1,48 хв.; ЖХ-МС (метод A): 1,108 хв., 344,95 (M+H ); H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,400 (s, 1H), 8,342 (d, 1H, J=2,4 Гц), 7,855 (dd, 1H, J=8,9 Гц, J=2,4 Гц), 7,723 (s, 2H), 6,995 (d, 1H, J=8,9 Гц), 6,821 (s, 1H), 3,719 (s, 2H), 2,969-2,918 (m, 2H), 2,642 (t, 2H, J=7,8 Гц). Приклад 8 Приготування (5-фенокси-піридин-2-іл)-тіазол- 2-іл-аміну ("A8") O N S N H 25 30 35 40 45 50 NH2 N Фенол (25 ммоль) розчиняли в ДМФА (30 мл) і додавали NaН (1,1 екв., 60% суспензія в рідкому парафіні) при 0 °C. Додавали 5-бром-2-нітропіридин (1,0 екв.) у ДМФА (20 мл) і перемішували протягом 16 годин при КТ. Реакційний розчин вливали у воду й екстрагували етилацетатом. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO 4 і розчинник видаляли у вакуумі. 2-Нітро-5-фенокси-піридин одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді коричневого масла з виходом 78 %; + ВЕЖХ (метод A): 1,95 хв.; ЖХ-МС: 1,678 хв., 217,15 (M+H ). 2-Нітро-5-фенокси-піридин (11,3 ммоль) розчиняли в оцтовій кислоті (30 мл) при 35 °C. Після додавання води (30 мл), додавали цинковий пил (6 екв.) і реакційну суспензію нагрівали до 105 °C протягом 2,5 годин. Реакційну суспензію охолоджували до КТ і фільтрували. Фільтрат вливали в 3,5 % NaОН (700 мл) і екстрагували дихлорметаном. Об'єднані органічні фази екстрагували соляним розчином, висушували над MgSO 4 і розчинник видаляли у вакуумі. 5Фенокси-піридин-2-іламін одержували у вигляді рожевого порошку з виходом 90 %; ВЕЖХ + (метод C): 1,32 хв., ЖХ-МС (метод A): 0,531 хв., 187,15 (M+H ). 5-Фенокси-піридин-2-іламін (6,1 ммоль) розчиняли в ТГФ (70 мл), охолоджували до 0 °C і додавали 1,1’-тіокарбонілдіімідазол (1,5 екв.). Реакційний розчин перемішували протягом 3 днів при 0 °C. додавали 32 % NH4OH (14 мл) і перемішували протягом 2 годин при КТ. Розчинник видаляли у вакуумі й додавали воду (100 мл). Осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. (5-Фенокси-піридин-2-іл)-тіосечовину одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді + безбарвного порошку з виходом 52 %; ЖХ-МС (метод A): 1,525 хв., 246,15 (M+H ). (5-Фенокси-піридин-2-іл)-тіосечовину (0,3 ммоль) розчиняли в ДМФА (1 мл) і додавали хлорацетальдегід (1,1 екв., 55 % у воді) і перемішували протягом 2 годин при 70 °C. Після охолодження до КТ осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. (5-Фенокси-піридин-2-іл)-тіазол-2-іл-амін одержували у вигляді безбарвного порошку з виходом 66 %; tпл. 161,4-162,4 °C; ВЕЖХ (метод C): 1,69 хв.; ЖХ-МС (метод A): 1,559 + 1 хв., 270,15 (M+H ); H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,248 (s, 1H), 8,114 (d, 1H, J=2,7 Гц), 7,523 (dd, 1H, J=9,0 Гц, J=2,7 Гц), 7,387-7,355 (m, 3H), 7,151 (d, 1H, J=9,0 Гц), 7,107 (t, 1H, J=7,1 Гц), 6,997-6,967 (m, 3H). 24 UA 100532 C2 Приклад 9 Приготування 2-(5-фенокси-піридин-2-іламіно)-тіазол-4-ілметилового ефіру оцтової кислоти ("A9") O N S 5 10 15 S N 25 N H N N N N 35 40 45 OH 2-(-(5-фенокси-піридин-2-іламіно)-тіазол-4-ілметиловий ефір оцтової кислоти (0,44 ммоль) суспендували в етанолі (1,5 мл) і додавали 1 M NaОН (1,5 мл). Розчин перемішували при КТ протягом 3 годин. Реакційний розчин розчиняли водою. Осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. "A10" одержували у вигляді бежевого порошку з виходом 88 %; tпл. 130,0-131,0 °C; ВЕЖХ (метод C): 1,64 хв.; ЖХ-МС (метод A): 1,430 + 1 хв., 300,15 (M+H ); H-ЯМР (ДМСО-d6, 400 МГц): [част. на млн.] 11,221 (s, 1H), 8,102 (d, 1H, J=2,8 Гц), 7,515 (dd, 1H, J=8,9 Гц, J=2,8 Гц), 7,389-7,349 (m, 2H), 7,125-7,083 (m, 2H), 6,996-6,972 (s, 2H), 6,687 (s, 1H), 5,105 (t, 1H, J=5,3 Гц), 4,442 (d, 2H, J=5,3 Гц). Приклад 11 Приготування (5-бензилокси-піридин-2-іл)-(1- метил-1Н-піразол-3-іл)-аміну ("A11") O 30 O (5-фенокси-піридин-2-іл)-тіосечовину (0,86 ммоль) розчиняли в ДМФА (1 мл) і додавали оксо-пропіловий ефір оцтової кислоти (1,1 екв.) в 1 мл ДМФА й перемішували протягом 2 годин при 70 °C. Після охолодження до КТ осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. "A9" одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді безбарвного порошку з виходом 69 %; t пл. 158,5+ 1 160,5 °C; ВЕЖХ (метод C): 1,89 хв.; ЖХ-МС (метод A): 1,938 хв., 342,15 (M+H ); H-ЯМР (ДМСОd6, 500 МГц): 1 H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,375 (s, 1H), 8,105 (d, 1H, J=2,8 Гц), 7,519 (dd, 1H, J= 8,9 Гц, J=2,8 Гц), 7,389-7,347 (m, 2H), 7,120-7,088 (m, 2H), 6,995-6,978 (m, 2H), 6,918 (s, 1H), 5,007 (s, 2H), 2,064 (s, 3H). Приклад 10 Приготування [2-( -(5-фенокси-піридин-2-іламіно)- тіазол-4-іл]- метанолу ("A10") O 20 O N N H N H 2-Бром-5-гідроксипіридин (2 ммоль) розчиняли в ДМФА (2,5 мл) і додавали NaН (1,4 екв., 60% суспензія в рідкому парафіні). Через 30 хв. додавали бензилбромід (1,1 екв.) і реакцію перемішували протягом 16 годин при КТ. Реакційний розчин розчиняли водою й екстрагували метил трет-бутиловим ефіром. Об'єднані органічні шари висушували над Na 2SO4 і розчинник видаляли у вакуумі. (5-Бензилокси-2-бром-піридин одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді безбарвного порошку з виходом 64 %; ВЕЖХ + (метод C): 2,09 хв.; ЖХ-МС (метод A): 1,987 хв., 263,95 (M+H ). 5-Бензилокси-2-бром-піридин (0,53 ммоль), трет-бутилат натрію (1,4 екв.), трис(дибензилиден-ацетоні)-дипаладій (0,01 екв.), BINAP (0,01 екв.) і 1-метил-1Н- піразол-3-амін (1,2 екв.) заповнювали в атмосфері азоту в мікрохвильову реакційну посудину. Додавали дегазований толуол (50 екв.). Реакційну суспензію нагрівали до 120 °C протягом 10 хвилин. До реакційної суспензії додавали етилацетат і фільтрували через целіт. Розчинник фільтрату видаляли у вакуумі. "A11" одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді безбарвного порошку з виходом 29 %; ВЕЖХ (метод C): 1,60 хв.); + 1 ЖХ-МС (Метод A): 1,008 хв., 281,15 (M+H ); H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 8,859 (s, 1H), 7,886 (d, 1H, J=2,5 Гц), 7,449-7,429 (m, 3H), 7,400-7,370 (m, 2H), 7,342-7,308 (m, 2H), 7,246 (d, 1H, J=9,0 Гц), 6,169 (d, 1H, J=2,5 Гц), 5,062 (s, 2H), 3,709 (s, 3H). 25 UA 100532 C2 Приклад 12 Приготування (5-Бром-піридин-2-іл)-тіазол-2-іл-аміну ("A12") S S N 5 10 15 20 N N H (5-Бром-піридин-2-іл)-тіосечовину (2,5 ммоль) розчиняли в ДМФА (5 мл) і додавали хлорацетальдегід (1,3 екв., 55 % у воді) і перемішували протягом 5 годин при 70 °C. Після охолодження до КТ, реакційний розчин вливали у воду й отриманий осад фільтрували, промивали водою й висушували протягом 16 годин у вакуумі при 40 °C. ( 2-іл)- 2-іл-амін одержували у вигляді безбарвного порошку з виходом 81 %; ВЕЖХ (метод C): 1,51 хв.; ЖХ-МС + (метод A): 1,464 хв., 255,95 (M+H ). (5-Бром-піридин-2-іл)-тіазол-2-іл-амін (0,66 ммоль) розчиняли в ТГФ, охолоджували до -70 °C і додавали метиллітій (1,3 екв., 5 % у простому діетиловому ефірі). Через 15 хв. додавали нбутил літій (1,3 екв., 15 % у гексані) при -70 °C і додавали дифенілисульфід (7 екв.) і реакційний розчин перемішували протягом 4 годин при -70 °C. Додавали розчин насиченого NH4Cl і екстрагували дихлорметаном. Об'єднані органічні екстракти промивали соляним розчином і висушували над MgSO4. "A12" одержували після здійснення колонкової хроматографії з оберненою фазою (вода /ацетоннітрил) у вигляді безбарвного порошку з виходом 20%; ВЕЖХ + 1 (метод C): 1,83 хв.; ЖХ-МС (метод A): 1,892 хв., 285,95 (M+H ); H ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,506 (s, 1H), 8,398-8,392 (m, 1H), 7,804 (dd, 1H, J=2,4 Гц, J=8,6 Гц), 7,414 (d, 1H, J=3,4 Гц), 7,334-7,307 (m, 2H), 7,230-7,184 (m, 3H), 7,145 (d, 1H, J=8,6 Гц), 7,061 (d, 1H, J=3,6 Гц). Приклад 13 Приготування (5-фенілсульфініл-піридин-2-іл)-тіазол-2-іл-аміну ("A13") O S S N 25 30 (5-Фенілсульфініл-піридин-2-іл)-тіазол-2-іл-амін (0,13 ммоль) розчиняли в дихлорметані, охолоджували до 0 °C і додавали м-хлор-пербензойну кислоту (1 екв.). Реакцію перемішували протягом 30 хвилин при 0 °C і 2,5 години при КТ. Додавали дисульфіт натрію (50 мл) і екстрагували дихлорметаном. Об'єднані органічні шари промивали насиченим NaНСО 3, висушували над MgSO4 і розчинник видаляли у вакуумі. "A13" одержували після здійснення колонкової хроматографії з оберненою фазою (вода/ацетонітрил) у вигляді жовтого порошку з + 1 виходом 44 %; ВЕЖХ (метод C): 1,41 хв.; ЖХ-МС (метод A): 1,223 хв., 301,95 (M+H ); H ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 11,657 (s, 1H), 8,634-8,628 (m, 1H), 7,853 (dd, 1H, J=2,4 Гц, J=8,9 Гц), 7,722-7,703 (m, 2H), 7,583-7,507 (m, 3H), 7,425 (d, 1H, J=3,6 Гц), 7,152 (d, 1H, J=8,9 Гц), 7,100 (d, 1H, J=3,6 Гц). Приклад 14 Приготування (5-фенілсульфініл-піридин-2-іл)-тіазол-2-іл-аміну ("A14") O O S 35 40 N N H N S N H N (5-фенілсульфініл-піридин-2-іл)-тіазол-2-іл-амін (0,07 ммоль) розчиняли в дихлорметані, охолоджували до 0 °C і додавали м-хлор-пербензойну кислоту (3 екв.). Реакцію перемішували 30 хвилин при 0 °C і 22 години при КТ. Додавали дисульфіт натрію (40 мл) і екстрагували дихлорметаном. Об'єднані органічні шари промивали насиченим NaНСО 3, висушували над MgSO4 і розчинник видаляли у вакуумі. "A14" одержували після здійснення колонкової хроматографії з оберненою фазою (вода/ацетонітрил) у вигляді безбарвного порошку з виходом + 1 41 %; ВЕЖХ (метод C): 1,63 хв.; ЖХ-МС (метод A): 1,537 хв., 317,95 (M+H ); H ЯМР (ДМСО-d6, 400 МГц): [част. на млн.] 11,907 (s, 1H), 8,837-8,829 (m, 1H), 8,146 (dd, 1H, J=2,6 Гц, J=8,9 Гц), 8,006-7,976 (m, 2H), 7,714-7,671 (m, 1H), 7,645-7,605 (m, 2H), 7,456 (d, 1H, J=3,6 Гц), 7,185-7,154 26 UA 100532 C2 (m, 2H). Приклад 15 Приготування [3-(2-метокси-етокси)-5-фенокси-піридин-2-іл]- 2-іл-аміну ("A20") O N O N H S N O 5 10 15 20 25 30 35 40 45 50 Стадія A: 5-Хлор-3-піридинoл (15,3 ммоль) розчиняли в концентрованої H2SO4 (15 мл). При 5 °C додавали концентровану азотну кислоту (0,9 мл). Реакційної суміші дозволяли нагрітися до кімнатної температури протягом 6 днів. Реакційний розчин вливали в лід (50 мл) і розчиняли водою (200 мл). Осад фільтрували, промивали водою й висушували при 40 °C у вакуумі. 5Хлор-2-нітро-піридин-3-oл одержували у вигляді жовтого порошку; t пл. 97°; ЖХ-МС (метод B): + 1,35 хв., 175,1 (M+H ). Стадія B: 5-Хлор-2-нітро-піридин-3-oл (1,15 ммоль) розчиняли в ДМФА (2 мл) і додавали NaН (1,4 екв., 60% суспензія в рідкому парафіні) і суспензію перемішували 45 хв. при кімнатній температурі. Додавали 2-метоксіетан (1 екв.) і реакційну суспензію нагрівали до 100 °C протягом 24 годин. Реакційний розчин вливали у воду й екстрагували дихлорметаном. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO 4 і розчинник видаляли у вакуумі. 5-Хлор-3-(2-метокси-етокси)-2-нітро-піридин одержували після здійснення колонкової хроматографії у вигляді бежевої твердої речовини з виходом 60 %; tпл. 71,5-72,5°; + ВЕЖХ (метод C): 1,63 хв.; ЖХ-МС (метод A): 1,36 хв., 232,95 (M+H ). Стадія C: 5-Хлор-3-(2-метокси-етокси)-2-нітро-піридин (0,68 ммоль) розчиняли в ДМФА (7 мл), додавали фенол (3 екв.) і K2CO3 (4 екв.). Реакційну суміш нагрівали до 100 °C під впливом мікрохвиль протягом 30 хвилин. Реакційний розчин вливали у воду й екстрагували метил-трет.бутиловим ефіром. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO4 і розчинник видаляли у вакуумі. 3-(2-Метокси-етокси)-2-нітро-5-фенокси-піридин одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді жовтого + масла з виходом 62 %; ВЕЖХ (метод C): 1,93 хв.; ЖХ-МС (метод A): 1,80 хв., 291,15 (M+H ). Стадія D: 3-(2-Метокси-етокси)-2-нітро-5-фенокси-піридин (0,4 ммоль) розчиняли в оцтовій кислоті (1,3 мл). Після додавання води (1,3 мл), додавали цинковий пил (6 екв.) і реакційну суспензію нагрівали до 100 °C протягом 3 годин. Реакційну суспензію охолоджували до кімнатної температури й фільтрували. Фільтрат виливали в 3,5 % NaОН (30 мл) і екстрагували дихлорметаном. Об'єднані органічні шари екстрагували соляним розчином, висушували над MgSO4 і розчинник видаляли у вакуумі. 3-(2-Метокси-етокси)-5-фенокси-піридин-2-іламін одержували у вигляді коричневого масла з виходом 76 %. ВЕЖХ (метод C): 1,43 хв.; ЖХ-МС + (метод A): 0,808 хв., 261,15 (M+H ). Стадія E: 3-(2-Метокси-етокси)-5-фенокси-піридин-2-іламін (0,3 ммоль) розчиняли в ТГФ (4 мл) і додавали 1,1’-тіокарбонілдіімідазол (4 екв.). Реакційний розчин перемішували протягом 19 годин. Додавали 32 % NH4OH (21 екв.) і перемішували 3 годин при кімнатній температурі. Додавали воду (50 мл) і екстрагували дихлорметаном. Об'єднані органічні шари промивали соляним розчином і висушували над MgSO4. Розчинник видаляли у вакуумі. [3-( метоксиетокси)-2-іл]-тіосечовину одержували у вигляді коричневого масла з виходом 81%; ВЕЖХ + (метод C): 1,85 хв.; ЖХ-МС (метод A): 1,68 хв., 320,15 (M+H ). Стадія F: [3-(2-Метокси-етокси)-5-фенокси-піридин-2-іл]-тіосечовину (0,24 ммоль) розчиняли в ДМФА (1 мл) і додавали хлор-ацетальдегід (1,1 екв., 55 % у воді) і перемішували протягом 3 годин при 100 °C. Після охолодження до кімнатної температури суспензію виливали в суміш води з льодом і екстрагували метил-трет-бутиловим ефіром. Об'єднані органічні фази промивали соляним розчином і висушували над MgSO4. Розчинник видаляли у вакуумі. [3-(2Метокси-етокси)-5-фенокси-піридин-2-іл]-тіазол-2-іл-амін ("A20") одержували після здійснення хроматографії з оберненою фазою (вода/ацетонітрил + 0,1 % ТФУ) у вигляді жовтої твердої речовини з виходом 45 %; tпл. 140,6-140,9°; ВЕЖХ (метод C): 1,73 хв.; ЖХ-МС (метод A): 1,589 + 1 хв., 344,1 (M+H ); H ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 10,174 (s, 1H), 7,712 (d, 1H, J=2,3 Гц), 7,445 (d, 1H, J=3,7 Гц), 7,397-7,365 (m, 2H), 7,334 (d, 1H, J=2,3 Гц), 7,134-7,105 (m, 1H), 7,062 (d, 1H, J=3,7 Гц), 7,032-7,013 (m, 2H), 4,254-4,236 (m, 2H), 3,762-3,744 /m, 2H), 3,328 (s, 3H). 27 UA 100532 C2 Приклад 16 Приготування (3-циклопентилокси-5-фенокси-піридин-2-іл)-тіазол-2-іл-аміну ("A21") O N 10 15 20 25 30 35 40 45 N N H O 5 S Стадія A: -3-oл (3,4 ммоль) розчиняли в ДМФА (2 мл) і додавали NaН (1,4 екв., 60% суспензія в рідкому парафіні) і суспензію перемішували 45 хв. при кімнатній температурі. Додавали циклопентилйодид (1 екв.) і реакційну суспензію нагрівали до 100 °C протягом 24 годин. Реакційний розчин вливали у воду й екстрагували дихлорметаном. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO 4 і розчинник видаляли у вакуумі. 5Хлор-2-нітро-піридин одержували після здійснення колонкової хроматографії у вигляді жовтого + масла з виходом 60 %; ВЕЖХ (метод C): 2,11 хв.; ЖХ-МС (метод A): 2,07 хв., 243,10 (M+H ). Стадія B: 5-Хлор-3-циклопентилокси-2-нітро-піридин (0,8 ммоль) розчиняли в ДМФА (8 мл), додавали фенол (3 екв.) і K2CO3 (4 екв.). Реакційну суміш нагрівали до 100 °C під впливом мікрохвиль протягом 60 хвилин. Реакційний розчин вливали у воду й екстрагували метил-трет.бутиловим ефіром. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO4 і розчинник видаляли у вакуумі. 3-Циклопентилокси-2-нітро-5-фенокси-піридин одержували після здійснення колонкової хроматографії (гептан/етилацетат) у вигляді жовтого + масла з виходом 60 %; ВЕЖХ (метод C): 2,23 хв.; ЖХ-МС (метод A): 2,31 хв., 301,15 (M+H ). Стадія C: 3-Циклопентилокси-2-нітро-5-фенокси-піридин (0,46 ммоль) розчиняли в оцтовій кислоті (1,5 мл). Після додавання води (1,5 мл) додавали цинковий пил (6,2 екв.) і реакційну суспензію нагрівали до 100 °C протягом 3 годин. Реакційну суспензію охолоджували до кімнатної температури й фільтрували. Фільтрат виливали в 3,5 % NaОН (30 мл) і екстрагували дихлорметаном. Об'єднані органічні шари промивали соляним розчином, висушували над MgSO4 і розчинник видаляли у вакуумі. 3-(2-Метокси-етокси)-5-фенокси-піридин-2-іламін одержували у вигляді коричневого масла з виходом 72 %; ВЕЖХ (метод C): 1,43 хв.; ЖХ-МС + (метод A): 1,231 хв., 271,15 (M+H ). Стадія D: 3-Циклопентилокси-5-фенокси-піридин-2-іламін (0,33 ммоль) розчиняли в ТГФ (5 мл) і додавали 1,1’-тіокарбонілдіімідазол (4 екв.). Реакційний розчин перемішували протягом 19 годин. Додавали 32 % NH4OH (20 екв.) і перемішували 3 годин при кімнатній температурі. Додавали воду (50 мл) і екстрагували дихлорметаном. Об'єднані органічні шари промивали соляним розчином і висушували над MgSO4. Розчинник видаляли у вакуумі. (3Циклопентилокси-5-фенокси-піридин-2-іл)-тіосечовину одержували у вигляді коричневого масла + з виходом 87%; ВЕЖХ (метод C): 2,13 хв.; ЖХ-МС (метод A): 2,18 хв., 330,15 (M+H ). Стадія E: (3-Циклопентилокси-5-фенокси-піридин-2-іл)-тіосечовину (0,29 ммоль) розчиняли в ДМФА (1 мл) і додавали хлор-ацетальдегід (1,1 екв., 55 % у воді) і перемішували протягом 3 годин при 100 °C. Після охолодження до кімнатної температури суспензію виливали в суміш води з льодом і екстрагували метил-трет-бутиловим ефіром. Об'єднані органічні фази промивали соляним розчином і висушували над MgSO 4. Розчинник видаляли у вакуумі. (3Циклопентилокси-5-фенокси-піридин-2-іл)-тіазол-2-іл-амін ("A21") одержували після здійснення хроматографії з оберненою фазою (вода/ацетонітрил + 0,1 % ТФУ) у вигляді жовтої твердої речовини з виходом 47 %; tпл.: 138,2-139,7°; ВЕЖХ (метод C): 2,00 хв.; ЖХ-МС (метод A): 2,00 + хв., 354,1 (M+H ); 1 H-ЯМР (ДМСО-d6, 500 МГц): [част. на млн.] 10,272 (s, 1H), 7,672 (d, 1H, J=2,3 Гц), 7,458 (d, 1H, J=3,7 Гц), 7,409-7,377 (m, 2H), 7,211 (d, 1H, J=2,3 Гц), 7,143-7,113 (m, 1H), 7,065 (d, 1H, J=3,7 Гц), 7,043-7,024 (m, 2H), 4,964-4,930 (m, 1H), 1,909-1,884 (m, 4H), 1,812-1,780 (m, 2H), 1,6191,567 (m, 2H). Приклад 17 Приготування [5-(2-метокси-етокси)-піридин-2-іл]-(1-метил-1Н-піразол-3-іл)-аміну ("A22") O N N N O N H 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridine derivatives useful as glucokinase activators
Автори англійськоюBurgdorf, Lars, Thore, Beier, Norbert, Gleitz, Johannes, Charon, Christine, Cravo, Daniel
Назва патенту російськоюПроизводные пиридина, пригодные в качестве активаторов глюкокиназы
Автори російськоюБургдорф Ларс Торе, Байер Норберт, Гляйтц Йоханнес, Харон Кристин, Краво Даниэл
МПК / Мітки
МПК: A61K 31/4427, C07D 401/14, C07D 417/12, A61P 3/00, C07D 417/14, C07D 213/74, C07D 401/12, A61K 31/444
Мітки: активаторі, придатні, похідні, піридину, глюкокінази
Код посилання
<a href="https://ua.patents.su/69-100532-pokhidni-piridinu-pridatni-yak-aktivatori-glyukokinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні піридину, придатні як активатори глюкокінази</a>
Попередній патент: Антитіло, яке специфічно зв’язується з тимічним стромальним лімфопоетином (tslp)
Наступний патент: Спосіб електрохімічного осадження при виготовленні металевого електроду сонячної батареї
Випадковий патент: Спосіб дослідження решітчастої кістки у перинатальному періоді онтогенезу людини та дітей грудного віку