Спосіб одержання сполук імідазолілу
Формула / Реферат
1. Спосіб одержання сполуки імідазолілу загальної формули
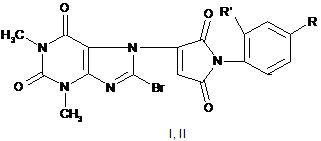 , (I)
, (I)
де:
Ra та Rb кожний незалежно один від одного – (С1-С6)алкіл, (С1-С6)алкоксіалкіл, можливо заміщений арил або гетероарил;
або Ra та Rb разом утворюють подальшу гомоциклічну або гетероциклічну систему, що містить одне або кілька кілець;
Ra' та Rb' кожний представляє водень або вони разом утворюють вуглець-вуглецевий подвійний зв'язок, який може становити частину ароматичної системи;
Rс - водень, (С1-С6)алкіл, (С1-С6)алкокси, (С1-С6)алкоксіалкіл або галоген;
Rd - водень або (С1-С4)алкіл;
Re - водень або (С1-С4)алкіл;
m - 1 або 2;
R1 - водень або (С1-С4)алкіл,
а також її кислої адитивної солі,
який відрізняється тим, що сполуку загальної формули
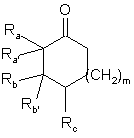 , (II)
, (II)
де Ra, Ra', Rb та Rb' мають значення, наведені вище,
піддають реакції зі сполукою формули
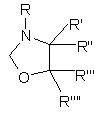 , (III)
, (III)
де:
R - водень, (С1-С4)алкільна група, яка може бути заміщена гідроксигрупою або може бути заміщена арильною групою,
R', R", R'" та R"" кожний незалежно один від одного – водень або (С1-С4)алкільна група,
після чого проводять реакцію зі сполукою формули
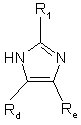 , (IV)
, (IV)
де R1, Rd та Re мають значення, наведені вище,
а потім можуть проводити реакцію з придатною кислотою.
2. Спосіб за п. 1, у якому
Ra, Rb, Ra', Rb', R', R", R'" та R"" мають значення, наведені у п. 1;
Rc – водень або (С1-С6)алкіл,
Rd – водень або (С1-C4)алкіл,
Re – водень або (С1-С4)алкіл,
m - 1 або 2,
R1 - водень, метил або етил.
3. Спосіб за будь-яким з пп. 1-2 одержання сполуки імідазолілу загальної формули
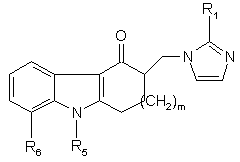 , (Ia)
, (Ia)
де:
m – 1 або 2;
R1 – водень, метил або етил;
R5 – (С1-С4)алкіл,
R6 – водень або (С1-С4)алкіл, або ж
R5 та R6, разом з проміжними атомами утворюють 5-, 6- або 7-членне кільце, яке може бути заміщене одним або двома замісниками, вибраними з групи, що складається з галогену, гідроксі, (С1-С4)алкілу, (С1-С4)алкоксіалкілу та (С1-С4)алкокси,
а також її фармаційно прийнятних адитивних солей,
який відрізняється тим, що сполуку загальної формули
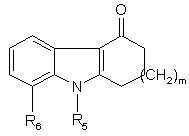 , (IIa)
, (IIa)
де R5, R6 та m мають значення, наведені вище,
піддають реакції зі сполукою формули
 , (III)
, (III)
де R, R', R", R'" та R"" мають значення, наведені у п. 1;
після чого проводять реакцію зі сполукою формули
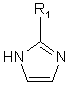 , (IVa)
, (IVa)
де R1 має значення, наведені у п. 1.
4. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що R, R', R", R'" та R"" у формулі (III) являють собою 2-гідроксіетил, водень, водень, водень та водень відповідно.
5. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що m = 1, а R5 та R6 разом з проміжними атомами утворюють 6-членне кільце.
6. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що m = 1, R5 – метил, a R6 – водень.
7. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що реакцію ведуть у спиртовому розчиннику.
8. Спосіб за п. 7, який відрізняється тим, що як спиртовий розчинник використовують 1-бутанол.
9. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що реакцію ведуть у суміші спиртового розчинника з ароматичним вуглеводнем.
10. Спосіб за п. 9, який відрізняється тим, що зазначена суміш являє собою суміш метанолу з хлорбензолом.
Текст
1. Спосіб одержання сполуки імідазолілу загальної формули 3 79655 2. Спосіб за п. 1, у якому Ra, Rb, R a' , Rb' , R', R", R'" та R"" мають значення, наведені у п. 1; Rc – водень або (С1-С6)алкіл, Rd – водень або (С1-C4)алкіл, Re – водень або (С1-С4)алкіл, m - 1 або 2, R1 - водень, метил або етил. 3. Спосіб за будь-яким з пп. 1-2 одержання сполуки імідазолілу загальної формули N R6 N R5 N R' R'' O R''' R'''' (IIa) (CH2)m (III) , R1 HN , де: m – 1 або 2; R1 – водень, метил або етил; R5 – (С1-С4)алкіл, R6 – водень або (С1-С4)алкіл, або ж R5 та R6, разом з проміжними атомами утворюють 5-, 6- або 7-членне кільце, яке може бути заміщене одним або двома замісниками, вибраними з групи, що складається з галогену, гідроксі, (С1-С4)алкілу, (С1-С4)алкоксіалкілу та (С1-С4)алкокси, а також її фармаційно прийнятних адитивних солей, який відрізняється тим, що сполук у загальної формули O R6 R (Ia) (CH 2) m R5 N де R5, R6 та m мають значення, наведені вище, піддають реакції зі сполукою формули де R, R', R", R'" та R"" мають значення, наведені у п. 1; після чого проводять реакцію зі сполукою формули R1 O N 4 , Винахід стосується способу одержання сполук імідазолілу. З [ЕР 191562 та US 4695578] відомий 1,2,3,9тетрагідро-9-метил-3-[2-метил-1Н-імідазол-1іл)метил]-4Н-карбазол-4-он (ондансетрон). У цих патентах описано загальний клас сполук, у тому числі ондансетрон та його гомологічні сполуки, їх одержання та застосування як могутніх селективних антагоністів у "нейтронних" рецепторах 5гідрокситриптаміну при лікуванні мігрені та психічних розладів. З [ЕР-В-0297651, ЕР-В-0601345 та ЕР-В768309] відомий (10R)-5,6,9,10-тетрагідро-10-[(2метил-1Н-імідазол-1-іл)метил]-4Н-піридо[3,2,1-jk]карбазол-11(8Н)-он (сілансетрон) (інакше (R)-(-)4,5,6,8,9,10-гексагідро-10-[(2-метил-1Н-імідазол-1іл)метил]-11Н-піридо[3,2,1-карбазол-jk]-11-он). У першому з цих патентів описано загальний клас N (IVa) , де R1 має значення, наведені у п. 1. 4. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що R, R', R", R'" та R"" у формулі (III) являють собою 2-гідроксіетил, водень, водень, водень та водень відповідно. 5. Спосіб за будь-яким з попередніх пунктів, який відрізняє ться тим, що m = 1, а R5 та R6 разом з проміжними атомами утворюють 6-членне кільце. 6. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що m = 1, R5 – метил, a R6 – водень. 7. Спосіб за будь-яким з попередніх пунктів, який відрізняє ться тим, що реакцію ведуть у спиртовому розчиннику. 8. Спосіб за п. 7, який відрізняється тим, що як спиртовий розчинник використовують 1-бутанол. 9. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що реакцію ведуть у суміші спиртового розчинника з ароматичним вуглеводнем. 10. Спосіб за п. 9, який відрізняється тим, що зазначена суміш являє собою суміш метанолу з хлорбензолом. сполук, у тому числі сілансетрон та його гомологічні сполуки, їх одержання та застосування як антагоністів 5-НТ. У другому патенті йдеться про застосування вибраних сполук цього типу для лікування певних хвороб, а у третьому - про приготування енантіомерно чистих сполук та їхнього моногідрату гідрохлориду. Спільна риса зазначених сполук полягає у тому, що вони містять заміщену імідазолільну гр упу, приєднану до a-положення відносно кетогрупи карбазольної системи метиленовим містком. У зазначених патентах описано кілька можливих шляхів синтезу цих сполук. В усіх ци х синтезах заміщену імідазолільну груп у вводять шляхом реакції Манніха з наступним деамінуванням, щоб одержати проміжну екзометиленову сполуку, яка реагує з заміщеною імідазолільною групою (див., наприклад, схему 1). 5 79655 Недоліком такого шляху є низький вихід у цій послідовності реакцій. У [US 4695578] на першому етапі, де вихід зазвичай найнижчий, його значення не наводиться, а на другому етапі [приклад 7 у US 4695578] він становить 68%. У [ЕР-В-0297651] вихід на першому етапі [приклад 1d y ЕР-В-0297651] вказано вихід 53%, а на другому [приклад 1d у ЕРВ-0297651] - 87%. При масштабуванні виявляється, що на цьому шляху синтезу утворюється чимало смоловидних бічних продуктів. 6 R1 - водень або (С1-С4)алкіл, а також її кислої адитивної солі, який відрізняється тим, що сполуку загальної формули піддають реакції зі сполукою формули Завданням винаходу є створення альтернативного способу одержання сполук імідазолілу, який був би економічно суттєвим та відповідав одній або більше з наступних вимог: а) відносно високий вихід, б) короткий час реакцій порівняно з відомими способами, в) менша кількість побічних реакцій, г) краща якість цільового продукту, д) застосування нерозбавлених реагентів та екологічно прийнятних розчинників. Несподівано виявилося, що сполуки імідазолілу такого типу можна одержувати з застосуванням сполуки оксазолідину для створення метиленового містка. Отже, цей винахід стосується способу одержання сполуки імідазолілу загальної формули де: Ra та Rb кожний незалежно один від одного (С1-С6)алкіл, (С1-С6)алкоксіалкіл, можливо заміщений арил або гетероарил; або Ra та Rb разом утворюють подальшу гомоциклічну або гетероциклічну систему, що містить одне або кілька кілець; Ra' та Rb' кожний представляє водень або вони разом утворюють вуглець-вуглецевий подвійний зв'язок, який може становити частину ароматичної системи Rc - водень, (С1-С6)алкіл, (С1-С6)алкоксі, (С1С6)алкоксіалкіл або галоген; Rd - водень або (С1-С4)алкіл; Re - водень або (С1-С4)алкіл; m - 1 або 2; де: R - водень, (С1-С4)алкільна група, яка може бути заміщена гідроксігрупою або може бути заміщена арильною групою, R', R'', R''' та R'''' кожний незалежно один від одного - водень або (С1-С4)алкільна група, після чого провадять реакцію зі сполукою формули ще, де R1, Rd та Re мають значення, наведені ви а далі можуть провадити реакцію з придатною кислотою. Алкільні групи за винаходом можуть включати алкільні радикали з прямим ланцюгом, розгалужені або циклічні, які містять до 6 атомів вуглецю. Відповідні алкільні групи можуть бути насичені або ненасичені. Алкільна група може також бути заміщена в одному або кількох положеннях замісниками, обраними з групи, що складається з арилу, галогену, гідроксі, ціано або аміну, заміщеного моно- або діалкільною групою. Арильні групи за винаходом включають арильні радикали, які можуть містити до 6 гетероатомів. Арильна група може також бути заміщена в одному або кількох положеннях замісниками, обраними з групи, що складається з арилу, (С1-С6) алкілу, галогену, гідроксі, ціано або аміну, заміщеного моно- або діалкільною групою, а також може зливатися з арильною групою або циклоалкільними кільцями. Серед придатних арильних груп можна назвати феніл, нафтил, толіл, імідазоліл, піриділ, піроїл, тієніл, піримиділ, тіазоліл та фурил. Гомоциклічна система - це система, що складається з принаймні однієї насиченої або ненасиченої циклічної групи, яка містить лише атоми вуглецю та водню. 7 79655 Гетероциклічна система містить принаймні одну насичену або ненасичену циклічну групу з вмістом одного або кількох гетероатомів, наприклад, Ν, Ο або S. Як гомоциклічні, та і гетероциклічні системи можуть за бажанням бути заміщені замісником, обраним з групи, що складається з алкілу, арилу, галогену, гідроксі, ціано або аміну, заміщеного моно- або діалкільною групою. У переважному варіанті здійснення винаходу Rc - водень або (С1-С6) алкіл, Rd - водень або (С1С4)алкіл, Re - водень або (С1-С4)алкіл, a R1 - водень, метил або етил. Реакція згідно з винаходом є особливо корисною для одержання сполук загальної формули де: m - 1 або 2; R1 - водень, метил або етил; R5 - (С1-С4)алкіл, R6 - водень або (С1-С4)алкіл, або ж R5 та R6 разом з проміжними атомами утворюють 5-, 6- або 7-членне кільце, яке може бути заміщене одним або двома замісниками, обраними з-поміж галогену, гідроксі, (С1-С4)алкілу, (С1С4)алкоксіалкілу та (С1-С4)алкоксі. У цьому разі вихідним матеріалом є сполука загальної формули Далі ця сполука зветься сполукою карбазолону. Переважно загальна формула охоплює сполуки, де m=1, a R5 та R6 разом з проміжними атомами утворюють 6-членне кільце, та сполуки, де m=1, R5 - метил, a R6 - водень. У першому разі вихід у способі, який починається з 5,6,9,10тетрагідро-4Н-піридр[3,2,1-jk]-карбазол-11(8Н)-ону та 3-оксазолідинетанолу, становить 77% (див. приклад 2) у порівнянні з 46% у способі згідно з [ЕР0297651] (приклади 1с та 1d). Високий вихід досягається у промисловому масштабі. У заміщеному оксазолідині переважно один з R' та R'' і один з R''' та R'''' є водень, позаяк оксазолідин, двозаміщений на одному атомі вуглецю, наприклад, 4,4-діметилоксазолідин, дає низький вихід при реакції. Переважними оксазолідинами є 3-оксазолідинетанол та 3-етилоксазолідин. Найсприятливішим є 3-оксазолідинетанол. Реакцію ведуть у кислому середовищі, причому ступінь кислотності залежить від активації сис 8 теми, що має реагувати. У разі карбазолонових систем середовище має бути сильно кислим. Придатними кислотами в останньому разі є метансульфонова кислота, трифторметансульфонова кислота, р-толуолсульфонова кислота та НСІ-газ у спиртовому носії. Щоб забезпечити високий вихід, реакційний розчин мусить мати якнайменший вміст води. Переважно вміст води має бути меншим за 0,5об.%, бажано меншим за 0,3% об.%, а найкраще меншим за 0,1об.%. Оптимальна температура реакції залежить від вихідного матеріалу та розчинника і є неоднаковою на двох етапах реакції. Перший етап реакції можна вести від 40 до 110°С. Для карбазолонових систем бажана температура на першому етапі становить від 50 до 90°С, а оптимальною є температура 70°С. Другий етап реакції можна вести від 100 до 140°С. Для карбазолонових систем бажана температура на другому етапі становить від 110 до 130°С, а оптимальною є температура близько 120°С. Реакцію можна вести у різних розчинниках, наприклад, у біполярних апротонних розчинниках на кшталт ДМФ або у спиртах. Переважними є С 4С7 спирти, а вибір між ними залежить від потрібної температури реакції. Придатними спиртами є, наприклад, 1-бутанол, 1-гексанол та ізоаміловий спирт. Оптимальний спирт - то 1-бутанол. Придатні є також суміші ароматичних вуглеводнів та спиртів, наприклад, толуолу зі спиртом або монохлорбензолу зі спиртом. Оптимальною є суміш монохлорбензолу з метанолом. При використанні мішаних розчинників низькокиплячий розчинник можна віддистилювати перед другим етапом, щоб одержати підвищену температуру флегми розчинникової системи на другому етапі. Співвідношення між обсягом розчинника та кількістю реагентів може коливатися у широких межах і залежить від розчинності реагентів. У цілому співвідношення між обсягом розчинника та кількістю реагентів може становити від 1:1 до 15:1 та виражається як обсяг розчинника відносно ваги реагентів у ньому у мл/г. Переважно це співвідношення становить від приблизно 1:1 до 10:1. У разі карбазолонових систем бажане співвідношення обсягу розчинника до ваги реагентів є близько 4:1. Одержані продукти можна кристалізувати з різних розчинників. Прикладами розчинників для кристалізації вільних основ є ароматичні вуглеводні, як от толуол. Солі соляної кислоти кристалізують, наприклад, зі спиртових розчинників на кшталт ізопропанолу або 1-бутанолу. Наступні приклади лише докладніше ілюструють винахід і ніяким чином не обмежують обсяг винаходу. Приклад 1: Матеріали та методики 5,6,9,10-тетрагідро-4Н-піридо[3,2,1-jk]карбазол-11(8Н)-он одержують згідно з [ЕР 0375045]. 3,4-дігідро-1(2Н)-нафталінон закуповують. 1,2,3,9-тетрагідро-9-метил-4Н-карбазол-4-он виготовляють згідно з [US 3892766] на фірмі Ворнер-Ламберт компані, як описано у [Elz S. and Heil W., Bioorganic and Medicinal Chemistry Letters 1995, 9 79655 5, 667-672]. Метансульфонову кислоту закуповують. ЯМР спектри виміряють на приладі VXR200 фірми Варіан, а МС спектри - на TSQ7000 фірми Фінніган. Високоефективну рідкісну хроматографію здійснюють на системі НР1050 з детектором розділення 757 (250нм) та колонковою піччю розділення Маратон XT при 35°С. Використовують колонку Зорбакс XDB C8 15x0,3см. Елюент готують наступним чином: змішують 2л води, 2мл триетиламіну та 5мл 25% аміаку, роблять буфер з мурашиною кислотою при рН=4 та додають 0,5л ацетонітрилу. Витрата 1мл/хв. Приклад 1а: Одержання оксазолідинів 3-оксазолідинетанол одержують наступним чином: Еквімолярні кількості діетаноламіну та параформальдегіду в 1-бутанолі нагрівають до 70°С. Після 1 години реакції видаляють утворену воду азеотропною дистиляцією з 1-бутанолом. 3-етилоксазолідин одержують за [Неаnу Н. et al., Tetrahedron 1997, 53, 14381-14396]. 4,4-діметилоксазолідин випускається промислово і був закуплений у вигляді 75мас.% водного розчину. 4,4-діметилоксазолідин екстрагують з водної фази шляхом промивання насиченим діхлорметаном розчином NaCl. Діхлорметанову фазу сушать над безводним сульфатом натрію, після чого випарюють. Приклад 2. Реакція 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону з 3оксазолідинетанолом 25,00г (111,0ммолів) 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону та 17,06г (177,5ммолів) метансульфонової кислоти у 100мл 1-бутанолу нагрівають до 70°С. За 3 хвилини до розчину додають 19,49г (166,4ммоля) 3оксазолідинетанолу у 39мл 1-бутанолу. За 50 хвилин додають при 80°С 45,55г (554,8ммоля) 2-метилімідазолу та 10мл 1бутанолу. Після 1,5 годин при 120°С реакційну суміш частково упарюють, доки залишиться 30мл 1-бутанолу. При 70°С до осаду додають 75мл толуолу та 50мл води. Фази змішують, водну фазу екстрагують 75мл толуолу, а з'єднані толуолові фази тричі промивають 100мл води. Органічну фаз у впарюють посуха і додають 125мл 1-бутанолу. До одержаного розчину додають 12,5мл 36мас.% розчину соляної кислоти. Після 2 годин перемішування при кімнатній температурі утворений осад відфільтровують і промивають 1-бутанолом та МТБЕ. Ви хід після сушки - 30,40г (77,0%) 5,6,9,10-тетрагідро-10-[(2-метил-1Німідазол-1-іл)метил]-4Н-піридо[3,2,1-jk]-карбазол11(8Н)-онгідрохлориду. ВЕРХ: ³95%. 1H-ЯМР [200МГц, DMSO-d 6 :CDCI3 4:1] d 1,97 (1Н, m), 2,18 (3H, m), 2,68 (3H, s), 2,95 (2H, t), 3,00 (1H, dd), 3,12 (2H, m), 4,13 (2H, m), 4,29 (1H, dd), 4,66 (1H, dd), 6,97 (1H, d), 7,09 (1H, t), 7,55 (1H, d), 7,68 (1H, d) та 7,71 (1H, d). MC [ESI] MH + = 320. Приклад 3. Реакція 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону з 4,4діметилоксазолідином 10 20,00г (88,8ммолів) 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону та 13,65г (142,0ммолів) метансульфонової кислоти у 60мл 1-бутанолу нагрівають до 70°С. За 2 хвилини додають 13,47г (133,2ммоля) 4,4діметилоксазолідину у 10мл 1-бутанолу. За 50 хвилин додають при 80°С 36,45г (444,0ммоля) 2-метилімідазолу та 10мл 1бутанолу. За 2 години реакційну суміш частково впарюють при 120°С, доки лишаються 20мл 1бутанолу. До осаду додають при 70°С 60мл толуолу та 40мл води. Фази розділяють. Водну фазу екстрагують 60мл толуолу, а з'єднані толуолові фази тричі промивають 80мл води. Органічну фаз у впарюють посуха і додають 100мл 1-бутанолу. До одержаного розчину додають 10,0мл 36мас.% розчину соляної кислоти. Після 2 годин перемішування при кімнатній температурі утворений осад відфільтровують і промивають 1-бутанолом та МТБЕ. Ви хід після сушки - 12,38г (39,2%) 5,6,9,10-тетрагідро-10-[(2-метил-1Німідазол-1-іл)метил]-4Н-піридо[3,2,1-jk]-карбазол11(8Н)-онгідрохлориду. ВЕРХ: >95%. 1H-ЯМР та МС див. приклад 2. Маточник містить 3,45г (10,9%) продукту. Приклад 4. Реакція 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону з 3етилоксазолідином 20,00г (88,8ммолів) 5,6,9,10-тетрагідро-4Нпіридо[3,2,1-jk]-карбазол-11(8Н)-ону та 13,65г (142,0ммолів) метансульфонової кислоти у 60мл 1-бутанолу нагрівають до 70°С. За 2 хвилини додають 13,46г (133,2ммоля) 3-етилоксазолідину у 10мл 1-бутанолу. За 50 хвилин додають при 80°С 36,45г (444,0ммоля) 2-метилімідазолу та 10мл 1бутанолу. За 2 години реакційну суміш частково впарюють при 120°С, доки лишаються 20мл 1бутанолу. До осаду додають при 70°С 60 мл толуолу та 40мл води. Фази розділяють. Водну фазу екстрагують 60мл толуолу, а з'єднані толуолові фази тричі промивають 80мл води. Органічну фаз у впарюють посуха і додають 100мл 1-бутанолу. До одержаного розчину додають 10,0мл 36мас.% розчину соляної кислоти. Після 2 годин перемішування при кімнатній температурі утворений осад відфільтровують і промивають 1-бутанолом та МТБЕ. Ви хід після сушки - 22,10г (70,0%) 5,6,9,10-тетрагідро-10-[(2-метил-1Німідазол-1-іл)метил]-4Н-піридо[3,2,1-jk]-карбазол11(8Н)-онгідрохлориду. ВЕРХ: ³95%. 1H-ЯМР та МС див. приклад 2. Приклад 5. Реакція 3,4-дігідро-1(2Н)нафталінонгу з 3-оксазолідинетанолом 12,98г (88,8ммолів) 3,4-дігідро-1(2Н)нафталінонгу та 13,65г (142,0ммолів) метансульфонової кислоти у 60мл 1-бутанолу нагрівають до 50°С. За 2 хвилини додають 15,59г (133,1ммоля) 3-оксазолідинетанолу у 14мл 1-бутанолу. За 50 хвилин додають при 80°С 36,45г (444,0ммоля) 2-метилімідазолу та 10мл 1бутанолу. За 2 години реакційну суміш частково 11 79655 впарюють при 120°С, доки лишаються 20мл 1бутанолу. До осаду додають при 70°С 60мл толуолу та 40мл води. Фази розділяють. Водну фазу екстрагують 60мл толуолу, а з'єднані толуолові фази тричі промивають 80мл води. Органічну фаз у впарюють посуха і додають 100мл 1-бутанолу. До одержаного розчину додають 10,0мл 36мас.% розчину соляної кислоти та впарюють до кінцевого обсягу 60мл. Після 2 годин перемішування при кімнатній температурі утворений осад відфільтровують і промивають 1бутанолом та МТБЕ. Вихід після сушки - 15,28г (62,2%) 3,4-дігідро-2-[(2-метил-1Н-імідазол-1іл)метил]-1(2Н)-нафталінонгідрохлориду. ВЕРХ: ³95%. 1H-ЯМР [200МГц, DMSO-d6:CDCl3 4:1] d 2,00 (2Η, m), 2,73 (3H, s), 3,20 (3H, m), 4,27 (1H, dd), 4,68 (1H, dd), 7,35 (2H, t), 7,55 (2H, m), 7,70 (1H, d), 7,90 (1H, d). MC [ESI] MH + = 241. Маточник містить 3,28г (13,3%) продукту. Приклад 6. Реакція 3,4-дігідро-1(2Н)нафталінону з 4,4-діметилоксазолідином 12,98г (88,6ммолів) 3,4-дігідро-1(2Н)нафталінону та 13,65г (142,0ммолів) метансульфонової кислоти у 60мл 1-бутанолу нагрівають до 70°С. За 2 хвилини додають 13,46г (133,1ммоля) 4,4-діметилоксазолідину у 10мл 1-бутанолу. За 50 хвилин додають при 80°С 36,45г (444,0ммоля) 2метилімідазолу та 10мл 1-бутанолу. За 2 години реакційну суміш частково впарюють при 120°С, доки лишаються 20мл 1-бутанолу. До осаду додають при 70°С 60мл толуолу та 40мл води. Фази розділяють. Водну фазу екстрагують 60мл толуолу, а з'єднані толуолові фази тричі промивають 80мл води. Органічну фазу впарюють до суха і додають 100мл 1-бутанолу. До одержаного розчину додають 10,0мл 36мас.% розчину соляної кислоти та впарюють до кінцевого обсягу 50мл. Після 2 годин перемішування при 0°С утворений осад відфільтровують і промивають 1-бутанолом та МТБЕ. Вихід після сушки - 14,13г (57,5%) 3,4-дігідро-2-[(2метил-1Н-імідазол-1-іл)метил]-1(2Н)нафталінонгідрохлориду. ВЕРХ: ³95%. 1H-ЯМР та МС див. приклад 5. Маточник містить 2,33г (9,5%) продукту. Приклад 7. Реакція 3,4-дігідро-1(2Н)нафталінону з 3-етилоксазолідином 12,98г (88,8ммолів) 3,4-дігідро-1(2Н)-нафталінону та 13,65г (142,0ммолів) метансульфонової кислоти у 60мл 1-бутанолу нагрівають до 50°С. За 2 хвилини додають 13,46г (133,1ммоля) 3-етилоксазолідину у 10мл 1-бутанолу. За 50 хвилин додають при 80°С 36,45г (444,0ммоля) 2-метилімідазолу та 10мл 1бутанолу. За 2 години реакційну суміш частково впарюють при 120°С, доки лишаються 20мл 1бутанолу. До осаду додають при 70°С 60мл толуолу та 40мл води. Фази розділяють. Водну фазу екстрагують 60мл толуолу, а з'єднані толуолові фази тричі промивають 80мл води. Органічну фазу впарюють до суха і додають 100мл 1-бутанолу. До одержаного розчину додають 10,0мл 36мас.% розчину соляної кислоти та впарюють до кінцевого обсягу 50мл. Після 2 годин 12 перемішування при 0°С утворений осад відфільтровують і промивають 1-бутанолом та МТБЕ. Вихід після сушки - 17,30г (70,4%) 3,4-дігідро-2-[(2метил-1Н-імідазол-1-іл)метил]-1(2Н)нафталінонгідрохлориду. ВЕРХ: ³95%. 1H-ЯМР та МС див. приклад 5. Приклад 8. Реакція 1,2,3,9-тетрагідро-9-метил4Н-карбазол-4-ону з 3-оксазолідинетанолом 13,26г (66,5ммолів) 1,2,3,9-тетрагідро-9-метил4Н-карбазол-4-ону та 10,23г (106,4ммолів) метансульфонової кислоти у 45мл 1-бутанолу нагрівають до 90°С. За 2 хвилини додають 11,68г (98,8ммолів) 3-оксазолідинетанолу у 11мл 1бутанолу. За 50 хвилин додають при 80°С 27,32г (332,5ммоля) 2-метилімідазолу та 8мл 1-бутанолу. За 2 години додають при 120°С 180мл толуолу та 120мл води при 80°С. Фази розділяють. Водну фазу екстрагують 180мл толуолу та 60мл 1бутанолу. З'єднані органічні фази двічі промивають 240мл води. Органічну фазу впарюють до суха і додають до осаду 150мл 1-бутанолу та 10мл 36мас.% розчину соляної кислоти. Кристалізація відбувається незабаром при 0°С. За 1 годину при 0°С утворені кристали відфільтровують і промивають 1-бутанолом та МТБЕ, після чого сушать. Вихід становить 15,39г (70,1%) 1,2,3,9-тетрагідро9-метил-3-[(2-метил-1Н-імідазол-1-іл)метил]-4Нкарбазол-4-онгідрохлориду. ВЕРХ: ³95%. 1Н-ЯМР [200МГц, DMSO-d 6:CDCl3 4:1] d 2,00 (1Η, m), 2,20 (1Н, m), 3,69 (3H, s), 3,09 (3H, m), 3,75 (3H, s), 4,30 (1H, dd), 4,67 (1H, dd), 7,23 (2H, m), 7,53 (2H, m), 7,69 (1H, d), 8,01 (1H, d). MC [ESI] MH+ = 294. Маточник містить 3,19г (14,5%) продукту. Приклад 9. Реакція 1,2,3,9-тетрагідро-9-метил4Н-карбазол-4-ону з 4,4-діметилоксазолідином 13,26г (66,5ммолів) 1,2,3,9-тетрагідро-9-метил4Н-карбазол-4-ону та 10,23г (106,4ммолів) метансульфонової кислоти у 45мл 1-бутанолу нагрівають до 90°С. За 2 хвилини додають 10,09г (99,9ммолів) 4,4-діметилоксазолідину у 8мл 1бутанолу. За 50 хвилин додають при 80°С 27,32г (332,5ммоля) 2-метилімідазолу та 8мл 1-бутанолу. За 2 години додають при 120°С 180мл толуолу та 120мл води. Фази розділяють. Водну фазу екстрагують 180мл толуолу та 60мл 1-бутанолу. З'єднані органічні фази двічі промивають 240мл води. Органічну фазу впарюють до суха і додають до осаду 150мл 1-бутанолу та 10мл 36мас.% розчину соляної кислоти. Кристалізація відбувається незабаром при 0°С. За 1 годину при 0°С утворені кристали відфільтровують і промивають 1-бутанолом та МТБЕ, після чого сушать. Вихід становить 10,02г (45,7%) 1,2,3,9-тетрагідро-9-метил-3-[(2-метил-1Німідазол-1-іл)метил]-4Н-карбазол-4онгідрохлориду. Ма точник містить 2,70г (12,3%) продукту. ВЕРХ: ³95%. 1Н-ЯМР та МС див. приклад 8. Приклад 10. Реакція 1,2,3,9-тетрагідро-9метил-4Н-карбазол-4-ону з 3-етилоксазолідином 13,26г (66,5ммолів) 1,2,3,9-тетрагідро-9-метил4Н-карбазол-4-ону та 10,23г (106,4ммолів) метансульфонової кислоти у 45мл 1-бутанолу нагріва 13 79655 ють до 90°С. За 2 хвилини додають 10,09г (99,9ммолів) 3-етилоксазолідину у 8мл 1-бутанолу. За 50 хвилин додають при 80°С 27,32г (332,5ммоля) 2-метилімідазолу та 8мл 1-бутанолу. За 2 години додають при 120°С 180мл толуолу та 120мл води. Фази розділяють. Водну фазу екстрагують 180мл толуолу та 60мл 1-бутанолу. З'єднані органічні фази двічі промивають 240мл води. Органічну фазу впарюють до суха і додають до осаду 150мл 1-бутанолу та 10мл 36мас.% розчину соля Комп’ютерна в ерстка О.Гапоненко 14 ної кислоти. Кристалізація відбувається незабаром при 0°С. За 1 годину при 0°С утворені кристали відфільтровують і промивають 1-бутанолом та МТБЕ, після чого сушать. Вихід становить 15,67г (71,4%) 1,2,3,9-тетрагідро-9-метил-3-[(2-метил-1Німідазол-1-іл)метил]-4Н-карбазол-4онгідрохлориду. ВЕРХ: ³95%. ЯМР та МС див. приклад 8. Маточник містить 2,06г (9,4%) продукту. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of imidazolyl compounds
Назва патенту російськоюСпособ получения cоединений имидазолила
МПК / Мітки
МПК: C07D 471/06, C07D 233/60, C07D 403/06, A61P 25/18, C07D 233/54
Мітки: імідазолілу, одержання, спосіб, сполук
Код посилання
<a href="https://ua.patents.su/7-79655-sposib-oderzhannya-spoluk-imidazolilu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполук імідазолілу</a>
Попередній патент: Дужка для перенесення посудини
Наступний патент: Спосіб відновлення зношеної поверхні ротора турбокомпресора
Випадковий патент: Харчовий продукт (варіанти)











