Триазолопіразини
Номер патенту: 114739
Опубліковано: 25.07.2017
Автори: Сметерст Крістіан, Джанні Давіде, Енгельхардт Харальд
Формула / Реферат
1. Сполука формули (І)
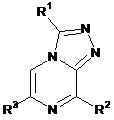 , (І)
, (І)
де
R1 являє собою -С1-3алкіл або -С1-3галогеналкіл;
R2 вибраний з -NHR4, -С1-5алкілу, -С1-5галогеналкілу, галогену і -S-С1-3алкілу;
R3 являє собою 5-12-членний гетероарил, група якого заміщена -X-R10 і необов'язково додатково заміщена однією або декількома групами, незалежно вибраними з R9;
R4 вибраний з -С1-5алкілу і 5-12-членного гетероциклоалкілу, де гетероциклоалкіл необов'язково може бути заміщений однією або декількома групами, незалежно вибраними з R5;
R5 вибраний з -С1-5алкілу, -С1-5галогеналкілу і -С1-3алкілен-О-С1-3алкілу;
R9 вибраний з -С1-5алкілу, -О-С1-5алкілу, -N(С1-5алкілу)2, галогену, -С1-3алкілен-О-С1-3алкілу, -С1-5алкілен-N(-С1-5алкіл, -С1-5алкілу), 5-12-членного гетероциклоалкілу, де гетероциклоалкільна група необов'язково може бути заміщена однією або декількома групами, незалежно вибраними з =О, -С1-3алкілу, або
R9 вибраний з -С6-10арилу і 5-12-членного гетероарилу, де арильна і гетероарильна групи необов'язково і незалежно можуть бути заміщені однією або декількома групами, вибраними з галогену, -С1-3алкілу, -О-С1-3алкілу, -С1-3галогеналкілу, -О-С1-3галогеналкілу, -N(С1-5алкіл, С1-5алкілу) і -NН-С1-5алкілу;
X являє собою -С1-3алкілен- або -О-;
R10 являє собою -С6-10арил або 5-12-членний гетероарил, кожна з цих груп необов'язково може бути заміщена однією або декількома групами, вибраними з галогену, -С1-3алкілу, -О-С1-3алкілу, -С1-3галогеналкілу, -О-С1-3галогеналкілу;
де сполуки формули (І) необов'язково можуть бути представлені у формі солей.
2. Сполука за п. 1, яка відрізняється тим, що R1 являє собою -СН3.
3. Сполука за п. 1 або 2, яка відрізняється тим, що R2 являє собою -NHR4 і R4 являє собою 5-6-членний гетероциклоалкіл, необов'язково заміщений, як визначено в п. 1.
4. Сполука за п. 3, яка відрізняється тим, що R4 є тетрагідрофураном або піперидином, де піперидин заміщений однією групою, вибраною з -СН3, -СН2СН3,-СН2СН2СН3 і -(СН2)2-О-СН3.
5. Сполука за будь-яким з пп. 1 або 2, яка відрізняється тим, що R2 являє собою -NHR4 і R4 являє собою -С1-3алкіл.
6. Сполука за п. 5, яка відрізняється тим, що R2 являє собою -NHR4 і R4 являє собою -СН3 або -СН(СН3)2.
7. Сполука за будь-яким з пп. 1 або 2, яка відрізняється тим, що R2 являє собою -С1-3алкіл.
8. Сполука за будь-яким з пп. 1-7, яка відрізняється тим, що R3 являє собою 5-9-членний гетероарил, який заміщений -X-R10 і необов'язково додатково заміщений однією або декількома групами, незалежно вибраними з R9, де R9, X і R10 є такими, як визначено в п. 1.
9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що -X-R10 вибраний з -СН2-фенілу, -СН(СН3)-фенілу, -СН2-піридилу, -СН(СН3)-піридилу, -О-фенілу, де кожна фенільна або піридильна група необов'язково заміщена -F або -СН3.
10. Сполука за п. 9, яка відрізняється тим, що -X-R10 вибраний з -СН2-фенілу, -СН2-піридилу, -СН(СН3)-фенілу, -СН(СН3)-піридилу, де кожна піридильна або фенільна група необов'язково заміщена -F або -СН3.
11. Сполука за п. 8, яка відрізняється тим, що R3 вибраний з піразолілу, імідазолу, бензімідазолілу, імідазопіридину і імідазопіримідину і R3 заміщений -X-R10 і R3 необов'язково додатково заміщений однією або декількома групами, незалежно вибраними з R9, де R9, X і R10 є такими, як визначено в п. 1.
12. Сполука за будь-яким з пп. 1-11, яка відрізняється тим, що R9 незалежно вибраний з -С1-3алкілу, -О-С1-3алкілу, -N(С1-3алкілу)2, фенілу і 6-членного гетероциклоалкілу, де гетероциклоалкіл необов'язково може бути заміщений однією або декількома групами, незалежно вибраними з =O і -С1-3алкілу.
13. Сполука за п. 11, яка відрізняється тим, що R3 являє собою імідазопіридин або бензімідазол, який заміщений -СН2-фенілом або -СН2-піридилом, -СН(СН3)-піридилом і необов'язково додатково заміщений -С1-3алкілом або 5-12-членним гетероциклоалкілом, де гетероциклоалкільна група необов'язково може бути заміщена однією або декількома групами, незалежно вибраними з -С1-3алкілу.
14. Сполука за п. 13, яка відрізняється тим, що R3 являє собою імідазопіридин або бензімідазол, який заміщений -СН2-фенілом, -СН(СН3)-піридилом або -СН2-піридилом і заміщений -СН(СН3)2 або морфолінілом, або піперазинілом, де морфолінільна або піперазинільна групи необов'язково заміщені однією або декількома групами, вибраними з -С1-3алкілу.
15. Сполука за п. 1, вибрана з
Пр.№
Структура
Пр.№
Структура
I-1
I-2

I-3
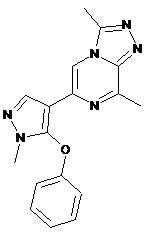
I-4
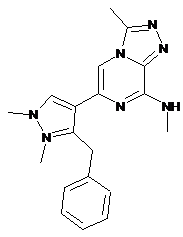
I-5
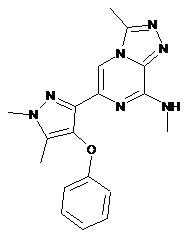
II-1
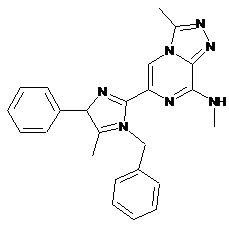
Пр.№
Структура
Пр.№
Структура
II-2

II-3

III-1
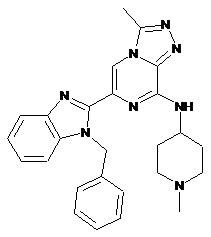
III-2

III-3

Ш-4
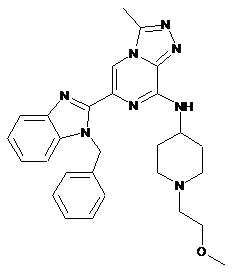
III-5

III-6

III-7
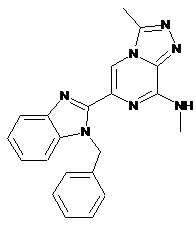
III-8

Пр.№
Структура
Пр.№
Структура
III-9

III-10
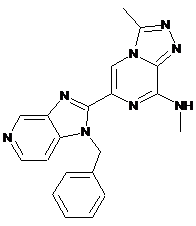
III-11

III-12
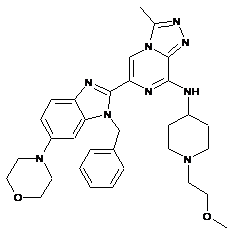
III-13

III-14
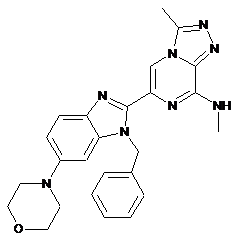
III-15

III-16
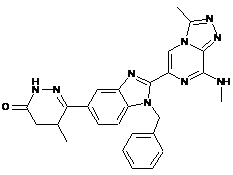
III-17

III-18

Пр.№
Структура
Пр.№
Структура
III-19

III-20
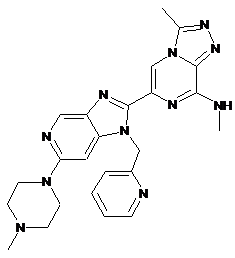
III-21

III-22
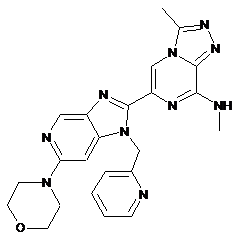
III-23

III-24

III-25

III-26

III-27

III-28

Пр.№
Структура
Пр.№
Структура
III-29

III-30

III-31

III-32
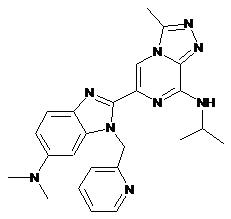
III-33

III-34
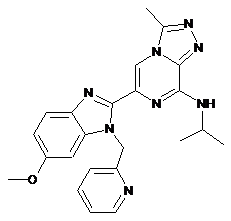
III-35

III-36

III-37

III-38
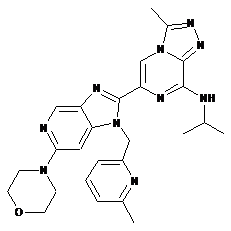
III-39

III-40
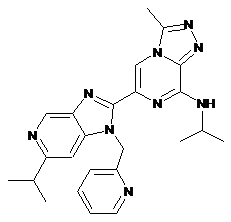
Пр.№
Структура
Пр.№
Структура
III-41

III-42
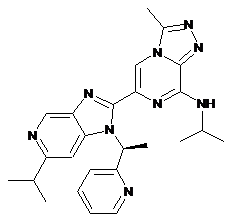
III-43

III-44

III-45

III-46
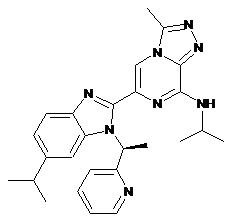
III-47

III-48

III-49

III-50
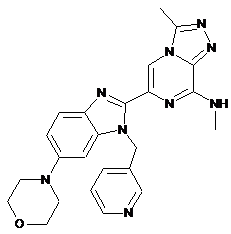
III-51

III-52

Пр.№
Структура
Пр.№
Структура
ІII-53

де сполука необов'язково може бути представлена у формі солей.
16. Сполука за п. 1 (ІII-13)
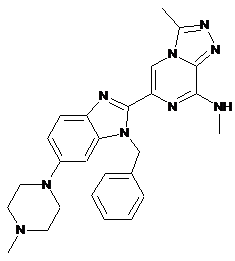
або її фармацевтично прийнятна сіль.
17. Сполука за п. 1 (IIІ-8)

або її фармацевтично прийнятна сіль.
18. Сполука за п. 1 (III-40)

або її фармацевтично прийнятна сіль.
19. Сполука за п. 1 (III-26)

або її фармацевтично прийнятна сіль.
20. Сполука за п. 1 (III-19)

або її фармацевтично прийнятна сіль.
21. Сполука за п. 1 (ІІІ-30)

або її фармацевтично прийнятна сіль.
22. Сполука за п. 1 (III-20)

або її фармацевтично прийнятна сіль.
23. Сполука за п. 1 (III-21)

або її фармацевтично прийнятна сіль.
24. Сполука за п. 1 (III-1)

або її фармацевтично прийнятна сіль.
25. Сполука за п. 1 (ІII-27)

або її фармацевтично прийнятна сіль.
26. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-25 або її фармацевтично прийнятних солей в лікуванні й/або запобіганні раку.
27. Фармацевтичний препарат, який містить як активну речовину одну або декілька сполук загальної формули (І) за будь-яким з пп. 1-25 необов'язково в комбінації із загальноприйнятими наповнювачами і/або носіями.
28. Фармацевтичний препарат, що містить сполуку загальної формули (І) за будь-яким з пп. 1-25 або одну з її фармацевтично прийнятних солей і щонайменше одну іншу цитостатичну або цитотоксичну активну речовину, яка відрізняється від формули (І).
29. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-25 або її фармацевтично прийнятних солей як лікарських засобів.
30. Застосування за п. 26 в лікуванні злоякісних захворювань кровотворної системи.
31. Застосування за п. 26 в лікуванні гострої мієлолейкоми (ГМЛ) або множинної мієломи (MM).
32. Застосування за п. 26 в лікуванні раку легенів, печінки, ободової кишки, головного мозку, щитовидної залози, підшлункової залози, молочної залози, яєчників і передміхурової залози.
Текст
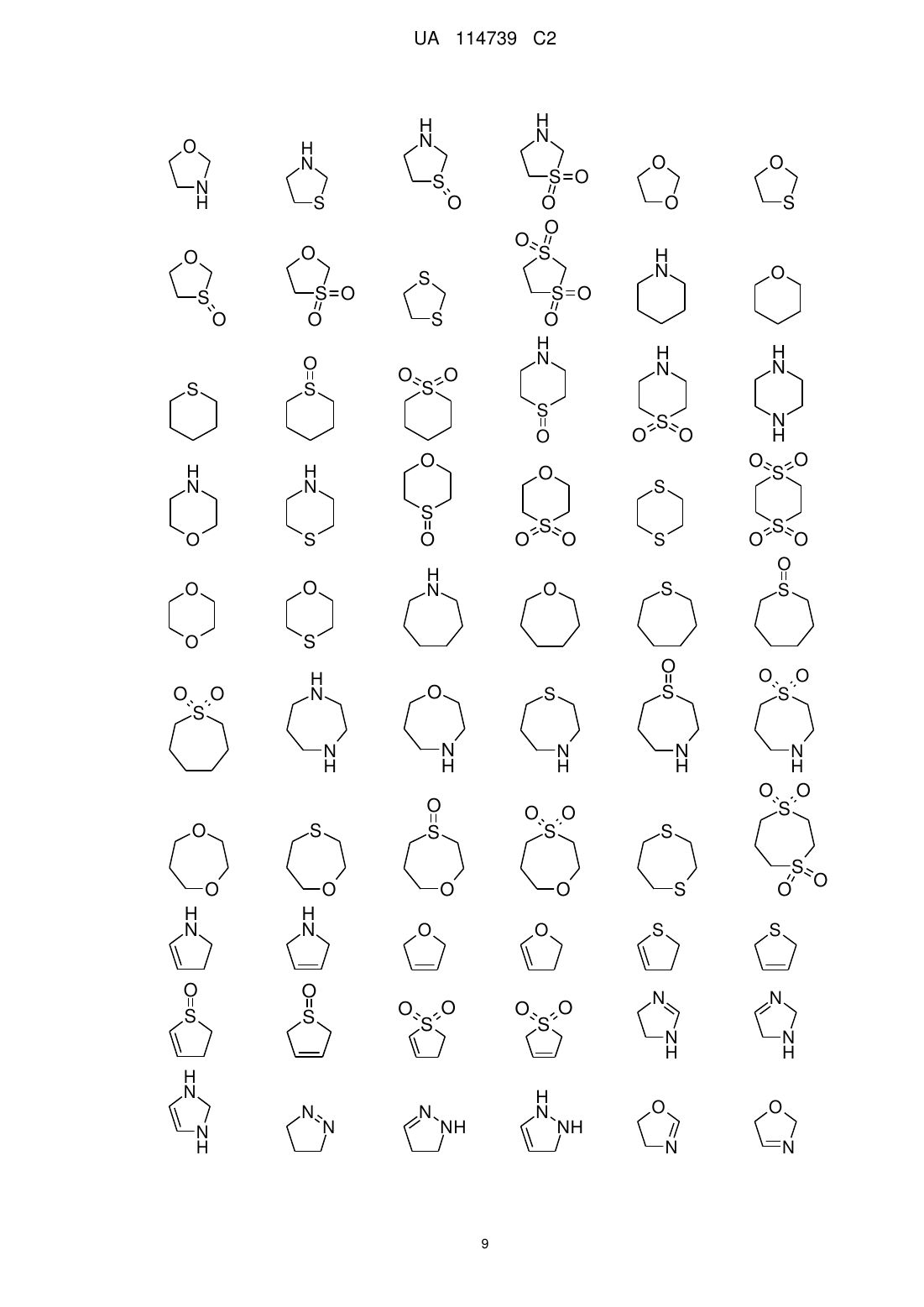
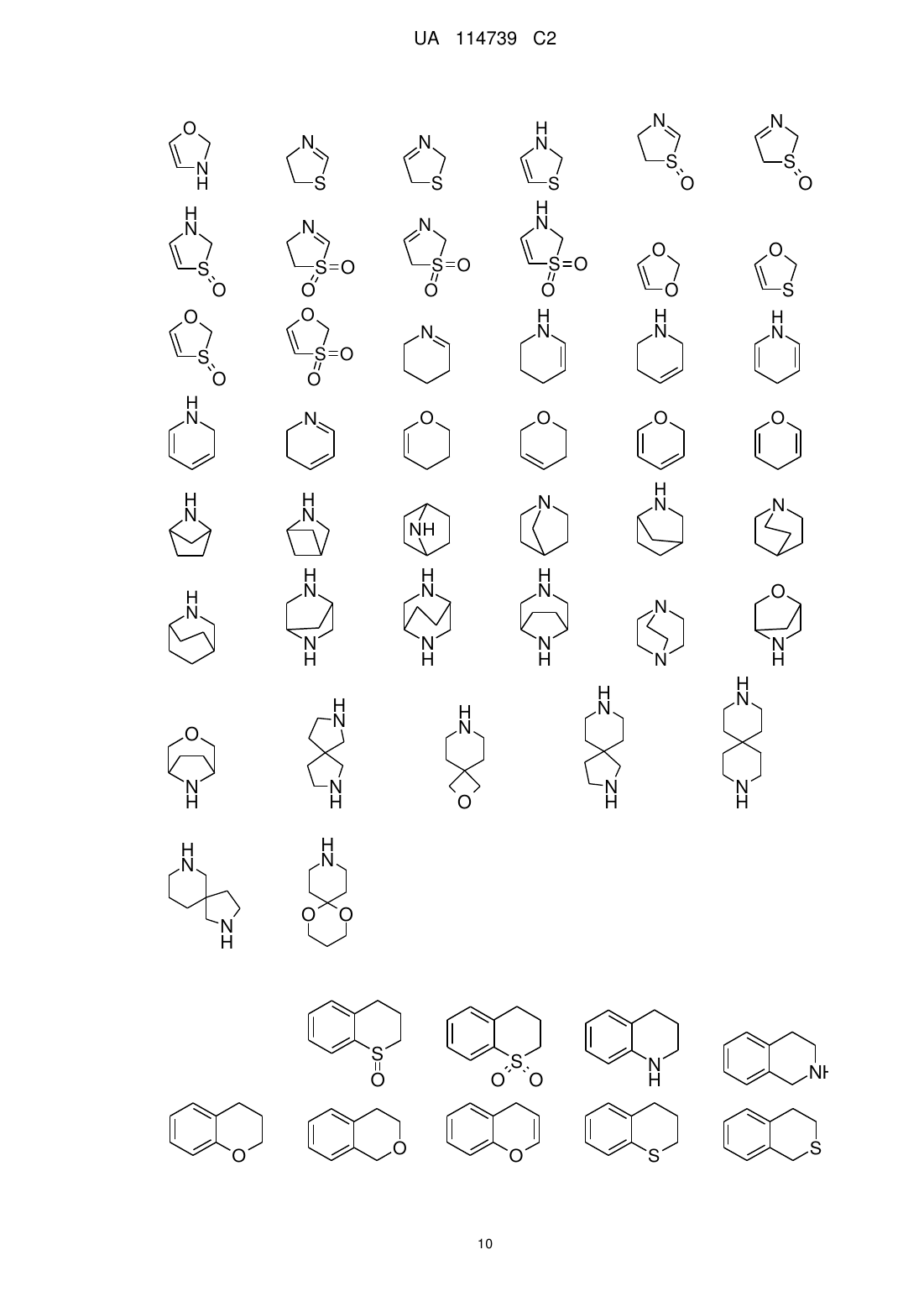
Реферат: Даний винахід охоплює сполуки загальної формули (І) R 1 N N R 3 N N R , (1) 2 1 3 де групи R -R мають значення, приведені у формулі винаходу і в описі. Сполуки згідно з винаходом придатні для лікування захворювань, які характеризуються надмірною або UA 114739 C2 (12) UA 114739 C2 аномальною клітинною проліферацією, фармацевтичних препаратів, що містять такі сполуки, і їх застосування як лікарського засобу. UA 114739 C2 Даний винахід відноситься до сполук загальної формули (I) R R 5 10 15 20 25 30 35 40 45 1 3 N N N N R 2 (I) 1 3 де групи R - R мають значення, приведені у формулі винаходу і в описі. Сполуки згідно з винаходом придатні для лікування захворювань, які характеризуються надмірною або аномальною клітинною проліферацією, фармацевтичних препаратів, що містять такі сполуки, і їх застосування як лікарського засобу. Сполуки згідно з винаходом є інгібіторами BRD4. Рівень техніки Ацетилювання гістонів у більшості випадків пов'язане з активацією транскрипції генів, оскільки модифікація послаблює взаємодію ДНК і гістонового октамеру шляхом зміни електростатики. Додатково до цієї фізичної зміни, специфічні білки зв'язуються з ацетильованими залишками лізину в межах гістонів для зчитування епігенетичного коду. Бромодомени є маленькими (близько 110 амінокислот) дискретними доменами в білках, які зв'язуються з ацетильованими залишками лізину в більшості випадків, але не виключно, в рамках гістонів. Існує родина, що складається з близько 50 білків, які, як відомо, містять бромодомени, і вони виконують ряд функцій у клітині. BET-родина бромодомен-вмісних білків містить 4 білки (BRD2, BRD3, BRD4 і BRD-T), які містять тандемні бромодомени, здатні зв'язуватися з двома ацетильованими залишками лізину, що знаходяться в безпосередній близькості, підвищуючи специфічність взаємодії. У недавніх дослідженнях було встановлено очевидне обґрунтування для націлювання BRD4 при раку. BRD4 залишається зв'язаним з сайтами ініціації транскрипції генів, що експресуються при входженні в G1 фазу клітинного циклу і функціонує для рекрутування комплексу позитивного фактора елонгації транскрипції (P-TEFb), що приводить до підвищеної експресії генів, які сприяють росту (Yang and Zhou, Mol. Cell. Biol. 28, 967, 2008). Важливо, що BRD4 був ідентифікований як компонент рецидивуючої хромосомної транслокації t(15;19) при агресивній формі плоскоклітинної карциноми у людей (French et al., Cancer Res. 63, 304, 2003). Такі транслокації експресують тандемні N-кінцеві бромодомени BRD4 у вигляді химери з білком NUT (ядерний білок в яєчках) всередині рамки зчитування, генетично визначаючи так звану NUT серединну карциному (NMC). Функціональні дослідження на клітинних лініях, одержаних від пацієнтів з NMC, підтвердили суттєву роль BRD4-NUT онкобілка для підтримки проліферації і блокування диференціації цих злоякісних клітин. Додатково, BRD4 був ідентифікований в якості критичної детермінанти чутливості в мишачій моделі генетично визначеного ГМЛ (Zuber et al., Nature 2011 478(7370):524-8). Супресія BRD4 приводить до значних анти-лейкемічних ефектів in vitro та in vivo, що супроводжується термінальною мієлоїдною диференціацією. Цікаво, що інгібування BRD4 ініціює негативну регуляцію MYC у багатьох досліджуваних клітинних лініях лейкозу мишей і людини, вказуючи на те, що низькомолекулярні інгібітори BRD4 можуть забезпечувати засоби для пригнічення шляху MYC у ряді підтипів ГМЛ. На завершення, також було описано, що інші представники родини BET мають певну дію, що полягає в контролі або проходженні стадій клітинного циклу, і було показано, що вони залишаються в комплексі з хромосомами в процесі ділення клітини - що свідчить про роль у підтримані епігенетичної пам'яті (Leroy et al, Mol. Cell. 2008 30(1 ):51-60). Прикладами інгібіторів бромодомена є похідні бензoдіазепіну, описані в WO2011/054553, і похідні імідазо [4,5] хіноліну, описані в WO2011/05484. 6 Таким чином, існує потреба в забезпеченні інгібіторів BRD4, придатних для запобігання і/або лікування захворювань, які характеризуються надмірною або аномальною клітинною проліферацією, таких як рак. Детальний опис суті винаходу Даний винахід відноситься до сполук формули (I) R R 3 1 N N N N R 2 (I) 1 UA 114739 C2 5 10 15 20 25 30 35 40 45 50 55 60 де 1 R являє собою -C1-3алкіл або -C1-3галогеналкіл; 2 4 R вибраний з -NHR , -C1-5алкілу, -C1-5галогеналкілу, галогену і -S-C1-3алкілу; 3 10 R являє собою 5-12-членний гетероарил, група якого заміщена -X-R , і необов'язково 9 додатково заміщений однією або декількома групами, незалежно вибраними з R ; 4 R вибраний з -C1-5алкілу і 5-12-членного гетероциклоалкілу, де гетероциклоалкіл необов'язково може бути заміщений однією або декількома групами, незалежно вибраними з 5 R; 5 R вибраний з -C1-5алкілу, -C1-5галогеналкілу і -C1-3алкілен-O-C1-3алкілу; 9 R вибраний з -C1-5алкілу, -O-C1-5алкілу, -N(C1-5алкілу)2, галогену, -C1-3алкілен-O-C1-3алкілу, C1-5алкілен-N(-C1-5алкіл, -C1-5алкілу), 5-12-членного гетероциклоалкілу, де гетероциклоалкільна група необов'язково може бути заміщена однією або декількома групами, незалежно вибраними з =O, -C1-3алкілу, або 9 R вибраний з -C6-10арилу і 5-12-членного гетероарилу, де арильна і гетероарильна групи необов'язково і незалежно можуть бути заміщені однією або декількома групами, вибраними з галогену, -C1-3алкілу, -O-C1-3алкілу, -C1-3галогеналкілу, -O-C1-3галогеналкілу, -N(C1-5алкіл, C15алкілу) і -NH-C1-5алкілу; X являє собою -C1-3алкілен- або -O-; 10 R являє собою -C6-10арил або 5-12-членний гетероарил, причому кожна з цих груп необов'язково може бути заміщена однією або декількома групами, вибраними з галогену, -C13алкілу, -O-C1-3алкілу, -C1-3галогеналкілу, -O-C1-3галогеналкілу; де сполуки формули (I) необов'язково можуть бути представлені у формі солей. 1 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє собою -CH3. 2 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє 4 4 собою -NHR і R являє собою 5-6-членний гетероциклоалкіл, необов'язково заміщений, як визначено в описі даного документа і у формулі винаходу. 2 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє 4 4 собою -NHR і R являє собою тетрагідрофуран або піперидин, де піперидин заміщений однією групою, вибраною з -CH3, -CH2CH3, -CH2CH2CH3 і -(CH2)2-O-CH3. 2 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє 4 4 собою -NHR і R являє собою -C1-3алкіл. 2 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє 4 4 собою -NHR і R являє собою -CH3 або -CH(CH3)2. 2 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє собою -C1-3алкіл. 3 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє 10 собою 5-9 членний гетероарил, який заміщений -X-R і необов'язково додатково заміщений 9 9 10 однією або декількома групами, незалежно вибраними з R , де R , R і X мають значення, як визначено в описі даного документа і у формулі винаходу. 3 9 Переважно, R необов'язково додатково заміщений одним або двома R . 10 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де -X-R вибраний з -CH2-фенілу, -CH(CH3)-фенілу, -CH2-піридилу, -CH(CH3)-піридилу, -O-фенілу, де кожна фенільна або піридильна група необов'язково заміщена -F або -CH3. 10 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де -X-R вибраний з -CH2-фенілу, -CH2-піридилу, -CH(CH3)-фенілу, -CH(CH3)-піридилу, де кожна піридильна або фенільна група необов'язково заміщена -F або -CH3. 3 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R 3 вибраний з піразолілу, імідазолу, бензімідазолілу, імідазопіридину і імідазопіримідину і R 10 3 заміщений -X-R і R необов'язково додатково заміщений однією або декількома групами, 9 9 10 незалежно вибраними з R , де R , R і X мають значення, як визначено в описі даного документа і у формулі винаходу. 9 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R незалежно вибраний з -C1-3алкілу, -O-C1-3алкілу, -N(C1-3алкіл)2, фенілу і 6-членного гетероциклоалкілу, де гетероциклоалкіл необов'язково може бути заміщений однією або декількома групами, незалежно вибраними з =O і -C1-3алкілу. 3 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє собою імідазопіридин або бензімідазол, який заміщений -CH2-фенілом або -CH2-піридилом, CH(CH3)-піридилом і необов'язково додатково заміщений -C1-3алкілом або 5-12-членним гетероциклоалкілом, де гетероциклоалкільна група необов'язково може бути заміщена однією 2 UA 114739 C2 5 10 15 20 25 30 35 40 45 50 55 60 або декількома групами, незалежно вибраними з -C1-3алкілу. 3 У переважному варіанті реалізації винахід відноситься до сполук формули (I), де R являє собою імідазопіридин або бензімідазол, який заміщений -CH2-фенілом, -CH(CH3)-піридилом або -CH2-піридилом і заміщений -CH(CH3)2 або морфолінілом або піперазинілом, де морфолінільна або піперазинільна групи необов'язково заміщені однією або декількома групами, вибраними з C1-3алкілу. У переважному варіанті реалізації винахід відноситься до сполук формули (I), де 5-93 членний гетероарил у положенні R приєднаний до ядра структури через атома вуглецю. У переважному варіанті реалізації винахід відноситься до сполук формули (I), де 10 піридильний фрагмент у положенні R зв'язаний з -X- в 2-му положенні. У додатковому варіанті реалізації винахід відноситься до сполук формули (I) для застосування в лікуванні раку. У додатковому варіанті реалізації винахід відноситься до сполуки загальної формули (I) згідно з будь-яким з варіантів реалізації винаходу, представлених в описі даного документа і у формулі винаходу, - або її фармацевтично прийнятних солей - для застосування в лікуванні і/або запобіганні раку. У додатковому варіанті реалізації винахід відноситься до фармацевтичного препарату, що містить як активну речовину, одну або декілька сполук загальної формули (I) згідно з будь-яким з варіантів реалізації винаходу, представлених в описі даного документа і у формулі винаходу необов'язково в комбінації із загальноприйнятими наповнювачами і/або носіями. У додатковому варіанті реалізації винахід відноситься до фармацевтичного препарату, що містить сполуку загальної формули (I) згідно з будь-яким з варіантів реалізації винаходу, представлених в описі даного документа і у формулі винаходу, - або одну з її фармацевтично прийнятних солей - і щонайменше одну іншу цитостатичну або цитотоксичну активну речовину, що відрізняються від формули (I). Даний винахід додатково відноситься до гідратів, сольватів, поліморфів, метаболітів, похідних і проліків сполук загальної формули (I). Даний винахід додатково відноситься до фармацевтично прийнятної солі сполуки загальної формули (I) з неорганічними або органічними кислотами або основами. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - як лікарських засобів. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в способі лікування людини або тварини. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в лікуванні і/або запобіганні раку, інфекціям, запаленням і аутоімунним захворюванням. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в способі лікування і/або запобігання раку, інфекціям, запаленням і аутоімунним захворюванням у людини і тварини. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в лікуванні і/або запобіганні раку. У іншому аспекті винахід відноситься до застосування сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для лікування і/або запобігання раку. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в способі лікування і/або запобігання раку у людини або тварини. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в лікуванні і/або запобіганні злоякісним захворюванням кровотворної системи, переважно ГМЛ, MM. У іншому аспекті винахід відноситься до сполук загальної формули (I) - або їхніх фармацевтично прийнятних солей - для застосування в лікуванні і/або запобіганні солідним пухлинам, переважно раку легенів, печінки, ободової кишки, головного мозку, щитовидної залози, підшлункової залози, молочної залози, яєчників і передміхурової залози. У іншому аспекті винахід відноситься до способу лікування і/або запобігання раку, що включає введення терапевтично ефективної кількості сполуки загальної формули (I) - або однієї з її фармацевтично прийнятних солей - людині. У іншому аспекті винахід відноситься до фармацевтичного препарату, що містить як активну речовину одну або декілька сполук загальної формули (I) - або її фармацевтично прийнятних солей - необов'язково в комбінації із загальноприйнятими наповнювачами і/або носіями. У іншому аспекті винахід відноситься до фармацевтичного препарату, що містить сполуку 3 UA 114739 C2 5 10 15 20 25 30 35 40 45 50 55 60 загальної формули (I) - або одну з її фармацевтично прийнятних солей - і щонайменше одну іншу цитостатичну або цитотоксичну активну речовину, що відрізняються від формули (I). Визначення Терміни, які конкретно в даному документі не визначені, мають значення, які очевидні для фахівця в даній області техніки з урахуванням загального розкриття і контексту в цілому. Як використовується в даному документі, застосовуються наступні визначення, якщо не вказане інше. У групах, радикалах або компонентах, визначених нижче, кількість атомів вуглецю часто вказана перед групою, наприклад, -C1-5алкіл означає алкільну групу або радикал, що має від 1 до 5 атомів вуглецю. В цілому, для груп, що містять дві або більше підгруп, перша названа підгрупа є точкою приєднання радикала, наприклад, замісник -C1-5алкіл-C3-10циклоалкіл, означає C3-10циклоалкільну групу, яка зв'язана з C1-5алкілом, останній з них зв'язаний з ядром структури або з групою, до якої приєднаний замісник. Вказівка числа членів у групах, які містять один або більше гетероатомів) (гетероалкіл, гетероарил, гетероарилалкіл, гетероцикліл, гетероциклілалкіл) відноситься до загального атомного числа всіх кільцевих членів або членів ланцюга або сумарного значення всіх кільцевих членів і членів ланцюга. Фахівець у даній області техніки візьме до уваги, що заміщаючі групи, що містять атом азоту, також можуть бути позначені як амін або аміно. Так само групи, що містять атом кисню, також можуть бути позначені з -окси, такі як, наприклад, алкокси. Групи, що містять -C(O)-, також можуть бути позначені як карбокси; групи, що містять -NC(O)-, також можуть бути позначені як амід; групи, що містять -NC(O)N-, також можуть бути позначені як сечовина; групи, що містять -NS(O)2-, також можуть бути позначені як сульфонамід. Алкіл означає моновалентні, насичені вуглеводневі ланцюги, які можуть бути представлені як у лінійній, так і в розгалуженій формі. Якщо алкіл заміщений, то заміщення може здійснюватися незалежно одне від одного, шляхом моно- або полізаміщения в кожному випадку, на всіх атомах вуглецю, що несуть водні. Термін "C1-5-алкіл" включає, наприклад, метил (Me; -CH3), етил (Et; -CH2CH3), 1-пропіл (нпропіл; n-Pr; -CH2CH2CH3), 2-пропіл (і-Pr; ізопропіл; -CH(CH3)2), 1-бутил (н-бутил; n-Bu; CH2CH2CH2CH3), 2-метил-1-пропіл (ізобутил; і-Bu; -CH2CH(CH3)2), 2-бутил (втор-бутил; sec-Bu; CH(CH3) CH2CH3), 2-метил-2-пропіл (трет-бутил; t-Bu; -C(CH3)3), 1-пентил (н-пентил; CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 3-метил-1-бутил (ізопентил; -CH2CH2CH(CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3) CH(CH3)2), 2,2-диметил-1-пропіл (неопентил; -CH2C(CH3)3), 2-метил-1-бутил (CH2CH(CH3)CH2CH3). Під термінами пропіл, бутил, пентил та ін. без якого-небудь додаткового визначення розуміють насичені вуглеводневі групи з відповідною кількістю атомів вуглецю, де включені всі ізомерні форми. Наведене вище визначення для алкілу також застосовується, якщо алкілом є частина іншої групи, така як, наприклад, Cx-y-алкіламіно або Cx-y-алкілокси або Cx-y-алкокси, де Cx-y-алкілокси і Cx-y-алкокси означають таку ж групу. Термін алкілен також може бути похідним від алкілу. Алкілен є двовалентним, на відміну від алкілу, і для нього необхідні два партнери для зв'язування. Формально, друга валентність утворюється шляхом видалення атома водню в алкілі. Відповідними групами є, наприклад, -CH3 і -CH2, -CH2CH3 і -CH2CH2 або >CHCH3 та ін. Термін "C1-4-алкілен" включає, наприклад, -(CH2)-, -(CH2-CH2)-, -(CH(CH3))-, -(CH2-CH2-CH2)-, (C(CH3)2)-, -(CH(CH2CH3))-, -(CH(CH3)-CH2)-, -(CH2-CH(CH3))-, -(CH2-CH2-CH2-CH2)-, -(CH2-CH2CH(CH3))-, -(CH(CH3)-CH2-CH2)-, -(CH2-CH(CH3)-CH2)-, -(CH2-C(CH3)2)-, -(C(CH3)2-CH2)-, (CH(CH3)-CH(CH3))-, -(CH2-CH(CH2CH3))-, -(CH(CH2CH3)-CH2)-, -(CH(CH2CH2CH3))-, (CHCH(CH3)2) - і -C(CH3)(CH2CH3)-. Іншими прикладами алкілену є метилен, етилен, пропілен, 1-метилетилен, бутилен, 1-метилпропілен, 1,1-диметилетилен, 1,2-диметилетилен, пентилен, 1,1-диметилпропілен, 2,2диметилпропілен, 1,2-диметилпропілен, 1,3-диметилпропілен та ін. Під узагальненими термінами пропілен, бутилен, пентилен, гексилен та ін. без якого-небудь додаткового визначення розуміють всі можливі ізомерні форми з відповідною кількістю атомів вуглецю, тобто, пропілен включає 1-метилетилен і бутилен включає 1-метилпропілен, 2-метилпропілен, 1,1-диметилетилен і 1,2-диметилетилен. Наведене вище визначення алкілену також застосовується, якщо алкіленом є частина іншої групи, такої як, наприклад, у HO-Cx-y-алкіленаміно або H2N-Cx-y-алкіленокси. На відміну від алкілу, алкеніл складається щонайменше з двох атомів вуглецю, де 4 UA 114739 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше два суміжні атоми вуглецю зв‘язано разом за допомогою C-C подвійного зв'язку. Якщо в алкілі, як визначено в даному документі вище, що має щонайменше два атоми вуглецю, два атоми водню на суміжних атомах вуглецю формально видалено і вільні валентності насичуються з утворенням другого зв'язку, то утворюється відповідний алкеніл. Прикладами алкенілу є вініл (етеніл), проп-1-еніл, аліл (проп-2-еніл), ізопропеніл, бут-1-еніл, бут-2-еніл, бут-3-еніл, 2-метил-проп-2-еніл, 2-метил-проп-1-еніл, 1-метил-проп-2-еніл, 1-метилпроп-1-еніл, 1-метиліденпропіл, пент-1-еніл, пент-2-еніл, пент-3-еніл, пент-4-еніл, 3-метил-бут-3еніл, 3-метил-бут-2-еніл, 3-метил-бут-1-еніл, гекс-1-еніл, гекс-2-еніл, гекс-3-еніл, гекс-4-еніл, гекс-5-еніл, 2,3-диметил-бут-3-еніл, 2,3-диметил-бут-2-еніл, 2-метиліден-3-метилбутил, 2,3диметил-бут-1-еніл, гекса-1,3-дієніл, гекса-1,4-дієніл, пента-1,4-дієніл, пента-1,3-дієніл, бута-1,3дієніл, 2,3-диметилбута-1,3-дієн та ін. Під узагальненими термінами пропеніл, бутеніл, пентеніл, гексеніл, бутадієніл, пентадієніл, гексадієніл, гептадієніл, октадієніл, нонадієніл, декадієніл та ін. без якого-небудь додаткового визначення розуміють всі можливі ізомерні форми з відповідною кількістю атомів вуглецю, тобто пропеніл включає проп-1-еніл і проп-2-еніл, бутеніл включає бут-1-еніл, бут-2-еніл, бут-3-еніл, 1-метил-проп-1-еніл, 1-метил-проп-2-еніл та ін. Алкеніл необов'язково може бути в цис або транс або E або Z орієнтації по відношенню до подвійного(их) зв'язку(ів). Наведене вище визначення для алкенілу також використовується, коли алкеніл є частиною іншої групи, такої як, наприклад, у C x-y-алкеніламіно або Cx-y-алкенілокси. На відміну від алкілену, алкенілен складається щонайменше з двох атомів вуглецю, де щонайменше два суміжні атоми вуглецю зв‘язано разом за допомогою C-C подвійного зв'язку. Якщо в алкілені, як визначено в даному документі вище, що має щонайменше два атоми вуглецю, два атоми водню на суміжних атомах вуглецю формально видалено і вільні валентності насичені з утворенням другого зв'язку, то утворюється відповідний алкенілен. Прикладами алкенілену є етенілен, пропенілен, 1-метилетенілен, бутенілен, 1-метилпропенілен, 1,1-диметилетенілен, 1,2-диметилетенілен, пентенілен, 1,1-диметилпропенілен, 2,2-диметилпропенілен, 1,2-диметилпропенілен, 1,3-диметилпропенілен, гексенілен та ін. Під узагальненими термінами пропенілен, бутенілен, пентенілен, гексенілен та ін. без якогонебудь додаткового визначення розуміють всі можливі ізомерні форми з відповідною кількістю атомів вуглецю, тобто пропенілен включає 1-метилетенілен і бутенілен включає 1метилпропенілен, 2-метилпропенілен, 1,1-диметилетенілен і 1,2-диметилетенілен. Алкенілен необов'язково може бути в цис або транс або E або Z орієнтації по відношенню до подвійного(их) зв'язку(ів). Наведене вище визначення для алкенілену також використовується, коли алкенілен є частиною іншої групи, такої як, наприклад, у HO-Cx-y-алкенілeнаміно або H2N-Cx-y-алкенілeнокси. На відміну від алкілу, алкініл складається щонайменше з двох атомів вуглецю, де щонайменше два суміжні атоми вуглецю зв‘язано разом за допомогою C-C потрійного зв'язку. Якщо в алкілі, як визначено в даному документі вище, що має щонайменше два атоми вуглецю, два атоми водню в кожному випадку на суміжних атомах вуглецю формально видалені і вільні валентності насичені з утворенням двох додаткових зв'язків, то утворюється відповідний алкініл. Прикладами алкінілу є етиніл, проп-1-ініл, проп-2-ініл, бут-1-иніл, бут-2-иніл, бут-3-иніл, 1-метил-проп-2-ініл, пент-1-иніл, пент-2-иніл, пент-3-иніл, пент-4-иніл, 3-метил-бут-1-иніл. Під узагальненими термінами пропініл, бутиніл, пентиніл та ін. без якого-небудь додаткового визначення розуміють всі можливі ізомерні форми з відповідною кількістю атомів вуглецю, тобто пропініл включає проп-1-ініл і проп-2-ініл, бутиніл включає бут-1-иніл, бут-2-иніл, бут-3-иніл, 1-метил-проп-1-иніл, 1-метил-проп-2-ініл. Якщо вуглеводневий ланцюг несе і щонайменше один подвійний зв'язок, і також щонайменше один потрійний зв'язок, то за визначенням вона відноситься до підгрупи алкінілу. Наведене вище визначення для алкінілу також застосовується, якщо алкініл є частиною іншої групи, такої як, наприклад, в Cx-y-алкініламіно або Cx-y-алкінілокси. На відміну від алкілену, алкінілен складається щонайменше з двох атомів вуглецю, де щонайменше два суміжні атоми вуглецю зв‘язано разом за допомогою C-C потрійного зв'язку. Якщо в алкілені, як визначено в даному документі вище, що має щонайменше два атоми вуглецю, два атоми водню в кожному випадку на суміжних атомах вуглецю формально видалені і вільні валентності насичені з утворенням двох додаткових зв'язків, то утворюється відповідний алкінілен. Прикладами алкінілену є етинілен, пропінілен, 1-метилетинілен, бутинілен, 1-метилпропінілен, 1,1-диметилетинілен, 1,2-диметилетинілен, пентинілен, 5 UA 114739 C2 5 10 15 20 25 30 35 40 45 1,1-диметилпропінілен, 2,2-диметилпропінілен, 1,2-диметилпропінілен, 1,3-диметилпропінілен, гексинілен та ін. Під узагальненими термінами пропінілен, бутинілен, пентинілен та ін. без якого-небудь додаткового визначення розуміють всі можливі ізомерні форми з відповідною кількістю атомів вуглецю, тобто пропінілен включає 1-метилетинілен і бутинілен включає 1-метилпропінілен, 2метилпропінілен, 1,1-диметилетинілен і 1,2-диметилетинілен. Наведене вище визначення для алкінілену також застосовується, якщо алкінілен є частиною іншої групи, такої як, наприклад, в HO-Cx-y-алкініленаміно або H2N-Cx-y-алкініленокси. Під гетероатомами розуміють атоми кисню, азоту і сірки. Галогеналкіл (галогеналкеніл, галогеналкініл) є похідним визначеного вище алкілу (алкенілу, алкінілу) шляхом заміни одного або декількох атомів водню вуглеводневого ланцюга незалежно один від одного атомами галогену, які можуть бути однаковими або різними. Якщо галогеналкіл (галогеналкеніл, галогеналкініл) додатково заміщений, то заміщення можуть здійснюватися незалежно одне від одного, у формі моно- або полізаміщення в кожному випадку, на всіх атомах вуглецю, що несуть водні. Прикладами галогеналкілу (галогеналкенілу, галогеналкінілу) є -CF3, -CHF2, -CH2F, -CF2CF3, -CHFCF3, -CH2CF3, -CF2CH3, -CHFCH3, -CF2CF2CF3, -CF2CH2CH3, -CF=CF2, -CCl=CH2, -CBr=CH2, -CI=CH2, -CC-CF3, -CHFCH2CH3, -CHFCH2CF3 та ін. З раніше визначених галогеналкілу (галогеналкенілу, галогеналкінілу) також є похідними терміни галогеналкілен (галогеналкенілен, галогеналкінілен). Галогеналкілен (галогеналкеніл, галогеналкініл), на відміну від галогеналкілу, є двовалентним і для нього необхідні два партнери для зв'язування. Формально, друга валентність утворюється шляхом видалення атома водню з галогеналкілу. Відповідними групами є, наприклад -CH2F і -CHF-, -CHFCH2F і -CHFCHF- або >CFCH2F та ін. Наведені вище визначення також застосовуються, якщо відповідні галогенові групи є частинами іншої групи. Галоген відноситься до атомів флуору, хлору, брому і/або йоду. Циклоалкіл складається з підгруп моноциклічних вуглеводневих кілець, біциклічних вуглеводневих кілець і спіро-вуглеводневих кілець. Системи є насиченими. У біциклічних вуглеводневих кільцях два кільця сполучено разом таким чином, що вони мають спільні щонайменше два атоми вуглецю. У спіро-вуглеводневих кільцях атом вуглецю (спіроатом) відноситься до двох кілець разом. Якщо циклоалкіл підлягає заміщенню, то такі заміщення можуть здійснюватися незалежно одне від одного, у формі моно- або полізаміщення в кожному випадку, на всіх атомах вуглецю, що несуть водні. Циклоалкіл сам може бути зв'язаний як замісник з молекулою за допомогою кожного придатного положення кільцевої системи. Прикладами циклоалкілу є циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, біцикло[2,2,0]гексил, біцикло[3,2,0]гептил, біцикло[3,2,1]октил, біцикло[2,2,2]октил, біцикло[4,3,0]ноніл (октагідроінденіл), біцикло[4,4,0]децил (декагідронафтален), біцикло[2,2,1]гептил (норборніл), біцикло[4,1,0]гептил (норкараніл), біцикло[3,1,1]гептил (пінаніл), спіро[2,5]октил, спіро[3,3]гептил та ін. Наведене вище визначення для циклоалкілу також застосовується, якщо циклоалкіл є частиною іншої групи, такої як, наприклад, у C x-y-циклоалкіламіно або Cx-y-циклоалкілокси. Якщо вільна валентність циклоалкілу насичена, то отримують аліциклічну групу. Отже, термін циклоалкілен може бути похідним визначеного вище циклоалкілу. Циклоалкілен, на відміну від циклоалкілу, є двовалентним і для нього необхідні два партнери для зв'язування. Формально, другу валентність отримують шляхом видалення атома водню з циклоалкілу. Відповідними групами є, наприклад, циклогексил і , або 50 , або (циклогексилен). Наведене вище визначення для циклоалкілену також застосовується, якщо циклоалкілен є частиною іншої групи, такої як, наприклад, у HO-Cx-y-циклоалкіленаміно або H2N-Cx-yциклоалкіленокси. Циклоалкеніл також складається з підгруп моноциклічних вуглеводневих кілець, біциклічних 6 UA 114739 C2 5 10 15 20 25 30 35 40 45 вуглеводневих кілець і спіро-вуглеводневих кілець. Проте системи є ненасиченими, тобто присутній щонайменше один C-C подвійний зв'язок, але немає ароматичної системи. Якщо в циклоалкілі, як визначено в даному документі вище, два атоми водню на суміжних циклічних атомах вуглецю формально видалено і вільні валентності насичені з утворенням другого зв'язку, то отримують відповідний циклоалкеніл. Якщо циклоалкеніл підлягає заміщенню, то такі заміщення можуть здійснюватися незалежно одне від одного, у формі моно- або полізаміщення в кожному випадку, на всіх атомах вуглецю, що несуть водні. Циклоалкеніл сам може бути зв'язаний як замісник з молекулою за допомогою кожного придатного положення кільцевої системи. Прикладами циклоалкенілу є циклопроп-1-еніл, циклопроп-2-еніл, циклобут-1-еніл, циклобут-2-еніл, циклопент-1-еніл, циклопент-2-еніл, циклопент-3-еніл, циклогекс-1-еніл, циклогекс-2-еніл, циклогекс-3-еніл, циклогепт-1-еніл, циклогепт-2-еніл, циклогепт-3-еніл, циклогепт-4-еніл, циклобута-1,3-дієніл, циклопента-1,4-дієніл, циклопента-1,3-дієніл, циклопента-2,4-дієніл, циклогекса-1,3-дієніл, циклогекса-1,5-дієніл, циклогекса-2,4-дієніл, циклогекса-1,4-дієніл, циклогекса-2,5-дієніл, біцикло[2,2,1]гепта-2,5-дієніл (норборна-2,5-дієніл), біцикло[2,2,1]гепт-2-еніл (норборненіл), спіро[4,5]дец-2-ен та ін. Наведене вище визначення для циклоалкенілу також використовується, коли циклоалкеніл є частиною іншої групи, такої як, наприклад, у C x-y-циклоалкеніламіно або Cx-y-циклоалкенілокси. Якщо вільна валентність циклоалкенілу є насиченою, то отримують ненасичену аліциклічну групу. Термін циклоалкенілен відповідно може бути похідним з раніше визначеного циклоалкенілу. Циклоалкенілен, на відміну від циклоалкенілу, є двовалентним і для нього необхідно двох партнерів для зв'язування. Формально другу валентність отримують шляхом видалення атома водню з циклоалкенілу. Відповідними групами є, наприклад, циклопентеніл і , або , або , або (циклопентенілен) та ін. Наведене вище визначення для циклоалкенілену також використовується, коли циклоалкенілен є частиною іншої групи, такої як, наприклад, у HO-Cx-y-циклоалкеніленаміно або H2N-Cx-y-циклоалкеніленокси. Арил означає моно-, бі- або трициклічну групу щонайменше з одним ароматичним карбоциклом. Переважно він означає моноциклічну групу з шістьма атомами вуглецю (феніл) або біциклічну групу з дев'ятьма або десятьма атомами вуглецю (два шестичленні кільця або одне шестичленне кільце з п’ятичленним кільцем), де друге кільце також може бути ароматичним або, в той же час, також може бути насиченим або частково насиченим. Якщо арил підлягає заміщенню, то такі заміщення можуть здійснюватися незалежно один від одного, у формі моно- або полізамещення в кожному випадку, на всіх атомах вуглецю, що несуть водні. Арил сам може бути зв'язаний як замісник з молекулою за допомогою кожного придатного положення кільцевої системи. Прикладами арилу є феніл, нафтил, інданіл (2,3-дигідроінденіл), інденіл, антраценіл, фенантреніл, тетрагідронафтил (1,2,3,4-тетрагідронафтил, тетралініл), дигідронафтил (1,2дигідронафтил), флуореніл та ін. Наведене вище визначення арилу також використовується, коли арилом є частина іншої групи, такої як, наприклад, в ариламіно або арилокси. Якщо вільна валентність арилу є насиченою, то згодом отримують ароматичну групу. Термін арилен також може бути похідним раніше визначеного арилу. Арилен, на відміну від арилу, є двовалентним і для нього необхідно два партнери для зв'язування. Формально, друга валентність утворюється шляхом видалення атома водню з арилу. Відповідними групами є, наприклад, феніл і , або , або 7 (о, м, п-фенілен), UA 114739 C2 нафтил і 5 10 15 20 25 30 35 40 , або , або та ін. Наведене вище визначення для арилену також використовується, коли арилен є частиною іншої групи, такої як, наприклад, у HO-ариленаміно або H2N-ариленокси. Гетероцикліл означає кільцеві системи, які є похідні раніше визначених циклоалкілу, циклоалкенілу і арилу шляхом заміни однієї або декількох груп -CH2- незалежно одна від одної у вуглеводневих кільцях на групи -O-, -S- або -NH- або шляхом заміни однієї або декількох груп =CH- на групу =N-, де в цілому може бути присутніми не більше п'яти гетероатомів, щонайменше один атом вуглецю може знаходитися між двома атомами кисню і між двома атомами сірки або між одним киснем і одним атомом сірки і кільце як єдине ціле повинне мати хімічну стабільність. Гетероатоми необов'язково можуть знаходитися у всіх можливих станах окислення (сірка сульфоксид -SO, сульфон -SO2-; азот N-оксид). Безпосередній результат дериватизації з циклоалкілу, циклоалкенілу і арилу полягає в тому, що гетероцикліл складається з підгруп моноциклічних гетерокілець, біциклічних гетерокілець, трициклічних гетерокілець і спіро-гетерокілець, які можуть бути представлені в насиченій або ненасиченій формі. Насичений і ненасичений, неароматичний, гетероцикліл також визначається як гетероциклоалкіл. Під ненасиченим мають на увазі, що існує щонайменше один подвійний зв'язок у даному кільці, але не утворюється гетероароматична системи. У біциклічних гетерокільцях два кільця зв'язано разом таким чином, що вони мають щонайменше два спільні (гетеро)атоми. У спіро-гетероциклах атом вуглецю (спіроатом) належить двом кільцям одночасно. Якщо гетероцикліл заміщений, то такі заміщення можуть здійснюватися незалежно один від одного, у формі моно- або полізамещення в кожному випадку, на всіх атомах вуглецю і/або азоту, що несуть водень. Гетероцикліл сам може бути зв'язаний як замісник з молекулою за допомогою кожного придатного положення кільцевої системи. Якщо гетероцикліл має атом азоту, то переважним положенням для зв'язування гетероциклільного замісника з молекулою єатом азоту. Прикладами гетероциклілу є тетрагідрофурил, піролідиніл, піролініл, імідазолідиніл, тіазолідиніл, імідазолініл, піразолідиніл, піразолініл, піперидиніл, піперазиніл, оксираніл, азиридиніл, азетидиніл, 1,4-діоксаніл, азепаніл, діазепаніл, морфолініл, тіоморфолініл, гомоморфолініл, гомопіперидиніл, гомопіперазиніл, гомотіоморфолініл, тіоморфолініл-S-оксид, тіоморфолініл-S,S-діоксид, 1,3-діоксоланіл, тетрагідропіраніл, тетрагідротіопіраніл, [1,4]оксазепаніл, тетрагідротієніл, гомотіоморфолініл-S,S-діоксид, оксазолідиноніл, дигідропіразоліл, дигідропіроліл, дигідропіразиніл, дигідропіридил, дигідро-піримідиніл, дигідрофурил, дигідропіраніл, тетрагідротієніл-S-оксид, тетрагідротієніл-S,S-діоксид, гомотіоморфолініл-Sоксид, 2,3-дигідроазет, 2H-піроліл, 4H-піраніл, 1,4-дигідропіридиніл, 8-азабіцикло[3,2,1]октил, 8азабіцикло[5,1,0]октил, 2-окса-5-азабіцикло[2,2,1]гептил, 8-окса-3-азабіцикло[3,2,1]октил, 3,8діаза-біцикло[3,2,1]октил, 2,5-діаза-біцикло-[2,2,1]гептил, 1-аза-біцикло[2,2,2]октил, 3,8діаза-біцикло[3,2,1]октил, 3,9-діаза-біцикло[4,2,1]ноніл, 2,6-діаза-біцикло[3,2,2]ноніл, 1,4-діоксаспіро[4,5]децил, 1-окса-3,8-діаза-спіро[4,5]децил, 2,6-діаза-спіро[3,3]гептил, 2,7-діазаспіро[4,4]ноніл, 2,6-діаза-спіро[3,4]октил, 3,9-діаза-спіро[5,5]ундецил, 2,8-діаза-спіро[4,5]децил та ін. Додатковими прикладами є структури, проілюстровані нижче, які можуть бути приєднані за допомогою кожного атома, що несе водень (замінюючи на водень): O O S S O H N S O S O 8 S O S O O H N H N H N N H NH UA 114739 C2 O H N H N H N N H O S O O S O O S S S S O O O S S O H N O H N S O O H N O S H N O H N O H N S N H O O O S O O O S O O H N S O O S O O O O S S S S O S O O O H N S O O O S O O S O S S O S O S O O S S N H N H O O S S O O H N O S O S O O O S O O O N H N N S H N NH S S O O S O S N N N H O N H O NH N 9 N H O O S S O H N N O S O H N N H N H N UA 114739 C2 O N N H N N N S N H S H N S N N S O S H N O O O O H N S H N N O O S O O H N O O O O N H N N S O O S O O O S S O O S O H N N H N H N NH H N H N N H H N H N N H N H H N N H O N H O N H N H N H N H N O N N H N H H N H N N H O O S O O S O O O O 10 N H NH S S UA 114739 C2 S S O O O S O O S O S H N S O O S H N S O N H H N O S H N S O O H N O O S O NH N H O O O O S O O S H N S O O N H O O O O S O O S H N S S O O S H N H N S S O O H N O S O O O O S S S O 5 S O S S O O O Наведене вище визначення гетероциклілу також застосовується, якщо гетероцикліл є частиною іншої групи, такої як, наприклад, у гетероцикліламіно або гетероциклілокси. Якщо вільна валентність гетероциклілу є насиченою, то згодом отримують гетероциклічну групу. Термін гетероциклілен також є похідним з раніше визначеного гетероциклілу. Гетероциклілен, на відміну від гетероциклілу, є двовалентним і для нього необхідно два партнери для зв'язування. Формально, другу валентність отримують шляхом видалення атома водню з гетероциклілу. Відповідними групами є, наприклад, піперидиніл і NH 10 або NH , або , 11 N , UA 114739 C2 2,3-дигідро-1H-піроліл і N H , або N , або , або та N H N H ін. 5 10 15 20 25 Наведене вище визначення гетероциклілену також застосовується, якщо гетероциклілен є частиною іншої групи, такої як, наприклад, у HO-гетероцикліленаміно або H2Nгетероцикліленокси. Гетероарил означає моноциклічні гетероароматичні кільця або поліциклічні кільця з щонайменше одним гетероароматичним кільцем, яке, у порівнянні з відповідним арилом або циклоалкілом (циклоалкенілом), містить, замість одного або декількох атомів вуглецю, один або декілька ідентичних або різних гетероатомів, вибраних незалежно один від одного з азоту, сірки і кисню, де отримана група має бути хімічно стабільною. Попередньою умовою для присутності гетероарилу є гетероатом і гетероароматична система. Якщо гетероарил підлягає заміщенню, то такі заміщення можуть здійснюватися незалежно один від одного, у формі моно- або полізамещення в кожному випадку, на всіх атомах вуглецю і/або азоту, що несуть водень. Гетероарил сам може бути зв'язаний як замісник з молекулою за допомогою кожного придатного положення кільцевої системи, як вуглецю, так і азоту. Прикладами гетероарилу є фурил, тієніл, піролил, оксазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, піразоліл, імідазоліл, триазоліл, тетразоліл, оксадіазоліл, тіадіaзоліл, піридил, піримідил, піридазиніл, піразиніл, триазиніл, піридил-N-оксид, піроліл-N-оксид, піримідиніл-Nоксид, пиридазиніл-N-оксид, піразиніл-N-оксид, імідазолил-N-оксид, ізоксазоліл-N-оксид, оксазоліл-N-оксид, тіазолил-N-оксид, оксадіaзоліл-N-оксид, тіадіaзоліл-N-оксид, триaзоліл-Nоксид, тетрaзоліл-N-оксид, індоліл, ізоіндоліл, бензoфурил, бензoтієніл, бензоксазоліл, бензoтіазоліл, бензізоксазоліл, бензізотіазоліл, бензімідазоліл, індазоліл, ізохінолініл, хінолініл, хіноксалініл, цинолініл, фталазиніл, хіназолініл, бензoтриазиніл, індолизиніл, оксазолопіридил, імідазопіридил, нафтиридиніл, бензоксазоліл, піридопіридил, пуриніл, птеридиніл, бензoтіазоліл, імідазопіридил, імідазотіазоліл, хінoлініл-N-оксид, індоліл-N-оксид, ізохіноліл-Nоксид, хіназолініл-N-оксид, хіноксалініл-N-оксид, фталазиніл-N-оксид, індолізиніл-N-оксид, індазоліл-N-оксид, бензoтіазоліл-N-оксид, бензімідазоліл-N-оксид та ін. Додатковими прикладами є структури, проілюстровані нижче, які можуть бути приєднані за допомогою кожного атома, що несе водень (обмінюючи на водень): 30 H N O S S O O S O S H N N O N N O N S H N N N S S N N N H N N H N N H N N N N N N N S N N S S N N N N N O + N N S N N N N S O N N O N N N S O O N N N H S 12 O N N N N N N O N N H N O O H N N O O N N N N UA 114739 C2 N N N N S O N H S N N N N N N H N N H N N N H N N H N H N N N N N H N N N N NH N H N N N N N N N N HN N N H N HN N N N N HN H N N HN N N H S N Наведене вище визначення гетероарилу також використовується, коли гетероарил є частиною іншої групи, такої як, наприклад, у гетероариламіно або гетероарилокси. Якщо вільна валентність гетероарилу є насиченою, то отримують гетероароматичну групу. Отже, термін гетероарилен може бути похідним від раніше визначеного гетероарилу. Гетероарілен, на відміну від гетероарилу, є двовалентним і для нього необхідно двох партнерів для зв'язування. Формально, другу валентність отримують шляхом видалення атома водню з гетероарилу. Відповідними групи є, наприклад, піроліл і , або N H 10 15 20 N N H N N N N N N N N 5 N N N H N H , або N H , або та ін. N N H Наведене вище визначення гетероарилену також використовується, коли гетероарилен є частиною іншої групи, такої як, наприклад, у HO-гетероариленаміно або H2N-гетероариленокси. Двовалентні групи, вказані вище (алкілен, алкенілен, алкінілен та ін.), також можуть бути частиною складних груп (наприклад, H2N-C1-4алкілен- або HO-C1-4алкілен-). У цьому випадку одна з валентностей є насиченою за допомогою приєднаної групи (в даному випадку: -NH2, -OH) таким чином, що складною групою цього типу, описаною таким чином, є тільки моновалентний замісник повністю. Під заміщеним мають на увазі, що атом водню, який зв'язаний безпосередньо з даним атомом, замінений іншим атомом або іншою групою атомів (замісником). Залежно від початкових умов (кількість атомів водню) на одному атомі може мати місце моно- або полізаміщення. Заміщення конкретним замісником можливо тільки в тому випадку, якщо допустимі валентності замісника і атома, який підлягає заміщенню, відповідають один одному і заміщення приводить до стабільної сполуки (тобто до сполуки, яка самовільно не перетворюється, наприклад, шляхом перегрупування, циклізації або елімінації). 13 UA 114739 C2 5 10 15 20 25 30 35 40 45 50 Двовалентні замісники, такі як =S, =NR, =NOR, =NNRR, =NN(R)C(O)NRR=N 2 або інші, можуть бути замісниками тільки на атомах вуглецю, де двовалентний замісник =O також може бути замісником на сірці. В цілому, заміщення може здійснюватися за допомогою двовалентного замісника тільки на кільцевих системах і для цього потрібне витіснення двох гемінальних атомів водню, тобто атомів водню, які зв'язані з одним і тим же атомом вуглецю, який насичений перед заміщенням. Отже, заміщення за допомогою двовалентного замісника можливо тільки на групі CH2- або атомах сірки кільцевої системи. Стереoхімія/сольвати/гідрати. Якщо не вказано інше, структурна формула, представлена в описі або у формулі винаходу або хімічна назва відноситься до відповідної хімічної сполуки як такої, але також охоплює таутомери, стереоізомери, оптичні і геометричні ізомери (наприклад, енантіомери, діастереoмери, E/Z ізомери та ін.), рацемати, суміші окремих енантіомерів у будьякій бажаній комбінації, суміші діастереoмерів, суміші форм, вказаних у даному документі нижче (якщо такі форми існують), а також солям, особливо їхнім фармацевтично прийнятних солям. Сполуки і солі згідно з винаходом можуть бути присутніми в сольватованій формі (наприклад, з фармацевтично прийнятними розчинниками, такими як, наприклад, вода, етанол та ін.) або в несольватованій формі. В цілому, для цілей даної заявки сольватовані форми, наприклад, гідрати, розглядаються нарівні з несольватованими формами. Солі. Термін "фармацевтично прийнятний" використовується в даному документі для позначення сполук, матеріалів, композицій і/або препаратів, які придатні, згідно з загальноприйнятою встановленою медичною думкою, для застосування відносно тканини людини і/або тварини і не мають або не викликають якої-небудь надмірної токсичності, роздратування або імунної відповіді або приводять до інших проблем або ускладнень, тобто відповідають, у цілому, прийнятному співвідношенню користь/ризик. Термін "фармацевтично прийнятні солі" відноситься до похідних розкритих хімічних сполук, в яких початкова сполука модифікована шляхом додавання кислоти або основи. Приклади фармацевтично прийнятних солей включають (але не обмежуючись тільки ними) солі мінеральних або органічних кислот по відношенню до основних функціональних груп, таких як, наприклад, аміни, солі лужних металів або органічні солі кислотних функціональних груп, таких як, наприклад, карбонові кислоти та ін. Ці солі включають, зокрема, етаноат, аскорбат, бензенсульфонат, бензоат, безилат, бікарбонат, бітартрат, бромід/гідробромід, Ca-едетат/едетат, камсилат, карбонат, хлорид/гідрохлорид, цитрат, едисилат, етандисульфонат, естолат, есилат, фумарат, глюцептат, глюконат, глутамат, гліколят, гліколіларснілат, гексилрезорцинат, гідрабамін, гідроксималеат, гідроксинафтоат, йодид, ізотіонат, лактат, лактобіонат, малат, малеат, манделат, метансульфонат, мезилат, метилбромід, метилнітрат, метилсульфат, мукат, напсилат, нітрат, оксалат, памоат, пантотенат, фенілетаноат, фосфат/дифосфат, полігалактуронат, пропаноат, саліцилат, стеарат, субетаноат, сукцинат, сульфамід, сульфат, танат, тартрат, теоклат, толуенсульфонат, триетіодид, амоній, бензaтин, хлорпрокаїн, холін, діетаноламін, етилендіамін, меглумін і прокаїн. Інші фармацевтично прийнятні солі можуть утворюватися з катіонами металів, такими як алюміній, кальцій, літій, магній, калій, натрій, цинк та ін. (див. також Pharmaceutical salts, Birge, S.M. et al., J. Pharm. Sci., (1977), 66, 1-19). Фармацевтично прийнятні солі згідно з даним винаходом можуть бути отримані, починаючи з вихідної сполуки, яка несе основну або кислотну функціональну групу, за допомогою загальноприйнятих хімічних методів. У цілому, ці солі можуть бути синтезовані шляхом приведення в контакт форми вільної кислоти або основи цих сполук з достатньою кількістю відповідної основи або кислоти у воді або органічному розчиннику, такому як, наприклад, ефір, етилетаноат, етанол, ізопропанол, ацетонітрил (або їхні суміші). Солі кислот, що відрізняються від вказаних вище, які є придатними, наприклад, для очищення або виділення сполук з реакційної суміші (наприклад, трифлуорацетати), також складають частину винаходу. У зображенні, такому як, наприклад X X 55 2 3 A 1 X , або A N , або A , літера A має функцію позначення кільця для полегшення, наприклад, вказівки приєднання даного кільця до інших кілець. Для двовалентних груп, в яких надзвичайно важливо визначити, які суміжні групи вони зв'язують і з якою валентністю, відповідні зв'язуючі партнери вказані в дужках, при необхідності 14 UA 114739 C2 для пояснення, як у подальших зображеннях: (R1) (A) 5 10 N N N 2 2 , або (R )-C(O)NH-, або (R )-NHC(O) -; Групи або замісники часто вибирають з числа альтернативних груп /замісників з відповідним a b позначенням групи (наприклад, R , R і ін). Якщо така група використовується неодноразово для визначення сполуки згідно з винаходом у різних частинах молекул, то завжди необхідно пам'ятати, що різні використання розглядаються як повністю незалежні одне від одного. Під терапевтично ефективною кількістю для цілей даного винаходу розуміють кількість речовини, яка здатна усувати симптоми захворювання або запобігати або полегшувати ці симптоми, або що продовжує виживання пацієнта, що лікується. Перелік скорочень ACN, CH3CN Boc ДХМ DIPEA DMAP ДМФА ДМСО EDTA EtOAc або EA FCS г HATU ВЕРХ KOAc LIHMDS M хв. мл МС н ЯМР PE PPh3 DIBAL ОФ об/хв. КТ або кт STAB TBME TEA трет ТФО ТГФ tУ TRIS мас.% нас. Ar ацетонітрил трет-бутоксикарбоніл дихлорметан діізопропілетиламін диметил-піридин-4-іл-амін N,N-диметилформамід диметилсульфоксид етилендіамінтетраоцтова кислота етилетаноат фетальна теляча сироватка година(и) N-[(диметиламіно)-(1H-1,2,3-триазоло[4,5-b]піридин-1-іл)-метилен]-Nметилметан-аміний гексафлуорфосфат N-оксид високоефективна рідинна хроматографія етаноат калію гексаметилдисилазид літію молярний хвилина(и) мілілітр мас-спектрометрія нормальний Спектроскопія ядерного магнітного резонансу петролейний ефір трифенілфосфін діізобутилалюміній гідрид обернена фаза обертів на хвилину кімнатна температура триацетоксиборгідрид натрію трет-бутилметиловий етер триетиламін третинний трифлуороцтова кислота тетрагідрофуран час утримування [хв.] тріс(гідроксиметил)амінометан масовий відсоток насичений ароматичний Інші характерні особливості і переваги даного винаходу будуть зрозумілими з подальших 15 UA 114739 C2 5 10 15 20 25 докладніших Прикладів, в яких для прикладу ілюструються принципи винаходу без обмеження його об'єму. Загальне Якщо не вказано інше, то всі реакції здійснюють у комерційно доступному приладі, використовуючи методи, які зазвичай використовуються в хімічних лабораторіях. Вихідні матеріали, які чутливі до повітря і/або вологи, зберігають під захисним газом і відповідні реакції і маніпуляції з ними здійснюють під захисним газом (азотом або аргоном). Сполуки називають згідно з правилами Бельштейна, використовуючи програмне забезпечення Autonom (Beilstein). Якщо сполука представлена за допомогою структурної формули, так і її номенклатури, то у разі конфлікту вирішальною є структурна формула. Хроматографія Тонкошарову хроматографію здійснювали на готових ТСХ-пластинах силікагелю 60 на склі (з індикатором флуоресценції F-254), отриманих від Merck. Препаративну високоефективну рідинну хроматографію (ВЕРХ) сполук прикладів згідно з винаходом здійснювали на колонках, виготовлених Waters (назви: Sunfire C18 OBD, 10 мкм, 30 x 100 мм № за каталогом 186003971; X-Bridge C18 OBD, 10 мкм, 30 x 100 мм № за каталогом 186003930). Сполуки елюювали, використовуючи різні градієнти H2O/ACN, де 0,2 % HCOOH додавали до води (кислотні умови). Для хроматографії в лужних умовах, воду підлуговували згідно з такою рецептурою: 5 мл розчину гідрокарбонату амонію (158 грам до 1 л H2O) і 2 мл 32 % аміаку (водн) доводили до 1 л за допомогою H2O. Аналітичні ВЕРХ (моніторинг за протіканням реакції) проміжних сполук здійснювали на колонках, виготовлених Waters і Phenomenex. Аналітична апаратура в кожному випадку також була забезпечена масс-детектором. ВЕРХ мас-спектроскопія /УФ спектроскопія + Час утримування /МС-ESI для характеристики сполук з прикладів згідно з винаходом отримували, використовуючи прилад ВЕРХ-МС (високоефективна рідинна хроматографія з масс-детектором), виготовлений Agilent. Сполуки, які елюювалися на ін'єкційному піку, давали час утримування tУт. = 0. Методи препаративної ВЕРХ преп. ВЕРХ1 ВЕРХ: Колонка: Розчинник: Виявлення: Потік: Градієнт: преп. ВЕРХ2 ВЕРХ: Колонка: Розчинник: Виявлення: Потік: Градієнт: 333 і 334 Pumps Waters X-Bridge C18 OBD, 10 мкм, 30 x 100 мм № за каталогом 186003930 A: 10 мМ NH4HCO3 в H2O; B: Ацетонітрил (якість ВЕРХ) УФ/від-155 50 мл/хв 0,00 - 1,50 хв.: 1,5 % B 1,50 - 7,50 хв.: змінний 7,50 - 9,00 хв.: 100 % B 333 і 334 Pumps Waters Sunfire C18 OBD, 10 мкм, 30 x 100 мм № за каталогом 186003971 A: H2O + 0,2 % HCOOH; B: Ацетонітрил (якість ВЕРХ) + 0,2 % HCOOH УФ/від-155 50 мл/хв 0,00 - 1,50 хв.: 1,5 % B 1,50 - 7,50 хв.: змінний 7,50 - 9,00 хв.: 100 % B 30 16 UA 114739 C2 Методи аналітичної ВЕРХ LCMSBAS1 ВЕРХ: МС: Колонка: Agilent 1100 Series Agilent LC/MSD SL Phenomenex Mercury Gemini C18, 3 мкм, 2 x 20 мм № за каталогом 00M-4439-B0-CE Розчинник: A: 5 мМ NH4HCO3/20 мМ NH3 в H2O; B: Ацетонітрил (якість ВЕРХ) Виявлення: МС: Позитивний і негативний режим Діапазон масових чисел: 120 - 900 m/z Потік: 1,00 мл/хв Температура колонки: 40 °C Градієнт: 0,00 - 2,50 хв.: 5 % 95 % B 2,50 - 2,80 хв.: 95 % B 2,81 - 3,10 хв.: 95 % 5 % B FECB5 ВЕРХ: МС: Колонка: Розчинник: Виявлення: Діапазон масових чисел: Потік: Температура колонки: Градієнт: FECBM3ESI ВЕРХ: МС: Колонка: Розчинник: Виявлення: Діапазон масових чисел: Потік: Температура колонки: Градієнт: VAB ВЕРХ: МС: Колонка: Розчинник: Виявлення: Діапазон масових чисел: Потік: Температура колонки: Градієнт: Agilent 1100/1200 Series Agilent LC/MSD SL Waters X-Bridge C18 OBD, 5 мкм, 2,1 x 50 мм A: 5 мМ NH4HCO3/19 мМ NH3 в H2O; B: Ацетонітрил (якість ВЕРХ) МС: Позитивний і негативний режим 105 - 1200 m/z 1,20 мл/хв 35 °C 0,00 - 1,25 хв.: 5 % 95 % B 1,25 - 2,00 хв.: 95 % B 2,00 - 2,01 хв.: 95 % 5 % B Agilent 1100/1200 Series Agilent LC/MSD SL Waters X-Bridge C18 OBD, 5 мкм, 2,1 x 50 мм A: 5 мМ NH4HCO3/19 мМ NH3 в H2O; B: Ацетонітрил (якість ВЕРХ) МС: Багаторежимна ESI Позитивний і негативний режим 105 - 1200 m/z 1,20 мл/хв 35 °C 0,00 - 1,25 хв.: 5 % 100 % B 1,25 - 2,00 хв.: 100 % B 2,00 - 2,01 хв.: 100 % 5 % B Agilent 1100/1200 Series Agilent LC/MSD SL Waters X-Bridge BEH C18, 2,5 мкм, 2,1 x 30 мм XP A: 5 мМ NH4HCO3/19 мМ NH3 в H2O; B: Ацетонітрил (якість ВЕРХ) МС: Позитивний і негативний режим 100 - 1200 m/z 1,40 мл/хв 45 °C 0,00 - 1,00 хв.: 5 % 100 % B 1,00 - 1,37 хв.: 100 % B 1,37 - 1,40 хв.: 100 % 5 % B FA-8 ВЕРХ-МС: Колонка: Розчинник: Waters - Alliance 2996 Symmetryshield C18, 5 мкм, 4,6 x 250 мм A: H2O + 0,1% ТФО; B: Ацетонітрил (якість ВЕРХ) Виявлення: МС: Позитивний і негативний режим Діапазон масових чисел: 100 - 1200 m/z 17 UA 114739 C2 Потік: Температура колонки: Градієнт: 1,00 мл/хв 25 °C 2,00 - 8,00 хв.: 20 % 80 % B 8,00 - 19,00 хв.: 80 % B 19,00 - 20,00 хв.: 80% 20 % B FSUN2 ВЕРХ: МС: Колонка: Розчинник: Виявлення: Діапазон масових чисел: Потік: Температура колонки: Градієнт: 5 10 Agilent 1100/1200 Series Agilent LC/MSD SL Waters Sunfire C18, 5 мкм, 2,1 x 50 мм A: H2O + 0,2% мурашина кислота; B: Ацетонітрил (якість ВЕРХ) МС: Позитивний і негативний режим 105 - 1200 m/z 1,20 мл/хв 35 °C 0,0 хв.: 5 % B 0,0 - 1,50 хв.: 5 % 95 % B 1,50 - 2,00 хв.: 95 % B 2,00 - 2,01 хв.: 95 % 5 % B Одержання сполук згідно з винаходом Сполуки згідно з винаходом отримують за допомогою методів синтезу, описаних у даному документі нижче, в яких замісники загальної формули мають значення, вказані в даному документі вище. Ці методи представлені як ілюстрація винаходу, без обмеження його об'єктів і об'єму заявлених сполук цими прикладами. Якщо одержання вихідних сполук не описане, то вони є комерційно доступними або можуть бути отримані аналогічно відомим сполукам або методами описаними в даному документі. Речовини, описані в літературі, одержують згідно з опублікованими методами синтезу. Якщо не вказано інше, замісники R1-R3 подальших схем реакцій мають значення, вказані в описі і в формулі винаходу. Синтез ключового проміжного сполуки J з вихідної сполуки A проілюстрований на схемі 1. Схема 1 O O F H2N NH2 N N N Cl A H N N B Cl O F F HN Cl O F F F F N D NH F F N NH2 Cl C E O O N Br N Br N J N N Cl O F O O NH2 O N I Br Cl N NH N HN H Br NH F F N F Cl G 15 20 Використовуючи як вихідний матеріал A, реакцію нуклеофільного ароматичного заміщення можна використовувати для введення гідразину B, що приводить до C. Сполуку G можна синтезувати, використовуючи реакцію амідування з D з подальшим бромуванням F. Після відщеплення аміду і замикання кільця за допомогою похідного ортоестеру I може бути отримана ключова проміжна сполука J. Синтез сполук формули I - III з ключової проміжної сполуки J проілюстрований на схемі 2. 18 UA 114739 C2 Схема 2 NH2 R1 R1 N N N Br N N Cl N N J N N Br H N R1 R2 Ar N N HO O K N R1 R3' N R2 N N M Ar OH R3 R2 N R3' (III) B L N N Q OH R1 N R1 N N N H R3 N R2 O N N N R2 N N (I) OH O H2N R3''' O R3'' R3' P R1 N N N N R3''' N R2 N R3'' R3' (II) 5 10 15 Залишок R2 може бути введений за допомогою реакції нуклеофільного ароматичного заміщення, використовуючи відповідний амін, спирт, тіол або вуглецевмісний нуклеофіл (наприклад, діетилмалонат), з одержанням проміжної сполуки K. Кінцеві сполуки I синтезували, використовуючи як вихідну проміжну сполуку K і застосовуючи реакцію Сузукі з боровими кислотами L. Проміжну сполуку M, яку синтезували з K, використовуючи реакцію карбонілювания, що каталізується паладієм, є ключовою проміжною сполукою для кінцевих сполук II і III. Проміжну сполуку M конденсували з ароматичними/гетероароматичними діамінами Q, отримуючи кінцеві сполуки III. Відновлення кислоти M і повторне окислення відповідного спирту приводить до проміжної сполуки N, яку конденсували з оксимом O і аміном P, отримуючи кінцеві сполуки II. Одержання проміжної сполуки J-1 6-Бром-8-хлор-3-метил-[1,2,4]триазоло[4,3-a]піразин J-1 N Br N N N Cl Схема реакції: 19 UA 114739 C2 O H2N N NH2 F (выход: (вихід: 75%)75 %) Cl O F O B-1 EtOH, 25 °C Cl N O F A-1 N H N N Cl NH2 F F F D-1 F HN N NH F F N Cl ТГФ; 0 °C (вихід: 100%) 100 %) (выход: C-1 E-1 O (вихід: 13%) 13 %) (выход: N O Br F-1 ДХM; -40 °C O O N N N Br O I-1 130 °C (вихід: 28%) 28 %) (выход: Cl Br N NH2 O J-1 HCl; EtOH 100 °C N NH N (вихід: 88%) 88 %) (выход: Cl Br H-1 HN N NH F F N F Cl G-1 2-хлор-3-гідразинілпіразин C-1 N H N N Cl NH2 5 10 2,3-Дихлорпіразин A-1 (15 г; 100,68 ммоль) і гідрат гідразину 65 % (15,509 мл; 201,37 ммоль) розчиняли в 45 мл етанолу і перемішували протягом 1 години при 80 °C. При охолодженні утворювався осад. Його суспендували з невеликою кількістю води і фільтрували. Промивали водою і після цього висушували, отримуючи продукт. Вихід: 93% (13,6 г; 94,07 ммоль) + ВЕРХ-МС: (M+H) = 145/147; tУт = 0,34 хв.; метод FECB5 N'-(3-хлорпіразин-2-іл)-2,2,2-трифлуорацетогідразид E-1 N H N N O Cl N H F F F 15 20 2-Хлор-3-гідразинілпіразин C-1 (15,6 г; 108 ммоль) суспендували в (300 мл) ТГФ і охолоджували на бані з льодом до -5 °C. Трифлуороцтовий ангідрид (17 мл; 118 ммоль) також розчиняли в 300 мл ТГФ і додавали краплями до першого розчину. Через 1 годину більшу частину ТГФ упарювали, після цього додавали невелику кількість води і суміш екстрагували ДХМ. Органічну фазу висушували над MgSO4 і упарювали досуха. Вихід: 100 % + ВЕРХ-МС: (M+H) = 241/243; tУт = 1,31 хв.; метод FSUN2 N'-(5-бром-3-хлорпіразин-2-іл)-2,2,2-трифлуорацетогідразид G-1 N 25 Br H N N Cl O N H F F F N'-(3-хлорпіразин-2-іл)-2,2,2-трифлуорацетогідразид E-1 (19,5 г; 81,1 ммоль) розчиняли в 300 мл безводного ДХМ і охолоджували до -40 °C. Після цього додавали NBS (18,8 г; 105 20 UA 114739 C2 5 ммоль) і перемішували протягом 1 години. Розчин розводили водою і екстрагували ДХМ. Потім органічну фазу очищали за допомогою флеш-хроматографії: cHex/(EtOAc/CH3COOH= 9/1)= 80% / 20% до 70% / 30% з 10 об'ємами колонки. Вихід: 11% (2,83 г; 8,859 ммоль) ВЕРХ-МС: (M-H) = 317/319/321; tУт = 1,79 хв.; спосіб FSUN2 5-бром-3-хлор-2-гідразинілпіразин H-1 N Br 10 15 H N N Cl NH2 N'-(5-бром-3-хлорпіразин-2-іл)-2,2,2-трифлуорацетогідразид G-1 (1,59 г; 4,97 ммоль) розчиняли в 30 мл EtOH і обробляли 3 мл конц. HCl. Суміш перемішували протягом 2 годин при 100 °C. Реакційну суміш охолоджували, розводили водою і потім рН доводили до 8 за допомогою насиченого розчину NaHCO3. Водну фазу екстрагували EtOAc, органічний шар висушували над MgSO4 і упарювали досуха. Вихід: 71 % (945 мг; 3,51 ммоль) ВЕРХ-МС: (M-H) = 221/223/225; tУт = 1,32 хв.; спосіб FECB5 6-бром-8-хлор-3-метил-[1,2,4]триазоло[4,3-a]піразин J-1 N N N Br 20 25 Cl N 5-бром-3-хлор-2-гідразинілпіразин H-1 (945 мг; 3,51 ммоль) розчиняли в 12 мл триметилортоетаноату і нагрівали до 130 °C протягом 1 години. Розчин розводили водою і екстрагували EtOAc. Потім органічну фазу очищали за допомогою флеш-хроматографії: cHex/EtOAc = 70% / 30% до 55% / 45% з 10 об'ємами колонки. Вихід: 71% (824 мг; 3,33 ммоль) + ВЕРХ-МС: (M+H) = 247/249/251; tУт = 1,23 хв.; спосіб FECB5 Одержання проміжної сполуки K-1 трет-бутил 4-({6-бром-3-метил-[1,2,4]триазоло[4,3-a]піразин-8-іл}аміно)піперидин-1карбоксилат N Br N N NH N N O 30 35 O 6-бром-8-хлор-3-метил-[1,2,4]триазоло[4,3-a]піразин J-1 (3,24 г; 13,1 ммоль), 4-аміно-1-bocпіперидин (5,24 г; 26,2 ммоль) і основу Хюніга (2,44 мл; 14,4 ммоль) розчиняли в 30 мл ТГФ і перемішували протягом 16 годин при 25 °C. Реакційну суміш розводили водою і екстрагували EtOAc. Органічний шар відокремлювали і висушували над MgSO4 і упарювали досуха. Вихід: 98 % (6,60 г; 12,8 ммоль) + ВЕРХ-МС: (M+H) = 411/413; tУт = 0,88 хв.; спосіб VAB Одержання проміжної сполуки K-3 6-бром-3,8-диметил-[1,2,4]триазоло[4,3-a]піразин K-3 21 UA 114739 C2 N 5 10 15 N N N Br Карбонат цезію (7,25 г; 22,3 ммоль) суспендували в 5 мл NMP. До цієї суспензії додавали ди-трет-бутилмалонат (4,80 г; 22,3 ммоль) і отриману суміш перемішували протягом 30 хвилин при 25 °C. На завершення додавали 6-бром-8-хлор-3-метил-[1,2,4]триазоло[4,3-a]піразин J-1 (1,00 г; 4,04 ммоль) і реакційну суміш перемішували протягом 18 годин при 25 °C. Реакційну суміш обробляли за допомогою водної 1 н HCl, до тих пір, доки значення pH було нижче 5, і після цього екстрагували ДХМ. Органічний шар відокремлювали і висушували над MgSO4 і упарювали досуха. Неочищену проміжну сполуку очищали, використовуючи хроматографію з оберненою фазою (метод преп. ВЕРХ2). Проміжну сполуку розчиняли в 5 мл ДХМ і 5 мл ТФО і перемішували протягом 16 години при 40 °C. Реакційну суміш упарювали і неочищений продукт очищали, використовуючи хроматографію з оберненою фазою (метод преп. ВЕРХ2). Вихід: 15 % (138 мг; 0,61 ммоль) + ВЕРХ-МС: (M+H) = 227/229; tУт = 0,47 хв.; спосіб VAB Згідно з процедурами K-1 і K-3 синтезували проміжні сполуки K-2. + МС (M+H) ; tУт. ВЕРХ [хв.] M+H=242/244; tУт.= 0,59 N K-2 Br K-3 N M+H=270/272; tУт.= 0,69 N N Br N N N N K-5 Br VAB NH N N N N NH N N K-6 Br VAB N N K-4 VAB NH N Br VAB M+H=256/258; tУт.= 0,64 N N VAB M+H=227/229; tУт.= 0,47 Структура ВЕРХ-спосіб M+H=298/300; № N NH O 22 UA 114739 C2 Одержання проміжної сполуки M-1 8-({1-[(трет-бутокси)карбоніл]піперидин-4-іл}аміно)-3-метил-[1,2,4]триазоло[4,3-a]піразин-6карбонова кислота M-1 N HO N N NH N O N O 5 10 15 O трет-бутил 4-({6-бром-3-метил-[1,2,4]триазоло[4,3-a]піразин-8-іл}аміно)піперидин-1карбоксилат K-1 (1,85 г; 3,59 ммоль), адукт дихлор[1,1’-біс(дифенілфосфіно)фероцен]паладію (II) і дихлорметану (310 мг, 0,38 ммоль) і триетиламін (910 мг; 8,99 ммоль) розчиняли в 10 мл метанолу і 10 мл NMP. Реакційну суміш перемішували протягом 3 годин при 70°C і тиску CO бар. Реакційну суміш розводили водою і екстрагували EtOAc. Органічний шар відокремлювали і висушували над MgSO4 і упарювали досуха. Неочищений продукт очищали, використовуючи спосіб преп. ВЕРХ1. Цю проміжну сполуку розчиняли в 20 мл ТГФ і обробляли 10 мл 1 н водного розчину LiOH. Через 1 г. реакційну суміш розводили водою і екстрагували ДХМ. Органічний шар відокремлювали і висушували над MgSO4 і упарювали досуха. Вихід: 72 % (976 мг; 2,59 ммоль) ВЕРХ-МС: (M-H) = 375; tУт = 0,88 хв.; спосіб FECB5 Згідно з процедурами M-1 синтезували проміжні сполуки M-2 і M-3. + № МС (M+H) ; tУт. ВЕРХ [хв.] N M-2 HO N VAB M+H=193; tУт.= 0,0 VAB M+H=222; tУт.= 0,0 VAB M+H=236; tУт.= 0,0 N N ВЕРХ-спосіб M+H=208; tУт.= 0,0 Структура VAB NH O N M-3 HO N N N O N M-4 HO N N N NH O N M-5 HO N N N NH O 23 UA 114739 C2 + № МС (M+H) ; tУт. ВЕРХ [хв.] N M-6 HO ВЕРХ-спосіб M+H=264; tУт.= 0,0 Структура VAB N N N NH O O Одержання проміжної сполуки L-1 (1-метил-5-фенокси-1H-піразол-4-іл)боронова кислота HO OH B O N N 5 Етиловий естер 1-метил-5-фенокси-1H-піразол-4-карбоновой кислоти O O O N N 10 Фенол (30,3 г; 322 ммоль) розчиняли в DMA і додавали порціями K 2CO3 (88,9 г; 643 ммоль). Суміш перемішували протягом 10 хвилин, потім по краплях до реакційної суміші додавали етиловий естер 5-бром-1-метил-1H-піразол-4-карбонової кислоти (50,0 г; 215 ммоль) і нагрівали до 140 °C протягом 16 годин. Додавали 10 % розчин лимонної кислоти і екстрагували ДХМ. Органічний шар промивали за допомогою бікарбонату натрію і сольового розчину, після цього висушували і очищали колонковою хроматографією. Вихід: 43 % (22,5 г; 91,37 ммоль) + ВЕРХ-МС: (M+H) = 247; tУт = 3,50 хв.; спосіб LCMS FA-8 15 1-Метил-5-фенокси-1H-піразол-4-карбонова кислота O OH N N 20 25 O Етиловий естер 1-метил-5-фенокси-1H-піразол-4-карбонової кислоти (22,6 г; 91,4 ммоль) розчиняли в ТГФ/MeOH (1/1) і додавали LiOH у воді (7,67 г; 183 ммоль). Через 16 годин за температури навколишнього середовища реакційну суміш промивали EtOAc. Водний шар підкисляли за допомогою 1 N HCl і екстрагували EtOAc. Органічний шар висушували і упарювали. Вихід: 80 % (16,0 г; 73,3 ммоль) + ВЕРХ-МС: (M+H) = 219; tУт = 2,88 хв.; спосіб LCMS FA-8 1-Метил-5-фенокси-1H-піразол-4-іламін 24 UA 114739 C2 NH2 O N N 5 10 15 До перемішуваної суміші 1-метил-5-фенокси-1H-піразол-4-карбонової кислоти (16,0 г; 73,3 ммоль), t-BuOH (51,2 г; 691 ммоль) в 1,4-діоксані в атмосфері аргону додавали DIPEA (37,4 г; 290 ммоль) і дифенілфосфорилазид (41,6 г; 151 ммоль). Через 10 хвилин за температури навколишнього середовища її нагрівали до 110 °C і перемішували протягом 3 годин. Розчинник упарювали і неочищену речовину очищали колонковою хроматографією. Цю сполуку розчиняли в ДХМ і обробляли 4 M HCl в 1,4-діоксані. Суміш перемішували протягом 2 днів за температури навколишнього середовища. Розчинник упарювали і залишок розчиняли у воді і промивали EtOAc. Водний шар підлуговували водним розчином NaHCO3 і екстрагували EtOAc. Органічний шар висушували і концентрували досуха. Вихід: 32 % (16,0 г; 73,3 ммоль) + ВЕРХ-МС: (M+H) = 190; tУт = 2,32 хв.; спосіб LCMS FA-8 4-Йод-1-метил-5-фенокси-1H-піразол I O N N 20 25 1-Метил-5-фенокси-1H-піразол-4-іламін (4,50 г; 23,8 ммоль) розчиняли в H 2SO4 і охолоджували до 0 °C. NaNO2 (1,64 г; 23,8 ммоль) розчиняли у воді і додавали до реакційної суміші. Суміш перемішували протягом 1 години при 0 °C, потім додавали KI (15,8 г; 95,1 ммоль), при цьому інтенсивно перемішували і нагрівали до температури навколишнього середовища протягом 30 хвилин. Суміш обробляли водою і нейтралізували за допомогою насиченого розчину NaHCO3. Водний шар екстрагували ДХМ, висушували і очищали колонковою хроматографією. Вихід: 38 % (2,70 г; 8,99 ммоль) + ВЕРХ-МС: (M+H) = 301; tУт = 3,74 хв.; спосіб LCMS FA-8 (1-метил-5-фенокси-1H-піразол-4-іл)боронова кислота HO B OH O N N 30 35 4-Йод-1-метил-5-фенокси-1H-піразол (862 мг; 2,75 ммоль) розчиняли в 15 мл додатково висушеного ТГФ і охолоджували до -78 °C. Після цього додавали n-BuLi (1,80 мл; 2,88 ммоль; 1,6 моль/л у гексані) і триізопропілборат (982,28 мг; 5,22 ммоль). Суміш перемішували протягом 1 години. Реакційну суміш гасили за допомогою 1 мл води і очищали шляхом хроматографії з оберненою фазою в лужних умовах. Вихід: 67 % (400 мг; 1,84 ммоль) + ВЕРХ-МС: (M+H) = 219; tУт = 1,34 хв.; спосіб FECB5 Одержання проміжної сполуки L-2 (5-Бензил-1-метил-1H-піразол-4-іл)боронова кислота 25 UA 114739 C2 OH B OH N N (4-Бром-2-метил-2H-піразол-3-іл)фенілметанол Br OH N N 5 10 4-Бром-2-метил-2H-піразол-3-карбальдегід (1,00 г; 5,29 ммоль) розчиняли в 5,0 мл безводного ТГФ і охолоджували до - 78 °C. Додавали хлорид фенілмагнію 2 моль/л (6,61 мл; 13,2 ммоль) і реакційну суміш перемішували протягом 1 години. Її нагрівали до 0 °C і гасили обережно водою, після цього екстрагували ДХМ. Органічні шари об'єднували, висушували над MgSO4 і очищали за допомогою хроматографії з оберненою фазою в лужних умовах. Вихід: 82 % (1,16 г; 4,35 ммоль) + ВЕРХ-МС: (M+H) = 267; tУт = 1,59 хв.; спосіб FECBM3ESI 5-Бензил-4-бром-1-метил-1H-піразол Br N N 15 20 (4-Бром-2-метил-2H-піразол-3-іл)-феніл-метанол (0,50 г; 1,87 ммоль) обробляли 3,0 мл ТФО і триетилсиланом (1,49 мл; 9,36 ммоль) і нагрівали до 50 °C протягом 16 годин. Продукт очищали за допомогою хроматографії з оберненою фазою в кислотних умовах. Вихід: 56 % (0,26 г; 1,06 ммоль) + ВЕРХ-МС: (M+H) = 251/253; tУт = 1,71 хв.; спосіб FECBM3ESI (5-Бензил-1-метил-1H-піразол-4-іл)боронова кислота OH B N N OH 25 30 5-Бензил-4-бром-1-метил-1H-піразол (0,27 г; 1,06 ммоль) розчиняли в 5,0 мл безводного ТГФ і охолоджували до - 78 °C. Після цього додавали триізопропілборат (0,46 мл; 2,01 ммоль) і n-BuLi; 1,6 моль/л у гексані; (0,69 мл; 1,11 ммоль). Суміш перемішували протягом 1 години, при цьому утворювався бажаний продукт. Його нагрівали до 25 °C і гасили водою. Суміш очищали за допомогою хроматографії з оберненою фазою, використовуючи лужні умови. Вихід: 39 % (0,08 г; 0,41 ммоль) + ВЕРХ-МС: (M+H) = 217; tУт = 1,41 хв.; спосіб FECBM3ESI 26 UA 114739 C2 Одержання проміжної сполуки L-5 (5-Бензил-1-метил-1H-піразол-4-іл)боронова кислота - L-5 OH N B N OH O 5 Схема реакції: N N N O O O O O L-5-2 L-5-1 L-5-3 OH N N N OH O O L-5-4 L-5 10 I N B Проміжну сполуку L-5-4 синтезували згідно із способами, описаними в Bioorganic & Med. Chem. Letters 18(2) 509-512 2008. Для синтезу боронової кислоти L-5 використовували способи, описані для L-1 і L-2. + ВЕРХ-МС: (M+H) = 233; tУт = 0,73 хв.; спосіб VAB Згідно із способами L-1 і L-2 синтезували проміжні сполуки L-3 і L-4. 15 27 UA 114739 C2 + № МС (M+H) ; tУт. ВЕРХ [хв.] ВЕРХ-спосіб M+H=217; tУт.= 0,60 VAB M+H=231; tУт.= 0,76 Структура VAB HO B OH L-3 N N HO B OH N N L-4 Загальний спосіб одержання сполук формули I 6-(3-Бензил-1-метил-1H-піразол-4-іл)-N,3-диметил-[1,2,4]триазоло[4,3-a]піразин-8-амін I-1 N N N N N NH N 5 10 15 Проміжну сполуку G-2 (32 мг; 0,13 ммоль), боронову кислоту L-3 (30 мг; 0,13 ммоль), 70 % розчин Cs2CO3 у воді (0,05 мл; 0,25 ммоль) і Pd[P(t-Bu)3]2 (5 мг; 0,01 ммоль) суспендували з ТГФ/NMP = 2/1 (0,3 мл) і продували аргоном. Суміш перемішували при 90 °C протягом 1 години. Неочищену реакційну суміш очищали за допомогою хроматографії з оберненою фазою в кислотних умовах (Спосіб: преп. ВЕРХ2). Вихід: 33 % (0,02 г; 0,04 ммоль) + ВЕРХ-МС: (M+H) = 417; tУт = 1,05 хв.; спосіб LCMSBAS1 Згідно з I-1 синтезували наступні приклади. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazolopyrazine
Автори англійськоюEngelhardt, Harald, Smethurst, Christian, Gianni, Davide
Автори російськоюЭнгельхардт Харальд, Сметерст Кристиан, Джанни Давидэ
МПК / Мітки
МПК: A61K 31/501, C07D 519/00, A61K 31/4985, A61K 31/519, C07D 487/04, A61K 31/5377
Мітки: триазолопіразини
Код посилання
<a href="https://ua.patents.su/70-114739-triazolopirazini.html" target="_blank" rel="follow" title="База патентів України">Триазолопіразини</a>
Попередній патент: Машина для розсівання сипких матеріалів з адаптаційним стабілізатором потоку
Наступний патент: Спосіб одержання дрібнодисперсного кристалічного льоду та установка для його здійснення
Випадковий патент: Спосіб профілактики карієсу постійних зубів у дітей