Композиція, що містить ліпосомний пухирець та введений у нього білковий медикамент, і спосіб її приготування
Формула / Реферат
1. Композиция, содержащая липосомный пузырек и введенный в него белковый медикамент, отличающаяся тем, что в качестве липосомного пузырька содержит отрицательно заряженный фосфолипид, а в качестве белкового медикамента - протеин, способный к переходу в распрямленное состояние глобулы, при соотношении липида к протеину не менее 10 : 1.
2. Композиция по п.1, отличающаяся тем, что она имеет pH 3,0 - 7,5.
3. Композиция по п.1, отличающаяся тем, что в качестве липосомного пузырька содержит фосфолипид, выбранный из группы, включающей: диолеилфосфатидилглицерол (DOPG), димиристоилфосфатидилглицерол (DMPG), дипальмитоилфосфатидилглицерол (DPPG), яичный фосфатидилглицерол, диолеилфосфатидилэтаноламин (DOPE), яичный фосфатидилэтаноламин, диолеилфосфатидовую кислоту (DOPA), димиристоилфосфатидовую кислоту (DMPA), дипальмитоилфосфатидовую кислоту (DРРА), диолеилфосфатидилсерин (DOPS), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), яичный фосфатидилсерин, лизофосфатидилглицерол, лизофосфатидилэтаноламин и лизофосфатидилсерин.
4. Композиция по п.1, содержащая в качестве названного протеина цитокин.
5. Композиция по п.4, содержащая цитокин, являющийся гематопоэтическим фактором.
6. Композиция по п.5, отличающаяся тем, что гематопоэтический фактор выбран из группы, включающей гранулоцит колониестимулирующий фактор (G-CSF) и гранулоцит макрофаг колониестимулирующий фактор (GM-CSF).
7. Композиция по п.5, отличающаяся тем, что гематопоэтическим фактором является G-CSF.
8. Композиция по п.7, отличaющаяся тем, что G-CSF является природным человеческим G-CSF или продуктом прокариотной или эукариотной экспрессии клетки-хозяина.
9. Композиция по п.7, отличaющаяся тем, что G-CSF является химически модицифированным.
10. Композиция по п.9, отличающаяся тем, что химическая модификация G-CSF проведена полиэтиленгликолем.
11. Композиция по п.1, отличающаяся тем, что она дополнительно содержит фармацевтически приемлемый носитель.
12. Композиция по п.1, отличающаяся тем, что она дополнительно содержит в качестве названного протеина рекомбинантный G-CSF (rhG-CSF), полученный с помощью E. coli, а в качестве липосомного пузырька - DOPG при соотношении DOPG и rhG-GSF, соответственно, 50 : 1 и дополнительно содержит 10мМ ацетата натрия, и имеет pH 4,5.
13. Способ приготовления композиции, содержащей липосомный пузырек с введенным в него белковым медикаментом, отличающийся тем, что в качестве липосомного пузырька используют отрицательно заряженный фосфолипид, а в качестве белкового медикамента в него вводят протеин, способный к переходу в распрямленное состояние глобулы.
14. Способ по п.13, отличающийся тем, что указанная композиция имеет pH 3,0 - 7,5 и отношение липида к протеину не менее 10 : 1.
15. Способ по п.13, отличающийся тем, что в качестве липосомного пузырька используют фосфолипид, выбранный из группы, включающей: диолеилфосфатидилглицерин (DOPG), димиристоилфосфатидилглицерол (DMPG), дипальмитоилфосфатидилглицерол (DPPG), яичный фосфатидилглицерол, диолеилфосфатидилэтаноламин (DOPE), яичный фосфатидилэтаноламин, диолеилфосфатидовую кислоту (DOPA), димиристоилфосфатидовую кислоту (DMPA), дипальмитоилфосфатидовую кислоту (DPPA), диолеилфосфатиделсирин (DOPS), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), яичный фосфатидилсерин, лизофосфатидилглицерон, лизофосфатидилэтаноламин и лизофосфатидилсерин.
16. Способ по п.13, отличающийся тем, что указанным протеином является цитокин.
17. Способ по п.16, отличающийся тем, что названный цитокин является гематопоэтическим фактором.
18. Способ по п.17, отличающийся тем, что названный гематопоэтический фактор выбран из группы, состоящей из G-CSF и GM-CSF.
19. Способ по п.18, отличающийся тем, что названным гемопоэтическим фактором является G-CSF.
20. Способ по п.19, отличающийся тем, что G-CSF является природным человеческим G-CSF или продуктом прокариотной или эукариотной экспрессии клетки-хозяина.
21. Способ по п.19, отличающийся тем, что G-CSF является химически модифицированным.
22. Способ по п.21, отличающийся тем, что химическая модификация G-CSF проведена полиэтиленгликолем.
23. Способ по п.13, отличающийся тем, что в композицию дополнительно вводят фармацевтически приемлемый носитель.
Текст
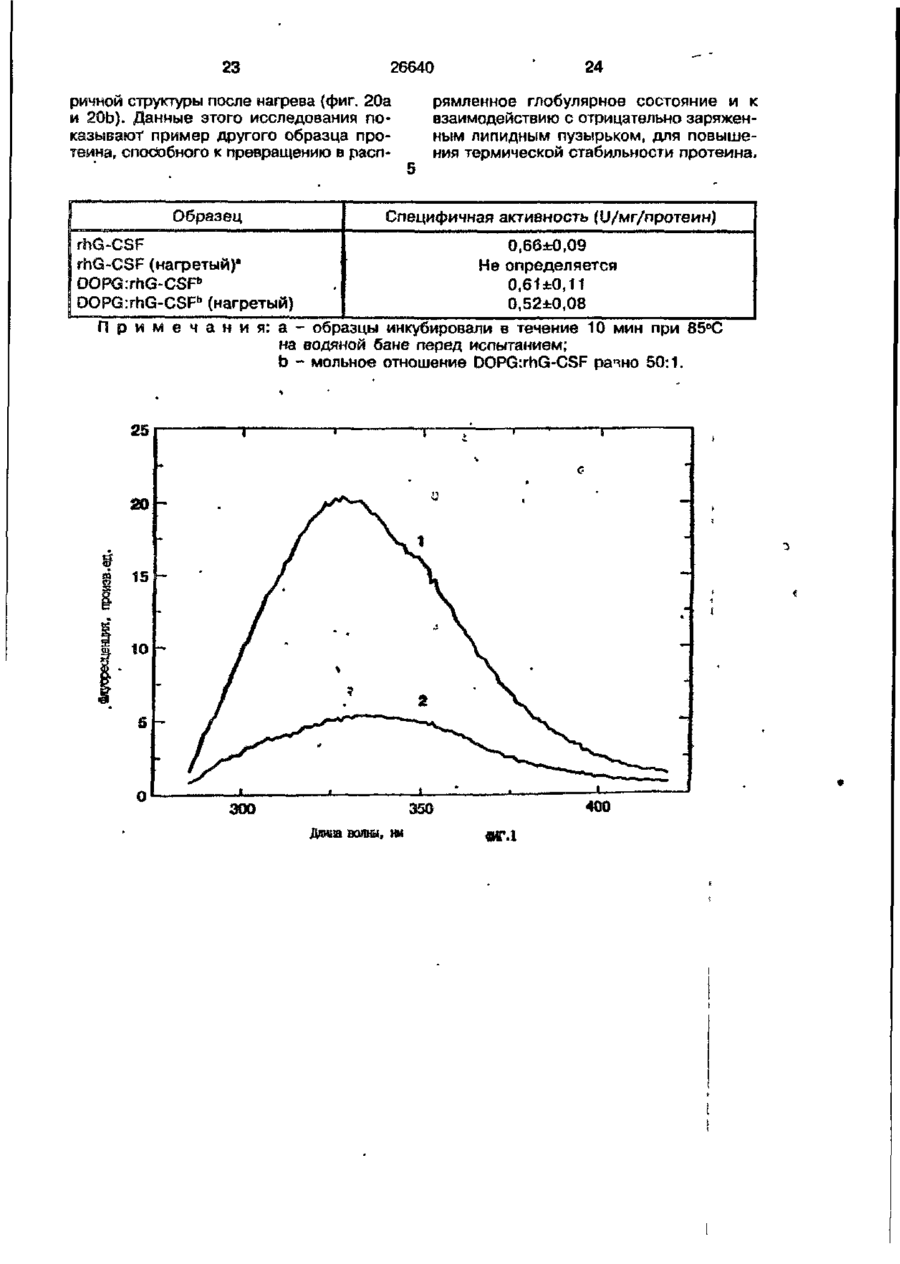
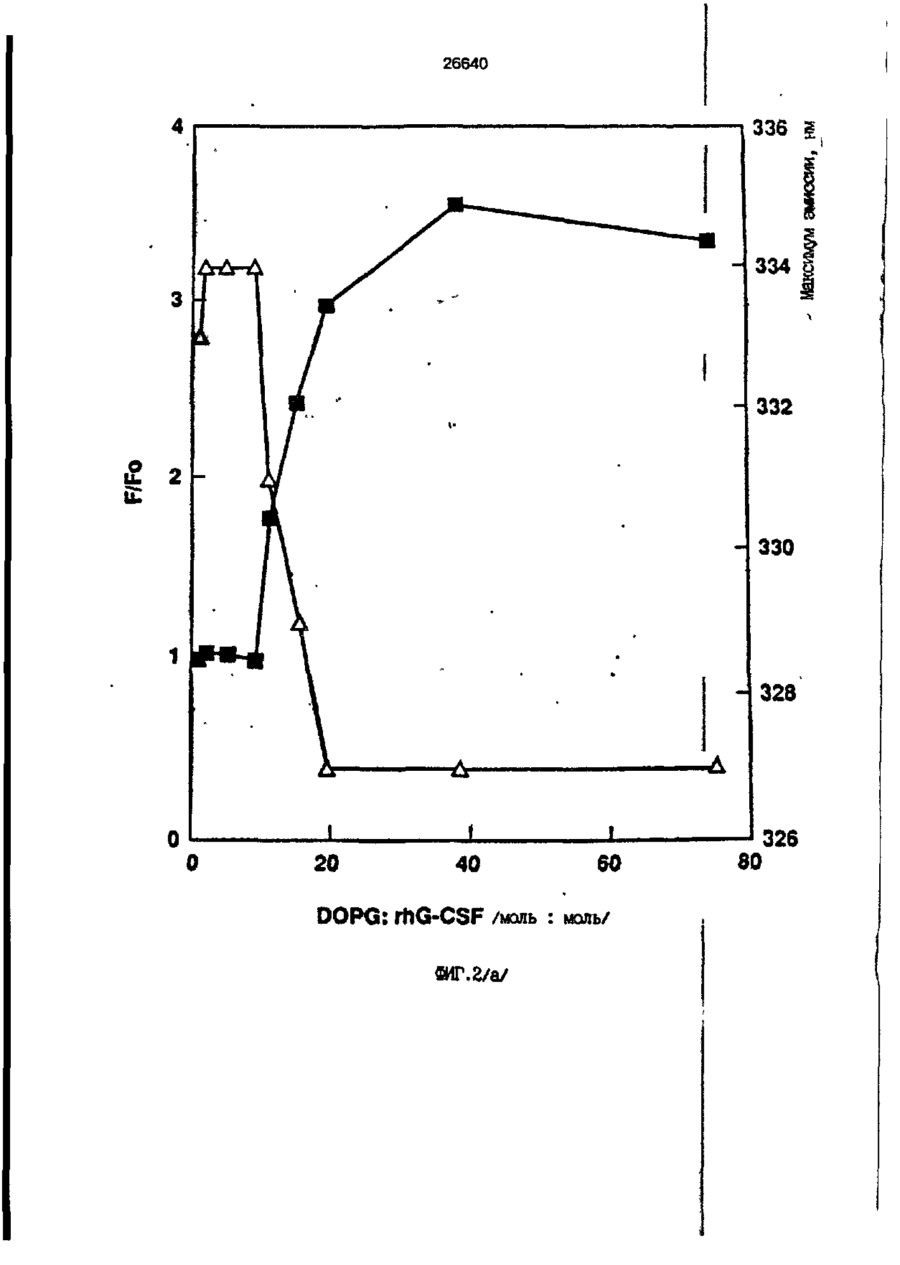
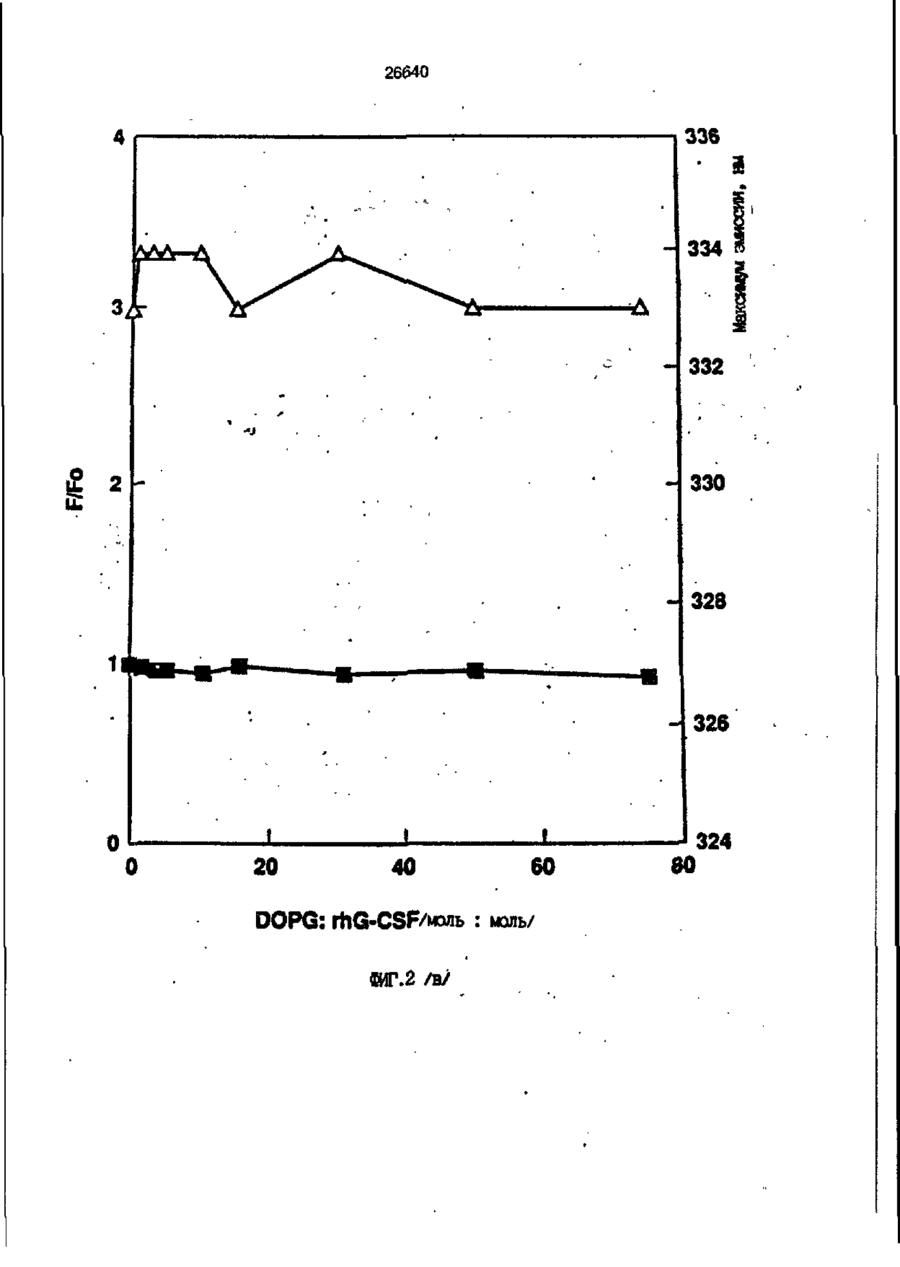
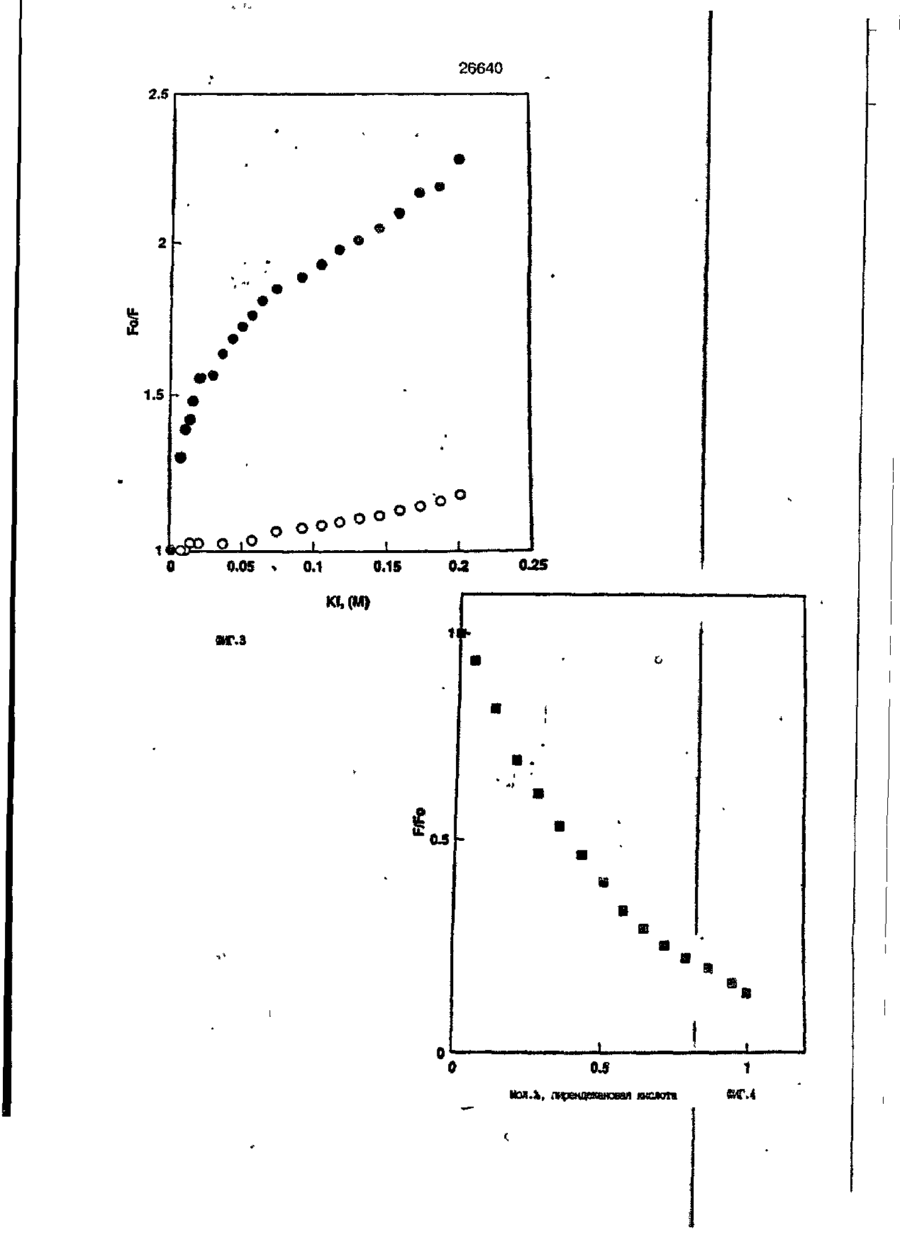
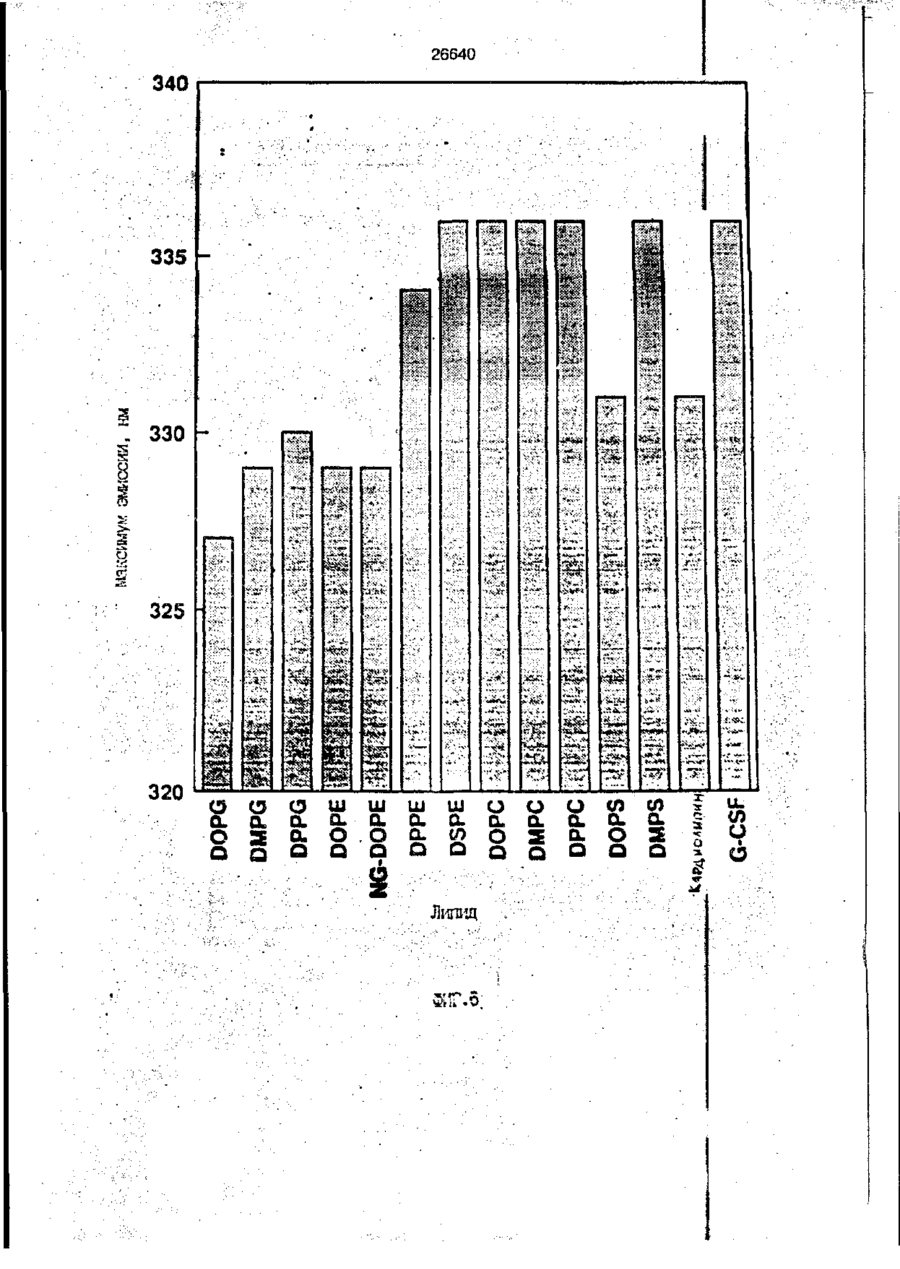
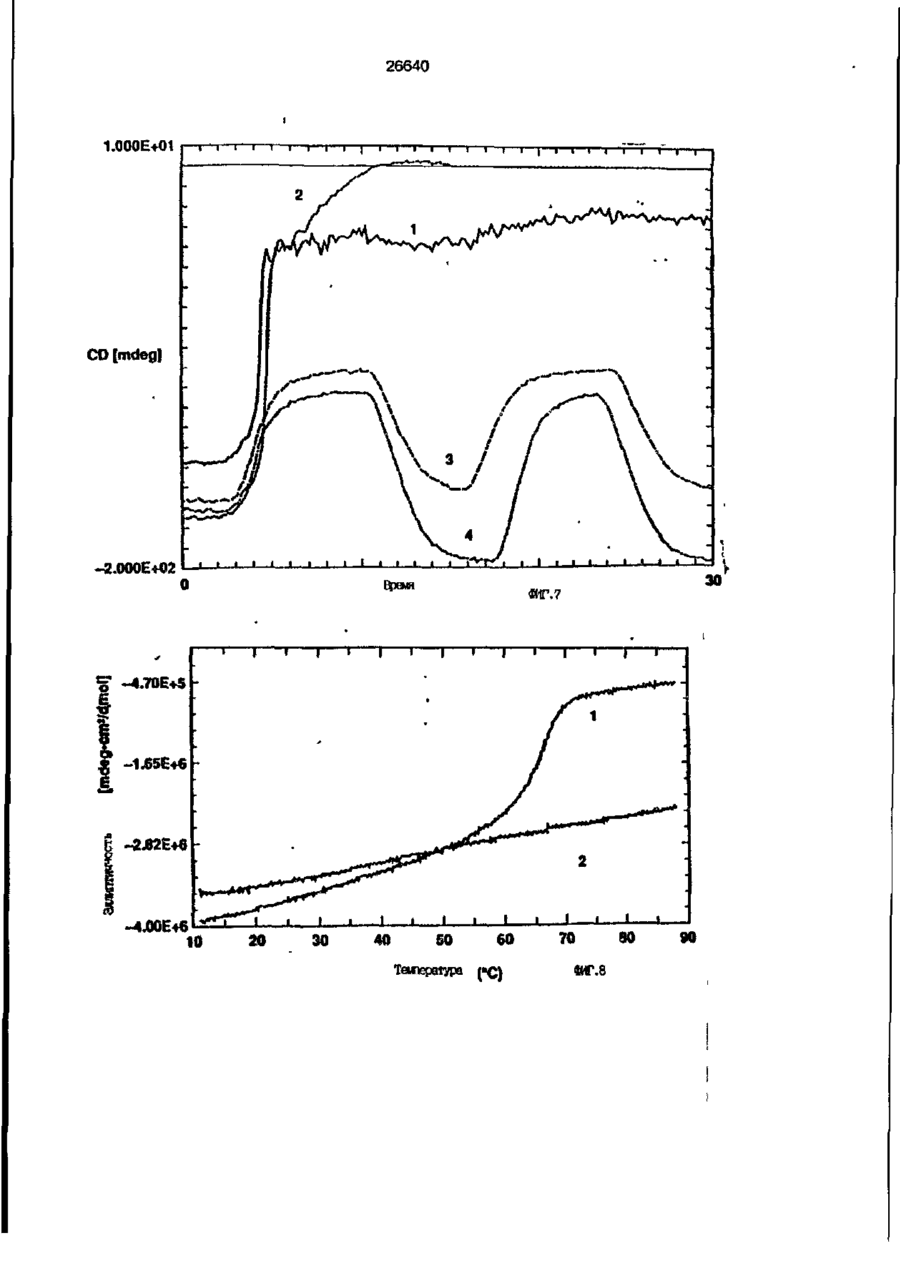
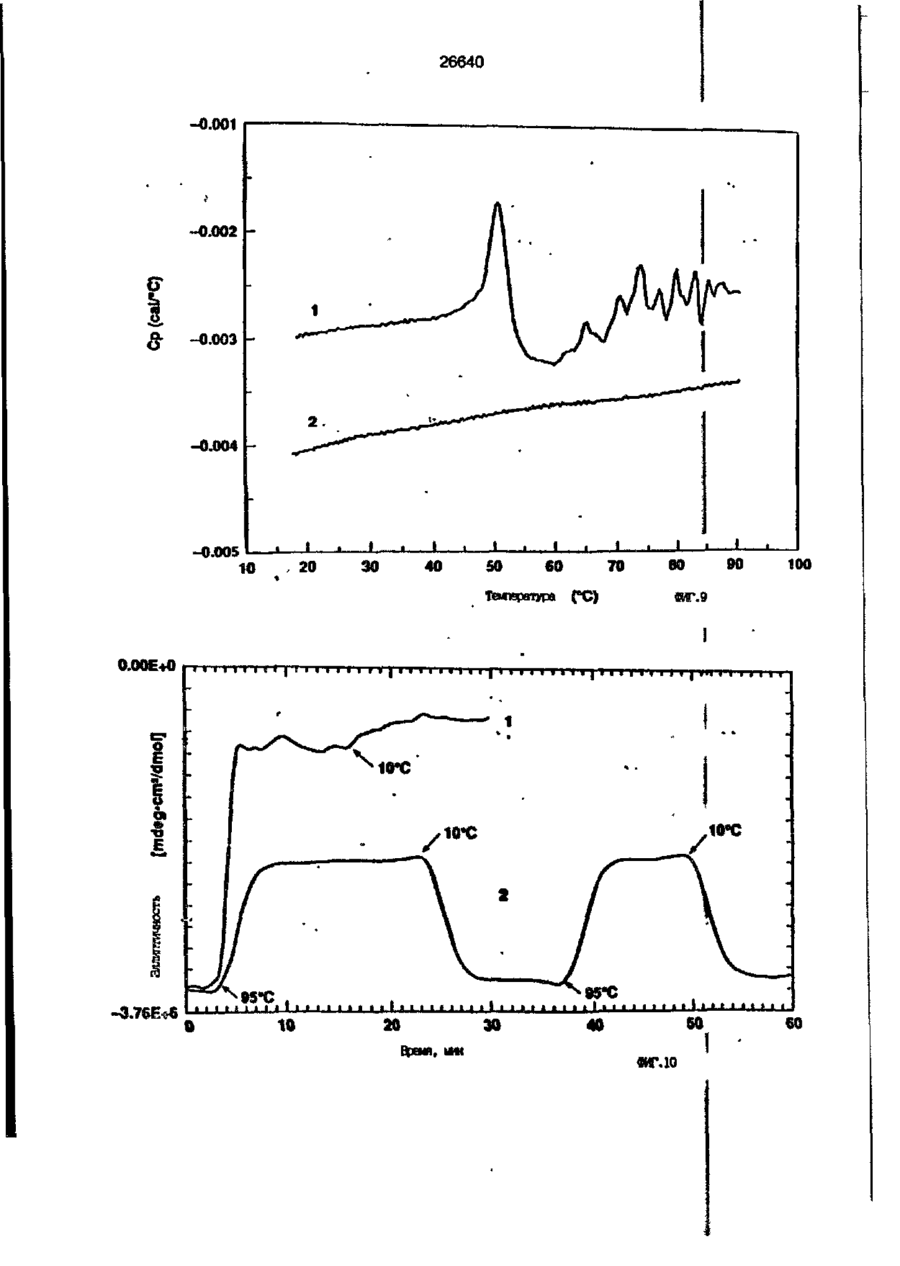
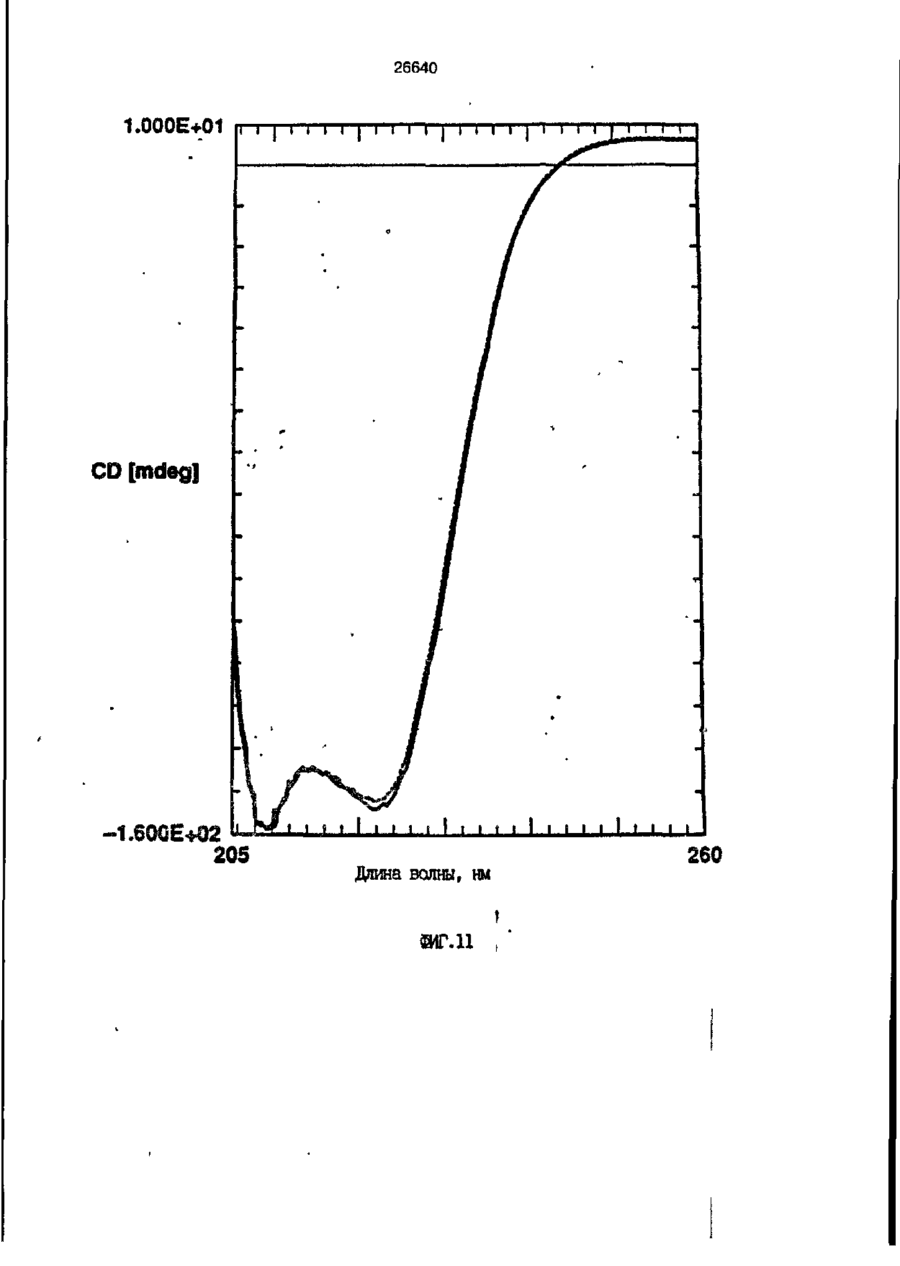
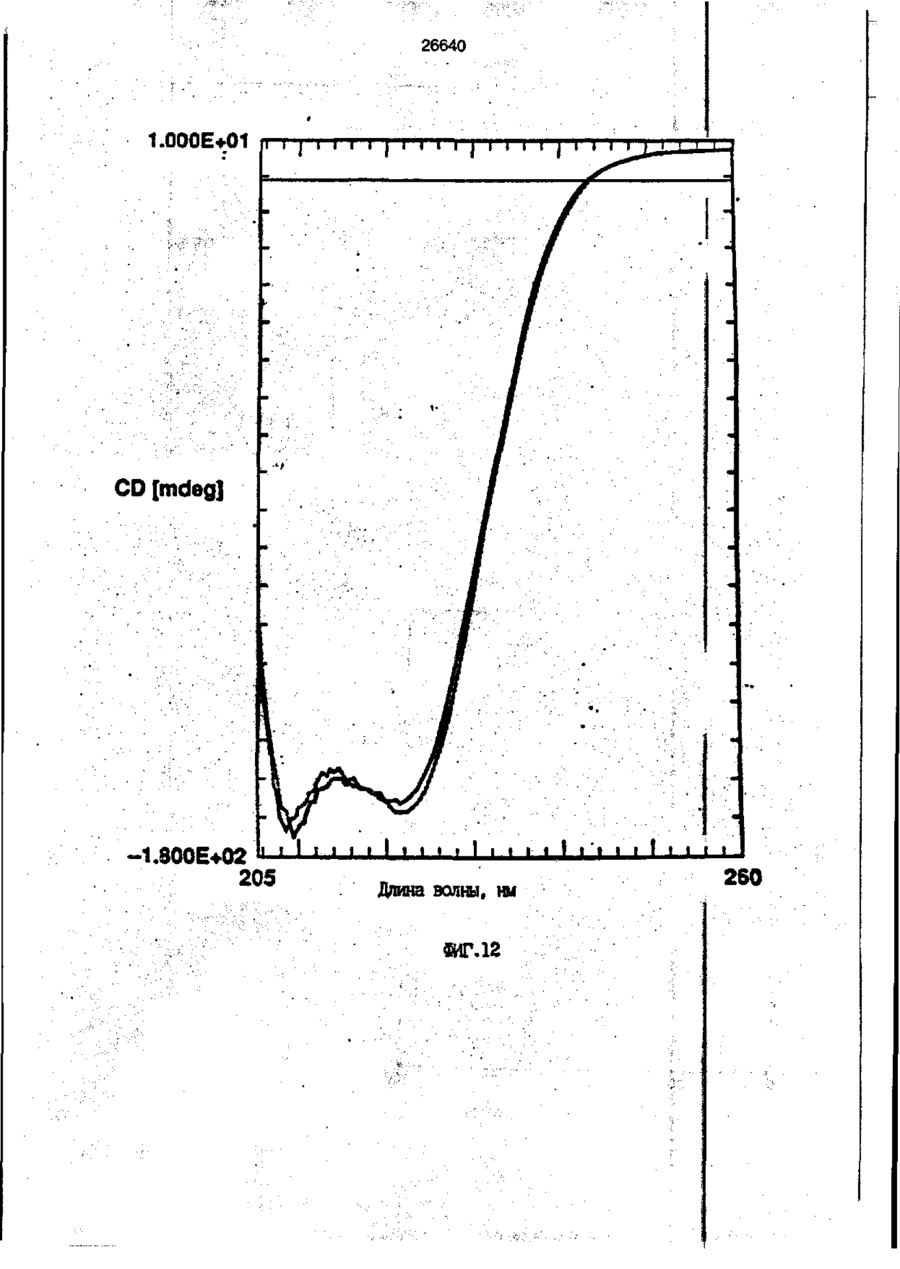
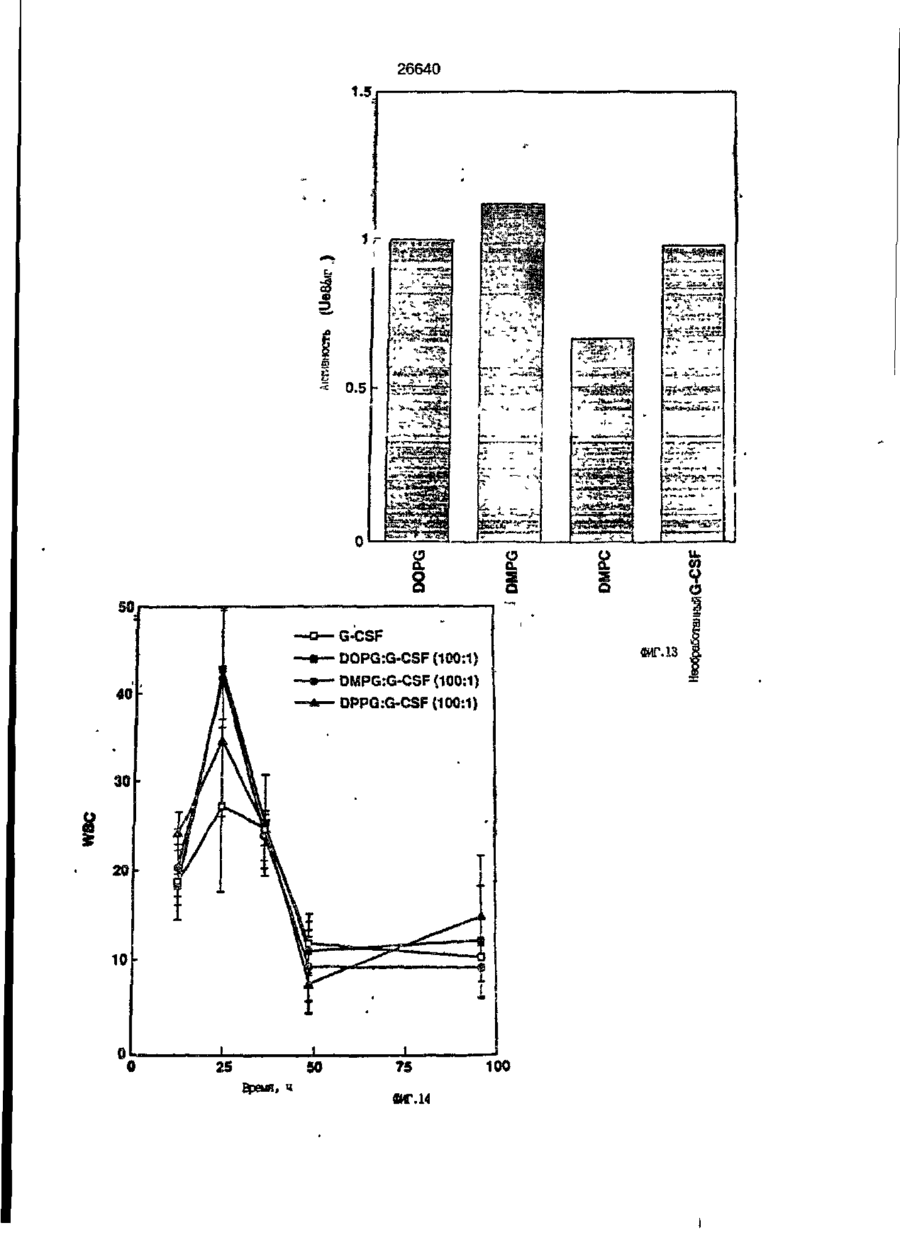
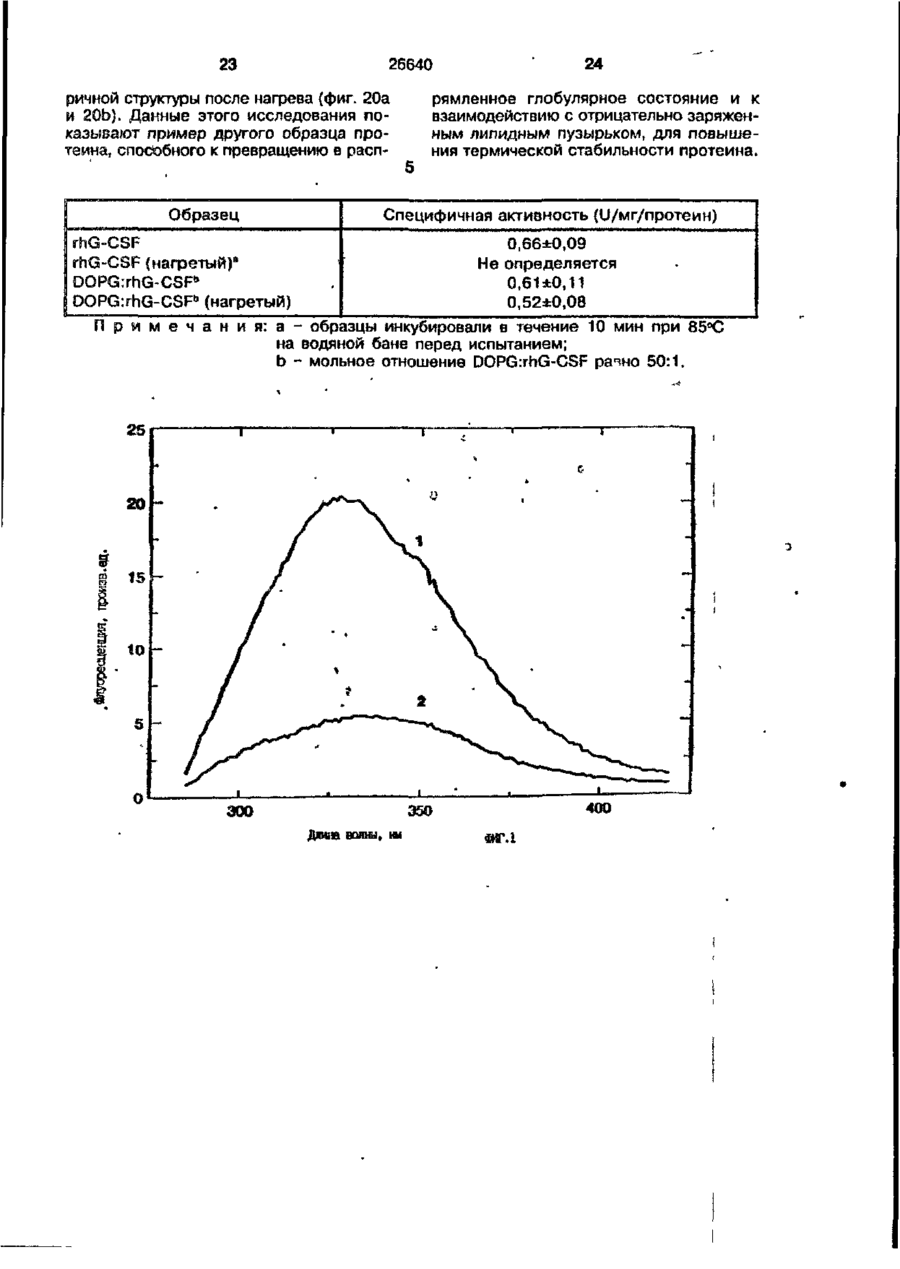
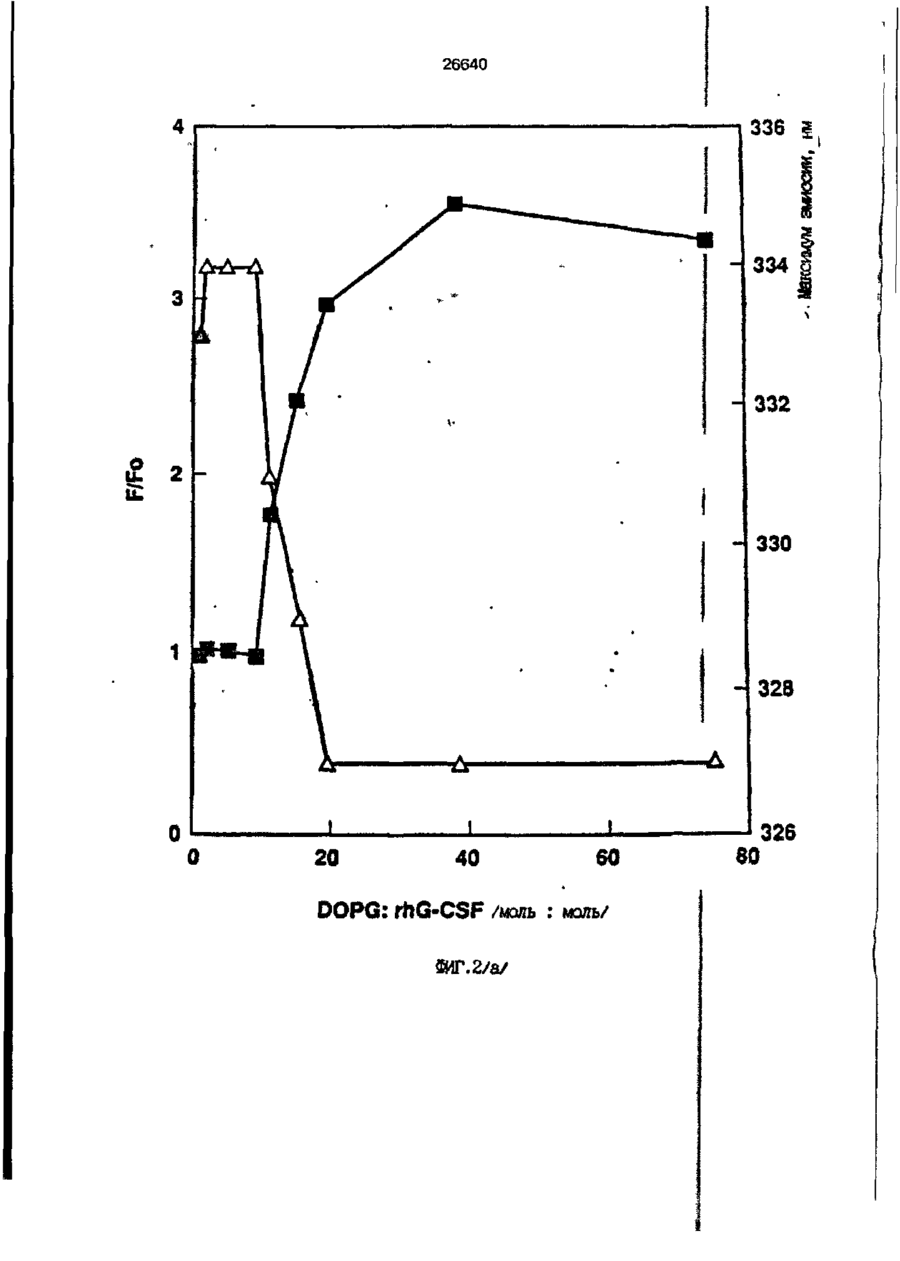
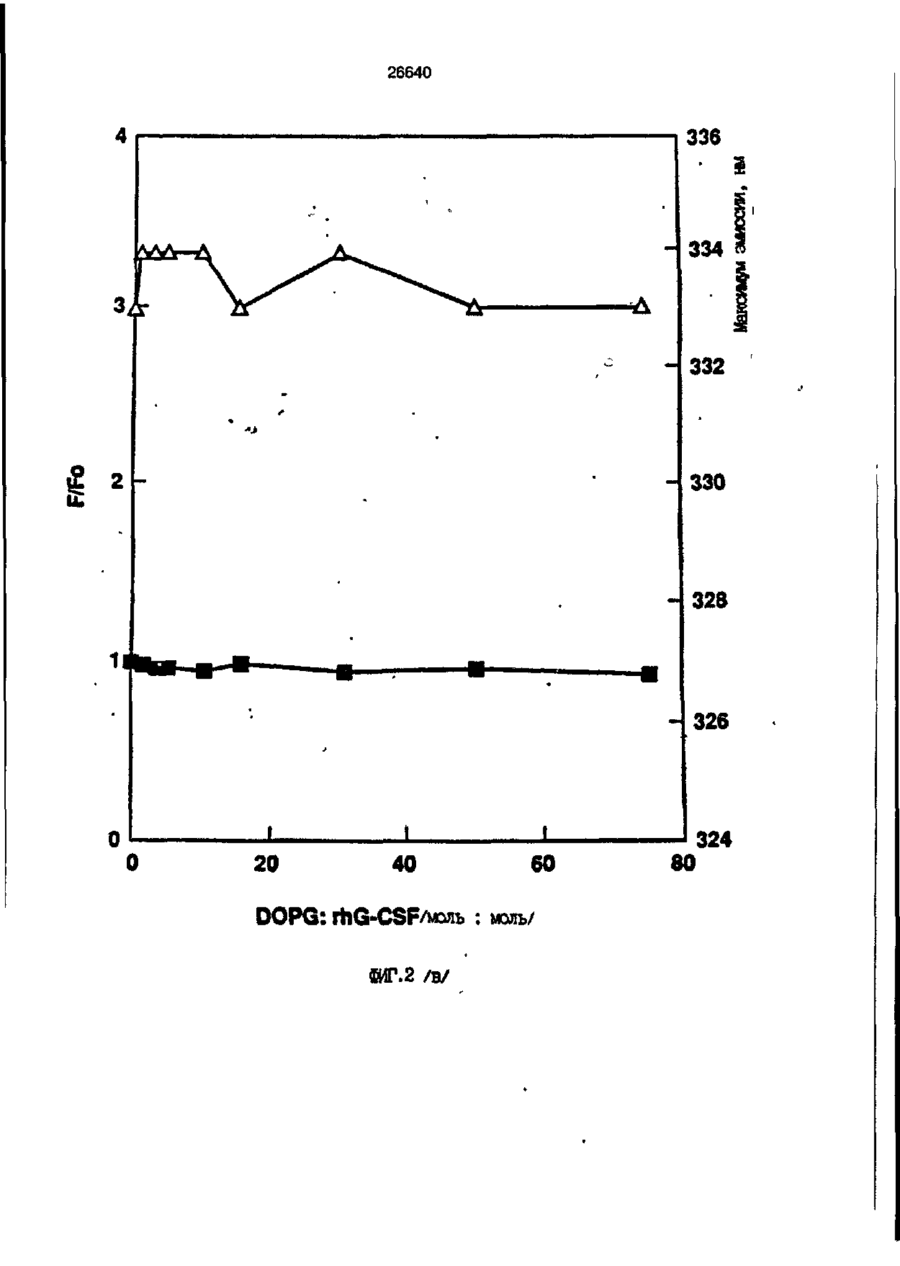
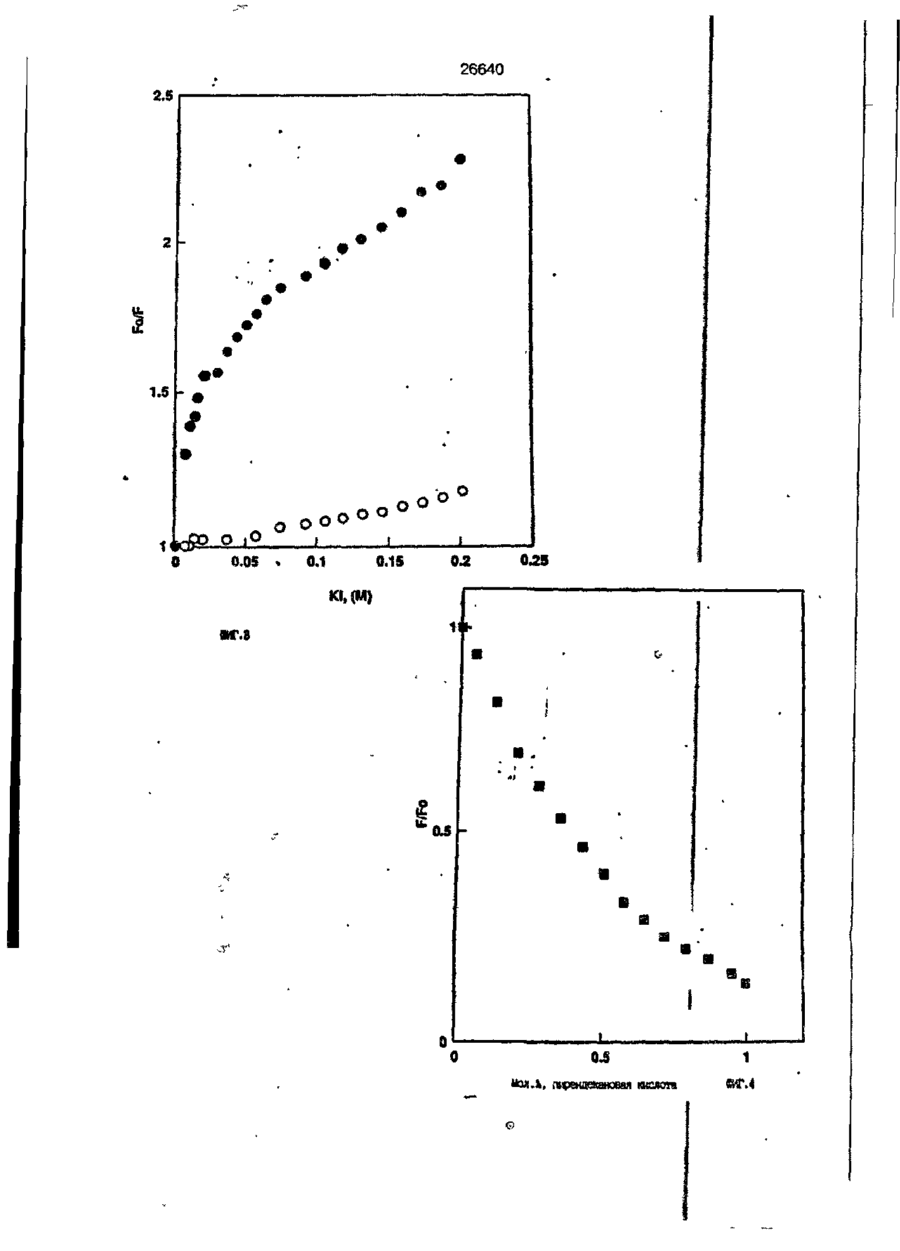
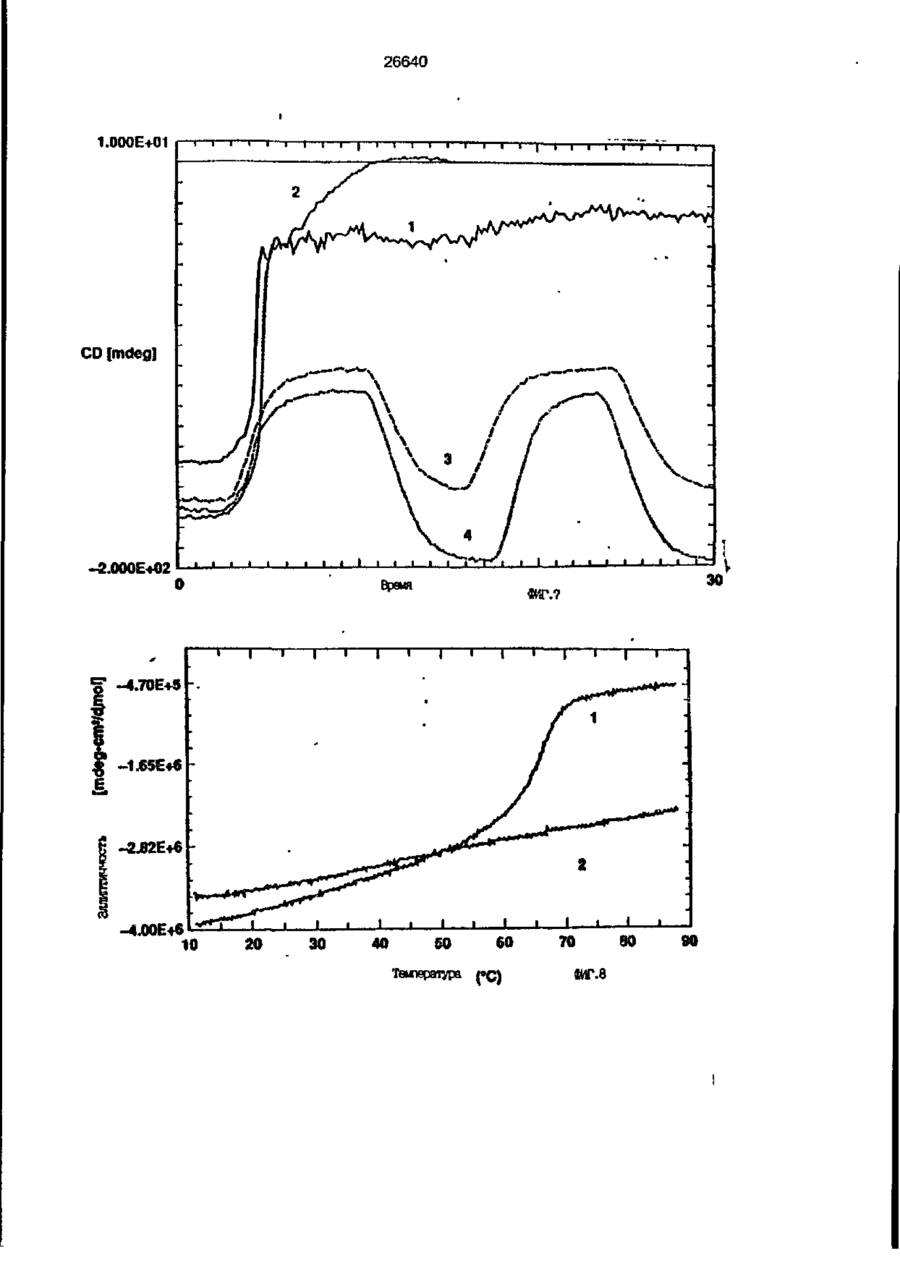
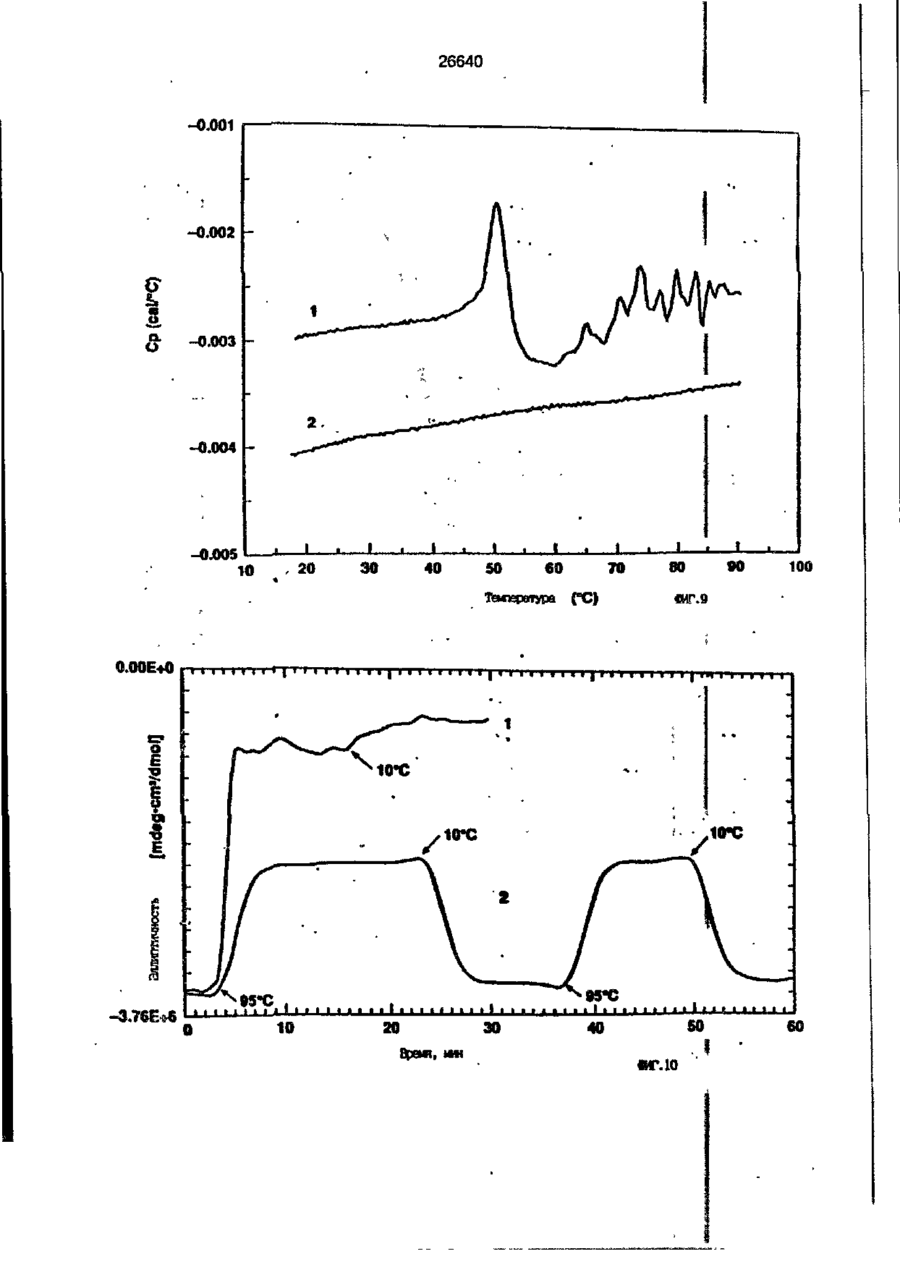
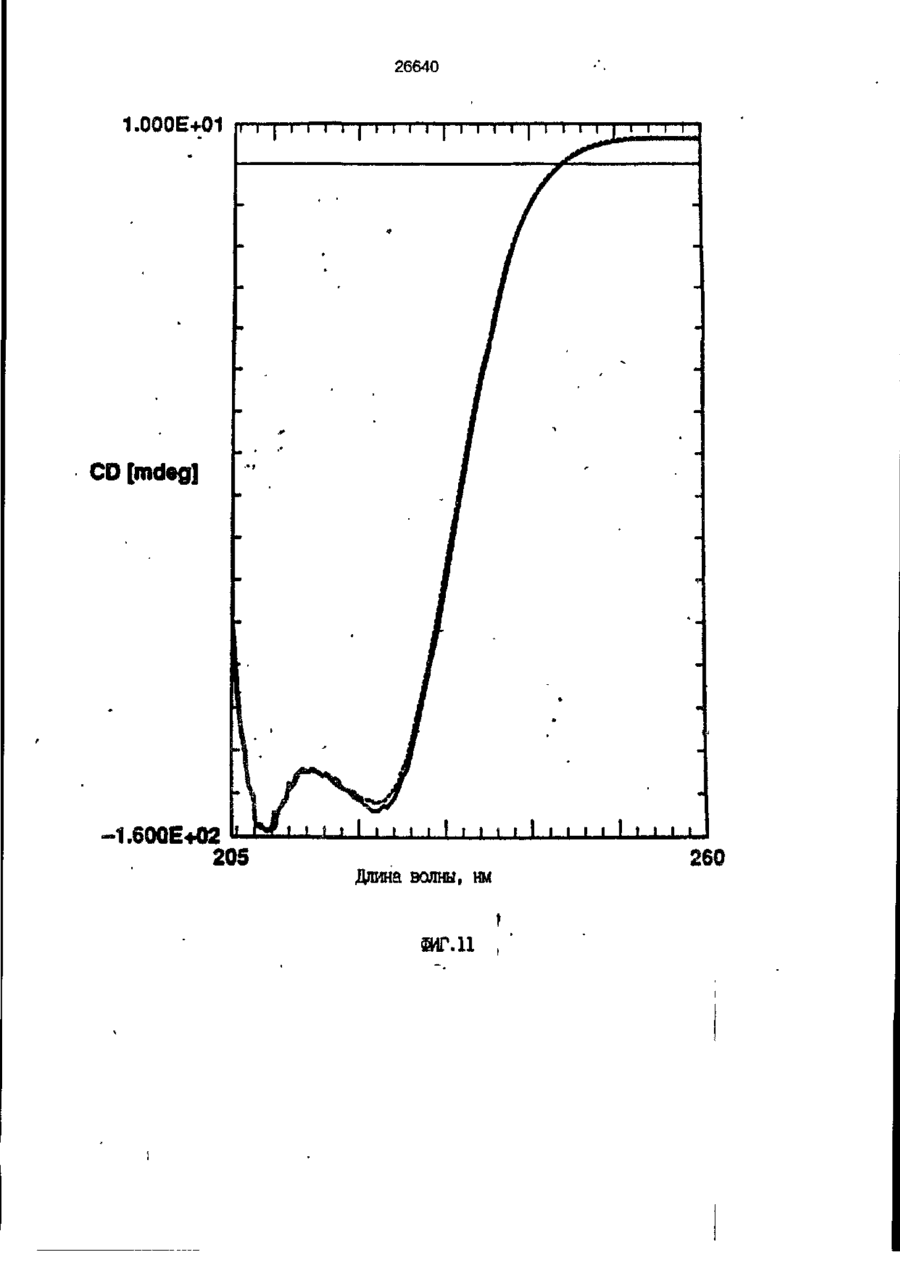
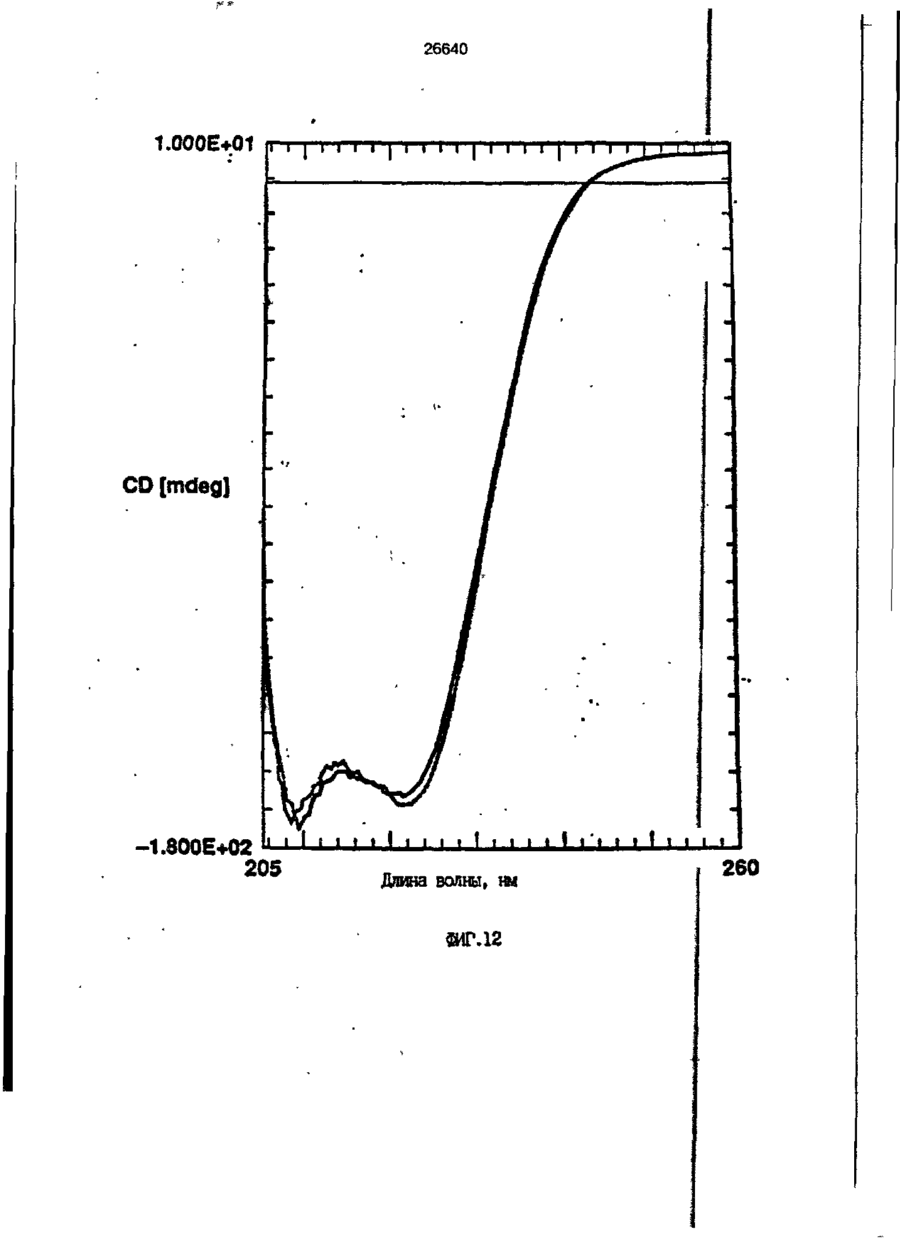
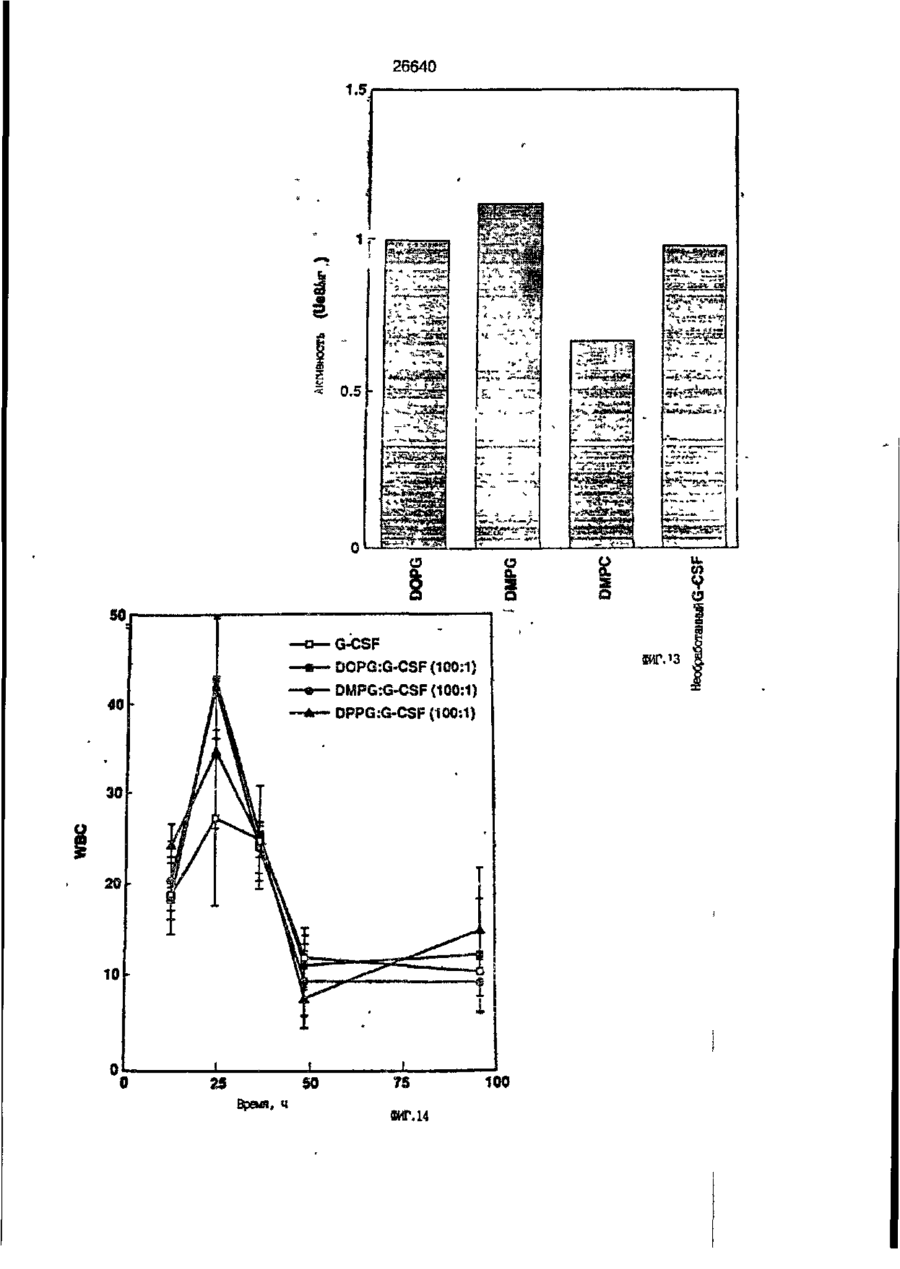
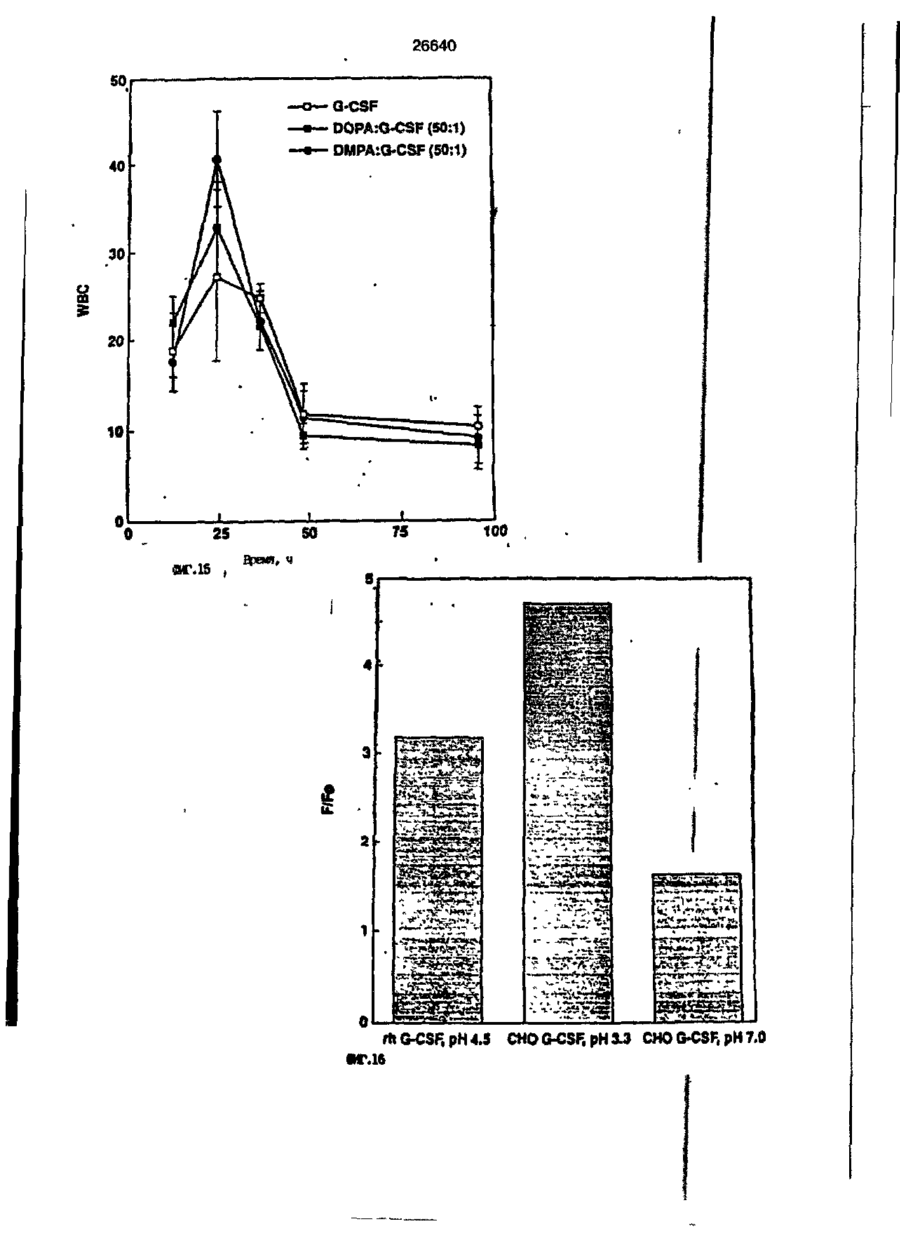
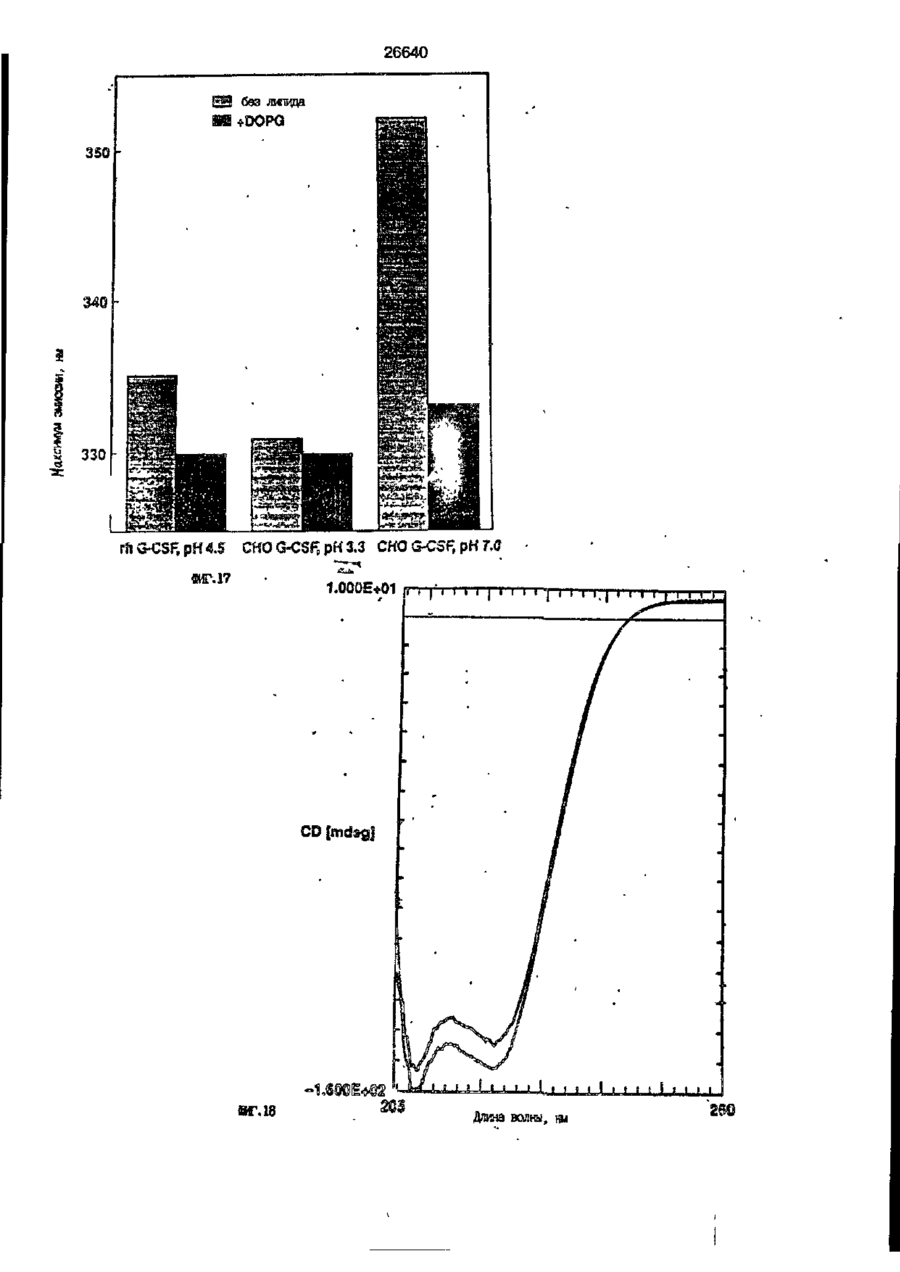
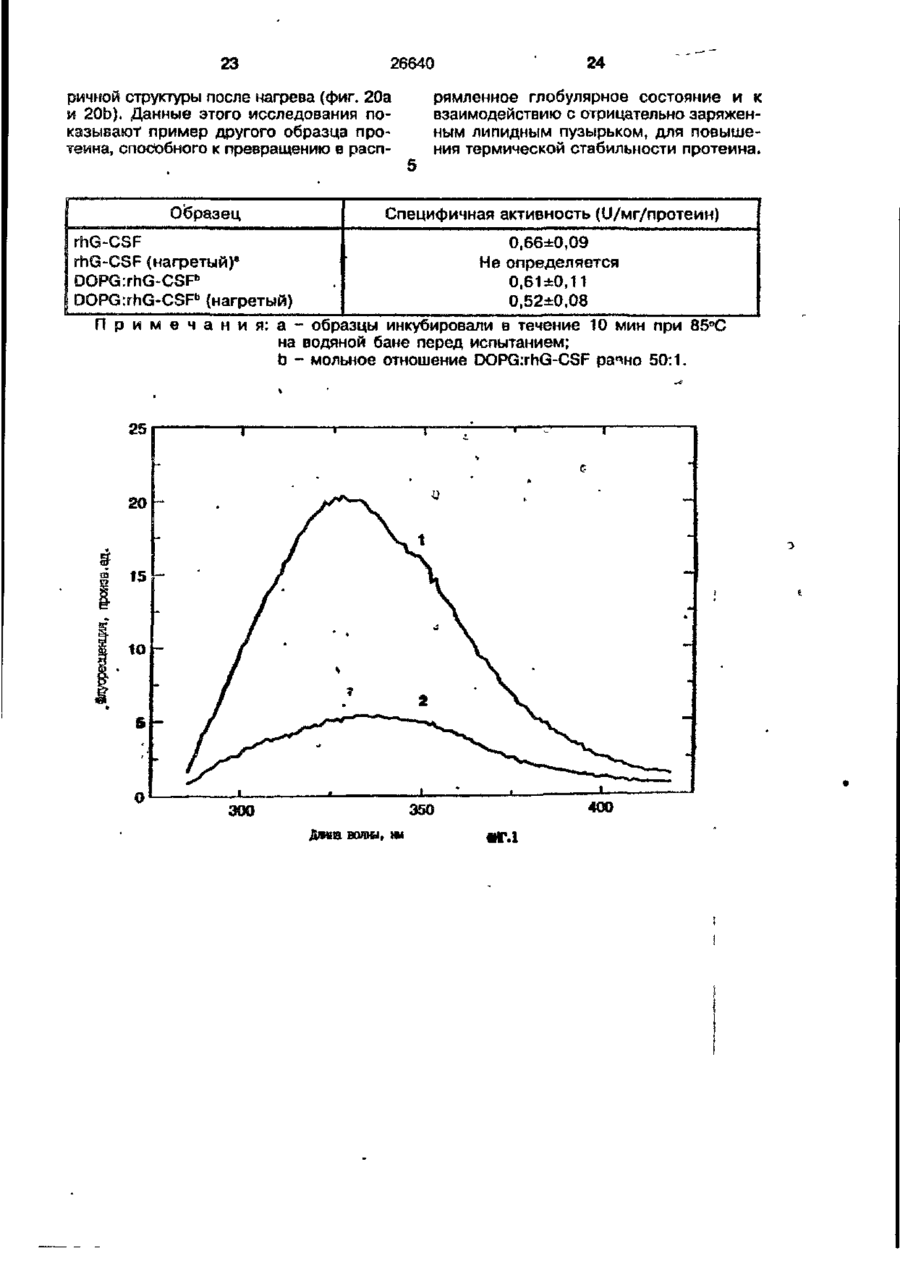
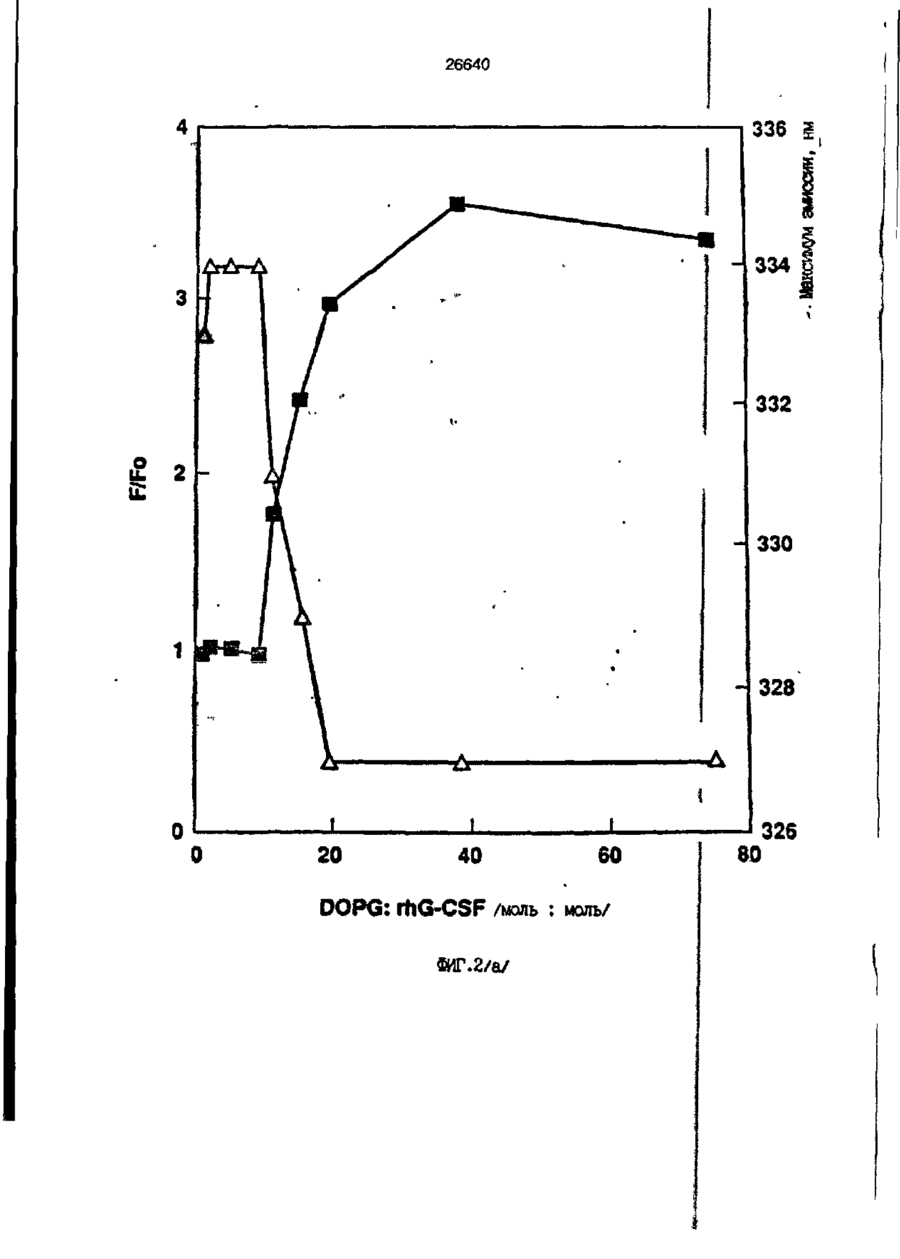
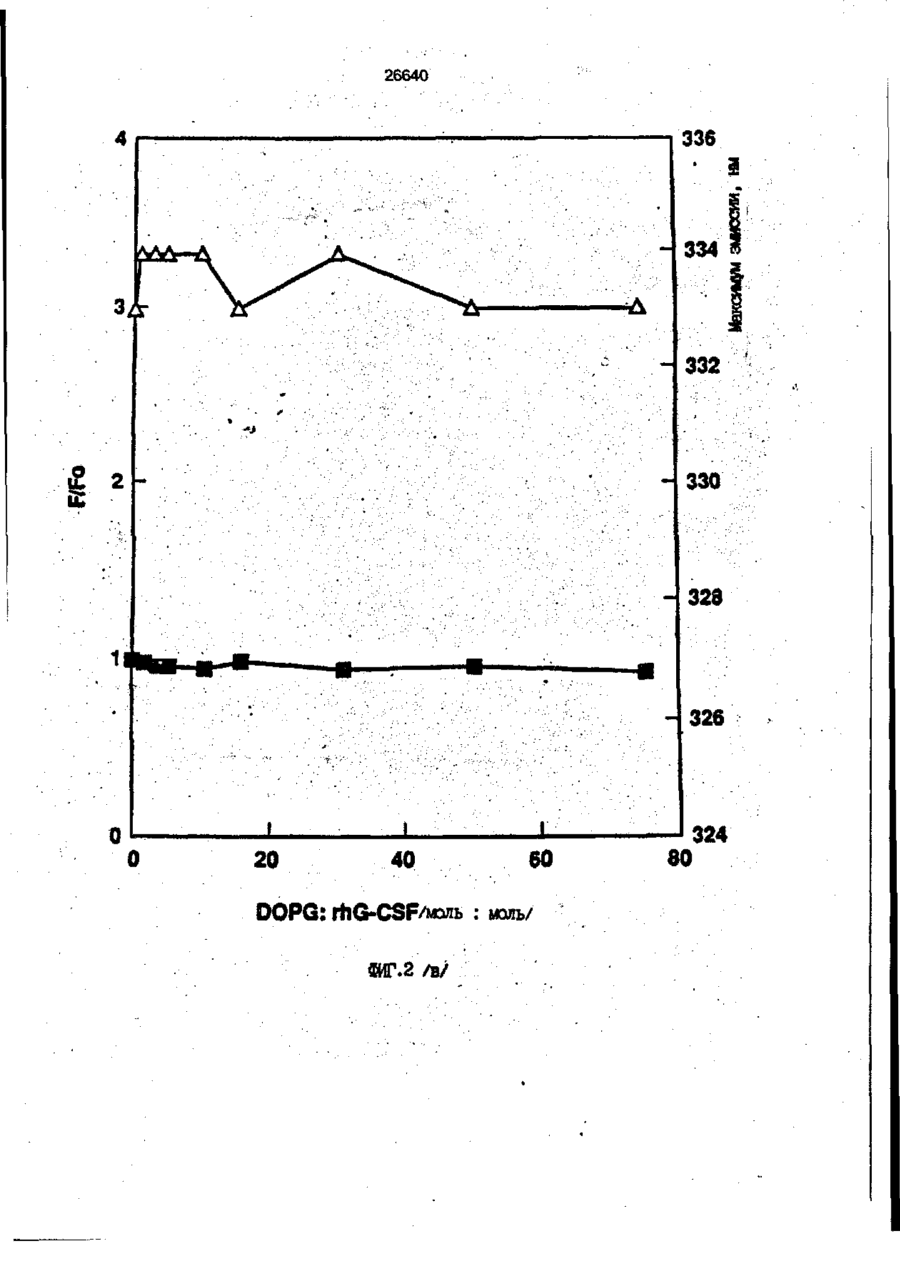
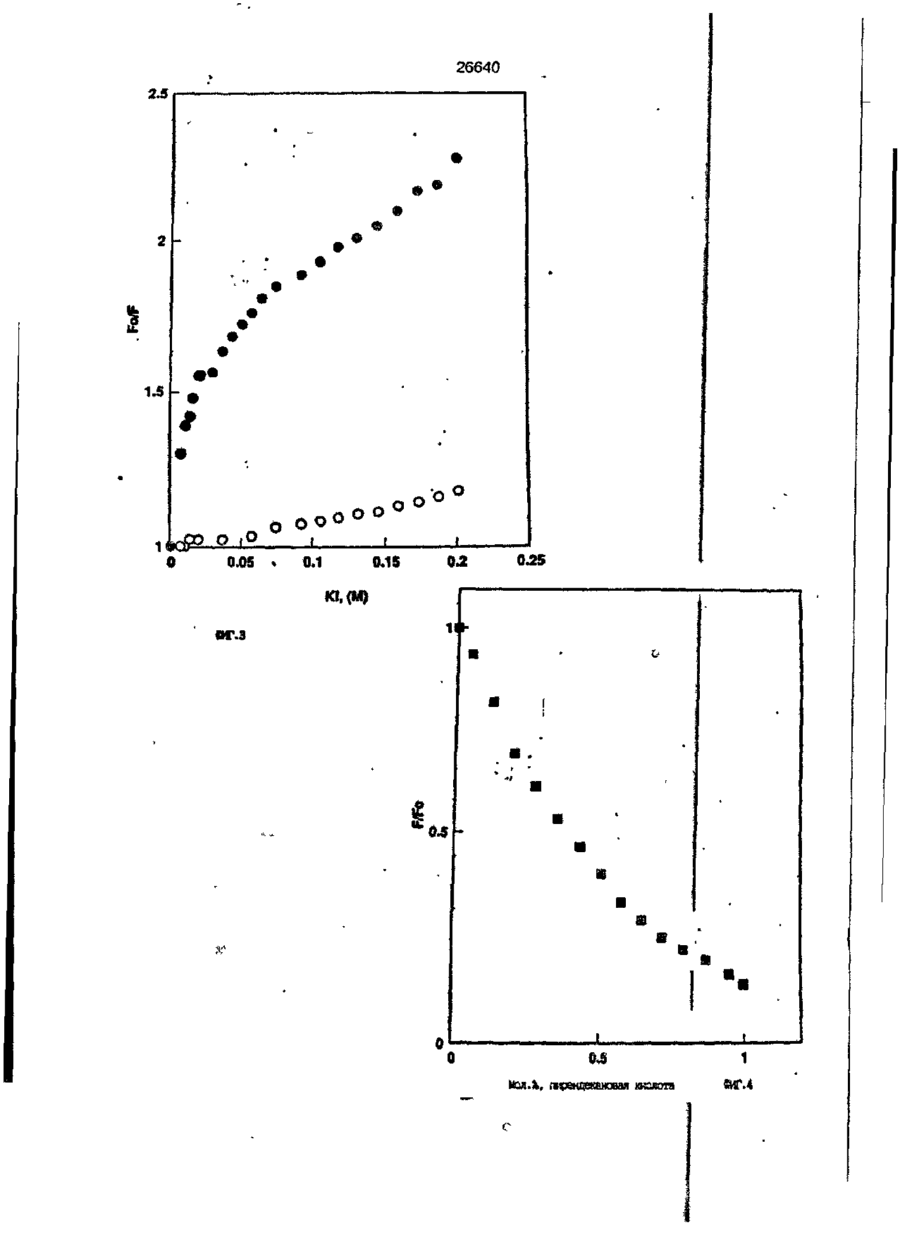
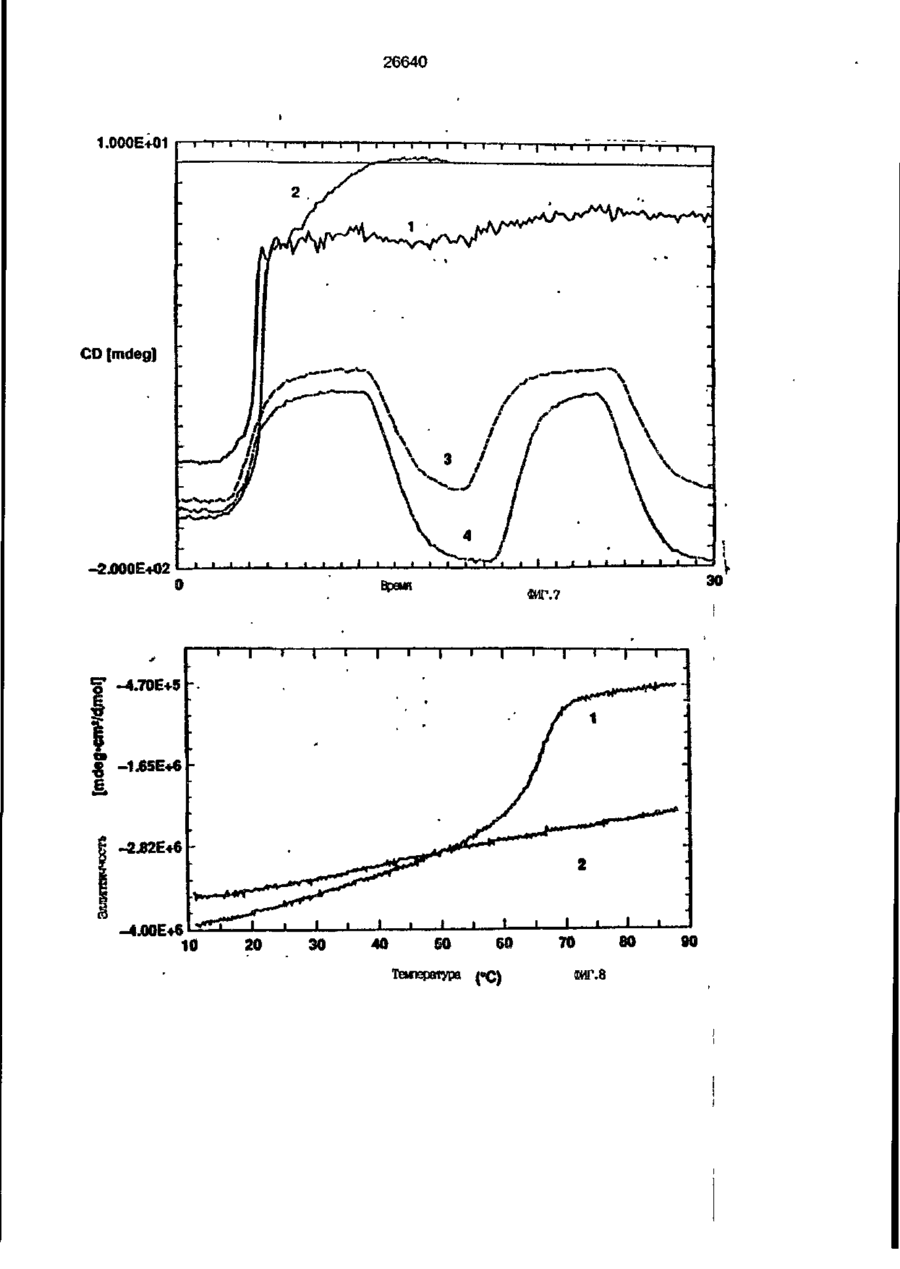
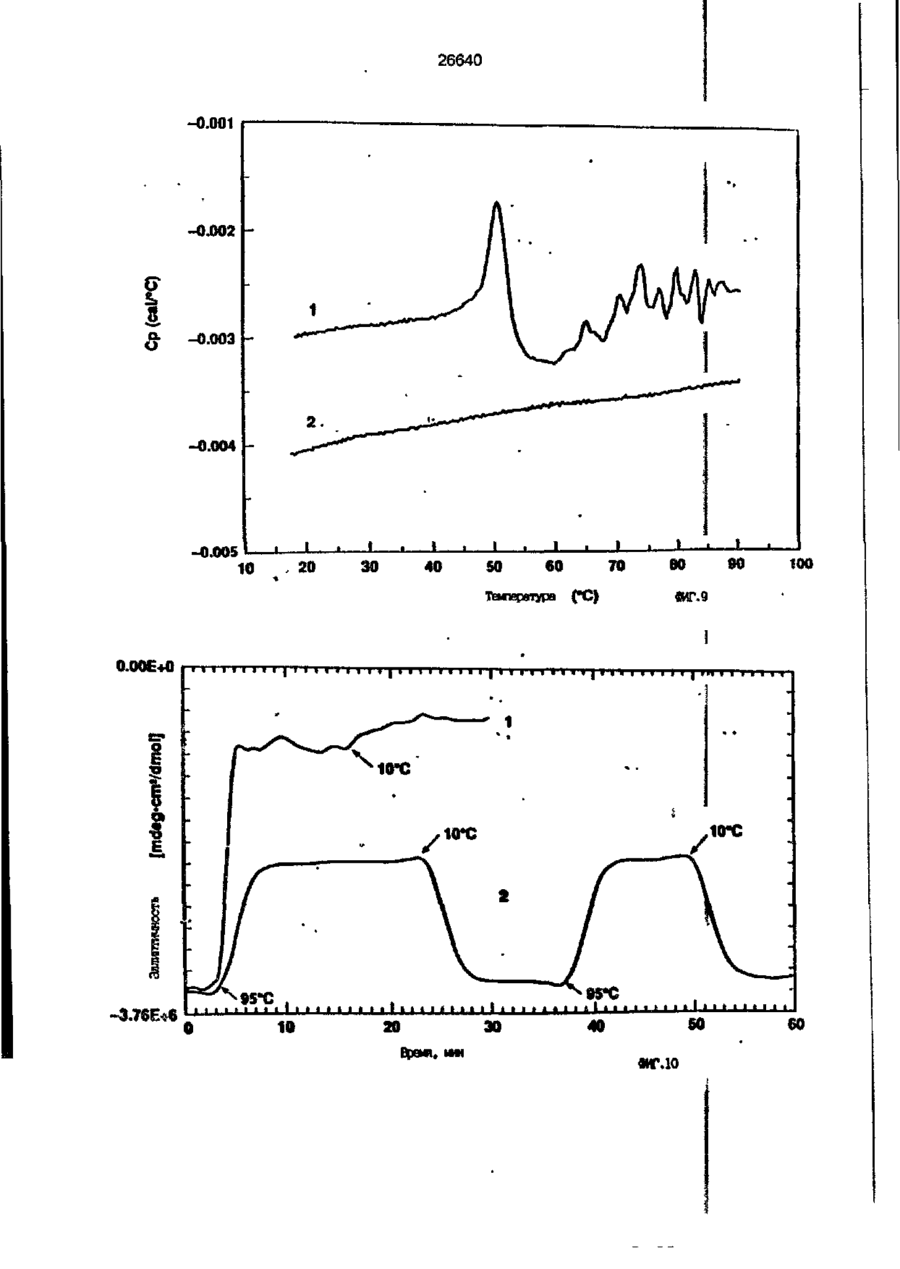
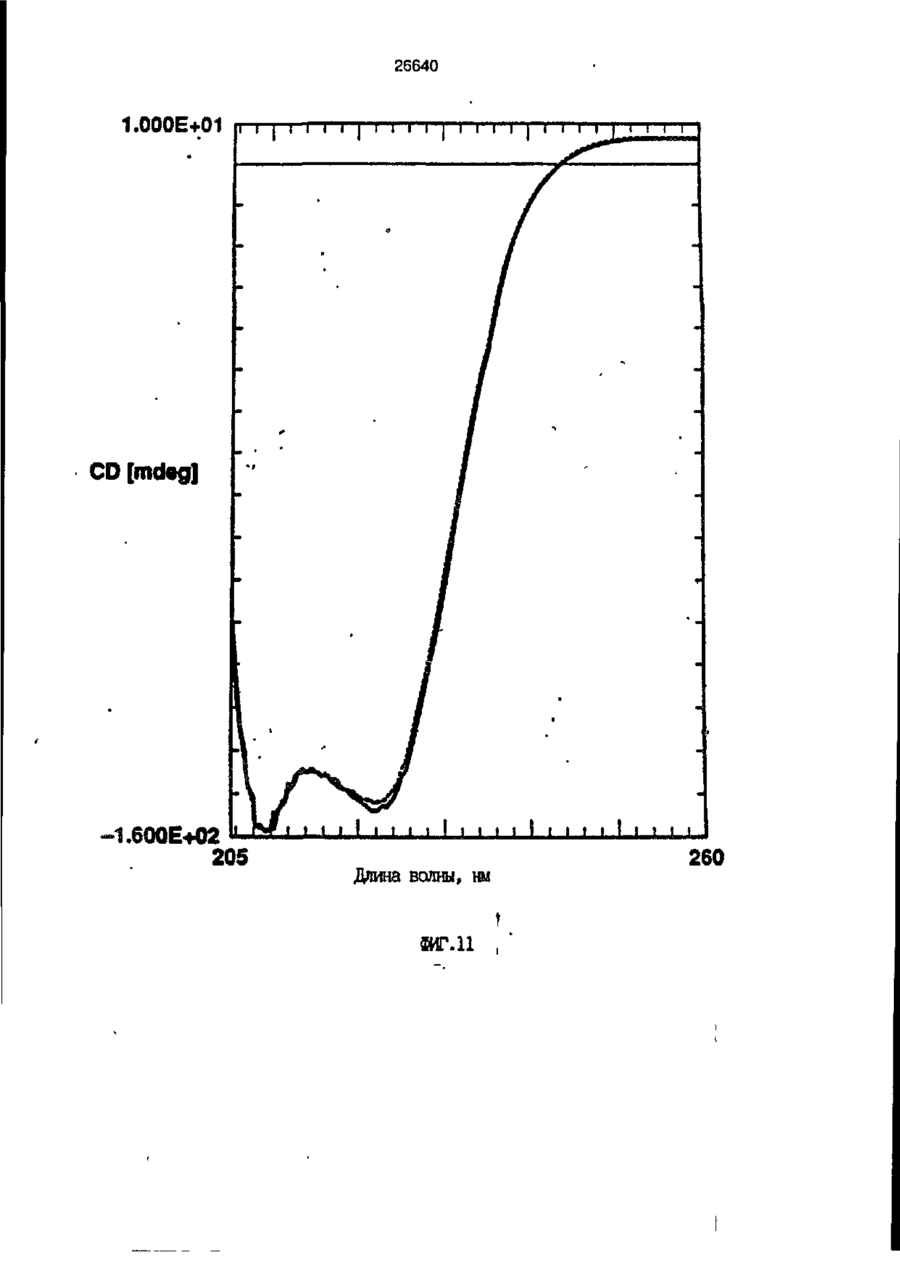
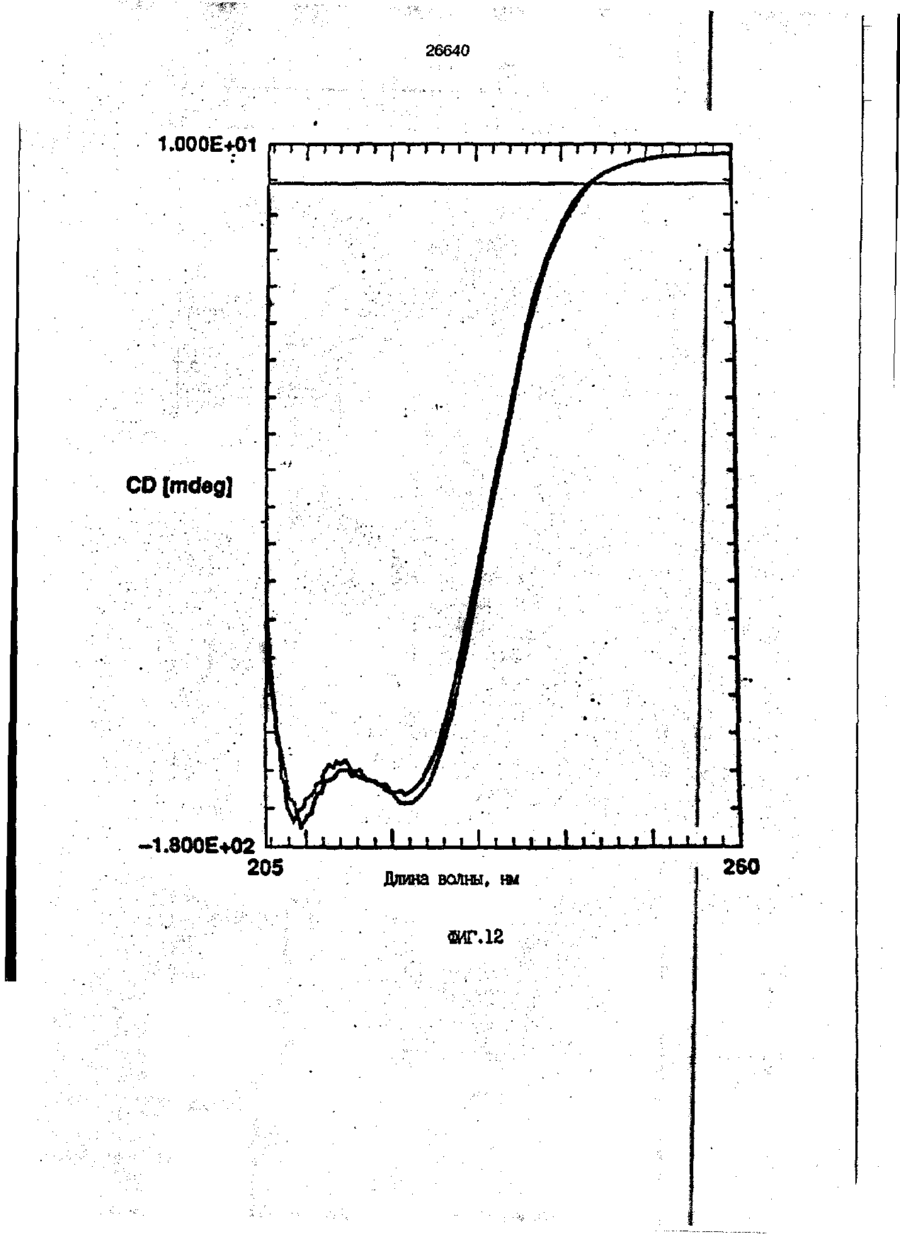
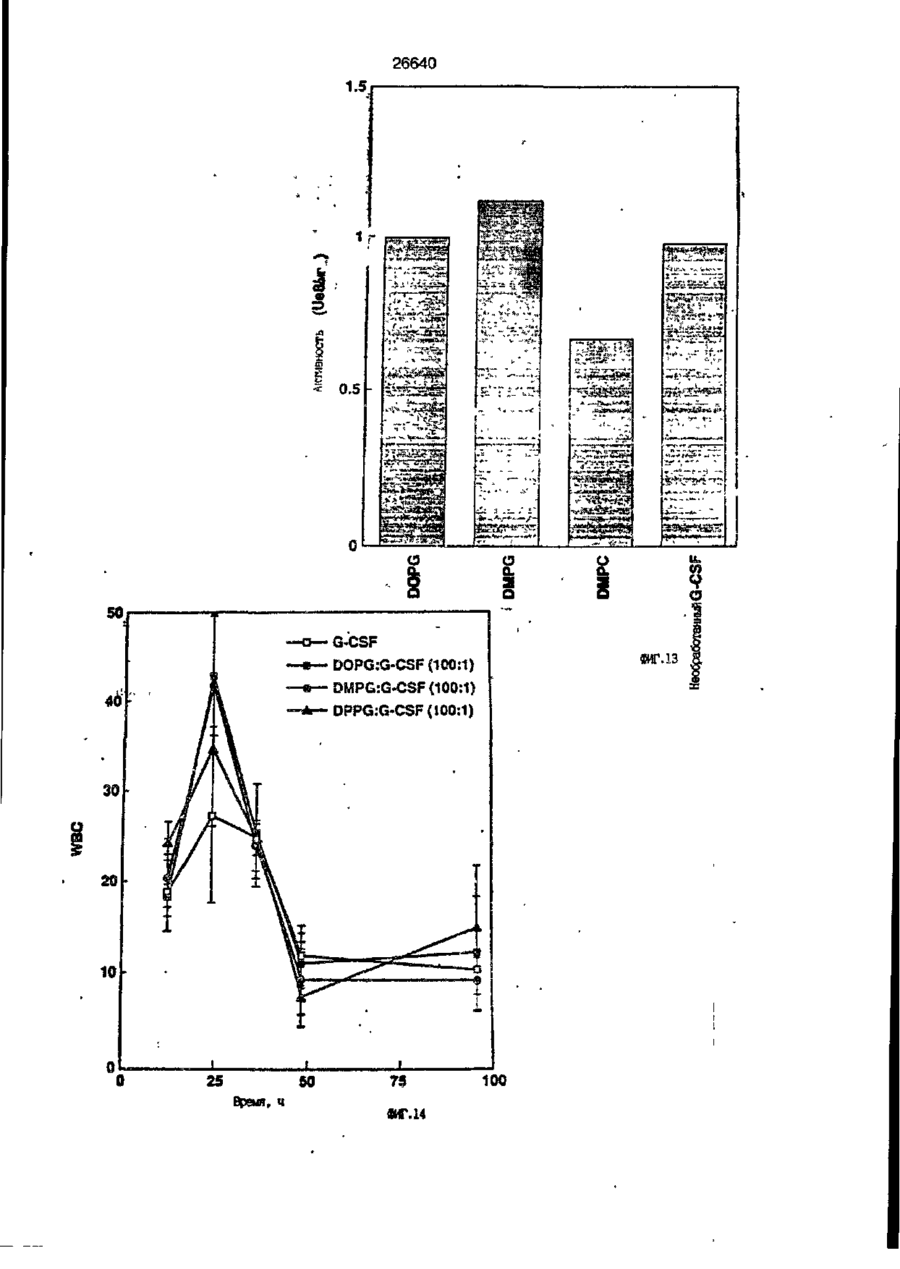
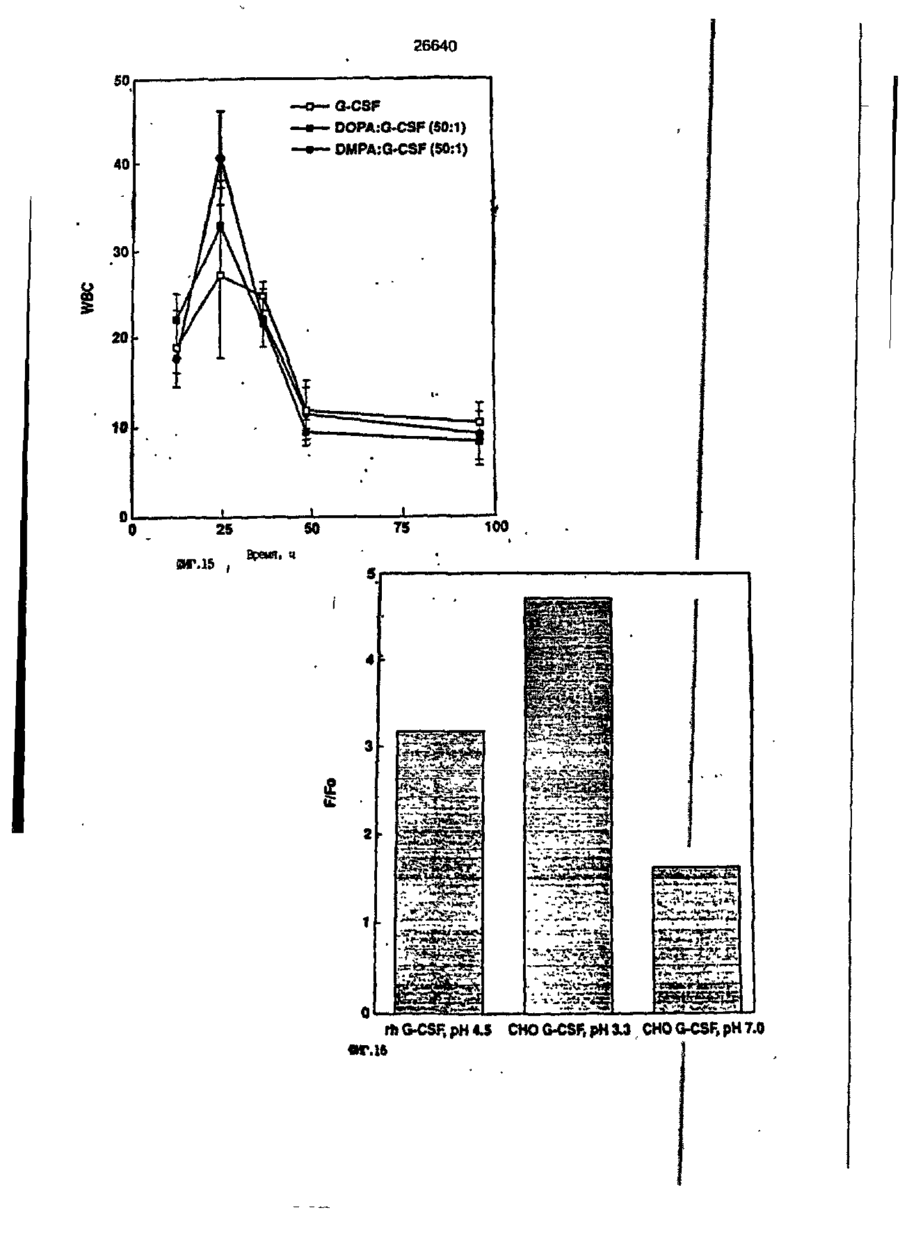
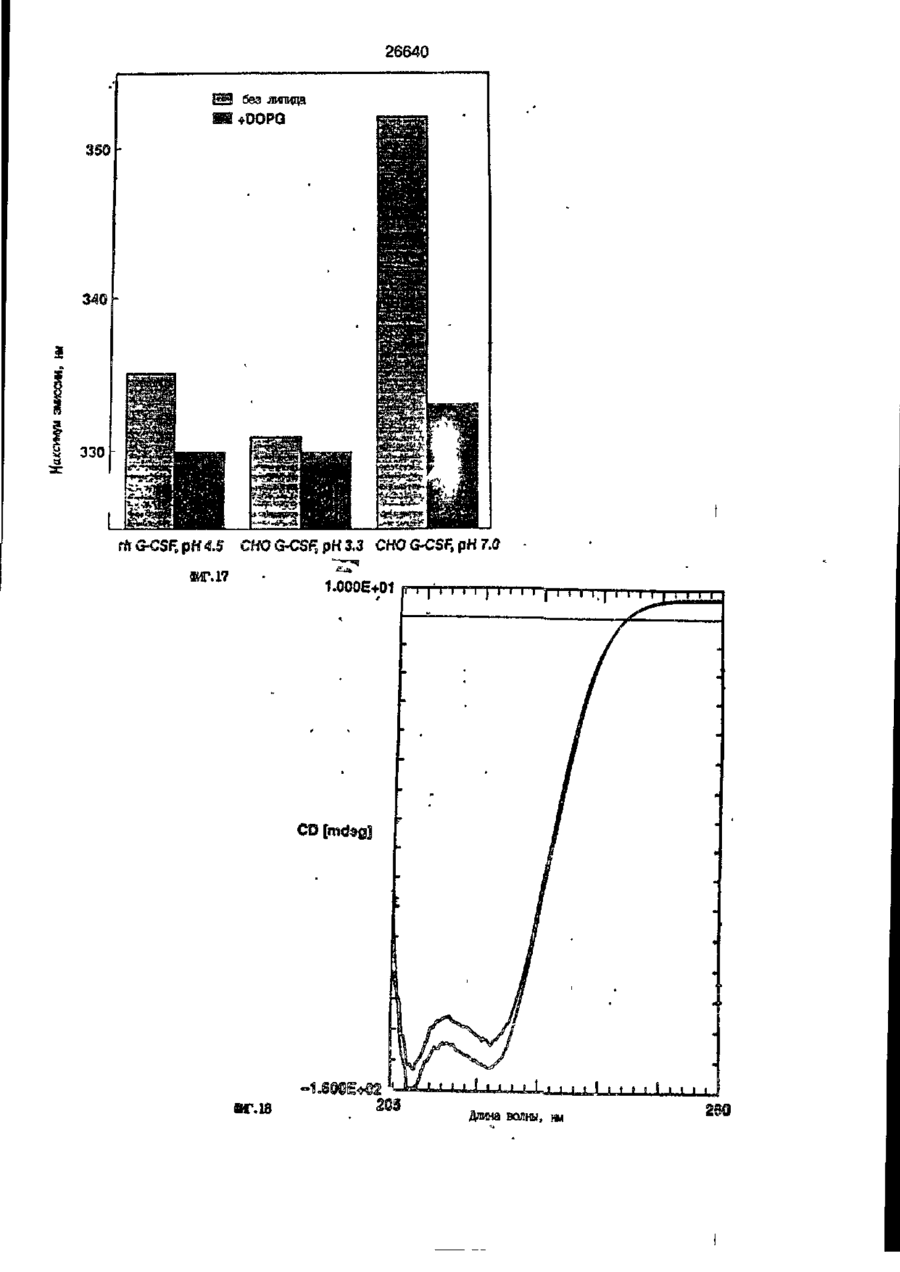
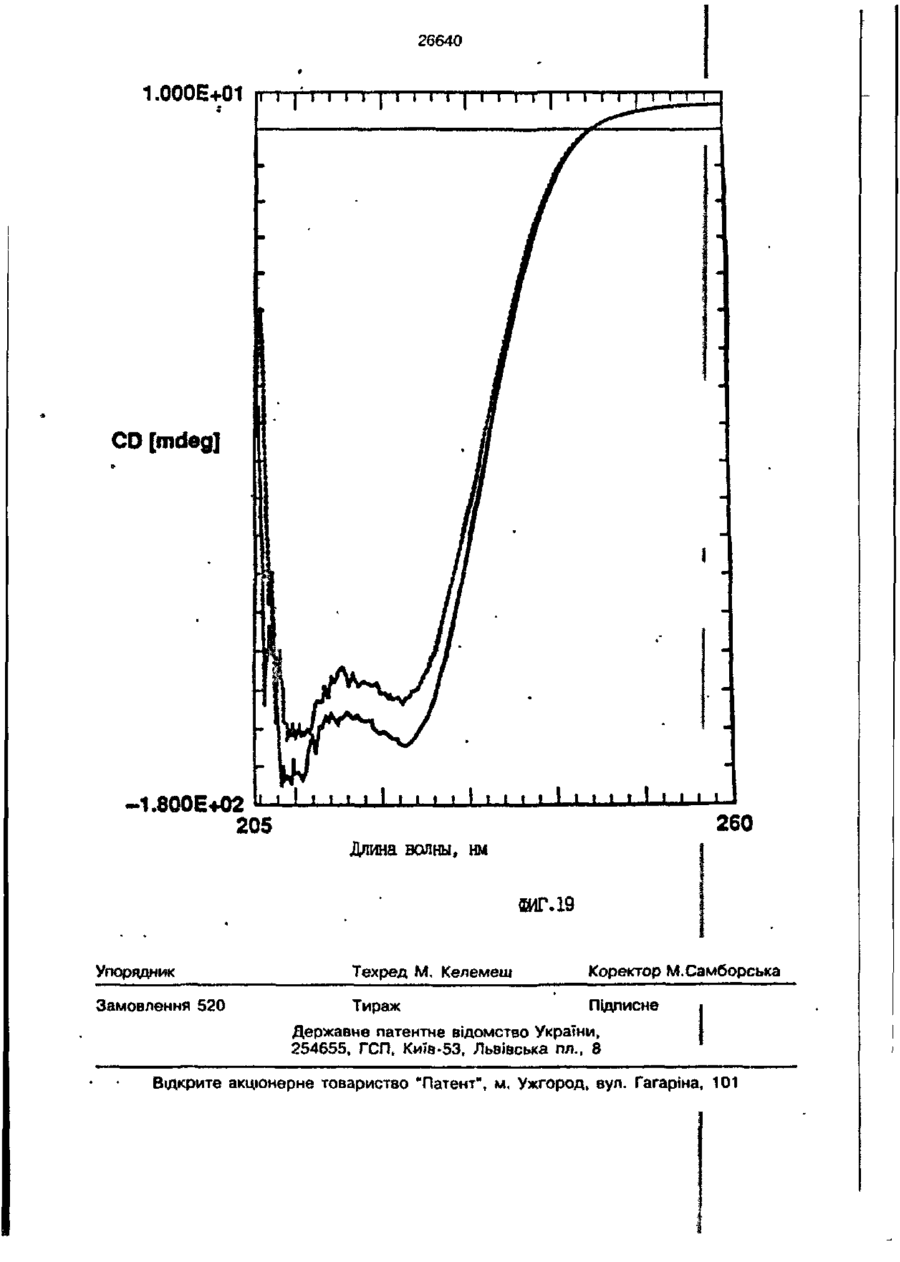
1. Композиция, содержащая липосомный пузырек и введенный в него белковый медикамент, о т л и ч а ю щ а я с я тем, что в качестве липосомного пузырька содержит отрицательно заряженный фосфолипид, а в качестве белкового медикамента - протеин, способный к переходу в распрямленное состояние глобулы, при соотношении липида к протеину не менее 10:1. 2, Композиция по п. ^ о т л и ч а ю щ а я с я тем, что она имеет рН 3,0-7,5. 3. Композиция по п. 1, о т л и ч а ющ а я с я тем, что в качестве липосомного пузырька содержит фосфолипид, выбранный из группы, включающей: диолеилфосфатидилглицерол (DOPG), димиристоилфосфатидилглицерол (DMPG), дипальмитоилфосфатидилглицерол (DPPG), яичный фосфатидилглицерол, диолеилфосфатидилэтаноламин (DOPE), яичный фосфатидилэтаноламин, диолеилфосфатидовую кислоту (DOPA), димиристоилфосфатидовую кислоту (DMPA), дипальмитоилфосфатидовую кислоту (DPPA), диолеилфосфатидилсерин (DOPS), димиристоил . 2 фосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), яичный фосфатидилсерин, лизофосфатидилглицерол, лизофосфатидилэтаноламин и лизофосфатидилсерин. | 4. Композиция по п. 1, содержащая в качестве названного протеина цитокин. 5. Композиция по п. 4, содержащая цитокин, являющийся гематопоэтическим фактором. 6. Композиция по п. 5, о т л и ч а ющ а я с я тем, что гематопоэтический фактор выбран из группы, включающей гранулоцит колониестимулирующий фактор (G-CSF) и гранулоцит макрофаг колониестимулирующий фактор (GM-CSF). 7. Композиция по п. 5, о т л и ч а ющ а я с я тем, что гематопоэтическим фактором является G-CSF. 8. Композиция по п. 7, о т л и ч а ющ а я. с я тем, что G-CSF является природным человеческим G-CSF или продуктом прокариотной или эукариотной экспрессии клетки-хозяина. 9. Композиция по п. 7, о т л и ч а к> щ а я с я тем, что G-CSF является химически модицифированным. 10. Композиция по п. 9. о т л и ч аю щ а я с я тем, что химическая модификация G-CSF проведена полиэтиленгликолем. 11. Композиция по п. 1, о т л и ч аю щ а я с я тем, что она дополнительно содержит фармацевтически приемлемый носитель. 12. Композиция по п. 1, о т л и ч аю щ а я с я тем, что она дополнительно содержит в качестве названного протеина рекомбинантный G-CSF (rhG-CSF), полученный с помощью Е. соїі, а в качестве липосомного пузырька - DOPG при соотношении DOPG и rhG-CSF, соответствен Os О О 26640 но, 50:1 и дополнительно содержит 10 мМ гцетата натрия, и имеет рН 4,5. 13. Способ приготовления композиции, содержащей липосомный пузырек с введенным в него белковым медикаментом, о т л и ч а ю щ и й с я тем, что в качестве липосомного пузырька используют отрицательно заряженный фосфолипид, а в качестве белкового медикамента в него вводят протеин, способный к переходу в распрямленное состояние глобулы. 14. Способ по п. 13, о т л и ч а гащ и й с я тем, что указанная композиция имеет рН 3,0-7,5 и отношение липида к протеину не менее 10:1. 15. Способ по п. 13, о т л и ч а гащ и й с я тем, что в качестве липосомного пузырька используют фосфолипид, выбранный из группы, включающей: диолеилфосфатидилглицерин (DOPG), димиристоилфосфатидилглицерол (DMPG), дипальмитоилфосфатидилглицерол (DPPG), яичный фосфатидилглицерол, диолеилфосфатидил этанол амин (DOPE), яичный фосфатидилэтаноламин, диолеилфосфатидовую кислоту (DOPA), димиристоилфосфатидоаую кислоту (DMPA), дипальмитоилфосфатидовую кислоту (DPPA), диолеилфосфати дел сирин (DOPS), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), яичный, фос фатидилсерин, лизофосфатидилглицерон, лизофосфатидилэтаноламин и лизофосфатидилсерин. 16. Способ по п. 13, о т л и ч а гащ и й с я тем, что указанным протеином является цитокин. 17. Способ по п. 16, о т л и ч а гащ и й с я тем, что названный цитокин является гематопоэтическим фактором. 18. Способ по \,. 17, о т л и ч а гащ и й с я тем, что названный гематопоэтический фактор выбран из группы, состоящей из G-CSF и GM-CSF. 19. Способ по п. 18, о т л и ч а гащ и й с я тем, что названным гемопоэтическим фактором является G-CSF. 20. Способ по п. ^ . о т л и ч а ю щ и й с я тем, что G-CSF является природным человеческим G-CSF или продуктом прокариотной или эукариотной экспрессии клетки-хозяина. 21. Способ по п. 19, о т л и ч а гащ и й с я тем, что G-CSF является химически модифицированным. 22. Способ по п. 21, о т л и ч а гащ и й с я тем, что химическая модификация G-CSF проведена пол иэтиленгл и колем. 23. Способ по п. 13, о т л и ч а гащ и й с я тем, что в композицию дополнительно вводят фармацевтически приемлемый носитель. Изобретение относится к протеину: структурам фосфолипида, которые используют для стабилизации вторичной и третичной структуры протеинов, способных к переходу в распрямленное глобулярное состояние. В особенности, это изобретение относится к G-CSF: фосфолипидным композициям с повышенной стабильностью и способностью к использованию в GCSF рецептурах и новых поставляющих проводниках G-CSF. Обнаружено несколько видов протеинов, способных к переходу в распрямленное глобулярное состояние (MGS) (Van der Goot, F.G., Nature 354, 408-410 (1991)). Протеины в распрямленном глобулярном состоянии проявляют вторичную структуру, сравнимую со структурой природного протеина, однако у них отсутствует жесткап третичная структура (Pitsyn et al., FEBS Letters 262:1, 20-24 (1990)). В некоторых случаях переход в это состояние сопровождается раскрытием ранее скрытых гидрофобных звеньев протеина. При раскрытии критических гидрофобных остатков, MGS может находиться в промежуточном состоянии между агрегированием и осаждением протеинов. MGS-конформация может быть обнаружена при сравнении кругового дихроизма в дальнем УФ диапазоне со спектром ароматических боковых цепей (ближний УФ круговой дихроизм и флуоресценция). Распрямлгнное глобулярное состояние показывает спектральные изменения ароматических групп в отсутствие изменений дальнего УФ кругового дихроизма (Bychkova et al. FEBS Letters 238:231-234 (1988)) и может быть вовлеченным в мембранную проницаемость некоторыми видами протеинов {Bychkova et at. FEBS Letters 238:231-234 (1988); Van der Goot, F.G., Nature 354, 408-41C (1991)). 5 10 15 20 26640 Для перехода в MGS до агрегирования известны два вида протеинов: гранулоцит колониестимулирующий фактор (GCSF) и гранулоцит макрофаг колониестимулирующий фактор (GM-CSF). В то время, как эти два вида протеинов могут быть стабилизированы при некоторых определенных условиях, существует необходимость продления жизни этих материалов стабилизации вторичной и третичной структуры протеинов. Человеческий рекомбинантный G-CSF селективно стимулирует нейтрофилы, вид белых кровяных клеток, используемых для борьбы с инфекцией. Общепринято, Filgrastim, что рекомбинантный G-CSF является пригодным для использования в терапии. Структура G-CSF в различных условиях подверглась интенсивному изучению (Lu et al. ( J. Biol. Chem. Vol. 267, 8770-8777 (1992)). Ввиду гидрофобного характера трудно получить G-CSF с продолжительной жизнеспособностью. Рецептуры некоторых гидрофобных протеинов теряют свою активность в результате образования димера или агрегатов более высокого порядка (макроагрегатов) в процессе продолжительного хранения. Другие химические превращения, такие как деамидация и окисление, также могут возникнуть в процессе хранения. Кроме того, G-CSF формулятор должен защищать против денатурации и, в особенности, быть склонным к стабилизации вторичной и третичной структуры протеина. 5 10 15 20 25 30 35 Человеческий GM-CSF является 22-kDa гликопротеином, непрерывно требуемым для быстрого размножения in vitro клетокпредшественников макрофагов и гранулоцитов. Он также контролирует необрати- 40 мое превращение этих клеток-предшественников при образовании гранулоцитов и макрофагов. Другие виды биологической активности могут включать регулирование функциональной активности зрелых кле- 45 точных видов (Gough et al., Nature, 309, 763-767 (1934)) и увеличение химотаксиса по отношению к опознанным химоаттрактантам (Williams et al, Hematology, 4th ed. (1990)). GM-CSF также стимулирует обра- 50 эование моноцитов и поэтому может быть использован при лечении моноцитных расстройств, таких как моноцитопения. Человеческий GM-CSF может быть получен и очищен из нескольких источни- 55 ков. Способы получения рекомбинактного человеческого GM-CSF были описаны ранее Burgess et a!., Blood, 69:1, 43-51 (1987). Согласно цитируемому здесь патенту US 5047504 (Воопе) предлагается получение в промышленном масштабе GM-CSF в негликозилированной форме как продукт выражения прокариотной клетки-хозяина. Одним из путей, предпринятым ранее при работе с такими протеинами, как GCSF и GM-CSF, явилось использование лйпосом. Липосомы представляют собой полностью закрытые липидные двухслойные мембраны, образованные водонерастворимыми полярными липидами, особенно фосфолипидами. Пузырьки липосом могут иметь один единственный мембранный двойной слой (однослойные) или множество мембранных двойных слоев (многослойные). Двойной слой состоит из двух липидных монослоев, имеющих гидрофильную (полярную) "головную" зону и гидрофобную (неполярную) "хвостовую" зону, в которой гидрофобные хвосты ориентированы по направлению к центру двойного слоя, в то время как гидрофильные головы ориентированы по направлению к водной фазе. Стабильность, жесткость и проницаемости липосом может изменяться путем изменений фосфолипидной композиции или температуры, включением стирола или введением заряженных амфифил. Основная структура липосом может быть получена различными известными методами. В процессе своего образования липосомы могут захватывать растворенные в воде вещества в водных каналах и освобождать их с различной скоростью. После обнаружения способности липосом к введению энзимов в клетки и к изменению их метаболизма (Gregoriadis, New Engl. J. Med. 295, 704-710, 765-770 (1976)) липосомы были объявлены средством, отвечающим требованию целенаправленной доставки медикаментов. В результате наблюдается усиленное развитие исследований в фармацевтической индустрии, включающих использование липосом в качестве медленных поставщиков лекарств, витаминов и протеинов, секвитированных в гидрофобных слоях или в гидрофобном ядре липосом. Успешное использование липосом в качестве переносчиков медикаментов было ограничено, т.к. исследователи, предпринимающие попытки в направлении такого применения липосом, встретились с рядом проблем. Например, известна способность липосом действовать в качестве сильных иммунологических помощников по отношению к захваченным антигенам, и должны быть приняты меры предосторожности в том случае, когда липосомами захвачены энзимы или протеины ксеногенного происхождения. Кроме того, трудно 26640 контролировать скорость диффузии медикамента. Это является следствием природной нестабильности липосом и присутствия некоторых компонентов крови, которые ускоряют диффузию некоторых медикаментов. Помимо этого, по своей природе некоторые вещества слабо захватываются липосомами и поэтому быстро рассасываются при кровообращении. Наконец, существует проблема нацеливания на любые клетки или органы, кроме печени или селезенки. Замечательным обзором по липосомам, веществам, которые были введены в липосомы и проблемам, связанным с использованием липосом в качестве переносчиков медикаментов, является Gregory Gregoriadis, "Liposomes", Drug Carriers in Biology and Medicine, Chapter 14, 287-341 (Academic Press, N. Y., 1979). В то время как в области попыток использования липосом в качестве переносчиков медикаментов опубликовано много работ, мало публикаций появилось в области использования липосом с целью увеличения периода жизни терапевтических пептидов или протеинов путем стабилизации структуры пептидов и/или протеинов. В PCT/US90/05163 "Терапевтические пептиды и протеины", Hostetler et a!. описано использование пустых липосом в качестве фармацевтически пригодных разбавителей для растворения попипептидов и/или протеинов с целью предотвращения аккумуляции полипептидов и/или протеинов на поверхности раздела воздух/вода и для' предотвращения адсорбции полипептидоа и/или протеинов на поверхности контейнера. Hostetler et at. описывает, что отрицательно заряженные фосфолипиды могут быть добавлены в количестве до около 50 мол. %, и что предпочтительными липосомами являются фосфатидилхолин, нейтральный фосфолипид. Hostetler et al. не описывает разбавителя, способного стабилизировать структуру полипептида и/или протеина, 5 10 15 20 25 30 35 40 45 В PCT/US91 /07694 "Получение и характеристика липосомных рецептур фактора некрозного новообразования (TNF)", 50 Hung et al., описана липофильная молекула фактора некрозного новообразования, связанная с поверхностью или инкапсулированная внутри липосомы. Липосомные липофильные TNF молекулы опи- 55 саны как имеющие повышенную стабильность in vivo. Стабильность рассматривается как уменьшение или как тенденция к уменьшению TNF-липосомы выделять TNF в систему in vrvo. Предпочтительными 8 липосомами были нейтральные липиды. Heing et al. не описывают композиции TNF, в которой наполнители (excipients) оказывают стабилизирующее действие на структуру протеина. В литературных источниках отсутствуют какие-либо сведения, касающиеся контактирования протеина, например GCSF, с отрицательно заряженными лузырьками (полостями) липид, в результате которого непосредственно стабилизируется протеин против термической агрегации, денатурации, потери активности и развертывается вторичная структура. Существует потребность в таких композициях, которые могут быть испол'хзованы в технологических процессах, требующих высоких температур, а также в качестве новых поставщиков (например, оральное применение лекарств, закрепленных в G-CSF). Настоящее изобретение касается таких композиций. Настоящее изобретение направлено на добавление гидрофобных эксипиентов, например, лизофосфолипидов или других липосом, к протеину в условиях расплавленного глобулярного состояния для стабилизации вторичной и третичной структуры протеина, защищая таким образом протеин против термической агрегации, денатурации и потери активности. В особенности целью изобретения являются стабильные С-С5Р:фосфолипидные композиции. Неожиданно оказалось, что предпочтительные G-CSF композиции могут быть несколько раз подвергнуты циклическому изменению температуры в диапазоне 10-95сС с последующим полным восстановлением вторичной структуры протеина после охлаждения. Эти композиции имеют двойное преимущество: быть полезными при технологических процессах, требующих высоких температур, а также при использовании в новых поставщиках G-CSF. В предпочтительном варианте, комплекс прогеин:фосфолипид включает отрицательно заряженную липосому, выбранную из группы: диоле ил фосфати дилглицерол (DOPG), димиристоилфосфатидилглицерол (DMPG), дипальмитоилфосфатидилглицерол (DPPG), яичный фосфатидияглицерол, диолеилфосфатидилэт аноламин (DOPE), яичный фосфатидилэтаноламин, диолеилфосфатидовая кислота (DOPA), димиристоилфосфатидовая кислота (DMPA), дипальмитоилфосфатидовая кислота (DPPA), диолеилфосфатидилсерин (DOPS), димиристоилфосфатидилсєрин (DMPS), дипальмитои л фосфатиди л серии (DPPS), яич 26640 ный фосфатидилсерин, лизофосфитодилглицерол, лизофосфатидилэтанолзмин и лизофосфатццилсерин. DOPG, отрицательно заряженный ненасыщенный фосфолипид, является осо- 5 бенно предпочтительным. Согласно изобретению рН поддерживают в пределах Э 07,5, а отношение липид:протеин не менее 10:1. Дополнительным элементом, соглас- 10 но предпочтительному варианту изобретения, является использование химически модифицированных протеинов в составе комплекса протеикфосфолипид, а также использование одного или нескольких из 15 следующих агентов:агент, устанавливающий изотонию, буферный агент и агент, устанавливающий рН. Специалисту понятно, что изобретение включает стабильные композиции протеин;фосфолипид с раз- 20 личным сочетанием дополнительных элементов. На фиг. 1 изображен спектр флуоресцентной эмиссии rhG-CSF в присутствии (кривая 1) и е отсутствии (кривая 2) пу- 25 зырьков DOPG. Концентрация DOPG:rhGCSF равна 0,2 мг/мл. Молярное отношение DOPG:rhG-CSF (кривая 1) равно 100:1. На фиг. 2(а) показано влияние увеличения отношения лмпид: протеин на rhG- 30 CSF флуоресценцию. Fo означает исходную флуоресценцию (без липида) и F означает флуоресценцию после добавления липида для достижения указанного молгрного отношения F/Fo(n) и максимум 35 длины волны эмиссии (Д) для смесей DQPG:rhG-CSF. На фиг. 2(в) показано отношение F/Fo(n) и максимум длины волны эмиссии (Д) для смесей DOPG:rhG-CSF. На фиг. 3 показана кривая Стерн- 40 Волмера (Stern-Volmer) затухания rhG-CSF флуоресценции посредством KJ в отсутст-. вии (о) и в присутствии (о) пузырьков DOPG. Эксперимент по затуханию проводился добавлением равных порций KJ к 45 rhG-CSF (0,2 мг/мл) и DOPG:rhG-CSF 100:1. На фиг. 4 показано затухание rhGCSF флуоресценции триптофана при добавлении пирендекановой кислоты {pyrene decanoic acid). Длина волны эмиссии рав- 50 на 327 нм. Молярное отношение DOPG:rhGCSF равно 100:1. Фиг. 5 представляет собой график, показывающий в сравнении изменения F интенсивности для rhG-CSF в отсутствии, 55 и в присутствии различных липидов. В каждом случае молярное отношение липид:прогеин равно 100:1. Фиг. 6 представляет собой график, показывающий в сравнении сдвиги мак 10 симумов эмиссии для rhG-CSF в отсутствии и в присутствии различных липидов. В каждом случае молярное отношение липид:протеин равно 100:1. На фиг. 7 показано влияние DMPC (кривая 2), DMPG (кривая 3) и DMPA (кривая 4) на CD rhG-CSF (кривая 1). В каждом случае молярное отношение липид:протеин в воде равно 50:1, рН 6,0. На фиг. 8 показано влияние повышения температуры на CD rhG-CSF {кривая 1) и DOPG:rhG-CSF (140:1 молярное) (кривая 2). Концентрация rhG-CSF в воде равна 80 мг/мл, рН 6,0. Температура изменялась в пределах 10-90°С со скоростью 100°С/ч. На фиг. 9 показана дифференциальная сканирующая калориметрическая термограмма для rhG-CSF (кривая 1) и DOPG:rhG-CSF (45:1 молярное) (кривая 2) Концентрация rhG-CSF в образцах равна 1 мг/мл, рН 7,0 в воде. Скорость сканирования 90°С/ч. На фиг. 10 показано влияние циклического изменения температуры на CD rhGCSF (кривая 1) и DOPG:rhG-CSF (140:1 молярное) (кривая 2). Образцы быстро нагревали до 95оС и охлаждали до 10°С как показано стрелками. Концентрация rhG-CSF в образцах равна 30 мг/мл, рН 6,0. На фиг. 11 показано влияние циклического изменения температуры на CD rhG-CSF (кривая 1) и DMPG:rhG-CSF (150:1 молярное) (кривая 2). Образцы нагревают до 95°С и охлаждают до 10°С. Концентрация rhG-CSF в образцах равна 80 мг/мл, рН 6,0. На фиг. 12 показано влияние температурных циклов на CD rhG-CSF (кривая 1) и DPPG:rhG-CSF (150:1 молярное) (кривая 2). Образцы нагревают до 95°С и охлаждают до 10°С. Концентрация rhG-CSF в образцах равна 80 мг/мл, рН 6,0. Фиг. 13 изображает график, покаэывающий способность различных липидов к стабилизации rhG-CSF в процессе замораживания-сушки. Отношение липид: протеин в каждом случае равно 100:1. Стабильность определялась nq сохранению активности in vitro в образце костного мозга. Один rhG-CSF не выдерживает процесса замораживания-сушки, поэтому контрольным образцом является необработанный rhG-CSF в отсутствии липида. На фиг. 14 показано влияние различных липидов на активность in vitro rhGCSF. Активность (в расчете на WBC) измеряли после подкожной инъекции хомячков. Доза rhG-CSF равна 100 мг/кг при отношении липид:протеин 100:1. 11 26640 На фиг. 15 показано влияние различных липидов на активность in vitro rhGCSF. Активность {в расчете на WBC) измеряли после подкожной инъекции хомячков. Доза rhG-CSF равна 100 мг/кг при отношении липид:протеин 50:1. • На фиг. 16 изображен график, показывающий сравнительное изменение СНОG-CSF в отсутствии и в присутствии DOPG при различном рН. В каждом случае молярное отношение липид:протеин равно 100:1. На фиг. 17 изображен график, показывающий сравнение сдвигов максимумов эмиссии для CHO-G-CSF в отсутствии и в присутствии DOPG при различном рН. В каждом случае молярное отношение липид:протеин равно 100:1. На фиг. 18 показано влияние температурных циклов на CD PEG-G-CSF (-) и DMPG.PE-G-CSF (17:1 молярное) (- -). Образцы нагревают до 90°С и охлаждают до 10°С. На фиг. 19 показано: а) влияние температурных циклов на CD GM-CSF в PBS, рН 7,0. GM-CSF при 10°С (-) сравнительн о с GM-CSF, который нагревают до 90°С и охлаждают до 10°С (- -); б) влияние температурных циклов на CD DPPG:PEGG-CSF (17:1 молярное). DPPG:GM~CSF при 10°С (-) сравнивают с DPPG:GM-CSF, который нагревают до 90°С и затем охлаждают до 10°С (- -). Композиция по изобретению иллюстрируется нижеследующими примерами. Примеры показывают различные аспекты изобретения и включают данные испытаний по стабильности и биологической активности различных протеин: фосфолипидных композиций. Взаимодействие протеинов с липидными пузырьками непосредственно стабилизирует протеиновую структуру протеина, оказывая, таким образом, стабилизирующее воздействие на протеин даже в условиях, приводящих к денатурации протеина в отсутствии липида. Предполагается использовать различные протеины, способные переходить в распрямленное глобулярное состояние. Примерами предполагаемых протеинов являются цитокины, включая различные гематопоэтические (hematopoietie) факторы, такие как упомянутые выше G-CSF, GMCSF, M-CSF, интерфероны (альфа, бета и гамма), интерлейкины (1-11), эритропоэтин (ЕРО), фактор роста фибробластов, клеточный фактор (stem all factor), фактор роста нерва, BDNF, NT3, полученный из тромбоцита фактора роста, и фактор роста опухолевых новообразований (альфа, 5 10 15 20 25 30 35 40 45 50 55 12 бета). Другие протеины могут быть оценены по способности к переходу в MGS. Если такой протеин способен к превращению в MGS, то такой протеин может затем быть приведен в контакт с пузырьками отрицательно заряженной липосомы и определен эффект стабилизации. В общем случае G-CSF может быть в нативной форме, выделенной в чистом виде из организма млекопитающих, или, альтернативно, может быть продуктом химического синтеза или продуктом эукариотной или прокариотной экспрессии клетки хозяина экзогенной последовательности ДНК, полученной геномным или сДНК клонированием или генным синтезом. Подходящие прокариотные хозяева включают различные бактериальные клетки (например, Е. coli). Подходящие эукариотные хозяева включают дрожжи (например, S. cerevisiae) и клетки млекопитающих (например, яичника китайского хомячка, обезьяны). Б зависимости от используемого хозяина, продукт G-CSF выражения может быть гликозилирован млекопитающими или другими эукариотными карбогидратами, или может быть негликозилирован. Изобретение предполагает использование любых или всех таких форм G-CSF, хотя предпочтительным, с точки зрения наибольшей коммерческой практичности, является рекомбинантный G-CSF, особенно полученный Є.со!і. G-CSF, который подвергают химической модификации с целью использования в настоящем изобретении, может быть также либо природным человеческим G-CSF (nhG-CSF), либо продуктом рекомбинантного процесса нуклеиновой кислоты, такого, как выражение прокариотной или эукариотной клетки хозяина. В общем случае, предполагаемой химической модификацией является присоединение химической половины к самой молекуле G-CSF. Обзорной статьей, описывающей модификацию протеина и слияние протеинов является Francis, Focus on Growth Factors 3; 4-10 (май 1992) (опубликовано Mediscript, Mountview Court, Frun Barnet Lane, London №20 OLD, UK). Например, ЕР 0401384 "Chemically Modified Granulocyte Colony Stimulating Factor, в которой описаны материалы и методы приготовления G-CSF, к которой присоединены молекулы полиэтиленгликоля. Присоединение может быть непосредственным связыванием с протеином или к половине, действующей в качестве мостика для активного агента. Наиболее предпочтительной, как 13 26640 наиболее стабильной, является ковалентная связь. Химическая модификация может способствовать контролируемому, длительному или расширенному эффекту GCSF. Это может приводить, например, к контролированию времени, необходимого для достижения химически модифицированным G-CSF свернутого в клубок положения. Примером химического модификатора является полиэтиленгликолевые композиции, включая их производные. По изобретению предполагается использовать любые химически модифицированные G-CSF препараты, эффективные при применении. Эффективность может быть определена различными методами, известными специалисту. Предпочтительными являются пегилированныи (pegyfated) G-CSF, в особенности полученный E.coli G-CSF и, еще более предпочтительно, тритетра пегилированныи полученный E.coli G-CSF. G-CSF описан как наиболее стабильный 8 кислой среде, несмотря на то, что при рН 2,5-5,0 происходит конформационное изменение, сопровождающееся потерей третичной структуры и повышением содержания альфа спиральной формы (Narhi et al. f J. Protein Chem. 10, 359367 (1991). Это конформационное изменение характерно для распрямленного глобулярного состояния (MGS). Так, как это происходит в случае работы препарата с другими протеинами, способными к превращению в MGS, препаратор, имеющий депо с G-CSF, должен принимать защитные меры против термического распрямления вторичной и третичной структуры для предотвращения агрегации и денатурации. GM-CSF, пригодный для использования по изобретению, может быть нативной формой, выделенной в чистом виде из организма млекопитающих, или продуктом прокариотной или эукариотной экспрессии клетки хозяина экзогенной последовательности ДНК, полученной reномом или сДНК клонированием, или генным синтезом. Подходящие прокариотные хозяева включают различные бактериальные клетки (например, E.coli). Подходящие эукариотпые хозяева включают дрожжи (например, S. cerevisiae) и клетки млекопитающих (например, яичника китайского хомячка, обезьяны). В зависимости от используемого хозяина, продукт GMCSF выражения может быть гликозилироэан млекопитающим или другими эукариотными карбогидратами, или может быть негликозилирован. Изобретение предполагает использование любых и всех таких форм GM-CSF, хотя предпочтительным яв 5 10 15 20 25 30 35 40 45 50 55 14 ляется рекомбинантный GM-CSF, в особенности полученный Е colt, по соображениям коммерческой практичности. Липидные пузырьки, используемые в композициях по изобретению, являются отрицательно заряженными липосомами, способными к взаимодействию с протеином. Предпочтительными являются следующие липосомы: диолеилфосфатидилглицерол (DOPG); димиристсилфосфатидилглицерол (DMPG); дипальмитоилфосфатидилглицерол (DPPG); яичный фосфатидилглицерол; диолеилфосфатидилэтаноламин (DOPE); яичный фосфатидилзтаноламин; диолеилфосфатидовая кислота (DOPA); димиристоилфосфатидовая кислота (DMPA); дипальмитоилфосфатидовая кислота (DPPA); диоле ил фосфатиди лее рин (DOPS); димиристоилфосфатидилсерин (DMPS); дипальмитоилфосфатидилсерин (DPPS); яичный фосфатидилсерии; лизофосфатидилглицерол; лизофасфатидилэтаноламин; лизофасфатидилсерин. В предпочтительном варианте с использованием E.coli полученного rhGMCSF, липосомным пузырьком является DMPG с отношением DMPG:GM-CSF 17:1, при рН 7,0 в растворе фосфатного буфера •$л-*. 71 V О 325 320 о о о ш ш ш ш о о о с п с л 0 . ( 1 0 . 0 . 0 . 0 . 0 . ( 1 0 , 0 . 0 . 0 . O 2 Q L O O 0 . £ O 2 Q - O 2 Q Q Q Q Q Q Q Q Лигоад Wlrli «О. Q Q Q O = СП Iч * 26640 1.000E+01 і і і і—і—і—і—і—і—і—і і CD [mdeg] і -2.000E+02 і і—і—I—і—і—і і «Г.7 1 J і ' I • I < l -4.70E+5 1 / • • I A Ц65Е«6 » * - - — • -2JB2E+6 I . I 10 2 20 30 і L— ' 40 ' £0 Теьпермура • I 60 • 70 ЇИГ.8 1 60 90 26640 -O.001 -0.002 (У т .о, Q -О.003 -0.004 -0.005 10 20 30 40 50 60 90 70 «ИГ.9 0.00E+0 І і і і і і і і і і і їй і і і і і і і 100 26640 1.000E+01 і і і І 205 і І і Ї I і It і і I I і I 1 ! І Длина волны, км ФИГ. 1 1 І [ I I I I I t I I t 26640 II I I I I I I I I I I 1 I I II І І ї І І І I 1 І І І І І I I I 1 I I I CD [mdeg] -1.300Е+02 205 І Длина волны, нм ФИГ.12 І І І І *І І І І 1 І І І 260 26640 О) g G-CSF DOPG:G-CSF (100:1) DMPG:G-CSF (100:1) DPPG:G-CSF (100:1) 40 30 10 25 SO Ереын, ч 75 «ИГ.14 100 с UA „„ _26£4_0_ с CJ л УКРАЇНА
ДивитисяДодаткова інформація
Автори англійськоюCollins David, Cha Younsik
Автори російськоюКоллинз Девид, Ча Янсик
МПК / Мітки
МПК: A61K 38/19, A61K 9/127
Мітки: нього, містить, білковий, приготування, введений, медикамент, композиція, спосіб, пухирець, ліпосомний
Код посилання
<a href="https://ua.patents.su/72-26640-kompoziciya-shho-mistit-liposomnijj-pukhirec-ta-vvedenijj-u-nogo-bilkovijj-medikament-i-sposib-prigotuvannya.html" target="_blank" rel="follow" title="База патентів України">Композиція, що містить ліпосомний пухирець та введений у нього білковий медикамент, і спосіб її приготування</a>
Попередній патент: Спосіб і установка для отримання заліза із сполук заліза
Наступний патент: Ємність для пакування стрічкових магнітних носіїв запису, які намотані на серцевину
Випадковий патент: Спосіб профілактики цукрового діабету та його ускладнень