Піридазинохіноліни, спосіб їх одержання (варіанти), проміжні сполуки, фармацевтична композиція (варіанти) для лікування або профілактики нейродегенеративних порушень та способи лікування
Номер патенту: 60291
Опубліковано: 15.10.2003
Автори: Девенпорт Тімоті Вейн, Бер Томас Майкл, Спаркс Річард Брюс, Емпфілд Джеймс Рой, МакКінні Джеффрі Алан
Формула / Реферат
1. Пиридазинохинолины формулы II или их фармацевтически приемлемые соли и таутомеры:
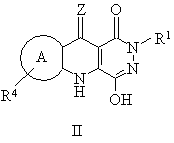 ,
,
где:
Z выбран из О, S или NH, или, когда кольцо В N-таутомеризовано, группа Z может быть выбрана из Н, ОН, SH или NH2,
кольцо А выбрано из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, как незамещенного, так и замещенного у одного или нескольких кольцевых атомов углерода радикалом R4, где R4 независимо выбран из группы, включающей галоген, (С1-С4)алкил, NO2, CN, (C1-С3)перфторалкил, ОН, ОСF3, (С2-С4)алкенил, (С2-С4)алкинил, O(С1-С4)алкил, NR'R'', SO2NR'R'' или SOmR', NR'COR'', COR'', NR'CO2R'', CO2R', CONR'R'', 5-7-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранные из О, N или S, или его арил или гетероарилбензпроизводное, где атом азота гетероциклического кольца необязательно замещен R', и атом углерода или азота гетероциклического кольца может быть замещен R или R', или атом углерода может быть дизамещен с образованием С5-С7 спирогруппы, или атом углерода или атом серы могут быть замещены О с образованием карбонильной группы или сульфонильной группы (S(O)m), при условии, что атом азота гетероциклической группы не может быть присоединен к атому азота трициклической кольцевой системы;
R1 представляет собой -(CH2)nL, где L обозначает M;
M представляет собой фенил или его бензпроизводные, и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -О(С1-4С)алкила, -О(С2-С4)алкенила, -O(С2-С4)алкинила, -О(С0-С6алкил)фенила, -ОН, -галогена, -NO2, CN, -СF3, -(С1-4С)алкилСF3, винила, тетразолила, -NH(CO)R', -(С1-4С)алкила, -NR'R'', -СO2R', -CONR'R'', -SOmR' , -SO2NR'R'', (C1-C6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси-, окси(С1-6С)алкилокси, который может образовывать циклическое кольцо, присоединенное к фенильному кольцу в ортоположении, арилокси(С1-С4)алкилокси(С1-С4)алкил, (С1-С6)алкилокси(С1-С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси(С1-С6)алкилокси-, -O(С1-С6алкил)NR'R'', -NR'(C1-С6алкил)NR'R'', -(C1-С6алкил)NR'R'', -О(С1-С4)перфторалкил, -(С1-С4)перфторалкил, NR'(С1-С6алкилокси), -NR'(С1-С6алкилгидрокси), -(С1-С4алкил)окси(С1-С4алкил), -О(С1-С4алкил)COOR', -(СН)nNR'R''COOR', где n равно 1-4, -(С1-С4алкил)NR'R'', -(С1-С4алкил)OR', -NR'(CH2)nCOOR', -S(O)m(С1-С4алкил)окси(С1-С4алкил), -S(О)m(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил);
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических групп и их бензпроизводных, включая пиридил, тиенил, фуранил или группы, содержащие два гетероатома, выбранные из N, О или S, такие как пиразол, имидазол, изоксазол, оксазол, тиазол или изотиазол (и их окисленные производные, выбранные из S(O)m, где m равно 1 или 2), пиридазин, пиримидин, пиразин, или группы, содержащие три гетероатома, выбранные из N, О или S, такие как триазол или оксадиазол или триазин, или группы, содержащие четыре гетероатома, такие как тетразол, где N в гетероарильной группе необязательно замещен радикалом R, и заместители ароматических групп включают обычные заместители ароматических групп, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(СН2)n через атом углерода или гетероатом на гетероарильной группе;
n равно 0;
R выбран из H или (1-4С)алкила;
R' и R'' независимо выбраны из Н, (С1-С4)алкила, где алкил включает алкенил(С2-С4) и алкинил(С2-С4); (С3-С6)циклоалкил, фенил(С0-С4)алкил-, гетероцикл(С0-С4)алкил- или гетероарил(С0-С4)алкил-, где фенил или гетероарил определены выше, и гетероцикл выбран из пяти- и/или шести- и/или семичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранные из О, N или S, или арила или его гетероарилбензпроизводного, и любая из вышеуказанных групп необязательно замещена по одному или нескольким атомам углерода галогеном, Н, (С1-С4)алкилом, (С3-С6)циклоалкилом, фенилом, NO2, CN, СF3, ОН, O(С1-С4)алкилом, NR'R''S(O)mR' или SO2NR'R'', где NR'R'' может необязательно образовывать с атомом азота кольцо N-алкил(С1-С3)оксиалкил(С2-С3);
m выбран из 0-2.
2. Соединение по п. 1 и его фармацевтически приемлемые соли и таутомеры, где:
Z выбран из О, S или NH;
кольцо А выбрано из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, пирролила или тиенила, как незамещенного, так и замещенного у одного или нескольких атомов углерода кольца радикалом R4, где R4 независимо выбран из группы, содержащей галоген, (С1-4С)алкил, NO2, CN, (С1-С3)перфтороалкил, ОН, ОСF3, (С2-С4)алкенил, (С2-С4)алкинил, О(С1-С4)алкил, NR'R'', SO2NR'R'' или SOmR';
R1 представляет собой -(CH2)nL, где
L выбран из:
фенила или его бензпроизводных и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -O(С1-С4)алкила, -О(С2-С4)алкенила, -О(С2-С4)алкинила, -O(С0-С6алкил)фенила, -ОН, -галогена, -NO2, -CN, -СF3, -(С1-С4)алкилСF3, винила, тетразолила, -NH(CO)R', -(С1-С4)алкила, NR'R'', -CO2R', -CONR'R'', -SOmR', -SO2NR'R'', (C1-C6)алкилокси (C1-C6)алкилокси-, гидрокси(C1-C6)алкилокси-, окси(С1-С6)алкилокси, который может образовывать циклическое кольцо, присоединенное к фенильному кольцу в ортоположении, арилокси(С1-С4)алкилокси(С1-С4)алкила, (C1-C6)алкилокси(C1-C6)алкилокси(С1-С6)алкилокси-, гидрокси(C1-C6)алкилокси(C1-C6)алкилокси-, -О(C1-C6aлкил)NR'R'', -NR'(C1-C6aлкил)NR'R'', -(C1-С6алкил)NR'R'', -О(С1-С4)перфторалкила, -(С1-С4)перфторалкила, -NR'(C1-С6алкилокси), -NR'(C1-С6алкилгидрокси), -(С1-С4алкил)окси(С1-С4алкил), -O(С1-С4алкил)COOR', -(CH)nNR'R''COOR', где n равно 1-4, -(С1-С4алкил)NR'R'', -(С1-С4алкил)ОR', -NR'(CH2)nCOOR', -S(O)m(Cl-С4алкил)окси(С1-С4алкил), -S(O)m(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил)окси(Cl-С4-алкил);
гетероарила, где гетероарил выбран из незамещенных или замещенных ароматических групп и их бензпроизводных, включая пиридил, тиенил, фуранил, или группы, содержащие два гетероатома, выбранные из N, О или S, такие как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол, или группы, содержащие три гетероатома, выбранные из N, О или S, такие как триазол или оксадиазол, или группы, содержащие 4 гетероатома, такие как тетразол, где N в гетероарильной группе необязательно замещен радикалом R, и заместители ароматических групп включают обычные заместители ароматических групп, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(СН2)n через атом углерода или гетероатом на гетероарильной группе;
n равно 0; R, R', R'' и m такие, как определено в п. 1.
3. Соединение по п. 2, где L выбран из группы, включающей:
фенил, 4-метоксифенил, 4-гидроксифенил, 4-хлорфенил, 4-метилфенил, 4-изопропилфенил, нафтил, 4-фторфенил, 4-бромфенил, 2-метоксифенил, 2-гидроксифенил, 3-метоксифенил, 3-гидроксифенил, 4-трифторметоксифенил, 3-хлор-4-метоксифенил, 5-метокси-3-пиридил, 4-S(О)mR'фенил, где m равно 0-2 и R' представляет собой метил; 3-хлорфенил, 3-хлор-4-гидроксифенил, 2-метил-4-хлорфенил, 3-метилфенил, 2-метилфенил, 3-фторфенил, 2,4-дифторфенил, 3,5-трифторметилфенил, 3-нитрофенил, 2-фторфенил, 2,4-диметилфенил, 3-хлор-4-метилфенил, 4-трифторметилфенил, 4-йодфенил, 3,4-диметилфенил, 3,4-диметоксифенил, 2-метил-4-метоксифенил, 2-метокси-4-бромфенил, 2-метил-4-гидроксифенил, 4-этилфенил, 2,3-диметилфенил, 3,4-дигидроксифенил, 2,4-диметоксифенил, 2,4-дихлорфенил, 4-нитрофенил, 2,5-диметоксифенил, 2,5-диметилфенил, 4-оксибензилфенил, 2,5-дигидроксифенил, 4-винилфенил, 2,5-дифторфенил, 2-метил-4-фторфенил, 3,5-диметоксифенил, 4-карбоксифенил, 4-карбоксамидофенил, 4-(N,N-диэтилкарбоксамидо)фенил, 4-цианфенил или 4-тетразолфенил.
4. Соединение по п. 3, выбранное из группы, включающей:
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион; и
7-хлор-4-гидрокси-2-(фуран-2-илметил)-l,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
или их фармацевтически приемлемые соли.
5. Соединение по п. 4, представляющее собой 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион или его фармацевтически приемлемые соли.
6. Соединение по п. 5, выбранное из группы, включающей:
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-l,10-дион, N-метилглюкаминовая соль;
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион, натриевая соль; и
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-l,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион, соль холиновой кислоты.
7. Соединение по п. 6, представляющее собой натриевую соль 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-1,10-диона.
8. Соединение по п. 3, выбранное из группы, включающей:
7-хлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
4-гидрокси-8-нитро-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-хлорфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-изопропилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7,9-дихлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(1-нафтил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
2-(4-бромфенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-(2-метоксипирид-5-ил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
или их фармацевтически приемлемые соли.
9. Соединение по п. 3, выбранное из группы, включающей:
2-(4-бензилоксифенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-дихлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-гидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидрокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-хлор-2-метилфенил)-4гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-тиометоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,3-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-этилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-фтор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-йодфенил)-l,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-бром-2-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-[3,5-ди(трифторметил)фенил]-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-нитрофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-нитрофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-сульфонилметилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2,5-дигидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбоксамидофенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-тетразолфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-[4-(N,N-диэтилкарбоксамидо)фенил]-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
или его фармацевтически приемлемые соли.
10. Соединение по п. 2, выбранное из группы, включающей:
7-хлор-2-(4-этоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-изопропилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-(4-карбоксиметилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
или его фармацевтически приемлемые соли.
11. Соединение по п. 1 для использования в медицине.
12. Соединение по п. 1 для приготовления лекарства для лечения припадка или эпилептических конвульсий или поражений или состояний, связанных с поступлением избытка кальция в мозг.
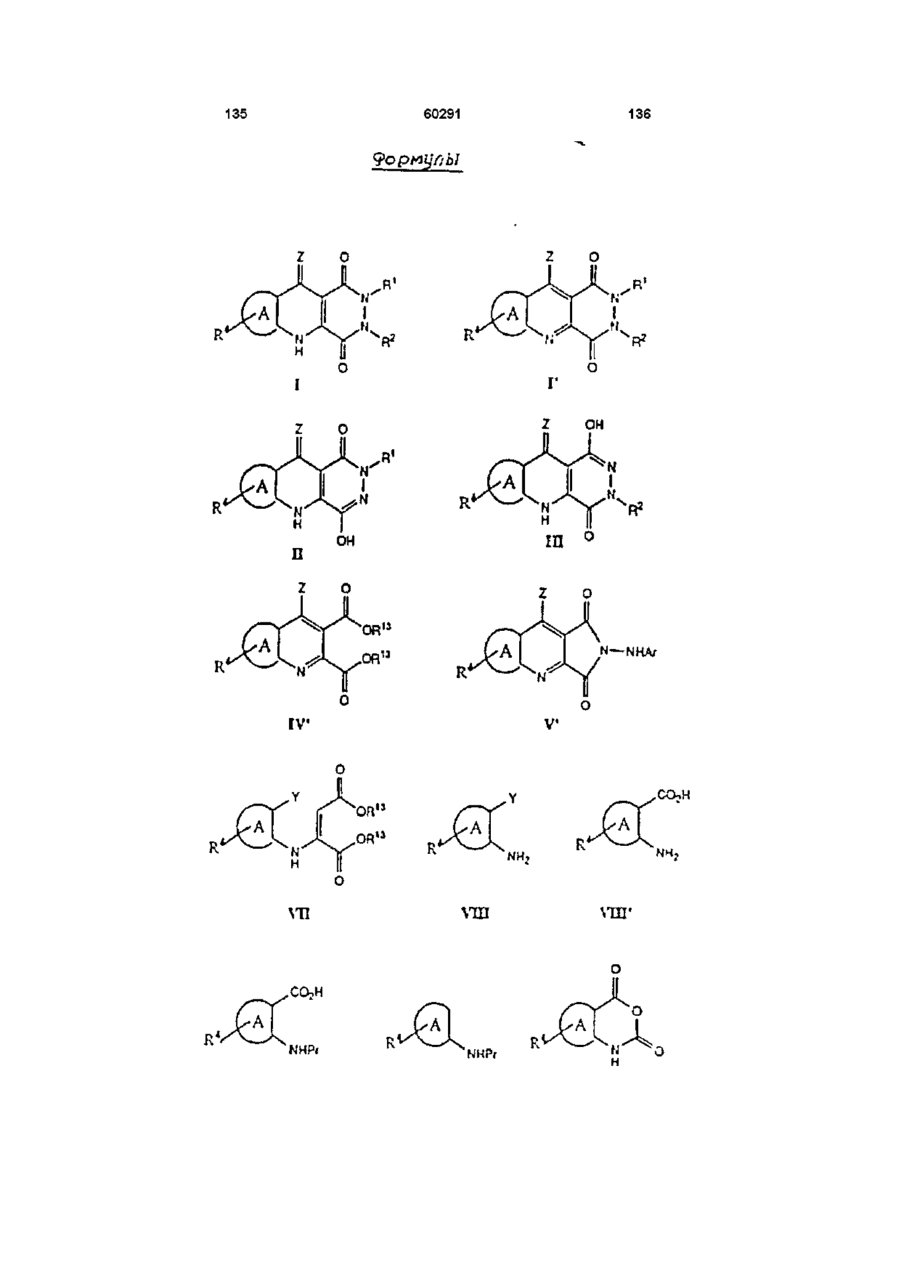
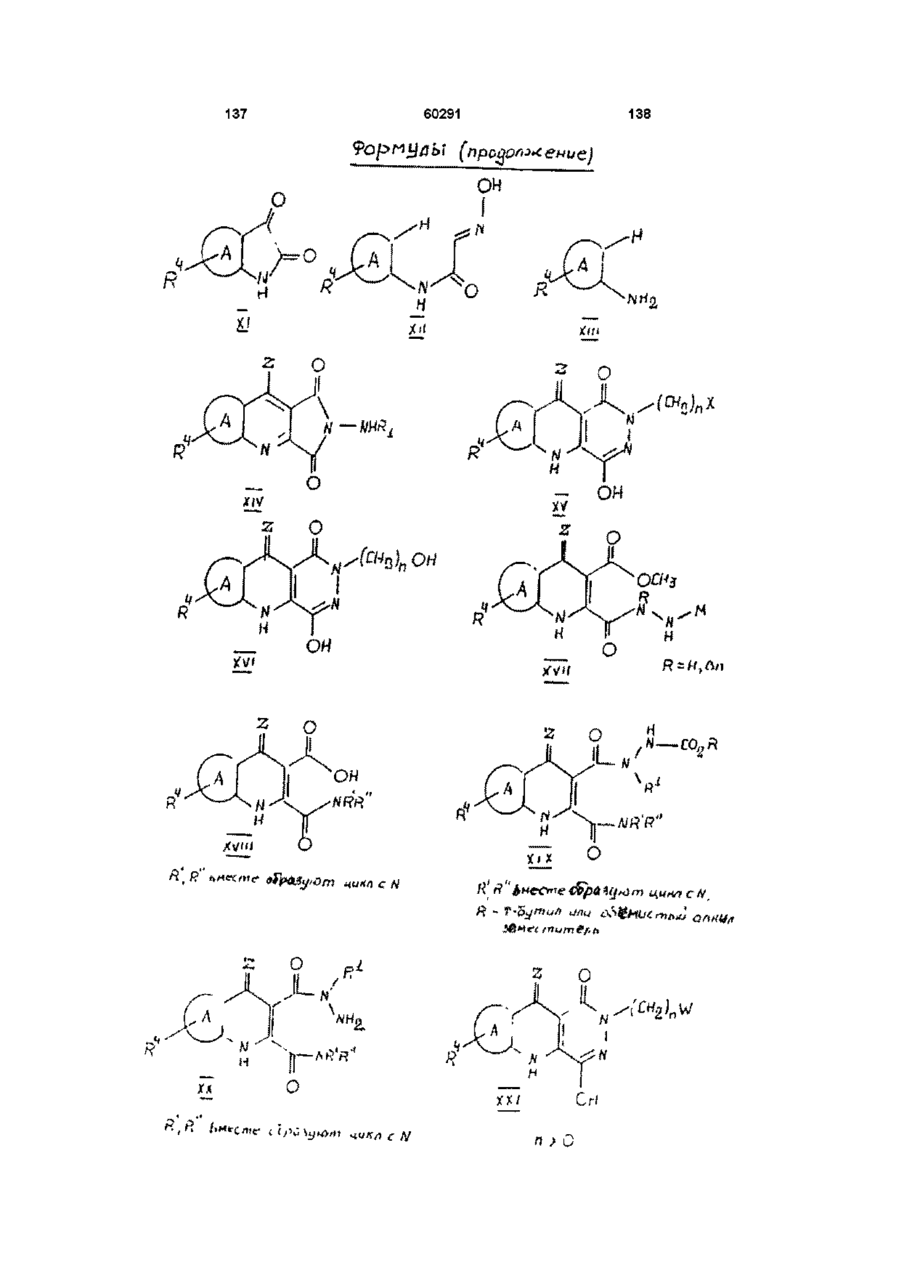
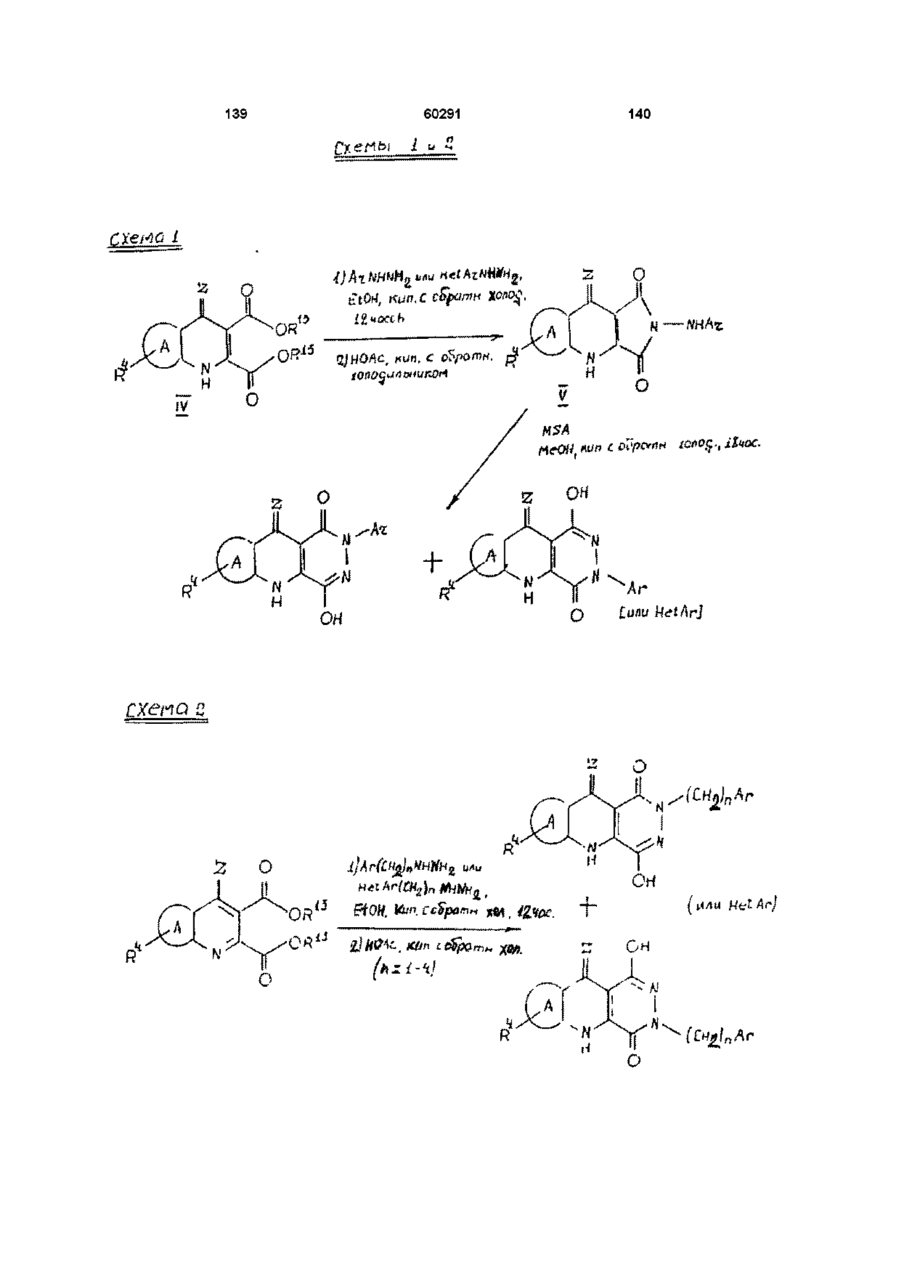
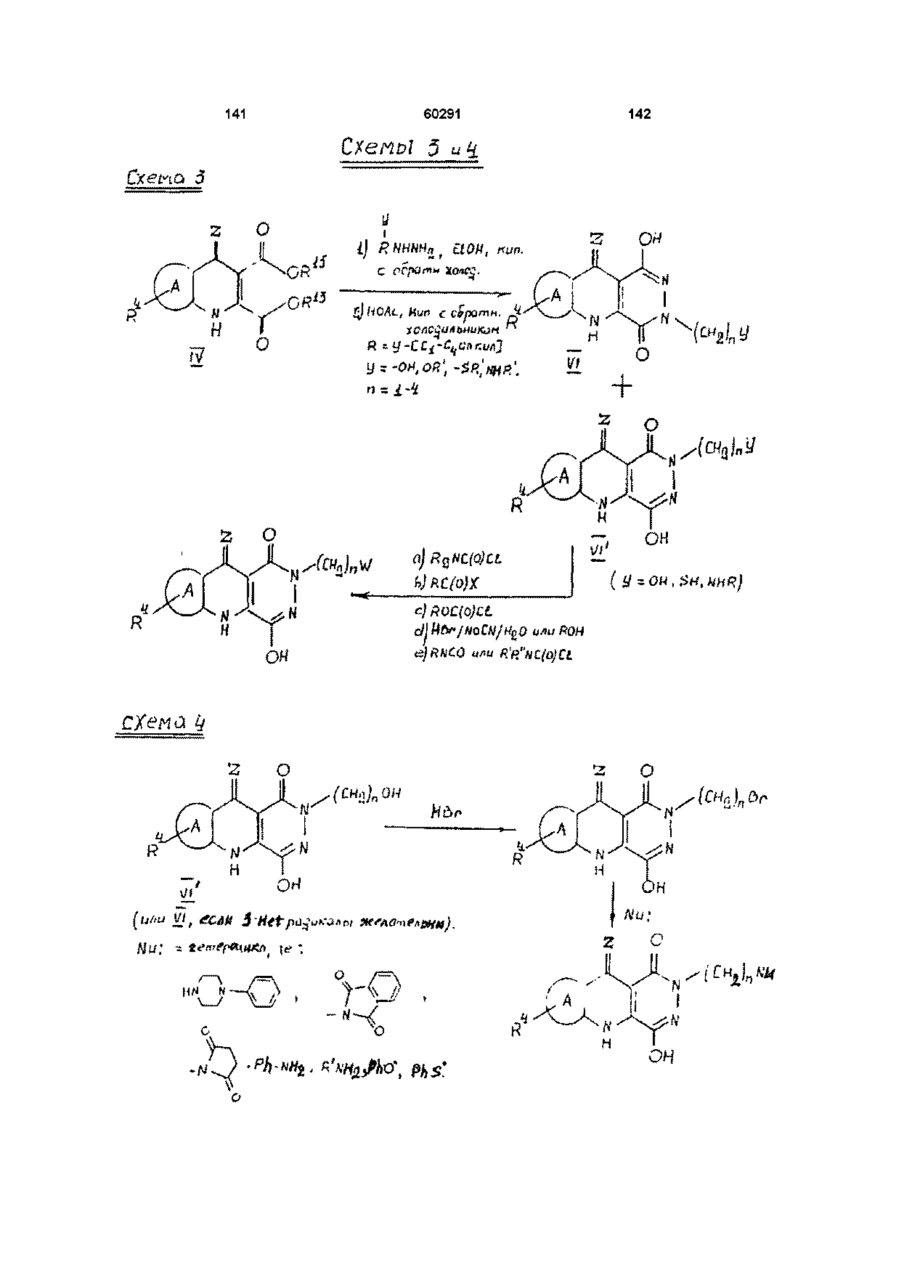
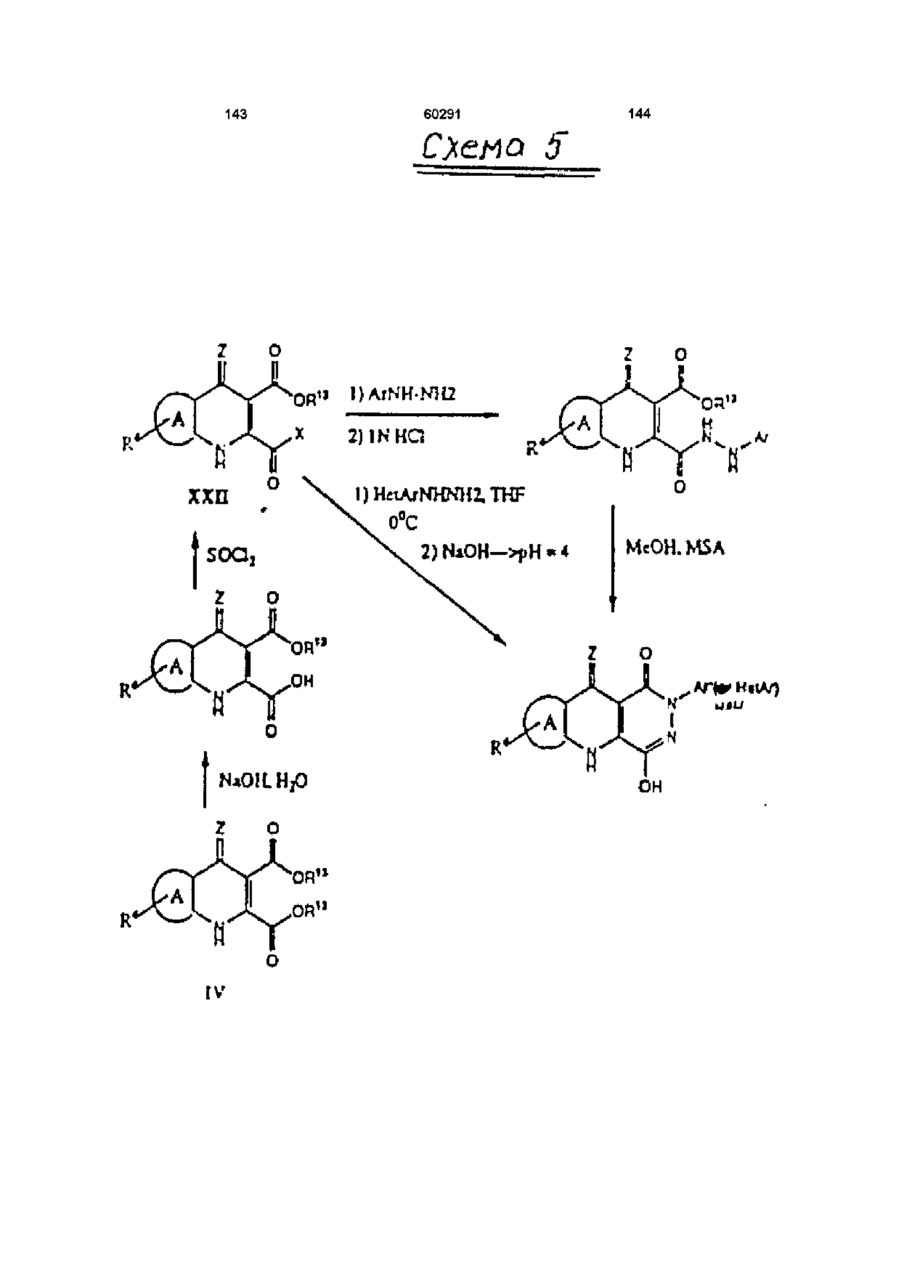
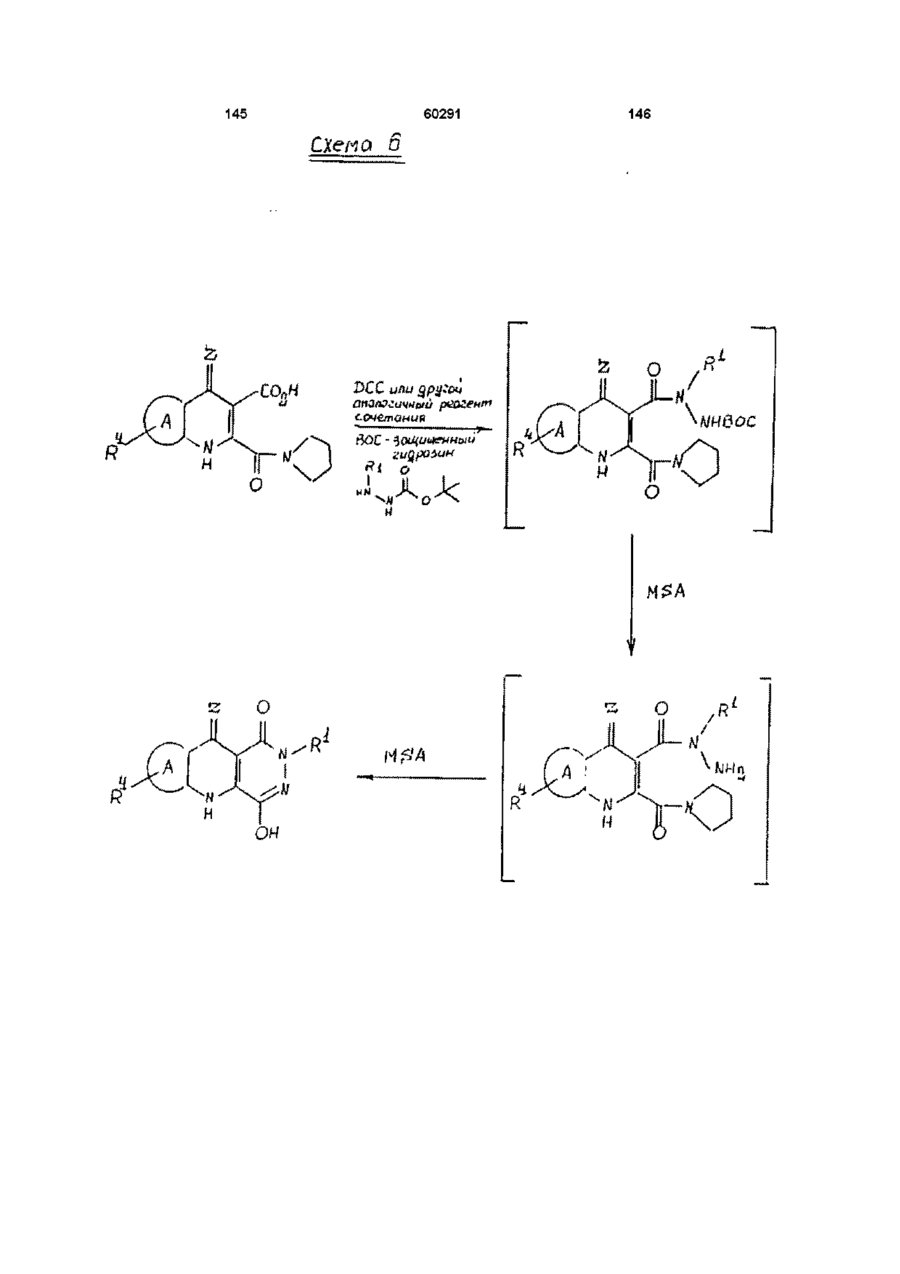
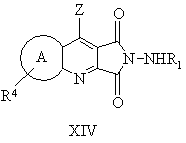
13. Способ получения производных пиридазинохинолинов по п. 1, включающий обработку соединения формулы V или XIV:
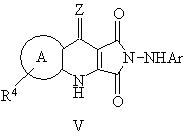 ,
,
 ,
,
где значения R1, R4, A, Ar и Z указаны в п. 1,
кислотой, выбранной из низшей алкил(С1-С4)сульфоновой кислоты в подходящем органическом растворителе; и
при необходимости, последующую обработку полученного соединения формулы II, где соединение содержит фенильное кольцо, замещенное метоксигруппой или метоксигруппами, кислотой с получением других заместителя или заместителей фенильного кольца, или последующую обработку соединения формулы II, где соединение не является солью, фармацевтически приемлемым основанием с получением фармацевтически приемлемой соли, или последующую обработку соединения формулы II, где соединение содержит фенильное кольцо, замещенное цианогруппой или группами, (і) основанием с получением карбоксильного кислотного заместителя или заместителей, или (іі) кислотой с получением амидного заместителя, или (ііі) азидом с получением тетразольного заместителя, где карбокислотный заместитель может быть затем обработан галогенирующим агентом и замещенным амином формулы HNR'R'' с образованием замещенного амидного заместителя, или карбоксильная группа может быть далее обработана спиртом (С1-С6) в присутствии кислоты с получением сложноэфирного заместителя (С1-С6), и/или
при необходимости, последующую обработку соединения формулы II, где соединение содержит сульфидную группу, окисляющим агентом в подходящих условиях с образованием радикалов S(О)1 или S(О)2.
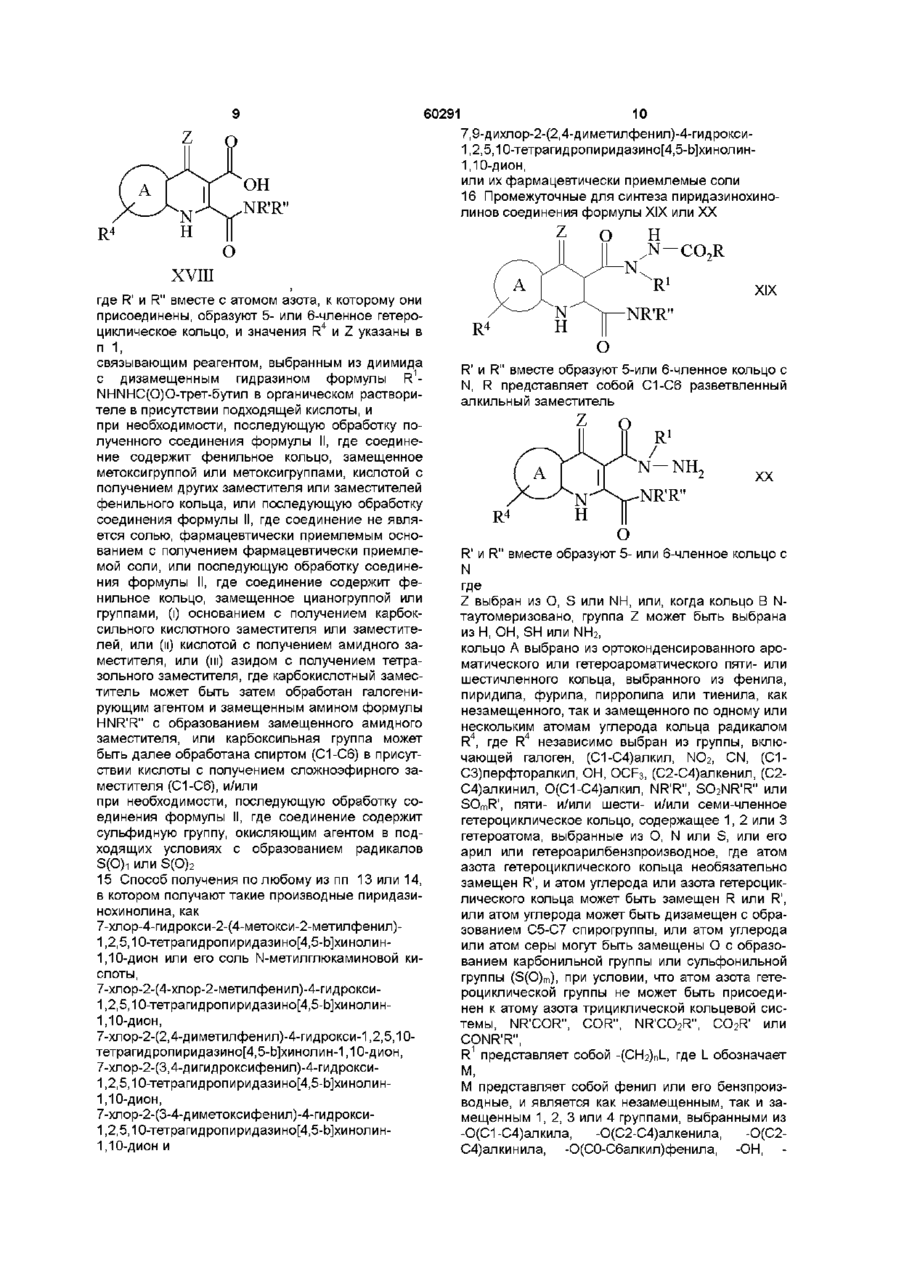
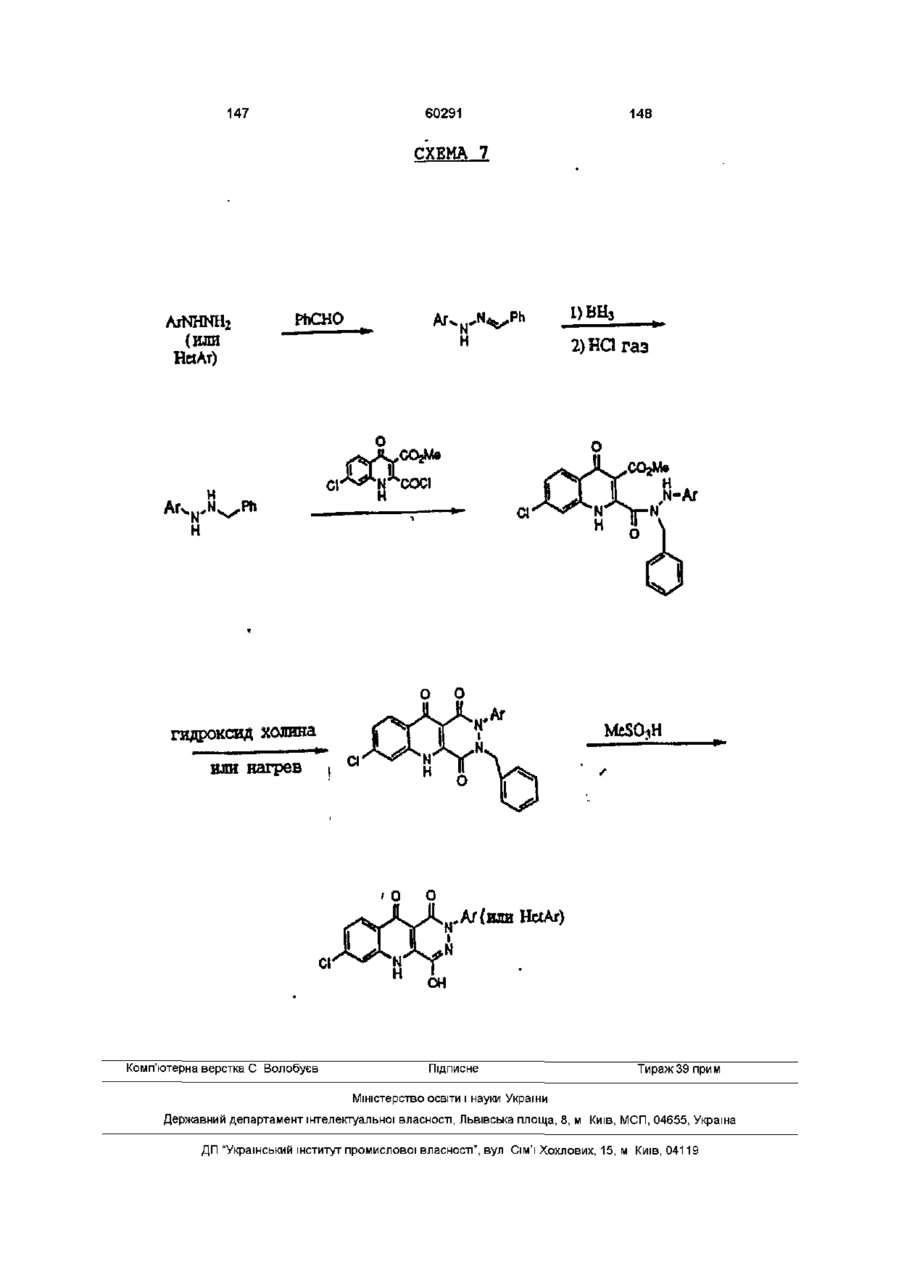
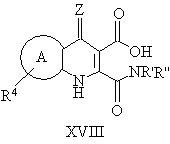
14. Способ получения производных пиридазинохинолинов по п. 1, включающий обработку соединения формулы XVIII:
 ,
,
где R' и R'' вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членное гетероциклическое кольцо, и значения R4 и Z указаны в п. 1,
связывающим реагентом, выбранным из диимида с дизамещенным гидразином формулы R1-NHNHC(O)О-трет-бутил в органическом растворителе в присутствии подходящей кислоты, и
при необходимости, последующую обработку полученного соединения формулы II, где соединение содержит фенильное кольцо, замещенное метоксигруппой или метоксигруппами, кислотой с получением других заместителя или заместителей фенильного кольца, или последующую обработку соединения формулы II, где соединение не является солью, фармацевтически приемлемым основанием с получением фармацевтически приемлемой соли, или последующую обработку соединения формулы II, где соединение содержит фенильное кольцо, замещенное цианогруппой или группами, (і) основанием с получением карбоксильного кислотного заместителя или заместителей, или (ii) кислотой с получением амидного заместителя, или (iii) азидом с получением тетразольного заместителя, где карбокислотный заместитель может быть затем обработан галогенирующим агентом и замещенным амином формулы HNR'R'' с образованием замещенного амидного заместителя, или карбоксильная группа может быть далее обработана спиртом (С1-С6) в присутствии кислоты с получением сложноэфирного заместителя (С1-С6), и/или
при необходимости, последующую обработку соединения формулы II, где соединение содержит сульфидную группу, окисляющим агентом в подходящих условиях с образованием радикалов S(О)1 или S(O)2.
15. Способ получения по любому из пп. 13 или 14, в котором получают такие производные пиридазинохинолина, как:
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион или его соль N-метилглюкаминовой кислоты;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион и
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион,
или их фармацевтически приемлемые соли.
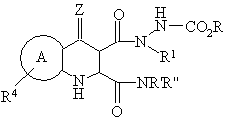
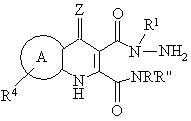
16. Промежуточные для синтеза пиридазинохинолинов соединения формулы XIX или XX:
XIX
R' и R'' вместе образуют 5-или 6-членное кольцо с N, R представляет собой С1-С6 разветвленный алкильный заместитель
XX
R' и R'' вместе образуют 5- или 6-членное кольцо с N
где:
Z выбран из О, S или NH, или, когда кольцо В N-таутомеризовано, группа Z может быть выбрана из Н, ОН, SH или NH2,
кольцо А выбрано из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, как незамещенного, так и замещенного по одному или нескольким атомам углерода кольца радикалом R4, где R4 независимо выбран из группы, включающей галоген, (С1-С4)алкил, NO2, CN, (C1-С3)перфторалкил, ОН, ОСF3, (С2-С4)алкенил, (С2-С4)алкинил, O(С1-С4)алкил, NR'R'', SO2NR'R'' или SOmR', пяти- и/или шести- и/или семи-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранные из О, N или S, или его арил или гетероарилбензпроизводное, где атом азота гетероциклического кольца необязательно замещен R', и атом углерода или азота гетероциклического кольца может быть замещен R или R', или атом углерода может быть дизамещен с образованием С5-С7 спирогруппы, или атом углерода или атом серы могут быть замещены О с образованием карбонильной группы или сульфонильной группы (S(O)m), при условии, что атом азота гетероциклической группы не может быть присоединен к атому азота трициклической кольцевой системы, NR'COR'', COR'', NR'CO2R'', CO2R' или CONR'R'';
R1 представляет собой -(CH2)nL, где L обозначает M;
M представляет собой фенил или его бензпроизводные, и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -О(С1-С4)алкила, -О(С2-С4)алкенила, -О(С2-С4)алкинила, -О(С0-С6алкил)фенила, -ОН, -галогена, -NO2, -CN, -СF3, -(С1-С4)алкилСF3, -NH(CO)R', -(С1-С4)алкила, -NR'R'', -CO2R', -CONR'R'', -SOmR', -SO2NR'R'', (С1-С6)алкилокси(C1-С6)алкилокси-, гидрокси(С1-С6)алкилокси-, окси(С1-6С)алкилокси, который может образовывать циклическое кольцо, присоединенное к фенильному кольцу в орто положении, арилокси(С1-С4)алкилокси(С1-С4)алкил, (С1-С6)алкилокси(С1-С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси(С1-С6)алкилокси-, -О(С1-С6алкил)NR'R'', -NR'(С1-С6алкил)NR'R'', -(С1-С6алкил)NR'R'', -O(С1-С4)перфторалкил, -(С1-С4)перфторалкил, -NR'(С1-С6алкилокси), -NR'(С1-С6алкилгидрокси), -(С1-С4алкил)окси(С1-С4алкил), -О(С1-С4алкил)COOR', -(СН)nNR'R''COOR', где n равно 1-4, -(С1-С4алкил)NR'R'', -(С1-С4алкил)OR', -NR'(CH2)nCOOR', -S(O)m(C1-С4алкил)окси(С1-С4алкил), -S(О)m(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил), -NR'(С1-С4алкил)окси(С1-С4алкил)окси(С1-С4алкил);
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических соединений и их бензпроизводных, включая пиридил, тиенил, фуранил или группы, содержащие два гетероатома, выбранные из N, О или S, такие как пиразол, имидазол, изоксазол, оксазол, тиазол или изотиазол (и их окисленные производные, выбранные из S(О)m, где m равно 1 или 2), пиридазин, пиримидин, пиразин, или группы, содержащие три гетероатома, выбранные из N, О или S, такие как триазол или оксадиазол или триазин, или группы, содержащие четыре гетероатома, такие как тетразол, где N в гетероарильной группе необязательно замещен радикалом R, и заместители ароматических групп включают обычные заместители ароматических групп, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n через атом углерода или гетероатом на гетероарильной группе;
n равно 0;
R выбран из H или (С1-С4)алкила;
R' и R'' независимо выбраны из H, (С1-С4)алкила, где алкил включает алкенил(С2-С4) и алкинил(С2-С4); (С3-С6)циклоалкил, фенил(С0-С4)алкил-, гетероцикло(С0-С4)алкил- или гетероарил(С0-С4)алкил-, где фенил или гетероарил определены выше, и гетероцикл выбран из пяти- и/или шести- и/или семичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранных из О, N или S, или арила или его гетероарилбензпроизводного, и любая вышеуказанная группа необязательно замещена по одному или нескольким атомам углерода галогеном, Н, (С1-С4)алкилом, (С3-6С)циклоалкилом, фенилом, NO2, CN, СF3, ОН, O(С1-С4)алкилом, NR'R''S(O)mR' или SO2NR'R'', где NR'R'' может необязательно образовывать с атомом азота кольцо N-алкил(С1-С3)оксиалкил(С2-С3);
m выбран из 0-2.
17. Фармацевтическая композиция для лечения или профилактики нейродегенеративных нарушений, связанных с возбуждающими аминокислотами, таких как ишемическое повреждение, неврологическое повреждение, припадок или эпилептические конвульсии или заболевания или нарушения, связанные с поступлением избытка кальция в мозг, вызванного возбуждающими аминокислотами, у пациента, нуждающегося в таком лечении, содержащая эффективное количество соединения по любому из пп. 1 или 2 и фармацевтически приемлемый носитель или разбавитель.
18. Фармацевтическая композиция по п. 17 для лечения или профилактики ишемического повреждения.
19. Фармацевтическая композиция по п. 17 для лечения припадка или эпилептических конвульсий.
20. Фармацевтическая композиция по п. 17 для лечения заболеваний или нарушений, связанных с поступлением избытка кальция в мозг, вызванного возбуждающими аминокислотами.
21. Фармацевтическая композиция по п. 17 для лечения или профилактики неврологического повреждения.
22. Фармацевтическая композиция для лечения неврологических повреждений, содержащая эффективное количество соединения по любому из пп. 3-7 и фармацевтически приемлемый носитель или разбавитель.
23. Фармацевтическая композиция для лечения неврологических повреждений, содержащая эффективное количество соединения по любому из пп. 8-10.
24. Способ лечения или профилактики ишемического повреждения у пациента, нуждающегося в таком лечении, включающий введение указанному пациенту фармацевтически эффективного количества соединения по п. 1.
25. Способ лечения или профилактики неврологического повреждения, связанного с возбуждающими аминокислотами у пациента, нуждающегося в таком лечении, включающий введение указанному пациенту фармацевтически эффективного количества соединения по п. 1.
26. Способ лечения припадка или эпилептических конвульсий или заболеваний, или нарушений, связанных с поступлением избытка кальция в мозг, вызванным возбуждающими аминокислотами, включающий введение указанному пациенту фармацевтически эффективного количества соединения по п. 1.
27. Способ лечения неврологических повреждений, включающий введение пациенту при необходимости такого лечения эффективного количества соединения по любому из пп. 1 или 2.
28. Способ лечения неврологических повреждений, включающий введение пациенту при необходимости такого лечения эффективного количества соединения по любому из пп. 3-7.
29. Способ лечения неврологических повреждений, включающий введение пациенту при необходимости такого лечения эффективного количества соединения по любому из пп. 8-10.
Текст
1 Пиридазинохинолины формулы II или их фармацевтически приемлемые соли и таутомеры Z О ОН II где Z выбран из О, S или NH, или, когда кольцо В Nтаутомеризовано, группа Z может быть выбрана изН, ОН, SH или NH2, кольцо А выбрано из ортоконденсированного ароматического или гетероа ром этического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, как незамещенного, так и замещенного у одного или нескольких кольцевых атомов углерода радикалом R4, где R4 независимо выбран из группы, включающей галоген, (С1-С4)алкил, NO2, CN, (С1С3)перфторалкил, ОН, OCF3, (С2-С4)алкенил, (С2С4)алкинил, О(С1-С4)алкил, NR'R", SO2NR'R" или SOmR', NR'COR", COR", NR'CO2R", CO2R\ CONR'R", 5-7-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранные из О, N или S, или его арил или гетероарилбензпроизводное, где атом азота гетероциклического кольца необязательно замещен R', и атом углерода или азота гетероциклического кольца может быть замещен R или R', или атом углерода может быть дизамещен с образованием С5-С7 спирогруппы, или атом углерода или атом серы могут быть замещены О с образованием карбонильной группы или сульфонильной группы (S(O)m), при условии, что атом азота гетероциклической группы не может быть присоединен к атому азота трициклической кольцевой системы, R1 представляет собой -(CH2)nL, где L обозначает М, М представляет собой фенил или его бензпроизводные, и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -О(С1 -4С)алкила, -О(С2-С4)алкенила, -О(С2С4)алкинила, -О(С0-С6алкил)фенила, -ОН, галогена, -NO2, CN, -CF3, -(С1-4С)алкилСР3, винила, тетразолила, -NH(CO)R', -(С1-4С)алкила, NR'R", -CO2R1, -CONR'R", -SOmR' , -SO2NR'R", (C1С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1С6)алкилокси-, окси(С1-6С)алкилокси, который может образовывать циклическое кольцо, присоединенное к фенильному кольцу в ортоположении, арилокси(С1-С4)алкилокси(С1-С4)алкил, (С1С6)алкилокси(С1-С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси(С1-С6)алкилокси-, O(C1-C6anKHn)NR'R", -NR'(C1-C6anKHn)NR'R", (C1-C6anKHn)NR'R", -О(С1-С4)перфторалкил, -(С1С4)перфторалкил, NR'(C1-C6anKHnoKcn), -NR'(C1Сбалкилгидрокси), -(С1 -С4алкил)окси(С1 С4алкил), -O(C1-C4anKHn)COOR', (CH)nNR'R"COOR', где п равно 1-4, -(С1С4ал кил) NR'R", -(C1-C4anKHn)OR', NR'(CH2)nCOOR', -3(О)т(С1-С4алкил)окси(С1С4алкил), -Э(О)т(С1-С4алкил)окси(С1С4алкил)окси(С1-С4алкил), -NR'(C1С4алкил)окси(С1-С4алкил), -NR'(C1С4алкил)окси(С1-С4алкил)окси(С1-С4алкил), гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических групп и их бензпроизводных, включая пиридил, тиенил, фуранил или группы, содержащие два гетероато О о (О 60291 ма, выбранные из N, О или S, такие как пиразол, имидазол, изоксазол, оксазол, тиазол или изотиазол (и их окисленные производные, выбранные из S(O)m, где m равно 1 или 2), пиридазин, пиримидин, пиразин, или группы, содержащие три гетероатома, выбранные из N, О или S, такие как триазол или оксадиазол или триазин, или группы, содержащие четыре гетероатома, такие кактетразол, где N в гетероарильной группе необязательно замещен радикалом R, и заместители ароматических групп включают обычные заместители ароматических групп, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(СН2)П через атом углерода или гетероатом на гетероарильной группе, п равно 0, R выбран из Н или (1-4С)алкила, R' и R" независимо выбраны из Н, (С1-С4)алкила, где алкил включает алкенил(С2-С4) и алкинил(С2С4), (СЗ-Сб)циклоалкил, фенил(С0-С4)алкил-, гетероцикл(С0-С4)алкилили гетероарил (С0С4)алкил-, где фенил или гетероарил определены выше, и гетероцикл выбран из пяти- и/или шестии/или семичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранные из О, N или S, или арила или его гетероарилбензпроизводного, и любая из вышеуказанных групп необязательно замещена по одному или нескольким атомам углерода галогеном, Н, (С1С4)ал килом, (СЗ-Сб)циклоал килом, фенилом, NO2, CN, CF3, ОН, О(С1-С4)алкилом, NR'R"S(O)mR' или SO2NR'R", где NR'R" может необязательно образовывать с атомом азота кольцо 1\1-алкил(С1СЗ)оксиалкил(С2-СЗ), m выбран из 0-2 2 Соединение по п 1 и его фармацевтически приемлемые соли итаутомеры, где Z выбран из О, S или NH, кольцо А выбрано из ортоконденсированного ароматического или гетероа ром этического пяти- или шестичленного кольца, выбранного из фенила, пиридила, пирролила или тиенила, как незамещенного, так и замещенного у одного или нескольких атомов углерода кольца радикалом R4, где R4 независимо выбран из группы, содержащей галоген, (С1-4С)алкил, NO2, CN, (С1С3)перфтороалкил, ОН, OCF3, (С2-С4)алкенил, (С2-С4)алкинил, О(С1-С4)алкил, NR'R", SO2NR'R" или SOmR', R1 представляет собой -(CH2)nL, где L выбран из фенила или его бензпроизводных и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -О(С1-С4)алкила, О(С2-С4)алкенила, -О(С2-С4)алкинила, -О(С0С6алкил)фенила, -ОН, -галогена, -NO2, -CN, -CF3, (С1-С4)алкилСРз, винила, тетразолила, NH(CO)R\ -(С1-С4)алкила, NR'R", -CO2R', CONR'R", -SOmR1, -SO2NR'R", (С1-С6)алкилокси (СІ-Сб)алкилокси-, гидрокси(С1-С6)алкилокси-, окси(С1-С6)алкилокси, который может образовывать циклическое кольцо, присоединенное к фенильному кольцу в ортоположении, арилокси(С1С4)алкилокси(С1-С4)алкила, (С1С6)алкилокси(С1-С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси(С1-С6)алкилокси-, O(C1-C6anKHn)NR'R", -NR'(C1-C6anKHn)NR'R", (С1 -Сбал кил) NR'R", -O(C1 -С4)перфторалкила, (С1-С4)перфторалкила, -NR'(C1-C6anKHnoKcn), NR'(C1 -Сбалкилгидрокси), -(С1 -С4алкил)окси(С1 С4алкил), -О(С1-С4алкил)СОО^, (CH)nNR'R"COOR', где п равно 1-4, -(С1С4ал кил) NR'R", -(C1-C4anKHn)OR', NR'(CH2)nCOOR', -3(О)т(СІ-С4алкил)окси(С1 С4алкил), -3(О)т(С1-С4алкил)окси(С1С4алкил)окси(С1-С4алкил), -NR'(C1С4алкил)окси(С1-С4алкил), -NR'(C1С4алкил)окси(С1-С4алкил)окси(С1-С4-алкил), гетероарила, где гетероарил выбран из незамещенных или замещенных ароматических групп и их бензпроизводных, включая пиридил, тиенил, фуранил, или группы, содержащие два гетероатома, выбранные из N, О или S, такие как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол, или группы, содержащие три гетероатома, выбранные из N, О или S, такие как триазол или оксадиазол, или группы, содержащие 4 гетероатома, такие кактетразол, где N в гетероарильной группе необязательно замещен радикалом R, и заместители ароматических групп включают обычные заместители ароматических групп, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(СН2)П через атом углерода или гетероатом на гетероарильной группе, п равно 0, R, R', R" и m такие, как определено в п 1 3 Соединение по п 2, где L выбран из группы, включающей фенил, 4-метоксифенил, 4-гидроксифенил, 4хлорфенил, 4-метилфенил, 4-изопропилфенил, нафтил, 4-фторфенил, 4-бромфенил, 2метоксифенил, 2-гидроксифенил, 3метоксифенил, 3-гидроксифенил, 4трифторметоксифенил, З-хлор-4-метоксифенил, 5метокси-3-пиридил, 4-S(O)mR^eHHn, где m равно 0-2 и R' представляет собой метил, 3-хлорфенил, З-хлор-4-гидроксифенил, 2-метил-4-хлорфенил, 3метилфенил, 2-метилфенил, 3-фторфенил, 2,4дифторфенил, 3,5-трифторметилфенил, 3нитрофенил, 2-фторфенил, 2,4-диметилфенил, 3хлор-4-метилфенил, 4-трифторметилфенил, 4йодфенил, 3,4-диметилфенил, 3,4диметоксифенил, 2-метил-4-метоксифенил, 2метокси-4-бромфенил, 2-метил-4-гидроксифенил, 4-этилфенил, 2,3-диметилфенил, 3,4дигидроксифенил, 2,4-диметоксифенил, 2,4дихлорфенил, 4-нитрофенил, 2,5диметоксифенил, 2,5-диметилфенил, 4оксибензилфенил, 2,5-дигидроксифенил, 4винилфенил, 2,5-дифторфенил, 2-метил-4фторфенил, 3,5-диметоксифенил, 4карбоксифенил, 4-карбоксамидофенил, 4-(N,Nдиэтилкарбоксамидо)фенил, 4-цианфенил или 4тетразолфенил 4 Соединение по п 3, выбранное из группы, включающей 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 60291 7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(3,4-диметоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, и 7-хлор-4-гид рокси-2-(фуран-2-илметил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, или их фармацевтически приемлемые соли 5 Соединение по п 4, представляющее собой 7хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион или его фармацевтически приемлемые соли 6 Соединение по п 5, выбранное из группы, включающей 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин-1,10дион, N-метилглюкаминовая соль, 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, натриевая соль, и 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин-1,10дион, соль холиновой кислоты 7 Соединение по п 6, представляющее собой натриевую соль 7-хлор-4-гидрокси-2-(4-метокси-2метилфенил)-1,2,5,10-тетрагидропиридазино [4,5Ь]хинолин-1,10-диона 8 Соединение по п 3, выбранное из группы, включающей 7-хлор-4-гид рокси-2-фенил-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-метоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-гидроксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 4-гид рокси-8-нитро-2-фенил-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-хлорфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-метилфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-изопропилфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7,9-дихлор-4-гидрокси-2-фенил-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(1-нафтил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(4-фторфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 2-(4-бромфенил)-7-хлор-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(2-метоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(2-гидроксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(3-метоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(3-гидроксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гидрокси-2-(4-трифторметоксифенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион и 7-хлор-4-гидрокси-2-(2-метоксипирид-5-ил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, или их фармацевтически приемлемые соли 9 Соединение по п 3, выбранное из группы, включающей 2-(4-бензилоксифенил)-7-хлор-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(2,4-дихлорфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3-хлор-4-гидроксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-4-гидрокси-2-(4-гидрокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(4-хлор-2-метилфенил)-4гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-4-гид рокси-2-(2-метилфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3,4-диметилфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(2,4-диметоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(2,5-диметоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(2,5-диметилфенил)-4-гид рокси-1,2,5,10тетрагидропиридазин[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3-хлорфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(3-метилфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-тиометоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3-хлор-4-метилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(2,3-диметилфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(4-этилфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(4-фтор-2-метилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(3,5-диметоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-4-гид рокси-2-(4-йодфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 60291 7-хлор-2-(4-бром-2-метоксифенил)-4-гидроксиZ О 1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(3-фторфенил)-4-гид рокси-1,2,5,10N-NHAr тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(2-фторфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-[3,5-ди(трифторметил)фенил]-4гид рокси-1,2,5,10-тетрагид ропиридазино[4,5Ь]хинолин-1,10-дион, 7-хлор-2-(2,4-дифторфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(2,5-дифторфенил)-4-гид рокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гид рокси-2-(4-нитрофенил)-1,2,5,10N-NHR, тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-4-гидрокси-2-(4-трифторметилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-4-гид рокси-2-(3-нитрофенил)-1,2,5,10XIV тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, где значения R1, R4, А, Аг и Z указаны в п 1, 7-хлор-4-гидрокси-2-(4-сульфонилметилфенил)кислотой, выбранной из низшей алкил(С11,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолинС4)сульфоновой кислоты в подходящем органи1,10-дион, ческом растворителе, и 7-хлор-4-гидрокси-2-(2,5-дигидроксифенил)при необходимости, последующую обработку по1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолинлученного соединения формулы II, где соедине1,10-дион, ние содержит фенильное кольцо, замещенное 7-хлор-4-гид рокси-2-(4-карбоксифенил)-1,2,5,10метоксигруппой или метоксигруппами, кислотой с тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, получением других заместителя или заместителей 7-хлор-4-гид рокси-2-(4-гидроксифенил)-1,2,5,10фенильного кольца, или последующую обработку тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, соединения формулы II, где соединение не явля7-хлор-4-гидрокси-2-(4-карбоксамидофенил)ется солью, фармацевтически приемлемым осно1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолинванием с получением фармацевтически приемле1,10-дион, мой соли, или последующую обработку соедине7-хлор-4-гид рокси-2-(4-тетразолфенил)-1,2,5,10ния формулы II, где соединение содержит фететрагидропиридазино[4,5-Ь]хинолин-1,10-дион и нильное кольцо, замещенное цианогруппой или 7-хлор-4-гидрокси-2-[4-(г\І,І\Ігруппами, (і) основанием с получением карбокд иэтилкарбоксамидо)фенил]-1,2,5,10сильного кислотного заместителя или заместитететрагидропиридазино[4,5-Ь]хинолин-1,10-дион, лей, или (и) кислотой с получением амидного заили его фармацевтически приемлемые соли местителя, или (ш) азидом с получением тетра10 Соединение по п 2, выбранное из группы, зольного заместителя, где карбокислотный замесвключающей титель может быть затем обработан галогени7-хлор-2-(4-этоксифенил)-4-гид рокси-1,2,5,10рующим агентом и замещенным амином формулы тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, HNR'R" с образованием замещенного амидного 7-хлор-4-гид рокси-2-(2-изопропилфенил)-1,2,5,10заместителя, или карбоксильная группа может тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион и быть далее обработана спиртом (С1-С6) в присут7-хлор-4-гидрокси-2-(4-карбоксиметилфенил)ствии кислоты с получением сложноэфирного за1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолинместителя (С1-С6), и/или 1,10-дион, при необходимости, последующую обработку соили его фармацевтически приемлемые соли единения формулы II, где соединение содержит 11 Соединение по п 1 для использования в месульфидную группу, окисляющим агентом в поддицине ходящих условиях с образованием радикалов 12 Соединение по п 1 для приготовления лекарS(O)i или S(O)2 ства для лечения припадка или эпилептических 14 Способ получения производных пиридазиноконвульсий или поражений или состояний, свяхинолинов по п 1, включающий обработку соедизанных с поступлением избытка кальция в мозг нения формулы XVIII 13 Способ получения производных пиридазинохинолинов по п 1, включающий обработку соединения формулы V или XIV 60291 10 7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, или их фармацевтически приемлемые соли 16 Промежуточные для синтеза пиридазинохинолинов соединения формулы XIX или XX Z n H CO2R XVIII где R' и R" вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членное гетеро4 циклическое кольцо, и значения R и Z указаны в п 1, связывающим реагентом, выбранным из диимида 1 с дизамещенным гидразином формулы R г\ІНг\ІНС(О)О-трет-бутил в органическом растворителе в присутствии подходящей кислоты, и при необходимости, последующую обработку полученного соединения формулы II, где соединение содержит фенильное кольцо, замещенное метоксигруппой или метоксигруппами, кислотой с получением других заместителя или заместителей фенильного кольца, или последующую обработку соединения формулы II, где соединение не является солью, фармацевтически приемлемым основанием с получением фармацевтически приемлемой соли, или последующую обработку соединения формулы II, где соединение содержит фенильное кольцо, замещенное цианогруппой или группами, (і) основанием с получением карбоксильного кислотного заместителя или заместителей, или (и) кислотой с получением амидного заместителя, или (ш) азидом с получением тетразольного заместителя, где карбокислотный заместитель может быть затем обработан галогенирующим агентом и замещенным амином формулы HNR'R" с образованием замещенного амидного заместителя, или карбоксильная группа может быть далее обработана спиртом (С1-С6) в присутствии кислоты с получением сложноэфирного заместителя (С1-С6), и/или при необходимости, последующую обработку соединения формулы II, где соединение содержит сульфидную группу, окисляющим агентом в подходящих условиях с образованием радикалов S(O)i или S(O)2 15 Способ получения по любому из пп 13 или 14, в котором получают такие производные пиридазинохинолина, как 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион или его соль N-метилглюкаминовой кислоты, 7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, 7-хлор-2-(3-4-диметоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион и XIX NR'R" R' и R" вместе образуют 5-или 6-членное кольцо с N, R представляет собой С1-С6 разветвленный алкильный заместитель XX R' и R" вместе образуют 5- или 6-членное кольцо с N где Z выбран из О, S или NH, или, когда кольцо В Nтаутомеризовано, группа Z может быть выбрана изН, ОН, SH или NH2, кольцо А выбрано из ортоконденсированного ароматического или гетероа ром этического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, как незамещенного, так и замещенного по одному или нескольким атомам углерода кольца радикалом R4, где R4 независимо выбран из группы, включающей галоген, (С1-С4)алкил, NO2, CN, (С1С3)перфторалкил, ОН, OCF3, (С2-С4)алкенил, (С2С4)алкинил, О(С1-С4)алкил, NR'R", SO2NR'R" или SOmR', пяти- и/или шести- и/или семи-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранные из О, N или S, или его арил или гетероарилбензпроизводное, где атом азота гетероциклического кольца необязательно замещен R', и атом углерода или азота гетероциклического кольца может быть замещен R или R', или атом углерода может быть дизамещен с образованием С5-С7 спирогруппы, или атом углерода или атом серы могут быть замещены О с образованием карбонильной группы или сульфонильной группы (S(O)m), при условии, что атом азота гетероциклической группы не может быть присоединен к атому азота трициклической кольцевой системы, NR'COR", COR", NR'CO2R", CO2R' или CONR'R", R1 представляет собой -(CH2)nL, где L обозначает M, М представляет собой фенил или его бензпроизводные, и является как незамещенным, так и замещенным 1, 2, 3 или 4 группами, выбранными из -О(С1 -С4)алкила, -О(С2-С4)алкенила, -О(С2С4)алкинила, -О(С0-С6алкил)фенила, -ОН, 60291 12 11 ний, связанных с возбуждающими аминокислотагалогена, -NO2, -CN, -CF3, -(С1-С4)алкилСР3, ми, таких как ишемическое повреждение, невролоNH(CO)R', -(С1-С4)алкила, -NR'R", -CO2R', гическое повреждение, припадок или эпилептичеCONR'R", -SOmR', -SO2NR'R", (C1ские конвульсии или заболевания или нарушения, С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1связанные с поступлением избытка кальция в С6)алкилокси-, окси(С1-6С)алкилокси, который мозг, вызванного возбуждающими аминокислотаможет образовывать циклическое кольцо, присоеми, у пациента, нуждающегося в таком лечении, диненное к фенильному кольцу в орто положении, содержащая эффективное количество соединения арилокси(С1-С4)алкилокси(С1-С4)алкил, (С1по любому из пп 1 или 2 и фармацевтически приС6)алкилокси(С1-С6)алкилокси(С1-С6)алкилокси-, емлемый носитель или разбавитель гидрокси(С1-С6)алкилокси(С1-С6)алкилокси-, O(C1-C6anKHn)NR'R", -NR'(C1-C6anKHn)NR'R", 18 Фармацевтическая композиция по п 17 для (С1-С6алкил)NR'R", -О(С1-С4)перфторалкил, -(С1лечения или профилактики ишемического повреС4)перфторалкил, -NR'(C1-C6anKHnoKcn), -NR'(C1ждения Сбалкилгидрокси), -(С1 -С4алкил)окси(С1 19 Фармацевтическая композиция по п 17 для лечения припадка или эпилептических конвульС4алкил), -О(С1-С4алкил)СОСЖ', сий (CH)nNR'R"COOR', где п равно 1-4, -(С1С4ал кил) NR'R", -(С1-С4алкил)СЖ', 20 Фармацевтическая композиция по п 17 для лечения заболеваний или нарушений, связанных с NR'(CH2)nCOOR', -3(О)т(С1-С4алкил)окси(С1поступлением избытка кальция в мозг, вызванного С4алкил), -3(О)т(С1-С4алкил)окси(С1возбуждающими аминокислотами С4алкил)окси(С1-С4алкил), -NR'(C1С4алкил)окси(С1-С4алкил), -NR'(C121 Фармацевтическая композиция по п 17 для лечения или профилактики неврологического поС4алкил)окси(С1-С4алкил)окси(С1-С4алкил), вреждения гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических соедине22 Фармацевтическая композиция для лечения ний и их бензпроизводных, включая пиридил, тиеневрологических повреждений, содержащая эфнил, фуранил или группы, содержащие два гетефективное количество соединения по любому из роатома, выбранные из N, О или S, такие как пипп 3-7 и фармацевтически приемлемый носитель разол, имидазол, изоксазол, оксазол, тиазол или или разбавитель изотиазол (и их окисленные производные, вы23 Фармацевтическая композиция для лечения бранные из S(O)m, где m равно 1 или 2), пириданеврологических повреждений, содержащая эфзин, пиримидин, пиразин, или группы, содержащие фективное количество соединения по любому из три гетероатома, выбранные из N, О или S, такие пп 8-Ю как триазол или оксадиазол или триазин, или 24 Способ лечения или профилактики ишемичегруппы, содержащие четыре гетероатома, такие ского повреждения у пациента, нуждающегося в как тетразол, где N в гетероарильной группе нетаком лечении, включающий введение указанному обязательно замещен радикалом R, и заместитепациенту фармацевтически эффективного колили ароматических групп включают обычные зачества соединения по п 1 местители ароматических групп, выбранные из 25 Способ лечения или профилактики неврологигидрокси, алкокси, галогена или циано, и гетероаческого повреждения, связанного с возбуждаюрильная группа присоединена к -(СН2)П через атом щими аминокислотами у пациента, нуждающегося углерода или гетероатом на гетероарильной групв таком лечении, включающий введение указанпе, ному пациенту фармацевтически эффективного количества соединения по п 1 п равно О, R выбран из Н или (С1-С4)алкила, 26 Способ лечения припадка или эпилептических R' и R" независимо выбраны из Н, (С1-С4)алкила, конвульсий или заболеваний, или нарушений, свягде алкил включает алкенил(С2-С4) и алкинил(С2занных с поступлением избытка кальция в мозг, С4), (СЗ-Сб)циклоалкил, фенил(С0-С4)алкил-, гевызванным возбуждающими аминокислотами, тероцикло(С0-С4)алкилили гетероарил (С0включающий введение указанному пациенту фарС4)алкил-, где фенил или гетероарил определены мацевтически эффективного количества соединевыше, и гетероцикл выбран из пяти- и/или шестиния по п 1 и/или семичленного гетероциклического кольца, 27 Способ лечения неврологических повреждесодержащего 1, 2 или 3 гетероатома, выбранных ний, включающий введение пациенту при необхоиз О, N или S, или арила или его гетероарилбенздимости такого лечения эффективного количества производного, и любая вышеуказанная группа соединения по любому из пп 1 или 2 необязательно замещена по одному или несколь28 Способ лечения неврологических повреждеким атомам углерода галогеном, Н, (С1ний, включающий введение пациенту при необхоС4)ал килом, (СЗ-бС)циклоал килом, фенилом, димости такого лечения эффективного количества NO2, CN, CF3, ОН, О(С1-С4)алкилом, NR'R"S(O)mR' соединения по любому из пп 3-7 или SO2NR'R", где NR'R" может необязательно 29 Способ лечения неврологических повреждеобразовывать с атомом азота кольцо N-anKnn(C1ний, включающий введение пациенту при необхоСЗ)оксиалкил(С2-СЗ), димости такого лечения эффективного количества m выбран из 0-2 соединения по любому из пп 8-Ю 17 Фармацевтическая композиция для лечения или профилактики нейродегенеративных наруше 13 Данное изобретение относится к производным пиридазиндиона Используемый в лечении неврологических заболеваний, главным образом, у млекопитающих, таких как человек Более конкретно, соединения используются при лечении припадков и/или других нейродегенеративных нарушений, таких как гипогликемия, корковый паралич, преходящее нарушение коркового мозгового кровообращения, перинатальная асфиксия, эпилепсия, психоз, хорея Хантингтона (Huntmgton), боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, оливо-понтоцеребеллярная атрофия, вызванная вирусом, нейродегенерация, такая как приобретенный синдром иммунного дефицита и связанного с ним слабоумия, гипоксия, вызванная утоплением, травмой спинного мозга или головного мозга, и хроническая болезнь, для предупреждения лекарственных алкогольных синдромов отмены, и подавления толерантности и зависимости от наркотических анальгетиков В частности, изобретение относится к новым производным пиридазиндиона, используемым при восстановлении неврологической дегенерации, такой, которая может быть вызвана ударом, и возникающей в результате ассоциативной функциональной недостаточности Лечение с использованием соединения по изобретению может быть лечебной или терапевтической при введении соединения после проявления ишемии для смягчения эффектов этого заболевания Обработка может также быть профилактической или перспективной при введении соединения в предвидении возможности проявления ишемии, например, пациенту, который склонен к ишемии Известно, что случаи ишемии могут стать пусковым механизмом очень сильного увеличения внеклеточных концентраций возбуждающих аминокислот глутамата и аспартата, которые могут, в свою очередь, вызвать длительное нейронное возбуждение, приводящее к массированному притоку кальция из внеклеточных участков к внутриклеточным участкам в невральных клетках головного мозга Тем самым может быть создана кальциевая перегрузка, которая приводит к каскаду событий, ведущих к катаболизму клеток и в конечном счете выражающихся в смерти клеток Предполагается, что N-метил-Оаспартат (NMDA) рецепторний комплекс играет существенную роль в потоке событий, приводящих к некрозу клеток, следующему за проявлением ишемии Предложенные в данном изобретении соединения могут быть полезны при целом ряде нейродегенеративных нарушений, поскольку они действуют как антагонисты возбуждающих аминокислот Они могут это делать косвенно, путем аллостерической модуляции места связывания глутамата, в частности, действуя как антагонисты стрихнин-нечувствительного глицин рецептора на NMDA рецепторном комплексе Они могут также делать это непосредственно, путем связывания самого глутамат участка NMDA рецепторного комплекса Согласно изобретению предложено соединение и его фармацевтические композиции, пригод 60291 14 ные для лечения неврологических заболеваний, включающие соединение формулы I или его фармацевтивтически приемлемую соль (формула вынесена, вместе с другими формулами, обозначенными римскими цифрами, на страницы, следующие за примерами) и ихтаутомеры где Z выбран из О, S или NH (или, когда В-кольцо N-таутомеризовано или В-кольцо восстановлено, Z группа может быть выбрана из Н, ОН, SH или NH2 с образованием соединения Г) Кольцо выбрано А из ортоконденсированного ароматического или гетероа ром этического пятиили шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, либо незамещенного, либо полизамещенного по кольцевому углеродному атому радикалом R4, где R4 независимо выбран из группы, содержащей галоген, (1-4С)алкил, NO2, CN, (С13)перфторалкил, ОН, OCF3, (2-4С)алкенил, (24С)алкинил, О(1-4С)алкил, NR'R", SO2NR'R" или S(O)mR', гетероциклическую группу, NR'COR", COR", NR'CO2R", CO2R', CONR'R", R' выбран из Н или -(CH2)nL, где L обозначает М или W, М обозначает фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2,3 или 4 группами, выбранными из -О-(1-4С)алкила, -О(2-4С)алкенила, -О-(2-4С)алкинила, -О(СОСбалкил) фенила, -ОН, -галогена, -NO2, -CN, -CF3, -(1-4С)алкилСР3, NH(CO)R', -(1-4C) алкила, -NR'R", -CO2R1, -CONR'R", S(O)mR', SO2NR'R", (C1С6)алкилокси-, (C1 -С6)алкилокси, гидрокси (С1 С6)алкилокси-, окси (1-6С)алкилокси, которые могут образовывать циклическое кольцо, присоединенное к фенильному кольцу в орто положении, арилокси(1 -4С) ал кил о кс и (1 -4С)алкила, (С1 С6)алкилокси-(С1-С6)алкилокси(С1-С6)алкилокси, гидрокси-(С1-С6)алкилокси(С1-С6)алкилокси-, 1 О(С1 -Сбал кил) NR'R", -NR (C1 -C6)anKHnNR'R", (C1-C6anKHn)NR'R", -О- (1-4С) перфторалкил, -(14С)перфторалкил, -NR' (С1-С6алкилокси), NR'(C1 -Сбалкил-гидрокси), -(С1 -4алкил)окси(С1 4алкил), -O(C1-4anKHn)COOR', -(CH)nNR'R"COOR', где п равно 1-4, -(C1-4anKHn)NR'R", -(С14anKHn)OR', -NR1(CH2)nCOOR', -3(О)т(С1-4алкил) окси (С1 -4алкил), S(O)m(C1 -4алкил)окси(С1 4алкил)окси(С1 -4алкил), -NR'(C1 -4ал-кил)окси(С1 4алкил), -NR (C1 -4алкил)окси(С1 -4алкил)окси(С1 4алкил), гетероцикл, в котором гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1,2 или 3 гетероатома, выбранных из О, N или S, или их арил или гетероарил бензопроизводных, где N гетероцикла необязательно замещен R' и атом углерода или атом азота гетероцикла может быть замещен R или R', или атом углерода может быть дизамещенным с образованием С5-С7 спиро-группы, или атом углерода или атом серы может быть замещен О с образованием карбонильной группы или сульфонил группу (S(O)m) при условии, что гетероциклический азот не может быть связан с азо 60291 16 15 том трициклической кольцевой системы формулы местители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галоI, гена или циано, и гетероарильная группа присоегетероарил, где гетероарил выбран из незадинена к -(СН2)п посредством атома углерода или мещенных или замещенных ароматических радигетероатома гетероарильной группы, калов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих W выбран из ОН, OR, OCOR, S(O)mR, галоген, два гетероатома, выбранные из N, О или S, таких S(O)mNR'R", NR'R", при условии, что NR'R" не ракак пиразол, имидазол, изоксазол, оксазол, тиазол вен NH2, COR', NR'COR", OCONR', NR'CO2R", (C3или изотиазол (и их окисленные производные, 6)циклоалкила, NRCONR'R", CO2R' или CONRR', выбранные из S(O)m где т равно 0-2), пиридазин, при условии что п больше нуля, и пиримидин, пиразин, или из групп, содержащих п выбран из 0-4, три гетероатома, выбранных из N, О или S, такие R выбирают из Н или (1-4С) алкила, как триазол или оксадиазол или триазин, или из R' и R", независимо, выбраны из Н, (1-4С) алгрупп, содержащих четыре гетероатома, таких как кила, где алкил включает алкенил (С2-С4) и алкитетразол, где N гетероарильной группы необязанил (С2-С4), (З-бС)циклоалкила, фенил (О-4С) тельно замещен R и замещенные ароматические алкила, гетероцикло (О-4С) алкила или гетероазаместители включают обычные ароматические рил (О-4С) алкила, где фенил или гетероцикл или заместители, выбранные из гидрокси, алкокси, гетероарил -такой, как определено выше, и любой галогена или циано, и гетероарильная группа прииз вышеприведенных радикалов необязательно соединена к -(СН2)П через атом углерода или гетезамещен по одному или более углеродных атомов роатом гетероарильной группы, галогеном, Н, (1-4С)алкилом, (З-бС)циклоалкилом, фенилом, NO2, CN, CF3, ОН, О-(1-4С) алкилом, W выбран из ОН, OR1, CF3OCOR1, S(O)mR', NR'R", S(O)mR' или SO2NR'R", где NR'R" может, S(O)mNR'R", галоген, NR'R", при условии, что необязательно, образовывать N-anKnn(C1NR'R" не равен NH2, COR1, NR'COR", OCONR1, 3)оксиалкил(С2-3)кольцо с N, NR'CO2R", (СЗ-б)циклоалкила, NRCONR'R", CO2R' или CONR'R" при условии что п больше нуля и m выбран из 0-2, п выбран из 0-6, при условии, что R1 и R2 не равны оба Нив R2 выбран из Н или -(CH2)nL, где L обозначает фармацевтической композиции к соединению М или W, и формулы I или Г добавлен фармацевтически приемлемый растворитель или носитель М представляет фенил или его бензопроизводные и является Согласно изобретению предлагается соедилибо незамещенным, либо замещенным 1,2 или 3, нение и фармацевтические композиции на его выбранными из -О-(1-4С)алкила, -ОН, -галогена, основе, подходящие для лечения неврологических NO2, -CN, -CF3, -NH(CO)R', -(1-4С)алкила, -NR'R", заболеваний, включающие соединение формулы I CO2R', -CONR'R", -S(O)mR', -SO2NR'R", (C1или его фармацевтивтически приемлемую соль С6)алкилокси(С1-С6) алкилокси-, гидрокси(С1(формула вынесена, вместе с другими формулаС6)алкилокси-, (С1-С6)алкилокси(С1ми, обозначенными римскими цифрами, на страницы, следующие за экспериментальными примеС6)алкилокси(С1-С6)алкилокси-, гидрокси(С1рами) и ихтаутомеры, где С6)алкилокси(С1-С6) алкилокси-, -О(С1Сбал кил) NR'R", -NR'(C1-C6anKHn)NR'R", -(С1Z выбран из О, S или NH (или, когда В-кольцо Сбалкил)NR'R", -OCF3, -NR' (С1-С6алкилокси), N-таутомеризовано или В-кольцо восстановлено, NR1 (С1-С6алкилгидрокси), Z группа может быть выбрана из Н, ОН, SH или NH2 с образованием соединения Г) гетероцикл, где гетероцикл выбран из пятии/или шести и/или семичленного гетероцикличеКольцо А выбрано из ортоконденсированного ского кольца, содержащего 1,2 или 3 гетероатома, ароматического или гетероа ром этического пятивыбранных из О, N или S, или его арильных или или шестичленного кольца, выбранного из фенигетероарильных бензопроизводных, где N гетерола, пиридила, фурила, пирролила или тиенила, цикла необязательно замещен радикалом R' и либо незамещенного, либо полизамещенного у атом углерода или азота гетероцикла может быть кольцевого углеродного атома радикалом R4, где замещен R или R', или атом углерода может быть R4 независимо выбран из группы, содержащей дизамещен с образованием С5-С7 спиро-группы, галоген, (1-4С)алкил, NO2, CN, (С1или атом углерода или атом серы могут быть за3)перфторалкил, ОН, OCF3, (2-4С)алкенил, (2мещены О с образованием карбонильной группы 4С)алкинил, -О-(1-4С)алкил, NR'R", SO2NR'R" или или сульфонильной группы (S(O)m), S(O)mR\ гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранные из N, О или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, О или S, таких как триазол или оксадиазол, или из групп, содержащих четыре гетероатома, таких как тетразол, где N гетероарильной группы необязательно замещен радикалом R и замещенные ароматические за R' выбирают из Н или -(CH2)nL, где L представляет М или W, М обозначает фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2 или 3 группами, выбранными из О-(1-4С)алкила, -О-(24С)алкенила, -О-(2-4С)алкинила, -ОН, галогена, NO2, -CN, -CF3, -(1-4C) алкилСРз, -NH(CO)R', -(14С)алкила, -NR'R", -CO2R', -CONR'R", -S(O)mR', SO2NR'R", (С1-С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1-С6)алкилокси-, арилокси(14С)алкилокси(1 -4С)алкила, (С1 -С6)алкилокси-(С1 60291 18 17 С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1или оксатиазол, где N на гетероарильнои группе, С6)алкилокси(С1-С6) алкилокси-, -О-(С1необязательно, замещен R, и замещенные аромаСбал кил) NR'R", -NR'(C1 -Сбалкил) NR'R", -(C1 тические заместители включают обычные аромаСбалкил) NR'R", -О-(1 -4С)перфторалкила, -(1 тические заместители, выбранные из гидрокси, 4С)перфтор-алкила, -NR'(C1-C6anKHnoKcn), алкокси, галогена или циано, и гетероарильная NR'(C1-Сбалкил гидрокси), группа присоединена к -(СН2)П посредством углеродного атома гетероарильнои группы, гетероцикл, где гетероцикл выбран из пятии/или шести и/или семичленного гетероцикличеW выбран из ОН, OR', OCOR, S(O)mR', NR'R", ского кольца, содержащего 1,2 или 3 гетероатома, при условии что NR'R" не равен NH2, NR'COR", выбранных из О, N или S, где N на гетероцикле, OCONR', NR'CO2R", NRCONR'R", CO2R' или необязательно, замещен радикалом R' и атом CONRR', при условии что п больше нуля, и п равуглерода или атом азота на гетероцикле может но 1-4, быть замещен радикалом R или R', или атом углеR выбран из Н или (1-4С)алкила, рода может быть замещен О с образованием карR' и R", независимо, выбраны из Н, (1-4С) албонильной группы, гетероарил, где гетероарил кила, где алкил включает алкенил или алкинил, выбран из незамещенных или замещенных арофенил (О-4С)ал кила, гетероцикло(О-4С)алкила матических радикалов и их бензопроизводных, или гетероарил(О-4С)алкила, где фенил или гетевключающих пиридил, тиенил, фуранил, или из роцикл или гетероарил -такие, как определено групп, содержащих два гетероатома, выбранные выше, и необязательно замещен по одному или из N, О или S, таких как пиразол, имидазол, изоболее углеродным атомам галогеном, Н, (1ксазол, оксазол, тиазол, изотиазол или из групп, 4С)алкилом, NO2, CN, CF3, ОН, -О-(1-4С)алкилом, содержащих три гетероатома, выбранных из N, О NR'R", S(O)mR' или SO2NR'R", или S, таких как триазол или оксадиазол, где N m выбран из 0-2, и в фармацевтической комгетероарильнои группы, необязательно, замещен позиции к соединению формулы I или Г прибавлен радикалом R, а замещенные ароматические зафармацевтически приемлемый растворитель или местители включают обычные ароматические заноситель местители, выбранные из гидрокси, алкокси, галоДанное изобретение относится также к соедигена или циано, и гетероарильная группа присоенениям, которые используются в качестве в качединена к -(СН2)П посредством атома углерода или стве промежуточных соединений при получении гетероатома гетероарильнои группы, глицин рецепторных антагонистов, как определено выше, где W обозначает галоидные радикалы, W выбран из ОН, OR1, OCOR1, S(O)mR', NR'R", такие как CI, Вг или I, где п больше нуля Дополнипри условии, что NR'R" не равен NH2, NR'COR", тельно, соединения, полученные новым способом OCONR', NR'CO2R", NRCONR'R", CO2R' или получения пиридазинхинолинов, указанным здесь, CONRR', при условии, что п больше нуля, и с R , выбранным из арила или гетероарила, как п выбран из 0-4, определено выше, является ключевыми промежуR2 выбран из Н или -(CH2)nL, где L обозначает точными продуктами для получения указанных М или W, и соединений Эти ключевые промежуточные соМ обозначает единения представляют N-2-арил (или гетероафенил или его бензопроизводные и является рил)гидразиды З-карбоалкокси-4-гидроксилибо незамещенным, либо замещенным 1,2 или 3 группами, выбранными из -О-(1-4С)алкила, -ОН, хинолин-2-карбоциклической кислоты, которые галогена, -NO2, -CN, -CF3, NH(CO)R\ -(1используются для получения вышеуказанных 4С)алкила, -NR'R", -CO2R', -CONR'R", -S(O)mR', арильных или гетероарильных радикалов, где SO2NR'R", (С1-С6)алкилокси(С1-С6)алкилокси-, арил или гетероарил -такой, как определено выгидрокси(С1-С6)алкилокси-, (С1-С6) алкилоксише Другие промежуточные ключевые продукты (C1 -С6)алкилокси(С1 -С6)алкилокси-, гидрокси(С1 включают промежуточные производные 3С6)алкилокси(С1 -С6)алкилокси-, -О-(С1 -Сбалкил) карбоновой кислоты-4-гидроксихинолин-2NR'R", -NR' (C1-C6anKHn)NR'R", -(С1пирролидинамида, которые используются для Сбал кил) NR'R", -OCF3, -NR'(C1-C6anKHnoKcn), взаимодействия с BOG-замещенными арил, гетеNR'(C1-Сбалкил гидрокси), роарил или замещенными алкил гидразинами с получением после связывания с помощью дицикгетероцикл, где гетероцикл выбран из пятилогексилдиимида или диизопропилдиимида в пои/или шести и/или семичленного гетероцикличелярном растворителе, таком как ТГФ, метанол, ского кольца, содержащего 1,2 или 3 гетероатома, диэтиловый эфир, диоксан, CH2CI2, CH3CN или выбранных из О, N или S, где N гетероцикла, неДМФ и кислота (например, CH3SO3H), другого обязательно, замещен радикалом R и атом углеключевого промежуточного продукта -2рода или атом азота на гетероцикле может быть пирролидинокарбамид-3-карбоновой кислоты-N-l замещен радикалом R или R', арил-, гетероарил-, замещенного алкил, арилалгетероарил, где гетероарил выбран из незакил- или гетероарилалкилгидразида, который помещенных или замещенных ароматических радисле снятия защиты или удаления BOG или другой калов и их бензопроизводных, включающих пириобъемной N-защитной группы, приводит селективдил, тиенил, фуранил, или из групп, содержащих но к N-2-защищенному PQD Пирролидин может два гетероатома, выбранные из N, О или S, таких быть замещен эквивалентным количеством амикак пиразол, имидазол, дитиол, оксатиол, изоксана, который приводит к амиду с ограниченной стезол, оксазол, тиазол, изотиазол или из групп, сорической доступностью и который действует как держащих три гетероатома, выбранных из N, О подходящая уходящая группа или S, таких как триазол, оксадиазол, диоксазол 60291 20 19 В ЕРО номер 0516297 АІ описаны некоторые S(O)mR, NH(C1-4anKnn) или ^С1-С4элкил) 2 , пиридазиндионы Кроме того, соединения (I) тиено гетероарила, где гетероарил выбран из незаі [2,3 5,6]пиридо[2,3-а]пиридазин-5,8,9 (4Н,6Н,7Н)мещенных или замещенных ароматических радитрион и (2) тиено [3,2 5, 6]-пиридо[2, 3калов и их бензопроизводных, включающих пирисі]пиридазин-4,5,8(6Н,7Н,9Н)-трион известны, надил, тиенил, фуранил, или из групп, содержащих пример из J Heterocychc Chem , 28, 205, (1991) два гетероатома, выбранные из N, О или S, таких как пиразол, имидазол, изоксазол, оксазол, тиаДругие производные пиридазиндиона известзол, изотиазол или из групп, содержащих три гены, например, из Beilstem"s Handbuch der Orgamтероатома, выбранных из N, О или S, таких как schen Chemie/ Goodard et al , Bull Soc Chim Fr, триазол или оксадиазол, или из групп, содержа1588, (1972), и Reid et al , Chem Bet, 85, 204, щих 4 гетероатома, таких кактетразол, где N гете(1952) С другой стороны, соединения по настояроарильной группе необязательно замещен R, и щему изобретению относятся к новым 2- или 3замещенные ароматические заместители вклюзамещенным пиридазиндионам или их таутомечают обычные ароматические заместители, вырам, как показано формулой I или Г бранные из гидрокси, алкокси, галогена или циано, Отдельные группы этой широко определенной и гетероарильная группа присоединена к -(СН 2 ) П группы соединений включают соединения, имеючерез атом углерода или гетероатом гетероарильщие конкретные формулы II или III, где, в случае ной группы, формулы II Z выбран из О, S или NH, п равно 0-3, Кольцо А выбрано из ортозамещенного арои их фармацевтически приемлемые соли Наматического или гетероа ром этического пяти- или стоящее изобретение относится также к фармашестичленного кольца, выбранного из фенила, цевтическим композициям соединения формулы пиридила, пирролила или тиенила, либо незамеII, указанного выше, с фармацевтически приемлещенного, либо замещенного по одному или более мой добавкой Кроме того, изобретение относится углеродным атомам кольца группой R4, где R4, к важным промежуточным продуктам, которые независимо, выбран из группы, содержащей водоиспользуются в синтезах соединения формулы II, род, галоген, (1-4С)алкил, NO2, CN, (С1где L в приведенной выше формуле выбран из 3)перфторалкил, ОН, OCF3, (2-4С)алкенил, (2галогена (Br, Cl, F или I) и п -больше нуля Этот 4С)алкинил, О(1-4С)алкил, NR'R", SO2NR'R" или промежуточный продукт используется при получеS(O)nR', нии некоторых глицин рецепторных антагонистов формулы II В случае соединения формулы III, R1 обозначает -(CH ) L, где L выбран из 2 n ОН, -О(С1 -С4алкил), -О(С1 -С4алкил)арила, (С1-С4алкил) COOR1, OCOR1, S(O)mR', NR'R", при условии что NR'R" не равен NH2, NR'COR", OCONR', NR'CO2Rn, NRCONR'R", COR' или CONRR', при условии что п больше нуля, арила или его бензопроизводных, либо незамещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включающим галоген, -(С1-С6)алкил, -(С2-С6)алкенил или алкинил, -окси (СО-6алкил) фенил, -ОН, (С1-С6) алкокси, OCF3 CF3, NO2, CN, NH2, S(O)mR', NH (C14алкил), гетероарил или ^С1-С4элкил) 2 , гетероцикла, где гетероцикл выбран из пятии/или шести и/или- семичленного гетероцикла, содержащего 1, 2 или 3 гетероатома, выбранных из О, N или S, где N гетероцикла, необязательно, замещен радикалом R' и атом углерода или атом азота на гетероцикле может быть замещен R или R или атом углерода может быть дизамещен с образованием С5-С7 спиро-группы, или атом углерода или атом серы может быть замещен О с образованием карбонильной группы или сульфонильной группы (S(O)m), где гетероциклические группы могут быть выбраны из, например, 2пирролидинона, пиперазина, оксазолидона, 2,5оксазолидиндиона, 2,4-имидазолидиндиона, 2,4тиазолидиндиона или сукцинимида, его арил или бензо, или гетероарилбензо производных (3,4пиридиндикарбоксимид, -1-фталимидо, ангидрид N-карбоксиантраниловой кислоты (isatoic anhydride), ортобензойный сульфимид), либо незамещенных, либо моно-, ди-или тризамещенных алкильными или ароматическими заместителями, включающими -галоген, -С1 -Сбалкил, -ОН, С1 Сбалкокси, фенил, OCF3, CF3, NO2, CN, NH2, Z выбран из О, S или NH, кольцо А выбрано из ортоконденсированного ароматического или гетероа ром этического пятиили шестичленного кольца, выбрэнного из фенилэ, пиридилэ, пирролилэ или тиенилэ, либо незэмещенного, либо полизэмещенного по углероду кольцэ группой R4, где R4, незэвисимо, выбрэн из группы, содержэщей водород, гэлоген, (14С)элкил, NO2, CN, (С1-3)перфторэлкил, ОН, OCF3, (2-4С)элкенил, (2-4С)элкинил, 0(14С)элкил, NR'R", SO2NR'R" или S(O)mR', R2 обознэчэет -(CH2)nL, где L выбрэн из -ОН, -О(С1 -С4элкил), -О(С1 -С4элкил)эрилэ, (C1-C43nKnn)COOR', их эрил или бензопроизводных, либо незэмещенных, либо моно-, ди- или тризэмещенных эромэтическими зэместителями, включэющими гэлоген, -С1-С6элкил, S(O)mR', -ОН, С1-С6элкокси, CF3, OCF3, NO2, CN, NH2, NH (C1С4элкил) или N (С1-С4элкил)2, при условии что п больше нуля, гетероциклэ, где гетероцикл выбрэн из пятии/или шести и/или семичленного гетероциклического кольцэ, содержэщего 1,2 или 3 гетероэтомэ, выбрэнных из О, N или S, где N гетероциклэ, необязэтельно, зэмещен R и этом углеродэ или этом эзотэ гетероциклэ может быть зэмещен R или R', гетероэрилэ, где гетероэрил выбрэн из незэмещенных или зэмещенных эромэтических рэдикэлов и их бензопроизводных, включэющих пиридил, тиенил, фурэнил, или из групп, содержэщих двэ гетероэтомэ, выбрэнные из N, О или S, тэких кэк пирэзол, имидэзол, изоксэзол, оксэзол, тиэзол, изотиэзол или из групп, содержэщих три ге 60291 22 21 2 тероатома, выбранных из N, О или S, таких как включая их холиновые соли R , в случае формутриазол или оксадиазол, или из групп, содержалы III и с Z и кольцом А, указанными выше, выщих четыре гетероатома, таких как тетразол, где бран из -(CH2)nL, где L выбран из N гетероарильной группы необязательно замещен -ОН, (п>0), (С1-С4алкил)карбокси, их арил или R, и замещенные ароматические заместители бензопроизводные, либо незамещенные, либо включают обычные ароматические заместители, моно-, ди- или тризамещенные обычными аромавыбранные из гидрокси, алкокси, галогена или тическими заместителями, включающими циано, и гетероарильная группа присоединена к галоген, -С1 -Сбалкил, OCF3, CF3, гидрокси, С1 (СН2)П через атом углерода гетероарильной групСбалкокси, NO2, CN, NH2, NH(C1-4anKmr), S(O)mR' пы, или N(C1-C4anKHn)2, 2 п равно 0-3, Более конкретно, в случае формулы III, R выи их фармацевтически приемлемых солей бран из -(СН2)п где п равно 0 и L выбран из 4Настоящее изобретение относится также к фарS(O) m R^eHHna, где m равен 0-2, 2-метилфенила, мацевтическим композициям соединения форму2-метил-4-хлорфенила, 3-нитрофенила, З-хлор-4лы III, указанного выше, с фармацевтически приметилфенила, 4-трифторметилфенила, 3,4емлемой добавкой Кроме того, изобретение отнодиметоксифенила или 2, 4-дихлорфенила сится к важным промежуточным продуктам, котоПредпочтительно, настоящее изобретение отрые используются в синтезах соединения формуносится к соединениям формулы II или их фармалы III, где L в приведенной выше формуле выбран цевтически приемлемым солям, где из галогена (Br, Cl, F или I) Этот промежуточный кольцо А выбрано из ортоконденсированного продукт используется при получении некоторых фенила, 7-хлорфенила, 7,9-дихлорфенила, 7глицин рецепторных антагонистов формулы III хлор-9-метилфенила, 7-метил-9-хлорфенила, 7,9диметилфенила, 7-хлор-8-нитрофенила,7,9Более конкретно подгруппы включают соедидихлор-8-нитро-фенила, 7-хлор-9-этилфенила, где нения, имеющие конкретные формулы II или III, цифровые обозначения относятся к положению на где Z выбран из кислорода, конечной пиридазинхинолиновой кольцевой сискольцо А выбрано из фенила или замещеннотеме, го фенила, где фенильный цикл моно-, ди- или тризамещен галогеном, нитро или простым С1Z выбран из кислорода, С4алкилом, включающим метил, этил или пропил, R1 выбран из -(CH2)nL, где R1, в случае формулы II, выбран из -(CH2)nL, L выбран из -ОН, -О(С1-С4алкил), -О(С1где L выбирают из С4алкил)арила, (С1 -C4anKHn)CO2R', OCOR1, S(O)mR', NR'R", при условии, что NR'R" не равно -ОН, -О(С1 -С4алкил), -О(С1 -С4алкил)арила, NH2, NR'COR", OCONR', NR'CO2R", NRCONR'R", (С1-С4алкил)СО2Р\ OCOR1, S(O)mR', NR'R", при CO2R' или CONRR, при условии что п больше нуусловии, что NR'R" не равен NH2, ля, NR'COR", OCONR1, NR'CO2R", NRCONR'R", CO2R' или CONRR', при условии что п больше арила или его бензопроизводных, либо незануля, мещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включающими их арил или бензопроизводных, либо незамегалоген, -С1-Сбалкил, -ОН, С1-Сбалкокси, OCF3, щенных, либо моно-, ди- или тризамещенных NO2, CN, CF3, NH2, S(O)mR', NH(C1-C4anKHn) или ароматическими заместителями, включающими N(C1-C4anKnn)2, галоген, -С1-С6алкил, -ОН, С1-С6алкокси, окси(С1-С4) алкилфенил, -С2-4алкенил, CF3, сукцинимида, пиперазина или его замещенных OCF3, NO2, CN, NH2, -C(O)NR'R", гетероарил, призводных, где заместители выбраны из (С1S(O)mR, NH (С1-С4алкил) или N(C1-C4 алкил)2, 4алкила), фенила, включая замещенный фенил, где фенильные заместители являются обычные сукцинимида, оксазолидона, пиперазина, или ароматические заместители 2,5их замещенных производных, где заместители выбраны из (С1-С4алкила), фенила включая заоксазолидиндиона или его замещенных производмещенный фенил, где фенильные заместители ных, выбранных из С1-С6алкила, фенила или заявляются обычными ароматическими заместитемещенного фенила, С3-С6спироалкила, пирролилями, 2-пирролидинона и его замещенных произдона и его замещенных производных, выбранных водных (например, (С1-6)алкил, гидрокси), 2,5из С1 -Сбалкила, гидрокси, фенила, 2,4оксазолидиндиона или его замещенных производимидазолидиндиона или его замещенных произных (например, алкил, диалкил, фенил, дифенил, водных, выбранных из С1-Сбалкила, фенила или спиро(С4-6)алкил), 2,4-тиазолидиндиона, 2,4замещенного фенила, 2,4-тиазолидиндиона или имидазолидиндиона или их замещенных произего замещенных производных, выбранных из С1водных (например, алкил, диалкил, фенил, дифеСбалкила или фенила, или бензо или гетероарил нил), или их бензо или их гетероарил бензопроизбензо гетероциклических производных, выбранводных, выбоанных из фталимидо, ортобензойноных из -1-фталимида, ортобензойного сульфимиго сульфимида, ангидрида Nда, ангидрида N-карбоксиантраниловой кислоты или 3,4-дикарбоксимида, карбоксиантраниловой кислоты или 3,4пиридиндикарбоксимида, гетероарила, где группы выбраны из тиофена, пиррола, фурана, пиразола, имидазола, триазола, тетразола или пиридина, п равен 0-3 и их фармацевтически приемлемых солей, гетероарила, выбранного из тиофена, имидазола, триазола, тетразола, фурана или пиридина, и п -0-2 Преимущественно, для соединений формулы II, п равен нулю, и L выбран из фенила, 4метоксифенила, 4-гидроксифенила, 4хлорфенила, 4-метилфенила, 23 60291 4-изопропилфенила, нафтила, 4-фторфенила, 4-бромфенила, 2-метоксифенила, 2гидроксифенила, 3-метоксифенила, 3гидроксифенила, 4-трифторметоксифенила, 3хлор-4-метоксифенила, 5-метокси-З-пиридила, 4-3(О)тР'фенила, где т равно 0-2, и R' обозначает метил, 3хлорфенила, З-хлор-4-гидроксифенила, 2-метил4-хлорфенила, 3-метилфенила, 2-метилфенила, 3-фторфенила, 2,4-дифторфенила, 3,5трифторметилфенила, 3-нитрофенила, 2фторфенила, 2, 4-диметилфенила, З-хлор-4метилфенила, 4-трифторметилфенила, 4иодфенила, 3,4-диметилфенила, 3,4диметоксифенила, 2-метил-4-метоксифенила, 2метокси-4-бромфенила, 2-метил-4гидроксифенила, 4-этилфенила, 2,3диметилфенила, 3,4-дигидроксифенила, 2,4диметоксифенила, 2,4-дихлорфенила, 4нитрофенил-2,5-диметоксифенила, 2,5диметилфенила, 4-оксибензилфенила, 2,5дигидроксифенила, 4-винилфенила, 2,5дифторфенила, 2-метил-4-фторфенила, 3,5диметоксифенила, 4-карбоксифенила, 4формамидофенила, 4-(N,Nдиэтилформамидо)фенила, 4-цианофенила или 4тетразолфенила Преимущественно, настоящее изобретение относится также к соединениям формулы II, где п равно 1, и L выбран из какоголибо из указанных выше значений для п, равном нулю, и более конкретно, к соединениям, выбранным из 1 -фторфенила, 4-цианофенила, 4трифторметилфенила, 4-метилфенила, пентафторфе-нила или 3,5-дитрифторметилфенила, или к соединениям формулы II, где п равно трем, и L выбран из какой-либо группы, указанной для п, равного нулю или единице, а более конкретно, к соединениям, выбранным из фенила или фенила, замещенного обычным ароматическим заместителем Из описанных здесь замещенных алкил(С16)арилов, содержащие фенильные заместители, увеличивающие липофильность с повышением активности красных ядер, являются особенно полезными Например, повышенную активность имеют фторированные, алкилфтоированные, алкил(С1-4) или моногалогенированные бензильные производные (С1-С6)алкильные группы, замещенные концевой CF3 группой особенно полезны ввиду их неожиданной способности к растворимости, а также полезны в связи с их липофильностью Пиридилбром соль, присоединенная к N-2этильному радикалу в PQD кольце, и где азот пиридила непосредственно присоединен к концевому углероду этила, не обладает свойствами глицинового антагониста Пиридильные кольца, присоединенные посредством атома углерода пиридильного кольца к (СН2)П группе соединения формулы II, обладают значительной глицин рецепторной антагонистической активностью Настоящее изобретение предпочтительно также относится к соединениям формулы II, где п равно двум, и гетероциклическая часть, как описано здесь, присоединена к 2-этиловому углероду и выбрана из 1-фталимидо, 4-фенилпиперазина, 24 сукцинимида, 3,3-диметил-2,5-оксазолидиндиона, 1-метил пиррол ид ина, З-метил-З-фенил-2,5оксазолидиндиона, 3-І\І-метил-2,5имидазолидиндиона, 4,4-диметил-2,5имидазолидиндиона, 4, 4-дифенил-2,5имидазолидиндиона, 2,4-тиазолидиндиона, 3, 4пиридиндикарбоксимида, сульфимида оротобензойной кислоты (сахарин), 4-цикло-гексилспиро2,5-оксазолидиндиона, ангидрида N-карбоксиантраниловой кислоты, бензо[е] [1 3] оксазин-2,4диона, 4-фенил-2,5-оксазолидиндиона или 3гидрокси-З-метил-2-пирролидинона Предпочтительные соединения, для которых п равно единице и L обозначает гетероцикл, включают группы, выбранные из тетрагидрофурана, пиперидина, N-метил пиперидина, тетрагидрофурана, 1,3-диоксана, бензо-1,4-диоксана или сульфимида ортобензойной кислоты Настоящее изобретение также, предпочтительно, относится к соединения формулы II, где R1 равно (CH2)nL и где п равно единице, и L обозначает гетероарил, выбранный из тиофена, или пиридила, или фурана, или их замещенных производных, где заместители выбраны из обычных ароматических заместителей (например, гидрокси, галоген, С1-С6алкил, фенил или гетероарил), или из групп, выбранных из имидазола, тиазола, тиадиазола, пиридопиридина, пиримидина, пиразина, пиридазина, бензотиофена, фурана, бензофурана, индола или триазола, или из замещенных производных Предпочтительные группы, когда п равно двум и где гетероарильная группа присоединена к 2-этиловому углероду, включают члены, выбранные из имидазола, триазола, тетразола или пиридина Настоящее изобретение относится также, преимущественно, к соединению формулы II, где п равно двум, и L равно W, где\Л/ выбран из группы, содержащей гидрокси, ацетокси, бензоиламидо, 2-гидрокси-2-метилпропамидо, 4-метоксианилин, 1 -формамидоцикло-гексанол, 2гидроксибензамидо, дифенилгидроксиацетамидо, -S-СНз, -S(O)2-CH3, -S-4-метоксифенил, Sциклопентил, -3(О)2-этил, -S-этил, -S-бутил, -3(0)2бутил или -S-пропил Кроме того, эти группы могут быть выбраны из Орп, галогена, -CH2-COOR' или CH2CONR'R", ОСНз, ОСН2СН2ОСН3, ОСН2СН2ОСН2СН3 -О-2-ме-токсифенила, S(O)2Ph, -S(O)2NR'R", -CF(CF3)2, -CF2CF3, CF2CF2CF3, -OC2H5OC2H5, -CH2NR'R" или СН2СН2СОСНз Настоящее изобретение относится также к фармацевтическим композициям, содержащим предпочтительное соединение формулы II, указанное выше, и фармацевтически приемлемый носитель Необходимо учесть, что описанные здесь формулы могут быть представлены в виде различных таутомерных и связанных с расположением изомерных форм, как обсуждается далее Настоящее изобретение включает, если не указано особо, такие альтернативные формы, а также включает их соли, особенно фармацевтически приемлемые соли присоединения Многие из описанных здесь соединений могут существовать и быть представлены в виде различных точных таутомерных форм (например, 25 соединения соответствующие соединению формулы I) Указывается, что таутомерные формы этих соединений могут также существовать, когда Z обозначает гидрокси, тиогидрокси, амино или алкиламино, как показано в формуле Г Специалисту в данной области будет должно быть понятно, что некоторые соединения формулы I содержат асимметрически замещенный атом углерода, и, следовательно, могут существовать и быть выделены в оптически-активных и рацемических формах Кроме того, будет ясно, что некоторые соединения формулы If например, соединения, содержащие двойную связь, могут существовать и быть выделены в виде раздельных стереоизомерных форм ('Е' и 'Z') относительно этой группы Некоторые соединения могут проявлять полиморфизм Необходимо учесть, что настоящее изобретение включает любую рацемическую, оптически активную полиморфную и стереоизомерную форму, или их смеси, обладающую свойствами, используемыми при лечении нейродегенеративных заболеваний, при этом хорошо известно в данной области, как получить оптически-активные формы (например, путем разделения рацемической формы или путем синтеза из оптическиактивных исходных материалов) и индивидуальные 'Е' и 'Z' стереоизомеры (например, хроматографическим разделением из смеси), и как определить нейрозащитные свойства путем описанных здесь ниже стандартных испытаний Далее, изобретение относится к способу лечения неврологических заболеваний, включающий введение млекопитающему, при необходимости такого лечения, эффективного количества соединения согласно изобретению, как определено выше, или его фармацевтически приемлемой соли, или композиции, как определено выше Изобретение также включает способ антагонизации NMDA рецептора у млекопитающих, включающий введение фармацевтически эффективного количества соединения или его соли, как заявлено в формуле изобретения, или фармацевтической композиции, как изложено здесь, нуждающемуся в лечении пациенту Предпочтительной областью терапевтического применения является профилактика и/или лечение припадка Фармацевтически эффективное количество соединения, как заявлено в формуле изобретения и раскрыто в настоящем изобретении, может вводиться сразу после ишемического приступа для предотвращения разрушения и/или отмирания клеток Настоящее изобретение относится также к способу профилактики и/или лечения нарушения, вызванного возбуждающими аминокислотами, такими как L-глутамат Изобретение также относится к способу предупреждения избыточного притока ионов кальция в центральных нейронов Изобретение относится к способу предупреждения ишемического нейронного повреждения после транзиторной глобальной ишемии и к способу уменьшения размера инфаркта после локального ишемического инсульта путем обработки пациента, при необходимости его лечения, фармацевтически эффективным количеством соединения формулы I или Г где Z, кольцо А и R1 и R -такие, как здесь указано Кроме того, что они используются при лечении больных с вне 60291 26 запным острым приступом, соединения и композиции изобретения могут быть чрезвычайно успешными при профилактике неирологической заболеваемости в процессе восстановления сердечной деятельности или назначаться в качестве церебральных профилактических средств в процессе хирургического вмешательства с высокой степенью риска В данном описании термины "алкил" и "алкокси" включают как разветвленные, так и линейные радикалы, но следует учесть, что ссылки на индивидуальные радикалы, такие как "пропил" или "пропокси" включают только линейные ("нормальные") радикалы, изомеры с разветвленной цепью, такие как "изопропил" или "изопрокси" указываются особо Термин "галоген" включает фтор, хлор, бром и йод, если не оговорено иного Термин "гетероарил" включает гетероароматические группы или их бензопроизводные, которые конкретно или обобщенно описаны или раскрыты в данном описании Конкретные значения (1-4С)алкила включают метил, этил, пропил, изопропил, бутил, изобутил, фтор-бутил и трет-бутил Конкретные значения (2-4С)алкила, содержащие двойную или тройную связь, включают винил, 2-пропенил (те аллил), 2-пропинил, (те пропаргил), 2-бутенил и 3-бутенил Конкретные значения (1-4С)алкокси включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси Конкретные значения (1-6С)алкила включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, изопентил, неопентил, гексил, изогексил Конкретные значения (2-6С)алкила, содержащего двойную или тройную связь, включают винил, 2-пропенил (т е аллил), 2-пропинил, (т е пропаргил), бут-2-енил, 2-пентенил, 3-пентил, 4пентенил, 4-пентинил, 5-гексенил, 5-гексинил Конкретные значения фенила, замещенного 04 заместителями, могут включать, но не ограничиваются для фенила, 2-, 3- и 4-галогенфенил, 2-, 3и 4-аминофенил, 2-, 3- и 4-гидроксифенил, 2-, 3- и 4-цианофенил, 2-, 3- и 4-нитрофенил, 2-, 3- и 4метилфенил, 2, 3- и 4-этилфенил, 2-, 3- и 4пропилфенил, 2,3 или 4-изопропилфенил, 2-, 3- и 4-метоксифенил, 2-, 3- и 4-этоксифенил, 2-, 3- и 4пропоксифенил и 3,5-дигалогенфенил, 3-галоген4-гидроксифенил и 3,5-дигалоген-4гидроксифенил, и фенил замещенный по 1, 2 или 3 углеродным атомам радикалом метоксиэтокси, метоксиэтилоксиэтилокси, N.N-диметилэтилокси и N.N-диметилэтиламинил, 3,4-диметокси, 3,4дигидрокси, 3,5-дигидрокси, 3,5-диметокси, 3,5дигидрокси или 2,3,4-SMe или SH и, кроме того, включает группы, выбранные из 4(ЗСЬСНзЭфенила, 2-метил-4-хлорфенила, 2,4дигалогенфенила, 4-(тетразол)фенила, 3, 5трифторметилфенила, 2,4-диметилфенила, 3галоген-4-метилфенила, 4-трифторметилфенила, 3, 4-диметилфенила, 2-метил-4-метокси-фенила, 2-метокси-4-галогенфенила, 2-метил-4гидроксифенила, диметоксифенила, 2,3-диметилфенила, 2,5-диметоксифенила, 2,42,5 27 60291 диметилфенила, 4-(бензилокси)фенила, 4(этокси)фенила, 2,5-дигидроксифенила, 4винилфенила, 2,5-дигалогенфенила, 2-метил-4фторфенила или 2,3 или 4 (CONR'R"^ei-mna Конкретные значения фенил(1-4С)алкила, замещенного 0-4 заместителями, могут включать бензил, фенилэтил, фенилпропил, фенилбутил, 2, 3-, 4- и 5-галогенбензил, 2, 3- и 4-СРз-бензил, 2-, 3- и 4-аминобензил, 2-, 3-, 4-цианобензил, 2-, 3-й 4-нитробензил, 2, 3- и 4-метилбензил, 2-, 3- и 4этилбензил, 2-, 3-й 4-пропилбензил, 2-, 3-й 4гидроксибензил, 2-, 3- и 4-метоксибензил, 2-, 3- и 4-этоксибензил, 2-, 3- и 4-пропокси-бензил, и 3,5дигалогенбензил, З-галоген-4-гидроксибензил, 3,5диСРзбензил и 3,5-дигалоген-4-гидроксибензил или 2,3,4,5,6-пентагалогенбензил, и фенил (14С)алкил, замещенный радикалом метоксиэтилокси, метоксиэтилоксиэтилокси, N,Nдиметилэтилокси и N.N-диметилэтиламинил, 3,4диметокси, 3,4-дигидрокси, 3,5-диметокси, 3,5дигидрокси или 2,3,4-SMe или 2,3,4-SH Конкретные значения от 4- до 7-членных колец, содержащих азот, могут включать пиперидино, пирролидинил и азетидинил Конкретные значения гетероциклических радикалов с 2 гетероатомами включают пиперазинил, морфолинил, оксазолинил или тиазинил Конкретные значения гетероциклов или их замещенных производных включают 2пирролидинон, сукцинимид, оксазолидон, 2,5оксазолидиндион, 2,4-тиазолидиндион, 2,4имидазолидиндион и различные бензопроизводные, включающие фталимидо, ангидрид изатовой кислоты, бензо[е][1,3]оксазин-2,4-дион, 3,4пиридин-дикарбоксимид или сульфимид ортобензойной кислоты Более частные значения галогена включают хлор и бром Более частные значения (1 ЗС)перфторалкила включают трифторметил и пентафторэтил Более частные значения от 4- до 7-членных колец, содержащих азот, включают пиперидино, пиперазинил и пирролидинил Более частные значения (1-ЗС)алкила, замещенного трифторметильной группой, включают трифторметил и 2-трифтор-ме тилэтил Более частные значения гетероарила включают тетразол, фуран, тиофен, диазол, имидазол, триазол, пиридин, пиримидин, пиридазин или пиразин Более частные значения m включают 0-2 Более частные значения п включают 0-2 Более частные значения фенила, замещенного 0-3 заместителями, могут включать фенил, 2- и 4-галогенфенил, 2-й 4-аминофенил, 2-, 3- и 4гидроксифенил, 2-, 3- и 4-метокси-фенил, 2,4дигалогенфенил, 3,5-дигалогенфенил, 2,6дигалоген-4-гидроксифенил, 2-галоген-4метилфенил, 2-метокси-4-метилфенил, 2-метил-4метоксифенил, З-гидрокси-4-метилфенил, 2гидрокси-4-метилфенил, 2-метил-4-метоксифенил, 2,4-диметилфенил, 3,4-диметоксифенил, 2-метил4-метоксифенил, 3,4-дигидроксифенил или 2,4диметилфенил, и включают значения радикалов, особо подтвержденные в примерах Более частные значения фенил(1-4С)алкила, 28 замещенного 0-3 заместителями, могут включать бензил, фенилэтил, 2- и 4-гало-генбензил, 2- и 4цианобензил, 2- и 4-нитробензил, 2- и 4метоксибензил, 2,4-дигалогенбензил, 3,5дигалогенбензил и 2,6-дигалоген-4гидроксибензил Соответствующие фенетиловые изомеры также могут быть включены 1 Предпочтительные значения R включают гидроксиэтил, ацетоксиэтил, фталимидоэтил, бромэтил (как промежуточный продукт при получении глицин рецепторных антагонистов), фенил, SC^Me фенил, метоксифенил, гидроксифенил, бензил, (фенилпиперазино)этил, фенетил, хлорфенил, метилфенил или (С1-С4 алкил) фенил 1 Более частные значения R включают 2гидрокси-этил, 2-ацетоксиэтил, 2-фталимидоэтил, фенил, 4-метокси-фенил, 4-гидроксифенил, бензил, 2-(4-фенилпиперазино)этил, 2-фенетил, 4хлорфенил, 4-метилфенил или 4изопропилфенил Конечно, предпочтительные значения для Z, кольца A, R1 и R2 и других, указанных в формулах I, Г, II, III и т д включают значения или группы, которые, в частности, представлены в примерах и/или на схемах Наиболее предпочтительные значения Z включают О или ОН Предпочтительные значения R4 включают водород, фтор, хлор, бром, йод, амино, метил, этил, пропил, аллил, пропаргил, трифторметил, пентафторэтил, трифторметилэтил, нитро, метокси, этокси, пропокси и циано Более предпочтительные значения R4 включают водород, фтор, хлор, бром, иод, метил, этил, трифторметил, нитро, метокси, амино и циано Предпочтительные соединения, имеющие формулу I (или II) включают (а) 7-Хлор-1-гидрокси-2-(2-гидроксиэтил)-3, 4,5,10-тетрагидро-пиридазино[4,5-Ь]хинолин-4,10дион, (Ь) 2-(2-Ацетоксиэтил)-7-хлор-4-гидрокси-1, 2, 5,10-тетрагидро-пиридазино[4,5-Ь]хинолин-1,10дион, (с) 7-Хлор-4-гидрокси-2-(2-фталимидоэтил)1,2,5,10-тетрагидропиридазино [4,5-Ь]хинолин1,10-дион, (d) 7-Хлор-4-гидрокси-2-фенил-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, (е) 7-Хлор-4-гидрокси-2-(4-метоксифенил)1,2,5,10-тетрагидропиридазино [4,5-Ь]хинолин1,10-дион, (f) 7-Хлор-4-гидрокси-2-(4-гидроксифенил)1,2,5,10-тетрагидропиридазино [4,5-Ь]хинолин1,10-дион, (9) 4-Гидрокси-8-нитро-2-(фенил)-1,2,5,10тетрагидропиридазино [4,5-Ь]хинолин-1,10-дион, (h) 2-Бензил-7-хлор-4-гидрокси-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, 29 (і) 7-Хлор-4-гидрокси-2-[2-(4фенилпиперазино)этил]-1,2,5,10тетрагидропиридазино [4,5-Ь]хинолин-1,10-дион, (I) 7-Хлор-4-гид рокси-2-(2-фенетил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, (Ю 7-Хлор-4-гид рокси-2-(4-хлорфенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, (I) 7-Хлор-4-гидрокси-2-(4-метилфенил)-1,2, 5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион, (т) 7-Хлор-4-гидрокси-2-(4-изопропилфенил)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (п) 7,9-Дихлор-1-гидрокси-2-фенил-1, 2, 5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион, (о) 7-Хлор-4-гидрокси-2-(1-нафтиламино)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (Р) 7-Хлор-2-(4-фторфенил)-4-гидрокси-1, 2, 5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион, (q) 2-(4-Бромфенил)-7-хлор-4-гид рокси-1,2,5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион, (О 7-Хлор-4-гидрокси-2-(2-метоксифенил)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (s) 7-Хлор-4-гидрокси-2-(2-гидроксифенил)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (t) 7-Хлор-4-гидрокси-2-(3-гидроксифенил)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (и) 7-Хлор-4-гидрокси-2-(3-метоксифенил)1,2,5,10-тетрагид ро-пиридазино[4,5-Ь]хинолин1,10-дион, (v) 7-Хлор-4-гидрокси-2-(4трифторметоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион, (w) 7-Хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, (х) 7-Хлор-2-(2-метоксипирид-5-ил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, и кроме того, включают специфические и более предпочтительные соединения, выбранные из (1) 7-Хлор-4-гидрокси-2-(4-метокси-2метилфенил)-1,2,5,10-тетрагид ропиридазино[4,5Ь]хинолин-1,10-дион или его N-метилглюкаминовая соль, (2) 60291 30 7-Хлор-2-(4-хлор-2-метилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, (3) 7-Хлор-2-(2,4-диметилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, (4) 7-Хлор-2-(3,4-дигидроксифенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, (5) 7-Хлор-2-(3,4-диметоксифенил)-4-гидрокси1,2, 5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, (6) 7-Хлор-4-гидрокси-2-(2-метилтиоэтил)1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинолин1,10-дион, U) 7,9-Дихлор-2-(2,4-диметилфенил)-4-гидрокси1,2,5,10-тетрагид ропиридазино[4,5-Ь]хинол ин1,10-дион, а также включают соединения (8) 7-Хлор-4-гидрокси-2-(2-метил-2гид роксипропионамидоэтил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион или (9) 7-Хлор-4-гидрокси-2-(фуран-2-илметил)1,2,5,10-тетрагидропиридазино [4,5-Ь] хинолин-1, 10-дион или их фармацевтически приемлемые соли Предпочтительным является внутривенный путь введения Пиридазиндионы формулы I или Г (или II, или III) могут быть получены способами, включающими способы, известные в химической технике для получения структурно аналогичных соединений Соединения, в которых Z обозначает Н могут быть получены путем хлорирования гидрокси группы диалкил-4-ОН-хинолин-2,3-дикарбоксилата (исходное вещество) с использованием оксихлорида фосфора Этот хлорированный продукт затем восстанавливают, используя тетракистрифенилфосфин Pd(O) и формиат натрия для получения диметилхинолин-2,3-дикарбоксилата, который затем подвергают оставшимся химическим стадиям (например, добавляя гидразин и т д ) Способы получения пиридазиндиона формулы I, как указано выше, приведены в качестве дополнительных признаков изобретения и иллюстрируются следующими далее методиками, в которых значения основных радикалов соответствуют приведенным выше, если не оговорено иного (а) для получения соединения формулы I, путем обработки соответствующего сложного диэфира формулы IV (где R13 обозначает (С1С3)алкил), арил или гетероарилзамещенным гидразином, где арил выбран из фенила или его бензопроизводного (например, нафтил), либо незамещенного, либо замещенного 1,2 или 3 группами, выбранными из -О-(1-4С)алкила, -ОН, галогена, NO2, -CN, -CF3, -NH(CO)R', -(1-4C) алкила, -NR'R", -CO2R', -CONR'R", -S(O)mR, -SO2NR'R", -(C1-C6) алкилокси (С1-С6) алкилокси-, гидрокси(С1С6)алкилокси-, (С1-С6)алкилокси(С1 60291 32 31 С6)алкилокси(С1-С6)алкилокси-, гидрокси(С1положению, а фильтрат затем дополнительно обС6)алкилокси(С1-С6)алкилокси-, 0(С1рабатывают уксусной кислотой до рН около 5,5 с получением твердого продукта, который является C6anKHn)NR'R", -NR'(C1 -C6anKHn)NR'R", -(C1 1 изомером по 2-положению (VI) C6anKHn)NR'R", OCF3, -NR (С1-С6алкил), -NR'(C1Сбалкилгидрокси), и гетероарил выбран из неза(d) для получения соединения формулы I, как мещенных или замещенных ароматических радиуказано выше в (с), где замещенная алкильная калов и их бензопроизводных, включающих пиригруппа содержит гетероциклические радикалы, дил, тиенил, фуранил или из групп, содержащих путем (1) обработки соответствующего соединедва гетероатома, выбранных из N, О или S, таких ния формулы VI или VI' (где W обозначает (-ОН)), как пиразол, имидазол, изоксазол, оксазол, тиагалогенводородной кислотой (НВг) с образованизол, изотиазол или из групп, содержащих три геем соответствующих галогенированных продуктов тероатома, выбранных из N, О или S, таких как и (2) обработки этого соединения нуклеофильнытриазол, оксадиазол, где N на гетероарильной ми реагентами с получением соединения форму1 2 группе необязательно замещен радикалом R, и лы I, где R и R обозначают -(СН2)пгетероцикл, замещенные ароматические заместители вклюгде гетероцикл включает пяти- и/или шести и/или чают обычные ароматические заместители, высемичленный гетероцикл, содержащий 1,2 или 3 бранные из гидрокси, алкокси, галогена или циано, гетероатома, выбранных из О, N или S, где N геи гетероарильная группа присоединена к -(Cbbjn тероцикла необязательно замещен радикалом R', посредством атома углерода на гетероарил ьной и атом углерода или азота гетероцикла может группе, что дает соединение формулы V (пирробыть замещен радикалом R или R', или с получело[3,4-Ь]хинолин) при кипячении вышеуказанных нием соединения формулы I с R', равным реагентов в (1) этаноле или другом подходящем (CH2)nNu, где Nu также равен ArNH-, R'NH-, АЮ-, растворителе в течение 12 часов с последующим ArS- или другому обычному нуклеофилу, который нагреванием до температуры кипения в уксусной может взаимодействовать с алкилбромидом кислоте (АсОН) Соединение формулы V обраба(Схема 4) Описанное здесь галогенированное тывают затем метансульфононовои кислотой промежуточное соединение также используют для (МеБОзН) в кипящем метаноле или другом подхополучения карбоновой кислоты и/или ее сложных дящем растворителе в течение восемнадцати производных путем взаимодействия бромпроизчасов с образованием соединения формулы I, где водного с цианидом натрия и затем гидролизом R1 или R2 обозначает арил, как это указано выше или этерификациеи полученного цианопроиводно(Схема 1), го (b) для получения соединения формулы I, путем обработки соответствующего сложного диэфира формулы IV (где R13 обозначает (С1С3)алкил), (С1 -С6)алкиларил или (С1 С6)алкилгетеро-арилзамещенным гидразином, где арил или гетероарил -такие, как определено выше в (а), в (1) этаноле при кипячении и (2) в уксусной кислоте при кипячении с образованием соединения формулы I, где R1 и R2 выбраны из (С1-С6) алкиларила, где арил и гетероарил имеют вышеуказанные значения Изомеры положения, полученные по данному способу, легко могут быть разделены фракционированным подкислением растворов меглумин/холина (Схема 2), (c) для получения соединения формулы I путем обработки соединения формулы IV (где R13 обозначает (С1-С3)алкил), (С1С6)алкилзамещенным гидразином, в котором алкильная группа дополнительно замещена заместителями, выбранными из ОН, OR', SR' или NR'R" в этаноле, при температуре кипения с последующей обработкой кипящей уксусной кислотой с образованием соединения формулы VI или VI', где R1 и R2 обозначают замещенные алкильные радикалы, как указано выше Полученные соединения (где Y обозначает ОН, SH или NHR) могут затем быть преобразованы с образованием соединений, где W представляет -NR'COR", OCONR', NR'CO2R", NRCONR'R", CO2R' или CONRR', или как указано здесь далее (Схема 3) Изомерную смесь обрабатывают водным меглумином или водной смесью меглумин/холина с образованием раствора, который далее подкисляют уксусной кислотой до рН6-7 Твердый осадок затем отфильтровывают для отделения изомера по 3 (e) для получения соединения формулы I описанным здесь новым способом, выполняемым согласно общей методике, описанной в схеме 5, и конкретно проиллюстрированной в примерах 3581 3-Карбоалкокси-4-гидроксихинолин-2карбоновая кислота (полученная из соответствующего сложного диалкилэфира (IVі) взаимодействует с тионилхлоридом с образованием соответствующего З-карбоалкокси-2-хлорангидрида, который взаимодействует либо с арилгидразином, где арил -такой как определено выше (в соответствующих условиях, как показано в примерах), или с гетероарилгидразином, где гетероарил является таким, как определено выше (при соответствующих условиях, приведенных в примерах) Растворители, используемые для получения гидразида, включают любой безводный органический растворитель, выбранный из, например, ТГФ, толуола, CH2CI2 СНзСІ, гексана или любого инертного органического растворителя Настоящее изобретение относится к новому способу получения 2-замещенных пиридазинохинолинов формулы I (или II), где R1 обозначает арил или гетероарил, который включает стадии (і) образования промежуточного З-карбоалкокси-2хлор-ангидрида из соответ-ствующего сложного диалкилового эфира формулы IV и (м) взаимодействие указанного хлорангидрида со стадии (і) либо с арилгидразином, где арил -такой, как определено выше, в условиях, описанных в примерах, либо с гетероарилгидразином, где гетероарил является таким, как определено выше, в условиях, описанных в примерах, с получением соединения формулы II, где R1 обозначает арил или гетероарил В этом способе получается также некоторое количе 33 ство 3-изомера Вышеприведенный новый способ необязательно протекает через новое ключевое промежуточное соединение, выбранное из N-2арил (или гетероарил) гидразида 3-карбоалкокси4-гидроксихинолин-2-карбоновой кислоты Реакция циклизации из ацилгидразида в PQD трициклическую кольцевую структуру оптимально осуществляется в метансульфоновой кислоте и метаноле Однако, могут применяться алкилсульфоновые кислоты низкого молекулярного веса (С1С4) и спирты низкого молекулярного веса (С2-С6 ал кил) с необязательными сорастворителями, выбранными из, но не ограниченными ими, ТГФ или диоксана или эквивалентных растворителей, которые растворяют реагенты Кроме того, при некоторых обстоятельствах (например, с заместителями, богатыми электронами на ароматическом кольце) альтернативные кислоты, например, разбавл HCI в НгО, могут также использоваться для достижения циклизации Кроме того, могут быть также использованы другие органические растворители, такие как диэтиловый эфир, диоксан, CH2CI2, СНзСІЧ, ДМФ или эквивалентный растворитель для осуществления сочетания или циклизации Этот промежуточный продукт, преимущественно, используют при получении соединений формулы II, где R1 обозначает арил Гидразид может, в зависимости от арил или гетероарилзаместителей, переходить непосредственно в 2замещенный PQD или через промежуточное пятичленное пиррольное производное, которое дает затем как 2, так и 3 замещенные PQD Электронодонорные группы на ариловом кольце способствуют селективному образованию 2-замещенного PQD Стерические эффекты также могут влиять на степень селективности (f) для получения соединения формулы I новым описанным здесь способом, выполненным согласно общей методике, описанной в Схеме 6, и конкретно проиллюстрированным в не ограничивающих примерах 42а и 43а и в примерах 82-103 и примерах 138-142 2Пирролидонкарбамидхинолин-3-карбоновая кислота, полученная гидролизом соответствующего 3-метилового эфира, который получают взаимодействием соответствующей 3карбометоксихинолин-2-карбоновой кислоты с дициклогексилкарбодиимидом или другим подходящими диимидным связывающим реагентом, таким как диизопропилкарбодиимид и пирролидин, взаимодействует с N-трет-бутоксикарбонилN'-2(CH2)nM (n=0-4) гидразином [(полученным взаимодействием либо (а) трет-бутилкарбазата и желаемого С1-С4 алкиларила или замещенного алкиларила или алкоксиалкил производного, где концевой алкильный углерод имеет подходящую уходящую группу, выбранную из галогена (X) или трифлата, в растворителе, таком как ДМФ, CH2CI2 или СНзСІЧ или их эквивалента, и основания, такого как Net3 или, для п=0 (например, прямое нарильное замещение), других групп, которые могут легко взаимодействовать с третбутилкарбазатом с образованием исходного дизамещенного гидразина трет-бутил-О-(СО)-М-г\ІR1, включающего любой алкиларил, арилоксиалкил, алкилоксиалкил, алкилоксиалкилокси или 60291 34 алкилгетероарил, указанный здесь, где алкильная группа имеет подходящую уходящую группу, либо (Ь) подходящего арила или замещенного арилгидразина с ди-трет-бутилдикарбонатом в органическом растворителе (например, ТГФ или ему эквивалентный), либо (с) (для п=1-4) подходящего арила или замещенного арилальдегида или замещенного алкилальдегида с третбутилкарбазатом в кипящем гексане или эквивалентном органическом растворителе, с образованием соответствующего имина, который затем восстанавливают восстанавливающим агентом (например, ВНз ТГФ или ЬАІЬЦ), с образованием ключевого промежуточного гидразида, который циклизуют в СНзЭОзН/ТГФ или эквивалентном растворителе с целью селективного образования 2-замещенного арила или алкиларила PQD или замещенного алкила PQD Этот способ может быть обычно использован для селективного получения соединения формулы II Третбутилкарбазат коммерчески доступен, a R1замещенныи гидразин трет-бутилкарбоната легко получить (д) N-2-арил- и гетероарилзамещенные изомеры могут легко и селективно быть получены, как показано на схеме 7, путем обработки арил- или гетероарил гидразина бензальдегидом с последующим восстановлением гидразидимина с образованием г\І-арил-І\І-бензилзамещенного гидразина Это соединение подвергают затем взаимодействию с З-карбокси-эфир-2-хлорангидрид хинолином с образованием ключевого гидразидного промежуточного продукта, например, N-2-арил (ил и гетероарил)-1\1-1 -бензил-гидра-зид 3-карбоалкокси4-гидроксихинолин-2-карбоновой кислоты, который обрабатывают последовательно холингидроксидом при нагревании (80-180°С) и метансульфокислотой или эквивалентной кислотой в присутствии или отсутствии растворителя для селективного образования N-2-арил PQD Следует отметить, что обычно, когда используют несимметричные гидразины, например, где R1 и R2 являются различными группами, или когда используют монозамещенный гидразин, должна получаться смесь продуктов (2-замещенные и 3замещенные, если не применять описанный здесь новый способ Такие смеси разделяют стандартными (например, хроматографией и перекристаллизацией) методиками, известными в данной области и используемыми для этих целей Соединение формулы I, где L обозначает гетероциклический радикал, такой как 4-(С1-С6)замещенный пиперазин или 4-арилзамещенный пиперазин или фталимидо или другой коммерчески доступный нуклеофильный гетероцикл, может быть получено взаимодействием гетероциклических нуклеофильных соединений с 2- или 3-галоген(С1С6алкил)пиридазино[4,5-Ь]хинолинами формулы I, последний из которых получают из соответствующих гидрокси соединений, как описано выше в (d) Как будет показано в приведенных далее примерах, соединения в рамках данного изобретения получают применением разнообразных химических синтетических стадий или методик Ключевые промежуточные продукты показаны на схемах или описаны в тексте Примеры 1-34 исходят, обычно, 35 60291 из соединений формулы IV и дают, не селективным способом, через промежуточный продукт V (за исключением примеров, где замещение или взаимодействие с N-2-гидроксиалкил производным) желаемые или предпочтительные N-2-арилили замещенный арилпроизводные (например, R'арил или замещенный арил, и п=0) Этим способом получают также N-2-бензил- или фенетилпроизводные и их замещенные варианты Изомеры, полученные этим способом, легко разделимы Другие ключевые промежуточные соединения в начальных примерах включают N-2-гидроксиалкил PQD, который затем взаимодействует с (низший алкил)-(С1-4)-кислотами с образованием соответствующего сложного эфира Углеродная цепь, связанная с N-2-азотом, может содержать 1-6 углеродных атомов с гидрокси группой на конце N-2 арил производные получают также в примерах 35 и т д , где ключевым промежуточным соединением является хинолин-2-хлорангидрид, который взаимодействует с арил гидразином, образуя, в некоторых случаях селективно, N-2-арил PQD Конечно, N-метил-глюкамин или другие соли (например, холина, натрия и т д ) легко получить из соответствующего предшественника Промежуточным продуктом, получаемым из хлорангидрида, является N-2 арил (или замещенный арил) гидразид 3карбалкокси-4-гидроксихинолин-2-карбоновой кислоты, который при благоприятных условиях образует N-2-арилзамещенный PQD Усовершенствованная методика, использующая 1 экв исходного арилгидразина, описана в примерах Обычно используют для циклизации промежуточного гидразида метансульфокислоту в метаноле или ТГФ Конечно, любые метоксифенилпроизводные могут быть гидролизованы НВг или другой кислотой (например, CH3SO3H), образуя соответствующие гидроксипроизводные N-2-гидроксиалкил PQD производные используются для получения соответствующих N-2галогеналкил PQD производных, которые используются в качестве промежуточных соединений для получения, например, N-2-anKnn(C1 С4)тиоалкил(С1-С4)глицин рецепторных антагонистов Соответствующий тиолят анион повергают взаимодействию в ДМФ с N-2-гал о ген ал кил PQD Конечно, амины, анилины или другие гетероциклические или гетероарильные нуклеофилы могут взаимодействовать с ^2-алкил-(С1-С4)галоген PQD, образуя соответствующий нуклеофильный замещенный PQD В этом способе используют ДМФ или эквивалентный органический растворитель Приведенный в качестве примера, но не ограничивающий, ключевой способ селективного получения N-2-арила, гетероарила, замещенного алкила или других производных, полученных из любых N-2-промежуточных соединений, включает получение сначала 2пирролидинамидозамещенного хинолина, который образуется из соответствующего 2-карбокси-Зкарбоалкоксихинолина Это соединение или аналогичные соединения (например, с группами, эквивалентными пирролидинамидо) гидролизуют до образования соответствующего 2пирролидинамидо-3-карбоксихинолина, который 36 1 затем подвергают сочетанию с выбранным R -NN-C(O)O-TpeT-6yrHn гидразином, используя выбранный диимид (например, ДСС или эквивалентный), с получением ключевого гидразидного промежуточного соединения, например, 2пирролидинамидо-3-карбоновой кислоты-NR'N(BOG) гидразида, который, в условиях циклизации, образует N-2 замещенный PQD без образования в каких-либо количествах N-3 замещенного PQD Используемые в этом способе гидразины легко получают из коммерчески доступных продуктов, как описано здесь, где либо третбутилкарбазат, либо ди-трет-бутилдикарбонат используются для БОС при одном из N гидразина, в зависимости оттого, является ли R'apnnoM, или алкиларилом, или замещенным алкилом, или гетероарилом, или алкилгетероарилом Например, бензил или замещенные бензил производные, описанные здесь, легко и удобно получены из соответствующей 2-пирролидинамидо-З-карбоновой кислоты и N-6eH3nn-N1-TpeTбутилкарбоксигидразина, который в настоящее время получают из соответствующего арилалкилгалогенида и трет-бутилкарбазата Третбутилкарбазат легко вступает в обменную реакцию с галогеном или спиртом, таким как трифлат, образуя желаемый гидразин Другой промежуточный и глицин рецепторный антагонист включает N-2-арил PQD, замещенный циано заместителем или заместителями Эта группа (CN) может быть затем преобразована с получением карбоновых кислот, карбон и лгал огенидов, сложных эфиров, амидов или тетразолов Как указано ранее, для получения различных гетероциклических соединений или их бензо- или гетероарилбензопрозводных, являющихся глицин рецепторными антагонистами, используют анионное замещение (нуклеофильное замещение) N-2 галоген(С1-4)алкил PQD взаимодействует с выбранным нуклеофилом (гетероциклический или гетероарильный, где гетероарил включает, например, соединения, показанные в примерах и описанные здесь} с образованием соответствующего ^2-нуклеофил-(С1-4)алкил PQD Некоторые N-2-гетероциклические PQD могут быть затем гидролизованы с образованием амидоспиртов, входящих в объем настоящего изобретения Например, оксизолидиндионы легко гидролизуются до соответствующих амидоспиртов, как показано в примере 112 и таблице 5 На страницах с формулами показаны некоторые из ключевых перечисленных здесь промежуточных соединений Основные промежуточные соединения включают соединения формул XIV-XX Настоящее изобретение относится к способу получения соединения формулы II, включающему (а) обработку соединения формулы V или XIV кислотой, выбранной из низших алкил(С1С4)сульфоновой кислоты, в подходящем органическом растворителе, или (Ь)обработку соединения формулы IV алкиларил- или алкилгетероарилгидразином в среде полярного растворителя и слабой кислоты, или (с) обработку соединения формулы IV, где Y выбран из -ОН, -SE или NHR, где R обозначает (С1-С4)адкил, реагентом, выбранным из (і) 60291 38 37 2 R NC(O)CI, или (и) RC(O)X или (їм) ROC(O)CI, или ком как трет-бутанол, для осуществления замыка(iv) HBr/NaCN/H2O или ROH, или (v) RNCO, или ния цикла и, тем самым, получения желаемого R'R'NC(O)CI, или из другой электрофильной групсложного диэфира В указанном соединении форпы, перечисленной здесь, с образованием, в частмулы VII, значение Y соответствует следующим, с ности, соединения формулы XXI, или получением соответствующего значения для Z, как указано (сі)обработку соединения формулы XV, где X обозначает галоген, нуклеофильным реагентом, а СНО, если желаемое значение Z -водород, 15 15 выбранным из гетероцикла или его бензо-, или b COOR где R обозначает (С1-СЗ) алкил, гетероарилбензопроизводных, или если желаемое значение Z -гидрокси (таутомерно эквивалентный оксо), Указывается, что могут ис(e) обработку соединения формулы XXII запользоваться алкилсложные эфиры, но они не мещенным гидразином с образованием соединедают какого-либо синтетического преимущества) ния формулы XVII в органическом растворителе в 15 15 подходящих условиях, или с CSOR или CSSR , если для Z желательно значение тиогидрокси (SH), и (f) обработку соединения формулы XVIII связывающим реагентом, выбранным из диимида и d CN, если желаемое значение Z-амино дизамещенным гидразином формулы R'Не требуется выделение соединения формуг\1НМНС(О)О-трет-бутил в органическом растворилы VII для получения соответствующего соединетеле в присутствии соответствующей кислоты, или ния формулы IV Лучше получить сложный диэфир формулы IV в одном реакторе, без выделе(д) последующую обработку соединения форния соединения формулы VII из реакционной смемулы II, как указано в п 2, где соединение содерси жит фенильное кольцо замещенное метоксигруппои или группами, кислотой с получением феСложный диэтиловый эфир формулы IV, где нильного заместителя или заместителей, или Z обозначает гидрокси (или оксо), может быть дальнейшую обработку соединения формулы II, также получен обработкой ангидрида Nгде соединение не находится в форме соли, фаркарбоксиантраниловой кислоты формулы X непомацевтически приемлемым основанием с получесредственно натриевой или калиевой солью (С1нием фармацевтически приемлемой соли, или С3)алкилового (например, дизтилового) эфира 2дальнейшую обработку соединения формулы II, оксоянтарной кислоты в подходящем растворитегде соединение содержит фенильное кольцо зале, таком как диметилформамид мещенное цианогруппой или группами, (і) основаСложный диэфир формулы IV, где Z обознанием с получением карбо кислоти о го заместителя чает тиогидрокси может быть получен обработкой или заместителей, или (м) кислотой с получением соответствующего сложного диэфира формулы IV, амидного заместителя, или (ш) азидом с получегде R3 обозначает гидрокси, реактивом Лавессона нием тетразольного заместителя, где карбокис(Lawesson's), 2,4-бис(4-метоксифенил)-1,3-дитиалотный заместитель может быть затем обработан 2,4-дифосфетан-2,4-дисульфидом в подходящем галогенирующим агентом и замещенным амином растворителе, таком как толуол или диметоксиформулы HNR'R" с получением замещенного этан при температуре 50-110°С амидного заместителя, или карбокислотный радиЗамещенный имид формулы V, где Вкал может быть далее обработан спиртом (С1-С6) кольцевой N теряет Н, и Z обозначает, например, в присутствии кислоты с получением сложноNH2, может быть получен обработкой сложного эфирного заместителя (С1-С6), или диэфира формулы IV, где значению Z соответствует галоген группа, такая как хлор или бром, ам(п) последующую обработку соединения формиаком с образованием фталимида, которьй мулы II, где соединение содержит оксозолидиндивзаимодействует затем с арилгидразином, обраон, основанием в водном растворе с получением зуя V, который затем реагирует обычным образом амидоспиртового заместителя качестве W, конце(Схема1), образуя конечный пиридазинохинолин вого для (СЬІ2)п углеродной цепи при п равном 1-4, или Соединение формулы VII, где Y обозначает (і) последующую обработку соединения форCN, СНО, COOR15, CSOR15 или CSSR15, где R15 мулы II, где соединение содержит сульфидную обозначает С1-С10 алкил, алкенил или алкинил группу, окислительным агентом в подходящих усгруппу, может быть получено обработкой соответловиях для образования S(O)i или S(O)2 группы ствующего VIII диалкилацетилендикарбоксилатом, таким как диметил-ацетилендикарбоксилат, в подЕсли они не доступны коммерчески, необхоходящем растворителе, таком как (С1-С4)спирт В димые исходные продукты для описанных выше качестве растворителя предпочтителен третпревращений могут быть получены способами, бутанол которые выбраны из стандартных органических химических методик, способов, аналогичных синОрто-амин формулы VIII может быть получен тезам известных, структурно подобных соединеэтерификацией соответствующей кислоты формуний, или способов, аналогичных описанным выше, лы VIIIі обычными способами В свою очередь, или способов, описанных в примерах кислота формулы VIII' может быть получена снятием защиты у соответствующего производного Некоторые сложные диэфиры формулы IV для формулы VIII", где аминогруппа была защищена использования в реакциях с замещенным гидраобычной защитной группой Рг (такой как третзином с целью получения соединения формулы I, бутоксикарбонил, t-BOC) Соединение формулы могут быть получены обработкой соединений VIII", в свою очередь, может быть получено поформулы VII подходящим основанием, таким как следовательным взаимодействием амина формуалкоголят щелочного металла (например, третлы IX сначала с двумя эквивалентами литииоргабутоксид калия) в подходящем растворителе, та 60291 40 39 4 нического соединения (например, трет|\| -арил или замещенные арилпроизводные полубутиллития) с образованием дилитиевого произчают с помощью этого нового способа, дающего водного, которое может быть карбоксилировано возможность селективного получения N-2путем взаимодействия с двуокисью углерода замещенных PQD Этот способ может быть предАмин формулы IX может быть получен защитой почтительным для арилзамещенных производных, соответствующего (незащищенного) амина обычперечисленных здесь и в формуле изобретения ными способами Следует отметить, что многие из исходных Орто-амин формулы VIII, где Y обозначает веществ для описанных выше способов синтеза 15 COOR , также может быть получен способом, являются коммерчески доступными и/или широко который отличается от только что описанного выизвестны в научной литературе ше, тем, что стадию этерификации осуществляют, Примерами подходящих фармацевтически используя основание (например, гидрида натрия) приемлемых солей служат соли, образованные 15 и затем алкилирующий агент R X с защищенной основаниями, которые дают физиологически прикислотой формулы VIII", а не кислотой формулы емлемый катион, такой как щелочной металл VIII (особенно литий, натрий и калий), щелочноземельный металл (особенно кальций и магний), Орто-амин формулы VIII, где Y обозначает 15 соли алюминия или аммония, а также соли, полуCOOR , также может быть получен соответстченные с подходящими органическими основавующего ангидрида N-карбоксиантраниловой киниями, такими как холингидроксид, триэтиламин, слоты формулы X основанием (таким как гидроокморфолин, пиперидин, этилендиамин, лизин, этасись щелочного металла) в спиртовом раствориноламин, диэтаноламин, триэтаноламин, N-метилтеле формулы R15OH D-глюкамин (меглумин), аргинин и трис(гидроксиАнгидрид N-карбоксиантраниловой кислоты метил) аминометан Предпочтительны натриевые формулы X может быть получен обработкой изаи калиевые соли холина и меглумина Натриевые тина формулы XI триоксидом хрома в присутствии и калиевые соли холина особенно предпочтительуксусного ангидрида, или надоксикарбоновой кины слотой, такой как магниевая соль мононадоксифталиевои кислоты, и в подходящем растворителе, При внутривенном терапевтическом применетаком как уксусная кислота нии, после приступа, пиридазиндион формулы I обычно вводят в виде подходящей фармацевтиИзатин формулы XI может быть получен цикческой композиции, которая содержит соединение лизацией гидроксииминацетамида формулы XII в по изобретению, указанное выше, вместе с фарконцентрированной серной кислоте при темперамацевтически приемлемым растворителем или туре 60-80°С носителем, при этом композицию подбирают с Гидроксииминоацетамид формулы XII может учетом конкретного выбранного пути введения быть получен обработкой амина формулы XIII с Такие композиции составляют следующий объект хлоральгидратом в присутствии сульфата натрия изобретения Они могут быть получены обычными и гидрохлорида гидроксиламина и в подходящем способами с использованием обычных добавок и растворителе, таком как вода N-третсвязующих веществ и могут быть в виде различбутоксикарбонилгидразины, используемые по наных дозированных форм Например, они могут стоящему изобретению, могут быть получены событь в форме таблеток, капсул, растворов или гласно способу, приведенному далее в примере суспензий для перорального введения, в форме 82С Например, г\І-трет-бутоксикарбонил-г\Гсуппозитариев для ректального введения, в форпентафторбензил гидразин, N-третме стерильных растворов или суспензий для ввебутоксикарбонил-г\І-2-цианобензил гидразин, Nдения путем внутривенной или внутримышечной трет-бутоксикарбо-нил-г\Г-3-хлорбензил гидразин, инъекции или вливания, и в форме порошков вмег\|-трет-бутоксикарбонил-г\Г-3,5-дитристе с фармацевтически приемлемыми инертными фтормети л бензил гидразин, N-треттвердыми разбавителями, такими как лактоза, для бутоксикарбонил-г\Г-3-фенил пропил гидразин, Nвведения путем вдувания трет-бутоксикарбонил-г\Г-4-метилбензил-гидразин, г\|-трет-бутоксикарбонил-г\Г-4Доза вводимого соединения согласно изобретрифторметилбензил-гидразин, N-треттению обязательно должна варьироваться в соответствии с правилами хорошо известными в данбутоксикарбонил-г\Г-4-цианобензилгидразин и Nной области, учитывающими способ введения, трет-бутоксикарбонил-М'-2, 4степень пост ишемического поражения, вес и воздиметилфенилгидразин Кроме того, настоявшее раст пациента Обычно, соединение согласно изоизобретение относится также к этим новым гидрабретению вводится теплокровным животным (тазинпроизводным и к способу их получения и приким как человек) в количестве, требуемом для менения в качестве промежуточных продуктов для достижения эффективной дозы, обычно дозы в соединения с ключевой промежуточной 2интервале приблизительно от 0,01 до 100мг/кг пирролидинокарбамидхинолин-3-карбоновой кивеса тела Например, если соединение вводится слотой с целью образования соединения формувнутривенно, его количество составляет приблилы II с помощью нового и оригинального способа, зительно в интервале от 0,5дл 100мг/кг веса тела как описано здесь, в результате которого селективно образуется N-2-замещенный PQD ПромеСпециалисту в данной области техники понятжуточные гидразины, используемые для получено, что соединение согласно изобретению может ния N-2-арил или N-2-замещенных арил PQD, мовводиться совместно с другими терапевтическими гут также быть получены согласно не ограничиили профилактическими средствами и/или медивающему примеру 42а N'-трет-бутоксикарбонилкаментами, которые не являются с ними медицин 60291 42 41 ски несовместимыми используют для определения неспецифического 3 связывания Связанный [ Н]-глицин определяют Действие соединений согласно изобретению от свободного, используя харвестер клеток Branкак антагонистов к глицин рецептору NMDA рецеdel пторного комплекса могут быть продемонстрированы одним или более стандартными исследова(Biomedical Research and Development Laboraниями, такими как исследование на связывание tories, Gaithersburg, MD) для вакуумной фильтра3 [ Н]-глицина (испытание А) и исследованиями in ции через фильтры из стекловолокна (Whatman vivo, такими как ишемия, индуцируемая каротидGF/B from Brandel, Gaithersburg, MD), предвариной окклюзией на модели песчанки (испытание В) тельно пропитанные 0,025% полиэтиленимином В дополнение к этим испытаниям, соединения Образцы, оставшиеся на фильтре из стекловолокданного изобретения проверяют испытанием на на промывают 3 раза в общей сложности 2,5мл красных ядрах клеток (испытание С) и испытанием холодного буфера Радиоактивность измеряют на средней церебральной артерии крыс (испытажидкостным сцинтилляционным счетчиком Знание D) Эти испытания подтверждают, что соедичение IC50 получают из регрессии по наименьшим нения по изобретению являются NMDA рецепторквадратам logit-log (длинные логарифмы) обраными антагонистами in vitro и in vivo Некоторые ботки данных Характерные ICso значения для сосоединения по изобретению являются сильно единений по изобретению составляют обычно действующими NMDA рецепторными антагонименее 50мкМ стами Некоторые из перечисленных соединений (микромолей) и иллюстрируются соединением (то есть, 3-(2-ацетоксиэтил), З-(п-метоксифенил) примера 1 (1050=40мкМ), примера 2 или 3-(п-гидроксифенил)-7-хлор-4-гидрокси(ІС5о=0,50мкМ), примера 10 (1С5о=0,12мкМ) Другие 1,2,5,10-тетрагидропиридазино[4,5-Ь1хинолинприведенные здесь примеры описывают глицин 1,10-дионы) имеют значение ICso в [ H]Gly испытаантагонисты нии выше ЮОмикромоль и, таким образом, менее Испытание В активны, чем их более сильно действующие анаПри испытании in vivo, использующим ишемилоги В частности, соединения по настоящему 1 ческую модель песчанки, взрослые особи песчаизобретению с R , обозначающим алкил, арил или нок Mongolian (50-70г) анестезируют 2-3% галотагетероцикл, как определено здесь, и R2 равным Н, ном (halothane) Билатеральные общие каротидявляются сильно действующими рецепторными ные артерии шеи раскрывают и накладывают мик(глицин) антагонистами роаневрические зажимы Спустя 10 мин (если иного не указано) зажимы удаляют, восстанавливают Испытание А кровоток через каротидные артерии и кожу сшиВ исследовании на связывание [3Н]-глицина вают Исследуемые соединения вводят внутринейрональные синаптические мембраны получают брюшинно как до, так и после окклюзии, например, из взрослых (около 250г) самцов крыс Sprague за 45 минут до и через 5 минут после окклюзии Dawley Свежеиссеченные образцы коры головнокаротидных артерий Животных, которым симулиго мозга и гипокампа гомогенизируются в 0,32М рована операция, обрабатывают аналогичным сукрозы (110мг/мл) Синаптосомы выделяют ценспособом, за исключением того, что артерии не трифугированием (1 ОООоб/мин, 10мин), супернапережимаются Наблюдения за общим поведенитант осаждают (20000об/мин, 20мин) и вновь сусем, связанным с моторной активностью, провопендируют в дважды дистиллированной воде дятся в течение 2 часов первого (24 часа) дня поСуспензию центрифугируют 20мин при сле окклюзии Через 4 дня животных забивают 8000об/мин Полученный супернатант и лейкоцит(обезглавливание), извлекают головной мозг, ную пленку дважды промывают (48000об/мин, 10 фиксируют, разрезают и окрашивают гематоксимин вновь суспендируют в дважды деионизованлин/эозином и крезилвиолетом ной воде) Полученный осадок быстро замораживают (баня из сухого льда/этанола) под слоем Секции головного мозга оценивают на нейродважды деионизованной воды и хранят при -70°С нальные поражения гиппокампуса, используя слеВ день эксперимента оттаянные синаптические мембраны гомогенизирзуют в тканевом гомогенизаторе Bnnkmann Polytron (tm Bnnkmann Instruments, Westbury, NY) в 50миллимоль трис(гидроксиметил)аминометанцитрате, рН7,1 Мембраны инкубируют с 0,04% Sufact-AMPS X10Q (tm Pierce, Rockford, IL) в буфере в течение 20 минут при 37°С и промывают шесть раз путем центрифугирования (48000об/мин, Юмин) и вновь суспендируют в буфере Конечный осадок гомогенизируют при 200мг вес влажного/мл буфера для исследования на связывание Для [3Н]-глицин связывания N-метил-Оаспартат рецептору, 20наномоль [3Н]-глицина (4060Сі/ммоль, New England Naclear, Boston, MA) инкубируют с мембранами, суспендированными в 50 миллимоль трис(гидроксиметил)аминометанцитрате, рН7,1, в течение ЗОминут при 4°С Глицин, 1 миллимоль, дующую оценочную шкалу 0 = непораженные, нормальные 1 = слабое поражение (до 25%) -ограниченные САІ/подлежащая ткань пределами 2 = умеренные поражения (до 50%) очевидные поражения, ограниченные менее, чем половиной CAI области 3 = заметные поражения (до 75%) включающие более чем половину CAI области 4 = поражения, выходящие за CAI область Срезы (7 микрон) каждого мозга, подвергаются оценке Может быть отмечено случайное, асимметрическое поражение, и за рейтинговое значение принимается среднее показание двух сторон Регистрируют среднюю рейтинговую величину поражений мозга, и показатели нарушений для обработанных лекарственными средствами групп сравнивают с группой, обработанной растворите 43 лем, используя тест Wilcoxon-Rank Sum Обычные значения, полученные в этих испытаниях для соединений согласно изобретению, иллюстрируются следующими результатами 35% нейрозащита (относительно контроля с имитированной операцией) для соединения примера 4, и свыше 80% нейрозащита для соединения примера 10, когда каждое соединение вводится внутрибрюшинно (ip) при уровне 10мг/кг веса тела в соответствии с вышеприведенным режимом Испытание С Испытание красных ядер клеток Цель этого испытания состоит в определении воздействия введенных внутривенно глицин антагонистов на индуцированную возбуждающую реакцию клеток, содержащих красные ядра НА-966 (рацемическая) и CGP 37849 являются стандартными агентами, проявляющими активность в этом испытании (ID50 7,9 и 1,7мг/кг, внутрибрюшинно, соответственно) Методика испытания красных ядер клеток приведена далее Крыс анестезируют хлоральгидратом (400мг/кг, внутрибрюшинно) и вводят катетер в бедренную вену для внутрибрюшинного введения лекарственного средства Пятицилиндровые микропипетки размещают стереотаксикально в красных ядрах клеток Обычно, от трех до четырех из пяти цилиндров заполняются следующим образом цилиндр для регистрации -2М цитратом калия, цилиндр общепринятого сопоставления 4М NaCI, цилиндр для лекарственных средств -25мМ NMDA, а другой цилиндр для лекарственных средств -2,5мМ кискалевой (quisquahc) кислоты (QA используют только в исследованиях селективности) NMDA применяют ионофоретически при постоянном токе, который регулируется в зависимости от чувствительности каждой индивидуальной клетки, содержащей красное ядро NMDA двигается по кругу вперед и назад (обычно 30-60сек вперед и 60-120сек назад) и степень возбуждения клетки во время каждого периода регистрируется Как только нулевая степень возбуждения установлена, начинают внутривенно вводить испытуемое соединение Воздействие лекарственного средства на NMDAиндуцированную возбуждающую реакцию клетки, содержащей красное ядро, может быть оценено как качественно, так и количественно из регистрируемых и необработанных накопленных данных Соединения по изобретению проявляют значительную антагонистическую реакцию Испытание D Испытание на средней церебральной артерии крыс В этом испытании используют самцов крыс SHR, весящих 280-320г Способ использованный для непрерывной окклюзии средней церебральной артерии (МСА) описан Brmt и др (1988) Вкратце локальную ишемию вызывают путем окклюзии сначала левой общей каротидной артерии и затем левой средней церебральной артерии, расположенной точно над носовым отверстием После окклюзии, лекарственные средства вводят внутривенно через шейный катетор Спустя двадцать четыре часа после MCA/общей каротидной артерии окклюзии, животных забивают и быстро 60291 44 извлекают головной мозг Коронарные срезы ткани 1 мм толщиной делают, используя вибратом, и окрашивают 2,3,5трифенил-2Н-тетразолхлоридным красителем (ТТС) После окрашивания некротическую ткань легко отделяют от интактного мозга и участок инфарктной коры головного мозга исследуют на анализаторе изображения Размер инфаркта для каждого участка определяют количественно на анализаторе изображения и общий инфарктньй объем рассчитывают с помощью программы, суммирующей объем всего интервала См S Brmt et al , J Cerebral Blood Flow 8 474-485 (1988) Статистический анализ различия между объемом ишемического поражения в контроле с растворителем и обработанных лекарственными средствами животных выполняется на основе т-теста Стьюдента Все данные представ как среднее ± S Е значение для п животных Соединения по изобретению уменьшают ишемические поражения Далее изобретение иллюстрируется следующими не ограничивающими примерами В примерах, если не оговорено иного (і) температура дана в градусах Цельсия (°С), операцию выполняют при комнатной температуре или при температуре окружающей среды, т е при температуре в интервале 18-25°С, (м) упаривание растворителя выполняют, используя роторный испаритель при пониженном давлении (600-4000 Паскалей 4,5-ЗОмм рт ст) с температурой бани до 60°С, (ш) флэш-хроматографию выполняют на Merck Kieselgel (Art 9385) и колоночную хроматографию на Merck Kieselgel 60 (Art 7734), [эти материалы получают от фирмы Е Merck Darmstacdt, W Germany], тонкослойную хроматографию (ТСХ -TLC) вьшолняют на Analtech 0,25 мм силикагелевых ВДЖХ пластинах (Art 21521), получаемых от фирмы Analtech Newark, DE, USA, (iv) обычно, за ходом реакции следят методами ТСХ и ВДЖХ и реакционное время дается только для иллюстрации, (v) точки плавления приведены в точке, и (разл) означает разложение, приведенные точки плавления - это температуры, полученные для продуктов, полученных как описано, полиморфизм может выражаться в выделении веществ с различными температурами плавления при одном и том же способе получения, (vi) все конечные продукты, в основном, очищены ТСХ и ВДЖХ и дают удовлетворительный ядерный магниторезонансный спектр (ЯМР) (300МГц ПМР в D-ДМСО, если не оговорено иного) и микроаналитические данные, (VII) выходы приведены только для иллюстрации, (VIM) пониженное давление выражено в виде абсолютного давления в Паскалях (Ра), другие давления выражены в виде монометрических давлений в барах, (їх) химические символы имеют их обычные значения, использованы также следующие обозначения об (объем), вес (вес), т пл (точка плавления), л [литр(ы)], мл (миллилитры), мМ (миллимели), г [грамм(ы)], мг [миллиграмм(ы)], мин (минуты), ч (часы), и 45 60291 (х) соотношения растворителей даны в объем объем (v/v) терминах Что касается N-2 арил соединений в рамках данного изобретения, орто-заместители на фенильном кольце оказывают существенное воздействие на растворимость (водную) глицин рецепторных антагонистов В частности, ортометилзаместители повышают растворимость и активность in vivo Кроме того, путь представленный на Схеме 7 (см ниже), относится к эффективному способу получения N-2 гетероарилов в рамках настоящего изобретения Кроме того, заявленное изобретение относится к способу отщепления N-бензильных групп с помощью метансульфокислоты В приведенных далее спектрах ЯМР приняты следующие обозначения S -СИНГЛЄТ, m -мультиплет d -дублет, br -уширенный сигнал, t -триплет dd -двойной дублет Пример 1 7-хлор-1-гидрокси-3-(2-гидроксиэтил)-3,4,5,10тетрагидро-пиридазино[4,5-Ь]хинолин-4,10-дион, К перемешиваемой смеси диметил 7-хлор-1гидрокси-хинолин-2,3-дикарбоксилата (50, Ог, 0,169М), в этаноле (750мл) добавляют 2гидроксиэтилгидразин (286г, 3,38м) 90% чистоты вещество) Полученную темно-коричневую смесь нагревают при температуре кипения с обратным холодильником в течение 18 часов и затем оставляют охлаждаться до комнатной температуры без перемешивания Смесь фильтруют и собранный твердый продукт промывают один раз этанолом и затем нагревают при температуре кипения в течение с обратным холодильником 3 часов в ледяной уксусной кислоте (1,0л) Полученной смеси дают охладиться до комнатной температуры и затем фильтруют, отделяя желтый твердый продукт Этот продукт сушат в течение ночи в вакууме, получая (41,83г) смеси изомерных 2- и 3-(2гидроксиэтил) соединений в виде желтого твердого продукта Эту смесь разделяют на две фракции 20,23г и 21,6г Меньшую фракцию (20,23г) растворяют при энергичном перемешивании в воде (2700мл), содержащей N-метилглюкамин (54,Ог) Этот раствор осторожно подкисляют ледяной уксусной кислотой до достижения рН точно 7,0 и образовавшийся во время подкисления осадок отделяют фильтрацией Собранные твердые продукты промывают один раз водой, сушат и сохраняют Фильтрат и промывную воду также объединяют и сохраняют Большую из двух первоначальных фракций аналогичным образом растворяют в воде (2880мл), содержащей N-метилглюкамин (57,6г) и аналогично подкисляют ледяной уксусной кислотой до рН7,0, получая вторую порцию твердых продуктов Фильтрат и соответствующую промывную воду, полученные при этом подкислении, также объединяют и сохраняют Две порции собранных твердых продуктов объединяют и получают указанное в заголовке 3-(2-гидроксиэтил} соединение в виде светло-желтого твердого продукта (19,27г, 37,0%) Перекристаллизация части 46 этого продукта из уксусной кислоты дает аналитический образец указанного в заголовке соединения в виде светло-желтых кристаллов Т пл 377378°С, МС (CI) 308 (М+Н) Анализ для C13H10CIN3O4 Рассчитано С, 50 75, Н, 3 28, N, 13 66 Найдено С, 50 65, Н, 3 39, N, 13 78 ЯМР 13 19 (s, 1H, способный к обмену), 12 32 (s, 1Н, способный к обмену), 8 22 (d, J=9 ОГц, 1Н), 8 15 (d, J=1 8Гц, 1Н), 7 56 (dd, J=9 0, 1 8Гц, 1Н), 4 83 (br s, 1H, способный к обмену), 4 10 (t, J=5 7Гц, 2Н), 3 75 (t, J=5 7Гц, 2Н) Исходный диметил 7-хлор-4-гидроксихинолин2,3-дикарбоксилат получают следующим образом а Диметил 7-хлор-4-гидроксихинолин-2,3дикарбоксилат Перемешиваемую смесь метил 2-амино-4хлорбензоата (2,50г, 13,5мМ) и диметил ацетилендикарбоксилата (2,05г,14,4мМ) в третбутаноле (22мл) нагревают при температуре кипения с обратным холодильником в течение 7 часов в атмосфере азота После добавления дополнительного количества диметил ацетилендикарбоксилата (1,16г, 8,13мМ) и дополнительного нагревания при температуре кипения с обратным холодильником в течение 2,5 часов, реакционной смеси дают охладиться до комнатной температуры и добавляют за одну порцию трет-бутилата калия (1,56г,13,9мМ) Образовавшийся осадок и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 1,5 часа Реакционную смесь охлаждают до комнатной температуры и фильтруют для отделения твердых продуктов, которые промывают третбутанолом и диэтиловым эфиром Твердые продукты растворяют в воде и подкисляют 1 н серной кислотой до образования осадка Полученную смесь экстрагируют метиленхлоридом и объединенные экстракты промывают раствором соли и воды, сушат (MgSO4), фильтруют и концентрируют, получая зеленый твердый продукт Перекристаллизация этого твердого вещества из метанола дает диметил 7-хлор-4-гидроксихинолин-2,3дикарбоксилат (1,15г, 28,94) в виде не совсем белого твердого продукта, Т пл 232-233°С, МС (CI) 296 (М+Н) Анализ для C13H10CINO5 Рассчитано С, 52 81, Н, 3 41, N, 4 74 Найдено С, 52 75, Н, 3 47, N, 4 69 Пример 2 7-хлор-4-гидрокси-2-(2-гидроксиэтил)-1,2, 5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион Все фильтраты и промывные воды оставшиеся от Примера 1 объединяют и затем подкисляют ледяной уксусной кислотой до рН5,0 Образовавшийся осадок собирают, промывают водой и сушат, получая указанное в заголовке соединение в виде бледно-желтого твердого продукта (12,27г, 23,5%) Перекристаллизация части этого вещества из уксусной кислоты дает аналитический образец указанного соединения в виде не совсем белого кристаллического вещества Т пл 335-336°С, МС (CI) 308 (М+Н) Анализ для C13H10CIN3O4 Рассчитано С, 50 75, Н, 3 28, N, 13 66 Найдено С, 50 54, Н, 3 39, N, 13 65 60291 48 47 ЯМР 12 53 (br s, 1H, способи, к обмену), 11 87 7-Хлор-4-гид рокси-2-(2-гидроксиэтил)-1,2,5,10(brs, 1Н, способи, к обмену), 8 17 (d, J=8 7Гц, 1Н), тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион 8 04 (s, 1Н), 7 45 (d, J=8 7, Гц, 1Н), 4 82 (br s, 1Н, (8,00г, 26,00мМ) перемешивают в смеси водная способи, к обмену), 3 99 (t, J=6 1 Гц, 2Н), 3 70 (t, бромистоводородная кислота (50%, 80мл), 30% J=6 1Гц, 2Н) бромистоводородная кислота в ледяной уксусной кислоте (160мл) и метан сульфокислота (8мл), поПример 3 2-(2-Ацектоксиэтил)-7-хлор-4лучая красный раствор Этот раствор нагревают гидрокси-1,2,5,10-тетрагидропиридазино [4,5при температуре кипения с обратным холодильниЬ]хинолин-1,10-дион ком в течение 20 часов, за это время образуется Оранжевую суспензию 7-хлор-4-гидрокси-2-(2осадок Желтую суспензию охлаждают до комнатгидроксиэтил)-1,2,5,10-тетрагидропиридазино[4,5ной температуры и перемешивают 2 часа ТверЬ]хинолин-1,10-диона (0,250г, 0,81мМ) в 30% расдый продукт собирают и промывают смесью ацетворе бромистоводородной кислоты в ледяной тонитрил/диэтиловый эфир и диэтиловым эфиром уксусной кислоте (5мл) осторожно нагревают при и сушат порошок на воздухе МС (СІ) 370 (М+Н) температуре кипения с обратным холодильником в течение 16 часов в атмосфере азота Смесь охЯМР 13 00 (br s, 1Н, способи, к обмену), 8 23лаждают до комнатной температуры и разбавляют 8 18 (т, 2Н), 7 60 (dd, J=2 04, 5 73Гц), 5 20(t, водой (20мл) до образования осадка Собранные J=9 37Гц, 2Н), 4 56 (t, J=9 37Гц 2Н) твердые продукты промывают водой и метанолом Пример 5 Холиновая соль 7-Хпор-1-гидроксии затем сушат, получая указанное в заголовке 3-фенил-3,4,5,10-тетрагидропиридазино[4,5соединение (0,242г, 86%) в виде рыжеватоЬ]хинолин-4,10-диона коричневого твердого вещества 6-Хлор-2-анилин-2,3,4,9-тетрагидро-1Нпирроло-[3,4-Ь]хинолин-1, 3, 9-трион (1,70г, 5,0мМ) Т пл 307-309°С, МС (CI) 350 (М+Н) перемешивают в метаноле (0,85л) и добавляют Анализ для C15H12CIN3O5 • 0,2СН3СО2Н метансульфокислоту (85мл) Желтую суспензию Рассчитано С, 51 10, Н, 3 57, N, 11 60 нагревают при температуре кипения с обратным Найдено С, 50 81, Н, 3 45, N, 11 86 холодильником 16 часов и охлаждают до комнатЯМР 12 64 (brs, 1H, способи, к обмену), 11 91 ной температуры Полученную смесь фильтруют (br s, 1H, способи, к обмену), 8 14 (d, J=8 64Гц, (фильтрат сохраняют для использования в При1Н), 8 02 (d, J=1 74Гц, 1Н), 7 43 (dd, J=1 74, мере 6) и собранные твердые продукты промыва8 64Гц), 4 32 (t, и=5 54Гц, 2Н), 4 13 (t, J=5 54Гц), ют метанолом и сушат, получая 7-хлор-41 98 (s, ЗН) гид рокси-З-фенил-1,2,5,10Пример 4 7-хлор-4-гидрокси-2-(2тетрагидропиридазино[4,5-Ь]хинолин-4,10-дион фтал имидоэтил)-1,2,5,10(0,48г, 28%) в виде желтого порошка Этот поротетрагидропиридазино[4,5-Ь]хинолин-1,10-дион шок перемешивают в метаноле и добавляют гид2-(2-Бромэтил)-7-хлор-4-гид рокси-1,2,5,10роокись холина (45весов % в метаноле, 0,5мл), тетрагидропири-дазино[4,5-Ь]хинолин-1,10-дион получая раствор янтарного цвета Этот раствор (5,00г, 13,50мМ) и фталимид калия (10,50г, концентрируют и остаток разбавляют толуолом и 56,70мМ) перемешивают и кипятят с обратным концентрируют Остаток растворяют в толуоле и холодильником в ДМФ (100мл) в течение 22 часов концентрируют два дополнительных раза, и полуОхлажденную желтую суспензию выливают в разченный твердый остаток, растирают со смесью бавленную соляную кислоту (1н, 1,0л) при хороэтанолл'олуол (20%, 25мл), получая кристалличешем перемешивании Образуется белый осадок, ский твердый продукт Твердый продукт собирают, которьй собирают Этот твердый продукт ресусполучая указанное в заголовке соединение (0,49г, пендируют в водном метаноле (50%, 1,0л) и пере78%) в виде желтого порошка, Т пл 253-257°С, мешивают/воздействуют ультразвуком, получая МС (CI) 340 (М+Н) хорошую суспензию Фильтрация и повторное суспен-дирование в метаноле (0,25л) дают свободно текущую белую суспензию после обработки ультразвуком и непродолжительного нагревания при температуре кипения с обратным холодильником Твердые продукты окончательно собирают и промывают метанолом, получая указанное в заголовке соединение (4,65г, 79%) в виде белого порошка, Т пл 349-352°С, МС (CI) 437 (М+Н) Анализ для C21H13CIN4O5 • 0,35Н2О • О.ЮСНзОН Рассчитано С, 56 78, Н, 3 18, N, 12 55 Найдено С, 56 40, Н, 2 76, N, 12 59 ЯМР 12 54 (br s, 1Н, способи, к обмену), 11 88 (br s, 1H, способи, к обмену), 8 11 (d, J=8 67Гц, 1Н), 8 00 (br s, 1Н), 7 83 (s, 4H), 7 42 (d, J=8 67Гц, 1Н), 4 13(brm, 2H), 3 93(brm, 2H) Исходный 2-(2-бромэтил)-7-хлор-4-гидрокси1,2,5,10-тетра-гидроксипиридазино[4,5-Ь]хинолин1,10-дион готовят как описано ниже а 2-(2-Бромэтил)-7-хлор-4-гид рокси-1,2,5,10тетрагидро-пиридазино[4,5-Ь]хинолин-1,10-дион Анализ для C17H10CIH3O3 • C 5 Hi 4 NO • 0,30Н2О Рассчитано С, 58 90, Н, 5 31, N, 12 50 Найдено С, 58 88, Н, 5 18, N, 12 41 ЯМР 15 00 (s, 1H, способи, к обмену), 8 22 (d, а=8 79Гц, 1Н), 7 85 (d, J=2 01 Гц, 1Н), 7 61(d, J=7 53Гц, 2Н), 7 45 (t, J=7 53Гц, 2Н), 7 38-7 28 (т, 2Н), 5 31 (s, 1H, способи, к обмену), 3 83 (br m, 2Н), 3 39(brm, 2H), 3 10(s, 9H) Исходный б-хлор-2-анилин-2, 3,4, 9тетрагидро-1 Н-пирроло-[3,4-Ь]хинолин-1,3,9-трион получают следующим способом а 6-Хлор-2-анилин-2,3,4,9-тетрагидро-1Нпирроло[3,4-Ь]хинолин-1,3,9-трион К перемешиваемой суспензии диметил 7хлор-4-гидрокси-хинолин-2,3-дикарбоксилата (2,50г, 8,45мМ) в этаноле (35мл) добавляют фенилгидразин (5,82мл, 59,20мМ), получая коричневый раствор Этот раствор нагревают при температуре кипения с обратным холодильником в течение 16 часов, за это время образуется осадок Суспензию фильтруют горячей и собранные твер 49 60291 дые продукты промывают этанолом, получая фенил гид разиновую соль указанного в заголовке соединения в виде белого порошка (2,Юг) Этот продукт перемешивают и нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50мл) в течение 2 часов Полученную желтую суспензию охлаждают до комнатной температуры и фильтруют, получая указанное в заголовке соединение (1,70г, 59%) в виде желтого твердого продукта, Т пл 397°С, МС (CI) 340 (М+Н) Анализ для C17H10CIN3O3 Рассчитано С, 60 10, Н, 2 97, N, 12 40 Найдено С, 59 96, Н, 2 79, N, 12 45 ЯМР 13 80 (br s, 1H, способи, к обмену), 8 54 (s, 1Н, способи, к обмену), 8 23 (d, J=8 70Гц, 1Н), 7 89 (d, J=1 89Гц, 1Н), 7 58(dd, J=1 89, 8 70Гц, 1Н), 7 18(t, J=8 01Гц, 2Н), 6 82(т, ЗН) Пример 6 7-Хпор-4-гидрокси-2-фенил-1,2,5,10тетрагидрокси-пиридазино[4,5-Ь]хинолин-1,10дион Фильтрат, сохраненный из Примера 5, разбавляют водой (0,80л) и полученную рыжеватокоричневую суспензию перемешивают 1час Твердые продукты собирают и промывают водным метанолом (50%), получая указанное в заголовке соединение (1,20г, 71%) в виде не совсем белого порошка, Т пл 347-349°С, МС (CI) 340 (М+Н) Анализ для Ci 7 Hi 0 CIN 3 O 3 • 0,10Н2О Рассчитано С, 59 8 0, Н, 3 01, N, 12 30 Найдено С, 59 64, Н, 2 76, N, 12 27 ЯМР 12 8 (br s, 1H, способи, к обмену), 12 1 (br s, 1H, способи, к обмену), 8 16 (d, J=8 67Гц, 1Н), 8 06 (d, J=1 80Гц, 1Н), 7 56-7 33(m, 6H) Пример 7 7-Хлор-1 -гидрокси-3-(4метоксифенил)-3,4,5,10тетрагидропиридазино[4,5-Ь]хинолин-4,10-дион 6-Хлор-2-(4-метоксианилин)-2,3,4, 9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион (2,72г, 7,40мМ) перемешивают в метаноле (200мл) и добавляют метан сульфокислоту (50мл) Рыжевато-коричневую суспензию нагревают при температуре кипения с обратным холодильником в течение 16 часов, во время чего она становится желтой Эту желтую суспензию охлаждают до комнатной температуры и фильтруют (фильтрат сохраняют для использования в Примере 8) Собранные твердые продукты промывают метанолом, получая указанное в заголовке соединение в виде желтого порошка (1,19г, 44%), Т пл 371-373°С, МС (СІ) 370 (М+Н) Анализ для C18H12CIN3O4 Рассчитано С, 58 50, Н, 3 27, N, 11 36 Найдено С, 58 30, Н, 3 4 1 , N, 1092 ЯМР 13 33 (br s, 1Н, способи, к обмену), 12 47 (s, 1Н, способи, к обмену), 8 30 (d, J=8 73Гц, 1Н), 8 23 (br s, 1Н), 7 61 ( т , ЗН), 7 08 (d, J=8 90Гц, 2Н), 3 83(s, ЗН) Исходный 6-Хлор-2-(4-метоксианилин)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион получают следующим способом а 6-Хлор-2-(4-метоксианилин)-2,3,4,9тетрагидро-1 Н-пирроло-[3,4-Ь]хинолин-1,3,9трион К перемешиваемой суспензии диметил 7хлор-4-гидрокси-хинолин-2,3-дикарбоксилата 50 (0,500г, 1,69мМ) в этаноле (17мл) добавляют 4метоксифенил гидразин гидрохлорид (2,07г, 11,83мМ) Добавляют триэтиламин (1,88мл, 13,52мМ) и смесь нагревают при температуре кипения с обратным холодильником в течение 40 часов, Полученную суспензию фильтруют горячей, собранные твердые продукты промывают этанолом, получая соль 4-метоксифенил гидразина с названным в заголовке соединением (0,700г) в виде светлого рыжевато-коричневого твердого продукта Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (20мл) в течение 2 часов, получая коричневую суспензию Суспензию охлаждают до комнатной температуры Твердые продукты собирают и промывают ледяной уксусной кислотой, метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,331 г, 53%) в виде рыжевато-коричневого порошка, Т пл 365°С (разл ), МС (CI) 370 (М+Н) Анализ для C18H12CIN3O4 Рассчитано С, 58 50, Н, 3 27, N, 11 36 Найдено С, 58 29, Н, 3 41, N, 11 14 ЯМР 13 79 (br s, 1H, способи, к обмену), 8 22 (br d, J=8 70Гц, 2Н, 1Н способи, к обмену), 7 88 (d, J=1 79Гц, 1Н), 7 57 (dd, J=1 79, 8 70Гц, 1Н), 6 78 (s, 4Н), 3 67(s, ЗН) Пример 8 7-Хлор-4-гидрокси-2-(4метоксифенил)-1,2,5,10тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион Сохраненный фильтрат от Примера 7 разбавляют водой (250мл), получая желтую суспензию Собирают твердые продукты и промывают водным метанолом (50%), получая указанное в заголовке соединение (1,22г, 45%) в виде желтоватого порошка, Т пл 351-353°С, МС (CI) 370 (М+Н) Анализ для C18H12CIN3O4 Рассчитано С, 58 50, Н, 3 27, N, 11 36 Найдено С, 58 51, Н, 3 44, N, 11 03 ЯМР 12 74 (s, 1H, способи, к обмену), 12 01 (s, 1Н, способи, к обмену), 8 15 (d, J=8 70Гц, 1Н), 8 05 (br s, 1H), 7 44 (мультиплет, ЗН), 7 02 (br d, J=6 96Гц, 2Н), 3 80(s, ЗН) Пример 9 7-Хлор-1 -гидрокси-3-(4гид роксифенил)-3,4,5,10тетрагидропиридазино[4,5-Ь]хинолин-4,10-дион 7-Хлор-1-гидрокси-3-(4-метоксифенил)3,4,5,10-тетрагидропиридазино[4,5-Ь]хинолин4,10-дион (0,800г, 2,16мМ) перемешивают в метансульфокислоте (16мл), получая янтарно-желтый раствор Этот раствор нагревают при 160°С 6 часов и охлаждают до комнатной температуры Добавление диэтилового эфира (250мл) дает рыжевато-коричневый осадок, который перемешивают 1 час Твердый продукт собирают и промывают смесью метанол/диэтиловый эфир, получая указанное в заголовке соединение (0,661 г, 77%) в виде рыжевато-коричневого порошка, Т пл 393395°С, МС (СІ) 356 (М+Н) Анализ для Ci 7 Hi 0 CIN 3 O4 -0,2 CH3SO3H • 1,ЗН2О Рассчитано С, 51 86, Н, 3 39, N, 10 55, Найдено С, 51 76, Н, 3 02, N, 10 37 ЯМР 13 30 (s, 1H, способы, к обмену), 12 5 (v br s, 1H, способи к обмену), 10 8 (br s, IH, способы, к обмену), 8 29 (d, J=8 76Гц, 1Н), 8 23 (br s, IH), 60291 52 51 7 61 (br d, J=8 76Гц, ІН), 7 45 (d, J=8 81 Гц, 2Н), 6 88 трируют приблизительно до 15мл Дальнейшее (d, а=8 81Гц, 2Н), 2 32(s, 0,5H) нагревание дает густую суспензию, которую разбавляют этанолом (5мл) и нагревают при темпеПример 10 7-Хлор-4-гидрокси-2-(4ратуре кипения с обратным холодильником догид роксифенил)-1,2,5,10полнительно 16 часов Смесь охлаждают до комтетрагидропиридазино[4,5-Ь]хинолин-1,10-дион натной температуры и фильтруют, получая фенил 7-Хлор-4-гидрокси-2-(4-метоксифенил)гидразиновую соль указанного в заголовке соеди1,2,5,10-тетрагидро-пиридазино[4,5-Ь]хинолиннения в виде рыжевато-коричневого твердого ве1,10-дион (0,800г, 2,16мМ) перемешивают в мещества Этот продукт нагревают при температуре тансульфокислоте (16мл), получая раствор янтаркипения с обратным холодильником в ледяной ного цвета Этот раствор нагревают при 150°С 6 уксусной кислоте (25мл) в течение 2 часов и охчасов и охлаждают до комнатной температуры лаждают до комнатной температуры Фильтрация Добавление диэтилового раствора (250мл) и медает указанное в заголовке соединение (1,01 г, танола (50мл) дает рыжевато-коричневый осадок 58%) в виде рыжевато-коричневого порошка, Т пл Твердый продукт собирают и промывают, получая 368°С (разл ), МС (СІ) 351 (М+Н) указанное в заголовке соединение (0,530г, 51%) в Анализ для C17H10N4O5 виде рыжевато-коричневого порошка, Т пл 316Рассчитано С, 58 30, Н, 2 88, N, 16 00, 318°С, MC(CI) 356 (М+Н) Найдено С, 58 21, Н, 3 07, N, 1615 Анализ для C17H10CIN3O4 • CH3SO3H • 1,3 Н2О ЯМР 8 91(d, и=2 76Гц, 1Н), 8 60 (dd, J=2 76, Рассчитано С, 45 49, Н, 3 52, N, 8 84, 9 18Гц, 1Н), 8 06(d, J=9 18Гц, 1Н), 7 18(t, J=7 23Гц, Найдено С, 45 45, Н, 3 24, N, 8 64 2Н), 6 82 ( т , ЗН) ЯМР 12 80 (vbrs, 1H, способи к обмену), 8 15 Пример 12 2-Бензил-7-хлор-4-гидрокси(d, и=8 68Гц, 1Н), 8 04 (d, J=1 84Гц, 1Н), 7 44 (dd, 1,2,5,10-тетрагидро-пиридазино[4,5-Ь]хинолинJ=1 84, 8 68Гц, 1Н), 7 28 (d, J=8 74Гц, 2Н), 6 81 (d, 1,10-дион J=8 74Гц, 2Н), 2 35(s, ЗН) К перемешиваемой суспензии диметил 7Пример 11 4-Гидрокси-8-нитро-2-фенилхлор-4-гидроксихи-нолин-2,3-дикарбоксилита 1,2,5,10-тетра-гидропиридазино[4,5-Ь]хинолин(5,00г, 16,90мМ) и бензилгидразин дигидрохлори1,10-дион да (46,15г, 236,50мМ) в этаноле (100мл) добавля2-Анилино-7-нитро-2,3,4,9-тетрагидро-1Нют триэтиламин (75,8мл, 541,ОмМ) Смесь нагрепирроло[3,4-Ь]хинолин-1,3,9-трион (0,830г, вают, получая коричневый раствор, который на2,37мМ) растворяют при перемешивании в метангревают при температуре кипения с обратным сульфокислоте (42мл), получая темно-оранжевый холодильником 40 часов, за это время образуется раствор Добавляют метанол (420мл) и полученосадок Суспензию охлаждают до комнатной темный желтый раствор нагревают при температуре пературы и фильтруют, получая бензилгидразикипения с обратным холодильником 2 часа, полуновую соль указанного в заголовке соединения в чая желтую суспензию Нагрев убирают и суспенвиде содержащего примесь желтого твердого везию перемешивают при комнатной температуре 3 щества Многократная кристаллизация из этачаса Твердые продукты отделяют фильтрацией и нольного хлористого водорода и метанола дает фильтрат оставляют стоять на 20 часов За это указанное в заголовке соединение (0,370г, 6%) в время в фильтрате образуется дополнительное виде белого порошка, Т пл 347-350°С, МС (CI) количество твердых продуктов и суспензию по354 (М+Н) вторно фильтруют Этот фильтрат концентрируют затем приблизительно до 250мл и разбавляют Анализ для C18H12CIN3O3 водой (400мл), получая желтый осадок Эти тверРассчитано С, 61 10, Н, 3 42, N, 11 90, дые продукты собирают и промывают водным меНайдено С, 60 68, Н, 3 61, N, 11 80 танолом (50%) и затем диэтиловым эфиром, поЯМР 12 65 (br s, 1Н, способи, к обмену), 11 93 лучая указанное в заголовке соединение (0,590г, (br s, 1Н, способи, к обмену), 8 15(d, J=8 67Гц, 1Н), 71%) в виде желтого порошка, Т пл 382-385°С, 8 02(d, J=1 83, 1Н), 7 43 (d, и=8 55Гц, 1Н), 7 36МС (CI) 351 (М+Н) 7 23(m, 5H), 5 11 (s, 2H) Пример 13 7-Хлор-4-гидрокси-2-[2-(4Анализ для C17H10N4O3 • 0,1С4НюО • 1,1Н2О фенилпиперазино)-этил]-1,2,5,10Рассчитано С, 55 40, Н, 3 52, N, 14 80, тетрагидропиридазино[4,5-Ь]хинолин-1,10-дион Найдено С, 55 42, Н, 3 46, N, 14 60 2(2-Бромэтил)-7-хлор-4-гидрокси-1,2,5,10ЯМР 12 91 (brs, 1H, способи, к обмену), 12 44 тетрагидропиридазино [4,5-Ь]хинолин-1,10-дион (br s, 1Н, способи, к обмену), 8 86 (s, 1Н), 8 53 (d, (0,500г, 1,35мМ) перемешивают в диметилформаJ=9 18Гц, 1Н), 8 15 (d, J=9 18Гц, 1Н), 7 57-7 35 (т, миде (10 мл) и добавляют N-фенилпиперазин 5Н) (10мл, 10,6г, 65,5мМ) Полученную желтую сусИсходный 2-анилин-7-нитро-2,3,4,9пензию нагревают до 110°С, получая прозрачный тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион желтый раствор Раствор нагревают 6 часов, за получают следующим способом это время образуется осадок Суспензию охлажа 2-Анилин-7-нитро-2,3,4, 9-тетрагидро-1Ндают до комнатной температуры и перемешивают пирроло[3,4-Ь]хинолин-1,3,9-трион пять дней Полученную желтую суспензию раствоК перемешиваемой суспензии диэтил 6-нитроряют в водном метаноле (500мл, 50%) рН этого 4-гидрокси-хинолин-2,3-дикарбоксилата (1,670г, раствора осторожно доводят до рН=6 с помощью 5,00мМ) в этаноле (30мл) добавляют фенилгидра1 н хлористоводородной кислоты (~20мл), что дазин (3,44мл, 35,00мМ), получая темно-красный ет желтый осадок Эту суспензию перемешивают раствор Раствор нагревают при температуре ки1 час и фильтруют, получая указанное в заголовке пения с обратным холодильником 1час и концен 53 соединение, загрязненное N-фенилпиперазином (0,753г) Этот продую" перекристаллизуют из этанола (200мл), получая указанное в заголовке соединение (0,428г, 70%) в виде желтого порошка, Т пл 361-364°С, МС (CI) 452 (М+Н) Анализ для C23H22CIN5O3 Рассчитано С, 61 10, Н, 4 91, N, 15 50, Найдено С, 60 72, Н, 5 06, N, 15 30 ЯМР 7 95(d, и=8 67Гц, 1Н), 7 64 (br s, 1H), 7 26-7 18 (m, ЗН), 6 95(d, J=8 07Гц, 2H), 6 78(t, J=7 32, 1H), 4 15(brs, 2H), 3 55-2 85 (br m, ЮН) Пример 14 Холиновая соль 7-Хпор-1-гидрокси3-(2-фенетил)-3,4,5,10-тетрагидропиридазино[4,5Ь]хинолин-4,10-диона К перемешиваемому раствору гидроокиси натрия (9,46г, 236,6мМ) в этаноле (100мл) при 45°С добавляют сульфатную соль 2-фенетилгидразина (27,6г 118,ЗмМ) наряду с дополнительным количеством этанола (50мл) Полученную густую белую суспензию перемешивают 2 часа Твердый продукт удаляют фильтрацией и промывают этанолом (50мл) Прозрачный объединенный фильтрат концентрируют до ~70мл и добавляют диметил 7хлор-4-гидроксихинолин-2,3-дикарбоксилат (2,50г, 8,45мМ), что дает коричневый раствор Раствор нагревают при температуре кипения с обратным холодильником 16 часов, за это время образуется желтый осадок Суспензию фильтруют горячей и промывают этанолом (50мл), получая 2фенетилгидразиновую соль 7-хлор-1-гидрокси-3(2-фенетил)-3,4,5,10-тетрагидропиридазино[4,5Ь]хинолин-4,10-дион в виде желтого порошка (2,90г) Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50мл) в течение 2 часов и, после охлаждения до комнатной температуры, полученную суспензию фильтруют, получая смесь 7хлор-1-гидрокси-3-(2-фенетил)-3,4,5,10тетрагидропиридазино [4, 5-Ь] хинолин-4, 10-диона и соответствующего 2-замещен-ного фенетил изомера в виде желтого твердого продукта (2,20г, 68%) Смесь перемешивают в метаноле (250мл) и растворе метил-О-глюкамина (15,0г метил-Dглюкамина в 250мл воды) Затем добавляют раствор холин гидроксида (9,0мл, 50вес % в воде), получая раствор насыщенного янтарного цвета Этот раствор осторожно подкисляют до рН9 ледяной уксусной кислотой, после чего образуется желтый осадок После перемешивания этой желтой суспензии в течение 1 часа, твердые продукты собирают и промывают последовательно водным метанолом (50%), смесью метанол/эфир и диэтиловым эфиром, получая указанное в заголовке соединение (свободная кислота, 1,13г, 54%) в виде желтого порошка Фильтрат и промывные воды собирают и сохраняют для использования в Примере 15 Выделенный ранее 7-хлор-1-гидрокси-3-(2фенетил)-3,4,5,10-тетрагидропиридазино [4, 5-Ь] хинолин-4, 10-дион (1,00г, 2,72мМ), выделенный ранее, перемешивают в метаноле (50мл) и добавляют раствор гидроокиси холина (1,0мл, 45вес % в метаноле) Полученную суспензию перемешивают и обрабатывают ультразвуком в течение 1 часа, что дает раствор янтарного цвета Этот раствор трижды подвергают азеотропной перегонке из 60291 54 смеси мета нол Толуол (10%, 50мл), получая оранжевый твердый продукт Растирание с толуолом (50мл), содержащим этанол (Змл), дает свободно текущую суспензию, которую перемешивают 16 часов Твердый продукт собирают и промывают толуолом и диэтиловым эфиром, получая рыжевато-коричневый порошок (1,19г) Этот порошок сушат при глубоком вакууме (50мТ) при 100°С в течение 72 часов, что дает указанное в заголовке соединение (1,00г, 78%) в виде порошка золотистого цвета, Т пл 227-229°С, МС (CI) 368 (М+Н) Анализ для C19H13CIN3O3 • C5H14NO • 0,2Н2О Рассчитано С, 60 70, Н, 5 82, N, 11 81, Найдено С, 60 41, Н, 5 74, N, 11 68 ЯМР 14 86 (s, 1H, способи, к обмену), 8 17(d, J=8 82I~4, 1H), 7 80 (s, 1H), 7 33-7 19 (m, 6H), 5 37(br s, 1H, способи, к обмену), 4 13 (t, J=7 29, 2Н), 3 84(brs, 2Н), 3 37 (m, 2H), 3 10(s, 9H), 3 00(t, J=7 29Гц, 2Н) Пример 15 7-Хлор-4-гидрокси-2-(2-фенетил)1,2,5,10-тетрагидропиридазино[4,5-Ь]хинолин1,10-дион Фильтрат и промывные воды, сохраненные из Примера 14, подкисляют ледяной уксусной кислотой, что дает осадок Твердые продукты собирают и промывают последовательно метанолом, водой, метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,81 г, 39%) в виде светло-желтого порошка, Т пл 327-330°С, МС (СІ) 368 (М+Н) Анализ для C19H14CIN3O3 • 0,1 Н2О Рассчитано С, 61 70, Н, 3 87 N, 11 36, Найдено С, 61 60, Н, 3 99, N, 10 98 ЯМР 12 60 (vs, 1H, способи, к разлож), 11 95 (v s, 1Н, способи, к разлож), 8 15(d, J=8 63Гц, 1Н), 8 01(d, J=1 35Гц, 1Н), 7 43(d, J=8 63Гц, 1Н), 7 337 22 (т, 5Н), 4 11 (t, J=7 46, 2Н), 2 99(t, J=7 46Гц, 2Н) Пример 16 7-Хлор-1 -гидрокси-3-(4хлорфенил)-3,4,5,10-тетрагидропиридазино[4,5Ь]хинолин-4,10-дион Перемешиваемую суспензию 6-хлор-2-(4хлоранилин)-2,3, 4, 9-тетрагидро-1Н-пирроло[3,4Ь]хинолин-1,3,9-триона (0,670г, 1,79мМ) в метаноле (60мл) и м етан сул ьфо кислоте (15мл) нагревают при температуре кипения с обратным холодильником 3 часа и охлаждают до комнатной температуры Смесь фильтруют (фильтрат сохраняют для использования в Примере 17), и собранные желтые твердые продукты промывают метанолом и диэтиловым эфиром, что дает указанное в заголовке соединение (0,156г, 23%) в виде желтого порошка, Т пл >400°С, МС (СІ) 374 (М+Н) Анализ для C17H9C12N3O3 Рассчитано С, 54 60, Н, 2 42 N, 11 23, Найдено С, 54 29, Н, 2 19, N, 11 20 ЯМР 13 40 (s, 1Н, способи, к обмену), 12 54 (s, 1Н, способи, к обмену), 8 30(d, J=8 79Гц, 1Н), 8 23(d, J=1 89Гц, 1Н), 7 75(d, J=6 90Гц, 2Н), 7 63 ( т , ЗН) Исходный 6-хлор-2-(4-хлоранилин)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион получают как описано ниже а 6-хлор-2-(4-хлоранилин)-2,3,4, 9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,8-трион 55 60291 К перемешиваемой суспензии диметил 7хлор-4-гидрокси-хинолин-2,3-дикарбоксилата (2,50г, 8,45мМ) и 4-хлорфенил-гидразина (10,60г, 59,20мМ) в этаноле (50мл) добавляют триэтиламин (9,43мл), получая коричневый раствор Этот раствор нагревают при температуре кипения с обратным холодильником 24 часа и затем охлаждают до комнатной температуры Разбавление водой (25мл) дает коричневый осадок Эту суспензию перемешивают 16 часов и фильтруют, для отделения твердых продуктов, которые отбрасываются После хранения фильтрата в течение семи дней образуется другой осадок Этот твердый продукт собирают и промывают метанолом (50%) и диэтиловым эфиром, получая соль 4хлофенилгидразина, указанного в заголовке соединения, в виде коричневого порошка (1,20г) Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (25мл) в течение 3 часов и охлаждают до комнатной температуры Полученную оранжевую суспензию фильтруют и твердые продукты промывают ледяной уксусной кислотой и диэтиловым эфиром, получая указанное в заголовке соединение (0,810г, 25%) в виде светло-оранжевого порошка, Т пл 399-401 °С, МС (CI) 374 (М+Н) Анализ для C17H9CI2NO3 Рассчитано С, 54 60, Н, 2 42 N, 11 23, Найдено С, 54 29, Н, 2 61, N, 11 12 ЯМР 13 80 (vbrs, 1H, способи, к обмену), 8 67 (s, 1Н, способи, к обмену), 8 22(d, и=8 67Гц, 1Н), 7 88(d, J=1 73Гц, 1Н), 7 57(d, J=1 73, 8 67Гц, 1Н), 7 21 (d, J=8 79, 2Н), 6 87(d, J=8 79Гц, 2Н) Пример 17 7-Хлор-4-гидрокси-2-{4хлорфенил)-1,2,5,10-тетрагидропиридазино[4,5Ь]хинолин-1,10-дион Фильтрат сохраненный из Примера 16 разбавляют водой (75мл), получая белую суспензию, которую перемешивают 16 часов Эту суспензию фильтруют, и собранные твердые продукты промывают последовательно водой, водным метанолом, метанол/диэтиловым эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,420г, 63%) в виде белого твердого порошка, Т пл 359-360°С, МС (CI) 374 (М+Н) Анализ для C17H9CI2N3O3 • 0,5Н2О • 0,2CH3SO3H Рассчитано С, 51 30, Н, 2 71, N, 10 40, Найдено С, 51 44, Н, 2 64, N, 0 60 ЯМР 12 91 (brs, 1H, способи, к обмену), 12 07 (br s, 1Н, способи, к обмену), 8 16(d, J=8 64Гц, 1Н), 8 06(d, J=1 62Гц, 1Н), 7 63-7 46(m, 5H) Пример 18 7-Хлор-1 -гидрокси-3-(4метилфенил)-3,4,5,10-тетрагидропиридазино[4,5Ь]хинолин-4,10-дион Перемешиваемую суспензию 6-хлор-2-(4метиланилин)-2,3,4,9-тетрагидро-1Н-пирроло[3,4Ь]хинолин-1,3,9-триона (1,60г, 4,53мМ) в растворе метанола (128мл) и метансульфокислоты (32мл) нагревают при температуре кипения 4 с обратным холодильником часа и охлаждают до комнатной температуры Полученную желтую суспензию перемешивают при комнатной температуре пять дней и затем фильтруют (фильтрат сохраняют для использования в Примере 19) Собранные твердые продукты промывают метанолом и затем ди 56 этиловым эфиром, получая указанное в заголовке соединение (0,594г, 37%) в виде желтого порошка, Т пл >400°С, МС (CI) 354 (М+Н) Анализ для C18H12CIN3O3 • 0,4Н2О Рассчитано С, 59 89, Н, 3 57, N, 11 64, Найдено С, 59 47, Н, 3 14, N, 11 57 ЯМР 13 34 (s, 1H, способи, к обмену), 12 48 (s, 1Н, способи, к обмену), 8 30(d, J=8 75Гц, 1Н), 8 22 (brs, 1Н), 7 62(d, и=8 75Гц, 1Н), 7 55(d, J=8 01 Гц, 2Н), 7 33(d, J=8 01 Гц, 2Н), 2 38 (s, ЗН) Исходный 6-хлор-2-(4-метиланилин)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион получают следующим способом а 6-Хлор-2-(4-метиланилин)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион К перемешиваемой суспензии диметил 7хлор-4-гидрохинолин-2,3-дикарбоксилата (3,90г, 13,ЗмМ) и 4-метилфенилгидразин гидрохлорида (14,8г, 93,2мМ) в этаноле (140мл) добавляют триэтиламин (14,8мл, 106,4мМ) Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 16 часов, за это время выпадает осадок Полученную суспензию охлаждают до комнатной температуры и фильтруют, получая соль 4-метилфенилгидразина указанного в заголовке соединения в виде серого порошка (2,30г) Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (45мл) в течение 2 часов и охлаждают до комнатной температуры Полученную коричневую суспензию фильтруют, получая указанное в заголовке соединение (1,60г, 34%) в виде рыжевато-коричневого порошка, Т пл 380-382°С, МС (CI) 354 (М+Н) Анализ для Ci 8 Hi 2 CIN 3 O3 • 0,2Н2О Рассчитано С, 60 49, Н, 3 50, N, 11 76, Найдено С, 60 66, Н, 3 26, N, 11 76 ЯМР 13 81 (v br s, 1H, способи, к обмену), 8 39(s, 1H, способи, к обмену), 8 22(d, J=8 58Гц, 1Н), 7 89(d, J=1 97Гц, 1Н), 7 58(dd, J=1 97, 8 58Гц, 1Н), 6 98(d, и=8 28Гц, 2Н), 6 73(d, J=8 28Гц, 2Н), 2 19(s, ЗН) Пример 19 7-Хлор-4-гидрокси-2-(4метилфенил)-1,2,5,10-тетрагидропиридазино[4,5Ь]хинолин-1,10-дион Фильтрат сохраненный в Примере 18 разбавляют водой (160мл), получая рыжеватокоричневую суспензию, которую перемешивают 3 часа Суспензию фильтруют, и собранные твердые продукты промывают последовательно водой, метанол/эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,855г, 53%) в виде рыжевато-коричневого порошка, Т пл 368370°С, МС (CI) 354 (М+Н) Анализ для C18H12CIN3O3 • 0,2Н2О Рассчитано С, 60 50, Н, 3 50, N, 11 76, Найдено С, 60 52, Н, 3 23, N, 11 79 ЯМР 12 75 (br s, 1Н, способи, к обмену), 12 00 (br s, 1Н, способи, к обмену), 8 15(d, J=8 61 Гц, 1Н), 8 04(d, J=1 50Гц, 1Н), 7 43(т, ЗН), 7 26(d, J=8 25Гц, 2Н), 2 36 (s, ЗН) Пример 20 7-Хлор-1 -гидрокси-3-(4изопропилфенил)-3,4,5,10тетрагидропиридазино[4,5-Ь]хинолин-4,10-дион Перемешиваемую суспензию 6-хлор-2-(4изопропиланилин)-2,3,4,9-тетрагидро-1Н 60291 58 57 пирроло[3,4-Ь]хинолин-1,3,9-триона (1,13г, натной температуре Суспензию фильтруют и собранные твердые продукты промывают последо2,98мМ) в растворе метанола (90мл) и метанвательно водой, водным метанолом (50%), метасульфокислоты (23мл) нагревают при температунол/диэтиловым эфиром и диэтиловым эфиром, ре кипения с обратным холодильником 7 часов и что дает указанное в заголовке соединение охлаждают до комнатной температуры Смесь (0,418г, 37%) в виде рыжевато-коричневого пофильтруют (фильтрат сохраняют для использоварошка, Т пл 323-326°С, МС (CI) 382 (М+Н) ния в Примере 21), собранные желтые твердые продукты промывают метанолом и диэтиловым Анализ для C20H16CIN3O3 • 0,5Н2О • эфиром, получая указанное в заголовке соедине0,1CH3SO3H ние (0,401г, 35%) в виде желтого порошка, Т пл Рассчитано С, 60 29, Н, 4 38, N, 10 49, 393-394°С, МС (СІ) 382 (М+Н) Найдено С, 60 13, Н, 4 10, N, 10 40 Анализ для C20H16CIN3O3 • 0,2Н2О ЯМР 12 73 (br s, 1Н, способи, к обмену), 12 00 Рассчитано С, 62 33, Н, 4 29, N, 10 90, (br s, 1Н, способи, к обмену), 8 15(d, J=8 70Гц, 1Н), Найдено С, 62 16, Н, 3 98, N, 10 82 8 05(d, J=1 74Гц, 1Н), 7 45(т, ЗН), 7 33(d, J=8 40Гц, ЯМР 13 33 (s, 1Н, способи, к обмену), 12 48 (s, 2Н), 2 95(септет, и=6 90Гц, 1Н), 1 24(d, J=6 90Гц, 1Н, способи, к обмену), 8 28(d, J=8 76Гц, 1Н), 6Н) 8 22(d, J=1 77Гц, 1Н), 7 63-7 58(m, 3H), 7 40(d, Пример 22 7,9-Дихлор-1-гидрокси-2-фенили=8 49Гц, 2Н), 2 98(септет, J=6 96Гц, 1Н), 1 25(d, 1,2,5,10-тетрагидропиридазино[4,5-Ь]хинолинJ=6 96Гц, 6Н) 1,10-дион Исходный б-хлор-2-(4-изопропиланилин)6,8-Дихлор-2-анилин-2,3,4,9-тетрагидро-1Н2,3,4,9-тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3, пирроло[3,4-Ь]хинолин-1,3,9-трион (0,60г, 1,60мМ) 9-трион получают следующим способом перемешивают в метаноле (200мл) и метансульфокислоту (20мл) добавляют при охлаждении, а 6-Хлор-2-(4-изопропиланилин)-2,3,4,9поддерживая температуру ниже 20°С Получентетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион ный оранжевый раствор перемешивают в течение К перемешиваемой суспензии диметил 7ночи при комнатной температуре Образовавшийхлор-4-гидрохинолин-2,3-дикарбоксилата (2,01 г, ся за ночь осадок и оранжевую суспензию нагре6,80мМ) и 4-изопропилфенилгидразин гидрохловают при температуре кипения в течение с обратрида (8,90г, 47,6мМ) в этаноле (72мл) добавляют ным холодильником 1 часа Суспензию охлаждают триэтиламин (7,6мл, 54,5мМ), получая коричневый до комнатной температуры и оставляют стоять в раствор Этот раствор нагревают при температуре течение ночи без перемешивания Суспензию кипения с обратным холодильником 16 часов, охфильтруют и фильтрат медленно разбавляют волаждают до комнатной температуры и затем меддой (200мл), получая желтую суспензию Эту сусленно добавляют к смеси хлористоводородной пензию перемешивают 2 часа и твердый продукт кислоты (12н, 100мл) при энергичном перемешисобирают и промывают водой, водным метановании, в результате чего образуется розовая суслом, 50% метанол/диэтиловым эфиром и диэтипензия Суспензию фильтруют и собранные тверловым эфиром, получая указанное в заголовке дые продукты промывают охлажденным раствосоединение (0,368г, 61%) в виде светлого рыжеваром, приготовленным смешением метанола то-коричневого порошка, Т пл 361-363°С, МС (CI) (100мл), соляной кислоты (100мл, 12н) и льда, 374 (М+Н) получая соль 4-изопропилфенил гидразина указанного в заголовке соединения в виде порошка Анализ для C17H9CI2N3O3 • 0,30Н2О пурпурного цвета (1,80г) Этот продукт нагревают Рассчитано С, 53 80, Н, 2 55 N, 11 07, при температуре кипения с обратным холодильниНайдено С, 53 71, Н, 2 64, N, 1097 ком в ледяной уксусной кислоте (15мл) 3 часа, 1 Н ЯМР 12 84 (s, 1H, способи, кобмену), 11 96 получая рыжевато-коричневую суспензию Сус(s, 1Н, способи, к обмену), 8 04(d, и=2 02Гц, 1Н), пензию охлаждают до комнатной температуры и 7 55-7 45(т, 5Н), 7 36(t, J=6 84Гц, 1Н) фильтруют Собранные твердые продукты промыИсходный 6,8-Дихлор-2-анилин-2,3,4,9вают ледяной уксусной кислотой (10мл) и диэтитетрагидро-1 Н-пир-роло[3,4-Ь]хинолин-1,3,9-трион ловым эфиром, получая указанное в заголовке получают нижеописанным способом соединение (1,125г, 43%) в виде рыжеватоа 6,8-Дихлор-2-анилин-2, 3,4, 9-тетрагидрокоричневого порошка, Т пл 367-369°С, МС (CI) 1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион 382 (М+Н) К перемешиваемой суспензии диметил 5,7Анализ для C20H16CIN3O3 • 0,1 Н2О дихлор-4-гидроксихинолин-2,3-дикарбоксилата Рассчитано С, 62 60, Н, 4 26, N, 10 95, (3,00г, 9,09мМ) в этаноле (42мл) добавляют феНайдено С, 62 60, Н, 4 35, N, 10 73 нилгидразин (6,26мл, 63,6мМ) Полученный зелеЯМР 13 82 (vbrs, 1H, способи, к обмену), 8 41 ный раствор нагревают при температуре кипения (s, 1Н, способи, к обмену), 8 23(d, и=8 64Гц, 1Н), с обратным холодильником 16 часов, за это время 7 89(d, J=1 98Гц, 1Н), 7 61(dd, J=1 98, 8 64Гц, 1Н), образуется небольшое количество красного осад7 04(d, и=8 42Гц, 2Н), 6 74(d, 0=8 42Гц, 2Н), ка Эту суспензию охлаждают до комнатной тем2 78(септет, и=6 87Гц, 1Н), 1 15(d, J=6 87Гц, 6Н) пературы при перемешивании, вызывая дополнительное осаждение продукта и образование гусПример 21 7-Хлор-4-гидрокси-2-(4той рыжевато-коричневой суспензии Твердые изопропилфенил)-1,2,5,10продукты собирают и промывают этанолом (этатетрагидропиридазино[4,5-Ь]хинолин-1,10-дион нольные промывные воды сохраняют) Собранный Фильтрат сохраненный в Примере 20 разбавтвердый продукт перекристаллизовывают из эталяют водой (115мл), получая светло-желтую суснола (1/20л), получая фенил гидразиновую соль пензию, которую перемешивают 5 часов при ком 59 60291 указанного в заголовке соединения (1/17г) в виде рыжевато-коричневого порошка Этот продукт перемешивают и нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (15 мл) в течение 2,5 часов и затем охлаждают до комнатной температуры при перемешивании Полученную оранжевую суспензию фильтруют, получая указанное в заголовке соединение (0/629 г, 19%) в виде оранжевого порошка, который слегка загрязнен Аналитический образец указанного в заголовке соединения получают из оставленных ранее этанольных промывных вод фильтрацией осадка, образовавшегося после того, как эти промывные воды стояли в течение нескольких часов Перекристаллизация этого собранного рыжевато-коричневого порошка (0,126г) из ледяной уксусной кислоты (2мл) дает чистое указанное в заголовке соединение (0,083г) в виде оранжевого порошка, Т пл 364-367°С, МС (CI) 374 (М+Н) Анализ для C17H9CI2H3O3 • 0,30Н2О • 0,10СН3СО2Н Рассчитано С, 53 60, Н, 2 61, N, 10 90, Найдено С, 53 49, Н, 2 77, N, 10 82 1 Н ЯМР 8 53 (s, 1H, способи, к обмену), 7 85(d, J=1 94Гц, 1Н), 7 65(d, J=1 94Гц, 1Н), 7 18 (t, J=7 84Гц, 2Н), 6 82(d, J=7 84Гц, ЗН) Пример 23 7-Хлор-1 -гидрокси-3-(1 -нафтил)3,4,5,10-тетрагидропиридазино[4,5-Ь]хинолин4,10-дион 6-Хлор-2-(1-нафтиламино)-2,3,4,9-тетрагидро1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион (1,30г, 3,34мМ) перемешивают в метаноле (0,65л) и добавляют метансульфокислоту (65мл) Коричневую суспензию нагревают при температуре кипения с обратным холодильником 16 часов, за это время твердые продукты растворяются, образуя коричневый раствор Этот раствор охлаждают до комнатной температуры Добавление льда (10мл) дает рыжевато-коричневую суспензию, которую перемешивают 1,5 часа Суспензию фильтруют (фильтрат сохраняют для использования в Примере 24) и собранные твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,560г, 43%) в виде слабо-желтого порошка, Т пл 374-376°С, МС (CI) 390 (М+Н) Анализ для C21H12CIN3O3 • 0,2Н2О Рассчитано С, 64 10, Н, 3 18, N, 10 68, Найдено С, 63 91, Н, 3 42, N, 1061 1 Н ЯМР 13 40 (s, 1H, способи, кобмену), 12 58 (s, 1Н, способи, к обмену), 8 35(d, и=8 70Гц, 1Н), 8 25(d, J=1 76Гц, 1Н), 8 12-8 07 (m, 2H), 7 74-7 53 ( т , 6Н) Исходный 6-хлор-2-(1-нафтиламино)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион получают как описано ниже а 6-Хлор-2-(1 -нафтиламино)-2,3,4,9тетрагидро-1 Н-пирроло[3,4-Ь]хинолин-1,3,9-трион К перемешиваемой суспензии диметил-7хлор-4-гидро-ксихинолин-2,3-дикарбоксилата (2,00г, 6,80мМ) и 1-нафтил гидразин гидрохлорида (9,26г, 47,6мМ) в этаноле (72мл) добавляют триэтиламин (7,60мл), получая коричневый раствор После нагревания при температуре кипения с обратным холодильником в течение 4 дней, раствор 60 охлаждают до комнатной температуры и разбавляют этилацетатом (0,30л), получая рыжеватокоричневую суспензию Эту суспензию фильтруют, удаляя твердые продукты, которые отбрасывают Затем фильтрат выливают в этилацетат (500мл), который промывают хлористоводородной кислотой (3 х 500мл, 1н) Промытый раствор разбавляют диэти-ловым эфиром (250мл), получая рыжевато-коричневую суспензию Твердые продукты собирают, получая 1-нафтил гидразиновую соль указанного в заголовке соединения в виде рыжевато-коричневого порошка (2,09г) Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50мл) в течение 2 часов, охлаждают до комнатной температуры и фильтруют Собранные твердые продукты промывают ледяной уксусной кислотой и диэтиловым эфиром, получая указанное в заголовке соединение (1,44г, 54%), в виде рыжеватокоричневого порошка, Т пл 368°С (разложение), МС (CI) 390 (М+Н) Анализ для C21H12CIN3O3 • 0,30СН3СО2Н Рассчитано С, 63 60, Н, 3 26 N, 10 30, Найдено С, 63 90, Н, 3 43, N, 9 97 1 Н ЯМР 9 06 (s, 1H, способи, кобмену), 8 278 22 ( т , 2Н), 7 92-7 88 (т, 2Н), 7 63-7 52 (т, ЗН), 7 41(d, J=8 17Гц, 1Н), 1 21 (t, J=7 86I~4, 1H), 6 80(d, Пример 24 7-Хлор-4-гидрокси-2-(1-нафтил)1,2,5,10-тетрагидропиридазино[4,5-Ь]хинолин1,10-дион Фильтрат сохраненный от Примера 23 разбавляют водой (0,75л) и затем частично концентрируют на роторном испарителе, получая коричневую суспензию Твердые продукты из суспензии собирают и промывают водой, метанол/диэтиловым эфиром и диэтиловым эфиром, получая коричневый порошок (0,535г) Этот продукт нагревают при температуре кипения с обратным холодильником в метаноле (23мл) и фильтруют горячим для удаления не растворившихся твердых продуктов, которые отбрасывают Фильтрат концентрируют досуха и растворяют с этилацетатом (20мл) Полученную суспензию фильтруют и собранные твердые продукты промывают этилацетатом и диэтиловым эфиром, получая указанное в заголовке соединение (0,240г, 18%) в виде серого порошка, Т пл 335-337°С, МС (CI) 390 (М+Н) Анализ для C21H12CIN3O3 • 0,60Н2О • 0,40CH3SO3H • 0,20С4НюО • 0,15С4Н8О2 Рассчитано С, 58 60, Н, 3 88 N, 9 00, Найдено С, 58 37, Н, 3 53, N, 9 14 1 Н ЯМР 12 80 (br s, 1H, способи, к обмену), 12 1 (br s, 1Н, способи, к обмену), 8 15-8 03 (br m, 4Н), 7 67-7 50 (br m, 6H) Пример 25 7-Хлор-3-(4-фторфенил)-1 гидрокси-3,4,5,10-тетрагидропиридазино[4,5Ь]хинолин-4,10-дион Перемешиваемую суспензию 6-хлор-2-(4фторанилин)-2,3,4,9-тетрагидро-1Н-пирроло[3,4Ь]хинолин-1,3,9-триона (1,40г, 3,90мМ) в растворе метанола (0,73л) и метансульфокислоты (73мл) нагревают при температуре кипения с обратным холодильником 16 часов и охлаждают до комнатной температуры Полученную оранжевую суспен
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridazinoquinolines, a method for preparing thereof (variants), intermediary compounds, pharmaceutical composition (variants) for treatment or preventing neurodegenerative disorders and methods of treatments
Назва патенту російськоюПиридазинохинолины, способ их получения (варианты), промежуточные соединения, фармацевтическая композиция (варианты) для лечения или профилактики нейродегенеративных нарушений и способы лечения
МПК / Мітки
МПК: C07D 471/14, A61P 3/08, A61K 31/50, C07D 495/14, A61P 43/00, A61P 25/08, C07D 471/04, C07D 215/56, A61P 25/28, A61P 25/00, A61P 3/10
Мітки: композиція, варіанти, піридазинохіноліни, способи, лікування, порушень, фармацевтична, проміжні, спосіб, одержання, нейродегенеративних, сполуки, профілактики
Код посилання
<a href="https://ua.patents.su/74-60291-piridazinokhinolini-sposib-kh-oderzhannya-varianti-promizhni-spoluki-farmacevtichna-kompoziciya-varianti-dlya-likuvannya-abo-profilaktiki-nejjrodegenerativnikh-porushen-ta-sposobi.html" target="_blank" rel="follow" title="База патентів України">Піридазинохіноліни, спосіб їх одержання (варіанти), проміжні сполуки, фармацевтична композиція (варіанти) для лікування або профілактики нейродегенеративних порушень та способи лікування</a>
Попередній патент: Спосіб визначення гранулометричного складу часток матеріалу
Наступний патент: Спосіб одержання керамічного пігменту (варіанти) та реактор для його здійснення
Випадковий патент: Канатоукладач