Композиції та застосування похідних триазолу для лікування b-амілоїдозів і синуклеїнопатій
Номер патенту: 101393
Опубліковано: 25.03.2013
Автори: Ларсен Леслі, Вайгеле Манфред, Лейк Томас, Сноу Алан Д., Каммінгз Джоул, Хадсон Ф. Майкл, Еспозіто Люк А.
Формула / Реферат
1. Сполука формули
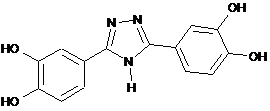
або її фармацевтично прийнятні солі.
2. Сполука за п. 1 для застосування в інгібуванні формування, відкладення, накопичення або тривалого існування Аb-амілоїдних або a-синуклеїнових агрегатів.
3. Сполука за п. 1 для застосування в лікуванні b-амілоїдозу або синуклеїнопатії у ссавця, що страждає від цього.
4. Сполука за п. 3, де b-амілоїдоз вибраний з групи хвороб, що включає хворобу Альцгеймера, синдром Дауна, спадкову церебральну геморагію з амілоїдозом голландського типу та церебральну b-амілоїдну ангіопатію.
5. Сполука за п. 3, де b-амілоїдоз являє собою хворобу Альцгеймера.
6. Сполука за п. 3, де синуклеїнопатія вибрана з групи, що включає хворобу Паркінсона, сімейну хворобу Паркінсона, хворобу тілець Леві, варіант хвороби Альцгеймера з тільцями Леві, деменцію з тільцями Леві, мультисистемну атрофію та комплекс паркінсонізм-деменція Гуама.
7. Сполука за п. 3, де синуклеїнопатія являє собою хворобу Паркінсона.
8. Сполука за п. 1 для застосування в покращенні рухової активності у ссавця, що страждає на синуклеїнопатію.
9. Сполука за п. 1 для застосування в припиненні розвитку рухових дефектів у ссавця, що страждає на хворобу Паркінсона.
10. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятну допоміжну речовину.
11. Застосування сполуки за п. 1 у виготовленні медикаменту для лікування b-амілоїдозу або синуклеїнопатії у ссавця, що страждає від цього.
12. Застосування за п. 11, де b-амілоїдоз вибраний з групи хвороб, що включає хворобу Альцгеймера, синдром Дауна, спадкову церебральну геморагію з амілоїдозом голландського типу та церебральну b-амілоїдну ангіопатію.
13. Застосування за п. 11, де b-амілоїдоз являє собою хворобу Альцгеймера.
14. Застосування за п. 11, де синуклеїнопатія вибрана з групи, що включає хворобу Паркінсона, сімейну хворобу Паркінсона, хворобу тілець Леві, варіант хвороби Альцгеймера з тільцями Леві, деменцію з тільцями Леві, мультисистемну атрофію та комплекс паркінсонізм-деменція Гуама.
15. Застосування за п. 11, де синуклеїнопатія являє собою хворобу Паркінсона.
16. Застосування сполуки за п. 1 у виготовленні медикаменту для покращення рухової активності у ссавця, що страждає на синуклеїнопатію.
17. Застосування сполуки за п. 1 у виготовленні медикаменту для припинення розвитку рухових дефектів у ссавця, що страждає на хворобу Паркінсона.
Текст
Реферат: Дигідроксіарильні сполуки і фармацевтично прийнятні складні ефіри, їх синтез, фармацевтичні композиції, що їх містять, та їх застосування в лікуванні -амілоїдних хвороб, таких як ті, що спостерігаються в хворобі Альцгеймера, і синуклеїнопатій, таких як ті, що спостерігаються в хворобі Паркінсона, і виготовлення медикаментів для такого лікування. UA 101393 C2 (12) UA 101393 C2 UA 101393 C2 5 10 15 20 25 30 35 40 45 50 55 60 Родинні заявки Дана заявка заявляє пріоритет заявки США № 12/244968, що має назву "Compounds, Compositions and Methods for the Treatment of β-Amyloid Diseases and Synucleinopathies" Esposito et al., поданої 3 жовтня 2008. Галузь винаходу Даний винахід стосується біс-дигідроксіарильних сполук і фармацевтично прийнятних солей, їхнього синтезу, фармацевтичних композицій, що їх містять, та їх застосування в лікуванні Aβ амілоїдозів, таких як ті, що спостерігаються при хворобі Альцгеймера, і синуклеїнопатій, таких як ті, що спостерігаються при хворобі Паркінсона, і в виготовленні медикаментів для такого лікування. Передумови винаходу Хвороба Альцгеймера характеризується накопиченням пептиду, що містить 39-43 амінокислоти, який називається β-амілоїдний білок або Aβ, у фібрилярній формі, що існує у вигляді агрегатів у позаклітинних амілоїдних бляшках і як амілоїд в стінках церебральних кровоносних судин. Вважають, що відкладення фібрилярних Aβ амілоїдних агрегатів при хворобі Альцгеймера наносить шкоду пацієнту і в результаті призводить до токсичності і смерті нервових клітин, характерних ознак хвороби Альцгеймера. Накопичені докази припускають, що амілоїд і, більш специфічно, формування, відкладення, накопичення і/або тривале існування Aβ агрегатів є головним етіологічним фактором патогенезу хвороби Альцгеймера. Додатково, окрім хвороби Альцгеймера, ряд інших амілоїдних хвороб включають формування, відкладення, накопичення і тривале існування Aβ агрегатів, включаючи синдром Дауна, розлади, що включають конгофільну ангіопатію, наприклад, не обмежуючись спадковою церебральною геморагією голландського типу і церебральною β-амілоїдною ангіопатією. Хвороба Паркінсона являє собою іншу хворобу людини, що характеризується формуванням, відкладенням, накопиченням, агрегацією і/або тривалим існуванням відкладень аномального фібрилярного білка, що демонструє багато з характеристик амілоїду. Вважають, що при хворобі Паркінсона накопичення цитоплазматичних тілець Леві, що складаються з агрегатів філаментів α-синуклеїну, є важливим в патогенезі і виступає в якості терапевтичних мішеней. Нові засоби або сполуки, здатні інгібувати формування, відкладення, накопичення, агрегацію і/або тривале існування α-синуклеїну або руйнувати попередньо сформовані α-синуклеїнові фібрили або агрегати (або їх частини) розглядаються в якості потенційних терапевтичних засобів для лікування хвороби Паркінсона і пов'язаних синуклеїнопатій. Фрагмент з 35 амінокислот αсинуклеїну, що має здатність формувати амілоїдоподібні фібрили або агрегати або in vitro, або як спостерігається в мозках пацієнтів із хворобою Паркінсона. Фрагмент α-синуклеїну є відносно важливою терапевтичною мішенню, оскільки частина α-синуклеїну, як вважають, є ключовою для формування тілець Леві, що спостерігаються у всіх пацієнтів з хворобою Паркінсона, синуклеїнопатіями і пов'язаними розладами. Крім того, α-синуклеїновий білок, що формує фібрили або агрегати, і є позитивним до Конго червоного і Тіофлавіну S (специфічні барвники, що використовуються для визначення амілоїдних фібрилярних агрегатів), як виявлено, є частиною тілець Леві в мозках пацієнтів з хворобою Паркінсона, хворобою тілець Леві (Lewy в Handbuch der Neurologie, M. Lewandowski, ed., Springer, Berlin pp. 920-933, 1912; Pollanen et al, J. Neuropath. Exp. Neurol. 52:183-191, 1993; Spillantini et al, Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al, Neurosci. Lett. 259:83-86, 1999), мультисистемною атрофією (Wakabayashi et al, Acta Neuropath. 96:445-452, 1998), деменцією з тільцями Леві і варіанті хвороби Альцгеймера з тільцями Леві. В хворобі Паркінсона агрегати розвиваються в мозках пацієнтів з цією хворобою, які є позитивними до Конго червоного і Тіофлавіну S і які містять переважну вторинну структуру бета-складчастого листа. Амілоїд як терапевтична мішень для хвороби Альцгеймера Хвороба Альцгеймера також накладає тяжкий економічний тягар на суспільство. Останні дослідження оцінили, що вартість догляду за одним пацієнтом з хворобою Альцгеймера з тяжкими когнітивними ураженнями дома або в будинку інвалідів становить більше $47000 на рік (A Guide to Understanding Alzheimer's Disease and Related Disorders). Для хвороби, що може тривати від 2 до 20 років, загальна вартість хвороби Альцгеймера для родин і суспільства коливається. Щорічна економічна втрата через хворобу Альцгеймера в Сполучених Штатах, виражена у витратах на охорону здоров'я і втраченої заробітної плати як пацієнтів, так і осіб, що здійснюють за ними догляд, оцінюється від $80 до $100 мільйонів (2003 Progress Report on Alzheimer's Disease). Такрин хлоргідрат ("Когнекс" або "Cognex"), перший схвалений FDA (Управління США по нагляду за якістю харчових продуктів і лікарських засобів) лікарський засіб для хвороби Альцгеймера, є інгібітором ацетилхолінестерази (Cutler і Sramek, N. Engl. J. Med. 328:808 810, 1 UA 101393 C2 5 10 15 20 25 30 35 40 45 50 55 60 1993). Проте, цей лікарський засіб показував обмежену ефективність в створенні когнітивного покращення у пацієнтів з хворобою Альцгеймера і з самого початку мав значні побічні ефекти, такі як печінкова токсичність. Другий схвалений FDA лікарський засіб, донепезил ("Арисепт" або Aricept"), що також є інгібітором ацетилхолінестерази, є більш ефективним, ніж такрин, демонструючи невелике когнітивне покращення у пацієнтів з хворобою Альцгеймера (Barner and Gray, Ann. Pharmacotherapy 32:70-77, 1998; Rogers and Friedhoff, Eur. Neuropsych. 8:67-75, 1998), але він не вважається засобом лікування. Внаслідок цього, зрозуміло, що існує потреба в більш ефективних лікуваннях пацієнтів з хворобою Альцгеймера. Хвороба Альцгеймера характеризується відкладенням і накопиченням пептиду довжиною 39-43 амінокислоти, що має назву бета-амілоїдний білок, Aβ або β/A4 (Glenner і Wong, Biochem. Biophys. Res. Comm. 120:885-890, 1984; Masters et al., Proc. Natl. Acad. Sci. USA 82:4245-4249, 1985; Husby et al., Bull. WHO 71:105-108, 1993). Aβ отримують шляхом протеазного відщеплення від більш великих білків-попередників, що мають назву β-амілоїдні білки-попередники (APP), з яких деякі є альтернативно сплайсованими варіантами. Найбільш поширені форми APP включають білки, що складаються з 695, 751 і 770 амінокислот (Tanzi et al., Nature 31:528-530, 1988). Невеликий Aβ пептид є важливим компонентом, що утворює амілоїдні відкладення "бляшок" в мозках пацієнтів із хворобою Альцгеймера. Крім того, хвороба Альцгеймера характеризується присутністю різних нейрофібрилярних "клубків", що складаються з спарених спіральних філаментів, які аномально накопичуються в нейрональній цитоплазмі (Grundke-Iqbal et al., Proc. Natl. Acad. Sci. USA 83:4913-4917, 1986; Kosik et al., Proc. Natl. Acad. Sci. USA 83:4044-4048, 1986; Lee et al., Science 251:675-678, 1991). Патологічною ознакою хвороби Альцгеймера є, внаслідок цього, присутність "бляшок" і "клубків", де β-амілоїд відкладається в серцевині бляшок. Інший важливий тип ураження, виявлений в мозку при хворобі Альцгеймера, являє собою накопичення β-амілоїду в стінках кровоносних судин як в паренхімі мозку, так і в стінках менінгеальних судин, що лежать за межами мозку. β-амілоїдні відкладення, локалізовані в стінках кровоносних судин, мають назву цереброваскулярний амілоїд або конгофільна ангіопатія (Mandybur, J. Neuropath. Exp. Neurol. 45:79-90, 1986; Pardridge et al., J. Neurochem. 49:1394-1401, 1987) Протягом багатьох років ведуться постійні наукові дебати стосовно важливості “β-амілоїду" в хворобі Альцгеймера і стосовно того, чи характерна ознака цієї хвороби у вигляді "бляшок" і "клубків" є причиною або лише наслідком хвороби. Протягом останніх декількох років дослідження визначили, що β-амілоїд безумовно є етіологічним фактором хвороби Альцгеймера і не повинен розглядатися лише в якості феномену "мовчазного спостерігача". Показано, що Aβ білок Альцгеймера в клітинній культурі призводить до дегенерації нервових клітин протягом короткого періоду часу (Pike et al., Br. Res. 563:311-314, 1991; J. Neurochem. 64:253-265, 1995). Дослідження дають змогу припустити, що існує фібрилярна структура (що складається з переважної вторинної структури β-складчастого листа), відповідальна за нейротоксичні ефекти. Виявили також, що Aβ є нейротоксичним в культурах зрізів гіпокапму (Harrigan et al., Neurobiol. Aging 16:779-789, 1995) і призводить до смерті нервових клітин в трансгенних мишах (Games et al., Nature 373:523-527, 1995; Hsiao et al., Science 274:99-102, 1996). Ін'єкція Aβ Альцгеймера в мозок щурів також призводить до порушень пам'яті і нейрональної дисфункції (Flood et al., Proc. Natl. Acad. Sci. USA 88:3363-3366, 1991; Br. Res. 663:271-276, 1994). Ймовірно, що найбільш переконливий доказ того, що Aβ амілоїд є безпосередньо залученим у патогенез хвороби Альцгеймера, надається генетичними дослідженнями. З'ясували, що продукція Aβ може бути результатом мутацій в гені, що кодує його попередник - β-амілоїдний білок-попередник (Van Broeckhoven et al., Science 248:1120-1122, 1990; Murrell et al., Science 254:97-99, 1991; Haass et al., Nature Med. 1:1291-1296, 1995). Визначення мутацій в гені бетаамілоїдного білка-попередника, що спричинює ранній прояв сімейної хвороби Альцгеймера, є вагомим аргументом того, що амілоїд є центральним в патогенному процесі, що лежить в основі цієї хвороби. Було відкрито чотири опублікованих мутації, що викликають хворобу, які демонструють важливість Aβ в спричиненні сімейної хвороби Альцгеймера (що розглядається в Hardy, Nature Genet. 1:233-234, 1992). Всі ці дослідження, що забезпечують лікарський засіб для зменшення, усунення або попередження формування, агрегації, відкладення, накопичення і/або тривалого існування фібрилярного Aβ в мозках пацієнтів-людей, будуть служити в якості ефективного терапевтичного засобу. Хвороба Паркінсона і синуклеїнопатії Хвороба Паркінсона являє собою нейродегенеративний розлад, що патологічно характеризується присутністю внутрішньоцитоплазматичних тілець Леві (Lewy in Handbuch der 2 UA 101393 C2 5 10 15 20 25 30 35 40 45 50 55 60 Neurologie, M. Lewandowski, ed., Springer, Berlin, pp. 920-933, 1912; Pollanen et al., J. Neuropath. Exp. Neurol. 52:183-191, 1993), основними компонентами яких є філаменти, що складаються з αсинуклеїну (Spillantini et al., Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al., Neurosci. Lett. 259:83-86, 1999), 140-амінокислотного білка (Ueda et al., Proc. Natl. Acad. Sci. USA 90:11282-11286, 1993). Дві домінанті мутації в α-синуклеїні, що спричиняють сімейний ранній прояв хвороби Паркінсона були описані, що дає можливість припустити, що тільця Леві здійснюють внесок механічно в дегенерацію нейронів при хворобі Паркінсона і пов'язаних розладах (Polymeropoulos et al., Science 276:2045-2047, 1997; Kruger et al., Nature Genet. 18:106-108, 1998). Нещодавно, дослідження in vitro продемонстрували, що рекомбінантний αсинуклеїн може дійсно формувати подібні до тілець Леві фібрили або агрегати (Conway et al., Nature Med. 4:1318-1320, 1998; Hashimoto et al., Brain Res. 799:301-306, 1998; Nahri et al., J. Biol. Chem. 274:9843-9846, 1999). Найбільш важливо, що обидві пов'язані з хворобою Паркінсона αсинуклеїнові мутації прискорюють цей процес агрегації, що демонструє, що такі in vitro дослідження можуть бути важливими для патогенезу хвороби Паркінсона. Агрегація альфасинуклеїну і формування фібрил задовольняє критеріям процесу полімеризації, що залежить від нуклеації (Wood et al., J. Biol. Chem. 274:19509-19512, 1999). При цьому формування або агрегація α-синуклеїнових фібрил подібна до такої у фібрил β-амілоїдного білка (Aβ) Альцгеймера. Альфа-синуклеїновий рекомбінантний білок і не-Aβ компонент (відомий як NAC), який являє собою пептидний фрагмент α-синуклеїну з 35 амінокислот, обидва мають здатність формувати фібрили або агрегат при інкубуванні при 37 °C і є позитивними по відношенню до амілоїдних барвників, таких як Конго червоний (демонструючи подвійне заломлювання променів червоний/зелений при спостереженні в поляризованому світлі) і Тіофлавін S (демонструючи позитивну флуоресценцію) (Hashimoto et al., Brain Res. 799:301-306, 1998; Ueda et al., Proc. Natl. Acad. Sci. USA 90:11282-11286, 1993). Синуклеїни являють собою родину невеликих, пресинаптичних нейрональних білків, що складається з α-, β- і γ-синуклеїнів, з яких лише α-синуклеїнові агрегати були пов'язані з деякими неврологічними хворобами (Ian et al., Clinical Neurosc. Res. 1:445-455, 2001; Trojanowski і Lee, Neurotoxicology 23:457-460, 2002). Роль синуклеїнів (та зокрема альфа-синуклеїну) в етіології ряду нейродегенеративних хвороб встановлена на основі деяких спостережень. Патологічно, синуклеїн був визначений як основний компонент тілець Леві, характерних включень хвороби Паркінсона, і його фрагмент був виділений з амілоїдних бляшок іншої неврологічної хвороби, хвороби Альцгеймера. Біохімічно, рекомбінантний α-синуклеїн, як показано, формує фібрили або агрегати, що повторюють ультраструктурні ознаки альфасинуклеїну, виділеного з пацієнтів з деменцією з тільцями Леві, хворобою Паркінсона і мультисистемною атрофією. Додатково, визначення мутацій в гені синуклеїну, хоча і в рідкісних випадках сімейної хвороби Паркінсона, продемонструвало безсумнівний зв'язок між синуклеїновою патологією і нейродегенеративними хворобами. Загальна участь α-синуклеїну в спектрі хвороб, таких як хвороба Паркінсона, деменція з тільцями Леві, мультисистемна атрофія і варіант хвороби Альцгеймера з тільцями Леві призвело до класифікації цих хвороб під егідою терміну "синуклеїнопатії". Як α-синуклеїнові фібрили або агрегати хвороби Паркінсона, так і Aβ фібрили хвороби Альцгеймера складаються з переважно структури β-складчастого листа. Виявлено, що сполуки, які інгібують формування Aβ амілоїдних фібрил хвороби Альцгеймера, також, як показано, є ефективними в інгібуванні формування фібрил або агрегації α-синуклеїну, як показано в Прикладах даного винаходу. Ці сполуки внаслідок цього будуть також служити в якості терапевтичних засобів для хвороби Паркінсона та інших синуклеїнопатій, які додатково мають ефективність в якості терапевтичного засобу для хвороби Альцгеймера. Хвороба Паркінсона і хвороба Альцгеймера характеризуються невідповідним накопиченням нерозчинних агрегатів, що включають насамперед неправильно зсідні білки, що збагачені вторинною структурою β-складчастого листа (що розглядається в Cohen et al., Nature 426:905909, 2003; Chiti et al., Annu. Rev. Biochem., 75:333-366, 2006). В хворобі Паркінсона -синуклеїн є основною складовою цих агрегатів в якості частини тілець Леві, і мутації в -синуклеїні, що збільшують його здатність до неправильного зсідання і агрегації, спостерігаються при сімейній хворобі Паркінсона (Polymeropoulos et al., Science 276:1197-1199, 1997; Papadimitriou et al., Neurology 52:651-654, 1999). Мітохондріальна дисфункція, особливо як результат порушення комплексу I ланцюгу транспорту електронів, є також загальною ознакою хвороби Паркінсона (Schapira et al., J. Neurochem., 54:823-827, 1990; що розглядається в Greenamyre et al., IUBMB Life, 52:135-141, 2001). Прямий доказ мітохондріальних дефіцитів в етіології хвороби Паркінсона по-перше виходить зі спостереження, що MPP+ (1-метил-4-феніл-2,3-дигідропіридин), активний метаболіт 3 UA 101393 C2 5 10 15 20 25 30 35 40 45 токсину паркінсонізму N-метил-4-феніл-1,2,3,6-тетрагідропіридину (MPTP), інгібує комплекс I (Nicklas et al., Life Sci., 36:2503-2508, 1985). Отже, ротенон, інший інгібітор комплексу I, як показано, є покращеною моделлю для -синуклеїнової агрегації, тому що він відтворює вищезгадані -синуклеїн-позитивні внутрішньоцитоплазматичні агрегати додатково до змін в поведінці і втрати допамінергічних нейронів, що спостерігалось в MPTP моделі. Ротенонова токсичність цього типу спостерігається в складних модельних системах, включаючи щурів (Betarbet et al., Nat. Neurosci., 3:1301-1306, 2000; Panov et al., J. Biol. Chem., 280:42026-42035, 2005), зрізи мозку щурів (Sherer et al., J. Neurosci., 23:10756-10764, 2003; Testa et al., Mol. Brain Res., 134:109-118, 2005), C. elegans (Ved et al., J. Biol. Chem., 280:42655-42668, 2005) і культивовані клітини (Sherer et al., J. Neurosci., 22:7006-7015, 2002), і було показано, що вона є наслідком збільшеного окисного ушкодження в результаті інгібування комплексу I. Для кращого розуміння взаємозв'язку окисного ушкодження з патогенезом мутантного синуклеїну з рівня техніки було встановлено, що клітинна лінія нейробластоми (використовуючи BE-M17 клітини) надекспресує A53T -синуклеїн. В цих клітинах A53T -синуклеїн агрегує у відповідь на різні засоби, що викликають окисний стрес, і посилює мітохондріальну дисфункцію і клітинну смерть (Ostrerova-Golts et al., J. Neurosci., 20:6048-6054, 2000). Ці клітини піддаються обробці ротеноном в якості індуктора окисного стресу і, отже, є особливо придатними для аналізу засобів, що можуть інгібувати -синуклеїнову агрегацію/фібрилогенез. Відкриття і визначення нових сполук або засобів в якості потенційних терапевтичних засобів для пригнічення амілоїдного формування, відкладення, накопичення і/або тривалого існування, що має місце при хворобі Альцгеймера і хворобі Паркінсона, є вкрай необхідними. Короткий опис винаходу Даний винахід стосується біс-дигідроксіарильних сполук та їх фармацевтично прийнятних солей. Сполуки придатні в лікуванні β-амілоїдозів і синуклеїнопатій. Сполуки являють собою сполуки формули: , де: де R1 і R2, і R3 і R4 являють собою гідроксильні групи, незалежно розташовані на одному з положень, вибраних з групи, що включає 2,3; 2,4; 2,5; 2,6; 3,5; 3,6; 4,5; 4,6 і 5,6, і R, вибраний з сульфонаміду, гетероарилу, трициклоалкілу і -C(O)NR", де R" вибраний з H або CH3, або їх фармацевтично прийнятних складних ефірів або солей. Також забезпечуються будь-які фармацевтично прийнятні похідні, включаючи солі, складні ефіри, прості або складні ефіри енолу, ацеталі, кеталі, складні ортоефіри, геміацеталі, гемікеталі, сольвати, гідрати або проліки сполук. Фармацевтично-прийнятні солі, включають, але не обмежуються наступним: солі амінів, такі як, але не обмежуючись, N, N'дибензилетилендіаміном, хлорпрокаїном, холіном, аміаком, диетаноламіном та іншими гідроксіалкіламінами, етилендіаміном, N-метилглюкаміном, прокаїном, N-бензилфенетиламіном, 1-пара-хлорбензил-2-піролідин-1'-ілметилбензімідазолом, диетиламіном та іншими алкіламінами, піперазином, трис(гідроксиметил)амінометаном, солі лужних металів, такі як, але не обмежуючись, літієм, калієм і натрієм, солі лужноземельних металів, такі як, але не обмежуючись, барієм, кальцієм і магнієм, солі перехідних металів, такі як, але не обмежуючись, цинком, та інші солі металів, такі як, але не обмежуючись, вторинним кислим фосфатом натрію і динатрію фосфатом, і також включаючи, але не обмежуючись наступним, солі мінеральних кислот, такі як, але не обмежуючись, хлоргідратами і сульфатами, солі органічних кислот, такі як, але не обмежуючись, ацетатами, лактатами, малатами, тартратами, цитратами, аскорбатами, сукцинатами, бутиратами, валератами і фумаратами. Також забезпечуються фармацевтичні склади для введення відповідним шляхом і засобами, що містять ефективні концентрації однієї або більше сполук, забезпечених в даному документі, або фармацевтично прийнятних похідних, таких як солі, складні ефіри, прості або складні ефіри 4 UA 101393 C2 5 10 15 20 25 30 35 40 45 50 55 енолу, ацеталі, кеталі, складні ортоефіри, геміацеталі, гемікеталі, сольвати, гідрати або проліки сполук, що доставляють кількості, ефективні для лікування амілоїдозів. Склади являють собою композиції, придатні для введення будь-яким бажаним шляхом, і включають розчини, суспензії, емульсії, таблетки, таблетки, що диспергуються, пігулки, капсули, порошки, сухі порошки для інгаляції, склади уповільненого вивільнення, аерозолі для назальної та респіраторної доставки, пластири для трансдермальної доставки і будь-який інший придатний шлях. Композиції будуть придатними для перорального введення, парентерального введення шляхом ін'єкції, включаючи підшкірне, внутрішньом'язове або внутрішньовенне у вигляді водного або масляного розчину або емульсії для ін'єкції, трансдермальне введення та інші вибрані шляхи. Забезпечуються способи, що використовують такі сполуки і композиції для руйнування, дезагрегування і спричинення переміщення, зменшення або виведення β-амілоїдних або αсинуклеїнових фібрил або агрегатів, таким чином забезпечуючи нові лікування β-амілоїдозів і синуклеїнопатій. Також забезпечуються способи лікування, профілактики або зменшення інтенсивності одного або більше симптомів амілоїдозних хвороб або амілоїдoзів, включаючи, але не обмежуючись хворобами, що пов'язані з формуванням, відкладенням, накопиченням або тривалим існуванням β-амілоїдних фібрил. Способи лікування амілоїдозів, включають, але не обмежуються наступним: хвороба Альцгеймера, синдром Дауна, спадкова церебральна геморагія з амілоїдозом голландського типу і церебральна β-амілоїдна ангіопатія. Також забезпечуються способи лікування, профілактики або зменшення інтенсивності одного або більше симптомів синуклеїнових хвороб або синуклеїнопатій. В одному варіанті здійснення способи інгібують або попереджають формування фібрил α-синуклеїну, інгібують або попереджають ріст фібрил α-синуклеїну і/або викликають розбирання, руйнування і/або дезагрегування попередньо сформованих α-синуклеїнових агрегатів і асоційованих з αсинуклеїном білкових відкладень. Синуклеїнові хвороби включають, але не обмежуються наступним: хвороба Паркінсона, сімейна хвороба Паркінсона, хвороба тілець Леві, варіант хвороби Альцгеймера з тільцями Леві, деменція з тільцями Леві, мультисистемна атрофія і комплекс паркінсонізм-деменція Гуама. Короткий опис графічних матеріалів Файл патенту або заявки містить щонайменше одне зображення, виконане в кольорі. Копії даного патенту або публікації патентної заявки з кольоровим зображенням(ями) будуть забезпечуватися Бюро на вимогу і при сплаті необхідного мита. Фігура 1A показує деякі спектри кругового дихроїзму, які ілюструють, що Aβ фібрили хвороби Альцгеймера руйнуються сполуками, що аналізуються при співвідношенні 1:1 вага/вага. Фігура 1B показує графічно % інгібування. Фігура 2 показує порівняльні спектри кругового дихроїзму, що ілюструють, що α-синуклеїн формує збагачену β-листами структуру через 4 дні при струшуванні при 37 °C. Фігура 3 показує деякі спектри кругового дихроїзму, які ілюструють, що аналізовані сполуки інгібують α-синуклеїнову агрегацію при 1:1 вага/вага. Фігура 3B показує графічно % інгібування. Фігура 4 показує деякі спектри кругового дихроїзму, які ілюструють, що сполуки інгібують αсинуклеїнову агрегацію при 1:0,1 вага/вага. Фігура 4B показує графічно % інгібування. Фігура 5 графічно підсумовує результати, що виміряні за допомогою Тіо T (тіофлавін Т), аналізованих сполук стосовно інгібування формування або агрегації Aβ фібрил. Фігура 6 графічно підсумовує результати, що виміряні за допомогою Конго червоного, аналізованих сполук стосовно інгібування формування або агрегації Aβ фібрил. Фігура 7 графічно підсумовує результати, що виміряні за допомогою Тіо T, аналізованих сполук стосовно інгібування формування або агрегації фібрил α-синуклеїну. Фігура 8 графічно підсумовує результати, що виміряні за допомогою Конго червоного, аналізованих сполук стосовно інгібування формування або агрегації фібрил α-синуклеїну. Фігури 9 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють ефекти ротенону на ряд тіофлавін S-позитивних агрегатів. Фігура 9A являє собою тільки наповнювач, Фігура 9B являє собою 1 мкмоль ротенону, Фігура 9C являє собою 5 мкмоль при малому збільшенні і Фігура 9D являє собою 5 мкмоль при великому збільшенні. Фігура 9E підсумовує кількісний аналіз за допомогою Тіофлавіну S у відповідь на обробку ротеноном. Фігури 10 A-C являють собою приклади флуоресцентних мікрофотографій, які демонструють зменшення в тіофлавін S-позитивних агрегатах (зелена флуоресценція) при введенні сполуки позитивного контролю. Фігура 10A є необробленою, Фігура 10 B показує 500 нг/мл сполуки 5 UA 101393 C2 5 10 15 20 25 30 35 40 45 50 55 позитивного контролю і Фігура 10C показує 1 мкг/мл сполуки позитивного контролю. Фігура 10D підсумовує кількісний аналіз дозозалежного зменшення в агрегації. Фігури 11 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють ефекти сполуки 1 на присутність ротенон-індукованих тіофлавін S-позитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 11A є необробленою (тільки ротенон), і Фігури 11 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 1. Фігура 11D підсумовує кількісний аналіз ефектів сполуки 1. Фігури 12 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 2 сильно зменшує присутність ротенон-індукованих тіофлавін Sпозитивних агрегатів (зелений) в клітинах. Фігура 12A є необробленою (тільки ротенон), і Фігури 12 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 2. Фігура 12E підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 2. Фігури 13 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 3 зменшує присутність ротенон-індукованих тіофлавін S-позитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 13A є необробленою (тільки ротенон), і Фігури 13 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 3. Фігура 13E підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 3. Фігури 14 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 4 мінімально зменшує присутність ротенон-індукованих тіофлавін Sпозитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 14A є необробленою (тільки ротенон), і Фігури 14 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 4. Фігура 14E підсумовує кількісний аналіз ефектів сполуки 4. Фігури 15 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 5 трохи зменшує присутність ротенон-індукованих тіофлавін Sпозитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 15A є необробленою (тільки ротенон), і Фігури 15 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 5. Фігура 15E підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 5. Фігури 16 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 6 мінімально впливає на присутність ротенон-індукованих тіофлавін S-позитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 16A є необробленою (тільки ротенон), і Фігури 16 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 6. Фігура 16E підсумовує кількісний аналіз ефектів сполуки 6. Фігури 17 A-C являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 7 помірно зменшує присутність ротенон-індукованих тіофлавін Sпозитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 17A є необробленою (тільки ротенон), і Фігури 17 B-C, відповідно, показують 500 нг/мл і 2 мкг/мл сполуки 7. Фігура 17D підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 7. Фігури 18 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 8 помірно зменшує присутність ротенон-індукованих тіофлавін Sпозитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 18A є необробленою (тільки ротенон), і Фігури 18 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 8. Фігура 18E підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 8. Фігури 19 A-D являють собою приклади флуоресцентних мікрофотографій, які демонструють, що сполука 9 зменшує присутність ротенон-індукованих тіофлавін S-позитивних агрегатів (зелений) в клітинах залежно від дози. Фігура 19 A є необробленою (тільки ротенон), і Фігури 19 B-D, відповідно, показують 500 нг/мл, 1 мкг/мл і 2 мкг/мл сполуки 9. Фігура 19E підсумовує кількісний аналіз антиагрегаційних ефектів сполуки 9, де * p
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and use of triazole derivatives for treating b-amyloid diseases and synucleinopathies
Автори англійськоюEsposito, Luke, A., Hudson, F., Michael, Lake, Thomas, Cummings, Joel, Weigele, Manfred, Snow, Alan, D., Larsen, Lesley
Назва патенту російськоюКомпозиции и применение производных триазола для лечения b-амилоидозов и синуклеинопатий
Автори російськоюЭспозито Люк А., Хадсон Ф. Майкл, Лейк Томас, Каммингз Джоул, Вайгеле Манфред, Сноу Алан Д., Ларсен Лесли
МПК / Мітки
МПК: A01N 47/28
Мітки: лікування, похідних, b-амілоїдозів, композиції, триазолу, синуклеїнопатій, застосування
Код посилання
<a href="https://ua.patents.su/76-101393-kompozici-ta-zastosuvannya-pokhidnikh-triazolu-dlya-likuvannya-b-amilodoziv-i-sinuklenopatijj.html" target="_blank" rel="follow" title="База патентів України">Композиції та застосування похідних триазолу для лікування b-амілоїдозів і синуклеїнопатій</a>
Попередній патент: Спосіб визначення продуктивності млина пилосистеми котельної установки
Наступний патент: Ультразвуковий випромінювач
Випадковий патент: Спосіб корекції гемітораксу












