Спосіб визначення вмісту вільного кальцію в клітині при двохвильовому методі збудження флуоресцентного барвника
Формула / Реферат
Спосіб визначення вмісту вільного кальцію в клітині при двохвильовому методі збудження флуоресцентного барвника, що включає завантаження барвника fura-2 (AM) всередину клітини, збудження барвника за допомогою епіфлуоресцентного мікроскопа хвилями 340 нм та 380 нм, реєстрацію флуоресценції від 500 нм на детектор за допомогою ПЗЗ камери, визначення фонового рівня автофлуоресценції, який віднімається для кожного сигналу при двох довжинах хвиль, проведення калібрування барвника, який відрізняється тим, що в ньому проводять додаткову нормалізацію сигналів при збудженні барвника хвилею 340 нм за формулою: ![]() , та при збудженні барвника хвилею 380 нм за формулою:
, та при збудженні барвника хвилею 380 нм за формулою: ![]() , де
, де ![]() (або
(або ![]() ) є поточний сигнал, a
) є поточний сигнал, a ![]() (або
(або ![]() ) - початкова флуоресценція до зміни сигналу, далі отримані нормовані сигнали складають, помножують на відношення сигналів
) - початкова флуоресценція до зміни сигналу, далі отримані нормовані сигнали складають, помножують на відношення сигналів ![]() та визначають узагальнений сигнал
та визначають узагальнений сигнал ![]() за формулою:
за формулою:
![]() ,
,
після чого розраховують вміст вільного кальцію в клітині:
![]() ,
,
де ![]() - константа дисоціації;
- константа дисоціації; ![]() та
та ![]() мінімальна та максимальна флуоресценція, що визначається за процедурою калібрування.
мінімальна та максимальна флуоресценція, що визначається за процедурою калібрування.
Текст
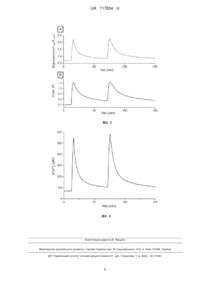
Реферат: Спосіб визначення вмісту вільного кальцію в клітині при двохвильовому методі збудження флуоресцентного барвника включає завантаження барвника fura-2 (AM) всередину клітини, збудження барвника за допомогою епіфлуоресцентного мікроскопа хвилями 340 нм та 380 нм, реєстрацію флуоресценції від 500 нм на детектор за допомогою ПЗЗ камери, визначення фонового рівня автофлуоресценції, який віднімається для кожного сигналу при двох довжинах хвиль, проведення калібрування барвника, причому в ньому проводять додаткову нормалізацію сигналів при збудженні барвника хвилею 340 нм за формулою: F340 /(2 F340 (0)) , та при збудженні барвника хвилею 380 нм за формулою: 1 F380 /(2 F380 (0)) , де F340 (або F380 ) є поточний сигнал, a F340 (0) (або F380 (0) ) - початкова флуоресценція до зміни сигналу, далі отримані нормовані сигнали складають, помножують на відношення сигналів F340 (0) / F380 (0) та визначають узагальнений сигнал F за формулою: F (0) 1 F340 F380 F 340 F (0) F (0) 1 , F380 (0) 2 340 380 після чого розраховують вміст вільного кальцію в клітині: F Fmin [Ca 2 ] Kd , Fmax F де K d - константа дисоціації; Fmin та Fmax мінімальна та максимальна флуоресценція, що визначається за процедурою калібрування. UA 117834 U (54) СПОСІБ ВИЗНАЧЕННЯ ВМІСТУ ВІЛЬНОГО КАЛЬЦІЮ В КЛІТИНІ ПРИ ДВОХВИЛЬОВОМУ МЕТОДІ ЗБУДЖЕННЯ ФЛУОРЕСЦЕНТНОГО БАРВНИКА UA 117834 U UA 117834 U Корисна модель належить до медицини, а саме до клітинної фізіології. 5 10 15 20 25 30 35 40 45 50 55 60 Визначення концентрації вільного кальцію [Ca 2 ]i для клітинної фізіології займає важливу роль при наукових дослідженнях та медичних підходах. Кальцій грає суттєву роль в фізіологічних процесах всередині клітини. Для визначення вмісту вільного кальцію всередині клітини використовують флуоресцентну мікроскопію з застосуванням дво- або однохвильового методу збудження флуоресцентного барвника [1, 2]. Як двохвильовий флуоресцентний барвник використовують fura-2(AM). При збудженні цього 2+ барвника хвилею 340 нм флуоресценція збільшується, при цьому іон Са зв'язується з молекулою барвника. Барвник має максимальну флуоресценцію, коли всі молекули барвника 2+ пов'язані з Са . Але при дії хвилі 380 нм зміна флуоресценції дзеркально протилежна і fura-2 2+ має пік випромінювання флуоресценції, коли барвник зовсім не пов'язаний з іонами Са і 2+ зменшує свою флуоресценцію при зв'язуванні молекулами барвника іонів Са . Для такого барвника використовується загально прийняте відношення двох флуоресцентних сигналів: сигналу при 340 нм збудження до сигналу при 380 нм. Дана дія отримала назву методу відносин 2+ цих сигналів для двохвильового методу визначення Са . Важливо пам'ятати, що флуоресценція, яка випромінюється від барвника, і відношення двох цих сигналів не має 2+ 2+ лінійної залежності від концентрації Са , і для отримання фактичної концентрації Са необхідно проводити додаткове калібрування. Постійне збудження флуоресцентного барвника може призводити до відсутності випромінювання фотонів від молекул барвника або навіть повного пошкодження молекул барвника. Це явище проявляється в зниженні флуоресцентного сигналу в часі, навіть незважаючи на постійну концентрацію кальцію. Така втрата флуоресценції (фотовигорання) під 2+ час досліджень призводить до спотворення результатів точного визначення Са [3]. У простих експериментальних умовах при однохвильовому методі збудження фарбника ефект фотовигорання може бути математично скоректований [4]. З використанням методу відносини двох флуоресцентних сигналів такий ефект фотовигорання усувається через просту математичну операцію ділення флуоресцентних сигналів однієї довжини хвилі збудження фарбника на іншу. При збудженні флуоресцентного барвника, поміщеного всередину клітини, сигнал реєструється детектором, що реєструє флуоресцентну інформацію не тільки обумовлену збудженням збуджених молекул барвника, а й деяким фоновим сигналом або автофлуоресценцією. Віднімання фонового рівня є важливою необхідністю, оскільки фонове значення може призводити до великої помилки і величина фону може відрізнятись від експерименту, від установки до установки. Фоновий рівень віднімається від двох сигналів при 340 нм та 380 нм збудженні. Найближчим до корисної моделі, що заявляється, є спосіб визначення вмісту вільного кальцію у клітині [5], в якому концентрація вільного кальцію усередині досліджуваного об'єкта визначається за допомогою наступної процедури строго виконуваних дій. Спочатку відбувається завантаження барвника fura-2 (AM) всередину клітини (зазвичай протягом 30 хвилин при концентрації 5 мкМ; залежить від досліджуваного об'єкта). Після того як барвник проник в клітку за допомогою деетерифікації fura-2 (AM) він активний і готовий до досліджень. Для досліджень використовується епіфлуоресцентний мікроскоп з можливістю збудження барвника на 340 нм та 380 нм і реєстрації флуоресценції від 500 нм на детектор, в якості якого може бути фотопримножуюча труба (ФПТ) або камера CCD-матриця (скор. від англ. charge-coupled device прилад із зарядним зв'язком - ПЗЗ). Зміна збудження відбувається по крокам і для кожної тимчасової точки вимірювання записується флуоресцентний сигнал при кожній довжини хвилі (як окрема точка або одновимірний, або двомірний масив даних). Для обчислення вільної концентрації кальцію необхідно визначити фоновий рівень автофлуоресценції. Для цього фоновий рівень визначається як сигнал від клітини без флуоресцентного барвника при таких же умовах, що будуть використовуватися для визначення концентрації вільного кальцію. Визначений фоновий рівень віднімається для кожного сигналу при двох довжинах хвиль. Для визначення концентрації кальцію необхідно зробити калібрування барвника. Для цього проводиться визначення флуоресценції барвника в двох граничних станах: при повній відсутності зв'язаного з барвником іонів кальцію і при повному його насичені. Для цих цілей використовується розчин, що містить 10 мМ EGTA - кальцієвий буфер, EGTA повністю пов'язує всі іони кальцію; та 10 мМ СаСІ2 з 10 мМ EGTA - що дозволяє отримати концентрацію вільного кальцію на рівні 39 мкМ, така концентрація повністю наситить флуоресцентний барвник fura-2. Наступним кроком є обчислення відношення сигналів, коли сигнал при 340 нм збудженні ділиться на сигнал при 380 нм збудженні. Отримане відношення сигналів позначається як R. Величина R являє собою сигнал, який можна використовувати для порівняння змін кальцію, але 1 UA 117834 U він не є прямо пропорційним концентрації кальцію. Використовуючи поточні значення відношення R, можна точно визначити концентрацію вільного кальцію за формулою: [Ca 2 ] K d 5 380 R Rmin Fmin , 380 Rmax R Fmax (1) де R F340 / F380 відповідає відношенню двох сигналів при 340 нм до сигналу при 380 нм збудженні; Rmax - співвідношення флуоресценції 340 до 380 при повному зв'язуванні кальцію з 340 380 барвником (Fmax / Fmin ) ; Rmin - це також співвідношення за умови, коли кальцій не пов'язаний з 10 15 20 25 30 35 40 340 380 380 380 барвником (Fmin / Fmax ) ; K d - константа дисоціації; (Fmin / Fmax ) - це відносна інтенсивність флуоресценції барвника, зв'язаного і не зв'язаного з кальцієм при 380 нм збудженні [6]. Даний прототип має суттєві недоліки. При обчисленні відносини (R) одного сигналу до іншого сигнал при збудженні в 380 нм при відніманні фонового рівня може приймати негативні і навіть нульові значення, що призводить до сильного спотворення як величини R так і точності визначення величини концентрації вільного кальцію. А це взагалі не прийнятно як для простих досліджень в клітинній фізіології так і в медицині. Тому, задачею корисної моделі є розробка найбільш удосконаленого способу визначення вмісту вільного кальцію за умов застосування двохвильового методу збудження флуоресцентного барвника. Технічним результатом корисної моделі, що заявляється, є висока точність визначення вмісту вільного кальцію всередині клітини при реєструванні на ПЗЗ камеру або ФПТ детектор та компенсації вигорання барвника. Суть корисної моделі, що заявляється, зводиться до суміжних процедур: завантаження досліджуваного об'єкта флуоресцентним барвником, наприклад fura-2 (am). Покрокова реєстрація випромінювання барвника від 500 нм при збудженні барвника на двох довжинах хвиль при 340 нм і 380 нм. Для кожної тимчасової точки вимірювання записується флуоресцентний сигнал (як окрема точка або одновимірний чи двомірний масив даних, в залежності від детектора) для кожної довжини хвилі. Проводиться визначення фонового рівня сигналу. Певний фоновий рівень віднімається для кожного сигналу при двох довжинах хвиль. Також проводиться калібрування барвника та визначається флуоресценція барвника для двох довжин хвиль в двох граничних станах: при повній відсутності пов'язаного з барвником кальцію і при повному його насиченні (аналогічно описаній дії в прототипі пропонованої корисної моделі). Дані етапи визначення концентрації вільного кальцію повторюють описані в прототипі пропонованої корисної моделі. Відмінною особливістю запропонованої корисної моделі є додаткова нормалізація сигналів для двох довжин хвиль з подальшим складанням нормованих сигналів. Так, наступним етапом є нормалізація. Для цього проводять нормалізацію сигналу при збудженні в 340 нм, яка проводитися згідно з формулою F340 /(2 F340 (0)) . Нормалізація сигналу при збудженні в 380 нм, отримується згідно з формулою: 1 F380 /(2 F380 (0)) . Де F340 (або F380 ) є поточний сигнал, а F340 (0) (або F380 (0) ) початкова флуоресценція до зміни сигналу. Отримані нормовані сигнали складаються один з одним і узагальнюючий сигнал F являє нормовану флуоресценцію, що скомпенсована на процес вигоряння. Додатково такий сигнал F помножують на відношення сигналів з початковими значеннями, до зміни сигналу (або перед кальцієвим транзієнтом - при базальному рівні), що є F340 (0) / F380 (0) та визначають за формулою: F (0) 1 F340 F380 . F 340 F (0) F (0) 1 (2) F380 (0) 2 340 380 45 Процес розрахунку вільної концентрації кальцію, згідно з корисною моделлю, що заявляється, визначають за формулою, що знайшла своє застосування для однохвильового методу визначення вмісту кальцію: [Ca 2 ] F Fmin Kd , Fmax F (3) 2 UA 117834 U 5 10 15 20 25 30 35 40 45 50 55 де K d - константа дисоціації; F - поточна флуоресценція, що визначена за формулою 2, F min та F max мінімальна та максимальна флуоресценція, що визначається за попередньою процедурою калібрування. Така процедура маніпуляції з сигналами, за умови компенсування процесу вигоряння барвника та використання з відніманням фонового рівня, дозволяє виключити помилки, що можуть спостерігатися при використанні просто відношення двох сигналів при 340 нм до 380 нм, коли в знаменниках можуть зустрічатися нульові значення і навіть негативні. Даний метод може бути використаний як для ФПТ детекторів, так і для ПЗЗ детекторів. Приклад Дослідження проводилися на культивованих нейронах гіпокампу (більш докладно дивися [7]), посаджених на скло товщиною #1. Культивовані нейрони поміщалися в розчин Тироде, що містив в мМ: NaCI - 140; KСІ - 2; СаСІ2 - 2; МgСІ2 - 2.0; HEPES-10; рН=7,4. Для деполяризації мембрани нейронів, щоб викликати кальцієвий транзієнт використовувався розчин з 50 мМ KСІ, 2+ який містив в мМ: NaCI - 82; KСІ - 50; СаСІ2 - 2; МgСІ2 - 2,0; HEPES-10; рН=7,4. Са транзієнт викликався за рахунок аплікації деполяризуючого розчину в 5 секунд за допомогою програмного забезпечення, що контролювалось за допомогою персонального комп'ютера і комп'ютер був синхронізований з програмним забезпеченням збору даних. Клітини були завантажені з 5 мкМ ацетоксиметилскладний ефір fura-2 (fura-2 AM), ця форма барвника проникає через клітинну мембрану і деетерифікується за допомогою мембранних естераз, що дозволяє пройти молекулам fura-2 в клітину. Процедура інкубування клітин з fura-2 здійснювалась протягом 30 хвилин при температурі 37 градусів і також додаткових 20 хвилин для деетерифікації барвника. Константа дисоціації (Kd) дорівнювала 200 нМ. Для проведення цих досліджень використовувався інвертований мікроскоп Olympus 1 × 71, оснащений системою освітлення МТ10, яка включає в собі колесо фільтрів 340 нм та 380 нм зрізу збудження від 150W ксенонової дугової лампи. Для збору флуоресцентної інформації використовувалась ПЗЗ камера (CCD; Olympus ХМ 10). Мікроскоп управлявся персональним комп'ютером за допомогою програмного забезпечення Cell M (Olympus, Японія), що використовувалось для управління системою МТ10 і ХМ10 камерою. Для візуалізації ми використовуємо об'єктив Olympus LUCPIanFFN 20x/0,45. Було досліджено зміну концентрації вільного кальцію в культивованих нейронах гіпокампу на 10 день культивування. Флуоресцентний сигнал відводився від соми нейрона. На фіг. 1 представлена вибіркова реєстрація змін флуоресценції, зареєстрованих при збудженні барвника від індивідуального нейрона (27 травня 2016 року реєстрація 2 нейрон 1) при дворазовій аплікації деполяризуючого розчину (що містить 50 мМ KСІ) по 5 секунд. Така реєстрація змін концентрації вільного кальцію під час кальцієвого транзієнта є хорошим прикладом для порівняння прототипу з корисною моделлю. Як ми бачимо зміна флуоресценції в двох каналах відбувається зі збільшенням і зменшенням флуоресценції при збільшенні концентрації вільного кальцію для 340 нм і 380 нм хвиль збудження барвника fura-2, відповідно, що є загально прийнятим явищем для такого барвника. Для визначення концентрації кальцію необхідно обчислити фоновий рівень. Для цього фоновий рівень обчислювався як величина сигналу поза області клітини. Він склав 140 одиниць. Величина фонового сигналу була віднята з обох сигналів при 340 нм і 380 нм. На фіг. 1 представлений результат за умови вирахування фонового рівня. Наступним кроком в представленій корисній моделі для визначення концентрації кальцію є нормалізація сигналів для двох каналів. На фіг. 2 представлена нормалізація сигналів при 340 нм збудженні барвника, згідно з формулою F340 /(2 F340 (0)) , де F340 (0) величина початкової флуоресценції при 340 нм збудженні. Для 380 нм сигнал був нормалізований по формулі 1 F380 /(2 F380 (0)) (F380 (0) також величина початкової флуоресценції для цієї хвилі) і представлений на цьому ж кресленні сірою лінією. Як видно ці сигнали трохи відрізняються, що зумовлено процесом вигоряння барвника. Наступним кроком визначення буде складання двох цих сигналів. Дана операція дозволяє усунути ефект вигорання фарбника і являє собою нормовану флуоресценцію для барвника fura-2. Наступним кроком є множення сигналу на величину базального сигналу або початкову флуоресценцію (до початку кальцієвого транзієнта) на F340 (0) / F380 (0) . Такий сигнал представимо як флуоресцентний сигнал F. Така маніпуляція дозволяє використовувати отриманий сигнал для порівняння при інших реєстраціях і з сигналами, отриманими від інших нейронів в інших експериментах. Отриманий результат представлений на фіг. 3 частина Б. На фіг. 3 частина А представлений сигнал, який відповідає сигналу, отриманому при простому відношенні двох сигналів при 340 нм до 380 нм збудженні (як у прототипі). Сигнали на цій фігурі схожі, але відрізняються по амплітуді, що обумовлено різними маніпуляціями з сигналами. Наступним 3 UA 117834 U 5 10 15 20 25 30 35 40 45 50 кроком визначення зміни вільної концентрації кальцію буде процес калібрування. Були визначені мінімальні і максимальні значення флуоресценції барвника для двох довжин хвиль. Сигнал при 340 нм збудження мав флуоресценцію в 92,4 одиниць при повному насиченні барвника іонами кальцію і 32,0 одиниць при повній відсутності пов'язаних іонів кальцію. Для сигналу при 380 нм збудженні при відсутності іонів кальцію, пов'язаних з барвником, сигнал склав 86,6 одиниць, а при повному насиченні молекул барвника склав 15,7 одиниць. Дані величини дозволили обчислити величини Fmin і Fmax що склали 0,47 і 1,36 одиниць відповідно. Використовуючи ці значення, була розрахована концентрація вільного кальцію, згідно з корисною моделлю. Для цього нами використовувалися вище набуті значення Fmin і Fmax і сумарний сигнал F після вище описаної процедури нормалізації та сумування, що наведено на фіг. 4. Зміна кальцієвого транзієнту на цій фігурі представлена в нМ та відповідає зміні концентрації вільного кальцію за умов деполяризації нейрона при кальцієвому транзієнті. Джерела інформації: 1. Minta A, Kao JP, Tsien RY. Fluorescent indicators for cytosolic calcium based on rhodamine and fluorescein chromophores. The Journal of biological chemistry. 1989. - 2 64(14):8171-8. Epub 1989/05/15. PubMed PMID: 2498308. 2. Bootman MD, Rietdorf K, Collins T, Walker S, Sanderson M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+imaging. Cold Spring Harbor protocols. 2013. - 2013(2):83-99. Epub 2013/02/05. doi: 10.1101/pdb.top066050. PubMed PMID: 23378644. 3. Scheenen WJ, Makings LR, Gross LR, Pozzan T, Tsien RY. Photodegradation of indo-1 and its effect on apparent Ca2+concentrations. Chemistry & biology. 1996. - 3(9):765-74. Epub 1996/09/01. PubMed PMID: 8939693. 4. Thomas D, Tovey SC, Collins TJ, Bootman MD, Berridge MJ, Lipp P. A comparison of fluorescent Ca2+ indicator properties and their use in measuring elementary and global Ca2+signals. Cell calcium. 2000. - 28(4):213-23. Epub 2000/10/18. doi: 10.1054/ceca.2000.0152. PubMed PMID: 11032777. 5. Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+indicators with greatly improved fluorescence properties. The Journal of biological chemistry. 1985. - 260(6):3440-50. Epub 1985/03/25. PubMed PMID: 3838314. 6. Bootman MD, Rietdorf K, Collins T, Walker S, Sanderson M. Converting fluorescence data into Ca2+concentration. Cold Spring Harbor protocols. 2013. - 2013(2):126-9. Epub 2013/02/05. doi: 10.1101/pdb.prot072827. PubMed PMID: 23378651. 7. Shkryl VM, Nikolaenko LM, Kostyuk PG, Lukyanetz EA. High-threshold calcium channel activity in rat hippocampal neurones during hypoxia. Brain research. 1999. - 833(2):319-28. Epub 1999/06/22. PubMed PMID: 10375713. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб визначення вмісту вільного кальцію в клітині при двохвильовому методі збудження флуоресцентного барвника, що включає завантаження барвника fura-2 (AM) всередину клітини, збудження барвника за допомогою епіфлуоресцентного мікроскопа хвилями 340 нм та 380 нм, реєстрацію флуоресценції від 500 нм на детектор за допомогою ПЗЗ камери, визначення фонового рівня автофлуоресценції, який віднімається для кожного сигналу при двох довжинах хвиль, проведення калібрування барвника, який відрізняється тим, що в ньому проводять додаткову нормалізацію сигналів при збудженні барвника хвилею 340 нм за формулою: F340 /(2 F340 (0)) , та при збудженні барвника хвилею 380 нм за формулою: 1 F380 /(2 F380 (0)) , де F340 (або F380 ) є поточний сигнал, a F340 (0) (або F380 (0) ) - початкова флуоресценція до зміни сигналу, далі отримані нормовані сигнали складають, помножують на відношення сигналів F340 (0) / F380 (0) та визначають узагальнений сигнал F за формулою: F (0) 1 F340 F380 F 340 F (0) F (0) 1 , F380 (0) 2 340 380 55 після чого розраховують вміст вільного кальцію в клітині: F Fmin [Ca 2 ] Kd , Fmax F 4 UA 117834 U де K d - константа дисоціації; Fmin та Fmax мінімальна та максимальна флуоресценція, що визначається за процедурою калібрування. 5 UA 117834 U Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01M 3/20, G01N 21/91, D21H 21/30
Мітки: вільного, збудження, барвника, двохвильовому, кальцію, флуоресцентного, спосіб, клітині, визначення, вмісту, методі
Код посилання
<a href="https://ua.patents.su/8-117834-sposib-viznachennya-vmistu-vilnogo-kalciyu-v-klitini-pri-dvokhvilovomu-metodi-zbudzhennya-fluorescentnogo-barvnika.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення вмісту вільного кальцію в клітині при двохвильовому методі збудження флуоресцентного барвника</a>
Попередній патент: Спосіб лікування синдрому післяопераційної нудоти та блювання у пацієнтів після лапароскопічної холецистектомії
Наступний патент: Спосіб виготовлення деталей з антифрикційними властивостями
Випадковий патент: Сепаратор газовий вихрового типу