Спосіб одержання йопамідолу та проміжні сполуки
Номер патенту: 75956
Опубліковано: 15.06.2006
Автори: Броккетта Маріно, Каппеллетті Енріко, Анеллі П'ер Лючіо, Люкс Джованні
Формула / Реферат
1. Спосіб одержання (S)-N,N'-біс[2-гідрокси-1-[(гідрокси)метил]етил]-5-[(2-гідроксі-1-оксопропіл)аміно]-2,4,6-трийод-1,3-бензолдикарбоксаміду формули (І)
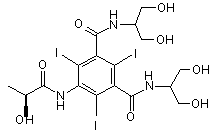 (I)
(I)
зі сполуки формули (II)
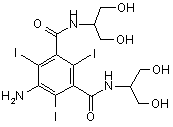 , (ІІ)
, (ІІ)
що включає
a) взаємодію сполуки формули (II) з придатним захисним засобом з одержанням сполуки формули (III)
 , (III)
, (III)
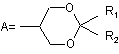
де -R є групою формули А або В
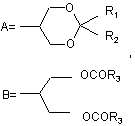 ,
,
де
R1 представляє атом гідрогену, лінійний чи розгалужений С1-С4алкіл або лінійну чи розгалужену С1-С4алкоксигрупу,
R2 - атом гідрогену, лінійний чи розгалужений С1-С4алкіл, лінійна чи розгалужена С1-С4алкоксигрупа,
R3 - лінійний чи розгалужений С1-С4алкіл, трифлуорметил або трихлорметил;
b) ацилування аміногрупи у позиції 5 інтермедіатної сполуки формули (III) взаємодією з (S)-2-(ацетилокси)пропаноїлхлоридом для одержання сполуки формули (IV)
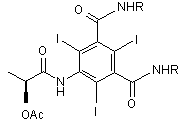 , (IV)
, (IV)
де R визначено вище; та
с) видалення усіх ацилгруп, представлених у сполуці формули (IV), в лужних умовах, з попереднім відщепленням циклічного захисту у кислотних умовах, коли R представляє групу формули А.
2. Спосіб за п. 1, де у інтермедіатній сполуці формули (III), одержаній на етапі а), -R представляє групу А.
3. Спосіб за п. 2, де R1 та R2 представляють лінійні С1-С4алкіли.
4. Спосіб за п. 1, де у інтермедіатній сполуці формули (III), одержаній на етапі а), -R представляє групу В.
5. Спосіб за п. 4, де R3 представляє лінійний С1-С4алкіл.
6. Спосіб за п. 2, де етап а) проводять взаємодією на моль сполуки формули (II) зі щонайменше 2 молів сполуки, вибраної з ді-(С1-С4)алкоксиметану, альдегідів та кетонів формули R1COR2, можливо у споріднених формах відповідного ацеталю або кеталю, де R1 представляє атом гідрогену або лінійний чи розгалужений С1-С4алкіл, a R2 представляє лінійний чи розгалужений С1-С4алкіл, та ортоестер R1С(R2)3, коли принаймні R2 представляє алкоксигрупу, у присутності приблизно від 0,1 до 2 молів кислоти на моль сполуки формули (II).
7. Спосіб за п. 4, де етап а) проводять взаємодією на моль сполуки формули (II) щонайменше 4 молів ангідриду (R3СО)2О у присутності каталітичної кількості 4-(диметиламіно)піридину у диполярному апротонному органічному розчиннику.
8. Спосіб за п. 1, де ацилування з етапу b) проводять взаємодією сполуки (III) зі щонайменше одним молем (S)-2-(ацетилокси)-пропаноїлхлориду у інертному диполярному апротонному розчиннику та у присутності приблизно від 0,1 до 0,4 моль на моль продукту формули (III) кислоти.
9. Спосіб за п. 2, де видалення ацилгрупи сполуки формули (IV), де -R представляє групу формули А, у лужних умовах згідно з етапом с) проводять у воді або у суміші води та органічного розчиннику, який змішується, підтримуючи рН реакційної суміші між 10 та 11 додаванням сильної неорганічної основи, та перед цим відщепляють циклічні захисні групи карбоксамідо-гідроксигруп у кислотних умовах.
10. Спосіб за п. 4, де видалення усіх ацилгруп у лужних умовах етапу с) проводять у воді або у суміші води та органічного розчиннику, який змішується, підтримують рН реакційної суміші між 10 та 11, додаванням сильної неорганічної основи.
11. Спосіб за п. 10, де органічний розчинник, що змішується з водою, вибрано з групи, що складається з лінійних чи розгалужених С1-С4алканолів та диполярних апротонних органічних розчинників, а рН реакційної суміші тримають між 10 та 11 додаванням водного розчину NaOH або КОН.
12. Спосіб за п. 1, де інтермедіат формули (IV), одержаний на етапі b), далі реагує без його виділення.
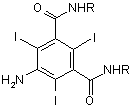
13. Сполука формули (III)
 , (III)
, (III)
де -R представляє групу А
 ,
,
де
R1 представляє атом гідрогену, лінійний чи розгалужений С2-С4алкіл або лінійна чи розгалужена С1-С4алкоксигрупа,
R2 - атом гідрогену, лінійний чи розгалужений С2-С4алкіл або лінійну чи розгалужену С1-С4алкоксигрупу.
14. Сполука формули (IV)
 , (IV)
, (IV)
де -R представляє групу А
 ,
,
де
R1 представляє атом гідрогену, лінійний чи розгалужений С2-С4алкіл або лінійну чи розгалужену С1-С4алкоксигрупу,
R2 - атом гідрогену, лінійний чи розгалужений С2-С4алкіл або лінійна чи розгалужена С1-С4алкоксигрупа.
15. Сполука за п. 13, де R1 та R2 представляють лінійні чи розгалужені C2-С4алкіли.
16. Сполука за п. 14, де R1 та R2 представляють лінійні С2-С4алкіли.
17 Сполука за п. 13, де R1 представляє атом гідрогену, а R2 представляє лінійну С1-С4алкоксигрупу.
18. Застосування сполуки за п. 13 як інтермедіату у способі виробництва йопамідолу (І).
19. Застосування сполуки за п. 14 як інтермедіату у способі виробництва йопамідолу (І).
Текст
1. Спосіб одержання (S)-N,N'-біс[2-гідрокси-1[(гідрокси)метил]етил]-5-[(2-гідроксі-1оксопропіл)аміно]-2,4,6-трийод-1,3бензолдикарбоксаміду формули (І) 2 3 75956 4 O R1 ангідриду (R3СО)2О у присутності каталітичної кіA= R2 лькості 4-(диметиламіно)піридину у диполярному O , апротонному органічному розчиннику. де 8. Спосіб за п.1, де ацилування з етапу b) провоR1 представляє атом гідрогену, лінійний чи розгадять взаємодією сполуки (III) зі щонайменше одлужений С2-С4алкіл або лінійна чи розгалужена С1ним молем (S)-2-(ацетилокси)-пропаноїлхлориду у С4алкоксигрупа, інертному диполярному апротонному розчиннику R2 - атом гідрогену, лінійний чи розгалужений С2та у присутності приблизно від 0,1 до 0,4 моль на С4алкіл або лінійну чи розгалужену С1моль продукту формули (III) кислоти. С4алкоксигрупу. 9. Спосіб за п.2, де видалення ацилгрупи сполуки 14. Сполука формули (IV) формули (IV), де -R представляє групу формули А, NHR O у лужних умовах згідно з етапом с) проводять у I I O воді або у суміші води та органічного розчиннику, NHR який змішується, підтримуючи рН реакційної суміN H ші між 10 та 11 додаванням сильної неорганічної O I OAc , (IV) основи, та перед цим відщепляють циклічні захисде -R представляє групу А ні групи карбоксамідо-гідроксигруп у кислотних O R1 умовах. A= R2 10. Спосіб за п.4, де видалення усіх ацилгруп у O , лужних умовах етапу с) проводять у воді або у де суміші води та органічного розчиннику, який зміR1 представляє атом гідрогену, лінійний чи розгашується, підтримують рН реакційної суміші між 10 лужений С2-С4алкіл або лінійну чи розгалужену С1та 11, додаванням сильної неорганічної основи. С4алкоксигрупу, 11. Спосіб за п.10, де органічний розчинник, що R2 - атом гідрогену, лінійний чи розгалужений С2змішується з водою, вибрано з групи, що складаС4алкіл або лінійна чи розгалужена С1ється з лінійних чи розгалужених С1-С4алканолів С4алкоксигрупа. та диполярних апротонних органічних розчинників, 15. Сполука за п.13, де R1 та R2 представляють а рН реакційної суміші тримають між 10 та 11 долінійні чи розгалужені C2-С4алкіли. даванням водного розчину NaOH або КОН. 16. Сполука за п.14, де R1 та R2 представляють 12. Спосіб за п.1, де інтермедіат формули (IV), лінійні С2-С4алкіли. одержаний на етапі b), далі реагує без його виді17 Сполука за п.13, де R1 представляє атом гідролення. гену, а R2 представляє лінійну С1-С4алкоксигрупу. 13. Сполука формули (III) 18. Застосування сполуки за п.13 як інтермедіату у O NHR I способі виробництва йопамідолу (І). 19. Застосування сполуки за п.14 як інтермедіату у способі виробництва йопамідолу (І). I NHR H2N , (III) де -R представляє групу А I O Представлений винахід стосується нового способу отримання йопамідолу (тобто (S)-N,N'біс[2-гідрокси-1-(гідроксиметил)етил]-5-[(2гідрокси-1-оксопропіл)аміно]-2,4,6-трийод-І33бензолдикарбоксамід) починаючи з відповідного 5незаміщеного амінопохідного та нових інтермедіатів, отриманих вказаним способом. (S)-N,N'-біс[2-гідрокси-1-(гідроксиметил)етил]5-[(2-гідрокси-1-оксопропіл)аміно]-2,4,6-трийод-І33бензолдикарбоксамід формули (І). (I) відомий як йопамідол, є одним з найширше застосовуваних неіонних радіографічні контрастних засобів у світі. Його спершу описано [у GB1472050], де його синтезовано способом представленим у наступній схемі: Вищенаведений спосіб, який ще широко застосовують у виробництві, має кілька недоліків. Одним з них є уведення захищеного хірального синтону (S)-2-(ацетилокси)пропаноїлу на 5аміногрупу на ранньому етапі загального способу, тобто перед амідування з 2-аміно-1,3-пропандіолу. Після уведення цієї хіральної груп реакцією 5аміно-N,N'-біс[2-гідрокси-1-(гідроксиметил)етил]2,4,6-трийод-1,3-бензолди-карбоксаміду з (S)-2(ацетилокси)пропаноїлхлоридом могла б призвести до преференційного ацилування більш реакти 5 75956 6 вних гідроксигруп карбоксамідозамісників, виклидеякою модифікацією також, коли захисту гідроккаючи тим помітні втрати коштовного реагенту. сигруп карбоксамідозамісників досягають перет[У WO 00/50385] нещодавно описано спосіб воренням цих груп у, як варіант, 2-монозаміщені отримання полігідроксисполуки (включаючи серед або 2,2-дизаміщені N,N'-біс(1,3-діоксан-5іншого йопамідол), що містить етап деацилування, іл)карбоксаміди. у кислотних умовах, ацилована сполука має форНові інтермедіати 5-аміно-N,N'-біс(довільно 2мулу: монозаміщені або 2,2-дизаміщені-1,3-діоксан-2-іл)2,4,6-трийод-1,3-бензолкарбоксаміди (III), а також (S)-N,N'-біс(довільно 2-монозаміщені або 2,2дизаміщен-1,3-діоксан-2-іл)-5-[2-ацетокси-1(оксопропіл)аміно]-2,4,6-трийод-1,3бензолкарбоксаміді (IV) представляють подальший специфічний об'єкт представленого винаходу. Першим об'єкт представленого винаходу є тоде R4 та R5 є, як варіант, ацилованими дигідму спосіб отримання йопамідолу (І) роксиалкілами, R6 є алкіл, a R3 є серед іншого метилом. Згідно [з WO 00/50385] кислоту, використову(I) вану у цій реакції деацилування, далі видаляють обробкою поглинаючою кислоту смолою; водний розчин отриманого так продукту очищають пропусканням через неіонні полімерні абсорбенти; елюпочинаючи зі сполуки формули (II) ат концентрують до масла, а масло кристалізують з суміші ацетонітрил/етанол або етанолу. Вищенаведений спосіб показаний для змен(II) шення рацемізації при хіральному атомі карбону, що згідно [з WO 00/50385] відбувається у будьякому разі, коли для видалення захисної групи спосіб включає R6CO-хірального заміснику застосовують основні а) реакцію сполуки формули (II) з придатним умови. захисним засобом, отримавши сполуку формули Прикладами ацилгруп [з WO 00/50385] є фор(III) міл, ацетил, пропаноїл, бутаноїл, півалоїл, пентаноїл, трифлуорацетил та бензоїл. Для йопамідолу [WO 00/50385] описує отри(III) мання вихідної ацилованої сполуки через уведення захищеного R6CO-хірального заміснику на 5аміногрупу тетраестеру 5-аміно-2,4,6-трийод-1,3де -R є групою формули А або В бензолдикарбоксаміду. Виділений пентацилований продукт далі перетворюють у йопамідол заявленим способом, що потребує деацилування в сильнокислотних умовах. Більш точно дійсними умовами, розкритими [у WO 00/50385] для йопамідолу, є нагрівання пентацетильного похідного при температурі кипіння під зворотним холодильником де R1 представляє атом гідрогену, лінійний чи з гідрохлоридною кислотою у метанолі протягом розгалужений С1-С4алкіл або лінійну чи розгалу30 годин. жену С1-С4алкоксигрупу, R2 представляє атом гідЗараз виявлено і це представляє перший рогену, лінійний чи розгалужений С1-С4алкіл лінійоб'єкт представленого винаходу, що можливо прону чи розгалужену С1-С4алкоксигрупу, a R3 водити деацилування пентаацилованого йопаміпредставляє лінійний чи розгалужений С1-С4алкіл, долу у лужних умовах, отримуючи кінцевий протрифлуорметил, або трихлорметил; дукт, йопамідол, що має надзвичайно високу b) ацилування аміногрупи у позиції 5 інтермеоптичну чистоту. діатної сполуки формули (III), реакцією з (S)-2Більш того, зараз виявлено, що згідно зі спо(ацетилокси)пропаноїлхлоридом для отримання собом представленого винаходу нема необхідноссполуки формули (IV) ті виділення пентацилованого продукту; більш точно, зараз виявлено, що уведення (S)-2(ацетилокси)пропаноїльного заміснику на 5аміногрупу N,N'-біс[2-гідрокси-1(IV) (гідроксиметил)етил]-2,4,6-трийод-1,3бензолдикарбоксаміду, де гідроксигрупи карбоксамідозамісників придатно ациловані, а далі видаде R визначено вище; та лення усіх ацилгруп у лужних умовах без виділенс) видалення усіх ацилгруп, представлених у ня інтермедіатного продукту, загальний спосіб сполуці формули (IV) в лужних умовах, з попередздійснюється з дуже високим виходом. нім відщепленням циклічних захисних груп гідрокПід кінець, зараз виявлено, що спосіб згідно з сикарбоксамідозамісників у кислотних умовах, копредставленим винаходом можна застосовувати з ли R представляє групу формули А. 7 75956 8 Сполука формули (II) є відомим продуктом та зверх стехіометричної кількості, молярний надлиїї отримання можна проводити будь-яким з відошок до приблизно 50% є переважним. мих способів, як-то описаних [у GB 1472050, СН Реакцію звичайно проводять при кімнатній те627653 або US 5278311]. мпературі, але можна проводити при нижчій або Згідно з етапом а) способу представленого вищій температурі. Як приклад, температури у винаходу сполука (II) реагує зі сполукою, яка є межах від приблизно 5°С до приблизно 60°С є придатно вибраною серед альдегідів, кетонів (мопридатними для етапу а). жливо у відповідних ацетальних або кетальних Уведення захисної групи на етапі а) переважспоріднених формах), ортоестерів, або ангідридів, но проводять у слабко відмінних умовах реакції залежно від типу уведених захисних груп. залежно від певного застосованого реагенту. ФаДля випадку, коли -R у сполуках (III) представхівцю відомо про ці відмінності і він спроможний ляє групу формули А, сполука (II) реагуватиме з оптимізувати умови реакції на базі свого знання. ди-(С1-С4)алкоксиметаном, коли R1 та R2 предстаЯк приклад, коли у сполуці (III) R представляє вляють атоми гідрогену, з придатно вибраними групу формули А, то етап а) у вищенаведеному альдегідами або кетонами формули R1COR2 (моспособі слід переважно проводити у присутності жливо у ацетальних або кетальних споріднених кислотного каталізатору. Конкретніше, реакцію формах) у присутності невеликої кількості три-(С1слід переважно проводити у присутності від прибС4)алкілортоформіату як дегідратувального засолизно 0.1 до приблизно 2моль кислоти на моль бу, коли R1 представляє атом гідрогену або лінійсполуки формули (II). Придатними кислотами, що ний чи розгалужений С1-С4алкіл, a R2 представляє можна застосовувати на цьому етапі, є, наприлінійний чи розгалужений С1-С4алкіл, або з ортоеклад, сульфатна кислота, гідрохлоридна кислота, стерами формули R1C(R2)3, коли щонайменше R2 метансульфонова кислота, п-толуолсульфонова є алкоксигрупою. кислота, або карбонові кислоти, як-то мурашина Коли, з іншого боку, -R у сполуках (III) предкислота, оцтова кислота, або пропіонова кислота. ставляє групу формули В, вказану груп звичайно Для отримання найпереважніших сполук форуводять реакцією сполуки (II) з придатно вибраним мули (III), де R представляє групу, де R1 та R2 є ангідридом формули (R3CO)2O. метилгрупами, переважним реагентом є ацетон у Коли -R у сполуках (III) представляє групу фоприсутності невеликої кількості три(С1рмули А, переважні сполуки є сполуками, в яких R1 С4)алкілортоформіату або 2,2-диметоксипропану, та R2 представляють лінійний чи розгалужений С1при тому, що для отримання сполук формули (III), С4алкіл; більш переважні є сполуками, в яких R1 та де -R представляє групу А, в якій R1 представляє R2 представляють лінійний С1-С4алкіл; а ще більш атом гідрогену, a R2 представляє лінійну С1переважні є сполуками, в яких R1 та R2 представС4алкоксигрупу, переважними реагентами є відполяють метил. відні лінійні три-(С1-С4)алкілортоформіати. Ще одна група переважних сполук (III), де -R У реальній практиці у вищенаведеному випадпредставляє групу А, є сполуками, в яких R1 предку, реакцію слід переважно проводити додаванням ставляє атом гідрогену та R2 представляє лінійну краплями надлишку над стехіометричною кількісС1-С4алкоксигрупу. тю суміші придатно вибраного кетону/кеталю або Коли -R у сполуках (III) представляє групу фоортоформіату разом з каталітичною кількістю, звирмули В, переважні сполуки є сполуками, в яких R3 чайно приблизно 0.1моль на моль сполуки формупредставляє лінійний чи розгалужений С1-С4алкіл; ли (II), сильної кислоти, переважно сульфатної або більш переважні є сполуками, в яких R3 представметансульфонової кислот, у розчин сполуки форляє лінійний С1-С4алкіл; а ще більш переважні є мули (II) у диполярний апротонний розчинник, звисполуками, в яких R3 представляє метил. чайно Ν,Ν-диметилацетамід. Реакцію етапу а) проводять у присутності орПісля завершення реакції, що може тривати ганічного розчиннику, вибраного з диполярного від кількох хвилин до 30 годин, виділяють захищеорганічного розчиннику, наприклад, Ν,Νну сполуку формули (III), де -R представляє групу диметилформаміду, Ν,Ν-диметилацетаміду та Nформули А, нейтралізацією кислотного каталізаметил-2-піролідону, інертного апротонного органітору, осадженням потрібної сполуки (III) додаванчного розчиннику, та їх суміші. ням розбавленого розчину (звичайно 3% за маРеакцію проводять, використовуючи щонайсою) гідрокарбонату, та очисткою осаду менше стехіометричну кількість реагентів але пекристалізацією з етанол та вод. реважно щонайменше невеликий надлишок реаЗ іншого боку, коли у сполуці (III) -R представгенту для уведення захисної групи з огляду на ляє групу формули В, то етап а) у вищенаведеновихідну сполуку (II). му способі слід переважно проводити у присутносГоді казати, що якщо є потрібною сполука фоті каталізатору. Конкретніше це слід звичайно рмули (III), де R представляє групу А, щонайменпроводити у присутності невеликої каталітичної ше два моль відповідного альдегіду або кетону кількості (звичайно від 5 10-4 до 5 10-1моль на (також у формі відповідного ацеталю або кеталю) моль вихідної сполуки (II)) 4або ортоестеру застосовують на моль вихідної (диметиламіно)піридину. Реакційний розчинник сполук (II); тоді як коли є потрібною сполука (III), де може бути вибраним - як визначено вище - серед -R представляє групу В, то слід використовувати диполярних апротонних органічних розчинників, щонайменше чотири молі відповідного ангідриду. інертних негідроксилованих органічних розчинниУ обох випадках, однак, звичайно застосовують ків та їх суміші. Коли R представляє групу В, також щонайменше невеликий надлишок, наприклад, можна застосовувати слабко основні органічні рощонайменше надлишок приблизно 5% за молями зчинники, як-то піридин. 9 75956 10 У реальній практиці реакцію для отримання ротонний органічний розчинник, як-то Ν,Νсполуки формули (III), де R є сполукою формули В диметилформамід, Ν,Ν-диметилацетамід, 1слід переважно проводити додаванням краплями метил-2-піролідон, тощо. суміші надлишку над стехіометричним придатно рН реакційної суміші тримають між 10 та 11 вибраного ангідриду (R3CO)2O та каталітичної кідодаванням сильної неорганічної основи, як-то лькості, звичайно від 0.01 до 0.1моль на моль споNaOH або КОН, звичайно як їх водний розчин. Релуки формули (II), 4-(диметиламіно)піридину у роакцію переважно проводять при кімнатній темпезчин вихідної сполук формули (III) у Ν,Νратурі, але температури від приблизно 10°С до диметилацетаміді, 4-(диметиламіно)піридин можприблизно 60°С є кращими. на додавати до реакційної суміші як такий або на Як визначено вище, коли у сполуці формули підкладці зі смоли. (IV) -R представляє групу формули А, основний Після завершення реакції, що звичайно може гідроліз ацетилгруп слід попереджати відщеплентривати від кількох годин до одної доби, залежно ням циклічних захисних груп гідроксигруп карбоквід застосованих умов реакції, захищені сполуки самідозамісників у кислотних умовах. формули (III), де -R представляє групу формули В, Цього легко досягають додаванням сильної осаджують з реакційної суміші розбавленням вокатіонообмінної смоли, переважно Duolite C20MB, дою або/та етанолом та виділяють фільтруванням. Amberlite IR120 або Amberjet 1200 (Rohm & Haas) Етап b) у загальному представленому вище або водного розчину сильної мінеральної кислоти, способі складається з реакції ацилування первиннаприклад, гідрохлоридної або сульфатної кислоної аміногрупи сполук формули (III), щонайменше ти, до розчину сполуки формули (IV), де -R пред1 молем (S)-2-(ацетилокси)пропаноїлхлориду, ставляє групу А, у воді або у суміші води та оргаотримавши сполуки формули (IV). нічного розчиннику, змішуваного з нею, як-то Реакцію звичайно проводять у інертному дилінійний чи розгалужений С1-С4алканол, або дипополярному апротонному розчиннику, як-то Ν,Νлярний апротонний органічний розчинник, як-то диметилацетамід, Ν,Ν-диметилформамід, 1Ν,Ν-диметилформамід, Ν,Ν-диметилацетамід, 1метил-2-піролідон тощо та у присутності кислоти. метил-2-піролідон, тощо. Кислотами, що можна придатно застосовувати Кількість кислоти, потрібної на цьому етапі є на етапі b) є, наприклад, гідрогалогенідна кислота, приблизно між 0.2 та 0.4моль кислоти на моль яку можна легко увести у реакційну суміш як гідросполуки формули (IV), де -R представляє групу А. галогенідні солі застосованих диполярних апроРеакцію переважно проводять при температурі тонних розчинників, як-то гідрохлорид Ν,Νслабко вище кімнатної температури, наприклад, диметилацетаміду або - переважно - продуванням між приблизно 40°С та приблизно 55°С, вона звибезводного газуватого гідрохлориду у реакційну чайно завершується протягом 2-5 годин залежно суміш. від застосованих умов реакції. Кислоту звичайно застосовують у кількості від Гідроліз у лужних умовах, отримуючи кінцевий приблизно 0.1 до приблизно 0.4моль на моль пройопамідол далі проводять додаванням водного дукту формули (III). розчину NaOH або КОН безпосередньо туди ж у Температура для цього етапу реакції є звитакій кількості, щоб тримати рН приблизно між 10 чайно між приблизно 5 та приблизно 60°С. та 11. Переважно, однак, реакцію проводять при кімВиділення продукту формули (І) з так отриманатній температурі або температурі слабко вище ного основного водного розчину, звичайно провокімнатної температури (приблизно 45-50°С). дять пропусканням розчину через систему іонообРеакція етапу b) звичайно завершується у час мінних смол та, як варіант, через пристрій для між приблизно 2 та приблизно 20 годин, залежно нанофільтрування, як описано наприклад, [у US-Aвід застосованого розчиннику та прийнятих умов 5811581 або ЕР-А-888190], а потім кристалізацією реакції. продукту (І) з нижчого алканолу, як описано, наУ наступному етапі с) усі ацилгрупи, як присуприклад, [у US-A-5571941]. тні у інтермедіатній сполуці формули (IV) видаляПодальшим специфічним об'єктом представють у лужних умовах, з попереднім відщепленням леного винаходу є інтермедіатні сполуки формули циклічних захисних груп у кислотних умовах, коли (III) та (IV), де -R представляє групу формули А R представляє групу формули А. Зокрема, коли застосовують сполуку (IV), де R представляє групу формули А, основний гідроліз для видалення ацетильних захисних груп 5-[(2гідрокси-1-оксопропіл)аміно] попереджують відщепленням циклічних захисних груп карбоксамідогідроксигруп у кислотних умовах. Коли, з іншого боку, застосовують сполуку (IV), де -R представляє групу формули В, усі ацилгруде R1 представляє атом гідрогену, лінійний чи пи, тобто, ацетильні захисні групи 5-[(2-гідрокси-1розгалужений С1-С4алкіл або лінійну чи розгалуоксопропіл)аміно]заміснику, а також чотири групи жену С1-С4алкоксигрупу, a R2 представляє атом R3CO-, видаляють одним етапом у лужних умовах. гідрогену лінійний чи розгалужений С1-С4алкіл або Основний гідроліз проводять звичайно у воді лінійну чи розгалужену С1-С4алкоксигрупу. або у суміші води та органічного розчиннику, зміПереважні серед сполук формул (III) та (IV), де шуваного, змішуваного з нею, як-то лінійний чи -R представляє групу А є сполуками, в яких R1 та розгалужений С1-С4алканол, або диполярний апR2 представляють лінійний чи розгалужений С1 11 75956 12 С4алкіл; більш переважні є сполуками, в яких R1 та розчин гідрокарбонату натрію, викликаючи утвоR2 є лінійним С1-С4алкілом; а ще більш переважні рення білого осаду, що через 15 годин перемішує сполуками, в яких R1 та R2 є метилом. вання збирають фільтруванням, промивають воЩе одна група переважних сполук (III) та (IV), дою та сушать. Твердий продукт далі суспендують де -R представляє групу А є сполуками, в яких R1 у абсолютному етанолі (600мл), кип'ятять під звопредставляє атом гідрогену, a R2 представляє ротним холодильником протягом 3 годин та дають лінійну С1-С4алкоксигрупу. охолонути до кімнатної температури. Твердий Наступні приклади слугують тільки для подапродукт збирають фільтруванням, промивають льшої ілюстрації представленого винаходу у деEtOH (30мл) та сушать, отримавши потрібну спояких з його переважних втілень але не є обмеженлуку (40г, 48.95ммоль) як білий твердий продукт. ням його рамок. Вихід: 86%. 1Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоПриклад 1 джуються з визначеною структурою. Отримання 5-аміно-N,N'-біс(2.2-диметил-1.3Приклад 3 діоксан-5-іл)-2.4.6-трийод-1.3Отримання N,N'-біс[2-ацетилокси-1бензолдикарбоксаміду ((III): -R = група А, де R1 та [(ацетилокси)метил]етил]-5-аміно-2.4.6-трийод-1.3R2 є метилом) бензолдикарбоксаміду ((III): -R представляє групу 2.2-Диметоксипропан (9.5мл, 77.8ммоль) та В, де R3 - метил) 98% сульфатну кислоту (0.25г, 2.6ммоль) додають Оцтовий ангідрид (9мл, 95ммоль) додають краплями у 0.5л посудину, що містить розчин спокраплями у суспензію сполуки. формули (II) (7г, луки формули (II) (18.3г, 25.9ммоль) (отримано, як 10ммоль), (отримано, як описано [у GB1472050]) у описано [у GB1472050]) у диметилацетаміді (90мл) піридині (40мл) і перемішують при 25°С. Через 3 і перемішують при кімнатній температурі. Через 20 години отриманий розчин додають краплями до годин при перемішуванні розчин нейтралізують деіонізованої води (0.3л) та осад збирають фільтрозчином гідрокарбонату натрію та концентрують руванням, промивають 5% оцтовою кислотою, далі під вакуумом. Ацетон (250мл) та 3% водний роздеіонізованою водою, а в кінці сушать під вакуучин гідрокарбонату натрію (50мл) далі додають до мом при температурі 40°С протягом 12 годин, отриманого маслянистого залишку та твердий отримавши потрібну сполуку (7.86г, 9ммоль). Випродукт збирають фільтруванням та кристалізують хід: 90% The 1Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуз 70% етанолу, отримавши потрібну сполуку (13г, ються з визначеною структурою. 16.5ммоль після сушка). Вихід: 64% Приклад 3 біс 1 Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з Альтернативне отримання N,N'-біс[2визначеною структур. ацетилокси-1-[(ацетилокси)метил]етил]-5-аміноПриклад 2 2.4.6-трийод-1.3-бензолдикарбоксаміду ((III): -R Отримання 5-аміно-N,N'-біс(2-етокси-1.3представляє групу В, де R3 - метил) діоксан-5-іл)-2.4.6-трийод-1.3Сполуку формули (II) (1486г, 2.1моль) заванбензолдикарбоксаміду ((III): -R= група А, де R1 тажують у 10л реактор, що містить Ν,Νпредставляє атом гідрогену та R2 є етокси) диметилацетамід (1.7л), та далі додають 4Метансульфонову кислоту (0.27г, 2.8ммоль) та диметиламіно-піридин (12.9г). Оцтовий ангідрид триетилортоформіат (9.25г, 62.4ммоль) додають (0.9кг, 8.82моль) додають краплями протягом прикраплями протягом 1 години у розчин сполуки фоблизно 1 годин, тримаючи температуру нижче рмули (II) (20г, 28.4ммоль) (отримано, як описано 30°С. Реакційну суміш перемішують при кімнатній [у GB1472050]) у Ν,Ν-диметилацетаміді (150мл) і температурі. протягом 20 годин та далі розбавляперемішують при 25°С. Через 1 годину розчин ють 96% етанолом (7.5л). Осад відфільтровують, нейтралізують розчином гідрокарбонату натрію. промивають 96% етанолом (2 1л) та сушать, Розчинник випарюють під вакуумом та маслянисотримавши потрібну сполуку (1715г, 1.96моль). тий залишок змішують з водним 5% розчином гідВихід: 94% 1 рокарбонату натрію (300мл). Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з Так отриманий твердий продукт фільтрують та визначеною структурою. кристалізують двічі з 70% етанолу, отримавши Приклад 4 потрібну сполуку (14.7г, 18.7ммоль). Вихід: 66% Отримання (S)-N,N'-біс[2-ацетилокси-11 Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з [(ацетилокси)метил]етил]-5-[(2-ацетилокси-1визначеною структурою. оксопропіл)аміно]-2.4.6-трийод-1.3Приклад 2 біс бензолдикарбоксаміду (IV): -R представляє групу Альтернативне отримання 5-аміно-N,N'-біс(2В, де R3 - метил) етокси-1.3-діоксан-5-іл)-2.4.6-трийод-1.3Сполуку, отриману у прикладі 3 (11г, бензолдикарбоксаміду ((III): -R= група А, де R1 12,6ммоль) розчиняють у Ν,Ν-диметилацетаміді представляє атом гідрогену та R2 є етокси) (200мл), що містить газуватий НСІ (0.055г, Триетилортоформіат (18.6г, 125.5ммоль) до1.5ммоль), та розчин тримають при температур дають протягом 3 хвилин до розчину сполуки фоміж 15 та 17°С. (S)-2рмули (II) (40г, 57ммоль) та метансульфонової (Ацетилокси)пропаноїлхлорид (4.75г, 31.5ммоль) кислоти (0.55г, 5.7ммоль) у Ν,Ν-диметилацетаміді додають краплями протягом 30 хвилин. Отриману (400мл) і перемішують при кімнатній температурі. реакційну суміш перемішують при 23°С протягом Через 15 хвилин реакційну суміш нейтралізують 20 годин. Розчинник далі випарюють під вакуумом 1М NaOH (5.7мл, 5.7ммоль) та Ν,Νта маслянистий залишок обробляють водним 4% диметилацетамід відганяють, отримавши маслярозчином гідрокарбонату натрію (250мл). Отриманистий залишок. Останній виливають у 1% водний ний осад збирають фільтруванням, промивають та 13 75956 14 сушать, отримуючи потрібну сполуку (9.9г, трують та сушать, отримавши потрібну сполуку (І) 10ммоль). Вихід: 80% (7г, 9ммоль). Вихід: 90% 1 1 Н ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з виН-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з значеною структурою. визначеною структурою. Приклад 5 Приклад 8 Отримання (S)-N,N'-біс(2.2-диметил-1.3Альтернативне отримання (S)-N,N'-біс[2діоксан-5-іл)-5-[(2-ацетилокси-1-оксопропіл)аміно]гідрокси-1-[(гідрокси)метил]етил]-5-[(2-гідрокси-12.4.6-трийод-1.3-бензолдикарбоксаміду ((IV): -R= оксопропіл)аміно]-2.4.6-трийод-1.3група А, де R1 та R2 є метилом бензолдикарбоксаміду (І) Сполуку, отриману у прикладі 1 (15г, 19ммоль) 5-Аміно-N,N'-біс(2.2-диметил-1.3-діоксан-5-іл)розчиняють у Ν,Ν-диметилацетаміді (80мл), що 2.4.6-трийод-1.3-бензолдикарбоксамід, отриманий, містить газуватий НСІ (0.073г, 2ммоль). (S)-2як у прикладі 1, реагує, як описано у прикладі 5. (Ацетилокси)пропаноїлхлорид (8г, 53 ммоль) до(S)-N,N'-біс(2.2-диметил-1.3-діоксан-5-іл)-5-[(2дають краплями протягом 30 хвилин у отриманий ацетилокси-1-оксопропіл)аміно]-2.4.6-трийод-1.3розчин, охолоджений до 15°С. Через дві години бензолдикарбоксамід, отриманий у реакції не випри тій же температурі, реакційній суміші дають діляють, але безпосередньо знімають захист згіднагрітися до кімнатної температури та перемішуно зі способом, описаним у прикладі 7 вище, отриють протягом додаткових 12 годин. Розчинник далі мавши потрібну сполуку. Вихід: 74%. 1 випарюють під вакуумом та залишок обробляють Н ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з ви4% розчином гідрокарбонату натрію (130мл). значеною структурою. Отриманий твердий продукт відфільтровують, Приклад 9 промивають та сушать, отримавши потрібну споАльтернативне отримання (S)-N,N'-біс[2луку (14г, 15,6ммоль). гідрокси-1-[(гідрокси)метил]етил]-5-[(2-гідрокси-1Вихід: 82% оксопропіл)аміно]-2.4.6-трийод-1.3The 1Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються бензолдикарбоксаміду (І) з визначеною структурою. (S)-2-(Ацетилокси)пропаноїлхлорид (16.5г, Приклад 6 110ммоль) додають, протягом періоду 20 хвилин, Отримання (S)-N,N'-біс[2-гідрокси-1до перемішуваного розчину N,N'-біс[2-ацетилокси[(гідрокси)метил]етил]-5-[(2-гідрокси-11-[(ацетилокси)метил]етил]-5-аміно-2.4.6-трийодоксопропіл)аміно]-2.4.6-трийод-1.31.3-бензолдикарбоксаміду (53.3г, 61.1ммоль) у бензолдикарбоксаміду (І) Ν,Ν-диметилацетаміді (75мл), тримаючи темпера(S)-N,N'-біс[2-ацетилокси-1туру реакційної суміші нижче 30°С. Додаткову кіль[(ацетилокси)метил]етил]-5-[(2-ацетилокси-1кість (S)-2-(ацетилокси)пропаноїлхлориду (0.9г, оксопропіл)аміно]-2.4.6-трийод-1.36.0ммоль) додають через 24 та 30 годин і реакційбензолдикарбоксаміду (4.9г, 5ммоль), отриманий у ну суміш перемішують при тій же температурі проприкладі 4, змішують з деіонізованою водою тягом подальших 15 годин. Реакційну суміш далі (30мл) та метанолом (30мл). Суспензію гріють до концентрують до половини об'єму та розбавляють 50°С, далі додають краплями 2М NaOH (12.8мл) 1:1 сумішшю вода/метанол (360мл). Утворену супротягом періоду 4 годин, тримаючи рН суміші у спензію гріють до 45°С та додають протягом 30 межах від 10 до 11. Розчин очищають на колонках хвилин 2М NaOH (225мл, 450ммоль). Через 2 гоз іонообмінними смолами та нейтральний так дини гідроліз завершується, розчин концентрують отриманий елюат концентрують під вакуумом та до половини об'єму, екстрагують дихлорметаном залишок кристалізують з етанолу, отримавши пот(6 100мл) та завантажують на дві колонки з іоноорібну сполуку (2.8г, 3.6ммоль) Вихід: 72%. бмінними смолами (Dowex® C350, Н+-форма, [α]20436=-5.15(40%Η2Ο). 200мл; Relite® MG1, ОН-форма, 160мл), елюють 1 Н-ЯМР, 13С-ЯМР, ІЧ та МС узгоджуються з водою, елюат випарюють та отриманий твердий визначеною структурою. залишок (49г) кристалізують з етанолу (450мл). Приклад 7 твердий продукт збирають (40.5г), розчиняють у Альтернативне отримання (S)-N,N'-біс[2Н2О (400мл) та розчин завантажують на колонку зі гідрокси-1-[(гідрокси)метил]етил]-5-[(2-гідрокси-1смолою Amberlite® XAD-16.00 (160мл), елюють оксопропіл)аміно]-2.4.6-трийод-1.3водою, елюат випарюють та залишок сушать, бензолдикарбоксаміду (І) отримавши йопамідол (40.0г, 51.5ммоль) як білий 0.2Μ НСІ (15мл) додають до розчину (S)-N,N'твердий продукт. Вихід: 84% [α]20436= -5.1 7(4 0% біс(2,2-диметил-1,3-діоксан-5-іл)-5-[(2-ацетилоксиН2O). 1-оксопропіл)аміно]-2,4,6-трийод-1,3Приклад 10 бензолдикарбоксаміду (9г, 10ммоль), отриманого, Альтернативне отримання (S)-N,N'-біс[2як описано у прикладі 5, у метанолі (60мл) та гідрокси-1-[(гідрокси)метил]етил]-5-[(2-гідрокси-1отриману суміш перемішують при 50°С протягом 2 оксопропіл)аміно]-2.4.6-трийод-1.3годин, а далі охолоджують до 40°С. 1М NaOH бензолдикарбоксаміду (І) (14мл) далі додають краплями протягом періоду 2 (3)-2-(Ацетилокси)пропаноїлхлорид (16.5г, години, тримаючи рН між 10.5 та 11. 110ммоль) додають протягом 20 хвилин до переЧерез дві години реакційну суміш охолоджумішуваного розчину N,N'-біс[2-ацетилокси-1ють до кімнатної температури та очищають на [(ацетилокси)метил]етил]-5-аміно-2.4.6-трийод-1.3іонообмінних смолах. Нейтральний так отриманий бензолдикарбоксаміду (53.3г, 61.1ммоль) у Ν,Νелюат концентрують та отриманий залишок крисдиметилацетаміді (75мл), тримаючи температуру талізують з етанолу (80мл). Твердий продукт фільреакційної суміші нижче 30°С. Подальшу кількість 15 75956 16 (S)-2-(ацетилокси)пропаноїлхлориду (0.9г, диметилацетамідом (2 20мл). Маточник поєдну6.0ммоль) додають через 24 та 30 годин та реакють з промивками, концентрують до маслянистого ційну суміш перемішують при тій же температурі залишку, який розбавляють водою (200мл) та напротягом додаткових 15 годин. 5М NaOH (90мл, нофільтрують. Залишок завантажують на колонку 450ммоль) додають краплями протягом періоду 2 зі смолою Amberlite® XAD-16.00 (160мл), елюють годин у реакційну суміш і енергійно перемішують водою, елюат концентрують та завантажують на при 45°С. Через дві години суміш концентрують дві колонки з іонообмінними смолами (Dowex® під вакуумом та додають додатковий Ν,ΝC350 15мл, Relite® MG1 10мл), елюат концентрудиметилацетамід (200мл). Через дві години при ють та твердий залишок кристалізують з етанолу, кімнатній температурі утворену суспензію фільтотримавши йопамідол (41.2г, 53ммоль). Вихід: рують та твердий продукт промивають Ν,Ν87% [α]20436=-5.19(40%Н2О). Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of iopamidol and intermediary compounds
Назва патенту російськоюСпособ получения йопамидола и промежуточные соединения
МПК / Мітки
МПК: C07C 237/46, C07C 231/00
Мітки: одержання, йопамідолу, проміжні, сполуки, спосіб
Код посилання
<a href="https://ua.patents.su/8-75956-sposib-oderzhannya-jjopamidolu-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання йопамідолу та проміжні сполуки</a>
Попередній патент: Спосіб механізованого догляду за посівами гороху
Наступний патент: Похідні алкінарилнафтиридин-4(1н)-онів як інгібітор фосфодиестерази типу iv
Випадковий патент: Пристрій для вимірювання рухової активності стулок молюсків












