Заміщені n-фенілметил-5-оксопролін-2-аміди як антагоністи p2x7-рецептора та їх застосування
Номер патенту: 100227
Опубліковано: 10.12.2012
Автори: Уолтер Деріл Саймон, Зенгер Стефан, Глів Роберт, Чемберз Лаура Дж.
Формула / Реферат
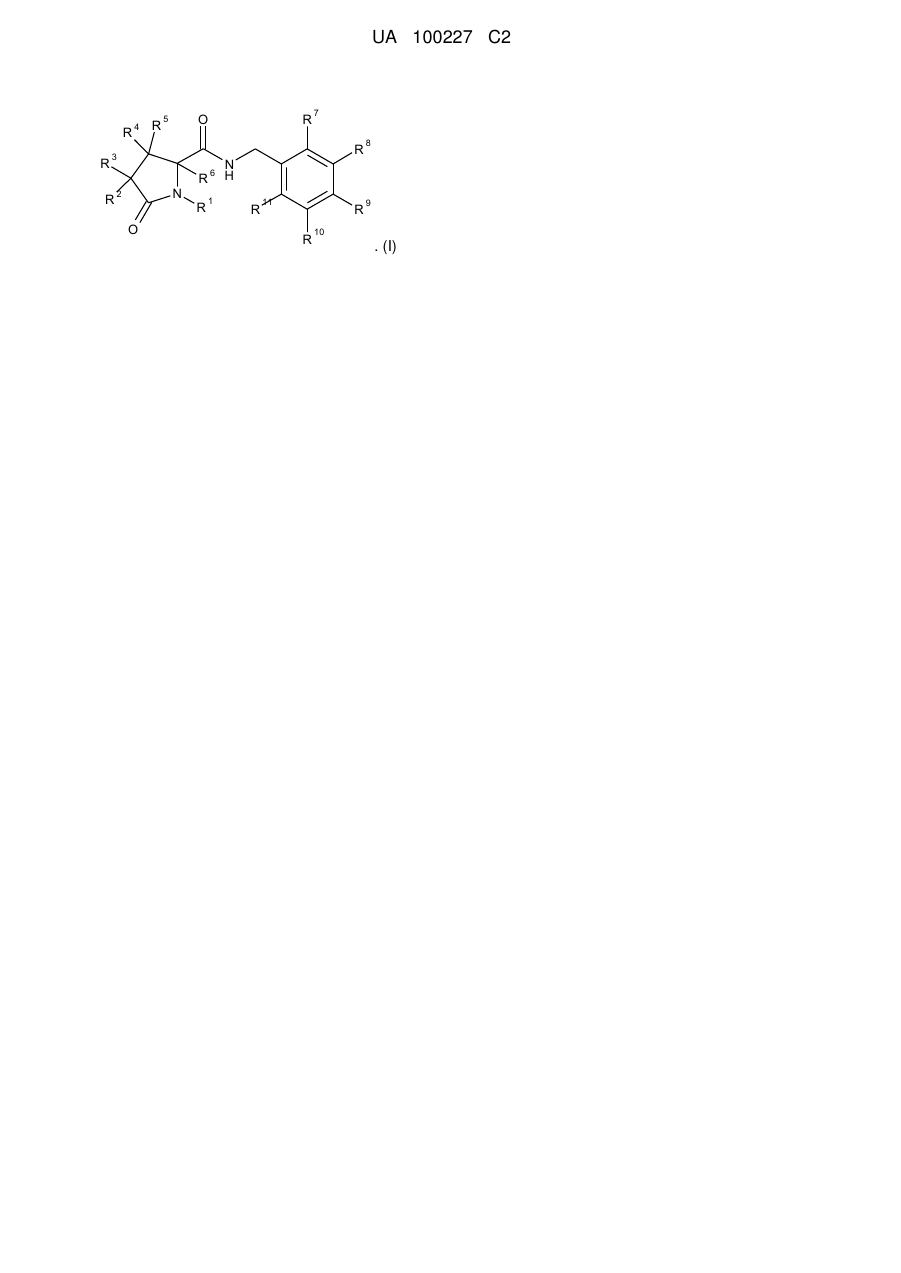
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
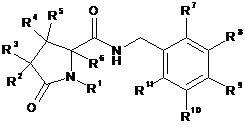 , (I)
, (I)
де:
R1 являє собою метил або етил, або незаміщений С3-5циклоалкіл, піридинілметил-, феніл або бензил;
R2 і R3 незалежно являють собою водень, галоген, С1-6алкіл, арилметил-, С2-6-алкеніл, С2-6алкініл або С3-6циклоалкілметил-; і будь-який із зазначених С1-6алкілу, арилметилу-, С2-6алкенілу, С2-6алкінілу або С3-6циклоалкілметилу-, необов'язково заміщений 1, 2 або 3 атомами галогену;
R4, R5 і R6 незалежно являють собою водень, фтор або метил; і
R7, R8, R9, R10 і R11 незалежно являють собою водень, галоген, ціано, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл, і будь-який із зазначених С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу або фенілу, необов'язково заміщений 1, 2 або 3 атомами галогену; або R10 і R11 разом з атомами вуглецю, до яких вони приєднані, утворюють бензольне кільце, яке необов'язково заміщене 1, 2 або 3 атомами галогену;
за умови, що, коли R7 і R11, обидва вибрані з водню або фтору, щонайменше один з R8, R9 і R10 являє собою атом галогену, або R8, R9 і R10 вибирають з групи, що складається з водню і CF3, і один, але не більш ніж один з R8, R9 і R10, являє собою CF3.
2. Сполука формули (І) або її фармацевтично прийнятна сіль:
 , (I)
, (I)
де:
R1 являє собою метил або етил, або незаміщений С3-5циклоалкіл, феніл або бензил;
R2 і R3 незалежно являють собою водень, галоген, С1-6алкіл, арилметил-, С2-6-алкеніл, С2-6алкініл або С3-6циклоалкілметил-; і будь-який із зазначених С1-6алкілу, арилметилу, С2-6алкенілу, С2-6алкінілу або С3-6циклоалкілметилу може бути необов'язково заміщений 1, 2 або 3 атомами галогену;
R4, R5 і R6 незалежно являють собою водень або фтор; і
R7, R8, R9, R10 і R11 незалежно являють собою водень, галоген, ціано, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл, і будь-який із зазначених С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу або фенілу може бути необов'язково заміщений 1, 2 або 3 атомами галогену;
за умови, що, коли R7 і R11 незалежно являють собою водень або фтор, щонайменше один з R8, R9 і R10 являє собою атом галогену.
3. Сполука формули (І) або її сіль за п. 1, де R4, R5 і R6 незалежно являють собою водень або метил.
4. Сполука формули (І) або її сіль за п. 1 або 3, де R7, R8, R9, R10 і R11 незалежно являють собою водень, галоген, ціано, трифторметил або незаміщений С1-6алкіл; або R10 і R11 разом з атомами вуглецю, до яких вони приєднані, утворюють незаміщене бензольне кільце.
5. Сполука формули (І) або її сіль за будь-яким з пп. 1-4, де R1 означає метил або етил.
6. Сполука формули (І) або її сіль за будь-яким з пп. 1-5, де R2 і R3 незалежно являють собою водень, фтор або метил.
7. Сполука формули (І) або її сіль за будь-яким з пп. 1-6, де R7, R8, R9, R10 і R11 незалежно являють собою водень, хлор, фтор, бром, метил або трифторметил.
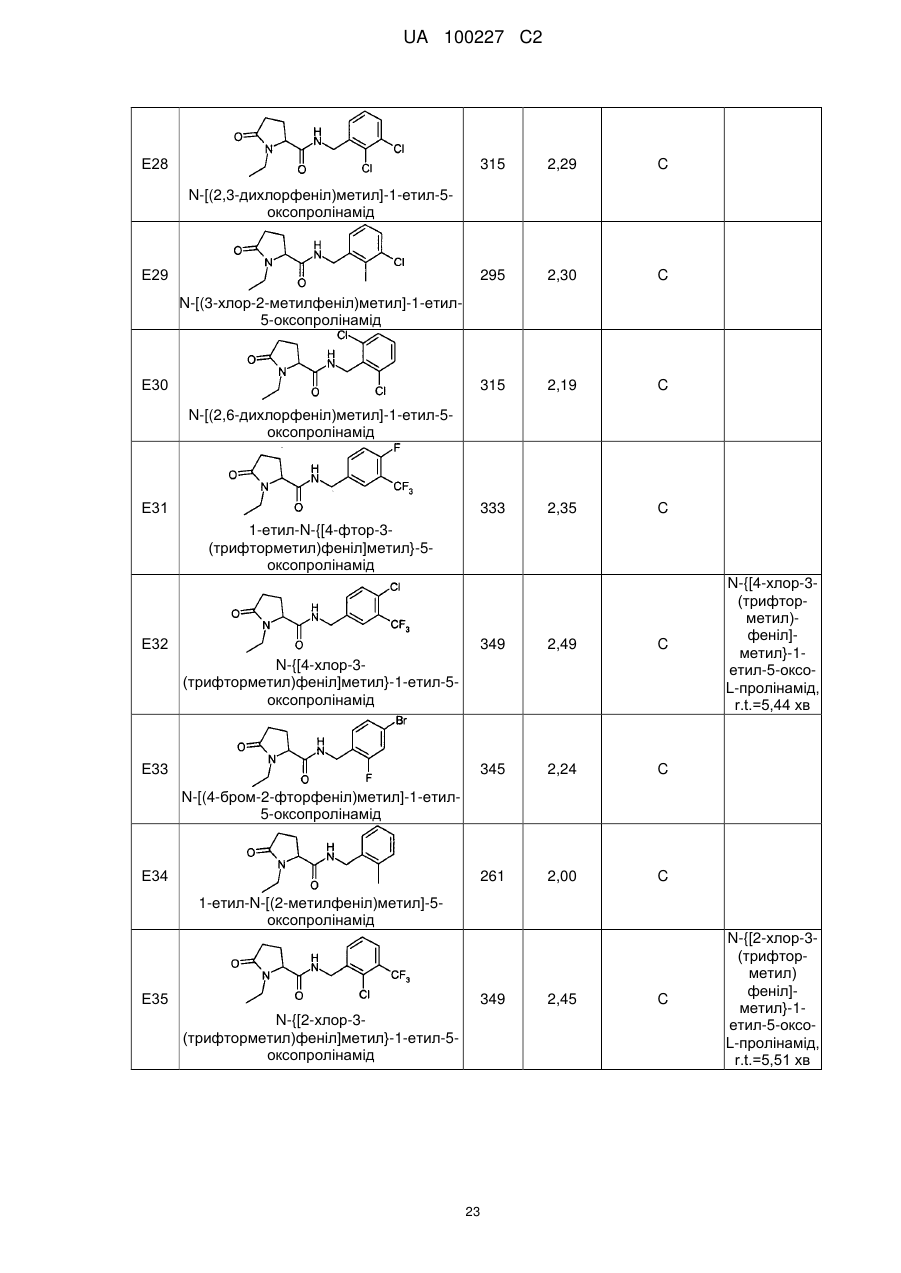
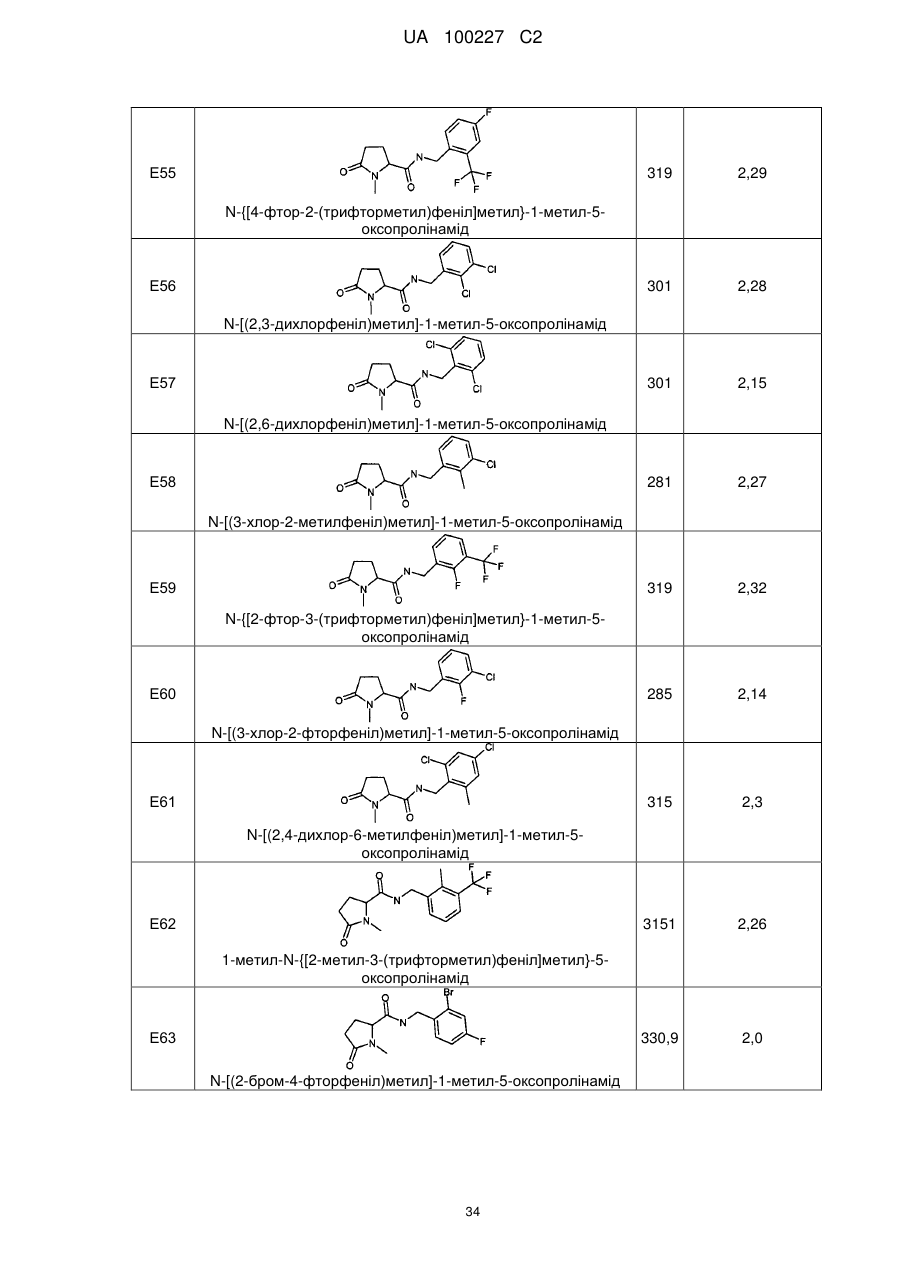
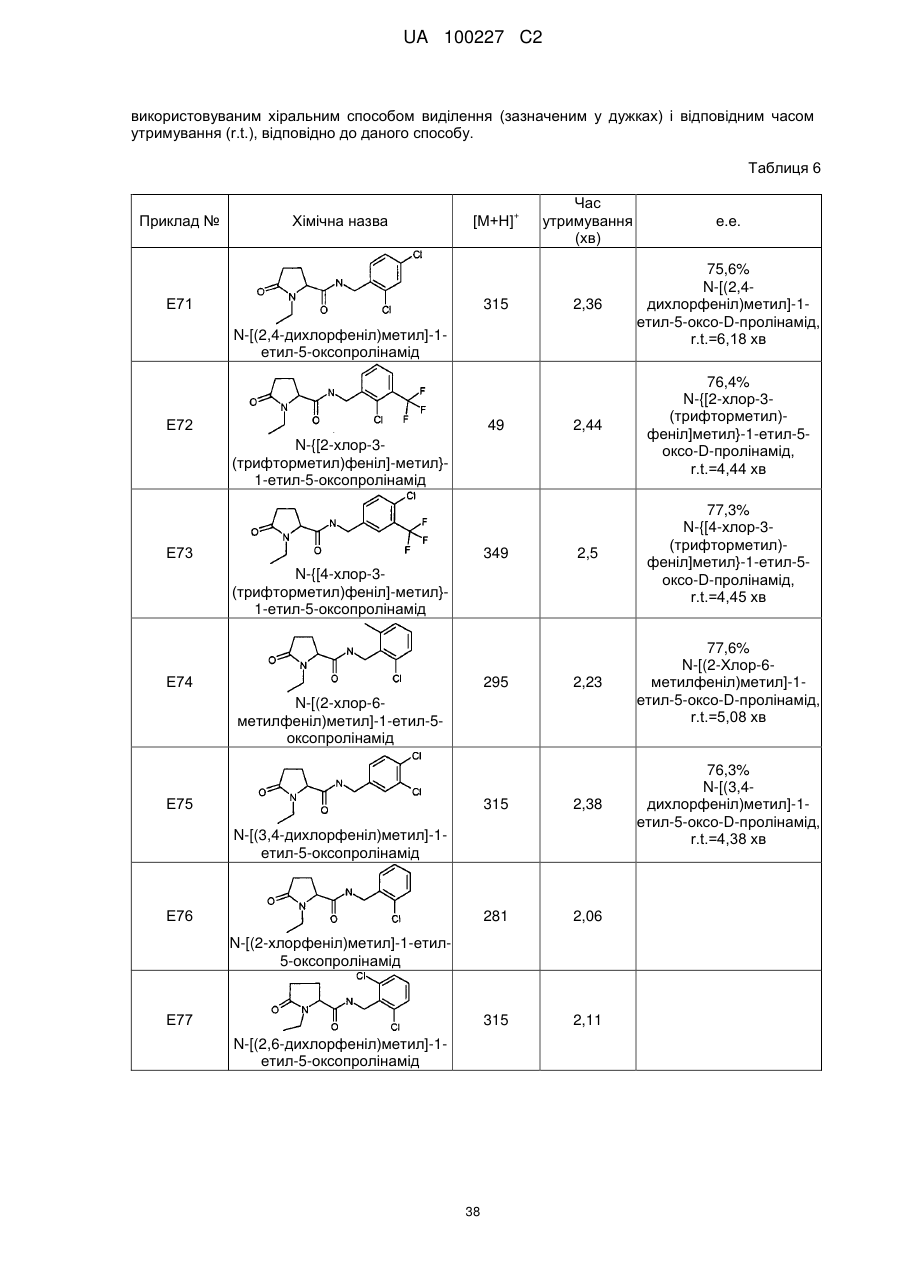
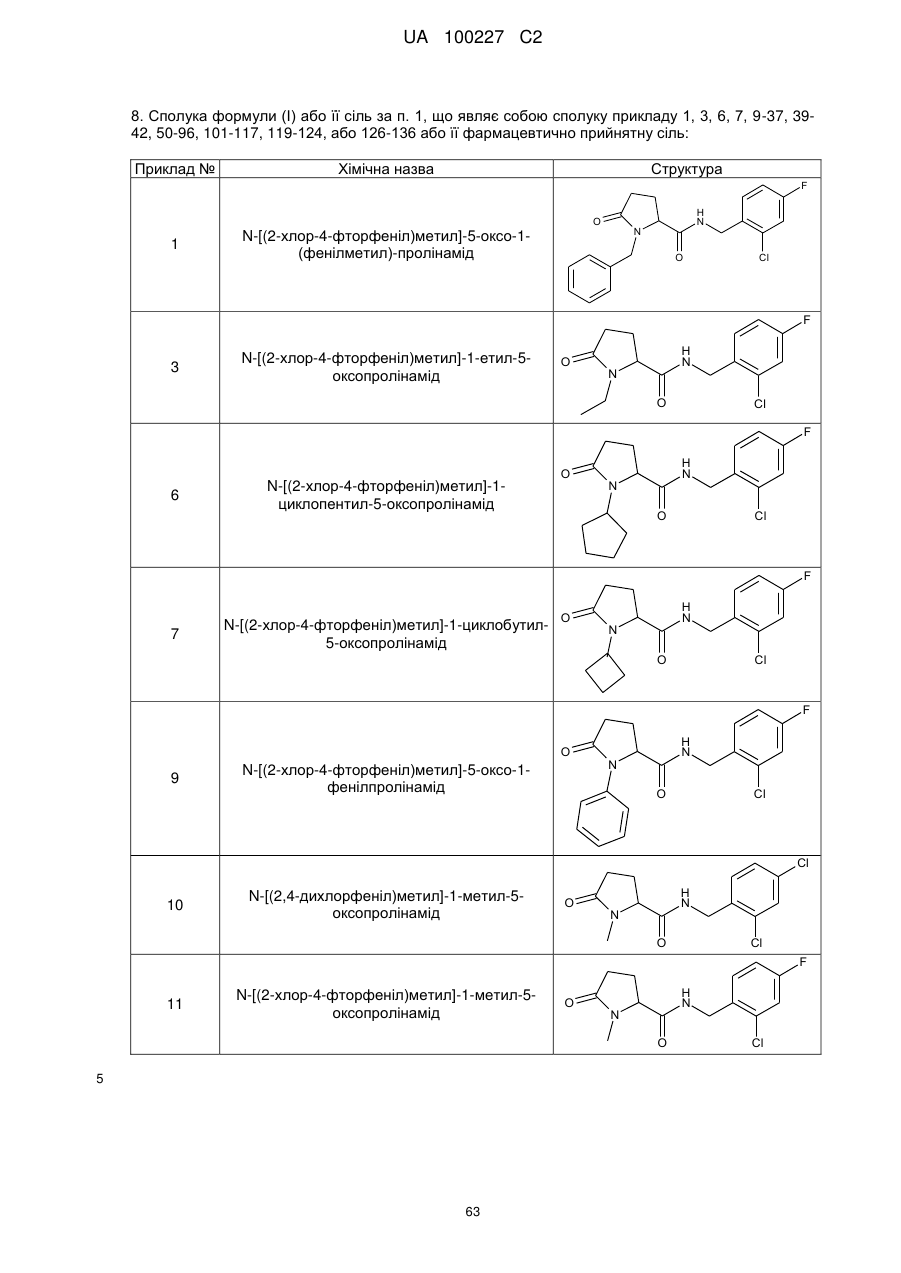
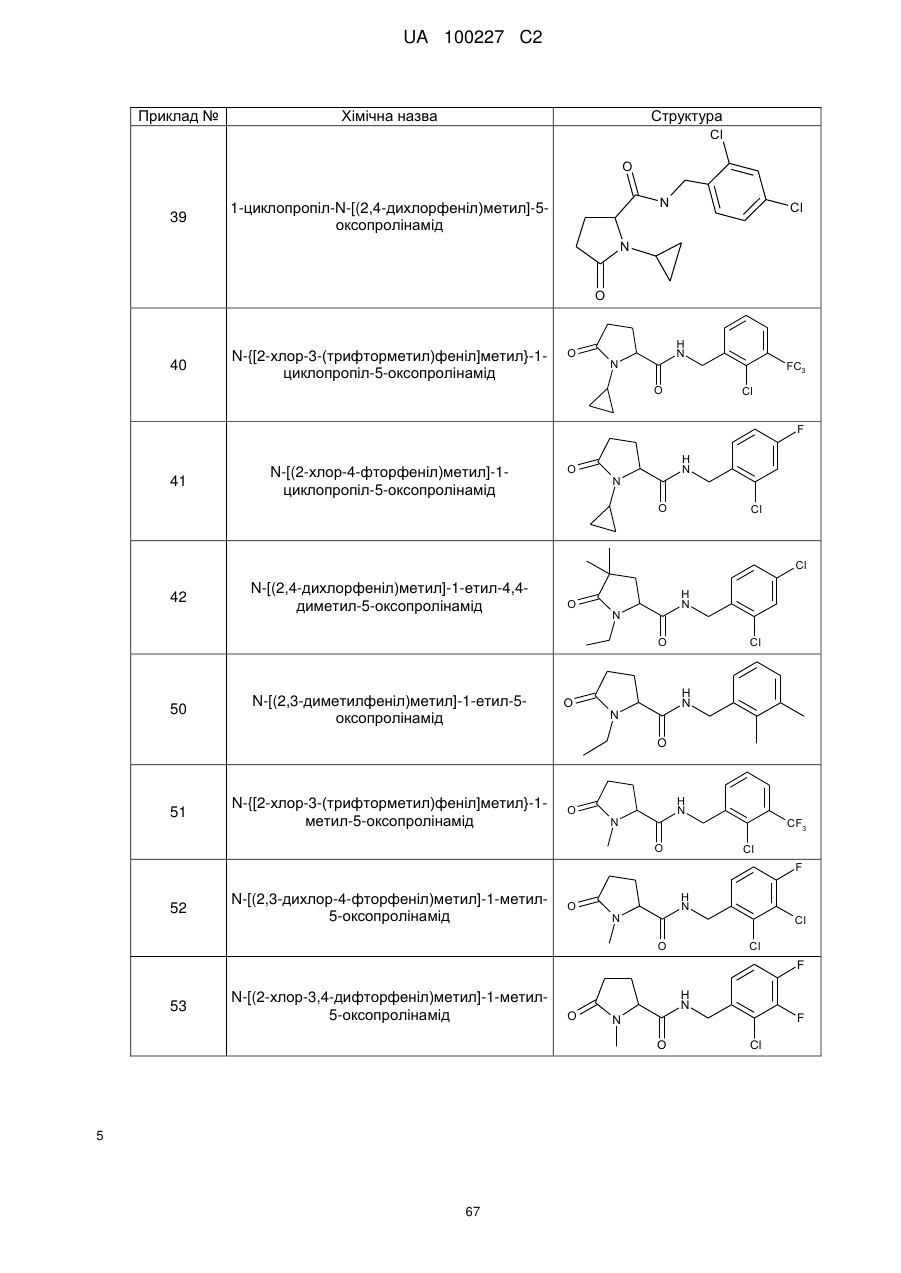
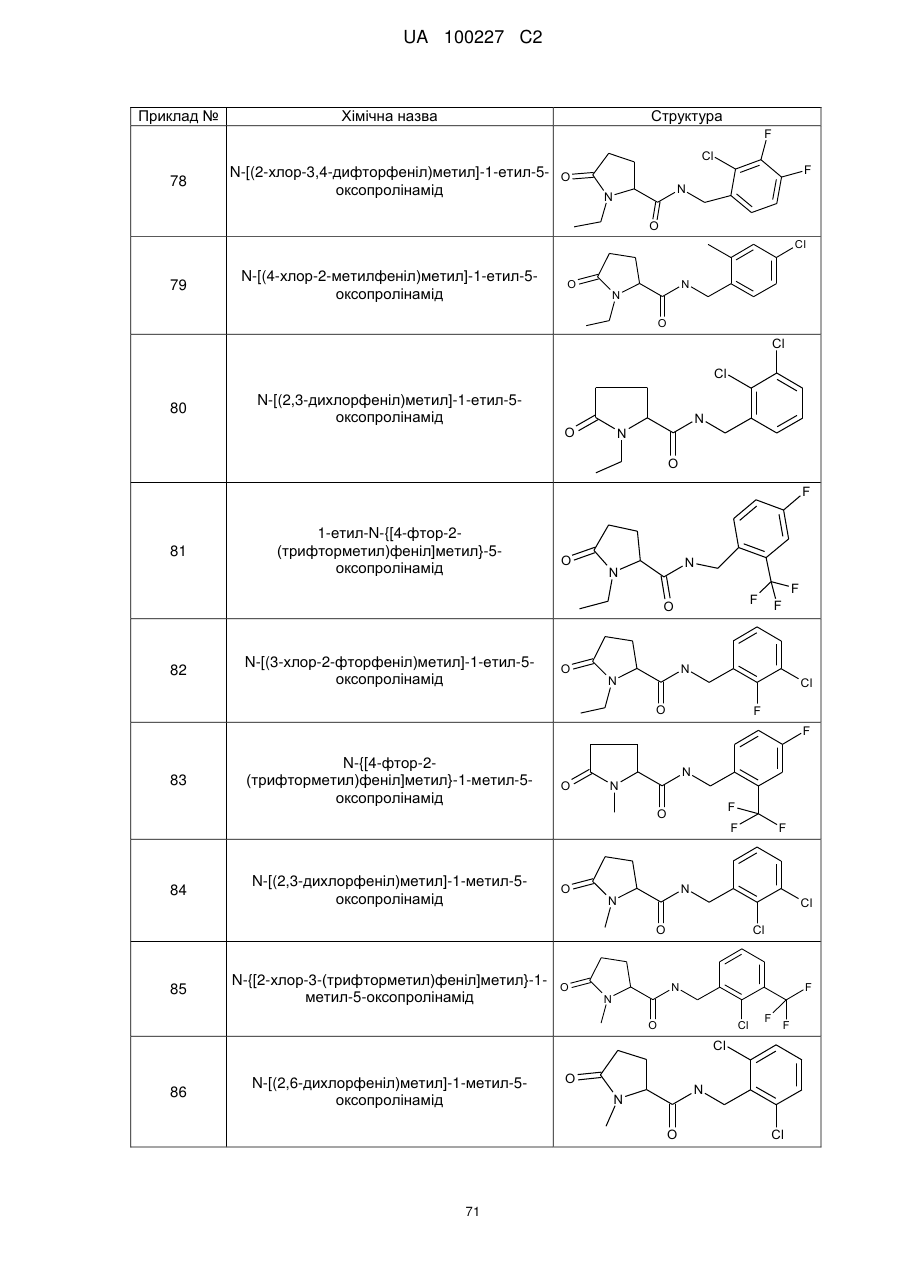
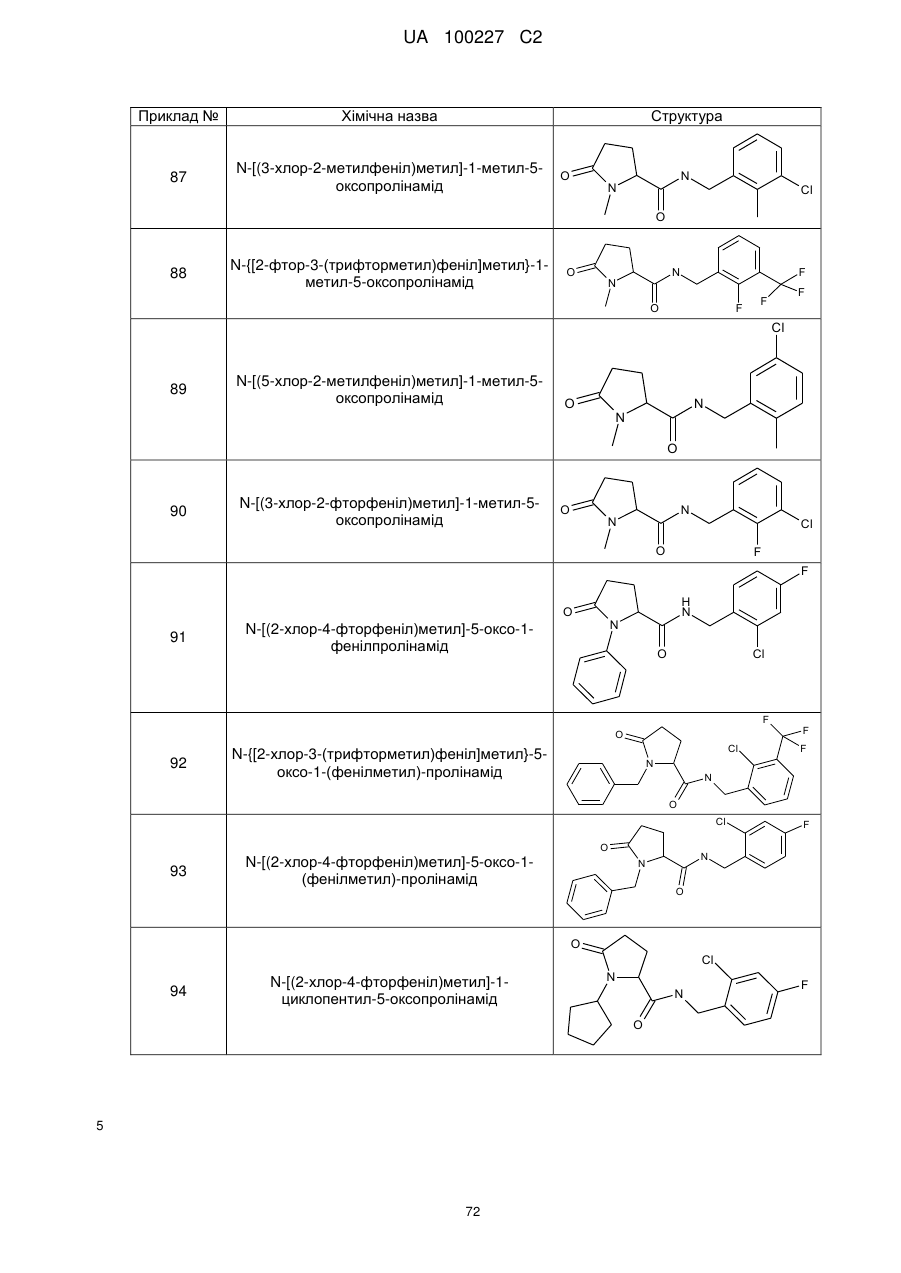
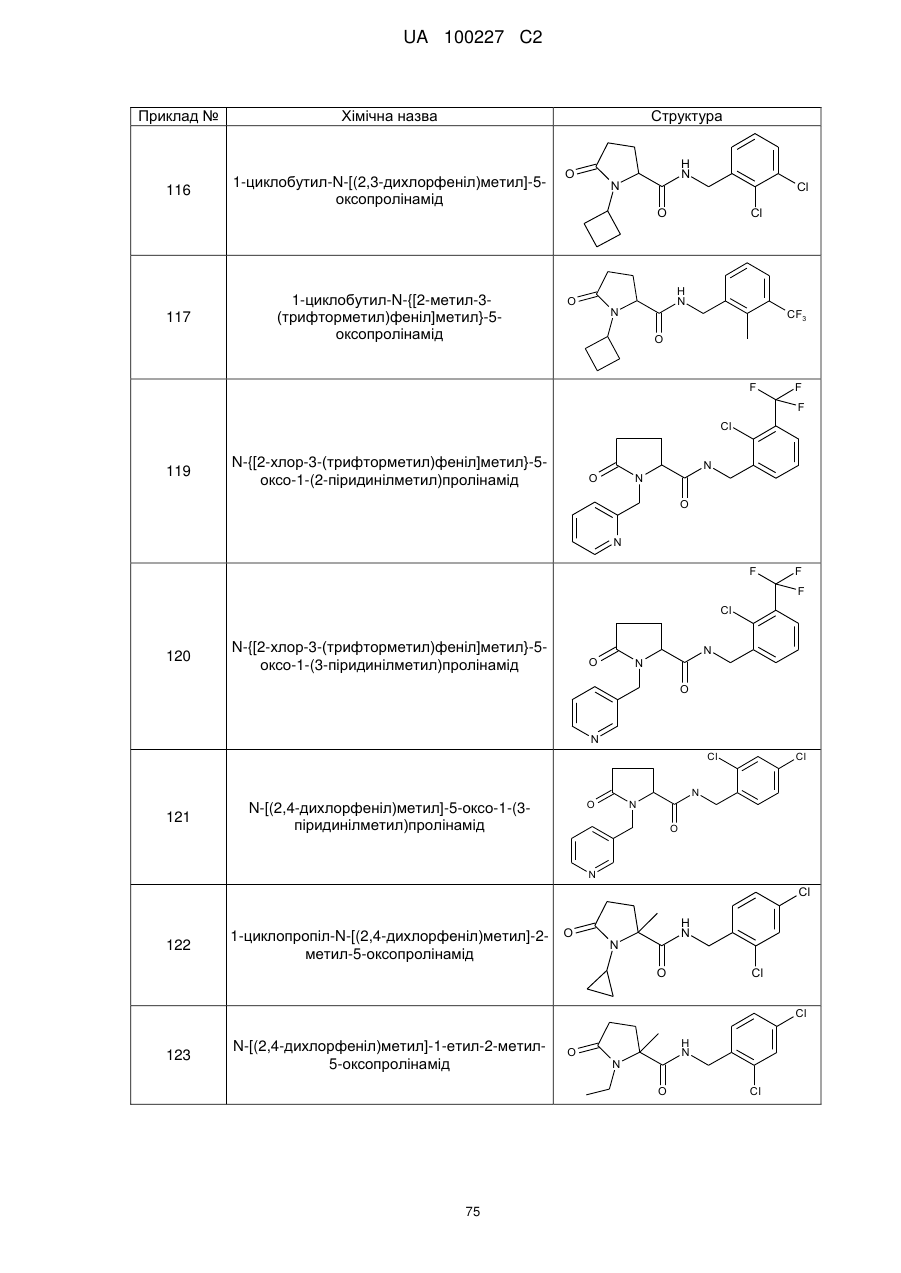
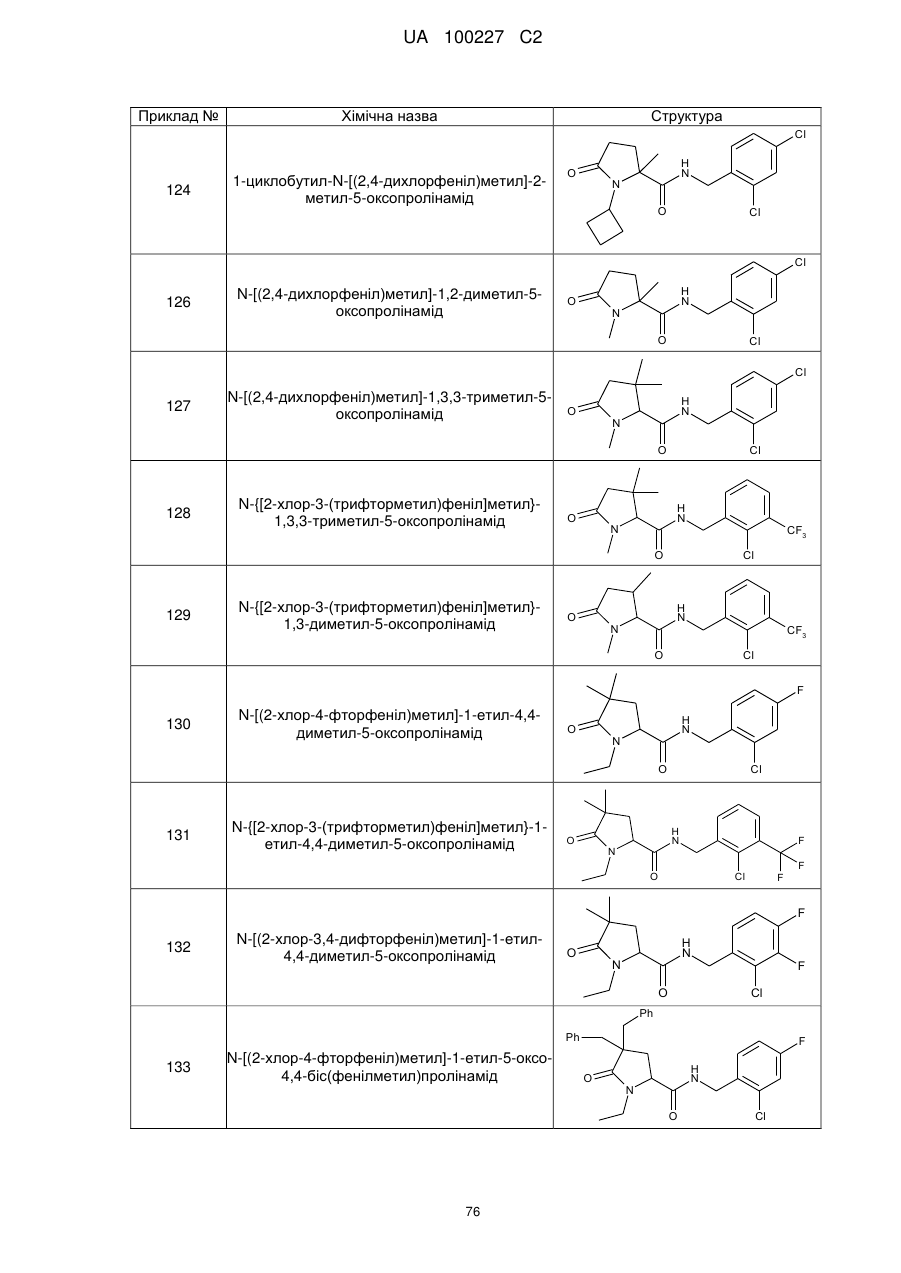
8. Сполука формули (І) або її сіль за п. 1, що являє собою сполуку прикладу 1, 3, 6, 7, 9-37, 39-42, 50-96, 101-117, 119-124, або 126-136 або її фармацевтично прийнятну сіль:
Приклад №
Хімічна назва
Структура
1
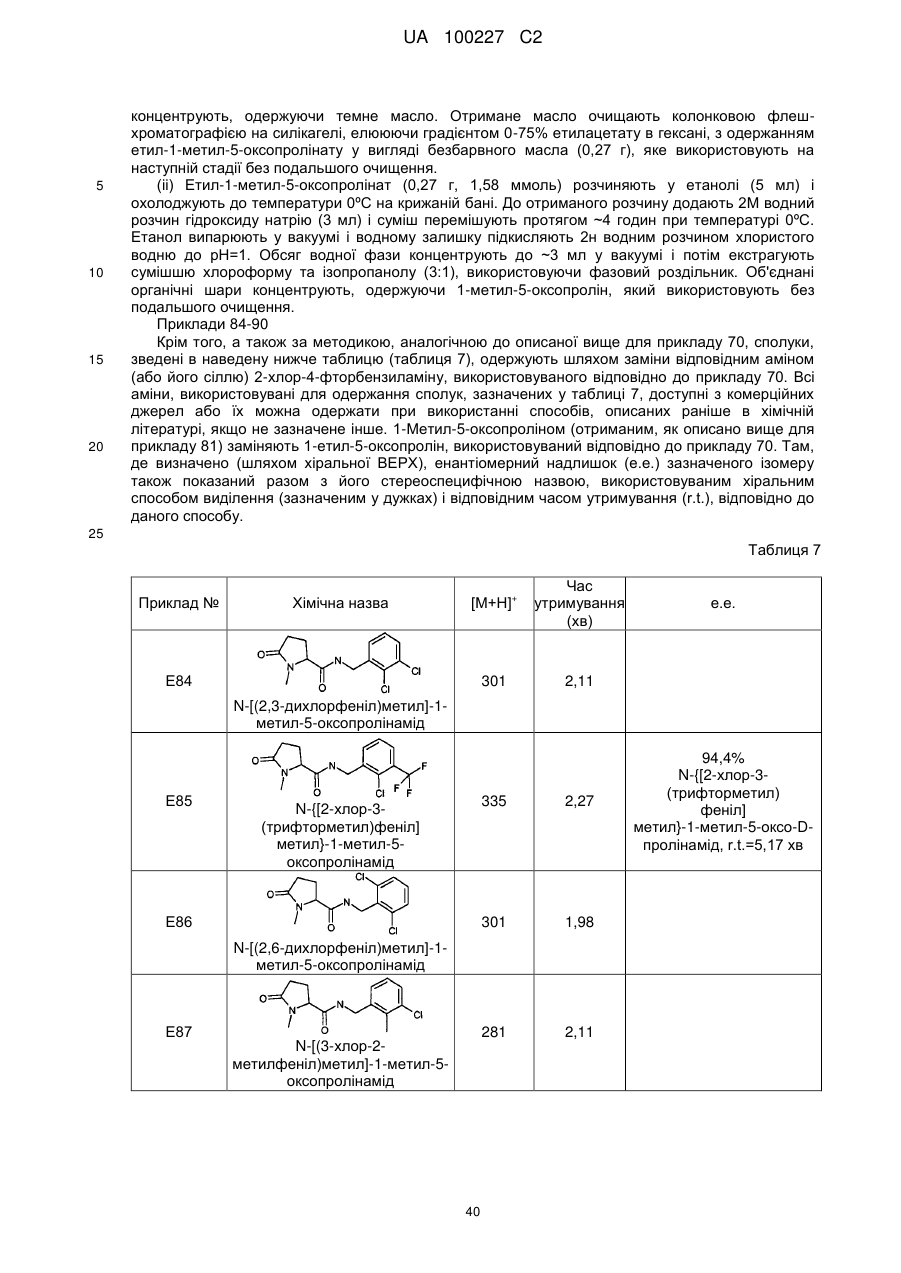
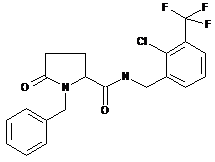
N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1-(фенілметил)-пролінамід
3
N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксо-пролінамід

6
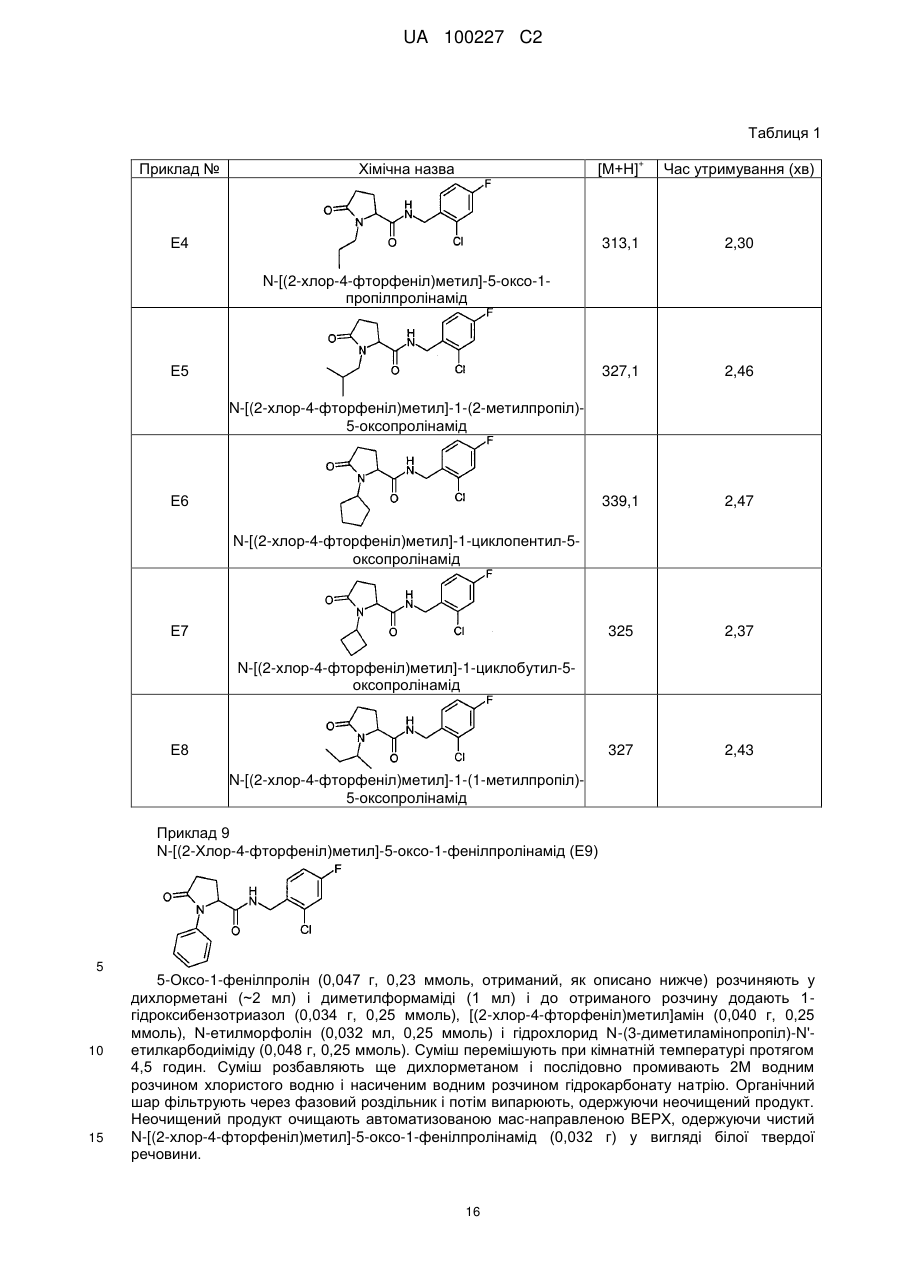
N-[(2-хлор-4-фторфеніл)метил]-1-циклопентил-5-оксо-пролінамід
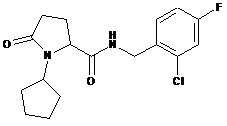
7
N-[(2-хлор-4-фторфеніл)метил]-1-циклобутил-5-оксопролінамід

9
N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1-феніл-пролінамід

10
N-[(2,4-дихлорфеніл)метил]-1-метил-5-оксо-пролінамід
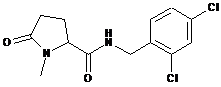
11
N-[(2-хлор-4-фторфеніл)метил]-1-метил-5-оксо-пролінамід
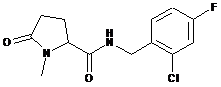
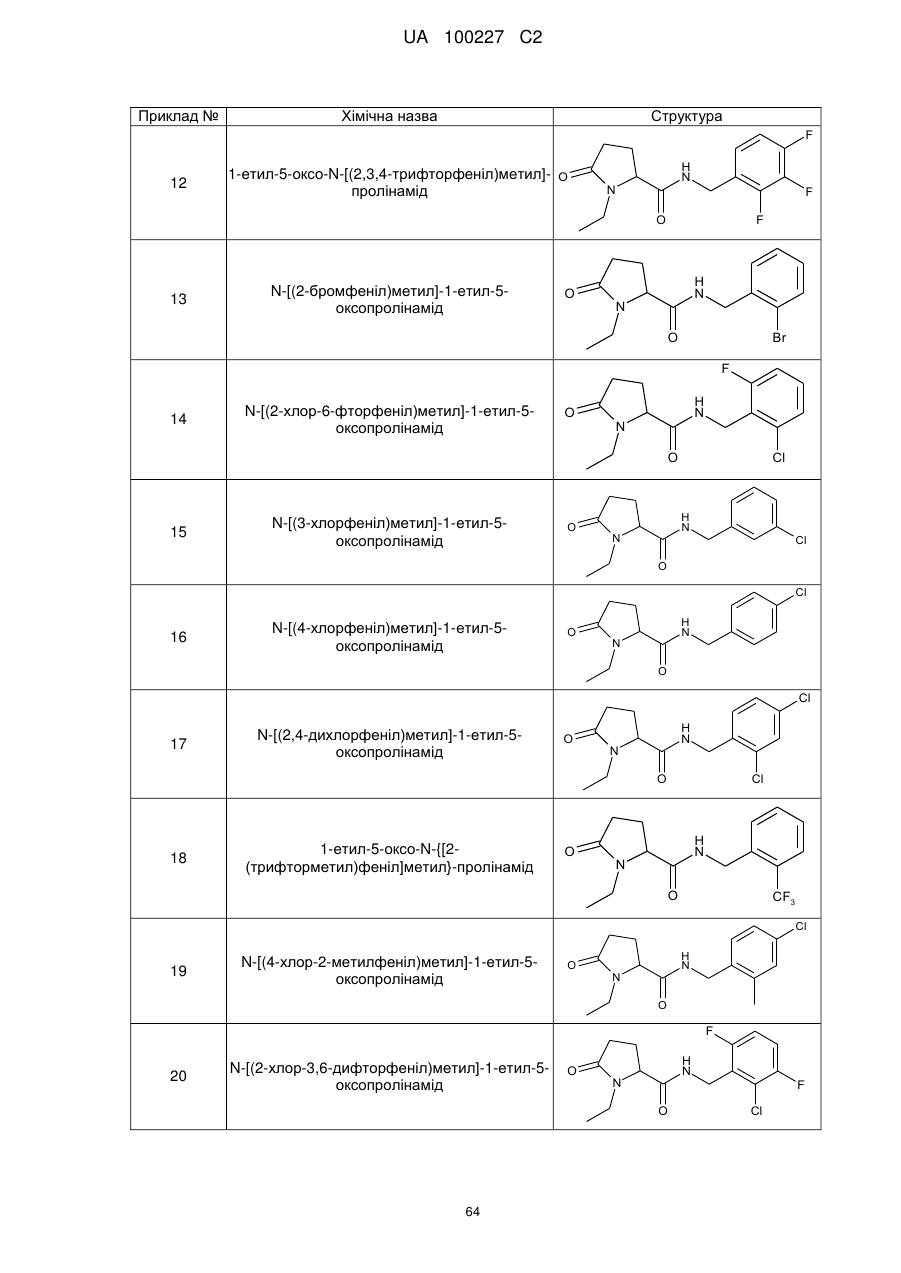
12
1-Етил-5-оксо-N-[(2,3,4-трифторфеніл)метил]-пролінамід

13
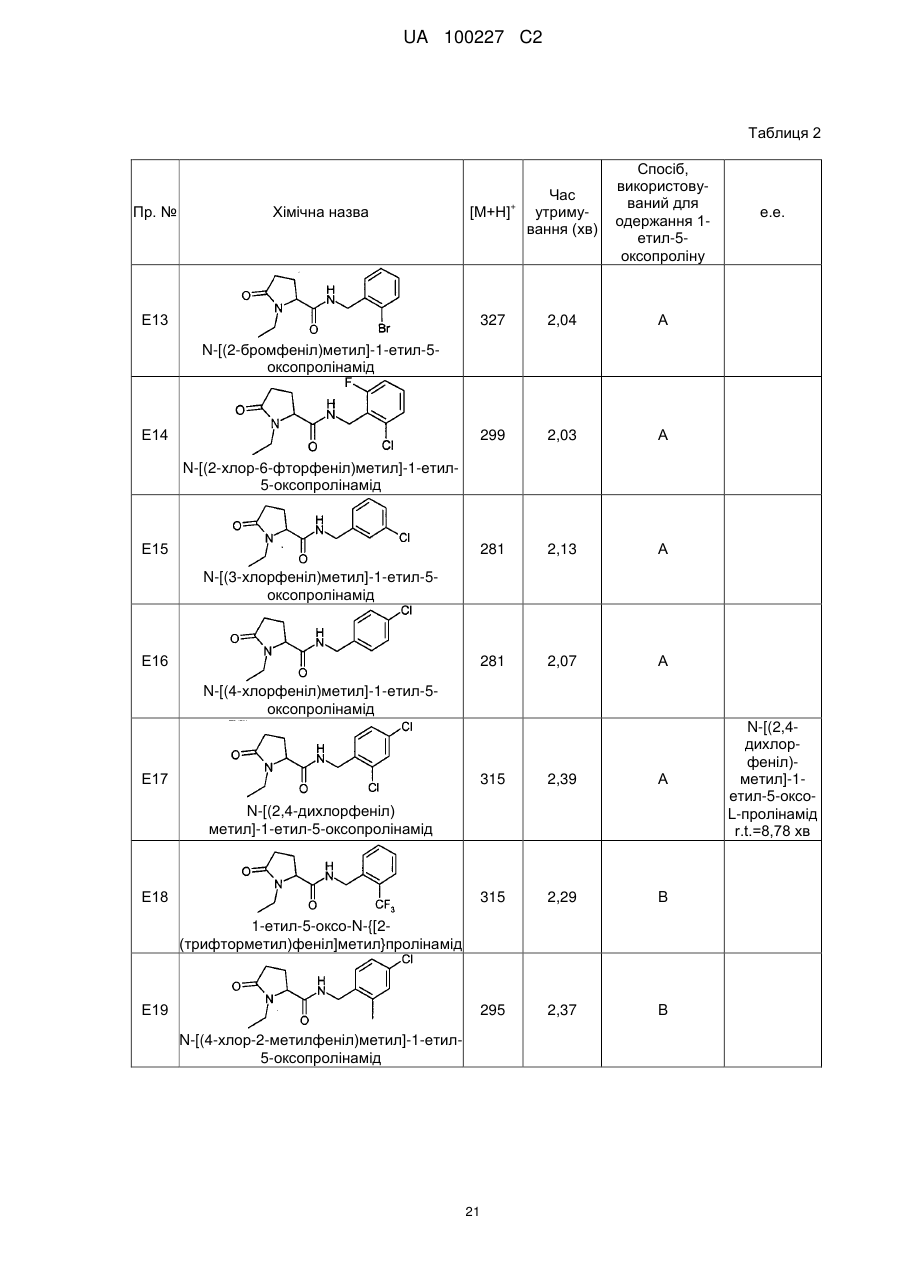
N-[(2-бромфеніл)метил]-1-етил-5-оксо-пролінамід

14
N-[(2-хлор-6-фторфеніл)метил]-1-етил-5-оксо-пролінамід

Приклад №
Хімічна назва
Структура
15
N-[(3-хлорфеніл)метил]-1-етил-5-оксо-пролінамід
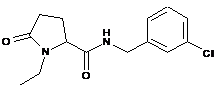
16
N-[(4-хлорфеніл)метил]-1-етил-5-оксо-пролінамід
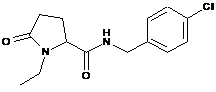
17
N-[(2,4-дихлорфеніл)метил]-1-етил-5-оксо-пролінамід

18
1-Етил-5-оксо-N-{[2-(трифторметил)феніл]метил}-пролінамід

19
N-[(4-хлор-2-метилфеніл)метил]-1-етил-5-оксо-пролінамід
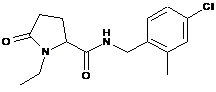
20
N-[(2-хлор-3,6-дифторфеніл)метил]-1-етил-5-оксо-пролінамід
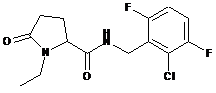
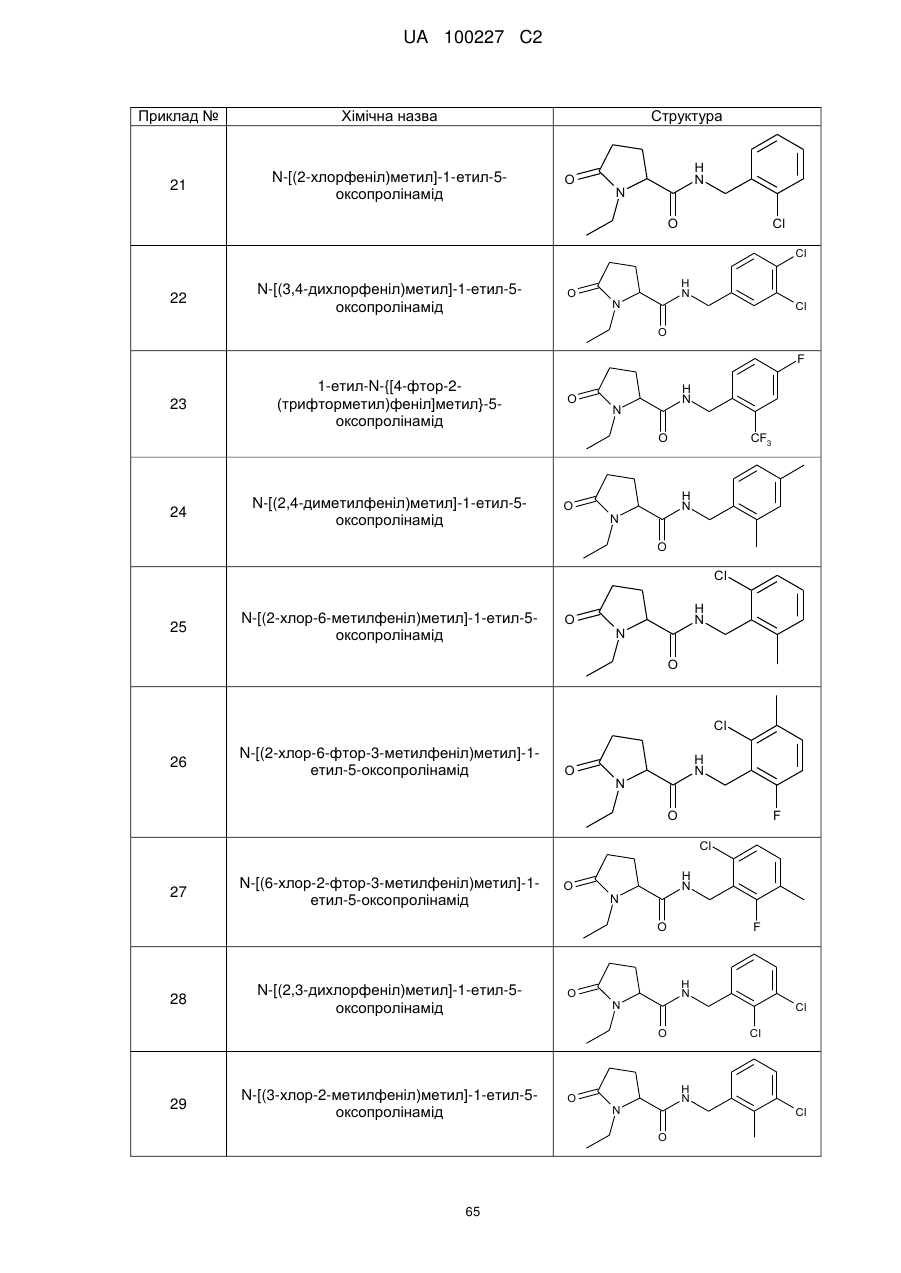
21
N-[(2-хлорфеніл)метил]-1-етил-5-оксо-пролінамід

22
N-[(3,4-дихлорфеніл)метил]-1-етил-5-оксо-пролінамід
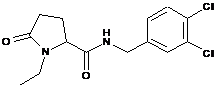
23
1-Етил-N-{[4-фтор-2-(трифторметил)феніл]метил}-5-оксо-пролінамід
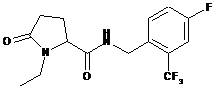
24
N-[(2,4-диметилфеніл)метил]-1-етил-5-оксо-пролінамід

25
N-[(2-хлор-6-метилфеніл)метил]-1-етил-5-оксо-пролінамід

Приклад №
Хімічна назва
Структура
26
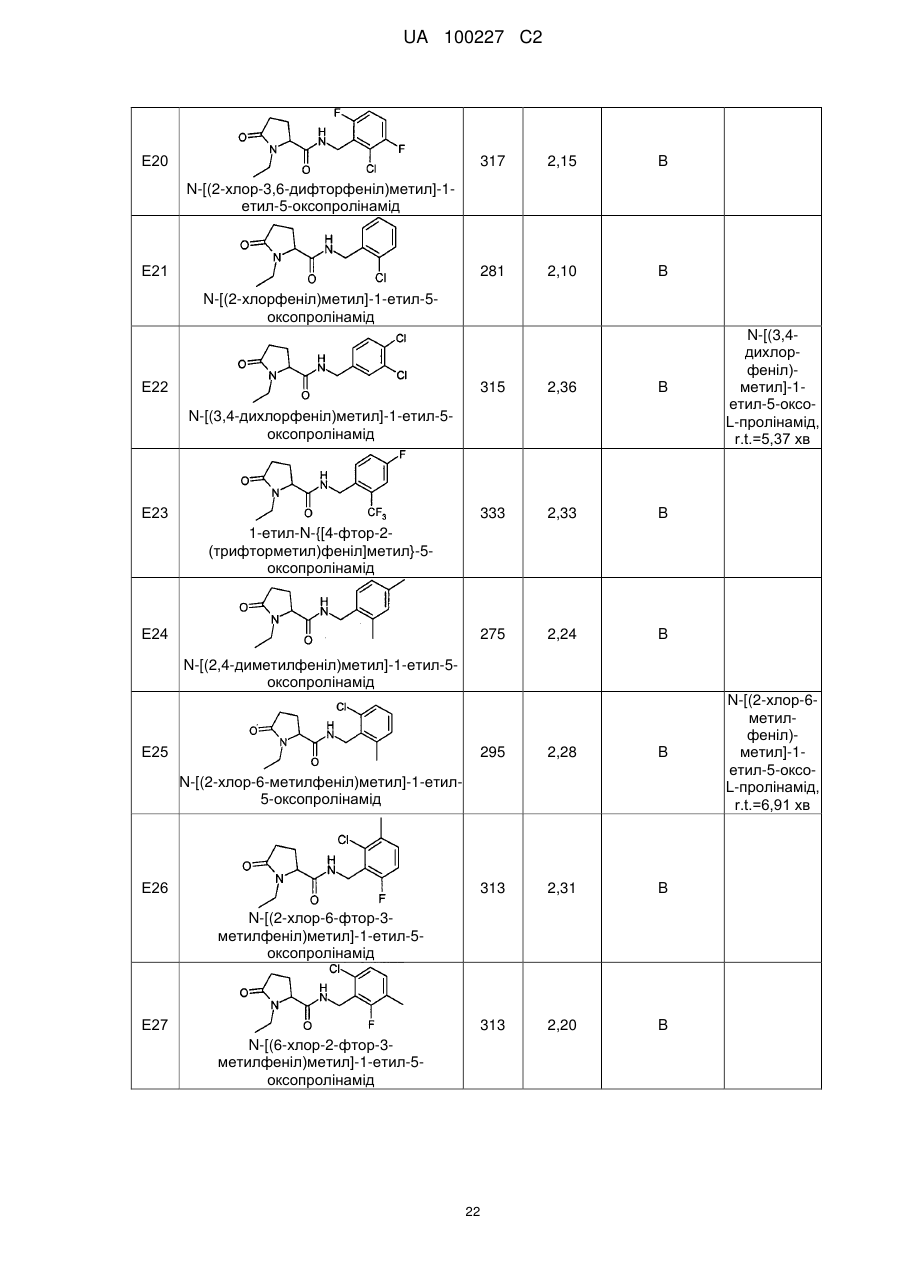
N-[(2-хлор-6-фтор-3-метилфеніл)метил]-1-етил-5-оксо-пролінамід
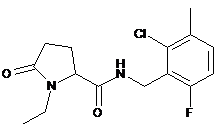
27
N-[(6-хлор-2-фтор-3-метилфеніл)метил]-1-етил-5-оксо-пролінамід
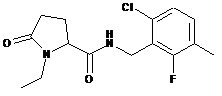
28
N-[(2,3-дихлорфеніл)метил]-1-етил-5-оксопролінамід
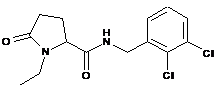
29
N-[(3-хлор-2-метилфеніл)метил]-1-етил-5-оксопролінамід
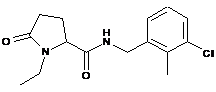
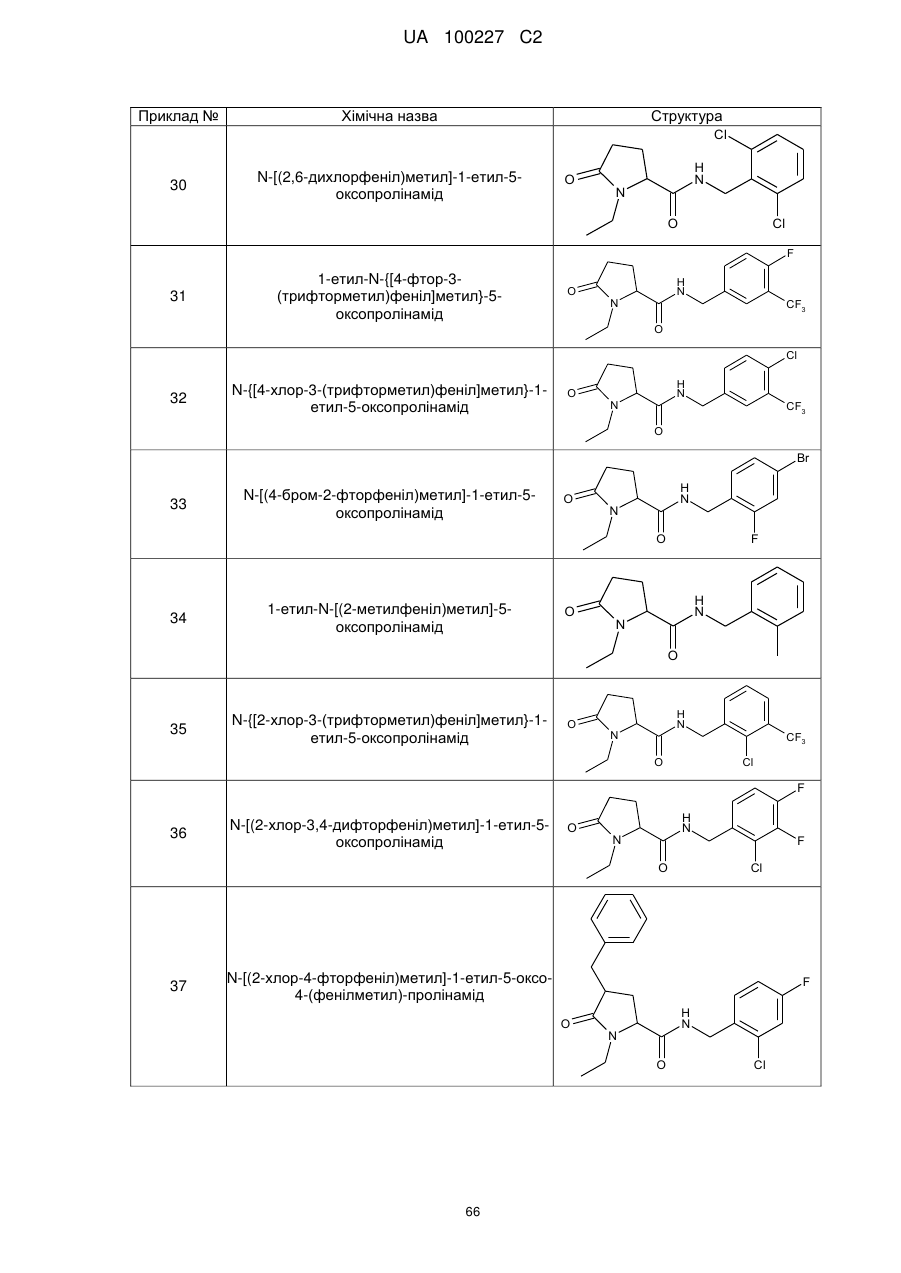
30
N-[(2,6-дихлорфеніл)метил]-1-етил-5-оксопролінамід

31
1-Етил-N-{[4-фтор-3-(трифторметил)феніл]метил}-5-оксопролінамід

32
N-{[4-хлор-3-(трифторметил)феніл]метил}-1-етил-5-оксо-пролінамід

33
N-[(4-бром-2-фторфеніл)метил]-1-етил-5-оксопролінамід
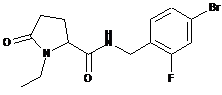
34
1-Етил-N-[(2-метилфеніл)метил]-5-оксопролінамід

35
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-етил-5-оксо-пролінамід

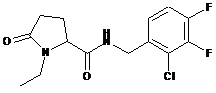
36
N-[(2-хлор-3,4-дифторфеніл)метил]-1-етил-5-оксопролінамід
Приклад №
Хімічна назва
Структура
37
N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксо-4-(фенілметил)-пролінамід

39
1-циклопропіл-N-[(2,4-дихлорфеніл)метил]-5-оксопролінамід
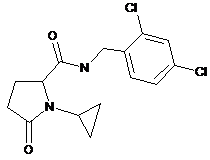
40
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-циклопропіл-5-оксопролінамід
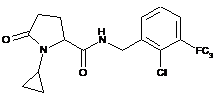
41
N-[(2-хлор-4-фторфеніл)метил]-1-циклопропіл-5-оксопролінамід

42
N-[(2,4-дихлорфеніл)метил]-1-етил-4,4-диметил-5-оксопролінамід
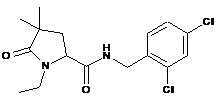
50
N-[(2,3-диметилфеніл)метил]-1-етил-5-оксопролінамід

51
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-метил-5-оксо-пролінамід
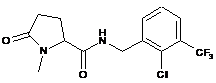
52
N-[(2,3-дихлор-4-фторфеніл)метил]-1-метил-5-оксопролінамід
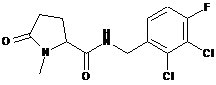
53
N-[(2-хлор-3,4-дифторфеніл)метил]-1-метил-5-оксопролінамід
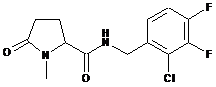
Приклад №
Хімічна назва
Структура
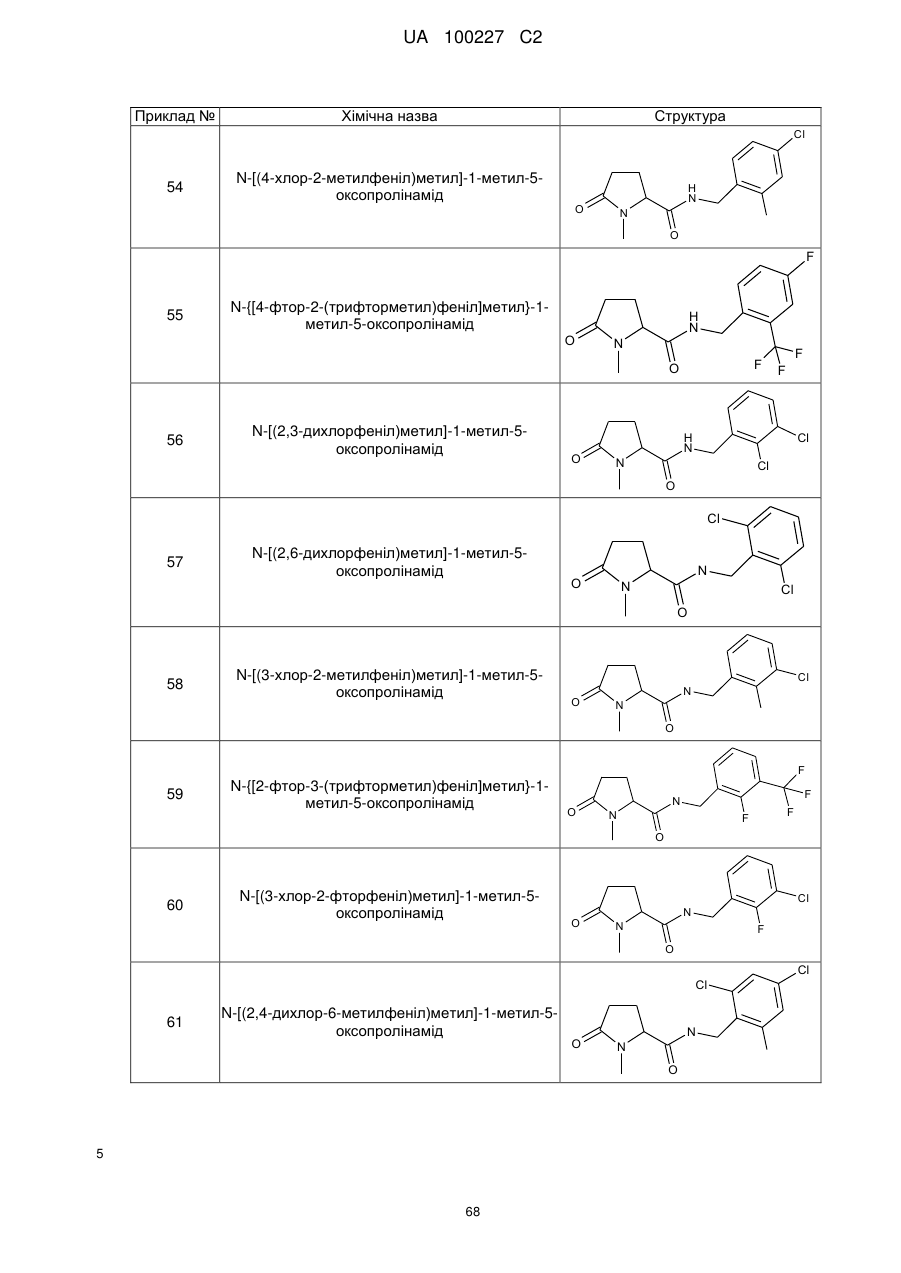
54
N-[(4-хлор-2-метилфеніл)метил]-1-метил-5-оксопролінамід
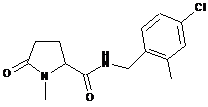
55
N-{[4-фтор-2-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід
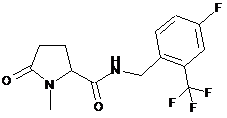
56
N-[(2,3-дихлорфеніл)метил]-1-метил-5-оксопролінамід

57
N-[(2,6-дихлорфеніл)метил]-1-метил-5-оксопролінамід
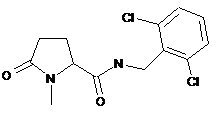
58
N-[(3-хлор-2-метилфеніл)метил]-1-метил-5-оксопролінамід
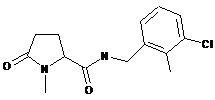
59
N-{[2-фтор-3-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід

60
N-[(3-хлор-2-фторфеніл)метил]-1-метил-5-оксопролінамід
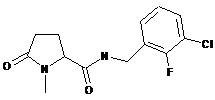
61
N-[(2,4-дихлор-6-метилфеніл)метил]-1-метил-5-оксопролінамід

62
1-метил-N-{[2-метил-3-(трифторметил)феніл]метил}-5-оксопролінамід

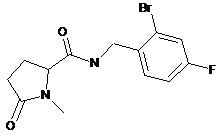
63
N-[(2-бром-4-фторфеніл)метил]-1-метил-5-оксопролінамід
Приклад №
Хімічна назва
Структура
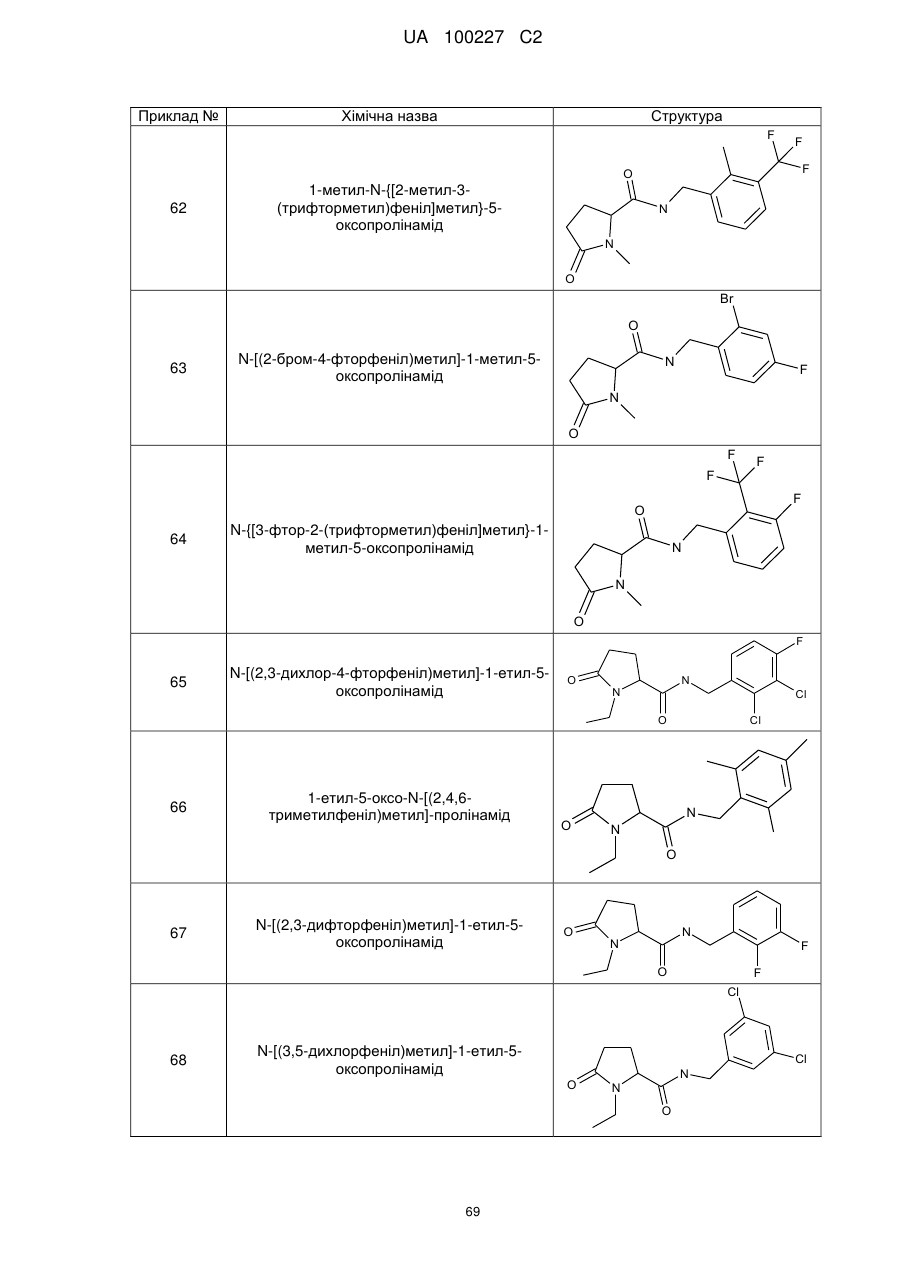
64
N-{[3-фтор-2-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід

65
N-[(2,3-дихлор-4-фторфеніл)метил]-1-етил-5-оксопролінамід
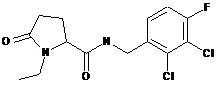
66
1-етил-5-оксо-N-[(2,4,6-триметилфеніл)метил]-пролінамід
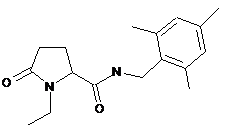
67
N-[(2,3-дифторфеніл)метил]-1-етил-5-оксопролінамід
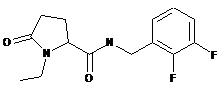
68
N-[(3,5-дихлорфеніл)метил]-1-етил-5-оксопролінамід
69
N-[(3-хлор-2-фторфеніл)метил]-1-етил-5-оксопролінамід
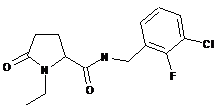
70
N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксопролінамід
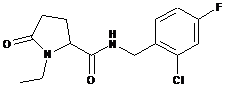
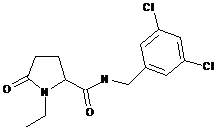
71
N-[(2,4-дихлорфеніл)метил]-1-етил-5-оксо-пролінамід
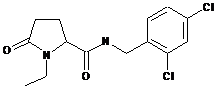
72
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-етил-5-оксо-пролінамід
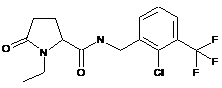
73
N-{[4-хлор-3-(трифторметил)феніл]метил}-1-етил-5-оксо-пролінамід
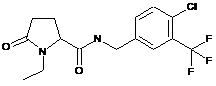
Приклад №
Хімічна назва
Структура
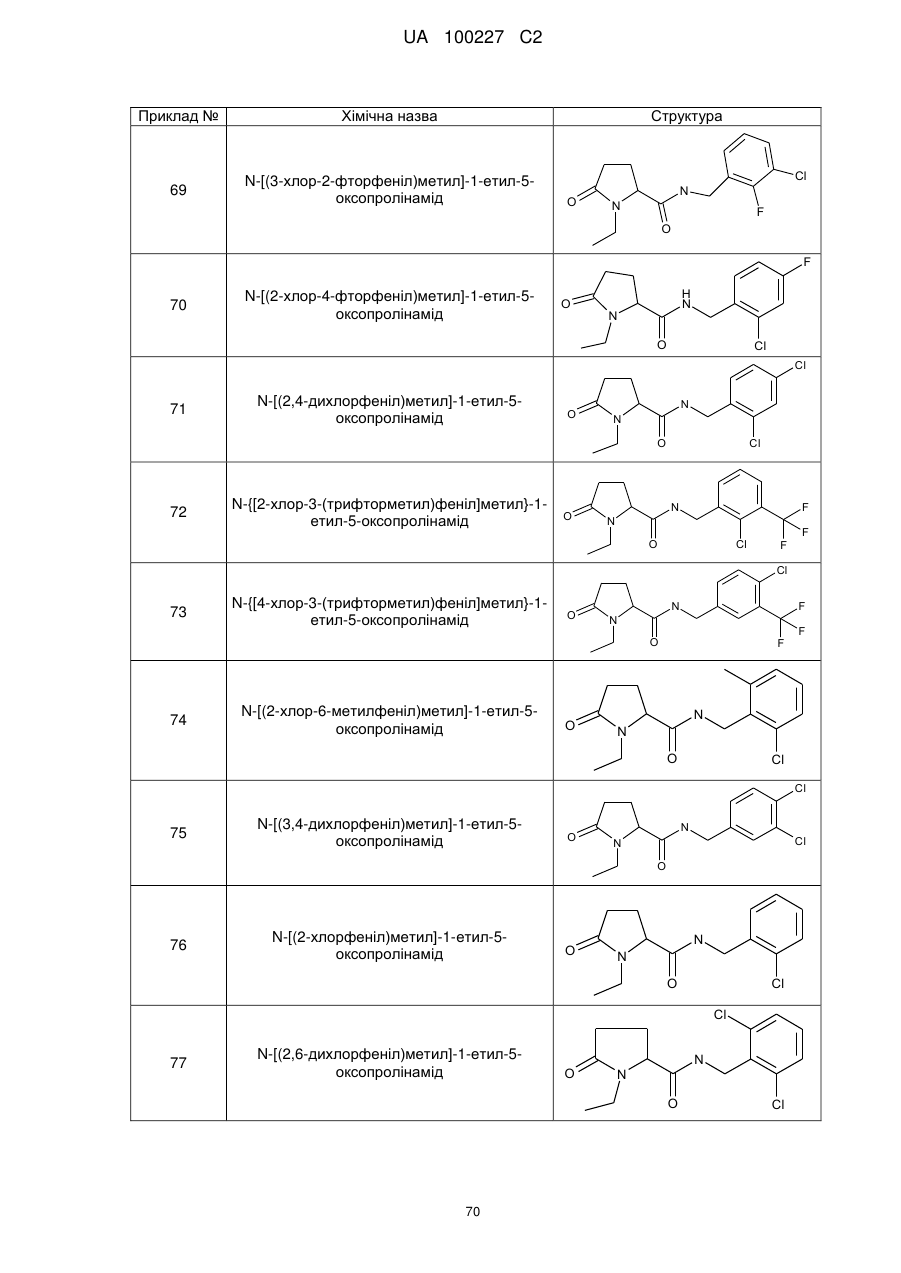
74
N-[(2-хлор-6-метилфеніл)метил]-1-етил-5-оксо-пролінамід

75
N-[(3,4-дихлорфеніл)метил]-1-етил-5-оксо-пролінамід
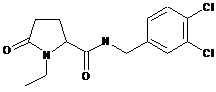
76
N-[(2-хлорфеніл)метил]-1-етил-5-оксопролінамід

77
N-[(2,6-дихлорфеніл)метил]-1-етил-5-оксопролінамід

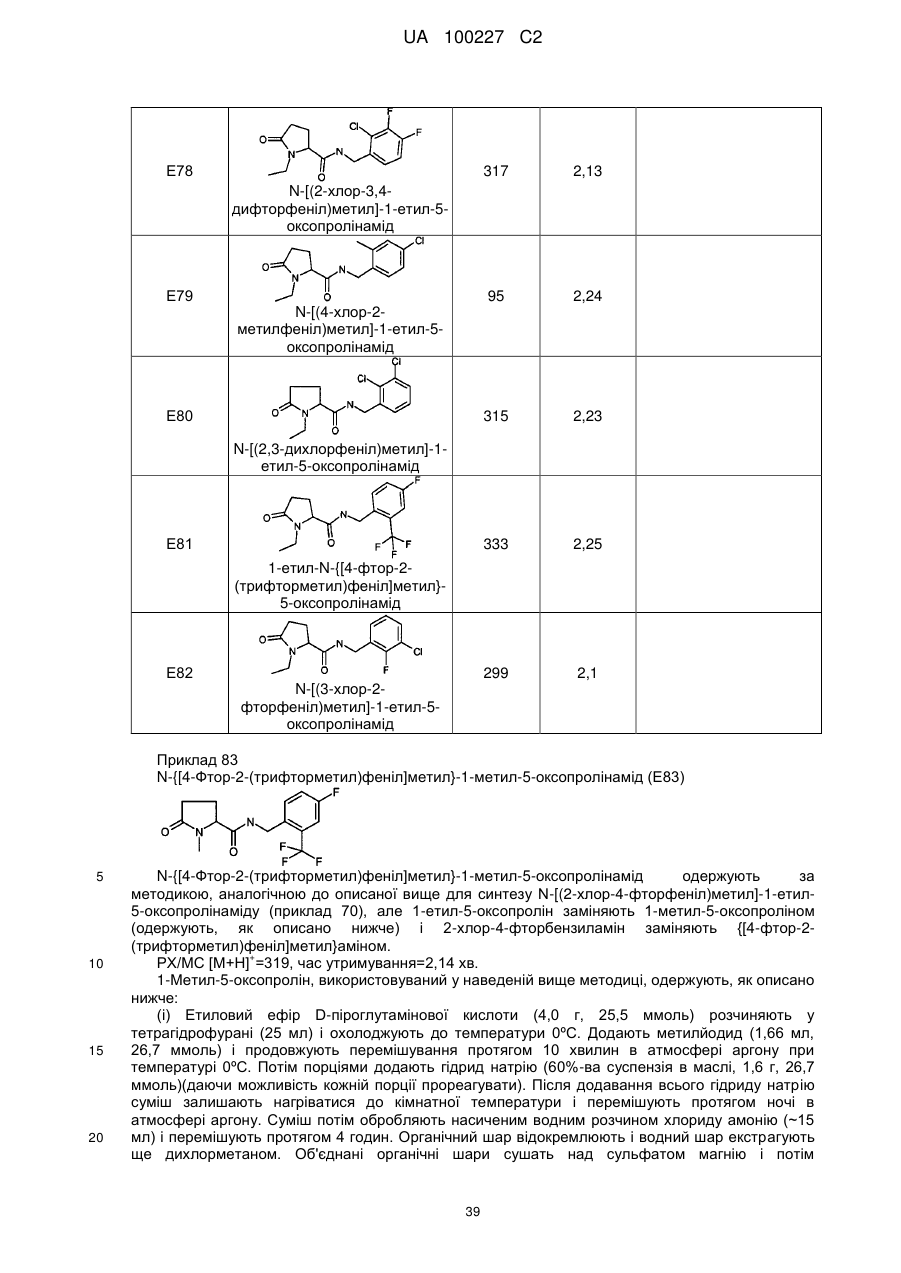
78
N-[(2-хлор-3,4-дифторфеніл)метил]-1-етил-5-оксопролінамід
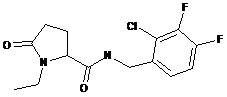
79
N-[(4-хлор-2-метилфеніл)метил]-1-етил-5-оксопролінамід
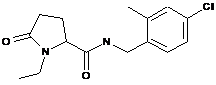
80
N-[(2,3-дихлорфеніл)метил]-1-етил-5-оксопролінамід
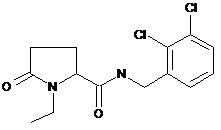
81
1-етил-N-{[4-фтор-2-(трифторметил)феніл]метил}-5-оксопролінамід
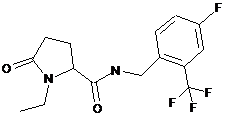
82
N-[(3-хлор-2-фторфеніл)метил]-1-етил-5-оксопролінамід
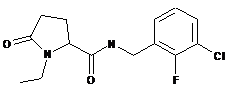
83
-{[4-фтор-2-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід
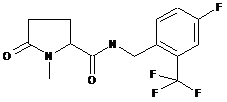
84
N-[(2,3-дихлорфеніл)метил]-1-метил-5-оксопролінамід
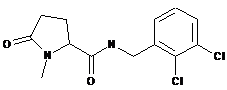
Приклад №
Хімічна назва
Структура
85
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-метил-5-оксо-пролінамід
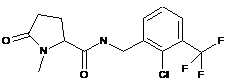
86
N-[(2,6-дихлорфеніл)метил]-1-метил-5-оксопролінамід
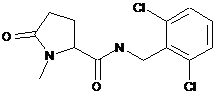
87
N-[(3-хлор-2-метилфеніл)метил]-1-метил-5-оксопролінамід
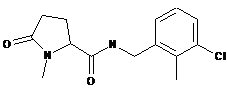
88
N-{[2-фтор-3-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід
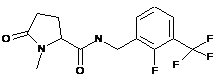
89
N-[(5-хлор-2-метилфеніл)метил]-1-метил-5-оксопролінамід
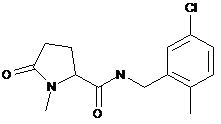
90
N-[(3-хлор-2-фторфеніл)метил]-1-метил-5-оксопролінамід
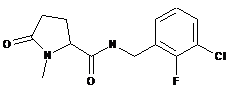
91
N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1-феніл-пролінамід
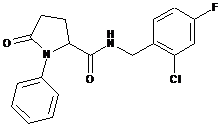
92
N-{[2-хлор-3-(трифторметил)феніл]метил}-5-оксо-1-(фенілметил)-пролінамід
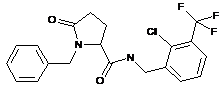
93
N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1-(фенілметил)пролінамід
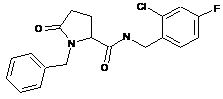
94
N-[(2-хлор-4-фторфеніл)метил]-1-циклопентил-5-оксопролінамід
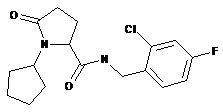
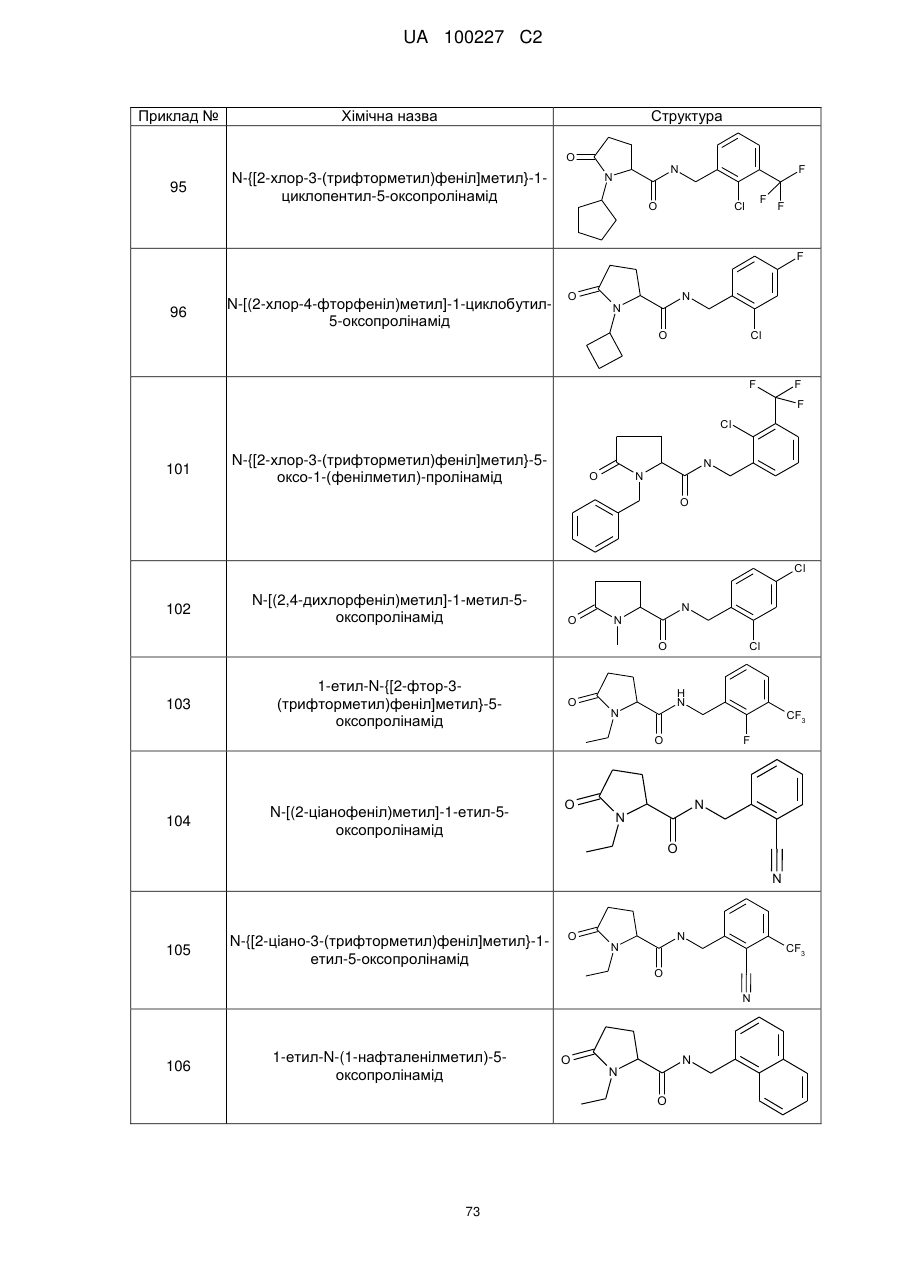
95
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-циклопентил-5-оксопролінамід
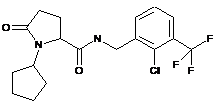
Приклад №
Хімічна назва
Структура
96
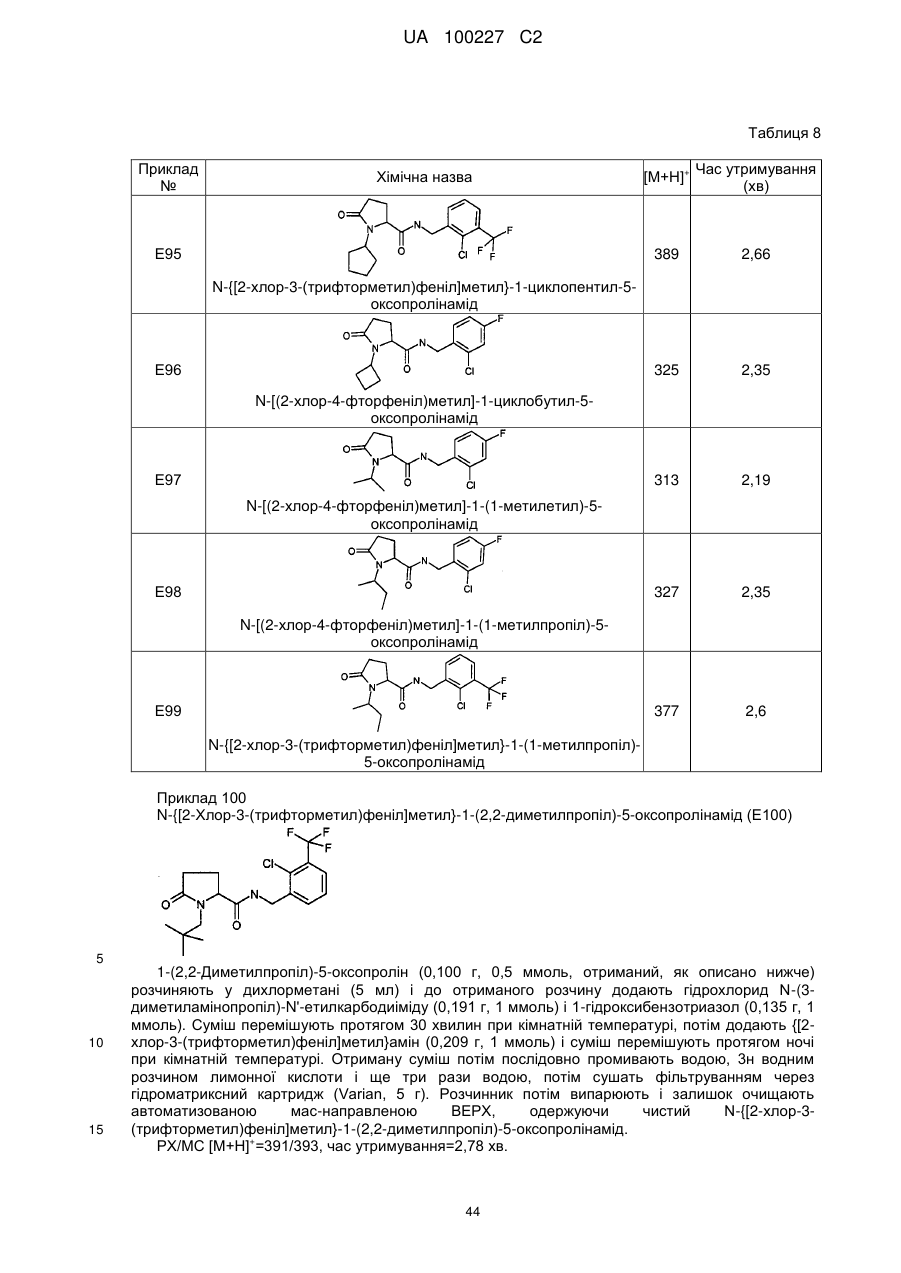
N-[(2-хлор-4-фторфеніл)метил]-1-циклобутил-5-оксопролінамід

101
N-{[2-хлор-3-(трифторметил)феніл]метил}-5-оксо-1-(фенілметил)-пролінамід
102
N-[(2,4-дихлорфеніл)метил]-1-метил-5-оксо-пролінамід
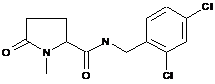
103
1-етил-N-{[2-фтор-3-(трифторметил)феніл]метил}-5-оксопролінамід
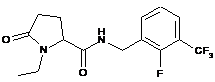
104
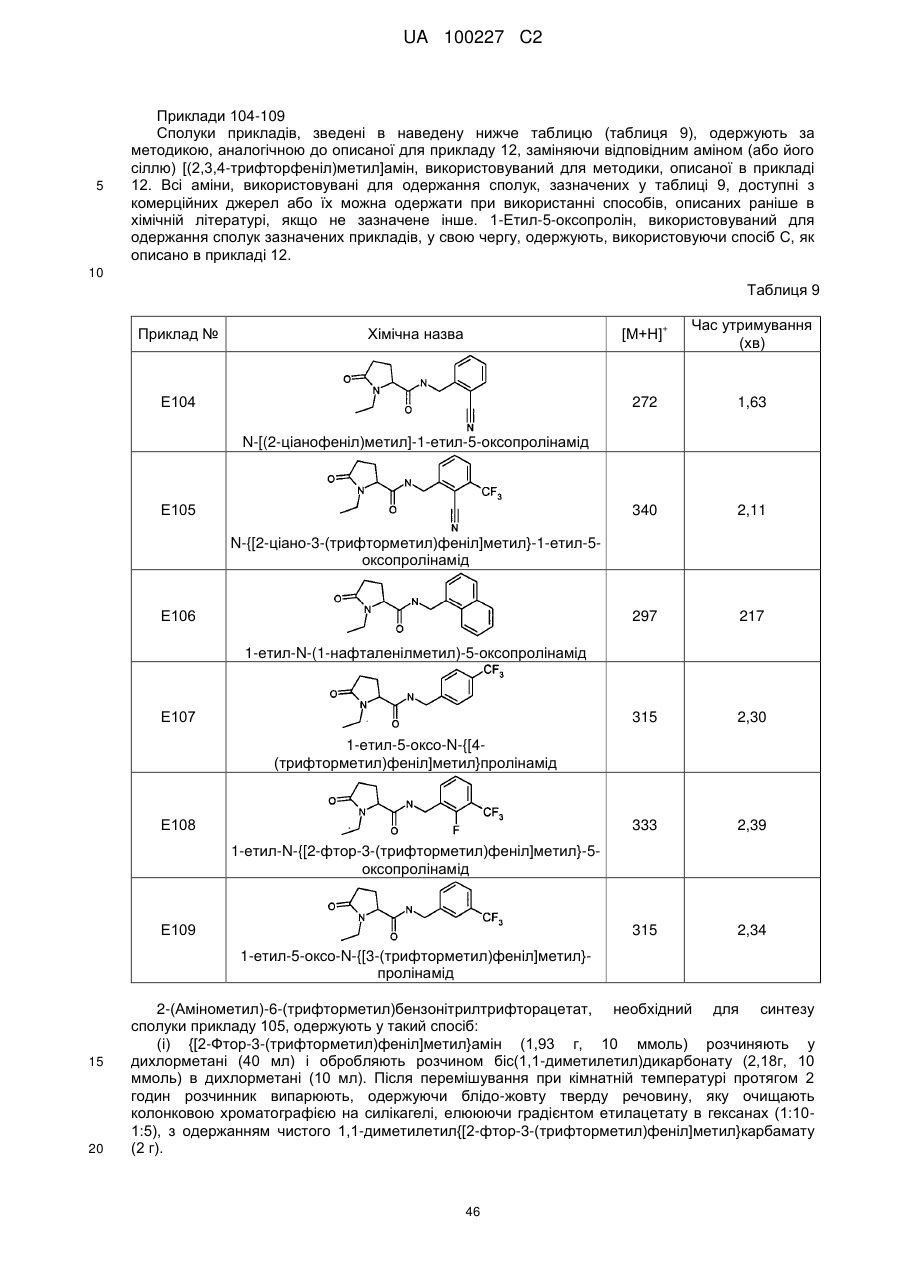
N-[(2-ціанофеніл)метил]-1-етил-5-оксопролінамід
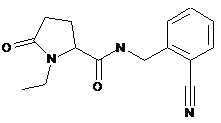
105
N-{[2-ціано-3-(трифторметил)феніл]метил}-1-етил-5-оксопролінамід
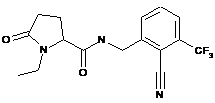
106
1-етил-N-(1-нафталенілметил)-5-оксопролінамід
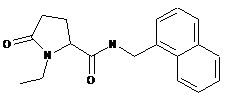
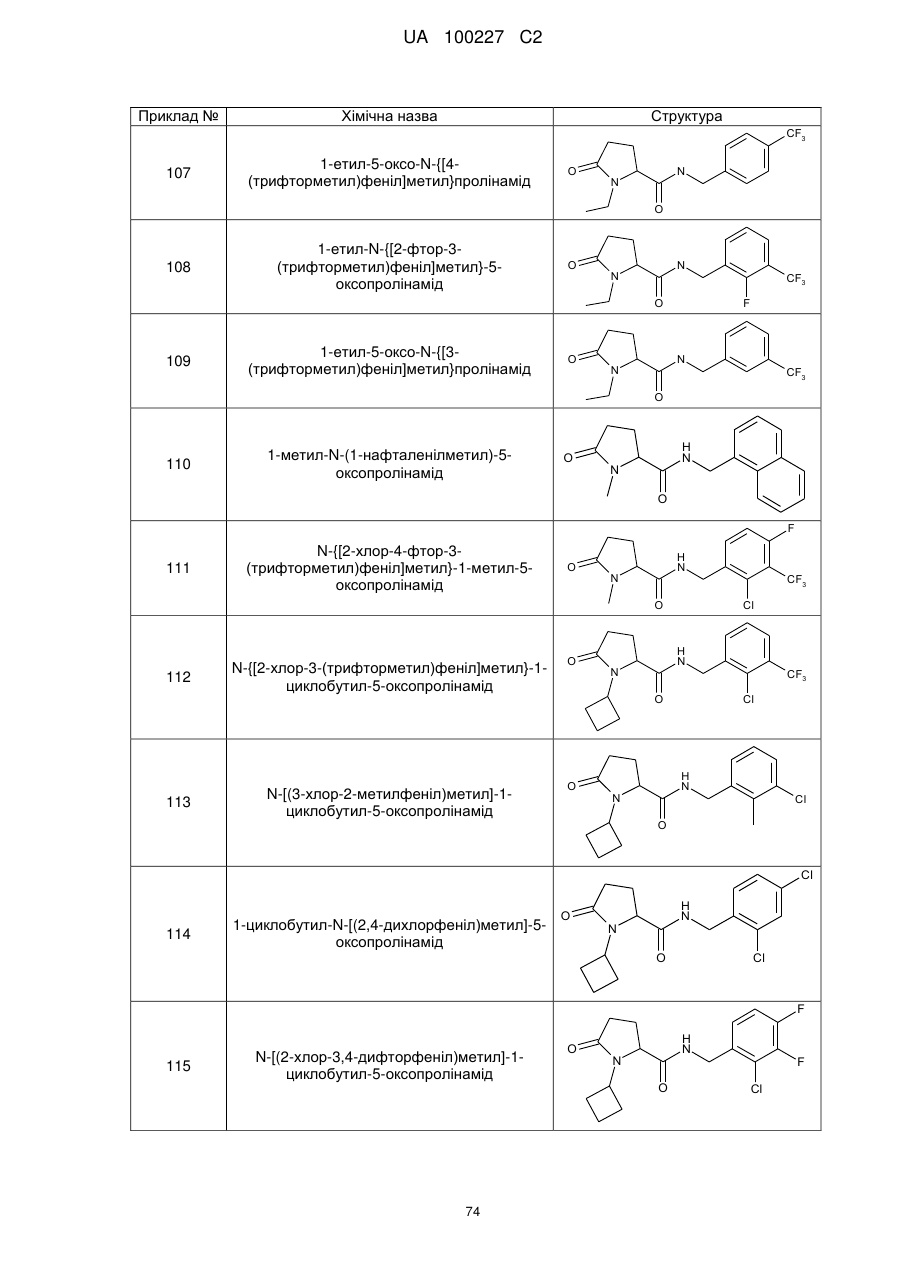
107
1-етил-5-оксо-N-{[4-(трифторметил)феніл]метил}пролінамід
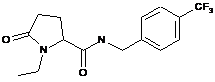
108
1-етил-N-{[2-фтор-3-(трифторметил)феніл]метил}-5-оксопролінамід
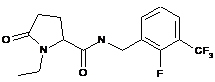
109
1-етил-5-оксо-N-{[3-(трифторметил)феніл]метил}пролінамід
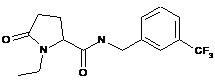
Приклад №
Хімічна назва
Структура
110
1-метил-N-(1-нафталенілметил)-5-оксопролінамід
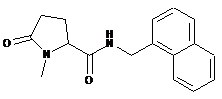
111
N-{[2-хлор-4-фтор-3-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід
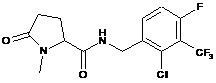
112
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-циклобутил-5-оксопролінамід
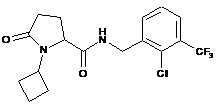
113
N-[(3-хлор-2-метилфеніл)метил]-1-циклобутил-5-оксопролінамід

114
1-циклобутил-N-[(2,4-дихлорфеніл)метил]-5-оксопролінамід

115
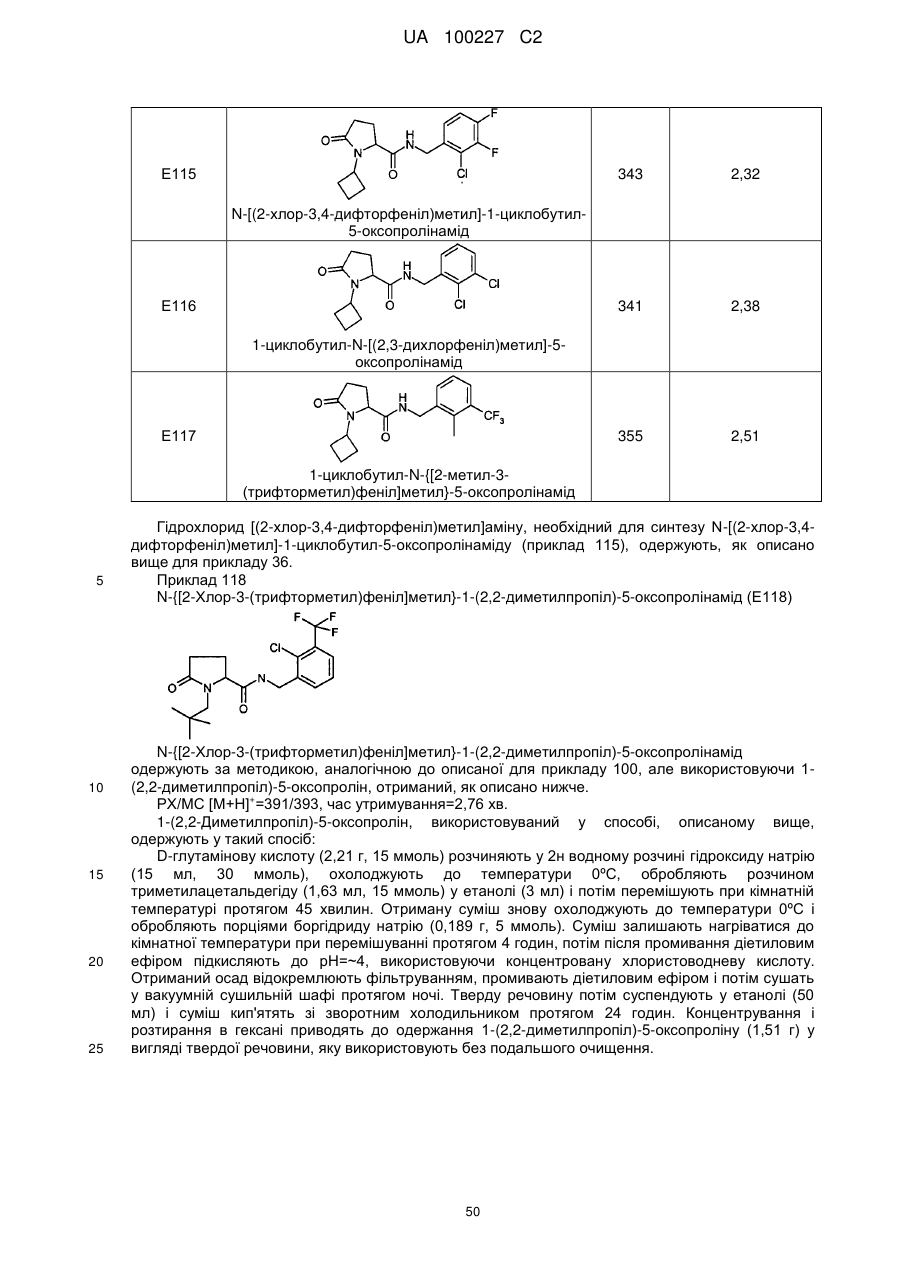
N-[(2-хлор-3,4-дифторфеніл)метил]-1-циклобутил-5-оксопролінамід

116
1-циклобутил-N-[(2,3-дихлорфеніл)метил]-5-оксопролінамід
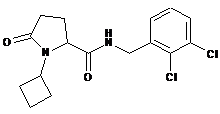
117
1-циклобутил-N-{[2-метил-3-(трифторметил)феніл]метил}-5-оксопролінамід
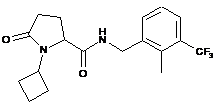
119
N-{[2-хлор-3-(трифторметил)феніл]метил}-5-оксо-1-(2-піридиніл метил) пролінамід
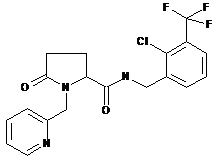
Приклад №
Хімічна назва
Структура
120
N-{[2-хлор-3-(трифторметил)феніл]метил}-5-оксо-1-(3-піридинілметил)пролінамід

121
N-[(2,4-дихлорфеніл)метил]-5-оксо-1-(3-піридинілметил)пролінамід
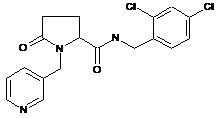
122
1-циклопропіл-N-[(2,4-дихлорфеніл)метил]-2-метил-5-оксопролінамід

123
N-[(2,4-дихлорфеніл)метил]-1-етил-2-метил-5-оксопролінамід
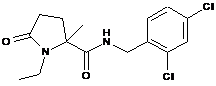
124
1-циклобутил-N-[(2,4-дихлорфеніл)метил]-2-метил-5-оксопролінамід

126
N-[(2,4-дихлорфеніл)метил]-1,2-диметил-5-оксопролінамід
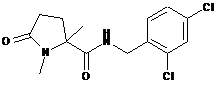
127
N-[(2,4-дихлорфеніл)метил]-1,3,3-триметил-5-оксопролінамід
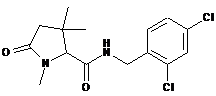
128
N-{[2-хлор-3-(трифторметил)феніл]метил}-1,3,3-триметил-5-оксопролінамід
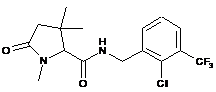
129
N-{[2-хлор-3-(трифторметил)феніл]метил}-1,3-диметил-5-оксопролінамід
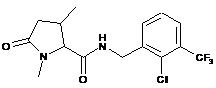
130
N-[(2-хлор-4-фторфеніл)метил]-1-етил-4,4-диметил-5-оксопролінамід

Приклад №
Хімічна назва
Структура
131
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-етил-4,4-диметил-5-оксопролінамід

132
N-[(2-хлор-3,4-дифторфеніл)метил]-1-етил-4,4-диметил-5-оксопролінамід

133
N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксо-4,4-біс(фенілметил)пролінамід
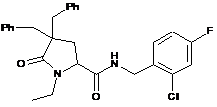
134
N-{[2-хлор-3-(трифторметил)феніл]метил}-1-етил-5-оксо-4-(феніл метил)пролінамід
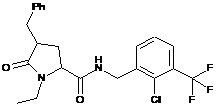
135
N-{[2-Ціано-3-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід
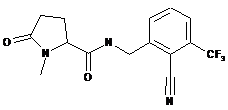
136
N-(2-біфенілілметил)-1-етил-5-оксопролінамід
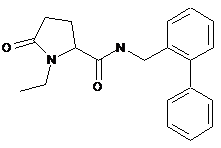
9. Сполука формули (І) або її сіль за п. 1, яка представляє собою N-{[2-хлор-3-(трифторметил)феніл]метил}-1-метил-5-оксопролінамід або його фармацевтично прийнятну сіль.
10. Сполука формули (І) або її сіль за п. 1, яка представляє собою N-{[2-хлор-3-(трифторметил)феніл]метил}-1-метил-5-оксо-L-пролінамід оксопролінамід або його фармацевтично прийнятну сіль.
11. Сполука формули (І) або її сіль за п. 1, яка представляє собою N-[(2,4-дихлорфеніл)-метил]-1-метил-5-оксопролінамід або його фармацевтично прийнятну сіль.
12. Сполука формули (І) або її сіль за п. 1, яка представляє собою N-[(2,4-дихлорфеніл)-метил]-1-етил-5-оксо-L-пролінамід або його фармацевтично прийнятну сіль.
13. Фармацевтична композиція, що містить сполуку формули (І) або її сіль, як визначено в будь-якому з попередніх пунктів, і фармацевтично прийнятний носій або ексципієнт.
14. Сполука або її фармацевтично прийнятна сіль за будь-яким з пп.1-12 для застосування в терапії.
15. Сполука або її сіль за будь-яким з пп.1-12 для застосування в лікуванні болю, запалення або нейродегенеративного захворювання.
16. Сполука формули (І) або її фармацевтично прийнятна сіль:
 , (I)
, (I)
де:
R1 являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл, С3-6циклоалкілметил- або піридинілметил-, будь-який з яких необов'язково заміщений 1, 2 або 3 атомами галогену; або незаміщений феніл або бензил;
R2 і R3 незалежно являють собою водень, галоген, С1-6алкіл, арилметил-, С2-6алкеніл, С2-6алкініл або С3-6циклоалкілметил-; і будь-який із зазначених С1-6алкілу, арилметилу-, С2-6алкенілу, С2-6алкінілу або С3-6циклоалкілметилу- необов'язково заміщений 1, 2 або 3 атомами галогену;
R4, R5 і R6 незалежно являють собою водень, фтор або метил; і
R7, R8, R9, R10 і R11 незалежно являють собою водень, галоген, ціано, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл, і будь-який із зазначених С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу або фенілу необов'язково заміщений 1, 2 або 3 атомами галогену; або R10 і R11 разом з атомами вуглецю, до яких вони приєднані, утворюють бензольне кільце, яке необов'язково заміщене 1, 2 або 3 атомами галогену;
за умови, що, коли R7 і R11, обидва вибрані з водню або фтору, щонайменше один з R8, R9 і R10 являє собою атом галогену, або R8, R9 і R10 вибирають з групи, що складається з водню і CF3, і один, але не більш ніж один з R8, R9 і R10 являє собою CF3,
для застосування в лікуванні болю, запалення або нейродегенеративних захворювань.
17. Сполука формули (І) або її сіль за п. 16, де R1 являє собою незаміщений С1-4алкіл, С3-5циклоалкіл, піридинілметил-, феніл або бензил.
18. Сполука формули (І) або її сіль за п. 16, де
R1 являє собою незаміщений С1-4алкіл, С1-4-алкеніл, С3-5циклоалкіл, піридинілметил-, феніл або бензил;
R2 і R3 обидва являють собою водень,
R4, R5 і R6 незалежно являють собою водень або метил; і
R7, R8, R9, R10 і R11 незалежно являють собою водень, хлор, фтор, бром, метил або трифторметил;
за умови, що, коли R7 і R11, обидва вибрані з водню або фтору, щонайменше один з R8, R9 і R10 являє собою атом галогену, або R8, R9 і R10 вибирають з групи, що складається з водню і CF3, і один, але не більш ніж один з R8, R9 і R10 являє собою CF3.
19. Сполука формули (І) або її сіль за будь-яким з пп. 15-18, для застосування при лікуванні або профілактиці запального болю, невропатичного болю або вісцерального болю, або для лікування чи профілактики хвороби Альцгеймера.
Текст
Реферат: Даний винахід стосується нових оксопролінамідних похідних формули (І), що модулюють функцію Р2Х7-рецептора і здатні викликати антагонізм у відношенні впливів АТФ на Р2Х7рецептор, і застосування таких сполук або фармацевтичних композицій, що їх містять, при лікуванні порушень, опосередковуваних Р2Х7-рецептором, наприклад, болю, запалення й нейродегенерації. UA 100227 C2 (12) UA 100227 C2 R R 4 R O 5 R 3 R R N 2 O R 6 1 7 R R 11 R 8 R N H 9 10 . (I) UA 100227 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід належить до гетероциклічних амідних похідних, які модулюють функцію Р2Х7рецептора й здатні викликати антагонізм у відношенні впливів АТФ на Р2Х7-рецептор (антагоністи Р2Х7-рецептора); до способів їх одержання; до фармацевтичних композицій, що їх містять, і до застосування таких сполук у терапії. Р2Х7-рецептор являє собою іонний канал, що відкривається лігандом, який експресується в клітинах гематопоетичної лінії диференціювання, наприклад макрофагах, мікрогліальних клітинах, мастоцитах і лімфоцитах (Т і В) (див., наприклад, Collo et al., Neuropharmacology, 36, 1277-1283 (1997)) і активується позаклітинними нуклеотидами, зокрема, аденозинтрифосфатом (АТФ). Активація Р2Х7-рецепторів залучена в утворення гігантської клітини, дегрануляцію, цитолітичну загибель клітини, втрату CD62L, регуляцію клітинної проліферації і вивільнення прозапальних цитокінів, таких як інтерлейкін 1 бета (IL-1β) (наприклад, Ferrary et al., J. Immunol., 176, 3877-3883 (2006)) і альфа-фактор некрозу пухлини (TNFα) (наприклад, Hide et al., Journal of Neurochemistry, 75, 965-972 (2000)). Р2Х7-Рецептори також локалізуються в антигенпрезентуючих клітинах, кератиноцитах, клітинах, що відносяться до привушної залози, гепатоцитах, еритроцитах, еритролейкозних клітинах, моноцитах, фібробластах, клітинах кісткового мозку, нейронах і ниркових мезангіальних клітинах. Крім того, Р2Х7-рецептор експресується пресинаптичними закінченнями в центральній і периферичній нервових системах і показано, що він опосередковує вивільнення глутамату з гліальних клітин (Anderson C. et al., Drug. Dev. Res., 50, 92 (2000)). Локалізація Р2Х7-рецетора в ключових клітинах імунної системи, зв'язана з його здатністю вивільняти в значній мірі запальні медіатори з цих клітин, наводить на думку про потенційну роль антагоністів Р2Х7-рецептора при лікуванні великого ряду захворювань, включаючи біль і нейродегенеративні порушення. В останніх преклінічних дослідженнях in vivo мається на увазі особиста участь Р2Х7-рецептора як у запальному болі, так і в невропатичному болі (Dell'Antonio et al., Neurosci. Lett., 327, 87-90 (2002); Chessel I.P. et al., Pain, 114, 386-396 (2005); Honore et al., J. Pharmacol. Exp. Ther., 319, 1376-1385 (2006)), тоді як мається доказ in vitro, що Р2Х7рецептори опосередковують індуковану мікрогліальною клітиною загибель кортикальних нейронів (Skaper S.D. et al., Glia, 54, 234-242 (2006)). На додаток, позитивна регуляція Р2Х7рецептора виявлена поблизу β-амілоїдних бляшок на трансгенній мишачій моделі хвороби Альцгеймера (Parvathenani L. et al., J. Biol. Chem., 278(15), 13309-13317 (2003)). Даний винахід відноситься до сполук, що модулюють функцію Р2Х7-рецептора і здатні викликати антагонізм у відношенні впливів АТФ на Р2Х7-рецептор (антагоністи Р2Х7рецептора). У першому аспекті запропоновані сполука формули (I) або її фармацевтично прийнятна сіль: де 1 R являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл, С3-6циклоалкілметил- або піридинілметил-, будь-який з котрих необов'язково заміщений 1, 2 або 3 атомами галогену; або незаміщений феніл або бензил; 2 3 R і R незалежно являють собою водень, галоген, С1-6алкіл, арилметил-, С2-6алкеніл, С26алкініл або С3-6циклоалкілметил-; і будь-який із вказаних вище С1-6алкілу, арилметилу-, С26алкенілу, С2-6алкінілу або С3-6циклоалкілметилу- необов'язково заміщений 1, 2 або 3 атомами галогену; 4 5 6 R , R і R незалежно являють собою водень, фтор або метил; і 7 8 9 10 11 R , R , R , R і R незалежно являють собою водень, галоген, ціано, С 1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл, і будь-який із вказаних вище С1-6алкілу, С2-6алкенілу, С26алкінілу, С3-6циклоалкілу або фенілу необов'язково заміщений 1, 2 або 3 атомами галогену; або 10 11 R і R разом з атомами вуглецю, до яких вони приєднані, утворюють бензольне кільце, яке необов'язково заміщене 1, 2 або 3 атомами галогену; 7 11 8 9 за умови, що, коли R і R , обидва вибрані з водню або фтору, щонайменше один з R , R і 10 8 9 10 R являє собою атом галогену, або R , R і R вибирають з групи, що складається з водню і 8 9 10 CF3, і один, але не більш ніж один з R , R і R , являє собою CF3. 1 UA 100227 C2 В одному варіанті здійснення запропоновані сполука формули (I) або її фармацевтично прийнятна сіль: 5 10 15 20 25 30 35 40 де 1 R являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або С3-6циклоалкілметил, будь-який з котрих може бути необов'язково заміщений 1, 2 або 3 атомами галогену; або незаміщений феніл або бензил; 2 3 R і R незалежно являють собою водень, галоген, С1-6алкіл, арилметил, С2-6алкеніл, С26алкініл або С3-6циклоалкілметил; і будь-який із вказаних вище С1-6алкілу, арилметилу, С26алкенілу, С2-6алкінілу або С3-6циклоалкілметилу може бути необов'язково заміщений 1, 2 або 3 атомами галогену; 4 5 6 R , R і R незалежно являють собою водень або фтор; і 7 8 9 10 11 R , R , R , R і R незалежно являють собою водень, галоген, ціано, С 1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл; і будь-який із вказаних вище С1-6алкілу, С2-6алкенілу, С26алкінілу, С3-6циклоалкілу або фенілу може бути необов'язково заміщений 1, 2 або 3 атомами галогену; 7 11 за умови, що, коли R і R незалежно являють собою водень або фтор, щонайменше один 8 9 10 С R , R і R являє собою атом галогену. В одному варіанті здійснення запропоновані сполука формули (I) або її фармацевтично прийнятна сіль: де 1 R являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл, С3-6циклоалкілметил- або піридинілметил-, будь-який з яких необов'язково заміщений 1, 2 або 3 атомами галогену; або незаміщений феніл або бензил; 2 3 R і R незалежно являють собою водень, галоген, С1-6алкіл, арилметил-, С2-6алкеніл, С26алкініл або С3-6циклоалкілметил-; і будь-який із вказаних вище С1-6алкілу, арилметилу-, С26алкенілу, С2-6алкінілу або С3-6циклоалкілметилу- необов'язково заміщений 1, 2 або 3 атомами галогену; 4 5 6 R , R і R незалежно являють собою водень, фтор або метил; і 7 8 9 10 11 R , R , R , R і R незалежно являють собою водень, галоген, ціано, С 1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл або феніл, і будь-який із вказаних вище С1-6алкілу, С2-6алкенілу, С26алкінілу, С3-6циклоалкілу або фенілу необов'язково заміщений 1, 2 або 3 атомами галогену; або 10 11 R і R разом з атомами вуглецю, до яких вони приєднані, утворюють бензольне кільце, яке необов'язково заміщене 1, 2 або 3 атомами галогену; 7 11 8 9 за умови, що, коли R і R , обидва вибрані з водню або фтору, щонайменше один з R , R і 10 8 9 10 R являє собою атом галогену або не більше ніж один з R , R і R , являє собою групу CF3. Як використовується в даному описі, термін «алкіл» (коли він використовується як група або частина групи) стосується лінійного або розгалуженого вуглеводневого ланцюга, що містить визначене число атомів вуглецю. Наприклад, С 1-6алкіл являє собою лінійний або розгалужений вуглеводневий ланцюг, що містить щонайменше 1-6 атомів вуглецю. Приклади алкілу включають, але, не обмежуючись ними, метил (Ме), етил (Et), н-пропіл, ізопропіл, н-гексил або ізогексил. 2 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використовується в даному описі, термін «алкеніл» стосується лінійного або розгалуженого вуглеводневого ланцюга, що містить визначене число атомів вуглецю, де щонайменше один зв'язок вуглець-вуглець є подвійним зв'язком. Приклади алкенілу включають, але, не обмежуючись ними, етеніл, пропеніл, н-бутеніл, ізобутеніл, н-пентеніл та ізопентеніл. Як використовується в даному описі, термін «алкініл» стосується лінійного й розгалуженого вуглеводневого ланцюга, що містить визначене число атомів вуглецю, де щонайменше один зв'язок вуглець-вуглець є потрійним зв'язком. Приклади алкінілу включають, але, не обмежуючись ними, етиніл, пропініл, бутиніл, ізопентиніл, н-пентиніл, ізогексиніл і н-гексиніл. Термін «циклоалкіл», якщо не зазначене інше, являє собою замкнуте 3-6-членне неароматичне кільце, наприклад циклопропіл, циклобутил, циклопентил або циклогексил. Термін «арил», як використовується в даному описі, стосується С6-10моноциклічного або біциклічного вуглеводневого кільця, де щонайменше одне кільце є ароматичним. Приклади таких груп включають феніл і нафтил. Термін «галоген», як використовується в даному описі, стосується, якщо не зазначене інше, до групи, вибраної з фтору, хлору, брому або йоду. 1 У деяких варіантах здійснення даного винаходу R являє собою С1-6алкіл, С2-6алкеніл, С26алкініл, С3-6циклоалкіл або піридинілметил-, будь-який з котрих необов'язково заміщений 1, 2 1 або 3 атомами галогену; або не заміщений феніл або бензил. В одному варіанті здійснення R являє собою незаміщений С1-6алкіл, С2-6алкеніл, С2-6алкініл, С3-6циклоалкіл, піридинілметил-, 1 феніл або бензил. В іншому варіанті здійснення R являє собою незаміщений С1-4алкіл, С31 5циклоалкіл, піридинілметил-, феніл або бензил. Ще в іншому варіанті здійснення R являє собою метил або етил. 2 3 У деяких варіантах здійснення даного винаходу R і R незалежно являють собою водень, галоген, С1-6алкіл, бензил, С2-6алкеніл, С2-6алкініл або С3-6циклоалкілметил; і будь-який із вказаних вище С1-6алкілу, бензилу, С2-6алкенілу, С2-6алкінілу або С3-6циклоалкілметилу- може бути необов'язково заміщений 1, 2 або 3 атомами галогену. 2 3 В одному варіанті здійснення R і R незалежно являють собою водень або галоген, незаміщений С1-6алкіл, бензил, С2-6алкеніл, С2-6алкініл або С3-6циклоалкілметил-. 2 3 В іншому варіанті здійснення R і R незалежно являють собою водень, фтор або метил. У 2 3 подальшому варіанті здійснення R і R , обидва, являють собою водень. 4 5 В одному варіанті здійснення даного винаходу R і R незалежно являють собою водень або 6 метил. В іншому варіанті здійснення R являє собою водень або метил. У додатковому варіанті 4 5 6 здійснення R , R і R , усі являють собою водень. 7 8 9 10 11 В іншому варіанті здійснення даного винаходу R , R , R , R і R незалежно являють собою 10 11 водень, галоген, ціано, трифторметил або незаміщений С 1-6алкіл; або R і R разом з атомами вуглецю, до яких вони приєднані, утворюють незаміщене бензольне кільце. У додатковому 7 8 9 10 11 варіанті здійснення R , R , R , R і R незалежно являють собою водень, галоген, ціано, метил 10 11 або трифторметил; або R і R разом з атомами вуглецю, до яких вони приєднані, утворюють 7 8 9 10 11 незаміщене бензольне кільце. Ще в одному іншому варіанті здійснення R , R , R , R і R незалежно являють собою водень, хлор, фтор, бром, метил або трифторметил. В одному варіанті здійснення даний винахід відноситься до сполуки формули (I) або до її фармацевтично прийнятної солі, де: 1 R являє собою незаміщений С1-4алкіл, С2-4алкеніл, С3-5циклоалкіл, піридинілметил-, феніл або бензил; 2 3 R і R , обидва являють собою водень; 4 5 6 R , R і R незалежно являють собою водень або метил; і 7 8 9 10 11 R , R , R , R і R незалежно являють собою водень, хлор, фтор, бром, метил або трифторметил; 7 11 8 9 за умови, що, коли R і R , обидва вибрані з водню або фтору, щонайменше один з R , R і 10 8 9 10 R являє собою атом галогену, або R , R і R вибирають з групи, що складається з водню і 8 9 10 CF3, і один, але не більше ніж один з R , R і R являє собою CF3. Конкретні сполуки відповідно до даного винаходу включають сполуки прикладів 1-136, як показано нижче, або їх фармацевтично прийнятні солі. Антагоністи Р2Х7 можуть бути корисні для попередження, лікування або полегшення різних болючих станів (наприклад, невропатичний біль, хронічний запальний біль або вісцеральний біль), запалення й нейродегенерації, зокрема, хвороби Альцгеймера. Антагоністи Р2Х7 також можуть являти собою корисні терапевтичні засоби при лікуванні ревматоїдного артриту і запального кишкового захворювання. Сполуки даного винаходу, що модулюють функцію Р2Х7-рецептора й здатні викликати антагонізм у відношенні впливів АТФ на Р2Х7-рецептор (антагоністи Р2Х7-рецептора), можуть 3 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути конкурентними антагоністами, зворотними агоністами, негативними алостеричними модуляторами або непрямими модуляторами функції рецептора. Визначені сполуки формули (I) у деяких випадках можуть утворювати їх адитивні солі кислот. Варто розуміти, що, для застосування в медицині, сполуки формули (I) можуть бути використані у вигляді солей, для яких солі мають бути фармацевтично прийнятними. Фармацевтично прийнятні солі включають солі, описані Berge, Bighley і Monkhouse, J. Pharm. Sci., 66, 1-19 (1977). Основні сполуки формули (I) можуть утворювати солі з фармацевтично прийнятними кислотами, включаючи неорганічні й органічні кислоти. Такі кислоти включають оцтову кислоту, бензолсульфонову кислоту, бензойну кислоту, камфорсульфонову кислоту, лимонну кислоту, етансульфонову кислоту, фумарову кислоту, глюконову кислоту, глутамінову кислоту, бромистоводневу кислоту, хлористоводневу кислоту, ізетіонову кислоту, молочну кислоту, малеїнову кислоту, яблучну кислоту, мигдальну кислоту, метансульфонову кислоту, слизову кислоту, азотну кислоту, памову кислоту, пантотенову кислоту, фосфорну кислоту, бурштинову кислоту, сірчану кислоту, винну кислоту, п-толуолсульфонову кислоту і т.п. Приклади фармацевтично прийнятних солей включають солі, утворені з малеїновою кислотою, фумаровою кислотою, бензойною кислотою, аскорбіновою кислотою, памовою кислотою, бурштиновою кислотою, хлористоводневою кислотою, сірчаною кислотою, бісметиленсаліціловою кислотою, метансульфоновою кислотою, етандисульфоновою кислотою, пропіоновою кислотою, винною кислотою, саліциловою кислотою, лимонною кислотою, глюконовою кислотою, аспарагіновою кислотою, стеариновою кислотою, пальмітиновою кислотою, ітаконовою кислотою, гліколевою кислотою, п-амінобензойною кислотою, глутаміновою кислотою, бензолсульфоновою кислотою, циклогексилсульфаміновою кислотою, фосфорною кислотою й азотною кислотою. Сполуки формули (I) можуть бути отримані в кристалічній або некристалічній формі і, якщо в кристалічній, можуть бути необов'язково сольватовані, наприклад, у вигляді гідрату. Даний винахід включає у свій обсяг стехіометричні сольвати (наприклад, гідрати), а також сполуки, що містять різні кількості розчинника (наприклад, води). Сполуки формули (I) здатні існувати в стереоізомерних формах (наприклад, діастереомери і енантіомери), і даний винахід поширюється на кожну з таких стереоізомерних форм і їх суміші, включаючи рацемати. Різні стереоізомерні форми можуть бути відділені одна від одної звичайними способами або будь-який даний ізомер може бути отриманий шляхом стереоспецифічного або асиметричного синтезу. У прикладах, де стереохімічний склад кінцевого продукту визначають хіральною ВЕРХ (більш конкретно, способами (А), (В), (С) або (D), як показано в прикладах), відповідну стереоспецифічну назву і структуру приписують кінцевому продуктові, де енантіомерний надлишок зазначеного вище продукту складає більше 70%. Призначення абсолютної стереохімії ґрунтується на відомій хіральності вихідної речовини. У прикладах, де склад кінцевого продукту не характеризується хіральною ВЕРХ, стереохімія кінцевого продукту не вказується. Однак вважають, що хіральність основного компонента отриманої суміші повинна відбивати хіральність вихідної речовини і енантіомерний надлишок залежить від використовуваного способу синтезу і, ймовірно, повинний бути подібний до способу, що визначається для аналогічного приклада (де такий приклад існує). Таким чином, вважають, що сполуки, представлені в одній хіральній формі, можуть бути отримані в альтернативній хіральній формі, використовуючи відповідну вихідну речовину. Альтернативно, якщо використовують рацемічні вихідні речовини, потрібно вважати, що повинен бути отриманий рацемічний продукт і окремі енантіомери можуть бути виділені звичайними способами. Даний винахід також включає будь-які таутомерні форми і їх суміші. В обсяг даного винаходу також включені мічені ізотопами сполуки, що ідентичні сполукам, які підпадають під формулу (I) і наступні, але при тій обставині, що один або більш атомів замінені атомом, що має атомну масу або масове число, відмінну(відмінне) від атомної маси або масового числа, що найбільш часто зустрічаються в природі. Приклади ізотопів, які можна вводити в сполуки відповідно до даного винаходу, включають ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору, йоду і хлору, такі як 3Н, 11С, 14С, 18F, 123I і 125I. Сполуки даного винаходу й фармацевтично прийнятні солі зазначених вище сполук, що містять вищевказані ізотопи і/або інші ізотопи інших атомів, входять в обсяг даного винаходу. Мічені ізотопами сполуки даного винаходу, наприклад, у які введені радіоактивні ізотопи, такі як 3Н, 14С, придатні для аналізів у відношенні розподілу в тканині лікарського засобу і/або субстрату. Мічені тритієм, тобто 3Н, і вуглецем-14, тобто 14С, ізотопи особливо бажані внаслідок легкості їхнього одержання і детектованості. Ізотопи 11С та 18F особливо придатні в РЕТ (позитронна емісійна томографія), та ізотопи 125I особливо придатні в SPECT (гаматомографія, однофотонна емісійна комп'ютерна томографія). РЕТ і SPECT придатні для 4 UA 100227 C2 5 10 15 20 25 30 35 40 отримання зображення головного мозку. Далі, заміщення більш важкими ізотопами, такими як дейтерій, тобто 2Н, може давати визначені терапевтичні переваги, що виникають від більшої метаболічної стабільності, наприклад збільшений період напіврозпаду in vivo або знижені вимоги у відношенні дозування, і, отже, може бути переважно в деяких випадках. Мічені ізотопами сполуки формули (I) і наступних, відповідно до даного винаходу, як правило, можна одержати шляхом здійснення методик синтезу, розкритих на схемах і/або в прикладах, нижче, шляхом заміни неміченого ізотопом реагенту легко доступним, міченим ізотопом, реагентом. Крім того, сполуки формули (I) можна вводити у вигляді проліків. Як використовується в даному описі, «проліки» сполуки формули (I) являють собою функціональні похідні сполуки, що після їх уведення пацієнтові, зрештою, вивільняють сполуку формули (I) in vivo. Уведення сполуки формули (I) у вигляді проліків дає можливість фахівцеві в даній галузі виконувати одне або більше з наступних: (а) модифікувати початок дії сполуки in vivo; (b) модифікувати тривалість дії сполуки in vivo; (с) модифікувати транспортування або розподіл сполуки in vivo; (d) модифікувати розчинність сполуки in vivo; і (е) переборювати або компенсувати побічний ефект або інше ускладнення, що зустрічаються при застосуванні сполуки. Типові функціональні похідні, використовувані для одержання проліків, включають модифікації сполуки, які є такими, що хімічно або ферментативно розщеплюються in vivo. Такі модифікації добре відомі фахівцеві в даній галузі. Одержання сполук Сполуки формули (I), де перемінні є такими, як описано вище, і їх солі і сольвати можна одержати шляхом методики, розкритої нижче, що складає подальший аспект даного винаходу. Спосіб одержання сполуки формули (I), відповідно до даного винаходу, включає: (а) сполучення карбонової кислоти формули (2) (або її активованої похідної) з аміном 1 2 3 4 5 6 7 8 9 10 11 формули (3) (див. схему 1), де R , R , R , R , R , R , R , R , R , R і R є такими, як описано вище. Сполуки (2) і (3) необов'язково захищені; (b) взаємодію дикарбонільної сполуки формули (4), ізоціаніду формули (5) і аміну формули (6) у придатному розчиннику, такому як метанол, і при придатній температурі, такій як 100ºС 1 2 3 4 5 7 8 9 10 11 6 (див. схему 2), де R , R , R , R , R , R , R , R , R і R є такими, як описано вище, і R являє собою водень або метил. Сполуки (4), (5) і (6) необов'язково захищені. Способи такого типу описані раніше в хімічній літературі (наприклад, H. Tye and M. Whittaker, Org. Biomol. Chem., 2, 813-815 (2004); G.C.B. Harriman, WO 9900362 А1); (с) зняття захисту зі сполуки формули (I), що захищена. Приклади захисних груп і способи їх видалення можна знайти в T.W. Greene і P.G.M. Wuts у керівництві ―Protective Groups in Organic Synthesis‖ (J. Wiley and Sons, 3-і вид., 1999); або (d) взаємоперетворення сполук формули (I) в інші сполуки формули (I). Приклади стандартних способів взаємоперетворення включають епімерізацію, окислювання, відновлення, алкілування, ароматичне заміщення, нуклеофільне заміщення, амідне сполучення і гідроліз складного ефіру. Схема 1 5 UA 100227 C2 5 10 15 20 25 30 35 40 Сполучення кислоти формули (2) і аміну формули (3) звичайно включає використання активуючих агентів, таких як гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду або нанесений на полімер карбодиімід, 1-гідроксибензотриазол (НОВТ) або 1-гідрокси-7азабензотриазол (HOAt), і, необов'язково, придатної основи, такої як третинний алкіламін (наприклад, діізопропілетиламін, N-етилморфолін, триетиламін) або піридину, у придатному розчиннику, такому як ДМФА і/або дихлорметан, і при придатній температурі, наприклад, у діапазоні від 0ºС до кімнатної температури. Альтернативно, сполучення сполук (2) і (3) можна здійснювати обробкою гексафторфосфату О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію і придатного третинного алкіламіну, такого як діізопропілетиламін, у придатному розчиннику, такому як диметилформамід, при придатній температурі, такій як кімнатна температура. Альтернативно, сполуку формули (2) можна використовувати у вигляді активованої похідної (наприклад, хлорангідрид кислоти, змішаний ангідрид, активований складний ефір (наприклад, О-ацилізосечовина)), і, у таких випадках, спосіб (а) звичайно включає обробку вказаної вище активованої похідної аміном (Ogliaruso M.A., Wolfe J.F., in The Chemistry of Functional Groups (вид. Patai S.), Suppl.B: The Chemistry of Acid Derivatives, Pt. 1 (John Wiley and Sons, 1979), сс.442-8; Beckwith A.L.J. in The Chemistry of Functional Groups (вид. Patai S.), Suppl.B: The Chemistry of Amides (вид. Zabricky J.) (John Wiley and Sons, 1970), сс.73 і наступні). Схема 2 Приклади способів одержання сполук формули (2) представлені на схемах 3-9, що наводяться нижче. Схема 3 1 2 3 4 5 6 1 2 де R , R , R , R і R є такими, як описано вище, R є H або F, і Р і Р являють собою 1 2 придатні захисні групи, такі як С1-6алкіл, або Р і Р є H. Аналогічні способи, описані нижче для перетворень, представлених на схемі 3, описані раніше в хімічній літературі (наприклад, G. Verardo, P. Geatti, E. Pol and A.G. Giumanini, Can. J. Chem., 80: 779-788 (2002); T. Godet et. al., Organic Letters (2004), 6(19), 3281-3284). Стадія (і) звичайно включає початкову обробку сполуки (7) основою, такою як гідроксид натрію, у придатному розчиннику, такому як метанол, при придатній температурі, такий як 0ºС, з наступним відновним алкілуванням, що звичайно включає послідовну обробку альдегідом або кетоном і кислотою, такою як оцтова кислота, і потім додавання відновника, такого як боргідрид натрію, при придатній температурі, такій як температура в діапазоні від 0ºС до кімнатної температури. Стадія (ii) може відбуватися мимовільно, на якій сполуку (9) безпосередньо виділяють з реакційної суміші сполуки (7), як описано на стадії (i) вище, але, як правило, сполуку (8) нагрівають при придатній температурі, такій як 110ºС, у придатному розчиннику, такому як толуол, одержуючи сполуку (9). Зняття захисту на стадії (iii) звичайно являє собою стандартну методику для перетворення 6 UA 100227 C2 ефіру карбонової кислоти в кислоту, як наприклад використання відповідного гідроксиду (наприклад, гідроксид натрію), у відповідному розчиннику, такому як метанол, при придатній температурі, такій як у діапазоні від 0ºС до кімнатної температури. Схема 4 5 10 15 20 25 1 1 30 2 3 4 5 6 1 де R , R , R , R і R є такими, як описано вище, R є H або F, L являє собою придатну групу, таку як галоген (наприклад, хлор або бром) або боронова кислота або ефір боронової 3 кислоти, і Р являє собою придатну захисну групу, таку як С1-6алкіл. Способи, аналогічні описаним нижче, для представлених на схемі 4 перетворень, описані раніше в хімічній літературі (наприклад, T. Itoh et al., Tetrahedron., 59 (2003), 3527-3536; T. Simandan і M.B. Smith, Synthetic Communications, 26(9), 1827-1838 (1996)). Стадія (i) звичайно включає обробку сполуки (10) основою, такою як гідрид натрію, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як у діапазоні від 0ºС до кімнатної температури, або, альтернативно, стадія може включати обробку сполуки (10) арилгалогенідом або арил- або алкенілбороновою кислотою (або ефіром), у придатному розчиннику, такому як толуол, у присутності придатного каталізатора, такого як суміш тріс(дибензиліденацетон)дипаладію(0) і Xantphos™ (9,9-диметил-4,5біс(дифенілфосфіно)ксантен), і придатної основи, такої як карбонат цезію, при придатній температурі, такій як 120ºС. Зняття захисту на стадії (ii) звичайно включає стандартну методику перетворення ефіру карбонової кислоти в кислоту, як наприклад використання відповідного гідроксиду (наприклад, гідроксид натрію), у відповідному розчиннику, такому як метанол, при придатній температурі, такій як у діапазоні від 0ºС до кімнатної температури; або використання відповідної кислоти (наприклад, трифтороцтова кислота), у відповідному розчиннику, такому як дихлорметан, при придатній температурі, такій як у діапазоні від 0ºС до кімнатної температури. Схема 5 2 3 4 5 6 де R , R , R , R і R є такими, як описано вище, і R є H або F. Способи, аналогічні до описаних нижче, для перетворення, представленого на схемі 5, описані раніше в хімічній літературі (наприклад, S. Aoki et al., Tetrahedron, 60 (2004), 7053-7059). Стадія (i) звичайно включає нагрівання сполуки (12) в автоклаві або герметично закритій посудині, у придатному розчиннику, такому як вода, і при придатній температурі, такій як 100140ºС, з використанням або без мікрохвильового випромінювання. 35 7 UA 100227 C2 Схема 6 1 1 5 10 15 20 25 30 35 4 2 5 2 де R , R і R є такими, як описано вище, R являє собою групу, як вказано вище, іншу, ніж 6 1 водень або галоген, R є H або F, L являє собою придатну групу, що видаляється, таку як 4 5 галоген (наприклад, хлор або бром), і Р і Р являють собою придатні захисні групи, такі як С 16алкіл і С1-6алкоксикарбоніл, відповідно. Способи, аналогічні до описаних нижче, для перетворень, представлених на схемі 6, описані раніше в хімічній літературі (наприклад, A. Bassoli et al., Eur. J. Org. Chem., 2005, 2518-2525). Стадія (i) звичайно включає захист сполуки (13) при використанні стандартних методик, як наприклад, обробка алкоксикарбонілангідридом, таким як ди-трет-бутилдикарбонат, і основою, такою як триетиламін, і каталізатора, такого як 4-диметиламінопіридин, у придатному розчиннику, такому як дихлорметан, при придатній температурі, такій як кімнатна температура. Стадія (ii) звичайно включає обробку сполуки (14) основою, такою як літійбіс(триметилсиліл)амід, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як у діапазоні від -78ºС до кімнатної температури. Стадія (iii) звичайно включає зняття захисту зі сполуки (15) при використанні стандартних 5 методик, як наприклад для випадку, коли Р являє собою трет-бутоксикарбонільну групу, обробка хлористоводневою кислотою, у придатному розчиннику, такому як діоксан, і при придатній температурі, такій як кімнатна температура. Стадія (iv) звичайно включає спосіб, описаний вище для стадій, представлених на схемі 4. Схема 7 3 4 5 6 5 6 7 де R , R , R , R і R є такими, як описано вище, і R є H або F. Р , Р і Р являють собою 5 6 7 придатні захисні групи, наприклад, Р може бути С1-6алкоксикарбонілом, і Р і Р можуть бути С16 7 1 6алкілом (Р і Р не повинні бути однаковими). L являє собою придатну групу, що видаляється, таку як галоген (наприклад, хлор або бром). Стадія (i) звичайно включає обробку сполуки (17) придатною основою, такою як гексаметилдисилазид калію, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як у діапазоні від -78ºС до кімнатної температури. Стадія (ii) звичайно включає стандартну методику для перетворення ефіру карбонової кислоти в кислоту, як наприклад обробка придатною кислотою (наприклад, трифтороцтова кислота), у відповідному розчиннику, такому як дихлорметан, при придатній температурі, такій як кімнатна температура. 8 UA 100227 C2 Схема 8 1 5 10 15 20 25 2 3 4 5 6 8 9 10 де R , R , R , R і R є такими, як описано вище, і R є H або F. Р , Р і Р являють собою 8 9 8 9 придатні захисні групи, такі як С1-6алкіл, у випадках Р і Р (Р і Р не повинні бути однаковими), і 10 групу, що походить від придатного ациклічного або циклічного кетону, для Р . Способи, аналогічні до описаних нижче для перетворень, представлених на стадіях (і)-(iii) схеми 8, описані раніше в хімічній літературі (наприклад, J. Wehbe et al., Tetrahedron: Asymmetry, 14 (2003), 1123-1126). Стадія (і) звичайно включає обробку сполуки (19) придатним кетоном, таким як (1R,2R,5R)-2гідроксипінан-3-он, і кислотою Льюіса, такою як ефірат трифториду бору, в придатному розчиннику, такому як толуол, при придатній температурі, такій як 110ºС. Стадія (ii) звичайно включає обробку сполуки (20) реактивом Гріньяра, таким як метилмагнійбромід, і основою, такою як 1,8-діазабіцикло[5.4.0]ундец-7-ен, з наступною обробкою ненасиченого складного ефіру (21), такого як етилкротонат, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як -30ºС. Стадія (iii) звичайно включає стандартну методику для перетворення іміну в амін, таку як обробка придатною кислотою (наприклад, 15%-вий водний розчин лимонної кислоти), у відповідному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як кімнатна температура. Стадія (iv) звичайно включає нагрівання сполуки (23) у придатному розчиннику, такому як толуол, при придатній температурі, такій як у діапазоні від кімнатної температури до 120ºС. Стадія (v) звичайно включає спосіб, описаний вище для стадій, представлених на схемі 4. Схема 9 1 4 5 6 2 3 де R , R , R і R є такими, як описано вище, R і R , кожний, являють собою групу, як 1 2 зазначену вище, іншу, ніж галоген, L і L являють собою придатні групи, що видаляються, такі 9 UA 100227 C2 11 5 10 15 20 25 30 35 40 45 50 55 60 як галоген (наприклад, хлор або бром), і Р являє собою придатну захисну групу, таку як тритил. Стадія (і) звичайно включає обробку сполуки (25) основою, такою як гідрид натрію, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як диметилформамід, при придатній температурі, такій як у діапазоні від 0ºС до кімнатної температури. Стадія (ii) звичайно включає обробку сполуки (26) основою, такою як літійдіізопропіламід, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як у діапазоні від -78ºС до кімнатної температури. Стадія (iii) звичайно включає обробку сполуки (27) основою, такою як діізопропіламід літію, і алкілувальним агентом, таким як алкілгалогенід, у придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як у діапазоні від -78ºС до кімнатної температури. Стадія (iv) звичайно включає стандартну методику для зняття захисту зі спирту. Наприклад, 11 коли Р являє собою тритил, проводять обробку сполуки (28) придатною кислотою, такою як ® Amberlyst 15 , у придатному розчиннику, такому як метанол, і при придатній температурі, такій як кімнатна температура. Стадія (v) звичайно включає стандартну методику для окислювання спирту у відповідну карбонову кислоту, як наприклад обробка спирту (29) окислювачем, таким як комбінація хлориту натрію, ТЕМРО (вільний 2,2,6,6-тетраметил-1-піперидинілокси радикал) і відбілювача (розчин гіпохлориту натрію), у придатному розчиннику, такому як суміш буферного водного розчину одноосновного фосфату натрію й ацетонітрилу, при придатній температурі, такій як 40ºС. 2 Стадією (ii) або стадією (iii) можна знехтувати, як необхідною для одержання сполук, де R є 3 H або R є H, відповідно. Сполуки загальної формули (3), (4), (5), (6), (7), (10), (12), (13), (17), (19), (21) і (25) звичайно або доступні з комерційних джерел, або можуть бути отримані фахівцем у даній галузі, використовуючи способи, описані у хімічній літературі (або використовуючи аналогічні способи). Де доречно, фармацевтично прийнятні солі можуть бути отримані звичайно шляхом взаємодії з відповідною кислотою або похідним кислоти. Клінічні показання Вважають, що, оскільки сполуки даного винаходу модулюють функцію Р2Х7-рецептора і здатні викликати антагонізм у відношенні впливів АТФ на Р2Х7-рецептор, вони можуть бути корисні при лікуванні болю, включаючи гострий біль, хронічний біль, хронічний суглобний біль, кістково-м'язовий біль, невропатичний біль, запальний біль, вісцеральний біль, пов'язаний з раковимзахворюванням біль, пов'язаний з мігренню біль, головний біль унаслідок тиску і мігрені, пов'язаний з функціональними кишковими розладами біль, задньонижній і шийний біль, пов'язаний з розтяганнями і навантаженнями біль, що зберігається у відношенні симпатичної нервової системи біль; міозит, біль, пов'язаний з (епідемічним) грипом або іншими вірусними інфекціями, такими, як нежить, пов'язаний з ревматичною атакою біль, пов'язаний з міокардіальною ішемією біль, післяопераційний біль, ракову хіміотерапію, цефалгію, зубний біль і дисменорею. Стани хронічного суглобного болю включають ревматоїдний артрит, остеоартрит, ревматоїдний спондиліт, подагричний артрит і ювенільний артрит. Пов'язаний з функціональними кишковими розладами біль включає невиразкову диспепсію, екстракардіальний грудний біль і синдром подразненої товстої кишки. Невропатичні больові синдроми включають: діабетичну невропатію, ішіалгію, неспецифічний задньонижній біль, тригемінальну невралгію, пов'язаний з розсіяним склерозом біль, фіброміалгію, пов'язану з ВІЛ невропатію, постгерпетичну невралгію, тригемінальну невралгію і біль, що виникає внаслідок фізичної травми, ампутації, фантомного синдрому, спиномозкової хірургії, раку, токсинів або хронічних запальних станів. Крім того, невропатичні болючі стани включають біль, пов'язаний зі звичайно неболючими відчуттями, як, наприклад, «поколювання і пунктування» (параестезія і дизестезія), підвищеною чутливістю до дотику (гіперестезія), болючим сприйняттям після нешкідливої стимуляції (динамічна, статична, термічна або холодова алодинія), підвищеною чутливістю до шкідливих стимулів (термічна, холодова, механічна гіпералгезія), що продовжується болючим відчуттям після припинення стимуляції (гіперпатія) або у випадку відсутності або дефіциту селективних сенсорних провідних шляхів (гіпоалгезія). Інші стани, які потенційно можна лікувати за допомогою сполук даного винаходу, включають лихоманку, запалення, імунологічні захворювання, пов'язані з анормальною тромбоцитною 10 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 60 функцією захворювання (наприклад, обтурувальні васкулярні захворювання), імпотенцію або еректильну дисфункцію; кісткове захворювання, що характеризується анормальним кістковим метаболізмом або резорбцією, гемодинамічні побічні ефекти нестероїдних протизапальних лікарських засобів (NSAID) та інгібіторів циклооксигенази-2 (СОХ-2), серцево-судинні захворювання; нейродегенеративні захворювання і нейродегенерацію, нейродегенерацію після травми, шум у вухах, залежність від засобу, що викликає залежність, такого як опиоїди (наприклад, морфін), депресанти центральної нервової системи (наприклад, етанол), психостимулятори (наприклад, кокаїн) і нікотин; ускладнення внаслідок діабету типу 1, ниркову дисфункцію, печінкову дисфункцію (наприклад, гепатит, цироз), шлунково-кишкову дисфункцію (наприклад, діарея), рак ободової кишки, підвищену активність сечового міхура і спонукальне нетримання. Депресію й алкоголізм потенційно також можна лікувати за допомогою сполук даного винаходу. Запалення й запальні стани, пов'язані із зазначеним вище запаленням, включають стани шкіри (наприклад, сонячна еритема, опіки, екзема, дерматит, алергійний дерматит, псоріаз), менінгіт, очні захворювання, такі як глаукома, ретиніт, ретинопатії, увеїти і гостра травма очної тканини (наприклад, кон’юнктивіт), запальні легеневі порушення (наприклад, астма, бронхіт, емфізема, алергійний риніт, респіраторний дистрес-синдром, хвороба любителів птахів, екзогенний алергійний альвеоліт, хронічне обструктивне захворювання легень (СОРD), гіперчутливість дихальних шляхів); розлади шлунково-кишкового тракту (наприклад, афтозна виразка, хвороба Крона, атопічний гастрит, варіоліформа гастриту, виразковий коліт, глютенова ентеропатія, регіональний ілеїт, синдром подразненої товстої кишки, запальне кишкове захворювання, шлунково-кишковий рефлюкс); трансплантацію органів та інші стани із запальним компонентом, такі як васкулярне захворювання, мігрень, вузликовий періартеріїт, тиреоїдит, гіпопластична анемія, хвороба Ходжкіна, склеродермія, важка міастенія, розсіяний склероз, соркоїдоз, нефротичний синдром, синдром Бехчета, гінгівіт, міокардіальна ішемія, гіпертермія, системний червоний вовчак, поліміозит, тендиніт, бурсит і синдром Шегрена. Імунологічні захворювання включають аутоімунні захворювання, імунологічні хвороби, викликувані недостатністю факторів харчування, або трансплантацію органів. Кісткові захворювання, що характеризуються анормальним кістковим метаболізмом або резорбцією, включають остеопороз (головним чином, постклімактеричний остеопороз), гіперкальціємію, гіперпаратиреоїдизм, кісткові хвороби Педжета, остеоліз, злоякісну гіперкальціємію з кістковими метастазами або без них, ревматоїдний артрит, періодонтит, остеоартрит, остеалгію, остеопенію, карциномну кахексію, калькульоз, літіаз (особливо уролітіаз), солідну карциному, подагричний і анкілозуючий спондилоартрит, тендиніт і бурсит. Серцево-судинні захворювання включають гіпертензію або міокардіальну ішемію; атеросклероз; функціональну або органічну венозну недостатність; варикозну терапію; гемороїдальні вузли; і шокові стани, пов'язані з помітним зниженням артеріального тиску (наприклад, септичний шок). Нейродегенеративні захворювання включають деменцію, особливо дегенеративну деменцію (включаючи старечу деменцію, деменцію з тільцями Леві, хворобу Альцгеймера, хворобу Піка, хорею Гентингтона, хворобу Паркінсона і хворобу Крейтцфельда-Якоба, бічний аміотрофічний склероз (ALS) і мотонейронне захворювання); судинну деменцію (включаючи багатоінфарктну деменцію); а також деменцію, пов'язану з патологічними змінами, що «окупують» інтракраніальний простір; травму; інфекції і родинні стани (включаючи ВІЛ-інфекцію, менінгіт і оперізуючі лишаї); метаболізм; токсини; гіпоксію і вітамінну недостатність; і легке когнітивне погіршення, пов'язане зі старінням, особливо пов'язане з віком погіршення пам'яті. Сполуки формули (I) також можуть бути придатні для нейрозахисту і при лікуванні нейродегенерації після травми, як, наприклад, інсульт, раптова зупинка серця, обхідний анастомоз легені, черепно-мозкова травма, спиномозкова травма і т.п. Сполуки даного винаходу також можуть бути корисні при лікуванні у відношенні розвитку злоякісних клітин і/або метастазування і гранулярного лейкозу. Ускладнення у випадку діабету типу 1 включають діабетичну мікроангіопатію, діабетичну ретинопатію, діабетичну нефропатію, дегенерацію жовтої плями, глаукому, нефротичний синдром, гіпопластичну анемію, увеїт, хворобу Кавасакі та саркоїдоз. Ниркова дисфункція включає нефрит, гломерулонефрит, особливо мезангіальний проліферативний гломерулонефрит, і нирковий синдром. Варто розуміти, що посилання на лікування включає як лікування встановлених симптомів, так і профілактичну обробку, якщо не зазначене інше. Відповідно до подальшого аспекту даного винаходу, представлена сполука формули (I) або її фармацевтично прийнятна сіль для застосування в медицині або ветеринарії. 11 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно до ще одного аспекту даного винаходу, представлена сполука формули (I) або її фармацевтично прийнятна сіль для застосування при лікуванні стану, що опосередковується Р2Х7-рецепторами. Відповідно до наступного аспекту даного винаходу, представлений спосіб лікування людини або тварини, що страждає від стану, опосередковуваного Р2Х7-рецепторами, який включає введення зазначеному вище суб'єктові ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Відповідно до іншого аспекту даного винаходу, представлений спосіб лікування людини або тварини, що страждає від болю, запалення або нейродегенеративного захворювання, який включає введення зазначеному вище суб'єктові ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно до ще одного іншого аспекту даного винаходу, представлений спосіб лікування людини або тварини, що страждає від запального болю, невропатичного болю або вісцерального болю, що включає введення зазначеному вище суб'єктові ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Відповідно до подальшого аспекту даного винаходу, представлений спосіб лікування суб'єкта, наприклад, людини, що страждає від хвороби Альцгеймера, що включає введення зазначеному вище суб'єктові ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно до ще одного аспекту даного винаходу, представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування стану, опосередковуваного впливом Р2Х7-рецепторів. Згідно до ще одного аспекту даного винаходу, представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування або запобігання болю, запалення або нейродегенеративного захворювання. Згідно до ще одного аспекту даного винаходу, представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування або запобігання запального болю, невропатичного болю або вісцерального болю. Відповідно до одного аспекту даного винаходу, представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування або запобігання хвороби Альцгеймера. Для застосування сполуки формули (I) або її фармацевтично прийнятної солі для лікування людей та інших ссавців, її звичайно використовують для одержання готового лікарського препарату у відповідності зі стандартною фармацевтичною практикою у вигляді фармацевтичної композиції. Тому, згідно до ще одного аспекту даного винаходу, представлена фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, адаптована для застосування в медицині або ветеринарії. Для застосування сполук формули (I) у терапії, їх звичайно використовують для одержання готового лікарського препарату у вигляді фармацевтичної композиції у відповідності зі стандартною фармацевтичною практикою. Даний винахід також відноситься до фармацевтичної композиції, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, і необов'язково фармацевтично прийнятний носій. Фармацевтична композиція відповідно до винаходу, яка може бути отримана шляхом змішування, придатним чином, при кімнатній температурі й атмосферному тиску, звичайно адаптується для перорального, парентерального або ректального введення і, як така, може бути у формі таблеток, капсул, пероральних рідких препаратів, порошків, гранул, коржів, здатних до відновлення порошків, ін’єктованих або таких, що вводять шляхом інфузії, розчинів або суспензій або супозиторіїв. Звичайно кращі композиції, що вводяться перорально. Таблетки і капсули для перорального введення можуть бути в одиничній дозованій формі і можуть містити звичайні ексципієнти, такі як зв'язувальні речовини, наповнювачі, лубриканти для таблетування, дезінтегратори і прийнятні змочувачі. На таблетки можуть бути нанесені покриття у відповідності зі способами, добре відомими в звичайній фармацевтичній практиці. Пероральні рідкі препарати можуть бути у формі, наприклад, водної або масляної суспензії, розчинів, емульсій, сиропів або еліксирів, або можуть бути у формі сухого продукту для реконструювання перед застосуванням за допомогою води або іншого придатного середовища. Такі рідкі препарати можуть містити звичайні добавки, такі як суспендуючі агенти, емульгатори, неводні середовища (які можуть включати харчові олії), консерванти і, якщо бажано, звичайні ароматизатори або барвники. Для парентерального введення, рідкі одиничні дозовані форми одержують, використовуючи сполуку відповідно до винаходу або її фармацевтично прийнятну сіль і стерильне середовище. 12 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 Сполука, залежно від використовуваного середовища і концентрації, може бути або суспендирована, або розчинена в середовищі. Для готування розчинів, сполука може бути розчинена для ін'єкції і стерилізована фільтруванням перед заповненням у придатний флакон або ампулу і запаюванням. Переважно, ад’юванти, такі як локальний анестетик, консерванти і буферизуючі агенти, розчиняють у середовищі. Для підвищення стабільності, композиція може бути заморожена після заповнення в ампулу і вода вилучена у вакуумі. Парентеральні суспензії одержують власне кажучи в такий же спосіб, за винятком того, що сполуку суспендують у середовищі замість розчинення і стерилізація не може бути здійснена фільтруванням. Сполука може бути стерилізована шляхом впливу етиленоксиду перед суспендуванням у стерильному середовищі. Переважно, поверхнево-активну речовину або змочувач включають у композицію для полегшення однорідного розподілу сполуки. Композиція може містити від 0,1 мас. % до 99 мас. %, переважно, від 10 мас. % до 60 мас. % активного інгредієнта залежно від способу введення. Дозу сполуки, використовуваної при лікуванні зазначених вище порушень, можна змінювати звичайним шляхом залежно від небезпеки порушень, маси пацієнта, що потерпає від страждання, та інших подібних факторів. Однак як загальна вказівка, разові дози можуть складати від 0,05 мг до 1000 мг, більш переважно, від 0,05 мг до 200 мг, наприклад, від 20 мг до 40 мг; і такі разові дози переважно повинні бути введені один раз на добу, хоча може бути потрібним введення більш ніж один раз у добу; і така терапія може продовжуватися протягом деякої кількості тижнів або місяців. Усі публікації, включаючи, але без обмеження, патенти і заявки на патент, цитовані в дійсному описі, включені в даний опис за допомогою посилання, як якщо б кожна індивідуальна публікація конкретно й індивідуально була включена в даний опис цілком. Наступні описи і приклади ілюструють одержання сполук даного винаходу, але не мається на увазі, що вони обмежують обсяг даного винаходу. Приклади Загальні способи (а)-(d), разом зі способами синтезу, представленими вище на схемах 1-9, для одержання сполук даного винаходу проілюстровані далі за допомогою наступних прикладів. Приклад 1 N-[(2-Хлор-4-фторфеніл)метил]-5-оксо-1-(фенілметил)пролінамід (Е1) 5-Оксо-1-(фенілметил)пролін (0,176 г, 0,80 ммоль, отриманий, як описано нижче) розчиняють у дихлорметані (3 мл) і до отриманого розчину додають 1-гідроксибензотриазол (0,119 г, 0,88 ммоль), триетиламін (0,113 мл, 0,81 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,134 г, 0,84 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,169 г, 0,88 ммоль) в атмосфері аргону. Суміш перемішують при кімнатній температурі протягом ночі. Суміш розбавляють дихлорметаном і послідовно промивають 2М водним розчином хлористого водню й насиченим водним розчином гідрокарбонату натрію. Органічний шар фільтрують через фазовий роздільник і потім випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4фторфеніл)метил]-5-оксо-1-(фенілметил)пролінамід (0,112 г), у вигляді білої твердої речовини. + РХ/МС (рідинна хроматографія/мас-спектрометрія) [М+Н] =361,2, час утримування=2,55 хв. 5-Оксо-1-(фенілметил)пролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Гідрохлорид диметил-L-глутамату (0,500 г, 2,37 ммоль) розчиняють у метанолі (10 мл) і охолоджують до температури 0ºС. Суміш потім обробляють гідроксидом натрію (0,099 г, 2,49 ммоль), потім оцтовою кислотою (0,136 мл, 2,37 ммоль) і бензальдегідом (0,361 мл, 3,55 ммоль). Після перемішування протягом 10 хвилин при температурі 0ºС додають боргідрид натрію (0,088 г, 2,37 ммоль), суміш залишають нагріватися до кімнатної температури і перемішують протягом ночі. Суміш знову охолоджують до температури 0ºС і потім обробляють додатковою кількістю боргідриду натрію (0,044 г, 1,18 ммоль). Суміш знову залишають нагріватися до кімнатної температури і перемішують протягом ночі. Метанол випарюють, одержуючи залишок, який обробляють етилацетатом і фільтрують. Фільтрат потім промивають насиченим водним розчином гідрокарбонату натрію, фільтрують через фазовий роздільник (при 13 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 перемішуванні) і випарюють, одержуючи прозоре масло (0,56 г). Масло розчиняють у метанолі і нагрівають у герметично закритій пробірці в мікрохвильовому реакторі протягом 10 хвилин при температурі 120ºС і потім протягом 15 хвилин при температурі 140ºС (РХ/МС показує, що ця фаза нагрівання істотно не змінює склад суміші). Розчинник випарюють і залишок очищають колонковою флеш-хроматографією на силікагелі, елююючи градієнтом 15-20% етилацетату в гексані, з одержанням чистого метил-5-оксо-1-(фенілметил)пролінату (0,212 г) у вигляді прозорого масла. + РХ/МС [М+Н] =234, час утримування=2,15 хв. (ii) Метил-5-оксо-1-(фенілметил)пролінат (0,212 г, 0,91 ммоль) розчиняють у воді (3 мл) і метанолі (0,5 мл) і обробляють 2М водним розчином гідроксиду натрію (0,682 мл, 1,36 ммоль). Суміш перемішують протягом ночі при кімнатній температурі і потім промивають дихлорметаном. Водний шар випарюють і залишок обробляють надлишком 1М розчину хлористого водню в діетиловому ефірі (~5 мл). Суміш випарюють ще раз і залишок розтирають у дихлорметані. Твердий продукт видаляють і об'єднані дихлорметанові фракції випарюють, одержуючи 5-оксо-1-(фенілметил)пролін (0,182 г) у вигляді жовтого масла, яке використовують без подальшого очищення. + РХ/МС [М+Н] =220, час утримування=1,72 хв. Приклад 2 N-[(2-Хлор-4-фторфеніл)метил]-1-(1-метилетил)-5-оксопролінамід (Е2) 1-(1-Метилетил)-5-оксопролін (0,060 г, 0,35 ммоль, отриманий, як описано нижче) розчиняють у дихлорметані (3 мл) і диметилформаміді (1 мл) і до отриманого розчину додають 1-гідроксибензотриазол (0,052 г, 0,39 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,061 г, 0,39 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,074 г, 0,39 ммоль) в атмосфері аргону. Отриману суміш перемішують при кімнатній температурі протягом ночі. Суміш розбавляють дихлорметаном і послідовно промивають 2М водним розчином хлористого водню і насиченим водним розчином гідрокарбонату натрію. Органічний шар фільтрують через фазовий роздільник і потім випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4фторфеніл)метил]-1-(1-метилетил)-5-оксопролінамід (0,032 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =313,1, час утримування=2,26 хв. 1-(1-Метилетил)-5-оксопролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Гідрохлорид диметил-L-глутамату (0,500 г, 2,37 ммоль) розчиняють у метанолі (4 мл) і тетрагідрофурані (8 мл) і суміш потім обробляють здрібненим гідроксидом натрію (0,099 г, 2,49 ммоль) протягом 10 хвилин. На даній стадії до суміші додають оцтову кислоту (0,136 мл, 2,37 ммоль) і ацетон (0,261 мл, 3,55 ммоль), разом, у вигляді розчину в тетрагідрофурані (1 мл). Після перемішування протягом 10 хвилин суміш охолоджують до температури 0ºС і обробляють гранулами боргідриду натрію (0,088 г, 2,37 ммоль). Суміш потім залишають нагріватися до кімнатної температури і перемішують протягом ночі. Метанол випарюють, одержуючи залишок, який обробляють етилацетатом і фільтрують. Фільтрат потім промивають насиченим водним розчином гідрокарбонату натрію, фільтрують через фазовий роздільник (при перемішуванні) і випарюють, одержуючи прозоре масло (0,217 г). Отримане масло очищають колонковою флешхроматографією на силікагелі, одержуючи чистий диметил-N-(1-метилетил)глутамат (0,200 г). (ii) Диметил-N-(1-метилетил)глутамат (0,200 г) розчиняють у метанолі і нагрівають у герметично закритій пробірці в мікрохвильовому реакторі при температурі 140ºС протягом 20 хвилин. Тонкошарова хроматографія показує, що вихідна речовина залишається такою, що не прореагувала, тому розчинник випарюють і заміняють толуолом. Суміш кип'ятять зі зворотним холодильником протягом ~3 годин і потім випарюють, одержуючи метил-1-(1-метилетил)-5оксопролінат (0,152 г) у вигляді ясно-жовтого масла, яке використовують на наступній стадії без подальшого очищення. (iii) Метил-1-(1-метилетил)-5-оксопролінат (0,152 г, 0,82 ммоль) розчиняють у воді (3 мл) і метанолі (0,5 мл) і обробляють 2М водним розчином гідроксиду натрію (0,682 мл, 1,36 ммоль). Отриману суміш перемішують протягом ~4 годин при кімнатній температурі і потім промивають дихлорметаном. Водний шар випарюють і залишок обробляють надлишком 1М розчину 14 UA 100227 C2 5 10 15 20 25 30 35 40 45 хлористого водню в діетиловому ефірі (~5 мл). Суміш випарюють ще раз і залишок розтирають у дихлорметані. Твердий продукт видаляють і об'єднані дихлорметанові фракції випарюють, одержуючи 1-(1-метилетил)-5-оксопролін (0,060 г) у вигляді жовтого масла, яке кристалізується при стоянні. Приклад 3 N-[(2-Хлор-4-фторфеніл)метил]-1-етил-5-оксопролінамід (Е3) Метил-1-етил-5-оксопролінат (0,135 г, 0,79 ммоль, отриманий, як описано нижче) розчиняють у метанолі (4 мл) і обробляють 2М водним розчином гідроксиду натрію (0,592 мл, 1,18 ммоль). Суміш перемішують протягом ~4 годин при кімнатній температурі і потім випарюють, одержуючи залишок, який потім обробляють надлишком 1М розчину хлористого водню в діетиловому ефірі (~5 мл) протягом 10 хвилин. Суміш випарюють ще раз, залишок розчиняють у дихлорметані (4 мл) і диметилформаміді (2 мл) і фільтрують для видалення твердих речовин. Отриманий розчин переносять у реакційну пробірку і потім додають 1гідроксибензотриазол (0,117 г, 0,87 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,138 г, 0,87 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,167 г, 0,87 ммоль). Суміш продувають аргоном і потім перемішують при кімнатній температурі протягом вихідних. Суміш потім розбавляють дихлорметаном і послідовно промивають 2М водним розчином хлористого водню і насиченим водним розчином гідрокарбонату натрію. Органічний шар фільтрують через фазовий роздільник і потім випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксопролінамід (0,086 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =299,1, час утримування=2,13 хв. Енантіомерний надлишок=100,0%, як визначено хіральною хроматографією, спосіб В, яка показує N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксо-L-пролінамід, час утримування=8,05 хв. Метил-1-етил-5-оксопролінат, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Гідрохлорид диметил-L-глутамату (0,500 г, 2,37 ммоль) розчиняють в метанолі (4 мл) і тетрагідрофурані (8 мл) і суміш потім обробляють здрібненим гідроксидом натрію (0,099 г, 2,49 ммоль) протягом 10 хвилин. На даній стадії до суміші додають оцтову кислоту (0,136 мл, 2,37 ммоль) і ацетальдегід (0,199 мл, 3,55 ммоль), разом, у вигляді розчину в тетрагідрофурані (1 мл). Після перемішування протягом 10 хвилин суміш охолоджують до температури 0ºС і обробляють гранулами боргідриду натрію (0,088 г, 2,37 ммоль). Отриману суміш потім залишають нагріватися до кімнатної температури. Коли суміш досягає кімнатної температури, її розбавляють етилацетатом (30 мл) і промивають насиченим водним розчином гідрокарбонату натрію, фільтрують через фазовий роздільник (при перемішуванні) і випарюють, одержуючи маслянистий залишок. Масло розчиняють у толуолі і кип'ятять зі зворотним холодильником протягом 4 годин. По досягненні завершення реакції, суміш потім кип'ятять зі зворотним холодильником протягом ночі. Розчинник потім випарюють і отриманий залишок очищають колонковою флеш-хроматографією на силікагелі, елююючи градієнтом 30-50% етилацетату в гексані, з одержанням неочищеного метил-1-етил-5-оксопролінату (0,135 г) у вигляді прозорого масла, яке використовують без подальшого очищення. Приклади 4-8 За методикою, аналогічною до описаної вище для прикладу 3, сполуки, зведені в наведену нижче таблицю (таблиця 1), одержують шляхом заміни відповідним альдегідом (або кетоном) ацетальдегіду, використовуваного в наведеній вище методиці. Всі альдегіди і кетони, використовувані для одержання сполук, зазначених у таблиці 1, доступні з комерційних джерел або їх можна одержати, використовуючи способи, описані раніше в хімічній літературі. 50 15 UA 100227 C2 Таблиця 1 Приклад № Хімічна назва [М+Н] Е4 + Час утримування (хв) 313,1 2,30 327,1 2,46 339,1 2,47 325 2,37 327 2,43 N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1пропілпролінамід Е5 N-[(2-хлор-4-фторфеніл)метил]-1-(2-метилпропіл)5-оксопролінамід Е6 N-[(2-хлор-4-фторфеніл)метил]-1-циклопентил-5оксопролінамід Е7 N-[(2-хлор-4-фторфеніл)метил]-1-циклобутил-5оксопролінамід Е8 N-[(2-хлор-4-фторфеніл)метил]-1-(1-метилпропіл)5-оксопролінамід Приклад 9 N-[(2-Хлор-4-фторфеніл)метил]-5-оксо-1-фенілпролінамід (Е9) 5 10 15 5-Оксо-1-фенілпролін (0,047 г, 0,23 ммоль, отриманий, як описано нижче) розчиняють у дихлорметані (~2 мл) і диметилформаміді (1 мл) і до отриманого розчину додають 1гідроксибензотриазол (0,034 г, 0,25 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,040 г, 0,25 ммоль), N-етилморфолін (0,032 мл, 0,25 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'етилкарбодиіміду (0,048 г, 0,25 ммоль). Суміш перемішують при кімнатній температурі протягом 4,5 годин. Суміш розбавляють ще дихлорметаном і послідовно промивають 2М водним розчином хлористого водню і насиченим водним розчином гідрокарбонату натрію. Органічний шар фільтрують через фазовий роздільник і потім випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4-фторфеніл)метил]-5-оксо-1-фенілпролінамід (0,032 г) у вигляді білої твердої речовини. 16 UA 100227 C2 + 5 10 15 20 25 30 35 40 45 50 55 РХ/МС [М+Н] =347,1, час утримування=2,51 хв. 5-Оксо-1-фенілпролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Метил-5-оксо-L-пролінат (0,204 мл, 1,75 ммоль) розчиняють у толуолі (5 мл) і обробляють трис(дибензиліденацетон)дипаладієм(0) (0,024 г, 0,03 ммоль), бромбензолом (0,184 мл, 1,75 ммоль), карбонатом цезію (0,795 г, 2,45 ммоль) і Xantphos™ (0,040 г, 0,07 ммоль). Отриману суміш нагрівають при температурі 120ºС протягом ~18 годин і потім залишають охолоджуватися до кімнатної температури. Суміш розбавляють етилацетатом і послідовно промивають 2М водним розчином хлористого водню, насиченим водним розчином гідрокарбонату натрію і насиченим розчином солі. Фільтрують через фазовий роздільник, потім випарюють, одержуючи жовто-коричневе масло (~0,200 г). Неочищений продукт очищають автоматизованою маснаправленою ВЕРХ, одержуючи чистий метил-5-оксо-1-фенілпролінат (0,054 г) у вигляді масла, яке кристалізується при стоянні. + РХ/МС [М+Н] =220, час утримування=2,03 хв. (ii) Метил-5-оксо-1-фенілпролінат (0,054 г, 0,25 ммоль) поєднують з 2М водним розчином гідроксиду натрію (0,160 мл, 0,32 ммоль) у метанолі (1 мл) і перемішують протягом ночі при кімнатній температурі. Розчинник потім випарюють і залишок обробляють етилацетатом і промивають 2М водним розчином хлористого водню. Водний шар відокремлюють, ще двічі промивають етилацетатом і потім об'єднані етилацетатні шари сушать, використовуючи фазовий роздільник, і випарюють, одержуючи 5-оксо-1-фенілпролін (0,047 г) у вигляді прозорого масла. Приклад 10 N-[(2,4-Дихлорфеніл)метил]-1-метил-5-оксопролінамід (Е10) 1-Метил-5-оксопролін (0,057 г, 0,4 ммоль, отриманий, як описано нижче) розчиняють у безводному дихлорметані (6 мл) і до отриманого розчину додають 1-гідроксибензотриазол (0,060 г, 0,4 ммоль), [(2,4-дихлорфеніл)метил]амін (0,055 мл, 0,4 ммоль), діізопропіламін (0,140 мл, 0,8 ммоль) і гексафторфосфат О-(7-азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію (0,152 г, 0,4 ммоль). Суміш перемішують при кімнатній температурі (20ºС) в атмосфері аргону протягом 3 годин і потім протягом ночі. Суміш розбавляють ще дихлорметаном (25 мл) і послідовно промивають 2М водним розчином хлористого водню (20 мл), насиченим водним розчином гідрокарбонату натрію (20 мл), 10%-вим водним розчином карбонату натрію (20 мл) і насиченим розчином солі (20 мл). Органічний шар фільтрують через гідрофобну фриту і потім випарюють, одержуючи неочищений продукт. Неочищений продукт розчиняють у суміші диметилсульфоксиду (0,9 мл) і ацетонітрилу (0,9 мл) і потім очищають автоматизованою маснаправленою ВЕРХ, одержуючи чистий N-[(2,4-дихлорфеніл)метил]-1-метил-5-оксопролінамід (0,085 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =301, час утримування=2,16 хв. 1-Метил-5-оксопролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) N-Метил-L-глутамінову кислоту (0,500 г, 3,1 ммоль) розчиняють у воді (1 мл) і нагрівають у герметично закритій пробірці при температурі 140ºС протягом 30 хвилин у мікрохвильовому реакторі. Воду потім випарюють і залишок розтирають у діетиловому ефірі, одержуючи, після сушіння, 1-метил-5-оксопролін (0,298 г) у вигляді білої твердої речовини. N-[(2,4-Дихлорфеніл)метил]-1-метил-5-оксопролінамід також може бути отриманий, як описано нижче: 1-Метил-5-оксопролін (36,79 г, 0,257 моль, отриманий, як описано вище) суспендують у DCM (дихлорметан) (500 мл). Додають EEDQ (2-етокси-1-етоксикарбоніл-1,2-дигідрохінолін, 66,7 г, 0,27 моль, 1,05 екв.) у вигляді однієї порції. Уся сукупність речовин здається розчиненою, утворюючи непрозору суміш, і температуру знижують з 21ºС до 10ºС. Отриману суміш перемішують протягом 20 хвилин в атмосфері аргону і потім по краплинах додають розчин 2,4дихлорбензиламіну (36 мл, 0,27 моль, 1,05 екв.) у DCM (100 мл) протягом 40 хвилин. Під час додавання в краплинній лійці утворюється білий осад. Суміш помірно кипить, і використовують баню лід/вода для підтримування температури 15-20ºС. Після завершення додавання аміну краплинну лійку потім ополіскують DCM (50 мл) для змивання цілком осаду в реакційну суміш. Суміш потім залишають нагріватися до кімнатної температури і перемішують протягом 17 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 приблизно 18 годин. До суміші додають насичений водний розчин гідрокарбонату натрію (200 мл) і перемішують протягом 5 хвилин. Органічний шар потім відокремлюють і промивають 2н розчином НСl (3250 мл). Під час промивань кислотою в органічному шарі починають утворюватися кристали, тому його потім розбавляють DCM (200 мл). Органічний шар сушать, пропускаючи через гідрофобну фриту, і потім концентрують у вакуумі, одержуючи 65 г рожевих твердих речовин. Тверді речовини утворюють великі шматки, тому неочищений продукт розмелюють товкачиком в ступці. Потім отримані тверді речовини розтирають у діетиловому ефірі (400 мл), тверді речовини відфільтровують і потім промивають Et2O (2200 мл). Потім після сушіння одержують 52,96 г блідо-рожевих твердих речовин. Тверді речовини поєднують із двома іншими порціями, отриманими таким же шляхом (всього 141,42 г), потім суспендують у етанолі (430 мл) і воді (715 мл) і поступово нагрівають до температури 65ºС (температура розчинення). Суміш дає майже прозорий розчин (насичений рожевий колір), за винятком дуже тонкої суспензії твердої речовини. Після нагрівання при температурі 65ºС протягом 20 хвилин колбу знімають з нагрівача і залишають доходити до кімнатної температури протягом ночі. Після цього часу, з розчину осаджуються голчасті білі кристали. Суміш охолоджують на крижаній бані протягом 20 хвилин, для осадження усіх твердих речовин. Білі тверді речовини потім відфільтровують з рожевого розчину і промивають порціями суміші (3:5) EtOH/Н 2О (2400 мл), яку охолоджують на крижаній бані. Тверді речовини сушать у вакуумній сушильній шафі (температура 40ºС) протягом, загалом, 5 діб, одержуючи чистий N-[(2,4-дихлорфеніл)метил]-1метил-5-оксопролінамід (125,37 г) у вигляді безбарвних кристалів. + РХ/МС [М+Н] =301, час утримування=2,34 хв. 1 H ЯМР (CDCl3, 500 MГц) δ 2,01 (м, 1H), 2,34 (м, 1H), 2,37 (м, 1H), 2,46 (м, 1H), 2,80 (з, 3H), 3,99 (дд, 1H, J=9,1, 4,2 Гц), 4,49 (дд, 1H, J=14,9, 5,9 Гц), 4,55 (дд, 1H, J=14,8, 6,1 Гц), 6,56 (шир.т, 13 1H, J=5,7 Гц), 7,24 (дд, 1H, J=8,2, 2,1 Гц), 7,33 (д, 1H, J=8,2 Гц), 7,40 (д, 1H, J=2,1 Гц); С-ЯМР, δ: 175,9, 171,3, 134,5, 134,3, 133,7, 131,5, 129,6, 127,5, 63,8, 41,2, 29,4, 29,2, 23,4. Енантіомерний надлишок=99,5%, як визначено хіральною хроматографією, спосіб А, яка показує N-{[2-хлор-3-(трифторметил)феніл]метил}-1-метил-5-оксо-L-пролінамід; час утримування=9,89 хв; [α]D=-2,1º (с=1, МеОН), температура=29,3ºС, довжина хвилі=589 нм; температура плавлення=144,0-144,8ºС. Приклад 11 N-[(2-Хлор-4-фторфеніл)метил]-1-метил-5-оксопролінамід (Е11) 1-Метил-5-оксопролін (0,050 г, 0,35 ммоль, отриманий, як описано нижче) розчиняють у безводному дихлорметані (~7 мл) і до отриманого розчину додають 1-гідроксибензотриазол (0,047 г, 0,42 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,056 мл, 0,42 ммоль), N-етилморфолін (0,166 мл, 1,04 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,067 г, 0,42 ммоль). Суміш перемішують при кімнатній температурі протягом ночі. До суміші додають додаткову аліквоту [(2-хлор-4-фторфеніл)метил]аміну (0,100 мл, 0,8 ммоль) і перемішування продовжують ще трохи, доки ВЕРХ не показує, що надалі продукт не утвориться. Суміш послідовно промивають 2М водним розчином хлористого водню (5 мл) і насиченим водним розчином гідрокарбонату натрію (5 мл). Органічний шар відокремлюють і випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою маснаправленою ВЕРХ, одержуючи чистий N-[(2-хлор-4-фторфеніл)метил]-1-метил-5оксопролінамід (0,015 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =285, час утримування=2,04 хв. 1-Метил-5-оксопролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Метиловий ефір (L)-піроглутамінової кислоти (1 г, 6,99 ммоль) розчиняють/змішують з тетрагідрофураном (10 мл) і охолоджують до температури 0ºС, використовуючи крижану баню. До суміші додають гідрид натрію (0,201 г 60%-вої суспензії в маслі, 8,38 ммоль). Коли кипіння припиняється, додають метилйодид (0,522 мл, 8,38 ммоль), суміш залишають нагріватися до кімнатної температури і потім перемішують протягом 1 години. Розчинник випарюють і додають воду (1 мл). Водний шар потім екстрагують дихлорметаном. Дихлорметан випарюють, одержуючи неочищений метил-1-метил-5-оксопролінат (0,308 г), який використовують на наступній стадії без подальшого очищення. 18 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 (ii) Метил-1-метил-5-оксопролінат (0,308 г, 1,96 ммоль) розчиняють у метанолі (~10 мл) і до отриманого розчину додають розчин гідроксиду натрію (0,157 г, 3,92 ммоль) у воді (~10 мл). Суміш кип'ятять зі зворотним холодильником протягом 3 годин, потім охолоджують і випарюють, залишаючи мінімальну кількість води. Підкисляють до рН=1, використовуючи 2М водний розчин хлористого водню. Водний шар промивають дихлорметаном і потім відокремлюють і випарюють, одержуючи 1-метил-5-оксопролін у вигляді білої твердої речовини (0,300 г). Приклад 12 1-Етил-5-оксо-N-[(2,3,4-трифторфеніл)метил]пролінамід (Е12) 1-Етил-5-оксопролін (0,050 г, 0,32 ммоль) розчиняють у безводному дихлорметані (~7 мл) і диметилформаміді (1 мл) і до отриманого розчину додають 1-гідроксибензотриазол (0,052 г, 0,38 ммоль), [(2,3,4-трифторфеніл)метил]амін (0,103 г, 0,64 ммоль), N-етилморфолін (0,151 мл, 0,95 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,073 г, 0,38 ммоль). Суміш струшують при кімнатній температурі протягом вихідних. До суміші додають додаткову аліквоту [(2,3,4-трифторфеніл)метил]аміну (0,051 г, 0,32 ммоль) і перемішування продовжують ще трохи, доки ВЕРХ не показує, що надалі продукт не утвориться. Суміш розбавляють 2М водним розчином хлористого водню (5 мл) і потім фільтрують через фазовий роздільник. Органічний шар потім промивають насиченим водним розчином гідрокарбонату натрію і знову фільтрують через фазовий роздільник. Органічний шар потім випарюють, одержуючи неочищений продукт. Неочищений продукт очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий 1-етил-5-оксо-N-[(2,3,4-трифторфеніл)метил]пролінамід (0,032 г). + РХ/МС [М+Н] =301, час утримування=2,03 хв. 1-Етил-5-оксопролін, використовуваний у вищенаведеній методиці, одержують у такий спосіб (спосіб А): (і) Гідрохлорид диметил-L-глутамату (5,0 г, 23,7 ммоль) розчиняють у метанолі (100 мл) і суміш потім обробляють гідроксидом натрію (1,0 г, 24,9 ммоль) в атмосфері аргону і при кімнатній температурі. Через 5 хвилин, додають ацетальдегід (1,99 мл, 35,5 ммоль) і продовжують перемішування протягом 10 хвилин. Отриману суміш охолоджують до температури 0ºС і обробляють гранулами боргідриду натрію (0,701 г, 18,95 ммоль). Продовжують перемішування протягом 1 години при температурі 0ºС, потім метанол випарюють і залишок обробляють етилацетатом і фільтрують. Фільтрат потім промивають насиченим розчином солі і насичений сольовий розчин після промивання екстрагують етилацетатом. Об'єднані етилацетатні фракції фільтрують через гідрофобну фриту і випарюють, одержуючи прозоре масло (3,2 г). Отримане масло розчиняють у толуолі (30 мл) і кип'ятять зі зворотним холодильником протягом ночі. Толуол потім випарюють, одержуючи світло-жовтогарячий залишок, який очищають колонковою флеш-хроматографією на силікагелі, елююючи градієнтом 20-60% етилацетату в гексані, з одержанням не зовсім чистого метил-1-етил-5-оксопролінату (1,9 г) у вигляді прозорого масла. Його використовують на наступній стадії без подальшого очищення. (ii) Метил-1-етил-5-оксопролінат (1,91 г, 11,17 ммоль) розчиняють у метанолі (25 мл) і обробляють 2М водним розчином гідроксиду натрію (7,3 мл, 14,52 ммоль). Суміш перемішують протягом 4 годин при кімнатній температурі й потім промивають дихлорметаном. Водний шар випарюють і залишок обробляють надлишком 1М розчину хлористого водню в діетиловому ефірі (~5 мл). Суміш випарюють ще раз і залишок розтирають у дихлорметані. Тверду речовину видаляють і об'єднані дихлорметанові фракції випарюють, одержуючи прозоре масло, яке кристалізується при стоянні. Розтирання в гексані та діетиловому ефірі і сушіння приводять до одержання чистого 1-етил-5-оксопроліну (0,271 г) у вигляді білої твердої речовини. Альтернативно, 1-етил-5-оксопролін може бути отриманий у такий спосіб (спосіб В): (і) 1,1-Диметилетил-5-оксо-L-пролінат (2,7 г, 12 ммоль, отриманий, як описано в Synth. Comm., 35(8), 1129 (2005)) додають до суспензії гідриду натрію (0,428 г (60%-ва суспензія в маслі), 10,7 ммоль) у тетрагідрофурані (6 мл) і суміш перемішують при кімнатній температурі протягом 5 хвилин. Потім додають етилйодид (1,67 г, 10,7 ммоль) і суміш нагрівають при температурі 40ºС протягом 2 годин. Додають додаткову кількість гідриду натрію (0,24 г) і продовжують перемішування протягом ночі при кімнатній температурі. На даній стадії до суміші додають додаткову кількість етилйодиду (0,86 мл) і суміш залишають стояти при кімнатній температурі протягом вихідних. До суміші додають воду (~10 мл) і суміш перемішують протягом 19 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 15 хвилин. Тетрагідрофуран випарюють і водний шар, що залишається, екстрагують дихлорметаном (250 мл) і сумішшю (3:1) хлороформу і ізопропанолу (50 мл). Об'єднані органічні шари фільтрують через гідрофобну фриту і випарюють, одержуючи жовте масло. До суміші додають толуол і потім випарюють ще раз, одержуючи жовте масло. Отриману речовину очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Biotage SP4), елююючи градієнтом 15-100% етилацетату в гексані, з одержанням чистого 1,1-диметилетил-1етил-5-оксопролінату. (ii) 1,1-Диметилетил-1-етил-5-оксопролінат (0,965 г) розчиняють у дихлорметані (~5 мл) і обробляють трифтороцтовою кислотою (1 мл). Суміш перемішують при кімнатній температурі протягом 1,5 годин і потім випарюють. Отримана речовина являє собою, головним чином, вихідну речовину, тому додають додаткову кількість трифтороцтової кислоти (1 мл) і дихлорметану (~5 мл) і суміш перемішують при кімнатній температурі протягом 36 годин. Суміш випарюють, потім до залишку додають толуол і його, у свою чергу, також випарюють. Після повторення цього процесу ще раз, одержують неочищений 1-етил-5-оксопролін у вигляді темножовтого масла, яке використовують без додаткового очищення. Альтернативно, 1-етил-5-оксопролін може бути отриманий наступним чином (спосіб С): (і) Гідрохлорид 1-(1,1-диметилетил)-5-метил-L-глутамату (5,0 г, 19,71 ммоль) розчиняють у суміші метанолу (30 мл) і тетрагідрофурану (60 мл) і суміш потім обробляють здрібненим, порошкоподібним гідроксидом натрію (0,828 г, 20,69 ммоль) в атмосфері аргону і при кімнатній температурі. Після перемішування протягом 10 хвилин додають ацетальдегід (1,11 мл, 19,71 ммоль) і оцтову кислоту (1,13 мл, 19,71 ммоль) і продовжують перемішування протягом 10-15 хвилин. Суміш охолоджують до температури 0ºС на крижаній бані й обробляють гранулами боргідриду натрію (0,746 г, 19,71 ммоль). Продовжують перемішування протягом ~1 години при температурі 0ºС в атмосфері аргону. Суміш залишають нагріватися до кімнатної температури, одержуючи густу суспензію. Тонкодисперсні білі тверді речовини відфільтровують, потім метанол випарюють, залишок обробляють дихлорметаном (~50 мл) і промивають насиченим водним розчином гідрокарбонату натрію (~25 мл). Органічний шар відокремлюють, використовуючи фазовий роздільник, і потім водний шар екстрагують ще дихлорметаном (220 мл). Об'єднані органічні шари випарюють, одержуючи безбарвне масло (~4 г). Отримане масло (3 г, приблизно 14,8 ммоль) розчиняють у толуолі (30 мл) і кип'ятять зі зворотним холодильником протягом ~16 годин протягом ночі, одержуючи жовтогарячий розчин. Толуол потім випарюють, одержуючи жовтогаряче масло (2,6 г). Його поєднують з додатковою порцією масла (0,850 г), що одержують подібним чином і потім очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Biotage SP4), при елююванні градієнтом 20-80% етилацетату в гексані, одержуючи чистий 1,1-диметилетил-1-етил-5-оксопролінат (2,14 г). (ii) 1,1-Диметилетил-1-етил-5-оксопролінат (0,933 г) розчиняють у дихлорметані (~5 мл) і обробляютьтрифтороцтовою кислотою (1 мл). Суміш перемішують протягом 3 годин при кімнатній температурі і потім випарюють. Залишок обробляють толуолом і випарюють ще раз. Одержують не зовсім чистий (>95%) 1-етил-5-оксопролін у вигляді жовтогарячо/жовтого масла (0,914 г), яке використовують без подальшого очищення. Приклади 13-36 За методикою, аналогічною до описаної для наведеного вище прикладу 12, сполуки, зведені в наведену нижче таблицю (таблиця 2), одержують шляхом заміни відповідним аміном (або його сіллю) [(2,3,4-трифторфеніл)метил]аміну, використовуваного в наведеній вище методиці. Всі аміни, використані для одержання сполук, зазначених у таблиці 2, доступні з комерційних джерел або їх можна одержати, використовуючи способи, розкриті раніше в хімічній літературі, або за допомогою аналогічних способів. 1-етил-5-оксопролін, використовуваний у реакції, одержують, у кожнім випадку, зазначеним способом. Там, де визначено (шляхом хіральної ВЕРХ), енантіомерний надлишок (е.е.) зазначеного ізомеру також зазначений разом з його стереоспецифічною назвою, використовуваним хіральним способом виділення (зазначеним у дужках) і відповідним часом утримування (r.t.), відповідно до даного способу. 20 UA 100227 C2 Таблиця 2 Пр. № Час утримування (хв) 2,04 А 299 2,03 А 281 2,13 А 281 Е13 [М+Н] 327 Хімічна назва Спосіб, використовуваний для одержання 1етил-5оксопроліну 2,07 А + е.е. N-[(2-бромфеніл)метил]-1-етил-5оксопролінамід Е14 N-[(2-хлор-6-фторфеніл)метил]-1-етил5-оксопролінамід Е15 N-[(3-хлорфеніл)метил]-1-етил-5оксопролінамід Е16 N-[(4-хлорфеніл)метил]-1-етил-5оксопролінамід Е17 315 2,39 А 315 2,29 B 295 2,37 B N-[(2,4-дихлорфеніл) метил]-1-етил-5-оксопролінамід Е18 1-етил-5-оксо-N-{[2(трифторметил)феніл]метил}пролінамід Е19 N-[(4-хлор-2-метилфеніл)метил]-1-етил5-оксопролінамід 21 N-[(2,4дихлорфеніл)метил]-1етил-5-оксоL-пролінамід r.t.=8,78 хв UA 100227 C2 Е20 317 2,15 B 281 2,10 B N-[(2-хлор-3,6-дифторфеніл)метил]-1етил-5-оксопролінамід Е21 N-[(2-хлорфеніл)метил]-1-етил-5оксопролінамід Е22 315 2,36 B 333 2,33 B 275 2,24 B N-[(3,4-дихлорфеніл)метил]-1-етил-5оксопролінамід Е23 N-[(3,4дихлорфеніл)метил]-1етил-5-оксоL-пролінамід, r.t.=5,37 хв 1-етил-N-{[4-фтор-2(трифторметил)феніл]метил}-5оксопролінамід Е24 N-[(2,4-диметилфеніл)метил]-1-етил-5оксопролінамід Е25 295 2,28 B 313 2,31 B 313 2,20 B N-[(2-хлор-6-метилфеніл)метил]-1-етил5-оксопролінамід Е26 N-[(2-хлор-6-фтор-3метилфеніл)метил]-1-етил-5оксопролінамід Е27 N-[(6-хлор-2-фтор-3метилфеніл)метил]-1-етил-5оксопролінамід 22 N-[(2-хлор-6метилфеніл)метил]-1етил-5-оксоL-пролінамід, r.t.=6,91 хв UA 100227 C2 Е28 315 2,29 C 295 2,30 C 315 2,19 C 333 2,35 C N-[(2,3-дихлорфеніл)метил]-1-етил-5оксопролінамід Е29 N-[(3-хлор-2-метилфеніл)метил]-1-етил5-оксопролінамід Е30 N-[(2,6-дихлорфеніл)метил]-1-етил-5оксопролінамід Е31 1-етил-N-{[4-фтор-3(трифторметил)феніл]метил}-5оксопролінамід Е32 349 2,49 C 345 2,24 C 261 2,00 C N-{[4-хлор-3(трифторметил)феніл]метил}-1-етил-5оксопролінамід Е33 N-{[4-хлор-3(трифторметил)феніл]метил}-1етил-5-оксоL-пролінамід, r.t.=5,44 хв N-[(4-бром-2-фторфеніл)метил]-1-етил5-оксопролінамід Е34 1-етил-N-[(2-метилфеніл)метил]-5оксопролінамід Е35 349 N-{[2-хлор-3(трифторметил)феніл]метил}-1-етил-5оксопролінамід 23 2,45 C N-{[2-хлор-3(трифторметил) феніл]метил}-1етил-5-оксоL-пролінамід, r.t.=5,51 хв UA 100227 C2 Е36 317 2,22 C N-[(2-хлор-3,4-дифторфеніл)метил]-1етил-5-оксопролінамід 5 10 15 20 25 30 35 40 45 Гідрохлорид [(2-хлор-3,4-дифторфеніл)метил]аміну, необхідний для синтезу N-[(2-хлор-3,4дифторфеніл)метил]-1-етил-5-оксопролінаміду (приклад 36), одержують у такий спосіб: (і) Розчин N,N,N',N'-тетраметилетилендіаміну (39,6 мл, 264 ммоль) в тетрагідрофурані (170 мл) охолоджують в атмосфері аргону до температури -70ºС перед додаванням втор-бутиллітію (205 мл, 288 ммоль). До суміші потім додають 3,4-дифторбензойну кислоту (19 г, 120 ммоль) у вигляді розчину в тетрагідрофурані (80мл) протягом 40 хвилин, забезпечуючи температуру суміші не вище -60ºС. Суміш потім перемішують при температурі від -68ºС до -70ºС протягом 1 години перед додаванням розчину гексахлоретану (100 г, 422 ммоль) у тетрагідрофурані (170 мл) протягом 35 хвилин при збереженні температури суміші нижче -60ºС. Суміш перемішують при температурі від -65ºС до -70ºС протягом 2 годин. Суміш залишають нагріватися до температури -10ºС і потім додають воду (500 мл) для гасіння реакції. Суміш розбавляють діетиловим ефіром (250 мл) і два отриманих шари розділяють. Водний шар підкисляють до рН=1, використовуючи концентрований водний розчин хлористого водню, і потім екстрагують 2500 мл аліквотами діетилового ефіру. Об'єднані органічні екстракти пропускають через гідрофобну фриту й концентрують у вакуумі, одержуючи жовту тверду речовину. Отриману речовину перекристалізовують з етилацетату, одержуючи дві порції (8,35 г і 4,47 г) чистої 2хлор-3,4-дифторбензойної кислоти. (ii) 2-Хлор-3,4-дифторбензойну кислоту (2 г, 10,4 ммоль) обробляють тіонілхлоридом (3,04 мл) і суміш нагрівають при температурі 80ºС протягом 90 хвилин. Суміш потім охолоджують і концентрують у вакуумі. Залишок розчиняють у безводному 1,4-діоксані (10 мл) і суміш потім охолоджують на бані лід/вода. 0,88 Аміак (водний розчин, 25 мл) по краплинах додають до суміші, яку потім залишають нагріватися до температури 22ºС протягом 2 годин. Цей процес повторюють, використовуючи 10,8 г 2-хлор-3,4-дифторбензойної кислоти, 8,2 мл тіонілхлориду і 45 мл 0,88 аміаку, потім обидві суміші поєднують і розподіляють між етилацетатом (150 мл) і водою (100 мл). Водний шар відокремлюють і екстрагують 2150 аліквотами етилацетату. Об'єднані органічні екстракти потім промивають насиченим водним розчином гідрокарбонату натрію (100 мл), сушать, використовуючи гідрофобну фриту, і концентрують у вакуумі, одержуючи 2-хлор-3,4-дифторбензамід (11,86 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =192/194, час утримування=1,69 хв. (iii) 2-Хлор-3,4-дифторбензамід (11,85 г, 62 ммоль) розчиняють в тетрагідрофурані (200 мл) і обробляють 1М розчином борану в тетрагідрофурані (247 мл, 247 ммоль). Суміш нагрівають при температурі 70ºС і перемішують протягом 18 годин. Суміш потім охолоджують на бані лід/вода і по краплинах додають концентрований водний розчин хлористого водню (150 мл). Нагрівання при перемішуванні при температурі 70ºС потім продовжують протягом наступних 2 годин. Суміш потім залишають охолоджуватися і розчинник випарюють у вакуумі. Залишок розподіляють між етилацетатом (200 мл) і 2н водним розчином хлористого водню (200 мл). Водний шар відокремлюють і рН доводять до 8-9 додаванням по краплинах 5н водного розчину гідроксиду натрію. Отриману непрозору суспензію екстрагують етилацетатом (4200 мл), об'єднані органічні екстракти потім пропускають через гідрофобну фриту і концентрують до об’єму ~200 мл. Суміш потім підкисляють додаванням 1М розчину хлористого водню в діетиловому ефірі (100 мл), що призводить до утворення осаду. Розчинник випарюють у вакуумі, одержуючи білу тверду речовину. Тверду речовину перекристалізовують з денатурату (60 мл), одержуючи три порції чистого гідрохлориду [(2-хлор-3,4-дифторфеніл)метил]аміну (об'єднана маса=4,46 г), у вигляді білої твердої речовини. 24 UA 100227 C2 Приклад 37 N-[(2-Хлор-4-фторфеніл)метил]-1-етил-5-оксо-4-(фенілметил)пролінамід (Е37) 5 10 15 20 25 30 35 40 45 50 Неочищений 1-етил-5-оксо-4-(фенілметил)пролін (0,052 г, 0,09 ммоль, отриманий, як описано нижче) суспендують у суміші дихлорметану (0,5 мл) і диметилформаміду (0,5 мл) і до отриманого розчину додають N-етилморфолін (0,034 мл, 0,27 ммоль), щоб сприяти розчиненню, у більшому ступені, речовини. Потім додають 1-гідроксибензотриазол (0,016 г, 0,12 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодиіміду (0,022 г, 0,12 ммоль) і суміш перемішують протягом 10 хвилин перед додаванням [(2-хлор-4-фторфеніл)метил]аміну (0,019 г, 0,12 ммоль). Суміш потім залишають стояти при кімнатній температурі протягом ночі. До суміші додають насичений водний розчин гідрокарбонату натрію (~2 мл) і перемішують протягом 10 хвилин. Органічний шар відокремлюють фільтруванням через фазовий роздільник і потім промивають 2М водним розчином хлористого водню. Органічний шар знову відокремлюють і випарюють, одержуючи жовте масло, яке очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4-фторфеніл)метил]-1-етил-5-оксо-4-(фенілметил)пролінамід (0,004 г) у вигляді безбарвного масла. + РХ/МС [М+Н] =389, час утримування=2,90 хв. 1-Етил-5-оксо-4-(фенілметил)пролін, використовуваний у наведеній вище методиці, одержують у такий спосіб (спосіб А): (і) Метил-(S)-(+)-2-піролідинон-5-карбоксилат (0,85 г, 5,94 ммоль) розчиняють у дихлорметані (5 мл) і обробляють триетиламіном (0,869 мл, 6,24 ммоль) і 4диметиламінопіридином (0,010 г). До отриманого розчину додають ди-трет-бутилдикарбонат (1,36 г, 6,24 ммоль) і отриманий жовтогарячий розчин залишають перемішуватися протягом ночі. Суміш змінює колір із блакитного на сірий, і випарювання розчинника приводить до одержання сіруватого масла (1,4 г). Його очищають автоматизованою колонковою флешхроматографією на силікагелі (Biotage SP4) при елююванні градієнтом 0-60% етилацетату в гексані, одержуючи 1-(1,1-диметилетил)-2-метил-5-оксо-1,2-піролідиндикарбоксилат (1,37 г) у вигляді безбарвного масла, яке кристалізується при стоянні. (ii) 1-(1,1-Диметилетил)-2-метил-5-оксо-1,2-піролідиндикарбоксилат (0,324 г, 1,33 ммоль) розчиняють у тетрагідрофурані (3 мл) і суміш охолоджують до температури -78ºС, використовуючи баню ацетон/сухий лід, в атмосфері аргону. По краплинах додають 1М розчин літійбіс(триметилсиліл)аміду в тетрагідрофурані (1,4мл, 1,40 ммоль) і перемішують в атмосфері аргону протягом 1 години. До отриманого розчину потім додають бензилбромід (0,174 мл, 1,46 ммоль) і суміш перемішують при температурі -78ºС протягом ще 2,5 годин. Суміш потім залишають нагріватися до кімнатної температури, гасять додаванням насиченого водного розчину хлориду амонію (~5 мл) і потім залишають стояти протягом ночі при кімнатній температурі. Органічний шар відокремлюють, водний шар розбавляють ще водою (5 мл) і екстрагують етилацетатом (310 мл). Об'єднані органічні шари сушать над безводним сульфатом натрію, потім фільтрують і концентрують, одержуючи жовте масло (0,700 г). Його очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Biotage SP4) при елююванні градієнтом 0-35% етилацетату в гексані, одержуючи після випарювання розчинника 1-(1,1-диметилетил)-2-метил-5-оксо-4-(фенілметил)-1,2-піролідин-дикарбоксилат у вигляді білої твердої речовини (0,418 г). (iii) 1-(1,1-Диметилетил)-2-метил-5-оксо-4-(фенілметил)-1,2-піролідин-дикарбоксилат (0,415 г, 1,24 ммоль) розчиняють у 4М розчині хлористого водню в діоксані (2 мл) і перемішують при кімнатній температурі протягом 2 годин. Розчинник випарюють, одержуючи безбарвне масло, яке кристалізується при стоянні, одержуючи метил-5-оксо-4-(фенілметил)пролінат у вигляді кремово/білої твердої речовини (0,205 г). Отриману речовину використовують без подальшого очищення на наступній стадії. (iv) Метил-5-оксо-4-(фенілметил)пролінат (0,205 г, 0,88 ммоль) розчиняють у тетрагідрофурані (2,5 мл) і обробляють етилйодидом (0,077 мл, 0,97 ммоль). Суміш потім охолоджують до температури 0ºС і обробляють гідридом натрію (0,037 г 60%-вої суспензії в маслі, 0,92 ммоль). Після перемішування при температурі 0ºС протягом 10-15 хвилин розчин нагрівають до кімнатної температури і перемішують ще протягом 3,5 годин. Суміш потім 25 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 60 обробляють насиченим водним розчином хлориду амонію (~2 мл) і розбавляють дихлорметаном (5 мл). Органічний шар відокремлюють фільтруванням через гідрофобну фриту (промивання водного шару додатковими аліквотами дихлорметану (25 мл)). Випарювання об'єднаних органічних фаз приводить до одержання коричневого масла (~0,100 г). Отримане масло очищають автоматизованою колонковою флеш-хроматографією на силікагелі, елююючи градієнтом 0-100% етилацетату в гексані, з одержанням не зовсім чистого (~90% чистоти) метил-1-етил-5-оксо-4-(фенілметил)пролінату (0,024 г) у вигляді жовтого масла, яке використовують на наступній стадії без подальшого очищення. (v) Метил-1-етил-5-оксо-4-(фенілметил)пролінат (0,024 г, 0,09 ммоль) розчиняють у метанолі (0,5 мл) і охолоджують до температури 0ºС на крижаній бані. До суміші додають 2М водний розчин гідроксиду натрію (0,137 мл, 0,27 ммоль) і продовжують перемішування при температурі 0ºС протягом 3 годин. Розчинник випарюють і залишок підкисляють обробкою 2М водним розчином хлористого водню (~0,2 мл), одержуючи непрозорий розчин. Його випарювання приводить до одержання неочищеного 1-етил-5-оксо-4-(фенілметил)проліну (0,052 г) у вигляді суміші твердих речовин білого кольору і маслянистих залишків жовтого кольору. Отриману суміш використовують без подальшого очищення. Альтернативно, 1-етил-5-оксо-4-(фенілметил)пролін також може бути отриманий у такий спосіб (спосіб В): (і) (S)-(+)-L-5-тритилоксиметил-2-піролідинон (1,88 г, 20 ммоль) розчиняють у диметилформаміді (9 мл) при температурі 0ºС і обробляють гідридом натрію (60%-ва суспензія в маслі, 0,220 г, 5,5 ммоль). Суміш перемішують при температурі 0ºС протягом 30 хвилин і потім обробляють етилйодидом (0,444 мл, 5,5 ммоль). Суміш залишають нагріватися до кімнатної температури і потім перемішують протягом ночі. Суміш потім розподіляють між етилацетатом і насиченим водним розчином хлориду амонію й екстрагують етилацетатом (3). Об'єднані органічні екстракти послідовно промивають водою, 50%-вим водним розчином хлориду натрію (2) і насиченим водним розчином хлориду натрію і потім сушать над сульфатом натрію. Концентрують, одержуючи бежеву тверду речовину, яку очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Віоtаgе SР4) при елююванні градієнтом 0100% етилацетату в гексані, одержуючи чистий 1-етил-5-{[(трифенілметил)окси]метил}-2піролідинон (1,78 г). (ii) 2М Розчин літійдіізопропіламіну в тетрагідрофурані (1,050 мл, 2,1 ммоль) додають при температурі -78ºС до розчину 1-етил-5-{[(трифенілметил)окси]метил}-2-піролідинону (0,771 г, 2 ммоль) у тетрагідрофурані (10 мл) і отриману суміш перемішують протягом 1 години при температурі -78ºС. Потім додають бензилбромід (0,262 мл, 2,2 ммоль), потім перемішують протягом наступної години при температурі -78ºС і суміш залишають нагріватися до кімнатної температури протягом ночі. Суміш гасять насиченим водним розчином хлориду амонію і потім екстрагують етилацетатом (3). Об'єднані органічні екстракти промивають водою і потім насиченим водним розчином хлориду натрію (2), сушать над безводним сульфатом магнію і концентрують, одержуючи неочищене масло (1,27 г). Неочищене масло очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Віоtаgе SР4), при елююванні градієнтом 0-100% етилацетату в гексані, одержуючи бажаний продукт (тобто 1етил-3-(фенілметил)-5-{[(трифенілметил)окси]метил}-2-піролідинон (0,561 г)), який використовують на наступній стадії, а також вихідну речовину, що не прореагувала, і продукт діалкілування, 1-етил-3,3-біс(фенілметил)-5-{[(трифенілметил)окси]метил}-2-піролідинон (0,053 г). (iii) 1-Етил-3-(фенілметил)-5-{[(трифенілметил)окси]метил}-2-піролідинон (0,561 г, 1,1 ммоль) перемішують протягом 24 годин при кімнатній температурі в суміші ацетонітрилу (21 мл) і мурашиної кислоти (3 мл). Реакція не завершується на даній стадії, тому розчинник випарюють, заміняють мурашиною кислотою (10 мл) і продовжують перемішування протягом 3 годин. Реакція усе ще не завершується, тому суміш концентрують у вакуумі (азеотропна перегонка з метанолом для видалення всієї кількості мурашиної кислоти) і потім розчиняють у метанолі (20 ® мл). До суміші потім додають смолу Amberlyst 15 і продовжують перемішування при кімнатній температурі протягом ночі. Смолу фільтрують, промивають ще метанолом і фільтрат концентрують, одержуючи смолу (0,625 г). Отриману смолу очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Віоtаgе SР4) при елююванні градієнтом 0100% етилацетату в гексані, одержуючи 1-етил-5-(гідроксиметил)-3-(фенілметил)-2-піролідинон (0,170 г), який використовують на наступній стадії. (iv) 1-Етил-5-(гідроксиметил)-3-(фенілметил)-2-піролідинон (0,748 г, 3,21 ммоль) розчиняють в ацетонітрилі (5 мл) і додають 1М водний одноосновний буферний розчин фосфату натрію (3,69 мл, 3,69 ммоль), кілька кристалів ТЕМРО (вільний 2,2,6,6-тетраметил-1 26 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 55 піперидинілоксирадикал) і хлорит натрію (0,580 г, 6,41ммоль) і суміш нагрівають до температури 40ºС. Потім до суміші додають приблизно 1 краплину відбілювача (розчин гіпохлориту натрію з вмістом хлору >12%) і продовжують перемішування при температурі 40ºС протягом 3 годин. Суміш потім виливають у суміш води з льодом, що містить 1% мас./мас. сульфіту натрію, і отриману суміш доводять до рН=2, використовуючи 5н водний розчин хлористого водню, і потім екстрагують етилацетатом (3). Об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію, потім сушать над сульфатом магнію й концентрують, одержуючи 1етил-5-оксо-4-(фенілметил)пролін (0,807 г) у вигляді твердої речовини, яку використовують без додаткового очищення. Приклад 38 N-[(2-Хлор-4-фторфеніл)метил]-1-(2-метил-2-пропен-1-іл)-5-оксопролінамід (Е38) Неочищений 1-(2-метил-2-пропен-1-іл)-5-оксопролін (~0,075 г, ~0,41 ммоль, отриманий, як описано нижче) розчиняють у дихлорметані (5 мл) і до отриманого розчину додають 1гідроксибензотриазол (0,061 г, 0,45 ммоль), [(2-хлор-4-фторфеніл)метил]амін (0,068 г, 0,43 ммоль) і гідрохлорид N-(3-диметиламінопропіл)-N’-етилкарбодиіміду (0,087 г, 0,45 ммоль). Суміш потім перемішують при кімнатній температурі протягом 24 годин. Суміш розбавляють ще дихлорметаном, потім послідовно промивають 2М водним розчином хлористого водню і насиченим водним розчином гідрокарбонату натрію. Органічний шар фільтрують через фазовий роздільник і випарюють, одержуючи коричневий залишок, який очищають автоматизованою мас-направленою ВЕРХ, одержуючи чистий N-[(2-хлор-4-фторфеніл)метил]-1-(2-метил-2пропен-1-іл)-5-оксопролінамід (0,018 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =325,1, час утримування=2,40 хв. 1-(2-Метил-2-пропен-1-іл)-5-оксопролін, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Метанол (55 мл) охолоджують до температури -10ºС (використовуючи баню сухий лід/тетрахлорид вуглецю) при перемішуванні і потім по краплинах додають тіонілхлорид протягом 45 хвилин. Потім трьома порціями додають (D)-глутамінову кислоту (10 г, 67,96 ммоль) протягом ~5 хвилин і потім реакційну суміш перемішують протягом 3 годин, поки вона не нагріється до температури 21ºС. Розчинники випарюють у вакуумі, одержуючи прозоре масло (15 г), яке розчиняють у суміші води (150 мл) і діоксану (150 мл). До отриманого розчину потім повільно додають карбонат натрію (46 г, 340 ммоль) при перемішуванні. Потім додають бензилхлорформіат (9,64мл, 68 ммоль) і продовжують перемішування протягом ночі. Суміш обережно обробляють 2н водним розчином хлористого водню (250 мл) і потім екстрагують етилацетатом (2250 мл). Об'єднані органічні фракції промивають насиченим розчином солі, потім сушать і випарюють, одержуючи прозоре масло (18,7 г). Отримане масло розчиняють у дихлорметані (400 мл) і обробляють концентрованою сірчаною кислотою (1 мл). Потім конденсують великий надлишок ізобутілену в суміш і потім перемішують протягом ночі при температурі 21ºС. Потім до суміші обережно додають насичений водний розчин гідрокарбонату натрію (~400 мл) і потім органічну фазу відокремлюють, промивають насиченим розчином солі, сушать і випарюють у вакуумі, одержуючи прозоре масло (21,9 г). Отримане масло очищають на силікагелі колонковою хроматографією при елююванні сумішшю циклогексану і етилацетату (3:1), одержуючи чистий 1-(1,1-диметилетил)-5-метил-N-{[(фенілметил)окси]-карбоніл}глутамат (4,87 г). (ii) До розчину гексаметилдисилазиду калію (10 мл 0,6М розчину в толуолі, 6ммоль) у тетрагідрофурані (25 мл) при температурі -70ºС по краплинах додають розчин 1-(1,1диметилетил)-5-метил-N-{[(фенілметил)окси]карбоніл}глутамату (1,05 г, 3 ммоль) у тетрагідрофурані (10 мл) протягом ~5 хвилин. Отриману суміш перемішують при температурі 70ºС протягом 1 години і потім обробляють металілйодидом (2,18 г, 12 ммоль) у тетрагідрофурані (10 мл). Продовжують перемішування при температурі -78ºС протягом 2 годин і потім нагрівають до температури 21ºС. Після перемішування протягом наступної години суміш виливають у 1н водний розчин хлористого водню й екстрагують етилацетатом (250 мл). Об'єднані органічні шари промивають насиченим розчином солі, сушать і випарюють у вакуумі, одержуючи жовте масло (1,03 г). Отримане масло очищають колонковою хроматографією на силікагелі, елююючи сумішшю циклогексану і етилацетату (4:1), з одержанням чистого 1,1 27 UA 100227 C2 5 10 15 20 25 30 35 40 45 50 диметилетил-1-(2-метил-2-пропен-1-іл)-5-оксопролінату у вигляді прозорого масла (0,322 г). (iii) 1,1-Диметилетил-1-(2-метил-2-пропен-1-іл)-5-оксопролінат (0,099 г, 0,41 ммоль) розчиняють у суміші дихлорметану (2 мл) і трифтороцтової кислоти (2 мл) і перемішують протягом ночі при кімнатній температурі. Розчинник випарюють (азеотропна перегонка з толуолом для видалення слідів трифтороцтової кислоти), одержуючи неочищений 1-(2-метил-2пропен-1-іл)-5-оксопролін у вигляді коричневого масла, яке використовують без подальшого очищення. Приклад 39 1-Циклопропіл-N-[(2,4-дихлорфеніл)метил]-5-оксопролінамід (Е39) До розчину (2,4-дихлорфеніл)метилізоціаніду (0,047 г, 0,25 ммоль) і 4-оксобутанової кислоти (15% у воді, 0,26 мл, 0,4 ммоль) у метанолі (1,75 мл) додають циклопропіламін (0,042 мл, 0,6 ммоль). Суміш нагрівають при температурі 100ºС протягом 30 хвилин у мікрохвильовому реакторі. Розчинник видаляють у вакуумі і залишок очищають автоматизованою маснаправленою ВЕРХ, одержуючи 1-циклопропіл-N-[(2,4-дихлорфеніл)метил]-5-оксопролінамід (0,072 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =326/328, час утримування=2,29 хв. Приклад 40 N-{[2-Хлор-3-(трифторметил)феніл]метил}-1-циклопропіл-5-оксопролінамід (Е40) До розчину [2-хлор-3-(трифторметил)феніл]метилізоціаніду (0,088 г, 0,4ммоль) і напівальдегіду бурштинової кислоти (15% у воді, 0,26 мл, 0,4 ммоль) у метанолі (1,75 мл) додають циклопропіламін (0,042 мл, 0,6 ммоль). Суміш нагрівають при температурі 100ºС протягом 30 хвилин у мікрохвильовому реакторі. Розчинник видаляють у вакуумі і залишок очищають автоматизованою мас-направленою ВЕРХ, одержуючи N-{[2-хлор-3(трифторметил)феніл]метил}-1-циклопропіл-5-оксо-пролінамід (0,076 г) у вигляді білої твердої речовини. + РХ/МС [М+Н] =361/363, час утримування=2,39 хв. [2-Хлор-3-(трифторметил)феніл]метилізоціанід, використовуваний у наведеній вище методиці, одержують у такий спосіб: (і) Розчин {[2-хлор-3-(трифторметил)феніл]метил}аміну (1,05 г, 5 ммоль) у безводному тетрагідрофурані (10 мл) по краплинах додають до розчину N-формілбензотриазолу (0,772 г, 5,25 ммоль) у безводному тетрагідрофурані (10 мл). Реакційну суміш перемішують при температурі 22ºС протягом 18 годин, потім концентрують у вакуумі й залишок розподіляють між дихлорметаном (75 мл) і 2н водним розчином гідроксиду натрію (40 мл). Органічний шар відокремлюють і екстрагують 2н водним розчином гідроксиду натрію (40 мл). Органічний шар пропускають через гідрофобну фриту й концентрують у вакуумі, одержуючи білу тверду речовину. Неочищений продукт очищають автоматизованою колонковою флеш-хроматографією на силікагелі (Biotage SP4), елююючи градієнтом розчинника, 0-10% етилацетату в дихлорметані, з одержанням {[2-хлор-3-(трифторметил)феніл]-метил}формаміду у вигляді білої твердої речовини. (ii) Розчин {[2-хлор-3-(трифторметил)феніл]метил}формаміду (0,67 г, 2,82ммоль) у безводному дихлорметані (20 мл) охолоджують в атмосфері аргону на бані лід/вода, перед додаванням діізопропіламіну (1,78 мл, 12,7 ммоль) і наступного додавання оксихлориду фосфору (0,393 мл, 4,23 ммоль). Реакційну суміш перемішують при температурі 2-5ºС протягом 2 годин. Суміш потім концентрують у вакуумі і залишок обробляють насиченим водним розчином гідрокарбонату натрію (20 мл) і екстрагують дихлорметаном (20 мл). Органічний шар пропускають через гідрофобну фриту і концентрують у вакуумі, одержуючи жовту тверду речовину. Подальше сушіння у вакуумі приводять до одержання [2-хлор-3(трифторметил)феніл]метилізоціаніду у вигляді жовтогарячої смоли (0,66 г), яку використовують без подальшого очищення. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted n-phenylmethyl-5-oxo-proline-2-amides as p2x7-receptor antagonists and their methods of use
Автори англійськоюChambers Laura J, Gleave Robert, Senger Stefan, Walter, Daryl, Simon
Назва патенту російськоюЗамещенные n-фенилметил-5-оксопролин-2-амиды как антагонисты p2x7-рецептора и их применение
Автори російськоюЧемберз Лаура Дж., Глив Роберт, Зенгер Стефан, Уолтер Дерил Саймон
МПК / Мітки
МПК: A61K 31/402, A61K 31/4015, C07D 401/06, C07D 207/28, A61P 29/00, A61P 25/28
Мітки: заміщені, n-фенілметил-5-оксопролін-2-аміди, p2x7-рецептора, застосування, антагоністи
Код посилання
<a href="https://ua.patents.su/80-100227-zamishheni-n-fenilmetil-5-oksoprolin-2-amidi-yak-antagonisti-p2x7-receptora-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені n-фенілметил-5-оксопролін-2-аміди як антагоністи p2x7-рецептора та їх застосування</a>
Попередній патент: Спосіб і установка для упаковування з лазерним гравіруванням
Наступний патент: Фармацевтична композиція, яка містить тетрагідрофолієву кислоту
Випадковий патент: Сигналізатор автоматизований інформативно-діагностичний для оперативної оцінки рівня льотної придатності об'єктів авіаційної техніки