Сполуки-інгібітори дипептидилпептидази-іv, фармацевтична композиція, яка містить вказані сполуки як активний інгредієнт
Номер патенту: 89396
Опубліковано: 25.01.2010
Автори: Кім Хіє Дзін, Хонг Санг Йонг, Йім Хієон Дзоо, Йєо Донг-Дзун, Хур Гвонг-Чєунг, Йєом Зі-Хо, Кім Кіоунг-Хеє, Квон Ох Хван, Кім Дзі Янг, Кох Дзонг Сунг, Кім Сунгсуб, Лі Чанг-Сеок, Кім Сунг Хо, Коо Кі Донг, Бу Сєонг Чєол, Лім Донгчул, Кім Гєун Тає, Кім Мін-Дзунг, Хан Хеє Оон
Формула / Реферат
1. Сполука формули (1) або її фармацевтично прийнятна сіль:
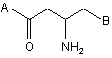 , (1)
, (1)
дe
А вибраний з групи, яка складається із замісників наступних формул з (2) по (7):
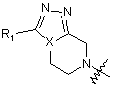 , (2)
, (2)
де R1 являє собою водень або заміщений або незаміщений C1-C4алкіл; і X являє собою вуглець або азот;
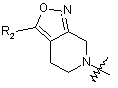 , (3)
, (3)
де R2 являє собою водень або заміщений або незаміщений С1-С4алкіл;
 , (4)
, (4)
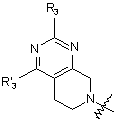 , (5)
, (5)
де R3 являє собою водень або заміщений або незаміщений С1-С4алкіл, С3-С7циклоалкіл, феніл або 5-6-членний гетероарил, який як гетероатоми містить N, S і О; і R’3 являє собою водень або CF3;
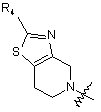 , (6)
, (6)
де R4 являє собою водень, галоген або заміщений або незаміщений С1-С4алкіл, або вибраний із замісників наступних формул (6а) і (6b):
 (6а)
(6а)
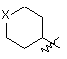 , (6b)
, (6b)
де R5 являє собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і X являє собою кисень, сірку або сульфон;
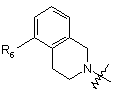 , (7)
, (7)
де R6 являє собою галоген або заміщений або незаміщений С1-С4алкіл;
В вибраний із групи, яка складається із замісників наступних формул з (8) по (11):
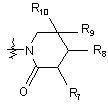 , (8)
, (8)
де R7, R8, R9 і R10, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл;
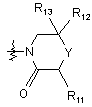 , (9)
, (9)
де R11, R12 і R13, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і Y являє собою кисень, сірку або SO2;
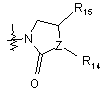 , (10)
, (10)
де R14 і R15, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і Z являє собою -СН- або кисень, де Z являє собою кисень, R14 відсутній;
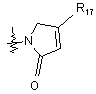 , (11)
, (11)
де R17 являє собою заміщений або незаміщений С1-С4алкіл.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль, де заміщений С1-С4алкіл являє собою алкіл, заміщений галогеном.
3. Сполука за п. 2 або її фармацевтично прийнятна сіль, де галоген являє собою фтор.
4. Сполука за п. 1 або її фармацевтично прийнятна сіль, де А являє собою замісник формули (5), і R3 вибраний із групи, яка складається з наступних замісників:
водень;
заміщений або незаміщений С1-С4алкіл;
група формули -CH2-R18, де R18 являє собою С1-С4алкоксіалкіл або С3-С7циклоалкіл, незаміщений або заміщений галогеном або гідрокси, або феніл, незаміщений або заміщений галогеном або гідроксилом, або 5- або 6-членний гетероарил;
заміщений або незаміщений С3-С7циклоалкіл;
група формули
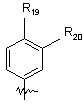 ,
,
де R19 і R20, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і
5-членний або 6-членний гетероарил, незаміщений або заміщений галогеном або гідрокси.
5. Сполука за п. 4 або її фармацевтично прийнятна сіль, де заміщений С3-С7циклоалкіл і С1-С4алкіл являють собою циклоалкіл і алкіл, заміщений галогеном або гідрокси.
6. Сполука за п. 1 або її фармацевтично прийнятна сіль, де гетероарил являє собою 2-фуран, 3-фуран, 2-тіофен, 3-тіофен, 2-піридин, 3-піридин, 4-піридин, 2-пірол або 3-пірол.
7. Сполука за п. 1 або її фармацевтично прийнятна сіль, де сполука являє собою стереоізомер, як представлено в наступній формулі (Іа):
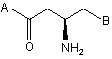 , (la)
, (la)
де А і В є тими ж самими, як у формулі (1).
8. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана із групи, яка складається з наступних сполук:
3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]оксазолідин-2-он;
3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5-метилоксазолідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]піперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-метилпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4,4-диметилпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3-фторпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]піролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3-фторпіперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3-метилпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-метил-1,5-дигідропірол-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-метилпіперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5,5-дифторпіперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5R-метилпіперидин-2-он;
3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3-азабіцикло[3,1,0]гексан-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-трифторметилпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-трифторметилпіперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5-трифторметилпіперидин-2-он;
4-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-6-метилморфолін-3-он;
1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутил]піперидин-2-он;
1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутил]-4-метилпіролідин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-4,5-дигідро-7Н-ізоксазоло[3,4-с]піридин-6-іл)бутил]піперидин-2-он;
1-[2S-аміно-4-оксо-4-(3-трифторметил-1,4,5,7-тетрагідропіразоло[3,4-с]піридин-6-іл)бутил]піперидин-2-он;
1-[2S-аміно-4-оксо-4-(4-трифторметил-5,8-дигідро-6Н-піридо[3,4-d]піримідин-7-іл)-бутил]-5R-метил-1-піперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-феніл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-aміно-4-оксо-4-[2-феніл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[2-феніл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-циклопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-циклопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-циклопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[5-(трифторметил)-3,4-дигідроізохінолін-2(1H)-іл]бутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[5-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-(4-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-2-он;
1-{(2S)-2-аміно-4-[2-(3-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-(3-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
(5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
(5R)-1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-циклопентил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-циклопентил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-[2-циклопентил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-[(2S)-2-аміно-4-оксо-4-{2-[4-(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл}бутил]-5-метилпіперидин-2-он;
(6S)-4-[(2S)-2-аміно-4-оксо-4-{2-[4-(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл}бутил]-6-метилморфолін-3-он;
1-[(2S)-2-аміно-4-оксо-4-{2-[4-(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл}бутил]-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(4-фторфеніл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н-піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-5-метилпіперидин-2-он;
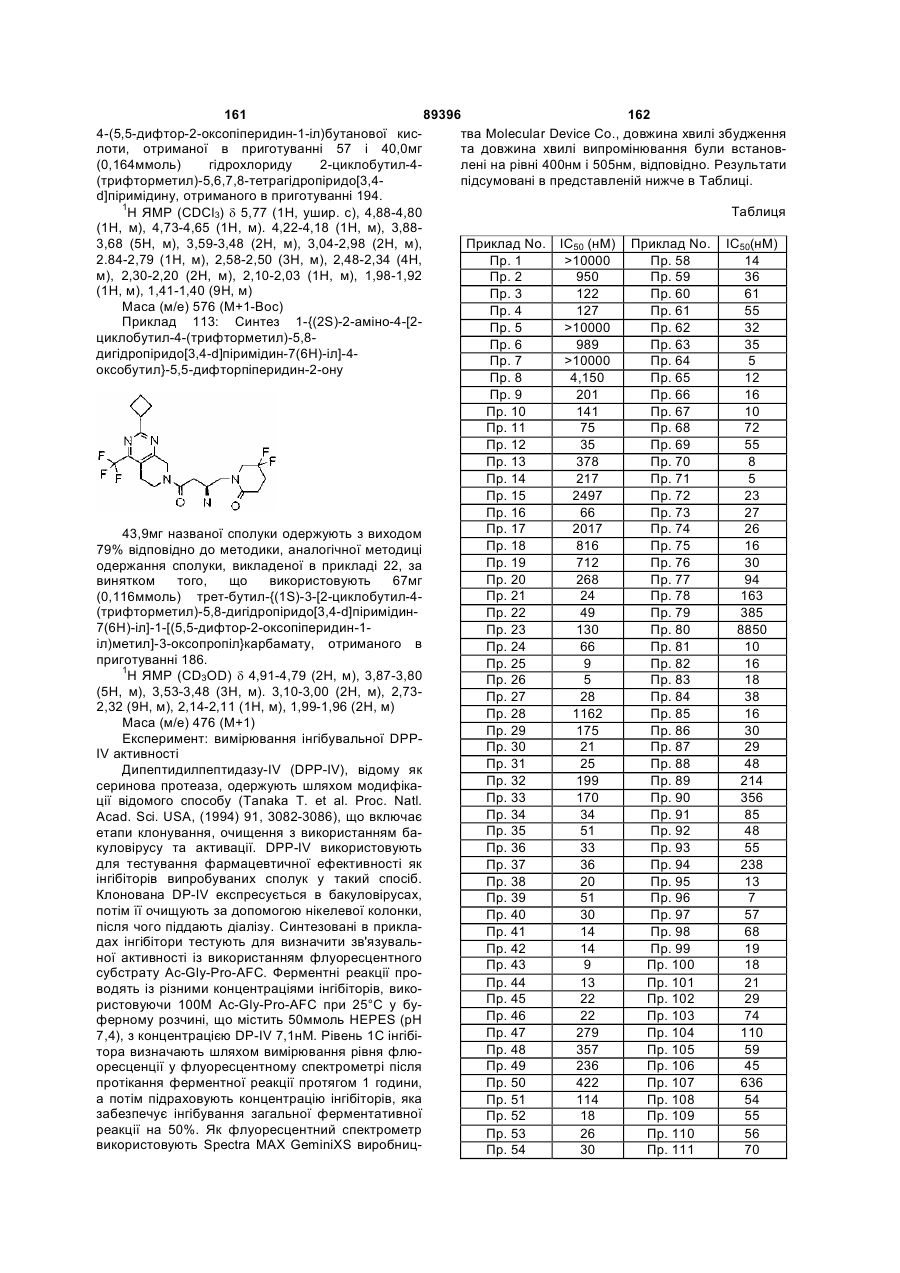
(6S)-4-{(2R)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н-піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н-піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(трифторметил)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(трифторметил)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(циклопропілметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(циклопропілметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(4-фторбензил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(4-фторбензил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(2-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(2-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-aміно-4-оксо-4-[2-(1Н-пірол-2-іл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(1Н-пірол-2-іл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-[2-ізопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-ізопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-ізопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
(6R)-4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он;
(5S)-1-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-5-метилпіперидин-2-он;
(5S)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(5R)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[3-(пентафторетил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[3-(пентафторетил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он;
4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилтіоморфолін-3-он;
1-{(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он;
4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]бутил}-6-метилтіоморфолін-3-он;
(5R)-1-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
(6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-6-метилморфолін-3-он;
1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-(фторметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(фторметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метил-1,5-дигідро-2Н-пірол-2-он;
1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метил-1,5-дигідро-2Н-пірол-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метилоксопіролідин-2-он;
1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метилпіролідин-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-(трифторметил)піперидин-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-(трифторметил)піролідин-2-он;
1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-(трифторметил)піролідин-2-он;
1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метилоксопіперидин-2-он;
1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-4-метилпіперидин-2-он;
(5R)-1-{(2S)-2-аміно-4-[2-циклобутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он;
1-{(2S)-2-аміно-4-[2-циклобутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он.
9. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (5R)-1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
10. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (5R)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
11. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
12. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
13. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
14. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
15. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-аміно-4-[2-(4-фторфеніл)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
16. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
17. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
18. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-аміно-4-[2-циклопропіл-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
19. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
20. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (6S)-4-{(2S)-2-aміно-4-oкco-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-6-метилморфолін-3-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
21. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
22. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з (5R)-1-{(2S)-2-аміно-4-[2-(фторметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
23. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-[2-(фторметил)-4-(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-ону і його солі малеїнової кислоти, фосфорної кислоти, винної кислоти, хлороводневої кислоти, метансульфонової кислоти або лимонної кислоти.
24. Фармацевтична композиція для інгібування дипептидилпептидази-IV (DPP-IV), яка містить ефективну кількість сполуки формули 1, як визначено в п. 1, або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
25. Фармацевтична композиція за п. 24, яка відрізняється тим, що композиція призначена для лікування або профілактики цукрового діабету або ожиріння.
Текст
1. Сполука формули (1) або її фармацевтично прийнятна сіль: A B (1) O NH2 , дe А вибраний з групи, яка складається із замісників наступних формул з (2) по (7): 2 3 89396 де R4 являє собою водень, галоген або заміщений або незаміщений С1-С4алкіл, або вибраний із замісників наступних формул (6а) і (6b): R5 (6а) X (6b) , де R5 являє собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і X являє собою кисень, сірку або сульфон; (7) R6 N , де R6 являє собою галоген або заміщений або незаміщений С1-С4алкіл; В вибраний із групи, яка складається із замісників наступних формул з (8) по (11): R10 R9 R8 N O (8) 4 R17 N (11) O , де R17 являє собою заміщений або незаміщений С1-С4алкіл. 2. Сполука за п. 1 або її фармацевтично прийнятна сіль, де заміщений С1-С4алкіл являє собою алкіл, заміщений галогеном. 3. Сполука за п. 2 або її фармацевтично прийнятна сіль, де галоген являє собою фтор. 4. Сполука за п. 1 або її фармацевтично прийнятна сіль, де А являє собою замісник формули (5), і R3 вибраний із групи, яка складається з наступних замісників: водень; заміщений або незаміщений С1-С4алкіл; група формули -CH2-R18, де R18 являє собою С1С4алкоксіалкіл або С3-С7циклоалкіл, незаміщений або заміщений галогеном або гідрокси, або феніл, незаміщений або заміщений галогеном або гідроксилом, або 5- або 6-членний гетероарил; заміщений або незаміщений С3-С7циклоалкіл; група формули R19 R20 R7 , де R7, R8, R9 і R10, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; R13 R 12 N Y O (9) R11 , де R11, R12 і R13, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і Y являє собою кисень, сірку або SO2; R15 N Z R14 O (10) , де R14 і R15, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і Z являє собою -СН- або кисень, де Z являє собою кисень, R14 відсутній; , де R19 і R20, кожний, незалежно являють собою водень, галоген або заміщений або незаміщений С1-С4алкіл; і 5-членний або 6-членний гетероарил, незаміщений або заміщений галогеном або гідрокси. 5. Сполука за п. 4 або її фармацевтично прийнятна сіль, де заміщений С3-С7циклоалкіл і С1-С4алкіл являють собою циклоалкіл і алкіл, заміщений галогеном або гідрокси. 6. Сполука за п. 1 або її фармацевтично прийнятна сіль, де гетероарил являє собою 2-фуран, 3фуран, 2-тіофен, 3-тіофен, 2-піридин, 3-піридин, 4піридин, 2-пірол або 3-пірол. 7. Сполука за п. 1 або її фармацевтично прийнятна сіль, де сполука являє собою стереоізомер, як представлено в наступній формулі (Іа): A B (la) O NH2 , де А і В є тими ж самими, як у формулі (1). 8. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вибрана із групи, яка складається з наступних сполук: 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро8Н-[1,2,4]триазоло[4,3-а]піразин-7іл)бутил]оксазолідин-2-он; 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5метилоксазолідин-2-он; 5 89396 6 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-aміно-4-оксо-4-[2-феніл-48Н-[1,2,4]триазоло[4,3-а]піразин-7(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиніл)бутил]піперидин-2-он; 7(6Н)-іл]бутил}-6-метилморфолін-3-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-оксо-4-[2-феніл-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметилпіролідин-2-он; 7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-[2-циклопропіл-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4,4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндиметилпіролідин-2-он; 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-[2-циклопропіл-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинфторпіролідин-2-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-аміно-4-[2-циклопропіл-48Н-[1,2,4]триазоло[4,3-а]піразин-7(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиніл)бутил]піролідин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-оксо-4-[5-(трифторметил)-3,48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3дигідроізохінолін-2(1H)-іл]бутил}-5,5фторпіперидин-2-он; дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-аміно-4-оксо-4-[5-(трифторметил)8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-33,4-дигідроізохінолін-2(1Н)-іл]бутил}-6метилпіролідин-2-он; метилморфолін-3-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметил-1,5-дигідропірол-2-он; 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-аміно-4-[2-(4-фторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-[2-(3-фторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5,5(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндифторпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-аміно-4-[2-(3-фторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5R(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-3(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиназабіцикло[3,1,0]гексан-2-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтрифторметилпіролідин-2-он; 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(6S)-4-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтрифторметилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(5R)-1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтрифторметилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 4-[2S-аміно-4-оксо-4-(3-трифторметил-5,6-дигідро(5R)-1-{(2S)-2-аміно-4-[2-циклопентил-48Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-6(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметилморфолін-3-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4(6S)-4-{(2S)-2-аміно-4-[2-циклопентил-4оксобутил]піперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; оксобутил]-4-метилпіролідин-2-он; 1-{(2S)-2-аміно-4-[2-циклопентил-41-[2S-аміно-4-оксо-4-(3-трифторметил-4,5-дигідро(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7Н-ізоксазоло[3,4-с]піридин-6-іл)бутил]піперидин7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 2-он; (5R)-1-[(2S)-2-аміно-4-оксо-4-{2-[41-[2S-аміно-4-оксо-4-(3-трифторметил-1,4,5,7(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5тетрагідропіразоло[3,4-с]піридин-6с]піридин-5(4Н)-іл}бутил]-5-метилпіперидин-2-он; іл)бутил]піперидин-2-он; (6S)-4-[(2S)-2-аміно-4-оксо-4-{2-[41-[2S-аміно-4-оксо-4-(4-трифторметил-5,8-дигідро(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,56Н-піридо[3,4-d]піримідин-7-іл)-бутил]-5R-метил-1с]піридин-5(4Н)-іл}бутил]-6-метилморфолін-3-он; піперидин-2-он; 1-[(2S)-2-аміно-4-оксо-4-{2-[4(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-феніл-4(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинс]піридин-5(4Н)-іл}бутил]-5,5-дифторпіперидин-27(6Н)-іл]бутил}-5-метилпіперидин-2-он; он; 7 89396 8 (5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,7(5R)-1-{(2S)-2-аміно-4-[2-(3-фурил)-4дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиноксобутил}-5-метилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(4-фторфеніл)-6,71-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}-65,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4метилморфолін-3-он; оксобутил}-5,5-дифторпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,7(5R)-1-{(2S)-2-aміно-4-оксо-4-[2-(1Н-пірол-2-іл)-4дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиноксобутил}-5,5-дифторпіперидин-2-он; 7(6Н)-іл]бутил}-5-метилпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н1-{(2S)-2-аміно-4-оксо-4-[2-(1Н-пірол-2-іл)-4піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5(4Н)-іл]бутил}-5-метилпіперидин-2-он; 7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; (6S)-4-{(2R)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-4піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5(4Н)-іл]бутил}-6-метилморфолін-3-он; 7(6Н)-іл]бутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н-піран-41-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-4іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиніл]бутил}-5,5-дифторпіперидин-2-он; 7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; (6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(трифторметил)1-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)-5,86,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4іл]бутил}-6-метилморфолін-3-он; оксобутил}-5,5-дифторпіперидин-2-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(трифторметил)-6,7(6S)-4-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]бутил}5,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-45,5-дифторпіперидин-2-он; оксобутил}-6-метилморфолін-3-он; (5R)-1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-41-{(2S)-2-аміно-4-[2-ізопропіл-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; оксобутил}-5,5-дифторпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-41-{(2S)-2-аміно-4-[2-ізопропіл-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; оксобутил}-5-метилпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(циклопропілметил)-4(6S)-4-{(2S)-2-аміно-4-[2-ізопропіл-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-[2-(циклопропілметил)-4(6R)-4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; іл]бутил}-6-метилморфолін-3-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-4(6S)-4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)7(6Н)-іл]бутил}-5-метилпіперидин-2-он; іл]бутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-4(5S)-1-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; іл]бутил}-5-метилпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(4-фторбензил)-4(5S)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(4-фторбензил)-4(5R)-1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; оксобутил}-5-метилпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-4(5R)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5-метилпіперидин-2-он; оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-41-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-5,5-дифторпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-4(5R)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5-метилпіперидин-2-он; оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-41-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-5,5-дифторпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(2-фурил)-4(6S)-4-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-[2-(2-фурил)-4-(трифторметил)1-{(2S)-2-аміно-4-оксо-4-[4-(трифторметил)-5,85,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-5,5оксобутил}-5,5-дифторпіперидин-2-он; дифторпіперидин-2-он; 9 89396 10 (6S)-4-{(2S)-2-аміно-4-оксо-4-[4-(трифторметил)1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,85,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-46-метилморфолін-3-он; оксобутил}-4-метилоксопіперидин-2-он; 1-{(2S)-2-аміно-4-оксо-4-[3-(пентафторетил)-5,61-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-4-метилпіперидин-2-он; (6S)-4-{(2S)-2-аміно-4-оксо-4-[3-(пентафторетил)(5R)-1-{(2S)-2-аміно-4-[2-циклобутил-45,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиніл]бутил}-6-метилморфолін-3-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,81-{(2S)-2-аміно-4-[2-циклобутил-4-(трифторметил)дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-45,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-4оксобутил}-6-метилтіоморфолін-3-он; оксобутил}-5,5-дифторпіперидин-2-он. 1-{(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)9. Сполука за п. 1 або її фармацевтично прийнят5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4на сіль, яка відрізняється тим, що вибрана з (5R)оксобутил}-5,5-дифторпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8(6S)-4-{(2S)-2-аміно-4-[2-трет-бутил-4дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиноксобутил}-5-метилпіперидин-2-ону і його солі ма7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; леїнової кислоти, фосфорної кислоти, винної кис4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)-5,6лоти, хлороводневої кислоти, метансульфонової дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)кислоти або лимонної кислоти. іл]бутил}-6-метилтіоморфолін-3-он; 10. Сполука за п. 1 або її фармацевтично прийня(5R)-1-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)тна сіль, яка відрізняється тим, що вибрана з 5,8-дигідропіридо[3,4-d]піридин-7(6Н)-іл]-4(5R)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8оксобутил}-5-метилпіперидин-2-он; дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)оксобутил}-5-метилпіперидин-2-ону і його солі ма4-(трифторметил)-5,8-дигідропіридо[3,4леїнової кислоти, фосфорної кислоти, винної кисd]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он; лоти, хлороводневої кислоти, метансульфонової (6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4кислоти або лимонної кислоти. (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин11. Сполука за п. 1 або її фармацевтично прийня7(6Н)-іл]бутил}-6-метилморфолін-3-он; тна сіль, яка відрізняється тим, що вибрана з 11-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-5,5-дифторпіперидин-2-ону і його солі (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-4малеїнової кислоти, фосфорної кислоти, винної (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинкислоти, хлороводневої кислоти, метансульфоно7(6Н)-іл]бутил}-5-метилпіперидин-2-он; вої кислоти або лимонної кислоти. 1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-412. Сполука за п. 1 або її фармацевтично прийня(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтна сіль, яка відрізняється тим, що вибрана з 7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; (6S)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(5R)-1-{(2S)-2-аміно-4-[2-(фторметил)-4дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиноксобутил}-6-метилморфолін-3-ону і його солі ма7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; леїнової кислоти, фосфорної кислоти, винної кис1-{(2S)-2-аміно-4-[2-(фторметил)-4лоти, хлороводневої кислоти, метансульфонової (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинкислоти або лимонної кислоти. 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 13. Сполука за п. 1 або її фармацевтично прийня1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8тна сіль, яка відрізняється тим, що вибрана з 1дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4{(2S)-2-аміно-4-[2-метил-4-(трифторметил)-5,8оксобутил}-4-метил-1,5-дигідро-2Н-пірол-2-он; дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-41-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)оксобутил}-5,5-дифторпіперидин-2-ону і його солі 5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4малеїнової кислоти, фосфорної кислоти, винної оксобутил}-4-метил-1,5-дигідро-2Н-пірол-2-он; кислоти, хлороводневої кислоти, метансульфоно1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8вої кислоти або лимонної кислоти. дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-414. Сполука за п. 1 або її фармацевтично прийняоксобутил}-4-метилоксопіролідин-2-он; тна сіль, яка відрізняється тим, що вибрана з 1-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)(6S)-4-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-45,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4оксобутил}-4-метилпіролідин-2-он; оксобутил}-6-метилморфолін-3-ону і його солі ма1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8леїнової кислоти, фосфорної кислоти, винної кисдигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4лоти, хлороводневої кислоти, метансульфонової оксобутил}-5-(трифторметил)піперидин-2-он; кислоти або лимонної кислоти. 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,815. Сполука за п. 1 або її фармацевтично прийнядигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4тна сіль, яка відрізняється тим, що вибрана з оксобутил}-4-(трифторметил)піролідин-2-он; (6S)-4-{(2S)-2-аміно-4-[2-(4-фторфеніл)-41-{(2S)-2-аміно-4-[2-(3-фурил)-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-2-ону і оксобутил}-4-(трифторметил)піролідин-2-он; його солі малеїнової кислоти, фосфорної кислоти, 11 89396 12 винної кислоти, хлороводневої кислоти, метансу7(6Н)-іл]бутил}-6-метилморфолін-3-ону і його солі льфонової кислоти або лимонної кислоти. малеїнової кислоти, фосфорної кислоти, винної 16. Сполука за п. 1 або її фармацевтично прийнякислоти, хлороводневої кислоти, метансульфонотна сіль, яка відрізняється тим, що вибрана з 1вої кислоти або лимонної кислоти. {(2S)-2-аміно-4-[2-трет-бутил-4-(трифторметил)21. Сполука за п. 1 або її фармацевтично прийня5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4тна сіль, яка відрізняється тим, що вибрана з 1оксобутил}-5,5-дифторпіперидин-2-ону і його солі {(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4малеїнової кислоти, фосфорної кислоти, винної (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинкислоти, хлороводневої кислоти, метансульфоно7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-ону і його вої кислоти або лимонної кислоти. солі малеїнової кислоти, фосфорної кислоти, вин17. Сполука за п. 1 або її фармацевтично прийняної кислоти, хлороводневої кислоти, метансультна сіль, яка відрізняється тим, що вибрана з фонової кислоти або лимонної кислоти. (6S)-4-{(2S)-2-аміно-4-[2-трет-бутил-422. Сполука за п. 1 або її фармацевтично прийня(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтна сіль, яка відрізняється тим, що вибрана з 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і (5R)-1-{(2S)-2-аміно-4-[2-(фторметил)-4його солі малеїнової кислоти, фосфорної кислоти, (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинвинної кислоти, хлороводневої кислоти, метансу7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-ону і льфонової кислоти або лимонної кислоти. його солі малеїнової кислоти, фосфорної кислоти, 18. Сполука за п. 1 або її фармацевтично прийнявинної кислоти, хлороводневої кислоти, метансутна сіль, яка відрізняється тим, що вибрана з льфонової кислоти або лимонної кислоти. (6S)-4-{(2S)-2-аміно-4-[2-циклопропіл-423. Сполука за п. 1 або її фармацевтично прийня(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинтна сіль, яка відрізняється тим, що вибрана з 17(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-ону і {(2S)-2-аміно-4-[2-(фторметил)-4-(трифторметил)його солі малеїнової кислоти, фосфорної кислоти, 5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4винної кислоти, хлороводневої кислоти, метансуоксобутил}-5,5-дифторпіперидин-2-ону і його солі льфонової кислоти або лимонної кислоти. малеїнової кислоти, фосфорної кислоти, винної 19. Сполука за п. 1 або її фармацевтично прийнякислоти, хлороводневої кислоти, метансульфонотна сіль, яка відрізняється тим, що вибрана з вої кислоти або лимонної кислоти. (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)24. Фармацевтична композиція для інгібування 4-(трифторметил)-5,8-дигідропіридо[3,4дипептидилпептидази-IV (DPP-IV), яка містить d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2ефективну кількість сполуки формули 1, як визнаону і його солі малеїнової кислоти, фосфорної чено в п. 1, або її фармацевтично прийнятну сіль і кислоти, винної кислоти, хлороводневої кислоти, фармацевтично прийнятний носій. метансульфонової кислоти або лимонної кислоти. 25. Фармацевтична композиція за п. 24, яка відрі20. Сполука за п. 1 або її фармацевтично прийнязняється тим, що композиція призначена для літна сіль, яка відрізняється тим, що вибрана з кування або профілактики цукрового діабету або (6S)-4-{(2S)-2-aміно-4-oкco-4-[2-(пентафторетил)-4ожиріння. (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин Галузь винаходу Даний винахід стосується сполук із новою структурою, які мають виражену інгібувальну активність відносно дипептидилпептидази-IV (DPP-IV), способів їх одержання, а також фармацевтичних композицій, які містять вказані сполуки у вигляді активного інгредієнта. Рівень техніки Цукровий діабет впливає на здоров'я людей і супроводжується різними ускладненнями. Існує два основних типи цукрового діабету: цукровий діабет 1 типу, що характеризується незначною або повністю відсутньою здатністю до секреції інсуліну в результаті руйнування клітин підшлункової залози, і діабет II типу, що характеризується недоліком інсуліну та інсулінорезистентністю внаслідок інших причин. Поширеність цукрового діабету II типу становить 90% або більше серед усіх пацієнтів, які занедужали цукровим діабетом. Типові приклади ускладнень, які супроводжують діабет, включають гіперліпідемію, гіпертензію, ретинопатію та ниркову недостатність (Paul Zimmer, et al., Nature, 2001, 414, 782). Препарати сульфонілсечовини (які стимулюють секрецію інсуліну в клітинах підшлунко вої залози), бігуаніди (які інгібують утворення глюкози в печінці), інгібітори a-глюкозидази (які інгібують всмоктування глюкози в кишечнику) та інші використовують для лікування діабету. Останнім часом агоністи ядерних гаммарецепторів, які активуються проліфератором пероксисом (PPARg), (тіазолідиндіони, які збільшують чутливість до інсуліну) привертають увагу як терапевтичні агенти для лікування діабету. Однак, дані препарати викликають такі побічні реакції, як гіпоглікемію, збільшення ваги та інші (David Ε. Moller, Nature, 2001, 414, 821). Відповідно, існує більша потреба в розробці терапевтичних агентів для лікування діабету, які мають менші побічні ефекти, зокрема, таких, що не викликають гіпоглікемію та збільшення ваги. Нещодавно було виявлено, що в мишей, дефіцитних до дипептидилпептидази-IV (DPP-IV), підтримується активність глюкагоноподібного протеїну 1 (GLP-I) і високий рівень інсуліну, що призводить до зниженого рівня глюкози крові, що свідчить про можливості використання вказаної сполуки як терапевтичного агента для лікування діабету (Marguet D. et al., Natl. Acad. Sd USA, 13 89396 14 (2000) 97, 6874-6879). GLP-I індукує диференціювання та ріст р-клітин підшлункової залози in vivo, а також відіграє важливу роль в утворенні та секреції інсуліну. GLP-I інактивується DPP-IV, а крім того було показано, що інгібітори DPP-IV підсилюють секрецію інсуліну за допомогою інгібування вищевказаного механізму інактивації. Інгібітори DPP-IV також розробляються для лікування ожиріння, оскільки вони призводять до виникнення де Ar являє собою незаміщену або замінену почуття насичення в щурів і зменшують засвоєння фенільну групу; R19, R20 і R21 являють собою воїжі в кишечнику, що призводить до втрати ваги. день або алкільну групу; і Q являє собою азот або Більше того, багато досліджень і експерименти на заміщений вуглець. тваринах показали, що інгібітори DPP-IV контроВказані DPP-IV інгібітори у своїх молекулярних люють рівень глюкози та ліпідів крові (Pospislik J. структурах мають амідний зв'язок аналогічно даΑ., et al., Diabetes, (2002) 51, 943-950). У зв'язку з ному винаходу; проте, незаміщені або заміщені цим, інгібітори DPP-IV можуть бути розглянуті як фенільні групи, які представлені як Ar в у вказаних потенційно корисних агентів для лікування діабету. вище формулах даних інгібіторів повністю відрізДотепер, множина досліджень, спрямованих няються від заміщених або незаміщених, 5на розробку інгібіторів DPP-IV, були зосереджені членних або 6-членних гетероциклічних замісників на сполуках, в яких ціаногрупа зв'язана з піролідиданого винаходу. Крім того, DPP-IV інгібітори дановим кільцем. Наприклад, WO 00/34241 розкриного винаходу, які мають лактамове кільце в поває інгібітори DPP-IV, представлені наступною ложення фенільної групи вказаних вище інгібітоформулою. рів, не розкриті в рівні техніки. Розкриття винаходу Технічне завдання У даному винаході, при виконанні великих досліджень і численних експериментів для розробки сполук, які мають DPP-IV інгібіторні ефекти, було знайдено, що сполуки, які мають необов'язково заміщену лактамову кільцеву структуру, демонде R являє собою адамантильну групу, і n має струють відмінну інгібувальну активність відносно значення від 0 до 3. DPP-IV. Даний винахід здійснений на основі такого Інші інгібітори розкриті в WO 04/064778, WO висновку. 03/004498, WO 03/082817, і так далі, і серед них, Отже, об'єктом винаходу є нові сполуки з неWO 04/064778 розкриває DPP-IV інгібітори, предобов'язково заміщеною лактамовою кільцевою ставлені формулою, вказаною нижче. структурою, які мають високу інгібувальну активність відносно DPP-IV. Крім того, об'єктом даного винаходу є способи одержання вказаних сполук. Іншим об'єктом даного винаходу є фармацевтичні композиції для інгібування DPP-IV активності, які містять фармацевтично ефективну кількість таких сполук як активного інгредієнта, і також способи лікування або профілактики захворювань, де Ar являє собою незаміщену або заміщену викликаних невідповідною активністю DPP-IV за фенільну групу; R15, R16 і R17 являють собою ворахунок застосування сполук даного винаходу. Інші об'єкти та переваги даного винаходу будень або алкільну групу; і U, V і W являють собою дуть очевидні середньому фахівцеві з наступного азот, кисень, або заміщений азот або вуглець. детального опису. WO 03/004498 розкриває DPP-IV інгібітори, Технічне рішення представлені формулою, вказаною нижче. Відповідно до даного винаходу, забезпечена сполука формули 1, представлена нижче. де Ar являє собою незаміщену або заміщену фенільну групу; R18 являє собою водень або алкільну групу; і Τ являє собою азот або заміщений вуглець. WO 03/082817 розкриває DPP-IV інгібітори, представлені формулою, вказаною нижче. де А вибраний із групи, яка складається із, замісників формул з 2 по 7, представлених нижче: 15 де R1 являє собою водень, або заміщений або незаміщений С1-С4 алкіл; і X являє собою вуглець або азот; 89396 16 де R6 являє собою галоген, або заміщений або незаміщений С1-С4 алкіл; (В) В вибраний із групи, яка складається із замісників формул з 8 по 11, представлених нижче: де R2 являє собою водень, або заміщений або незаміщений С1-С4 алкіл; де R7, R8, R9 і R10, кожний, незалежно являє собою водень, галоген, або заміщений або незаміщений С1-С4 алкіл; де R3 являє собою водень, або заміщений або незаміщений алкіл, циклоалкіл, арил або гетероарил; і R'3 являє собою водень, CF3; де R11, R12 i R13, кожний, незалежно являє собою водень, галоген, або заміщений або незаміщений С1-С4 алкіл; і Υ являє собою кисень, сірку або SO2; де R4 являє собою водень, галоген, або заміщений або незаміщений С1-С4 алкіл, або вибраний із замісників формул 6а і 6b, представлених нижче: де R14 і R15, кожний, незалежно являє собою водень, галоген, або заміщений або незаміщений С1-С4 алкіл; і Ζ являє собою -СН- або кисень, де Ζ являє собою кисень, R відсутній; де R5 являє собою водень, галоген, або заміщений або незаміщений С1-С4 алкіл; і X являє собою кисень, сірку, або сульфон; де R являє собою заміщений або незаміщений С1-С4 алкіл. Де С1-С4 алкіл є заміщеним, як визначено у вказаній вище формулі, переважно є, що алкіл заміщений галогеном, і більш переважно, що алкіл заміщений фтором. 17 89396 18 Сполука даного винаходу або її фармацевтичУ переважному втіленні, R5 у формулі 5 вибно прийнятні солі можуть бути представлені у вираний із групи, яка складається з представлених гляді гідрату або сольвату. нижче замісників: В особливо переважному втіленні, сполуки водню; формули 1 за даним винаходом являють собою заміщеного або незаміщеного С1-С4 алкілу; сполуки як визначено нижче: групи формули -CH2-R18, де R18 являє собою 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6С1-С4 алкоксіалкіл, або С3-С7 циклоалкіл, незамідигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)щений або заміщений галогеном або гідрокси, або бутил]-оксазолідин-2-он; феніл, незаміщений або заміщений галогеном або 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6гідрокси; дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)заміщеного або незаміщеного С3-С7 циклоалбутил]-5-метил-оксазолідин-2-он; кілу; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6групи формули дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-піперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4-метилпіролідин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-4,4-диметилпіролідин-2-он; де R19 і R20, кожний, незалежно являє собою 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6водень, галоген, або заміщений або незаміщений дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)С1-С4 алкіл; і бутил]-3-фторпіролідин-2-он; 5-членного або 6-членного гетероарилу, неза1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6міщеного або заміщеного галогеном або гідрокси. дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)У вказаному вище втіленні, де С3-С7 циклоалбутил]-піролідин-2-он; кіл і С1-С4 алкіл являють собою заміщену форму, 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6вони переважно являють собою циклоалкіл і алкіл, дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)заміщений галогеном або гідрокси. бутил]-3-фторпіперидин-2-он; Переважні приклади гетероарилу, як визначе1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6но вище, включають, але без обмеження 2-фуран, дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)3-фуран, 2-тіофен, 3-тіофен, 2-піридин, 3-піридин, бутил]-3-метилпіролідин-2-он; 4-піридин, 2-пірол, 3-пірол, і так далі. 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6Сполуки за даним винаходом включають їх дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)номери, і переважно ізомер являє собою сполуку бутил]-4-метил-1,5-дигідропірол-2-он; формули Іа, представленої нижче, в якій атом вуг1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6лецю, суміжний із групою NH2, є хіральним дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)центром: бутил]-4-метилпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5,5-дифторпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутил]-5R-метилпіперидин-2-он; 3-[2S-аміно-4-оксо-4-(3-трифторметил-5,6де, А і В є тими ж самими, як у формулі 1. дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)Сполука даного винаходу може утворювати бутил]-3-азабіцикло[3,1,0]гексан-2-он; кислотний адукт із фармацевтично прийнятною 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6кислотою. Як використовують у даному винаході, дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)фармацевтично прийнятна сіль включає неорганібутил]-4-трифторметилпіролідин-2-он; чні солі, органічні солі, солі амінокислоти, і так 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6далі, і більш конкретно, солі з неорганічними кисдигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)лотами, такими як соляна кислота, бромводнева бутил]-4-трифторметилпіперидин-2-он; кислота, фосфорна кислота або сірчана кислота; 1-[2S-аміно-4-оксо-4-(3-трифторметил-5,6солі з органічними карбоновими кислотами, такидигідро-8Н-[1,2,4]триазоло[4,3-а] піразин-7-іл)ми як оцтова кислота, лимонна кислота, трифтобутил]-5-трифторметилпіперидин-2-он; роцтова кислота, мурашина кислота, малеїнова 4-[2S-аміно-4-оксо-4-(3-трифторметил-5,6кислота, щавлева кислота, бурштинова кислота, дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бензойна кислота, винна кислота, фумарова кисбутил]-6-метилморфолін-3-он; лота, мигдальна кислотна, аскорбінова кислота, 1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4яблучна кислота і подібні до них солі; солі з метаоксобутил]-піперидин-2-он; нсульфоновою кислотою, п-толуолсульфоновою 1-[2S-аміно-4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4кислотою та подібні до них. оксобутил]-4-метилпіролідин-2-он; 19 89396 20 1-[2S-аміно-4-оксо-4-(3-трифторметил-4,5(5R)-1-[(2S)-2-аміно-4-оксо-4-{2-[4дигідро-7Н-ізоксазоло[3,4-с]піридин-6-іл)бутил](трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5піперидин-2-он; с]піридин-5(4Н)-іл}бутил]-5-метилпіперидин-2-он; 1-[2S-аміно-4-оксо-4-(3-трифторметил-1,4,5,7(6S)-4-[(2S)-2-аміно-4-оксо-4-{2-[4тетрагідропіразоло[3,4-с]піридин-6-іл)-бутил](трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5піперидин-2-он; с]піридин-5(4Н)-іл}бутил]-6-метилморфолін-3-он; 1-[2S-аміно-4-оксо-4-(4-трифторметил-5,81-[(2S)-2-аміно-4-оксо-4-{2-[4дигідро-6H-піридо[3,4-d]піримідин-7-іл)-бутил]-5R(трифторметил)феніл]-6,7-дигідро[1,3]тіазоло[4,5метил-1-піперидин-2-он; с]піридин-5(4Н)-іл}бутил]-5,5-дифторпіперидин-2(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-феніл-4он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,77(6Н)-іл]бутил}-5-метилпіперидин-2-он; дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-4(6S)-4-{(2S)-2-аміно-4-оксо-4-[2-феніл-4оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-оксо-4-[2-(47(6Н)-іл]бутил}-6-метилморфолін-3-он; фторфеніл)6,7-дигідро[1,3]тіазоло[4,5-с]піридин1-{(2S)-2-аміно-4-оксо-4-[2-феніл-45(4Н)-іл]бутил}-6-метилморфолін-3-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піридин1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-6,77(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)-іл]-41-{(2S)-2-аміно-4-[2-циклопропіл-4оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин1-{(2S)-2-аміно-4-[2-циклопропіл-45(4Н)-іл]бутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2R)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин(6S)-4-{(2S)-2-аміно-4-[2-циклопропіл-45(4Н)-іл]бутил}-6-метилморфолін-3-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-оксо-4-[2-(тетрагідро-2Н7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; піран-4-іл)-6,7-дигідро[1,3]тіазоло[4,5-с]піридин1-{(2S)-2-аміно-4-оксо-4-[5-(трифторметил)5(4Н)-іл]бутил}-5,5-дифторпіперидин-2-он; 3,4-дигідроізохінолін-2(1Н)-іл]бутил}-5,5(6S)-4-{(2S)-2-аміно-4-оксо-4-[2дифторпіперидин-2-он; (трифторметил)-6,7-дигідро[1,3]тіазоло[4,5(6S)-4-{(2S)-2-аміно-4-оксо-4-[5с]піридин-5(4Н)-іл]бутил}-6-метилморфолін-3-он; (трифторметил)-3,4-дигідроізохінолін-2(1Н)1-{(2S)-2-аміно-4-оксо-4-[2-(трифторметил)іл]бутил}-6-метилморфолін-3-он; 6,7-дигідро[1,3]тіазоло[4,5-с]піридин-5(4Н)1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-4іл]бутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-[2-(4-фторфеніл)-47(6Н)-іл]-4-оксобутил}-5-метилпіперидиіі-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-(2-метоксіетил)-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-(3-фторфеніл)-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(циклопропілметил)-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-[2-(3-фторфеніл)-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-(циклопропілметил)-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(4-фторфеніл)-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-47(6Н)-іл]бутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-оксо-4-[2-піридин-4-іл-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(4-фторбензил)-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-(3,4-дифторфеніл)-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-(4-фторбензил)-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-[2-циклопентил-47(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-[2-циклопентил-47(6Н)-іл]бутил}-5-метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-оксо-4-[2-(3-тієніл)-47(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин1-{(2S)-2-аміно-4-[2-циклопентил-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-5,5-дифторшперидин-2-он; 21 89396 22 (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-4(5R)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5-метилпіперидин-2-он; оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(2-тієніл)-41-{(2S)-2-аміно-4-[2-метил-4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-5,5-дифторпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(2-фурил)-4(6S)-4-{(2S)-2-аміно-4-[2-метил-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d)піримідин7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-[2-(2-фурил)-41-{(2S)-2-аміно-4-оксо-4-[4-(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}7(6Н)-іл]-4-оксобутил}-5,5-дифторпіпеpидин-2-он; 5,5-дифторпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(3-фурил)-4(6S)-4-{(2S)-2-аміно-4-оксо-4-[4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил)-5-метилпіперидин-2-он; 7(6Н)-іл]бутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-[2-(3-фурил)-41-{(2S)-2-аміно-4-оксо-4-[3-(пентафторетил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; іл]бутил}-5,5-дифторпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-(1Н-пірол-2-іл)(6S)-4-{(2S)-2-аміно-4-оксо-4-[34-(трифторметил)-5,8-дигідропіридо[3,4(пентафторетил)-5,6-дигідро[1,2,4]триазоло[4,3d]піримідин-7(6Н)-іл]бутил}-5-метилпіперидин-2-он; а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(1Н-пірол-2-іл)-44-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; оксобутил}-6-метилтіоморфолін-3-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-41-{(2S)-2-аміно-4-[2-трет-бутил-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]бутил}-5-метилпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 1-{(2S)-2-аміно-4-оксо-4-[2-піридин-3-іл-4(6S)-4-{(2S)-2-аміно-4-[2-трет-бутил-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-[2-етил-4-(трифторметил)4-{(2S)-2-аміно-4-оксо-4-[3-(трифторметил)5,8-дигідропіридо[3,4-d|піримідин-7(6Н)-іл]-45,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)оксобутил}-5,5-дифторпіперидин-2-он; іл]бутил}-6-метилтіоморфолін-3-он; (6S)-4-{(2S)-2-аміно-4-[2-етил-4(5R)-1-{(2S)-2-аміно-4-[2-етил-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-ізопропіл-4(5R)-1-{(2S)-2-аміно-4-оксо-4-[2(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(пентафторетил)-4-(трифторметил)-5,87(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; дигидропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-51-{(2S)-2-аміно-4-[2-ізопропіл-4метилпіперидин-2-он; (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(6S)-4-{(2S)-2-аміно-4-оксо-4-[27(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; (пентафторетил)-4-(трифторметил)-5,8(6S)-4-{(2S)-2-аміно-4-[2-ізопропіл-4дигидропіридо[3,4-d]піримідин-7(6Н)-іл]бутил}-6(трифторметил)-5,8-дигідропіридо[3,4-d]піримідинметилморфолін-3-он; 7(6Н)-іл]-4-оксобутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-(пентафторетил)-4(6R)-4-{(2S)-2-аміно-4-оксо-4-[3(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,37(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он; (5R)-1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-4(6S)-4-{(2S)-2-аміно-4-оксо-4-[3(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,37(6Н)-іл]бутил}-5-метилпіперидин-2-он; а]піразин-7(8Н)-іл]бутил}-6-метилморфолін-3-он; 1-{(2S)-2-аміно-4-оксо-4-[2-пропіл-4(5S)-1-{(2S)-2-аміно-4-оксо-4-[3(трифторметил)-5,8-дигідропіридо[3,4-d]піридин(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,37(6Н)-іл]бутил}-5,5-дифторпіперидин-2-он; а]піразин-7(8Н)-іл]бутил}-5-метилпіперидин-2-он; (5R)-1-{(2S)-2-аміно-4-[2-(фторметил)-4(5S)-1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин5,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(фторметил)-4(5R)-1-{(2S)-2-аміно-4-[2-метил-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(5R)-4-{(2S)-2-аміно-4-[2,4-біс(трифторметил)дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-45,8-дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4оксобутил}-4-метил-1,5-дигідро-2Н-пірол-2-он; оксобутил}-5-метилпіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(3-фурил)-41-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8(трифторметил)-5,8-дигідропіридо[3,4-d]піримідиндигідропіридо[3,4-d]піримідин-7(6Н)-іл]-47(6Н)-іл]-4-оксобутил}-4-метил-1,5-дигідро-2Ноксобутил}-5,5-дифторпіперидин-2-он; пірол-2-он; 23 89396 24 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8Р1 являє собою амінозахисну групу; і дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4G1 відсутній, або являє собою соляну кислоту, оксобутил}-4-метилоксопіролідин-2-он; сірчану кислоту або трифтороцтову кислоту. 1-{(2S)-2-аміно-4-[2-(3-фурил)-4Вказана вище реакція може бути проведена в (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинприсутності органічного розчинника, такого як дих7(6Н)-іл]-4-оксобутил}-4-метилпіролідин-2-он; лоретан або циклічний ефір (наприклад, тетрагід1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8рофуран (ТГФ)) в інтервалі температур від -10 до дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-44°С. Продукт реакції може бути виділений та очиоксобутил}-5-(трифторметил)піперидин-2-он; щений від реагентів відомими способами, такими 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8як хроматографія. дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4Сполука формули 12, вказаної вище може буоксобутил}-4-(трифторметил)піролідин-2-он; ти отримана відповідно до реакційної Схеми 1, 1-{(2S)-2-аміно-4-[2-(3-фурил)-4представленої нижче: (трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-4-(трифторметил)піролідин[Реакційна Схема 1] 2-он; 1-{(2S)-2-аміно-4-[2,4-біс(трифторметил)-5,8дигідропіридо[3,4-d]піримідин-7(6Н)-іл]-4оксобутил}-4-метилоксопіперидин-2-он; 1-{(2S)-2-аміно-4-[2-(3-фурил)-4(трифторметил)-5,8-дигідропіридо[3,4-d]піримідин7(6Н)-іл]-4-оксобутил}-4-метилпіперидин-2-он; де (5R)-1-{(2S)-2-аміно-4-[2-циклобутил-4а являє собою ClCO2Et, Et3N, ТГФ; NaBH4, (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинMeOH; 7(6Н)-іл]-4-оксобутил}-5-метилпіперидин-2-он; b являє собою TBSCl, імідазол, ДМФА; 1-{(2S)-2-аміно-4-[2-циклобутил-4с являє собою Pd/C, H2 (бензиловий ефір) або (трифторметил)-5,8-дигідропіридо[3,4-d]піримідинLiOH-H2O, Me0H-H2O (метиловий або етиловий 7(6Н)-іл]-4-оксобутил}-5,5-дифторпіперидин-2-он. ефір); Даний винахід також стосується способів одеd являє собою EDC, НОВТ, АН; ржання сполуки формули 1. e являє собою TBAF, ТГФ; У першому ілюстративному способі одержанf являє собою реагент Сверна[О] (Swern) або ня, сполука формули 1 може бути отримана спореагент Десс Мартіна[О] (Dess Martin); собом, що включає стадію взаємодії сполуки форА і Ρ1 є тими ж самими, як визначено вище; і мули 12, представленої нижче, із сполукою Р2 являє собою бензил, метил або етил. формули 13 і стадію видалення амінозахисної груБільш конкретно, карбонову кислоту формули пи Р1: 14, вказаної вище перетворюють на ангідрид ефіру, який потім обробляють, використовуючи NaBH4 у присутності метанольного розчинника для одержання первинного спирту як продукту. Отриманий первинний спирт захищають третбутилдиметилсилільною групою, потім у випадку утворення бензилового ефіру, проводять реакцію R21NH2G1 (13), гідролізу, використовуючи платиновий комплекс і водень, а у випадку утворення метилу або етилу, де R21 вибраний із групи, яка складається із проводять реакцію гідролізу, використовуючи гідзамісників формул з 13а по 13d: роксид літію, у такий спосіб одержуючи карбонову кислоту. При цьому, бажана амінова група може бути піддана перетворенню через реакцію зв'язування, використовуючи EDC і НОВТ, після чого TBS групу видаляють, з наступним окислюванням за допомогою методик за Згорном або ДессМартином, щоб одержати альдегід формули 12. У випадку, якщо амінозахисна група являє собою Вос-групу, вона може бути вилучена з використанням TFA або HCl, а у випадку, якщо амінозахисна група являє собою Cbz, вона може бути вилучена з використанням суміші H2/Pd/C або TMSI, а у випадку, якщо амінозахисна група являє собою Fmoc, вона може бути вилучена з використанням Et2NH. де Амін 'A' у формулі 12 може бути отриманий А, В, Υ, Z, R7, R8, R9, R10, R11, R12, R13, R14, R15 і способами, викладеними в WO 04/064778, WO R17 є тими ж самими, як визначено вище; 03/004498, WO 03/082817, і так далі, або можуть R22, R23, R24 і R25, кожний, незалежно являє бути використані комерційно доступні аміни. собою С1-С3 алкіл; 25 89396 26 суміші H2/Pd/C, щоб синтезувати карбонову кислоАльтернативно, сполука формули 12 може буту. У випадку, якщо захисна група Р2 являє собою ти синтезована зі сполуки формули 14 як описано трет-бутил і Ρ1 являє собою Вос-групу, ці захисні у відомій методиці (наприклад, J. Med. Chem. групи разом видаляють, використовуючи суміш 1999, 42(18), 3557-3571; WO 04/069162 і так далі). дихлорметан/TFA, групу аміну знову захищають за Відповідно до другого ілюстративного способу допомогою Вос-групи, щоб синтезувати карбонову одержання, сполука формули 1 може бути отрикислоту. Використовуючи в такий спосіб отриману мана способом, що включає стадію взаємодії спокарбонову кислоту та амін АН, сполуку формули луки формули 13, вказаної вище, із сполукою фо18 одержують за допомогою відомої Реакції с). рмули 15, представленою нижче, стадію У випадку, якщо амінозахисна група Ρ1 являє видалення кислотно-захисної групи Р3: і стадію собою Вос-групу, сполуку формули Іа одержують взаємодії отриманого продукту із сполукою форза допомогою реакції d). У випадку, якщо Ρ1 являє мули АН (де А є тим самим як у формулі 1), з насобою Cbz, Ρ1 видаляють, використовуючи суміш ступним видаленням амінозахисної групи: H2/Pd/C або TMSI, і у випадку, якщо Ρ1 являє собою Fmoc, Ρ1 видаляють, використовуючи Et2NH, у такий спосіб одержуючи сполуку формули Іа. Амін АН у Реакції с) може бути отриманий способами, викладеними в WO 04/064778, WO 04/007468, і так далі, або можуть бути використані комерційно доступні аміни. Серед амінів у Реакції с), амін, як визначено де нижче, може бути синтезований, наприклад, за Р1 є тим самим як визначено вище; і Р3 являє собою бензил або трет-бутил. допомогою реакційної Схеми 3, представленої Наприклад, вказаний вище спосіб може бути нижче: проведений за допомогою реакційної Схеми 2, представленої нижче: дe a) являє собою Na(OAc)3BH, R21NH2G1, і СlСН2СН2Сl; b) являє собою Pd/C, Н2 (бензиловий ефір) або TFA/CH2Cl2 (трет-бутиловий ефір, Р1=Вос) і потім Вос2О; c) являє собою EDC, НОВТ, АН; d) являє собою суміш НСІ/діоксан; А і В є тими ж самими, як визначено вище; Р1 являє собою амінозахисну групу, таку як Вос-група, Cbz або Fmoc; Р2 являє собою бензил або трет-бутил; G1 відсутній, або являє собою соляну кислоту, сірчану кислоту або трифтороцтову кислоту. Спосіб одержання сполуки формули 16 відомий (наприклад, J. Med. Chem. 1999, 42(18), 35573571). Реакцію а) проводять у присутності органічного розчинника, такого як дихлоретан або циклічний ефір (наприклад, тетрагідрофуран (ТГФ)) в інтервалі температур від -10 до 40°С шляхом взаємодії сполуки формули 15 переважно з первинним аміном, взятим у кількості від 0,7 до 1,5 еквівалентів (сполука формули 13). При цьому, далі реакцію циклізації проводять у тих самих умовах, як вказано вище, щоб синтезувати сполуку формули 16, і потім сполук} формули 16 перетворюють на карбонову кислоту формули 17 через Реакцію b). При цьому, у випадку, якщо захисна група Р2 являє собою бензил, Р2 видаляють за допомогою де а являє собою LHMDS, CF3CO2Et, DME; b являє собою (1) R21C=NH(NH2), EtOH або iРrОН, температура кипіння зі зворотним холодильником, (2) R21C=NH(NH2)HCl, NaOEt, EtOH або iРrОН, температура кипіння зі зворотним холодильником, (3) R21C=NH(NH2), каталізатор BF3OEt2, iPrOH, температура кипіння зі зворотним холодильником, або (4) R21C=NH(NH2), піридин, температура кипіння зі зворотним холодильником; с являє собою суміш НСІ/Діоксан або НСІ/Етилацетат; R21 являє собою водень, алкіл або арил. Більш конкретно, сполука формули 20 може бути отримана шляхом утворення феноляту зі сполуки формули 19, з використанням LHMDS, з наступним додаванням трифторацетату (посилання: J. Fluorine Chem. 2003, 123(2), 267-272). Є різні способи одержання сполуки формули 21, яка має піримідинове кільце, зі сполуки формули 20, і серед них, спосіб, що використовує BF3OEt2 як каталізатор (Synthesis 2000, 12, 1738-1748) і спосіб, що використовує піридин як розчинник (Tetrahedron 1983, 39(19), 3197-3199) є переважними, з погляду одержання гарного виходу. Використовуючи в такий спосіб отриману сполуку формули 21, може бути отримана бажана сполука формули 22. Згідно з третім ілюстративним способом одержання, сполука формули 1 може бути отримана способом, що включає стадію взаємодії сполуки 27 89396 28 формули 15, вказаної вище, із сполукою формули Склади можуть приймати такі форми, як розчини, 23, представленої нижче: суспензії або емульсії з маслянистими або водними наповнювачами, і можуть містити звичайні диспергувальні, суспендувальні або стабілізуючі агенти. Альтернативно, перед застосуванням активний інгредієнт може перебувати в порошкоподібній формі для з'єднання зі стерильною водою, яка не містить пірогену. Сполука формули 1 може також бути введена в супозиторії, які містять звичайні дe супозиторні основи, такі як олія какао або інші гліG2 відсутній або являє собою кислоту, перецериди. Тверді форми для орального введення важно соляну кислоту, сірчану кислоту або тривключають капсулу, таблетку, пігулку, порошок і фтороцтову кислоту; гранулу. Переважними лікарськими формами є R26 являє собою водень, заміщений або незакапсула та таблетка. Переважним є те, що таблетміщений С1-С4 алкіл. ки та пігулки мають оболонку. Тверді форми для У випадку, якщо сполука формули 15 взаємоорального введення можуть бути отримані шляхом діє із сполукою формули 23, відбувається реакція змішування сполуки формули 1 як активного інгциклізації сполуки, яку одержують відповідно до редієнта, з неактивними розріджувачами, такими методики, аналогічної методиці одержання сполуяк сахароза, лактоза, крохмаль та подібні до них ки формули 13 у другому ілюстративному способі, та носіями, такими як мастило, наприклад стеарат використовуючи СОСl2, щоб утворити залишок В, і магнію, включаючи розпушувач, зв'язувальну ренаступну реакцію проводять відповідно до методичовину та подібні до них. ки, аналогічної методиці другого ілюстративного За необхідності, сполука формули 1 і композиспособу, щоб синтезувати сполуку формули 1. Із ції, які містять вказану сполуку за даним винаховказаної реакції може бути отримана сполука фодом можуть бути введені в комбінації з іншими рмули 15 і сполука формули 12, сполука формули фармацевтичними агентами, наприклад, іншими 1, в якій Ζ являє собою О у формулі 10. агентами для лікування діабету. Як вихідні продукти використовують відомі Коли склад представлений у формі одиничної сполуки, за винятком випадку, коли способи їх стандартної дози, сполука формули 1 як активний одержання є особливо бажаними в даному винаінгредієнт може переважно утримуватися в кількоході, або вони можуть бути синтезовані з відомих сті від приблизно 0,1~1,500мг у стандартній дозі. сполук відомими способами або способами, подіКількість сполуки формули 1 у дозі буде залежати бними до них. від ваги суб'єкта та віку, характеру та серйозності Сполука формули 1 може бути виділена та хвороби та рішення лікаря. Для введення доросочищена від реакційного продукту відомими сполому суб'єкту, необхідна кількість щоденної дози собами, такими як перекристалізація, іонний елекбуде в діапазоні від 1 до 500мг залежно від частотрофорез, хроматографія на колонку із силікагети та інтенсивності дозування. Для внутрішньом'ялем, хроматографія на йонообмінній смолі та зового або внутрішньовенного введення дорослоподібні до них. му суб'єкту, повна кількість щоденної дози буде Як описано вище, сполуки за даним винаходостатньою приблизно в межах 5~300мг. Для дедом, вихідні продукти для їх одержання та проміжяких пацієнтів, кількість щоденної дози буде більш ні сполуки можуть бути синтезовані різними спосовисокою, ніж ця. бами, які повинні інтерпретуватися, як включені до Крім того, даний винахід забезпечує застосуобсягу даного винаходу у зв'язку з одержанням вання сполуки формули 1, як визначено в пункті 1 сполуки формули 1. Формули винаходу, для виготовлення лікарського Також даний винахід забезпечує фармацевтизасобу для лікування або профілактики захворючну композицію для інгібування DPP-IV, яка місвань, пов'язаних з невідповідною активністю DPPтить сполуку формули 1 або її фармацевтично IV. прийнятну сіль і фармацевтично прийнятний носій. Представлені приклади захворювань, виклиСполука формули 1 може бути введена в різканих невідповідними рівнями DPP-IV, включають, них лікарських (стандартних фармацевтичних) не обмежуючись ними, цукрові діабети, ожиріння формах відповідно до призначеного застосування. та подібні до них, як описано вище. Серед цукроВ отриманих фармацевтичних композиціях, відпових діабетів, даний винахід є переважним для лівідно до даного винаходу, активний агент, більш кування та профілактики цукрового діабету типу II. конкретно, сполука формули 1 може бути змішана Втілення винаходу з одним або більшою кількістю фармацевтично Даний винахід представлений більш докладно прийнятних носіїв, які можуть бути вибрані залежнаступним викладенням приготувань і прикладів. но від отриманої лікарської форми. Наприклад, Проте, зрозуміло, що даний винахід не обмежений фармацевтична композиція за даним винаходом вказаними конкретними приготуваннями та приможе бути складена у формах, які підходять для кладами, але представляє можливість для різних ін'єкцій, або орального введення. модифікацій, які очевидні середньому фахівцеві в Сполука формули 1 може бути введена відпогалузі, що має відношення до даного винаходу. відно до звичайних методик, використовуючи віПриприготування 1: Синтез гідрохлориду 3домі фармацевтично прийнятні носії та наповнюамінометил-4,4,4-трифторбутанової кислоти етивачі та представлена у формі одиничної лового ефіру стандартної дози або контейнера з множиною доз. 29 89396 30 трифторбутанової кислоти етилового ефіру, отри(1) Синтез 4,4,4-трифтор-3маного на вказаній вище стадії (3) розчиняють в нітрометилбутанової кислоти етилового ефіру 6мл етилацетату, насичених хлористим воднем, а Змішують 1,0г (5,94ммоль) 4,4,4-трифтор-2потім перемішують при кімнатній температурі пробутенової кислоти етилового ефіру та 0,15мл тягом 3 годин. Розчинник відганяють при знижено(1,19ммоль) 1,1,3,3-тетраметилгуанідину та 1,6мл му тиску та потім затишок очищують хроматогра(29,8ммоль) нітрометану. Отриману суміш охолофією на колонці, що дає 110мг (0,69ммоль) джують до температури 0°С і потім перемішують названої сполуки з виходом 86%. протягом 3 годин при кімнатній температурі, з наступним додаванням 100мл етилацетоацетату. ЯМР: 1Н-ЯМР (CDCl3) d 8,50 (2Н, ушир. с), 4,18 Реакційну суміш промивають водою, і потім орга(2Н, кв., J=4Гц), 3,50-3,20 (3H, м), 2,97-2,64 (2Н, м), нічний шар сушать над безводним сульфатом ма1,24 (3H, т, J=4Гц) гнію. Розчинник відганяють при зниженому тиску, Маса (ΕΙ) 182(Μ++1) що дає 1,1г (4,80ммоль) названої сполуки з вихоПриготування 2: Синтез гідрохлориду 4-амінодом 81%. 3-метилбутанової кислоти метилового ефіру ЯМР: 1Н-ЯМР (CDCl3) d 5,21-4,59 (2Н, м), 4,22 (1) Синтез 3-метил-4-нітробутанової кислоти (2Н, кв., J=8Гц), 3,67-3,64 (1H, м), 2,82-2,72 (1Н, м), метилового ефіру 2,63-2,57 (1H, м), 1,28 (3H, т, J=8Гц) Змішують 3г (29,9ммоль) транс-2-бутенової Маса (ΕΙ) 176 (M++1) кислоти метилового ефіру та 0,69г (5,99ммоль) (2) Синтез N-гідрокси-3-(треттетраметилгуанідину та 9,14г (149ммоль) нітромебутоксикарбоніламінометил)-4,4,4тану. Отриману суміш перемішують при кімнатній трифторбутанової кислоти етилового ефіру температурі протягом 24 днів. До раніше утворе1,1г (4,80ммоль) 4,4,4-трифтор-3ного розчину додають 100мл етилацетоацетату та нітрометилбутанової кислоти етилового ефіру, реакційний розчин промивають водою, потім оргаотриманого на вказаній вище стадії (1), розчинянічний шар сушать над безводним сульфатом мають в 20мл метанолу, і потім до раніше утвореного гнію. Розчинник відганяють при зниженому тиску, розчину додають 1,85г (8,47ммоль) ди-третпотім залишок очищують хроматографією на кобутилгідрокарбонату. Реакцію проводять у присутлонці, що дає 5,7г (23,6ммоль) названої сполуки з ності 180мг 10% паладію на куті при атмосферновиходом 100%. му тиску протягом 15 годин. Реакційний розчин ЯМР: 1Н-ЯМР (CDCl3) d 4,48 (1Н, дд, J=4Гц, фільтрують через целіт і відганяють при знижено12Гц), 4,35 (1Н, дд, J=4Гц, 12Гц), 3,71 (3H, с), 2,84му тиску, без наступного очищення, що дає 1,5г 2,74 (1Н, м), 2,47 (1Н, дд, J=4Гц, 16Гц), 2,37 (1Н, (4,80ммоль) названої сполуки з виходом 100%. дд, J=8Гц, 16Гц), 1,11 (3H, д, J=8Гц) ЯМР: 1Н-ЯМР (CDCl3) d 6,48 (1Н, с), 4,20 (2Н, Маса (ЕІ) 162 (М++1) кв., J=8Гц), 3,89-3,83 (1Н, м), 3,66-3,62 (1Н, м), (2) Синтез N-трет-бутилоксикарбонілгідрокси3,24-3,17 (1Н, м), 2,76-2,68 (1Н, м), 2,53 (1Н, дд, 4-трет-бутоксикарбоніламіно-3,3J=8Гц, 16Гц), 1,48 (9Н, с), 1,25 (3H, т, J=8Гц) диметилбутанової кислоти метилового ефіру Маса (ΕΙ) 262 (M++1) 4г (24,8ммоль) 3-метил-4-нітробутанової кис(3) Синтез 3-(третлоти метилового ефіру, отриманого на вказаній бутоксикарбоніламінометил)-4,4,4вище стадії (1), розчиняють в 50мл метанолу та трифторбутанової кислоти етилового ефіру потім до раніше утвореного розчину додають 10,4г 760мг (2,41ммоль) N-гідрокси-3-(трет(47,6ммоль) ди-трет-бутилдикарбонату. Реакцію бутоксикарбоніламінометил)-4,4,4проводять у присутності 500мг 10% паладію на трифторбутанової кислоти етилового ефіру, отрикуті при тиску 50псі протягом 9 годин. Реакційний маного на вказаній вище стадії (2) розчиняють в розчин фільтрують через целіт і відганяють при 80мл метанолу та 40мл води, потім до раніше зниженому тиску, потім залишок очищують хромаутвореного розчину додають 2,4г (28,9ммоль) ацетографією на колонці, що дає 3,6г (10,3ммоль) тату натрію, з наступним додаванням по краплях названої сполуки та 1,1г (4,45ммоль) N-гідрокси-44мл (4,81ммоль) 20% водного розчину трихлориду трет-бутоксикарбоніламіно-3,3-диметилбутанової титану при кімнатній температурі. Через 20 хвилин кислоти метилового ефіру з виходом 62%. до раніше утвореного розчину додають 300мл Маса (ЕІ) 348 (М++1) етилацетоацетату та реакційний розчин промива(3) Синтез N-гідрокси-4-третють водою, потім органічний шар сушать над безбутоксикарбоніламіно-3,3-диметилбутанової кисводним сульфатом магнію. Розчинник відганяють лоти метилового ефіру при зниженому тиску та потім залишок очищують 600мг (1,72ммоль) N-третхроматографією на колонці, що дає 550мг бутилоксикарбонілгідрокси-4-трет(2,24ммоль) названої сполуки з виходом 92%. бутоксикарбоніламіно-3,3-диметилбутанової кислоти метилового ефіру, отриманого на вказаній ЯМР: 1Н-ЯМР (CDCl3) d 4,70 (1Н, с), 4,18 (2Н, вище стадії (2), розчиняють в 80мл метанолу, з кв., J=6,8Гц), 3,64-3,53 (1Н, м), 3,35-3,34 (1Н, м), наступним додаванням гідрокарбонату натрію 250 3,05-2,90 (1Н, м), 2,60 (1Н, дд, J=5,2Гц, 16,4Гц), і перемішуванням при температурі 80°С протягом 2,48 (1Н, дд, J=8Гц, 16,4Гц), 1,43 (9Н, с), 1,27 (3H, 9 годин. До раніше утвореного розчину додають т, J=6,8Гц) 200мл етилацетату та реакційний розчин промиМаса (ΕΙ) 246 (M++1) вають водою, і потім органічний шар сушать над (4) Синтез гідрохлориду 3-амінометил-4,4,4безводним сульфатом магнію. Розчинник відганятрифторбутанової кислоти етилового ефіру ють при зниженому тиску, і потім залишок очищу170мг (0,69ммоль) 3-(третбутоксикарбоніламінометил)-4,4,4 31 89396 32 ють хроматографією на колонці, що дає 332мг а потім перемішують протягом години. До раніше (1,34ммоль) названої сполуки з виходом 77% утвореного розчину додають 561мг (1,78ммоль) Nфторбензолсульфоніміду та потім температуру ЯМР: 1Н-ЯМР (CDCl3) d 7,27 (1Н, ушир. с), 3,49 поступово підвищують до -30°С протягом 2 годин. (3H, с), 3,46 (1Н, дд, J=4Гц, 12Гц), 3,33 (1Н, дд, До раніше утвореного розчину додають 100мл J=5,6Гц, 14,4Гц), 2,51-2,42 (1Н, м), 2,39 (1Н, дд, етилацетоацетату, і реакційний розчин промиваJ=4Гц, 16Гц), 2,22 (1Н, дд, J=4Гц, 16Гц), 1,48 (9Н, ють водним розчином хлориду амонію, і потім орс), 0,98 (3H, д, J=8Гц) ганічний шар сушать над безводним сульфатом Маса (ΕΙ) 248 (M++1) магнію. Розчинник відганяють при зниженому тис(4) Синтез 4-трет-бутоксикарбоніламіно-3ку, потім залишок очищують хроматографією на метилбутанової кислоти метилового ефіру колонці, що дає 60мг (0,29ммоль) названої сполу213мг (0,92ммоль) названої сполуки одержуки з виходом 18%. ють з виходом 47% відповідно до методики, анаЯМР: 1Н-ЯМР (CDCl3) d 5,16-5,12 (0,5Н, м), логічної методиці одержання сполуки, описаної в приготуванні 1(3), за винятком того, що використо5,01-4,94 (0,5Н, м), 3,91-3,85 (1Н, м), 3,64-3,57 (1Н, вують 330мг (1,33ммоль) N-гідрокси-4-третм), 2,50-2,45 (1Н, м), 2,25-2,13 (1Н, м), 1,54 (9Н, с) бутоксикарбоніламіно-3,3-диметилбутанової кисМаса (ЕІ) 204 (М++1) лоти метилового ефіру, отриманого на вказаній (3) Синтез 4-трет-бутоксикарбоніламіно-2вище стадії (3). фторбутанової кислоти метилового ефіру 60мг (0,29ммоль) 3-фтор-2-оксопіролідин-1ЯМР: 1Н-ЯМР (CDCl3) d 4,65 (1H, ушир. с), 3,68 карбонової кислоти трет-бутилового ефіру, отри(3H, с), 3,10-3,00 (2Н, м), 2,38-2,33 (1Н, м), 2,20маного на вказаній вище стадії (2), розчиняють в 2,05 (2Н, м), 1,44 (9Н, с), 0,96 (3H, д, J=8Гц) 3мл метанолу, і потім до раніше утвореного розМаса (ЕІ) 232 (M++1) чину додають 32мг (0,59ммоль) метилату натрію (5) Синтез гідрохлориду 4-аміно-3при температурі 0°С. Через годину до раніше метилбутанової кислоти метилового ефіру утвореного розчину додають 10мл етилацетату, 62мг (0,36ммоль) названої сполуки одержують реакційний розчин промивають водним розчином з виходом 83% відповідно до методики, аналогічхлориду амонію, і органічний шар сушать над безної методиці одержання сполуки, описаної в приводним сульфатом магнію. Розчинник відганяють готуванні 1(4), за винятком того, що використовупри зниженому тиску, потім залишок очищують ють 100мг (0,43ммоль) 4-третхроматографією на колонці, що дає 49мг бутоксикарбоніламіно-3-метилбутанової кислоти (0,29ммоль) названої сполуки з виходом 18%. метилового ефіру, отриманого на вказаній вище Маса (ЕІ) 236 (М++1) стадії (4). 1 (4) Синтез гідрохлориду 4-аміно-2ЯМР: Н-ЯМР (CDCl3) d 8,26 (2Н, ушир. с), 3,68 фторбутанової кислоти метилового ефіру (3H, с), 3,10-2,99 (2Н, м), 2,77-2,35 (3H, м), 1,13 17мг (0,099ммоль) названої сполуки одержу(3H, д, J=8Гц) ють з виходом 47% відповідно до методики, анаМаса (ΕΙ) 168 (M++1) логічної методиці одержання сполуки, описаної в Приготування 3: Синтез гідрохлориду 4-аміноприготуванні 1(4), за винятком того, що використо2-фторбутанової кислоти метилового ефіру вують 50мг (0,21ммоль) 4-трет(1) Синтез 2-оксопіролідин-1-карбонової кисбутоксикарбоніламіно-2-фторбутанової кислоти лоти трет-бутилового ефіру метилового ефіру, отриманого на вказаній вище 1г (11,7ммоль) 2-піролідинону розчиняють в стадії (3). 15мл дихлорметану, і потім до раніше утвореного ЯМР: 1Н-ЯМР (CD3OD) d 5,24-5,20 (0,5Н, м), розчину додають 2,5мл (17,8ммоль) триетиламіну 5,15-4,95 (0,5Н, м), 3,81 (3H, с), 3,21-3,08 (2Н, м), та 107мг (0,87ммоль) диметиламінопіридину та 2,40-2,10 (2Н, м) 2,7г (12,3ммоль) ди-трет-бутилгідрокарбонату. Маса (ЕІ) 172 (М++1) Реакційний розчин перемішують при кімнатній теПриготування 4: Синтез гідрохлориду 5-аміномпературі протягом 8 годин. До раніше утвореного 2-фторпентанової кислоти метилового ефіру розчину додають 100мл етилацетату, і реакційний (1) Синтез 2-оксопіперидин-1-карбонової кисрозчин промивають водою, і потім органічний шар лоти трет-бутилового ефіру 1,17г (8,88ммоль) насушать над безводним сульфатом магнію. Роззваної сполуки одержують з виходом 88% відповічинник відганяють при зниженому тиску, і потім дно до методики, аналогічної методиці одержання залишок очищують хроматографією на колонці, що сполуки, описаної в приготуванні 3(1), за винятком дає 1,2г (6,47ммоль) названої сполуки з виходом того, що використовують 1г (10,08ммоль) 255%. піперидинону. ЯМР: 1Н-ЯМР (CDCl3) d 3,76-3,73 (2Н, м), 2,53ЯМР: 1Н-ЯМР (CDCl3) d 3,67-3,64 (2Н, м), 2,522,49 (2Н, м), 2,04-1,88 (2Н, м), 1,53 (9Н, с) + 2,49 (2Н, м), 1,86-1,78 (4Н, м), 1,53 (9Н, с) Маса (ЕІ) 186(М +1) Маса (ЕІ) 200 (М++1) (2) Синтез 3-фтор-2-оксопіролідин-1(2) Синтез 3-фтор-2-оксопіперидин-1карбонової кислоти трет-бутилового ефіру карбонової кислоти трет-бутилового ефіру 300мг (1,61ммоль) 2-оксопіролідин-1160мг (0,73ммоль) названої сполуки одержукарбонової кислоти трет-бутилового ефіру, отриють з виходом 48% відповідно до методики, анаманого на вказаній вище стадії (1), розчиняють у логічної методиці одержання сполуки, описаної в тетрагідрофурані та охолоджують до температури приготуванні 3(2), за винятком того, що використо-78°С. До раніше утвореного розчину по краплях вують 300мг (1,5ммоль) 2-оксопіперидин-1додають 1,7мл (1,7ммоль) 1,0Μ біс(триметилсиліл)аміду літію в тетрагідрофурані, 33 89396 34 карбонової кислоти трет-бутилового ефіру, отриЯМР: 1Н-ЯМР (CDCl3) d 4,58 (1Н, ушир. с), 3,68 маного на вказаній вище стадії (1). (3H, с), 3,17-3,14 (2Н, м), 2,55-2,47 (1Н, м), 1,89ЯМР: 1Н-ЯМР (CDCl3) d 5,03-4,75 (1Н, м), 3,751,80 (1Н, м), 1,67-1,60 (1Н, м), 1,44 (9Н, с), 1,19 3,55 (2Н, м), 2,35-2,22 (1Н, м), 2,05-1,78 (3H, м), (3H, д, J=4Гц) 1,54 (9Н, с) Маса (ЕІ) 232 (М++1) Маса (ЕІ) 218 (М++1) (3) Синтез гідрохлориду 4-аміно-2(3) Синтез 5-трет-бутоксикарбоніламіно-2метилбутанової кислоти метилового ефіру фторпентанової кислоти метилового ефіру 80мг (0,47ммоль) названої сполуки одержують 56мг (0,22ммоль) названої сполуки одержують з виходом 92% відповідно до методики, аналогічз виходом 30% відповідно до методики, аналогічної методиці одержання сполуки, описаної в приної методиці одержання сполуки, описаної в приготуванні 1(4), за винятком того, що використовуготуванні 3(3), за винятком того, що у вказаній виють 120мг (0,51ммоль) 4-третще стадії (2) використовують 160мг (0,73ммоль) 3бутоксикарбоніламіно-2-метилбутанової кислоти фтор-2-оксопіперидин-1-карбонової кислоти третметилового ефіру, отриманого на вказаній вище бутилового ефіру. стадії (2). ЯМР: 1Н-ЯМР (CDCl3) d 5,02-4,87 (1Н, м), 4,63 ЯМР: 1Н-ЯМР (CD3OD) d 3,70 (3H, с), 3,05-2,90 (1Н, ушир. с), 3,80 (3H, с), 3,25-3,05 (2Н, м), 1,99(2Н, м), 2,65-2,55 (1Н, м), 2,05-1,70 (2Н, м), 1,23 1,88 (2Н, м), 1,72-1,64 (2Н, м), 1,44 (9Н, с) (3H, д, J=6Гц) Маса (ЕІ) 250 (М++1) Маса (ΕΙ) 168 (M++1) (4) Синтез гідрохлориду 5-аміно-2Приготування 6: Синтез гідрохлориду 4-амінофторпентанової кислоти метилового ефіру 3-метил-2-бутенової кислоти метилового ефіру 40мг (0,21ммоль) названої сполуки одержують (1) Синтез (2-гідроксипропіл)-карбамінової киз виходом 95% відповідно до методики, аналогічслоти трет-бутилового ефіру ної методиці одержання сполуки, описаної в при1г (13,3ммоль) 1-амінопропан-2-олу розчиняготуванні 1(4), за винятком того, що у вказаній виють в 40мл метанолу та 10мл води та потім до ще стадії (3) використовують 56мг (0,224ммоль) 5раніше утвореного розчину додають 3,7г трет-бутоксикарбоніламіно-2-фторпентанової кис(16,9ммоль) ди-трет-бутилгідрокарбонату, а потім лоти метилового ефіру. перемішують протягом 3 годин при кімнатній температурі. До розчину додають 200мл етилацетату ЯМР: 1Н-ЯМР (CDCl3) d 5,15-4,95 (1Н, м), 3,81 та реакційний розчин промивають водою, і потім (3H, с), 3,00-2,90 (2Н, м), 2,10-1,73 (4Н, м) органічний шар сушать над безводним сульфатом Маса (ЕІ) 186 (М++1) магнію. Розчинник відганяють при зниженому тисПриготування 5: Синтез гідрохлориду 4-аміноку, потім залишок очищують хроматографією на 2-метилбутанової кислоти метилового ефіру колонці, що дає 2,24г (12,8ммоль) названої сполу(1) Синтез 3-метил-2-оксопіролідин-1ки з виходом 96%. карбонової кислоти трет-бутилового ефіру ЯМР: 1Н-ЯМР (CDCl3) d 4,91 (1Н, ушир. с), 300мг (1,61ммоль) 2-оксопіролідин-1карбонової кислоти трет-бутилового ефіру розчи3,95-3,85 (1Н, м), 3,30-3,22 (1Н, м), 3,05-2,95 (1Н, няють у тетрагідрофурані та потім охолоджують до м), 1,43 (9Н, с), 1,16 (3H, д, J=4Гц) температури -78°С. До раніше утвореного розчину Маса (ΕΙ) 176 (Μ++1) по краплях додають 1,7мл (1,7ммоль) розчину (2) Синтез (2-оксопропіл)-карбамінової кислоти 1,0Μ літій біс(триметилсиліл)амідтрет-бутилового ефіру тетрагідрофуран, а потім перемішують протягом 2,24г (12,7ммоль) (2-гідроксипропіл)години. До раніше утвореного розчину додають по карбамінової кислоти трет-бутилового ефіру, краплях 0,19мл (3,05ммоль) йодметану. Після цьоотриманого на вказаній вище стадії (1), розчиняго температуру поступово підвищують до -30°С ють в 30мл дихлорметану, і потім по краплях допротягом 2 годин. До раніше утвореного розчину дають 3,6мл (25,7ммоль) триетиламіну. До раніше додають 50мл етилацетату, реакційний розчин утвореного розчину додають 6,05г (19ммоль) 50% промивають водним розчином хлориду амонію, і піридин-сульфотриоксид, що розчиняють в 15мл органічний шар сушать над безводним сульфатом диметилсульфоксиду. Через 6 годин до раніше магнію. Розчинник відганяють при зниженому тисутвореного розчину додають 200мл етилацетату ку, потім залишок очищують хроматографією на та реакційний розчин промивають водою, потім колонці, що дає 130мг (0,65ммоль) названої споорганічний шар сушать над безводним сульфатом луки з виходом 40%. магнію. Розчинник відганяють при зниженому тиску, потім залишок очищують хроматографією на ЯМР: 1Н-ЯМР (CDCl3) d 3,79-3,74 (1Н, м), 3,61колонці, що дає 1,15г (6,64ммоль) названої сполу3,54 (1Н, м), 2,59-2,53 (1Н, м), 2,25-2,17 (1Η, м), ки з виходом 52%. 1,67-1,59 (1Н, м), 1,53 (9Н, с), 1,20 (3H, д, J=12Гц) ЯМР: 1Н-ЯМР (CDCl3) δ 5,20 (1Н, ушир. с), Маса (ЕІ) 200 (М++1) 4,05-4,00 (2Н, м), 2,17 (3H, с), 1,43 (9Н, с) (2) Синтез 4-трет-бутоксикарбоніламіно-2Маса (ЕІ) 174 (М++1) метилбутанової кислоти метилового ефіру (3) Синтез цис-4-трет-бутоксикарбоніламіно-3120мг (0,51ммоль) названої сполуки одержуметил-2-бутенової кислоти метилового ефіру ють з виходом 78% відповідно до методики, ана500мг (2,88ммоль) (2-оксопропіл)-карбамінової логічної методиці одержання сполуки, описаної в кислоти трет-бутилового ефіру, отриманого на приготуванні 3(3), за винятком того, що використовказаній вище стадії (2), розчиняють в 8мл бензовують 130мг (0,65ммоль) 3-метил-2-оксопіролідинлу, і потім до раніше утвореного розчину додають 1-карбонової кислоти трет-бутилового ефіру, 1,45г (4,33ммоль) метилотриманого на вказаній вище стадії (1). 35 89396 36 (трифенілфосфораніліден)ацетату та 35мг (3) Синтез (S)-3-трет-бутоксикарбоніламіно-2(0,28ммоль) бензойної кислоти. Реакційний розчин метилпронанової кислоти метилового ефіру нагрівають до температури 80°С протягом 3 годин. 3,9г (26,8ммоль) (S)-3-азидо-2Розчинник відганяють при зниженому тиску, потім метилпропанової кислоти метилового ефіру, залишок очищують хроматографією на колонці, що отриманого на вказаній вище стадії (2), розчинядає 54мг (6,64ммоль) названої сполуки з виходом ють в 50мл метанолу, з наступним додаванням 23% і 301мг (1,31ммоль) транс ізомеру з виходом 8,8г (40,3ммоль) ди-трет-бутилгідрокарбонату. 45%. Реакцію проводять у присутності 40мг 20% паладію на куті в атмосфері водню протягом 9 годин. ЯМР: 1Н-ЯМР (CDCl3) d 5,77 (1Н, с), 5,17 (1Н, Реакційний розчин фільтрують через целіт і відгаушир. с), 4,16 (2Н, д, J=6,4Гц), 3,69 (3H, с), 2,05 няють при зниженому тиску, потім залишок очи(3H, с), 1,44 (9Н, с) щують хроматографією на колонці, що дає 2,6г Маса (ЕІ) 230 (М++1) (11,9ммоль) названої сполуки з виходом 44%. (4) Синтез гідрохлориду 4-аміно-3-метил-2ЯМР: 1Н-ЯМР (CDCl3) d 4,92 (1Н, ушир. с), 3,70 бутенової кислоти метилового ефіру 30мг (0,23ммоль) названої сполуки одержують (3H, с), 3,31-3,20 (2Н, м), 2,70-2,55 (1Н, м), 1,43 з виходом 97% відповідно до методики, аналогіч(9Н, с), 1,15 (3H, д, J=12Гц) ної методиці одержання сполуки, описаної в приМаса (ЕІ) 218 (М++1) готуванні 1(4), за винятком того, що використову(4) Синтез (S)-(3-гідрокси-2-метилпропіл)ють 54мг (0,235ммоль) цис-4-треткарбамінової кислоти трет-бутилового ефіру бутоксикарбоніламіно-3-метил-2-бутенової кисло500мг (2,30ммоль) (S)-3-третти метилового ефіру, отриманого на вказаній вище бутоксикарбоніламіно-2-метилпропанової кислоти стадії (3). метилового ефіру, отриманого на вказаній вище стадії (3), розчиняють в 30мл тетрагідрофурану, і ЯМР: 1Н-ЯМР (CD3OD) d 6,05 (1Н, с), 4,00 (2Н, потім в отриманий розчин повільно додають 262мг с), 3,72 (3H, с), 3,29-3,28 (2Н, м), 2,05 (3H, с) (6,9ммоль) літійалюмінійгідриду при температурі Маса (ЕІ) 130 (М++1) 0°С. Після нагрівання до кімнатної температури, Приготування 7: Синтез гідрохлориду (R)-5реакцію проводять протягом 4 годин. Реакційний аміно-4-метилпентанової кислоти метилового ефірозчин охолоджують до температури 0°С, і потім в ру отриманий розчин повільно додають 0,26мл води (1) Синтез (S)-3-метансульфонілокси-2та 0,26мл розчину гідроксиду натрію та 0,78мл метилпропанової кислоти метилового ефіру води. Реакційний розчин фільтрують через целіт і 3г (25,3ммоль) (S)-3-гідрокси-2відганяють при зниженому тиску, потім залишок метилпропанової кислоти метилового ефіру розочищують хроматографією на колонці, що дає чиняють в 50мл дихлорметану, потім в отриманий 430мг (2,27ммоль) названої сполуки з виходом розчин по краплях додають 5,3мл (37,9ммоль) 98%. триетиламіну. Після цього до раніше утвореного ЯМР: 1Н-ЯМР (CDCl3) d 4,78 (1Н, ушир. с), розчину додають 2,16мл (27,9ммоль) метансульфонілхлориду при температурі 0°С. Через годину 3,55-3,50 (1Н, м), 3,33-3,20 (2Н, м), 3,05-2,98 (1Н, до раніше утвореного розчину додають 200мл м), 1,75-1,65 (1Н, м), 1,46 (9Н, с), 0,87 (3H, д, етилацетоацетату і потім реакційний розчин проJ=12Гц) мивають водою та потім органічний шар сушать Маса (ΕΙ) 190(Μ++1) над безводним сульфатом магнію. Розчинник від(5) Синтез (S)-(2-метил-3-оксопропіл)ганяють при зниженому тиску, потім залишок очикарбамінової кислоти трет-бутилового ефіру щують хроматографією на колонці, що дає 4,97г 423мг (2,26ммоль) названої сполуки одержу(25,3ммоль) названої сполуки з виходом 100%. ють з виходом 99% відповідно до методики, анаМаса (ЕІ) 197 (М++1) логічної методиці одержання сполуки, описаної в (2) Синтез (S)-3-азидо-2-метилпропанової кисприготуванні 6-(2), за винятком того, що викорислоти метилового ефіру товують 430мг (2,27ммоль) (S)-(3-гідрокси-24,97г (25,3ммоль) (S)-3-метансульфонілокси-2метилпропіл)-карбамінової кислоти третметилпропанової кислоти метилового ефіру, бутилового ефіру, отриманого на вказаній вище отриманого на вказаній вище стадії (2), розчинястадії (4). ють в 40мл диметилформаміду, і потім до раніше Маса(ЕІ) 188 (М++1) утвореного розчину додають 5г (76,8ммоль) азиду (6) Синтез (R)-5-трет-бутоксикарбоніламіно-4натрію, а потім перемішують при температурі 60°С метил-2-пентенової кислоти метилового ефіру протягом 24 годин. До раніше утвореного розчину 380мг (2,26ммоль) названої сполуки одержудодають 200мл етилацетоацетату, і реакційний ють з виходом 99% відповідно до методики, анарозчин промивають водою, потім органічний шар логічної методиці одержання сполуки, описаної в сушать над безводним сульфатом магнію. Розприготуванні 6-(3), за винятком того, що викорисчинник відганяють при зниженому тиску, потім затовують 423мг (2,26ммоль) (S)-(2-метил-3лишок очищують хроматографією на колонці, що оксопропіл)-карбамінової кислоти трет-бутилового дає 3,5г (24,4ммоль) названої сполуки з виходом ефіру, отриманого на вказаній вище стадії (5). 96%. ЯМР: 1Н-ЯМР (CDCl3) d 6,84 (1Н, дд, J=15Гц, 1 ЯМР: Н-ЯМР (CDCl3) d 3,71 (3H, с), 3,54-3,52 10Гц), 5,84 (1Н, д, J=15Гц), 4,55 (1Н, ушир. с), 3,72 (1Н, м), 3,40-3,30 (1Н, м), 2,80-2,65 (1Н, м), 1,20 (3H, с), 3,25-3,15 (1Н, м), 3,06-3,00 (1Н, м), 2,54(3H, д, J=7,2Гц) 2,47 (1Н, м), 1,42 (9Н, с), 1,03 (3H, д, J=15Гц) Маса (ΕΙ) 144 (M++1) Маса (ΕΙ) 244 (M++1) 37 89396 38 (7) Синтез (R)-5-трет-бутоксикарбоніламіно-4приготуванні 3-(3), за винятком того, що викорисметилпентанової кислоти метилового ефіру товують 368мг (1,72ммоль) 4-метил-2370мг (2,26ммоль) (R)-5-третоксопіперидин-1-карбонової кислоти третбутоксикарбоніламіно-4-метил-2-пентенової кисбутилового ефіру, отриманого на вказаній вище лоти метилового ефіру, отриманого на вказаній стадії (2). 1 вище стадії (6), розчиняють в 50мл метанолу. РеаН ЯМР (CDCl3) d 4,5-4,6 (1Н, ушир. с), 3,65 кцію проводять у присутності 40мг 20% гідроксиду (3H, с), 3,0-3,2 (2Н, м), 2,3 (1Н, м), 2,15 (1Н, м), 2,0 паладію в атмосфері водню протягом 9 годин і (1Н, м), 1,4-1,5 (2Н, м), 1,45 (9Н, с) реакційний розчин фільтрують через целіт. ВідфіМаса (м/е) 268 (M+Na) льтрований розчин відганяють при зниженому тис(4) Синтез гідрохлориду 5-аміно-3ку, потім залишок очищують хроматографією на метилпентанової кислоти метилового ефіру колонці, що дає 310мг (1,26ммоль) названої спо226мг (1,24ммоль) названої сполуки одержулуки з виходом 55%. ють з виходом 74% відповідно до методики, анаЯМР: 1Н-ЯМР (CDCl3) d 4,87 (1Н, ушир. с), 3,67 логічної методиці одержання сполуки, описаної в (3H, с), 3,05-2,96 (2Н, м), 2,39-2,27 (2Н, м), 1,75приготуванні 1-(4), за винятком того, що викорис1,40 (3H, м), 1,44 (9Н, с), 0,87 (3H, д, J=12Гц) товують 410мг (1,24ммоль) 5-третМаса (ЕІ) 246 (М++1) бутоксикарбоніламіно-3-метилпентанової кислоти (S) Синтез гідрохлориду (R)-5-аміно-4метилового ефіру, отриманого на вказаній вище метилпентанової кислоти метилового ефіру стадії (3). 1 220мг (1,21ммоль) названої сполуки одержуН ЯМР (CD3OD) d 3,65 (3H, с), 2,9-3,0 (2Н, м), ють з виходом 96% відповідно до методики, ана2,34 (1Н, дд, J=15,7Гц), 2,27 (1Н, дд, J=15,7Гц), 2,0 логічної методиці одержання сполуки, описаної в (1Н, м), 1,7 (1Н, м), 1,54 (1Н, м), 0,98 (3H, д, J=7Гц) приготуванні 1-(4), за винятком того, що викорисМаса (м/е) 146 (М+1) товують 310мг (1,26ммоль) (R)-5-третПриготування 9: Синтез гідрохлориду 4бутоксикарбоніламіно-4-метилпентанової кислоти амінометил-5,5,5-трифторпентанової кислоти меметилового ефіру, отриманого на вказаній вище тилового ефіру стадії (7). (1) Синтез 5-трифторметилпіперидин-2-ону ЯМР: 1Н-ЯМР (CD3OD) d 3,87 (3H, с), 2,96-2,91 1г (6,13ммоль) 5-трифторметил-2-піридинолу розчиняють в 20мл оцтової кислоти. Реакцію про(1Н, м), 2,81-2,76 (1Н, м), 2,47-2,40 (2Н, м), 1,88водять у присутності 300мг оксиду платини при 1,76 (2Н, м), 1,56-1,50 (1Н, м), 1,04 (3H, д, J=6,4Гц) тиску 50псі водню (г) протягом 9 годин. Реакційний Маса (ΕΙ) 182 (Μ++1) розчин фільтрують через целіт і відганяють при Приготування 8: Синтез гідрохлориду 5-амінозниженому тиску, потім залишок очищують хрома3-метилпентанової кислоти метилового ефіру тографією на колонці, що дає 920мг (5,50ммоль) (1) Синтез 4-метилпіперидин-1-карбонової киназваної сполуки з виходом 89%. слоти трет-бутилового ефіру 3,5г (17,5ммоль) названої сполуки одержують з виходом 87% відповіЯМР: 1Н-ЯМР (CDCl3) d 3,56-3,51 (1Н, м), 3,42дно до методики, аналогічної методиці одержання 3,36 (1Н, м), 2,59-2,53 (2Н, м), 2,45-2,41 (1Н, м), сполуки, описаної в приготуванні 6(1), за винятком 2,19-2,13 (1Н, м), 1,95-1,87 (1Н, м) того, що використовують 2г (20,1ммоль) 4Маса (ЕІ) 168 (М++1) метилпіперидину. (2) Синтез 2-оксо-5-трифторметилпіперидин-1Маса (ЕІ) 200 (М++1) карбонової кислоти трет-бутилового ефіру (2) Синтез 4-метил-2-оксопіперидин-11,3г (7,7ммоль) 5-трифторметилпіперидин-2карбонової кислоти трет-бутилового ефіру ону, отриманого на вказаній вище стадії (1), роз1г (5,02ммоль) 4-метилпіперидин-1-карбонової чиняють в 10мл ацетонітрилу. До розчину додають кислоти трет-бутилового ефіру, отриманого на 2,0г (14,3ммоль) триетиламіну, 48мг (0,39ммоль) вказаній вище стадії (1), розчиняють в 70мл етидиметиламінопіридину та 1,8г (8,2ммоль) ди-третлацетату. До раніше утвореного розчину по крапбутил гідрокарбонату. Після перемішування при лях додають розчин, в якому розчиняють в 40мл температурі 80°С протягом 4 годин, до раніше води, 5,4г (25,2ммоль) перйодату натрію та і 247мг утвореного розчину додають 100мл етилацетату (1,85ммоль) діоксиду рутенію. Через 3 години до та реакційний розчин промивають водою. Органічраніше утвореного розчину додають 5% тіосульний шар сушать над безводним сульфатом магнію. фат натрію, і отриманий розчин екстрагують етиРозчинник відганяють при зниженому тиску, і потім лацетатом, потім органічний шар сушать над беззалишок очищують хроматографією на колонці, що водним сульфатом магнію. Розчинник відганяють дає 669мг (2,5ммоль) названої сполуки з виходом при зниженому тиску, потім залишок очищують 32%. хроматографією на колонці, що дає 750мг ЯМР: 1Н-ЯМР (CDCl3) d 4,09-3,97 (1Н, м), 3,77(3,52ммоль) названої сполуки з виходом 70%. 3,71 (1Н, м), 2,70-2,47 (3H, м), 2,15-2,10 (1Н, м), ЯМР: 1Н-ЯМР (CDCl3) d 4,11-3,77 (1Н, м), 3,531,97-1,89 (1Н, м), 1,50 (9Н, с) 3,49 (1Н, м), 2,62-2,56 (1Н, м), 2,15-1,90 (3H, м), Маса (ЕІ) 268 (М++1) 1,49 (9Н, с), 1,48-1,26 (1Н, м), 1,02 (3H, д J=4Гц) (3) Синтез 4-(третМаса (ЕІ) 214 (М++1) бутоксикарбоніламінометил)-5,5,5(3) Синтез 5-трет-бутоксикарбоніламіно-3трифторпентанової кислоти метилового ефіру метилпентанової кислоти метилового ефіру 500мг (1,67ммоль) названої сполуки одержу410мг (1,67ммоль) названої сполуки одержують з виходом 66% відповідно до методики, анають з виходом 97% відповідно до методики, аналогічної методиці одержання сполуки, описаної в логічної методиці одержання сполуки, описаної в приготуванні 3-(3), за винятком того, що викорис 39 89396 40 товують 669мг (2,5ммоль) 2-оксо-52,82г (3,2ммоль) мета-перйодату натрію трифторметилпіперидин-1-карбонової кислоти (NaIO4), розчиняють в 20мл води, з наступним дотрет-бутилового ефіру, отриманого на вказаній даванням 117мг (0,88ммоль) оксиду рутенію вище стадії (2). (RuO2). До реакційної суміші додають розчин, в якому в 35мл етилацетату розчинено 660мг ЯМР: 1Н-ЯМР (CDCl3) d 4,76 (1Н, с), 3,68 (3H, (2,6ммоль) 4-трифторметилпіперидин-1с), 3,45-3,30 (2Н, м), 2,55-2,48 (2Н, м), 2,40-2,32 карбонової кислоти трет-бутилового ефіру, а потім (1Н, м), 2,00-1,95 (1Н, м), 1,90-1,80 (1Н, м), 1,43 перемішують протягом 2 годин і 20 хвилин. Реак(9Н, с) ційний розчин розбавляють надлишком етилацеМаса (ΕΙ) 300 (M++1) тату та промивають один раз водою та водним (4) Синтез гідрохлориду 4-амінометил-5,5,5розчином NaCl, відповідно, і потім сушать над безтрифторпентанової кислоти метилового ефіру водним сульфатом магнію та відфільтровують. 335мг (1,42ммоль) названої сполуки одержуВідфільтрований розчин відганяють при зниженоють з виходом 85% відповідно до методики, анаму тиску, потім залишок очищують хроматографілогічної методиці одержання сполуки, описаної в єю на колонці (2:1 суміш гексан:етилацетат), що приготуванні 1-(4), за винятком того, що викорисдає 0,63г названої сполуки з виходом 90%. товують 500мг (1,67ммоль) 4-(трет1 Н ЯМР (CDCl3) d 3,86 (1Н, дд, J=13,5, 5,5Гц), бутоксикарбоніламінометил)-5,5,5трифторпентанової кислоти метилового ефіру, 3,62 (1Н, м), 2,6-2,8 (2Н, м), 2,56 (1Н, дд, J=17, отриманого на вказаній вище стадії (3). 10Гц), 2,1-2,2 (1Н, м), 1,8-1,9 (1Н, м), 1,53 (9Н, с) Маса (м/е) 290 (M+Na) ЯМР: 1Н-ЯМР (CDCl3) d 8,48 (2Н, с), 3,69 (3H, (2) Синтез 5-трет-бутоксикарбоніламіно-3с), 3,50-3,40 (1Н, м), 3,30-3,15 (1Н, м), 2,99-2,89 трифторметилпентанової кислоти етилового ефіру (1Н, м), 2,65-2,52 (2Н, м), 2,11-1,91 (2Н, м) 630мг (2,36ммоль) 2-оксо-4Маса (ЕІ) 236 (М++1) трифторметилпіперидин-1-карбонової кислоти Приготування 10: Синтез гідрохлориду (2трет-бутилового ефіру, отриманого на вказаній аміно-1-метилетоксі)-оцтової кислоти етилового вище стадії (1), розчиняють у метанолі, потім до ефіру раніше утвореного розчину додають 255мг (1) Синтез (2-трет-бутоксикарбоніламіно-1(4,5ммоль) етилату натрію, а потім перемішують метилетоксi)-оцтової кислоти етилового ефіру протягом 15 хвилин. Після концентрації реакційний 500мг (2,85ммоль) (2-гідроксипропіл)розчин розбавляють надлишком етилацетату, і карбамінової кислоти трет-бутилового ефіру розреакційний розчин промивають один раз водним чиняють в 10мл дихлоретану, потім до раніше розчином 1н соляної кислоти та водним розчином утвореного розчину додають 0,44мл (4,24ммоль) NaCl, відповідно, і сушать над безводним сульфаетилдіазоацетату. До реакційної суміші додають том магнію та відфільтровують. Відфільтрований 38мг (0,085ммоль) ацетату родію та потім суміш розчин відганяють при зниженому тиску, потім занагрівають до температури 80°С протягом 2 годин. лишок очищують хроматографією на колонці (5:1 Розчинник відганяють при зниженому тиску, і засуміш гексан:етилацетат), що дає 0,48г названої лишок очищують хроматографією на колонці, що сполуки з виходом 65%. дає 381мг (1,45ммоль) названої сполуки з виходом 1 Н ЯМР (CDCl3) d 4,76 (1Н, ушир. с), 4,17 (2Н, 50%. 1 кв., J=7,0Гц), 3,1-3,3 (2Н, м), 2,7-2,8 (1Н, м), 2,62 ЯМР: Н-ЯМР (CDCl3) d 5,39 (1Н, с), 4,23 (2Н, (1Н, дд, J=16,5Гц), 2,4 (1Н, дд, J=16, 8Гц), 1,9 (1Н, кв., J=8Гц), 4,09 (1Н, д, J=16Гц), 4,00 (1Н, д, м), 1,6 (1Н, м), 1,43 (9Η, с), 1,26 (3H, т, J=7,0Гц) J=16Гц), 3,60-3,35 (1Н, м), 3,35-3,15 (1Н, м), 3,10Маса (м/е) 336 (M+Na) 3,04 (1Н, м), 1,46 (9Н, с), 1,31 (3H, т, J=4Гц), 1,16 (3) Синтез гідрохлориду 5-аміно-3(3H, д, J=4Гц) трифторметилпентанової кислоти етилового ефіру Маса (ЕІ) 262 (М++1) 477мг (1,5ммоль) 5-трет(2) Синтез гідрохлориду (2-аміно-1бутоксикарбоніламіно-3-трифторметилпентанової метилетоксі)-оцтової кислоти етилового ефіру кислоти етилового ефіру, отриманого на вказаній 130мг (0,65ммоль) названої сполуки одержувище стадії (2) взаємодіє із сумішшю етилацеють з виходом 44% відповідно до методики, анатат/соляна кислота, а потім перемішують протягом логічної методиці одержання сполуки, описаної в 35 хвилин. Потім реакційний розчин концентрують приготуванні 1-(4), за винятком того, що викорисі висаджують діетиловим ефіром, що дає 0,220г товують 381мг (1,45ммоль) 2-третназваної сполуки з виходом 68%. бутоксикарбоніламіно-1-метилетоксі)-оцтової кис1 Н ЯМР (CDCl3) d 4,16 (2H, кв., J=7,0Гц), 3,04 лоти етилового ефіру, отриманого на вказаній ви(2Н, т, J=8,0Гц), 2,9 (1Н, м), 2,70 (1Н, дд, ще стадії (1). J=16,5Гц), 2,55 (1Н, дд, J=17,8Гц), 2,0-2,1 (1Н, м), ЯМР: 1Н-ЯМР (CDCl3) d 8,47 (2Н, с), 4,23 (2Н, 1,8-1,9 (1Н, м), 1,26 (3H, т, J=7,0Гц) кв., J=8Гц), 4,22-3,99 (2Н, м), 3,80-3,70 (1Н, м), Маса (м/е) 214 (М+1) 3,25-3,20 (1Н, м), 3,10-2,98 (1Н, м), 1,29 (3H, т, Приготування 12: Синтез гідрохлориду 5J=7,5Гц), 1,20 (3H, д, J=8Гц) аміно-4,4-дифторпентанової кислоти метилового Маса (ΕΙ) 200 (M++1) ефіру Приготування 11: Синтез гідрохлориду 5(1) Синтез 3,3-дифторпіперидин-1-карбонової аміно-3-трифторметилпентанової кислоти етилокислоти трет-бутилового ефіру вого ефіру 400мг (2,0ммоль) 3-оксопіперидин-1(1) Синтез 2-оксо-4-трифторметилпіперидин-1карбонової кислоти трет-бутилового ефіру розчикарбонової кислоти трет-бутилового ефіру няють у дихлорметані та охолоджують до темпе 41 89396 42 1 ратури -78°С, і потім в отриманий розчин по крапН-ЯМР (CD3OD) d 3,68 (3H, с), 3,48 (2Н, т, лях додають 0,53мл діетиламіносульфотрифторид J=15Гц), 2,59 (2Н, т, J=7,5Гц), 2,3-2,4 (2Н, м) (DAST, 4,0ммоль), а потім перемішують протягом Маса (м/е) 168 (М+1) 19 годин. Після цього температуру підвищують до Приготування 13: Синтез 3S-треткімнатної температури та до реакційного розчину бутоксикарбоніламіно-4-гідроксибутанової кислоти додають приблизно 0,3мл води. Після концентрабензилового ефіру ції залишок очищують хроматографією на колонці 6,46г (20ммоль) 2S-трет(10:1 суміш гексан:етилацетат), що дає 0,29г набутоксикарбоніламінобурштинової кислоти 4званої сполуки з виходом 64%. бензилового ефіру розчиняють у тетрагідрофурані 1 Н ЯМР (CDCl3) d 3,61 (2Н, т, J=11Гц), 3,4 (2Н, та потім охолоджують до температури 0°С. До отриманого розчину по краплях додають послідом), 1,9-2,0 (2Н, м), 1,7-1,8 (2Н, м), 1,45 (9Н, с) вно 1,9мл (20ммоль) етилхлорформіату та 2,79мл Маса (м/е) 244 (M+Na) триетиламіну. Через 30 хвилин до раніше утворе(2) Синтез 5,5-дифтор-2-оксопіперидин-1ного розчину додають 1,5г (40ммоль) боргідриду карбонової кислоти трет-бутилового ефіру натрію, і реакційний розчин повільно виливають у 0,53г (2,5ммоль) мета-перйодату натрію метанол, а потім перемішують протягом години. (NalO4), розчиняють в 4мл води, і потім до раніше Потім реакційний розчин розбавляють надлишком утвореного розчину додають 22мг (0,17ммоль) етилацетату, і промивають один раз водним розоксиду рутенію (RuO2). Отриманий розчин розбавчином 1н HCl і водним розчином NaCl, відповідно, ляють в 7мл етилацетату. До вказаного розчину потім сушать над безводним сульфатом магнію та додають 110мг (0,5ммоль) 3,3-дифторпіперидин-1відфільтровують. Відфільтрований розчин відгакарбонової кислоти трет-бутилового ефіру, отриняють при зниженому тиску, потім залишок очиманого на вказаній вище стадії (1), а потім перещують хроматографією на колонці (4:1 суміш гекмішують при кімнатній температурі протягом 21 сан:етилацетат), що дає 4,44г названої сполуки з годин. Після перемішування, реакційний розчин виходом 72% розбавляють надлишком етилацетату, і промива1 ють один раз водою та водним розчином NaCl, Н ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,21 (1Н, д, відповідно, сушать над безводним сульфатом маJ=8Гц), 5,12 (2Н, с), 4,0 (1Н, м), 3,69 (2Η, д, J=5Гц), гнію та відфільтровують. Відфільтрований розчин 2,67 (2Н, д, J=5,5Гц), 1,42 (9Н, с) відганяють при зниженому тиску, потім залишок Маса (м/е) 310 (М+1) очищують хроматографією на колонці (2:1 суміш Приготування 14: Синтез 3S-третгексан:етилацетат), що дає 91мг названої сполуки бутоксикарбоніламіно-4-оксобутанової кислоти з виходом 78%. бензилового ефіру 1 0,31г (1,0ммоль) 3S-третН ЯМР (CDCl3) d 3,97 (2Н, т, J=13Гц), 2,66 бутоксикарбоніламіно-4-гідроксибутанової кислоти (2Н, т, J=7,0Гц), 2,3-2,4 (2Н, м), 1,53 (9Н, с) бензилового ефіру розчиняють у дихлорметані, Маса (м/е) 258 (M+Na) отриманого в приготуванні 13, і потім до раніше (3) Синтез 5-трет-бутоксикарбоніламіно-4,4утвореного розчину додають 6мл реагенту Дессдифторпентанової кислоти метилового ефіру Мартина (~0,3М), а потім перемішують протягом 4 91мг (0,39ммоль) 5,5-дифтор-2-оксопіперидингодин. Після концентрації залишок очищують хро1-карбонової кислоти трет-бутилового ефіру, матографією на колонці (2:1 суміш гекотриманого на вказаній вище стадії (2), розчинясан:етилацетат), що дає 0,23г названої сполуки з ють у метанолі, потім до раніше утвореного розчивиходом 75%. ну додають 42мг (0,78ммоль) метилату натрію, а 1 потім перемішують протягом 20 хвилин. Після конН ЯМР (CDCl3) d 9,64 (1Н, с), 7,3-7,4 (5Н, м), центрації реакційний розчин розбавляють надлиш5,6 (1Н, д, J=7,5Гц), 5,12 (2Н, с), 4,35 (1Н, м), 3,05 ком етилацетату, і промивають один раз водним (1Н, дд, J=15,0, 5,0Гц), 2,88 (1Н, дд, J=15,0, 5,0Гц), розчином 1н соляної кислоти та водним розчином 1,44 (9Н, с) NaCl, відповідно, потім сушать над безводним суМаса (м/е) 308 (М+1) льфатом магнію та відфільтровують. ВідфільтроПриготування 15: Синтез 3S-третваний розчин відганяють при зниженому тиску, бутоксикарбоніламіно-4-(2потім залишок очищують хроматографією на когідроксіетиламіно)бутанової кислоти бензилового лонці (2:1 суміш гексан:етилацетат), що дає 73мг ефіру названої сполуки з виходом 71%. 0,68г (2,2ммоль) 3S-трет1 Н-ЯМР (CDCl3) d 4,83 (1Н, ушир. с), 3,69 (3H, бутоксикарбоніламіно-4-оксобутанової кислоти бензилового ефіру, отриманого в приготуванні 14, с), 3,4-3,6 (2Н, м), 2,55 (2Н, т, J=8Гц), 2,1-2,3 (2Н, розчиняють у дихлоретані та потім охолоджують м), 1,44 (9Н, с) до температури 0°С, потім до раніше утвореного Маса (м/е) 290 (M+Na) розчину додають 2-аміноетанол (130 1, 2,2ммоль), (4) Синтез гідрохлориду 5-аміно-4,4а потім перемішують протягом приблизно 30 хвидифторпентанової кислоти метилового ефіру лин. Після цього до раніше утвореного розчину 73мг (0,27ммоль) 5-третдодають 1,4г (6,6ммоль) триацетоксиборгідриду бутоксикарбоніламіно-4,4-дифторпентанової киснатрію, а потім перемішують протягом приблизно лоти метилового ефіру, отриманого на вказаній 1 1/6 годин. Отриманий розчин розбавляють дихвище стадії (3) взаємодіє із сумішшю етилацелорметаном, і промивають насиченим водним тат/соляна кислота, а потім перемішують протягом розчином гідрокарбонату натрію, потім сушать над 25 хвилин. Після цього, реакційний розчин конценбезводним сульфатом магнію та відфільтровують. трують і висаджують діетиловим ефіром, що дає Відфільтрований розчин відганяють при знижено40мг названої сполуки з виходом 88%. 43 89396 44 Приклад 1: Синтез 3-[2S-аміно-4-оксо-4-(3му тиску, потім залишок очищують хроматографітрифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3єю на колонці (1:1 суміш гексан:етилацетат®10:1 а]піразин-7-іл)-бутил]-оксазолідин-2-ону суміш СН2СІ2:МеОН), що дає 0,14г названої сполуки з виходом 18%. ! 1 Н ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,8-6,1 (1Н, м), 5,12 (2Н, с), 4,15-4,35 (1Н, м), 3,7-3,8 (2Н, м), 2,9-3,15 (4Н, м), 2,6-2,8 (2Н, м), 1,42 (9Н, с) Маса (м/е) 353 (М+1) Приготування 16: Синтез 3S-третбутоксикарбоніламіно-4-(2-оксо-оксазолідин-3-іл)бутанової кислоти бензилового ефіру 140мг (0,4ммоль) 3S-третбутоксикарбоніламіно-4-(2-гідроксіетиламіно)21мг (0,045ммоль) [3-оксо-1-(2-оксобутанової кислоти бензилового ефіру, отриманого оксазолідин-3-ілметил)-3-(3-трифторметил-5,6в приготуванні 15, розчиняють у дихлорметані та дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)потім охолоджують до температури 0°С, потім до пропіл]-1S-карбамінової кислоти трет-бутиловий утвореного розчину додають 280 1 (1,6ммоль) ефір, отриманий у приготуванні 17, розчиняють у Ν,Ν-діізопропілетиламіну та 49мг (0,4ммоль) дисуміші етилацетат/соляна кислота, а потім переметиламінопіридину, з наступним додаванням 0,4г мішують протягом близько 17 годин, і потім розчин (0,6ммоль) фосгену (в 20% розчині толуолу) а поконцентрують, що дає тверду речовину білого котім перемішують протягом 2 годин і 40 хвилин. льору. Після цього тверду речовину промивають Після цього отриманий розчин розбавляють дихдіетиловим ефіром і сушать, що дає 15мг названої лорметаном, і промивають водним розчином NaCl, сполуки з виходом 91%. 1 потім сушать над безводним сульфатом магнію та Н ЯМР (CD3OD) d 5,06 (2H, с), 4,4 (3H, м), 4,26 відфільтровують. Відфільтрований розчин відга(1Н, м), 4,05-4,15 (2Н, м), 3,9 (1Н, м), 3,5-3,8 (4Н, няють при зниженому тиску, потім залишок очим), 3,0-3,1 (1Н, м), 2,85-2,95 (1Н, м) щують хроматографією на колонці (1:1 суміш гекМаса (м/е) 363 (М+1) сан:етилацетат), що дає 30мг названої сполуки з Приготування 18: Синтез 3S-третвиходом 20%. бутоксикарбоніламіно-4-(2-гідроксипропіламіно)1 Н ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,12 (2Н, с), бутанової кислоти бензилового ефіру 5,1 (1Н, м), 4,3 (2Н, м), 4,2 (1Н, м), 3,76 (1Н, м), 3,5 0,68г (2,2ммоль) 3S-трет(2Н, м), 3,22 (1Н, м), 2,63 (1Н, дд, J=16, 5,5Гц), 2,58 бутоксикарбоніламіно-4-оксобутанової кислоти (1Н, дд, J=16,6,5Гц), 1,41 (9Н, с) бензилового ефіру, отриманого в приготуванні 14, Маса (м/е) 379 (М+1) розчиняють у дихлоретані, і потім охолоджують до Приготування 17: Синтез [3-оксо-1-(2-оксотемператури 0°С, потім до раніше утвореного розоксазолідин-3-ілметил)-3-(3-трифторметил-5,6чину додають 2-аміноетанол (1701, 2,2ммоль), а дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7потім перемішують протягом 30 хвилин. Після цьоіл)пропіл]-1S-карбамінової кислоти третго до раніше утвореного розчину додають 1,4г бутилового ефіру (6,6ммоль) триацетоксиборгідриду натрію, а потім 30мг (0,079ммоль) 3S-третперемішують приблизно протягом 1 години 10 бутоксикарбоніламіно-4-(2-оксо-оксазолідин-3-іл)хвилин. Після цього розчин розбавляють дихлорбутанової кислоти бензилового ефіру, отриманого метаном, потім промивають насиченим водним в приготуванні 16, розчиняють у метанолі, потім до розчином гідрокарбонату натрію, і сушать над безраніше утвореного розчину додають 3мг паладію водним сульфатом магнію та відфільтровують. на куті (Pd/C), а потім перемішують в атмосфері Відфільтрований розчин відганяють при зниженоводню протягом 3 годин 40 хвилин. Після заверму тиску, потім залишок очищують хроматографішення реакції, реакційний розчин фільтрують чеєю на колонці (1:1 суміш гексан:етилацетат®10:1 рез целіт, і потім промивають метанолом, конценсуміш СН2СІ2:МеОН), що дає 0,36г названої сполутрують. До вказаної реакційної суміші негайно ки з виходом 45%. 1 додають 15мг (0,079ммоль) 3-трифторметил-5,6Н ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,8-6,0 (1Н, дигідро-8Н-[1,2,4]триазоло[4,3-а]піразину та потім м), 5,10 (2Н, м), 3,9-4,0 (1Н, м), 2,5-3,1 (6Н, м), 1,40 розчиняють у дихлорметані. Реакційний розчин (9Н, с), 1,15 (3H, д, J=7Гц) охолоджують до температури 0°С, потім додають Маса (м/е) 367 (М+1) 13мг (0,095ммоль) НОВТ, і перемішують протягом Приготування 19: Синтез 3S-трет10 хвилин, до раніше утвореного розчину додають бутоксикарбоніламіно-4-(5-метил-2-оксо23мг (0,12ммоль) EDC. Після видалення бані з оксазолідин-3-іл)-бутанової кислоти бензилового льодом реакційний розчин перемішують протягом ефіру близько 17 годин, потім концентрують, залишок 360мг (0,98ммоль) 3S-треточищують препаративною ТШХ (10:1 суміш бутоксикарбоніламіно-4-(2-гідроксипропіламіно)СН2СІ2:МеOН), що дає 21мг названої сполуки із бутанової кислоти бензилового ефіру, отриманого загальним виходом 57%. в приготуванні 18, розчиняють у дихлорметані, і 1 Н ЯМР (CDCl3) d 5,6-5,8 (1Н, м), 4,9-5,1 (2Н, потім охолоджують до температури 0°С, потім до м), 4,0-4,4 (6Н, м), 3,6-3,8 (2Н, м), 3,3-3,5 (2Н, м), раніше утвореного розчину додають 120мг 2,6-2,9 (2Н, м), 1,39 (9Н, с) (0,98ммоль) Ν,Ν-діізопропілетиламіну та 680мг Маса (м/е) 463 (М+1) (3,92ммоль) диметиламінопіридину, з наступним 45 89396 46 додаванням 1,0г (1,5ммоль) фосгену (20% толуол) мивають діетиловим ефіром і сушать, що дає 42мг і потім перемішують протягом 2 годин і 40 хвилин. названої сполуки з виходом 60%. 1 Реакційний розчин розбавляють дихлорметаном, і Н ЯМР (CD3OD) d 5,1-5,2 (2Н, м), 4,7-4,8 (1Н, промивають водним розчином NaCl, потім сушать м), 4,45 (1Н, м), 4,3 (1Н, м), 4,0-4,2 (3H, м), 3,8-3,9 над безводним сульфатом магнію та відфільтро(2Н, м), 3,4-3,7 (2Н, м), 2,9-3,1 (2Н, м), 1,41 (3H, м) вують. Відфільтрований розчин відганяють при Маса (м/е) 377 (М+1) зниженому тиску, потім залишок очищують хромаПриготування 21: Синтез 3S-треттографією на колонці (1:1 суміш гекбутоксикарбоніламіно-4-(третсан:етилацетат), що дає 120мг названої сполуки з бутилдиметилсиланілокси)-бутанової кислоти бенвиходом 31%. зилового ефіру 1 Н ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,10 (2Н, с), 4,0г (12,9ммоль) 3S-трет5,10 (1Н, м), 4,55-4,65 (1Н, м), 4,1-4,2 (1Н, м), 3,0бутоксикарбоніламіно-4-гідроксибутанової кислоти 3,8 (3H, м), 2,5-2,8 (2Н, м), 1,41 (12Н, м) бензилового ефіру, отриманого в приготуванні 13, Маса (м/е) 393 (М+1) розчиняють у диметилформаміде, потім до раніше Приготування 20: Синтез [1-(5-метил-2-оксоутвореного розчину додають 2,34г (15,5ммоль) оксазолідин-3-ілметил)-3-оксо-3-(3-трифторметилімідазолу та 2,34г (32,3ммоль) трет5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7бутилдиметилсилілхлориду, а потім перемішують іл)пропіл]-1S-карбамінової кислоти третпротягом близько 2 годин. Після цього розчин розбутилового ефіру бавляють надлишком етилацетату та промивають 120мг (0,31ммоль) 3S-третодин раз водою та водним розчином NaCl, відпобутоксикарбоніламіно-4-(5-метил-2-оксовідно, потім сушать над безводним сульфатом оксазолідин-3-іл)-бутанової кислоти бензилового магнію та відфільтровують. Відфільтрований розефіру, отриманого в приготуванні 19, розчиняють у чин відганяють при зниженому тиску, потім залиметанолі, потім до раніше утвореного розчину дошок очищують хроматографією на колонці (5:1 дають 12мг паладію на куті (Pd/C), а потім перемісуміш гексан:етилацетат), що дає 4,0г названої шують в атмосфері водню протягом 3 годин 40 сполуки з виходом 73%. 1 хвилин. Після завершення реакції, реакційний розН ЯМР (CDCl3) d 7,3-7,4 (5Н, м), 5,21 (1Н, д, чин фільтрують через целіт, потім промивають J=8Гц), 5,08 (1Н, м), 4,0-4,1 (1Н, м), 3,6-3,7 (2Н, м), метанолом, з наступною концентрацією. В отри2,6-2,7 (2Н, м), 1,42 (9Н, с), 0,86 (9Н, с), 0,01 (6Н, с) ману суміш негайно додають 9мг (0,31ммоль) аміМаса (м/е) 424 (М+1) ну, потім суміш розчиняють у дихлорметані. РеакПриготування 22: Синтез [1-(третційний розчин охолоджують до температури 0°С, бутилдиметилсиланілоксиметил)-3-оксо-3-(3потім у нього додають 50мг (0,37ммоль) НОВТ. трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3Після перемішування протягом 10 хвилин до раніа]піразин-7-іл)-пропіл]-1S-карбамінової кислоти ше утвореного розчину додають 88мг (0,47ммоль) трет-бутилового ефіру EDC. Після видалення бані з льодом реакційний (1) Синтез 3S-трет-бутоксикарбоніламіно-4розчин перемішують протягом близько 17 годин, (трет-бутилдиметилсиланілокси)-бутанової кислопотім концентрують, залишок очищують препарати тивною ТШХ (10:1 суміш СН2СІ2:МеOН), що дає 1,0г (2,36ммоль) 3S-трет88мг названої сполуки із загальним виходом 60%. бутоксикарбоніламіно-4-(трет1 Н ЯМР (CDCl3) d 5,6-5,9 (1Н, м), 4,9-5,1 (2Н, бутилдиметилсиланілокси)-бутанової кислоти бенм), 4,6-4,8 (1Н, м), 3,9-4,3 (5Н, м), 3,6-3,8 (1Н, м), зилового ефіру, отриманого в приготуванні 21, 3,1-3,5 (3H, м), 2,5-2,9 (2Н, м), 1,40 (12Н, м) розчиняють у метанолі, потім до раніше утвореноМаса (м/е) 477 (М+1) го розчину додають 120мг паладію на куті (Pd/C), а Приклад 2: Синтез 3-[2S-аміно-4-оксо-4-(3потім перемішують в атмосфері водню протягом 3 трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3годин і 25 хвилин. Після завершення реакції, реака]піразин-7-іл)-бутил]-5-метил-оксазолідин-2-ону ційний розчин фільтрують через целіт і промивають метанолом, потім концентрують. 1 Н ЯМР (CDCl3) d 5,10 (1Н, м), 4,02 (1Н, м), 3,63,7 (2Н, м), 2,61 (2Н, м), 1,43 (9Н, с), 0,88 (9Н, с), 0,04 (6Н, с) Маса (м/е) 356 (M+Na) (2) Синтез [1-(третбутилдиметилсиланілоксиметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-15-карбамінової кислоти трет-бутилового ефіру 88мг (0,045ммоль) [1-(5-метил-2-оксоДо 333мг (1ммоль) 3S-третоксазолідин-3-ілметил)-3-оксо-3-(3-трифторметилбутоксикарбоніламіно-4-(трет5,6-дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)бутилдиметилсиланілокси)-бутанової кислоти, яку пропіл]-1S-карбамінової кислоти трет-бутилового одержують зі стадії (1), додають 192мг (1ммоль) 3ефіру, отриманого в приготуванні 20, розчиняють у трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3суміші етилацетат/соляна кислота. Після переміа]піразину, і отриману суміш розчиняють у дихлошування протягом близько 30 хвилин, реакційний рметані. Реакційний розчин охолоджують до темрозчин концентрують, що дає тверду речовину ператури 0°С, і додають 162мг (1,2ммоль) НОВТ, а білого кольору. Після цього тверду речовину пропотім перемішують протягом 10 хвилин і потім до 47 89396 48 77мг (0,2ммоль) [1-форміл-3-оксо-3-(3дають 288мг (1,5ммоль) EDC. Після видалення трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3бані з льодом реакційний розчин перемішують а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти протягом близько 13 годин, і потім залишок, який трет-бутилового ефіру додають до 33мг одержують після концентрації, очищують хромато(0,2ммоль) гідрохлориду 5-амінопентанової кислографією на колонці (1:1 суміш гексан:етилацетат), ти метилового ефіру, розчиняють у дихлоретані, а що дає 0,27г названої сполуки з виходом 53%. 1 потім перемішують протягом 30 хвилин. До раніше Н ЯМР (CDCl3) d 5,1-5,3 (1Н, м), 4,9-5,1 (2Н, утвореного розчину додають 83мг (0,4ммоль) трим), 3,9-4,3 (4Н, м), 3,7-3,8 (2Н, м), 2,6-2,9 (2Н, м), ацетоксиборгідриду натрію, а потім перемішують 1,40 (9Н, с), 0,87 (9Н, с), 0,03 (6Н, с) протягом приблизно 1 години та 40 хвилин. ОтриМаса (м/е) 508 (М+1) маний розчин нагрівають до температури 80°С Приготування 23: Синтез [1-форміл-3-оксо-3протягом приблизно 7 годин і концентрують, потім (3-трифторметил-5,6-дигідро-8Нзалишок очищують препаративною ТШХ (10:1 су[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sміш СН2СІ2:МеOН), що дає приблизно 20г названої карбамінової кислоти трет-бутилового ефіру сполуки із загальним виходом 21%. (1) Синтез [1-гідроксиметил-3-оксо-3-(31 Н ЯМР (CD3OD) d 6,5 (1Н, м), 4,9-5,1 (2Н, м), трифторметил-5,6-дигідро-8Н-[1,2,41триазоло[4,34,0-4,4 (5Н, м), 3,35-3,5 (3H, м), 2,6-2,8 (2Н, м), 2,28 а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти (2Н, т, J=6,0Гц), 1,7-1,8 (4Н, м), 1,36 (9Н, с) трет-бутилового ефіру Маса (м/е) 475 (М+1) 2,3г (4,53ммоль) [1-(третПриклад 3: Синтез 1-[2S-аміно-4-оксо-4-(3бутилдиметилсиланілоксиметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-бутил]-піперидин-2-ону а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 22, розчиняють у тетрагідрофурані, потім в отриманий розчин по краплях додають 9мл тетрабутиламонійфториду (1Μ у ТГФ), а потім перемішують протягом приблизно 12 хвилин. Потім розчин розбавляють надлишком етилацетату, розведений розчин промивають один раз водою та водним розчином NaCl, відповідно та сушать над безводним сульфатом магнію та відфільтровують. Відфі88мг (0,045ммоль) [3-оксо-1-(2-оксопіперидинльтрований розчин відганяють при зниженому тис1-ілметил)-3-(3-трифторметил-5,6-дигідро-8Нку, потім залишок очищують хроматографією на [1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sколонці (15:1 СН2СІ2:МеOН), що дає 1,78г [1карбамінової кислоти трет-бутилового ефіру, гідроксиметил-3-оксо-3-(3-трифторметил-5,6отриманого в приготуванні 24, розчиняють у суміші дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)етилацетат/соляна кислота, а потім перемішують пропіл]-1S-карбамінової кислоти трет-бутилового протягом приблизно 30 хвилин і потім концентруефіру з виходом 99%. ють. Залишок очищують препаративною ТШХ (10:1 1 Н ЯМР (CDCl3) d 5,3-5,5 (1Н, м), 5,0-5,2 (2Н, суміш СН2СІ2:МеОН), що дає приблизно 10,4мг м), 3,9-4,3 (4Н, м), 3,6-3,8 (2Н, м), 2,7-3,0 (2Н, м), названої сполуки з виходом 66%. 1,41 (9Н, с) 1 Н-ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,6 (1Н, Маса (м/е) 394 (М+1) ушир.), 4,0-4,4 (4Н, м), 3.8-3,9 (2Н, м), 3,35-3,5 (2Н, (2) Синтез [1-форміл-3-оксо-3-(3м), 2,8-3,0 (2Н, м), 2,0-2,4 (2Н, м), 1,8-1,9 (4Н, м) трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3Маса (м/е) 375 (М+1) а]піразин-7-іл)пропіл]-1S-карбамінової кислоти Приготування 25: Синтез [1-(4-метил-2трет-бутилового ефіру оксопіролідин-1-ілметил)3-оксо-3-(3500мг (1,27ммоль) [1-гідроксиметил-3-оксо-3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3(3-трифторметил-5,6-дигідро-8На]піразин-7-іл)пропіл]-1S-карбамінової кислоти [1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sтрет-бутилового ефіру карбамінової кислоти трет-бутилового ефіру, який 50мг (0,13ммоль) [1-форміл-3-оксо-3-(3одержують зі стадії (1), розчиняють у дихлорметатрифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3ні, і потім до раніше утвореного розчину додають а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти 10мл реагенту Десс-Мартина (~0,3М), а потім петрет-бутилового ефіру, отриманого в приготуванні ремішують протягом 2 годин і 40 хвилин. Після 23 і 21мг (0,13ммоль) гідрохлориду 4-аміно-3концентрації, залишок очищують хроматографією метилбутанової кислоти метилового ефіру (вказана колонці (1:2 суміш гексан:етилацетат), що дає ний продукт отриманий у приготуванні 2) взаємо0,33г названої сполуки з виходом 66%. діють відповідно до методики, аналогічної методи1 Н ЯМР (CDCl3) d 9,67 (1Н, с), 5,7-5,9 (1Н, м), ці, викладеної в приготуванні 24, що дає 18мг 4,9-5,1 (2Н, м), 3,9-4,5 (5Н, м), 3,1-3,2 (1Н, м), 2,9названої сполуки з виходом 30%. 3,0 (1Н, м), 1,42 (9Н, с) 1 Н ЯМР (CDCl3) d 5,7-6,0 (1Н, м), 4,8-5,1 (2Н, Маса (м/е) 392 (М+1) м), 3,9-4,4 (5Н, м), 3,3-3,7 (3H, м), 3,0-3,1 (1Н, м), Приготування 24: Синтез [3-оксо-1-(22,3-2,9 (4Н, м), 1,9-2,0 (1Н, м), 1,40 (9Н, с), 1,09 оксопіперидин-1-ілметил)-3-(3-трифторметил-5,6(3H, д, J=5Гц) дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7Маса (м/е) 475 (М+1) іл)пропіл]-1S-карбамінової кислоти третбутилового ефіру 49 89396 50 1 Приклад 4: Синтез 1-[2S-аміно-4-оксо-4-(3Н ЯМР (CD3OD) d 5,0-5,3 (3H, м), 4,2-4,4 (2Н, трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3м), 4,0-4,2 (2Н, м), 3,4-3,7 (5Н, м), 2,5-2,8 (3H, м), а]піразин-7-іл)-бутил]-4-метилпіролідин-2-ону 2,1-2,3 (1Н, м) Маса (м/е) 379 (М+1) Приклад 6: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-бутил]-піролідин-2-ону 18мг [1-(4-метил-2-оксопіролідин-1-ілметил)-3оксо-3-(3-трифторметил-5,6-дигідро-8Н[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sкарбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 25, взаємодіє із сумішшю етилацетат/соляна кислота відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 5,8мг названої сполуки з виходом 37%. 1 Н-ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,0-4,3 (4Н, м), 3,3-3,7 (4Н, м), 3,0-3,1 (1Н, м), 2,4-2,8 (4Н, м), 1,9-2,0 (1Н, м), 1,1 (3H, м) Маса (м/е) 375(М+1) Приготування 26: Синтез [1-(3-фтор-2оксопіролідин-1-ілметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру [1-форміл-3-оксо-3-(3-трифторметил-5,6дигідро-8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру 39мг (0,1ммоль), отриманого в приготуванні 23 і 17мг (0,1ммоль) гідрохлориду 4-аміно-2фторбутанової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 3) і 42мг (0,2ммоль) триацетоксибор гідр йду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, викладеної в прикладі 3, що дає 5,8мг названої сполуки з виходом 37%. 1 Н ЯМР (CDCl3) d 5,7-5,9 (1Н, м), 4,9-5,1 (3H, м), 3,8-4,3 (5Н, м), 3,3-3,7 (4Н, м), 2,4-2,8 (3H, м), 2,1-2,2 (1Н, м), 1,40 (9Н, с) Маса (м/е) 479 (М+1) Приклад 5: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-бутил]-3-фторпіролідин-2-ону 15мг [1-(3-фтор-2-оксопіролідин-1-ілметил)-3оксо-3-(3-трифторметил-5,6-дигідро-8Н[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sкарбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 26 і суміш етилацетат/соляна кислота взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 5,9мг аміну з виходом 45%. 77мг (0,2ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 23, додають до 23мг (0,2ммоль) 4-амінобутанової кислоти метилового ефіру, потім отриману суміш розчиняють у дихлоретані, а потім перемішують протягом 30 хвилин. Після цього до раніше утвореного розчину додають 84мг (0,4ммоль) триацетоксиборгідриду натрію, а потім перемішують протягом приблизно 2 годин. Після концентрації, залишок взаємодіє із сумішшю етилацетат/соляна кислота відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 15мг названої сполуки з виходом 21%. 1 Н ЯМР (CD3OD) d 5,00-4,95 (2Н, м), 4,31-4,22 (2Н, м), 4,10-4,01 (2Н, м), 3,74 (1Н, ушир. с), 3,533,41 (3H, м), 2,89-2,72 (2Н, м), 2,37-2,34 (2Н, м), 2,08-2,05 (2Н, м), 1,27 (2Н, ушир. с). Маса (м/е) 361 (М+1) Приготування 27: Синтез [1-(3-фтор-2оксопіперидин-1-ілметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру 90мг (0,1ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 23, 43мг (0,1ммоль) гідрохлориду 5-аміно-2фторпентанової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 4) і 98мг (0,2ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, описаної в приготуванні 24, що дає 24мг названої сполуки з виходом 21%. 1 Н ЯМР (CDCl3) d 5,8-6,1 (1Н, м), 4,6-5,2 (3H, м), 3,8-4,4 (5Н, м), 3,2-3,6 (4Н, м), 2,6-3,0 (2Н, м), 1,7-2,1 (4Н, м), 1,40 (9Н, с) Маса (м/е) 493 (М+1) Приклад 7: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)-бутил]-3-фторпіперидин-2-ону 51 24мг [1-(3-фтор-2-оксопіперидин-1-ілметил)-3оксо-3-(3-трифторметил-5,6-дигідро-8Н[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sкарбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 27 і суміш етилацетат/соляна кислота взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 6мг названої сполуки з виходом 31%. 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,7-4,9 (1Н, м), 4,2-4,4 (2Н, м), 4,0-4,2 (2Н, м), 3,7-3,8 (1Н, м), 3,3-3,6 (4Н, м), 2,7-3,0 (2Н, м), 1,8-2,2 (4Н, м) Маса (м/е) 393 (М+1) Приготування 28: Синтез [1-(3-метил-2оксопіролідин-1-ілметил)3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру 75мг (0,1ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 25 і 32мг (0,1ммоль) гідрохлориду 4-аміно-2метилбутанової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 5) і 81мг (0,2ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, описаної в приготуванні 24, що дає 20мг названої сполуки з виходом 22%. 1 Н ЯМР (CDCl3) d 5,8-6,0 (1Н, м), 4,8-5,1 (2Н, м), 3,8-4,3 (5Н, м), 3,3-3,5 (4Н, м), 2,5-2,9 (2Н, м), 2,1-2,4 (2Н, м), 1,5-1,6 (1Н, м), 1,40 (9Н, с), 1,09-1,1 (3H, м) Маса (м/е) 475 (М+1) Приклад 8: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)-бутил]-3-метилпіролідин-2-ону 20мг [1-(3-метил-2-оксопіролідин-1-ілметил)-3оксо-3-(3-трифторметил-5,6-дигідро-8Н[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sкарбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 28 і суміш етилацетат/соляна кислота взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 4,5мг названої сполуки з виходом 29%. 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, м), 4,0-4,2 (2Н, м), 3,6-3,7 (1Н, м), 3,4-3,5 (4Н, м), 2,6-2,9 (2Н, м), 2,2-2,5 (2Н, м), 1,6-1,7 (1Н, м), 1,3 (1Н, м), 1,1-1,2 (3H, м) Маса (м/е) 375 (М+1) Приготування 29: Синтез [1-(4-метил-2-оксо2,5-дигідропірол-1-ілметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру 89396 52 85мг (0,22ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 23, 36мг (0,22ммоль) гідрохлориду 4-аміно-3метил-2-бутенової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 6) і 92мг (0,44ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, описаної в приготуванні 24, що дає 34мг названої сполуки з виходом 33%. 1 Н ЯМР (CDCl3) d 5,9-6,2 (1Н, м), 5,72 (1Н, м), 4,9-5,1 (2Н, м), 3,9-4,4 (7Н, м), 3,6-3,7 (1Н, м), 3,43,5 (1Н, м), 2,7-2,9 (1Н, м), 2,5-2,6 (1Н, м), 2,04 (3H, с), 1,38 (9Н, м) Маса (м/е) 473 (М+1) Приклад 9: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)-бутил]-4-метил-1,5-дигідропірол-2ону 34мг [1-(4-метил-2-оксо-2,5-дигідропірол-1ілметил)-3-оксо-3-(3-трифторметил-5,6-дигідро8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sкарбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 29 і суміш етилацетат/соляна кислота взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 25мг названої сполуки з виходом 93%. 1 Н ЯМР (CD3OD) 5,81 (1Н, м), 5,0 (2Н, м), 4,24,4 (2Н, м), 4,0-4,1 (4Н, м), 3,8-3,9 (1Н, м), 3,65-3,75 (2Н, м), 2,9-3,0 (1Н, м), 2,75-2,85 (1Н, м), 2,10 (3H, с) Маса (м/е) 373 (М+1) Приготування 30: Синтез [1-(4-метил-2оксопіперидин-1-ілметил)-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)пропіл]-1S-карбамінової кислоти трет-бутилового ефіру 85мг (0,22ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 25, 39мг (0,22ммоль) гідрохлориду 5-аміно-3метилпентанової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 8) і 92мг (0,44ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, описаної в приготуванні 24, що дає 46мг названої сполуки з виходом 43%. 1 Н ЯМР (CDCl3) d 5,9-6,0 (1Н, м), 4,8-5,1 (2Н, м), 3,9-4,3 (6Н, м), 3,5-3,6 (1Н, м), 3,3-3,5 (3H, м), 2,7-2,9 (1Н, м), 2,3-2,6 (2Н, м), 1,8-1,9 (2Н, м), 1,41,5 (1Н, м), 1,39 (9Н, с), 0,95 (3H, м) Маса (м/е) 489 (М+1) 53 89396 54 Приклад 10: Синтез 1-[2S-аміно-4-оксо-4-(3тат/соляна кислота взаємодіють відповідно до метрифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3тодики, аналогічної методиці одержання сполуки, a]піразин-7-іл)-бутил]-4-метилпіперидин-2-ону викладеної в прикладі 3, що дає 7,9мг названої сполуки з виходом 39%. 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, м), 4,0-4,2 (2Н, м), 3,7-3,9 (2Н, м), 3,6-3,7 (2Н, м), 3,4-3,5 (1Н, м), 2,8 (1Н, тд, J=16, 5Гц), 2,6-2,7 (1Н, м), 2,5-2,6 (2Н, м), 2,3-2,4 (2Н, м) Маса (м/е) 411 (М+1) Приготування 32: Синтез [1-(5R-метил-2оксопіперидин-1-ілметил)3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)пропіл]-1S-карбамінової кислоти 46мг [1-(4-метил-2-оксопіперидин-1-ілметил)-3трет-бутилового ефіру оксо-3-(3-трифторметил-5,6-дигідро-8Н80мг (0,20ммоль) [1-форміл-3-оксо-3-(3[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sтрифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3карбамінової кислоти трет-бутилового ефіру, а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти отриманого в приготуванні 30 і суміш етилацетрет-бутилового ефіру, отриманого в приготуванні тат/соляна кислота взаємодіють відповідно до ме23 і 37мг (0,20ммоль) гідрохлориду (R)-5-аміно-4тодики, аналогічної методиці одержання сполуки, метилпентанової кислоти метилового ефіру (вкавикладеної в прикладі 3, що дає 29мг названої заний продукт отриманий у приготуванні 7) і 87мг сполуки з виходом 79%. 1 (0,40ммоль) триацетоксиборгідриду натрію взаєН ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, модіють відповідно до методики, аналогічної мем), 4,0-4,2 (2Н, м), 3,8-3,9 (2Н, м), 3,3-3,8 (3H, м), тодиці одержання сполуки, описаної в приготуван2,8-3,0 (2Н, м), 2,4 (1Н, м), 1,8-2,0 (3H, м), 1,5-1,6 ні 24, що дає 33мг названої сполуки з виходом (1Н, м), 1,0 (3H, м) 33%. Маса (м/е) 389 (М+1) 1 Н ЯМР (CDCl3) d 5,9-6,0 (1Н, м), 4,8-5,1 (2Н, Приготування 31: Синтез [1-(5,5-дифтор-2м), 3,8-4,3 (5Н, м), 3,2-3,7 (3H, м), 2,9-3,1 (1Н, м), оксопіперидин-1-ілметил)3-оксо-3-(32,1-2,9 (4Н, м), 1,7-2,0 (2Н, м), 1,3-1,5 (1Н, м), 1,40 трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3(9Н, с), 0,98 (3H, м) а]піразин-7-іл)пропіл]-1S-карбамінової кислоти Маса (м/е) 489 (М+1) трет-бутилового ефіру Приклад 12: Синтез 1-[2S-аміно-4-оксо-4-(385мг (0,22ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)-бутил]-5R-метилпіперидин-2-ону а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні 23, 44мг (0,22ммоль) гідрохлориду 5-аміно-4,4дифторпентанової кислоти метилового ефіру (вказаний продукт отриманий у приготуванні 12) і 92мг (0,44ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, описаної в приготуванні 24, що дає 25мг названої сполуки з виходом 23%. 1 33мг [1-(5R-метил-2-оксопіперидин-1-ілметил)Н ЯМР (CDCl3) 5,8-5,9 (1Н, м), 4,8-5,1 (2Н, м), 3-оксо-3-(3-трифторметил-5,6-дигідро-8Н4,1-4,3 (4Н, м), 3,9-4,0 (1Н, м), 3,6-3,8 (3H, м), 3,3[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1S3,5 (1Н, м), 2,7-2,9 (1Н, м), 2,5-2,6 (2Н, м), 2,4 (1Н, карбамінової кислоти трет-бутилового ефіру, т, J=7,0Гц), 2,2-2,3 (2Н,м), 1,40 (9Н, с) отриманого в приготуванні 32 і суміш етилацеМаса (м/е) 511 (М+1) тат/соляна кислота взаємодіють відповідно до меПриклад 11: Синтез 1-[2S-аміно-4-оксо-4-(3тодики, аналогічної методиці одержання сполуки, трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3викладеної в прикладі 3, що дає 15,3мг названої а]піразин-7-іл)-бутил]-5,5-дифторпіперидин-2-ону сполуки з виходом 58%. 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, м), 4,0-4,2 (2Н, м), 3,8-3,9 (1Н, м), 3,7-3,8 (1Н, м), 3,55-3,65 (1Н, м), 3,3-3,4 (1Н, м), 2,8-3,1 (3H, м), 2,3-2,4 (2Н, м), 2,0-2,1 (1Н, м), 1,8-1,9 (1Н, м), 1,51,6 (1Н, м), 1,03 (3H, д, J=6Гц) Маса (м/е) 389 (М+1) Приготування 33: Синтез [3-оксо-1-(2-оксо-4трифторметилпіролідин-1-ілметил)3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,325мг [1-(5,5-дифтор-2-оксопіперидин-1a]піразин-7-іл)пропіл]-1S-карбамінової кислоти ілметил)-3-оксо-3-(3-трифторметил-5,6-дигідротрет-бутилового ефіру 8Н-[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1S80мг (0,20ммоль) [1-форміл-3-оксо-3-(3карбамінової кислоти трет-бутилового ефіру, трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3отриманого в приготуванні 31 і суміш етилацеа]піразин-7-іл)-пропіл]-1S-карбамінової кислоти 55 89396 56 трет-бутилового ефіру, отриманого в приготуванні 23, 48мг (0,20ммоль) гідрохлориду 3-амінометил4,4,4-трифторбутанової кислоти етилового ефіру (вказаний продукт отриманий у приготуванні 1) і 87мг (0,40ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, описаної в приготуванні 24, що дає 4,6мг названої сполуки з виходом 41мг [3-оксо-1-(2-оксо-440%. 1 трифторметилпіперидин-1-ілметил)-3-(3Н ЯМР (CDCl3) d 5,6-5,7 (1Н, м), 4,8-5,1 (2Н, трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3м), 3,9-4,3 (5Н, м), 3,3-3,8 (4Н, м), 3,0-3,1 (1Н, м), а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти 2,4-2,9 (4Н, м), 1,4 (9Н, с) трет-бутилового ефіру, отриманого в приготуванні Маса (м/е) 529 (М+1) 34 і суміш етилацетат/соляна кислота взаємодіють Приклад 13: Синтез 1-[2S-аміно-4-оксо-4-(3відповідно до методики, аналогічної методиці одетрифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3ржання сполуки, викладеної в прикладі 3, що дає a]піразин-7-іл)-бутил]-4-трифторметил-піролідин-228,3мг названої сполуки з виходом 85%. ону 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, м), 4,0-4,2 (2Н, м), 3,7-3,9 (2Н, м), 3,4-3,7 (3H, м), 2,8-3,1 (3H, м), 2,5-2,7 (1Н, м), 2,3-2,5 (1Н, м), 2,12,2 (1Н, м), 1,8-2,0 (1Н, м), 1,3 (1Н, м) Маса (м/е) 443 (М+1) Приготування 35: Синтез [3-оксо-1-(2-оксо-5трифторметилпіперидин-1-ілметил)3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3a]піразин-7-іл)пропіл]-1S-карбамінової кислоти 18мг [3-оксо-1-(2-оксо-4трет-бутилового ефіру трифторметилпіролідин-1-ілметил)-3-(3286мг (0,73ммоль) [1-форміл-3-оксо-3-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти трет-бутилового ефіру, отриманого в приготуванні трет-бутилового ефіру, отриманого в приготуванні 33 і суміш етилацетат/соляна кислота взаємодіють 23, 172мг (0,73ммоль) гідрохлориду 4-амінометилвідповідно до методики, аналогічної методиці оде5,5,5-трифторпентанової кислоти метилового ефіржання сполуки, викладеної в прикладі 3, що дає ру (вказаний продукт отриманий у приготуванні 9) і 7мг названої сполуки з виходом 48%. 310мг (1,46ммоль) триацетоксиборгідриду натрію 1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, взаємодіють відповідно до методики, аналогічної м), 4,0-4,2 (2Н, м), 3,7-3,9 (2Н, м), 3,5-3,7 (3H, м), методиці одержання сполуки, описаної в приготу3,3-3,4 (1Н, м), 2,8-3,0 (2Н, м), 2,5-2,7 (2Н, м) ванні 24, що дає 260мг названої сполуки з виходом Маса (м/е) 429 (М+1) 37%. 1 Приготування 34: Синтез [3-оксо-1-(2-оксо-4Н ЯМР (CDCl3) d 5,7-6,0 (1Н, м), 4,8-5,1 (2Н, трифторметилпіперидин-1-ілметил)3-(3м), 4,1-4,3 (4Н, м), 3,7-4,0 (2Н, м), 3,3-3,7 (3H, м), трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,32,2-2,9 (5Н, м), 2,0-2,1 (1Н, м), 1,8-1,9 (1Н, м), 1,39 а]піразин-7-іл)пропіл]-1S-карбамінової кислоти (9Н, с) трет-бутилового ефіру Маса (м/е) 543 (М+1) 80мг (0,20ммоль) [1-форміл-3-оксо-3-(3Приклад 15: Синтез 1-[2S-аміно-4-оксо-4-(3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти a]піразин-7-іл)-бутил]-5-трифторметилпіперидин-2трет-бутилового ефіру, отриманого в приготуванні ону 23, 51мг (0,20ммоль) гідрохлориду 5-аміно-3трифторметилпентанової кислоти етилового ефіру (вказаний продукт отриманий у приготуванні 11) і 87мг (0,40ммоль) триацетоксиборгідриду натрію взаємодіють відповідно до методики, аналогічній методиці одержання сполуки, описаної в приготуванні 24, що дає 41мг названої сполуки з виходом 37%. 1 Н ЯМР (CDCl3) d 5,7-6,0 (1Н, м), 4,8-5,1 (2Н, м), 3,8-4,3 (5Н, м), 3,3-3,7 (4Н, м), 2,7-2,9 (1Н, м), 260мг [3-оксо-1-(2-оксо-52,4-2,6 (3H, м), 2,3-2,4 (1Н, м), 2,1 (1Н, м), 1,8 (1Н, трифторметилпіперидин-1-ілметил)-3-(3м), 1,4 (9Н, с) трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3Маса (м/е) 543 (М+1) а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти Приклад 14: Синтез 1-[2S-аміно-4-оксо-4-(3трет-бутилового ефіру, отриманого в приготуванні трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,335 і суміш етилацетат/соляна кислота взаємодіють а]піразин-7-іл)-бутил]-4-трифторметилпіперидин-2відповідно до методики, аналогічної методиці одеону ржання сполуки, викладеної в прикладі 3, що дає 15мг названої сполуки з виходом 7%. 57 89396 58 2,8-3,0 (3H, м), 2,6-2,7 (1Н, м), 1,47 (9Н, с), 0,92 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, (9Н, с), 0,19 (3H, с), 0,14 (3H, с) м), 4,0-4,2 (2Н, м), 3,8-3,9 (2Н, м), 3,4-3,8 (3H, м), Маса (м/е) 449 (М+1) 2,8-3,0 (3H, м), 2,4-2,5 (2Н, м), 2,0-2,1 (1Н, м), 1,8Приготування 38: Синтез [3-(3,4-дигідро-1Н2,0 (1Н, м) ізохінолін-2-іл)-1-форміл-3-оксопропіл]-1SМаса (м/е) 443 (М+1) карбамінової кислоти трет-бутилового ефіру Приготування 36: Синтез [1-(2-метил-5-оксо(1) Синтез [3-(3,4-дигідро-1Н-ізохінолін-2-іл)-1морфолін-4-ілметил)3-оксо-3-(3-трифторметилгідроксиметил-3-оксопропіл]-1S-карбамінової кис5,6-дигідро-8Н-[1,2,4]триазоло[4,3-a]піразин-7лоти трет-бутилового ефіру іл)пропіл]-1S-карбамінової кислоти трет250мг [3-(3,4-дигідро-1Н-ізохінолін-2-іл)-1бутилового ефіру гідроксиметил-3-оксопропіл]-1S-карбамінової кис140мг (0,36ммоль) [1-форміл-3-оксо-3-(3лоти трет-бутилового ефіру, одержують з виходом трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,396% відповідно до методики, аналогічної методиці а]піразин-7-іл)-пропіл]-1S-карбамінової кислоти одержання сполуки, описаної в приготуванні 23трет-бутилового ефіру, отриманого в приготуванні (1), використовуючи 349мг [1-(трет23, 71мг (0,36ммоль) гідрохлориду (2-аміно-1бутилдиметилсиланілоксиметил)-3-(3,4-дигідрометилетоксі)-оцтової кислоти етилового ефіру 1Н-ізохінолін-2-іл)-3-оксопропіл]-1S-карбамінової (вказаний продукт отриманий у приготуванні 10) і кислоти трет-бутилового ефіру, отриманого в при151мг (0,72ммоль) триацетоксиборгідрид натрію готуванні 37. взаємодіють відповідно до методики, аналогічної 1 Н ЯМР (CDCl3) d 7,1-7,2 (4Н, м), 5,5-5,6 (1Н, методиці одержання сполуки, описаної в приготум), 4,6-4,8 (2Н, м), 3,7-4,0 (5Н, м), 3,3-3,4 (2Н, м), ванні 24, що дає 78мг названої сполуки з виходом 2,7-3,0 (2Н, м), 1,41 (9Н, с), 0,90 (9Н, с), 0,10 (6Н, с) 44%. 1 Маса (м/е) 357 (M+Na) Н ЯМР (CDCl3) d 5,8-6,0 (1Н, м), 4,8-5,1 (2Н, (2) Синтез [3-(3,4-дигідро-1Н-ізохінолін-2-іл)]м), 3,9-4,3 (7Н, м), 3,7-3,9 (1Н, м), 3,5-3,7 (1Н, м), форміл-3-оксопропіл]-1S-карбамінової кислоти 3,1-3,5 (3H, м), 2,5-2,9 (2Н, м), 1,33 (9Н, с), 1,19 трет-бутилового ефіру (3H, ушир. с) 250мг [3-(3,4-дигідро-1Н-ізохінолін-2-іл)-1Маса (м/е) 491 (М+1) гідроксиметил-3-оксопропіл]-1S-карбамінової кисПриклад 16: Синтез 4-[2S-аміно-4-оксо-4-(3лоти трет-бутилового ефіру (продукт, отриманий трифторметил-5,6-дигідро-8Н-[1,2,4]триазоло[4,3на стадії 1). отриманого відповідно до методики, а]піразин-7-іл)-бутил]-6-метилморфолін-3-ону аналогічної методиці одержання сполуки, описаної в приготуванні 23-(2) і 10мл реагенту ДессМартина (~0,3М) взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, викладеної в прикладі 3, що дає 180мг названої сполуки з виходом 72%. 1 Н ЯМР (CDCl3) d 9,72 (1Н, с), 7,1-7,2 (4Н, м), 5,97 (1Н, м), 4,3-4,8 (4Н, м), 3,6-3,8 (2Н, м), 2,8-3,0 (2Н, м), 1,45 (9Н, с) 78мг [1-(2-метил-5-оксо-морфолін-4-ілметил)Маса (м/е) 333 (М+1) 3-оксо-3-(3-трифторметил-5,6-дигідро-8НПриготування 39: Синтез [3-(3,4-дигідро-1Н[1,2,4]триазоло[4,3-а]піразин-7-іл)-пропіл]-1Sізохінолін-2-іл)-3-оксо-1-(2-оксопіперидин-1карбамінової кислоти трет-бутилового ефіру, ілметил)-пропіл]-1S-карбамінової кислоти третотриманого в приготуванні 36 і суміш етилацебутилового ефіру тат/соляна кислота взаємодіють відповідно до ме60мг (0,18ммоль) [3-(3,4-дигідро-1Н-ізохінолінтодики, аналогічної методиці одержання сполуки, 2-іл)-1-форміл-3-оксопропіл]-1S-карбамінової кисвикладеної в прикладі 3, що дає 25,7мг названої лоти трет-бутилового ефіру, отриманого в пригосполуки з виходом 45%. туванні 30 і гідрохлориду 5-амінопентанової кисло1 Н ЯМР (CD3OD) d 4,9-5,1 (2Н, м), 4,2-4,4 (2Н, ти метилового ефіру та 77мг (0,36ммоль) м), 4,1-4,2 (2Н, м), 3,8-4,1 (4Н, м), 3,68 (1Н, м), 3,2триацетоксиборгідриду натрію взаємодіють відпо3,5 (3H, м), 2,8-3,1 (2Н, м), 1,24 (3H, д, J=6,5Гц) відно до методики, аналогічної методиці одержанМаса (м/е) 391 (М+1) ня сполуки, описаної в приготуванні 24, що дає 9мг Приготування 37: Синтез [1-(третназваної сполуки з виходом 12%. бутилдиметилсиланілоксиметил)-3-(3,4-дигідроМаса (м/е) 416 (М+1) 1Н-ізохінолін-2-іл)-3-оксопропіл-1S-карбамінової Приклад 17: Синтез 1-[2S-аміно-4-(3,4-дигідрокислоти трет-бутилового ефіру 1Н-ізохінолін-2-іл)-4-оксобутил]-піперидин-2-ону 100мг 3S-трет-бутоксикарбоксиламіно-4-(третбутилдиметилсиланілокси)-бутанової кислоти, отриманої в приготуванні 22(1) і 110 1 3,4-дигідро1Н-ізохіноліну взаємодіють відповідно до методики, аналогічної методиці одержання сполуки, описаної в приготуванні 22-(2), що дає 34мг названої сполуки з виходом 87%. 1 Н ЯМР (CDCl3) d 7,1-7,3 (4Η, м), 5,5-5,6 (1Н, м), 4,7-4,8 (2Н, м), 4,0-4,1 (1Н, м), 3,6-3,9 (4Н, м), 9мг [3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3-оксо-1(2-оксопіперидин-1-ілметил)-пропіл]-1S1 59 89396 60 карбамінової кислоти трет-бутилового ефіру, ремішування при тій самій температурі протягом отриманого в приготуванні 39 і суміш етилаце20 хвилин, розчин, в якому 2,0мл триетиламіну тат/соляна кислота взаємодіють відповідно до ме(11,7ммоль) розчиняють в 5мл дихлорметану, по тодики, аналогічної методиці одержання сполуки, краплях додають до реакційного розчину протягом викладеної в прикладі 3, що дає 4,4мг названої 5 хвилин. Після цього температуру поступово підсполуки з виходом 64%. вищують до -70°С, і реакційний розчин розбавля1 ють діетиловим ефіром і потім промивають один Н ЯМР (CD3OD) d 7,1-7,2 (4Н, м), 4,67 (2Н, д, раз водним розчином 0,5н KHSO4, водою та водJ=13Гц), 3,6-3,8 (4Н, м), 3,3-3,5 (3H, м), 2,8-3,0 (3H, ним розчином NaCl, відповідно. Органічний шар м), 2,6-2,7 (1Н, м), 2,3-2,4 (2Н, м), 1,7-1,9 (4Н, м) сушать над безводним сульфатом магнію, і відфіМаса (м/е) 316 (М+1) льтровують, потім концентрують, що дає названу Приготування 40: Синтез [3-(3,4-дигідро-1Нсполуку. Сполуку використовують на наступній ізохінолін-2-іл)-1-(4-метил-2-оксопіролідин-1стадії без додаткового очищення. ілметил)-3-оксопропіл]-1S-карбамінової кислоти 1 Н ЯМР (CDCl3) d 9,65 (1Н, с), 5,65 (1Н, ушир. трет-бутилового ефіру с), 4,54 (1Н, ушир. с), 2,92-2,72 (2Н, м), 1,52-1,44 59мг (0,18ммоль) [3-(3,4-дигідро-1Н-ізохінолін(18Н, м) 2-іл)-1-форміл-3-оксопропіл]-1S-карбамінової кисМаса (м/е) 274 (М+1) лоти трет-бутилового ефіру, отриманого в пригоПриготування 42: Синтез 3S-треттуванні 38, 30мг (0,18ммоль) 4-аміно-3-метил бубутоксикарбоніламіно-4-(2-оксопіперидин-1-іл)танової кислоти метилового ефіру та 77мг бутанової кислоти трет-бутилового ефіру (0,36ммоль) триацетоксиборгідриду натрію взаєРозчин, отриманий при розчиненні 576мг модіють відповідно до методики, аналогічної ме(3,44мг) гідрохлориду 5-амінопентанової кислоти тодиці одержання сполуки, описаної в приготуванметилового ефіру в 5мл 1,2-дихлоретану, додають ні 24, що дає 20мг названої сполуки з виходом при кімнатній температурі до розчину, отриманого 27%. при розчиненні 1,80г 3S-третМаса (м/е) 416 (М+1) бутоксикарбоніламіно-4-оксобутанової кислоти Приклад 18: Синтез 1-[2S-аміно-4-(3,4-дигідротрет-бутилового ефіру (вказаний продукт отрима1Н-ізохінолін-2-іл)-4-оксобутил]-4-метилпіролідинний у приготуванні 41) в 50мл 1,2-дихлоретану. 2-ону Після перемішування при кімнатній температурі протягом 15 хвилин до раніше утвореного розчину додають 1,46г (6,88ммоль) триацетоксиборгідриду натрію. Після перемішування при кімнатній температурі протягом 5 годин, отриманий розчин розбавляють хлористим метиленом і потім послідовно промивають 1н водним розчином соляної кислоти та розсолом. Отриманий у такий спосіб органічний шар сушать над безводним сульфатом магнію, і 20мг [3-(3,4-дигідро-1Н-ізохінолін-2-іл)-1-(4розчинник відганяють при зниженому тиску, потім метил-2-оксопіролідин-1-ілметил)-3-оксопропіл]залишок, що одержують після концентрації при 1S-карбамінової кислоти трет-бутилового ефіру, зниженому тиску, очищують хроматографією на отриманого в приготуванні 40 і суміш етилацеколонці, що дає 568мг названої сполуки із загальтат/соляна кислота взаємодіють відповідно до меним виходом 46%. 1 тодики, аналогічної методиці одержання сполуки, Н ЯМР (CDCl3) d 5,34-5,29 (1Н, м), 4,17 (1Н, викладеної в прикладі 3, що дає 11мг названої ушир. с), 3,92-3,84 (1Н, м), 3,51-3,46 (1Н, м), 3,27сполуки з виходом 72%. 3,23 (1H, м), 3,10-3,05 (1Н, м), 2,56-2,51 (1H, м), 1 Н ЯМР (CD3OD) d 7,1-7,2 (4Н, м), 4,67 (2Н, д, 2,41-2,31 (3H, м), 1,82-1,75 (4Н, м), 1,45 (9Н, с) J=13Гц), 3,6-3,8 (4Н, м), 3,5 (1Н, д, J=6Гц), 3,3-3,4 Маса (м/е) 357 (М+1) (1Н, м), 3,0-3,2 (1Н, м), 2,8-3,0 (3H, м), 2,6-2,8 (1Н, Приготування 43: Синтез 3S-третм), 2,4-2,6 (2Н, м), 2,0-2,1 (1Н, м), 1,1 (3H, м) бутоксикарбоніламіно-4-(2-оксопіперидин-1-іл)Маса(м/е)316(М+1) бутанової кислоти Приготування 41: Синтез 3S-трет(1) Синтез 3S-аміно-4-(2-оксопіперидин-1-іл)бутоксикарбоніламіно-4-оксобутанової кислоти бутанової кислоти трет-бутилового ефіру 214мг (0,60ммоль) трет-бутоксикарбоніламіно0,69мл (9,72ммоль) диметилсульфоксиду, 4-(2-оксопіперидин-1-іл)-бутанової кислоти третрозчиняють в 20мл хлористого метилену, і охолобутилового ефіру, отриманого в приготуванні 42, джують до температури -78°С сумішшю сухого розчиняють в 2мл розчини хлормельоду в ацетоні, потім в отриманий розчин повільтан/трифтороцтова кислота (1/1), а потім переміно додають 0,42мл (4,81ммоль) оксалілхлориду. шують при кімнатній температурі протягом 18 гоЧерез 20 хвилин, до раніше утвореного розчину дин. Надлишок трифтороцтової кислоти та повільно додають при тій самій температурі протядихлорметану видаляють при зниженому тиску, гом 5 хвилин розчин, в якому 666мг (2,42ммоль) щоб одержати 280мг названої сполуки. Сполуку 3S-трет-бутоксикарбоніламіно-4-гідроксивикористовують на наступній стадії без додатковобутанової кислоти трет-бутилового ефіру синтезого очищення. 1 ваний з Boc-L-Asp(O-tBu)-OH за допомогою метоН ЯМР (CD3OD) d 4,00-3,77 (2Н, м), 3,48-3,38 дики з посилання J. Med. Chem. 1999, 42, 3557(3H, м), 2,80-2,70 (2Н, с), 2,43-2,40 (2Н, м), 1,893571, розчиняють в 9мл дихлорметану. Після пе1,82 (4Н, м)
ДивитисяДодаткова інформація
Назва патенту англійськоюDipeptidyl peptidase-iv inhibiting compounds, methods of preparing the same, and pharmaceutical compositions containing the same as an active agent
Автори англійськоюLee Chang-Seok, Koh Jong Sung, Koo Ki Dong, Kim Geun Tae, Kim Kyoung-Hee, Hong Sang Yong, Kim Sungsub, Kim Min-Jung, Yim Hyeon Joo, Lim Dongchul, Kim Hye Jin, Han Hee Oon, Bu Seong Cheol, Kwon Oh Hwan, Kim Sung Ho, Hur Gwong-Cheung, Kim Ji Young, Yeom Zi-Ho, Yeo Dong-Jun
Назва патенту російськоюСоединения-ингибиторы дипептидилпептидазы-iv, фармацевтическая композиция, которая содержит указанные соединения как активный ингридиент
Автори російськоюЛи Чанг-Сеок, Кох Дзонг Сунг, Коо Ки Донг, Ким Геун Тае, Ким Киоунг-Хее, Хонг Санг Йонг, Ким Сунгсуб, Ким Мин-Дзунг, Йим Хиеон Дзоо, Лим Донгчул, Ким Хие Дзин, Хан Хее Оон, Бу Сеонг Чеол, Квон Ох Хван, Ким Сунг Хо, Хур Гвонг-Чеунг, Ким Дзи Янг, Йеом Зи-Хо, Йео Донг-Дзун
МПК / Мітки
МПК: C07D 471/04
Мітки: дипептидилпептидази-iv, активний, інгредієнт, вказані, яка, композиція, фармацевтична, сполуки-інгібітори, сполуки, містить
Код посилання
<a href="https://ua.patents.su/82-89396-spoluki-ingibitori-dipeptidilpeptidazi-iv-farmacevtichna-kompoziciya-yaka-mistit-vkazani-spoluki-yak-aktivnijj-ingrediehnt.html" target="_blank" rel="follow" title="База патентів України">Сполуки-інгібітори дипептидилпептидази-іv, фармацевтична композиція, яка містить вказані сполуки як активний інгредієнт</a>
Попередній патент: Спосіб та пристрій для будівництва автоматично конгломерованих структур
Наступний патент: Засіб для профілактики або лікування депресивних або тривожних розладів
Випадковий патент: Спосіб визначення внутрішніх дефектів у стінах приміщень