Похідні 5-гідроксі-4-амінометил-1-циклогексил(або циклогептил)-3-алкоксикарбоніліндолів, їх фармацевтично прийнятні солі, що мають противірусну активність
Номер патенту: 74114
Опубліковано: 25.10.2012
Автори: Цишкова Ніна Гавріловна, Трофімов Фьодор Алєксандровіч, Циб Анатолій Фьодоровіч, Подгородніченко Владімір Константіновіч, Верховскій Юрій Григор'євіч, Гончарова Анна Яковлєвна, Розієв Рахімджан Ахметджановіч
Формула / Реферат
1. Похідні 5-гідрокси-4-амінометил-1-циклогексил (або циклогептил)-3-алкоксикарбоніліндолів загальної формули (І)
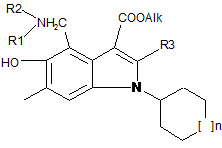 , (I)
, (I)
де n=1 або 2,
R3-C1-С3 алкіл,
Alk означає С1-С6алкільну групу,
R1, R2 незалежно вибираються зі С1-С4 алкілу, переважно метилу, або група NR1R2 означає групи, що відповідають формулам
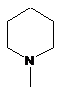 ,
, ,
, ,
, ,
,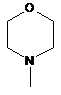 ,
,
і їх фармацевтично прийнятні солі.
2. Сполука за п. 1, що являє собою 5-гідрокси-4-диметиламінометил-2-метил-і-циклогексил-3-етоксикарбоніліндол.
Текст
Реферат: Корисна модель належить до нових похідних 5-гідроксі-4-амінометил-1-циклогексил-3алкоксикарбоніліндолів загальної формули (І) і їх фармацевтично прийнятним солям, що мають противірусну активність. Сполуки можуть бути використані для лікування й/або профілактики вірусних захворювань таких, як грип А, а також пташиний грип. Корисна модель пояснює шляхи одержання сполук. У загальній формулі (І) n=1 або 2, R 3 є С1-С3алкіл, Alk є С1-С6алкіл група, R1 і R2 незалежно вибрані із С1-С4алкілу, переважно метилу, або група NR1R2, що означає групи формули (II). UA 74114 U (12) UA 74114 U UA 74114 U 5 10 15 20 25 30 35 40 Корисна модель належить до нової групи похідних 5-гідроксі-4-амінометил-1циклогексил(або циклогептил)-3-алкоксикарбоніліндолів, а також їх фармацевтично прийнятним солям, що мають противірусну активність. Зазначені сполуки можуть знайти застосування для одержання лікарських засобів для профілактики й лікування вірусних захворювань. Відомі противірусні сполуки й лікарські препарати на їхній основі, як правило, мають противірусну активність тільки відносно певних вірусів. Тому пошук і створення нових сполук що мають противірусну активність, і створення препаратів на їхній основі є життєво необхідним. Механізм дії сучасних противірусних засобів полягає в блокуванні одного з етапів відтворення вірусів у клітинах вірусоносія (людини), які включають етап прикріплення вірусу до клітини й проникнення усередину її, вбудовування нуклеїнової кислоти вірусу в геном клітинихазяїна, синтез власної ДНК і РНК, синтез і збірку власних білків вірусу. Більша частина наявних противірусних засобів являє собою аналоги нуклеозидів. Вони ефективні, однак після їхнього застосування в ряду хворих можливий феномен рикошету, що призводить до загострення хвороби. Крім того, для ряду сполук із противірусною активністю характерний розвиток стійкості вірусів до них. У цей час для лікування грипу широко використовуються в медичній практиці препарати, що мають як компоненту сполуки групи амантадину (амантадин і ремантадин) (RU 2214997). Однак такі препарати проявляють побічну дію на ЦНС. Важливим напрямком у пошуку нових противірусних засобів є пошук біологічно активних сполук, на основі яких можуть бути створені лікарські засоби, які мали би новий механізм дії. Це можуть бути засоби, здатні модулювати (стимулювати або придушувати) імунні реакції організму. Таким засобом є арбідол (RU 2033156 і RU 2033157) - який являє собою 1-метил-2-фенілтіометил-3-карбетокси-4-диметиламінометил5-окси-6-броміндол. Арбідол здатний стимулювати різноманітні функції системи імунітету і, як показано, здійснює профілактичну и лікувальну дію при вірусних інфекціях. При цьому арбідол практично не токсичний й добре переноситься здоровими і хворими на грип людьми. Однак арбідол недостатньо ефективний до деяких штамів вірусів, наприклад до вірусу грипу А і В. Є ряд інших патентних публікацій (ЕР1731506А1, JP-63-188665 і CN 1482118) стосовно до похідних 5-гідроксііндол-3-карбоксилатів, що мають противірусну активність. Найбільш близькими до сполук технічного рішення, що пропонують, є 5-гідроксііндол-3-карбоксилати і їхнє використання для одержання лікарських засобів для лікування й попередження вірусних інфекцій, таких як гепатит В й ВІЛ-інфекція, що описані в ЕР1731506А1. Однак у жодній із зазначених публікацій не отримані й не розкриваються сполуки технічного рішення, що пропонують, а також їхнє використання для одержання лікарських засобів для лікування або попередження вірусних інфекцій, таких як грип А або В, а також пташиний грип. Задачею пропонованої корисної моделі - пошук нових похідних індолу, що мають імуностимулюючу активність одночасно з високою противірусною активністю відносно конкретних вірусів, наприклад вірусів грипу А і В, а також пташиного грипу. Згідно із пропонованою корисною моделлю, пропонуються похідні 1-циклогексил(або циклогептил)-3-алкоксикарбоніл-4-діамінометил-5-гідроксііндоли, що відповідають загальній формулі (І): R2 NH2C COOAlk R1 R3 HO (I) N [ ]n 45 , де n=1 або 2, R3-С1-С3алкіл, Alk означає С1-С6 алкільну групу, R1, R2 незалежно вибираються зі С1-С4-алкілу, переважно метилу, або R1, R2 разом з атомом азоту (тобто група NR1R2) означає групи, що відповідні формулам 1 UA 74114 U CH2C6H5 N 5 N N O N N C6H5 N CH3 N N , , , , . Корисна модель також належить до фармацевтично прийнятних солей зазначених сполук загальної формули І. Солі можуть бути отримані звичайними методами, наприклад обробкою сполуки формули (І) відповідними кислотами. До фармацевтично прийнятних солей належать насамперед. гідрохлориди, мезилати, оксалати й ін. Привабливими сполуками є 5-гідрокси-4-диметиламіно-2-метил-1-циклогексил-3етоксикарбоніліндол (з'єднання А) і його гідрохлориди. Синтез з'єднань здійснюють відповідно до схеми 1: 10 NH2 ( )n R3COCH2COOAlk O O R3C = CHCOOAlk NH (II) ( )n COOAlk R2 COOAlk NH2C R1 CH2(N(R1R2))2 R3 R3 HO HO N N [ ]n [ ]n ( IA ) ( III ) 15 У зазначеній схемі R1, R2, R3, X, Alk, n мають вищевказані значення. Відповідно до зазначеної схеми 1 спосіб здійснюють таким чином. При взаємодії алкілкарбонілоцтового ефіру формули R3COCH2COOAIk 20 переважно, ацетооцтового ефіру, із циклогексиламіном або циклогептиламіном у присутності каталітичної кількості кислоти, наприклад соляної кислоти, у середовищі розчинника, наприклад, бензолу або толуолу, одержують відповідний алкіловий ефір βциклогексил (або циклогептил) аміно-алкенілової кислоти, переважно, С1-С6 алкіловий ефір βциклогексил (або циклогептил) амінокротонової кислоти, формули (II) R3C = CHCOOAlk NH (II) ( )n 25 При взаємодії ефіру формули (II) з бензохіноном одержують 5-гідроксі-2-алкіл-1-циклогексил (або циклогептил)-3-алкоксикарбоніліндол формули (III) 2 UA 74114 U R3 HO N (III) [ ]n COOAlk Потім сполуку формули (III) піддають амінометилюванню відповідним біс-амінометаном загальної формули 5 CH2(N(R1R2))2 в умовах реакції Манніха з одержанням відповідного 5-гідроксі-4-амінометил-2-алкіл-1циклогексил (або циклогептил)-3-алкоксикарбоніліндолу формули 1А: 10 R2 NH2C R1 COOAlk R3 HO (IA) N [ ]n Значення радикалів R1, R2, R3, X, Alk, n у всіх структурних формулах такі, як зазначено вище. Для одержання сполуки формули 1А або 1У, де група NR 1R2 означає групи, що відповідають формулам, 15 CH3 20 25 30 N N O N , C6H5 N N CH2C6H5 N N N , , , переважно використовувати як амінометилюючий агент відповідний циклічний вторинний амін і формальдегід. При одержанні сполуки 1А, де кожний з R 1 і R2 означають, наприклад, метил, також можна використовувати як амінометилуючий агент формальдегід і відповідний діалкіламін. Отримані продукти виділяють у вільному вигляді або у вигляді фармацевтично прийнятних солей. Пропоновані, згідно із представленою корисною моделлю, сполуки є активними відносно різних штамів вірусу грипу. При цьому є розходження в ефективності пропонованих сполук із аналогом - Арбідолом стосовно різних штамів. Пропоновані сполуки також ефективні й проти інших вірусів і при цьому не є аналогами нуклеозидів. Це дозволяє припускати, що сполука даної корисної моделі поповнять список сполук із "м'яким", що не зачіпає обмінні процеси в клітинах, механізмом дії. Крім того, спосіб одержання сполук простіше й припускає меншу кількість стадій, чим при одержанні відомих аналогів. Тому спосіб одержання пропонованих сполук є більш економічно вигідним. При цьому спосіб одержання пропонованих сполук не вимагає використання неприємних і отрутних вихідних сполук, таких як тіофенол. Нижче наведені приклади більш докладно ілюструють пропоновану корисну модель. 3 UA 74114 U Одержання 5-гідрокси-4-диметиламінометил-2-метил-1-циклогексил-3-етоксикарбоніліндол (А) здійснюють таким чином. Схема синтезу 2. H2N O [ ]n CH3COCH2COOC2H5 O CH3C=CHCOOC2H5 NH II n = 1 III n = 2 (II) [n ] COOC2H5 COOC2H5 CH2(N(R1R2))2 HO (CH3)2NH2C CH3 HO CH3 N N [n ] [n ] ( A) ( III ) IV, V 5 10 15 20 25 30 35 n=1 IV n = 1 V n=2 Приклад 1. Етиловий ефір δ-циклогексил амінокротонової кислоти(ll). До 13 г (0,1 моль) ацетооцтового ефіру в 20 мл толуолу додають 11,9 г (0,12 моль) циклогексиламіну й 1 краплю концентрованої НСl. Залишають при кімнатній температурі на добу. Потім відганяють воду, що виділилася, з насадкою Діна-Старка. Толуол упарюють у 21 вакуумі, залишок переганяють. Т.кип. 130-134 °C/1 мм. Пд 1,514. Вихід (II) 18,5 г (87 %). Приклад 2. Аналогічно із 9,75 г. (0,075 моль) ацетооцтового ефіру 10,2 г. (0,09 моль) циклогептиламіну в 20 мл толуолу, одержують етиловий ефір δ-циклогептил амінокротонової кислоти (III), яку використовують у наступній стадії без перегону Приклад 3. 5-Гідрокси-2-метил-1-циклогексил-3-етоксикарбонілідол (IV). До розчину 2,1 г (0,01 моль) (II) в 10 мл льодяної оцтової кислоти при перемішуванні додають 1,08 г (0,01 моль) 1,4-бензохінону. Реакційну суміш залишають при кімнатній температурі на добу. Осад, що утворився, відфільтровують, промивають у холодній оцтовій кислоті і висушують. Вихід (III) 0,6 г (20 %), т.пл. 237 °C (із оцтової кислоти). Знайдено, % С 71,14; Н 7,87; N 4.78. С18Н23NO3. Обчислене, С 71,74; Н 7,69; N 4,65. Приклад 4. 5-гидроокси-2-метил-1-циклогептил-3-етоксикарбоніліндол т.пл. 155-157 °C (із етилацетату з гексаном). Знайдено, %: С 72,51; Н 8,95; N 4,53. С19Н25NO3 Обчислене, %: С 72,35; Н 7,99; N 4,44 Rf=0,53 Приклад 5. 5-гідрокси-4-диметиламінометил-2-метил-1-циклогексил-3-етоксикарбоніліндол (А). Суміш 1,2 г (0,004 моль) (III), 0,9 мл біс(диметиламіно) метану в 10 мл діоксану кип'ятять 4 години. Після відгонки діоксану у вакуумідоливають 5 мл спирту, охолоджують, омад відфільтровують. Вихід 1,0 г (69,7 %), т.пл. 141-142 °C (із спирту). Знайдено, %: С 70,25; Н 8,32; N 7,72. С21Н30N2O3 Обчислене, %: С 70,35; Н 8,44; N 7,82. Гідрохлорид одержують додаванням НСl в ефірі до розчину основи в ацетоні, т. пл. 194195 °C°(із спирту з ефіром) Знайдено, %: С 63,93; Н 7,70; N 6,99. С21,Н31, С1N2O3. Обчислене, С 63,87; Н 7,91; N 7,09. В аналогічних умовах з використанням відповідних вихідних сполук одержують: 5-гідрокси-4-диметиламінометил-2-метил-1-циклогептил-3-етоксикарбоніліндол, т.пл. 125 °C; Rf=0,48 5-гідрокси-4-діетиламінометил-2-метил-1-циклогексил-3-етоксикарбоніліндол, т.пл. 130 °C; Rf=0,51 4 UA 74114 U 5 10 15 20 25 30 35 40 45 Використовуючи відповідне вихідну сполуку (III), формальдегід і вторинний циклічний амін в умовах реакції Манніха одержують наступні сполуки 5-гідрокси-4-піперидинометил-2-метил-1-циклогексил-3-етоксикарбоніліндол і його гідрохлорид, т.пл. 223 °C; Rf=0,45 5-гідрокси-4-морфолінометил-2-метил-1-циклогексил-3-етоксикарбоніліндол і його гідрохлорид, т.пл. 183-184 °C; Rf=0,4 5-гідрокси-4-(N-метилпіперазіно)метил-2-етил-1-циклогексил-3-етоксикарбоніліндол, його гідрохлорид і мезилат, т.пл. 131-132 °C; Rf=0,6 5-гідрокси-4-(N-бензилпіперазіно)метил-2-метил-1-циклогексил-3-етоксикарбоніліндол і його гідрохлорид, т.пл. 201-202 °C; Rf=0,53 5-гідрокси-4-(N-фенілпіперазіно)метил-2-метил-1-циклогексил-3-етоксикарбоніліндол, гідрохлорид, т.пл. 195-196 °C; Rf=0,57 Солі сполук були отримані при обробці основ відповідними кислотами. Будова одержаних сполук підтверджена даними елементного аналізу, спектрами ПМР, а індивідуальність - тонкошаровою хроматографією в системі бензол-спирт-триетиламін (10:2-01) на пластинках Silufol UV 254. Була вивчена in vitro антивірусна активність цих сполук відносно вірусів грипу А. Противірусна активність. Вивчення дії з'єднання А на вірус грипу А методом імуноферментного аналізу (ІФА) проводилися за наступною схемою: на моношар клітин МДСК в 96 лунковій панелі вносили досліджувану сполуку (попередньо розчинене в етиловому спирті, потім у живильному MEM середовищі). До вірусного контролю додавали по 100 мкл цього ж середовища, а до клітинного контролю - по 200 мкл. Панелі інкубували при 37 °C у атмосфері 5 % СО2 протягом двох годин. При визначенні дії противірусних препаратів на експресію вірусних антигенів до клітин після їхньої інкубації із сполукою А додавали десятикратні розведення вірусу з урахуванням розведення препаратом (1:5, 1:50, 1:500 і т.д.) в обсязі 100 мкл. середовища MEM. Панелі інкубували в термостаті в атмосфері 5 % СО2 протягом 24 годин при 37 °C. Середовище видаляли й клітини фіксували 80 % ацетоном на фосфатно-сольовому буфері PBS протягом 15-20 хвилин в об'ємі 100 мкл, потім добре висушували й відмивали розчином PBS. Потім до клітин додавали по 100 мкл ІФА-буфера (фосфатно-сольовий буфер з 1 % фетальною сироваткою й 0,05 % TWEEN 20) і інкубували при 37 °C протягом 30 хв. Після видалення розчину до клітин додавали по 100 мкл моноклональних антитіл (МКА) до внутрішніх білків М и NP вірусу грипу А в розведенні 1:1000 на ІФА-буфері. Після інкубації з антитілами протягом 1 години при 37 °C й наступного 2-кратного відмивання в лунки вносили по 100 мкл IgG кролика проти IgG миші, мічених пероксидази хрону, у розведенні 1:5000 на ІФА-буфері й інкубували 1 годину при 37 °C. Після 3-кратного відмивання леговану пероксидазу виявляли додаванням у лунки 100 мкл 0,05 % розчину ортофенілендіаміну (ОФД) в 0,003 % цитратному буфері рН=5,0, що містить 0,003 % Н2О2 (субстрактний буфер). Панелі витримували 15-30 хвилин у темряві до появи жовтого фарбування, реакцію зупиняли додаванням у кожну лунку 50 мкл 1Н H2SO4. Далі вимірювали оптичну щільність (ОЩ) на автоматичному спектрофотометрі при довжині хвилі 492 нм. Як контроль використовували лунки, незаражені вірусом. Процент інгібування вірусної репродукції сполукою А визначали по формулі: відсоток інгібування = 100-(ОЩ досліду-ОЩ клітинного контролю/ОЩ вірусного контролю у відсутності сполуки - ОЩ клітинного контролю) х 100. Для однієї точки досліду використовували три лунки панелі. Концентрацію препарату або сполуки, що зменшує значення величини ОЩ на 50 %, приймали за мінімальну інгібуючу концентрацію (МIK50). Таблиця 1 Мінімальна інгібуюча концентрація (МІК50) і активність сполуки А стосовно еталонного вірусу А/Нова Каледонія/20/99 (H1N1) у дослідах in vitro Сполука Арбідол Сполука А 50 Розчинник Спирт Спирт MIK50 мкг/мл 6,0 5,4 Активність при 10 мкг/мл, % 89,5 96,5 Визначення ефективності сполуки А на моделі грипозної пневмонії мишей. Досліди виконані на 60 білих мишах масою 12-15 г. Тварин інфікували інтраназально під легким ефірним наркозом вірусом грипу А/Аічі/2/69 (H 3N2) (10 ЛД50). Випробувані сполуки вводили per os у дозі 60 або 15 мг/кг/день. Лікування проводили за наступною схемою: за 24 5 UA 74114 U 5 години й за 1 годину до інфікування, далі 2 рази в день (в 8 годин ранку й в 8 годин вечора) протягом 5 днів. Хіміотерапевтичну активність Арбідолу й сполуки А на моделі грипозної пневмонії мишей оцінювали по двох критеріях: показник захисту від смертельної вірусної інфекції й збільшення середньої тривалості життя тварин, що ліковані, у порівнянні з контрольною групою. Середня тривалість життя мишей вираховувалася по формулі: Σf(d-1)/n, де f - кількість мишей, що вмерли на день d (миші, що вижили, включені в f, d у цьому випадку = 16), n - кількість мишей у групі. Таблиця 2 Ефективність сполуки А в порівнянні з Арбідолом на моделі грипозної інфекції в мишей (вірусу/Аічі/2/69). Виживаність Смертність, % Зниження смертності, % Середня тривалість життя, дні 6/10 40 50 10,8 3/10 70 20 7,3 5/8 40 50 11,5 1/10 Сполука 90 Арбідол, 60 мг/кг/день Арбідол, 15 мг/кг/день Сполука А, 15 мг/кг/день Вірусний контроль (10LD50) 10 15 7,2 Таким чином, отримані результати свідчать про вірусоспецифічні активності заявлених сполук. Сполука А в дослідах in vitro виявилася трохи активніше Арбідолу (таблиця 1). У дослідах на тваринах сполука А була значніше активніше Арбідолу. Так ефективність сполуки А в дозі 15 мг/кг/день при лікуванні грипозної пневмонії мишей дорівнювала ефективності Арбідолу в дозі в 4 рази більшої (60 мг/кг/день). У дозі 15 мг/кг/день Арбідол був практично не активний (таблиця 2). ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 1. Похідні 5-гідроксі-4-амінометил-1-циклогексил(або циклогептил)-3-алкоксикарбоніліндолів загальної формули (І) R2 NH2C COOAlk R1 R3 HO N [ ]n , (I) 25 де n=1 або 2, R3-C1-С3алкіл, Alk означає С1-С6алкільну групу, R1, R2 незалежно вибираються зі С1-С4алкілу, переважно метилу, або група NR1R2 означає групи, що відповідають формулам 6 UA 74114 U CH3 C6H5 N N CH2C6H5 N N O N N N N , , , , , і їх фармацевтично прийнятні солі. 2. Сполука за п. 1, що являє собою 5-гідрокси-4-диметиламінометил-2-метил-і-циклогексил-3етоксикарбоніліндол. 5 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійською5-hydroxy-4-aminomethyl-l-cyclohexane or (cycloheptyl)-3-alkoxycarbonyl indole derivatives, pharmaceutically acceptable salts thereof exhibiting antiviral activity
Автори англійськоюVerkhovskii Yurii Hryhorovych, Tsysckova Nina Havrylivna, Roziev Rakhimdzan Akhmetdzhanovich, Tsyb Anatolii Fiodorovych, Honcharova Anna Yakovlevna, Trofimov Fodor Aleksandrovych, Podhorodnichenko Vladimir Konstantinovcich
Назва патенту російськоюПроизводные 5-гидрокси-4-аминометил-1-циклогексил (или циклогептил)-3-алкоксикарбонилиндолов, их фармацевтически приемлемые соли, которые имеют противовирусную активность
Автори російськоюВерховский Юрий Григорьевич, Цышкова Нина Гавриловна, Розиев Рахимджан Ахметджанович, Цыб Анатолий Фёдорович, Гончарова Анна Яковлевна, Трофимов Фёдор Александрович, Подгородниченко Владмимир Константинович
МПК / Мітки
МПК: C07D 401/10, A61K 31/404, C07D 209/42, C07D 403/10, C07D 413/10
Мітки: активність, мають, солі, фармацевтично, похідні, противірусну, прийнятні, 5-гідроксі-4-амінометил-1-циклогексил(або, циклогептил)-3-алкоксикарбоніліндолів
Код посилання
<a href="https://ua.patents.su/9-74114-pokhidni-5-gidroksi-4-aminometil-1-ciklogeksilabo-ciklogeptil-3-alkoksikarbonilindoliv-kh-farmacevtichno-prijjnyatni-soli-shho-mayut-protivirusnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Похідні 5-гідроксі-4-амінометил-1-циклогексил(або циклогептил)-3-алкоксикарбоніліндолів, їх фармацевтично прийнятні солі, що мають противірусну активність</a>
Попередній патент: Газорозрядна електронна гармата
Наступний патент: Пласкоспіральний комплексований вибухомагнітний генератор
Випадковий патент: Інгібітори фарнезил білок трансферази як засіб для лікування артропатії












