Антиретровірусна фармацевтична композиція керованого вивільнення та спосіб її виготовлення
Номер патенту: 82564
Опубліковано: 25.04.2008
Автори: Джаянтхі Сурйакумар, Арра Ганга Срінівас, Сен Хімадрі, Рагхаван Вінеетх
Формула / Реферат
1. Антиретровірусна фармацевтична композиція, що включає селективну комбінацію
і. складу керованого вивільнення, який включає:
а. ламівудин або його фармацевтично прийнятну похідну,
b. зідовудин або його фармацевтично прийнятну похідну,
с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та
d. фармацевтично прийнятну сіль кальцію;
іі. складу негайного вивільнення, який включає щонайменше один селективний лікарський препарат Ненуклеозидних Інгібіторів Зворотної Транскриптази (NNRTI) або його фармацевтично прийнятну похідну разом з фармацевтично прийнятними наповнювачами.
2. Антиретровірусна фармацевтична композиція за п. 1, де згаданий лікарський препарат NNRTI вибраний з невірапіну та ефавіренсу.
3. Антиретровірусна фармацевтична композиція за п. 1, що знаходиться у формі двох окремих шарів згаданих складу керованого вивільнення та складу негайного вивільнення.
4. Антиретровірусна фармацевтична композиція за п. 1, що знаходиться у такій формі, що ядро являє собою згаданий склад керованого вивільнення, а зовнішнє покриття являє собою склад негайного вивільнення.
5. Антиретровірусна фармацевтична композиція за п. 1, що включає двошарову селективну комбінацію
і. першого шару складу керованого вивільнення, який включає:
а. ламівудин або його фармацевтично прийнятну похідну,
b. зідовудин або його фармацевтично прийнятну похідну,
с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та
d. фармацевтично прийнятну сіль кальцію;
іі. другого шару складу негайного вивільнення, де згаданий NNRTI є невірапіном або його фармацевтично прийнятною похідною разом з фармацевтично прийнятними наповнювачами.
6. Антиретровірусна фармацевтична композиція за п. 1, що включає селективну комбінацію
і. ядра, що містить склад керованого вивільнення, який включає:
а. ламівудин або його фармацевтично прийнятну похідну,
b. зідовудин або його фармацевтично прийнятну похідну,
с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та
d. фармацевтично прийнятну сіль кальцію;
іі. зовнішнього покриття складу негайного вивільнення, де згаданий NNRTI є невірапіном або його фармацевтично прийнятною похідною разом з фармацевтично прийнятними наповнювачами.
7. Антиретровірусна фармацевтична композиція за п. 1, що включає селективну двошарову комбінацію
і. першого шару складу керованого вивільнення, який включає:
а. ламівудин або його фармацевтично прийнятну похідну,
b. зідовудин або його фармацевтично прийнятну похідну,
с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та
d. фармацевтично прийнятну сіль кальцію;
ii. другого шару складу негайного вивільнення, де згаданий NNRTI є ефавіренсом або його фармацевтично прийнятною похідною разом з фармацевтично прийнятними наповнювачами.
8. Антиретровірусна фармацевтична композиція за п. 1, що включає селективну комбінацію
і. ядра зі складу керованого вивільнення, який включає:
а. ламівудин або його фармацевтично прийнятну похідну,
b. зідовудин або його фармацевтично прийнятну похідну,
с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та
d. фармацевтично прийнятну сіль кальцію;
іі. зовнішнього покриття складу негайного вивільнення, де згаданий NNRTI є ефавіренсом або його фармацевтично прийнятною похідною разом з фармацевтично прийнятними наповнювачами.
9. Композиція за одним з пп. 1-8, де кількість ламівудину або його фармацевтично прийнятної похідної складає від приблизно 50 мг до приблизно 500 мг.
10. Композиція за п. 9, де кількість ламівудину або його фармацевтично прийнятної похідної складає приблизно 300 мг.
11. Композиція за одним з пп. 1-8, де кількість зідовудину або його фармацевтично прийнятної похідної складає від приблизно 100 мг до приблизно 1000 мг.
12. Композиція за п. 11, де кількість зідовудину або його фармацевтично прийнятної похідної складає 600 мг.
13. Композиція за одним з пп. 1-12, де кількість невірапіну/ефавіренсу або його фармацевтично прийнятної похідної складає від приблизно 100 мг до приблизно 1000 мг.
14. Композиція за п. 13, де кількість невірапіну або його фармацевтично прийнятної похідної складає приблизно 400 мг.
15. Композиція за п. 13, де кількість ефавіренсу або його фармацевтично прийнятної похідної складає приблизно 600 мг.
16. Композиція за одним з пп. 1-15, де ефір целюлози вибраний з гідроксипропілцелюлози, гідроксипропілметилцелюлози, карбоксиметилцелюлози, натрію карбоксиметилцелюлози, етилцелюлози, метилцелюлози, гідроксиетилцелюлози і т. п.
17. Композиція за п. 16, де ефір целюлози є гідроксипропілметилцелюлозою та присутній у кількості від приблизно 2 % до приблизно 12 % ваги складу керованого вивільнення.
18. Композиція за п. 17, де ефір целюлози є гідроксипропілметилцелюлозою та присутній у кількості від приблизно 3 % до приблизно 8 % ваги складу керованого вивільнення.
19. Композиція за одним з пп. 1-18, де поліуронова кислота вибрана з альгінової кислоти, альгінату натрію, альгінату кальцію, альгінату натрію-кальцію, альгінату калію, альгінату амонію, альгінату магнію і т. п.
20. Композиція за п. 19, де поліуронова кислота є альгінатом натрію та присутня у кількості від приблизно 0,5 % до приблизно 10 % ваги складу керованого вивільнення.
21. Композиція за п. 20, де поліуронова кислота є альгінатом натрію та присутня у кількості від приблизно 1 % до приблизно 6 % ваги складу керованого вивільнення.
22. Композиція за одним з пп. 1-21, де фармацевтично прийнятна смола вибрана з гуарової смоли, ксантанової смоли, смоли карайя, трагакантової смоли, акацієвої смоли і т. п.
23. Композиція за п. 22, де фармацевтично прийнятна смола є гуаровою смолою та присутня у кількості від приблизно 0,1 % до приблизно 10 % ваги складу керованого вивільнення.
24. Композиція за п. 23, де фармацевтично прийнятна смола є гуаровою смолою та присутня у кількості від приблизно 0,5 % до приблизно 6 % ваги складу керованого вивільнення.
25. Композиція за одним з пп. 1-24, де фармацевтично прийнятна сіль кальцію вибрана з групи, що включає сульфат кальцію, фосфат кальцію, карбонат кальцію та хлорид кальцію.
26. Композиція за п. 25, де фармацевтично прийнятна сіль кальцію є сульфатом кальцію та присутня у кількості від приблизно 0,1 % до приблизно 2,5 % ваги складу керованого вивільнення.
27. Композиція за п. 26, де фармацевтично прийнятна сіль кальцію є сульфатом кальцію та присутня у кількості від приблизно 0,1 % до приблизно 2 % ваги складу керованого вивільнення.
28. Композиція за одним з пп. 1-27, де склад керованого вивільнення додатково містить щонайменше один розріджувач, що може диспергуватися у воді, або розчинний у воді розріджувач, вибраний з мікрокристалічної целюлози, двозаміщеного фосфату кальцію, карбонату кальцію, лактози, порошкоподібної целюлози, крохмалю, маніту і т. п.
29. Композиція за п. 28, де розріджувач присутній у кількості від приблизно 1 % до приблизно 28 % ваги складу керованого вивільнення.
30. Композиція за п. 29, де розріджувач є мікрокристалічною целюлозою.
31. Композиція за п. 30, де кількість мікрокристалічної целюлози складає від приблизно 5 % до приблизно 20 % ваги.
32. Композиція за п. 29, де розріджувач є двозаміщеним фосфатом кальцію.
33. Композиція за п. 32, де кількість двозаміщеного фосфату кальцію складає від приблизно 1 % до приблизно 5 % ваги.
34. Композиція за одним з пп. 1-33, де склад керованого вивільнення додатково містить щонайменше одну змащувальну добавку, вибрану зі стеарату магнію, стеарату кальцію, стеаринової кислоти, діоксиду кремнію, тальку і т. п.
35. Композиція за п. 34, де змащувальна добавка присутня у кількості від приблизно 0,1 % до приблизно 3 % ваги.
36. Композиція за одним з пп. 1-35, де склад негайного вивільнення включає від приблизно 10 % до приблизно 95 % ваги невірапіну або його фармацевтично прийнятної похідної разом з одним або більше фармацевтично прийнятними наповнювачами, вибраними з розріджувачів, зв'язувальних речовин, дезінтеграторів, змащувальних добавок, барвників і т. п.
37. Композиція за п. 36, де розріджувач вибраний з мікрокристалічної целюлози, двозаміщеного фосфату кальцію, карбонату кальцію, лактози, порошкоподібної целюлози, крохмалю, маніту і т. п.
38. Композиція за п. 37, де розріджувач є порошкоподібною целюлозою та присутній у кількості від приблизно 2 % до приблизно 15 % ваги складу негайного вивільнення.
39. Композиція за п. 36, де зв'язувальна речовина вибрана з натрію карбоксиметилцелюлози, повідону, прежелатинізованого крохмалю, желатину або їх сумішей.
40. Композиція за п. 39, де зв'язувальна речовина присутня у кількості від приблизно 1 % до приблизно 10 % ваги складу негайного вивільнення.
41. Композиція за п. 36, де дезінтегратор вибраний із кросповідону, натрію крохмальгліколяту, прежелатинізованого крохмалю, натрію карбоксиметилцелюлози, натрію кроскармелози, крохмалю та їх сумішей.
42. Композиція за п. 41, де дезінтегратор присутній у кількості від приблизно 0,5 % до приблизно 15 % ваги складу негайного вивільнення.
43. Композиція за п. 36, де змащувальна добавка вибрана зі стеарату магнію, стеарату кальцію, стеаринової кислоти, діоксиду кремнію, тальку і т. п.
44. Композиція за п. 43, де змащувальна добавка присутня у кількості від приблизно 0,1 % до приблизно 3 % ваги.
45. Спосіб виготовлення антиретровірусної фармацевтичної композиції, що включає наступні етапи: (і) одержують склад керованого вивільнення перемішуванням разом активних інгредієнтів, вибраних з ламівудину, зідовудину або їх сумішей, з гідрофільними полімерами, вибраними з ефірів целюлози, поліуронових кислот, фармацевтично прийнятних смол або їх сумішей, та з фармацевтично прийнятною сіллю кальцію, необов'язково, з розріджувачем та змащувальною добавкою, (іі) одержують склад негайного вивільнення щонайменше змішуванням NNRTI з фармацевтично прийнятними наповнювачами та (ііі) одержують з них композицію пресуванням утворених сумішей у двошарові таблетки.
46. Спосіб виготовлення антиретровірусної фармацевтичної композиції, що включає наступні етапи: (і) одержують ядро згаданого складу керованого вивільнення перемішуванням разом активних інгредієнтів, вибраних з ламівудину, зідовудину або їх сумішей, з гідрофільними полімерами, вибраними з ефірів целюлози, поліуронових кислот, фармацевтично прийнятних смол або їх сумішей, з фармацевтично прийнятною сіллю кальцію, необов'язково, з розріджувачем та змащувальною добавкою, (іі) одержують зовнішнє покриття складу негайного вивільнення з щонайменше NNRTI, вибраного з невірапіну та ефавіренсу, змішаного з фармацевтично прийнятними наповнювачами, та (ііі) одержують з них композицію шляхом нанесення згаданого зовнішнього покриття на згадане ядро пресуванням покриття.
47. Спосіб за п. 45 або п. 46, в якому кожну суміш гранулюють сухим способом перед пресуванням.
48. Спосіб за п. 45 або п. 46, в якому кожну суміш гранулюють вологим способом перед пресуванням.
49. Спосіб зниження лікарського навантаження на пацієнта, що страждає на інфекцією ВІЛ та/або на Синдром Набутого Імунного Дефіциту, при якому вводять антиретровірусну фармацевтичну композицію з трьох лікарських препаратів, що включає комбінацію ламівудину та зідовудину як компонент керованого вивільнення та невірапіну або ефавіренсу як компонент негайного вивільнення.
50. Спосіб зниження лікарського навантаження на пацієнта, що страждає на інфекцією ВІЛ та/або на Синдром Набутого Імунного Дефіциту, при якому вводять антиретровірусну фармацевтичну композицію з трьох лікарських препаратів, що включає ламівудин та зідовудин як компонент керованого вивільнення та невірапін або ефавіренс як компонент негайного вивільнення, причому композиція після введення згаданому пацієнту забезпечує Сmах від приблизно 1,2 до приблизно 2,0 мкг/мл для ламівудину, від приблизно 1,0 до приблизно 2,0 мкг/мл для зідовудину та від приблизно 4,5 до приблизно 5,5 мкг/мл для невірапіну.
51. Спосіб зниження лікарського навантаження на пацієнта, що страждає на інфекцією ВІЛ та/або Синдром Набутого Імунного Дефіциту, при якому вводять антиретровірусну фармацевтичну композицію з трьох лікарських препаратів, що включає ламівудин та зідовудин як компонент керованого вивільнення, та невірапін або ефавіренс як компонент негайного вивільнення, причому композиція після введення згаданому пацієнту забезпечує AUC0-t від приблизно 8 до приблизно 14 мкг·година/мл для ламівудину, від приблизно 5 до приблизно 9 мкг·година/мл для зідовудину та від приблизно 32 до приблизно 40 мкг·година/мл для невірапіну.
52. Спосіб збільшення in vivo періоду напіввиведення ламівудину та зідовудину, без впливу на період напіввиведення невірапіну, і ,таким чином, зниження лікарського навантаження на пацієнта, що страждає на інфекцією ВІЛ та/або на Синдром Набутого Імунного Дефіциту, при якому вводять антиретровірусну композицію з трьох лікарських препаратів, що включає ламівудин та зідовудин як компонент керованого вивільнення та невірапін або ефавіренс як компонент негайного вивільнення.
53. Спосіб за п. 51, де композиція після введення згаданому пацієнту забезпечує t1/2 приблизно 5 годин для ламівудину, приблизно 2 годин для зідовудину та приблизно 29 годин для невірапіну.
54. Спосіб зниження лікарського навантаження на пацієнта, що страждає на інфекцією ВІЛ та/або на Синдром Набутого Імунного Дефіциту, при якому вводять антиретровірусну фармацевтичну композицію з трьох лікарських препаратів, що включає ламівудин та зідовудин як компонент керованого вивільнення та невірапін або ефавіренс як компонент негайного вивільнення, де композиція після введення згаданому пацієнту забезпечує Сmах згаданих лікарських препаратів для компонента керованого вивільнення, що є в значній мірі подібною до тієї, що забезпечується композиціями негайного вивільнення згаданих лікарських препаратів, при введенні спільно, послідовно або одночасно.
Текст
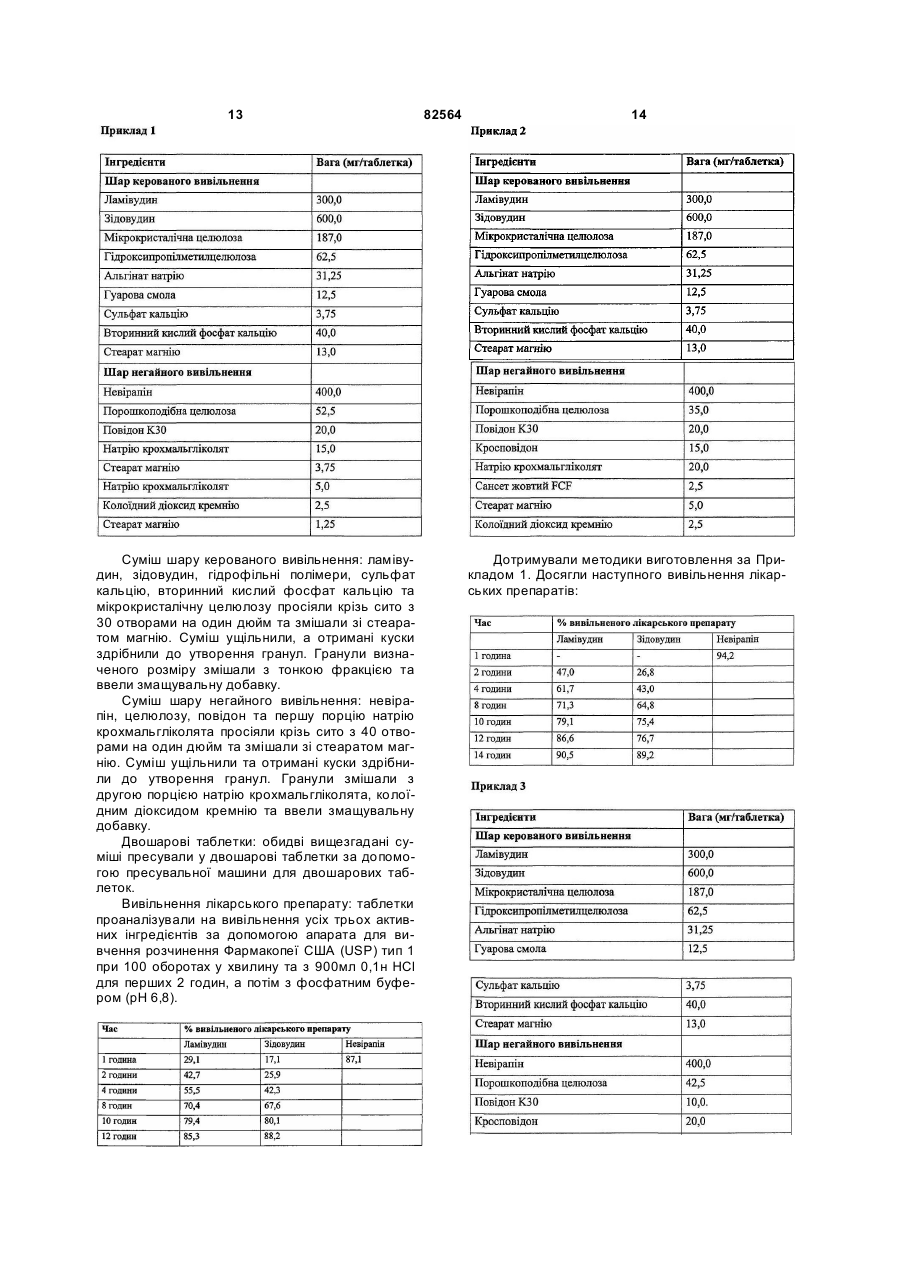
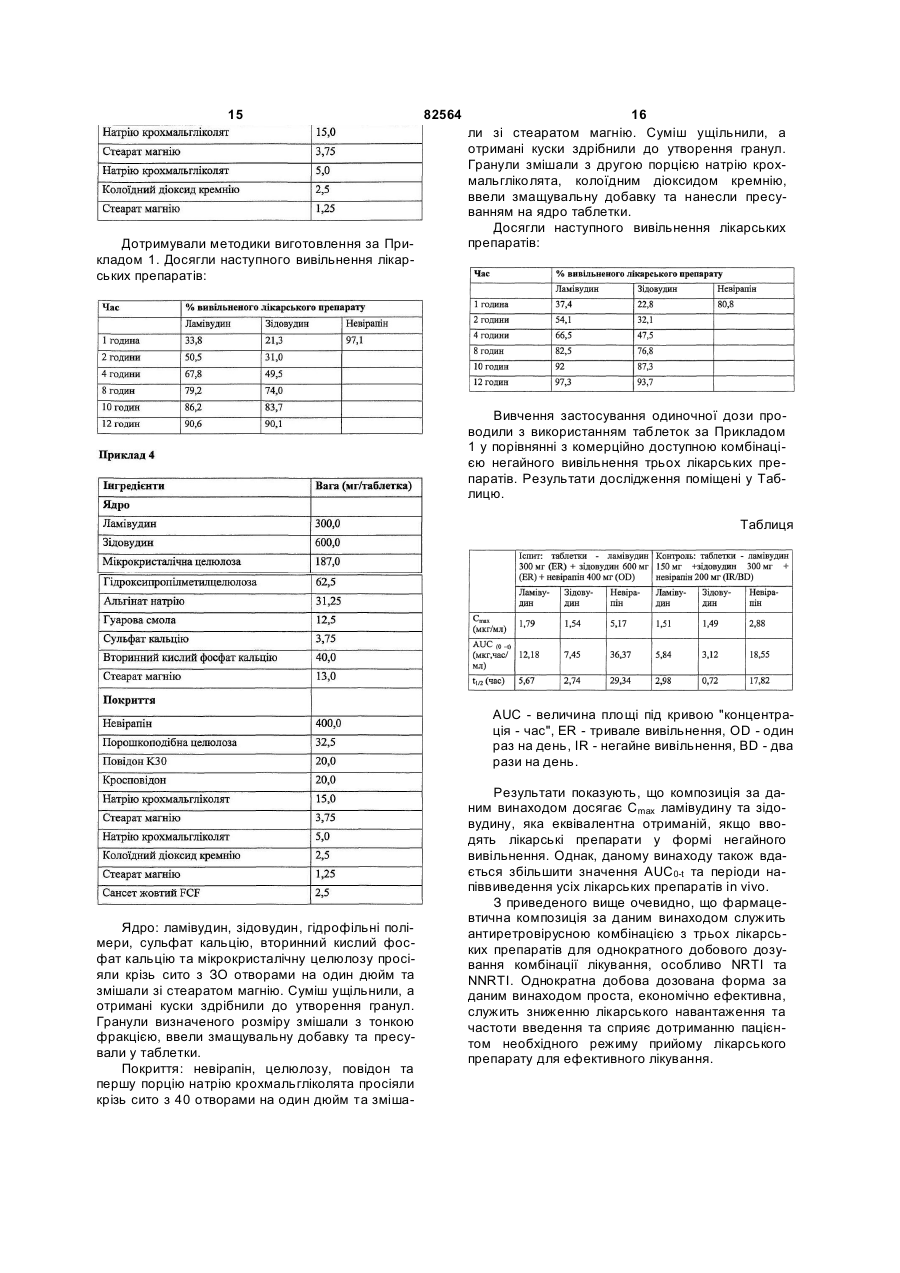
1. Антиретровірусна фармацевтична композиція, що включає селективну комбінацію і. складу керованого вивільнення, який включає: а. ламівудин або його фармацевтично прийнятну похідну, b. зідовудин або його фармацевтично прийнятну похідну, с. суміш гідрофільних полімерів, причому згадані полімери вибрані з групи, що включає ефіри целюлози, поліуронові кислоти та фармацевтично прийнятні смоли або їх суміші, та d. фармацевтично прийнятну сіль кальцію; іі. складу негайного вивільнення, який включає щонайменше один селективний лікарський препарат Ненуклеозидних Інгібіторів Зворотної Транскриптази (NNRTI) або його фармацевтично прийнятну похідну разом з фармацевтично прийнятними наповнювачами. 2. Антиретровірусна фармацевтична композиція за п. 1, де згаданий лікарський препарат NNRTI вибраний з невірапіну та ефавіренсу. 3. Антиретровірусна фармацевтична композиція за п. 1, що знаходиться у формі двох окремих шарів згаданих складу керованого вивільнення та складу негайного вивільнення. 2 (19) 1 3 82564 4 фармацевтично прийнятною похідною разом з етилцелюлози, метилцелюлози, гідроксиетилцефармацевтично прийнятними наповнювачами. люлози і т. п. 7. Антиретровірусна фармацевтична композиція за 17. Композиція за п. 16, де ефір целюлози є гідроп. 1, що включає селективну двошарову комбінаксипропілметилцелюлозою та присутній у кількості цію від приблизно 2 % до приблизно 12 % ваги складу і. першого шару складу керованого вивільнення, керованого вивільнення. який включає: 18. Композиція за п. 17, де ефір целюлози є гідроа. ламівудин або його фармацевтично прийнятну ксипропілметилцелюлозою та присутній у кількості похідну, від приблизно 3 % до приблизно 8 % ваги складу b. зідовудин або його фармацевтично прийнятну керованого вивільнення. похідну, 19. Композиція за одним з пп. 1-18, де поліуронова с. суміш гідрофільних полімерів, причому згадані кислота вибрана з альгінової кислоти, альгінату полімери вибрані з групи, що включає ефіри ценатрію, альгінату кальцію, альгінату натріюлюлози, поліуронові кислоти та фармацевтично кальцію, альгінату калію, альгінату амонію, альгіприйнятні смоли або їх суміші, та нату магнію і т. п. d. фармацевтично прийнятну сіль кальцію; 20. Композиція за п. 19, де поліуронова кислота є ii. другого шару складу негайного вивільнення, де альгінатом натрію та присутня у кількості від призгаданий NNRTI є ефавіренсом або його фармаблизно 0,5 % до приблизно 10 % ваги складу кецевтично прийнятною похідною разом з фармацерованого вивільнення. втично прийнятними наповнювачами. 21. Композиція за п. 20, де поліуронова кислота є 8. Антиретровірусна фармацевтична композиція за альгінатом натрію та присутня у кількості від прип. 1, що включає селективну комбінацію близно 1 % до приблизно 6 % ваги складу кероваі. ядра зі складу керованого вивільнення, який ного вивільнення. включає: 22. Композиція за одним з пп. 1-21, де фармацева. ламівудин або його фармацевтично прийнятну тично прийнятна смола вибрана з гуарової смоли, похідну, ксантанової смоли, смоли карайя, трагакантової b. зідовудин або його фармацевтично прийнятну смоли, акацієвої смоли і т. п. похідну, 23. Композиція за п. 22, де фармацевтично прийнс. суміш гідрофільних полімерів, причому згадані ятна смола є гуаровою смолою та присутня у кільполімери вибрані з групи, що включає ефіри цекості від приблизно 0,1 % до приблизно 10 % ваги люлози, поліуронові кислоти та фармацевтично складу керованого вивільнення. прийнятні смоли або їх суміші, та 24. Композиція за п. 23, де фармацевтично прийнd. фармацевтично прийнятну сіль кальцію; ятна смола є гуаровою смолою та присутня у кільіі. зовнішнього покриття складу негайного вивількості від приблизно 0,5 % до приблизно 6 % ваги нення, де згаданий NNRTI є ефавіренсом або його складу керованого вивільнення. фармацевтично прийнятною похідною разом з 25. Композиція за одним з пп. 1-24, де фармацевфармацевтично прийнятними наповнювачами. тично прийнятна сіль кальцію вибрана з групи, що 9. Композиція за одним з пп. 1-8, де кількість ламівключає сульфат кальцію, фосфат кальцію, карвудину або його фармацевтично прийнятної похідбонат кальцію та хлорид кальцію. ної складає від приблизно 50 мг до приблизно 500 26. Композиція за п. 25, де фармацевтично прийнмг. ятна сіль кальцію є сульфатом кальцію та присут10. Композиція за п. 9, де кількість ламівудину або ня у кількості від приблизно 0,1 % до приблизно його фармацевтично прийнятної похідної складає 2,5 % ваги складу керованого вивільнення. приблизно 300 мг. 27. Композиція за п. 26, де фармацевтично прийн11. Композиція за одним з пп. 1-8, де кількість зіятна сіль кальцію є сульфатом кальцію та присутдовудину або його фармацевтично прийнятної ня у кількості від приблизно 0,1 % до приблизно похідної складає від приблизно 100 мг до прибли2 % ваги складу керованого вивільнення. зно 1000 мг. 28. Композиція за одним з пп. 1-27, де склад керо12. Композиція за п. 11, де кількість зідовудину або ваного вивільнення додатково містить щонайменйого фармацевтично прийнятної похідної складає ше один розріджувач, що може диспергуватися у 600 мг. воді, або розчинний у воді розріджувач, вибраний 13. Композиція за одним з пп. 1-12, де кількість з мікрокристалічної целюлози, двозаміщеного фоневірапіну/ефавіренсу або його фармацевтично сфату кальцію, карбонату кальцію, лактози, пороприйнятної похідної складає від приблизно 100 мг шкоподібної целюлози, крохмалю, маніту і т. п. до приблизно 1000 мг. 29. Композиція за п. 28, де розріджувач присутній у 14. Композиція за п. 13, де кількість невірапіну або кількості від приблизно 1 % до приблизно 28 % його фармацевтично прийнятної похідної складає ваги складу керованого вивільнення. приблизно 400 мг. 30. Композиція за п. 29, де розріджувач є мікро15. Композиція за п. 13, де кількість ефавіренсу кристалічною целюлозою. або його фармацевтично прийнятної похідної 31. Композиція за п. 30, де кількість мікрокристаліскладає приблизно 600 мг. чної целюлози складає від приблизно 5 % до при16. Композиція за одним з пп. 1-15, де ефір целюблизно 20 % ваги. лози вибраний з гідроксипропілцелюлози, гідро32. Композиція за п. 29, де розріджувач є двозаміксипропілметилцелюлози, карбоксиметилцелюлощеним фосфатом кальцію. зи, натрію карбоксиметилцелюлози, 5 82564 6 го вивільнення перемішуванням разом активних 33. Композиція за п. 32, де кількість двозаміщеного інгредієнтів, вибраних з ламівудину, зідовудину фосфату кальцію складає від приблизно 1 % до або їх сумішей, з гідрофільними полімерами, вибприблизно 5 % ваги. раними з ефірів целюлози, поліуронових кислот, 34. Композиція за одним з пп. 1-33, де склад керофармацевтично прийнятних смол або їх сумішей, з ваного вивільнення додатково містить щонайменфармацевтично прийнятною сіллю кальцію, неше одну змащувальну добавку, вибрану зі стеараобов'язково, з розріджувачем та змащувальною ту магнію, стеарату кальцію, стеаринової кислоти, добавкою, (іі) одержують зовнішнє покриття складу діоксиду кремнію, тальку і т. п. негайного вивільнення з щонайменше NNRTI, виб35. Композиція за п. 34, де змащувальна добавка раного з невірапіну та ефавіренсу, змішаного з присутня у кількості від приблизно 0,1 % до прифармацевтично прийнятними наповнювачами, та близно 3 % ваги. (ііі) одержують з них композицію шляхом нанесен36. Композиція за одним з пп. 1-35, де склад неня згаданого зовнішнього покриття на згадане ядгайного вивільнення включає від приблизно 10 % ро пресуванням покриття. до приблизно 95 % ваги невірапіну або його фар47. Спосіб за п. 45 або п. 46, в якому кожну суміш мацевтично прийнятної похідної разом з одним гранулюють сухим способом перед пресуванням. або більше фармацевтично прийнятними напов48. Спосіб за п. 45 або п. 46, в якому кожну суміш нювачами, вибраними з розріджувачів, зв'язувальгранулюють вологим способом перед пресуванних речовин, дезінтеграторів, змащувальних добаням. вок, барвників і т. п. 49. Спосіб зниження лікарського навантаження на 37. Композиція за п. 36, де розріджувач вибраний з пацієнта, що страждає на інфекцією ВІЛ та/або на мікрокристалічної целюлози, двозаміщеного фосСиндром Набутого Імунного Дефіциту, при якому фату кальцію, карбонату кальцію, лактози, порошвводять антиретровірусну фармацевтичну компокоподібної целюлози, крохмалю, маніту і т. п. зицію з трьох лікарських препаратів, що включає 38. Композиція за п. 37, де розріджувач є порошкомбінацію ламівудину та зідовудину як компонент коподібною целюлозою та присутній у кількості від керованого вивільнення та невірапіну або ефавіприблизно 2 % до приблизно 15 % ваги складу ренсу як компонент негайного вивільнення. негайного вивільнення. 50. Спосіб зниження лікарського навантаження на 39. Композиція за п. 36, де зв'язувальна речовина пацієнта, що страждає на інфекцією ВІЛ та/або на вибрана з натрію карбоксиметилцелюлози, повідСиндром Набутого Імунного Дефіциту, при якому ону, прежелатинізованого крохмалю, желатину вводять антиретровірусну фармацевтичну компоабо їх сумішей. зицію з трьох лікарських препаратів, що включає 40. Композиція за п. 39, де зв'язувальна речовина ламівудин та зідовудин як компонент керованого присутня у кількості від приблизно 1 % до приблививільнення та невірапін або ефавіренс як композно 10 % ваги складу негайного вивільнення. нент негайного вивільнення, причому композиція 41. Композиція за п. 36, де дезінтегратор вибраний після введення згаданому пацієнту забезпечує із кросповідону, натрію крохмальгліколяту, прежеСmах від приблизно 1,2 до приблизно 2,0 мкг/мл латинізованого крохмалю, натрію карбоксиметилдля ламівудину, від приблизно 1,0 до приблизно целюлози, натрію кроскармелози, крохмалю та їх 2,0 мкг/мл для зідовудину та від приблизно 4,5 до сумішей. приблизно 5,5 мкг/мл для невірапіну. 42. Композиція за п. 41, де дезінтегратор присутній 51. Спосіб зниження лікарського навантаження на у кількості від приблизно 0,5 % до приблизно 15 % пацієнта, що страждає на інфекцією ВІЛ та/або ваги складу негайного вивільнення. Синдром Набутого Імунного Дефіциту, при якому 43. Композиція за п. 36, де змащувальна добавка вводять антиретровірусну фармацевтичну комповибрана зі стеарату магнію, стеарату кальцію, стезицію з трьох лікарських препаратів, що включає аринової кислоти, діоксиду кремнію, тальку і т. п. ламівудин та зідовудин як компонент керованого 44. Композиція за п. 43, де змащувальна добавка вивільнення, та невірапін або ефавіренс як компоприсутня у кількості від приблизно 0,1 % до принент негайного вивільнення, причому композиція близно 3 % ваги. після введення згаданому пацієнту забезпечує 45. Спосіб виготовлення антиретровірусної фарAUC0-t від приблизно 8 до приблизно 14 мацевтичної композиції, що включає наступні етамкг·година/мл для ламівудину, від приблизно 5 до пи: (і) одержують склад керованого вивільнення приблизно 9 мкг·година/мл для зідовудину та від перемішуванням разом активних інгредієнтів, вибприблизно 32 до приблизно 40 мкг·година/мл для раних з ламівудину, зідовудину або їх сумішей, з невірапіну. гідрофільними полімерами, вибраними з ефірів 52. Спосіб збільшення in vivo періоду напіввивецелюлози, поліуронових кислот, фармацевтично дення ламівудину та зідовудину, без впливу на прийнятних смол або їх сумішей, та з фармацевперіод напіввиведення невірапіну, і ,таким чином, тично прийнятною сіллю кальцію, необов'язково, з зниження лікарського навантаження на пацієнта, розріджувачем та змащувальною добавкою, (іі) що страждає на інфекцією ВІЛ та/або на Синдром одержують склад негайного вивільнення щонайНабутого Імунного Дефіциту, при якому вводять менше змішуванням NNRTI з фармацевтично приантиретровірусну композицію з трьох лікарських йнятними наповнювачами та (ііі) одержують з них препаратів, що включає ламівудин та зідовудин як композицію пресуванням утворених сумішей у компонент керованого вивільнення та невірапін двошарові таблетки. або ефавіренс як компонент негайного вивільнен46. Спосіб виготовлення антиретровірусної фарня. мацевтичної композиції, що включає наступні етапи: (і) одержують ядро згаданого складу керовано 7 82564 8 ламівудин та зідовудин як компонент керованого 53. Спосіб за п. 51, де композиція після введення вивільнення та невірапін або ефавіренс як композгаданому пацієнту забезпечує t1/2 приблизно 5 нент негайного вивільнення, де композиція після годин для ламівудину, приблизно 2 годин для зівведення згаданому пацієнту забезпечує Сmах згадовудину та приблизно 29 годин для невірапіну. даних лікарських препаратів для компонента керо54. Спосіб зниження лікарського навантаження на ваного вивільнення, що є в значній мірі подібною пацієнта, що страждає на інфекцією ВІЛ та/або на до тієї, що забезпечується композиціями негайного Синдром Набутого Імунного Дефіциту, при якому вивільнення згаданих лікарських препаратів, при вводять антиретровірусну фармацевтичну комповведенні спільно, послідовно або одночасно. зицію з трьох лікарських препаратів, що включає Даний винахід стосується антиретровірусної фармацевтичної композиції. Докладніше, даний винахід стосується антиретровірусної фармацевтичної композиції, що містить селективну комбінацію активного складу керованого вивільнення та активного складу негайного вивільнення, для однократного добового введення. Даний винахід також стосується способу виготовлення такої однократної добової антиретровірусної фармацевтичної композиції. Синдром Набутого Імунного Дефіциту (СНІД), який спричиняється вірусом імунодефіциту людини (ВІЛ), одна з не багатьох хвороб, для яких людство завзято намагається знайти спосіб лікування. В останні кілька років відкрито багато антиретровірусних агентів, що застосовуються для лікування СШД. Лікарські препарати, що у даний час прийняті в анти-ВІЛ терапії, розподілені на три категорії, а саме: 1. Нуклеозидні Інгібітори Зворотної Транскриптази (NRTI), що включають ламівудин, зідовудин, діданозин, абакавір, ставудин та зальцитабін. 2. Ненуклеозидні Інгібітори Зворотної Транскриптази (NNRTI), що включають невірапін, ефавіренс та делавірдин. 3. Інгібітори Протеази (РІ), що включають індінавір, ритонавір, нелфінавір, саквінавір та ампренавір. Для успішного лікування будь-якої хвороби, спричиненої мікроорганізмом, лікарський препарат, що застосовується у терапії, повинний усувати хвороботворний організм цілком, не дозволяючи мікроорганізму мутувати. Мутація може призвести до утворення стійких штамів, які можуть утруднити лікування. Такий розвиток стійких штамів звичайно спостерігається, якщо при лікуванні застосовується винятково один агент або лікарські препарати, що належать до однієї категорії. З'ясовано, що більшість хвороб, спричинених мікроорганізмами, можна з великим успіхом лікувати комбінуванням двох або більше лікарських препаратів, переважно, з різних класів. Лікарські препарати високоактивної антиретровірусної терапії спочатку призначалися як вільна комбінація двох або трьох лікарських препаратів. Це було раціоналізовано застосуванням комбінацій з фіксованими дозами, що вводили двічі на день. У [заявці на патент PCT/IN02/00110], що знаходиться на стадії розгляду, описано склад, що сприяє зниженню лікар ського навантаження до одного разу на день. Однак, дотепер немає повідомлень про склад, що приймають один раз на день, який включає комбінацію з трьох лікарських препаратів. Існує три відомих альтернативних режими, наприклад: 1) 3 NRTI, 2) 2 NRTI+1 NNRTI, 3) 2 NRTI+1 PL Нуклеозидні Інгібітори Зворотної Транскриптази (NRTI) були першими лікарськими препаратами, які призначали як антиретровірусні агенти, та вони залишаються основою терапії проти ВІЛ інфекції та Синдрому Набутого Імунного Дефіциту (СНІД). Хоча випробували різні режими лікування, зазначені вище, повідомлялося, що комбінація лікарських препаратів, яка включає три NRTI не така ефективна як інші комбінації. Комбінація, що складає основу терапії, двох NRTI, ламівудину та зідовудину, з одним NNRTI, таким як невірапін або ефавіренс, є переважною. Період напіввиведення із сироватки ламівудину складає від близько 3 до 6 годин, у той час як зідовудину - 1,1 години. Невірапін має тривалий період напіввиведення - більш ніж 25 годин, та у даний час його призначають дозою по 200мг двічі на день. Ефавіренс призначають дозою по 600мг один раз на день. Пропонується застосовувати 400мг невірапіну, що буде призначатися як комбінація з фіксованою дозою ламівудину та зідовудину один раз на день. У випадку ефавіренса його кількість або кількість його фармацевтично прийнятної похідної складає переважно 600-800мг. Лікування кількома лікарськими препаратами у випадку антиретровірусів має перевагу, яка полягає у тім, що лікарські препарати мають різні механізми дії, діють на різних стадіях життєвого циклу вірусу та можуть виявляти при такому застосуванні синергічний ефект. Однак, цей вид терапії приводить до того, що пацієнт повинний приймати велику кількість таблеток кілька разів у день, а це, як відомо, викликає проблеми дотримання режиму лікування. Було зроблено кілька спроб знизити лікарське навантаження для поліпшення дотримання режиму пацієнтом. Ламівудин 150мг та зідовудин 300мг належать до NRTI, що призначають двічі на день. Розроблено комбінацію з фіксованою дозою ламівудину 150мг та зідовудину 300мг (КОМБІВІРИН), що знижує лікарське навантаження цієї 9 82564 10 та/або на Синдром Набутого Імунного Дефіциту, комбінації до двох. Аналогічно, розроблена комвведенням антиретровірусної композиції з трьох бінація з трьох лікарських препаратів з фіксовалікарських препаратів, яка включає ламівудин та ною дозою ламівудину 150мг, зідовудину 300мг зідовудин, як компонент керованого вивільнення, та абакавіру 300мг (ТРИЗИВІР). Однак, є повідта невірапін або ефавіренс, як компонент негайомлення про токсичність, пов'язану з абакавіром. ного вивільнення. Крім того, частота дозування для комбінації з Наступна мета спрямована на здійснення двох та з трьох лікарських препаратів усе ще способу виготовлення згаданої антиретровірусної складає два рази на день. фармацевтичної композиції, яка б знизила лікарУ [патенті США №6113920] розкривається ське навантаження та частоту введення лікарсьфармацевтична композиція, яка включає два аккого препарату, тим самим сприяючи дотримантивних фармацевтичних інгредієнти, а саме, ланю пацієнтом режиму лікування та ефективності мівудин і зідовудин, та фармацевтично прийнятлікування. ний інгредієнт, що забезпечує ковзання, Таким чином, даний винахід передбачає анвибраний з колоїдного діоксиду кремнію, мікротиретровірусну фармацевтичну композицію, що кристалічної целюлози, стеаратів металів, карбовключає селективну комбінацію і. складу керованату кальцію та їх комбінацій, у формі таблетки, ного вивільнення, який включає: покритої плівкою. Композиція містить ламівудин у a. ламівудин або його фармацевтично прикількості від 15 до 1500мг на таблетку та зідовуйнятне похідне, дин у кількості від 30 до 1000мг на таблетку. Ця b. зідовудин або його фармацевтично прийнкомбінація призначається двічі на день. ятне похідне, У [патенті США №4917900] розкривається с суміш гідрофільних полімерів, причому згафармацевтичний склад для орального введення, дані полімери вибрані з групи, що включає ефіри у якому дискретні елементи, у тому числі зідовуцелюлози, поліуронові кислоти та фармацевтичдин, здійснені з покриттям керованого вивільненно прийнятні смоли або їх. суміші, та d. фарманя, що включає алкільні ефіри акрилової та метацевтично прийнятну сіль кальцію; крилової кислот та етилцелюлози з ваговим ii. складу негайного вивільнення, що включає співвідношенням 1:3-3:1. Ці сфероїди містять щонайменше один селективний лікарський прещонайменше 80% зідовудину, мікрокристалічної парат Ненуклеозидних Інгібіторів Зворотної целюлози та маніта, як ядроутворюючого агента. Транскриптази (NNRTI) або його фармацевтично Як обговорювалося вище, незважаючи на те, прийнятну похідну разом з фармацевтично прищо продукт комбінації двох лікарських препаратів йнятними наповнювачами. може знизити лікарське навантаження на полоВідповідно до наступних аспектів даний вивину, його усе ще потрібно приймати двічі на нахід передбачає спосіб виготовлення фармацедень, а якщо поєднати його з третім лікарським втичної композиції, що включає препаратом, лікарське навантаження істотно зро(і) змішування активних інгредієнтів, вибрасте. них з ламівудину, зідовудину, або їх фармацевОсновною метою даного винаходу є здійстично прийнятних похідних, або їх сумішей, з гіднення антиретровірусної фармацевтичної компорофільними полімерами, вибраними з ефірів зиції з трьох лікарських препаратів, що знизила б целюлози, поліуронових кислот, фармацевтично лікарське навантаження та частоту введення ліприйнятних смол або їх сумішей, та з фармацевкарського препарату, таким чином, сприяючи дотично прийнятною сіллю кальцію, у складі керотриманню пацієнтом режиму лікування та ефекваного вивільнення необов'язково передбачені тивності лікування. розріджувач та змащувальна добавка, Інша мета полягає у здійсненні комбінації з (іі) одержання складу негайного вивільнення фіксованою дозою ламівудину, зідовудину та з щонайменше одного NNRTI або їх фармацевщонайменше одного лікарського препарату тично прийнятних похідних, змішаних з фармацеNNRTI, прийнятного для однократного добового втично прийнятними наповнювачами, та введення, що знизила б лікарське навантаження (ііі) одержання композиції пресуванням утводо одиниці та частоту до одного разу на день. рених сумішей у двошарові таблетки, або нанеНаступна мета даного винаходу спрямована сенням згаданого складу негайного вивільнення на розробку комбінації з трьох лікарських препаяк зовнішнього покриття на ядро згаданого скларатів з фіксованою дозою, що включає, по суті, ду керованого вивільнення. антиретровірусні лікарські препарати ламівудину, Фармацевтична композиція знаходиться пезідовудину та щонайменше одного лікарського реважно у формі двошарової таблетки з керовапрепарату NNRTI, переважно вибраного з невіним вивільненням одного шару і з негайним вивірапіну та ефавіренсу, прийнятної для однократльненням другого шару. Альтернативно ного добового дозування, причому ламівудин та компонент керованого вивільнення може бути у зідовудин мали б кероване вивільнення, тоді як формі ядра, а другий шар негайного вивільнення невірапін/ефавіренс - негайне вивільнення. може покривати ядро зверху. Шар керованого вивільнення фармацевтичЩе одна мета даного винаходу стосується ної композиції включає ламівудин та зідовудин способу збільшення in vivo періоду напіввиведенабо їх фармацевтично прийнятні похідні разом із ня ламівудину та зідовудину, не торкаючись перісумішшю гідрофільних полімерів, вибраних з груоду напіввиведення невірапіну або ефавіренсу, пи, що включає ефіри целюлози, поліуронові киста, таким чином, зниження лікарського навантаження на пацієнта, що страждає на ВІЛ інфекцією 11 82564 12 лоти, фармацевтично прийнятні смоли або їх 1% до близько 5% ваги шару керованого вивільсуміші. нення. До того ж, цей шар також включає фармацеШар негайного вивільнення включає щонайвтично прийнятну сіль кальцію та, необов'язково, менше один NNRTI, вибраний з невірапіну та один або більше розчинних у воді або диспергоефавіренсу або їх фармацевтично прийнятних ваних у воді фармацевтично прийнятних наповпохідних. нювачів. Шар негайного вивільнення може додатково Ефір целюлози, застосовуваний у даному включати фармацевтично прийнятні наповнювавинаході, вибраний із широко відомих у даній чі, вибрані з групи, що включає розріджувачі, регалузі, таких як гідроксипропілцелюлоза, гідрочовини, які зв'язують, дезінтегратори, змащуваксипропілметилцелюлоза, карбоксиметилцелюльні добавки, барвники і т. п. лоза, натрію карбоксиметилцелюлоза, етилцеРозріджувач вибраний з мікрокристалічної люлоза, метилцелюлоза, гідроксиетилцелюлоза і целюлози, вторинного кислого фосфату кальцію, т. п. Він присутній у кількості від близько 2% до карбонату кальцію, лактози, порошкоподібної близько 12% ваги шару керованого вивільнення целюлози, крохмалю, маніта і т. п. Розріджувач та, переважно, у кількості від близько 3% до блиприсутній у кількості від близько 2% до близько зько 8% ваги шару керованого вивільнення. 15% ваги шару негайного вивільнення. Поліуронова кислота, застосовувана у даноРечовина, що зв'язує, вибрана з натрію карму винаході, вибрана з альгінової кислоти, альгібоксиметилцелюлози, повідону, прежелатинізонату натрію, альгінату кальцію, альгінату натріюваного крохмалю, желатину і т. п. Речовина, що кальцію, альгінату калію, альгінату амонію, альгізв'язує, присутня у кількості від близько 1% до нату магнію і т. п. Вона присутня у кількості від близько 10% ваги шару негайного вивільнення. близько 0,5% до близько 10% ваги шару кероваДезінтегратор вибраний із кросповідону, наного вивільнення та, переважно, у кількості від трію крохмальгліколята, прежелатинізованого близько 1% до близько 6% ваги шару керованого крохмалю, натрію карбоксиметилцелюлози, навивільнення. трію кроскармелози, крохмалю і т. п. Він присутФармацевтично прийнятна смола, застосовуній у кількості від близько 0,5% до близько 15% вана у даному винаході, вибрана із широко відоваги шару негайного вивільнення. мих у даній галузі, таких як гуарова смола, ксанКожен шар може також містити змащувальні танова смола, смола карайя, трагакантова добавки, вибрані із широко відомих у даній галузі, смола, акацієва смола і т. п. Вона присутня у кітаких як стеарат магнію, стеарат кальцію, стеалькості від близько 0,1% до близько 10% ваги ринова кислота, діоксид кремнію, тальк і т. п. шару керованого вивільнення та, переважно, у Змащувальна добавка присутня у кількості від кількості від близько 0,5% до близько 6% ваги близько 0,1% до близько 3% ваги кожного шару. шару керованого вивільнення. Фармацевтичні композиції за даним винахоСолі кальцію, застосовувані разом з визначедом можна виготовити способами, широко відоними полімерами, особливо альгінати, як відомо, мими фахівцям у даній галузі. Відповідно до пристабілізують матрицю. У зв'язку з цим, у перевайнятного способу одержання гранульованої жному варіанті здійснення згаданий шар керовасуміші для кожного шару усі активні інгредієнти ного вивільнення композиції також містить фарзмішали разом з необхідними наповнювачами, а мацевтично прийнятну сіль кальцію. потім ущільнили. Ущільнену масу потім здрібнили Сіль кальцію вибрана з групи, що включає для одержання гранул. Альтернативно, гранули сульфат кальцію, фосфат кальцію, карбонат можна також отримати способом вологої гранукальцію та хлорид кальцію. Вона присутня у кільляції з використанням прийнятного агента, що кості від близько 0,1% до близько 2,5% ваги шару гранулює. керованого вивільнення, переважно, від близько Остаточну гранульовану суміш двох шарів 0,1% до близько 2% ваги шару керованого вивіабо пресують у двошарові таблетки на пресувальнення. льній машині, прийнятній для цієї мети, або шар Шар керованого вивільнення композиції може керованого вивільнення може бути ядром, а шар додатково містити один або більше інших фарнегайного вивільнення є покриттям поверх ядра. мацевтично прийнятних наповнювачів, вибраних Таблетки, отримані таким чином, можуть бути з розчинних у воді та/або диспергованих у воді додатково покриті з застосуванням розчинного у розріджувачів та змащувальних добавок. воді полімеру. Розріджувач, що може диспергуватися у воді, Вищезгаданий спосіб дає фармацевтичну або розчинний у воді розріджувач вибраний з композицію, що містить три антиретровірусних мікрокристалічної целюлози, вторинного кислого агента в одній таблетці, прийнятній для однокрафосфату кальцію, карбонату кальцію, лактози, тного добового введення. Ефективна терапевтипорошкоподібної целюлози, крохмалю, маніта і т. чна доза, яку можна вводити, включає комбінацію п. Вони присутні у кількості від близько 1% до 300мг ламівудину, 600мг зідовудину та 400мг близько 28% ваги шару керованого вивільнення. невірапіну/600мг ефавіренсу. Якщо розріджувач - мікрокристалічна целюКомпозиція даного винаходу та її переваги лоза, він присутній у кількості від близько 5% до докладно пояснюються нижче не обмежуючими близько 20% ваги шару керованого вивільнення. прикладами: Якщо розріджувач - вторинний кислий фосфат кальцію, він присутній у кількості від близько 13 Суміш шару керованого вивільнення: ламівудин, зідовудин, гідрофільні полімери, сульфат кальцію, вторинний кислий фосфат кальцію та мікрокристалічну целюлозу просіяли крізь сито з 30 отворами на один дюйм та змішали зі стеаратом магнію. Суміш ущільнили, а отримані куски здрібнили до утворення гранул. Гранули визначеного розміру змішали з тонкою фракцією та ввели змащувальну добавку. Суміш шару негайного вивільнення: невірапін, целюлозу, повідон та першу порцію натрію крохмальгліколята просіяли крізь сито з 40 отворами на один дюйм та змішали зі стеаратом магнію. Суміш ущільнили та отримані куски здрібнили до утворення гранул. Гранули змішали з другою порцією натрію крохмальгліколята, колоїдним діоксидом кремнію та ввели змащувальну добавку. Двошарові таблетки: обидві вищезгадані суміші пресували у двошарові таблетки за допомогою пресувальної машини для двошарових таблеток. Вивільнення лікарського препарату: таблетки проаналізували на вивільнення усіх трьох активних інгредієнтів за допомогою апарата для вивчення розчинення Фармакопеї США (USP) тип 1 при 100 оборотах у хвилину та з 900мл 0,1н НСl для перших 2 годин, а потім з фосфатним буфером (рН 6,8). 82564 14 Дотримували методики виготовлення за Прикладом 1. Досягли наступного вивільнення лікарських препаратів: 15 Дотримували методики виготовлення за Прикладом 1. Досягли наступного вивільнення лікарських препаратів: 82564 16 ли зі стеаратом магнію. Суміш ущільнили, а отримані куски здрібнили до утворення гранул. Гранули змішали з другою порцією натрію крохмальгліколята, колоїдним діоксидом кремнію, ввели змащувальну добавку та нанесли пресуванням на ядро таблетки. Досягли наступного вивільнення лікарських препаратів: Вивчення застосування одиночної дози проводили з використанням таблеток за Прикладом 1 у порівнянні з комерційно доступною комбінацією негайного вивільнення трьох лікарських препаратів. Результати дослідження поміщені у Таблицю. Таблиця AUC - величина площі під кривою "концентрація - час", ER - тривале вивільнення, OD - один раз на день, IR - негайне вивільнення, BD - два рази на день. Ядро: ламівудин, зідовудин, гідрофільні полімери, сульфат кальцію, вторинний кислий фосфат кальцію та мікрокристалічну целюлозу просіяли крізь сито з ЗО отворами на один дюйм та змішали зі стеаратом магнію. Суміш ущільнили, а отримані куски здрібнили до утворення гранул. Гранули визначеного розміру змішали з тонкою фракцією, ввели змащувальну добавку та пресували у таблетки. Покриття: невірапін, целюлозу, повідон та першу порцію натрію крохмальгліколята просіяли крізь сито з 40 отворами на один дюйм та зміша Результати показують, що композиція за даним винаходом досягає Сmax ламівудину та зідовудину, яка еквівалентна отриманій, якщо вводять лікарські препарати у формі негайного вивільнення. Однак, даному винаходу також вдається збільшити значення AUC0-t та періоди напіввиведення усіх лікарських препаратів in vivo. З приведеного вище очевидно, що фармацевтична композиція за даним винаходом служить антиретровірусною комбінацією з трьох лікарських препаратів для однократного добового дозування комбінації лікування, особливо NRTI та NNRTI. Однократна добова дозована форма за даним винаходом проста, економічно ефективна, служить зниженню лікарського навантаження та частоти введення та сприяє дотриманню пацієнтом необхідного режиму прийому лікарського препарату для ефективного лікування. 17 Комп’ютерна верстка О. Гапоненко 82564 Підписне 18 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntiretrovial pharmaceutical composition of a controlled release active formulation and method for its manufacture
Автори англійськоюSEN HIMADRI, JAYANTHI SURYAKUMAR, RAGHAVAN VINEETH, ARRA GANGA SRINIVAS
Назва патенту російськоюАнтиретровирусная фармацевтическая композиция замедленного высвобождения и способ ее изготовления
Автори російськоюСэн Химадри, Джаянтхи Сурьякумар, Рагхаван Винеетх, Арра Ганга Сринивас
МПК / Мітки
МПК: A61K 9/22, A61K 31/7072, A61K 31/551, A61K 31/715, A61K 31/505, A61K 33/06, A61P 31/18
Мітки: виготовлення, композиція, фармацевтична, керованого, спосіб, вивільнення, антиретровірусна
Код посилання
<a href="https://ua.patents.su/9-82564-antiretrovirusna-farmacevtichna-kompoziciya-kerovanogo-vivilnennya-ta-sposib-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Антиретровірусна фармацевтична композиція керованого вивільнення та спосіб її виготовлення</a>
Попередній патент: Похідні піримідин-2-аміну і їх застосування як антагоністів аденозинового рецептора a2b
Наступний патент: Торцеве ущільнення
Випадковий патент: Пластика ахіллесового сухожилка