Похідні піроло[2,3-d]піримідину, специфічні до аденозинового a1, a2а і a3 рецептора, спосіб їх одержання та фармацевтична композиція
Номер патенту: 74228
Опубліковано: 15.11.2005
Автори: Кастелано Арліндо Л., Уіттер Девід Дж., Маккіббен Брайан
Формула / Реферат
1. Сполука, що має структуру:
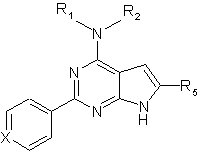 ,
,
де Х являє собою С,
R1NR2 разом утворюють кільце, що має структуру:
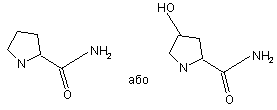 ,
,
або R1 являє собою Н і R2 являє собою
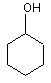 ,
,
або R1 являє собою Н і R2 являє собою
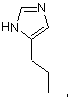
де, якщо R1NR2 разом є
 ,
,
то R5 являє собою Н, -СН2(NС5Н8)(ОН)(С6Н5), -СН2ОСН3, -(СН2)2С(O)ОН, -CH2OCH2C(O)NH2, -С(O)ОН, -СН3, -СН2(СН2)2OН, -СН2OСН2С(O)ОСН3 або -СН2OСН2С(O)ОН;
і якщо R1 являє собою Н і R2 являє собою
 ,
,
то R5 являє собою –СН2(N2С3Н3), -С(O)ОН, -СН2O(СН2)2OН, -С(O)ОСН3 або -C(O)NH2,
і якщо R1 являє собою Н і R2 являє собою

то R5 являє собою Н;
або
де Х являє собою N,
R1NR2 являє собою
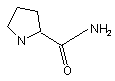
і R5 являє собою С6Н5, (С6Н4)ОСН3,
або її фармацевтично прийнятна сіль.
2. Сполука за п.1, що має структуру
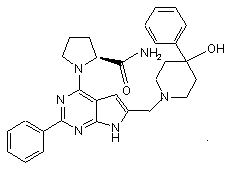
3. Сполука за п.1, що має структуру:
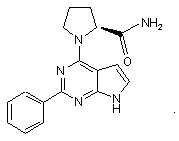
4. Сполука за п. 1, що має структуру
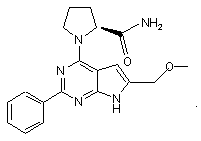
5. Сполука за п.1, що має структуру:
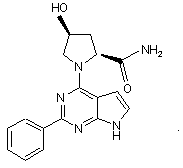
6. Сполука за п.1, що має структуру:
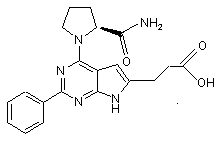
7. Сполука за п. 1, що має структуру:
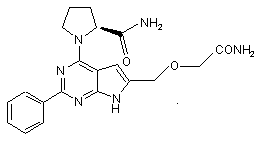
8. Сполука за п. 1, що має структуру:
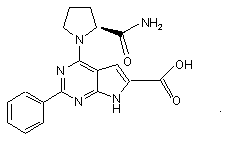
9. Сполука за п.1, що має структуру:
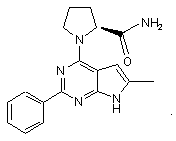
10. Сполука за п.1, що має структуру:
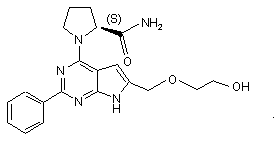
11. Сполука за п.1, що має структуру:
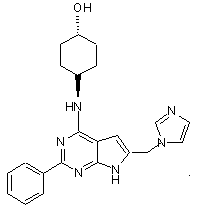
12. Сполука за п. 1, що має структуру:
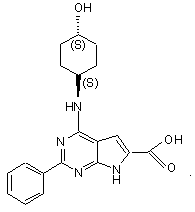
13. Сполука за п.1, що має структуру:
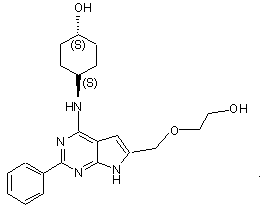
14. Сполука за п.1, що має структуру:
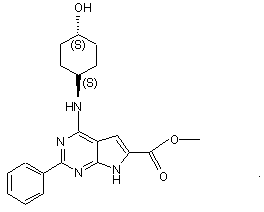
15. Сполука за п.1, що має структуру:
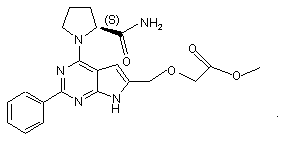
16. Сполука за п. 1, що має структуру:
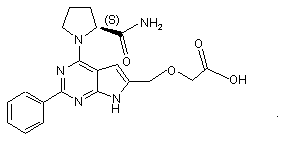
17. Сполука за п. 1, що має структуру:
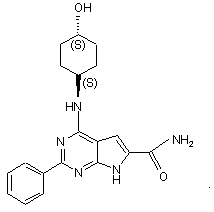
18. Сполука за п.1, що має структуру:
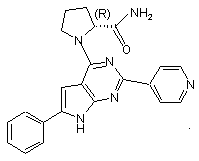
19. Сполука за п.1, що має структуру:
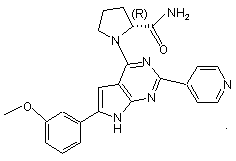
20. Сполука за п.1, що має структуру:
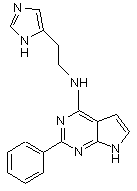 ,
,
або її фармацевтично прийнятна сіль.
21. Сполука за будь-яким одним з пп.1-20, яка придатна для виготовлення лікарського засобу для лікування захворювання, пов'язаного з А1, А2а або А3 аденозиновим рецептором, у суб'єкта.
22. Сполука за п. 21, де захворюванням, пов'язаним з А1 аденозиновим рецептором, є затримка води, брадикардія, бронхіт, бронхоспазм, хвороба Альцгеймера, серцева гіпоксія, негативна серцева інотропія і дромотропія, гіпертензія, запалення, захворювання, пов'язане з седативною дією, порушення пізнавальної здатності, ниркова недостатність, серцеві аритмії, рефлюкс, виразкове захворювання або захворювання, пов'язане з дихальним епітелієм, вивільненням трансмітерів, звуженням кровоносних судин, нейтрофільним хемотаксисом, скороченням гладкої мускулатури під дихальним епітелієм, звуженням кровоносних судин або дегрануляцією тучних клітин.
23. Сполука за п. 21, де захворюванням, пов'язаним з А1 аденозиновим рецептором, є астма, хронічне обструктивне захворювання легенів, алергічний риніт або захворювання верхніх дихальних шляхів.
24. Сполука за п. 21, де захворюванням, пов'язаним з А1 аденозиновим рецептором, є застійна серцева недостатність.
25. Сполука за п. 21, де захворюванням, пов'язаним з А2а аденозиновим рецептором, є порушення пізнавальної здатності, старече недоумство, глаукома або хвороба Паркінсона, або захворювання, пов'язане з руховою активністю, розширенням судин, інгібуванням тромбоцитів або нейтрофільним генеруванням супероксиду.
26. Сполука за п. 21, де захворюванням, пов'язаним з А3 аденозиновим рецептором, є глаукома.
27. Сполука за п. 21, де захворюванням, пов'язаним з А3 аденозиновим рецептором, є астма, глаукома, ретинопатія, пошкодження ока внаслідок ішемії, дегенерація жовтої плями, ішемія міокарда, бронхіт, хронічне обструктивне захворювання легенів або бронхоспазм, або захворювання, пов'язане з очним запаленням, або дегрануляцією тучних клітин.
28. Сполука за п. 21, де захворюванням, пов'язаним з А2а аденозиновим рецептором, є хвороба Паркінсона.
29. Спосіб одержання сполуки за п. 20, що включає стадії (а) взаємодії сполуки
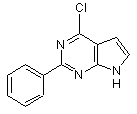
з гістаміном в присутності диметилсульфоксиду;
(b) нагрівання реакційної суміші в інертній атмосфері;
(c) охолоджування реакційної суміші і відділення органічного шару від водного шару;
(d) промивання органічного шару насиченим розчином солі, осушення і фільтрація з утворенням цільової сполуки.
30. Спосіб за п. 29, в якому на стадії (b) реакційну суміш нагрівають в атмосфері азоту.
31. Спосіб за п. 29, в якому на стадії (d) органічний шар осушують MgSO4.
32. Фармацевтична композиція для лікування захворювання, пов'язаного з А1, А2а або А3 аденозиновим рецептором, у суб'єкта, що містить терапевтично ефективну кількість сполуки за будь-яким одним з пп.1-20 і фармацевтично прийнятний носій.
33. Композиція за п. 32, яка додатково містить одну або декілька сполук, вибраних з групи, що складається з антагоністів бета-адреноцептора, агоністів альфа-2-адреноцептора, інгібіторів карбонової ангідрази, холінергічних агоністів, простагландинів і агоністів простагландинового рецептора, інгібіторів ангіотензинконвертуючого ферменту (АСЕ), антагоністів АМРА рецептора, 5-НТ агоністів, інгібіторів ангіогенезу, NMDA антагоністів, інгібіторів реніну, агоністів канабіноїдного рецептора, антагоністів ангіотензинового рецептора, гідрохлортіазиду (HCTZ), агоністів соматостатину, глюкокортикоїдних антагоністів, інгібіторів дегрануляції тучних клітин, блокаторів альфа-адренергічних рецепторів, антагоністів альфа-2-адреноцептора, міметиків тромбоксану А2, інгібіторів протеїнкінази, похідних простагландину F, антагоністів простагландин-2 альфа, агоністів допаміну D1 і 5-НТ2, агентів, що вивільняють окисел азоту, антагоністів 5-НТ2, інгібіторів циклооксигенази, інозину, агоністів допамінового D2 рецептора і альфа 2 адреноцептора, антагоніста допамінового D1 рецептора і агоністів D2 рецептора, антагоністів вазопресинового рецептора, ендотеліальних антагоністів, 1-(3-гідрокси-2-фосфонілметоксипропілцитозину (НРМРС) і родинних аналогів і проліків, лігандів рецептора тироїдного гормону, мускаринових М1 агоністів, блокаторів натрієвих каналів, блокаторів іонних каналів змішаної дії, антагоністів бета-адреноцептора і комбінації PGF2 альфа агоністів, активаторів гуанілатциклази, нітровазодилаторів, модуляторів ендотелінового рецептора, етакринової кислоти, інших аналогів феноксіоцтової кислоти, руйнувачів актину, блокаторів кальцієвих каналів і нейрозахисних агентів.
34. Композиція за п. 32, яка додатково містить одну або декілька сполук, вибраних з групи, що складається з антагоністів бета-адреноцептора, агоністів альфа-2-адреноцептора, інгібіторів карбонової ангідрази, холінергічних агоністів і агоністів простагландинового рецептора.
Текст
Дана заявка є частковим продовженням і по ній запитується пріоритет на основі заявок на патент США №№09/728316, поданої 1 грудня 2000p., 09/728607, поданої 1 грудня 2000p., і 09/728616, поданої 1 грудня 2000p., кожна з яких включена в даний опис як посилання у всій своїй повноті. У даній заявці згадуються сполуки, які специфічно зв'язуються з і) А1 аденозиновими рецепторами (як наприклад, крім іншого, стор. 3-61, 104-142 і 199-280); іі) А2а аденозиновими рецепторами (як наприклад, крім іншого, стор. 142-159 і стор. 221-224) і А3 аденозиновими рецепторами (як наприклад, крім іншого, стор. 160-199 і 225-229). Аденозин являє собою широко поширений модулятор численних видів фізіологічної активності, зокрема у серцево-судинній і нервовій системах. Виявляється, що дія аденозину опосередковується специфічними рецепторними білками поверхні клітини. Аденозин модулює різні фізіологічні функції, включаючи індукування седативної дії, розширення судин, придушення частоти серцевих скорочень і скорочуваності серця, інгібування агрегації тромбоцитів, стимулювання глюконеогенезу та інгібування ліполізу. Було показано, що в доповнення до його дії на аденілатциклазу, аденозин відкриває калієві канали, зменшує потік через кальцієві канали та інгібує або стимулює фосфоїнозитидний оборот за допомогою рецепторопосередкованих механізмів (дивись, наприклад, "C.E.Muller and В.Stein Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design 2:501 (1996) і "C.E.Muller AiAdenosine Receptor Antagonists", Exp. Opin.Ther. Patents 7(5): 419 (1997)). Аденозинові рецептори належать до надсімейства пуринових рецепторів, які в цей час поділяють на Ρ1 і (аденозин) і Р2 (АТФ, АДФ та інші нуклеотиди) рецептори. До цього часу з різних видів, включаючи людину, було клоновано чотири підтипи рецепторів для аденозинового нуклеозиду. Два підтипи рецепторів (А1 і А2а) виявляють спорідненість до аденозину в наномолярному діапазоні, тоді як два інших відомих підтипи А2b і А3 є рецепторами з низькою спорідненістю до аденозину в нижньому мікромолярному діапазоні. Активація А1 і А3 аденозинового рецептора може приводити до інгібування активності аденілатциклази, тоді як активація А2а і А2ь викликає стимуляцію аденілатциклази. Для лікування порушення пізнавальної здатності, ниркової недостатності і серцевої аритмії було розроблено декілька Аі антагоністів. Було висловлене припущення, що A2a антагоністи можуть виявитись сприятливими для пацієнтів, страждаючих від паркінсонізму (хвороба Паркінсона). Зокрема, беручи до уваги здатність до місцевої доставки, антагоністи аденозинового рецептора можуть виявитись цінними для лікування алергічного запалення і астми. Доступна інформація (наприклад, "Nyce & Metzger DNA antisense Therapy for Asthma in an Animal Model", Nature (1997) 385: 721-5) вказує, що в даному патофізіологічному контексті А1 антагоністи можуть блокувати скорочення гладкої мускулатури, яка лежить під дихальним епітелієм, тоді як антагоністи А2b або А3 рецептора можуть блокувати дегрануляцію тучни х клітин, зменшуючи вивільнення гістаміну та інших запальних медіаторів. А2b рецептори були виявлені у шлунковокишковому тракті, особливо в епітелії прямої кишки і тонкого кишечника. Було висловлене припущення, що А2b рецептори опосередковують цАМФ реакцію у відповідь (Strohmeier et al., J.Bio.Chem. (1995) 270:238794). Також було показано, що аденозинові рецептори існують на сітківці різних видів ссавців, включаючи велику рогату худобу, свиню, мавпу, щура, морську свинку, мишу, кролика і людину (дивись, Blazynski et al., Discrete Distributions of Adenosine Receptors in mammalian Retina, Journal of Neurochemistry, volume 54, pages 648-655 (1990); Woods et al., Characterization of Adenosine ArReceptor binding Sites in Bovine Retinal Membranes, Experimental Eye Research, volume 53, pages 325-331 (1991); і Braas et al., Endogenous adenosine and adenosine receptors localized to ganglion cells of the retina, Proceedings of the National Academy of Science, volume 84, pages 3906-3910 (1987)). Нещодавно повідомлялось про результати спостережень аденозинових транспортних сайтів у культивованій клітинній лінії сітківки людини (Williams et al., Nucleoside Transport Sites in a Cultures Human Retinal cell Line Established by SV-40 Τ Antigen gene, Current Eye Research, volume 13, pages 109-118 (1994)). Сполуки, які регулюють поглинання аденозину, раніше були запропоновані як потенційні терапевтичні агенти для лікування пошкодження сітківки і головного зорового нерва. У патенті США 5780450, виданому Shade, автор обговорює застосування інгібіторів поглинання аденозину для лікування очних захворювань. Shade не описує застосування специфічних інгібіторів А3 рецептора. Повний зміст патенту США №5780450 включений у даний опис як посилання. Як фармакологічні інструменти необхідні додаткові антагоністи аденозинових рецепторів, і вони представляють суттєвий інтерес як лікарські засоби для згаданих вище хворобливих станів і/або захворювань. Даний винахід відноситься до сполук, які селективно зв'язуються з А1-аденозиновим рецептором, виліковуючи таким чином захворювання, пов'язане з А1-аденозиновим рецептором, у суб'єкта при введенні суб'єкту терапевтично ефективної кількості таких сполук. Захворювання, що піддається лікуванню, пов'язане з порушенням пізнавальної здатності, нирковою недостатністю, серцевою аритмією, дихальним епітелієм, вивільненням трансмітерів, седативною дією, звуженням кровоносних судин, брадикардією, негативною серцевою інотропією і дромотропією, бронхостенозом, нейтрофільним хемотаксисом, рефлюксом або виразковим захворюванням. Даний винахід оснований, принаймні частково, на тому факті, що деякі N-6 заміщені 7-дезазапурини, описані нижче, можна використати для лікування хворобливого стану, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин. Приклади таких станів включають ті, в яких підвищена активність аденозинових рецепторів, наприклад, бронхіт, шлунково-кишкові захворювання або астма. Такі стани можуть бути охарактеризовані тим, що активація аденозинового рецептора може вести до інгібування або стимуляції активності аденілатциклази. Композиції і способи винаходу включають енантіомерно або діастереомерно чисті N-6 заміщені 7-дезазапурини. Переважні N-6 заміщені 7-дезазапурини включають ті, які містять фрагменти ацетаміду, карбоксаміду, заміщеного циклогексилу, наприклад, циклогексанол, або сечовини, приєднані до N-6 азоту через алкіленовий ланцюг. Даний винахід відноситься до способів модулювання аденозинового рецептора(ів) у ссавця шляхом введення ссавцеві терапевтично ефективної кількості N-6 заміщеного 7-дезазапурину таким чином, що відбувається модуляція активності аденозинового рецептора. Відповідні аденозинові рецептори включають сімейство А1, А2 і А3 . У переважному варіанті здійснення N-6 заміщений 7-дезазапурин є антагоністом аденозинового рецептора. Крім того, винахід відноситься до способів лікування захворювань, що дають реакцію у відповідь на N-6 заміщені 7-дезазапурини, наприклад, астми, бронхіту, алергічного риніту, хронічного обструктивного захворювання легень, ниркових захворювань, шлунково-кишкових захворювань і очних захворювань у ссавця шляхом введення ссавцеві терапевтично ефективної кількості N-6 заміщеного 7-дезазапурину, таким чином, що відбувається лікування захворювання у ссавця. Відповідні N-6 заміщені 7-дезазапурини включають ті, які проілюстровані загальною формулою І: і їх фармацевтично прийнятні солі. Кожний з R 1 і R2 незалежно являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент, або вони разом утворюють заміщене або незаміщене гетероциклічне кільце. R3 являє собою заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент. R4 являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент. Кожний з R5 і R6 незалежно являє собою атом галогену, наприклад, хлор, фтор або бром, атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент, або R5 являє собою карбоксил, складні ефіри карбоксилу або карбоксаміди, або R 4 і R5, або R5 і R6 разом утворюють заміщене або незаміщене гетероциклічне або карбоциклічне кільце. У деяких варіантах здійснення кожний з R 1 і R2 незалежно може являти собою заміщені або незаміщені циклоалкільні або гетероарилалкільні фрагменти. У інших варіантах здійснення R3 являє собою атом водню або заміщений або незаміщений гетероарильний фрагмент. Ще в інших варіантах здійснення кожний з R4, R5 і R6 незалежно може являти собою гетероарильний фрагмент. У переважному варіанті здійснення R1 являє собою атом водню, R2 являє собою циклогексанол, наприклад, транс-циклогексанол, R3 являє собою феніл, R4 являє собою атом водню, R5 являє собою метильну груп у і R 6 являє собою метильну груп у. В іншому варіанті здійснення R1 являє собою атом водню, R2 являє собою R3 являє собою феніл, R4 являє собою атом водню, R5 і R6 являють собою метильні групи. Винахід додатково відноситься до фармацевтичних композицій для лікування станів, що дають реакцію у відповідь на N-6 заміщені 7-дезазапурини, у ссавців, наприклад, астми, бронхіту, алергічного риніту, хронічного обструктивного захворювання легень, ниркових захворювань, шлунково-кишкових захворювань і очних захворювань. Фармацевтична композиція включає терапевтично ефективну кількість N-6 заміщеного 7-дезазапурину і фармацевтично прийнятного носія. Даний винахід також відноситься до упакованих фармацевтичних композицій для лікування станів, що дають реакцію у відповідь на N-6 заміщені 7-дезазапурини, у ссавців. Упаковані фармацевтичні композиції включають контейнер, що містить терапевтично ефективну кількість принаймні одного N-6 заміщеного 7дезазапурину, та інструкції з використання N-6 заміщеного 7-дезазапурину для лікування станів, що дають реакцію у відповідь на N-6 заміщені 7-дезазапурини, у ссавців. Далі винахід відноситься до сполук формули І, де R1 являє собою водень; R2 являє собою заміщений або незаміщений циклоалкіл, заміщений або незаміщений алкіл, або R1 і R2 разом утворюють заміщене або незаміщене гетероциклічне кільце; R3 являє собою незаміщений або заміщений арил; R4 являє собою водень; і кожний з R5 і R6 незалежно являє собою водень або алкіл, і їх фармацевтично прийнятних солей. Дезазапурини даного варіанту здійснення можуть переважно бути селективними антагоністами А1 рецептора. Дані сполуки можуть виявитись корисними для множини терапевтичних застосувань, як, наприклад, лікування астми, ниркової недостатності, пов'язаної з серцевою недостатністю, і глаукоми. В особливо переважному варіанті здійснення дезазапурин являє собою розчинні у воді проліки, які здатні метаболізувати in vivo в активний лікарський засіб, наприклад, за допомогою гідролізу, який каталізується естеразою. Ще в одному варіанті здійснення, винахід відноситься до способу інгібування активності аденозинового рецептора (наприклад, А3) у клітині шляхом контактування клітини з N-6 заміщеним 7-дезазапурином (наприклад, переважно антагоністом аденозинового рецептора). В іншому аспекті винахід відноситься до способу лікування пошкодження ока у ссавця (наприклад, людини) шляхом введення тварині ефективної кількості N-6 заміщеного 7-дезазапурину формули І. Переважно N-6 заміщений 7-дезазапурин є антагоністом А3 аденозинових рецепторів у клітинах ссавців. Пошкодження відноситься до сітківки або зорового головного нерва і може бути гострим або хронічним. Пошкодження може бути результатом, наприклад, глаукоми, набряку, ішемії, гіпоксії або травми. Винахід також відноситься до фармацевтичної композиції, що включає N-6 заміщену сполуку формули І. Переважно фармацевтичний препарат являє собою офтальмологічну композицію (наприклад, композицію для періокулярної, ретробульбарної або внутрішньоочної ін'єкції, системну композицію і хірургічний зрошувальний розчин). Ще в одному варіанті здійснення винахід відноситься до сполуки, що має формулу II: де X являє собою N або CR6; кожний з R1 і R2 незалежно являє собою водень або заміщений або незаміщений алкокси, аміноалкіл, алкіл, арил або алкіларил, або разом вони утворюють заміщене або незаміщене гетероциклічне кільце, за умови, що обидва R1 і R2 не є воднем; R3 являє собою заміщений або незаміщений алкіл, арилалкіл або арил; R4 являє собою водень або заміщений або незаміщений С 1-С6 алкіл; L являє собою водень, заміщений або незаміщений алкіл, або R4 і L разом утворюють заміщене або незаміщене гетероциклічне або карбоциклічне кільце; R6 являє собою водень, заміщений або незаміщений алкіл, або галоген; Q являє собою СН2, О, S або NR7, де R7 являє собою водень або заміщений або незаміщений С1-С6 алкіл; і W являє собою незаміщений або заміщений алкіл, циклоалкіл, арил, арилалкіл, біарил, гетероарил, заміщений карбоніл, заміщений тіокарбоніл або заміщений сульфоніл; за умови, що якщо R3 являє собою піролідино, то R4 не є метилом. Винахід також включає фармацевтично прийнятні солі і проліки сполук за винаходом. У переважному варіанті здійснення X являє собою CR6, і Q являє собою СН2, О, S або NH у формулі II, де R6, є таким, як визначено вище. В іншому варіанті здійснення формули II, X являє собою N. Винахід додатково відноситься до способу інгібування активності аденозинового рецептора (наприклад, А2b-аденозинового рецептора) в клітині при контактуванні клітини зі сполукою за винаходом. Переважно сполука є антагоністом рецептора. Винахід також відноситься до способу лікування шлунково-кишкового захворювання (наприклад, діареї) або захворювання дихальних шля хів (наприклад, алергічного риніту, хронічного обструктивного захворювання легень) у тварини шляхом введення тварині ефективної кількості сполуки формули II (наприклад, антагоніста А2b). Переважно тварина являє собою людину. Відмітною особливістю винаходу також є сполука, що має структур у: де R1 являє собою транс-4-гідроксициклогексил, 2-метиламінокарбоніламіноциклогексил, 2метиламінокарбоніламіноциклогексил, ацетамідоетил або метиламінокарбоніламіноетил; де R3 являє собою заміщене або незаміщене чотирьох-шестичленне кільце; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)XR9, де X являє собою О, S або NR10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R9 і R10 незалежно являє собою алкіл або циклоалкіл, або R9, R10 і азот разом утворюють заміщене або незаміщене кільце, що містить 4-7 членів; де R6 являє собою Н, алкіл, заміщений алкіл, циклоалкіл; або фармацевтично прийнятна сіль, або пролікарське похідне, або біологічно активний метаболіт; за умови, що коли R1 являє собою ацетиламіноетил, R3 не є 4-піридилом. В одному варіанті здійснення сполуки R3 являє собою феніл, пірол, тіофен, фуран, тіазол, імідазол, піразол, 1, 2,4-триазол, піридин, 2(1Н)-піридон, 4(1Н)-піридон, піразин, піримідин, піридазин, ізотіазол, ізоксазол, оксазол, тетразол, нафталін, тетралін, нафтиридин, бензофуран, бензотіофен, індол, 2,3дигідроіндол, 1Н-індол, індолін, бензопіразол, 1,3-бензодіоксол, бензоксазол, пурин, кумарин, хромон, хінолін, тетрагідрохінолін, ізохінолін, бензімідазол, хіназолін, піридо[2,3-b]піразин, піридо[3,4-b]піразин, піридо[3,2-с]піридазин, піридо[3,4-b]піридин, 1Н-піразол[3,2-d]піримідин, птеридин, 2(1Н)-хінолон, 1(2Н)ізохінолон, 1,4-бензізоксазин, бензотіазол, хіноксалін, хінолін-N-оксид, ізохінолін-N-оксид, хіноксалін-Nоксид, хіназолін-N-оксид, бензоксазин, фталазин, цинолін або має структур у: де Υ являє собою вуглець або азот; де R2 і R2' ·незалежно являють собою Н, заміщений або незаміщений алкіл, заміщений або незаміщений арил, галоген, метокси, метиламіно або метилтіо. Даний винахід також відноситься до сполуки, що має структур у: де R3 являє собою арил, заміщений арил або гетероарил; де R6 являє собою Н, алкіл, заміщений алкіл або циклоалкіл; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)NR9R10, де кожний з R7 і R8 являє собою N або алкіл, де кожний з R9 і R10 являє собою алкіл або циклоалкіл, або R9, R10 і азот разом утворюють кільцеву систему, що містить 4-7 членів. Даний винахід також відноситься до способу інгібування активності А1-аденозинового рецептора в клітині, що включає контактування вказаної клітини з вищезгаданими сполуками. Відмітні особливості та інші подробиці винаходу тепер будуть описані більш конкретно і відображені у формулі винаходу. Потрібно розуміти, що конкретні варіанти здійснення винаходу наведені як ілюстрація, а не обмеження винаходу. Принципові відмітні особливості даного винаходу можуть бути використані у різних варіантах здійснення, не відступаючи від об'єму винаходу. Даний винахід відноситься до способів лікування станів, що дають реакцію у відповідь на N-6заміщений 7-дезазапурин у ссавця. Способи включають введення ссавцеві терапевтично ефективної кількості N-6 заміщеного 7-дезазапурину, описаного нижче, так що відбувається лікування стану у ссавця, що дає реакцію у відповідь на N-6-заміщений 7-дезазапурин. Вираз «стан, що дає реакцію у відповідь на N-6-заміщений 7-дезазапурин», призначений для позначення хворобливого стану або захворювання, яке відрізняється реакцією у відповідь на лікування N-6 заміщеним 7-дезазапурином за винаходом, як описано нижче, наприклад, лікування включає значне зменшення принаймні одного симптому або наслідку хворобливого стану, що досягається з використанням N-6 заміщеного 7-дезазапурину за винаходом. Звичайно, такі стани пов'язані із збільшенням кількості аденозину у хазяїна, так що хазяїн часто переживає фізіологічні симптоми, які включають, але не обмежуються цим, вивільнення токсинів, запалення, кому, затримку води, набирання ваги або втрату ваги, панкреатит, емфізему, ревматоїдний артрит, остеоартрит, множинне ураження органів, дитячий або дорослий респіраторний дистрес-синдром, алергічний риніт, хронічне обструктивне захворювання легень, очні захворювання, шлунково-кишкові захворювання, стимулювання шкірних новоутворень, імунодефіцит і астма (дивись, наприклад, "C.E.Muller and В.Stein Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design, 2:501 (1996) і "C.E.Muller А1-Adenosine Receptor Antagonists", Exp.Opin.Ther.Patents 7(5):419 (1997), і I.Feoktistove, R.Polosa, S.T.Holgate і "I.Biaggioni Adenosine А2b receptors: a novel therapeutic target in Asthma TIPS 19: 148 91998)). Дія, часто пов'язана з такими симптомами, включає, але не обмежується цим, жар, нестачу дихання, нудоту, діарею, слабкість, головний біль і навіть смерть. В одному варіанті здійснення хворобливий стан, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин, включає ті захворювання, які опосередковані стимуляцією аденозинових рецепторів, наприклад, А1 , А2а, А2b, А3 і т.д., таких, при яких модулюється концентрація кальцію у клітинах і/або активація PLC (фосфоліпази С). У переважному варіанті здійснення хворобливий стан, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин, пов'язаний з аденозиновим(ими) рецептором(ами), наприклад, N-6 заміщений 7-дезазапурин діє як антагоніст. Приклади відповідних таких, що дають реакцію у відповідь, станів, які можна лікувати за допомогою сполук за винаходом, наприклад, підтипів аденозинових рецепторів, які опосередковують біологічну дію, включають дію на центральну нервову систему (ЦНС), серцево-судинну дію, ниркову дію, ди хальну дію, імунологічний дію, шлунково-кишкову дію і метаболічну дію. Відносна кількість аденозину у суб'єкта може бути пов'язана з перерахованою нижче дією; тобто підвищені рівні аденозину можуть ініціювати дію, наприклад, небажану фізіологічну реакцію у відповідь, наприклад, приступ астми. Дія на ЦНС включає знижене вивільнення трансмітера (А1), седативну дію (А2), знижену рухову активність (А2а), протисудомну активність, стимуляцію хеморецептора (А2) і гіпералгезію. Терапевтичне застосування сполук винаходу включає лікування недоумства, хвороби Альцгеймера і поліпшення пам'яті. Серцево-судинна дія включає розширення судин (А2а), (А2b) і (А3), звуження судин (А1), брадикардію (А1), інгібування тромбоцитів (А2а) негативн у серцеву інотропію і дромотропію, аритмію, тахікардію і ангіогенез. Терапевтичне застосування сполук винаходу включає, наприклад, профілактику індукованого ішемією пошкодження серця і стимуляцію діяльності серця, захист тканин міокарда і відновлення функції серця. Ниркова дія включає знижену швидкість клубочкової фільтрації (А1), мезангіальне скорочення клітин (А1), антидіурез (А1) та інгібування вивільнення реніну (А1). Відповідні терапевтичні застосування сполук за винаходом включають застосування сполук, що пропонуються як діуретики, натрійуретики, препаратів при калієвій недостатності, для захисту нирок/профілактики гострої ниркоподібної недостатності, антигіпертензивного, протинабряклого і протинефритного агентів. Респіраторна дія включає розширення бронхів (А2), звуження бронхів (А1), хронічне обструктивне захворювання легень, алергічний риніт, слизові виділення і утискування дихання (А2). Відповідні терапевтичні застосування сполук за винаходом включають протиастматичні застосування, лікування захворювання легень після трансплантації і респіраторних захворювань. Імунологічна дія включає придушення імунітету (А2), нейтрофільний хемотаксис (А1), нейтрофільне генерування супероксиду (А2а) і дегрануляцію тучни х клітин (А2b і А3). Терапевтичне застосування антагоністів включає алергічне і неалергічне запалення, наприклад, вивільнення гістаміну та інших запальних медіаторів. Шлунково-кишкова дія включає інгібування виділення кислоти (А1), терапевтичне застосування може включати рефлюкс і виразкові захворювання. Шлунково-кишкова дія також включає захворювання прямої кишки, тонкого кишечника і діарею, наприклад, діарею, пов'язану із запаленням кишечнику (А2b). Очні захворювання включають захворювання, пов'язані з пошкодженням і травмою сітківки і головного зорового нерва (А3). У переважному варіанті здійснення очне захворювання являє собою глаукому. Інші терапевтичні застосування сполук за винаходом включають лікування ожиріння (ліполітичні властивості), підвищений тиск, лікування депресії, седативну, нейролептичну дію, і дію як протилепрозні і проносні засоби, що, наприклад, впливають на рухливість, але не викликають діарею. Мається на увазі, що термін «хворобливий стан» включає ті стани, які викликані або пов'язані з небажаними рівнями аденозину, активністю аденілилциклази, підвищеною фізіологічною активністю, пов'язаною з аномальною стимуляцією аденозинових рецепторів і/або підвищенням цАМФ. В одному варіанті здійснення хворобливий стан являє собою, наприклад, астму, хронічне обструктивне захворювання легень, алергічний риніт, бронхіт, ниркові захворювання, шлунково-кишкові захворювання або очні захворювання. Додаткові приклади включають хронічний бронхіт і циститний фіброз. Відповідні приклади запальних захворювань включають нелімфоцитну лейкемію, ішемію міокарда, стенокардію, інфаркт, церебрально-васкулярну ішемію, переміжну кульгавість, критичне недокрів'я кінцівок, венозну гіпертензію, варикозне захворювання вен, виразкове захворювання вен і артеріосклероз. Погіршені реперфузійні стани включають, наприклад, будь-яку постхірургічн у травму, як наприклад при відновній хірургії, тромболізі і ангіопластиці. Мається на увазі, що вираз «лікування стану, що дає реакцію у відповідь на N-6 заміщений 7дезазапурин», або «проведення курсу лікування стану, що дає реакцію у відповідь на N-6 заміщений 7дезазапурин», включає такі зміни у захворюванні або хворобливому стані, як описано вище, що фізіологічні симптоми у ссавця можуть бути значно зменшені або зведені до мінімуму. Вираз також включає контролювання, профілактику або інгібування фізіологічних симптомів або дій, пов'язаних з аномальною кількістю аденозину. В одному переважному варіанті здійснення, контролювання захворювання або хворобливого стану полягає у викорінюванні захворювання або хворобливого стану. В іншому переважному варіанті здійснення, контролювання є селективним таким чином, що контролюються аномальні рівні активності аденозинового рецептора, тоді як інші фізіологічні системи і параметри не зачіпаються. Мається на увазі, що термін «N-6 заміщені 7-дезазапурини» є загальноприйнятим в даній області і включає сполуки, які мають формулу І: «N-заміщений 7-дезазапурин» включає його фармацевтично прийнятні солі і, в одному варіанті здійснення, також включає деякі описані тут N-6 заміщені пурини. У деяких варіантах здійснення N-6 заміщений 7-дезазапурин не є N-6 бензил або N-6 фенілетил заміщеним. В інших варіантах здійснення R4 не є бензил або фенілетил заміщеним. У переважних варіантах здійснення обидва R1 і R2 не є атомами водню. Ще в інших переважних варіантах здійснення R3 не є атомом водню. Вираз «терапевтично ефективна кількість» N-6 заміщеного 7-дезазапурину, описаного нижче, являє собою таку кількість терапевтичної сполуки, яка є необхідною або достатньою для виконання призначеної функції в організмі ссавця, наприклад, для лікування стану, що дає реакцію у відповідь на N-6-заміщений 7дезазапурин, або захворювання у ссавця. Ефективна кількість терапевтичної сполуки може змінюватись відповідно до таких факторів як кількість збудника захворювання, вже присутнього у ссавці, вік, стать і вага ссавця і здатність терапевтичних сполук за даним винаходом впливати на стан, що дає реакцію у відповідь на N-6-заміщений 7-дезазапурин, у ссавця. Звичайний фахівець в даній області буде здатний дослідити вищезгадані фактори і визначити ефективну кількість терапевтичної сполуки без надмірного експериментування. Для визначення «ефективної кількості» описаних вище терапевтичних сполук також можна використати аналіз in vitro або in vi vo. Звичайний фахівець вибере відповідну кількість терапевтичної сполуки для використання у вищезгаданому аналізі або як терапевтичне лікування. Терапевтично ефективна кількість переважно зменшує принаймні один симптом або дію, пов'язану зі станом, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин, або із захворюванням, що піддається лікуванню, принаймні приблизно на 20% (більш переважно принаймні приблизно на 40%, ще більш переважно принаймні приблизно на 60% і ще більш переважно принаймні приблизно на 80%) у порівнянні з суб'єктом, що не піддається лікуванню. Фахівцем в даній області можуть бути розроблені аналізи для вимірювання зниження таких симптомів і/або дій. Мається на увазі, що будь-який відомий в даній області аналіз, здатний вимірювати такі параметри, включений як частина даного винаходу. Наприклад, якщо астма є станом, що піддається лікуванню, то об'єм повітря, що витрачається легенями суб'єкта, може бути виміряний до і після лікування для вимірювання збільшення об'єму з використанням відомих методик в даній області. Аналогічно, якщо запалення є станом, що піддається лікуванню, то площа, яка запалена, може бути виміряна до і після лікування для вимірювання зменшення запаленої площі з використанням відомих методик в даній області. Термін «клітина» включає як прокаріотичні, так і еукаріотичні клітини. Термін «тварина» включає будь-який організм, що містить аденозинові рецептори, або будь-який організм, сприйнятливий до стану, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин. Приклади тварин включають дріжджі, ссавців, рептилій і птахів. Термін також включає трансгенних тварин. Термін «ссавець» є загальноприйнятим в даній області, і, мається на увазі, що він включає тварину, більш переважно теплокровну тварину, найбільш переважно велику рогату худобу, овець, свиней, коней, собак, кішок, щурів, мишей і людей. Ссавці, сприйнятливі до стану, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин, наприклад, до запалення, емфіземи, астми, захворювання центральної нервової системи або гострого респіраторного дистрес-синдрому, включені як частина даного винаходу. В іншому аспекті даний винахід охоплює способи модулювання аденозинового рецептора(ів) у ссавця шляхом введення ссавцеві терапевтично ефективної кількості N-6 заміщеного 7-дезазапурину, таким чином, що відбувається модулювання аденозинового рецептора у ссавця. Відповідні аденозинові рецептори включають сімейство А1, А2 або А3. У переважному варіанті здійснення N-6 заміщений 7дезазапурин є антагоністом аденозинового рецептора. Мається на увазі, що вираз «модулювання аденозинового рецептора» включає ті випадки, де сполука взаємодіє з аденозиновим рецептором(ами), викликаючи підвищену, знижену або аномальну фізіологічну активність, пов'язану з аденозиновим рецептором або подальшими каскадними ефектами, що є результатом модулювання аденозинового рецептора. Фізіологічна активність, пов'язана з аденозиновими рецепторами, включає індукування заспокоєння, розширення судин, придушення частоти серцевих скорочень, інгібування агрегації тромбоцитів, стимуляцію глюконеогенезу, інгібування ліполізу, розкриття кальцієвих каналів, зменшення потоку через кальцієві канали і т.д. Мається на увазі, що терміни «модулювати», « що модулює» і «модулювання» включають запобігання, корекцію або інгібування одержаного зростання небажаної фізіологічної активності, пов'язаної з аномальною стимуляцією аденозинового рецептора, наприклад, в контексті терапевтичних способів за винаходом. В іншому варіанті здійснення термін «модулювання» включає антагоністичні ефекти, наприклад, зменшення активності або продукування алергічних медіаторів і алергічного запалення, яке виникає при понадстимуляції аденозинового рецептора(ів). Наприклад, терапевтичні дезазапурини за винаходом можуть взаємодіяти з аденозиновим рецептором для інгібування, наприклад, активності аденілатциклази. Мається на увазі, що вираз «стан, який характеризується аномальною активністю рецептора» включає ті захворювання, порушення або хворобливі стани, які пов'язані з аномальною стимуляцією аденозинового рецептора, в яких стимуляція рецептора викликає біохімічний або фізіологічний ланцюг подій, які безпосередньо або непрямо пов'язані із захворюванням, порушенням або хворобливим станом. Така стимуляція аденозинового рецептора не повинна бути єдиною причиною захворювання, порушення або хворобливого стану, але є тільки відповідальною за виклик деяких симптомів, типово пов'язаних із захворюванням, порушенням або хворобливим станом, що піддається лікуванню. Аномальна стимуляція рецептора може бути єдиним фактором або щонайменше один інший агент може бути включений у стан, що піддається лікуванню. Приклади станів включають ті захворювання, які перераховані раніше, включаючи запалення, шлунково-кишкові захворювання і ті симптоми, які виявляються через підвищену активність аденозинового рецептора. Переважні приклади включають ті симптоми, які пов'язані з астмою, алергічним ринітом, хронічним обструктивним захворюванням легень, емфіземою, бронхітом, шлунково-кишковими захворюваннями і глаукомою. Мається на увазі, що вираз «проведення курсу лікування або лікування стану, який характеризується аномальною активністю аденозинового рецептора» включає ослаблення або зменшення вияву принаймні одного симптому, пов'язаного із захворюванням. Лікування також включає полегшення або зменшення вияву більше ніж одного симптому. Переважно, лікування виліковує, наприклад, по суті виключає симптоми, пов'язані із захворюванням. Даний винахід відноситься до сполуки, N-6 заміщених 7-дезазапуринів, що мають формулу І: де кожний з R1 і R2 незалежно являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент, або вони разом утворюють заміщене або незаміщене гетероциклічне кільце; R3 являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент; R4 являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент. Кожний з R 5 і R6 незалежно являє собою атом галогену, наприклад, хлор, фтор або бром, атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент, або R4 і R5, або R5 і R6 разом утворюють заміщене або незаміщене гетероциклічне або карбоциклічне кільце. Також включені фармацевтично прийнятні солі N-6 заміщених 7-дезазапуринів. У деяких варіантах здійснення кожний з R 1 і R2 незалежно може являти собою заміщений або незаміщений циклоалкільний або гетероарилалкільний фрагмент. В іншому варіанті здійснення R3 являє собою атом водню або заміщений або незаміщений гетероарильний фрагмент. Ще в інших варіантах здійснення кожний з R4, R5 і R6 може незалежно являти собою гетероарильний фрагмент. В одному варіанті здійснення R1 являє собою атом водню, R2 являє собою заміщений або незаміщений циклогексановий, циклопентильний, циклобутильний або циклопропановий фрагмент, R3 являє собою заміщений або незаміщений фенільний фрагмент, R4 являє собою атом водню, і обидва R5 і R6 являють собою метил. В іншому варіанті здійснення R2 являє собою циклогексанол, циклогександіол, циклогексилсульфонамід, циклогексанамід, циклогексиловий складний ефір, циклогексен, циклопентанол або циклопентандіол, і R3 являє собою фенільний фрагмент. Ще в одному варіанті здійснення R1 являє собою атом водню, R2 являє собою циклогексанол, R3 являє собою заміщений або незаміщений фенільний, піридиновий, фурановий, циклопентановий або тіофеновий фрагмент, R4 являє собою атом водню, заміщений алкільний, арильний або арилалкільний фрагмент, кожний з R5 і R6 незалежно являє собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент. Ще в одному варіанті здійснення R1 являє собою атом водню, R2 являє собою заміщений або незаміщений алкіламін, ариламін або алкілариламін, заміщений або незаміщений алкіламід, ариламід або алкілариламід, заміщений або незаміщений алкілсульфонамід, арилсульфонамід або алкіларилсульфонамід, заміщений або незаміщений алкілсечовину, арилсечовину або алкіларилсечовину, заміщений або незаміщений алкілкарбамат, арилкарбамат або алкіларилкарбамат, заміщений або незаміщений алкілкарбонову кислоту, арилкарбонову кислоту або алкіларилкарбонову кислоту, R3 являє собою фенільний фрагмент, R4 являє собою атом водню, і R5 і R6 являють собою метильні групи. У наступному варіанті здійснення R2 являє собою гуанідин, модифікований гуанідин, ціаногуанідин, тіосечовину, тіоамід або амідин. В одному варіанті здійснення R2 може являти собою де R2a-R2c кожний незалежно являють собою атом водню або насичений або ненасичений алкільний, арильний або алкіларильний фрагмент, і R2d являє собою атом водню або насичений або ненасичений алкіл, арильний або алкіларильний фрагмент, NR 2eR2f або OR2g , де R2e-R2g кожний незалежно являє собою атом водню або насичений або ненасичений алкільний, арильний або алкіларильний фрагменти. Альтернативно, R2a і R2b можуть разом утворювати карбоциклічне або гетероциклічне кільце, що має розмір кільця від 3 до 6 членів, наприклад, циклопропільну, циклопентильну, циклогексильну групи. В одному аспекті винаходу обидва R5 і R« не є метильними групами, переважно один з R5 і R6 являє собою алкільну груп у, наприклад, метильну гр упу, а інший є атомом водню. В іншому аспекті винаходу, коли R4 являє собою 1-фенілетил, і R1 являє собою атом водню, тоді R3 не є фенілом, 2-хлорфенілом, 3-хлорфенілом, 4-хлорфенілом, 3,4-дихлорфенілом, 3-метоксифенілом або 4метоксифенілом, або коли R4 і R1 являють собою 1-фенілетил, тоді R3 не є атомом водню, або коли R 4 являє собою атом водню, і R3 являє собою феніл, тоді R1 не є фенілетилом. В іншому аспекті винаходу, коли R5 і R6 разом утворюють карбоциклічне кільце, наприклад, або піримідо[4,5-6]індол, тоді R3 не є фенілом, коли R4 являє собою 1-(4-метилфеніл)етил, фенілізопропіл, феніл або 1-фенілетил, або R3 не є атомом водню, коли R4 являє собою 1-фенілетил. Карбоциклічне кільце, утворене R5 і R6, може бути або ароматичним, або аліфатичним і може містити від 4 до 12 атомів вуглецю, наприклад, нафтил, фенілциклогексил і т.д., переважно від 5 до 7 атомів вуглецю, наприклад, циклопентил або циклогексил. Альтернативно, R5 і R6 разом можуть утворювати гетероциклічне кільце, таке як такі, що обговорюються нижче. Типові гетероциклічні кільця включають від 4 до 12 атомів вуглецю, переважно від 5 до 7 атомів вуглецю і може бути або ароматичним, або аліфатичним. Гетероциклічне кільце може бути додатково заміщеним, включаючи заміщення біля одного або декількох атомів вуглецю кільцевої структури, що містить один або декілька гетероатомів. Ще в одному аспекті винаходу, R1 і R2 утворюють гетероциклічне кільце. Ілюстративні приклади включають, але не обмежуються цим, перераховані нижче гетероциклічні кільця, такі як морфоліно, піперазин і тому подібні, наприклад, 4-гідроксипіперидини, 4-амінопіперидини. Коли R 1 і R2 разом утворюють піперазино групу, то R7 може являти собою атом водню або заміщений або незаміщений алкільний, арильний або алкіларильний фрагмент. Ще в одному аспекті винаходу, R4 і R 5 разом можуть утворювати гетероциклічне кільце, наприклад, де гетероциклічне кільце може бути або ароматичним або аліфатичним і можуть утворювати кільце, що містить від 4 до 12 атомів вуглецю, наприклад, нафтил, фенілциклогексил і т.д. і може бути або ароматичним, або аліфатичним, наприклад, циклогексил, циклопентил. Гетероциклічне кільце може бути додатково заміщеним, включаючи заміщення біля атомів вуглецю кільцевої структури, що містить один або декілька гетероатомів. Альтернативно, R4 і R5 разом можуть утворювати гетероциклічне кільце, таке як такі, що обговорюються нижче. У деяких варіантах здійснення N-6 заміщений 7-дезазапурин не є N-6-бензил або N-6фенілетилзаміщеним. У інших варіантах здійснення R4 не є бензил- або фенілетил-заміщеним. У переважних варіантах здійснення обидва R1 і R2 не є атомами водню. Ще в інших переважних варіантах здійснення R3 не є Н. Сполуки винаходу можуть включати водорозчинні проліки, які описані у W099/33815, Міжнародній заявці на патент № PCT/US98/04595, поданій 9 березня, 1998 року і опублікованій 8 липня 1999. Повний зміст W099/33815 спеціально включений в даний опис як посилання. Водорозчинні проліки метаболізують in vi vo до активного лікарського засобу, наприклад, за допомогою каталізованого естеразою гідролізу. Приклади потенційних проліків включають дезазапурини, в яких, наприклад, R2 являє собою циклоалкіл, заміщений-C(O)(Z)NH2, де Ζ є бічним ланцюгом природної або синтетичної амінокислоти або її аналога, a-, b-, g-або w-амінокислот або дипептиду. Переважні бічні ланцюги включають бічні ланцюги гліцину, аланіну, валіну, лейцину, ізолейцину, лізину, a-метилаланіну, аміноциклопропанкарбонової кислоти, азетидин-2карбонової кислоти, β-аланіну, g-амінобутанової кислоти, аланін-аланіну або гліцин-аланіну. У наступному варіанті здійснення винахід відноситься до дезазапуринів формули (І), де R1 являє собою водень; R2 являє собою заміщений або незаміщений циклоалкіл, заміщений або незаміщений алкіл, або R 1 і R2 разом утворюють заміщене або незаміщене гетероциклічне кільце; R3 являє собою незаміщений або заміщений арил; R4 являє собою водень, і кожний з R5 і R6 незалежно являє собою водень або алкіл, і їх фармацевтично прийнятних солей. Дезазапурини даного варіанту здійснення потенційно можуть бути селективними антагоністами А3 рецептора. В одному варіанті здійснення R2 являє собою заміщений (наприклад, гідроксизаміщений) або незаміщений циклоалкіл. У переважному варіанті здійснення R1 і R4 являють собою водень, R3 являє собою незаміщений або заміщений феніл, і кожний з R5 і R6 являє собою алкіл. Переважно R2 являє собою моногідроксициклопентил або моно-гідроксициклогексил. R2 також може бути заміщений групою-NH-C(O)E, де Ε являє собою заміщений або незаміщений С1-С4алкіл (наприклад, алкіламін, наприклад, етиламін). Також R1 і R2 разом можуть утворювати заміщене або незаміщене гетероциклічне кільце, яке може бути заміщене аміном або ацетамідо групою. В іншому аспекті, R2 може являти собою-A-NH-C(O)B, де А являє собою незаміщений С 1-С4 алкіл (наприклад, етил, пропіл, бутил), і В являє собою заміщений або незаміщений С 1-С4 алкіл (наприклад, метил, аміноалкіл, наприклад, амінометил або аміноетил, алкіламіно, наприклад, метиламіно, етиламіно), переважно, коли R1 і R4 являють собою водень, R3 являє собою незаміщений або заміщений феніл, і кожний з R5 і R6 являє собою алкіл. В може являти собою заміщений або незаміщений циклоалкіл, наприклад, циклопропіл або 1-аміноциклопропіл. В іншому варіанті здійснення R3 може являти собою заміщений або незаміщений феніл, переважно, коли кожний з R5 і R6 являє собою алкіл. Переважно R3 може містити один або декілька замісників (наприклад, о-, м- або п-хлорфеніл, о-, м- або п-фторфеніл). Переважно, R3 може являти собою заміщений або незаміщений гетероарил, переважно, коли кожний з R5 і R6 являє собою алкіл. Приклади гетероарильних груп включають піридил, піримідил, піридазиніл, піразиніл, піроліл, триазоліл, тіоазоліл, оксазоліл, оксадіазоліл, фураніл, метилендіоксифеніл і тіофеніл. Переважно, R3 являє собою 2-піридил, 3-піридил, 4-піридил, 2-піримідил або 3-піримідил. Переважно в одному варіанті здійснення кожний з R 5 і R6 являє собою водень. В іншому варіанті здійснення кожний з R5 і R6 являє собою метил. В особливо переважному варіанті здійснення дезазапурини за винаходом являють собою розчинні у воді проліки, які можуть метаболізувати in vivo до активного лікарського засобу, наприклад, за допомогою каталізованого естеразою гідролізу. Переважно проліки включають R2 груп у, яка заміщена у циклоалкіліOC(O)(Z)NH2, де Ζ являє собою бічний ланцюг природної або синтетичної амінокислоти, її аналога, a-, b-, gабо w- амінокислоти або дипептиду. Приклади переважних бічних ланцюгів включають бічні ланцюги гліцину, аланіну, валіну, лейцину, ізолейцину, лізину, a-метилаланіну, аміноциклопропанкарбонової кислоти, азетидин-2-карбонової кислоти, β-аланіну, g-амінобутанової кислоти, аланін-аланіну або гліциналаніну. В особливо переважному варіанті здійснення Ζ являє собою бічний ланцюг гліцину, R2 являє собою циклогексил, R3 являє собою феніл, і R5 і R6 являють собою метил. В іншому варіанті здійснення дезазапурин являє собою 4-(цис-3-гідроксициклопентил)аміно-5,6диметил-2-феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою сіль трифтороцтової кислоти 4-(цис-3-(2аміноацетокси)циклопентил)аміно-5,6-диметил-2-феніл-7Н-піроло[2,3-d]піримідину. В іншому варіанті здійснення дезазапурин являє собою 4-(3-ацетамідо)піперидиніл-5,6-диметил-2феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(2-Ν'-метилуреапропіл)аміно-5,6-диметил-2феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(2-ацетамідобутил)аміно-5,6-диметил-2феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(2-Ν'-метилуреабутил)аміно-5,6-диметил-2феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(2-амшоциклопропілацетамідоетил)аміно-2феніл-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(транс-4-гідроксициклогексил)аміно-2-(3хлорфеніл)-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(транс-4-гідроксициклогексил)аміно-2-(3 фтор феніл)-7Н-піроло[2,3-d]піримідин. В іншому варіанті здійснення дезазапурин являє собою 4-(транс-4-гідроксициклогексил)аміно-2-(4піридил)-7Н-піроло[2,3-d]піримідин. Ще в одному варіанті здійснення винахід відноситься до способу інгібування активності аденозинового рецептора (наприклад, А1,А2а , А2b або переважно А3) у клітині контактуванням клітини з Ν-6 заміщеним 7дезазапурином (наприклад, переважно, з антагоністом аденозинового рецептора). В іншому аспекті винахід відноситься до способу лікування пошкодження ока у тварини (наприклад, людини) введенням тварині ефективної кількості Ν-6 заміщеного 7-дезазапурину. Переважно N-6 заміщений 7-дезазапурин є антагоністом А3 аденозинових рецепторів у клітинах тварин. Пошкодження відноситься до сітківки або головного зорового нерва і може бути гострим або хронічним. Пошкодження може бути результатом, наприклад, глаукоми, набряку, ішемії, гіпоксії або травми. У переважному варіанті здійснення винахід відноситься до дезазапурину, що має формулу II, див. вище, де X являє собою N або CR6; кожний з R1 і R2 незалежно являє собою водень або заміщений або незаміщений алкокси, аміноалкіл, алкіл, арил або алкіларил, або разом вони утворюють заміщене або незаміщене гетероциклічне кільце, за умови, що обидва R1 і R2 не є воднем; R3 являє собою заміщений або незаміщений алкіл, арилалкіл або арил; R4 являє собою водень або заміщений або незаміщений С 1-С6 алкіл; L являє собою водень, заміщений або незаміщений алкіл, або R4 і L разом утворюють заміщене або незаміщене гетероциклічне або карбоциклічне кільце; R6 являє собою водень, заміщений або незаміщений алкіл, або галоген; Q являє собою СН2, О, S або NR7, де R7 являє собою водень або заміщений або незаміщений С1-С6 алкіл; і W являє собою незаміщений або заміщений алкіл, циклоалкіл, алкініл, арил, арилалкіл, біарил, гетероарил, заміщений карбоніл, заміщений тіокарбоніл або заміщений сульфоніл, за умови, що якщо R3 являє собою піролідино, то R4 не є метилом. В одному варіанті сполуки формули II, X являє собою CR6, і Q являє собою СН2, О, S або NH. В іншому варіанті здійснення X являє собою N. У наступному варіанті сполук формули II, W являє собою заміщений або незаміщений арил, 5- або 6членний гетероарил або біарил. W може бути заміщений одним або декількома замісниками. Приклади замісників включають: галоген, гідрокси, алкокси, аміно, аміноалкіл, амінокарбоксіамід, CN, CF3, CO2R8, CONHR8, COR8R9, SOR8 і SO2NR8R9, де кожний з R8 і R9 незалежно являє собою водень або заміщений або незаміщений алкіл, циклоалкіл, арил або арилалкіл. Переважно, W може являти собою заміщений або незаміщений феніл, наприклад, метилендіоксифеніл. W також може являти собою заміщене або незаміщене 5-членне гетероарильне кільце, наприклад, пірол, піразол, оксазол, імідазол, триазол, тетразол, фуран, тіофен, тіазол і оксадіазол. Переважно W може являти собою 6-членне гетероарильне кільце, наприклад, піридил, піримідил, піридазиніл, піразиніл і тіофеніл. У переважному варіанті здійснення W являє собою 2-піридил, 3-піридил, 4-піридил, 2-піримідил, 4-піримідил або 5-піримідил. В одному переважному варіанті сполук формули II, Q являє собою NH, і W являє собою 3-піразольне кільце, яке є незаміщеним або N-заміщеним або не заміщеним алкілом, циклоалкілом, арилом або арилалкілом. В іншому варіанті сполук формули II, Q являє собою кисень, і W являє собою 2-тіазольне кільце, яке є незаміщеним або заміщеним або не заміщеним алкілом, циклоалкілом, арилом або арилалкілом. В іншому варіанті сполук формули II, W являє собою заміщений або незаміщений алкіл, циклоалкіл, наприклад, циклопентил або арилалкіл. Приклади замісників включають галоген, гідрокси, заміщений або незаміщений алкіл, циклоалкіл, арил, арилалкіл або NHR10, де R10 являє собою водень або заміщений або незаміщений алкіл, циклоалкіл, арил або арилалкіл. Ще в одному варіанті здійснення винахід відноситься до дезазапурину формули II, де W являє собою-(CH2)a-C(=O) Υ або-(CH2)a-C(=S)Y, і а являє собою ціле число від 0 до 3, Υ являє собою арил, алкіл, арилалкіл, циклоалкіл, гетероарил, алкініл, NHR11R12, або, за умови, що Q являє собою NH, OR13, де кожний з R11, R12 і R13 незалежно являє собою водень або незаміщений або заміщений алкіл, арил, арилалкіл або циклоалкіл. Переважно Υ являє собою 5- або 6членне гетероарильне кільце. Крім того, W може являти собою- (CH 2)b-S(=O)jY, де j дорівнює 1 або 2, b дорівнює 0, 1, 2 або 3, Υ являє собою арил, алкіл, арилалкіл, циклоалкіл, алкініл, гетероарил, NHR14R15, або, за умови, що коли b дорівнює 1, Q являє собою СН2, і де кожний з R14, R15 і R10 незалежно являє собою водень або незаміщений або заміщений алкіл, арил, арилалкіл або циклоалкіл. В іншому варіанті здійснення, R3 вибирають з групи, що включає заміщений або незаміщений феніл, піридил, піримідил, піридазиніл, піразинал, піроліл, триазоліл, тіазоліл, оксазоліл, оксадіазоліл, піразоліл, фураніл, метилендіоксифеніл і тіофеніл. Коли R3 являє собою феніл, він може бути заміщеним, наприклад, гідроксилом, алкокси (наприклад, метокси), алкілом (наприклад, толіл) і галогеном (наприклад, о-, м- або пфтор феніл або о-, м- або п-хлорфеніл). Переважно, R3 може являти собою 2-, 3- або 4-піридил або 2- або 3-піримідил. Винахід також включає дезазапурин, в якому R6, являє собою водень або С 1-С3 алкіл. Переважно, R6 являє собою водень. Винахід також включає дезазапурини, в яких R1 являє собою водень, і R2 являє собою заміщений або незаміщений алкіл або алкокси, заміщений або незаміщений алкіламін, ариламін або алкілариламін, заміщений або незаміщений аміноалкіл, аміноарил або аміноалкіларил, заміщений або незаміщений алкіламід, ариламід або алкілариламід, заміщений або незаміщений алкілсульфонамід, арилсульфонамід або алкіларилсульфонамід, заміщений або незаміщений алкілсечовину, арилсечовину або алкіларилсечовину, заміщений або незаміщений алкілкарбамат, арилкарбамат або алкіларилкарбамат, або заміщений або незаміщений алкілкарбонову кислоту, арилкарбонову кислоту або алкіларилкарбонову кислоту. Переважно, R2 являє собою заміщений або незаміщений циклоалкіл, наприклад, моно- або дигідроксизаміщений циклогексил або циклопентил (переважно моногідроксизаміщений циклогексил або моногідроксизаміщений циклопентил). Переважно R2 може мати одну з наступних формул: де А являє собою С1-С6 алкіл, С3-С7 циклоалкіл, ланцюг з одного-семи атомів або кільце з трьох-семи атомів, необов'язково заміщене С 1-С6 алкілом, галогенами, гідроксилом, карбоксилом, тіолом або аміногрупами; де В являє собою метил, N(Me)2, N(Et)2, NHMe, NHEt, (CH2)2NH3+, NH(CH2)2CH3, (CH2)=2=NH2, (CH2)2CHCH3NH2, (CH 2)2NHMe, (CH2)2OH, CH2CN, (CH2)mCO2H, CHR18R19 або СНМеОН, де r є цілим числом від 0 до 2, m дорівнює 1 або 2, R18 являє собою алкіл, R19 являє собою NH3+ або СО2Н, або R18 і R19 разом являють собою: де p дорівнює 2 або 3; і R17 являє собою С 1-С6 алкіл, С3-С7 циклоалкіл, ланцюг з одного-семи атомів або кільце з трьох-семи атомів, необов'язково заміщене С 1-С6 алкілом, галогенами, гідроксилом, карбоксилом, тіолом або аміногрупами. Переважно, А являє собою незаміщений або заміщений С1-С6 алкіл. В може являти собою незаміщений або заміщений С1-С6 алкіл. У переважному варіанті здійснення R2 має формулу-A-NHC(=O)B. В особливо переважному варіанті здійснення А являє собою-СН 2СН2-, і В являє собою метил. Сполуки за винаходом можуть включати розчинні у воді проліки, які метаболізують in vivo в активний лікарський засіб, наприклад, за допомогою гідролізу, каталізованого естеразою. Приклади потенційних проліків включають дезазапурини, в яких, наприклад, R2 знаходиться у вигляді циклоалкілу, заміщеногоOC(O)(Z)NH2, де Ζ являє собою бічний ланцюг існуючої у природі або не існуючої у природі амінокислоти або її аналога, a-, b-, g- або w-аміноксилоти або дипептиду. Переважні бічні ланцюги амінокислот включають ланцюги гліцину, аланіну, валіну, лейцину, ізолейцину, лізину, a-метилаланіну, аміноциклопропанкарбонової кислоти, азетидин-2-карбонової кислоти, β-аланіну, g-аміномасляної кислоти, аланін-аланіну або гліцин-аланіну. В іншому варіанті здійснення R1 і R2 разом являють собою де n дорівнює 1 або 2, і де кільце необов'язково може бути заміщеним одним або декількома гідроксилом, аміно, тіолом, карбоксилом, галогеном, СН2ОН, СН2NНС(=О)алкільною або СН2NНС(=O)NНалкільною групами. Переважно n дорівнює 1 або 2, і вказане кільце заміщене NНС(=О)алкілом. В одному переважному варіанті здійснення R1 являє собою водень, R2 являє собою заміщений або незаміщений С1-С6 алкіл, R3 являє собою заміщений або незаміщений феніл, R4 являє собою водень, L являє собою водень або заміщений або незаміщений С 1-С6 алкіл, Q являє собою О, S або NR7, де R7 являє собою водень або заміщений або незаміщений С 1-С6 алкіл, і W являє собою заміщений або незаміщений арил. Переважно R2 являє собою-A-NHC(=O)B, де кожний з А і В незалежно являє собою незаміщений або заміщений С 1-С4 алкіл. Наприклад, А може являти собою СН2СН2. В може являти собою, наприклад, алкіл (наприклад, метил) або аміноалкіл (наприклад, амінометил). Переважно, R3 являє собою незаміщений феніл, і L являє собою водень. R6 може являти собою метил або, переважно, водень. Переважно, Q являє собою О, S або NR7, де R7 являє собою водень або заміщений або незаміщений С 1-С6 алкіл, наприклад, метил. W являє собою незаміщений або заміщений феніл (наприклад, алкокси-, галоген-заміщений). Переважно, W являє собою п-фторфеніл, п-хлорфеніл або п-метоксифеніл. W також може являти собою гетероарил, наприклад, 2-піридил. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6феноксиметил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(4-фторфенокси)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(4-хлорфенокси)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(4-метоксифенокси)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(2-піридилокси)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(N-феніламіно)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-ацетиламіноетил)аміно-6(N-метил-N-феніламіно)метил-2-феніл-7Н-піроло[2,3-d]піримідин. В особливо переважному варіанті здійснення дезазапурин являє собою 4-(2-N'-метилуреаетил)аміно-6феноксиметил-2-феніл-7Н-піроло[2,3-d]піримідин. Далі винахід відноситься до способу інгібування активності аденозинового рецептора (наприклад, А2b аденозинового рецептора) у клітині контактуванням клітини зі сполукою за винаходом. Переважно сполука є антагоністом аденозинового рецептора. Винахід також відноситься до способу лікування шлунково-кишкового захворювання (наприклад, діареї) у тварини шляхом введення тварині ефективної кількості сполуки за винаходом (наприклад, антагоніста А2b). Переважно тварина являє собою людину. В іншому варіанті здійснення винахід відноситься до фармацевтичної композиції, що містить N-6 заміщений 7-дезазапурин за винаходом і фармацевтично прийнятний носій. Винахід також відноситься до способу лікування хворобливого стану, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин у тварини шляхом введення ссавцеві терапевтично ефективної кількості дезазапурину за винаходом, таким чином, що відбувається лікування стану, що дає реакцію у відповідь на N-6 заміщений 7-дезазапурин у тварини. Переважно, захворювання може являти собою порушення, опосередковане аденозином. Приклади переважних хворобливих станів включають: порушення центральної нервової системи, серцево-судинні захворювання, ниркові захворювання, запальні захворювання, алергічні захворювання, шлунково-кишкові захворювання, очні захворювання і захворювання дихальних шля хів. Термін «алкіл» відноситься до радикалу насичених аліфатичних гр уп, включаючи лінійні алкільні групи, розгалужені алкільні групи, циклоалкільні (аліциклічні) групи, алкілзаміщені циклоалкільні групи і циклоалкілзаміщені алкільні групи. Термін алкіл додатково включає алкільні групи, які можуть додатково включати атоми кисню, азоту, сірки або фосфору, що заміняють один або декілька вуглеводів в основному вуглеводневому ланцюгу, наприклад, атоми кисню, азоту, сірки або фосфору. У переважних варіантах здійснення алкіл з лінійним або розгалуженим ланцюгом містить 30 або менше атомів вуглецю в основному ланцюгу (наприклад, С1-СЗО для лінійного ланцюга, С3-С30 для розгалуженого ланцюга) і, більш переважно, 20 або менше. Аналогічно, переважні циклоалкіли мають 4-10 атомів вуглецю у своїй кільцевій структурі і, більш переважно, мають 5, 6 або 7 вуглеводів в кільцевій структурі. Більш того мається на увазі, що термін алкіл, як він використаний в описі і формулі винаходу, включає як «незаміщені алкіли», так і «заміщені алкіли», останні відносяться до алкільних фрагментів, що мають замісники, які замінюють водень у одного або декількох вуглеводів в основному вуглеводневому ланцюгу. Такі замісники можуть включати, наприклад, галоген, гідроксил, алкілкарбонілокси, арилкарбонілокси, алкоксикарбонілокси, арилоксикарбонілокси, карбоксилат, алкілкарбоніл, алкоксикарбоніл, амінокарбоніл, алкілтіокарбоніл, алкоксил, фосфат, фосфонато, фосфінато, ціано, аміно (включаючи алкіламіно, діалкіламіно, ариламіно, діариламіно і алкілариламіно), ациламіно (включаючи алкілкарбоніламіно, арилкарбоніламіно, карбамоїл і уреїдо), амідино, іміно, сульфгідрил, алкілтіо, арилтіо, тіокарбоксилат, сульфати, сульфонато, сульфамоїл, суль фонамідо, нітро, трифторметил, ціано, азидо, гетероцикліл, алкіларил або ароматичний або гетероароматичний фрагмент. Фахівцям в даній області потрібно розуміти, що фрагменти, розташовані як замісники у вуглеводневому ланцюгу, самі можуть бути заміщеними, якщо це можливо. Циклоалкіли додатково можуть бути заміщеними, наприклад, описаними вище замісниками. «Алкіларильний фрагмент» являє собою алкіл, заміщений арилом (наприклад, фенілметил (бензил)). Термін «алкіл» також включає ненасичені аліфатичні групи, аналогічні по своїй довжині і можливому заміщенню описаним вище алкілам, але також які містять принаймні один подвійний або потрійний зв'язок, відповідно. Термін «арил», як він використаний у даному описі, відноситься до арильного радикалу, включаючи 5- і 6-членні ароматичні групи, що складаються з одного кільця, які можуть включати від нуля до чотирьох гетероатомів, наприклад, бензол, пірол, фуран, тіофен, імідазол, бензоксазол, бензотіазол, триазол, тетразол, піразол, піридин, піразин, піридазин і піримідин і тому подібні. Арильні групи також включають поліциклічні конденсовані ароматичні групи, такі як нафтил, хіноліл, індоліл і тому подібні. Ті арильні групи, які мають гетероатоми в кільцевій структурі, також можуть згадуватись як «арильні гетероцикли», «гетероарили» або «гетероароматичні» групи. Ароматичне кільце може бути заміщеним в одному або декількох положеннях кільця такими замісниками, як описано вище, як наприклад, галоген, гідроксил, алкокси, алкілкарбонілокси, арилкарбонілокси, алкоксикарбонілокси, арилоксикарбонілокси, карбоксилат, алкілкарбоніл, алкоксикарбоніл, амінокарбоніл, алкілтіокарбоніл, фосфат, фосфонато, фосфінато, ціано, аміно (включаючи алкіламіно, діалкіламіно, ариламіно, діариламіно і алкілариламіно), ациламіно (включаючи алкілкарбоніламіно, арилкарбоніламіно, карбамоїл і уреїдо), амідино, іміно, сульфгідрил, алкілтіо, арилтіо, тіокарбоксилат, сульфати, сульфонато, сульфамоїл, сульфонамідо, нітро, трифторметил, ціано, азидо, гетероцикліл, алкіларил або ароматичний або гетероароматичний фрагмент. Арильні групи також можуть бути конденсованими або пов'язані містками з аліциклічними або гетероциклічними кільцями, які не є ароматичними, що таким чином утворюють поліцикл (наприклад, тетралін). Термін «алкеніл» і «алкініл» відноситься до ненасичених аліфатичних гр уп, аналогічних по своїй довжині і можливому заміщенню описаним вище алкілам, але які також містять принаймні один подвійний або потрійний зв'язок, відповідно. Наприклад, у винаході розглядаються ціано і пропаргільні групи. Якщо число атомів вуглецю не вказане інакше, «нижчий алкіл», як використано у даному описі, означає алкільну груп у, як визначено вище, але яка містить від одного до десяти вуглеводів, більш переважно від одного до шести вуглеводів у структурі основного ланцюга, ще більш переважно від одного до трьох атомів вуглецю у структурі свого основного ланцюга. Аналогічно, «нижчий алкеніл» і «нижчий алкініл» мають аналогічну довжину ланцюга. Терміни «алкоксіалкіл», «поліаміноалкіл» і «тіоалкоксіалкіл» відносяться до алкільних груп, як описано вище, які додатково включають атоми кисню, азоту або сірки, що заміняють один або декілька вуглеводів у вуглеводневому основному ланцюгу, наприклад, атоми кисню, азоту або сірки. Терміни «поліцикліл» або «поліциклічні радикали» відносяться до радикалів, що складаються з двох або більше циклічних кілець (наприклад, циклоалкіли, циклоалкеніли, циклоалкініли, арили і/або гетероцикліли), в яких два або декілька вуглеводів є спільними для двох суміжних кілець, наприклад, кільця є «конденсованими кільцями». Кільця, які сполучені за допомогою несуміжних атомів, називаються «місточковими» кільцями. Кожне з кілець поліциклу може бути заміщене такими замісниками, як описане вище, такими як, наприклад, галоген, гідроксил, алкілкарбонілокси, арилкарбонілокси, алкоксикарбонілокси, арилоксикарбонілокси, карбоксилат, алкілкарбоніл, алкоксикарбоніл, амінокарбоніл, алкілтіокарбоніл, алкоксил, фосфат, фосфонато, фосфінато, ціано, аміно (включаючи алкіламіно, діалкіламіно, ариламіно, діариламіно і алкілариламіно), ациламіно (включаючи алкілкарбоніламіно, арилкарбоніламіно, карбамоїл і уреїдо), амідино, іміно, сульфгідрил, алкілтіо, арилтіо, тіокарбоксилат, сульфати, сульфонато, сульфамоїл, сульфонамідо, нітро, трифторметил, ціано, азидо, гетероциклил, алкіл, алкіларил або ароматичний або гетероароматичний фрагмент. Термін «гетероатом», як він використаний у даному описі, означає атом будь-якого елемента, відмінного від вуглецю або водню. Переважними гетероатомами є азот, кисень, сірка і фосфор. Термін «амінокислоти» включає природні і синтетичні амінокислоти, що виявляються в білках, такі як гліцин, аланін, валін, цистеїн, лейцин, ізолейцин, серин, треонін, метіонін, глутамінова кислота, аспартамова кислота, глутамін, аспарагін, лізин, аргінін, пролін, гістидин, фенілаланін, тирозин і триптофан. Аналоги амінокислот включають амінокислоти з подовженими або укороченими бічними ланцюгами або відмінними бічними ланцюгами з відповідними функціональними групами. Амінокислоти також включають D і L стереоізомери амінокислот, коли структура амінокислоти допускає існування стереоізомерних форм. Термін «дипептид» включає дві або декілька амінокислот, пов'язаних разом. Переважно, дипептиди являють собою дві амінокислоти, пов'язані пептидним зв'язком. Особливо переважні дипептиди включають, наприклад аланін-аланін або гліцин-аланін. Потрібно зазначити, що структура деяких сполук за даним винаходом включає асиметричні атоми вуглецю, і таким чином вони існують у вигляді рацематів і рацемічних сумішей, окремих енантіомерів, діастереомерних сумішей і індивідуальних діастереомерів. Всі такі ізомерні форми даних сполук включені в даний винахід. Кожний стереогенний вуглець може мати R або S конфігурацію. Відповідно, потрібно розуміти, що ізомери, які виникають при такій асиметрії (наприклад, всі енантіомери і діастереомери) включені в об'єм даного винаходу, якщо не указано іншого. Такі ізомери можуть бути одержані по суті в чистій формі за допомогою класичних способів розділення і шляхом стереохімічно селективного синтезу. Винахід додатково відноситься до фармацевтичних композицій для лікування станів, що дають реакцію у відповідь на N-6 заміщені 7-дезазапурини у ссавців, наприклад, респіраторних захворювань (наприклад, астма, бронхіт, хронічне обструктивне захворювання легень і алергічний риніт), ниркових захворювань, шлунково-кишкових захворювань і очних захворювань. Фармацевтична композиція включає терапевтично ефективну кількість N-6 заміщеного 7-дезазапурину, описаного вище, і фармацевтично прийнятний носій. Потрібно розуміти, що всі описані вище дезазапурини включені для терапевтичного лікування. Додатково потрібно розуміти, що дезазапурини за винаходом можна використати окремо або в поєднанні з іншими дезазапуринами за винаходом, або в поєднанні з додатковими терапевтичними сполуками, такими, наприклад, як антибіотики, протизапальні або протиракові агенти. Термін «антибіотик» є загальноприйнятим в даній області, і, передбачається, що він включає ті речовини, які продукуються зростаючими мікроорганізмами, і їх синтетичні похідні, які виключають або інгібують зростання патогенів і є селективно токсичними до патогенів, надаючи мінімальне або не надаючи шкідливого впливу на інфікованого суб'єкта-хазяїна. Відповідні прикладиантибіотиків включають, але не обмежуються цим, принципові класи аміноглікозидів, цефалоспоринів, хлорамфеніколів, фусцинових кислот, макролідів, пеніцилінів, поліміксинів, тетрациклінів і стрептоміцинів. Термін «протизапальний» є загальноприйнятим в даній області, і, передбачається, що він включає ті агенти, які впливають на механізми тіла без прямого антагонізування агента, що є причиною запалення, такі як глюкокортикоїди, аспірин, ібупрофен, НСПЗЗ (нестероїдні протизапальні засоби) і т.д. Термін «протираковий агент» є загальноприйнятим в даній області, і, передбачається, що він включає ті агенти, які зменшують, викорінюють або запобігають зростанню ракових клітин, переважно без негативного впливу на інші фізіологічні функції. Ілюстративні приклади включають цисплатин і циклофосфамід. Коли сполуки за даним винаходом вводять у вигляді лікарських засобів людям і ссавцям , їх можна давати в чистому вигляді або у вигляді фармацевтичної композиції, що містить, наприклад, від 0,1 до 99,5% (більш переважно від 0,5 до 90%) активного інгредієнта в поєднанні з фармацевтично прийнятним носієм. Вираз «фармацевтично прийнятний носій», як він використаний у даному описі, означає фармацевтично прийнятну речовину, композицію або носій, таку як рідкий або твердий наповнювач, розріджувач, ексципієнт, розчинник або інкапсулюючу речовину, включену в доставку або транспортування сполук(и) за винаходом всередині суб'єкта або до суб'єкта таким чином, що сполука виконує призначену функцію. Звичайно такі сполуки доставляють або транспортують від органу або частини тіла до іншого органу або частини тіла. Кожний носій повинен бути «прийнятним» у значенні сумісності з іншими інгредієнтами рецептури і не завдавати шкоди пацієнту. Деякі приклади речовин, які можуть служити як фармацевтично прийнятні носії, включають: цукор, такий як лактоза, глюкоза і сахароза; крохмаль, такий як кукурудзяний крохмаль і картопляний крохмаль; целюлозу і її похідні, такі як карбоксиметилцелюлоза натрію, етилцелюлоза і ацетат целюлози; порошкоподібні камеді; солод; желатин; тальк; ексципієнти, такі як масло какао і віск для супозиторіїв; олії, такі як арахісова олія, бавовняна олія, соняшникова олія, кунжутна олія, оливкова олія, кукурудзяна олія і соєва олія; гліколі, такі як пропіленгліколь; багатоатомні спирти, такі як гліцерин, сорбіт, маніт і поліетиленгліколь; складні ефіри, такі як етил олеат і етиллаурат; агар; буферні агенти, такі як гідроксид магнію і гідроксид алюмінію; альгінову кислоту; апірогенну воду; ізотонічний фізіологічний розчин; розчин Рінгера; етиловий спирт; фосфатні буферні розчини і інші нетоксичні сумісні речовини, що використовуються у фармацевтичних препаратах. Як указано вище, деякі варіанти здійснення даних сполук можуть містити основні функціональні групи, такі як аміно або алкіламіно, і тому здатні утворювати фармацевтично прийнятні солі з фармацевтично прийнятними кислотами. Термін «фармацевтично прийнятні солі» у даному відношенні відноситься до відносно нетоксичних кислотно-адитивних солей сполук за даним винаходом з неорганічними або органічними кислотами. Дані солі можуть бути одержані in situ при кінцевому виділенні і очищенні сполук за винаходом або шляхом окремої взаємодії очищеної сполуки за винаходом у формі її вільної основи з відповідною органічною або неорганічною кислотою і виділення утвореної таким чином солі. Ілюстративні солі включають гідробромід, гідрохлорид, сульфат, бісульфат, фосфат, нітрат, ацетат, валерат, олеат, пальмітат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, дактобіонат і лаурилсульфонатні солі і тому подібні (дивись, наприклад, Berge et al. (1977) "Parmaceutical Salts", J. Pharm. Sci., 66:1-19). В інших випадках сполуки за даним винаходом можуть містити одну або декілька кислотних функціональних груп і таким чином здатні утворювати фармацевтично прийнятні солі з фармацевтично прийнятними основами. Термін «фармацевтично прийнятні солі» у таких випадках відноситься до відносно нетоксичних основно-адитивних солей сполук за даним винаходом з неорганічними або органічними основами. Такі солі можуть бути одержані аналогічним чином in situ під час кінцевого виділення і очищення сполук або шляхом окремої взаємодії очищеної сполуки у формі її вільної кислоти з відповідною основою, такою як гідроксид, карбонат або бікарбонат фармацевтично прийнятного катіону металу, з аміаком або з фармацевтично прийнятними органічними первинними, вторинними або третинними амінами. Ілюстративні лужні або лужноземельні солі включають солі літію, натрію, калію, кальцію, магнію і алюмінію і тому подібні. Ілюстративні органічні аміни, корисні для утворення основно-адитивних солей, включають етиламін, діетиламін, етилендіамін, етаноламін, діетаноламін, піперазин і тому подібні. Термін «фармацевтично прийнятні складні ефіри» відноситься до відносно нетоксичних етерифікованих продуктів сполук за даним винаходом. Дані складні ефіри можуть бути одержані in situ під час кінцевого виділення і очищення сполук або шляхом окремої взаємодії очищеної сполуки у формі її вільної кислоти або гідроксилу з відповідним етерифікуючим реагентом. Карбонові кислоти можуть бути перетворені у складні ефіри при обробці спиртом у присутності каталізатора. Гідроксилвмісні похідні можуть бути перетворені у складні ефіри при обробці етерифікуючим агентом, таким як алканоїлгалогеніди. Крім того мається на увазі, що термін включає нижчі вуглеводневі групи, здатні до сольватації у фізіологічних умовах, наприклад, алкілові складні ефіри, метилові, етилові і пропілові складні ефіри (дивись, наприклад, Berge et al., див. ви ще). У винаході додатково розглядається застосування проліків, які перетворюються in vivo у терапевтичні сполуки за винаходом (дивись, наприклад, R.B.Silverman, 1992, "The Organic Chemistry of Drug Desing and Drug Action", Academic Press, Chapter 8). Такі проліки можуть використовуватись для зміни біорозподілу (наприклад, щоб зробити можливими сполуки, які не будуть звичайним чином вступати у реакційноздатні сайти протеази) або для фармакокінетики терапевтичної сполуки. Наприклад, група карбонової кислоти може бути етерифікована, наприклад, метильною групою або етильною групою з одержанням складного ефіру. Коли складний ефір вводять суб'єкту, складний ефір розщеплюється під дією ферментів або неферментативно, відновлювально або гідролітично, вивільняючи аніонну групу. Аніонна група може етерифікуватись фрагментами (наприклад, ацилоксиметильні складні ефіри), які розщеплюються, вивільняючи проміжну сполуку, яка згодом розкладається, даючи активну сполуку. В іншому варіанті здійснення проліки являють собою відновлену форму сульфату або сульфонату, наприклад, тіол, який окислюється in vivo до терапевтичної сполуки. Крім того, аніонний фрагмент може бути етерифікований до групи, яка активно транспортується in vivo, або яка селективно поглинається органами-мішенями. Складний ефір може бути вибраний так, щоб дати можливість специфічно націлювати терапевтичні фрагменти на конкретні реакційноздатні сайти, як описано далі для фрагментів-носіїв. Змочувальні агенти, емульгатори і змащувальні агенти, такі як лаурилсульфат натрію і стеарат магнію, а також барвники, вивільняючі агенти, агенти покриття, підсолоджувачі, смакові агенти і віддушки, консерванти і антиоксиданти також можуть бути присутніми в композиціях. Приклади фармацевтично прийнятних антиоксидантів включають водорозчинні антиоксиданти, такі як аскорбінова кислота, гідрохлорид цистеїну, бісульфат натрію, метабісульфіт натрію, сульфіт натрію і тому подібні; розчинні в олії антиоксиданти, такі як аскорбіл пальмітат, бутильований гідроксіанізол (ВНА), бутильований гідрокситолуол (ВНТ), лецитин, пропілгалат, альфа-токоферол і тому подібні; і хелатуючі метал агенти, такі як лимонна кислота, етилендіамінтетраоцтова кислота (ЕДТА), сорбіт, винна кислота, фосфорна кислота і тому подібні. Композиції за даним винаходом включають склади, відповідні для перорального, назального, місцевого, черезшкірного, букального, сублінгвального, ректального, вагінального і/або парентерального введення. Препарати можуть зручним чином існувати у вигляді одиничних дозованих лікарських форм і можуть бути одержані будь-якими способами, добре відомими в області фармацевтики. Кількість активного інгредієнта, яку можна об'єднувати з носієм для одержання одиничної дозованої форми, звичайно буде такою кількістю сполуки, яка надає терапевтичну дію. Звичайно, виключаючи сто процентів, дана кількість буде коливатись від приблизно 1 процента до приблизно дев'яноста дев'яти процентів активного інгредієнта, переважно від приблизно 5 процентів до приблизно 70 процентів, найбільш переважно від приблизно 10 процентів до приблизно 30 процентів. Способи одержання даних композицій або складів включають стадію об'єднання сполуки за даним винаходом з носієм і, необов'язково, одним або декількома допоміжними інгредієнтами. Звичайно, композиції одержують шляхом однорідного і ретельного змішування сполуки за даним винаходом з рідкими носіями або тонко подрібненими твердими носіями, або обома, а потім, за необхідністю, формування продукту. Композиції за винаходом, відповідні для перорального введення, можуть бути представлені у вигляді капсул, облаток, пілюль, таблеток, коржиків (з використанням смакової основи, звичайно сахарози і гуміарабіку або трагаканту), порошків, гранул або у вигляді розчину або суспензії у водній або неводній рідині, або вигляді рідкої емульсії олія-у-воді або вода-в-олії, або у вигляді еліксиру або сиропу, або у вигляді пастилок (з використанням інертної основи, такої як желатин і гліцерин, або сахарози і гуміарабіку), і/або у вигляді полоскання для рота і тому подібного, кожний з яких містить заздалегідь визначену кількість сполуки за даним винаходом як активного інгредієнта. Сполуку за даним винаходом також можна вводити у вигляді болюсу, електуарію або пасти. У твердих препаративних лікарських формах за винаходом для перорального введення (капсули, таблетки, пілюлі, драже, порошки, гранули і тому подібне) активний інгредієнт змішують з одним або декількома фармацевтично прийнятними носіями, такими як цитрат натрію або дикальцій фосфат, і/або будь-яким з наступних агентів: наповнювачі або заповнювачі, такі як крохмаль, лактоза, сахароза, глюкоза, маніт і/або кремнева кислота; зв'язувальні речовини, такі як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і/або гуміарабік; зволожувач, такі як гліцерин; дезінтегруючі агенти, такі як агар-агар, карбонат кальцію, картопляний або маїсовий крохмаль, альгінова кислота, деякі силікати і карбонат натрію; уповільнюючі розчинення агенти, такі як парафін; прискорювачі всмоктування, такі як четвертинні амонійні сполуки; змочувальні агенти, такі як, наприклад, цетиловий спирт і гліцерин моностеарат; абсорбенти, такі як каолін і бентонітова глина; змащувальні речовини, такі як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію і їх суміші; і барвники. У випадку капсул, таблеток і пілюль, фармацевтичні композиції також можуть містити буферні агенти. Тверді композиції аналогічного типу також можуть використовуватись як наповнювачі у м'яких і твердих желатинових капсулах, що наповнюються з використанням таких ексципієнтів як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі і тому подібне. Таблетка може бути одержана пресуванням або формуванням, необов'язково з використанням одного або декількох додаткових інгредієнтів. Пресовані таблетки можуть бути одержані з використанням зв'язувальної речовини (наприклад, желатину або гідроксипропілметилцелюлози), змащувальної речовини, інертного розріджувача, консерванту, дезінтегранту (наприклад, крохмальгліколяту натрію або зшитої карбоксиметилцелюлози натрію), поверхнево-активного або диспергуючого агента. Формовані таблетки можуть бути одержані формуванням у відповідному пристрої суміші порошкоподібної сполуки, зволоженої інертним рідким розріджувачем. Таблетки та інші тверді препаративні лікарські форми фармацевтичних композицій за даним винаходом, такі як драже, капсули, пілюлі і гранули, необов'язково можуть мати насічки або бути одержані з використанням покриттів або оболонок, таких як розчинні у кишечнику покриття та інші покриття, добре відомі в області одержання фармацевтичних рецептур. Вони також можуть бути складені таким чином, щоб забезпечити повільне або контрольоване вивільнення з них активного інгредієнта з використанням, наприклад, гідроксипропілметилцелюлози у різних пропорціях для створення бажаного профілю вивільнення, інших полімерних матриць, ліпосом і/або мікросфер. Вони можуть бути стерилізовані, наприклад, через фільтр, який утримує бактерії, або за допомогою включення стерилізуючих агентів у формі стерильних твердих композицій, які можуть бути розчинені у стерильній воді або деяких інших стерильних ін'єкційних середовищах безпосередньо перед вживанням. Дані композиції також необов'язково можуть містити агенти для придания каламутності і можуть являти собою композицію, яка вивільняє активний інгредієнт(и) тільки або переважно у певній частині шлунково-кишкового тракту, необов'язково, уповільненим чином. Приклади композицій, що імплантуються, які можуть використовуватись, включають полімерні речовини і віск. Активний інгредієнт також може бути у мікроінкапсульованій формі, якщо це підходить, з одним або декількома описаними вище ексципієнтами. Рідкі дозовані лікарські форми для перорального введення сполук за винаходом включають фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи і еліксири. У доповнення до активного інгредієнта рідкі дозовані лікарські форми можуть містити інертні розріджувачі, що звичайно використовуються в даній області, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, олії (зокрема, бавовняна, арахісова, кукурудзяна, олія паростків, оливкова, касторова і кунжутна олії), гліцерин, терагідрофуриловий спирт, поліетиленгліколи і складні ефіри сорбіту і жирних кислот і їх суміші. Крім інертних розріджувачів пероральні композиції також можуть включати допоміжні агенти, такі як змочувальні агенти, емульгуючі і суспендуючі агенти, підсолоджувачі, смакові добавки, барвники, віддушки і консерванти. Суспензії, в доповнення до активних сполук, можуть містити суспендуючі агенти, наприклад, такі як етоксильовані ізостеарилові спирти, поліоксіетиленовий сорбіт і складні ефіри сорбіту, мікрокристалічна целюлоза, метагідроксид алюмінію, бентоніт, агар-агар і трагакант, і їх суміші. Рецептури фармацевтичних композицій за винаходом для ректального або вагінального введення можуть бути представлені у вигляді супозиторію, який може бути одержаний змішуванням одного або декількох сполук за винаходом з одним або декількома відповідними неподразнюючими ексципієнтами або носіями, що включають, наприклад, масло какао, поліетиленгліколь, віск для супозиторіїв або саліцилат, які є твердими при кімнатній температурі, але рідкими при температурі тіла і отже будуть розплавлятись у прямій кишці або вагінальній порожнині і вивільняти активну сполуку. Рецептури за даним винаходом, які є придатними для вагінального введення, також включають песарії, тампони, креми, гелі, пасти, пінисті або препарати, що розпилюються, які містять такі носії, що відомі в даній області, як відповідні для даного застосування. Препаративні лікарські форми для місцевого або черезшкірного введення сполуки за даним винаходом включають порошки, спреї, мазі, пасти, креми, лосьйони, гелі, розчини, пластири та інгалятори. Активна сполука може бути змішана у стерильних умовах з фармацевтично прийнятним носієм і з будь-яким необхідним консервантом, буфером або пропелентом. Мазі, пасти, креми і гелі можуть містити, у доповнення до активної сполуки за даним винаходом, ексципієнти, такі як тваринні і рослинні жири, олії, віск, парафіни, крохмаль, трагакант, похідна целюлоза, поліетиленгліколі, силікони, бентоніти, кремнієва кислота, тальк і оксид цинку, або їх суміші. Порошки і спреї можуть містити, в доповнення до сполуки за даним винаходом, ексципієнти, такі як лактоза, тальк, кремнієва кислота, гідроксид алюмінію, силікати кальцію і поліамідний порошок, або суміші даних речовин. Спреї додатково можуть містити звичайні пропеленти, такі як хлорфторвуглеводні і леткі незаміщені вуглеводні, такі як бутан і пропан. Черезшкірні пластири мають додаткову перевагу в забезпеченні контрольованої доставки сполуки за даним винаходом до тіла. Такі препаративні лікарські форми можуть бути одержані шляхом розчинення або диспергування сполуки у відповідному середовищі. Для збільшення проникнення речовини через шкіру можуть бути додані підсилювачі всмоктування. Швидкість такого потоку через шкіру можна контролювати або за допомогою швидкість-контролюючої мембрани, або при диспергуванні активної сполуки у полімерній матриці або гелі. Офтальмологічні препарати, очні мазі, порошки, розчини і тому подібне також розглядаються як такі, що попадають в об'єм даного винаходу. Переважно, фармацевтичний препарат являє собою офтальмологічну композицію (наприклад, препарат для періокулярної, ретробульбарної або внутрішньоочної ін'єкції, системний препарат або хірургічний зрошувальний розчин). Офтальмологічні препарати за даним винаходом можуть включати один або декілька дезазапуринів і фармацевтично прийнятний носій. Можна використати різні типи носіїв. Носій звичайно буде водним за своїй природою. Звичайно віддають перевагу водним розчинам, основуючись на типі композиції, а також здатності пацієнта легко вводити такі композиції, закапуючи одну або дві краплі розчину в уражене око. Однак, дезазапурини за даним винаходом також легко можуть бути введені в іншітипи композицій, такі як суспензії, в'язкі або напівв'язкі гелі або інші типи твердих або напівтвердих композицій. Офтальмологічні композиції за даним винаходом також можуть включати різні типи інгредієнтів, такі як буфери, консерванти, співрозчинники і агенти, які створюють в'язкість. Відповідна буферна система (наприклад, фосфат натрію, ацетат натрію або борат натрію) може бути додана для запобігання зміні рН в умовах зберігання. Офтальмологічні продукти звичайно упаковуються у вигляді безлічі дозованих форм. Таким чином, для запобігання мікробному забрудненню під час використання потрібні консерванти. Відповідні консерванти включають: хлорид бензалконію, тимерозал, хлорбутанол, метилпарабен, пропілпарабен, фенілетиловий спирт, едетат динатрію, сорбінову кислоту, полікватерній-1 або інші агенти, відомі фахівцям в даній області. Такі консерванти звичайно використовуються на рівні від 0,001 до 1,0% ваг./об'єм (% ваг./об.). Коли дезазапурини за даним винаходом вводять під час внутрішньоочної хірургічної процедури, наприклад, за допомогою ретробульбарної або періокулярної ін'єкції і внутрішньоочного введення або ін'єкції, найбільш переважним є використання збалансованих сольових зрошувальних розчинів як носіїв. Прикладами фізіологічно збалансованих внутрішньоочних зрошувальних розчинів є BSS® стерильний зрошувальний розчин і BSS Plus® стерильний внутрішньоочний зрошувальний розчин (Alcon Laboratories, Inc., Fort Worth, Te xas, USA). Останній тип розчину описаний у патенті США 4550022 (Garabedian et al.), повний зміст якого включений в даний опис як посилання. Ретробульбарні і періокулярні ін'єкції відомі фа хівцям в даній області і описані у численних публікаціях, включаючи, наприклад, Ophthalmic Surgery: Principles of Practice (Офтальмологічна хірургія: принципи практики) Ed., G.L.Spaeth, W.B.Sanders Co., Philadelphia Pa., USA, сторінки 85-87 (1990). Як указано вище, застосування дезазапуринів для профілактики або зменшення пошкодження тканин сітківки або головного зорового нерва на клітинному рівні являє собою особливо важливий аспект одного варіанту здійснення винаходу. Офтальмологічні захворювання, які можна лікувати, включають, але не обмежуються цим, ретинопатію, дегенерацію жовтої плями, ішемію ока, глаукому і пошкодження, пов'язані з пошкодженням тканин ока, такі як ішемічні реперфузійні пошкодження, фото хімічні пошкодження і пошкодження, пов'язані з хірургією ока, особливо пошкодження сітківки або головного зорового нерва, викликані дією світла або хірургічними інструментами. Сполуки також можна використати як супутнє лікування в офтальмологічній хірургії, наприклад, як ін'єкцію всередину сітківки або надкон'юнктивну ін'єкцію після офтальмологічної хірургії. Сполуки можна використати для короткочасного лікування тимчасово виникаючих захворювань, або їх можна вводити постійно, особливо у разі дегенеративного захворювання. Сполуки також можна використати профілактично, особливо перед очним хірургічним втручанням або неінвазивними офтальмологічними процедурами, або іншими типами хірургічного втр учання. Фармацевтичні композиції за даним винаходом, придатні для парентерального введення, включають одну або декілька сполук за винаходом в поєднанні з одним або декількома фармацевтично прийнятними стерильними ізотонічними водними або неводними розчинами, дисперсіями, суспензіями або емульсіями, або у вигляді стерильних порошків, вологовміст яких відновлюється безпосередньо перед застосуванням у стерильних розчинах або дисперсіях для ін'єкцій, які можуть містити антиоксиданти, буфери, бактеріостатичні агенти, розчинні речовини, що надають рецептурі ізотонічних властивостей з кров'ю передбачуваного реципієнта, або суспендуючі або згущувальні агенти. Приклади відповідних водних і неводних носіїв, які можна використати у фармацевтичних композиціях за винаходом, включають воду, етанол, багатоатомні спирти (такі як гліцерин, пропіленгліколь, поліетиленгліколь і тому подібні) і їх відповідні суміші, олії, такі як оливкова олія, та ін'єктовані органічні складні ефіри, такі як етилолеат. Належна текучість може підтримуватись, наприклад, за рахунок використання матеріалів покриттів, таких як лецитин, підтримка необхідного розміру частинок у разі дисперсій і застосування поверхнево-активних речовин. Дані композиції також можуть містити допоміжні агенти, такі як консерванти, змочувальні агенти, емульгуючі агенти і диспергуючі агенти. Запобігання дії мікроорганізмів можна гарантувати при включенні до складу композиції різних протимікробних і протигрибкових агентів, наприклад, парабену, хлорбутанолу, фенолсорбінової кислоти і тому подібних. Також може виявитись бажаним включати до складу композицій ізотонічні агенти, такі як цукор, хлорид натрію і тому подібні. Крім того, пролонговане всмоктування ін'єктованої фармацевтичної форми може досягатись шляхом введення агентів, які уповільнюють всмоктування, таких як моностеарат алюмінію і желатин. У деяких випадках для досягнення тривалої дії лікарського засобу бажано уповільнити всмоктування лікарського засобу при підшкірній або внутрішньом'язовій ін'єкції. Це може досягатись за рахунок застосування рідкої суспензії кристалічної або аморфної речовини, що володіє низькою розчинністю у воді. Швидкість всмоктування лікарського засобу тоді залежить від швидкості його розчинення, що, в свою чергу, може залежати від розміру кристала і кристалічної форми. Альтернативно, уповільнене всмоктування парентерально препаративної лікарської форми, що вводиться, здійснюють шляхом розчинення або суспендування лікарського засобу в масляному носії. Ін'єктовані депо-форми одержують шляхом утворення мікроінкапсульованих матриць сполук, що обговорюються, у біознищуваних полімерах, таких як полілактид-полігліколід. В залежності від співвідношення лікарського засобу і полімеру і природи конкретного полімеру, що використовується, можна контролювати швидкість вивільнення лікарського засобу. Приклади інших біознищуваних полімерів включають полі(орто-складні ефіри) і полі(ангідриди). Ін'єктовані депо-форми також одержують шляхом захоплення лікарського засобу ліпосомами або мікроемульсіями, які сумісні з тканинами тіла. Препарати за даним винаходом можна вводити перорально, парентерально, місцево або ректально. Звичайно, їх вводять у вигляді форм, придатних для кожного шляху введення. Наприклад, їх вводять у вигляді таблеток або капсул, шля хом ін'єкції, інгаляції, у вигляді очного лосьйону, мазі, супозиторію і т.д., здійснюють введення за допомогою ін'єкції, вливання або інгаляції; місцево з використанням лосьйону або мазі; і ректально з використанням супозиторіїв. Переважним є пероральне введення. Вирази «парентеральне введення» і «вводять парентерально», як вони використовуються в даному описі, означають способи введення, які відрізняються від ентерального і місцевого введення, звичайно шляхом ін'єкції, і включають, без обмежень, внутрішньовенну, внутрішньом'язову, внутрішньоартеріальну, внутрішньооболонкову, внутрішньокапсульну, внутрішньоочну, внутрішньосерцеву, вн утрішньошкірну, внутрішньоочеревинну, транстрахейну, підшкірну, підкутикулярну, вн утрішньосуглобн у, підкапсульну, субарахноїдальну, інтраспінальну і вн утрішньогрудинну ін'єкцію та інфузію. Вирази «системне введення» і «вводять системно», «периферичне введення» і «вводять периферично», як вони використані в даному описі, означають введення сполуки, лікарського засобу або іншої речовини іншим шляхом, ніж безпосереднє введення в центральну нервову систему, так що вона надходить в систему пацієнта і таким чином зазнає метаболізму та інших подібних процесів, наприклад, при підшкірному введенні. Дані сполуки можна вводити людям та іншим тваринам для лікування за допомогою будь-якого відповідного шляху введення, включаючи пероральне, назальне, наприклад, за допомогою спрею, ректальне, внутрішньовагінальне, парентеральне, інтрацистернальне і місцеве введення, наприклад, за допомогою порошків, мазей і крапель, включаючи букальне і сублінгвальне введення. Незалежно від вибраного шляху введення, сполуки за даним винаходом, які можуть використовуватись у відповідній гідратованій формі, і/або фармацевтичні композиції за даним винаходом одержують у вигляді фармацевтично прийнятних препаративних лікарських форм звичайними способами, відомими фахівцям в даній області. Фактичні рівні дозування активних інгредієнтів у фармацевтичних композиціях за даним винаходом можуть змінюватись так, щоб одержувати кількість активного інгредієнта, яка є ефективною для досягнення бажаної терапевтичної реакції у відповідь для конкретного пацієнта, композиції і способу введення, не будучи токсичним для пацієнта. Вибрані рівні дозування будуть залежати від множини факторів, включаючи активність конкретної сполуки, що використовується за даним винаходом, або її складного ефіру, солі або аміду, шлях введення, час введення, швидкість виведення з організму конкретної сполуки, що використовується, тривалість лікування, інші лікарські засоби, сполуки і/або речовини, що використовується в поєднанні з конкретною сполукою, що використовується, вік, стать, вага, захворювання, загальний стан здоров'я і попередню історію хвороби пацієнта, що піддається лікуванню, і аналогічні фактори, добре відомі в медицині. Лікуючий лікар або ветеринар, що є звичайним фахівцем в даній області, легко може визначити і прописати ефективну кількість необхідної фармацевтичної композиції. Наприклад, лікуючий лікар або ветеринар можуть почати із застосування доз сполук, що використовуються у фармацевтичній композиції, на рівнях, більш низьких, ніж потрібно для досягнення бажаної терапевтичної дії, і поступово збільшувати дозування доти, поки не буде досягнутий бажаний ефект. Звичайно, відповідна денна доза сполуки за винаходом буде такою кількістю сполуки, яка являє собою найменшу дозу, ефективну для надання терапевтичної дії. Така ефективна доза звичайно буде залежати від описаних вище факторів. Звичайно внутрішньовенні і підшкірні дози сполук за даним винаходом для пацієнта, коли їх використовують для надання вказаної анальгетичної дії, будуть коливатись від приблизно 0,0001 до приблизно 200мг на кілограм ваги тіла на добу, більш переважно від приблизно 0,01 до приблизно 150мг на кг на добу і ще більш переважно від приблизно 0,2 до приблизно 140мг на кг на добу. При бажанні, ефективну денну дозу активної сполуки можна водити у ви гляді двох, трьох, чотирьох, п'яти, шести або більше піддоз, що вводяться окремо з відповідними проміжками протягом дня, необов'язково у вигляді одиничних дозованих лікарських форм. Хоча сполуку за даним винаходом можливо вводити саму по собі, переважним є введення сполуки у вигляді фармацевтичної композиції. Даний винахід також відноситься до упакованих фармацевтичних композицій для лікування хворобливих станів, що дають реакцію у відповідь на N-6 заміщений 7-дезазапурин, наприклад, при небажаній підвищеній активності аденозинового рецептора у ссавця. Упаковані фармацевтичні композиції включають контейнер, що містить терапевтично ефективну кількість принаймні одного дезазапурину, як описано вище, і інструкції з використання дезазапурину для лікування стану, що дає реакцію у відповідь на дезазапурин. Дезазапурини даного винаходу можуть бути одержані з використанням стандартних способів органічного синтезу. Дезазапурини можуть бути очищені ВЕРХ із оберненою фазою, хроматографією, перекристалізацією і т.д. і їх структури підтверджені за допомогою мас-спектрального аналізу, елементного аналізу, IЧ і/або ЯМР спектроскопії. Звичайно, синтез проміжних сполук, а також дезазапуринів за винаходом здійснюють у розчині. Приєднання і видалення однієї або декількох захисних гр уп також є звичайним на практиці і відомо фа хівцям. Типові схеми синтезу проміжних сполук для одержання дезазапуринів за винаходом представлені нижче на схемі І. Даний винахід додатково відноситься до сполуки, що має структур у (IV): де R1 являє собою транс-4-гідроксициклогексил, 2-метиламінокарбоніламіноциклогексил, ацетиламіноетил або метиламінокарбоніламіноетил; де R3 являє собою заміщене або незаміщене чотирьох-шестичленне кільце; феніл, пірол, тіофен, фуран, тіазол, імідазол, піразол, 1,2,4-триазол, піридин, 2(1Н)-піридон, 4(1Н)-піридон, піразин, піримідин, піридазин, ізотіазол, ізоксазол, оксазол, тетразол, нафталін, тетралін, нафтиридин, бензофуран, бензотіофен, індол, 2,3-дигідроіндол, 1Н-індол, індолін, бензопіразол, 1,3-бензодіоксол, бензоксазол, пурин, кумарин, хромон, хінолін, тетрагідрохінолін, ізохінолін, бензімідазол, хіназолін, піридо[2,3-b]піразин, піридо[3,4-b]піразин, піридо[3,2-b]піридазин, піридо[3,4-b]піридин, 1H-піразол[3,4-d]піримідин, птеридин, 2(1Н)-хінолон, 1(2Н)-ізохінолон, 1,4-бензізоксазин, бензотіазол, хіноксалін, хінолін-N-оксид, ізохінолін-Nоксид, хіноксалін-N-оксид, хіназолін-N-оксид, бензоксазин, фталазин, цинолін, або має структуру: де Υ являє собою вуглець або азот; де R2 і R2' незалежно являють собою Н, заміщений або незаміщений алкіл, заміщений або незаміщений арил, галоген, метокси, метиламіне або метилтіо; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)XR9, де X являє собою О, S або NR10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R9 і R10 незалежно являє собою алкіл або циклоалкіл, або NR9R10 являє собою заміщене або незаміщене кільце, що містить від 4 до 7 членів; де R6 являє собою Н, алкіл, заміщений алкіл, циклоалкіл; або до її фармацевтично прийнятної солі, похідних проліків або біологічно активного метаболіту, за умови, що коли R1 являє собою ацетиламіноетил, R3 не є 4-піридилом. В одному варіанті здійснення сполуки, що має структур у IV, NR9R10 являє собою заміщене або незаміщене кільце, що містить від 4 до 7 членів, яке вибране з групи, що складається з: де m дорівнює 0, 1 або 2, де n дорівнює 0, 1, 2 або 3; де R8' являє собою водень,-ОН,-СН2ОН,-C(=O)NR 9R10, NHR11; де R11 являє собою-С(=О)СН3 або-SO2Me, або де R являє собою Н, алкіл або арил. При іншому варіанті здійснення сполуки, що має структур у IV, R 3 має структур у де Υ являє собою вуглець або азот; де R2 являє собою N або галоген, О-алкільну групу, аміногрупу або сульфідну гр упу; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)NR9R10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R9 і R10 незалежно являє собою алкіл або циклоалкіл, або R9, R10 і азот разом утворюють заміщене або незаміщене кільце, що складається з 4-7 членів. В іншому варіанті здійснення сполуки Υ являє собою вуглець. В іншому варіанті здійснення сполуки R2 являє собою водень. В іншому варіанті здійснення сполуки R6 являє собою водень. В іншому варіанті здійснення сполуки R5 являє собою водень. В іншому варіанті здійснення сполуки кожний з R 5 і R6 являє собою метил. В іншому варіанті здійснення сполуки R5 являє собою-C(R7)(R8)NR9R10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R9 і R10 незалежно являє собою алкіл або циклоалкіл, або R9, R10 і азот разом утворюють заміщене або незаміщене кільце, що складається з 4-7 членів. В іншому варіанті здійснення сполуки R2 являє собою галоген. В іншому варіанті здійснення сполуки Υ являє собою азот. Ще в одному варіанті здійснення сполуки R2 являє собою водень. У наступному варіанті здійснення сполуки кожний з R 5 і R6 являє собою водень. Даний винахід також відноситься до сполуки, що має структуру (V): де R3 являє собою арил, заміщений арил або гетероарил; де R6 являє собою Н, алкіл, заміщений алкіл або циклоалкіл; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)NR9R10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R9 і R10 являє собою алкіл або циклоалкіл, або R9, R10 і азот разом утворюють кільцеву систему, що складається з 4-7 членів. В одному варіанті здійснення сполуки, що має структур у V, кожний з R 7 і R8 являє собою Н; де R9 являє собою H і R10 являє собою-R12C(=O)R13. В іншому варіанті здійснення сполуки, що має структуру V, кожний з R7 і R8 являє собою Н; де кільцева система являє собою морфоліно, тіоморфоліно, N-4-заміщений піперазино, 2-заміщений піперизин або R8' заміщений піролідино, піперидин, де R8' являє собою Н, ОН, СН2ОН,-C(=O)NR 9R10, NR11 де R 11 являє собою-С(=О)СН3,-SO2Me. В іншому варіанті здійснення сполуки, сполука має наступну стр уктур у: (Сполука 706) В іншому варіанті здійснення сполуки, сполука має структуру: В іншому варіанті здійснення сполуки, сполука має структуру: (Сполука 1318-а) В іншому варіанті здійснення сполуки, сполука має структуру: (Сполука 1318-b) В іншому варіанті здійснення сполуки, сполука має структуру: (Сполука 1319) В іншому варіанті здійснення сполуки, сполука має структуру: (Сполука 1320) В іншому варіанті здійснення сполуки, сполука має структуру: (Сполука 1321) Сполука має структур у де R3 являє собою 5-6-членне ароматичне кільце; де R5 і R6 незалежно являють собою N або алкіл. В одному варіанті здійснення сполуки, сполука має структур у: (Сполука 1500) В одному варіанті здійснення сполуки, сполука має структур у: В іншому варіанті здійснення сполуки, сполука має структуру: В іншому варіанті здійснення сполуки 1500, сполука має структуру: У наступному втіленні сполуки, сполука має структур у: Даний винахід також відноситься до сполуки, що має структуру: де R3 являє собою 5-6-членне ароматичне кільце; де R 5 і R6 незалежно являють собою N або алкіл; за умови, що R3 не є 4-піридилом. В одному варіанті здійснення сполуки, сполука має структур у: (Сполука 1501) Даний винахід додатково відноситься до сполуки, що має структур у: де R3 являє собою заміщене 5-6-членне ароматичне кільце; де R5 і R6 незалежно являють собою N або алкіл. В одному варіанті здійснення сполуки, сполука має структур у: (Сполука 1520) Даний винахід додатково відноситься до сполуки, що має структур у: де R3 являє собою 5-6-членне ароматичне кільце; де X являє собою кисень або сірку. В одному варіанті здійснення сполуки, сполука має структур у: (Сполука 1503) Даний винахід додатково відноситься до сполуки, що має структур у: де R3 являє собою 5-6-членне ароматичне кільце; де X являє собою кисень або сірку. В одному варіанті здійснення сполуки, сполука має структур у: (Сполука 1504) Даний винахід також відноситься до способу лікування захворювання, пов'язаного з А1 аденозиновим рецептором у суб'єкта, що включає введення суб'єкту терапевтично ефективної кількості сполуки, що має формулу IV, V, VI, VI, VII, VIII, IX або X. В одному варіанті здійснення способу суб'єкт являє собою ссавця. В іншому варіанті здійснення способу ссавець є людиною. У наступному варіанті здійснення способу, А1 аденозиновий рецептор пов'язаний з порушенням пізнавальної здатності, нирковою недостатністю, серцевою аритмією, епітелієм дихальних шля хів, вивільненням трансмітера, седативною дією, звуженням кровоносних судин, брадикардією, негативною серцевою інотропією і дромотропією, бронхостенозом, нейтрофільним хемотаксисом, станом рефлюксу або виразковим захворюванням. Даний винахід також відноситься до комбінованої терапії астми, що включає сполуки IV і V, і стероїд, b2-агоніст, глюкокортикоїд, антагоніст люкотриєну або антихолінергічний агоніст. Захворювання, пов'язані з А1 , А2а, А2b і А3 аденозиновими рецепторами, описані в WO 99/06053 і WO-09822465, WO-09705138, WO09511681, WO-09733879, JP-09291089, PCT/US98/16053 і патенті США № 5516894, повний зміст яких у всій своїй повноті включений в даний опис як посилання. Даний винахід також відноситься до водорозчинних проліків сполук, що мають структур у IV, V, VI, VI, VII, VIII, IX або X, де вказані водорозчинні проліки метабол ізують in vivo до активного лікарського засобу, який селективно інгібує А1 аденозиновий рецептор. В одному варіанті здійснення проліків, вказані проліки метаболізують in vivo за допомогою каталізованого естеразою гідролізу. Даний винахід також відноситься до фармацевтичної композиції, що включає проліки і фармацевтично прийнятний носій. Даний винахід додатково відноситься до способу інгібування активності А1 аденозинового рецептора в клітині, який включає контактування вказаної клітини зі сполукою, що має структур у IV, V, VI, VI, VII, VIII, IX або X. В одному варіанті здійснення способу сполука є антагоністом вказаного А! аденозинового рецептора. Даний винахід також відноситься до способу лікування шлунково-кишкового захворювання у суб'єкта, що включає введення терапевтично ефективної кількості сполуки, що має структур у IV, V, VI, VI, VII, VIII, IX або X. В одному варіанті здійснення способу вказане захворювання являє собою діарею. В іншому варіанті здійснення способу суб'єкт є людиною. В іншому варіанті здійснення способу сполука є антагоністом А1 аденозинових рецепторів. Даний винахід також відноситься до способу лікування захворювання дихальних шля хів у суб'єкта, що включає введення суб'єкту ефективної кількості сполуки, що має структур у IV, V, VI, VI, VII, VIII, IX або X. В одному варіанті здійснення способу вказане захворювання являє собою астму, хронічне обструктивне захворювання легень, алергічний риніт або захворювання верхніх дихальних шляхів. В іншому варіанті здійснення способу суб'єкт є людиною. В іншому варіанті здійснення способу вказана сполука є антагоністом А1 аденозинових рецепторів. Даний винахід також відноситься до способу лікування пошкодження ока у суб'єкта, що включає введення вказаному суб'єкту е фективної кількості сполуки, що має структуру IV, V, VI, VI, VII, VIII, IX або X. В одному варіанті здійснення способу вказане пошкодження включає пошкодження сітківки або зорового головного нерва. В іншому варіанті здійснення способу вказане пошкодження є гострим або хронічним. В іншому варіанті здійснення способу вказане пошкодження є результатом глаукоми, набряку, ішемії, гіпоксії або травми. В іншому варіанті здійснення способу суб'єкт є людиною. В іншому варіанті здійснення способу сполука є антагоністом А1 аденозинових рецепторів. Даний винахід також відноситься до фармацевтичної композиції, що включає терапевтично ефективну кількість сполуки, що має структур у IV, V, VI, VI, VII, VIII, IX або X, і фармацевтично прийнятний носій. В іншому варіанті здійснення фармацевтичної композиції вказана терапевтично ефективна кількість є ефективною для лікування захворювання дихальних шляхів або шлунково-кишкового захворювання. В іншому варіанті здійснення фармацевтичної композиції вказане шлунково-кишкове захворювання являє собою діарею. В іншому варіанті здійснення фармацевтичної композиції вказане захворювання дихальних шляхів являє собою астму, алергічний риніт або хронічне обструктивне захворювання легень. В іншому варіанті здійснення фармацевтичної композиції вказана фармацевтична композиція являє собою офтальмологічний препарат. В іншому варіанті здійснення фармацевтичної композиції вказана фармацевтична композиція являє собою препарат для періокулярної, ретробульбарної або внутрішньоочної ін'єкції. Ще в одному варіанті здійснення фармацевтичної композиції дана фармацевтична композиція являє собою системний препарат. У додатковому варіанті здійснення фармацевтичного препарату вказана фармацевтична композиція являє собою хірургічний зрошувальний розчин. Даний винахід також відноситься до упакованої фармацевтичної композиції для лікування захворювання, пов'язаного з А1-аденозиновим рецептором у суб'єкта, що включає: (а) контейнер, що містить терапевтично ефективну кількість А1-аденозин специфічної сполуки, і (b) інструкції для використання вказаної сполуки для лікування вказаного захворювання у суб'єкта. Як використано в даному описі, вираз «сполука є А1 селективною» означає, що сполука має константу зв'язування з Араденозиновим рецептором принаймні в десять разів вище, ніж аналогічна константа для А2а, А2b або А3 аденозину. Даний винахід також відноситься до способу одержання сполуки, що має структуру (IV), який включає стадії: а) взаємодії з одержанням де Р являє собою захисну гр упу, що видаляється; b) обробки продукту стадії а) в умовах циклізації з одержанням c) обробки продукту стадії b) у відповідних умовах з одержанням d) обробки хлорованого продукту стадії с) NH 2R1 з одержанням де R1 являє собою транс-4-гідроксициклогексил, 2-метиламінокарбоніламіноциклогексил, ацетиламіноетил або метиламінокарбоніламіноетил; де R3 являє собою заміщене або незаміщене чотирьох-шестичленне кільце; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)XR9, де X являє собою О, S або NR10, де кожний з R7 і R8 незалежно являє собою N або алкіл, де кожний з R 9 і R10 незалежно являє собою алкіл або циклоалкіл, або NR9R10 являє собою заміщене або незаміщене кільце, що містить від 4 до 7 членів; де R6 являє собою Н, алкіл, заміщений алкіл, циклоалкіл; або її фармацевтично прийнятної солі, пролікарського похідного або біологічно активного метаболіту; за умови, що коли R1 являє собою ацетиламіноетил, R3 не є 4-піридилом. Даний винахід також відноситься до способу одержання сполуки, що має структуру V, який включає стадії a) взаємодії з одержанням де Ρ являє собою захисну гр упу, що видаляється; b) обробки продукту стадії а) в умовах циклізації з одержанням c) обробки продукту стадії b) у відповідних умовах з одержанням d) обробки хлорованого продукту стадії с) з одержанням де R3 являє собою арил, заміщений арил, гетероарил; де R6 являє собою Н, алкіл, заміщений алкіл або циклоалкіл; де R5 являє собою Н, алкіл, заміщений алкіл, арил, арилалкіл, аміно, заміщений арил, де вказаний заміщений алкіл являє собою-C(R7)(R8)NR9R10, де кожний з R7 і R8 являє собою N або алкіл, де кожний з R9 і R10 являє собою алкіл або циклоалкіл, або NR9R10 являє собою кільцеву систему, що містить від 4 до 7 членів. Сполуки, представлені формулами VI, VII і VIII, можуть бути синтезовані за будь-якою зі схем І-VIII. Сполуки, представлені формулою IX і X, можуть бути одержані за схемою IX. Винахід далі проілюстрований наступними прикладами, які жодним чином не треба розглядати як додаткове обмеження. Зміст всіх посилань, що чекають рішення заявок на патенти і опублікованих заявок на патенти, процитованих в даній заявці, включаючи процитовані в розділі «Передумови створення винаходу», включений в даний опис як посилання. Потрібно розуміти, що моделі, використані у прикладах, є загальноприйнятими моделями, і демонстрування ефективності на даних моделях передбачає ефективність на людях. Даний винахід буде краще зрозумілий з наведених далі експериментальних подробиць. Однак, фа хівцеві в даній області буде без великих зусиль зрозуміло, що конкретні способи і результати, що обговорюються, є тільки ілюстрацією винаходу, як описано більш детально у формулі винаходу, яка йде далі. Дезазапурини за винаходом можуть бути одержані стандартними способами органічного синтезу. Дезазапурини можуть бути очищені ВЕРХ із оберненою фазою, хроматографією, перекристалізацією і т.д., і їх стр уктури підтверджені масспектральним аналізом, елементним аналізом, IЧ і/або ЯМР спектроскопією. Звичайно синтез проміжних сполук, а також дезазапуринів за винаходом проводять у розчині. Додавання і видалення однієї або декількох захисних гр уп також типово для практичного здійснення і відомо фахівцям у даній області. Типові схеми синтезу для одержання проміжних продуктів дезазапуринів за винаходом представлені нижче на схемі І. де R3, R5 і R6 є такими, як визначено вище. В цілому, захищений 2-аміно-3-ціано-пірол може бути оброблений ацилгалогенідом з утворенням карбоксамідо-3-ціанопіролу, який може бути оброблений підкисленим метанолом для здійснення замикання кільця в піроло[2,3-d]піримідин-4-(3Н)-он (Muller СЕ. et al., J.Med.Chem. 40:4396 (1997)). Видалення захисної групи піролу з подальшою обробкою хлоруючим реагентом, наприклад, оксихлоридом фосфору, приводить до заміщених або незаміщених 4-хлор-7Н-піроло[2,3-d]піримідинів. Обробка хлорпіримідину амінами давала 7-дезазапурини. Наприклад, як показано на схемі І, N-(1-d1-фенілетил)-2-аміно-3-ціаношрол обробляли ацилгалогенідом у піридині і дихлорметані. Одержаний N-(1-d1-фенілетил)-2-фенілкарбоксамідо-3-ціанопірол обробляли сумішшю метанол/сірчана кислота у співвідношенні 10:1 для проведення замикання кільця, що приводить до d1-7Н-7-(1-фенілетил)піроло[2,3-d]піримідин-4(3Н)-ону. Видалення фенілетилової групи при обробці піримідину поліфосфорною кислотою (РРА) з подальшою обробкою РОСl3, давало ключову проміжну сполуку 4-хлор-7Н-піроло[2,3-d]піримідин. Подальша обробка 4-хлор-7Н-піроло[2,3-d]піримідину різними амінами, перерахованими у таблиці 1, дає сполуки формули (І) і (II). Загальний підхід до одержання 6-заміщених піролів зображений на наступній схемі (Схема II). де R1-R5 є такими, як визначено вище. Переетерифікація і алкілування етилціаноацетату а-галогенкетоном приводять до кетометилового складного ефіру. Захист кетону з подальшою обробкою гідрохлоридом амідину (наприклад, алкіл, арил або алкіларил) приводить до кінцевого піримідину, захи щеного кеталем. Видалення захисної групи з подальшою циклізацією і обробкою оксихлоридом фосфору приводить до хлорвмісної проміжної сполуки, яка далі може бути оброблена аміном з одержанням амін-6-заміщеного піролу. Додатково може бути здійснене алкілування азоту піролу в умовах, відомих в даній області. Загальний підхід до синтезу 5-заміщених піролів зображений на наступній схемі (Схема III) де R1-R6 є такими, як визначено вище, і R являє собою захисну гр уп у, що видаляється. Конденсація малононітрилу і надлишку кетону з подальшим бромуванням продукту приводить до суміші вихідної речовини, монобромованого і дибромованого продуктів, які були оброблені алкіламіном, ариламіном або алкіларил аміном. Одержаний амінний продукт ацилювали хлорангідридом кислоти і моноацильований пірол циклізували в присутності кислоти з одержанням відповідного піримідину. За хисну груп у піролу видаляли поліфосфорною кислотою і обробляли оксихлоридом фосфору з одержанням хлорованого продукту. Хлорований пірол згодом міг бути оброблений аміном, даючи аміно-5-заміщений пірол. Алкілування азоту піролу може бути здійснене в умовах, відомих в даній області. На схемах IV і V зображені способи одержання дезазапуринів 1 і 2 за винаходом. де R5 і R6 є такими, як описано вище, наприклад, СН3. Конкретне одержання 6-метилпіролопіримідинів Ключовою реакцією для одержання 6-метилпіролопіримідинів (1) [R5=CH3] була циклізація ціаноацетату з бензамідином у піримідин. Передбачали, що метилціаноацетат буде циклізуватись з бензамідином у піримідин більш ефективно, ніж відповідний етиловий складний ефір. Тому, переетерифікація і алкілування етилціаноацетату в присутності NaOMe і надлишку a-галогенацетильного фрагменту, наприклад, хлорацетону, давала бажаний метиловий складний ефір (3) з виходом 79% (схема IV). Складний кетоефір (3) захищали у вигляді ацеталю (4) з виходом 81%. Новий спосіб циклізації у піримідин (5) здійснювали з використанням гідрохлориду амідину, наприклад, гідрохлориду бензамідину, з використанням 2 еквівалентів ДБУ, одержуючи 5 з виходом виділеного продукту 54%. Даний спосіб дозволяє поліпшити вихід з 20% відповідно до опублікованих умов, де під час циклізації з гуанідином використовується NaOMe. Циклізацію у пірол-піримідин (6) проводили зняттям ацетального захисту у водної НСl з 78% виходом. Взаємодія (6) з оксихлоридом фосфору при кипінні із зворотним холодильником давала відповідне 4хлорпохідне (7). Поєднання з транс-4-аміноциклогексанолом у диметилсульфоксиді при 135°С давало (1) з виходом 57% з (7). Фахівцеві в даній області буде очевидно, що вибір реагентів допускає велику гнучкість при виборі бажаного замісника R5. Конкретне одержання 5-метилпіролопіримідинів Конденсація Кневенагеля малонітрилу і надлишку кетону, наприклад, ацетону в киплячому бензолі приводила до 8 з виходом 50% після перегонки. Бромування 8 N-бромсукцинімідом у присутності перекису бензоїлу у хлороформі давало суміш вихідної речовини, моно- (9), і дибромованого продуктів (5/90/5) після перегонки (70%). Суміш піддавали взаємодії з a-метилалкіламіном або a-метилариламіном, наприклад, aметилбензиламіном, одержуючи амінопірол (10). Після пропущення через коротку колонку з силікагелем частково очищений амін (вихід 31%) ацилювали хлорангідридом кислоти, наприклад, бензоїлхлоридом, одержуючи моно- (11) і діацильовані (12) піроли, які розділяли флеш-хроматографією. Кислотний гідроліз дизаміщеного піролу (12) давав загальний вихід у 29% для ацилпіролу (11). Циклізація у присутності концентрованої сірчаної кислоти і ДМФ давала (13) (23%), в якому знімали захист поліфосфорною кислотою, одержуючи (14). Взаємодія (14) з оксихлоридом фосфору при кипінні із зворотним холодильником давала відповідне 4-хлорпохідне (15). Поєднання з транс-4-аміноциклогексанолом у диметилсульфоксиді при 135°С давало (2) [R 6=CH3] y з виходом 30% з (14) (дивись схему V). Фахівцеві в даній області буде очевидно, що вибір реагентів допускає велику гн учкість при виборі бажаного замісника R6. Альтернативний шлях синтезу R6-заміщених піролів, наприклад, 5-метилпіролопіримідинів Даний альтернативний шлях до R6-заміщених піролів, наприклад, 5-метилпіролопіримідинів, включає переетерифікацію і алкілування етилціаноацетату з утворенням (16) (схема VI). Конденсація (16) з гідрохлоридом бензамідину з використанням 2 еквівалентів ДБУ давала піримідин (17). Циклізацію у піролпіримідин (14) будуть проводити шляхом зняття ацетального захисту у водної НСl. Взаємодія (14) з оксихлоридом фосфору при кипінні із зворотним холодильником давала відповідне 4-хлорпохідне (15). Поєднання з транс-4-аміноциклогексанолом в диметилсульфоксиді при 135°С давало (2). За даною методикою число синтетичних реакцій для цільової сполуки (2) зменшується з 9 до 4 стадій. Крім того, вихід різко поліпшується. Знову ж, фа хівцеві в даній області буде очевидно, що вибір реагентів допускає велику гнучкість при виборі бажаного замісника R6. Загальний підхід до одержання дез-метилпіролу зображений на наступній схемі (Схема VII). де R1-R3 є такими, як визначено вище. Алкілування алкілціаноацетату діетилацеталем у присутності основи давало ціанодіетилацеталь, який обробляли сіллю амідину, одержуючи попередник метилпіролопіримідину. Попередник хлорували і обробляли аміном з утворенням цільового дез-метилпіролопіримідину, як показано вище. Наприклад, на схемі VIII зображений синтез сполуки (18). Комерційно доступний метилціаноацетат алкілували діетилацеталем бромацетальдегіду в присутності карбонату калію і Nal, одержуючи (19). Циклізацію у піримідин (20) проводили в дві стадії. Спочатку, утворювався піримідин-ацеталь при реакції (19) з гідрохлоридом бензамідину з використанням 2 еквівалентів ДБУ. В одержаному піримідин-ацеталі без очищення знімали захисну групу водної 1н НСl і одержаний альдегід циклізували у піроло-піримідин (20), який виділяли фільтруванням. Взаємодія (20) з оксихлоридом фосфору при кипінні із зворотним холодильником приводила до відповідного 4хлорпохідного (21). Зв'язування хлорпохідного з транс-4-аміноциклогексанолом в ДМСО при 135°С давало сполуку (18) із сполуки (21). На схемах II-VIII продемонстровано, що можна функціоналізувати 5- і 6-положення піролопіримідинового кільця. З використанням різних вихідних реагентів і незначних модифікацій вищезгаданих реакційних схем різні функціональні групи можуть бути введені в 5- і 6-положення у формулі (І) і (II). Деякі приклади проілюстровані у таблиці 2. Кваліфікованому фахівцеві відомо, що метаболізм описаних тут сполук у суб'єкта буде приводити до деяких біологічно активних метаболітів, які служать як лікарські засоби. Винахід далі проілюстрований наступними прикладами, які жодним чином не треба розглядати як додаткове обмеження. Зміст всіх посилань, що чекають рішення заявок на патенти і опублікованих заявок на патенти, процитованих в даній заявці, включаючи процитовані в розділі «Передумови створення винаходу», включений в даний опис як посилання. Потрібно розуміти, що моделі, використані у прикладах, є загальноприйнятими моделями, і демонстрування ефективності на даних моделях передбачає ефективність на людях. Одержання 1. Використали модифікацію способу алкілування Seela і Lüpke1. До розчину, що о холоджується льодом, (0°С) етилціаноацетату (6,58г, 58,1ммоль) в МеОН повільно додавали розчин NaOMe (25% ваг./об.; 58,1ммоль). Через 10 хвилин повільно додавали хлорацетон (5мл; 62,8ммоль). Через 4 години розчинник видаляли. Коричневе масло розбавляли ЕtOАс (100мл) і промивали Н 2О (100мл). Органічну фракцію сушили, фільтрували і концентрували, одержуючи коричневе масло (7,79г; 79%). Масло (3) (схема IV) являло собою суміш продуктів метилового/етилового складних ефірів (9/1) і його використали без додаткового очищення. 1H-ЯМР (200МГц, CDCl3) d 4,24 (кв, J=7,2Гц, ОСН2), 3,91 (дд, 1Н, J=7,2, 7,0Гц, СH), 3,62 (с, 3Н, ОСН3), 3,42 (дд, 1Н, J=15,0, 7,1Гц, 1xСН2); 3,02 (дд, 1Н, J=15,0, 7,0Гц, 1xСН2); 2,44 (с, 3Н, СН3), 1,26 (т, J=7, 1Гц, складноефірний-СН3). 1 Seela F.; Lüpke U. Chem.Ber. 1977, 110, 1462-1469. Одержання 2: Використали метод Seela і Lüpke1. Таким чином, захист кетону (3) (схема IV; 5,0г, 32,2ммоль) етиленгліколем (4мл, 64,4ммоль) в присутності TsOH (100мг) давала 4 у вигляді масла (схема IV; 5,2г, 81,0) після флеш-хроматографії (SiO2; 3/7 EtOAc/гексани, Rf 0,35). Продукт все ще містить 5% етилового складного ефіру: 1H-Я МР (200МГц, CDCl3) d 4,24 (кв, J=7,2Гц, ОСН2), 3, 98 (с, 4Н, 2 xацетальний-СН2), 3,79 (с, 3Н, ОСН3), 3,62 (дд, 1Н, J=7,2, 7,0Гц, СН), 2,48 (дд, 1Н, J=15,0, 7,1Гц, 1xСН2), 2,32 (дд, 1Н, J=15,0, 7,0Гц, 1xСН2); 1,35 (с, 3Н, СН3), 1,26 (т, J=7,1Гц, складноефірний-СН3); Мас-спектр (ES-електророзпилення): 200,1 (M++1). 1 Seela F.; Lüpke U. Chem.Ber. 1977, 110, 1462-1469. Одержання 3: Розчин ацеталю (4) (схема IV; 1,0г, 5,02ммоль), бензамідину (786мг, 5,02ммоль) і ДБУ (1,5мл, 10,04ммоль) в сухому ДМФ (15мл) нагрівали при 85°С протягом 15 годин. Суміш розбавляли СНСl3 (30мл) і промивали 0,5н NaOH (10мл) і Н2О (20мл). Органічну фракцію сушили, фільтрували і концентрували, одержуючи коричневе масло. Була зроблена спроба флеш-хроматографії (SiO2; 1/9 EtOAc/CH 2Cl2, Rf 0,35), але речовина кристалізувалась на колонці. Силікагель промивали МеОН. Фракції, що містять продукт (5) (схема IV), концентрували і використовували без додаткового очищення (783мг, 54,3%): 1H-ЯМР (200МГц, CDCl3) d 8,24 (м, 2Н, Ar-H), 7,45 (м, 3Н, Аr-Н), 5,24 (ушир.с, 2Н, NH2), 3,98 (с, 4Н, 2 xацетальний-СН2), 3,603,15 (м, 2Н, СН2), 1,38 (с, 3Н, СН3); Мас-спектр (ES): 288,1 (М++1). Одержання сполуки (20) (схема VIII): Розчин ацеталю (19) (4,43г, 20,6ммоль) 1, гідрохлориду бензамідину (3,22г, 20,6ммоль) і ДБУ (6,15мл, 41,2ммоль) в безводному ДМФ (20мл) нагрівали при 85°С протягом п'ятнадцяти годин. Суміш розбавляли СНСl3 і промивали Н2О (2x50мл). Органічну фракцію сушили, фільтрували і концентрували, одержуючи темно-коричневе масло. Темно-коричневе масло перемішували в 1н НСl (100мл) протягом 2 годин при кімнатній температурі. Одержану суспензію фільтрували, одержуючи НСl сіль сполуки (20) у вигляді золотисто-коричневої твердої речовини (3,60г, 70,6%); 1H-ЯМР (200МГц, ДМСО-d6) 11,92 (с, 1Н), 8,05 (м, 2Н, Аr-Н), 7,45 (м, 3Н, Аr-Н), 7,05 (с, 1Н, пірол-Н); Мас-спектр (ES): 212,1 (М++1). Одержання 4: Розчин ацеталю (5) (700мг, 2,44ммоль) в 1н НСl (40мл) перемішували протягом 2 годин при кімнатній температурі. Одержану суспензію фільтрували, одержуючи НСl сіль 2-феніл-6-метил-7Н-піроло[2,3d]піримідин-4(3Н)-ону у вигляді золотисто-коричневої твердої речовини (498мг, 78,0 1H-ЯМР (200МГц, ДМСО-d6) d 11,78 (с, 1Н), 8,05 (м, 2Н, Ar-Н), 7,45 (м, 3Н, Ar-Н), 6,17 (с, 1Н, пірол-Н), 2,25 (с, 3Н, СН3); Масспектр (ES): 226,1 (М++1). Одержання 5: Використали модифікацію способу циклізації Chen et al.1 До розчину броміду (9), що охолоджується льодом (0°С), (схема V; 20,0г, 108ммоль, 90% чистота) в ізопропіловому спирті (60мл) повільно додавали розчин a-метилбензиламіну (12,5мл, 97,3ммоль). Чорний розчин залишали нагріватись до кімнатної
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of pyrrolo[2,3-d]pyrimidine, specific to adenosine a1, a2а and a3 receptors, a method for producing thereof and a pharmaceutical composition
Автори англійськоюCastelhano Arlindo L., McKibben, Bryan
Назва патенту російськоюПроизводные пирроло[2,3-d]пиримидина, специфические к аденозиновому a1, a2а и a3 рецептору, способ их получения и фармацевтическая композиция
Автори російськоюКастелано Арлиндо Л.
МПК / Мітки
МПК: A61P 37/08, A61K 9/08, A61P 11/06, A61P 11/02, A61P 9/06, A61K 45/00, A61P 11/00, A61P 25/20, A61P 9/08, A61P 43/00, C07D 487/04, A61P 7/00, A61P 39/06, A61P 5/46, A61P 29/00, A61P 25/16, A61P 13/12, A61P 27/06, A61P 11/08, A61P 9/04, A61P 25/00, A61P 25/28, A61P 9/00, A61K 31/519, A61P 27/02
Мітки: спосіб, аденозинового, одержання, фармацевтична, піроло[2.3-d]піримідину, композиція, рецептора, специфічні, похідні
Код посилання
<a href="https://ua.patents.su/95-74228-pokhidni-pirolo23-dpirimidinu-specifichni-do-adenozinovogo-a1-a2a-i-a3-receptora-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні піроло[2,3-d]піримідину, специфічні до аденозинового a1, a2а і a3 рецептора, спосіб їх одержання та фармацевтична композиція</a>
Попередній патент: Пристрій для розподілу мінеральних добрив
Наступний патент: Сталевий корд для зміцнення гумових шин та/або конвеєрних стрічок
Випадковий патент: Система електронної торгівлі нематеріальними активами та інноваційними продуктами через мережу інтернет












