Похідні аміноалкілбензолу оба їх фармацевтично прийнятні солі з кислотами
Формула / Реферат
Производные аминоалкилбензола общей формулы
R1
где R1 и R2 каждый обозначают водород, низший алкил или вместе образует неразветвленный алкилен С2-С4; Q-С4-С11- алкилен, минимум с двумя атомами углерода между двумя свободными валентностями; Υ - простая связь, R - обозначает, что кольцо незамещено или замещено галогеном, трифторметилом, нитрогруппой или низшим алкилом, или их фармацевтически приемлемые соли с кислотами.
Текст
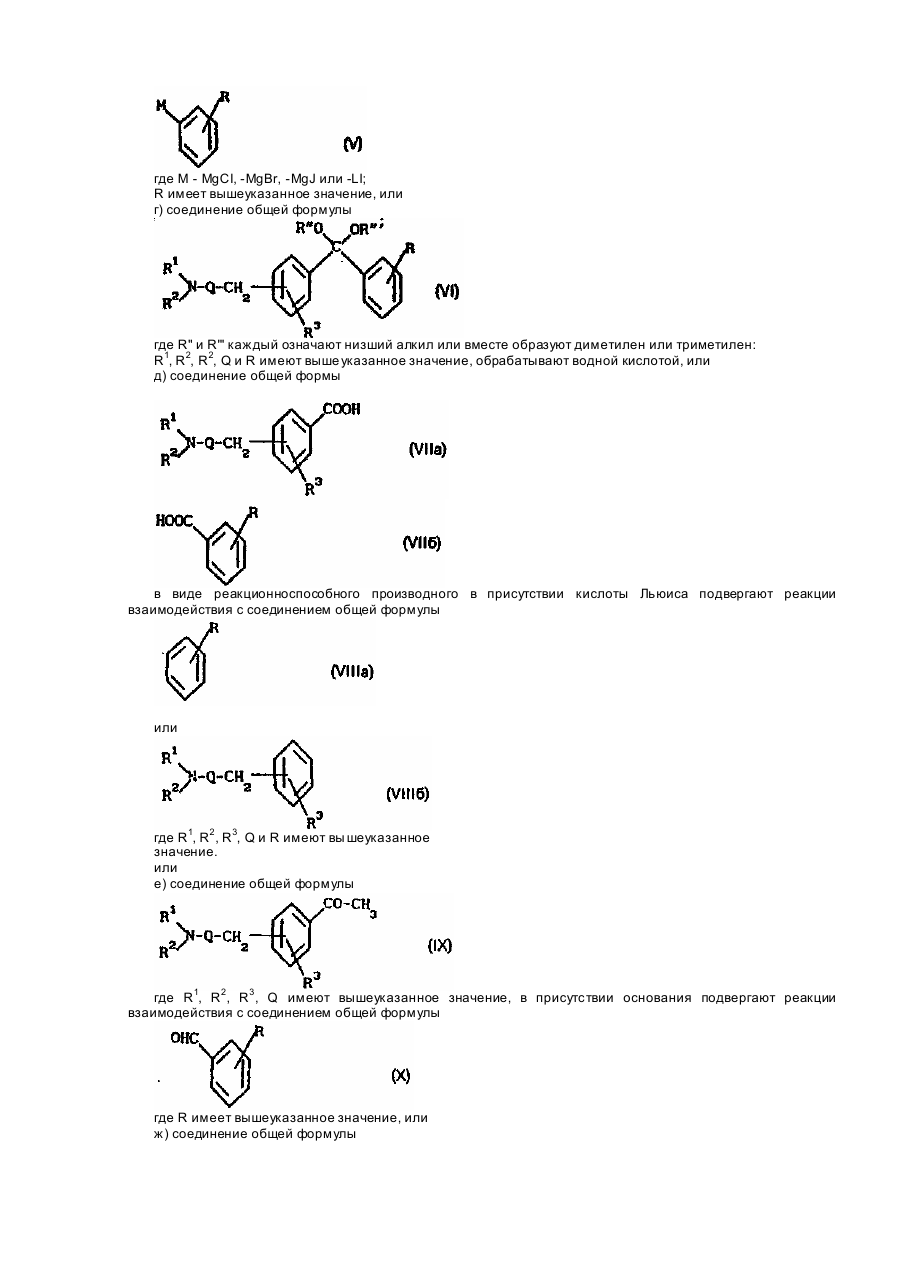
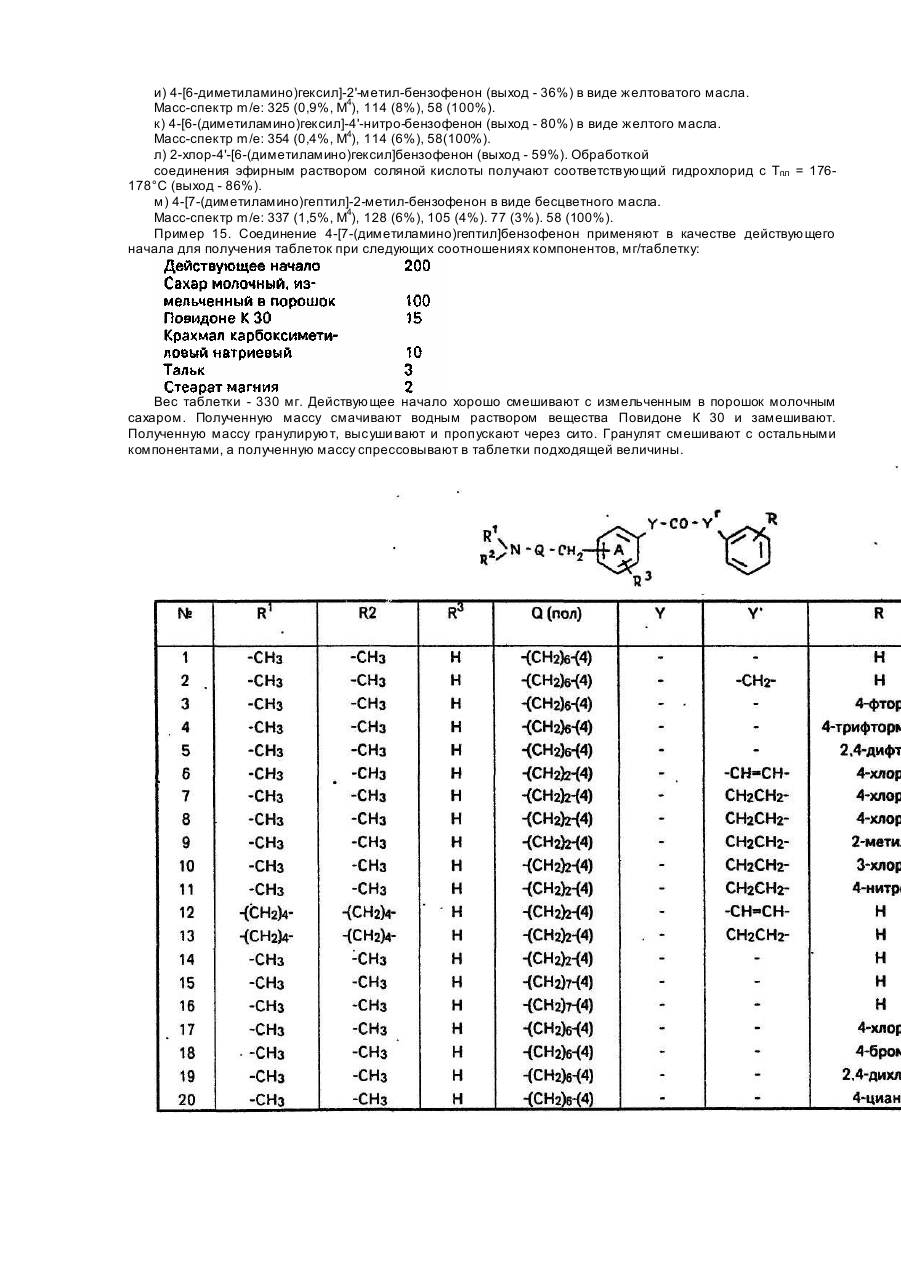
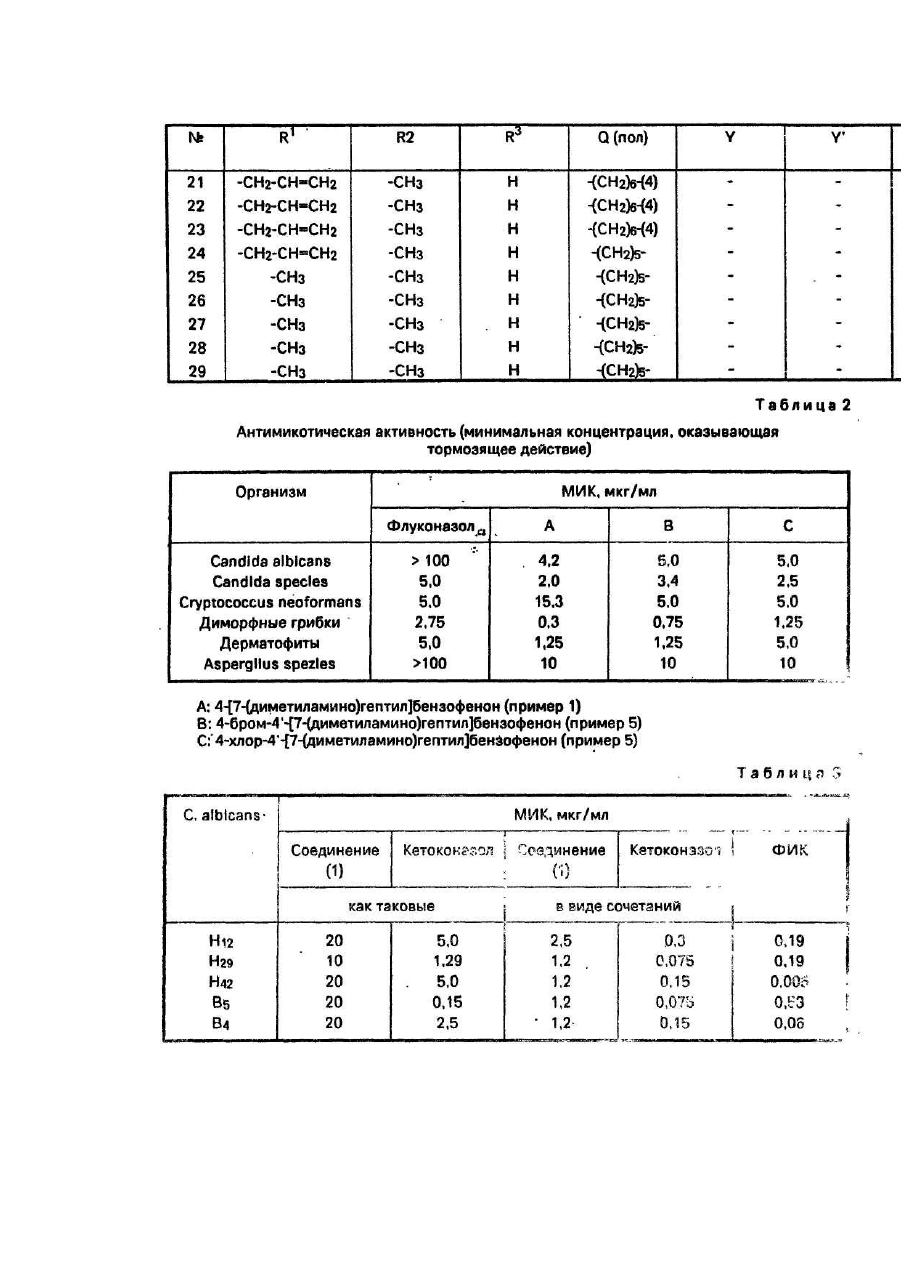
Изобретение относится к соединениям общей формулы (I) где R1 и R2 - каждый означают водород, низший алкил или вместе образуют нераз-ветвленный алкилен С2-4; Q - алкилен С 4-11 минимум с двумя атомами С между двумя свободными валентностями; R означает, что кольцо не замещено или замещено галогеном, трифторметилом, нитрогруппой или низшим алкилом, а также к приемлемым для фармацевтических целей солям этих соединений с кислотами. Эти соединения обладают ценными фармакологическими свойствами, в частности имеют выраженные противогрибковое и синергическое действия в комбинации с известными противогрибковыми веществами, подавляющими биосинтез таких стеролов, как кетоцоназол и тербинафин. Поэтому соединения формулы (I) можно использовать в качестве лекарств, в частности для борьбы с топическими или системными заражениями, вызываемыми патогенными грибками, или для предупреждения подобного рода заражений. Выражение "низший" обозначает остатки и соединения с числом атомов С не более семи, предпочтительно не более четырех. Выражение "алкил" обозначает неразветвленные или разветвленные насыщенные углеводородные остатки, например метил, этил, пропил, изопропил, трет-бутил. Выражение "алкокси" обозначает присоединенные через атом кислорода алкилы, такие как метокси и этокси. Выражение "алкилен" обозначает неразветвлениые или разветвленные насыщенные углеводородные остатки с двумя свободными валентностями, такими как ди-метилен, триметилен, тетраметилен, пентаметилен, гексаметилен. Выражение "галоген" обозначает четыре вида галогенов - фтор, хлор, бром, йод. В рамках этого аспекта изобретения предпочитаются следующие соединения формулы (I): 3-(4-хлорфенил)-4'-[3(диметиламино)пропил]пропиофенон; 3-(2-метилфенил)-4'-[3-(Диметиламино)пропил]пропиофенон; (Е)-3-фенил-4'-[3-(1-пирролидинил)пропил]акрилофенон. Новые соединения формулы (I) и их приемлемые для фармацевтических целей соли с кислотами согласно изобретению получают тем, что а) соединение общей формулы где X - отщепляемая группа; R3, Q, R имеют выше указанное значение, подвергают реакции взаимодействия с амином общей формулы HNR1R2. где R1 и R2 имеют выше указанное значение, б) соединение общей формулы где R1, R2 , R3, Q, R имеют выше указанное значение, окисляют, или в) соединение общей формулы где R1 - низший алкил; R1, R2 R3, Q имеют выше указанное значение, подвергают реакции взаимодействия с соединением общей формулы где Μ - MgCI, -MgBr, -MgJ или -LI; R имеет вышеуказанное значение, или г) соединение общей формулы где R" и R'" каждый означают низший алкил или вместе образуют диметилен или триметилен: R1, R2, R2, Q и R имеют выше указанное значение, обрабатывают водной кислотой, или д) соединение общей формы в виде реакционноспособного производного в присутствии кислоты Льюиса подвергают реакции взаимодействия с соединением общей формулы или где R1, R2 , R3, Q и R имеют вы шеуказанное значение. или е) соединение общей формулы где R1, R2 , R3 , Q имеют вышеуказанное значение, в присутствии основания подвергают реакции взаимодействия с соединением общей формулы где R имеет вышеуказанное значение, или ж) соединение общей формулы или где Q' - гр уппа Q, уменьшенная на атом водорода; R1, R2, R3, Q и R имеют выше указанное значение, гидрируют и з) полученное соединение формулы (I) при необходимости переводят в приемлемую для фармацевтических целей соль с кислотой. Реакцию взаимодействия соединения формулы (II) с амином HNR1R2 согласно варианту а) способа осуществляют известными специалисту методами. Ее, в частности, проводят в полярном растворителе и в присутствии основания в качестве акцептора кислоты в температурном интервале около 0-150°С. При этом пригодными растворителями являются, например, такие низшие спирты, как метанол и этанол, и такие низшие диалкил кетоны, как ацетон. Пригодными основаниями являются, например, амин формулы NHR1R2 в избытке, третичные амины, например, триэтиламин, и такие неорганические основания, как карбонаты, гидроокиси и алкоголяты щелочных металлов. Реакцию окисления соединения (III) согласно варианту б) также осуществляют известными специалисту методами, в частности в присутствии инертного растворителя и б присутствии окислителя в приблизительном температурном интервале от -80°С до комнатной температуры. Пригодными растворителями являются, например, хлорированные низшие углеводороды, например, метиленхлорид и хлороформ. Пригодными окислителями являются, например, двуокись марганца или смеси ДМСО с оксалилхлоридом, дициклогексилкарбодиимидом или ацетангидридом и третичным амином, например триэтиламином. Реакцию взаимодействия соединения (IV) с соединением (V) по варианту в) также осуществляют известными специалисту способами, в частности в инертном растворителе и в приблизительном температурном интервале от -80°С до комнатной температуры. Подходящими растворителями являются, например, такие нециклические и циклические простые эфиры, как диэтиловый эфир, метил-трет-бутиловый эфир и тет-рагидрофуран,.и смеси этих соединений. Для обработки соединения формулы VI водной кислотой согласно варианту г) применяют предпочтительно разбавленную водную минеральную кислоту, например разбавленную соляную, и проводят реакцию в температурном интервале примерно от 0°С до комнатной температуры. Реакцию взаимодействия реакционноспособного производного соединения формулы (Vila) с соединением формулы (Villa) или реакционноспособного соединения формулы (VII6) с соединением формулы (VIII6) согласно варианту д) способа осуществляют известными специалисту методами. Реакцию проводят предпочтительно в инертном растворителе и в присутствии кислоты Льюиса в температурном интервале примерно от 0°С до примерно 100°С, Подходящими растворителями являлися, например, такие галогенированные низшие углеводороды, как метиленхлорид, хлороформ и этиленхлорид, нитробензол, сероуглерод и избыток соединения формулы (VIlla). В качестве кислоты Льюиса применяют предпочтительно хлористый алюминий, Подходящими реакционноспособными производными соединений формулы (Vila) или (VI16) являются, например, хлориды карбоновых кислот. Реакцию взаимодействия соединения формулы (IX) с соединением формулы (X) в присутствии основания согласно варианту е) способа осуществляют известными специалисту способами. Реакцию осуществляют преимущественно в полярном растворителе и в температурном интервале около 0-60° Подходящими растворителями являются, например, низшие спирты, такие как метанол и этанол, и смеси этих соединений с водой. В качестве оснований применяют предпочтительно карбонаты и гидроокиси щелочных металлов, такие как карбонат калия и гидроокись натрия. Реакцию гидрирования соединения формулы (I) или (XI) согласно варианту ж) способа осуществляют известными специалисту методами, в частности в полярном растворителе с элементарным водородом в присутствии пригодного катализатора гидрирования и в приблизительном температурном интервале от 0°С до комнатной температуры. Пригодными растворителями являются также низшие спирты, как метанол и этанол. Пригодными катализаторами являются, например, палладий или платина на угле, окись платины или никель Ранея. Получение приемлемых для фармацевтических целей солей соединений формулы (I) с кислотами согласно варианту з) способа осуществляют известными специалисту способами. Имеются в виду соли с приемлемыми для фармацевтических целей неорганическими или органическими кислотами. Предпочтительными солями с кислотами являются гидрохлориды, гидробромида, сульфаты, -нитраты, цитраты, ацетаты, сукцинагы, Фумараты, метансульфонаты, п-толуолсульфонаты. Соединения формулы (I) и их приемлемые для фармацевтических целей соли с кислотами обладают ценными противогрибковыми качествами. Они оказываются эффективными в борьбе со множеством патогенных грибков, вызывающих топические и системные заражения, например с такими видами грибков, как Candida albicans и Histopiasma capsulatum. Незаменимым энзимом в жизнедеятельности грибков, участвующим в биосинтезе стерола эукариотической клетки, является 2,3-эпоксиквален-ланостерол-циклаза. Так, штаммы S.cerevlslae, лишенные этого энзима, не жизнеспособны (см. F.Karst F.Lacroute, Molec. Gen. Genet. 154, 269 (1977), Тормозящее действие соединений формулы (і) на вышеназванный энзим, содержащийся в грибке С. albicans, выбрали как критерий противогрибкового действия. Торможение можно измерить, например, нижеописанным методом. Установление торможения активности 2,3-эпоксисквален-ланостерол-циклазы грибка Candida albicans определением значения ІС50. Сначала собирают клетки культуры Candida albicans в конце логарифмической фазы роста и промывают их 100 мМ фосфатным буфером (рН - 6,9) - буфером для переваривания, и 50 мМ фосфа тным буфером (рН - 7,4), содержащим 1 Μ маннита и 5 мМ DTT. 1,0 г клеток взвешивают в 5 мл буфера для переваривания и во взвесь добавляют 1 мг зимолазы 100Т (ф-мы Selkagaku Kogyo, Япония) и 12,5 мкл b-меркаптоэтанола, после чего ее выдерживают в течение 30 мин при 30°С. Образовавшиеся за это время протопласты отделяют путем центрифугирования (10 мин при 2500 д) с последующим их разрывом путем добавления 2 мл 100 мМ фосфатного буфера (рН - 6,9). В результате повторного центрифугирования (10 мин при 10000 д) получают надосадочную жидкость, представляющую собой не содержащий клеток экстракт (CFE). Последний разбавляют до содержания 10 мг белка/мл, после чего значение рН доводят до 6,9. Активность 2,3-эпоксисквален-ланосте-рол-циклазы в CFE измеряют обработкой эпоксида сквалена -С 14 в присутствии n-децилпентаоксиэтилена в качестве детергента. Титрацией подходящих количеств испытуемого вещества определяют значения IC50. т.е. концентрацию испытуемого вещества, уменьшающую активность энзима на половину. Этот опыт проводят следующим образом. Обработкой ультразвуком сначала приготовляют 250 мкМ раствор эпоксида сквалена-С 14 в 100 мМ фосфатном буфере (рН - 6,9), содержащем 1 % nдецилпентаоксиэтилена. К 100 мкл этого раствора добавляют 20 мкл раствора испытуемого вещества (или 20 мкл чистого диметилсульфоксида в качестве контроля). После добавления 880 мкл CFE хорошо смешанный раствор со встряхиванием выдерживают в течение 1 ч при 30°С. Затем добавлением 500 мкл 15%-ной гидроокиси калия в 90%-ном этаноле прекращают реакцию. Полученную смесь два раза экстрагируют 1 мл n-гексана, после чего упаривают гексан и образовавшийся липидный остаток смешивают с 200 мкл диэтилового эфира. После тонкослойной хроматографии продукта на силикагеле с метиленхлоридом в качестве растворителя пластинки ТСХ исследуют с помощью сканирующего устройства для установления наличия радиоактивных ве ществ. В вышеописанных условиях в качестве радиоактивного продукта обнаруживают только ланостерол. Количество последнего сравнивают с количеством радиоактивного ланостерола в контрольном веществе. Значение IC50 определяют графическим способом, и их указывают в мкг испытуемого вещества на мл. В табл. 1 приведены значения IC50 для показательных представителей соединений формулы (I), а также данные об острой токсичности при подкожном введении испытуемых соединений мышами (ЛД50 в мг/кг). Вышеуказанное синергическое действие соединений формулы (I) и их фармацевтически приемлемых солей с кислотами в комбинации с ингибиторами биосинтеза стерола, например кетоконазола, можно, например, показать методом серийного разведения на агаре. В этих целях используют казеиновый агар типа "Casitonagar" и инокуляры (10 клеток/мл) двухсуточных культур Candida albicans. Тест-вещества (соединения формулы (I), ТВ) наносят в концентрациях 80-1,25 мкг/мл, а ингибиторы биосинтеза стерола (ИБС) - в концентрации 20-0,001 мкг/мл) с кратностью разведения 1:2. Культуры в течение 2 сут инкубируют при 37°С. Определяют минимальную ингибирующую концентрацию (МИК) отдельных действующих начал в чистом виде и в комбинации с другими вещества. Исходя из значений МИК, вычисляют фракционированную ингибирующую концентрацию (ФИК) по следующей формуле: Соединения формулы (I) имеют синергическое действие при том условии, что значение ФИК 230°С )с разл.); ° к) гидрохлорид (Е)-3-(4-фторфенил)-4'-[3-(диметиламино]пропил]акрилофенона; тПл =219-220,5°С (из этанола); л) гидрохлорид (Е)-3-(2-метилфенил)-4'-[3-(диметиламино]-пропил]акрилофенона; Тпл = 150,5-152°С (из смеси этанола и толуола). Πример 11. Аналогично примеру 9 можно получить нижеприведенные соединения· а) 3-)4-метилфенил)4'-[3-(диметила-мино)пропил]пропиофенон в виде масла; 1Н-ЯМР (CDCl3, 400 МГц): 2,22 (с, 6Н); 2,32 (с, ЗН) ррт; б) 3-(4-изопропилфенил)-4'-[3-(диметиламино)пропил]-пропиофенон в виде масла; масс-спектр m/e: M+ 337 (5), 133 (4), 58 (100); в) 3-(4-мстоксифенил)-4'-[3-(диметиламино)пропил]пропиофенон в виде сиропа; масс-спектр m/e: M+ 325 (4), 121 (9), 58 (100); г) 3-(4'-трифторметилфенил)-4'-[3-(диметиламино)пропил]-пропиофенон в виде масла; масс-спектр m/e: M+ 363 (2), 159 (3), 58 (100); д) 3-(4-метилфенил)-4'-[3-(диметиламино)пропил]пропиофенон в виде масла; масс-спектр m/e: M+ 309 (10,4), 145 (3,8), 105 (7,0), 58(100); е) 3-(3-хлорфенил)-4'-[3-(диметиламино)пропил]пропиофенон в виде масла; масс-спектр m/e: M+ 329 (1,0), 125 (2,5), 58 (100); ж) 3-фенил-4'-[3-(этилметиламино)пропил]пропиофенон в виде сиропа; масс-спектр m/e: M+309 (6), 294 (1), 91 (6), 72 (100); з) 3-{4-трет.бутилфенил)-4'-[3-(диметиламино)пропил]-пропиофенон в виде масла; масс-спектр: М+ 351 (34,7), 131 (32,8), 91 (34,5), 58 (100); и) 3-(4-фторфенил)-4'-[3-(диметиламино)пропил]пропиофенон в виде сиропа; масс-спектр m/e: М+313(3), 109 (11), 58 (100); й) 3-(2-метилфенил)-4'-[3-(диметиламино)пропил]пропиофенон; тПл 145-147°С (из ТГФ); к) 3-фенил-4'-[3-(1-пирролидинил)пропил]пропиофенон в виде сиропа; масс-спектр m/e: M+ 321 (7). 91 (6), 84 (100). Πример 12. Аналогично примеру 1 можно получить, например, следующие соединения: а) 4-[5(диметиламино)пентил]бензофенон в виде бесцветного масла (выход -96 %). Масс-спектр m/e: Μ 295 (2%, Μ ), 100 (3%), 58(100%). б) 4-[8-(диметиламино)октил]бензофенон в виде бесцветного маслэ (выход - 88%). Масс-спектр m/e: M¥ 337 (2%, М+), 149 (2,8%), 105 (3.3%), 58 (100%). Πример 13. а) К раствору 10 г 7-хлор-гептанола [Rec. Trav. Chim. Pays-Bas, 99, 87 (1980)] и 18,7 мл триэтиламина в 100 мл метиленхлорида в атмосфере аргона при 0°С в течение 1 ч по каплям добавляют раствор 13,3 г р-толуолсульфонилхлорида в 100 мл метиленхлориде. Реакционную массу перемешивают в течение б ч при комнатной температуре, после чего ее промывают два раза 200 мл 2 н. соляной кислоты, два раза 200 мл насыщенного раствора бикарбоната натрия и один раз 200 мл насыщенного раствора хлорида натрия. Затем высушивают органическую фазу сульфатом магния и концентрируют ее. Полученный сырой 7хлоргеп-тил-р-толуолсульфонат (19,5 г. 96%) растворяют в 40 мл ТГФ с 0,6 ммоль тетрахлоркупрата дилития. Этот раствор охлаждают до 0°С в атмосфере аргона. Затем в течение 2 ч по каплям добавляют раствор бромида фенилмагния, полученного из 3,1 г магниевой стружки и 20 г бромбензола в 80 мл ТГФ. Полученную реакционную массу перемешивают в течение 18 ч при комнатной температуре и выпаривают. К остатку добавляют 200 мл насыщенного раствора хлористого аммония и три раза экстрагируют диэтиловым эфиром (по 200 мл). Органические фазы высушивают сульфа том магния и выпаривают. Остаток перегоняют в высоком вакууме при 100-110°С и под давлением около 13,4 Ма. В результате получают 13 г (86%) 7-хлоргептилбензола в виде бесцветной жидкости. б) 1,07 г 7-хлоргептилбензола и 0,89 г 4-хлорбензоилхлорида растворяют в 10 мл нитробензола, после чего в атмосфере аргона с охлаждением льдом добавляют 0,82 г хлористого алюминия. Полученную смесь перемешивают в течение 18 ч при комнатной температуре, после чего смесь смешивают со 100 мл ледяного 2 н. раствора соляной кислоты и три раза экстрагируют диэтиловым эфиром (по 50 мл). Органические фазы промывают сначала 50 мл 10%-ного раствора бикарбоната натрия и потом 50 мл насыщенного раствора хлорида натрия, после чего их высушивают суль фатом магния и концентрируют. Потом удаляют нитробензол, перегоняя массу при 80-100°С под давлением 20 Па. В результате перегонки при 240-250°С и под давлением около 13,4 Па получают 1,32 г (74%) 4-хлор-4'-(7-хлоргеп-тил)бензофенона в виде желтоватого масла. Данные 1Н-ЯМР-анализа (CDCl 3): 1,2-1,9 (м, 9Н)Ь 1,71 (т, J - 7,5 Гц, 2Н), 3,53 (т. J -7,2 Гц, 2Н), 7,2-7,9 (м. 8Н) ррт. в) 1.32 г 4-хлор-4'-(7-хлоргептил)бензофенона и 0.85 г йодида натрия нагревают при температуре дефлегмации в 20 мл этилметилкетона. Через 24 ч выпаривают реакционную массу. Остаток взвешивают в 50 мл воды и экстрагируют три раза этилацетатом (по 50 мл). Собранные органические фазы промывают 50 мл насыщенного раствора хлорида натрия, высушивают сульфа том магния и выпаривают. Получают 1,5 г (90%) сырого 4-хлор-4'-(7-йодгептил)бензофенона в виде желтоватого масла, которое без дальнейшей очистки применяют на следующей стадии способа. г) К этому сырому маслу добавляют 10 мл 33%-ного раствора диметиламина в этаноле. Массу перемешивают в течение 24 ч при комнатной температуре, поток ее выпаривают. Остаток растворяют в 50 мл 1 н. соляной кислоты и промывают три раза диэтиловым эфиром (по 50 мл). Охлаждая водную фазу льдом, ее доводят до щелочной реакции с помощью 2 н. раствора едкого натра. После этого ее экстрагируют три раза диэтиловым эфиром (по 50 мл). Органические фазы высушивают сульфатом магния и выпаривают. Сырой продукт хроматографируют на сили-кагеле (100 г) смесью метиленхлорида, метанола и хлористого аммония (90:10:1). Получают 0.6 г (51%) 4-хлор-4'-[7-(диметила-мино)гептил]бензофенона β виде бесцветного масла. Масс-спектр m/e: 357 (0.6%. М+). 128(4%), 58(100%). Πhимер 14. Аналогично примеру 13 можно получить нижеприведенные соединения: а) 4-бром-4'-[7(диметиламино)гептил]бензофенон в виде бесцветного масла (выход - 38%). После добавления эфирной соляной кислоты получают соответствующий гидрохлорид с Тпл = 122-123°С (выход -85%). б) 2,4-дихлор-4'-[7-(диметиламино)гептил]бензофенон в виде бесцветного масла (выход-73%). Масс-спектр m/e: 391 (0.3%, Μ4), 173 (1,3%), 128 (4.2%), 58 (100%). в) 4-[4-(диметиламино)гептил]бензоил]бензонитрил в виде бесцветного масла (выход-68%). Масс-спектр m/e: 348 (0,6%, Μ4), 128 (2,7%), 58 (100%). г) 4-[4'-(аллилметиламино)гептил]бензо-фенон (выход - 66%) в виде бесцветного масла. Масс-спектр m/e: 349 (1,5%, Μ4), 167 (4,3%), 84 (100%). д) 4-[7-(аллилметиламино)гептил]-4'-бромбензофенон в виде желтоватого масла (выход-62%). Масс-спектр m/e: 427 (0,7%, Μ4), 400 (3.3%). 84 (100%). є) 4-[4'-[7-{аллилметиламино)гептил]бензоил]бензонитрил в виде желтого масла (выход-46%). Масс-спектр m/e: 374(2%. М^, 345(8%), 84(100%). ж) Гидрохлорид 4-бром-4'-[6-(диметиламино)гексил]бензофенона (выход - 82%) в виде бесцветных кристаллов с тПл = 115-117°С. з) 4-[6-(зллилметиламино)гексил]-4'-бромбензофенон (выход - 77%) в виде бесцветного масла. Масс-спектр m/e: 415 (0,8%, Μ4). 413 (0.8%), 386 (2%). 84 (100%). и) 3-бром-4'-[6-(диметиламино)гексил]бензофенон (выход - 48%) в виде желтоватого масла. Масс-спектр m/e: 387 (0.3%, Μ4). 114 (7%), 58 (100%). и) 4-[6-диметиламино)гексил]-2'-метил-бензофенон (выход - 36%) в виде желтоватого масла. Масс-спектр m/e: 325 (0,9%, Μ4), 114 (8%), 58 (100%). к) 4-[6-(диметиламино)гексил]-4'-нитро-бензофенон (выход - 80%) в виде желтого масла. Масс-спектр m/e: 354 (0,4%, Μ4), 114 (6%), 58(100%). л) 2-хлор-4'-[6-(диметиламино)гексил]бензофенон (выход - 59%). Обработкой соединения эфирным раствором соляной кислоты получают соответствующий гидрохлорид с Тпл = 176178°С (выход - 86%). м) 4-[7-(диметиламино)гептил]-2-метил-бензофенон в виде бесцветного масла. Масс-спектр m/e: 337 (1,5%, Μ4), 128 (6%), 105 (4%). 77 (3%). 58 (100%). Πример 15. Соединение 4-[7-(диметиламино)гептил]бензофенон применяют в качестве действующего начала для получения таблеток при следующих соотношениях компонентов, мг/таблетку: Вес таблетки - 330 мг. Действующее начало хорошо смешивают с измельченным в порошок молочным сахаром. Полученную массу смачивают водным раствором вещества Повидоне К 30 и замешивают. Полученную массу гранулируют, высуши вают и пропускают через сито. Гранулят смешивают с остальными компонентами, а полученную массу спрессовывают в таблетки подходящей величины.
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of amino alkyl benzol or their pharmaceutically acceptable salts with acids
Автори англійськоюSYNESE Jolidon
Назва патенту російськоюПроизводные аминоалкилбензола или их фармацевтически приемлемые соли с кислотами
Автори російськоюСинез Жолидон
МПК / Мітки
МПК: A61P 31/10, C07C 211/28, A61K 9/00, C07C 225/00
Мітки: аміноалкілбензолу, прийнятні, кислотами, солі, оба, похідні, фармацевтично
Код посилання
<a href="https://ua.patents.su/10-18867-pokhidni-aminoalkilbenzolu-oba-kh-farmacevtichno-prijjnyatni-soli-z-kislotami.html" target="_blank" rel="follow" title="База патентів України">Похідні аміноалкілбензолу оба їх фармацевтично прийнятні солі з кислотами</a>
Попередній патент: Спосіб підготовки дротового електроду для електроерозійної обробки
Наступний патент: Склад для обробки деревини для надання їй вогнестійкості
Випадковий патент: Вібророторна дробарка