Спосіб одержання сполук, які мають протиракову активність
Номер патенту: 80955
Опубліковано: 26.11.2007
Автори: Лехнер Річард Шелтон, Сантафіанос Дінос Поль, Норріс Тімоті
Формула / Реферат
1. Спосіб одержання сполуки формули 9
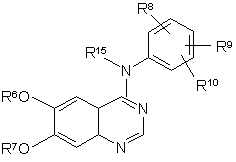 , (9)
, (9)
або її фармацевтично прийнятної солі або сольвату, в якій
R6 є C1-C10 алкілом або -(СН2)mО(СН2)nСН3;
R7 є С1-С10 алкілом або -(С1-С6 алкіл)(С6-С10 арил), де вищезгадані R7 групи, необов'язково, заміщені від 1 до 3 замісників, що незалежно вибирають з галогену, нітро, трифторметилу, трифторметокси, (С1-С6 алкіл)сульфонілу, С1-С6 алкілу, С1-С6 алкокси, С6-С10 арилокси та С6-С10арилсульфонілу;
кожна m, незалежно, є цілим числом від 1 до 6, а n є цілим числом від 0 до 3;
R8, R9 та R10 кожний, незалежно, вибирають з Н, С1-С10 алкілу, галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -OR11, -C(O)R11, -C(O)OR11, -NR12C(O)R14, -OC(O)R11, -NR12SO2R14, -SO2NR11R12, -NR12C(O)R11, -C(O)NR11R12, -NR11R12, -S(O)j(CH2)q(C6-C10 арил), -S(O)j(С1-С6 алкіл), де j є цілим числом від 0 до 2, -(CH2)q(C6-C10 арил), -O(СН2)q(С6-С10 арил), -NR12(CH2)q(C6-C10 арил) та -(СН2)q(4-10-членний гетероцикл), де q є цілим числом від 0 до 4; згадана алкільна група, необов'язково, містить 1 або 2 гетерозамісники, вибрані з О, -S(O)j-, де j є цілим числом від 0 до 2, та -N(R12)-, за умови, що два атоми О, два атоми S або атом О та S не приєднані безпосередньо один до одного; згадані арильні та гетероциклічні групи, необов'язково, сконденсовані з С6-С10 арильною групою, C5-C8 насиченою циклічною групою або з 4-10-членним гетероциклом; згадані алкільні, арильні та гетероциклічні групи, необов'язково, заміщені від 1 до 5 замісників, які незалежно вибирають з галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -NR12SO2R14, -SO2NR11R12, -C(O)R11, -OC(O)R11, -NR12C(O)R14, -NR12C(О)R11, -C(O)NR11R12, -NR11R12, -OR11, С1-С10 алкілу, -(CH2)q(C6-C10 арил) та -(CH2)q(4-10-членний гетероцикл), де q є цілим числом від 0 до 4;
кожний R11 незалежно вибирають з Н, С1-С10 алкілу, -(CH2)q(C6-C10 арил) та -(CH2)q(4-10-членний гетероцикл), де q є цілим числом від 0 до 4; згадана алкільна група, необов'язково, містить 1 або 2 гетерозамісники, вибрані з О, -S(O)j-, де j є цілим числом від 0 до 2, та -N(R12)-, за умови, що два атоми О, два атоми S або атом О та S не приєднані безпосередньо один до одного; вищезгадані арильні та гетероциклічні групи, необов'язково, сконденсовані з С6-С10 арильною групою, C5-C8 насиченою циклічною групою або з 4-10-членним гетероциклом; а вищезгадані R11 замісники, крім Н, необов'язково, заміщені від 1 до 5 замісників, які незалежно вибирають з галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -C(O)R12, -C(O)OR12, -OC(O)R12, -NR12C(O)R13, -C(O)NR12R13, -R12R13, гідрокси, C1-C6 алкілу, С1-С6 алкокси;
кожний R12 і R13 є, незалежно, Н або С1-С6 алкілом;
R14 вибирають з замісників, що згадуються у визначенні R11, окрім Н;
R15 є Н, С1-С10 алкілом або -(СH2)q(С6-С10 арил), де q є цілим числом від 0 до 4;
який включає обробку сполуки формули 10
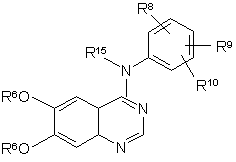 , (10)
, (10)
в якій R15, R6, R8, R9 і R10 є такими, як було визначено вище;
первинним або вторинним спиртом формули R7-OH, де R7 є С1-С10 алкілом або -(С1-С6 алкіл)(С6-С10 арил), а вищезгадані R7 групи, необов'язково, заміщені від 1 до 3 замісників, що незалежно вибирають з галогену, нітро, трифторметилу, трифторметокси, (С1-С6 алкіл)сульфонілу, С1-С6 алкілу, С1-С6 алкокси, С6-С10 арилокси та С6-С10 арилсульфонілу;
в присутності гідроксиду лужного металу або лужноземельного металу.
2. Спосіб згідно з пунктом 1, де згаданий гідроксид лужного металу або лужноземельного металу вибирають з гідроксиду натрію, гідроксиду літію, гідроксиду цезію, гідроксиду кальцію, гідроксиду магнію та гідроксиду калію.
3. Спосіб згідно з пунктом 2, де згаданим гідроксидом лужного металу або лужноземельного металу є гідроксид натрію, а згаданим спиртом формули R7-OH є первинний спирт.
Текст
1. Спосіб одержання сполуки формули 9 R8 C2 2 (19) 1 3 80955 R8 R9 R15 N R 6O R10 N N R 6O , (10) в якій R , R , R8, R9 і R10 є такими, як було визначено вище; первинним або вторинним спиртом формули R7OH, де R7 є С1-С10 алкілом або -(С1-С6 алкіл)(С6С10 арил), а вищезгадані R7 групи, необов'язково, заміщені від 1 до 3 замісників, що незалежно вибирають з галогену, нітро, трифторметилу, 15 6 Даний винахід стосується проміжних сполук та способів одержання за їх допомогою сполук, які є корисними при лікуванні гіперпроліферативних порушень, таких як рак. Патент Сполучених Штатів 5,747,489 виданий 5 травня 1998р. і який наводиться тут для довідки в повному обсязі, пов'язаний з новими серіями похідних хіназоліну, включаючи [6,7-біс(2метоксиетокси)хіназолін-4-іл]-(3-етинілфеніл)амін, які є інгібіторами erbB родини онкогенних та протоонкогенних протеїнтирозинкіназ, таких як рецептор фактору епідермального росту (РФЕР) і таким чином є корисними при лікуванні проліферативних порушень, таких як рак, у людей. Попередня патентна заявка США, що називається «Ангідрат та моногідрат мезилату N-(3етинилфеніламіно)-6,7-біс(2-метоксиетокси)-4хіназолінаміну», подана 29 квітня 1998р., від імені винахідників T. Noppis, D. Santafianos, D.J.M. Allen, R.M. Shanker та J.W. Raggon, номер справи патентного повіреного РС10074; що наводиться тут як посилання у повному обсязі і стосується ангідрату та моногідрату мезилату N-(3етинилфеніламіно)-6,7-біс(2-метоксиетокси)-4хіназолінаміну, що мають такі ж протиракові властивості, як і відповідна гідрохлоридна сіль, яка згадувалась вище. Даний винахід стосується проміжних сполук та способів одержання за їх допомогою протиракових сполук, які згадуються в патенті США і в попередній патентній заявці. Даний винахід стосується способу одержання сполук формули та фармацевтично прийнятних солей і сольватів згаданих сполук, де кожний R1 та R2 незалежно вибирають з С1-С10 алкілу та С1-С10 алкокси, де вищезгадані алкіл та алкокси, 4 трифторметокси, (С1-С6 алкіл)сульфонілу, С1-С6 алкілу, С1-С6 алкокси, С6-С10 арилокси та С6-С10 арилсульфонілу; в присутності гідроксиду лужного металу або лужноземельного металу. 2. Спосіб згідно з пунктом 1, де згаданий гідроксид лужного металу або лужноземельного металу вибирають з гідроксиду натрію, гідроксиду літію, гідроксиду цезію, гідроксиду кальцію, гідроксиду магнію та гідроксиду калію. 3. Спосіб згідно з пунктом 2, де згаданим гідроксидом лужного металу або лужноземельного металу є гідроксид натрію, а згаданим спиртом формули R7-OH є первинний спирт. необов'язково, заміщені до 2 замісників, які незалежно вибирають з гідрокси та С1-С6 алкокси; R15 є Н, С1-С10 алкілом або -(СН2)q(С6С10арил), де q ціле число від 0 до 4; котрий включає обробку сполуки формули 2, в якій R15, R1 та R2 - є такими, як було визначено вище, і G є блокувальною групою, що вибирають з -C(OH)R3R4 та -SiR3R4R5; R3, R4 та R5 кожний є, незалежно, С1-С6 алкілом; або (а) гідроксидом лужного металу або лужноземельного металу в розчиннику, що містить гідрокси-заміщений С1-С10 алкіл, коли G є C(OH)R3R4, або (б) фторидом тетра(С 1С6алкіл)амонію в апротонному розчиннику, коли G є -SiR3R4R5. В переважному втіленні, де G є -C(OH)R3R4, вищезгаданим розчинником є вторинний спирт, такий як бутан-2-ол або ізопропанол, а вищезгаданий гідроксид лужного металу або лужноземельного металу вибирають з гідроксиду натрію, гідроксиду літію, гідроксиду цезію, гідроксиду кальцію, гідроксиду магнію та гідроксиду калію, найбільша перевага віддається гідроксиду натрію. В іншому переважному втіленні, коли G є SiR3R4R5, вищезгаданою сполукою фториду тетра(С1-С6 алкіл)амонію є фторид тетра-(нбутил)амонію, і апротонний розчинник вибирають з тетрагідрофурану (ТГФ), діетилового етеру, диметоксиетану (ДМЕ), толуолу, дихлорометану, хлороформу, та суміші двох або більше з вищезгаданих розчинників, найбільша перевага віддається ТГФ. 5 80955 6 Даний винахід також стосується одержання сполуки формули 2, як це описувалось вище, яке включає обробки сполуки формули 3 1 2 в якій R та R є такими, як було визначено вище, сполукою формули 4, в якій G та R15 є такими, як вони були визначені для сполуки формули 2. В переважному втіленні вищезгаданого способу, сполуку формули 3 обробляють сполукою формули 4 в органічному розчиннику, такому як диметилформамід (ДМФА), диметилсульфоксид (ДМСО), ТГФ, ацетонітрил (MeCN), або в суміші двох або більше вищезгаданих розчинників, найбільша перевага віддається ацетонітрилу. Даний винахід також стосується одержання сполуки формули 3, як це описувалось вище, який включає обробку сполуки формули 5 тіонілхлоридом в безводному дихлорометані. В переважному втіленні кожної з вищезгаданих реакцій, R 1 та R2 обидва є 2метоксиетокси, a R15 є Н. Даний винахід також стосується одержання сполук формул 6 і 7 та їх фармацевтично прийнятних солей і сольватів, в яких R15 є таким, як було визначено вище, R6 є С1-С10 алкілом або -(CH2)mO(CH2)nCH3; R7 є С1-С10 алкілом або -(С1-С6 алкіл)(С6-С10 арил), де вищезгадані R7 групи, необов'язково, заміщені від 1 до 3 замісників, що незалежно вибирають з галогену, нітро, трифторметилу, трифторметокси, (С1-С6алкіл)сульфонілу, С1С6алкілу, С1-С6алкокси, С6-С10арилокси та С6С10арилсульфонілу; кожна m незалежно є цілим числом від 1 до 6, і n цілим числом від 0 до 3; яке включає обробку сполуки формули 8, в якій G1 є -C(OH)R3R4, і R15, R6, R3 та R4 є такими, як було визначено вище, з первинним або вторинним спиртом формули R7-OH, де R7 є таким, як було визначено вище, в присутності гідроксиду лужного металу або лужноземельного металу, такого як гідроксид натрію, гідроксид літію, гідроксид цезію, гідроксид кальцію, гідроксид магнію або гідроксид калію, більш переважним є гідроксид натрію. В переважному втіленні вищезгаданої реакції, R6 є 2-метоксиетокси і вищезгаданий спирт формули R7-OH є переважно вторинним спиртом. Даний винахід також стосується способу одержання сполук формули 9, та їх фармацевтично прийнятних солей і сольватів, в яких R15, R6 та R7 є такими, як визначено вище; R8, R9 та R10 кожний незалежно вибирають з Н, С1-С10 алкілу, галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -OR11, -C(O)R11, -C(O)OR11, -NR12C(O)OR14, -OC(O)R11, -NR12SO2R14, -SO2NR11R12, NR12C(O)R11, -C(O)NR11R12, -NR11R12,S(O)j(CH2)q(C6-C10 арил), -S(O)j(С1-С6 алкіл), де j є цілим числом від 0 до 2, -(СН2)q(С6-С10 арил), O(CH2)q(C6-C10 арил), -HR12(СН2)q(С6-С10арил), та (СН2)q(4-10-членний гетероцикл), де q є цілим числом від 0 до 4; вищезгадана алкільна група містить, хоча і необов'язково, 1 або 2 гетерозамісники, вибрані з О, -S(O)j-, де j є цілим числом від 0 до 2, та -N(R12)-, за умови що два атоми О, два атоми S, або атом О та S не приєднані безпосередньо один до одного; вищезгадані арильні та гетероциклічні групи конденсовані з, хоча і необов'язково, з С6-С10 арильною групою, С5-С8 насиченою циклічною групою або з 4-10-членним гетероциклом; а вищезгадані алкіл, арил та гетероциклічні групи, необов’язково, заміщені від 1 до 5 замісників, які незалежно вибирають з галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -NR12SO2R14, -SO2NR11R12, -C(O)R11, OC(O)R11, -NR12C(O)OR14, -NR12C(O)R11, 11 12 11 12 11 C(O)NR R , -NR R , -OR , С1-С10 алкілу, (CH2)q(С6-С10 арил), та -(CH2)q(4-10-членний гетероцикл), де q є цілим числом від 0 до 4; кожний R11 незалежно вибирають з Н, С1-С10 алкілу, -(CH2)q(C6-C10 арил), та -(CH2)q(4-10 7 членний гетероцикл), де q є цілим числом від 0 до 4; вищезгадана алкільна група містить, хоча і необов'язково, 1 або 2 гетерозамісники, вибрані з О, -S(O)j-, де j є цілим числом від 0 до 2, та -N(R12), за умови що два атоми О, два атоми S, або атом О та S не приєднані безпосередньо один до одного; вищезгадані арильні та гетероциклічні групи, необов'язково, конденсовані з С6С10арильною групою, С5-С8 насиченою циклічною групою або з 4-10-членним гетероциклом; а вищезгадані R11 замісники, окрім Н, необов'язково, заміщені від 1 до 5 замісників, які незалежно вибирають з галогену, ціано, нітро, трифторметилу, дифторметокси, трифторметокси, азидо, -C(O)R12, -C(O)OR12, -OC(O)R12, NR12C(O)R13, -C(O)NR12R13, -R12R13, гідрокси, С1С6алкілу, С1-С6алкокси; кожний з R12 і R13 є, незалежно, Н або С1-С6 алкілом; і R14 вибирають з замісників, що згадуються у визначенні R11, окрім випадку коли R14 не є H; який включає обробку сполуки формули 10, в якій R15, R6, R8, R9 та R10 є такими як було визначено вище; первинним або вторинним спиртом формули R7-OH де R7 є таким, як було визначено вище, перевага віддається первинному спирту, в присутності гідроксиду лужного металу або лужноземельного металу, такого як гідроксид натрію, гідроксид літію, гідроксид цезію, гідроксид кальцію, гідроксид магнію та гідроксид калію. Вищезгадані сполуки формул 1, 6, 7 та 9 є корисними при лікуванні гіперпроліферативних порушень, таких як рак, у ссавців. Даний винахід також стосується проміжної сполуки 2, як це описувалось вище по відношенню до одержання сполуки формули 1. Термін «галоген», так як він вживається тут і якщо не вказується інше, включає фтор, хлор, бром або йод. Переважними галогенами є фтор, хлор та бром. Термін «алкіл», так як він вживається тут і якщо не вказується інше, включає насичені моновалентні вуглеводневі радикали, що мають нерозгалужену, розгалужену або циклічну будову, або їх комбінацію. Зрозуміло, для того щоб вищезгадана алкільна група мала циклічну будову, потрібно, щоб вона мала принаймні три атоми вуглецю. Термін «арил» так як він вживається тут і якщо не трактується по іншому, включає органічний радикал, що одержується з ароматичного вуглеводню шляхом вилучення одного водню, такого як феніл або нафтил. Термін «4-10-членний гетероцикл», так як він вживається тут і якщо не трактується по іншому, включає ароматичні та не ароматичні гетероциклічні групи, що містять один або більше 80955 8 гетероатомів, кожний з котрих вибирається з О, S та N, де кожна гетероциклічна група має від 4 до 10 атомів в своїй кільцевій системі. Неароматичні циклічні групи включають групи, що мають тільки 4 атоми в своїх кільцевих системах, проте ароматичні гетероциклічні групи повинні мати принаймні 5 атомів в своїх кільцевих системах. Гетероциклічні групи включають бензоконденсовані кільцеві системи та кільцеві системи, що заміщені одним або більшою кількістю оксо замісників. Прикладом 4-членного гетероциклу є азетидиніл (що походить від азетидину). Прикладом 5-членного гетероциклу є тіазоліл, а прикладом 10-членного гетероциклу є хінолініл. Прикладами неароматичних гетероциклічних груп є піролідил, тетрагідрофураніл, тетрагідротієніл, тетрагідропіраніл, тетрагідротіопіраніл, піперидино, морфоліно, тіоморфоліно, тіоксаніл, піперазиніл, азетидиніл, оксетаніл, тієтанил, гомопіперидиніл, оксепаніл, тієпаніл, оксазепиніл, діазепиніл, тіазепиніл, 1,2,3,6-тетрагідропіридиніл, 2-піролініл, 3-піролініл, індолініл, 2Н-піраніл, 4Нпіраніл, діоксаніл, піразолініл, дитіаніл, дитіоланіл, дигідропіраніл, дигідротієніл, дигідрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3азабіцикло[3,1,0]гексаніл, 3азабіцикло[4,1,0]гептаніл, 3Н-ідоліл та хінолізиніл. Прикладами ароматичних гетероциклічних груп є піридиніл, імідазоліл, піримідиніл, піразоліл, триазоліл, піразиніл, тетразоліл, фурил, тієніл, ізоксазоліл, тіазоліл, оксазоліл, ізотіазоліл, пірроліл, хіинолінил, ізохінолініл, індоліл, бензімідазоліл, бензофураніл, циннолініл, індазоліл, індолізиніл, фталазиніл, піридазиніл, триазиніл, ізоіндоліл, птеридиніл, пуриніл, оксадиазоліл, тіадиазоліл, фуразаніл, бензофуразаніл, бензотіофеніл, бензотіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл, та фуропіридиніл. Фраза «фармацевтично прийнятна сіль» так, як він вживається тут і, якщо не трактується по іншому, включає солі кислот або основних груп, що можуть бути присутні в сполуках даного винаходу. Сполуки, що готуються згідно з даним винаходом і які мають основну природу, можуть утворювати велику кількість солей з різноманітними неорганічними і органічними кислотами. Кислоти, які можуть бути використані для приготування фармацевтично прийнятних кислотно-адитивних солей для таких основних сполук, є ті що утворюють нетоксичні кислотні солі, тобто солі, що містять фармакологічно прийнятні аніони, такі як гідрохлорид, гідробромід, гідройодид, нітрат, сульфат, бісульфат, фосфат, кислотний фосфат, ізонікотинат, ацетат, лактат, саліцилат, цитрат, кислий цитрат, тартрат, пантотенат, бітартрат, аскорбат, сукцинат, малеат, фумарат, глюконат, глюкуронат, форміат, бензоат, глютамат, метансульфонат, етансульфонат, бензолсульфонат, п-толуолсульфонат та памоат, тобто 1,1'-метилен-біс-(2-гідрокси-3-нафтоат). Сполуки, що готуються згідно з даним винаходом і які включають основну частку, таку як аміногрупа, можуть утворювати фармацевтично прийнятні солі 9 з різними амінокислотами, на додачу до вище наведених кислот. Сполуки, що одержуються у відповідності з даним винаходом і які мають кислотну природу можуть утворювати основні солі з різноманітними фармацевтично прийнятними катіонами. Прикладами таких солей можуть бути солі лужних металів або лужноземельних металів і особливо солі кальцію, магнію, натрію та калію, що входять до сполук даного винаходу. Сполуки, що одержуються у відповідності з даним винаходом мають асиметричні центри і тому існують в різних енантіомерних та діастереомерних формах. Даний винахід пов'язаний з усіма оптичними ізомерами та стереоізомерами сполук, що одержані у відповідності з даним винаходом. Сполуки формули 1 можуть також існувати як таутомери. Даний винахід пов'язаний з використанням всіх таких таутомерів та їх сумішей. Даний винахід також включає мічені ізотопами сполуки, виготовлені у відповідності з даним винаходом та їх фармацевтично прийнятні солі, які співпадають з описаними у Формулі 1, коли б не той факт, що один або більше атомів заміщаються атомом з атомною масою або масовим номером, що відрізняється від атомної маси або масового номеру, що зазвичай зустрічаються у природі. Прикладами ізотопів, які можна ввести в сполуки, можуть бути ізотопи водню, вуглецю,азоту, кисню, фосфору, фтору та хлору, такі як 2Н, 3Н, 13С, 14С, 15 N, 18O, 18O, 35S, 18F, та 36СІ. Сполуки одержані у відповідності з даним винаходом, їх похідні та фармацевтично прийнятні солі вищезгаданих сполук або похідних, що містять згадані ізотопи та/або інші ізотопи інших атомів, теж входять в рамки даного винаходу. Деякі мічені ізотопами сполуки, наприклад ті, в які введені радіоактивні ізотопи, такі як 3Н та 14С, є ефективними при дослідженні розповсюдження в тканинах лікарських препаратів та/або субстратів. Ізотопам тритію або 3Н та вуглецю-14 або 14С віддають особливу перевагу, оскільки їх легше одержувати та детектувати. Далі, заміщення більш важкими ізотопами, такими як дейтерій тобто 2Н, може надати певні терапевтичні переваги, які випливають з більшої метаболічної стабільності, наприклад підвищений in vivo період напіввиведення, або зменшена потреба в ліках, і тому, при деяких обставинах воно матиме більший ефект. Мічені ізотопами сполуки з формулою 1 даного винаходу та їх похідні можна одержати застосовуючи способи, описані в Схемах та/або в Прикладах та Способах приготування, наведених нижче, шляхом заміщення не міченого ізотопом реагенту готовим ізотопоміченим реагентом. 80955 10 11 Способи даного винаходу можна описати застосовуючи наведені вище Схеми 1-3. Описані нижче реакції проводяться при атмосферному тиску і кімнатній температурі (20-25°С) або при інших специфічних умовах. Далі, без додаткових пояснень, R1-R10, R15 G та G1 є такими як вони описані вище. В Схемі 1, сполуки формули 1 можна одержати шляхом обробки вихідної сполуки формули 5, яку одержують добре відомими фахівцям способами, тіонілхлоридом в безводному дихлорметані при температурі кипіння (біля 38-42°С при атмосферному тиску) до одержанням сполуки формули 3. Сполуку формули 2 можна одержати обробкою сполуки формули 3 сполукою формули 4 в органічному розчиннику, такому як ДМФ, ДМСО, ТГФ, MeCN, або в суміші двох чи більше розчинників, перевага віддається MeCN, при температурі від 50°С до кипіння, краще при температурі кипіння. Вищезгадані акроніми є такими як вони визначені в короткому описі винаходу, зазначеному вище. Сполуку формули 1 можна одержати шляхом обробки сполуки формули 2 гідроксидом лужного металу або лужноземельного металу в розчиннику, який містить С1-С10 алкіл, що заміщується принаймні однією гідроксигрупою де G є -C(OH)R3R4, або фторидом тетра(С1С6алкіл)амонію в апротонному розчиннику, де G є -SiR3R4R5. Де G є -C(OH)R3R4, краще щоб розчинником був вторинний спирт, такий як бутан2-ол або ізопропанол, вищезгаданий гідроксид лужного металу або лужноземельного металу може бути вибраний з поміж гідроксиду натрію, гідроксиду літію, гідроксиду цезію, гідроксиду кальцію, гідроксиду магнію та гідроксиду калію, найбільша перевага віддається гідроксиду натрію, а реакція бажано, щоб протікала при температурі від 100°С до 150°С. У випадку, коли G є -SiR3R4R5, краще щоб сполукою фториду тетра(С1-С6 алкіл)амонію був фторид тетра(н-бутил)амонію, апротонний розчинник може бути вибраний з поміж тетрагідрофурану (ТГФ), діетилового етеру, диметоксиетану (ДМЕ), толуолу, дихлорометану, 80955 12 хлороформу, та суміші двох або більше з вищезгаданих розчинників, найбільша перевага віддається ТГФ, а реакція бажано щоб протікала при температурі від кімнатної до 70°С. Протиракові сполуки формули 1 можуть бути перетворені у фармацевтично прийнятні солі, як це описується нижче. В Схемі 2, протиракові сполуки формул 6 та 7 можна одержати шляхом обробки проміжних сполук формули 8 первинним або вторинним спиртом формули R7-OH, де R7 є таким як визначено вище, в присутності гідроксиду лужного металу або лужноземельного металу, такого як гідроксид натрію, гідроксид літію, гідроксид цезію, гідроксид кальцію, гідроксид магнію та гідроксид калію, найбільша перевага віддається гідроксиду натрію, при температурі від 100°С до 150°С. Використання вторинних спиртів формули R7-OH буде мінімізувати перетворення в асиметричний аналог формули 7, в той час як застосування первинного спирту формул R7-OH підвищить відносну концентрацію асиметричного аналогу формули 7. Таким чином, в залежності від того який потрібен аналог, застосовують вторинний або первинний спирт. Сполуки формул 6 та 7 можна розділити різними способами, такими як хроматографія, які добре відомі фахівцям. Сполуки формул 6 та 7 можуть бути перетворені у фармацевтично прийнятні солі, як це описується нижче. В Схемі 3, сполуки формули 9 можна одержати шляхом обробки сполук формули 10 первинним або вторинним спиртом формули R7OH, як це описувалось вище щодо Схеми 2. Оскільки метою реакції Схеми 3 є одержання асиметричного аналога, то перевага віддається застосуванню первинного спирту формули R7-OH. Сполуки формули 9 можуть бути перетворені у фармацевтично прийнятні солі, як це описується нижче. Деякі сполуки, які одержуються у відповідності з даним винаходом, про що говорилось вище, можуть мати асиметричні атоми вуглецю. Сполуки, що мають ізомери в одному або більше центрах, існуватимуть як діастереомерні суміші, які можуть бути розділені на окремі діастереомери на основі їх фізико-хімічних відмінностей, добре відомими фахівцям способами, таким як хроматографія або фракційна кристалізація. Всі подібні ізомери включаючи суміші діастереомерів, вважаються складовою частиною винаходу. Сполуки, які розглядались вище і які мають основну природу, можуть утворювати велику кількість солей з різноманітними неорганічними і органічними кислотами. Хоча такі солі мають бути фармацевтично прийнятними для вживання ссавцями, однак на практиці часто буває необхідним спочатку виділити сполуку даного винаходу з реакційної суміші як фармацевтично не прийнятну сіль, а потім перетворити її у вільну основу, обробивши лужним реагентом, а потім перетворити вільну основу у фармацевтично прийнятну кислотно-адитивну сіль. Утворені кислотно-адитивні солі основних сполук даного винаходу легко приготувати обробивши основну 13 сполуку еквівалентною кількістю вибраної неорганічної або органічної кислоти в середовищі водного розчинника або в придатному органічному розчиннику, такому, як метанол або етанол. Після обережного випарювання розчинника утворюється тверда сіль. Вищезгадана сіль може бути також осаджена з розчину вільної основи в органічному розчиннику, якщо додати до розчину відповідну неорганічну або органічну кислоту. Сполуки, які розглядаються вище, і які мають кислотну природу можуть утворювати основні солі з різними фармакологічно прийнятними катіонами. Прикладами таких солей можуть бути солі лужних та лужноземельних металів і особливо солі натрію та калію. Такі солі одержують звичайним способом. Хімічні основи, які застосовуються як реагенти для приготування фармацевтично прийнятних основних солей даного винаходу є ті, що утворюють нетоксичні основні солі з кислотними сполуками даного винаходу. Такі нетоксичні основні солі включають похідні від таких фармацевтично прийнятних катіонів як натрій, калій, кальцій та магній. Такі солі легко приготувати обробивши відповідні кислотні сполуки водним розчином, що містить алкоксид лужного металу або гідроксид металу, а потім випарити одержаний розчин, бажано при низькому тиску. Альтернативно, їх можна одержати змішавши нижчоспиртовий розчин кислотної сполуки з алкоксидом лужного металу або гідроксидом металу і випарити отриманий розчин. В любому випадку бажано застосовувати стехіометричні кількості реагентів, для того щоб забезпечити завершення реакції та максимальний вихід кінцевого продукту. Приклади, наведені нижче конкретизують способи та проміжні сполуки даного винаходу, хоча робота не обмежується тільки ними. Приклад 1 Одержання 3[(триметилсиліл)етиніл]нітробензолу Суміш 1-бромо-нітробензолу (10,0г, 49,45ммоль) з триметилсилилацетиленом (8,4мл, 59,34ммоль) обробляли триетиламіном (33мл), після чого утворювалась невелика кількість осаду. Одержану суміш обробляли дихлорбіс(трифенілфонсфон)паладієм II (7мг, 0,01) та йодидом міді (І) (8,5мг, 0,04ммоль) і нагрівали при температурі 80-85° на масляній бані протягом 4 годин. Одержану яскраво-жовту суміш охолоджували до кімнатної температури, і потім вилучали тверду речовину шляхом фільтрації за допомогою триетиламіну (33мл). Прозорий жовтий розчин концентрували шляхом випарювання і висушування in vacuo при кімнатній температурі півдоби, одержуючи кінцевий продукт (11,11г, 102%) у вигляді темно коричневого масла. ГХ/масспектроскопія показала, що кінцева сполука була 100% чистою m/е 219(М+Н)+. Приклад 2 Одержання 3-[(триметилсиліл)етиніл]аміну Суміш нітросполуки 3[(триметилсиліл)етиніл]нітробензолу одержаної вищеописаним способом (0,86г, 3,92ммоль) в 2пропанолі (30мл), дегазували воднем і обробляли 80955 14 5% платиною на оксиді алюмінію (263мг). Суміш збовтували у атмосфері водню (30псі) в шейкері Парра протягом 22 годин. Реакційну суміш фільтрували через тонкий шар Celite™, концентрували шляхом випарювання, після чого утворювалось масло, яке висушували in vacuo півдоби і утворювався кінцевий продукт (692мг, 93%) у вигляді коричневого масла. d н (300МГц; CDCI 3) 0,24 (9Н, с), 3,56 (2Н, шс), 6,62 (1Н, ддд, J=1,0, 2,3 & 8,0), 6,78 (1Н, т, J=2,2), 6,87 (1Н, дт, J=7,7 & 1,2), 7,07 (1Н, т, J=7,8); dс (75,5МГц; CDCI3) 93,4, 105,4, 115,6, 118,2, 122,4, 123,8, 129,2, 146,2; m/e 190 (М+Н)+ Приклад 3 Одержання моногідрохлориду 6,7-біс(2метоксиетокси)-N-[3[(триметилсиліл)етиніл]феніл]-4-хіназолінаміну 4-хлор-6,7-біс(2-метоксиетокси)хіназолін (942мг, 3,01ммоль) обробляли розчином аніліну (645мг, 3,41ммоль) в 2-пропанолі (14мл) і суміш нагрівали при температурі кипіння протягом 2,5 годин. Суміш охолоджували до кімнатної температури і перемішували 1 годину. Тверду речовина вилучали шляхом фільтрації, промивали 2-пропаналом (5мл) і висушували in vacuo півдоби, одержуючи кінцевий продукт (1,33г, 88%) у вигляді білої твердої речовини. d н (400МГц; CDCI 3) 0,21 (9Н, с), 3,38 (3Н, с), 3,41 (3Н, с), 3,72 (2Н, м), 3,77 (2Н, м), 4,10 (2Н, с), 7,20 (1Н, т, J=7,8), 7,23-7,28 (2Н, м), 7,75 (1Н, д, J=7,8), 7,88 (1Н, с), 8,20 (1Н, с), 8,42 (1Н, с); m/e 466(M+H)+ Приклад 4 Одержання моногідрохлориду N-(3етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну Порошок силільної сполуки моногідрохлорид 6,7-біс(2-метоксиетокси)-N-[3[(триметилсиліл)етиніл]феніл]-4-хіназолінаміну, одержаний вище (1,22г, 2,43ммоль) в тетрагідрофурані (6,1мл) обробляли 1М розчином фториду тетра-н-бутиламонію в тетрагідрофурані (2,6мл, 2,55ммоль) і перемішували при кімнатній температурі протягом 2 годин. До розчину добавляли 2-пропанол (12,2мл) і концентрували випарюванням. Масло в 2-пропанолі (20мл) обробляли концентрованою соляною кислотою (0,2мл), після чого з'являвся осад. Суміш перемішували при кімнатній температурі протягом 1 години. Тверду речовина вилучали шляхом фільтрації, промивали 2-пропанолом (2мл) і висушували in vacuo одержуючи кінцевий продукт (747мг, 72%) у вигляді білої твердої речовини (точка плавлення 226-229°С). d н (300МГц; d6-ДМСО) 3,36 (6Н, с), 3,77-3,80 (4Н, м), 4,30 (1Н, с), 7,39 (1Н, с), 7,41 (1Н, д, J=7,8), 7,50 (1Н, т, J=7,9), 7,79 (1Н, д, J=8,1), 7,88 (1Н, с), 8,40 (1Н, с), 8,86 (1Н, с), 11,48 (1Н, шс); d c (100МГц; d6-ДМСО) 58,4, 58,5, 68,7, 69,2, 69,7, 67,0, 81,3, 83,0, 100,3, 105,2, 107,2, 121,9, 125,4, 127,6, 128,9, 129,2, 135,2, 137,7, 148,3, 149,2, 155,4, 158,0; m/е 394 (М+Н)+ Приклад 5 15 Одержання моногідрохлориду 4-[3-[[6,7-біс(2метоксиетокси]-4-хіназолініл]аміно]феніл]-2-метил3-бутин-2-олу 4-хлор-6,7-біс(2-метоксиетокси)хіназолін (15г, 48ммоль), 4-(3-амінофеніл)-2-метил-3-бутин-2-ол (9,2г, 52,8ммоль) та ацетонітрил (225мл) нагрівали при температурі кипіння протягом 5 годин. Суміш охолоджували до 5-10°С та перемішували 1 годину. Тверду речовину вилучали шляхом фільтрації, промивали ацетонітрилом (15мл) і півдоби висушували in vacuo одержуючи кінцевий продукт (23,4г, 100%) у вигляді білої твердої речовини. d н (300МГц; d6-0ДМСО) 1,44 (6Н, с), 3,31-3,32 (6Н, м), 3,69-3,75 (4Н, м), 4,24-4,30 (2Н, м), 4,354,37 (2Н, м), 7,25 (1Н, м), 7,39 (2Н, м), 7,72-7,74 (2Н, м), 8,47 (1Н, с), 8,79 (1Н, с), 11,64 (1Н, с); m/е 452 (М+Н)+ Приклад 6 Одержання 4-[3-[[6,7-біс(2-метоксиетокси]-4хіназолініл]аміно]феніл]-2-метил-3-бутин-2-олу Моногідрохлорид 4-[3-[[6,7-біс(2метоксиетокси]-4-хіназолініл]аміно]феніл]-2-метил3-бутин-2-олу, одержаний вищезгаданим способом (19,0г, 39,7ммоль), воду (95мл) та етилацетат (380мл) перемішували при кімнатній температурі до утворення суміші. рН суміші доводився до рН 10-12 за допомогою 50% водного розчину гідроксиду натрію, для того щоб утворилось два прозорі шари. Органічний шар відділяли від водного і концентрували у вакуумі до обсягу ~ 190мл. Після грануляції на льодяній ванні утворювалися кристали необхідного продукту, потім їх промивали і висушували до одержання продукту. (15,13г, 86%) d н (400МГц; CDCI 3) 1,56 (6Н, с), 3,35 (3Н, с), 3,37 (3Н, с), 3,7-3,71 (4Н, м), 4,13-4,19 (4Н, м), 7,0 (1Н, м), 7,13-7,17 (2Н, м), 7,3 (1Н, м), 7,6 (2Н, м), 8,55 (1Н, с); m/е 452 (М+Н)+ Приклад 7 Одержання моногідрохлориду N-(3етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну Моногідрохлорид 4-[3-[[6,7-біс(2метоксиетокси]-4-хіназолініл]аміно]феніл]-2-метіл3-бутин-2-олу, одержаний вищезгаданим способом (32,34г, 66,3ммоль), воду (300мл) та бутан-1-ол (600мл) перемішували при кімнатній температурі для утворення суміші. рН суміші доводили до рН 10-12 за допомогою 50% водного розчину гідроксиду натрію, одержуючи два прозорих шари. Органічний шар відділяли від водного і концентрували при атмосферному тиску, так що вода азеотропно вилучалася з розчину бутан-1олу. Кінцевий об'єм розчину бутан-1-олу становив ~ 300мл. До азеотропно висушеного розчину бутан-1-олу додавали твердий безводний гідроксид натрію (0,13г 3,3ммоль) і одержану суміш нагрівали при температурі кипіння при 115120°С протягом 24 годин. Бутан-1-ол (150мл) вилучали шляхом дистиляції, а концентровану реакційну суміш охолоджували до 15-25°С. До охолодженого концентрату додали концентровану соляну кислоту (6,1мл) і бутан-1-ол (60мл), потім суміш 80955 16 півдоби гранулювали при 20-25°С до закріплення кристалізації. Кристали продукту відділяли фільтрацією і висушували у вакуумі при температурі 45-50°С для видалення бутан-1-олу. Вихід кінцевого продукту (21,0г, 73,7%). Чистота по ВЕРХ (Високоефективна Рідинна Хроматографія) 96,5%. Приклад 8 Одержання солі метансульфонової кислоти N(3-етинілфеніл)-6,7-біс(2-метоксиетокси)хіназолінаміну Моногідрохлорид 4-[3-[[6,7-біс(2метоксиетокси]-4-хіназолініл]аміно]феніл]-2-метил3-бутин-2-олу, одержаний вищезгаданим способом (32,34г, 66,3ммоль), воду (300мл) та бутан-1-ол (600мл) перемішували при кімнатній температурі до утворення суміші. рН суміші доводили до рН 10-12 за допомогою 50% водного розчину гідроксиду натрію, одержуючи два прозорих шари. Органічний шар відділяли від водного і концентрували при атмосферному тиску, так що вода азеотропно вилучалася з розчину бутан-1олу. Кінцевий об'єм розчину бутан-1-олу становив ~ 300мл. До азеотропно висушеного розчину бутан-1-олу додавали твердий безводний гідроксид натрію (0,13г, 3,3ммоль) і одержану суміш нагрівали при 115-120°С протягом 24 годин. Реакційну суміш охолоджували до 15-25°С, додавали метансульфонову кислоту (4,6мл) і суміш півдоби кристалізували. Кристали продукту відділяли фільтрацією, промивали бутан-1-олом (25мл) і висушували в вакуумі при 45-50°С до видалення бутан-1-олу. Вихід (29,16г, 90%). Чистота по ВЕРХ 96,7% Приклад 9 Одержання моногідрохлориду N-(3етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну Моногідрохлорид 4-[3-[[6,7-біс(2метоксиетокси]-4-хіназолініл]аміно]феніл]-2-метил3-бутин-2-олу, одержаний вищезгаданим способом (20,0г, 44,3ммоль), безводний твердий гідроксид натрію (0,09г, 2,2ммоль) та бутан-2-ол (400мл) перемішували і нагрівали при 100-102°С протягом 36 годин. Реакційну суміш охолоджували до 1525°С і до неї додавали концентровану соляну кислоту (4,1мл). Одержана суміш півдоби гранулювали при 20-25°С для закріплення кристалізації. Кристали продукту відділяли шляхом фільтрації, промивали бутан-2-олом (25мл) і висушували у вакуумі при 45-50°С до видалення бутан-2-олу. Вихід продукту (17,7г, 93%) Чистота за ВЕРХ 99,1% Приклад 10 Одержання моногідрохлорид N-(3етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну 4-[3-[[6,7-біс(2-метоксиетокси]-4хіназолініл]аміно]феніл]-2-метил-3-бутин-2-ол, одержаний вищезгаданим способом (20,0г, 44,3ммоль), безводний твердий гідроксид натрію (260мг, 6,5ммоль) та пропан-2-ол (200мл) перемішували і нагрівали в автоклаві при 135140°С протягом 23 годин. Реакційну суміш охолоджували до 60-65°С і до неї додавали 17 концентровану соляну кислоту (4,8мл). Одержану суміш півдоби гранулювали при 20-25°С для закріплення кристалізації. Суміш обробляли водою (10 мл), перемішували при 58-60°С протягом 21 години, охолоджували до 15-20°С гранулювали 2 години. Кристали продукту відділялись фільтрацією, промивали пропан-2-олом (2×30мл) і висушували у вакуумі при 45-50°С до видалення пропан-2-олу. Вихід (17,6г, 92%). Приклад 11 Одержання моногідрохлориду N-(3етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну 4-[3-[[6,7-біс(2-метоксиетокси]-4хіназолініл]аміно]феніл]-2-метил-3-бутин-2-ол, одержаний вищезгаданим способом (5,0г, 11ммоль),безводний твердий гідроксид натрію (44мг, 11ммоль) та 2-метоксиетанол (50мл) перемішували і нагрівали при температурі кипіння протягом 47 годин. Реакційну суміш охолоджували до 20-25°С і до неї додавали концентровану соляну кислоту (1,1мл). Одержану суміш гранулювали 1 годину при 20-25°С для стабілізації кристалізації. Кристали продукту відділяли фільтрацією, промивали 2-метоксиетанолом (10мл) і висушували у вакуумі при 45-50°С до видалення 2-метоксиетанолу. Вихід продукту (3,73г, 78%). Приклад 12 Одержання солі метасульфонової кислоти N(3-етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінаміну 4-[3-[[6,7-біс(2-метоксиетокси]-4хіназолініл]аміно]феніл]-2-метил-3-бутин-2-ол, одержаний вищезгаданим способом (20,0г, 44,3ммоль), безводний твердий гідроксид натрію (0,09г, 2,2ммоль) та бутан-2-ол (400мл) перемішували і нагрівали при температурі кипіння 100-102°С протягом 36 годин. Реакційну суміш охолоджували до 15-25°С і до неї додавали метаносульфонову кислоту (5,1г, 53,2ммоль). Одержану суміш півдоби гранулювали при 20-25°С для стабілізації кристалізації. Кристали продукту відділяли фільтрацією, промивали бутан-2-олом (25мл) і висушували у вакуумі при 45-50°С до видалення бутан-2-ол у. Вихід продукту (19,45г, 90%) Чистота за ВЕРХ 98,5%. Приклад 13 Одержання N-(3-етинілфеніл)-6,7-біс(2метоксиетокси)-4-хіназолінаміну 4-хлор-6,7-біс(2-метоксиетокси)хіназолінамін (50г, 160ммоль), 3-етиланілін (21,34г, 176ммоль) та пропан-2-ол (500мл) нагрівали при 78-82°С протягом 16 годин. Суміш охолоджували до 5-10°С перемішували 1 годину. Тверду речовину відокремлювали фільтрацією і змішували з водою (200мл) та етилацетатом (500мл). Суміш доводили до рН 10-12 за допомогою 50% водного гідроксиду натрію для утворення прозорих шарів. Органічний шар відділяли і промивали водою (200мл), сольовим розчином (200мл) і висушували над безводним сульфатом магнію, фільтрували і концентрували до утворення масла. Маслу давали загуснути і висушували у вакуумі при 20-25°С 80955 18 одержуючи кінцевий продукт (57,2г, 90%) у вигляді білої твердої речовини, Тпл. 72-74°С; d н (300МГц; CDCI 3) 1,16 (3Н, т, J=7,6), 2,58 (2Н, к, J=7,6), 3,32 (3Н, с), 3,34 (3Н, с), 2,01-2,47 (2Н, м), 2,08-2,54 (2Н, м), 4,07-4,12 (4Н, м), 6,91 (1Н, д, J=7,6), 7,11 (1Н, с), 7,21 (1Н, т, J=7,8), 7,35 (1Н, с), 7,42 (1Н, с), 7,48 (1Н, д, J=8,0), 8,13 (1Н, шс), 8,58 (1Н, с), d c (75,5МГц; CDCI 3) 15,4, 28,8, 29,1, 68,2, 68,9, 70,4, 70,8, 103,0, 108,3, 109,3, 119,7, 121,7, 123,9, 128,8, 138,6, 145,1, 147,0, 148,6, 153,6, 154,4, 156,9; vmax (KBr) см-1 3136 (С), 1624 (С), 1575 (С), 1535 (С), 1487 (С); m/z 398 (М+Н)+ (Знайдено: С, 65,64; Н, 6,96; N,10,32. С22Н27N3O4 0,25 Н2О потрібно С, 65,73; Н, 6,90; N, 10,45%). Приклад 14 Одержання N-(3-етинілфеніл)-6,7-біс(2метоксиетокси)-7-бензилокси-4-хіназолінаміну N-(3-етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінамін, одержаний вищезгаданим способом (4,0г, 10ммоль),безводний твердий гідроксид натрію (104мг, 2,6ммоль) та бензиловий спирт (20мл) нагрівали при 150-152°С протягом 23 годин. Реакційну суміш охолоджували до кімнатної температури і очищали колоночною хроматографією на силікагелі, застосовуючи градієнтну систему етилацетат/гексан як елюентом, одержуючи білу тверду речовину, яку висушували у вакуумі при 45-50°С і одержували кінцевий продукт (2,52г, 58%), Тпл. 156-157°С. d н (300МГц; CDCI 3) 1,17 (3Н, т, J=7,6), 2,58 (2Н, к, J=7,6), 3,33 (3Н, с), 3,65-3,68 (2Н, м), 4,07-4,11 (2Н, м), 5,11 (2Н, с), 6,93 (1Н, д, J=7,7), 7,18-7,29 (5Н, м), 7,35-7,42 (4Н, м), 7,50 (1Н, д, J=8,0), 8,20 (1Н, шс), 8,61 (1Н, с); dс (75,5МГц; CDCI 3) 14,2, 15,4, 28,8, 59,2, 69,2, 70,0, 70,8, 103,2, 109,1, 119,7, 121,7, 124,0, 127,3, 128,1, 128,8, 135,8, 138,6, 145,1, 147,0, 148,9, 153,7, 154,2, 156,9; vmaх (KBr) см-1 1625, 1611, 1576; m/z 430 (M+H)+ (Знайдено: С, 71,42; Н, 6,34; N,9,48. С26Н27N3О3 потрібно С, 72,70; Н, 6,34; N, 9,78%). Приклад 15 Одержання N-(3-етинілфеніл)-6-(2метоксиетокси)-7-бутилокси-4-хіназолінаміну N-(3-Етинілфеніл)-6,7-біс(2-метоксиетокси)-4хіназолінамін, одержаний вищезгаданим способом (4,0г, 10ммоль), безводний твердий гідроксид натрію (94мг, 2,36ммоль) та бутан-1-ол (20мл) нагрівали при температурі кипіння 12 днів. Реакційну суміш охолоджували до кімнатної температури і очищали колоночною хроматографією на силікагелі застосовуючи градієнтну систему етилацетат/гексан як елюент, одержуючи білу тверду речовину, яку висушували у вакуумі при 45-50°С і одержували кінцевий продукт (2,57г, 65%), Тпл. 90-92°С. d н (300МГц; CDCI 3) 0,93 (3Н, т, J=7,4), 1,19 (3Н, т, J=7,6), 1,45 (2Н, секстет, J=7,5), 1,79 (2Н, пентет, J=6,9), 3,39 (3Н, с), 3,70-3,74 (2Н, м), 4,00 (2Н, т, J=6,6), 4,12-4,15 (2Н, м), 6,94 (1Н, д, J=7,8), 7,34 (1Н, с), 7,44 (1Н, с), 7,51 (1Н, д, J=8,0), 7,95 (1Н, шс), 8,60 (1Н, с); dc (75,5МГц; CDCI 3) 13,8, 15,4, 19,2, 28,8, 30,8, 59,3, 68,7, 69,3, 70,9, 103,2, 108,9, 119,6, 121,6, 124,0, 128,9, 138,6, 145,2, 147,2, 148,8, 153,6, 154,9, 156,8; vmax (KBr) см-1 1618, 1576, 1519; m/z 396(M+H)+; (Знайдено: С, 19 70,90; Н, 7,56; N, 10,66. C23H29N3O3 потрібно С, 69,85; Н, 7,39; N, 10,63%). Приклад 16 Одержання N-(4-метоксифеніл)-6,7-біс(2метоксиетокси)-4-хіназолінаміну 4-хлор-6,7-біс(2-метоксиетокси)хіназолін (25г, 79,9ммоль), 4-анізідин (9,8г, 79,9ммоль) та пропан2-ол (250мл) нагрівали при 78-82°С протягом 16 годин. Суміш охолоджували до 5-10°С і перемішували 1 годину. Тверду речовина відокремлювали фільтрацією і промивали пропан2-олом (25мл). Відокремлену тверду речовину перекристалізовували з суміші етанола/вода, півдоби висушували у вакуумній пічці при 40-45°С. Перекристалізовану тверду речовину змішували з водою (100мл) та етилацетатом (250мл). Суміш доводилась до рН 10-12 за допомогою 50% водного гщроксиду натрію для того, щоб утворилися прозорі шари. Органічний шар відділяли і промивали водою (100мл), сольовим розчином (200мл) і висушували над безводним сульфатом магнію, фільтрували та концентрували, після чого утворювалась біла тверда речовина, яку висушували у вакуумі при 45-50°С і одержували кінцевий продукт 20,86г, 65%, Тпл. 186187°С. d н (300МГц; CDCI 3) 3,31 (3Н, с), 3,35 (3Н, с), 3,62-3,65 (2Н, м), 3,70-3,72 (2Н, м), 3,74 (3Н, с), 4,04-4,11 (4Н, м), 6,83 (2Н, д, J=9,0), 7,09 (1Н, с), 7,33 (1Н, с), 7,46 (2Н, д, J=9,0), 8,12 (1Н, шс), 1Н, с); dc (75,5МГц; CDCI 3) 55,4, 59,2, 68,2, 69,0, 70,4, 70,8, 103,1, 108,3, 109,1, 114,2, 124,7, 131,4, 146,8, 148,6, 153,7, 154,3, 156,7, 157,3 ; vmax (KBr) см-1 1619,1590, 1582, 1511; m/z 400 (M+H)+; (Знайдено: С, 63,30; Н, 6,37; N,10,47. С21Н25N3О5 потрібно С, 63,42; Н, 6,31; N, 10,52%). Приклад 17 Одержання N-(4-метоксифент)-6-(2метоксиетокси)-7-бензилокси-4-хіназолінаміну N-(4-метоксифеніл)-6,7-біс(2-метоксиетокси)4-хіназолінамін, одержаний вищезгаданим способом (2,0г, 4,6ммоль), безводний твердий гідроксид натрію (104мг, 2,6ммоль) та бензиловий спирт (20мл) нагрівали при 145-150°С протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури і очищали колоночною хроматографією на силікагелі застосовуючи градієнтну систему етилацетат/гексан як елюент, утворювалась біла тверда речовина, яку висушували у вакуумі при 45-50°С і одержували кінцевий продукт (0,915г, 42%), Тпл. 208-209°С. d н (300МГц; CDCI 3) 3,34 (3Н, с), 3,91 (3Н, т, J=4,2), 3,74 (3Н, с), 4,10 (2Н, шс), 5,13 (2Н, шс), 6,83 (2Н, д, J=8,9), 7,20-7,30 (5Н, м), 7,36-7,38 (3Н, м), 7,47 (2Н, д, J=8,9), 8,10 (1Н, шс), 8,54 (1Н, с), dc (75,5МГц; CDCI 3) 55,5, 59,3, 69,2, 70,7, 70,9, 103,3, 109,0, 109,1, 114,2, 124,6, 127,3, 128,1, 128,5, 131,3, 135,8, 146,8, 148,8, 153,7, 154,2, 154,2, 156,8, 157,2; vmax (КВг) см-1 1619, 1580, 1511; m/z 432 (M+H)+; (Знайдено: С, 69,48; Н, 5,85; N,9,68. С25Н25N3О4 потрібно С, 69,59; Н, 5,85; N, 9,74%). Приклад 18 Одержання N-феніл-N-метил-6,7-біс(2метоксиетокси)-4-хіназолінаміну 80955 20 4-хлор-6,7-біс(2-етоксиметокси)хіназолін (10г, 31,97ммоль), 4-метиланілін (3,5мл, 31,97ммоль) та ацетонітрил (100мл) нагрівали при 78-82°С протягом 24 годин. Суміш охолоджували до 5-10°С і перемішували півгодини. Тверду речовину відокремлювалу фільтрацією і висушували протягом 5 годин у вакуумній пічці при 50-55°С. Потім тверду речовину змішували з водою (50мл) та етилацетатом (200мл). Суміш доводили до рН 10-12 за допомогою 50% водного гідроксиду натрію для того, щоб утворились прозорі шари. Органічний шар відділяли і промивали водою (50мл), сольовим розчином (50мл) і висушування над безводним сульфатом магнію, фільтрували та концентрували, після чого утворювалась біла тверда речовина, яку висушували у вакуумі при 50-55°С і одержували кінцевий продукт 8,55г, 70% Тпл. 109-111°С. d н (300МГц; CDCI 3) 3,33 (3Н, с), 3,39 (3Н, с), 3,42-3,45 (2Н, м), 3,48-3,51 (2Н, м), 3,58 (3Н, с), 3,74-3,78 (2Н, м), 4,16-4,20 (2Н, м), 6,33 (1Н, с), 7,11-7,20 (4Н, м), 7,83 (2Н, т, J=7,8), 8,68 (1Н, с); dc (75,5МГц; CDCI 3) 42,0, 59,2, 59,3, 67,6, 68,2, 70,3, 70,4, 106,5,107,9, 110,9, 125,8, 126,0, 129,9, 147,0, 148,4, 148,7, 153,0, 153,4, 160,4; vmax (KBr) см-1 1615, 1571, 1497; m/z 384 (M+H)+; (Знайдено: С, 65,85; Н, 6,52; N,11,01. C21H25N3O4 потрібно С, 65,78; Н, 6,57; N, 20,96%). Приклад 19 Одержання N-феніл-N-метил-6-(2метоксиетокси)-7-бутилокси-4-хіназолінаміну N-метил-N-феніл-6,7-біс(2-метоксиетокси)-4хіназолінамін, одержаний вищезгаданим способом (1,0г, 2,61ммоль), безводний твердий гідроксид натрію (97,5мг, 2,43ммоль) та бутан-1-ол (20мл) нагрівали при температурі кипіння протягом 24 годин. Реакційну суміш охолоджували до кімнатної температури і очищали колоночною хроматографією на силікагелі, застосовуючи градієнтну систему етилацетат/гексан як елюент, утворювалась біла тверда речовина, яку висушували у вакуумі при 45-50°С і одержували кінцевий продукт (517мг, 52%), Тпл. 62-63°С. d н (300МГц; CDCI 3) 0,93 (3Н, т, J=7,4), 1,45 (2Н, секстет, J=7,4), 1,80 (2Н, пентет, J=6,7), 3,35 (3Н, с), 3,44-3,52 (4Н, м), 3,59 (3Н, с), 4,05 (2Н, т, J=6,7), 6,34 (1Н, с), 7,12-7,21 (4Н, м), 7,34 (2Н, т, J=7,7), 8,69 (1Н, с); dc (75,5МГц; CDCI 3) 13,8, 19,2, 30,7, 42,0, 59,2, 67,8, 68,6, 70,4, 106,5, 107,7, 110,6, 125,8 125,9, 129,9, 147,0, 148,6, 153,0, 153,8, 160,4; vmax (KBr) см-1 1616, 1572, 1543; m/z 382 (M+H)+; (Знайдено: С, 69,39; Н, 7,38; N,10,86. C22H27N3O3 потрібно С, 69,27; Н, 7,38; N, 11,02%).
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing compounds having antitumor activity
Автори англійськоюLehner, Richard, Shelton, Norris, Timothy, Santafianos, Dinos, Paul
Назва патенту російськоюСпособ получения соединений, которые имеют противораковую активность
Автори російськоюЛехнер Ричард Шелтон, Норрис Тимоти, Сантафианос Динос Поль
МПК / Мітки
МПК: C07D 239/94
Мітки: одержання, спосіб, активність, протиракову, сполук, мають
Код посилання
<a href="https://ua.patents.su/10-80955-sposib-oderzhannya-spoluk-yaki-mayut-protirakovu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполук, які мають протиракову активність</a>
Попередній патент: Витяжний вентилятор зі знімною передньою кришкою
Наступний патент: Гітара диференціала зубофрезерувального верстата
Випадковий патент: Закупорювальний пристрій для пляшки з рідиною












