Похідні гекса- та октагідропіридо[1,2-a]піразину з антагоністичною активністю щодо nk1
Номер патенту: 84300
Опубліковано: 10.10.2008
Автори: Івема Баккер Воутер І., ван Шарренбург Густав Й.М., Маккрірі Ендрю С., ван ден Гоогенбанд Адріанус
Формула / Реферат
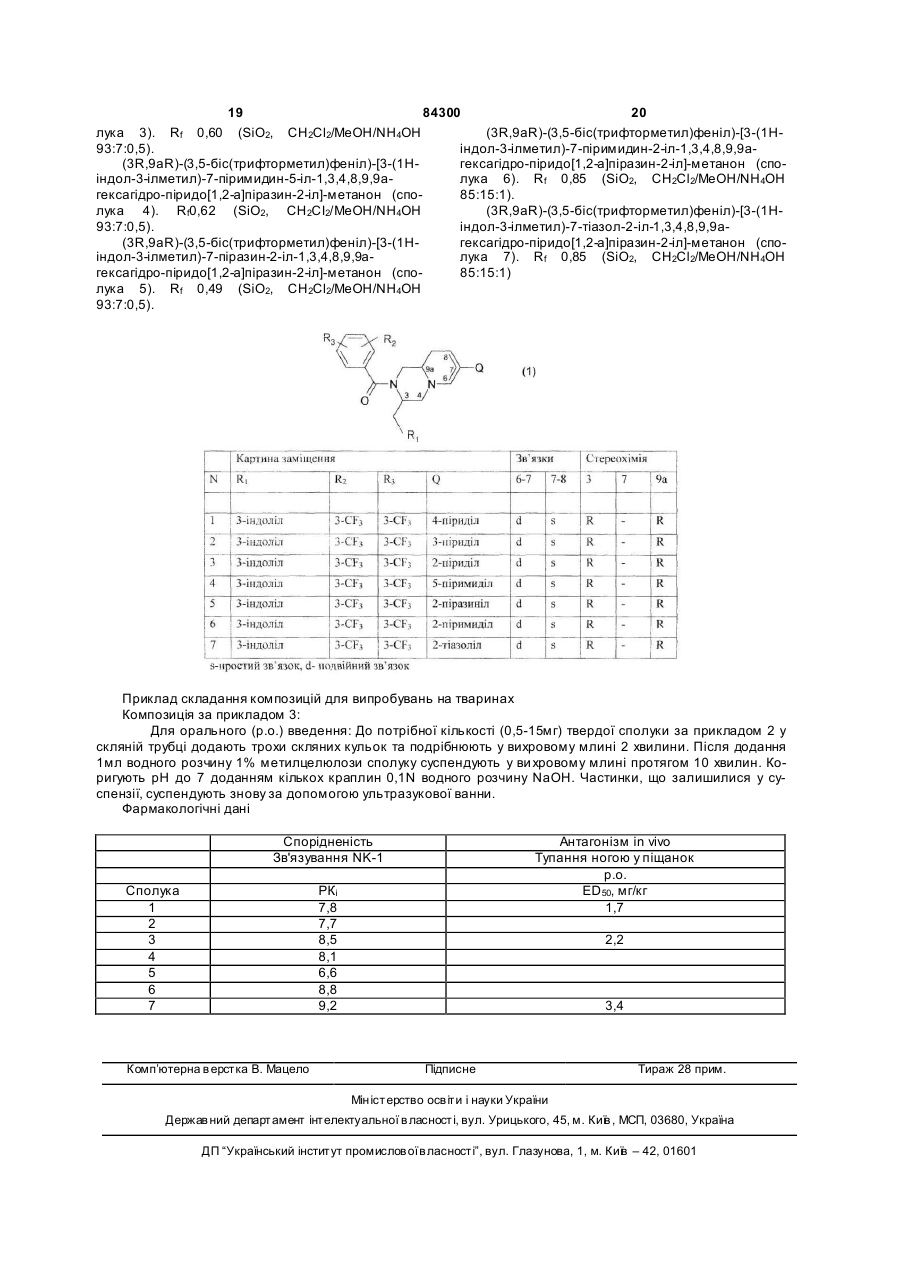
1. Сполуки загальної формули (1)
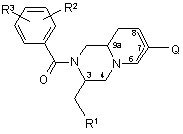 , (1)
, (1)
де:
R1 представляє феніл, 2-індоліл, 3-індоліл, 3-індазоліл або бензо[b]тіофен-3-іл, причому ці групи можуть бути заміщені галогеном або (1-3С)-алкілом,
R2 та R3 незалежно один від одного представляють галоген, Н, ОСН3, СН3 та CF3,
Q - ароматичне або гетероароматичне п'яти- або шестичленне кільце з вуглець-вуглецевим зв'язком, яке може бути заміщене,
піридо[1,2-а]піразинова частина може містити або не містити подвійний зв'язок між або атомами 6 та 7, або атомами 7 та 8 вуглецю,
усі їх стереоізомери, а також їх фармацевтично прийнятні солі та проліки, причому проліки є похідними сполук загальної формули (1), що містять групу, яка легко видаляється після введення до організму, як, зокрема, амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О-(ацилоксиметиленкарбамату), карбамат, ефір, амід або енамінон.
2. Сполуки за п. 1 формули (1), у яких Q - шестичленне гетероароматичне кільце, довільно заміщене, з вмістом азоту, а інші позначки мають значення, наведені вище, включаючи усі можливі стереоізомери.
3. Сполуки за п. 1 формули (1), де R1 - 3-індоліл, R2 та R3 - групи CF3 у 3 та 5 позиціях, a Q - шестичленне гетероароматичне кільце з вмістом азоту, довільно заміщене, включаючи усі можливі стереоізомери.
4. Фармацевтична композиція, яка містить фармацевтично активну кількість принаймні однієї зі сполук, як заявлено в одному з пп. 1-3, як діючу речовиу.
5. Сполука за будь-яким з пп. 1-3 або її сіль для застосування як лікарський засіб.
6. Застосування сполуки за будь-яким з пп. 1-3 для приготування фармацевтичної композиції для лікування розладів, у яких беруть участь нейрокініни, що взаємодіють з рецепторами NK1, зокрема речовина Р, або які піддаються лікуванню шляхом маніпуляції зазначеними рецепторами.
7. Застосування за п. 5, яке відрізняється тим, що до зазначених розладів належать гострий та хронічний біль, блювання, запальні захворювання, наприклад, менінгіт, артрит, астма, псоріаз та (сонячні) опіки; шлунково-кишкові захворювання, наприклад, синдром подразненого кишечнику, запалення кишечнику, або хвороба Крона, виразковий коліт; гіперрухомість сечового міхура або шлунково-кишкового тракту, запалення сечових шляхів; алергійні реакції, наприклад, екзема та риніт; серцево-судинні розлади (гіпертонія, атеросклероз, набряки, стенокардія, наскрізний головний біль та мігрень); хвороби шкіри (кропивниця, короста, сверблячка); респіраторні захворювання, включаючи хронічні обструктивні захворювання легенів, бронхоспазми, бронхопневмонію, бронхіт, синдром розладу дихання та цистофіброз; розноманітні новоутворення; психічні та/або неврологічні розлади, в тому числі шизофренія та інші психози; розлади настрою, як-от двополярні депресії І та II, однополярні депресії, в тому числі легка депресія, сезонні афективні розлади, післяпологова дистимія та важка депресія; бентежні стани, включаючи панічний синдром (з агорафобією чи без), соціальну фобію, нав'язливі стани (з супутнім хронічним тиком або шизоподібним розладом чи без), посттравматичні розлади та загальну збентеженість; розлади, пов'язані зі вживанням різних речовин (алкогольно-наркотична залежність та зловживання) або спричинені різними речовинами (наприклад, утримання від тієї чи іншої речовини); розповсюджені розлади розвитку, як аутизм та хвороба Ретта; дефіцит уваги та руйнівні розлади поведінки, наприклад, гіперактивність на тлі дефіциту уваги; розлади нестримання імпульсів (агресивна поведінка, патологічне картярство); розлади харчування, наприклад, нервова анорексія та нервова булімія, опасистість; розлади сну (нічниці); тики типу хвороби Туретта; синдром неспокійних ніг; розлади, що характеризуються дефіцитом розуму та пам'яті, наприклад, хвороба Альцгеймера, хвороба Крейцфельда-Якоба, хвороба Гантінгтона, хвороба Паркінсона та нейрореабілітація (посттравматичні ураження мозку).
Текст
1. Сполуки загальної формули (1) C2 2 (19) 1 3 84300 4 набряки, стенокардія, наскрізний головний біль та (алкогольно-наркотична залежність та зловживанмігрень); хвороби шкіри (кропивниця, короста, свеня) або спричинені різними речовинами (наприрблячка); респіраторні захворювання, включаючи клад, утримання від тієї чи іншої речовини); розпохронічні обструктивні захворювання легенів, бронвсюджені розлади розвитку, як аутизм та хвороба хоспазми, бронхопневмонію, бронхіт, синдром Ретта; де фіцит уваги та р уйнівні розлади поведінрозладу дихання та цистофіброз; розноманітні ки, наприклад, гіперактивність на тлі дефіциту увановоутворення; психічні та/або неврологічні розги; розлади нестримання імпульсів (агресивна полади, в тому числі шизофренія та інші психози; ведінка, патологічне картярство); розлади розлади настрою, як-от двополярні депресії І та II, харчування, наприклад, нервова анорексія та нероднополярні депресії, в тому числі легка депресія, вова булімія, опасистість; розлади сну (нічниці); сезонні афективні розлади, післяпологова диститики типу хвороби Туретта; синдром неспокійних мія та важка депресія; бентежні стани, включаючи ніг; розлади, що характеризуються дефіцитом ропанічний синдром (з агорафобією чи без), соціальзуму та пам'яті, наприклад, хвороба Альцгеймера, ну фобію, нав'язливі стани (з супутнім хронічним хвороба Крейцфельда-Якоба, хвороба Гантінгтотиком або шизоподібним розладом чи без), постна, хвороба Паркінсона та нейрореабілітація травматичні розлади та загальну збентеженість; (посттравматичні ураження мозку). розлади, пов'язані зі вживанням різних речовин Винахід стосується похідних гекса- та октогідропіридо[1,2-а]піразину, які посідають цікаву антагоністичну активність щодо рецептора нейрокінину-ΝΚ1. Винахід також стосується способів одержання цих сполук, фармаційних композицій, що містять фармакологічно дійову кількість принаймні однієї з цих сполук у якості діючої речовини, а також застосування таких композицій для лікування розладів, пов'язаних з рецепторами нейрокінину. Похідні піперазину з антагоністичною активністю щодо нейрокінину відомі з [Європейської заявки ЕР 0655442]. Похідні піперазину з подібною біологічною активністю описані також у ЕР 0899270, де наведено низку похідних 2-(3-індолілметил)-1бензоїл-4-[(2бензиламін)етил)амінокарбоніл]піперазину з антагоністичною активністю щодо NK1. Нами несподівано встановлено, що похідні піперазину виявляють антагоністичну активність щодо ΝΚ1 і в тому разі, коли піперазинове кільце та його замісник зливаються, утворюючи похідні гекса- та октогідропіридо[1,2-а]піразину. Винахід стосується сполук загальної формули (1), де: R1 представляє феніл, 2-індоліл, 3-іпдоліл, 3індазоліл або бензо[b]тіофен-3-іл, причому ці групи можуть бути заміщені галогеном або (і-3С)алкілом, R2 та R3 незалежно один від одного представляють галоген, Н, ОСН3, СН3 та СFз, Q - ароматичне або гетероароматичне п'ятиабо шестичленне кільце з вуглець-вуглецевим зв'язком, яке може бути заміщене, піридо[1,2-а]піразинова частина може містити або не містити подвійний зв'язок між атомами 6 та 7, або атомами 7 та 8 вуглецю, а також їх фармаційно прийнятних солей та проліків. Усі сполуки формули (1), у яких асиметричні атоми вуглецю 3 та 9а, а також потенційно асиметричний атом вуглецю 7 знаходяться у R- або Sконфігурації. охоплюються винаходом. До винаходу також належать проліки, тобто сполуки, які, будучи введені до людського організму будь-яким відомим шляхом, метаболізуються у сполуки формули (1). Зокрема, це стосується сполук з первинними або вторинними аміно- або гідроксігрупами. Такі сполуки здатні реагувати з органічними кислотами, даючи сполуки формули (1), де присутня додаткова група, яка легко видаляється після введення, як, зокрема, амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О-(ацилоксіметиленкарбамату), карбамат, ефір, амід або енамінон. Проліки - це інертні сполуки, які набувають активності після засвоєння [Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, ed. F.D.King, p.216]. Придатні кислі адуктні солі можуть утворюватися з органічними або неорганічними кислотами. Зокрема, винахід стосується сполук формули (1), у яких Q - шестичленне гетероароматичне кільце з вмістом азоту, можливо, заміщене, а інші позначки мають вищенаведені значення, включаючи усі можливі стереоізомери, як зазначено вище. Перевага віддається сполукам формули (1), де R1 - 3-індоліл, R2 та R3 - гр упи СF3 у 3 та 5 позиціях, a Q - шестичленне гетероароматичне кільце з вмістом азоту, можливо, заміщене, включаючи усі можливі стереоізомери, як зазначено вище. При описі замісників скорочення (С1-3)алкіл означає метил, етил, n-пропил або ізопропил. 5 84300 6 "Можливо заміщене" значить, що гр упа може бути ний синдром (з агорафобією чи без), соціальну або не бути надалі заміщена однією або кількома фобію, нав'язливі стани (з супутним хронічним групами, обраними з-поміж алкілу, алкенілу, алкітіком або шизоподібним розладом чи без), постнілу, арилу, фтору, хлору, брому, гідроксилу, алітравматичні розлади та загальну збентеженість; локсі, алкенілоксі, арилоксі, ацилоксі, аміно, амідо, розлади, пов'язані зі вживанням різних речовин алкіламіну, діалкіламіну, ариламіну, тіо, алкілтіо, (алкогольно-наркотична залежність та зловживанарилтіо, ціано, оксо, нітро, ацилу, аміду, алкіламіня) або спричинені різними речовинами (наприду, діалкіламіду, карбоксилу або два можливі заміклад, утримання від тієї чи іншої речовини); розпосники можуть разом з атомами вуглецю, до яких всюджені розлади розвитку, як аутізм та хвороба вони приєднані, утворювати 5- або 6-членне ароРетта; де фіцит уваги та р уйнівні розлади поведінматичне або неароматичне кільце з вмістом 0, 1 ки, наприклад, гіперактивність на тлі дефіциту уваабо 2 гетероатомів, обраних з-поміж азоту, кисню ги; розлади нестримання імпульсів (агресивна поабо сірки. У межах пояснення виразу "можливо ведінка, патологічне картярство); розлади заміщене" під алкілом розуміється С1-3 алкіл, під харчування, наприклад, нервова анорексія та нералкенілом - С1-3 алкеніл, під алкінілом - С1-3 алківова булімія, опасистість; розлади сну (нічниці); ніл, під ацилом - С1-3 ацил, а "арил" означає футіки типу хвороби Туретта; синдром бентежливих рил, тієнил, піроліл, оксазоліл, тіазоліл, імідазоліл, ніг; розлади, що характеризуються дефіцитом ропіразоліл, ізоксазоліл, ізотіазоліл, піриділ, піридазуму та пам'яті, наприклад, хвороба Альцгеймера, зиніл, піримидиніл, піразиніл, 1,3,5-триазиніл, фехвороба Крейцфельда-Якоба, хвороба Гантінгтоніл, індазоліл, індоліл, індолізиніл, ізоіндоліл, бенна, хвороба Паркінсона та нейрореабілітація зи[b]фураніл, бензи[b]тіофеніл, бензімідазоліл, (посттравматичні ураження мозку). бензтіазоліл, пуриніл, хінолиніл, ізохінолиніл, хіноАнтагоністичні властивості сполук за винахоліл, фталазиніл, хіназолиніл, хіноксалиніл, 1,8дом щодо ΝΚ-1 випробувалися наступними метонафтиридиніл, птеридиніл, нафтил або азуленіл, дами. переважно феніл, піриділ або нафтил. Можливі Фармакологічні методи замісники можуть самі містити додаткові можливі Зв'язування людського рецептора ΝΚ-1 замісники. Переважно можливими замісниками Спорідненість сполук до людських рецепторів виступають С 1-3 алкіл, наприклад, метил, етил або ΝΚ-1 визначали аналізом зв'язування радіорецептрифторметил, фтор, хлор, бром, гідроксил, С1-3 торів. Готували мембранні препарати з клітин фібалкілоксі, наприклад, метоксі, етоксі або трифторробластів яєчників китайського хом'яка (ЯКХ), у метоксі, та амін. "Гетероароматичний" значить яких людський рецептор ΝΚ-1 має постійну екстакий, що містить принаймні один гетероатом, як пресію. Мембрани інкубували з [3Н]Р у присутності N, О або S. "П'яти- або шестичленне кільце" - це, завданих концентрацій дослідних сполук або без наприклад, фуран, тіофен, пірол, оксазол, тіазол, них, розбавляли у належному буфері у присутності імідазол, піразол, ізоксазол, ізотіазол, 1,2,3інгібітора пептидази протягом 10хв при 25°С. Зв'яоксадіазол, 1,2,3-триазол, 1,3,4-тіадіазол, піридин, зану радіоактивність відокремлювали від вільної піридазин, піримідин або піразин. фільтрацією на скловолокнистих фільтрах Сполуки загальної формули (1) за винаходом, Whatman GF/B з двома промивками по 5с кожна. а також їхні солі посідають антагоністичну активЗв'язану радіоактивність рахували рідинноність щодо ΝΚ1 і виявляють гарну біозасвоювасцинтиляційним лічильником Betaplate. Одержані ність. Вони корисні при лікуванні розладів, у яких значення радіоактивності накладали на графік беруть участь нейрокінини, що реагують з рецепконцентрації витискної дослідної сполуки, а криві торами ΝΚ1, наприклад, нейрокінин-1 (речовина витиснення розраховували логістичною регресією Р), або тих, що піддаються лікуванню при маніпуза чотирма параметрами, одержуючи величини ляціях з цими системами. Це, наприклад, гострий ІС50, тобто концентрацій витискної сполуки, за яких та хронічний біль, блювання, запалювальні захвовитискується 50% радіоліганду. Значення рК1 спорювання (менінгіт, артрит, астма, псоріаз та сонярідненості вираховували коригуванням величин чні опіки); шлунково-кишкові захворювання (поІС50 на концентрацію радіоліганду, а значення дражнювальний синдром кишковика, запалення спорідненості до людського рецептора NK-1 - зарікишковика, або хвороба Крона, виразковий коліт); внянням Ченга-Прусоффа: гіперрухомість сечового міхура або шлунковоpK1=-log(IC 50/(1+S/Kd)) кишкового тракту, запалення сечових шляхів; аледе IС50 дивись вище, S - концентрація [3Н]Рргійні реакції, наприклад, екзема та рініт; серцеворечовини, що використовувалась у тесті, у мосудинні розлади (гіпертонія, атеросклероз, набрялях/л, a K d - постійна дисоціації рівноваги [3H]Ρ з ки, стенокардія, наскрізний головний біль та міглюдськими рецепторами NK-1 у молях/л. рень); хвороби шкіри (кропивниця, короста, свербВимірювання цАМФ лячка); респіраторні захворювання, включаючи Вплив дослідних речовин на утворення цикліхроничні обструктивні захворювання легенів, брочного АМФ (цАМФ) оцінювали на клітинах фібробнхоспазми, бронхопневмонію, бронхит, синдром ласту ЯКХ, де є стійко виражені клоновані людські розладу дихання та цистофіброз; розмаїті новорецептори нейрокініну NK-1. На додаток до прив'яутворення; психічні та/або неврологічні розлади, в зування до фосфоліпази С людські рецептори ΝΚтому числі шизофренія та інші психози; розлади 1 здатні також стимулювати аденілатциклазу, яка настрою, як от двополярні депресії І та II, однопоперетворює АТФ на цАМФ. Для дослідів клітини лярні депресії, в тому числі легка депресія, сезонні вирощували на 24-лункових пластинках. Перед афективні розлади, посляпологова дистимія та дослідом середовище замінювати вільним від сиважка депресія; бентежні стани, включаючи панічроватки a-модифікованим за Дульбекко культур 7 84300 8 ним середовищем Ігла, яке містило [3Н]-аденин, Відома здатність антагоністів ΝΚ-1 антагонізукотрий засвоювався клітинами й поступово перевати тупання ногою, спричинене введеними до творювався на радіомічений аденозин, АМФ, АДФ центральної нервової системи агоністами NK-1 і, нарешті, радіомічений АТФ. За 2 години клітини (Rupniak and Williams, 1994 (EurJ. Pharmacol. двічі промивали фосфатно-буферним фізроз чи265:179); Bristow and Young, 1994 (EurJ.Pharmacol. ном (pH 7,4) у присутності 1мМ ізобутилметилкса254:245)). Через те ми використали цю модель для нтину (ІБМК; інгібітор фосфодіестераз, який гідрооцінки активності in vivo сполук за винаходом. лізує цАМФ до АМФ). Після того клітини За 60хв до анестезування N2O (0,8л/хв), 3% стимулювали 10нМ речовини Ρ у присутності або галотаном та О2 (0,8л/хв) самці піщанки з Чарлзвідсутності дослідних сполук у фосфатноРівер (40-60г) одержували ін'єкцію носія чи дослідбуферному розчині/IБМК протягом 20хв. Після ної сполуки (орально). Після успішного наркозустимулювання середовище продмухували й екствання анестезію змінили на N2О (0,6л/хв), 1,5% рагували клітини 5% трихлороцтовою кислотою. галотан та O2 (0,6л/хв) та зробили надрізи уздовж Радіомічені АТФ та цАМФ видобували з екстракту середньої лінії голови. До мізково-шлуночкової послідовною колонковою хроматографією. Екстрапорожнини інфузували GR 73632 (АР-0,5мм, Lкти розділяли іонообмінною хроматографією на 1,2мм та вертикаль - 4,5мм від брегми). Після виколонках DOWEX 50WX4 аж до поновлення АТФ. ходу з анестезії (за 3-4хв) реакція тупання ногою Після того колонки ставили зверху на колонки з фіксувалася 5 хвилин. Завданим критерієм анатаоксидом алюмінію та елюювали водою. Відновгонізму до цієї реакції було припинення тупання за лення цАМФ здійснювали елююванням колонок з ³5хв. оксидом алюмінію 100мМ імідазолом (pH7,4). РаСполуки за винаходом, прикладами яких є діоактивність обох фракцій АТФ та цАМФ рахувасполуки 1-6, мають високу спорідненість до рецепли рідкісно-сцінтиляційним лічильником та вираторів NK-1 з pH³7,0 у вищеописаних випробуванховували коефіцієнти конверсії: нях на зв'язування. Як зазначається у нижченавеV=[цАМФ]*100%/([АТФ]+[цАМФ]) дених прикладах, деякі з них слугують проміжними Співвідношення "концентрація-відгук" будувапри синтезі інших сполук. Сполуки за винаходом ли, накладаючи значення конверсії цАМФ на гратакож виявляються активними у пробі на цАМФ, фік концентрацій сполук, й вираховували концентпричому величини рА2 та рК 1 у них на одному ріврації ІС 50 за допомогою логістичної регресії за ні. Деякі сполуки за винаходом долають кров'яний чотирма параметрами. Значення антагоністичної бар'єр до мозку, як видно з їх активності щодо потужності (рА2) визначали за формулою: спричиненого агоністом нейрокініну тупання ногою pA2=IC 50/(1+[SP]/EC 50) у піщанок. Це дає змогу застосовувати їх для лікуде значення ІС50 дослідної сполуки одержано вання розладів ЦНС. зі співвідношень концентрація-ефект, [SP] - концеСполуки формули (1) та їх солі можна одержунтрація речовини Ρ у молях/л (звичайно 10нМ), а вати принаймні одним з наступних способів, відоЕС50 - потужність речовини Ρ щодо клонованих мих для сполук цього типу. людських рецепторів ΝΚ-1. Спричинене агонiстом ΝΚ-1 тупання ногою у піщанок 9 84300 Сполуки за винаходом можна одержувати загальним шляхом, наведеним на схемі 1. Отже, реакція ефіру амінокислоти з 1-бензилефіром 5оксопіперилин-1,2-дікарбонової кислоти [H.C.Beyerman, P.Boekee, Recl.Trac.Chim.PaysBas, 1959, 78, 648] за стандартною процедурою зв'язування пептиду, як описано у M.Bodanszky, A.Bodanszky, The Practice of Peptide Synthesis, Springer-Verlag, 1994, ISBN: 0-387-57505-7, дає діпептиди І, а при застосуванні хіральної амінокислоти утворюються діастереомери, які можна розділити на цій (або наступній) стадії звичайними хроматографічними прийомами. Якщо захистити кетон у І як циклічний або ациклічний кеталь, як описано у T.W.Greene, P.G.M.Wuts, Protecti ve Groups in Organic Synthesis, John Wiley and Sons, 1999, утворюються сполуки формули II, де А та В позначають циклічний або ациклічний кеталь. Цю реакцію можна провадити за звичайними методиками, добре відомими з рівня техніки. При видаленні бензилоксікарбонільної групи у відновлювальних умовах (Ft, Pd/C) у розчиннику на кшталт метанолу з наступною циклізацією, каталізованою кислотою, утворюються дікетопіперазини формули III. Відновлення III активним гідридним реагентом, наприклад, алюмогідридом літію, до аміну, який піддається ацилюванню хлоридом відповідної кислоти, за умов, добре відомих з рівня техніки, дає сполуку IV. Гідроліз кеталю до форми V можна провадити, як [описано у T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, 1999]. У випадках, коли R1 містить NHгруп у, наприклад, індолільну або індазолільну групу, NH захи щають трет-бутилоксікарбонільною групою, одержаною так, як [описано у T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, 1999]. Після можливого захисту R1 сполуку V перетворюють на три флат VI шляхом обробки літій-амідною основою, наприклад, біс(триметилсиліл)амідом літію, в етерному розчиннику, наприклад, тетрагідрофурані, при низькій температурі (-70°), а потім додають біс(трифторметансульфонімід), наприклад, Nфеніл-біс(трифторметансульфонімід). Трифлат VI можна зв'язати, за допомогою паладієвих каталізаторів, з ароматичним або гетероароматичним станнатом у розчиннику на кшталт 1,4-діоксану, одержуючи сполуку VII за винаходом. Або ж можна перетворити трифлат VI на станнат VIII за допомогою гексаметилдіолова з паладієвим каталізато 10 ром у розчиннику на кшталт тетрагідрофурану, а потім зв'язати станнат VIII з відповідним ароматичним або гетероароматичним галідом за допомогою паладієвих каталізаторів у розчиннику на кшталт Ν,Ν-діметилформаміду з одержанням сполук VII. Сполуки VI та VIII виділяють як суміш ізомерів з подвійним зв'язком або як єдиний ізомер з невизначеним положенням подвійного зв'язку. Сполуки VII спочатку утворюються як суміші ізомерів з подвійним зв'язком, які можна ізомеризувати до найстабільнішої конфігурації, у якій подвійний зв'язок знаходиться між атомами вуглецю 6 та 7. Докладно сполуки, синтезовані цим шляхом, описані у наступних прикладах. Конкретні приклади синтезу Приклад 1 (див. схему 1) До розчину 93,5г 1-бензилефіру 5оксопіперидин-1,2-дікарбонової кислоти в 1л ацетонітрилу додають розчин 53мл діізопропилкарбодііміду у 50мл ацетонітрилу та охолоджують суміш до 5°С. До одержаної суспензії додають порціями 85,5г D-триптофанметилефіргідрохлориду та по краплинах розчин 58,6мл діізопропилетиламіну у 50мл ацетонітрилу. Одержану суміш перемішують 18 годин при кімнатній температурі, потім фільтрують та концентрують у вакуумі. Осад розчиняють у ді хлорметані, двічі промивають 1Μ соляною кислотою та двічі водою, сушать, фільтрують та концентрують у вакуумі, одержуючи 171,2г суміші бензилефірів (2R,2'R) та (2S,2’R)-2-[2-(1Н-індол-3іл)-1-метоксікарбонілетилкарбамоїл]-5оксопіперидин-1-карбонової кислоти, яку використовують па наступному етапі. Приклад 2 11 84300 12 а]піразин-1,4-діон-7,2'-[1,3]-діоксану; Rf 0,34 (Et2O/MeOH 9:1). Фільтрат концентрують та очищують випарювальною хроматографією (SiO2, Et2O/MeOH 9:1), одержуючи 20,6г (3R,9аR)-3-(1Ніндол-3-ілметил-гексагідроспіро[2Н-піридо[1,2а]піразин-1,4-діон-7,2'-[1,3]-діоксану; Rf 0,18 (SiO2, Et2O/MeOH 9 :1). Приклад 5 Суміш 138,9г бензилефірів (2R,2'R) та (2S,2’R)-2-[2-(1H-індол-3-іл)-1метоксікарбонілетилкарбамоїл]-5-оксопіперидин-1карбонової кислоти, 180г щавлевої кислоти та 87мл 1,3-пропандіолу у 1,5л ацетонітрилу нагрівають при 40°С 20 годин. Потім розчинник видаляють у вакуумі, а осад очищують випарювальною хроматографією (SiO2, СН2Сl2/МeOН 99:1), одержуючи 118г суміші бензилефірів (9R,2'R) та (9S,2'R)-9-[2-(1H-індол-3-іл)-1метоксікарбонілетилкарбамоїл]-1,5-діокса-8азаспіро[5.5]ундекан-8-карбонової кислоти. МН+ 536, Rf 0,07 (SiO2, CH2Cl2/MeОH 99:1). Приклад 3 До 92,8г розчину суміші бензилефірів (9R,2'R) та (9S,2'R)-9-[2-(1H-індол-3-іл)-1метоксікарбонілетилкарбамоїл]-1,5-діокса-8азаспіро[5.5]ундекан-8-карбонової кислоти в 1л метанолу додають 10% паладій-вуглецевого каталізатора (приблизно 5г). Одержану суміш гідрогенують усю ніч під атмосферним тиском при кімнатній температурі. Каталізатор відфільтровують крізь Целіт, після чого розчин концентрують у вакуумі, одержуючи 69,0г суміші метилефірів (2R,9'R) та (2R,9'S)-2-[1,5-діоксa-8-азаспіро[5.5]ундекан-9карбоніл)амін]-3-(1Н-індол-3-іл)-пропіонової кислоти. Rf 0,24 (SiO2 , CН2Cl2/MeOH/NH4OH 92:7,5:0,5). Приклад 4 Суміш 69,0г метилефірів (2R,9'R) та (2R,9'S)-2[1,5-діокса-8-азаспіро[5.5]ундекан-9-карбоніл)амін]3-(1Н-індол-3-іл)-пропіонової кислоти з 9мл оцтової кислоти у 900мл ацетонітрилу нагрівають усю ніч зі зворотним холодильником. Після охолодження до кімнатної температури суміш концентрують до приблизно третини вихідного обсягу. Осад фільтрують та одержують 23,7г (3R,9aS)-3(1H-iндoл-3-iлмeтил-гeкcaгiдpocпipo[2H-піридо[1,2 До суспензії 10,6г алюмогідриду літію у 500мл ТГФ додають по краплинах розчин 20,6г (3R,9аR)3-(1Н-індол-3-ілметил-гексагідроспіро[2Нпіридо[1,2-а]піразин-1,4-діон-7,2'-[1,3]-діоксану у 100мл ТГФ й нагрівають одержану суміш 2 доби зі зворотним холодильником. Після охолодження до 5°С додають по краплинах 9,2мл води, 18,4мл 2М водного розчину гідроксиду натрію та знову 9,2мл води. Суміш нагрівають 1 годину зі зворотним холодильником, охолоджують до кімнатної температури, фільтрують крізь Целіт та концентрують у вакуумі, одержуючи 19,7г сирого (3R,9аR-3-(1Hіндол-3-ілметил-октагідроспіро[2Н-піридо[1,2а]піразин-7,2'-[1,3]-діоксану; Rf0,16 (SiO2, CH2Cl2/MeOH/NH 4OH 92:7,5:0,5), який використовують на наступному етапі. Приклад 6 До розчину 19,7г (3R,9aR)-3-(1H-iндoл-3iлмeтил-oктaгiдpocпipo[2H-пipидo[1,2-а]піразин7,2'-[1,3]-діоксану у ді хлорметані додають 9,6мл діізопропилетиламіну при кімнатній температурі та при 5°С по краплинах 10мл 3,5біс(трифторметил)бензоїл хлориду. Одержану суміш перемішують усю ніч при кімнатній температурі, концентрують у вакуумі та очищують колонковою хроматографією (SiO2, CH2Cl2/MeOH/NH 4OH 96:3,75:0,25), одержуючи 30,0г (3R,9aR)-2-[3,5біс(трифторметил)бензоїл]-3-(1Н-індол-3-ілметилоктагідроспіро[2Н-піридо[1,2-а]піразин-7,2'-[1,3]діоксану. Rf 0,35 (SiO2, CH2Cl2/MeOH/NH4OH 96:3,75:0,25). Приклад 7 13 84300 Суміш 30,0г (3R,9аR)-2-[3,5біс(трифторметил)бензоїл]-3-(1H-індол-3-ілметилоктагідроспіро[2Н-піридо[1,2-а]піразин-7,2'-[1,3]діоксану у 150мл оцтової кислоти та 150мл 6М соляної кислоти нагрівають 3 доби при 40°С. Після охолодження до кімнатної температури додають 750мл діхлорметану та 17,00мл 2М водного розчину гідроксиду натрію. Фази розділяють, водну фазу двічі екстрагують діхлорметаном. Органічні фази з'єднують, промивають водою, концентрують у вакуумі та очищують випарювальною хроматографією (SiO2, СН2Сl2/МеOН 98:2), одержуючи 21,7г (3R,9aR)-2-[3,5-біс(трифторметил)бензоїл]-3-(1Ніндол-3-ілметил-октагідро[2Н-піридо[1,2-а]піразин7-ону. Rf 0,12 (SiO2, CH2Cl2/MeОH 98:2). Приклад 8 До розчину 1,0г біс(триметилсиліл)аміду літію у 35мл тетрагідрофурану додають по краплинах розчин 2,8г трет-бутилефір у (3R,9aR)-3-[2-(3,5бic(тpифтopмeтил)бeнюїл)-7-оксо-3-(1Н-індол-3ілметил-октагідро-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти у 30мл тетрагідрофурану при -70°С. Після 1,5 годин перемішування при -70°С додають по краплинах розчин 2,15г N-фенілбіс(трифторметансульфоніміду) у 10 мл тетрагідрофурану. Після додання розчин залишають на ніч, щоб нагрівся до кімнатної температури, потім гасять 5мл метанолу, концентрують у вакуумі та 14 До суспензії 12,0г (3R,9аR)-2-[3,5біс(трифторметил)бензоїл]-3-(1Н-індол-3-ілметилоктагідро[2Н-піридо[1,2-а]піразин-7-ону, 2,93г триетиламіну та 600мг 4-діметиламінпіридину у 125мл ацетонітрилу додають по краплинах розчин 6,4г дітрет-бутилдікарбонату у 50мл ацетонітрилу при кімнатній температурі. Суміш перемішують 2,5 години при кімнатній температурі та концентрують у вакуумі. Осад розчиняють у діхлорметані, промивають 5% водним розчином бікарбонату натрію, сушать, фільтрують, концентрують у вакуумі та очищують випарювальною хроматографією (SiО2, СН2СІ2/МеОН 98,5:1,5), одержуючи 11г третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-оксо-3-(1Н-індол-3ілметил-октагідро-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти. Rf 0,46 (SіO2, СН2Сl2/МеОН 95:5). Приклад 9 очищують колонковою хроматографією (SiO2, CH2Cl2/MeOH 99:1), одержуючи 3,4г суміші третбутиле фіру (3R,9aR)-3-[2-(3,5бic(тpифтopмeтил)бeнзoїл)-7тpифтopмeтaнcyльфoнілoкci-1,3,4,6,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти та трет-бутилефір у (3R,9aR)-3-[2-(3,5-бic(тpифтopмeтил)бeнзoїл)-7трифторметансульфонілоксі-1,3,4,8,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти. Rf 0,75 (SiO2, СН2Сl2/МеOН 99:1). Приклад 10 15 84300 16 До 0,9г суміші трет-бутилефіру (3R,9аR)-3-[2(3,5-біс(трифторметил)бензоїл)-7трифторметансульфонілоксі-1,3,4,6,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти та трет-бутилефіру (3R,9aR)-3-[2-(3,5-біс(трифторметил)бензоїл)-7трифторметансульфонілоксі-1,3,4,8,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти у 40мл дегазованого 3,4-діоксану додають 0,67г 4трибутилстаннілпіридину, 153мг хлориду літію та 70мг тетракіс(трифенілфосфин)паладію. Суміш нагрівають 20 годин при 70°С. Потім розчинник видаляють у вакуумі, осад розчиняють в етилацетаті, промивають розчином фториду кшіію, сушать, фільтрують та концентрують у вакуумі. Осад очищують колонковою хроматографією (SiO2, діетилетер), одержуючи 0,25г суміші трет-бутилефіру (3R,9аR)-3-[2-(3,5-біс(трифторметил)бензоїл)-7піридин-4-іл-1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2а]піразин-3-ілметил]-індол-1-карбонової кислоти та трет-бутилефіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бснзоїл)-7-піридин-4-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,57 (SіO2, діетилетер). Подібним шляхом одержують суміші: трет-бутилефіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піридин-3-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піридин-3-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf- 0,06 (SіO2, діетилетер); трет-бутилефіру (3R,9аR-3-[2-(3,5біс(трифторметил)бензоїл)-7-піридин-2-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піридин-2-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]шразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,39 (SiO2, діетилстер); трет-бутилефіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піримидин-5-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піримидин-5-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,84 (SiO2, CH2Cl2/MeOH/NH 4OH 93:7:0,5). Приклад 11 До 0,76г суміші суміші трет-бутилефір у (3R,9aR)-3-[2-(3,5-біс(трифторметил)бензоїл)-7трифторметансульфонілоксі-1,3,4,6,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил]індол-1-карбонової кислоти та трет-бутилефіру (3R,9aR)-3-[2-(3,5-біс(трифторметил)бензоїл)-7трифторметансульфонілоксі-1,3,4,8,9,9агексагідро-2Н-піридо[1,2-а]піразин-3-ілметил] індол-1-карбонової кислоти у 40мл дегазованого тетрагідрофурану додають 0,33г гексаметилдітину, 0,26г хлориду літію та 35мг тетракіс(трифенілфосфін)паладію(0). Суміш нагрівають 3 години при 65°С, охолоджують до кімнатної температури та охолоджують розчином фториду калію. Після додання діетилетеру фази розділяють, органічну фазу промивають водним розчином 17 84300 18 хлориду амонію, сушать, фільтрують та конценткислоти та трет-бутиле фіру (3R,9аR)-3-[2-(3,5рують у вакуумі. Осад очищують колонковою хробіс(трифторметил)бензоїл)-7матографією (SiO2, діетилетер/гексани 1:1), одертрифметиластаннаніл-1,3,4,8,9,9а-гексагідро-2Нжуючи 0,36г суміші трет-бутилефіру (3R,9аR)-3-[2піридо[1,2-а]піразин-3-ілметил]-індол-1-карбонової (3,5-біс(трифторметил)бензоїл)-7кислоти. Rf0,49 (SiO2, діетилетер/гексани 1:1). триметилстаннаніл-1,3,4,6,9,9а-гексагідро-2НПриклад 12 піридо[1,2-а]піразин-3-ілметил]-індол-1-карбонової До 0,35г суміші трет-бутиле фіру (3R,9аR)-3-[2(3,5-біс(трифторметил)бензоїл)-7триметилстаннанІл-1,3,4,6,9,9а-гексагідро-2Нпіридо[1,2-а]піразин-3-ілметил]-індол-1-карбонової кислоти та трет-бутиле фіру (3R,9аR)-3-[2-(3,5біс(трифторметил)бензоїл)-7трифмстиластаннаніл-1,3,4,8,9,9а-гексагідро-2Нпіридо[1,2-а]піразин-3-ілметил]-індол-1-карбонової кислоти у 15мл дегазованого діметилформаміду додають 52мг 2-хлорпіразину та 24мг діхлорбіс(трифенілфосфін)паладію(II). Одержаний розчин перемішують усю ніч при 100°С, охолоджують до кімнатної температури, розбавляють діетилетером та обробляють розчином фториду калію. Осад очищують колонковою хроматографією (SiO2, діетилетер), одержуючи 0,19г суміші третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піразин-2-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піразин-2-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,30 (SіO2, діетилетер). Подібним чином одержують суміш третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піримидин-2-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піримидин-2-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,54 (SiO2, діетилетер). Подібним чином одержують суміш третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-тіазол-2-іл1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти та третбутиле фіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-тіазол-2-іл1,3,4,8,9,9а-гексагідро-2Н-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти. Rf 0,60 (SiO2, діетилетер). Приклад 13 До суміші 35мг анізолу, 0,20г трет-бутилефіру (3R,9aR)-3-[2-(3,5-біс(трифторметил)бензоїл)-7піридин-4-іл-1,3,4,6,9,9а-гексагідро-2Н-піридо[1,2а]піразин-3-ілметил]-індол-1-карбонової кислоти та трет-бутилефіру (3R,9aR)-3-[2-(3,5біс(трифторметил)бензоїл)-7-піридин-4-іл1,3,4,8,9,9а-гексагідро-2H-піридо[1,2-а]піразин-3ілметил]-індол-1-карбонової кислоти у 2мл діхлорметану додають трифтороцтову кислоту при 0°С. Суміш витримують 1,5 години при кімнатній температурі, охолоджують кригою та обережно підлужують гідроксидом амонію. Фази розділяють, органічну фазу сушать, фільтрують та концентрують у вакуумі. Осад розчиняють у метанолі та нагрівають 1 годину при 50°С, потім охолоджують до кімнатної температури та концентрують у вакуумі. Тверду фазу перемішують усю ніч з гексанами, потім відфільтровують та одержують 70мг (3R,9аR)-(3,5-бic(тpифтopмeтил)фeнiл)-7-пipидин4-iл-1,3,4,8,9,9a-гексагідро-піридо[1,2-а]піразин-2іл]-метанону (сполука 1). Rf0,51 (SіO2, CH2Cl2/MeOH/NH 4OH 93:7:0,5). Аналогічним чином одержують наступні сполуки: {3R,9aR)-(3,5-бic(тpифтopмeтил)фeнiл)-[3-(1Нiндoл-3-iлмeтил)-7-пipидин-3-iл-1,3,4,8,9,9агексагідро-піридо[1,2-а]піразин-2-іл]-метанон (сполука 2). Rf 0,74 (SiО2, CH2Cl2/MeOH/NH 4OH 93:7:0,5). (3R,9аR)-(3,5-біс(трифторметил)феніл)-[3-(1Ніндол-3-ілметил)-7-піридин-2-іл-1,3,4,8,9,9агексагідро-піридо[1,2-а]піразин-2-іл]-метанон (спо 19 84300 20 лука 3). Rf 0,60 (SiO2, CH2Cl2/MeOH/NH 4OH (3R,9aR)-(3,5-біс(трифторметил)феніл)-[3-(1Н93:7:0,5). індол-3-ілметил)-7-піримидин-2-іл-1,3,4,8,9,9а(3R,9aR)-(3,5-біс(трифторметил)феніл)-[3-(1Нгексагідро-піридо[1,2-а]піразин-2-іл]-метанон (споіндол-3-ілметил)-7-піримидин-5-іл-1,3,4,8,9,9алука 6). Rf 0,85 (SiO2, СH2Сl2/МеОН/NН4ОН гексагідро-піридо[1,2-а]піразин-2-іл]-метанон (спо85:15:1). лука 4). Rf0,62 (SiO2, СН2СІ2/МеОН/NH4ОН (3R,9aR)-(3,5-бic(тpифтopмeтил)фeнiл)-[3-(1H93:7:0,5). iндoл-3-iлмeтил)-7-тiaзoл-2-iл-1,3,4,8,9,9а(3R,9аR)-(3,5-біс(трифторметил)феніл)-[3-(1Нгексагідро-піридо[1,2-а]піразин-2-іл]-метанон (споіндол-3-ілметил)-7-піразин-2-іл-1,3,4,8,9,9алука 7). Rf 0,85 (SiO2, CH2Cl2/MeOH/NH 4OH гексагідро-піридо[1,2-а]піразин-2-іл]-метанон (спо85:15:1) лука 5). Rf 0,49 (SiO2, CH2Cl2/MeOH/NH 4OH 93:7:0,5). Приклад складання композицій для випробувань на тваринах Композиція за прикладом 3: Для орального (р.о.) введення: До потрібної кількості (0,5-15мг) твердої сполуки за прикладом 2 у скляній трубці додають трохи скляних кульок та подрібнюють у вихровому млині 2 хвилини. Після додання 1мл водного розчину 1% метилцелюлози сполуку суспендують у ви хровому млині протягом 10 хвилин. Коригують pH до 7 доданням кількох краплин 0,1N водного розчину NaOH. Частинки, що залишилися у суспензії, суспендують знову за допомогою ультразукової ванни. Фармакологічні дані Спорідненість Зв'язування NK-1 Сполука 1 2 3 4 5 6 7 Антагонізм in vivo Тупання ногою у піщанок р.о. ED50, мг/кг 1,7 РКi 7,8 7,7 8,5 8,1 6,6 8,8 9,2 Комп’ютерна в ерстка В. Мацело 2,2 3,4 Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHexa- and octahydro-pyrido[1,2-a]pyrazine derivatives with nk1 antagonistic activity
Автори англійськоюIwema Bakker Wouter I., van den Hoogenband Adrianus, Mccreary Andrew C.
Назва патенту російськоюПроизводные гекса- и октагидропиридо[1,2-a]пиразина с антагонистической активностью относительно nk1
Автори російськоюИвема Баккер Воутер И., ван ден Гоогенбанд Адрианус, Маккрири Эндрю С.
МПК / Мітки
МПК: C07D 471/04, A61P 1/08, A61K 31/4985, A61P 29/00, C07D 221/00, C07D 241/00
Мітки: похідні, октагідропіридо[1,2-a]піразину, активністю, антагоністичною, гекса
Код посилання
<a href="https://ua.patents.su/10-84300-pokhidni-geksa-ta-oktagidropirido12-apirazinu-z-antagonistichnoyu-aktivnistyu-shhodo-nk1.html" target="_blank" rel="follow" title="База патентів України">Похідні гекса- та октагідропіридо[1,2-a]піразину з антагоністичною активністю щодо nk1</a>
Попередній патент: Спосіб інтенсифікації ферментації вуглеводневих субстратів
Наступний патент: Водостічний жолоб
Випадковий патент: Термоелектричний охолоджувач