Глюкокортикоїди, спосіб їх застосування, спосіб лікування та фармацевтична композиція на їх основі
Номер патенту: 96794
Опубліковано: 12.12.2011
Автори: Хаген Стейнар, Еріксен Олє Хенрік, Мірен Фінн, Сандвольд Маріт Ліланд
Формула / Реферат
1. Сполука загальної формули (І)
 ,
,
де:
Х1 і Х2 означають F;
R1 означає SCH2F;
R2 означає OCOEt або O-R4;
R3 означає СН3;
R4 означає Н або ацильну групу C8-C24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II)
де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7;
при умові, що в сполуці є щонайменше одна ацильна група формули (II);
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, визначена як:
 ,
,
 ,
,
 ,
,
 .
.
3. Сполука формули (І) за п. 1, в якій:
Х1 і Х2 означають F;
R1 означає O-R4;
R2 означає O-R4;
R3 означає СН3;
R4 означає Н або ацильну групу C8-C24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II)
де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1,
n - ціле число від 2 до 7;
при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II),
або її фармацевтично прийнятна сіль.
4. Сполука формули (І) за п. 1, в якій:
X1 і Х2 означають Н;
R1 означає ОСН2Сl або O-R4;
R2 означає ОСО2СН2СН3 або O-R4;
R3 означає Н;
R4 означає Н або ацильну групу C8-C24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II)
де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1,
n - ціле число від 2 до 7;
при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II);
або її фармацевтично прийнятна сіль.
5. Сполука формули (І) за п. 1, в якій:
Х1 і Х2 означають Н;
R1 означає ОСН2СН3 або O-R4;
R2 означає ОСОСНС12 або O-R4;
R3 означає Н;
R4 означає Н або ацильну групу C8-C24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II)
де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1,
n - ціле число від 2 до 7;
при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II);
або її фармацевтично прийнятна сіль.
6. Сполука формули (І) за будь-яким з пп. 1 або 3-5, в якій ацильна група формули (II) являє собою залишок елаїдинової кислоти.
7. Сполука, яка вибрана з:
 ,
,
 ,
,
 ,
,
 .
.
8. Сполука формули (І)
 ,
,
в якій:
Х1 і Х2 означають Н або F;
R1 означає ОН, ОСН2СН3, ОСН2Сl, SCH2F, CH2OCOCH(CH3)2, CH2-O-R4 або O-R4;
R2 означає OCOEt, ОСОСНСl2, ОСО2СН2СН3 або O-R4;
R3 означає СН3; або
R2 і R3, разом з атомами вуглецю, з якими вони сполучені, утворюють 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6;
R4 означає Н або ацильну групу C8-C24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II)
де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1,
n - ціле число від 2 до 7;
з наступними умовами:
- в сполуці є щонайменше одна ацильна група загальної формули (II); і
- сполука формули (І) не є 21-складним ефіром будесоніду і однієї з наступних жирних кислот: олеїнової кислоти, пальмітинової кислоти, ліноленової кислоти, пальмітолеїнової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, докозапентаєнової кислоти, докозагексаєнової кислоти;
або її фармацевтично прийнятна сіль для лікування раку.
9. Сполука за п. 8 або її фармацевтично прийнятна сіль для лікування раку крові.
10. Сполука за п. 8 або її фармацевтично прийнятна сіль для лікування стероїдрезистентного раку.
11. Сполука за п. 8 або її фармацевтично прийнятна сіль для застосування у допоміжній або паліативній терапії.
12. Застосування сполуки формули (І)
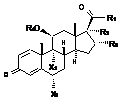 ,
,
в якій:
X1 і Х2 незалежно один від одного означають Н або F;
R1 означає ОН, ОСН2СН3, ОСН2Сl, SCH2F, CH2OCOCH(CH3)2, CH2-O-R4 або O-R4;
R2 означає ОСОЕt, ОСОСНСl2, ОСО2СН2СН3 або O-R4;
R3 означає Н, СН3 або ОН; або
R2 і R3, разом з атомами вуглецю, з якими вони сполучені, утворюють 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6;
R4 означає Н або ацильну групу С8-С24 загальної формули
CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO, (II)
де к - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1,
n - ціле число від 2 до 7;
при умові, що
- в сполуці є щонайменше одна ацильна група загальної формули (II);
або її фармацевтично прийнятні солі для лікування раку.
13. Застосування за п. 12 для виготовлення фармацевтичної композиції для лікування раку крові.
14. Застосування за п. 12 для виготовлення фармацевтичної композиції для лікування стероїдрезистентного раку.
15. Застосування за п. 12 для виготовлення фармацевтичної композиції для використання у допоміжній або паліативній терапії.
16. Сполука формули (І) за п. 8 або її фармацевтично прийнятна сіль для лікування запалення.
17. Сполука за п. 16 або її фармацевтично прийнятна сіль для лікування стероїдрезистентного запалення.
18. Застосування сполуки формули (І) за п. 12 при умові, що ця сполука не є складним ефіром бетаметазону, дексаметазану, флуоцинолону, параметазону або преднізолону і однієї з мононенасичених жирних кислот С18 або С20, або її фармацевтично прийнятної солі для виготовлення фармацевтичної композиції для лікування запалення.
19. Застосування за п. 18 для виготовлення фармацевтичної композиції для лікування стероїдрезистентного запалення.
20. Застосування сполуки формули (І) за п. 12 або її фармацевтично прийнятної солі для виготовлення фармацевтичної композиції для лікування хронічного обструктивного захворювання легенів (COPD).
21. Спосіб лікування раку у пацієнта, потребуючого такого лікування, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули (І) за п. 12 або її фармацевтично прийнятної солі.
22. Спосіб за п. 21, в якому підлягаюче лікуванню захворювання являє собою рак крові.
23. Спосіб за п. 21, в якому підлягаюче лікуванню захворювання являє собою стероїдрезистентний рак.
24. Спосіб лікування запалення у пацієнта, потребуючого такого лікування, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули (І) за п. 12 при умові, що ця сполука не є складним ефіром бетаметазону, дексаметазану, флуоцинолону, параметазону або преднізалону і н-9 мононенасиченої жирної кислоти С18 або С20, або її фармацевтично прийнятної солі.
25. Спосіб за п. 24, в якому підлягаюче лікуванню захворювання являє собою стероїдрезистентне запалення.
26. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-7 і фармацевтично прийнятні допоміжні речовини, носіїв і/або розріджувачі.
Текст
1. Сполука загальної формули (І) X2 , де: Х1 і Х2 означають F; R1 означає SCH2F; R2 означає OCOEt або O-R4; R3 означає СН3; R4 означає Н або ацильну групу C8-C24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; UA X1 (19) (21) a200910594 (22) 13.03.2008 (24) 12.12.2011 (86) PCT/NO2008/000096, 13.03.2008 (31) 20071485 (32) 20.03.2007 (33) NO (46) 12.12.2011, Бюл.№ 23, 2011 р. (72) МІРЕН ФІНН, NO, САНДВОЛЬД МАРІТ ЛІЛАНД, NO, ЕРІКСЕН ОЛЄ ХЕНРІК, NO, ХАГЕН СТЕЙНАР, NO (73) КЛАВІС ФАРМА АСА, NO (56) MILLER-LARSSON A ET AL: "Reversible fatty acid conjugation of budesonide. Novel mechanism for prolonged retention of topically applied steroid in airway tissue." DRUG METABOLISM AND DISPOSITION: THE BIOLOGICAL FATE OF CHEMICALS JUL 1998, vol. 26, no. 7, July 1998 (1998-07), pages 623-630, XP002495986 ISSN: 0090-9556 WO9832718 A 30.07.1998 WO2004033478 A 22.04.2004 SCHOELLER W: "Die antiphlogistische Wirksamkeit von Glucocorticoidestern bei lokaler Anwendung" ARZNEIMITTEL FORSCHUNG. DRUG RESEARCH, ECV EDITIO CANTOR VERLAG, AULENDORF, DE, vol. 10, no. 11, 1 January 1960 (1960-01-01), pages 921-923, XP002286160 ISSN: 0004-4172 TESHIMA MUGEN ET AL: "PEGylated liposomes loading palmitoyl prednisolone for prolonged blood concentration of prednisolone." BIOLOGICAL & PHARMACEUTICAL BULLETIN JUL 2006, vol. 29, no. 7, July 2006 (2006-07), pages 1436-1440, XP002495987 ISSN: 0918-6158 HASHIGUCHI T ET AL: "Evaluation of the topical delivery of a prednisolone derivative based upon percutaneous penetration kinetic analysis." BIOLOGICAL & PHARMACEUTICAL BULLETIN AUG 1998, vol. 21, no. 8, August 1998 (1998-08), pages 882-885, XP002495988 ISSN: 0918-6158 GIRALDI P N ET AL: "Chemical and physicochemical properties of the pregna-1,4-diene-3,20-dione 2 (11) 1 3 при умові, що в сполуці є щонайменше одна ацильна група формули (II); або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, визначена як: , 96794 4 R3 означає Н; R4 означає Н або ацильну групу C8-C24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II); або її фармацевтично прийнятна сіль. 6. Сполука формули (І) за будь-яким з пп. 1 або 35, в якій ацильна група формули (II) являє собою залишок елаїдинової кислоти. 7. Сполука, яка вибрана з: , , , SCH2F , . 3. Сполука формули (І) за п. 1, в якій: Х1 і Х2 означають F; R1 означає O-R4; R2 означає O-R4; R3 означає СН3; R4 означає Н або ацильну групу C8-C24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II), або її фармацевтично прийнятна сіль. 4. Сполука формули (І) за п. 1, в якій: X1 і Х2 означають Н; R1 означає ОСН2Сl або O-R4; R2 означає ОСО2СН2СН3 або O-R4; R3 означає Н; R4 означає Н або ацильну групу C8-C24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II); або її фармацевтично прийнятна сіль. 5. Сполука формули (І) за п. 1, в якій: Х1 і Х2 означають Н; R1 означає ОСН2СН3 або O-R4; R2 означає ОСОСНС12 або O-R4; , . 8. Сполука формули (І) R1 R2 R4O R3 X1 X2 , в якій: Х1 і Х2 означають Н або F; R1 означає ОН, ОСН2СН3, ОСН2Сl, SCH2F, CH2OCOCH(CH3)2, CH2-O-R4 або O-R4; R2 означає OCOEt, ОСОСНСl2, ОСО2СН2СН3 або O-R4; R3 означає СН3; або R2 і R3, разом з атомами вуглецю, з якими вони сполучені, утворюють 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6; 5 R4 означає Н або ацильну групу C8-C24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)nCO, (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; з наступними умовами: - в сполуці є щонайменше одна ацильна група загальної формули (II); і - сполука формули (І) не є 21-складним ефіром будесоніду і однієї з наступних жирних кислот: олеїнової кислоти, пальмітинової кислоти, ліноленової кислоти, пальмітолеїнової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, докозапентаєнової кислоти, докозагексаєнової кислоти; або її фармацевтично прийнятна сіль для лікування раку. 9. Сполука за п. 8 або її фармацевтично прийнятна сіль для лікування раку крові. 10. Сполука за п. 8 або її фармацевтично прийнятна сіль для лікування стероїдрезистентного раку. 11. Сполука за п. 8 або її фармацевтично прийнятна сіль для застосування у допоміжній або паліативній терапії. 12. Застосування сполуки формули (І) R1 R4O R2 R3 X1 X2 , в якій: X1 і Х2 незалежно один від одного означають Н або F; R1 означає ОН, ОСН2СН3, ОСН2Сl, SCH2F, CH2OCOCH(CH3)2, CH2-O-R4 або O-R4; R2 означає ОСОЕt, ОСОСНСl2, ОСО2СН2СН3 або O-R4; R3 означає Н, СН3 або ОН; або R2 і R3, разом з атомами вуглецю, з якими вони сполучені, утворюють 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6; R4 означає Н або ацильну групу С8-С24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO, (II) де к - ціле число від 0 до 10, l - ціле число від 0 до 6, m - ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що - в сполуці є щонайменше одна ацильна група загальної формули (II); або її фармацевтично прийнятні солі для лікування раку. Даний винахід стосується деяких дериватизованих ненасиченими жирними кислотами глюкокортикоїдів, які мають лікувальну дію, і фармацевтичних складів, які їх містять. У даному описі і формулі винаходу вказані похідні іменуються "Сполуки формули (I)». Сполуки формули (I) можуть бути використані в терапії ракових і запаль 96794 6 13. Застосування за п. 12 для виготовлення фармацевтичної композиції для лікування раку крові. 14. Застосування за п. 12 для виготовлення фармацевтичної композиції для лікування стероїдрезистентного раку. 15. Застосування за п. 12 для виготовлення фармацевтичної композиції для використання у допоміжній або паліативній терапії. 16. Сполука формули (І) за п. 8 або її фармацевтично прийнятна сіль для лікування запалення. 17. Сполука за п. 16 або її фармацевтично прийнятна сіль для лікування стероїдрезистентного запалення. 18. Застосування сполуки формули (І) за п. 12 при умові, що ця сполука не є складним ефіром бетаметазону, дексаметазану, флуоцинолону, параметазону або преднізолону і однієї з мононенасичених жирних кислот С18 або С20, або її фармацевтично прийнятної солі для виготовлення фармацевтичної композиції для лікування запалення. 19. Застосування за п. 18 для виготовлення фармацевтичної композиції для лікування стероїдрезистентного запалення. 20. Застосування сполуки формули (І) за п. 12 або її фармацевтично прийнятної солі для виготовлення фармацевтичної композиції для лікування хронічного обструктивного захворювання легенів (COPD). 21. Спосіб лікування раку у пацієнта, потребуючого такого лікування, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули (І) за п. 12 або її фармацевтично прийнятної солі. 22. Спосіб за п. 21, в якому підлягаюче лікуванню захворювання являє собою рак крові. 23. Спосіб за п. 21, в якому підлягаюче лікуванню захворювання являє собою стероїдрезистентний рак. 24. Спосіб лікування запалення у пацієнта, потребуючого такого лікування, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули (І) за п. 12 при умові, що ця сполука не є складним ефіром бетаметазону, дексаметазану, флуоцинолону, параметазону або преднізалону і н-9 мононенасиченої жирної кислоти С18 або С20, або її фармацевтично прийнятної солі. 25. Спосіб за п. 24, в якому підлягаюче лікуванню захворювання являє собою стероїдрезистентне запалення. 26. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-7 і фармацевтично прийнятні допоміжні речовини, носіїв і/або розріджувачі. них захворювань. Охоплюється терапія як раку крові, так і солідного раку і стероїд-резистентних типів раку, астми, а також стероїд-резистентних запальних захворювань і хронічного обструктивного захворювання легенів. Глюкокортикоїди широко використовуються в терапії запальних захворювань, таких як астма, 7 ревматоїдний артрит, запальні захворювання шлунку і автоімунні захворювання. Глюкокортикоїди також є ключовими препаратами в терапії дитячого гострого лімфобластного лейкозу (ALL) [1]. Хоча їх використання в терапії хронічних запальних захворювань і раку стало звичайним, оптимальна ефективність обмежується властивою організму або придбаною резистентністю до даного препарату. Стероїдна резистентність також являє собою важливу проблему при веденні хворих із запальним захворюванням шлунку [2]. Невелика кількість пацієнтів з астмою не реагують адекватно або не піддаються лікуванню кортикостероїдами [3]. Хоча питання кортикостероїдної резистентності у випадку ревматоїдного артриту може бути менш досліджене, ніж у випадку раку крові, цим двом захворюванням властивий однаковий механізм резистентності, і прийоми подолання резистентності після терапії захворювання можуть представляти обопільний інтерес [7]. Вважають, що сприятливий вплив глюкокортикоїдів опосередковується придушенням експресії запальних генів. Вони діють шляхом скріплення з одиночним рецептором (глюкокортикоїдним рецептором, GR), розташованим в цитозолі клітини. При активації GR переміщується в ядро, де він або включає (трансактивація) протизапальні гени, або відключає (трансрепресія) запальні гени [4]. Для індукції гена необхідна димеризація GR і скріплення ДНК зі специфічними GRE-елементами, розташованими в промоторних областях генів-мішеней. Глюкокортикоїди можуть активувати транскрипцію генів, які кодують протизапальні білки, такі як ліпокортин-1 і інтерлейкін-10. Самою чудовою дією глюкокортикоїдів є інгібування експресії полімерних генів (цитокінів, ензимів, рецепторів і адгезивних молекул). Прикладом є прозапальний цитокін гранулоцитарно-макрофагальний колонієстимулюючий фактор (GM-CSF, ГМКСФ). Глюкокортикоїди опосередковують цю інгібовану дію шляхом взаємодії між активованими GR і активованими факторами транскрипції, такими як ядерний фактор-kB (NFkB) і активуючий білок-1 (АР-1), які регулюють експресію запальних генів. GM-CSF грає ключову роль в запальних і автоімунних захворюваннях, а зменшення кількості GM-CSF вважається окремою метою медикаментозної терапії, направленої на придушення симптомів захворювання [8]. Застосування глюкокортикоїдів має обмеження через серйозні побічні ефекти [5], зумовлені їх впливом на ендокринну систему і обмін речовин, приблизно, опосередкованим індукованим транскрипційним регулюванням напряму регульованих GR генів-мішеней. Відомі потенційні негативні дії включають остеопороз і придушення гіпоталамогіпофізарно наднирковозалозної системи, після систематичного застосування - зниження швидкості лінійного зростання дітей, втрата кісткових мінералів, симптоми порушення зору і зміна шкіри після прийому інгаляційних кортикостероїдів [6]. Регулювання трансактивації і трансрепресії, як тканиноспецифічної, так і лінієспецифічної, може привести до підвищення терапевтичного індексу і відкриття нових високоселективних кортикостерої 96794 8 дів [6] з більш високим терапевтичним ефектом проти запалення або раку, і меншими побічними ефектами внаслідок зниженого транскрипційного регулювання регульованих GR генів, значущих з точки зору цих побічних ефектів. Крім того, що стосується механізму протиракового впливу глюкокортикоїдів, він включає взаємодію з GR і їх генами-мішенями, контролюючими експресію білків некрозу/апоптозу клітин. Клітинні лінії U937 і ТНР1 є моноцитарними/макрофаговими клітинами людини і являють собою модельну систему лінії кліток, використовувану для випробування продуктів з протизапальною і протираковою дією, ці клітинні лінії також релевантні відносно глюкокортикоїдної резистентності, оскільки вони не схильні до інгібування зростання дексаметазаном і преднізалоном [7]. У публікації WО98/32718, яка належить тому ж патентовласнику, описані адренокортикостероїди, які можуть утворювати похідні з ліпофільними групами. Серед згаданих сполук є бетаметазон, дексаметазан і беклометазон. Дериватизовані сполуки використовують для лікування запалення. Описані кон'югати будесоніду з жирними кислотами, більш конкретно, олеат, пальмітат, лінолеат, пальмітолеат і арахідонат будесоніду. Ці кон'югати утворяться в ході лікування запалення, більш конкретно, астми, однак затверджується, що кон'югати згадуваних стероїдів з жирними кислотами є фармакологічно неактивними кон'югатами. Даний винахід несподівано показав, що дериватизовані певними ненасиченими жирними кислотами глюкокортикоїди мають невідому раніше і незвичайну терапевтичну активністю. Велика кількість вказаних похідних становить новий, раніше не описаний клас хімічних сполук. Похідні сполуки даного винаходу мають підвищену активність і дають менше побічних ефектів, ніж описані раніше похідні глюкокортикоїдів, показано, що вони активні в стероїд-резистентних системах. Відомо, що глюкокортикоїди займають певне положення в терапії ракових захворювань і запалень. Добре відома властива організму або придбана резистентність до терапії глюкокортикоїдними препаратами. Повідомлялося, що моноцитарні/макрофагові клітини U937 і ТНР1 людини являють собою модельну систему лінії клітин, відмінну внутрішньою резистентністю до глюкокортикоїдів дексаметазану і преднізалону [7]. Ці дані підтверджені, крім того, показано, що ці клітини мають перехресну резистентність до високоактивного стероїду - флутіказону пропіонату, який не виявляє активність до 100 мкМ. Як показано на прикладах, заявниками несподівано виявлена сильна антипроліферативна дія дериватизованих жирними кислотами глюкокортикоїдів на ці резистентні клітинні лінії. Це відкриття робить можливим лікування захворювань, резистентних до терапії відомими глюкокортикоїдними препаратами. Заявниками несподівано виявлена підвищена протизапальна активність в поєднанні з менш вираженою активацією генів, релевантних відносно побічних ефектів, які викликаються цими дериватизованими жирними кислотами глюкокортикоїда 9 ми. Для флутиказону, дериватизованого елаїдиновою кислотою, спостерігалося в 22 рази більш сильне інгібування секреції цитокіну GM-CSF, ніж для флутиказону пропіонату на активованих клітинах легенів. У той же час, виявлене 7-кратне ослаблення побічних ефектів. Ці побічні ефекти представлені активацією GRE-елементів. Активація генів стероїдними похідними в цій системі, де активація є мірою побічних ефектів, на 85 % менше. Ці результати збільшують відносний терапевтичний індекс в 154 разів. Таким чином, даний винахід стосується сполук формули (I) 96794 10 де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II), або її фармацевтично прийнятна сіль. Іншим варіантом здійснення винаходу є сполука формули (I), в якій і Х1, і Х2 означають Н; R1 означає СН2-О-R4; R2 і R3, разом з атомами вуглецю, з якими вони сполучені, утворять 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6; R4 означає Н або ацильну групу С8-С24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO (II) , де: Х1 і Х2 незалежно один від одного означають Н або F; R1 означає ОН, ОСН2СН3, ОСН2Cl, SCH2F, СН2ОСОСН(СН3)2, СН2-О-R4 або O-R4; R2 означає ОСОEt, ОСОСНCl2, ОСО2СН2СН3 або O-R4; R3 означає Н, СН3 або ОН; або R2 і R3, разом з атомами вуглецю, з якими вони зв'язані, утворять 2-R5, R6-1,3-діоксоланове кільце, де R5 і R6 незалежно один від одного означають Н, алкіл С1-С6 або циклоалкіл С3-С6; R4 означає Н або ацильну групу С8-С24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m ціле число від 0 до 1, n - ціле число від 2 до 7; з наступними умовами: - коли Х1 є F, Х2 не є Н; - в сполуці є щонайменше одна ацильна група загальної формули (II); і - сполуки формули (I) не є однією з наступних сполук: будесоніду олеат, будесоніду лінолеат, будесоніду пальмітолеат і будесоніду арахідонат; або їх фармацевтично прийнятних солей. У переважному варіанті здійснення винаходу сполука формули (I) являє собою сполуку, в якій і Х1, і Х2 означають F; R1 означає SCH2F; R2 означає ОСОEt або O-R4; R3 означає СН3; R4 означає Н або ацильну групу С8-С24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II), або її фармацевтично прийнятна сіль. Ще одним варіантом здійснення винаходу є сполука формули (I), в якій і Х1, і Х2 означають F; R1 означає О-R4; R2 означає О-R4; R3 означає СН3; R4 означає Н або ацильну групу С8-С24 загальної формули CH3-(CH2)k-(CH=CH-CH2)l-(CH=CH)m-(CH2)n-CO (II) де k - ціле число від 0 до 10, l - ціле число від 0 до 6, m ціле число від 0 до 1, n - ціле число від 2 до 7; при умові, що в сполуці є щонайменше одна ацильна група загальної формули (II), або її фармацевтично прийнятна сіль. Прикладами переважних сполук, відповідних даному винаходу, є, крім інших, наступні сполуки: , , 11 , , , , , , . Сполуки формули (I) можуть бути використані для лікування захворювань. Більш конкретно, сполуки формули (I) можуть бути використані для лікування ракових захворювань. У зв'язку з цим ракові захворювання включають рак крові, солідний рак і стероїд-резистентний рак. Ці сполуки також можуть бути використані для лікування запалення. Більш конкретно, ці сполуки добре підходять для терапії стероїд-резистентних запалень. Сполуки формули (I) також можуть бути використані для терапії СОРD (хронічного обструктивного захворювання легенів). 96794 12 Сполуки, відповідні даному винаходу, викликають менше побічних ефектів, ніж базові стероїди, і мають більш специфічну протизапальну активність. Сполуки даного винаходу, звичайно, але не обов'язково, вводять до складу фармацевтичних композицій перед введенням пацієнту. Отже, в іншому своєму аспекті даний винахід направлений на фармацевтичні композиції, які містять сполуки даного винаходу і одну або більше фармацевтично прийнятну допоміжну речовину. Вказані допоміжні речовини підбирають відповідно до потрібної фармацевтичної форми і способу введення. Вказані допоміжні речовини разом із сполуками формули (I), відповідним даному винаходу, як правило, сполучають з одержанням лікарської форми, відповідної для введення пацієнту вибраним способом введення. Таким чином, лікарські форми включають форми, придатні для: (а) інгаляції, такі як аерозолі, розчини і сухі порошки; (b) місцевого застосування, такі як креми, лосьйони, пасти, мазі, розчини, спреї і гелі; (с) внутрішньовенного введення, такі як стерильні розчини, суспензії і порошки для розведення; (d) орального прийому, такі як таблетки, капсули, драже, порошки, сиропи, еліксири, суспензії, розчини, емульсії і саше. Сполуки формули (I) також можуть бути введені як очні краплі. Фармацевтично прийнятні допоміжні речовини можуть бути різними в залежності від конкретної лікарської форми. Крім іншого, фармацевтично прийнятні допоміжні речовини включають наступні: розріджувачі, змазувальні речовини, наповнювачі, дезинтегранти, розчинники, зволожувальні агенти, суспендуючі агенти, емульгатори, гранульовані агенти, покрівельні агенти, зв'язуючі, смакові добавки, речовини, корегуючі смак, підсолоджувачі, пластифікатори, загусники, антиоксиданти, стабілізатори, поверхнево-активні речовини і буферні речовини. Деякі допоміжні речовини можуть виконувати більше однієї функції. До придатних розріджувачів і наповнювачів належить лактоза, сахароза, декстроза, маніт, сорбіт, картопляний крохмаль, кукурудзяний крохмаль, пептизований крохмаль, целюлоза і їх похідні. До придатних зв'язуючим належить крохмаль, желатин, триптанік (acaica), альгінат натрію, альгінова кислота, трагант, гуарова смола, провідон, целюлоза і їх похідні. До придатних дезинтегрантів належить натрій крохмальгліколят, альгінова кислота, кросповідон і натрій карбометилцелюлоза. Сполуки формули (I) також можуть бути сполучені з полімерами, які піддаються біологічному розкладу з метою керованого вивільнення препарату. Фармацевтичні композиції, відповідні даному винаходу, можуть бути приготовані з використанням способів і методик, відомих фахівцям в даній галузі. Таким чином, одним з аспектів даного винаходу є сполуки формули (I) для терапії раку, відповідні пунктам 9-12 формули винаходу. Іншим аспектом даного винаходу є застосування сполук формули (I) для приготування фармацевтичних композицій для терапії вказаних за 13 хворювань відповідно до пунктів 14-21 формули винаходу. Сполуки формули (I) можуть бути одержані, як показано на прикладах нижче. Складний ефір 11-елаїдинової кислоти і флутиказону пропіонату До розчину флутиказону пропіонату (1,02 г, 2,04 моль) в дихлорметані (35 мл) додали елаїдинову кислоту (576 мг, 2,04 моль), потім 4(диметиламіно)піридин (249 мг, 2,04 моль) і 1,3дициклогексилкарбодиїмід (421 мг, 2,04 моль). Одержаний розчин перемішували протягом 24 годин, через цей час аналіз методом тонкошарової хроматографії показав значне зменшення кількості початкового матеріалу. Суміш концентрували під вакуумом (~10 мл розчину) і перемішували ще 140 годин. Суміш додатково концентрували під вакуумом і очистили при допомозі флеш-хроматографії на силікагелі, елююючи сумішшю гексан/ЕtОАс (3:1) з одержанням 1,23 г (79 %) цільової сполуки, яка має вигляд безбарвної олії. 6,9-дифтор-11,17-дигідрокси-16(-метил-3оксоандросту-1,4-дієн-17-карбонова кислота 96794 14 30 моль) і диметилформаміду (в каталітичній кількості) в толуолі (45 мл) при перемішуванні при кімнатній температурі протягом 17 годин, після чого випарений до сухого стану. Одержану суміш перемішували протягом 2 годин при кімнатній температурі, обробили діетиламіном (0,97 мл, 9,2 моль), одержаний розчин перемішували ще 1,5 години при кімнатній температурі. Потім додали 1М НСl, суміш екстрагували дихлорметаном (3×50 мл). Об'єднані органічні екстракти висушили (Na2SO4), відфільтрували і виділили під вакуумом. Неочищений продукт розчинили в ЕtОАс, додали гексан і помістили в холодильник на ніч. Одержану брудно-білу тверду речовину (2,07 г, яка містить деяку кількість N, N-діетиламіду) відділили фільтруванням, висушили і використали безпосередньо на наступній стадії. Деяку кількість вказаного в заголовку з'єднання (170 мг) очистили при допомозі флеш-хроматографії на силікагелі, елююючи сумішшю гексан/ЕtОАс (4:1), потім сумішшю гексан/ЕtОАс/АсОН (100:100:1) і одержали 123 мг (72 %) білої твердої речовини. 6,9-дифтор-17-(N,Nдиметилкарбамоїлтіо)карбоїл-16-елаїдоїлокси11-гідрокси-16-метил-3-оксоандросту-1,4-дієн . . До суспензії флуметазону (1,19 г, 2,9 моль) в тетрагідрофурані (11 мл) додали розчин перйодної кислоти (2,25 г, 9,9 моль) у воді (5,3 мл). Одержаний розчин перемішували при кімнатній температурі протягом 1 години. Тетрагідрофуран видалили у вакуумі, після чого залишилася водна суспензія, яку відфільтрували, твердий матеріал промили водою, висушили і одержали 1,17 г (100 %) сполуки, вказаної в заголовку, яка мала вигляд безбарвної твердої речовини. 6,9-дифтор-16-елаїдоїлокси-11-гідрокси16-метил-3-оксоандросту-1,4-дієн-17-карбонова кислота Розчин 6,9-дифтор-16-елаїдоїлокси-11гідрокси-16-метил-3-оксоандросту-1,4-дієн-17карбонової кислоти (1,9 г, 2,9 моль) і N,Nдиметилтіокарбамоїлхлориду (0,71 г, 5,8 моль) в ацетоні (40 мл) при кімнатній температурі послідовнообробили триетиламіном (0,58 г, 5,8 моль), безводним йодидом натрію (0,43 г, 2,9 моль) і водою (0,19 мл, 10 % ваг. зі стероїдом). Розчин перемішували 18 годин, додали воду (100 мл) і ЕtОАс (100 мл), фази розділилися. Органічну фазу промили 1М НСl, 5 % водним розчином гідрокарбонату натрію, водою, висушили (Na2SO4), відфільтрували і відділили під вакуумом. Після флешхроматографії на силікагелі з елююванням сумішшю гексан/ЕtОАс (3:2) одержали 1,55 г (~70 %, в дві стадії) сполуки, вказаної в заголовку, у вигляді жовтої твердої речовини. 6,9-дифтор-16-елаїдоїлокси-11-гідрокси16-метил-3-оксоандросту-1,4-дієн-17карботіонова кислота . До розчину 6,9-дифтор-11,17-дигідрокси16-метил-3-оксоандросту-1,4-дієн-17-карбонової кислоти (1,22 г, 3,1 моль) і триетиламіну (0,72 г, 7,1 моль) в ацетоні (25 мл) додали в дихлорметані (10 мл). Елаїлоїлхлорид був одержаний з елаїдинової кислоти (2,0 г, 7,1 моль), оксалілхлориду (2,6 мл, . Розчин 6,9-дифтор-17-(N,Nдиметилкарбамоїлтіо)карбоїл-16-елаїдоїлокси11-гідрокси-16-метил-3-оксоандросту-1,4-дієну (1,55 г, 2,1 моль) в діетиламіне (16 мл) дефлегмували протягом 3 годин. Розчин охолодили до кім 15 натної температури, налили в холодну 3М НСl (150 мл) і екстрагували ЕtОАс (2×150 мл). Об'єднані органічні екстракти промили водою і розсолом перед сушінням (Na2SO4), відфільтрували і випарили під вакуумом. Неочищений продукт (1,35 г брудно-білої твердої речовини) використали безпосередньо на наступній стадії. S-хлорметил 6,9-дифтор-16-елаїдоїлокси11-гідрокси-16-метил-3-оксоандросту-1,4-дієн17-карботіоат У розчин, який перемішується, 6,9-дифтор16-елаїдоїлокси-11-гідрокси-16-метил-3оксоандросту-1,4-дієн-17-карботіонової кислоти (1,35 г, 2 моль) в дихлорметані (40 мл) додали триетиламін (0,28 мл, 2 моль), потім хлорйодметан (0,56 мл, 8 моль). Одержаний розчин перемішували при кімнатній температурі протягом 70 годин, додали насичений водний розчин хлориду амоній і відділили фази. Водну фазу екстрагували дихлорметаном (2×), об'єднані органічні фази висушили (Na2SO4), відфільтрували і випарили під вакуумом. Після флеш-хроматографії на силікагелі з елююванням сумішшю гексан/ЕtОАс (3:1) одержали 1,04 г (72 %) сполуки, вказаної в заголовку, у вигляді безбарвної твердої речовини. S-йодметил 6,9-дифтор-16-елаїдоїлокси11-гідрокси-16-метил-3-оксоандросту-1,4-дієн17-карботіоат У розчин S-хлорметил 6,9-дифтор-16елаїдоїлокси-11-гідрокси-16-метил-3оксоандросту-1,4-дієн-17-карботіоату (1,04 г, 1,4 моль) в ацетоні (100 мл) додали йодид натрію (0,86 г, 5,7 моль) і дефлегмували протягом 22 годин. Розчинник випарили під вакуумом, залишок розчинили в ЕtОАс і промили водою, 10 % водним розчином гідрокарбонату натрію, водою, висушили (Na2SO4), відфільтрували і випарили під вакуумом. Неочищений продукт (1,1 г) використали безпосередньо на наступній стадії. S-фторметил 6,9-дифтор-16-елаїдоїлокси11-гідрокси-16-метил-3-оксоандросту-1,4-дієн17-карботіоат 96794 16 оксоандросту-1,4-дієн-17-карботіоату (1,1 г, 1,35 моль) в ацетонітрилі (65 мл) додали фторид срібла (1,7 г, 13,5 моль) і перемішували в темряві при кімнатній температурі протягом 40 годин. Суміш розбавили ЕtОАс і відфільтрували на короткому штранзі целіту і силікагелю. Фільтрат промили водою, висушили (Na2SO4), відфільтрували і випарили під вакуумом. Аналіз 1Н ЯМР показав наявність деякої кількості непрореагувавшого хлориду, і останні дві стадії були повторені для повного перетворення хлориду у фторид. Потім продукт очистили методом флеш-хроматографії на силікагелі з елююванням сумішшю гексан/ЕtОАс (3:1) і одержали 0,65 г (46 %, дві стадії) сполуку, вказану в заголовку, у вигляді безбарвної твердої речовини. Приклади Наведені нижче приклади пояснюють даний винахід. Однак ці приклади не треба розглядати як такі, що обмежують об'єм даного винаходу. Приклад 1 Клітинні лінії U937 і ТНР-1 висіяли в 96-ямкові планшети по 20000 клітин на ямку. У кожну ямку додали 50 мкл культурального середовища. У той же час були додані досліджувані сполуки в 5 різних концентраціях, інкубацію проводили протягом 48 годин. Для вивчення цитотоксичності досліджуваних сполук, в цих клітинах використали набір ® для аналізу проліферації клітин CellTiter96 NonRadiactive (Promega). В цьому наборі використовується колориметричний метод визначення кількості життєздатних проліферуючих клітин або набори для аналізу хімічної чутливості. Він складається з розчинів нової сполуки тетразолію (3-(4,5диметилтіазол-2-іл)-5-(3-карбоксиметоксифеніл)-2(4-сульфофеніл)-2Н-тетразолій, внутрішня сіль; МТS) і переносника електронів (феназин метосульфат; РМS). МТS в клітинах зазнає біовідновлення до формазанового продукту, розчинного в середовищі тканинної культури. Поглинання випромінювання 490 нм формазаном можна виміряти безпосередньо на 96-ямковому планшеті без додаткової обробки. Кількість формазанового продукту, виміряна за кількістю поглиненого випромінювання 490 нм, прямо пропорційна кількості живих клітин в культурі (величина ІК50). Досліджуваними сполуками були флутиказону пропіонат і флутиказон, дериватизований елаїдиновою кислотою. У клітинних лініях, резистентних до глюкокортикоїдів, флутиказон, дериватизований елаїдиновою кислотою, виявився високоактивним, характеризувався величиною ІК50 в мікромолярному діапазоні, клітини U937 були найбільш чутливими. Таблиця 1 Сполуки Флутіказона пропіонат У розчин S-йодметил 6,9-дифтор-16елаїдоїлокси-11-гідрокси-16-метил-3 Клітини Клітини U937Б, ІК50, ТНР1, ІК50, мкM(SD мкM(SD >100 >100 мкM±0,03 мкM±0,02 Флутиказон, дериватизований елаїдиновою 1 мкM±0,02 10 мкM±0,04 кислотою SD - середньоквадратичне відхилення 17 96794 Приклад 2 Клітини СОS-1 нирки мавпи (АТСС СRL 1650) були вирощені в модифікованому за способом Дульбеко середовищі Голка (Gibco BRL, Grand Island, Нью-Йорк), як описано в (9). Транзиторна трансфекція клітин СОS-1 проведена, як описано в 5 (10). Клітини були висіяні з густиною 2×10 клітин/ямку. У кожну ямка було вміщено 5 мкг досліджуваних плазмід, 5 мкг контрольних плазмід галактозидазу як внутрішній контроль і або 2 мкг експресійних плазмід рМТ-hGR, або pGL3-basic як носій. Про плазміди: мишачий ген PPAR описаний в (11). В GL3-LUC векторі (Promega) були конструйовані вектори, експресуючі ген-репортер LUC під контролем 5'-фланкуючої області і області промотору PPAR. 5'-фланкуюча послідовність PPAR між -28000bp і +100bp була клонована в розчеплю вальний NheI pGL3-LUC з утворенням плазміди PPAR(-2800/+100)LUC. Кожну трансфекцію проводили тричі. Клітини трансфектували 24 години після посіву з доданням свіжого середовища, яке містить ліганд. Через 72 години клітини зібрали, приготували цитозольний екстракт і виміряли активність LUC відповідно до протоколу Promega. Результати нормалізували відносно активності галактозідази, виміряної шляхом інкубації 100 мкл екстракту з 0,28 о-нітрофеніл-D-галактозідою (ONPG) в 50 мМ фосфатного буферу з рН 7,0, 10 мМ KCl, 1 мМ MgCl2 протягом 30 хв. при 30 °C і вимірювання поглинання випромінювання 420 нм. Досліджувані сполуки були флутиказону пропіонат, флутиказон, дериватизований елаїдиновою кислотою, і флуметазон, дериватизований елаїдиновою кислотою. Стероїдні сполуки, флутиказону пропіонат, було здібно індукувати 100 % активність гена-репортера, тоді як складний ефір елаїдинової кислоти і флутиказону і елаїдинової кислоти і флуметазону індукував активність генарепортера на 15 % і 2 %, відповідно, що виявилося несподіваним. Ці стероїдні аналоги значно менше активували гени, які обумовлюють, побічні ефекти. Таблиця 2 Сполуки Флутіказону пропіонат Складний ефір елаїдинової кислоти і флутиказону Складний ефір елаїдинової кислоти і флуметазону Активність люциферази/-галактозидази (у % відносно флутиказону пропіонату) 100 % 15 % 2% Приклад 3 IL-1-стимулювання спричиняє збільшення секреції гранулоцитарно-макрофагального колонієстимулюючого фактора (GM-CSF) через 24 години в клітинах А549 ТRЕ (АР-1 регуляція). Інгібування секреції GM-CSF вимірювали через 24 години впливу досліджуваною сполукою. Важкоефірний флутиказон, дериватизований елаїдиновою кисло 18 тою, викликав залежне від концентрації інгібування IL-1β-стимулювання секреції GM-CSF в клітинах -11 А549 ТRЕ при ІК50=1,4×10 М. Флутиказону пропіонат викликав залежне від концентрації ініибування секреції GM-CSF в клітинах А549 ТRЕ при -10 ІК50=3,1×10 М (таблиця 3). Флутиказон, дериватизований елаїдиновою кислотою, в 22 рази сильніше інгібував секрецію GM-CSF, тобто, в даному випробуванні виявив в 22 рази більш сильну протизапальну дію. Індукування активності GRЕ-люциферази спостерігали на стабільно трансфіцованих клітинах А549 GRЕ-люциферази. У клітинах А549 GRЕлюциферази не виявлено жодного впливу на активність GRЕ-люциферази в порівнянні із залежною від концентрації індукцією активності генарепортера GRЕ-люциферази в клітинах А549 GRЕ-люциферази, підданих дії флутиказону пропіонату, який спричиняє максимальне стимулю-10 вання активності люциферази при ЕК50=5,1×10 М. Несподівано виявлене, що у випадку використання флутиказону, дериватизованого елаїдиновою кислотою, інгібування GM-CSF збільшується більш, ніж в 20 разів в порівнянні з відсутністю впливу на GRЕ-люциферазу, що в даній випробувальній системі також вказує на більш високий терапевтичний індекс. Стероїд Дексаметазан Флутіказону пропіонат Складний ефір елаїдинової кислоти і флутиказону Таблиця 3 А549 (TRE (+IL-1), ІК50 -10 8,5×10 М -10 3,1×10 М -11 1,4×10 М Джерела інформації: 1. Genome-wide identification of prednisoloneresponsive genes in acute lymphoblastic leukaemia cells., Tissing W.J. et al., Blood, 2007, jan.11 2. Identification of budesonide and prednisolone as substrates of the intestinal drug efflux pump Pglycoprotein., Dilger K. et al. Inflamm.Bowel Dis. 2004, Sept, ; 10 (5): 578-83. 3. Mechanisms of steroid action and resistance in inflammation., I. M. Adcock and S.J. Lane, J. of Endocrinology (2003) 178, 347-355. 4. Anti-inflammatory actions of glucocorticoids: Molecular mechanism., Barnes et al. (1998) J. Clinical Science 94, 557-572. 5. Inhaled corticosteroids: past lessons and future issues, Allen D.B. et al., J. Allergy Clinic. Immunol. 2003; 112, р. 1-40. 6. Designing corticosteroid drugs for pulmonary selectivity.; K. Biggadike, I. Uings and S. N. Farrow; Proceedings of the American Thoracic Society, Vol 1, р. 352-355, 2004. 7. Sulfasalazine sensitizes human monocytic/macrophage cells for glucocorticoids by up-regulation of receptor (alpha) and glucocorticoidinduced apoptosis., Oerlemans R. et al., Ann. Rheum. Dis., 2007 Jan 31. 19 8. GM-CSF in inflammation and autoimmunity, Hamilton J.A., Trends Immunol., 2002, Aug., 23(8); 403-8. 9. Establishment of а clonal strain of hetatoma cells which maintain in culture the five enzymes of the urea cycle. Richardson U.I., Snodgrass P.J., Nuzum C.T., Tashjian A.H., Jr. (1974) J. Cell Physiol. 83: 141-149. 10. А new technique for the assay of infectivity of human adenovirus 5 DNA, Graham et al. 1973) Virology 52: 456-467. Комп’ютерна верстка А. Крижанівський 96794 20 11. Structure of the mouse peroxisome proliferator activated reporter gene. Gearing et al. (1994) BBRC 199, 25512. Reversible formation of fatty acid esters of budesonide, an antiasthma glucocorticoid, in human lung and liver microsomes. Tunej, A. Sjodin, K. and Hallstrom, G., Drug Metabolism and Disposistion, 25(11); 1311-7 (1997). Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucocorticoides, method of use thereof, treatment method and pharmaceutical formulation based thereon
Автори англійськоюMyhren, Finn, Sandvold, Marit, Liland, Eriksen, Ole, Henrik, Hagen, Steinar
Назва патенту російськоюГлюкокортикоиды, способ их применения, способ лечения и фармацевтическая композиция на их основе
Автори російськоюМирэн Финн, Сандвольд Марит Лиланд, Эриксен Оле Хенрик, Хагэн Стэйнар
МПК / Мітки
МПК: C07J 71/00, A61K 31/57, A61K 31/58, C07J 3/00, A61P 5/44, A61K 35/00
Мітки: лікування, основі, спосіб, застосування, фармацевтична, композиція, глюкокортикоїди
Код посилання
<a href="https://ua.patents.su/10-96794-glyukokortikodi-sposib-kh-zastosuvannya-sposib-likuvannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Глюкокортикоїди, спосіб їх застосування, спосіб лікування та фармацевтична композиція на їх основі</a>
Попередній патент: Капсула для готування напоїв
Наступний патент: Пробіотики для зниження ризику ожиріння
Випадковий патент: Шпонкове з'єднання














