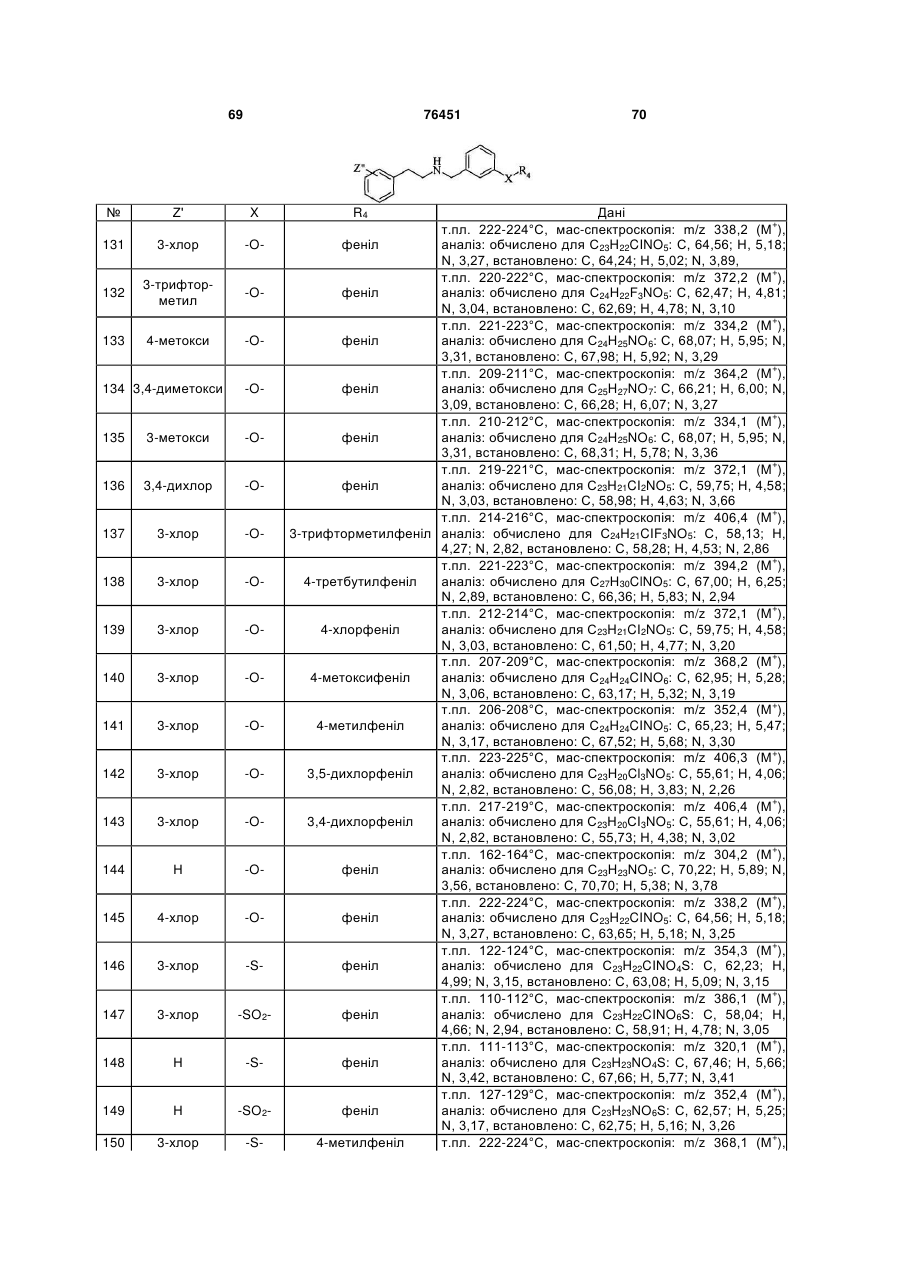
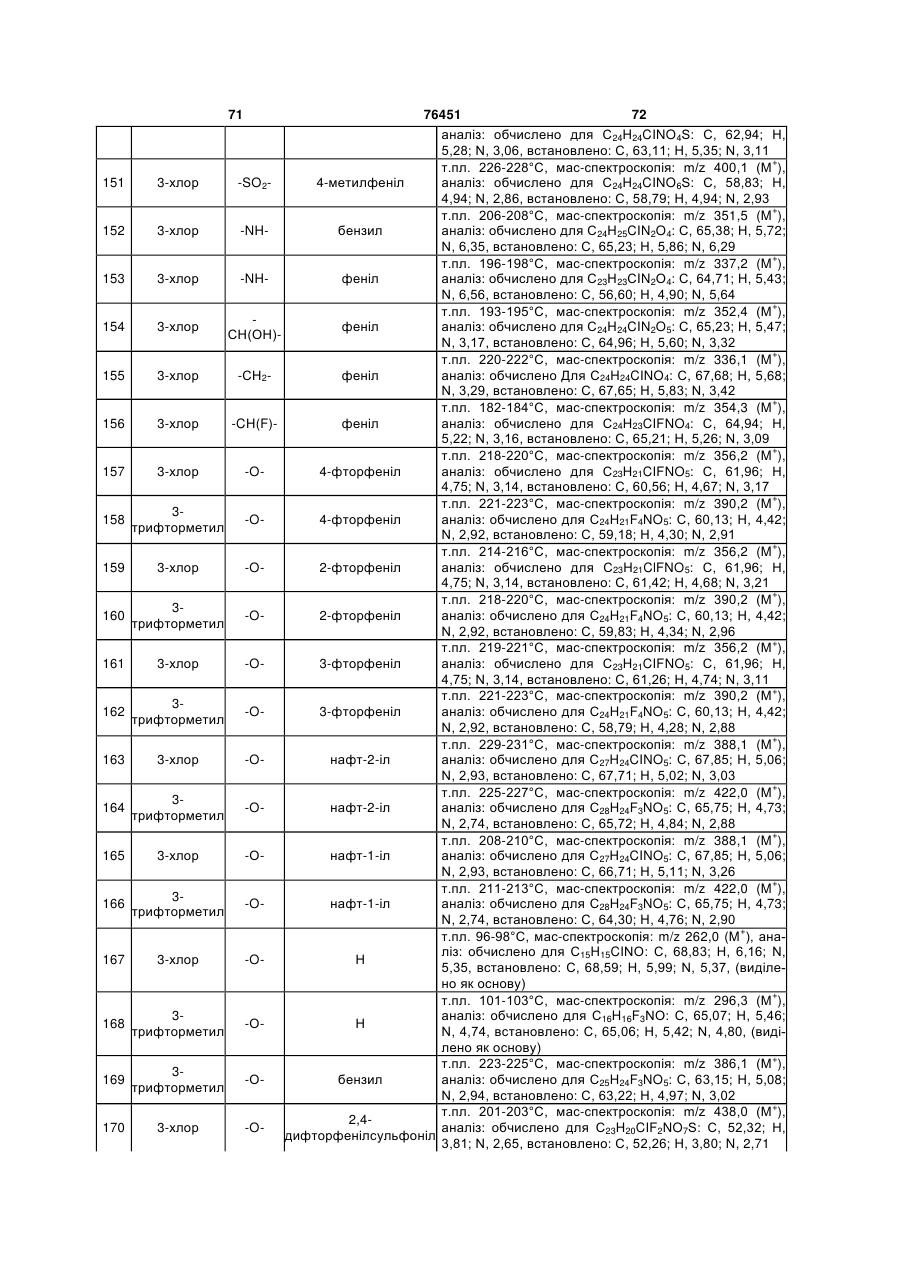
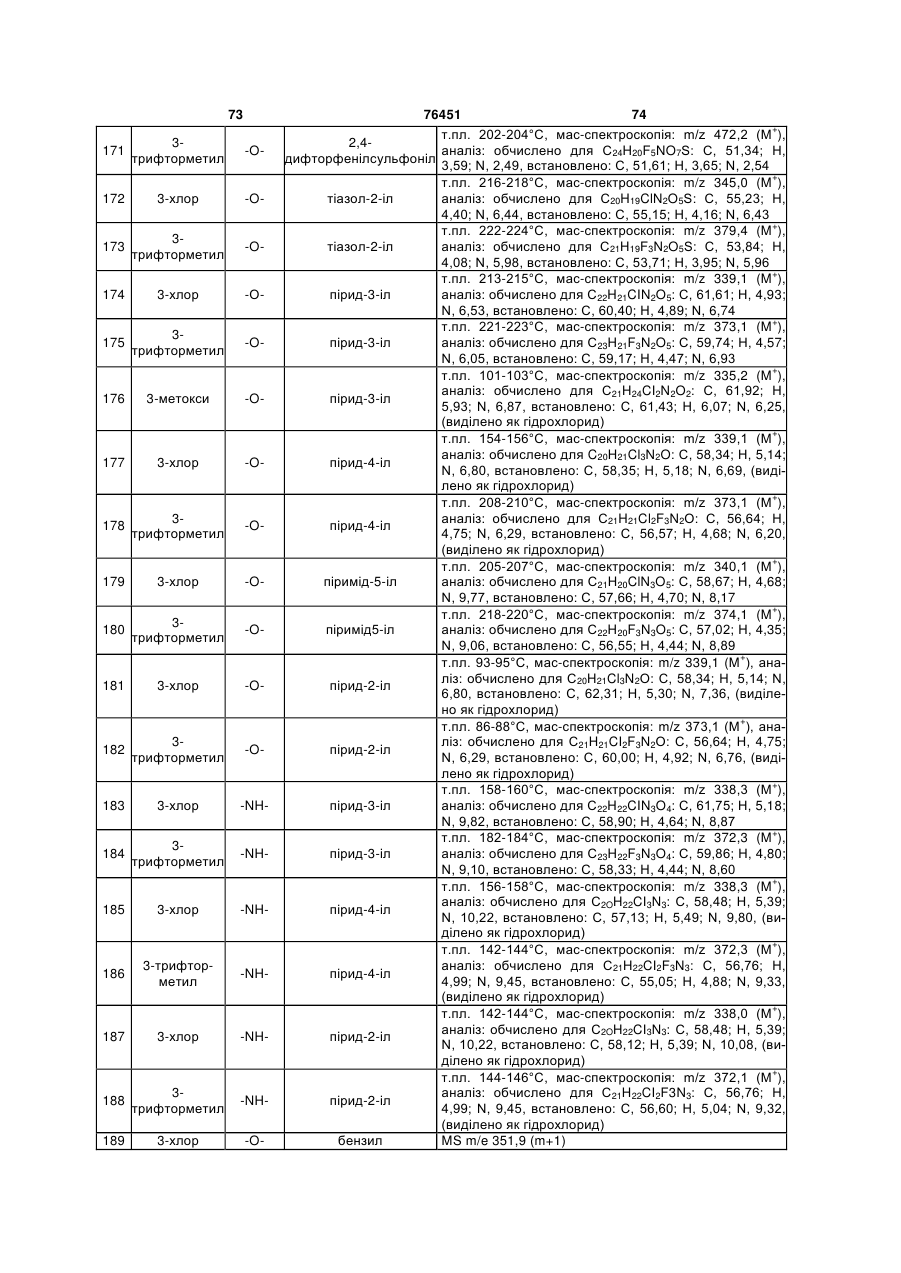
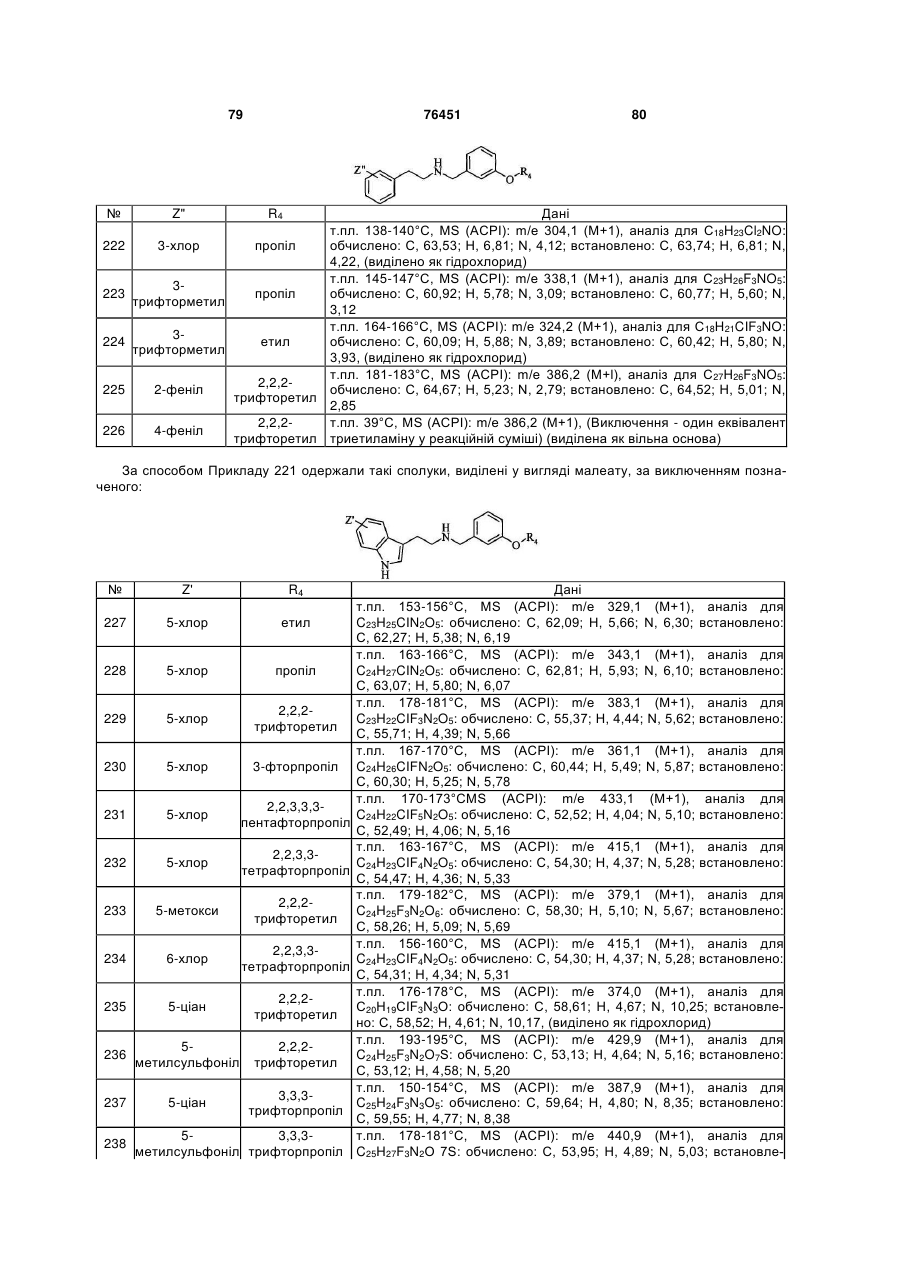
N-(2-арилетил)бензиламіни як антагоністи рецептора 5-ht6, фармацевтична композиція на їх основі
Номер патенту: 76451
Опубліковано: 15.08.2006
Автори: Гілліг Джеймз Роналд, Фішер Метью Джозеф, Гітлен Бруно, Коуен Майкл Філіп, Міллер Шон Крістофер, Шаус Джон Менерт, Маккоуан Джефферсон Рей, Чен Жаочжен
Формула / Реферат
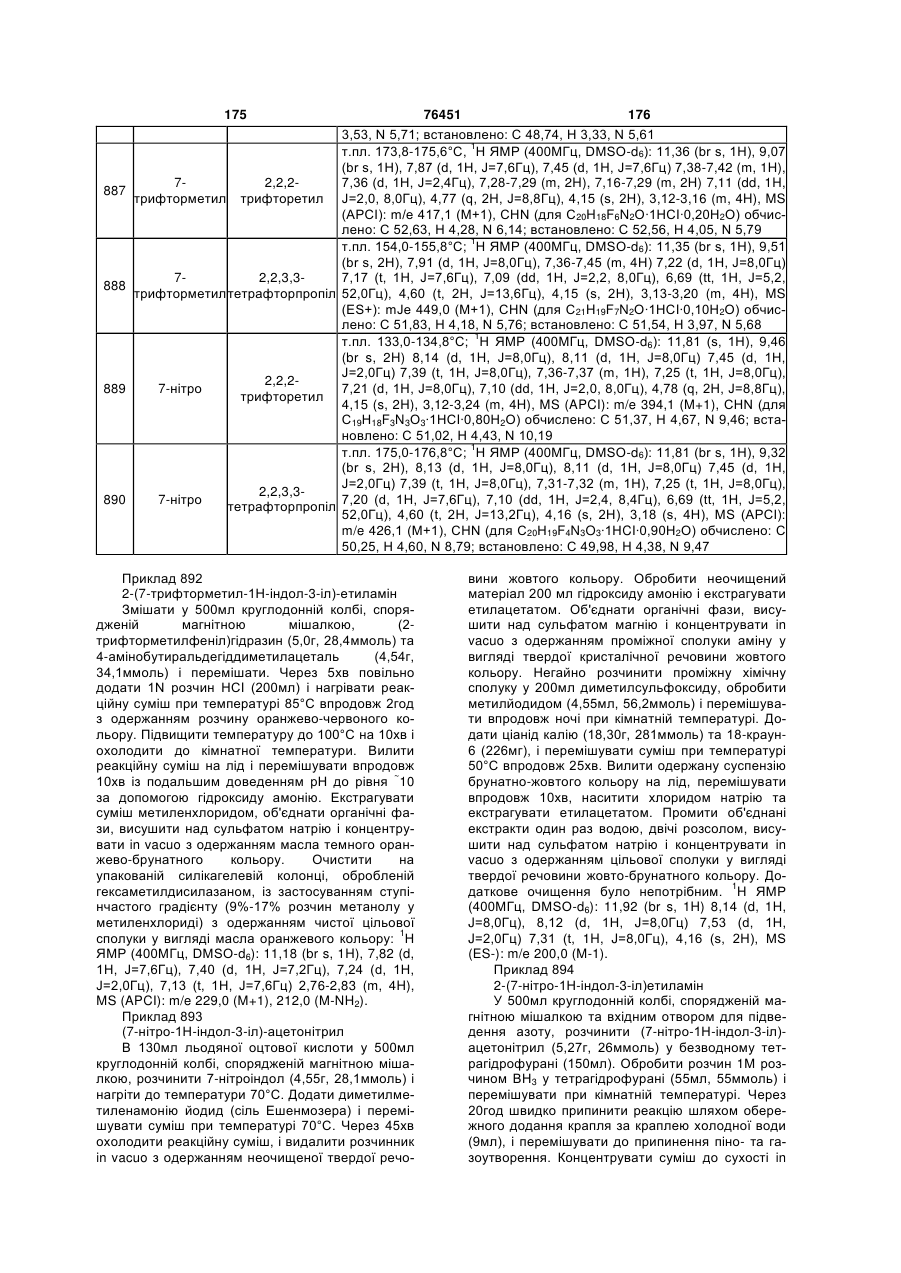
1. Сполука формули I
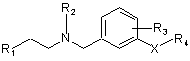 , формула I
, формула I
де
X вибраний із групи, що включає -O-, -NH-, -S-, -SO2-, -CH2-, -CH(F)-, -CH(OH)- та -C(O)-;
R1 вибраний із групи, що включає феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; нафтил, незаміщений або заміщений 1-2 групами, незалежно одна від одної вибраними із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу, трифторметил та нітрогрупу; імідазоліл; і радикал, вибраний з  ,
,
де Q1 вибраний із групи, що включає -O-, -S- та -NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; де кожний з Rd, Re та Rf незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу та трифторметил, або Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та Rf вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, трифторметил та галоген;
R2 вибраний із групи, що включає водень та C1-C3 алкіл;
R3 вибраний із групи, що включає водень, фтор та метил;
R4 вибраний із групи, що включає водень, аліл, C2-C4 алкіл, фторований C2-C4 алкіл, гексил, феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; нафтил; фенілсульфоніл, причому фенільна група згаданого фенілсульфонілу є незаміщеною або заміщена 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу, трифторметил, нітрогрупу та феніл; бензил, причому фенільна група згаданого бензилу є незаміщеною або заміщена 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, ціано-, нітрогрупу, трифторметил та галоген; і радикал, вибраний з  ,
,
де Q3 вибраний із групи, що включає -O-,-S- та
-NRg¢-, де Rg¢ вибраний із групи, що включає водень та C1-C4 алкіл; та Q4 і Q5 – -CRm, де кожний з Rm незалежно вибраний із групи, що включає водень, C1-C4 алкіл, галоген та трифторметил; або один чи обидва Q4 та Q5 є -N=; і де один або обидва Q6 є -N=, у той час як інші є -CRn; де кожний Rn незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціано-, нітрогрупу та трифторметил;
за умови, що R4 не є фенілсульфонілом у разі, коли X є -SO2-, -CH2-, -CH(F)-, -CH(OH)- або -C(O)-; та
фармацевтично прийнятні солі цієї сполуки;
за умови, що дана сполука не є 3-етоксибензил-[2-(4-етоксифеніл)етил]аміном; 3-етоксибензил-[2-(3-етоксифеніл)етил]аміном; 3-етоксибензил-[2-(2-етоксифеніл)етил]аміном або N-[2-(3,4-диметоксифеніл)етил]-3-феноксибензиламіном.
2. Сполука за п. 1, де X – -O-.
3. Сполука за одним із пп. 1 або 2, де R3 – водень.
4. Сполука за будь-яким із пп. 1-3, де R4 вибраний із групи, що включає фторований C2-C4-алкіл та феніл, незаміщений або заміщений однією-трьома групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом.
5. Сполука за будь-яким із пп. 1-4, де R1 – феніл, незаміщений або заміщений однією-трьома групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом.
6. Сполука за будь-яким із пп. 1-4, де R1 – радикал, вибраний з  ,
,
де Q1 вибраний із групи, що включає -O-, -S- та -NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; де Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та Rf вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, трифторметил та галоген.
7. Сполука за п. 6, де R1 – індол-3-іл, незаміщений або заміщений 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2 та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом.
8. Сполука за п. 1, яка являє собою N-(2-(6-фтор-1H-індол-3-іл)етил)-3-(2,2,3,3-тетрафторпропокси)бензиламін.
9. Сполука за п. 1, яка являє собою гідрохлорид N-(2-(6-фтор-1H-індол-3-іл)етил)-3-(2,2,3,3-тетрафторпропокси)бензиламіну.
10. Фармацевтична композиція, яка містить сполуку за п. 1 та фармацевтично прийнятний розріджувач.
11. Спосіб лікування розладу, вибраного із групи, яка включає розлади пізнавальної здатності, розлади пам’яті, психози, шизофренію, розлади, що супроводжуються тривогою, та хворобу Альцгеймера, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за п. 1.
12. Сполука формули II
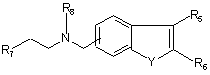 , формула (II)
, формула (II)
де
Y вибраний із групи, що включає O, NH та NR9, де R9 вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом;
R5 та R6 – водень або разом з атомами, з якими вони сполучені, утворюють бензольне кільце, за умови, що R5 та R6 – водень, коли Y – NR9;
R7 вибраний із групи, що включає феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; нафтил, незаміщений або заміщений однією-двома групами, незалежно одна від одної вибраними із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу, трифторметил та нітрогрупу; і радикал, вибраний з  ,
,
де Q1 вибраний із групи, що включає -O-, -S- та -NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; кожний з Rd, Re та Rf незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу та трифторметил, або Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та Rf вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, трифторметил та галоген;
R8 вибраний із групи, що включає водень та C1-C3 алкіл; та
фармацевтично прийнятні солі цієї сполуки.
13. Сполука за п. 12, де складова
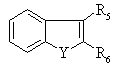
приєднана у 4 або 6 положенні.
14. Сполука за п. 13, де Y - NR9.
15. Сполука за будь-яким із пп. 12-14, де R7 вибраний із групи, що включає феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та радикал, вибраний з  ,
,
де Q1 вибраний із групи, що включає -O-, -S- та -NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; де кожний з Rd, Re та Rf незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу та трифторметил, або Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та Rf вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, трифторметил та галоген.
16. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 12-15 та фармацевтично прийнятний розріджувач.
17. Спосіб лікування розладів, вибраних із групи, що включає розлади пізнавальної здатності, шизофренію, розлади, що супроводжуються тривогою, та хворобу Альцгеймера, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за п. 12.
Текст
1. Сполука формули I R2 UA (21) 2003098796 (22) 15.03.2002 (24) 15.08.2006 (86) PCT/US02/05115, 15.03.2002 (31) 60/279,928 (32) 29.03.2001 (33) US (31) 60/329,449 (32) 15.10.2001 (33) US (46) 15.08.2006, Бюл. № 8, 2006 р. (72) Чен Жаочжен , US, Коуен Майкл Філіп, US, Фішер Метью Джозеф, US, Гітлен Бруно , FR, Гілліг Джеймз Роналд, US, Маккоуан Джефферсон Рей, US, Міллер Шон Крістофер, US, Шаус Джон Менерт, US (73) ЕЛІ ЛІЛЛІ ЕНД КОМПАНІ, US (56) DATABASE CROSSFIRE BEILSTEIN 'Online! Beilstein Institut zur Forderung der Chemischen Wissenschaften, Frankfurt am Main, DE; (3-ethoxybenzyl)-(4-ethoxy-phenethyl)-amine, IDE, BUCK: Database accession no. 3365864, XP002209139 2 (19) 1 3 76451 4 R1 вибраний із групи, що включає феніл, незамічому фенільна група згаданого фенілсульфонілу є щений або заміщений 1-3 групами, незалежно однезаміщеною або заміщена 1-3 групами, незалежна від одної вибраними із групи, що включає воно одна від одної вибраними із групи, що включає день, гідроксигрупу, C1-C4 алкіл, C1водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, C4 алкоксигрупу, галоген, бензилокси-, карбоксигціаногрупу, трифторметил, нітрогрупу та феніл; рупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1бензил, причому фенільна група згаданого бензиC4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трилу є незаміщеною або заміщена 1-3 групами, нефторметил, трифторметокси-, нітрогрупу та феніл, залежно одна від одної вибраними із групи, що незаміщений або заміщений C1-C4 алкілом, C1включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, C4 алкоксигрупою, галогеном, ціаногрупою або ціано-, нітрогрупу, трифторметил та галоген; і ратрифторметилом; нафтил, незаміщений або замідикал, вибраний з щений 1-2 групами, незалежно одна від одної вибQ6 Q6 раними із групи, що включає водень, C1-C4 алкіл, Q5 Rm C1-C4 алкоксигрупу, галоген, ціаногрупу, трифторта Rn Q6 Q4 метил та нітрогрупу; імідазоліл; і радикал, вибраQ6 Q1 ний з , Re Rd де Q3 вибраний із групи, що включає -O-,-S- та Rf Rd -NRg -, де Rg вибраний із групи, що включає воRf та день та C1-C4 алкіл; та Q4 і Q5 – -CRm, де кожний з Re Q1 Re Q2 Rm незалежно вибраний із групи, що включає во, день, C1-C4 алкіл, галоген та трифторметил; або де Q1 вибраний із групи, що включає -O-, -S- та один чи обидва Q4 та Q5 є -N=; і де один або обидNRg-, де Rg вибраний із групи, що включає водень ва Q6 є -N=, у той час як інші є -CRn; де кожний Rn та C1-C4 алкіл; і Q2 – -N=; де кожний з Rd, Re та Rf незалежно вибраний із групи, що включає водень, незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціано-, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрунітрогрупу та трифторметил; пу та трифторметил, або Rd та Re (або один із Re), за умови, що R4 не є фенілсульфонілом у разі, разом із атомами, з якими вони сполучені, утвоколи X є -SO2-, -CH2-, -CH(F)-, -CH(OH)- або -C(O)-; рюють бензольне кільце, незаміщене або заміщета не 1-4 замісниками, незалежно один від одного фармацевтично прийнятні солі цієї сполуки; вибраними із групи, що включає водень, гідроксигза умови, що дана сполука не є 3-етоксибензил-[2рупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси(4-етоксифеніл)етил]аміном; 3-етоксибензил-[2-(3, 2,2,2-трифторетоксигрупу, трифторметил, галоетоксифеніл)етил]аміном; 3-етоксибензил-[2-(2ген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, етоксифеніл)етил]аміном або N-[2-(3,4N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, диметоксифеніл)етил]-3-феноксибензиламіном. ациламіногрупу, де згадана ацильна група вибра2. Сполука за п. 1, де X – -O-. на із групи, що включає C1-C4 алкіл та феніл; ціа3. Сполука за одним із пп. 1 або 2, де R3 – водень. но-, нітро-, сульфоніламідогрупу, феніл, незамі4. Сполука за будь-яким із пп. 1-3, де R4 вибраний щений або заміщений C1-C4 алкілом, C1 із групи, що включає фторований C2-C4-алкіл та C4 алкоксигрупою, галогеном, ціаногрупою або феніл, незаміщений або заміщений однією-трьома трифторметилом; фенілокси-, бензилоксигрупу, групами, незалежно одна від одної вибраними із NHS(O)2Rh, де Rh вибраний із групи, що включає групи, що включає водень, гідроксигрупу, C1C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; C4 алкіл, C1-C4 алкоксигрупу, галоген, бензилокси-, та Ri вибраний із групи, що включає C1-C4 алкіл та карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, Nфеніл, незаміщений або заміщений C1-C4 алкілом, (C1-C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметил, трифторметокси-, нітрогрупу та трифторметилом; та Rf вибраний із групи, що феніл, незаміщений або заміщений C1-C4 алкілом, включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметил та галоген; трифторметилом. R2 вибраний із групи, що включає водень та C15. Сполука за будь-яким із пп. 1-4, де R1 – феніл, C3 алкіл; незаміщений або заміщений однією-трьома групаR3 вибраний із групи, що включає водень, фтор та ми, незалежно одна від одної вибраними із групи, метил; що включає водень, гідроксигрупу, C1-C4 алкіл, C1R4 вибраний із групи, що включає водень, аліл, C2C4 алкоксигрупу, галоген, бензилокси-, карбоксигC4 алкіл, фторований C2-C4 алкіл, гексил, феніл, рупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1незаміщений або заміщений 1-3 групами, незалеC4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трижно одна від одної вибраними із групи, що вклюфторметил, трифторметокси-, нітрогрупу та феніл, чає водень, гідроксигрупу, C1-C4 алкіл, C1незаміщений або заміщений C1-C4 алкілом, C1C4 алкоксигрупу, галоген, бензилокси-, карбоксигC4 алкоксигрупою, галогеном, ціаногрупою або рупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1трифторметилом. C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, три6. Сполука за будь-яким із пп. 1-4, де R1 – радикал, фторметил, трифторметокси-, нітрогрупу та феніл, вибраний з незаміщений або заміщений C1-C4 алкілом, C1C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; нафтил; фенілсульфоніл, при 5 Re Rd Re Q1 Rf та Rd Re Q2 Rf , де Q1 вибраний із групи, що включає -O-, -S- та NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; де Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та S(O)pRi, де p – 0, 1 або 2; та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; та Rf вибраний із групи, що включає водень, C1C4 алкіл, C1-C4 алкоксигрупу, трифторметил та галоген. 7. Сполука за п. 6, де R1 – індол-3-іл, незаміщений або заміщений 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси-, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C 1C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, -NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та S(O)pRi, де p – 0, 1 або 2 та Ri вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений C1-C4 алкілом, C1-C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом. 8. Сполука за п. 1, яка являє собою N-(2-(6-фтор1H-індол-3-іл)етил)-3-(2,2,3,3тетрафторпропокси)бензиламін. 9. Сполука за п. 1, яка являє собою гідрохлорид N(2-(6-фтор-1H-індол-3-іл)етил)-3-(2,2,3,3тетрафторпропокси)бензиламіну. 10. Фармацевтична композиція, яка містить сполуку за п. 1 та фармацевтично прийнятний розріджувач. 11. Спосіб лікування розладу, вибраного із групи, яка включає розлади пізнавальної здатності, розлади пам’яті, психози, шизофренію, розлади, що супроводжуються тривогою, та хворобу Альцгеймера, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за п. 1. 76451 12. Сполука формули II R8 6 R5 N R7 Y R6 , формула (II) де Y вибраний із групи, що включає O, NH та NR9, де R9 вибраний із групи, що включає C1-C4 алкіл та феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; R5 та R6 – водень або разом з атомами, з якими вони сполучені, утворюють бензольне кільце, за умови, що R5 та R6 – водень, коли Y – NR9; R7 вибраний із групи, що включає феніл, незаміщений або заміщений 1-3 групами, незалежно одна від одної вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1C4 алкоксигрупу, галоген, бензилокси-, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1C4 алкіл)амідо-, сульфоніламідо-, ціаногрупу, трифторметил, трифторметокси-, нітрогрупу та феніл, незаміщений або заміщений C1-C4 алкілом, C1C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; нафтил, незаміщений або заміщений однією-двома групами, незалежно одна від одної вибраними із групи, що включає водень, C1C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу, трифторметил та нітрогрупу; і радикал, вибраний з Re Rd Re Q1 Rf та Rd Re Q2 Rf , де Q1 вибраний із групи, що включає -O-, -S- та NRg-, де Rg вибраний із групи, що включає водень та C1-C4 алкіл; і Q2 – -N=; кожний з Rd, Re та Rf незалежно вибраний із групи, що включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрупу та трифторметил, або Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, незаміщене або заміщене 1-4 замісниками, незалежно один від одного вибраними із групи, що включає водень, гідроксигрупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміщений або заміщений C1-C4 алкілом, C1C4 алкоксигрупою, галогеном, ціаногрупою або трифторметилом; фенілокси-, бензилоксигрупу, NHS(O)2Rh, де Rh вибраний із групи, що включає C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; 7 76451 8 та Ri вибраний із групи, що включає C1-C4 алкіл та та C1-C4 алкіл; і Q2 – -N=; де кожний з Rd, Re та Rf феніл, незаміщений або заміщений C1-C4 алкілом, незалежно вибраний із групи, що включає водень, C1-C4 алкоксигрупою, галогеном, ціаногрупою або C1-C4 алкіл, C1-C4 алкоксигрупу, галоген, ціаногрутрифторметилом; та Rf вибраний із групи, що пу та трифторметил, або Rd та Re (або один із Re), включає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, разом із атомами, з якими вони сполучені, утвотрифторметил та галоген; рюють бензольне кільце, незаміщене або заміщеR8 вибраний із групи, що включає водень та C1-C3 не 1-4 замісниками, незалежно один від одного алкіл; та вибраними із групи, що включає водень, гідроксигфармацевтично прийнятні солі цієї сполуки. рупу, C1-C4 алкіл, C1-C4 алкокси-, трифторметокси13. Сполука за п. 12, де складова , 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-C4 алкоксикарбоніл, амідо-, R5 N-(C1-C4 алкіл)амідо-, аміно-, (C1-C4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибраR6 Y на із групи, що включає C1-C4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, незаміприєднана у 4 або 6 положенні. щений або заміщений C1-C4 алкілом, C114. Сполука за п. 13, де Y - NR9. C4 алкоксигрупою, галогеном, ціаногрупою або 15. Сполука за будь-яким із пп. 12-14, де R7 вибтрифторметилом; фенілокси-, бензилоксигрупу, раний із групи, що включає феніл, незаміщений NHS(O)2Rh, де Rh вибраний із групи, що включає або заміщений 1-3 групами, незалежно одна від C1-C4 алкіл та феніл; та -S(O)pRi, де p – 0, 1 або 2; одної вибраними із групи, що включає водень, гідта Ri вибраний із групи, що включає C1-C4 алкіл та роксигрупу, C1-C4 алкіл, C1-C4 алкоксигрупу, галофеніл, незаміщений або заміщений C1-C4 алкілом, ген, бензилокси-, карбоксигрупу, C 1C1-C4 алкоксигрупою, галогеном, ціаногрупою або C4 алкоксикарбоніл, амідо-, N-(C1-C4 алкіл)амідо-, трифторметилом; та Rf вибраний із групи, що сульфоніламідо-, ціаногрупу, трифторметил, тривключає водень, C1-C4 алкіл, C1-C4 алкоксигрупу, фторметокси-, нітрогрупу та феніл, незаміщений трифторметил та галоген. або заміщений C1-C4 алкілом, C1 16. Фармацевтична композиція, яка містить сполуC4 алкоксигрупою, галогеном, ціаногрупою або ку за будь-яким із пп. 12-15 та фармацевтично трифторметилом; та радикал, вибраний з прийнятний розріджувач. Re Rd 17. Спосіб лікування розладів, вибраних із групи, Rf Rd що включає розлади пізнавальної здатності, шиRf та зофренію, розлади, що супроводжуються тривоRe Q1 Re Q2 гою, та хворобу Альцгеймера, який включає вве, дення пацієнту, що потребує такого лікування, де Q1 вибраний із групи, що включає -O-, -S- та ефективної кількості сполуки за п. 12. NR -, де R вибраний із групи, що включає водень g g Цей винахід має відношення до галузі фармацевтичної та органічної хімії і стосується сполук, які є антагоністами рецептора 5-НТ6. Рецептор 5-НТ6 є членом суперсімейства рецепторів серотоніну, сполучених із Г-білком, і, подібно рецепторам 5-НТ4 та 5-НТ7, він позитивно сполучається з аденілатциклазою [1]. Рецептор 5НТ6 пацюків вперше клонували у 1993 році [2,3], а про клонування людського гомолога, з яким згаданий рецептор має 89% спільну ідентичність послідовності, було повідомлено у 1996 році [4]. Локалізацію рецепторів 5-НТ6 у головному мозку пацюків досліджували шляхом кількісного визначення мРНК за допомогою назерн-блотингу та полімеразної ланцюгової реакції із зворотною транскприптазою (RT-PCR), імуногістохімічними та ауторадіографічними засобами [2, 3, 5, 6, 7, 8]. За допомогою цих методів високі рівні згаданого рецептора постійно знаходили у нюхових цибулинах, гіпокампі, смугастому тілі, прилеглому ядрі (nucleus accumbens) та кортикальних ділянках. У периферичних тканинах рецептори 5-НТ6 відсутні або рівень їхньої присутності є дуже незначним [2, 3]. На сьогодні немає відомих високоафінних, селективних агоністів рецептора 5-НТ6. Сам серотонін має лише помірну спорідненість до рецептора 5-НТ6 (Кі=65нМ). Найбільш селективний агоніст, відомий на цей час, N,N-диметил-2-етил-5метокситриптамін, має Кі=81нМ і лише у 3,5 рази більшу селективність відносно рецептора 5НТ2А [9]. Нещодавнє зацікавлення рецептором 5-НТ6 більшою мірою обумовлене спостереженням того, що декілька психотропних агентів є високоафінними антагоністами людського рецептора 5-НТ6 [4, 10]. До цих сполук належить амітриптилін (amitriptyline) (Ki=65нМ) та атипові антипсихотичні засоби клозапін (clozapine) (Кі=9,5нМ), оланзапін (olanzapine) (Кі=10нМ) та кветіапін (quetiapine) (33нМ). Жодна з цих сполук, однак, не є селективною. Першими селективними антагоністами рецептора 5-НТ6, про які було повідомлено, є Ro 046790 та Ro 63-0563. Придатність цих антагоністів обмежується їх помірною спорідненістю (Кі=50нМ та 12нМ, відповідно) та поганими фармакокінетичними характеристиками [11]. Було повідомлено про ряд антагоністів рецептора 5-НТ6, останнім з яких є SB-271,046 [12]. Ця сполука має високу 9 76451 10 афінність (Кі=1,2нМ), селективність (>200-кратна представляє собою модель пізнавальної функції. відносно >55 рецепторів, ферментів та іонних каІнший селективний антагоніст рецептора 5-НТ6, налів) та 80% біодоступність. Для дослідження SB-271046, підсилював поведінкову реакцію (позізв'язування ліганду, міченого радіоактивним ізотохання), що викликалась інгібітором холінестерази пом, та авторадіографічних досліджень був викофізостигміном (physostigmine) [18]. Результати цих ристаний селективний ліганд, мічений радіоактивдосліджень дозволяють висунути припущення про ним ізотопом, [125I]-SB-258,585 [13, 14]. Ці сполуки те, що екранування рецептора 5-НТ6 полегшує є придатними інструментами для передклінічних холінергічну передачу. Під час дослідження мікродосліджень рецептора 5-НТ6. діалізу in vivo. SB-271,046 (10мг/кг, підшкірно) підОсновна причина використання селективних силює вивільнення глутамату у префронтальній антагоністів рецептора 5-НТ6 для лікування порузоні кори головного мозку за посередництвом нершення пізнавальної здатності базується на трьох вового механізму [25]. розумних поясненнях: здатність селективних антаРезультати клінічних досліджень впливу атигоністів рецептора 5-НТ6 модулювати холінергічну пових антипсихотичних засобів клозапіну та оланта глутаматергічну функцію нервових клітин, резапіну на пізнавальну функцію. Обидва атипові зультати клінічних досліджень впливу атипових антипсихотичні засоби, клозапін та оланзапін, є антипсихотичних засобів клозапіну та оланзапіну високоафінними, хоча і неселективними антагонісна пізнавальну здатність, активність селективних тами рецептора 5-НТ6 [4]. З іншого боку, ріспериантагоністів рецептора 5-НТ6 у разі моделювання дон (risperidone) та типовий антипсихотичний засіб пізнавальної здатності на тваринах. галоперидол (haloperidol) не мають значної споріСелективні антагоністи рецептора 5-НТ6 модудненості до рецептора 5-НТ6. Клінічні різниці, що люють холінергічну та глутаматергічну функцію спостерігаються у разі цих наборів лікарських занервових клітин. Холінергічні та глутаматергічні собів, можуть бути віднесені на рахунок екранусистеми нервових клітин відіграють важливу роль вання рецептора 5-НТ6. Гольдберг (Goldberg) та у пізнавальній функції. Відомо, що холінергічні інші повідомляли про відсутність благотворного нейронні шляхи є важливими для формування та впливу клозапіну на пізнавальну здатність під час процесу консолідації пам'яті. Антихолінергічні запроведення випробувань із використанням клозасоби, що діють на центральну нервову систему, піну для лікування невеликої групи (N=15) невиліпорушують пізнавальну функцію у тварин та під ковних хворих на шизофренію [19]. У протилежчас клінічних досліджень, і втрата холінергічних ність до цього, Мельцер (Meltzer) та інші [20] під нейронів є одним із головних симптомів хвороби час проведення досліджень на дещо численнішій Альцгеймера. І, навпаки, відомо, що стимулювангрупі хворих на шизофренію (N=36) спостерігали ня холінергічної функції поліпшує пізнавальну акполіпшення деяких аспектів нейрофізіологічної тивність. Обидва з двох існуючих на цей час схвафункції через шість тижнів та шість місяців після лених засобів для лікування порушення започаткування лікування клозапіном. У невилікопізнавальної здатності при хворобі Альцгеймера, вних хворих на шизофренію, що не піддавались такрин (tacrine) та донепезил (donepezil), є інгібітолікуванню, клозапін був більш ефективним аніж рами ацетилхолінестерази. Відомо також, що глуплацебо щодо поліпшення пізнавальної функції за таматергічна система префронтальної зони кори декількома показниками [21]. Цей ефект спостеріголовного мозку є залученою до пізнавальної фунгали через шість місяців і він стійко зберігався кції [26, 27]. впродовж 12-місячних досліджень. Ефект оланзаБуло показано, що блокування функції рецеппіну, рісперидону та галоперидолу на пізнавальну тора 5-НТ6 викликає прохолінергічні ефекти in vivo. функцію порівнювали під час проведення багатоВведення (до судин головного мозку) пацюкам центрового, подвійного сліпого дослідження на антисмислових олігонуклеотидів, спрямованих на хворих на шизофренію [22]. Група, що одержувала послідовність рецептора 5-НТ6, викликало поведіоланзапін, продемонструвала статистично значункову реакцію (позіхання та потягування), яка блоще поліпшення пізнавальної функції порівняно із кувалась холінергічним антагоністом атропіном групами, що одержували галоперидол або ріспе(atropine) [15]. Селективний антагоніст рецептора ридон. Цей ефект був очевидним після 65-НТ6 Ro 04-6790 викликав поведінкову реакцію тижневого лікування і зберігався впродовж 54(потягування) дозозалежним чином. Ця поведінкотижневого дослідження. Результати досліджень на ва реакція блокувалась антихолінергічними засотваринах дозволяють висунути припущення про бами скополаміном (scopolamine) та атропіном, що те, що ці ефекти можуть опосередковуватись вивідіють на центральну нервову систему, але не мельненням ацетилхоліну у префронтальній зоні тилскополаміном (methylscopolamine), у дозах, які, кори головного мозку [23]. як відомо, є периферично селективними [16]. Було Активність селективних антагоністів рецептора показано також, що Ro 04-6790 блокує поведінкову 5-НТ6 на тваринних моделях пізнавальної функції. реакцію (обертання), що викликається введенням Завдяки нещодавній розробці селективних антагоскополаміну пацюкам з однобічними пошкодженністів рецептора 5-НТ6, Ro-04,6790 та SB-271,046, нями сірої речовини мозку та смугастого тіла (6з'явилось декілька повідомлень щодо активності OH-DA). Цей засіб не блокував поведінкової реакцих сполук у моделях пізнавальної функції. Селекції (обертання), що викликалась введенням Lтивний антагоніст рецептора 5-НТ6 SB-271046 поДОФА (L-3,4-діоксифенілаланін) або амфетаміну ліпшував пізнавальну активність у разі тестування [17]. Ro 04-6790 реверсував викликані скополаміна водному лабіринті Морріса (Morris water maze) ном порушення пізнавальної здатності при прове[24]. Ці результати співпадають із даними про те, денні тестування з розпізнавання об'єкта, яке що постійне введення антисмислових олігонуклео 11 76451 12 тидів, спрямованих на послідовність рецептора 5моноциклічний ароматичний гетероцикл, що має НТ6, до судин головного мозку викликало поліподин гетероатом, вибраний із групи, що включає шення деяких показників пізнавальної активності у азот, кисень та сірку, де згаданий 5-6-членний моразі тестування на водному лабіринті Моріса [16]. ноциклічний ароматичний гетероцикл є факультаНаслідком лікування SB-271,046 також було потивно сконденсованим із бензольним кільцем; ліпшення деяких показників пізнавальної активноR8 вибраний із групи, що включає водень та сті старих пацюків під час проведення поведінкоC1-С3 алкіл; та вого тесту з виробленням інструментального їхні фармацевтично прийнятні солі. рефлексу при зміні просторового положення [24]. Цей винахід надає також нові фармацевтичні Сполуки за цим винаходом є селективними, композиції, що включають: сполуку формули І або високоафінними антагоністами рецептора 5-НТ6 і, II та фармацевтично прийнятний розріджувач. таким чином, забезпечують можливість цінного Оскільки сполуки формули І та формули II є лікування розладів, опосередкованих рецептором антагоністами рецептора 5-НТ6, згадані сполуки 5-НТ6. формули І та формули II є придатними для лікуЦей винахід надає сполуки формули І: вання різноманітних розладів. Так, за іншим варіантом втілення, цей винахід надає способи лікування розладів, пов'язаних із 5-НТ6, що включають: введення пацієнту, який потребує цього, ефективної кількості сполуки формули І або формули II. Тобто цей винахід надає спосіб застосування сполуки формули І або формули II та її фармацевтичде них композицій для лікування розладів, пов'язаних X вибраний із групи, що включає -О-, -NH-, -S-, із 5-НТ6. Конкретніше, цей винахід надає спосіб -SO2-, -СН2-, -CH(F)-, -СН(ОН)- та -С(О)-; лікування розладів, вибраних із групи, що включає R1 вибраний із групи, що включає факультатирозлади пізнавальної здатності, розлад пізнавальвно заміщений феніл, факультативно заміщений ної здатності, пов'язаний із віком, незначне порунафтил, факультативно заміщений 5-6-членний шення пізнавальної здатності, депресивні розлади моноциклічний ароматичний гетероцикл, що має (у тому числі депресію, манію, маніакальноодин гетероатом, вибраний із групи, що включає депресивні психози), психози (зокрема, шизофреазот, кисень та сірку, де згаданий 5-6-членний монію), розлади, що супроводжуються тривогою (у ноциклічний ароматичний гетероцикл є факультатому числі, зокрема, генералізований розлад, що тивно сконденсованим із бензольним кільцем. супроводжується тривогою, розлад, що супровоR2 вибраний із групи, що включає водень та джується панічним страхом та обсесивноC1-С3 алкіл; компульсивний розлад), ідіопатичну хворобу ПарR3 вибраний із групи, що включає водень, кінсона та хворобу Паркінсона, викликану лікарсьфтор та метил; кими засобами, епілепсію, конвульсії, мігрень (у R4 вибраний із групи, що включає водень, аліл, тому числі пульсуючий головний біль), синдром С2-С4 алкіл, фторований С2-С4 алкіл, факультатистримування від прийняття наркотичних речовин вно заміщений феніл, факультативно заміщений (у тому числі таких речовин, як опіати, нікотин, феніл сульфоніл, факультативно заміщений бентютюнові вироби, алкоголь, бензодіазепіни, кокаїн, зил та факультативно заміщений 5-6-членний моседативні засоби, снодійні засоби тощо), розлади ноциклічний ароматичний гетероцикл, що має сну (у тому числі нарколепсію), дефіцит уваодин або два гетероатоми, вибрані із групи, що ги/синдром гіперактивності, розлади поведінки, включає азот, кисень та сірку, за умови, що R4 не розлади здатності до навчання, слабоумство (у є факультативно заміщеним фенілсульфонілом у тому числі хворобу Альцгеймера та слабоумство, разі, коли X - -SO2-, -CH2-, -CH(F)-, -СН(ОН)- або викликане СНІД'ом), хорею Гентингтона, порушенС(О)-; та ня пізнавальної здатності унаслідок реконструктиїхні фармацевтично прийнятні солі. вної артеріальної хірургії та трансплантації, інЦей винахід також надає сполуки формули II: сульт, церебральну ішемію, пошкодження спинного мозку, пошкодження головного мозку, перинатальну гіпоксемію, зупинку серця та гіпоглікемічне пошкодження нервових клітин, слабоумство унаслідок судинних захворювань, поліінфарктне слабоумство, бічний аміотрофічний склероз та розсіяний склероз, що включає: введення пацієнту, який цього потребує, ефективної кількості споде луки формули І або ефективної кількості сполуки Υ вибраний із групи, що включає О, ΝΗ та NR9, формули II. де R9 вибраний із групи, що включає C1-С4 алкіл та На додаток до цього, цей винахід надає також факультативно заміщений феніл; способи одержання сполук формули І та формули R5 та R6 - водень або разом з атомами, з якиII та їхніх проміжних хімічних сполук. ми вони сполучені, утворюють бензольне кільце, Наведені далі терміни, які використовуються у за умови, що R5 та R6 - водень, коли Υ - NR9; цьому описі, мають такі значення: R7 вибраний із групи, що включає факультатиТермін " C1-С3 алкіл" означає нерозгалужений вно заміщений феніл, факультативно заміщений або розгалужений алкільний ланцюг, що має від нафтил, факультативно заміщений 5-6-членний 13 76451 14 одного до трьох атомів вуглецю і включає метил, трифторметилом; та Rf вибраний із групи, що етил, пропіл та ізопропіл. включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, Термін "факультативно заміщений феніл" трифторметил та галоген. Згаданий термін, зокреозначає радикал формули ма, означає фурил, тієніл, піроліл, піридил, бензофурил, бензотієніл, індоліл та хінолініл; кожен з них факультативно заміщений за описом, який було наведено вище. Термін "фторований С2-С4 алкіл" означає нерозгалужений або розгалужений алкільний ланде Ra включає від 1 групи до 3 груп, незалежно цюг, що має від двох до чотирьох атомів вуглецю, вибраних із групи, що включає водень, гідроксигзаміщених одним або декількома атомами фтору. рупу, С1-С4 алкіл, C1-С4 алкоксигрупу, галоген, беЗгаданий термін означає 2-фторетил, 2,2нзилокси-, карбоксигрупу, Q-Q алкоксикарбоніл, дифторетил, 2,2,2-трифторетил, 3-фторпропіл, амідо-, N-(C1-С4 алкіл)амідо-, сульфоніламідо-, 3,3-дифторпропіл, 3,3,3-трифторпропіл, 2,2,3,3,3ціаногрупу, трифторметил, трифторметокси-, нітпентафторпропіл, 2,2,3,3-тетрафторпропіл, 4,4,4рогрупу та феніл, факультативно заміщений C1-С4 трифторбутил, 3,3,4,4,4-пентафторбутил тощо. алкілом, C1-С4 алкоксигрупою, галогеном, ціаногТермін "факультативно заміщений фенілсурупою та трифторметилом. льфоніл" означає радикал формули Термін "факультативно заміщений нафтил" означає радикал формули де Rc включає від 1 групи до 2 груп, незалежно вибраних із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, галоген, ціаногрупу, трифторметил та нітрогрупу. Термін "факультативно заміщений 5-6членний моноциклічний ароматичний гетероцикл, що має один гетероатом, вибраний із групи, що включає азот, кисень та сірку, де згаданий 5-6членний моноциклічний ароматичний гетероцикл є факультативно сконденсованим із бензольним кільцем" означає радикали формули де Q1 вибраний із групи, що включає -О-, -Sта -NRg-, де Rg вибраний із групи, що включає водень та C1-С4 алкіл; і Q2 - -N=, Rd, де кожен Re, та Rf незалежно вибраний із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, галоген, ціаногрупу та трифторметил або Rd та Re (або один із Re), разом із атомами, з якими вони сполучені, утворюють бензольне кільце, яке факультативно заміщується 1-4 замісниками, незалежно вибраними із групи, що включає водень, гідроксигрупу, C1-С4 алкіл, C1-С4 алкокси-, трифторметокси, 2,2,2-трифторетоксигрупу, трифторметил, галоген, карбоксигрупу, C1-С4 алкоксикарбоніл, амідо-, N-(C1-С4 алкіл)амідо-, аміно-, (C1-С4 алкіл)аміно-, ациламіногрупу, де згадана ацильна група вибрана із групи, що включає C1-С4 алкіл та феніл; ціано-, нітро-, сульфоніламідогрупу, феніл, факультативно заміщений C1-С4 алкілом, C1-С4 алкоксигрупою, галогеном, ціаногрупою та трифторметилом; фенілокси-, бензилоксигрупу, NHS(O)2Rh, де Rh вибраний із групи, що включає C1-С4 алкіл та феніл; та -S(O)pRi, де p - 0, 1 або 2 та Ri вибраний із групи, що включає C1-С4 алкіл та феніл, факультативно заміщений C1-С4 алкілом, C1-С4 алкоксигрупою, галогеном, ціаногрупою та де Rj включає від 1 групи до 3 груп, незалежно вибраних із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, галоген, ціаногрупу, трифторметил, нітрогрупу та феніл. Термін "факультативно заміщений феніл" означає радикал формули де Rk включає від 1 групи до 3 груп, незалежно вибраних із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, ціано-, нітрогрупу, трифторметил та галоген. Термін "факультативно заміщений 5-6членний моноциклічний ароматичний гетероцикл, що має один або два гетероатоми, вибрані із групи, що включає азот, кисень та сірку" означає радикали формули де Q3 вибраний із групи, що включає -Ο-,-S- та -NRg'-, де Rg' вибраний із групи, що включає водень та C1-С4 алкіл; та Q4 і Q5 - -CRm, де кожен Rm незалежно вибраний із групи, що включає водень, C1-С4 алкіл, галоген та трифторметил або один чи обидва Q4 та Q5 - -N=; і де один або обидва Q6 - N=, у той час як інші є -CRn; де кожен Rn незалежно вибраний із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, галоген, ціано-, нітрогрупу та трифторметил. Згаданий термін зокрема означає фурил, тієніл, тіазоліл, піразоліл, імідазоліл, триазоліл, оксазоліл, тіазоліл, ізоксазоліл, тіоізоксазоліл, піридил, піримідил, піридизаніл та піразидиніл; кожен із них факультативно заміщується за описом, який було наведено вище. Термін "С1-С4 алкіл" означає нерозгалужений або розгалужений алкільний ланцюг, що має від 15 76451 16 одного до чотирьох атомів вуглецю і включає меПеревага віддається сполукам, де X вибраний тил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізоіз групи, що включає -О-, -NH- та -S-, причому бібутил та трет-бутил. льша перевага віддається сполукам, де X - -О-. Термін "С2-С4 алкіл" означає нерозгалужений Перевага віддається сполукам, де R1 - факуабо розгалужений алкільний ланцюг, що має від льтативно заміщений феніл або факультативно двох до чотирьох атомів вуглецю і включає етил, заміщений 5-6-членний моноциклічний ароматичпропіл, ізо-пропіл, бутил, втор-бутил, ізобутил та ний гетероцикл, що має один гетероатом, вибратрет-бутил. ний із групи, що включає азот, кисень та сірку, де Термін "С1-С4 алкоксигрупа" означає нерозгазгаданий 5-6-членний моноциклічний ароматичний лужений або розгалужений алкільний ланцюг, що гетероцикл є факультативно сконденсованим із має від одного до чотирьох атомів вуглецю, сполубензольним кільцем. чених з атомом кисню, і включає метокси-, етокси-, У разі, коли R1 є факультативно заміщеним пропокси-, ізо-пропокси-, бутокси-, ізо-бутокси-, фенілом, замісниками, яким віддається перевага, втор-бутокси- та трет-бутоксигрупу. є від 1 групи до 3 груп, незалежно вибраних із груТермін "галоген" означає атом хлору, фтору, пи, що включає водень, C1-С4 алкіл, галоген, бенброму або йоду. зилокси-, карбокси-, C1-С4 алкоксикарбонільну груТермін "фармацевтично прийнятна сіль кислопу, амідо-, N-(C1-С4 алкіл)амідо-, сульфоніламідо-, ти" означає сіль кислоти. ціаногрупу, трифторметил, трифторметокси-, нітСполуки формули І або формули II та проміжні рогрупу та феніл, факультативно заміщений C1-С4 хімічні сполуки, опис яких наведено, утворюють алкілом, C1-С4 алкоксигрупою, галогеном, ціаногфармацевтично прийнятні солі кислот з найрізнорупою та трифторметилом. манітнішими органічними та неорганічними кислоУ разі, коли R1 є факультативно заміщеним тами і включають фізіологічно прийнятні солі, які фенілом, замісниками, яким віддається більша часто застосовуються у фармацевтичній хімії. Такі перевага, є від 1 групи до 3 груп, незалежно вибсолі також становлять частину цього винаходу. раних із групи, що включає водень, C1-С4 алкіл, Фармацевтично прийнятні солі одержують за догалоген, ціаногрупу та трифторметил. помогою фармацевтично прийнятних кислот, що є Перевага віддається сполукам, де R3 - водень добре відомим у цій галузі. До таких солей налеабо фтор. жать фармацевтично прийнятні солі, перелік яких У разі сполуки, де R1 - факультативно заміщенаведено у [Journal of Pharmaceutical Science, 66, ний 5-6-членний моноциклічний ароматичний ге2-19 (1977)], що є відомими досвідченому фахівтероцикл, що має один гетероатом, вибраний із цю. До типових неорганічних кислот, що застосогрупи, що включає азот, кисень та сірку, де згадавуються для одержання таких солей, належать ний 5-6-членний моноциклічний ароматичний гехлористоводнева, бромистоводнева, йодистоводтероцикл є факультативно сконденсованим із беннева, азотна, сірчана, фосфорна, гіпофосфорна, зольним кільцем, перевага віддається сполукам, метафосфорна, пірофосфорна кислоти тощо. Защо є сконденсованими з бензольним кільцем, де стосовуватись можуть також солі, одержані з оргаперевага віддається індолілу і ще більша перевага нічних кислот, наприклад, аліфатичних моно- та віддається індол-3-ілу. дикарбонових кислот, фенілзаміщених алканових У разі, коли R1 - індол-3-іл, групи, яким віддакислот, гідроксіалканової та гідроксіалкандіонової ється перевага, зображають як радикал, наведекислот, ароматичних кислот, аліфатичних та ароний нижче: матичних сульфокислот. До таких фармацевтично прийнятних солей, таким чином, належать хлорид, бромід, йодид, нітрат, ацетат, фенілацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динітробензоат, гідроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, ізобутират, фенілбутират, -гідроксибутират, бутин-1,4-дикарбокосилат, гексин-1,4-дикарбоксилат, капрат, каприлат, цинамат, цитрат, форміат, фумарат, гліколят, гептаноат, гіпурат, лактат, малат, a) Ro вибраний із групи, що включає водень та малеат, гідроксималеат, малонат, манделат, меС1-С4 алкіл, де більша перевага віддається водню; зилат, нікотинат, ізонікотинат, оксалат, фталат, b) Rp вибраний із групи, що включає водень та тетрафталат, пропіолат, пропіонат, фенілпропіоC1-С4 алкіл, де більша перевага віддається водню; нат, саліцилат, себацат, сукцинат, суберат, бензоc) Rq вибраний із групи, що включає водень, лсульфонат, р-бромбензолсульфонат, хлорбензоC1-С4 алкіл, C1-С4 алкоксигрупу та галоген, де білсульфонат, етилсульфонат, 2льша перевага віддається водню; гідроксіетилсульфонат, метилсульфонат, нафтаd) Rq' вибраний із групи, що включає водень, лін-1-сульфонат, нафталін-2-сульфонат, нафтаC1-С4 алкіл, C1-С4 алкокси-, трифторметокси-, лін-1,5-сульфонат, р-толуолсульфонат, ксилолсу2,2,2-трифторетоксигрупу, трифторметил, галоген льфонат, тартрат і тощо. та -S(O)pRi, де p - 2 та Rj - феніл, факультативно Як і з будь-якою групою фармацевтично актизаміщений С1-С4 алкілом, C1-С4 алкоксигрупою, вних сполук, деяким групам віддається перевага трифторметилом, де більша перевага віддається за їхнім кінцевим застосуванням. Варіанти втіленгалогену; ня цього винаходу, яким віддається перевага, наe) Rq" вибраний із групи, що включає водень, водяться для сполук формули І далі: C -С алкіл, C -С алкоксигрупу, галоген, нітро-, 1 4 1 4 17 76451 18 ціаногрупу, трифторметил та -S(O)pRi, де p - 2 та попередньо наведеному визначенню, усі вихідні Ri - феніл, факультативно заміщений C1-С4 алкіматеріали та реактиви є добре відомими і належлом, де більша перевага віддається галогену; та ним чином оціненими у цій галузі та легкодоступf) Rq''' вибраний із групи, що включає водень, ними або такими, що одержують за способами, С1-С4 алкіл, C1-С4 алкоксигрупу, галоген, трифторнаведеними у цьому описі. Зрозуміло, що на Схеметил, ціано- та нітрогрупу, де перевага віддаєтьмах, наведених нижче, у разі потреби можуть вися водню та галогену. користовуватись групи захисту для одержання Перевага віддається сполукам, де R4 вибрачастини сполук формули І або формули II. Вибір, ний із групи, що включає С2-С4 алкіл, фторований застосування та видалення відповідних груп захиС2-С4 алкіл та факультативно заміщений феніл. сту є добре відомим та належним чином оціненим У разі, коли R4 - С2-С4 алкіл, групами, яким у цій галузі [Protecting Groups in Organic Synthesis. віддається особлива перевага, є пропіл, ізопропіл Theodora Greene (Wiley-Interscience)]. та бутил. У разі, коли R4 - фторований С2-С4 алкіл, групами, яким віддається перевага, є 2,2дифторетил, 2,2,2-трифторетил, 3-фторпропіл, 3,3-дифторпропіл, 3,3,3-трифторпропіл, 2,2,3,3,3пентафторпропіл та 2,2,3,3-тетрафторпропіл. У разі, коли R4 є факультативно заміщеним фенілом, групи, яким віддається перевага, включають від 1 групи до 3 груп, незалежно вибраних із групи, що включає водень, C1-С4 алкіл, C1-С4 алкоксигрупу, галоген, ціаногрупу та трифторметил. Варіанти втілення цього винаходу, яким віддається перевага, наводяться для сполук формули II далі: Перевага віддається сполукам, де R7 - факуСхема А зображає альтернативні способи льтативно заміщений феніл або факультативно одержання сполук формули І шляхом гідроамінузаміщений 5-6-членний моноциклічний ароматичвання. ний гетероцикл, що має один гетероатом, вибраЗа одним з альтернативних варіантів Схеми А, ний із групи, що включає азот, кисень та сірку, де стадія а, придатна сполука формули (1) контактує згаданий 5-6-членний моноциклічний ароматичний з придатною сполукою формули (2) у реакції гідгетероцикл є факультативно сконденсованим із роамінування з одержанням сполуки формули І. бензольним кільцем. Придатною сполукою формули (1) є сполука, R1 та У разі, коли R7 є факультативно заміщеним R2 якої є бажаними у кінцевому продукті формули І фенілом, замісниками, яким віддається перевага, або така сполука, що забезпечує одержання груп, є від 1 групи до 3 груп, незалежно вибраних із грубажаних у кінцевому продукті формули І. Придатпи, що включає водень, С1-С4 алкіл, C1-С4 алкоксиною сполукою формули (2) є сполука, X, R3 та R4 групу, галоген, ціано-, трифторметоксигрупу та якої є бажаними у кінцевому продукті формули І трифторметил. або така сполука, що забезпечує одержання груп, У разі сполук, де R7 - факультативно заміщебажаних у кінцевому продукті формули І. ний 5-6-членний моноциклічний ароматичний геЗа іншим альтернативним варіантом Схеми А, тероцикл, що має один гетероатом, вибраний із стадія а, придатна сполука формули (3) контактує групи, що включає азот, кисень та сірку, де згадаз придатною сполукою формули (4) у реакції гідний 5-6-членний моноциклічний ароматичний героамінування з одержанням сполуки формули І. тероцикл є факультативно сконденсованим із бенПридатною сполукою формули (3) є сполука, R1 та зольним кільцем, перевага віддається сполукам, R2 якої є бажаними у кінцевому продукті формули І що є сконденсованими з бензольним кільцем, де або така сполука, що забезпечує одержання груп, перевага віддається індолілу і ще більша перевага бажаних у кінцевому продукті формули І. Придатвіддається індол-3-ілу, де більша перевага відданою сполукою формули (4) є сполука, X, R3 та R4 ється індол-3-ілу, наведеному вище для формуякої є бажаними у кінцевому продукті формули І ли І. або така сполука, що забезпечує одержання груп, Сполуки формули II, яким віддається перевабажаних у кінцевому продукті формули І. га, що мають точки приєднання, зображені нижче: Гідроамінування, представлене на Схемі А, стадія а, може здійснюватись за різноманітних умов, наприклад, шляхом гідрогенізації із застосуванням придатного каталізатора або придатного відновника. Наприклад, придатний амін формули (1) контактує з придатним альдегідом формули (2) (або, за альтернативним варіантом, придатний амін формули (4) та придатний альдегід формули (3)) Незважаючи на те, що представлені лише та придатним відновником з одержанням сполуки сполуки формули І, сполуки формули І та формуформули І. Згадану реакцію здійснюють у придатли II одержують за описом, наведеним на Схемі А ному розчиннику, наприклад, метанолі, етанолі, та Схемі В нижче. На схемах, що наведені нижче, тетрагідрофурані або сумішах метанолу або етаусі замісники, якщо не вказано інше, відповідають 19 76451 20 нолу та тетрагідрофурану, дихлорметану та 1,2Придатною сполукою формули (7) є сполука, де А дихлоретану. Згадану реакцію можна здійснювати - активуюча група, опис якої наведено вище, та R1 у присутності сушильного агента, наприклад, суякої є бажаним укінцевому продукті формули І. льфату натрію, сульфату міді або молекулярних Придатною сполукою формули (4) є сполука, опис сит. Згадану реакцію здійснюють у присутності від якої наведено на Схемі А. Придатні сполуки форприблизно 1 до 20 мольних еквівалентів придатномули (4) та (7) є, взагалі, доступними з комерційго відновника, наприклад, борогідриду натрію, ціаних джерел і їх можна також одержати за спосоноборогідриду натрію та триацетоксиборогідриду бами, опис яких наведено тут або за способами, натрію. Перед доданням придатного відновника, відомими у цій галузі. корисним може видатись одержання шифових Реакція одержання аміду, зображена на Схемі основ. У разі застосування ціаноборогідриду наВ, стадія а, легко здійснюється у численні способи, трію, корисним може видатись контролювання та легко доступні для досвідченого фахівця, у тому регулювання рН під час проходження реакції, що є числі у способи, до яких традиційно вдаються для відомим у цій галузі. Згадану реакцію, взагалі, синтезування пептидів. Такі способи можна здійсздійснюють при температурах від 0°С до темперанювати з кислотою, галогенангідридом, активоватури перегонки розчинника. Взагалі, реакції потреними складними ефірами, активованими амідами бують від 1год до 72год. Продукт може виділятись та ангідридами. та очищатись способами, добре відомими у цій Для полегшення одержання аміду, наприклад, галузі, наприклад, фільтруванням, екстрагуванможуть застосовуватись добре відомі реактиви ням, випарюванням, розтиранням у порошок, хросполучення, наприклад, карбодііміди з або без матографуванням та перекристалізацією. застосування добре відомих домішок, наприклад, Схема А, факультативна стадія b (не показаN-гідроксисукциніміду, 1-гідроксибензотриазолу на), сіль кислоти і сполуки формули І одержують із тощо. У таких реакціях сполучення застосовуютьзастосуванням фармацевтично прийнятної кислося, як правило, приблизно 1:1,5 мольні співвідноти. Одержання солей кислот є добре відомим та шення кислоти, аміну та реактиву сполучення і належними чином оціненим у цій галузі. вони, загальноприйнятно, здійснюються у інертному апротонному розчиннику, наприклад, піридині, диметилформаміді, дихлорметані, хлороформі, 1,2-дихлоретані, ацетонітрилі, тетрагідрофурані тощо. У таких реакціях сполучення корисним може бути застосування придатної основи, наприклад, триетиламіну або Ν,Ν-діізопропілетиламіну. Згадану реакцію за варіантом, якому віддається перевага, здійснюють при температурі від приблизно 0°С до приблизно 60°С до завершення реакції, що, як правило, відбувається у межах від 1год до приблизно 48год. Після завершення реакції продукт може виділятись та очищатись способами, добре відомими у цій галузі, наприклад, фільтруванням, екстрагуванням, випарюванням, розтиранням у порошок, хроматографуванням та перекристалізацією. За альтернативним варіантом, наприклад, у цій реакції може застосовуватись галогенангідрид. Може бути корисним застосування придатної основи для видалення кислоти, що утворюється під Схема В зображає альтернативні способи час реакції; придатні основи включають, наприодержання сполук формули І шляхом одержання клад, триетиламін, Ν,Ν-діізопропілетиламін, Nта відновлення аміду. метилморфолін, піридин тощо. Як правило, застоЗа одним з альтернативних варіантів Схеми В, совують приблизно 1:1,5 мольні співвідношення стадія а, придатна сполука формули (1) контактує галогенангідриду та аміну. Згадана реакція може із придатною сполукою формули (5) у реакції одездійснюватись у різноманітних інертних апротонржання аміду з одержанням сполуки формули (6). них розчинниках, наприклад, у піридині, дихлормеПридатною сполукою формули (1) є сполука, опис тані, хлороформі, 1,2-дихлоретані, тетрагідрофуякої наведено на Схемі А. Придатною сполукою рані тощо. Реакцію за варіантом, якому віддається формули (5) є сполука, де А - активуюча група, що перевага, здійснюють при температурі від приблиприймає форму галогенангідриду, активованого зно 0°С до приблизно 60°С до її завершення, яке, складного ефіру, активованого аміду або ангідрияк правило, відбувається у межах від 1год до приду, та X, R3 та R4 якої є бажаними у кінцевому близно 12год. Після завершення реакції продукт продукті формули І або така сполука, що забезпеможе виділятись та очищатись способами, добре чує одержання груп, бажаних у кінцевому продукті відомими у цій галузі, наприклад, фільтруванням, формули І. екстрагуванням, випарюванням, розтиранням у За іншим альтернативним варіантом Схеми В, порошок, хроматографуванням та перекристалізастадія а, придатна сполука формули (7) контактує цією. із придатною сполукою формули (4) у реакції одеЗа альтернативним варіантом, наприклад, гаржання аміду з одержанням сполуки формули (8). логенангідрид може застосовуватись у реакції 21 76451 22 Шоттена-Баумана. За умов проведення такої реаЗа схемою В (факультативна стадія, не покакції, як правило, застосовують 1-10 мольних еквізана), сіль кислоти і сполуки формули І одержують валентів аміну. У таких реакціях сполучення, звиіз застосуванням фармацевтично прийнятної кисчайно, застосовують придатну основу для лоти. Одержання солей кислот є добре відомим та видалення кислоти, що утворюється під час реакналежним шляхом оціненим у цій галузі. ції, наприклад, гідроксид натрію, гідроксид калію, За Схемами А та В (факультативна стадія, не карбонат натрію, карбонат калію, бікарбонат напоказана), що буде належним чином оцінене дострію, бікарбонат калію тощо. Згадана реакція може відченим фахівцем, сполука формули І, де R2 здійснюватись у різноманітних сумішах розчинниводень, може алкілуватись з одержанням сполуки, ків, наприклад, дихлорметану, хлороформу, етиде R2 не є воднем. Способи алкілування таких лацетату, тетрагідрофурану тощо; і води. Реакцію вторинних амінів є добре відомими у цій галузі і за варіантом, якому віддається перевага, здійсобговорюються на Схемі С, стадія с, нижче. нюють при температурі від приблизно 0°С до приЗа Схемами А та В, що буде належним чином близно 80°С до її завершення, яке, як правило, оцінене досвідченим фахівцем, за способами, відбувається у межах від 1год до приблизно 6год. опис яких наведено на Схемах А та В одержують Після завершення реакції продукт може виділятакож сполуки формули II із застосуванням сполук тись та очищатись способами, добре відомими у формул (9) та (10), нижче: цій галузі, наприклад, фільтруванням, екстрагуванням, випарюванням, розтиранням у порошок, хроматографуванням та перекристалізацією. За альтернативним варіантом, наприклад, у цій реакції може застосовуватись ангідрид (симетричний або змішаний). Такі ангідриди одержують Придатною сполукою формули (9) є сполука, численними способами, відомими у цій галузі. Як Y, R5 та R6 якої є бажаними у кінцевому продукті правило, застосовують приблизно 1:1,5 мольні формули II, і придатною сполукою формули (10) є співвідношення ангідриду та аміну. Може бути косполука, у якій А - активуюча група, як описано рисним застосування придатної основи для видавище, та Y, R5 та R6 якої є бажаними у кінцевому лення кислоти, що утворюється під час реакції. продукті формули II. Придатні основи включають, наприклад, триетиВихідний матеріал для Схем А та В одержують ламін, Ν,Ν-діізопропілетиламін, N-метилморфолін, за Схемами, наведеними нижче. На Схемах, навепіридин, карбонат натрію, карбонат калію, бікардених нижче, усі замісники, якщо не обумовлене бонат натрію тощо. Згадана реакція може здійссупротивне, відповідають раніше наведеному винюватись у різноманітних розчинниках. Реакцію за значенню і вихідний матеріал та усі реактиви є варіантом, якому віддається перевага, здійснюють добре відомими та належним чином оціненими у при температурі від приблизно 0°С до приблизно цій галузі. На Схемі С представлені способи одер60°С до її завершення, яке, як правило, відбуважання сполук формули (1). ється у межах від 1год до приблизно 12год. Після завершення реакції продукт може виділятись та очищатись способами, добре відомими у цій галузі, наприклад, фільтруванням, екстрагуванням, випарюванням, розтиранням у порошок, хроматографуванням та перекристалізацією. На Схемі В, стадії b, представлено відновлення сполуки формули (6) або формули (8) з одержанням сполуки формули І. Наприклад, сполука формули (6) або формули (8) контактує з придатним відновником з одержанням сполуки формули І. Придатними відновниками є відновники, здатні до відновлення аміду до аміну, і до їх числа належать боранові реактиви, наприклад, комплекс борану-диметилсульфіду, реакНа Схемі С, стадія а, зображена реакція притиви перенесення гідриду, наприклад, гідрид датного альдегіду формули (24) та нітрометану з алюмінію та алюмогідрид літію тощо. Згадана реаодержанням сполуки формули (25). Придатним кція здійснюється у розчиннику, наприклад, тетраальдегідом формули (24) є альдегід, R1 якого є гідрофурані або діетиловому ефірі, із застосуванбажаним у кінцевому продукті формули І. Реакція ням, як правило, від 1 еквіваленту до 10 аніону нітрометану з альдегідами з одержанням еквівалентів відновника. Згадану реакцію, як пранітроолефінів є добре відомою та належним чином вило, здійснюють при температурі від приблизно оціненою у цій галузі. [Modern Synthetic Reactions, 0°С до температури перегонки вибраного розчинH.O. House (2nd ed. The Benjamin/Cummings ника, і її тривалість становить, як правило, від 1год Publishing Company 1972]. до приблизно 48год. Продукт може виділятись та Наприклад, придатний альдегід формули (24) очищатись способами, добре відомими у цій галуконденсують із нітрометаном з одержанням сполузі, наприклад, швидким охолодженням, фільтруки формули (25). Згадану реакцію, як правило, ванням, екстрагуванням, випарюванням, розтиздійснюють у присутності надлишку нітрометану. ранням у порошок, хроматографуванням та Реакцію здійснюють у придатному розчиннику, перекристалізацією. наприклад, тетрагідрофурані, нітрометані та диме 23 76451 24 тилсульфоксиді. Реакцію здійснюють із застосусполуки формули (25) може відновлюватись за ванням від приблизно 1,1 до приблизно 3 мольних допомогою таких реактивів, як борогідрид натрію. еквівалентів придатної основи, наприклад, Згадану реакцію здійснюють, як правило, із застобіс(триметилсиліл)аміду натрію, трет-бутоксиду суванням надлишку борогідриду у розчиннику, калію, гідриду натрію, ацетату натрію, триетиламінаприклад, метанолі, етанолі, ізопропанолі, воді ну, Ν,Ν-діізопропілетиламіну, солей амонію, натощо. Проміжна хімічна сполука, 2-нітроетил, може приклад, ацетату амонію. Реакцію здійснюють при виділятись та очищатись способами, добре відотемпературах від приблизно -20°С до температури мими у цій галузі, наприклад, швидким охолоперегонки вибраного розчинника, і її тривалість дженням, фільтруванням, екстрагуванням, випастановить, як правило, від 6год до 48год. Продукт рюванням, розтиранням у порошок, реакції сполучення може виділятись та очищатись хроматографуванням та перекристалізацією. Пісспособами, добре відомими у цій галузі, наприля цього проміжна хімічна сполука, 2-нітроетил, клад, екстрагуванням, випарюванням, хроматогможе відновлюватись за допомогою різноманітних рафуванням та перекристалізацією. способів, наприклад, шляхом гідрогенізації або із На Схемі С, стадія b, зображено відновлення застосуванням реактивів перенесення гідриду, як сполуки формули (25) з одержанням сполуки фообговорювалось вище. Крім того, проміжна хімічна рмули (1), де R2 - водень. сполука, 2-нітроетил, може відновлюватись за доНаприклад, придатна сполука формули (25) гіпомогою металів, наприклад, цинку, з одержанням дрогенізується над відповідним каталізатором, необхідного аміну формули (1), де R2 - водень. На Схемі С, стадія с, представлено факультанаприклад, нікелем Ренея або паладієвим катативне алкілування сполуки формули (1), де R2 лізатором. У разі застосування нікелю Ренея, згаводень, з одержанням сполуки формули (1), де R2 дану реакцію здійснюють у придатному розчиннине є воднем. ку, наприклад, етанолі, метанолі, воді та їхніх Наприклад, сполука формули (1), де R2 - восумішах. Корисним може бути здійснення гідрогедень, контактує із придатним алкілувальним агеннізації за кислих умов, наприклад, із застосувантом. Придатним алкілувальним агентом є агент, ням хлористоводневої або сірчаної кислоти. У разі що переносить групу R2 до кінцевого продукту фозастосування паладієвого каталізатора, перевага рмули І. До придатних алкілувальних агентів навіддається паладію на деревному вугіллі і реакцію лежать C1-С3 алкілгалогеніди. Згадану реакцію здійснюють у придатному розчиннику, наприклад, здійснюють у придатному розчиннику, наприклад, етанолі, метанолі, тетрагідрофурані, воді та їхніх діоксані, тетрагідрофурані, сумішах тетрагідрофусумішах. Вигідним може бути здійснення гідрогенірану/води або ацетонітрилу. Реакцію здійснюють у зації за кислих умов, наприклад, із застосуванням присутності 1,0-6,0 мольних еквівалентів придатхлористоводневої, трифтороцтової або сірчаної ної основи, наприклад, карбонату натрію, бікарбокислоти. Реакцію, як правило, здійснюють при тенату натрію, карбонату калію, бікарбонату калію, мпературах від температури навколишнього серетриетиламіну або Ν,Ν-діізопропілетиламіну. Реакдовища до 70°С. Реакцію здійснюють із воднем під цію, як правило, здійснюють при температурах від тиском від 15фунт/дюйм2 (103кПа) до -78°С до температури перегонки розчинника. Вза120фунт/дюйм2 (827кПа) у апараті, призначеному галі, тривалість реакцій становить від 1год до для здійснення реакцій під тиском, наприклад, у 72год. Продукт може виділятись та очищатись гідрогенізаційній установці Парра . Продукт може способами, добре відомими у цій галузі, напривиділятись шляхом ретельного видалення каталіклад, екстрагуванням, випарюванням, розтиранзатора фільтрацією або випарюванням. Продукт ням у порошок, хроматографуванням та перекрисможе очищатись екстрагуванням, випарюванням, талізацією. розтиранням у порошок, хроматографуванням та За альтернативним варіантом, наприклад, перекристалізацією. сполука формули (1), де R2 - водень, піддається За альтернативним варіантом, наприклад, гідроамінуванню з альдегідом або кетоном, з одепридатна сполука формули (25) контактує із приржанням сполуки формули (1), де R2 не є воднем. датним відновником. До придатних відновників До придатних альдегідів належить формальдегід, належать реактиви перенесення гідриду, наприацетальдегід, пропіональдегід та ацетон. Реакцію клад, гідрид алюмінію та алюмогідрид літію тощо. здійснюють за описом, наведеним на Схемі А, Згадана реакція здійснюється у розчиннику, настадія а. приклад, тетрагідрофурані або діетиловому ефірі, За іншим альтернативним варіантом, наприіз застосуванням, як правило, від 1 еквіваленту до клад, сполука формули (1), де R2 - водень, оброб10 еквівалентів відновника. Згадану реакцію, як ляється з одержанням аміду або карбамату з поправило, здійснюють при температурі від приблиздальшим відновленням з одержанням сполуки но 0°С до температури перегонки вибраного розформули (1), де R2 не є воднем. До придатних чинника, і її тривалість становить, як правило, від альдегідів належить формальдегід, ацетальдегід, 1год до приблизно 48год. Продукт може виділяпропіональдегід та ацетон. Реакцію здійснюють за тись та очищатись способами, добре відомими у описом, наведеним на Схемі А, стадія а. цій галузі, наприклад, швидким охолодженням, На Схемі С, стадії d та e, зображено альтернафільтруванням, екстрагуванням, випарюванням, тивний варіант підходу до одержання сполук форрозтиранням у порошок, хроматографуванням та мули (1) шляхом одержання аміду із застосуванперекристалізацією. ням придатної сполуки формули (7) та придатного На додаток до цього, придатна сполука фораміну формули (26) з одержанням аміду формули мули (25) може відновлюватись двома стадіями до (27) із подальшим відновленням з одержанням сполуки формули (1). Наприклад, вінільна група 25 76451 26 сполуки формули (1). Придатною сполукою фортиловому ефірі, із застосуванням, як правило, від мули (7) є сполука, опис якої наведено на Схемі В. 1 до 12 мольних еквівалентів відновника. Згадану Придатним аміном формули (26) є амін, що забезреакцію, як правило, здійснюють при температурі печує кінцеву сполуки формули І необхідним R2. від приблизно 0°С до температури перегонки вибДосвідченому фахівцю буде зрозуміло, що багато раного розчинника, і її тривалість становить, як амідів формули (27) є комерційно доступними та правило, від 12год до приблизно 48год. Продукт доступними у цій галузі. може виділятись та очищатись способами, добре Одержання та відновлення аміду на Схемі С відомими у цій галузі, наприклад, швидким охолоздійснюється за описом, наведеним на Схемі В. дженням, фільтруванням, екстрагуванням, випаНа Схемі D зображені способи одержання рюванням, розтиранням у порошок, хроматограсполук формули (1), де R1 являє собою факультафуванням та перекристалізацією. тивно заміщений індол-3-іл. На Схемі D, стадія с, придатний індол формули (28) формілується з одержанням сполуки формули (30). Придатний індол формули (28) відповідає опису, наведеному на стадії а, вище. Наприклад, придатний індол формули (28) реагує із придатним реактивом перенесення формілу, наприклад, реактивом Вільсмайєра, що одержали з диметилформаміду. Взагалі, застосовують приблизно 1 мольний еквівалент реактиву перенесення формілу. Згадана реакція здійснюється у придатному розчиннику, наприклад, бензолі, диметилформаміді, тетрагідрофурані або діетиловому ефірі. Реакцію здійснюють при температурі від приблизно -70°С до приблизно 20°С, і її тривалість становить від 1год до 6год. Продукт реакції може виділятись та очищатись способами, добре відомими у цій галузі. До цих способів належить екстрагування, випарювання, хроматографування та На Схемі D, стадія а, зображена двостадійна перекристалізація. реакція придатного індолу формули (28) спочатку На Схемі D, стадія d, придатний індол формуз оксалілхлоридом, потім із придатним аміном фоли (28) контактує з (CH3)2N-CH=CH-NO2 з одеррмули (26), R2NH2, з одержанням сполуки формужанням сполуки формули (30). Придатний індол ли (29). Придатним індолом формули (28) є індол, формули (28) відповідає опису, наведеному на де Z' зображає факультативні замісники у полостадії а, вище. женнях 2- та 4-7 індолу, що є бажаним для кінцеНаприклад, придатний індол формули (28) ревого продукту формули І. Придатний амін формуагує з 1-диметиламіно-2-нітроетиленом. Взагалі, ли (26) відповідає опису на Схемі С вище. застосовують приблизно 1 еквімолярні кількості Наприклад, придатний індол формули (28) кореактивів. Згадана реакція здійснюється у придатнтактує із приблизно 1-2 мольними еквівалентами ному розчиннику, наприклад, трифтороцтовій кисоксалілхлориду з одержанням проміжної хімічної лоті або дихлорметані, який включає приблизно 2сполуки, хлорангідриду кетокислоти. Згадану реа15 еквівалентів трифтороцтової кислоти. Реакцію кцію здійснюють у придатному розчиннику, наприздійснюють при температурі від приблизно -70°С клад, діетиловому ефірі або тетрагідрофурані. до приблизно 20°С, і її тривалість, як правило, Реакцію, як правило, здійснюють при температустановить від 1год до 24год. Продукт реакції може рах від 0°С до 40°С, і її тривалість становить, взавиділятись та очищатись способами, добре відогалі, від 6год до 48год. Проміжна хімічна сполука, мими у цій галузі. До цих способів належить екстхлорангідрид кетокислоти, може виділятись та рагування, випарювання, хроматографування та очищатись способами, добре відомими у цій галуперекристалізація. зі, наприклад, екстрагуванням, випарюванням, На Схемі D, стадії e та f, зображена реакція хроматографуванням та перекристалізацією. Взаальдегіду формули (30) з одержанням нітроолефігалі, проміжна хімічна сполука, хлорангідрид кетону формули (31) та відновлення нітроолефіну з кислоти, використовується безпосередньо після одержанням сполуки формули (1), де R1 є факульвиділення. Проміжна хімічна сполука, хлорангідтативно заміщеним індол-3-ілом. Ці стадії можуть рид кетокислоти, контактує з придатним аміном, здійснюватись за способами, опис яких наведено R2NH2, як визначалось вище за способами, опис на Схемі С. яких було наведено вище. Як буде належним чином оцінене досвідченим На Схемі D, стадія b, зображено відновлення фахівцем, на стадіях, що не показані, азот індолу сполуки формули (29) з одержанням сполуки фосполуки формули (1) може заміщуватись, за бармули (1), де R1 є факультативно заміщеним інжанням, із застосуванням придатних груп захисту дол-3-ілом. аміну з одержанням сполук, де R1 являє собою Наприклад, сполука формули (29) відновлюоднозаміщений індол-3-іл. Як також буде належється із застосуванням придатного відновника, ним чином оцінене досвідченим фахівцем, на станаприклад, алюмогідриду літію з одержанням сподіях, опис яких наведено на Схемі С, групи R2, які луки формули (1), де R1 є факультативно заміщене є воднем, можуть вводитись різними спосоним індол-3-ілом. Згадана реакція здійснюється у бами. розчиннику, наприклад, тетрагідрофурані або діе 27 76451 28 Схема Ε зображає способи одержання сполук метилацетаміді, тетрагідрофурані, піридині та диформули (2), де X - -О-або -S-. метилсульфоксиді. Реакцію здійснюють у присутності приблизно 1-3 мольних еквівалентів придатної основи, наприклад, гідриду калію, гідроксиду натрію, гідриду натрію, карбонату натрію, карбонату калію, карбонату цезію, Ν,Νдіізопропілетиламіну, триетиламіну тощо. Реакцію здійснюють при температурі від приблизно -30°С до приблизно 100°С, і її тривалість, як правило, становить від 6год до 48год. Продукт реакції може виділятись та очищатись способами, добре відомими у цій галузі. До цих способів належить екстрагування, випарювання, хроматографування та перекристалізація. Звичайно, у разі застосування N-оксиду галопіридину, N-оксид видаляють шляхом відновлення з одержанням R4, який є бажаним у кінцевому продукті формули І. Такі відновлення легко здійснюються досвідченим фахівцем і включають каталітичне відновлення над паладієвим каталізатором із застосуванням водню або форміату амонію у придатному розчиннику, наприклад, метанолі, На Схемі Е, стадія а, зображено одержання етанолі, воді та їхніх сумішах. ацеталю придатної сполуки формули (11) з одерЗа альтернативним варіантом, наприклад, у жанням сполуки формули (12). Придатною сполуразі, коли придатним реактивом перенесення грукою формули (11) є сполука, X та R3 якої є бажапи R4 є алканол, сполучення може здійснюватись ними у кінцевій сполуці формули І. Такі реакції за допомогою реакції Міцунобу, яка є добре відоодержання ацеталю легко здійснюють за способамою у цій галузі техніки. Згадану реакцію здійснюми, добре відомими у цій галузі. [Protecting Groups ють у придатному розчиннику, наприклад, тетрагіin Organic Synthesis. Theodora Greene (Wileyдрофурані та діетиловому ефірі, із застосуванням Interscience)]. фосфіну, наприклад, трифенілфосфіну або зв'язаНаприклад, сполука формули (11) контактує за ного зі смолою фосфіну та діалкілазодикарбоксиумов кислотного каталізу із придатним спиртом, лату, наприклад, діетилазодикарбоксилату, діізопHOR. Придатним спиртом є спирт, який забезперопілазодикарбоксилату або ди-третчує одержання ацеталю, що зберігає стійкість у бутилазодикарбоксилату. Реакцію, як правило, реакції на стадії b і може видалятись на стадії с з здійснюють при температурі від температури наодержанням сполуки формули (2). До придатних вколишнього середовища до 60°С. Тривалість спиртів належить метанол, етанол, пропанол, 1,3реакції, як правило, становить від 1год до 12год. пропандіол, етиленгліколь тощо. Продукт може виділятись способами, добре відоНа Схемі Е, стадія b, придатна сполука формими у цій галузі, наприклад, екстрагуванням та мули (11), формули (12) або формули (14) реагує з випарюванням. Після цього продукт може очищареактивом перенесення групи R4, за потребою, з тись способами, добре відомими у цій галузі, наодержанням сполуки формули (2), формули (13) приклад, перегонкою, хроматографуванням або або формули (15), відповідно. Придатними сполуперекристалізацією. ками формули (11), формули (12) та формули (14) На Схемі Е, стадія с, зображено відщеплення є сполуки, X та R3 яких є бажаними у кінцевому захисної групи ацеталю формули (13) з одержанпродукті формули І. Доступним та придатним для ням сполуки формули (2). Такі відщеплення захисреакції, представленій на Схемі Е, є цілий ряд рених груп легко здійснюються за способами, добре активів, які переносять R4, за потребою, до кінцевідомими у цій галузі. [Protecting Groups in Organic вого продукту. До таких реактивів належать галоSynthesis, Theodora Greene (Wiley-Interscience)]. піридини, N-оксиди галопіридину, алілгалогеніди, Наприклад, сполука формули (13) контактує у С2-С4 алканоли, С2-С4 алкілгалогеніди та сульфоприсутності кислоти у водному середовищі з оденати, фторовані С2-С4 алканоли, фторовані С2-С4 ржанням сполуки формули (2). алкілгалогеніди та сульфонати, факультативно На Схемі Е, стадія d, сполука брому формули заміщений феніл, що має щонайменш один атом (15) формілується з одержанням сполуки формуфтору або хлору, факультативно заміщені фенілли (2). сульфонілгалогеніди або ангідриди та факультаНаприклад, сполука формули (15) металуєтьтивно заміщені бензилгалогеніди. ся шляхом обробки металувальним реактивом, Наприклад, у разі, коли придатним реактивом наприклад, бутиллітієм. Згадану реакцію здійснюперенесення групи R4 є галогенід, сульфонат або ють у придатному розчиннику, наприклад, гексані, ангідрид, придатна сполука формули (11), формубензолі, толуолі, тетрагідрофурані або діетиловоли (12) або формули (14) сполучається за основму ефірі. Реакцію, як правило, здійснюють у приних умов з одержанням сполуки формули (2), фосутності приблизно 1-1,5 мольних еквівалентів рмули (13) або формули (15), відповідно. Згадану металувального реактиву. Реакція металування реакцію здійснюють у придатному розчиннику, здійснюється при температурі від приблизно -70°С наприклад, ацетонітрилі, диметилформаміді, дидо приблизно 20°С, і її тривалість, як правило, 29 76451 30 становить від 1год до 6год. Після цього металовані лучення здійснюють із застосуванням придатного різновиди обробляють реактивом перенесення каталізатора, наприклад, солей міді. Тривалість формілу, наприклад, диметилформамідом або реакції становить, як правило, від 6год до 48год. алкілхлороформіатом, з одержанням сполуки фоПродукт реакції сполучення може виділятись та рмули (2) або алкоксикарбонільної сполуки, яка очищатись способами, добре відомими у цій галуможе перетворюватись на альдегід за наведеним зі. До цих способів належить екстрагування, випаописом. Продукт реакції може виділятись та очирювання, хроматографування та перекристалізащатись способами, добре відомими у цій галузі. До ція. цих способів належить екстрагування, випарюванСхема F, стадії b-е, зображає ряд реакцій приня, хроматографування та перекристалізація. датної сполуки формули (17), після металування Схема F зображає способи одержання сполук за описом на Схемі Е, стадія d, з одержанням споформули (2) з універсальної проміжної хімічної лук формули (18)-(21), відповідно. На цих стадіях сполуки (17), яку легко одержують шляхом одерпридатною сполукою формули (17) є така сполука, жання ацеталю, як описано вище. R3 якої є бажаним у кінцевому продукті формули І і на яку не справляють негативного впливу умови металування згаданої реакції. Взагалі, ці реакції здійснюють у розчиннику та при температурі, що використовуються для одержанням металованих різновидів. Продукти цих реакцій можуть виділятись та очищатись способами, добре відомими у цій галузі, у тому числі швидким охолодженням, екстрагуванням, випарюванням, розтиранням у порошок, хроматографуванням та перекристалізацією. Наприклад, на Схемі F, стадія b, металована сполука формули (17) контактує із придатним дисульфідом (R4S-)2 з одержанням сполуки формули (18). Придатним дисульфідом є такий дисульфід, R4 якого є бажаним у кінцевому продукті формули І та який забезпечує одержання сполук, де X - -S-. До придатних дисульфідів належать C1-C4 алкіддисульфіди, факультативно заміщені фенілдисульфіди та факультативно заміщені бензилдисульфіди. Згадану реакцію здійснюють із застосуванням приблизно 1-2 мольних еквівалентів придатного дисульфіду. Реакцію, як правило, здійснюють у тому саме розчиннику, який застосовувався для металування та при температурах від приблизно -78°С до приблизно 50°С. Тривалість реакції становить, як правило, від 12год до 48год. На Схемі F, стадія а, зображена реакція заміНаприклад, на Схемі F, стадія с, металована щення ароматичного кільця придатної сполуки сполука формули (17) контактує із придатним суформули (17) та придатного спирту (R4OH) або льфонілфторидом (R4SO2F) з одержанням сполуки придатного тіолу (R4SH) з одержанням сполуки формули (19). Придатним сульфонілфторидом є формули (13), де X - -О- або -S-, як визначено витакий сульфонілфторид, який переносить R4, за ще на Схемі Е. Придатною сполукою формули (17) потребою, до кінцевого продукту формули І, і який є така сполука, R3 якої є бажаним у кінцевому прозабезпечує одержання сполук, де X - -SO2-. До дукті формули І. R4 придатного спирту (R4OH) або придатних сульфонілфторидів належить факульпридатного тіолу (R4SH) є бажаним у кінцевому тативно заміщений фенілсульфонілфторид. Згапродукті формули І, і до них належать С2-С4 алкідану реакцію здійснюють із застосуванням прибльні спирти та тіоли, фторовані С2-С4 алкільні лизно 1-3 мольних еквівалентів придатного спирти та тіоли, факультативно заміщені феноли сульфонілфториду. Реакцію, як правило, здійснюта тіофеноли, факультативно заміщені бензильні ють у тому саме розчиннику, який застосовувався спирти та тіоли. для металування та при температурах від приблиНаприклад, придатна сполука формули (17) та зно -78°С до приблизно 0°С. Тривалість реакції придатний спирт (R4OH) або придатний тіол становить, як правило, від 2год до 12год. (R4SH) сполучаються з одержанням сполуки форНаприклад, на Схемі F, стадія d, металована мули (13). Згадану реакцію здійснюють у придатсполука формули (17) контактує із придатним хлоному розчиннику, наприклад, диметилформаміді, рангідридом (R4C(O)CI) з одержанням сполуки диметилацетаміді та диметилсульфоксиді. Реакформули (20). Придатним хлорангідридом є такий цію здійснюють із застосуванням приблизно 1,1-3 хлорангідрид, який переносить R4, за потребою, до мольних еквівалентів придатного спирту або тіолу. кінцевого продукту формули І, і який забезпечує Реакцію здійснюють у присутності приблизно 1-6 одержання сполук, де X - -С(О)-. До придатних мольних еквівалентів придатної основи, наприхлорангідридів належать С2-С4 алкілхлорангідриклад, гідриду калію, гідроксиду натрію, карбонату ди, фторовані С2-С4 алкілхлорангідриди, факулькалію, карбонату натрію або гідриду натрію. Спотативно заміщені фенілхлорангідриди, факульта 31 76451 32 тивно заміщені бензилхлорангідриди та факультативно заміщені 5-6-членні моноциклічні ароматичні гетероциклохлорангідриди. Згадану реакцію здійснюють із застосуванням приблизно 0,8-1,2 мольних еквівалентів придатного хлорангідриду. Реакцію, як правило, здійснюють у тому саме розчиннику, який застосовувався для металування та при температурах від приблизно -78°С до приблизно 50°С. Тривалість реакції становить, як правило, від 1год до 12год. Наприклад, на Схемі F, стадія e, металована сполука формули (17) контактує із придатним альдегідом (R4C(O)H) з одержанням сполуки формули (21). Придатним альдегідом є такий альдегід, який переносить R4, за потребою, до кінцевого продукту формули І, і який забезпечує одержання сполук, де X - -СН(ОН)-. До придатних альдегідів належить С2-С4 алкілальдегід, фторований С2-С4 алкілальдегід, факультативно заміщений фенілальдегід, Схема G, стадія а, сполука брому формули факультативно заміщений бензилальдегід та фа(15) піддається карбоксилуванню з одержанням культативно заміщений 5-6-членний моноциклічсполуки формули (5), де А - -ОН. ний ароматичний гетероциклоальдегід. Згадану Наприклад, сполука формули (15) металуєтьреакцію здійснюють із застосуванням приблизно 1ся за описом Схеми Е, стадія d, після чого мета3 мольних еквівалентів придатного альдегіду. Реалований різновид обробляють діоксидом вуглецю кцію, як правило, здійснюють у тому саме розчинз одержанням сполуки формули (5), де А - -ОН. нику, який застосовувався для металування, та Продукт реакції може виділятись та очищатись при температурах від приблизно -50°С до приблиспособами, добре відомими у цій галузі. До цих зно 50°С. Тривалість реакції становить, як прависпособів належить екстрагування, випарювання, ло, від 4год до 24год. хроматографування та перекристалізація. Як буде належним чином оцінене досвідченим Схема G, стадія b, сполука брому формули фахівцем, сполуки формули (18)-(21) можуть під(15) піддається алкоксиформілуванню із застосудаватись ряду інших перетворень, які зображені ванням придатного хлороформіату або карбонату на Схемі F, стадії f-i, з одержанням, кінець-кінців, з одержанням сполуки формули (32). Придатним сполук формули І, які мають різні групи на X. Ці хлороформіатом або карбонатом є такий хлороперетворення є добре відомими і знаходяться у форміат або карбонат, що переносить групу межах можливостей досвідченого фахівця. Ці пеRO(O)C-, де R - метил, етил або бензил. ретворення включають окиснення сульфідів (стаНаприклад, сполука формули (15) металуєтьдія f), яке може здійснюватись за допомогою перося за описом Схеми Е, стадія d, після чого метаксиду, надкислот та інших реактивів, відомих у цій лований різновид обробляють приблизно 1-3 могалузі; відновлення бензилового спирту (стадія g), льними еквівалентами придатного хлороформіату яке може здійснюватись за допомогою цілого ряду або карбонату. Реакцію, як правило, здійснюють у реактивів, наприклад, триетилсилатому саме розчиннику, який застосовувався для ну/трифтороцтової кислоти; галогенування бензиметалування та при температурах від приблизно лового спирту з одержанням фтору (стадія h) за 78°С до приблизно 50°С. Тривалість реакції, як допомогою таких реактивів, як трифторид діетиправило, становить від 1год до 24год. Продукт ламіносірки та фторуючих агентів; відновлення реакції може виділятись та очищатись способами, кетону (стадія і) за допомогою різноманітних реакдобре відомими у цій галузі техніки. До цих спосотивів перенесення гідриду або окиснення бензибів належить екстрагування, випарювання, хромалового спирту (стадія і), яке може здійснюватись тографування та перекристалізація. за допомогою діоксиду марганцю або реакції СвеНа Схемі G, стадія с, придатна сполука форрна. мули (33) реагує з реактивом перенесення групи На Схемі F, стадія j, сполуки формули (13) та R4, за потребою, з одержанням сполуки формули формули (18)-(23) позбавляються захисної групи з (32). Придатною сполукою формули (33) є сполуодержанням альдегіду формули (2), як описано на ка, X та R3 якої є бажаними у кінцевому продукті Схемі Е, стадія с. формули І. Реактиви, які переносять R4, відповіСхема G зображає способи одержання сполук дають опису Схеми Е. формули (5). Наприклад, у разі, коли придатним реактивом перенесення групи R4 є галогенід або ангідрид, придатна сполука формули (34) сполучається за основних умов з одержанням сполуки формули (33). Згадану реакцію здійснюють у придатному розчиннику, наприклад, диметилформаміді, тетрагідрофурані або піридині. Реакцію, як правило, здійснюють у присутності приблизно 1-3 мольних еквівалентів придатної основи, наприклад, карбо 33 76451 34 нату натрію, карбонату калію, карбонату цезію, Ν,Ν-діізопропілетиламіну, триетиламіну тощо. Реакцію здійснюють при температурі від приблизно 30°С до приблизно 100°С, і її тривалість, як правило, становить від 6год до 48год. Продукт реакції може виділятись та очищатись способами, добре відомими у цій галузі. До цих способів належить екстрагування, випарювання, хроматографування та перекристалізація. За альтернативним варіантом, наприклад, у разі, коли придатним реактивом перенесення групи R4 є алканол, сполучення може здійснюватись за допомогою реакції Міцунобу, яка є добре відомою у цій галузі техніки і опис якої наведено на Схемі Е. На Схемі G, стадія d, від складного ефіру формули (32) відщеплюється захисна група з одержанням сполуки формули (5), де А - -ОН. Такі відщеплення захисних груп легко здійснюються за способами, добре відомими у цій галузі. [Protecting Groups in Organic Synthesis. Theodora Greene (Wiley-Interscience)]. Схема G, стадія є, сполука формули (5), де А -OH, перетворюється на сполуку формули (5), де Схема Н, стадія а, сполуку брому формули А - активуюча група, наприклад, галогенангідрид, (15) перетворюють на нітрил формули (35). активований складний ефір, активований амід або Наприклад, сполуку формули (15) обробляють ангідрид. Одержання таких активованих проміжних ціанідом міді (І) з одержанням сполуки формули хімічних сполук є добре відомим та належним чи(35). Цю реакцію здійснюють у придатному розном оціненим у цій галузі. чиннику, наприклад, диметилформаміді. Реакцію, Наприклад, галогенангідрид можна одержати як правило, здійснюють у присутності приблизно 1за допомогою цілого ряду реактивів, наприклад, 3 мольних еквівалентів ціаніду міді (І). Реакцію оксалілхлориду, оксалілброміду, тіонілхлориду, здійснюють при температурі від приблизно темпетіонілброміду, оксихлориду фосфору, трихлориду ратури навколишнього середовища до приблизно фосфору та пентахлориду фосфору; змішаний 100°С, і її тривалість, як правило, становить від ангідрид заміщеної фосфорної кислоти, напри6год до 48год. Продукт реакції може виділятись та клад, діалкілфосфорної кислоти, дифенілфосфорочищатись способами, добре відомими у цій галуної кислоти, галогенфосфорної кислоти, аліфатичзі. До цих способів належить екстрагування, випаної карбонової кислоти, наприклад мурашиної рювання, хроматографування та перекристалізакислоти, оцтової кислоти, пропіонової кислоти, ція. масляної кислоти, ізомасляної кислоти, півалової Схема Н, стадія b, сполуку нітрилу формули кислоти, 2-етилмасляної кислоти, активований (35) відновлюють з одержанням сполуки формули складний ефір, наприклад, фенольний складний (4), де R2 - водень. ефір, р-нітрофенольний складний ефір, NНаприклад, сполуку нітрилу формули (35) гідроксисукцинімідний складний ефір, Nвводять у контакт із борогідридом натрію у присутгідроксифталімідний складний ефір, 1ності хлориду кобальту. Згадану реакцію здійснюгідроксибензотриазольний складний ефір або акють у придатному розчиннику, наприклад, метанотивований амід, наприклад, імідазол, диметилпілі або етанолі. Реакцію, як правило, здійснюють разол, триазол, одержують за способами, які є при температурі від приблизно 0°С до 50°С. Тридобре відомі та належним чином оцінені у цій гавалість реакції, як правило, становить від 1год до лузі. Такі активовані проміжні хімічні сполуки мож72год. Продукт може виділятись та очищатись на одержувати та використовувати безпосередньо способами, добре відомими у цій галузі, наприабо одержувати та виділяти перед використанням клад, шляхом екстрагування аквокислотою, випаза вищенаведеними схемами. рювання, змішування, хроматографування та пеСхема Η зображає способи одержання сполук рекристалізації. формули (4). За альтернативним варіантом, наприклад, сполука нітрилу формули (35) гідрогенізується над придатним каталізатором, наприклад, нікелем Ренея . У разі застосування нікелю Ренея як каталізатора, згадану реакцію здійснюють у придатному розчиннику, причому придатні розчинники будуть, як правило, включати аміак, наприклад, етанол/гідроксид амонію. Реакцію, як правило, здійснюють при температурах від температури навколишнього середовища до 50°С. Реакцію здійснюють під тиском від 15фунт/дюйм2 (103кПа) до 120фунт/дюйм2 (827кПа) у апараті, призначе 35 76451 36 ному для здійснення реакцій під тиском, напридати оксид міді (5,5г, 69,5ммоль). Нагрівати зі звоклад, у гідрогенізаційній установці Парра. Продукт ротним холодильником. Через 24год охолодити до може виділятись шляхом ретельного видалення кімнатної температури, розбавити дихлорметаном каталізатора фільтрацією або випарюванням. та відфільтрувати. Концентрувати фільтрат під Продукт може очищатись екстрагуванням, випавакуумом з одержанням масла жовтого кольору. рюванням, розтиранням у порошок, хроматограХроматографувати масло на силікагелі з елююфуванням та перекристалізацією. ванням сумішшю (95:5) гексану:ЕtOАс з одержанСхема Н, стадія с, сполуку нітрилу формули ням цільової сполуки. (35) перетворюють на амід формули (36). За способом Прикладу 1 одержали такі споНаприклад, сполуку формули (35) обробляють луки: кислотою або основою за умов гідролізу з одерa) 2-(3-(2-фторфенокси)феніл)-(1,3)діоксолан; жанням сполуки формули (36). Згадану реакцію b) 2-(3-(3-фторфенокси)феніл)-(1,3)діоксолан; здійснюють у придатному розчиннику, наприклад, c) 2-(3-(нафт-2-ілокси)феніл)-(1,3)діоксолан; етанолі, ізопропанолі, диметилсульфоксиді, кожен d) 2-(3-(нафт-1-ілокси)феніл)-(1,3)діоксолан; з яких включає воду. Гідроліз ароматичного нітриe) 2-(3-(пірид-3-ілокси)феніл)-(1,3)діоксолан; лу до аміду є добре відомим та належним чином f) 3-(піридин-3-ілокси)бензальдегід; оціненим у цій галузі. Продукт реакції може видіg) 3-(піримідин-5-ілокси)бензальдегід; і лятись та очищатись способами, добре відомими у h) 3-(піридин-4-ілокси)бензальдегід. цій галузі. До цих способів належить екстрагуванПриклад 2 ня, випарювання, хроматографування та перекри3-[1,3]діоксолан-2-ілфеніл)феніламін сталізація. Змішати 2-(3-бромфеніл)-1,3-діоксолан (0,7мл, Схема Н, стадія d, зображає одержання аміду 4,3ммоль), анілін (0,4мл, 4,7ммоль), трет-бутоксид формули (37) шляхом реагування сполуки формунатрію (0,6г, 6,0ммоль), BINAP (2,2'ли (5) та придатного аміну формули H2NR2 у реакбіс(дифенілфосфін)-1,1'-бінафтил) (10,0мг, ції одержання аміду. Придатним аміном формули 0,03моль), Pd2(dba)3 (30,0мг, 0,01ммоль) та толуол H2NR2 є амін, що надає R2, за потребою, до кінце(20мл). Нагрівати при температурі 80°С. Через вого продукту формули І. Придатні способи одер18год охолодити до кімнатної температури, розбажання амідів є добре відомі у цій галузі і їхній опис вити ефіром (40мл), відфільтрувати та концентрупредставлено на вищенаведеній Схемі В. вати з одержанням залишку. Хроматографувати Схема Н, стадія є, сполука аміду формули (36) залишок на силікагелі з елююванням сумішшю або (37) відновлюється до сполуки формули (4). (9:1) гексану:ЕtOАс з одержанням цільової споТакі відновлення амідів легко здійснюються за луки. описом на вищенаведеній Схемі В і є відомими у За способом Прикладу 2 одержали такі сполуцій галузі. ки: Схема Н, стадія f, сполука формули (2) та a) бензил-(3-[1,3]діоксолан-2-ілфеніл)-амін; придатний амін формули H2NR2 піддаються гідроb) (3-[1,3]діоксолан-2-ілфеніл)-піридин-3амінуванню з одержанням сполуки формули (4). іламін; Таке гідроамінування легко здійснюється за опиc) (3-[1,3]діоксолан-2-ілфеніл)-піридин-4сом на вищенаведеній Схемі В та за допомогою іламін; і інших способів, відомих у цій галузі. d) (3-[1,3]діоксолан-2-ілфеніл)-піридин-2Як буде належним чином оцінене досвідченим іламін. фахівцем, сполуки формули II легко одержують за Приклад 3 допомогою способів, аналогічних до способів, опис 2-(3-фенілсульфанілфеніл)-[1,3]-діоксолан яких було наведено вище. Змішати 2-(3-бромфеніл)-1,3-діоксолан (3,0мл, Цей винахід додатково ілюструється наведе20,0ммоль) та тетрагідрофуран (100мл). Охолодиними далі прикладами та препаратами. Ці приклати до температури приблизно -78°С. Додати крапди та препарати є виключно ілюстративними і не ля за краплею розчин п-бутиллітію, 1,6Μ розчин у призначеними для будь-якого обмеження цього гексані (13,4мл, 21,0ммоль). Через 10хв додати винаходу. дисульфід фенілу (4,3г, 20,0ммоль) у вигляді розТерміни, які використовуються у прикладах та чину у тетрагідрофурані (50мл). Через 1год нагріпрепаратах, мають своє звичайне значення, якщо вати до кімнатної температури впродовж 1год, не вказано інше. Наприклад, "°С" означає градуси після чого реакцію швидко припинити доданням за Цельсієм; "N" означає нормальний або нормахолодної води (150мл) та екстрагувати ефіром. льність; "М" означає молярний або молярність; Екстрагувати об'єднані органічні шари послідовно "ммоль" означає мілімоль або мілімолі; "г" означає дистильованою водою та розсолом, після чого грам або грами; "мл" означає мілілітр або мілілітвисушити (Na2SO4), відфільтрувати та концентрури; "т.пл." означає точку плавлення; "розеол" вати з одержанням залишку. Хроматографувати означає насичений водний розчин хлориду натрію; залишок з елююванням сумішшю (9:1) гексатощо. У спектрах 1Н ЯМР усі хімічні зсуви надані у ну:ЕtOАс з одержанням цільової сполуки. За способом Прикладу 3 одержали такі спо, якщо не вказано інше. луки: Приклад 1 а) 2-(3-р-толілсульфанілфеніл)-[1,3]-діоксолан. 2-(3-(4-6торфенокси)феніл)-(1,3)діоксолан Приклад 4 Змішати 4-фторфенол (3,0г, 227,8ммоль), 2-(32-(3-бензолсульфонілфеніл)-[1,3]-діоксолан бромфеніл)-1,3-діоксолан (5,0мл, 33,3ммоль), карЗмішати 2-(3-фенілсульфанілфеніл)-[1,3]бонат калію (безводний, 8,0г, 55,6ммоль) та сухий діоксолан (1,0г, 3,6ммоль) та дихлорметан (15мл). піридин (50мл). Нагріти до температури 90°С і до 37 76451 38 Охолодити до температури приблизно -78°С. До2-(3-( -фторбензил)феніл)-[1,3]-діоксолан дати суспензію m-хлорпербензойної кислоти (2,3г, Змішати (3-[1,3]діоксолан-2-ілфеніл)-феніл7,2ммоль) у дихлорметані (10мл). Через 30хв наметанол (2,3г, 8,9ммоль) та дихлорметан (50мл). гріти до кімнатної температури, після чого додати Охолодити до температури приблизно -78°С. Кра1N розчин тіосульфату натрію (20мл). Через 15хв пля за краплею додати розчин трифториду (діетидодати насичений розчин бікарбонату натрію. Віламіно)сірки (1,7мл, 12,9ммоль). Через 10хв реакдокремити органічний шар та екстрагувати водний цію швидко припинити доданням холодної води та шар дихлорметаном. Об'єднати органічні шари і екстрагувати дихлорметаном. Об'єднати органічні послідовно промити дистильованою водою та розшари і послідовно промити дистильованою водою солом, після чого висушити (Na2SO4), відфільтрута розсолом, після чого висушити (Na2SO4), відфівати та концентрувати з одержанням залишку. льтрувати та концентрувати з одержанням залишХроматографувати залишок з елююванням EtOAc ку. Хроматографувати залишок з елююванням з одержанням цільової сполуки. сумішшю (7:3) гексану:ЕtOАс з одержанням цільоЗа способом Прикладу 4 одержали такі спової сполуки. луки: Приклад 9 а) 2-(3-(толуол-4-сульфоніл)-феніл)-[1,3]3-нітродибензофуран діоксолан. Змішати дибензофуран (20,0г, 0,11моль) та Приклад 5 оцтову кислоту (80мл). Нагріти до температури (3-[1,3]діоксолан-2-ілфеніл)фенілметанол 65°С. Додати 98% розчин азотної кислоти (20,0г, Змішати 2-(3-бромфеніл)-1,3-діоксолан 11,8моль). Через 3год охолодити до кімнатної те(10,0мл, 66,0ммоль) та тетрагідрофуран (100мл) і мператури з одержанням твердої речовини. Відфіохолодити до температури приблизно -78°С. Кральтрувати тверду речовину, промити водою та пля за краплею додати розчин n-бутиллітію, 1,6Μ висушити з одержанням цільової сполуки. розчин у гексані (44,0мл, 66,0ммоль). Через 10хв Приклад 10 за допомогою канюлі додати розчин бензальдегіду N-дибензофуран-3-іламін (7,6мл, 66,0ммоль) у тетрагідрофурані (50мл). ЧеЗмішати 3-нітродибензофуран (22,0г, рез 1год нагріти до кімнатної температури. Через 0,1моль), нікель Ренея (2,75г) та етанол (365мл) і 18год реакцію швидко припинити доданням хологідрогенізувати при кімнатній температурі та під дної води та екстрагувати дихлорметаном. Об'єдтиском у 40фунт/дюйм2 (276кПа). Через 18год віднати органічні шари і послідовно промити дистифільтрувати та концентрувати фільтрат з одерльованою водою та розсолом, після чого висушити жанням залишку. Хроматографувати залишок з (Na2SO4), відфільтрувати та концентрувати з одеелююванням сумішшю (9:1) гексану:ЕtOАс з одерржанням залишку. Хроматографувати залишок з жанням цільової сполуки. елююванням сумішшю (7:3) гексану:EtOAc з одерПриклад 11 жанням цільової сполуки. 3-бромдибензофуран Приклад 6 Змішати N-дибензофуран-3-іламін (2,0г, (3-[1,3]діоксолан-2-ілфеніл)фенілметанон 10,8ммоль), воду (20мл) та концентровану бромиЗмішати (3-[1,3]діоксолан-2-ілфеніл)-фенілстоводневу кислоту (6мл). Охолодити до темпераметанол (5,0г, 18,5ммоль) та розчин 18-краун-6 тури 0°С. Додати розчин нітриту натрію (0,7г, (160мг, 0,6ммоль) у дихлорметані. Додати перман10,8ммоль) у воді (16мл). Через 15хв додати виганат калію (8,8г, 55,5ммоль). Нагріти до темперащезгадану суміш до суміші броміду міді (1,7г, тури приблизно 40°С. Через 4год охолодити до 12,3ммоль) у воді (9,2мл) та бромистоводневої кімнатної температури, додати воду та сірковокислоти (4мл). Нагріти до температури навколишдень-натрій (6,0г). Підвищити основність 1N рознього середовища. Через 18год додати воду та чином гідроксиду натрію (приблизно 60мл) та ексекстрагувати дихлорметаном. Об'єднати органічні трагувати дихлорметаном. Об'єднати органічні шари і послідовно промити дистильованою водою шари і послідовно промити дистильованою водою та розсолом, після чого висушити (Na2SO4), відфіта розсолом, після чого висушити (Na2SO4), відфільтрувати та концентрувати з одержанням залишльтрувати та концентрувати з одержанням залишку. Хроматографувати залишок з елююванням ку. Хроматографувати залишок з елююванням сумішшю (8:2) гексану:EtOAc з одержанням цільоEtOAc з одержанням цільової сполуки. вої сполуки. Приклад 7 Приклад 12 3-бензилбензальдегід Дибензофуран-3-карбальдегід Змішати (3-[1,3]діоксолан-2-ілфеніл)-фенілЗмішати 3-бромдибензофуран (0,5г, 2,0ммоль) метанол (2,3г, 8,7ммоль) та йодид натрію (5,3г, та тетрагідрофуран (30мл). Охолодити до темпе35,0ммоль) у ацетонітрилі (25мл). За допомогою ратури приблизно -78°С. Додати розчин третшприца додати дихлорметилсилан (2,1мл, бутиллітію, 1,6Μ розчин у гексані (2,2мл, 17,4ммоль). Через 10хв розбавити EtOAc та про3,0ммоль), після чого нагрівати до температури мити водою, насиченим розчином бікарбонату приблизно 0°С впродовж 10хв. Охолодити до темнатрію, 10% розчином тіосульфату натрію, потім ператури приблизно -78°С, і додати диметилфоррозсолом. Висушити органічні шари (Na2SO4), відмамід (0,5мл, 5,9ммоль). Нагріти до кімнатної темфільтрувати та концентрувати з одержанням заператури, швидко припинити реакцію доданням лишку. Хроматографувати залишок з елююванням холодної води та екстрагувати дихлорметаном. сумішшю (9:1) гексану:ЕtOАс з одержанням цільоОб'єднати органічні шари і послідовно промити вої сполуки. дистильованою водою та розсолом, після чого Приклад 8 висушити (Na2SO4), відфільтрувати та концентру 39 76451 40 вати з одержанням залишку. Хроматографувати фенатролін (1,3г, 6,2ммоль), трансдибензиліденазалишок з елююванням сумішшю (8:2) гексацетон (0,1г, 0,3ммоль), карбонат цезію (2,6г, ну:ЕtOАс з одержанням цільової сполуки. 7,9ммоль) та йодобензол (1,6мл, 14,3ммоль) у Приклад 13 ксилолі (40мл). Нагрівати при температурі прибли3-(тіазол-2-ілокси)бензальдегід зно 110°С. Через 24год охолодити до кімнатної У герметизованій пробірці змішати 2температури, розбавити дихлорметаном та насибромотіазол (2,0мл, 22,2ммоль), 3ченим розчином хлориду амонію. Відокремити гідроксибензальдегід (1,8г, 15,0ммоль) та карбошари, і екстрагувати водний шар дихлорметаном. нат калію (2,1г, 15,0ммоль) у диметилформаміді Об'єднати органічні шари і послідовно промити (20мл). Нагріти до температури 100°С. Через дистильованою водою та розсолом, після чого 48год охолодити, вилити у воду (150мл) та екстрависушити (Na2SO4), відфільтрувати та концентругувати простим ефіром. Об'єднати органічні шари, вати з одержанням залишку. Хроматографувати і послідовно промити дистильованою водою та залишок з елююванням сумішшю (8:2) гексарозсолом, після чого висушити (Na2SO4), відфільтну:EtOAc з одержанням цільової сполуки. рувати та концентрувати з одержанням залишку. За способом Прикладу 16 одержали такі споХроматографувати залишок з елююванням сумілуки: 1-феніл-1Н-індол-4-карбальдегід. шшю (9:1) гексану:EtOAc з одержанням цільової Приклад 17 сполуки. 3-фенілеульфанілбензальдегід Приклад 14 Змішати 2-(3-фенілсульфанілфеніл)-[1,3]6-бром-1Н-індол діоксолан (0,3г, 1,1ммоль) та ацетонітрил (8,0мл), Змішати 4-бром-2-нітротолуол (5,0г, додати розчин хлористоводневої кислоти (1N, 23,1ммоль), диметилформамід (50мл), диметил2,0мл). Через 18год концентрувати під вакуумом із формамід-диметилацеталь (9,0мл, 69,4ммоль) та видаленням більшої частини ацетонітрилу, розбапіролідин (2,0мл, 23,1ммоль). Нагріти до темперавити водою та екстрагувати простим ефіром. тури 110°С. Через 3год охолодити до кімнатної Об'єднати органічні шари і промити один раз наситемператури, розбавити простим ефіром та проченим розчином бікарбонату натрію, потім розсомити водою. Об'єднати органічні шари, та конценлом. Висушити (Na2SO4) органічні шари, відфільттрувати з одержанням залишку. Об'єднати залирувати та концентрувати з одержанням цільової шок та 80% водний розчин оцтової кислоти сполуки. (120мл), і нагрівати при температурі 75°С. ПорціяЗа способом Прикладу 17 одержали такі споми додати цинковий пил (13,1г, 200,5ммоль). Налуки: гріти до температури 85°С. Через 2год охолодити a) 3-бензолсульфонілбензальдегід; та відфільтрувати. Розбавити фільтрат простим b) 3-р-толілсульфанілбензальдегід; ефіром, промити водою, висушити (Na2SO4) і конc) 3-(р-тозил)бензальдегід; центрувати з одержанням залишку. Хроматограd) 3-бензиламінобензальдегід; фувати залишок з елююванням сумішшю (9:1) гекe) 3-феніламінобензальдегід; сану:EtOAc з одержанням цільової сполуки. f) 3-бензоїлбензальдегід; За способом Прикладу 14 одержали такі споg) 3-( -фторбензил)бензальдегід; луки: 4-бром-1Н-індол. h) 3-(4-фторфенокси)бензальдегід; Приклад 15 і) 3-(2-фторфенокси)бензальдегід; 1Н-індол-6-карбальдегід j) 3-(3-фторфенокси)бензальдегід; Змішати промитий гексаном гідрид калію (1,3г, k) 3-(нафт-2-ілокси)бензальдегід; 10,7ммоль) та простий ефір (20мл). Охолодити до l) 3-(нафт-1-ілокси)бензальдегід; температури приблизно 0°С, і додати розчин 6m) 3-(пірвдин-3-іламіно)бензальдегід; бром-1Н-індолу (2,1г, 10,7ммоль) у простому ефірі n) 3-(піридин-4-іламіно)бензальдегід; (5мл). Через 15хв охолодити до температури прио) 3-(піридин-2-іламіно)бензальдегід; і близно -78°С, і додати розчин тpет-бутиллітію, р) 3-(пірвдин-2-ілокси)бензальдегід. 1,4Μ розчин у гексані (14,0мл, 10,7ммоль). Через Приклад 18 10хв додати розчин диметилформаміду (1,7мл, 2-нафт-2-ілетиламін 20,0ммоль) у простому ефірі (5мл). Повільно наЗмішати нафт-2-ілацетонітрил (1,0г, гріти до кімнатної температури, після чого вилити 6,0ммоль), гексагідрат хлориду нікелю (II) (0,7г, до холодного 1Μ розчину (температура танення 3,0ммоль) та тетрагідрофуран (30мл). Крапля за льоду) фосфорної кислоти і екстрагувати EtOAc. краплею додати комплекс борануОб'єднати органічні шари, і послідовно промити тетрагідрофурану, 1M розчин у тетрагідрофурані дистильованою водою та розсолом, після чого (24,0мл, 24,0ммоль). Через 1год випарити з одервисушити (Na2SO4), відфільтрувати та концентружанням залишку. Хроматографувати на силікагелі вати з одержанням залишку. Хроматографувати з елююванням сумішшю (8:2) EtOAc:MeOH + 2% залишок з елююванням сумішшю (9:1) гексаNH4OH з одержанням цільової сполуки. ну:EtOAc з одержанням цільової сполуки. За способом Прикладу 18 одержали такі споЗа способом Прикладу 15 одержали такі сполуки: 2-нафт-1-ілетиламін. луки: 1Н-індол-4-карбальдегід. Приклад 19 Приклад 16 5-метансульфонілтриптамін 1-феніл-1Н-індол-6-карбальдегід Змішати 2-(3-хлорпропіл)-(1,3)-діоксолан Змішати у герметизованій пробірці 1Н-індол-6(6,69г, 44,5ммоль), гідрохлорид (4карбальдегід (0,9г, 6,2ммоль), комплексну сполуку метансульфонілфеніл)гідразину (9,92г, 44,5ммоль) трифторметансульфат міді (І) (0,2г, 0,3ммоль), та Na2HPO4 (1,58г, 11,1ммоль) у 300мл суміші ме 41 76451 42 танолу/води (1:1). Нагрівати зі зворотним холодиванням сумішшю етилацетату/гексану (10/90) з льником. Через 4,5год охолодити до температури одержанням цільової сполуки: т.пл. 84-89°С. MS навколишнього середовища, після чого випарити з (ACPI): m/e 212,0 (М+1). Аналіз для C14H10FN: ободержанням залишку. Розчинити залишок у 1N числено: С, 79,60; Н, 4,77; N, 6,63; встановлено: С, розчині NaOH та екстрагувати дихлорметаном. 79,33; Н, 4,92; N, 6,64. Об'єднати органічні шари, промити розсолом, виЗа способом Прикладу 21 одержали такі спосушити (Na2SO4), відфільтрувати, після чого конлуки: центрувати з одержанням залишку. Хроматограa) 5-феніл-1Н-індол: т.пл. 71-74°С. MS (ACPI): фувати залишок на силікагелі з елююванням m/e 194,0 (М+1). Аналіз для C14H11N: обчислено: сумішшю дихлорметану/2N розчину ΝΗ3 (метанол) С, 87,01; Н, 5,74; N, 7,25; встановлено: С, 86,67; Н, (84/16) з одержанням цільової сполуки у вигляді 5,82; N, 7,31. твердої речовини світло-брунатного кольору: т.пл. b) 4-фенілфенетиламіну гідрохлорид: (Виклю134-138°С, MS (ACPI) (мас-спектрометрія з хіміччення - Хроматографувати залишок на силікагелі ною іонізацією під атмосферним тиском): m/е із застосуванням суміші дихлорметану/2N розчину 239,1 (М+1). Аналіз для C11H14N2O2S: обчислено: NH3 (метанол) (90/10) з одержанням кінцевого С, 55,44; Н, 5,92; N, 11,76; встановлено: С, 55,33; продукту. Хлористоводневу сіль одержали у етиН, 5,97; N, 11,48. лацетаті: MS (ACPI): m/e 198,1 (М+1). Аналіз для Приклад 20 C14H16CIN: обчислено: С, 71,94; Н, 6,90; N, 5,99; N-трет-бутоксикарбоніл-2-(6-хлор-1Н-індол-3встановлено: С, 71,66; Н, 6,90; N, 5,94. іл)етиламін Приклад 22 Змішати ди-тpет-бутилдикарбонат (1,2г, 7-ціан-1Н-індол 5,34ммоль), 6-хлортриптамін (866,4мг, 4,45ммоль) Змішати 7-броміндол (4,72г, 24,0ммоль) та ціта NаНСО3 (598,2мг) у діоксані (50мл). Перемішуанід міді (4,30г, 48,1ммоль) у 1-метил-2-піролідині вати при температурі навколишнього середовища. (40мл). Нагріти до температури 200°С. Через Через 15год випарити з одержанням залишку, ро2,5год охолодити до кімнатної температури, додазподілити залишок між водою та дихлорметаном. ти суміш води-етилацетату (200мл, 1/1) з одерВідокремити шари і екстрагувати водний шар дихжанням твердої речовини. Профільтрувати через лорметаном. Об'єднати органічні шари, промити целіт, екстрагувати фільтрат етилацетатом, об'єдрозсолом, висушити (Na2SO4), відфільтрувати, нати органічні шари, промити розсолом, висушити після чого випарити з одержанням цільової сполунад Na2SO4, відфільтрувати та випарити in vacuo з ки у вигляді масла світло-жовтого кольору. одержанням залишку. Хроматографувати залишок Приклад 21А на силікагелі з елююванням сумішшю гекN-метил-2-(6-хлор-1Н-індол-3-іл)етиламін сан:етилацетат (10:1) з одержанням (1,87г) цільоЗмішати N-тpет-бутоксикарбоніл-2-(6-хлор-1Нвої сполуки у вигляді твердої речовини жовтого індол-3-іл)етиламін (1,3г, 4,41ммоль) та сухий теткольору: 1Н ЯМР (300МГц, DMSO-d6)) 6,64-6,66 (m, рагідрофуран (20мл), і крапля за краплею додати 1Н), 7,17 (t, 1Н, J=7,6Гц), 7,51-7,53 (m, 1H), 7,60до охолодженої на льодяній бані суспензії LiAIH4 7,62 (m, 1H), 7,94 (d, 1H, J=8,0H), 12,03 (br, 1H). (1,0г, 26,5ммоль) у сухому тетрагідрофурані Приклад 23 (30мл). Нагрівати зі зворотним холодильником. 3-форміл-5-ціан-1Н-індол Через 2год охолодити до температури навколишКрапля за краплею додати оксихлорид фоснього середовища і перемішувати. Через 15год фору (11,76г, 76,67ммоль) до диметилформаміду швидко припинити реакцію доданням холодного (24,3мл) з одночасним підтриманням температури насиченого розчину NaSO4 (100мл/моль), переміна рівні не нижче ніж 10°С. Нагріти до температури шувати впродовж 1год при температурі навколишнавколишнього середовища та перемішувати нього середовища, після чого відфільтрувати під впродовж 15хв при температурі навколишнього вакуумом. Промити осад тетрагідрофураном, висередовища. Крапля за краплею додати розчин 5парити фільтрат і промити з одержанням залишку. ціаноіндолу (10,00г, 70,34ммоль) у диметилфорХроматографувати залишок на силікагелі з елююмаміді (30мл) з одночасним підтриманням темпеванням сумішшю дихлорметану/2М розчину NH3 ратури нижче 35°. Через 1год вилити реакційну (метанол) (84/16) з одержанням цільової сполуки: суміш у суміш води з льодом (300мл), після чого з MS (ACPI): m/e 209,0 (М+1). перемішуванням додати 5N розчин NaOH (54мл). Приклад 21В Повільно додати додаткову кількість 5N розчину 5-(4-фторфеніл)-1Н-індол NaOH (19,7мл), після чого нагрівати до температуЗмішати 5-броміндол (5,00г, 25,50ммоль) та ри 90°С впродовж 1хв, потім охолодити до темпеPd(Ph3P)4 (1,47г, 1,28ммоль) у толуолі (510мл). ратури навколишнього середовища з одержанням Через 30хв додати розчин 4-фторбензолборонової осаду. Відфільтрувати осад, промити водою і викислоти (5,35г, 38,26ммоль) у етанолі (153мл), сушити з одержанням цільової сполуки: т.пл. 248після чого додати насичений розчин NaНСО3 250°С. MS (ACPI): m/e 171,0 (М+1). Аналіз для (255мл). Нагрівати зі зворотним холодильником. C10H6N2O: обчислено: С, 70,58; Н, 3,55; N, 16,46; Через 4год охолодити до температури навколишвстановлено: С, 70,41; Н, 3,53; N, 16,33. нього середовища, вилити у насичений розчин За способом Прикладу 23 одержали такі споNaCl (250мл) і відокремити органічний шар. Екстлуки: рагувати органічний шар етилацетатом. Об'єднати a) 3-форміл-5-(4-фторфеніл)-1Н-індол; т.пл. органічні екстракти, промити розсолом, висушити, 215-217°С. MS (ACPI): m/e 239,1 (М+1). Аналіз для після чого випарювати з одержанням залишку. C15H10FNO: обчислено: С, 75,30; Н, 4,21; N, 5,85; Хроматографувати залишок на силікагелі з елюювстановлено: С, 74,94; Н, 4,17; N, 5,84; 43 76451 44 b) 3-форміл-5-феніл-1Н-індол; т.пл. >250°С. спектрометрія з електророзпилюванням, m/e: MS (ACPI): m/e 222,1 (М+1). Аналіз для C15H11NO: 212,1 (M-1). обчислено: С, 81,43; Н, 5,01; N, 6,33; встановлено: і) 3-(2-нітровініл)-6-бром-1Н-індол; т.пл. 210°С, С, 81,04; Н, 5,05; N, 6,36; з розкладом. Аналіз для СюНуВг^Ог: обчислено: c) 3-форміл-6-метил-1Н-індол; т.пл. 178-180°С. С, 44,97; Н, 2,64; N, 10,49; встановлено: С, 44,62; MS (ACPI): m/e 159,9 (М+1). Аналіз для C10H9NO: Н, 2,70; N, 10,49. обчислено: С, 75,45; Н, 5,70; N, 8,80; встановлено: j) 3-(2-нітровініл)-7-фтор-1Н-індол; т.пл. 176С, 75,60; Н, 5,78; N, 8,97; 180°С. MS (ACPI): m/e 207,1 (M+1). Аналіз для d) 3-форміл-6-ціан-1Н-індол; т.пл. 246°С. MS C10H7FN2O2: обчислено: С, 58,26; Н, 3,42; N, 13,59; (ACPI): m/e 171,0 (М+1). Аналіз для С10Н6N2О: обвстановлено: С, 58,01; Н, 3,31; N, 13,26. числено: С, 70,58; Н, 3,55; N, 16,46; встановлено: Приклад 26 С, 70,51; Н, 3,59; N, 16,40; і 3-(2-нітроетил)-5-ціан-1Н-індол e) 3-форміл-6-трифторметокси-1Н-індол; т.пл. Додати борогідрид натрію (25,65г, 678ммоль) 189-192°С. MS (ACPI): m/e 230,0 (М+1). Аналіз для до охолодженого на льодяній бані розчину 3-(2C10H6F3NO2: обчислено: С, 52,41; Н, 2,64; N,6,11; нітровініл)-5-ціано-1Н-індолу (12,68г, 59,5ммоль) у встановлено: С, 52,31; Н, 2,61; N, 6,09. суміші (1:1) МеОН/диметилформаміду (600мл). f) 3-форміл-7-ціан-1Н-індол; 1Н ЯМР (300МГц, Через 1,5год додати розеол (600мл), після чого довести рН до приблизно 7 за допомогою 5N розOMSO-d6) 7,41 (t, 1H, J=7,6Гц), 7,80-7,82 (m, 1H), чину НСI. Випарити під зниженим тиском для ви8,42-8,50 (m, 2H), 10,02 (s 1H), 13,06 (br, 1H). далення метанолу, після чого екстрагувати дихлоg) 3-форміл-6-бром-1Н-індол; т.пл. 197-200°С. рметаном. Об'єднати органічні екстракти, промити Аналіз для C9H6BrNO: обчислено: С, 48,25; Η, 2,70; розсолом, висушити (Na2SO4), після чого випарити Ν, 6,25; встановлено: С, 47,87; Η, 2,68; Ν, 6,17. з одержанням залишку. Хроматографувати залиh) 3-форміл-7-фтор-1Η-індол; т.пл. 211-214°С. шок на силікагелі з елююванням дихлорметаном з MS(ACPI): m/e 163,9 (М+1). Аналіз для C9H6FNO: одержанням, після випарювання, цільової сполуки обчислено: С, 66,26; Η, 3,71; Ν, 8,59; встановлено: у вигляді безбарвних призм: т.пл. 132-136°С. MS С, 66,12; Η, 3,67; Ν, 8,56. (ACPI): m/e 215,0 (М+1). Аналіз для C11H9N3O2: Приклад 25 обчислено: С, 61,39; Н, 4,22; N, 19,52; встановле3-(2-нітровініл)-5-ціан-1Н-індол но: С, 61,09; Н, 4,10; N, 19,16. Змішати 3-форміл-5-ціано-1Н-індол (10,60г, За способом Прикладу 26 одержали такі спо63,32ммоль) та розчин ацетату амонію (10,60г) у луки: а) 3-(2-нітроетил)-7-ціан-1Н-індол; 1Н ЯМР нітрометані (660мл). Нагріти до температури 90°С. (300МГц, DMSO-d6) 3,39 (t, 2H, J=6,9Гц), 4,87 (t, Через 2год охолодити до температури навколиш2H, J=7,0Гц), 7,17 (t, 1Н, J=7,4Гц), 7,38 (m, 1Н), нього середовища з одержанням осаду. Відфільт7,63 (d, 1H, J=7,4Гц), 7,99 (d, 1H, J=7,9Гц), 11,96 рувати осад, промити сумішшю (1:1) МеОН/води (br, 1H). Mac-спектрометрія з електророзпилюван(500мл) та висушити з одержанням цільової споням, m/e: 214,1 (M-1). луки: т.пл. 247-251°С. MS (ACPI): m/e 214,0 (М+1). Приклад 27 За способом Прикладу 25 одержали такі спо5-ціанотриптамін луки: Додати цинковий пил (16,22г, 248,1ммоль) чоa) 3-(2-нітровініл)-5-(4-фторфеніл)-1Н-індол; тирма порціями до 2N розчину НСI (300,0мл). Крат.пл. 217-220°С. MS (ACPI): m/e 282.2 (М+1). Анапля за краплею додати 3-(2-нітроетил)-5-ціано-1Нліз для C15H10FN2O2: обчислено: С, 68,08; Н, 3,93; індол (2,25г, 10,5ммоль) у вигляді розчину у метаN, 9,92; встановлено: С, 67,73; Н, 3,92; N, 9,73; нолі (300,0мл). Нагріти до кипіння. Через 2,5год b) 3-(2-нітровініл)-5-феніл-1Н-індол; MS охолодити до температури навколишнього сере(ACPI): m/e 265,1 (М+1); довища, довести рН до 11 із застосуванням 5N c) 3-(2-нітровініл)-6-метил-1Н-індол; MS розчину NaOH, профільтрувати через шар целіту, (ACPI): m/e 203,1 (M+1); промити водою, після чого екстрагувати фільтрат d) 3-(2-нітровініл)-6-ціан-1Н-індол; т.пл. дихлорметаном. Об'єднати органічні екстракти, >250°C. MS (ACPI): m/e 212,0 (M-1). Аналіз для промити розсолом, висушити (Na2SO4), після чого С11Н7N3O2: обчислено: С, 61,97; Η, 3,31; Ν, 19,71; випарити з одержанням цільової сполуки: т.пл. встановлено: С, 62,09; Η, 3,34; Ν, 20,06; і 102-105°С, MS (ACPI): m/e 186,1 (М+1). Аналіз для e) 3-(2-нітровініл)-6-трифторметокси-1Н-індол; С11Н11N3: обчислено: С, 71,33; Н, 5,99; N, 22,69; т.пл. 139-143°С. MS (ACPI): m/e 273,0 (М+1). встановлено: С, 71,03; Н, 5,91; N, 22,64. f) 3-(2-нітровініл)-6-фенокси-1 Η-індол: 1Н ЯМР За способом Прикладу 27 одержали такі спо(DMSO d6) 12,1 (s, 1Н), 8,38-8,34 (d, 1H), 8,20-8,19 луки: а) 3-(2-аміноетил)-7-ціан-1Н-індол; 1Н ЯМР (m, 1H), 8,01-7,97 (m, 2H), 7,39-7,35 (m, 2H), 7,14(300МГц, DMSO-d6) 2,76-2,82 (m, 4Н), 7,15 (t, 1Н, 7,07 (m, 2H), 7,02-7,00 (m, 2H), 6,95-6,92 (m, 1H). J=7,6Гц), 7,31 (s, 1H), 7,58 (d, 1H, J=7,4Гц), 7,91g) 3-(2-нітровініл)-5-(піридин-3-ілокси)-1Н7,94 (m, 1H), 11,80 (br, 1H); мас-спектрометрія з індол: ISMS (мас-спектрометрія з розсіюванням електророзпилюванням, m/e: 186,1 (M+1), 184,1 іонів) 282 (М+1); 1Н ЯМР (DMSO-d6) 9,5 (bs, 1Н), (m-1). 8,36-8,32 (m, 2H), 8,26-8,24 (m, 2H), 7,98-7,95 (m, За способом Прикладу 27 одержали такі спо1H), 7,79-7,78 (m, 1H), 7,55-7,53 (m, 1H), 7,34-7,31 луки: а) 6-бромтриптамін; т.пл. 114-116°С. Аналіз (m, 1H), 7,27-7,24 (m, 1H), 7,02-7,00 (m, 1H). для C10H11BrN2: обчислено: С, 50,23; Н, 4,64; N, h) 3-(2-нітровініл)-7-ціан-1Н-індол: 1Н ЯМР 11,72; встановлено: С, 49,96; Н, 4,49; N, 11,47. (300МГц, CDCl3) 7,36 (t, 1Н, J=7,7Гц), 7,76 (d, 1Н, Приклад 28 J=7,2Гц), 8,09-8,14 (m, 1H), 8,36-8,46 (m, 3H); мас 45 76451 46 N-трет-бутоксикарбоніл-2-(5-ціан-1Н-індол-3Змішати LiAlH4 (2,66г, 70,17ммоль) та безводіл)етиламін ний тетрагідрофуран (70,0мл) і охолодити суспенЗмішати ди-тpет-бутилдикарбонат та розчин 5зію на льодяній бані. Крапля за краплею додати ціанотриптаміну (1,33г, 7,15ммоль) і 2N розчин розчин 5-(4-фторфеніл)-3-(2-нітровініл)-1Н-індолу NaOH (4,2мл) у тетрагідрофурані (60мл). Через (3,30г, 11,69ммоль) у сухому тетрагідрофурані 3год при температурі навколишнього середовища (30,0мл). Нагрівати зі зворотним холодильником. випарити з одержанням залишку. Розчинити заЧерез 1год охолодити до температури навколишлишок у воді та екстрагувати дихлорметаном. нього середовища і перемішувати. Через 15год Об'єднати органічні екстракти, промити розсолом, швидко припинити реакцію доданням холодного висушити (Na2SO4) та випарити з одержанням занасиченого розчину Na2SO4 (100мл/моль), і перелишку. Хроматографувати залишок на силікагелі з мішувати при температурі навколишнього середоелююванням сумішшю дихлорметану/2К розчину вища. Через 1год профільтрувати. Промити осад NH3 (метанол) (97/3) з одержанням цільової сполутетрагідрофураном, та випарити фільтрат з одерки: т.пл. 129-132°С. MS (ACPI): m/e 286,2 (М+1). жанням залишку. Хроматографувати залишок на Аналіз для C16H19N3O2: обчислено: С, 67,35; Η, силікагелі з елююванням сумішшю дихлормета6,71; Ν, 14,73; встановлено: С, 67,16; Η, 6,68; Ν, ну/2N розчину NH3 (метанол) (80/20)) з одержан14,46. ням цільової сполуки. Одержати хлористоводневу За способом Прикладу 28 одержали такі спосіль у діетиловому ефірі: т.пл. >250°С. MS (ACPI): луки: a) N-тpет-бутоксикарбоніл-2-(6-ціан-1Нm/e 255.0 (М+1). Аналіз для C16H16ClFN2: обчислеіндол-3-іл)етиламін. но: С, 66,09; Η, 5,55; Ν, 9,63; встановлено: С, Приклад 29 65,78; Η, 5,48; Ν, 9,58. N-тpет-бутоксикарбоніл-2-(5-амідо-1Н-індол-3За способом Прикладу 32 одержали такі споіл)етиламін луки: Змішати воду (64,0мл) та NaOH (8,53г) і охоа) 5-фенілтриптамін; т.пл. 244-246°С. MS лодити до температури приблизно 5°С на льодяній (ACPI): m/e 237,1 (M+1). Аналіз для C16H17CIN2: бані. Додати розчин N-трет-бутоксикарбоніл-2-(5обчислено: С, 70,45; Η, 6,28; Ν, 10,27; встановлеціано-1H-індол-3-іл)етиламіну (1,85г, 6,50ммоль) у но: С, 70,75; Η, 6,33; Ν, 10,27, (виділено як гідрохетанолі (128,0мл), після чого додати до охолоджелорид); ного розчину. Крапля за краплею додати 30% розb) 6-метилтриптамін; т.пл. 139-141°С. MS чин пероксиду (6,4мл) з одночасним підтримуван(ACPI): m/e 175,0 (M+1). Аналіз для C11H14N2: обням температури на рівні нижче 5°С. Через 30хв числено: С, 75,82; Н, 8,10; N, 16,08; встановлено: нагріти до температури навколишнього середовиС, 76,05; Н, 8,26; N, 16,12. ща. Через 22год розкласти надлишок пероксиду c) 6-трифторметокстриптамін; MS (ACPI): m/e шляхом додання 20% розчину бісульфіту натрію 245,0 (М+1). Аналіз для C11H11F3N2O: обчислено: (45,0мл) з перемішуванням. Через 30хв випарити С, 54,10; Н, 4,54; N, 11,47; встановлено: С, 53,92; під зниженим тиском для видалення етанолу та Н, 4,50; N, 11,06. екстрагувати одержаний водний розчин етилацеd) 7-фтортриптамін; MS (ACPI): m/e 179,0 татом. Об'єднати органічні екстракти, промити (М+1). Аналіз для C10H11FN2: обчислено: С, 67,40; розсолом, висушити (Na2SO4), після чого випарити Η, 6,22; Ν, 15,72; встановлено: С, 67,06; Η, 6,11; Ν, з одержанням залишку. Хроматографувати зали15,48. шок на силікагелі з елююванням сумішшю дихлоПриклад 33 рметану/2М розчину NH3 (метанол) (96/4)) з одер6-етоксикарбоніл-1Н-індол жанням, після випарювання, цільової сполуки: Змішати 6-карбокси-1Н-індол та етанол т.пл. 65-68°С. MS (ACPI): m/e 304,2 (M+1). Аналіз (110мл) і охолодити до температури 5°С. Крапля для C16H21N3O3: обчислено: С, 63,35; Н, 6,98; N, за краплею додати концентровану H2SO4 (96%, 13,85; встановлено: С, 63,26; Н, 6,99; N, 13,71. 11,08мл) з одночасним підтриманням температури За способом Прикладу 28 одержали такі спона рівні нижче 10°С. Нагрівати зі зворотним хололуки: дильником. Через 4год охолодити та вилити до а) N-трет-бутоксикарбоніл-2-(6-амідо-1Н-індолсуміші льоду/води, довести рН до приблизно 9 та 3-іл)етиламін: MS (ACPI): m/e 302,3 (M-1). екстрагувати етилацетатом. Об'єднати органічні Приклад 30 екстракти, промити розсолом, висушити (Na2SO4), 5-амідотриптамін після чого концентрувати з одержанням залишку. Розчинити N-тpет-бутоксикарбоніл-2-(5-амідоХроматографувати залишок на силікагелі з елюю1Н-індол-3-іл)етиламін (1,83г, 6,04ммоль) у діоксаванням хлороформом з одержанням, після випані (25,0мл). Крапля за краплею додати 4М розчин рювання, цільової сполуки: т.пл. 72-75°С. MS НСI у діоксані (7,5мл). Через 18год відфільтрувати (ACPI): m/e 189,9 (М+1). тверду речовину і промити діетиловим ефіром з Приклад 34 одержанням, після висушування, цільової сполуки 3-(2-нітровініл)-6-етоксикарбоніл-1Н-індол у вигляді гідрохлориду: т.пл. 192-195°С. MS Змішати 1-диметиламіно-2-нітроетилен (1,93г, (ACPI): m/e 202,0 (M+1). 16,58ммоль) та трифтороцтову кислоту (10,0мл) і За способом Прикладу 30 одержали такі споперемішувати до розчинення. Додати 6луки: а) 6-амідотриптамін: т.пл. 169-173°С. MS етоксикарбоніл-1Н-індол (3,14г, 16,58ммоль), і (ACPI): m/e 204,1 (M+1). перемішувати при температурі навколишнього Приклад 32 середовища. Через 1год вилити реакційну суміш 5-(4-фторфеніл)триптамін до суміші льоду/води, екстрагувати етилацетатом, після чого випарити з одержанням залишку. Пере 47 76451 48 мішати залишок у теплому етанолі, охолодити до Змішати 1-метил-4-трифторметоксибензол температури навколишнього середовища, потім (5,44г, 30,87ммоль) та H2SO4 (96%, 30,9мл). Оховідфільтрувати та висушити з одержанням цільолодити до температури приблизно 0°С. Крапля за вої сполуки у вигляді порошку темно-жовтого кокраплею додати димлячу HNO3 (2,06г, льору: т.пл. 241°С. MS (ACPI): m/e 261,1 (М+1). 32,72ммоль) з одночасним підтримуванням темАналіз для C13H12N2O4: обчислено: С, 60,00; Н, ператури на рівні нижче 10°С. Після завершення 4,65; N, 10,76; встановлено: С, 59,99; Н, 4,63; N, додання нагріти до температури навколишнього 10,59. середовища. Через 2,5год вилити одержану суміш Приклад 35 у суміш льоду/води, екстрагувати дихлорметаном. 3-(2-нітроетил)-6-етоксикарбоніл-1Н-індол Об'єднати органічні екстракти, промити розсолом, Змішати 3-(2-нітровініл)-6-етоксикарбоніл-1Нвисушити (Na2SO4), після чого концентрувати з індол (4,0г, 15,37ммоль) та NaBH4 (726,7мг, одержанням залишку. Хроматографувати залишок 19,21ммоль) у 100мл суміші тетрагідрофурана силікагелі з елююванням сумішшю гексану/метанолу (9:1) і перемішувати при температурі ну/етилацетату (75/25) з одержанням після випанавколишнього середовища. Через 1,5год конценрювання 1-метил-2-нітро-4трувати з одержанням залишку. Розподілити затрифторметоксибензолу: MS (ACPI): m/e 220,1 лишок між розсолом та етилацетатом, промити (M-1). розсолом, об'єднати органічні шари, висушити Змішати 1-метил-2-нітро-4(Na2SO4), потім випарити з одержанням цільової трифторметоксибензол (3,73г, 16,86ммоль), піросполуки у вигляді порошку жовтого кольору: т.пл. лідин (1,32г, 18,55ммоль), Ν,Ν124-127°С. MS (ACPI): m/e 263,0 (М+1). Аналіз для диметилформаміддиметилацеталь (6,03г, C13H14N2O4: обчислено: С, 59,54; Н, 5,38; N, 10,68; 50,58ммоль) та сухий диметилформамід (35мл). встановлено: С, 59,40; Н, 5,36; N, 10,53. Нагріти до температури приблизно 105°. Через За способом Прикладу 35 одержали такі спо19год видалити диметилформамід під зниженим луки: тиском з одержанням маслянистого залишку. Зміa) 3-(2-нітроетил)-6-ціан-1Н-індол: m/e 214,1 шати залишок та етилацетат, промити розсолом, (М-1). Аналіз для C11H9N3O2: обчислено: С, 61,39; висушити (Na2SO4), після чого концентрувати з Н, 4,22; N, 19,52; встановлено: С, 61,05; Н, 4,09; N, одержанням N,N-диметил-2-(2-нітро-419,19. трифторметоксифеніл)вініламіну. b) 3-(2-нітроетил)-6-бром-1Н-індол; Змішати N,N-диметил-2-(2-нітро-4c) 3-(2-нітроетил)-6-метансульфоніл-1Н-індол; трифторметоксифеніл)вініламін т.пл. 162-164°С. MS (ACPI): m/e 269,1 (М+1). (4,64г, 16,8ммоль) та нікель Ренея (900мг) у d) 3-(2-нітроетил)-6-бензолсульфоніл-1Н-індол етанолі (100мл). Гідрогенізувати під тиском (виняток: було використано 75мл THF). 60фунт/дюйм2 (410кПа) та при температурі навкоПриклад 36 лишнього середовища. Через 18год профільтру6-етоксикарбонілтриптамін вати через шар целіту, концентрувати фільтрат з Змішати Pt2O (440мг) та розчин 3-(2одержанням залишку і хроматографувати на силінітроетил)-6-етоксикарбоніл-1Н-індолу (3,55г, кагелі з елююванням сумішшю гекса13,54ммоль) у етилацетаті (100мл). Гідрогенізувану/етилацетату (30/70) з одержанням після випати під тиском 60фунт/дюйм2 (410кПа) та при темрювання цільової сполуки у вигляді порошку не пературі навколишнього середовища. Через 4год зовсім білого кольору: т.пл. 59°С. MS (ACPI): m/e профільтрувати через шар целіту, і концентрувати 200,0 (M-1). фільтрат з одержанням залишку. ХроматографуПриклад 39 вати залишок на силікагелі з елююванням суміш2-фенілфенетиламін шю дихлорметану/2N розчину NH3 (метанол) Змішати 2-фенілфенілацетонітрил (4,69г, (85/15) з одержанням після випарювання цільової 24,26ммоль) та діетиловий ефір (10мл) і крапля за сполуки у вигляді порошку не зовсім білого кольокраплею додати до охолодженого (-10°С) розчину ру: т.пл. 127-131°С. MS (ACPI): m/e 233,0 (М+1). LiAIH4 (2,76г, 72,81ммоль) у діетиловому ефірі Аналіз для C13H16N2O2: обчислено: С, 67,22; Н, (100мл). Нагріти до температури навколишнього 6,94; N, 12,06; встановлено: С, 66,87; Н, 6,86; N, середовища. Через 2год швидко припинити реак11,86. цію доданням холодного насиченого розчину суЗа способом Прикладу 36 одержали такі спольфату натрію (100мл/моль). Осад відфільтрувалуки: ти, одержаний фільтрат висушити (Na2SO4), а) 6-ціанотриптамін: т.пл. 144-147°С. MS профільтрувати і концентрувати з одержанням (ACPI): m/e 186,0 (М+1). Аналіз для С11Н11N3: обзалишку. Хроматографувати залишок на силікагелі числено: С, 71,33; Н, 5,99; N, 22,69; встановлено: з елююванням сумішшю дихлорметану/2N розчину С, 71,10; Η, 5,89; Ν, 22,38. NH3 (метанол) (95/5) з одержанням цільової сполуb) 6-метансульфонілтриптамін: т.пл. 149ки у вигляді масла жовтого кольору. Одержати 153°С. MS (ACPI): m/e 239,1 (М+1). Аналіз для хлористоводневу сіль у діетиловому ефірі: т.пл. C11H14N2O2S: обчислено: С, 55,44; Н, 5,92; N, 197-199°С. MS (ACPI): m/e 198,1 (М+1). Аналіз для 11,76; встановлено: С, 55,12; Н, 5,82; N, 11,97. C14H16CIN: обчислено: С, 71,94; Н, 6,90; N, 5,99; c) 6-бензолсульфонілтриптамін: т.пл. 169встановлено: С, 72,15; Н, 6,84; N, 6,09. 172°С. MS (ACPI): m/e 301,0 (М+1). Приклад 40 Приклад 38 7-хлор-1Н-індол 6-трифторметокси-1Н-індол За способом J. Med. Chem. (1990, 33, 2777), крапля за краплею додати розчин 2-хлораніліну 49 76451 50 (5,8г, 45,45ммоль) у безводному толуолі (80мл) до кислоти, який може використовуватись без додатхолодного 1M розчину ВСІ3 (50мл) у дихлорметані. кового очищення. Після завершення додання, перемішувати реакЗа процедурою, опис якої наведено у J. Org. ційну суміш при температурі 0°С впродовж 10хв. Chem. 1997, 62, 6507, змішати етиловий ефір N-(2Через 10хв при температурі 0°С, 5 рівними порцібром-5-трифторметилфеніл)карбамінової кислоти ями впродовж 45хв додати хлорацетонітрил (34,33г, 110ммоль), триетиламін (300мл), дихлор(13,72г, 11,53мл, 181,8ммоль, 4екв.) та трихлорид біс(трифенілфосфін)паладій (II) (5,4г, 7,7ммоль) та алюмінію (6,67г, 50ммоль, 1,1екв.), після чого найодид міді (І) (1,47г, 7,7ммоль). Видалити розчин грівати зі зворотним холодильником (~65°С). Через темного кольору, двічі заповнити N2, після чого з 6год охолодити до кімнатної температури. Через енергійним перемішуванням швидко додати (три16год охолодити реакційну суміш на льодяній бані, метилсиліл)ацетилен (16,21г, 165ммоль, 23,32мл). додати 2N розчин НСI (61,4мл), після чого нагріти Нагріти до температури 80°С. Коли за даними тонреакційну суміш до кипіння. Через 45хв охолодити кошарового хроматографування буде підтверджена льодяній бані, нейтралізувати кислоту 2N розна відсутність вихідного матеріалу, додати воду та чином NaOH із підтримуванням температури реакEt2O, профільтрувати через шар целіту і випарити ційної суміші на рівні нижче 15°С, доки рівень рН фільтрат in vacuo з одержанням залишку. Розбане досягне приблизно 5. Перенести реакційну сувити залишок водою, екстрагувати Et2O, об'єднати міш до ділильної лійки і видалити органічний шар. органічні шари і випарити з одержанням масла Екстрагувати водний шар дихлорметаном темно-брунатного кольору. Абсорбувати масло силікагелем і внести до короткої силікагелевої ко(2 200мл). Об'єднати органічні шари, висушити лонки, урівноваженої 100% гексаном. Промити над MgSO4, профільтрувати і видалити розчинник 100% гексаном (2л) і елюювати продукт 1% розчиin vacuo з одержанням 1-(2-аміно-3-хлорфеніл)-2ном EtOAc у гексані. Об'єднати фракції, що містять хлоретанону, який можна використовувати без продукт і видалити розчинник in vacuo з одержандодаткового очищення. ням 5-трифторметил-2Розчинити 1-(2-аміно-3-хлорфеніл)-2триметилсиланілетинілфеніламіну у вигляді масла хлоретанон (7,0г, 34,30ммоль) в 10% водному розчервоного/брунатного кольору; MS (IS): m/z 330 чині 1,4-діоксану (75мл). Обережно додати NaBH4 (М+Н)+. (2,6г, 68,6ммоль, 2екв.) у вигляді твердої речовиОбережно додати NaH (10,83г, 60% розчин у ни. Нагріти до кипіння. Через 4год охолодити до маслі, 270,8ммоль, 4екв.) до EtOH (200мл). Після кімнатної температури, розбавити водою (300мл) охолодження додати розчин 5-трифторметил-2та екстрагувати дихлорметаном (2 200мл). Об'єдтриметилсиланілетинілфеніламіну (22,3г, нати органічні шари, висушити над MgSO4, профі67,7ммоль) у EtOH (400мл) з енергійним перемільтрувати та видалити розчинник in vacuo з одершуванням. Через 2год нагрівати зі зворотним хожанням у колбі масла світло-брунатного кольору. лодильником. Через 4год випарити in vacuo для Очистити масло засобами високоефективної рівидалення EtOH, розбавитиодержаний осад водинної хроматографії (силікагелева рухома фаза: дою і екстрагувати Et2O. Об'єднати органічні шари, 100% гексан:50% розчин EtOAc у гексані впродовж промити розсолом, висушити над MgSO4, профі50хв) з одержанням цільової сполуки у вигляді льтрувати і випарити з одержанням масла темного масла брунатного кольору: 1Н ЯМР (300МГц, d6кольору. Абсорбувати масло силікагелем і внести DMSO-d6): 5,16 (m, 1Н), 5,39 (d, 1H), 5,70 (bs, 1H), до короткої силікагелевої колонки. Промити 20% 6,59 (t, 1H), 7,09 (m, 2H); MS (ES+) (масрозчином EtOAc у гексані. Об'єднати фракції, що спектрометрія з пружним розсіюванням): m/z 154, містять продукт і видалити розчинник з одержан152 (M+H)+. ням масла темно-брунатного кольору. Піддати За способом Прикладу 40 одержали такі спомасло додатковому очищенню засобами високоелуки: фективної рідинної хроматографії (колонка з діока) 5-бром-7-етил-1Н-індол: 1Н ЯМР (300МГц, сидом кремнію) із застосуванням градієнта від 1% d6-DMSO-d6): 1,25 (t, 3Н), 2,85 (m, 2Н), 6,41 (m, 1Н), розчину Et2O у гексані до 15% розчину Et2O у гек7,02 (Μ, 1H), 7,36 (m, 1H), 7,55 (m, 1H), 11,28 (bs, сані. Об'єднати фракції, що містять продукт і ви1H); MS(ES+): m/z 224, 226 (M+H)+; аналіз для далити розчинник з одержанням цільової сполуки C10H10BrN: обчислено; С, 53,60; Η, 4,50; Ν, 6,25; у вигляді твердої речовини оранжевого кольору: встановлено; С, 53,50; Η, 4,34; Ν, 6,22. 1 Н ЯМР (300МГц, d6-DMSO-d6): 6,58 (m, 1Н), 7,28 Приклад 42 (m, 1H), 7,61 (t, 1H), 7,74 (m, 2H), 11,51 (bs, 1H); 6-трифторметил-1Η-індол MS(EI+): m/z 185 (M+). Змішати 2-бром-5-трифторметилфеніламін За способом Прикладу 42 одержали такі спо(27,06г, 112,74ммоль) та 200мл піридину. Охололуки: а) 5-ізопропіл-1Н-індол: MS(ES+): m/z 160 дити на льодяній бані та додати етилхлороформі(М+Н)+; (ES)-: m/z 158 (M-Η)-. ат (18,35г, 169,11мл, 1,5екв.). Після закінчення Приклад 44 додання витримати реакційну суміш із повільним 6-фтор-5-метокси-1Н-індол нагріванням до кімнатної температури. Через Розчинити димлячу азотну кислоту (24мл) у 18год випарити in vacuo з одержанням залишку. концентрованій H2SO4 у круглодонній колбі. За Розчинити залишок у суміші Еt2О/вода і перенести допомогою піпетки крапля за краплею з енергійдо ділильної лійки. Відокремити шари, екстрагуваним перемішуванням додати 3,4ти водний шар Et2O (2 300мл), об'єднати органічні дифторбромбензол (20г, 104ммоль). Після завершари, висушити над MgSO4, профільтрувати та шення додання перемішувати реакційну суміш при випарити in vacuo з одержанням етилового ефіру кімнатній температурі впродовж 2год, вилити реаN-(2-бром-5-трифторметилфеніл)карбамінової 51 76451 52 кційну суміш у суміш води з льодом та екстрагуваЗа способом Прикладу 42 і з використанням 2бром-4-(трифторметокси)аніліну одержують етити Et2O (2 250мл). Зібрати та об'єднати органічні ловий ефір Ν-(2-бром-4шари, висушити над MgSO4, профільтрувати, і трифторметоксифеніл)карбамінової кислоти: 1Н видалити розчинник з одержанням 1-бром-4,5ЯМР (300МГц, CDCl3): 1,34 (t, 3Н), 4,25 (m, 2Н), дифтор-2-нітробензолу у вигляді масла світло7,19 (m, 1Н), 7,41 (m, 1H), 8,20 (d, 1H); MS(ES-): жовтого кольору. m/z 326, 328 (M-H)-; аналіз для C10H9BrF3NO3: обДодати 1-бром-4,5-дифтор-2-нітробензол (24г, числено; С, 36,6096; Η, 2,7650; Ν, 4,2692; встанов100ммоль) до розчину метоксиду натрію (1,2екв.) у лено; С, 36,50; Η, 2,67; Ν, 3,97; з якого одержують МеОН. Після завершення додання, перемішувати етиловий ефір N-(4-трифторметокси-2реакційну суміш при кімнатній температурі впротриметилсиланілетинілфеніл)карбамінової кислодовж 2,5год. Видалити розчинник in vacuo. розбати; з якого одержують цільову сполуку у вигляді вити залишок водою і екстрагувати Et2O масла жовтого кольору: MS(ES-): m/z 200 (M-H)-. (2 250мл). Об'єднати органічні шари, висушити Приклад 47 над MgSO4, профільтрувати і видалити розчинник 4-феніл-1Н-індол in vacuo з одержанням 1-бром-4-фтор-5-метокси-2За способом Каррера (Carrera) та Шеппарда нітробензолу у вигляді твердої речовини жовтого (Sheppard) у Synlett. 1994, 93-94, цільову сполуку кольору: 1Н ЯМР (300МГц, CDCl3): 3,99 (s, 3Н), одержують із 4-броміндолу: 1Н ЯМР (300МГц, d67,26 (m, 1Н), 7,83 (d, 1H); MS(FD+) (масDMSO-d6): 6,56 (m, 1Н), 7,08 (m, 1H), 7,17 (m, 1H), спектрометрія з польовою десорбцією): m/z 249, 7,43 (m, 5H), 7,67 (m, 2H), 11,27 (bs, 1H); MS(ES+): 251 (М+); аналіз для C7H5BrFNO3: обчислено: С, m/z 194 (M+H)+; (ES-): m/z 192 (M-H)-. 33,63; Н, 2,02; N, 5,60; встановлено: С, 33,79; Н, Приклад 48 1,98; N, 5,62. (2-нітро-5-трифторметилфеніл)-ацетонітрил Змішати 1-бром-4-фтор-5-метокси-2За способом Liebigs Ann. Chem. 1988, 203-208, нітробензол (20,5г, 82ммоль) та Pt на деревному цільову сполуку одержують із використанням 4вугіллі (сульфідовану) у тетрагідрофурані (600мл) нітробензотрифториду (15г, 78,49ммоль): MS(ES-): та гідрогенізувати під тиском 60фунт/дюйм2 m/z 229 (M-H)-. (414кПа) впродовж 4год. Профільтрувати реакційПриклад 49 ну суміш через шар целіту для видалення каталі5-трифторметил-1Н-індол затора і видалити розчинник з одержанням 2За способом Liebigs Ann. Chem. 1988, 203-208, бром-5-фтор-4-метоксіаніліну у вигляді твердої цільову сполуку у вигляді твердої речовини білого речовини брунатного кольору, яка може викорискольору одержують з використанням (2-нітро-5товуватись без додаткового очищення. 1 трифторметилфеніл)ацетонітрилу: Н ЯМР За способом Прикладу 42, із застосуванням 2(300МГц, d6-DMSO-d6): 6,60 (m, 1Н), 7,36 (m, 1H), бром-5-фтор-4-метоксіаніліну, одержують етило7,53 (m, 1H), 7,57 (m, 1H), 7,94 (m, 1H), 11,51 (bs, вий ефір Ν-(2-бром-5-фтор-41H); MS(ES-): m/z 184 (M-H)-. метоксифеніл)карбамінової кислоти у вигляді тве1 Приклад 50 рдої речовини брунатного кольору: Н ЯМР 3-форміл-4-метокси-1Н-індол (300МГц, CDCl3): 1,33 (t, 3Н), 3,85 (s, 3Н), 4,23 (q, З енергійним перемішуванням до диметилфо2H), 7,09 (d, 1Н), 7,97 (bd, 1H); MS(FD+): m/z 291, рмаміду (який було охолоджено на льодяній бані) 293 (M+); етиловий ефір Ν-(5-фтор-4-метокси-2додати оксихлорид фосфору (1,1екв.). Після заветриметилсиланілетинілфеніл)карбамінової кислоршення додання перемішувати на льодяній бані ти у вигляді твердої речовини жовтого кольору: впродовж ~10хв, після чого з енергійним переміMS(ES+): m/z 310 (М+Н)+; (ES-): m/z 308 (М-Н)-; і 1 шуванням додати розчин 4-метокси-1Н-індолу (5г) цільову сполуку у вигляді твердої речовини: Н у безводному диметилформаміді. Продовжувати ЯМР (300МГц, CDCl3): 3,93 (s, 3Н), 6,48 (m, 1Н), перемішування при температурі 0°С. Через 1год 7,15 (m, ЗН), 8,11 (bs, 1H); MS(ES+): m/z 166 нагріти до кімнатної температури. Через 16год з (M+H)+; (ES-): m/z 164 (M-H)-; аналіз для C9H8FNO: енергійним перемішуванням обережно додати обчислено: С, 65,45; Η, 4,88; Ν, 8,48; встановлено: 4екв. 2N розчину NaOH. Нагріти до температури С, 65,17; Η, 4,97; Ν, 8,70. приблизно 80°С, після чого охолодити. Вилити Приклад 45 реакційну суміш у холодну воду з енергійним пе5,6-дифтор-1Н-індол ремішуванням з одержанням твердої речовини. За способом Прикладу 42 одержують 2-бромВідфільтрувати тверду речовину і висушити у ва4,5-дифторанілін; з якого одержують етиловий куумній печі при кімнатній температурі з одержанефір N-(2-бром-4,5-дифторфеніл)карбамінової ням цільової сполуки. Підкислити фільтрат і ексткислоти; з якого одержують етиловий ефір N-(4,5рагувати EtOAc. Об'єднати органічні шари і дифтор-2-триметилсиланілетинілпромити 50% розсолом. Зібрати органічний шар, феніл)карбамінової кислоти; з якого одержують висушити (MgSO4), профільтрувати і видалити цільову сполуку у вигляді твердої речовини оранрозчинник з одержанням цільової сполуки у вигляжевого кольору: 1Н ЯМР (300МГц, d6-DMSO-d6): ді твердої речовини світло-пурпурового кольору. 6,43 (m, 1Н), 7,38 (m, 2H), 7,50 (m, 1H), 11,25 (bs, Загальний вихід цільової сполуки дорівнює 5,44г: 1H); MS(ES-): m/z 152 (M-H)-. Аналіз для C8H5F2N: MS (ES+): m/z 175 (М+Н)+, 160 (М-СН3)+; (ES-): m/z обчислено: С, 62,75; Η, 3,29; Ν, 9,15; встановлено: 174 (М-Н)-. С, 62,41; Η, 3,12; Ν, 8,98. За способом Прикладу 50 одержали такі споПриклад 46 луки: 5-трифторметокси-1Η-індол 53 76451 54 1 a) 3-форміл-6-метокси-1Н-індол, 1Н ЯМР q) 3-форміл-4-феніл-1Р-індол, Н ЯМР (300МГц, d6-DMSO): 3,79 (s, 3Н); 6,85 (dd, 1Н); 6,98 (300МГц, d6-DMSO): 7,07 (m, 1Н), 7,30 (m, 1H), 7,46 (m, 1H); 7,92 (d, 1H); 8,15 (s, 1H); 9,86 (s, 1H); 11,92 (m, 6H), 7,53 (m, 1H), 8,20 (bs, 1H), 9,37 (s, 1H), (bs, 1H); MS (ES+): m/z 176 (M+H)+ ;(ES-): m/z 174 12,40 (bs, 1H), MS(ES+): m/z 222 (M+H)+; (ES-): m/z (M-H) ; 220 (М-Н)-; 1 b) 3-форміл-7-метокси-1Н-індол; r) 3-форміл-6-феніл-1Н-індол, Н ЯМР c) 3-форміл-4-хлор-1Н-індол; (300МГц, d6-DMSO): 7,35 (m, 1H), 7,49 (m, 3H), 7,71 d) 3-форміл-6-хлор-1Н-індол, 1Н ЯМР (300МГц, (m, 3H), 8,15 (m, 1H), 8,33 (d, 1H), 9,96 (s, 1H), d6-DMSO-d6): 7,24 (dd, 1H), 7,56 (d, 1H), 8,06 (d, 12,20 (bs, 1H), MS(EI+): m/z 221 (M)+; 1H), 8,33 (s, 1H), 9,93 (s, 1H), 12,21 (bs, 1H); MS s) 3-форміл-5-ізопропіл-1Н-індол, 1H ЯМР (ES+): m/z 182, 180 (M+H)+; (ES-): m/z 180, 178 (M(300МГц, d6-DMSO): 1,24 (d, 6H), 2,99 (m, 1H), 7,15 H)-; (m, 1H), 7,41 (m, 1H), 7,94 (m, 1H), 8,22 (m, 1H), e) 3-форміл-7-хлор-1Н-індол, 1Н ЯМР (300МГц, 9,90 (s, 1H), 12,02 (bs, 1H); MS(ES+): 188 (M+H)+; d6-DMSO): 7,23 (t, 1Н), 7,35 (d, 1H), 8,05 (d, 1H), (ES-): m/z 186 (М-Н)-; 8,38 (bs, 1H), 9,95 (s, 1H), 12,54 (bs, 1H); MS (ES+): t) 3-форміл-4,6-дифтор-5-метокси-1-метил-1Нm/z 182, 180 (M+H)+; (ES-): m/z 180, 178 (M-H)-; індол: 1Н ЯМР (300МГц, CDCl3): 3,81 (s, 3H), 4,02 f) 3-форміл-4-фтор-1Н-індол, 1Н ЯМР (300МГц, (s, 3H), 6,92 (m, 1H), 7,77 (s, 1H), 10,14 (d, 1H); d6-DMSO): 7,01 (m, 1H), 7,24 (m, 1H), 7,36 (d, 1H), MS(ES+): m/z 226 (M+H)+; і 8,30 (s, 1H), 10,03 (d, 1H), 12,48 (bs, 1H); MS (ES+): u) 3-форміл-4,6-дифтор-1-метил-1Н-індол: 1Н m/z 164 (M+H)+; (ES-): m/z 162 (M-H) ; ЯМР (300МГц, d6-DMSO): 3,87 (s, 3Н), 7,10 (m, 1Н), g) 3-форміл-5-метокси-6-трифторметил-1Н7,41 (m, 1H), 8,32 (s, 1H), 9,93 (d, 1H); MS(ES+): індол, 1H ЯМР (300МГц, d6-DMSO): 3,91 (s, 3H), 196 (M+H)+. 7,77 (dd, 1H), 7,95 (bs, 1H), 8,42 (s, 1H), 9,96 (s, Приклад 51 1H), 12,29 (bs, 1H); MS (ES+): m/z 244 (M+H)+; (ES3-(2-нітровініл)-4-метокси-1Η-індол ): m/z 242 (M-H)-; Змішати ацетат амонію (висушений після обh) 3-форміл-6-хлор-5-метокси-1H-індол, 1H робки толуолом та видалення толуолу in vacua) у ЯМР (300МГц, d6-DMSO): 3M88 (s, 3H), 7,58 (s, вигляді твердої речовини (0,75екв.), нітрометан 1H), 7,71 (s, 1H), 8,26 (s, 1H), 9,91 (s, 1H), 12,08 (20екв.) та 4-метокси-1H-індол-3-карбальдегід (bs, 1H); MS (ES+): m/z 210, 212 (M+H)+ ; (ES-): m/z (5,4г; 30,82ммоль). Нагріти до температури приб208, 210 (M-H)-; лизно 65°С. Після того як за даними тонкошаровоі) 3-форміл-4-хлор-5-метокси-1Н-індол, 1H го хроматографування дійдуть висновку про наЯМР (300МГц, d6-DMSO): 3,89 (s, 3H), 7,13m (dd, ближення реакції до завершення, додати 1H), 7,47 (dd, 1H), 8,23 (s, 1H), 10,5 (s, 1H), 12,39 силікагель та випарити in vacuo для видалення (bs, 1H); MS (ES+): m/z 210, 212 (M+H)+ (ES-): m/z нітрометану. Перенести силікагель із реакційної 208, 210 (M-H)-; суміші до верхньої частини короткої силікагелевої j) 3-форміл-6-трифторметил-1Н-індол, 1Н ЯМР колонки і елюювати 25% розчином ацетону у гек(300МГц, d6-DMSO): 7,52 (d, 1H), 8,27 (d, 1H), 8,51 сані з одержанням, після випарювання, цільової (m, 1H), 9,99 (s, 1H), 12,47 (bs, 1H), MS(ES+): m/z сполуки, яка може використовуватись на наступній 214 (M+H)+; (ES-): m/z 212 (M-H)-; стадії без додаткового очищення. k) 3-форміл-5-метокси-2-метил-1Н-індол, 1Н За способом Прикладу 51 одержали такі спо(300МГц, d6-DMSO): 2,65 (s, 3H), 3,76 (s, 3H), 6,78 луки: (dd, 1H), 7,27 (d, 1H), 7,56 (m, 1H), 10,00 (s, 1H), a) 3-(2-нітровініл)-6-метокси-1Н-індол; 11,85 (bs, 1H); MS(ES+): m/z 190 (M+H)+;(ES-): m/z b) 3-(2-нітровініл)-7-метокси-1Н-індол, 1Н ЯМР 188 (M-H) ; (300МГц; d6-DMSO): 3,95 (s, 3Н), 5,02 (m, 1Н), 6,86 I) 3-форміл-6-фтор-5-метокси-1Н-індол, 1H (d, 1H), 7,17 (t, 1H), 7,50 (d, 1H), 8,38 (d, 1H), 12,40 ЯМР (300МГц, d6-DMSO): 3,87 (s, 3H), 7,35 (d, 1H), (bs, 1Н); MS (ES+): m/z 219 (M+H)+; (ES-): m/z 217 7,71 (d, 1H), 8,21 (s, 1H), 9,89 (s, 1H), 12,03 (bs, 1h); (M-H)-; + MS(ES+): m/z 194 (M+H) ; (ES-): m/z 192 (M-H) ; c) 3-(2-нітровініл)-4-хлор-1Н-індол, 1H ЯМР 1 m) 3-форміл-5,6-дифтор-1H-індол, Н ЯМР (300МГц, d6-DMSO): 5,08 (m, 1H), 7,24 (m, 2H), 7,51 (300МГц, d6-DMSO): 7,56 (m, 1H), 7,92 (m, 1H), 8,36 (dd, 1H), 8,12 (d, 1H), 8,92 (d, 1H), 12,6 (bs, 1H); (s, 1H), 9,92 (s, 1H), 12,25 (bs, 1H); MS(ES+): m/z MS(ES-): m/z 221, 223 (M-H)-; 182 (M+H)+ (ES-): m/z 180 (M-H)-; d) 3-(2-нітровініл)-6-хлор-1Н-індол, 1Н ЯМР 1 n) 3-форміл-6-хлор-5-фтор-1Н-індол, Н ЯМР (300МГц, d6-DMSO): 5,03 (m, 1H), 7,22 (dd, 1H), (300МГц, d6-DMSO): 7,72 (d, 1H), 7,91 (d, 1H), 8,40 7,58 (d, 1H), 8,03 (m, 2H), 8,38 (d, 1H), 12,23 (bs, (s, 1H), 9,93 (s, 1H), 12,29 (bs, 1H); MS(ES+): m/z 1H); MS (ES-): m/z 223, 221 (M-H)-; + 198 (M+H) ; (ES-): m/z 196 (M-H) ; e) 3-(2-нітровініл)-7-хлор-1Н-індол, 1Н ЯМР о) 3-форміл-5-трифторметокси-1H-індол, 1H (300МГц, d6-DMSO): 7,23 (t, 1H), 7,36 (d, 1H), 7,97 ЯМР (300МГц, d6-DMSO): 7,24 (m, 1H), 7,61 (m, (d, 1H), 8,06 (d, 1H), 8,33 (bs, 1H), 8,40 (d, 1H), 1H), 7,97 (bs, 1H), 8,42 (d, 1H), 9,95 (s, 1H), 12,35 12,58 (bs, 1H); MS (ES+): m/z 225, 223 (M+H)+; (ES+ (bs, 1H); MS(ES+): m/z 230 (M+H) ; (ES-): m/z 228 ): m/z 223, 221 (M-H) ; (M-H) ; аналіз для C10H6F3NO2: обчислено; С, f) 3-(2-нітровініл)-4-фтор-1Н-індол, 52,4138; Η, 2,6391; Ν, 6,1122; встановлено; С, g) 3-(2-нітровініл)-5-метокси-6-трифторметил52,70; Η, 2,73; Ν, 6,13; 1Н-індол, MS (ES+): m/z 286 (M+); (ES-): m/z 285 p) 3-форміл-4,6-дифтор-5-метокси-1Н-індол, (M-H)-; + MS(ES+): 212 (Μ+Η) ; (ES-): 210 (М-Н) ; h) 3-(2-нітровініл)-6-хлор-5-метокси-1Н-індол, 55 76451 56 і) 3-(2-нітровініл)-4-хлор-5-метокси-1Н-індол, (m, 1H), 7,30 (d, 1H), 11,19 (bs, 1H); MS(ES+): m/z 1 H ЯМР (300МГц, d6-DMSO): 3,88 (s, ЗН), 5,03 (m, 178, 180 (M+H)+; (ES-): m/z 193 (M-H)-; 2H), 7,13 (d, 1Н), 7,46 (d, 1Н), 8,08 (d, 1H), 12,42 d) 6-хлортриптамін, 1H ЯМР (300МГц, d6(bs, 1H); MS(ES-): m/z 151, 153 (M-H) ; DMSO): 2,89 (t, 2H), 3,42 (t, 2H), 6,96 (dd, 1H), 7,17 j) 3-(2-нітровініл)-6-трифторметил-1Н-індол, (bs, 1H), 7,35 (m, 1H), 7,52 (d, 1H), 10,91 (bs, 1H); + + + MS(ES+): m/z 257 (M+H) ; (ES-): m/z 255 (M-H) ; MS (ES+): m/z 197, 195 (M+H) , 180, 178 (M-NH2) ; k) 3-(2-нітровініл)-5-метокси-2-метил-1Н-індол, (ES-): m/z 195, 193 (M-H) ; 1 Н ЯМР (300МГц, d6-DMSO): 2,58 (s, 3H), 3,84 (s, e) 7-хлортриптамін, 1Н ЯМР (300МГц, d63H), 6,82 (m, 1H), 7,28 (m, 2H), 7,89 (d, 1H), 8,29 (d, DMSO): 2,91 (t, 2H), 3,43 (t, 2H), 6,98 (t, 1H), 7,13 1H), 12,14 (bs, 1H); MS(ES+): m/z 233 (M+H)+; (ES-): (d, 1H), 7,20 (bs, 1H), 7,51 (d, 1H), 11,15 (bs, 1H); m/z 231 (M-H)-; MS (ES+): m/z 197, 195 (M+H)+, 180, 178 (M-NH2)+; I) 3-(2-нітровініл)-6-фтор-5-метокси-1Н-індол; (ES-): m/z 195, 193 (M-H)-; m) 3-(2-нітровініл)-5,6-дифтор-1Н-індол; f) 4-фтортриптамін, n) 3-(2-нітровініл)-6-хлор-5-фтор-1Η-індол; g) 5-метокси-6-трифторметилтриптамін, 1 ο) 3-(2-нітровініл)-5-трифторметокси-1Н-індол; h) 6-хлор-5-метокситриптамін, H ЯМР p) 3-(2-нітровініл)-4,6-дифтор-5-метокси-1Н(300МГц, d6-DMSO): 2,89 (t, 2H), 3,42 (t, 2H), 3,84 індол; (s, 3H), 7,12 (bs, 1H), 7,19 (s, 1H), 7,36 (s, 1H), 8,01 q) 3-(2-нітровініл)-4-феніл-1Н-індол; (bs, 1H); MS (ES+): m/z 225, 227 (M+H)+, 208, 210 r) 3-(2-нітровініл)-6-феніл-1Н-індол; (M-NH2)+; (ES-): m/z 223, 225 (M-H)-; 1 s) 3-(2-нітровініл)-5-ізопропіл-1Н-індол; і) 4-хлор-5-метокситриптамін, H ЯМР t) 3-(2-нітровініл)-4,6-дифтор-5-метокси-1(300МГц, d6-DMSO): 3,10 (t, 2H), 3,43 (t, 2H), 3,81 метил-1Н-індол: 1Н ЯМР (300МГц, d6-DMSO): 3,82 (s, 3H), 6,95 (d, 1H), 7,18 (m, 1H), 7,25 (dd, 1H), (t, 3Н), 3,92 (s, 3Н), 7,53 (m, 1Н), 7,84 (m, 1Н), 8,30 10,93 (bs, 1H); MS(ES+): m/z 208, 210 (M-NH2)+ (ES+ (m, 2H); MS(ES+): m/z 269 (M+H) ; і ): m/z 223, 225 (M-H)-; u) 3-(2-нітровініл)-4,6-дифтор-1-метил-1Нj) 6-трифторметилтриптамін, індол. k) 5-метокси-2-метилтриптамін, 1Н ЯМР Приклад 52 (300МГц, d6-DMSO): 2,28 (s, 3H), 2,80 (t, 2H), 3,31 4-метокситриптамін (bt, 2H), 6,59 (dd, 1H), 6,88 (d, 1H), 7,09 (d, 1H); Змішати LiАІН4 (6,78г; 178,74ммоль; 6екв.) та MS(ES+): m/z 188 (M-NH2)+(ES-): m/z 203 (M-H)-; безводний тетрагідрофуран. Розчинити 3-(21) 6-фтор-5-метокситриптамін; нітровініл)-4-метокси-1Н-індол (6,5г; 29,79ммоль) у m) 5,6-дифтортриптамін; безводному тетрагідрофурані і з енергійним переn) 6-хлор-5-фтортриптамін; мішуванням крапля за краплею додати до розчину о) 5-трифторметокситриптамін; LiАІН4. Після завершення додання нагрівати зі p) 4,6-дифтор-5-метокситриптамін; зворотним холодильником. Через 1год охолодити q) 4-фенілтриптамін; до температури навколишнього середовища і пеr) 6-фенілтриптамін; ремішати. Через 16год різко охолодити надлишок s) 5-ізопропілтриптамін; LiАІН4 за описом у J. Med. Chem. 1995, 38, 2050. t) 4,6-дифтор-5-метокси-1-метилтриптамін: 1Н Профільтрувати суспензію сірого кольору через ЯМР (300МГц, CDCl3): 3,0 (m, 4Н), 3,67 (s, 3Н), шар целіту та промити целіт етилацетатом. Випа3,98 (s, ЗН), 6,85 (m, 2H); і рити фільтрат in vacuo з одержанням залишку. u) 4,6-дифтор-5-метокси-1-метилтриптамін: 1Н Хроматографувати залишок на силікагелі з елююЯМР (300МГц, d6-DMSO): 2,92 (t, 2Н), 3,39 (t, 2Н), ванням 1л суміші СНСІ3/МеОН/NH4ОН (95:10:1), 3,69 (s, ЗН), 6,75 (m, 1Н), 7,13 (m, 2H); MS(ES+): потім 1л суміші CHCl3/MeOH/NH4OH (90:10:1), як m/z 211; (M+H)+ 194 (M-NH2)+. рухомої фази. Об'єднати фракції, що містять проПриклад 53 дукт, і випарити з одержанням цільової сполуки у Гідрохлорид 4-метокситриптаміну вигляді твердої речовини жовто-брунатного коРозчинити 4-метокситриптамін (1г, 5,26ммоль) льору: 1Н ЯМР (300МГц, d6-DMSO): 2,96 (t, 2Н); в МеОН і додати NH4CI (0,97екв, 0,27г, 3,42 (t, 2Н); 3,83 (s, 3Н); 6,42 (dd, 1Н); 6,93 (m, 3H); 5,10ммоль). Через 30хв випарити in vacuo для 10,7 (s, 1H); MS (ES+): m/z 191 (M+H)+; 174 (Mвидалення МеОН з одержанням густого масла NH2)+; 159 (M-OCH3)+; (ES-): m/z 189 (M-H)-. оранжевого кольору. Розчинити масло у МеОН, і За способом Прикладу 52 одержали такі спокрапля за краплею з енергійним перемішуванням луки: додати до Et2O (200мл) з одержанням клейкого a) 6-метокситриптамін, 1Н ЯМР (300МГц; d6осаду білого кольору. Перемішати з нагріванням з DMSO): 2,86 (t, 2H); 3,42 (t, 2Н); 3,75 (s, 3Н); 6,62 одержанням цільової сполуки у вигляді твердої (dd, 1Н); 6,83 (m, 1H); 6,97 (bs, 1H); 7,37 (m, 1H); речовини: 1Н ЯМР (d6-DMSO, 300МГц): 3,06 (bs, 4 10,55 (s, 1H); MS (ES+): m/z 191 (M+H)+; 174 (MΗ); 3,86 (s, 3Н); 6,46 (dd, 1H); 7,06-6,9 (m, 3Н); 7,93 NH2)+; (ES-): m/z 189 (ΜΗ)-; (bs, 1H); 10,9 (s, 1H); MS (ES+): m/z 191 (M+H)+; b) 7-метокситриптамін, 1H ЯМР (300МГц, d6175 (M-CH3)+; 174 (M-NH2)+; (ES-): 189 (M-H)-; анаDMSO): 2,88 (t, 2H), 3,42 (t, 2H), 3,89 (s, 3H), 6,61 ліз для С11Н15СIN2О: обчислено: С, 58,2788; Η, (d, 1H), 6,89 (t, 1H), 7,02 (m, 1H), 7,10 (d, 1H), 10,85 6,6692; Ν, 12,3566; встановлено С, 58,18; Η, 6,73; (bs, 1H); MS (ES+): m/z 191 (M+H)+, 174 (M-NH2)+; Ν, 12,15. (ES-): m/z 189 (M-H)-; Приклад 54 c) 4-хлортриптамін, 1Н ЯМР (300МГц, d6Гідрохлорид 5,6-дифтортриптаміну DMSO): 3,11 (t, 2H), 3,44 (t, 2H), 6,99 (m, 2H), 7,22 Цільову сполуку одержують за способом Прикладу 53: 1Н ЯМР (300МГц, d6-DMSO): 2,97 (m, 57 76451 58 4Н), 7,27 (m, 1Н), 7,36 (m, 1H), 7,53 (m, 1H), 11,20 ацетоні. Нагріти і додати Et2O до точки помутніння, (bs, 1H); MS(ES+): m/z 197 (M+H)+, 180 (M-NH2)+; після чого на ніч помістити до морозильної камери (ES-): m/z 195 (M-H)-. з одержанням цільової сполуки у вигляді кристаліПриклад 55 чної твердої речовини білого кольору: 1Н ЯМР Гідрохлорид 4-фенілтриптаміну (300МГц, d6-DMSO): 3,02 (m, 4Н), 7,06 (m, 1Н), 7,39 Розчин НСI (4,6мл 4Μ розчину НСI у 1,4(m, 1H), 7,45 (d, 1H), 7,55 (m, 1H), 11,30 (bs, 1H), діоксані) крапля за краплею додати до розчину 4MS(ES+): m/z 245 (M+H)+, 228 (M-NH2)+; (ES-): m/z фенілтриптаміну (3,33г, 14,09ммоль) у суміші 243 (M-H)-; аналіз для С11Н11F3N2O: обчислено; С, EtOAc/Et2O з одержанням твердої речовини. Від46,7144; Η, 3,9203; Ν, 8,3809; встановлено; С, фільтрувати тверду речовину і висушити впродовж 46,55; Η, 3,62; Ν, 8,27. ночі у вакуумній печі при кімнатній температурі з Використовуючи метод Прикладу 58 одержали одержанням цільової сполуки у вигляді твердої такі сполуки: а) Оксалат 4,6-дифтор-5речовини не зовсім білого кольору: 1Н ЯМР метокситриптаміну: 1Н ЯМР (300МГц, d6-DMSO): (300МГц, d6-DMSO): 2,54 (m, 4Н), 6,82 (m, 1Н), 7,14 3,04 (m, 4H), 3,85 (s, 3Н), 7,10 (m, 1H), 7,22 (m, 1H), (t, 1H), 7,27 (m, 1H), 7,41 (m, 5H), 7,68 (bs, 2H), 11,29 (bs, 1H); MS(ES+): m/z 227 (M+H)+; (ES-): m/z + 11,28 (bs, 1H); MS(ES+): m/z 237 (M+H) , 220 (M225 (M-H)-; аналіз для C13H14F2N2O5: обчислено; С, + NH2) ; (ES-): m/z 235 (M-H) ; аналіз для C16H17CIN2; 49,3718; Η, 4,4620; Ν, 8,8576; встановлено; С, Обчислено; С, 70,4517; Η, 6,2818; Ν, 10,2696; 49,68; Η, 4,57; Ν, 8,60. встановлено; С, 70,26; Η, 6,16; Ν, 10,20. Приклад 60 Приклад 56 Оксалат 4-фтортриптаміну Гідрохлорид 5-хлор-6-фтортриптаміну Розчин щавлевої кислоти (1,44г, 1,2екв.) у Цільову сполуку одержують за способом Приацетонітрилі додати крапля за краплею з енергійкладу 55: 1Н ЯМР (300МГц, d6-DMSO): 3,00 (m, ним перемішуванням до розчину 44Н), 7,37 (m, 1H), 7,53 (d, 1H), 7,59 (d, 1H), 11,28 фтортриптаміну у ацетонітрилі. Нагріти і додати (bs, 1H); MS(ES+): m/z 213 (M+H)+, 196, 198 (MМеОН з одержанням розчину. Додати Et2O до точNH2)+; (ES-): m/z 211, 213 (M-H)-. ки помутніння, і охолодити розчин у морозильній Приклад 57 камері з одержанням твердої речовини. ВідфільтОксалат 4-хлортриптаміну рувати тверду речовину і впродовж ночі висушити Розчин щавлевої кислоти (1,32г, 1,3екв.) у у вакуумній печі при температурі 45°С з одержанМеОН додати крапля за краплею з енергійним ням цільової сполуки у вигляді твердої речовини перемішуванням до розчину 4-хлортриптаміну у жовто-брунатного кольору: 1Н ЯМР (300МГц, doEtOAc (2,2г, 11,3ммоль). Після завершення доданDMSO): 3,07 (m, 4Н), 6,73 (m, 1Н), 7,04 (m, 1H), ня додати Et2O до точки помутніння і помістити до 7,22 (m, 2H), 11,30 (bs, 1H); MS (ES+): m/z 179 морозильної камери з одержанням твердої речо(M+H)+; (ES-): m/z 177 (M-H)-. вини. Відфільтрувати тверду речовину і промити Приклад 61 простим ефіром. Висушити у вакуумній печі при Оксалат 6-фтор-5-метокситриптаміну кімнатній температурі з одержанням цільової споРозчин щавлевої кислоти (3,91г, 1,2екв.) у луки у вигляді твердої речовини не зовсім білого МеОН додати крапля за краплею з енергійним кольору: 1Н ЯМР (300МГц, d6-DMSO): 3,11 (m, 2H), перемішуванням до розчину 6-фтор-53,2 (m, 2H), 7,04 (m, 2H), 7,34 (m, 2H), 11,44 (bs, метокситриптаміну у EtOAc/МеОН. Додати Et2O з 1H); MS (ES+): m/z 195 (M+H)+, 178 (M-NH2)+; (ES-): одержанням твердої речовини, відфільтрувати m/z 193 (M-H)-; аналіз для C12H13CIN2O4: обчислетверду речовину і впродовж ночі висушити у вакуно: С, 50,6263; Η, 4,6026; Ν, 9,8396; встановлено: умній печі при температурі 60°С з одержанням С, 50,56; Η, 4,57; Ν, 9,66. цільової сполуки: 1H ЯМР (300МГц, d6-DMSO): 3,0 Використовуючи метод Прикладу 57 одержали (m, 4Н), 3,85 (s, 3Н), 7,21 (m, 3Н), 10,89 (bs, 1Н); такі сполуки: MS(ES+): m/z 209 (M+H)+; аналіз для C13H15FN2O5: a) Оксалат 6-фенілтриптаміну: 3,05 (m, 4Н), обчислено: С, 52,3496; Η, 5,0690; Ν, 9,3919; вста7,31 (m, 3Н), 7,45 (t, 2H), 7,65 (m, 4Н), 11,10 (bs, новлено: С, 52,06; Η, 4,91; Ν, 9,20. 1Н), MS(ES+): m/z 237 (M+H)+, 220 (M-NH2)+; (ES-): Приклад 62 m/z 235 (M-H); 2-(2-(7-фтор-1Н-індол-3-іл)етил)ізоіндол-1,3b) Оксалат 4,6-дифтор-5-метокситриптаміну: діон 1 Н ЯМР (300МГц, d6-DMSO): 3,04 (m, 4H), 3,85 (s, Змішати 2-фторгідразину гідрохлорид (3,25г, 3H), 7,10 (m, 1H), 7,22 (m, 1H), 11,29 (bs, 1H); 20ммоль) та 2-(4,4-діетоксибутил)-ізоіндол-1,3-діон MS(ES+): m/z 227 (M+H)+; (ES-): m/z 225 (M-H)-; (6,99г, 24ммоль) і розчинити у 4% водному розчині аналіз для C13H14F2N2O5: обчислено; С, 49,3718; Η, H2SO4. Нагрівати реакційну суміш зі зворотним 4,4620; Ν, 8,8576; встановлено; С, 49,68; Η, 4,57; холодильником. Через 2год охолодити до темпеΝ, 8,60; і ратури навколишнього середовища. Підвищити c) Оксалат 5-ізопропілтриптаміну: 1Н ЯМР основність реакційної суміші за допомогою 30% (300МГц, dg-DMSO): 1,25 (d, 6Н), 3,01 (m, 4Н), 6,99 водного розчину NH4OH до рН приблизно 11. Екс(m, 1Н), 7,17 (m, 1H), 7,27 (m, 1H), 7,36 (bs, 1H), трагувати дихлорметаном (2 100мл). Об'єднати 10,85 (bs, 1H); MS(ES+): m/z 203 (M+H)+, 186 (Mорганічні фази, висушити над MgSO4, профільтруNH2)+; (ES-): m/z 201 (M-H)-. вати і видалити розчинник з одержанням масла Приклад 58 оранжевого кольору. Абсорбувати масло силікагеОксалат 5-трифторметокситриптаміну лем і внести до верхньої частини короткої силікаРозчин щавлевої кислоти (1,3екв.) у ацетоні гелевої колонки, урівноваженої 15% розчином додати до розчину 5-трифторметокситриптаміну у EtOAc у гексані. Промити 15% розчином EtOAc у 59 76451 60 гексані (1500мл), потім 30% розчином EtOAc у гекЗмішати 1,3-дифтор-2-метокси-5-нітробензол сані (2000мл) з одержанням, після випарювання, (10,12г, 53,51ммоль) та 4-хлорфеноксіацетонітрил цільової сполуки у вигляді твердої речовини жов(11,21г, 66,89ммоль, 1,25екв.) у диметилсульфоктого кольору: 1Н ЯМР (300МГц, d6-DMSO): 3,03 (t, сиді (150мл). Впродовж 5год крапля за краплею 2H), 3,85 (t, 2H), 6,91 (m, 2H), 7,25 (m, 1Н), 7,36 (d, додати до суспензії твердий NaOH (порошкоподіб1H), 7,83 (m, 4H), 11,32 (bs, 1H); MS (FD): m/z 308 ний, 10,70г, 267,55ммоль, 5екв.). Через 18год ви(M+). лити реакційну суміш до холодного водного розчиПриклад 63 ну НСI і екстрагувати Et2O (2 150мл). Об'єднати Оксалат 7-фтортриптаміну органічні шари, промити розсолом і випарити з Розчинити 2-(2-(7-фтор-1Н-індол-3одержанням залишку. Хроматографувати залишок іл)етил)ізоіндол-1,3-діон у 25мл тетрагідрофурану. на силікагелі з елююванням 20% розчином EtOAc Додати з енергійним перемішуванням етаноламін у гексані з одержанням, після випарювання, (2,4(63,4г, 62,65мл, 1038ммоль, 100екв.) і нагріти до дифтор-3-метокси-6-нітрофеніл)ацетонітрилу у температури 70°С. Через 1,5год охолодити до кімвигляді масла жовтого кольору: MS(ES-): m/z 227 натної температури. Через 18год вилити реакційну (М-Н)-. суміш у воду (250мл), що містить 5N розчин NaOH Використання (2,4-дифтор-3-метокси-6(3мл), і екстрагувати Et2O (2 200мл). Об'єднати нітрофеніл)ацетонітрилу у циклізації за описом у органічні шари і промити 0,1Ν розчином NaOH. Israel J. Chem. 1966, 4, 155-159 дає масло. ХромаЗібрати органічний шар, висушити над MgSO4, тографувати масло на силікагелі з елююванням профільтрувати і видалити розчинник in vacuo з 20% розчином EtOAc у гексані з одержанням, після одержанням цільової сполуки у вигляді масла жовипарювання, цільової сполуки у вигляді твердої втого кольору. речовини темно-червоного кольору; 1Н ЯМР Крапля за краплею з енергійним перемішуван(300МГц, d6-DMSO): 3,85 (bs, 3Н), 6,46 (m, 1Н), ням додати розчин щавлевої кислоти (0,62г, 7,12 (d, 1Н), 7,36 (m, 1H), 11,35 (bs, 1H); MS(ES-): 1,2екв.) у МеОН до розчину основи (1,02г, m/z 182 (M-H)-. 5,72ммоль) у EtOAc. Нагрівати каламутну суспенВикористовуючи метод Прикладу 65 одержали зію зі зворотним холодильником впродовж 30хв, такі сполуки: а) 4,6-дифтор-1Н-індол: 1Н ЯМР після чого охолодити з одержанням твердої речо(300МГц, CDCl3): 4,68 (d, 2H), 6,14 (m, 2H), 6,57 вини. Відфільтрувати тверду речовину і висушити (bs, 2Н); MS(ES+): m/z 205, 207 (M+H)+ з якого у вакуумній печі впродовж ночі при температурі одержали цільову сполуку. 60°С з одержанням цільової сполуки у вигляді твеПриклад 66 рдої речовини не зовсім білого кольору: 1Н ЯМР 4,6-дифтор-5-метокси-1-метил-1Н-індол (300МГц, d6-DMSO): 3,04 (m, 4Н), 6,96 (m, 2Н), 7,30 Змішати 4,6-дифтор-5-метокси-1Н-індол (7,5г, (m, 1Н), 7,38 (d, 1H), 11,51 (bs, 1H); MS (ES+): m/z 40,95ммоль) та холодний диметилформамід 179 (M+H)+, 162 (M-NH2)+; (ES-): m/z 177 (M-H)-; (100мл) і обробити суміш NaH (1,8г, 45,05ммоль, аналіз для C12H13FN2O4: обчислено: С 53,7318; Η 1,1екв.) з енергійним перемішуванням. Через при4,8849; Ν 10,4431; встановлено: С, 53,50; Η, 4,86; близно 10хв крапля за краплею додати йодометан Ν, 10,32. (11,62г, 81,90ммоль, 2екв.). Після завершення доПриклад 64 дання, перемішувати реакційну суміш при кімнатОксалат 6-трифторметилтриптаміну ній температурі впродовж декількох годин, доки Додати 6-трифторметилтриптамін до суміші дані тонкошарового хроматографування не вка(1:1) ацетону/Et2О. Крапля за краплею додати розжуть на відсутність вихідного матеріалу. Розбавичин щавлевої кислоти (1,2екв.) у ацетоні з одерти реакційну суміш водою і екстрагувати Et2O жанням твердої речовини. Відфільтрувати тверду (2 150мл). Об'єднати органічні шари, висушити речовину і висушити у вакуумній печі впродовж над MgSO4, профільтрувати і видалити розчинник ночі з одержанням цільової сполуки: MS(ES+): m/z з одержанням масла. Хроматографувати масло на + 212 (M-NH2) ; (ES-): m/z 227 (M-H) . силікагелі з елююванням 10% розчином EtOAc у Приклад 65 гексані з одержанням, після випарювання, цільової 4,6-дифтор-5-метокси-1Н-індол сполуки у вигляді масла світло-жовтого кольору: 1 Розчинити 2,6-дифтор-4-нітрофенол (J. Н ЯМР (300МГц, CDCl3): 3,72 (s, 3Н), 3,97 (s, 3Н), Heterocyclic. Chem. 1976, 13, 1253; 10г, 6,50 (d, 1Н), 6,84 (d, 1H), 6,98 (d, 1H); MS(ES+): m/z 57,11ммоль) у 300мл бензолу. Крапля за краплею 198 (M+H)+; аналіз для C10H9F2NO: обчислено: додати розчин 1-метил-3-р-толілтриазену (9,37г, C,60,91; Η, 4,60; Ν, 7,10; встановлено: С, 60,93; Η, 62,82ммоль, 1,1екв.) у бензолі (150мл). Після того 4,63; Ν, 7,25. як за даними тонкошарового хроматографування Використовуючи метод Прикладу 66 одержали буде встановлена відсутність вихідного матеріалу, такі сполуки: а) 4,6-дифтор-1-метил-1Н-індол. перенести реакційну суміш до ділильної лійки, Приклад 67 промити 1N розчином НСI, після чого насиченим N-(2-(5-метокси-1Н-індол-3-іл)етил)-3розчином NaHCO3 і потім водою. Висушити органіфеноксибензиламін чний шар над MgSO4, профільтрувати і видалити розчинник з одержанням залишку. Кристалізувати залишок із суміші МеОН/води з одержанням 1,3дифтор-2-метокси-5-нітробензолу у вигляді голчастих кристалів білого кольору: 1Н ЯМР (300МГц, CDCI3): 4,25 (t, 3Н), 7,80 (d, 2H).
ДивитисяДодаткова інформація
Назва патенту англійськоюN-(2-arylethyl)benzylamines as antagonists of 5-ht6 receptor, pharmaceutical composition
Автори англійськоюChen, Zhaogen, Cohen Michael Philip, Fisher Matthew Joseph
Назва патенту російськоюN-(2-арилэтил)бензиламины как антагонисты рецептора 5-нт6, фармацевтическая композиция на их основе
Автори російськоюЧен Жаочжен, Коуэн Майкл Филип, Фишер Метью Джозеф
МПК / Мітки
МПК: C07C 317/14, C07D 213/64, A61K 31/506, C07C 323/01, A61K 31/4045, C07D 239/34, C07D 209/14, A61K 31/4402, C07D 401/12, C07D 403/12, C07C 217/54, A61P 25/18, C07D 209/16, A61K 31/4406, C07D 277/34, C07D 333/20, C07D 307/91, A61P 25/28, A61K 31/4409, C07D 233/24
Мітки: основі, композиція, рецептора, 5-ht6, антагоністи, n-(2-арилетил)бензиламіни, фармацевтична
Код посилання
<a href="https://ua.patents.su/100-76451-n-2-ariletilbenzilamini-yak-antagonisti-receptora-5-ht6-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">N-(2-арилетил)бензиламіни як антагоністи рецептора 5-ht6, фармацевтична композиція на їх основі</a>
Попередній патент: Мобільна станція розподілення рідини
Наступний патент: Спосіб одержання форполімеру для застосування в дозаторі однокомпонентної піни (варіанти)
Випадковий патент: Пристрій для подрібнення покришок