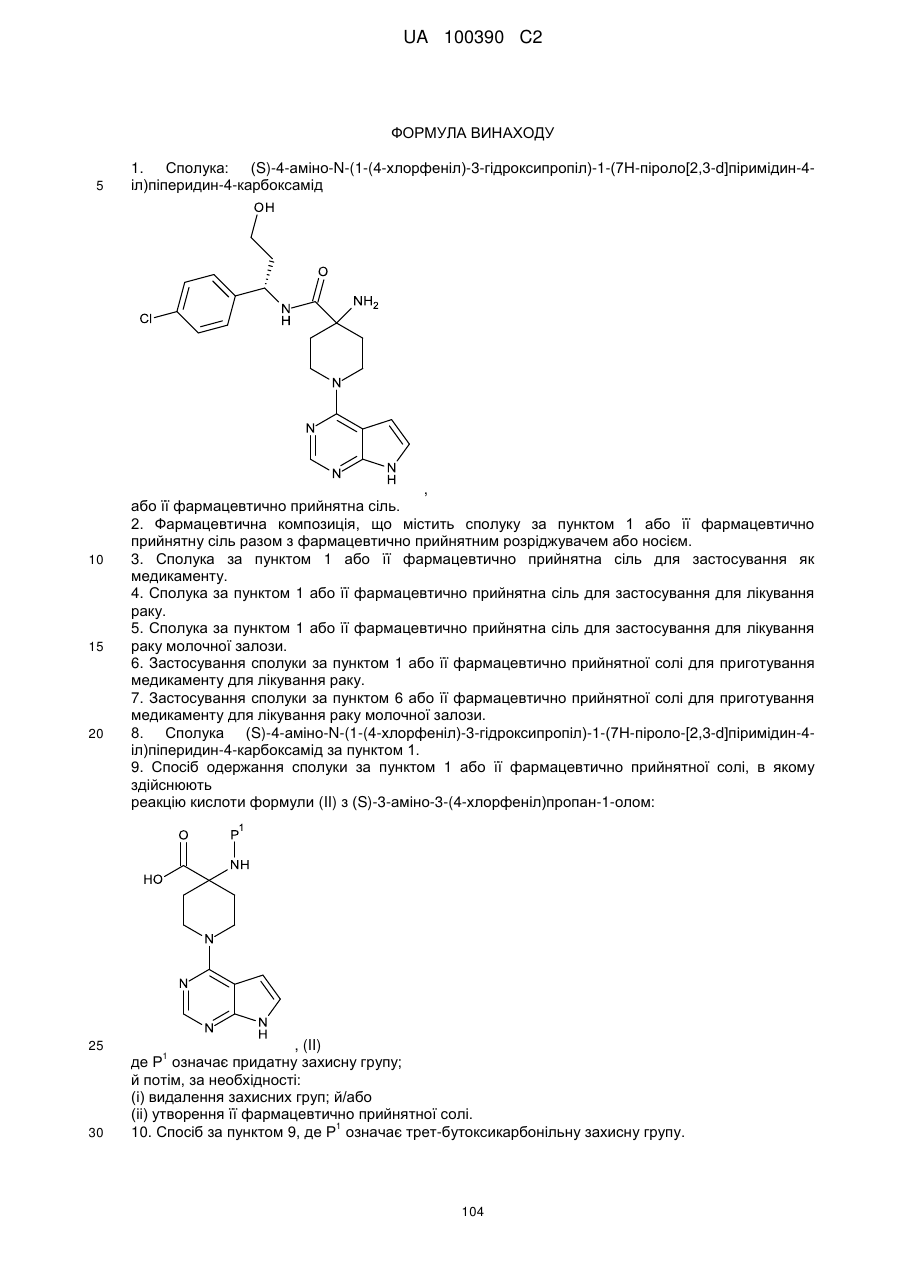
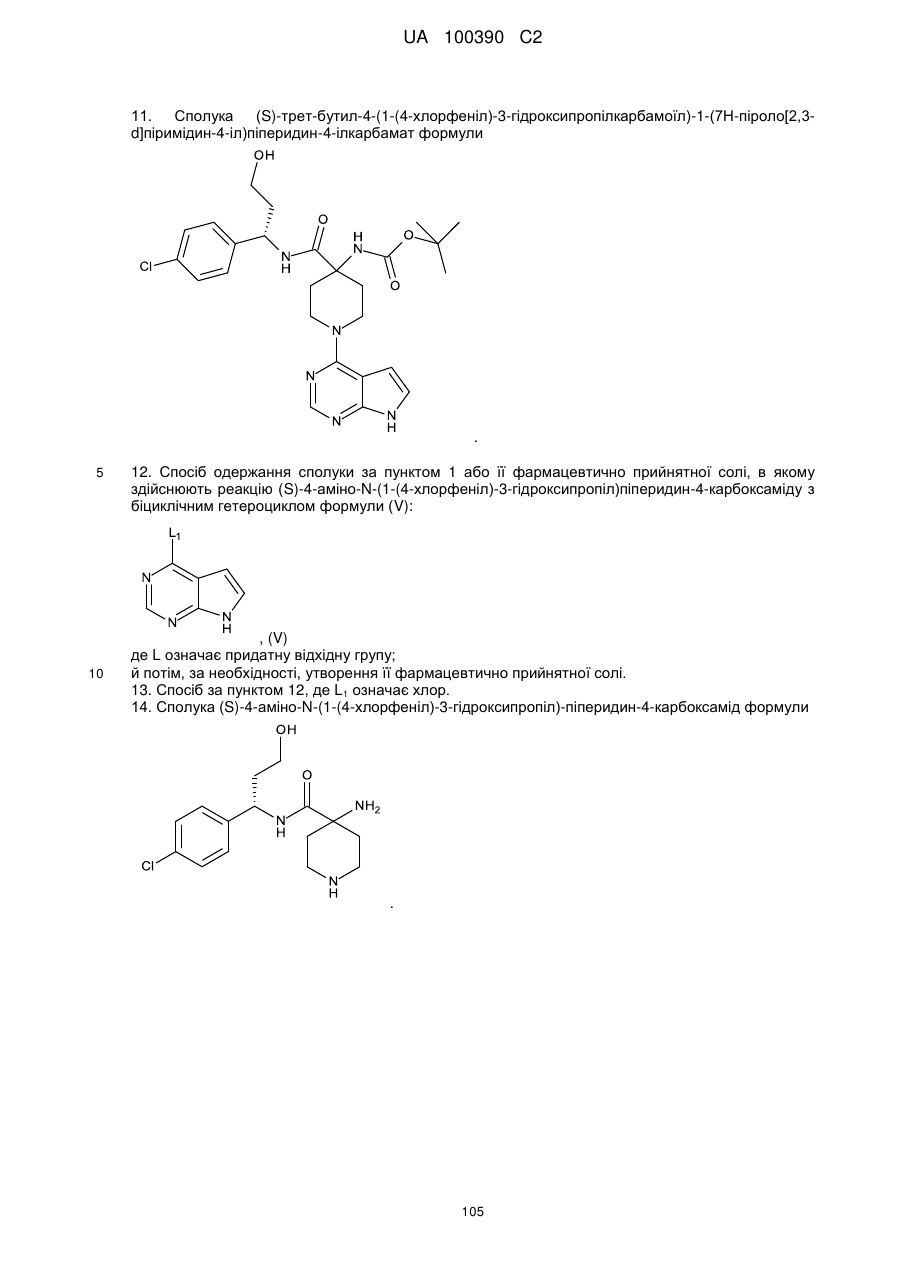
Похідна піроло[2,3-d]піримідину як інгібітор протеїнкінази b, спосіб її одержання та проміжні сполуки
Номер патенту: 100390
Опубліковано: 25.12.2012
Автори: Джонсон Поль Девід, Лук Річард Вілльям Артур, Ліч Ендрю, Матусяк Збігнев Стенлі, Морріс Джеффрі Джеймс
Формула / Реферат
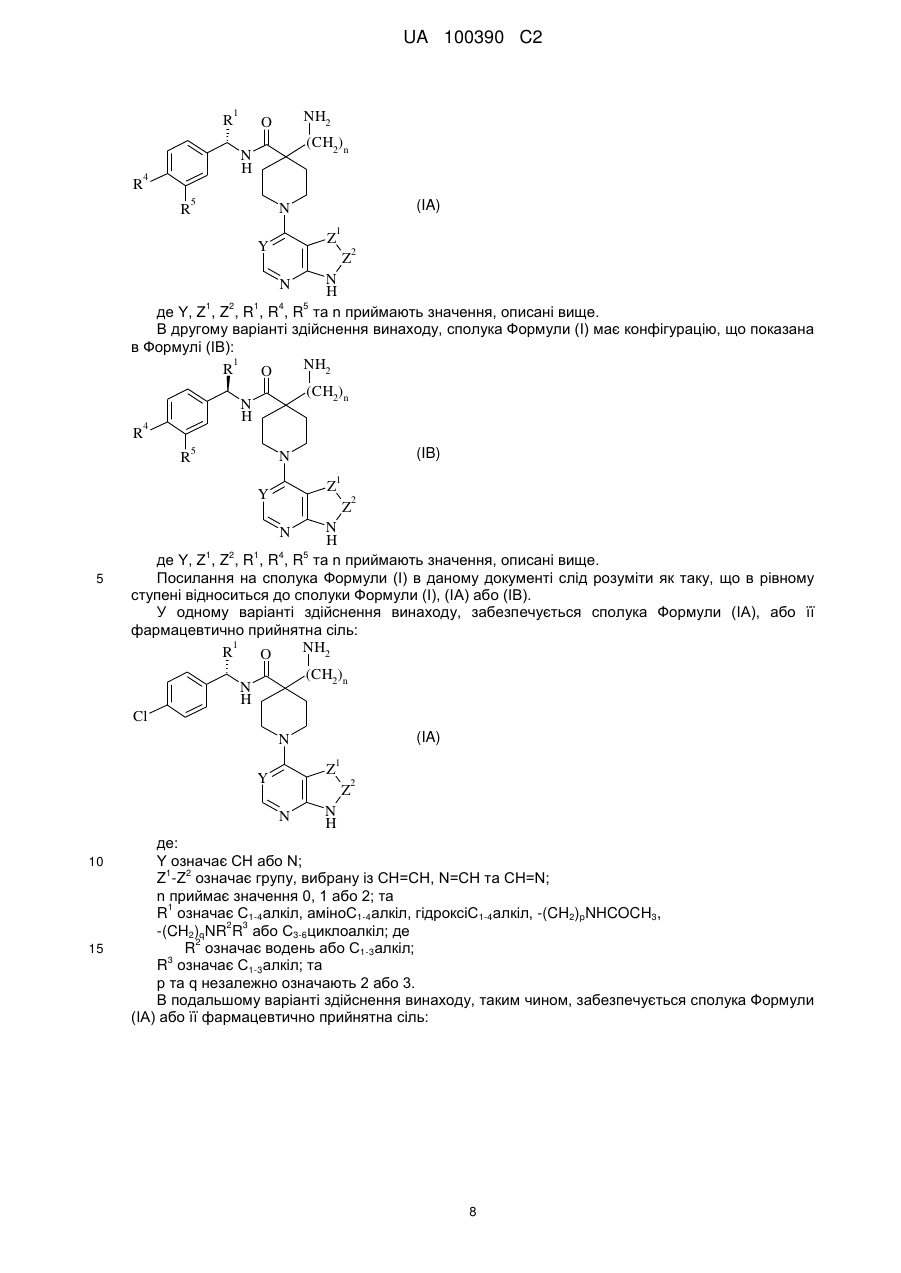
1. Сполука: (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7Н-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід
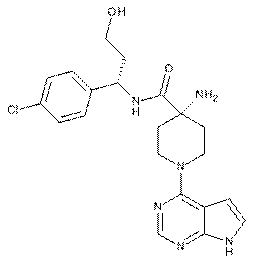 ,
,
або її фармацевтично прийнятна сіль.
2. Фармацевтична композиція, що містить сполуку за пунктом 1 або її фармацевтично прийнятну сіль разом з фармацевтично прийнятним розріджувачем або носієм.
3. Сполука за пунктом 1 або її фармацевтично прийнятна сіль для застосування як медикаменту.
4. Сполука за пунктом 1 або її фармацевтично прийнятна сіль для застосування для лікування раку.
5. Сполука за пунктом 1 або її фармацевтично прийнятна сіль для застосування для лікування раку молочної залози.
6. Застосування сполуки за пунктом 1 або її фармацевтично прийнятної солі для приготування медикаменту для лікування раку.
7. Застосування сполуки за пунктом 6 або її фармацевтично прийнятної солі для приготування медикаменту для лікування раку молочної залози.
8. Сполука (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7Н-піроло-[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід за пунктом 1.
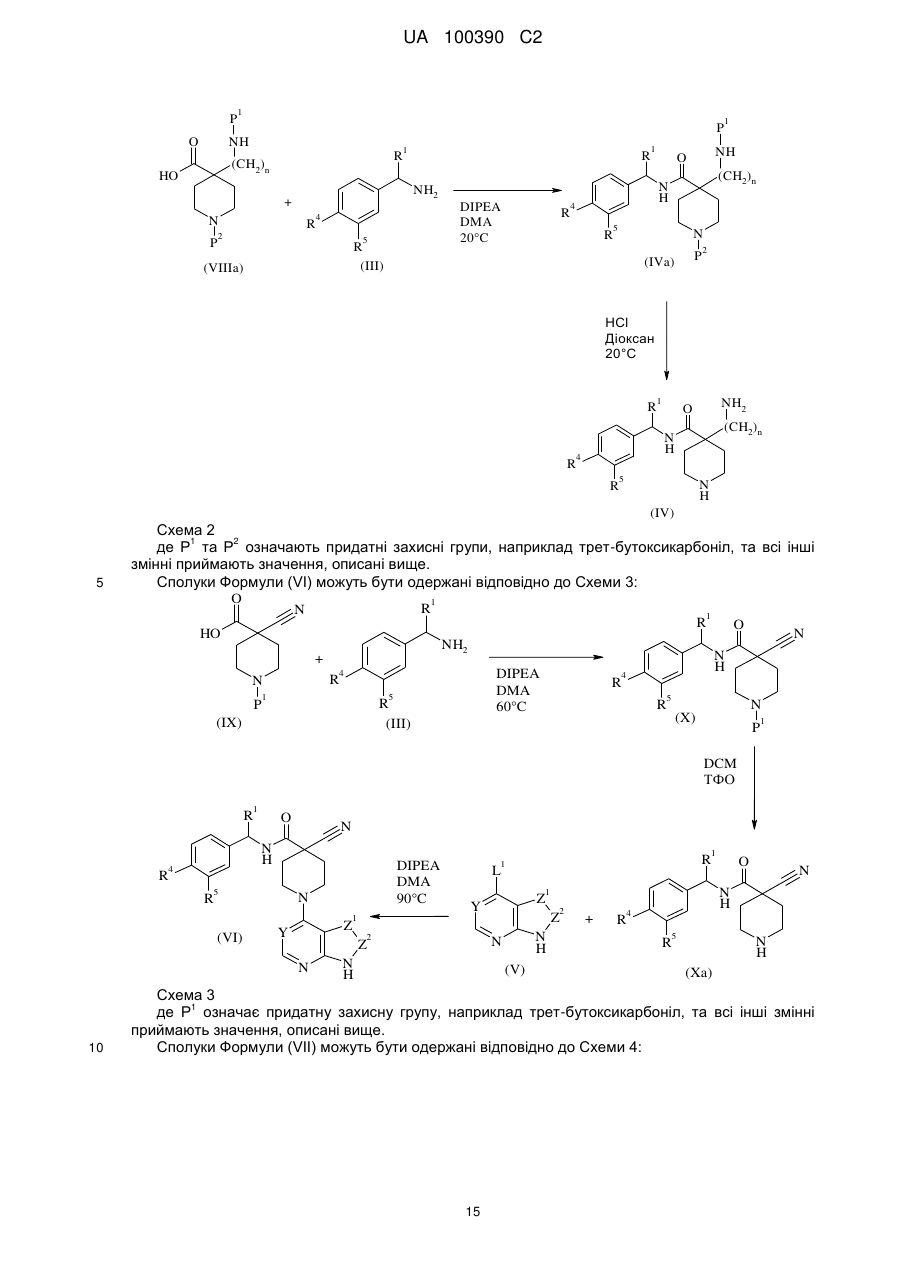
9. Спосіб одержання сполуки за пунктом 1 або її фармацевтично прийнятної солі, в якому здійснюють
реакцію кислоти формули (II) з (S)-3-аміно-3-(4-хлорфеніл)пропан-1-олом:
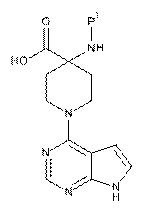 , (II)
, (II)
де Р1 означає придатну захисну групу;
й потім, за необхідності:
(і) видалення захисних груп; й/або
(іі) утворення її фармацевтично прийнятної солі.
10. Спосіб за пунктом 9, де Р1 означає трет-бутоксикарбонільну захисну групу.
11. Сполука (S)-трет-бутил-4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7Н-піроло[2,3-d]піримідин-4-іл)піперидин-4-ілкарбамат формули
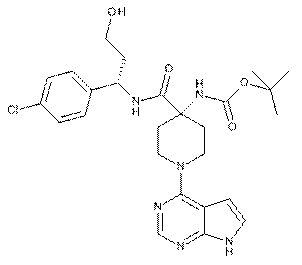 .
.
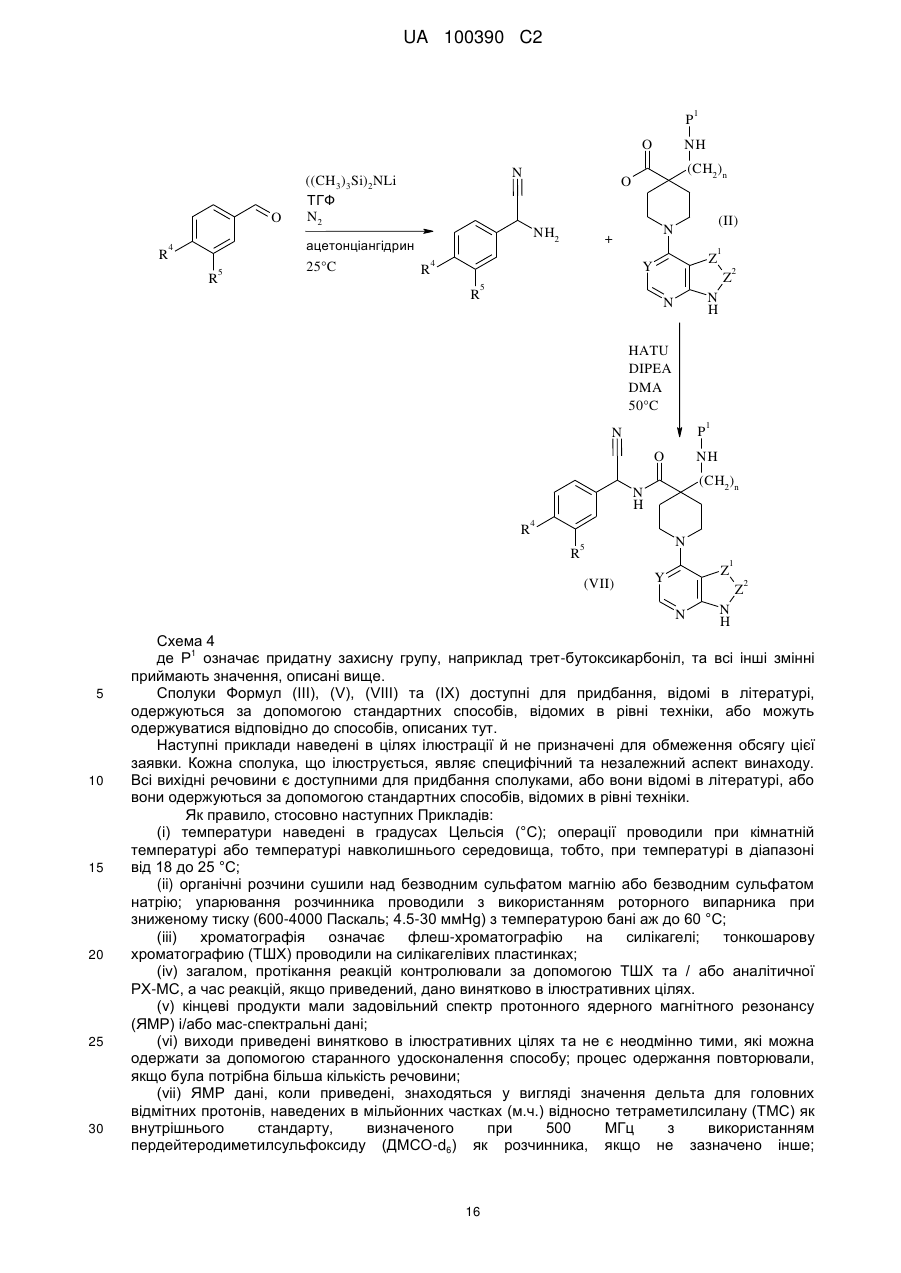
12. Спосіб одержання сполуки за пунктом 1 або її фармацевтично прийнятної солі, в якому здійснюють реакцію (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)піперидин-4-карбоксаміду з біциклічним гетероциклом формули (V):
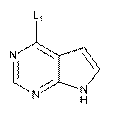 , (V)
, (V)
де L означає придатну відхідну групу;
й потім, за необхідності, утворення її фармацевтично прийнятної солі.
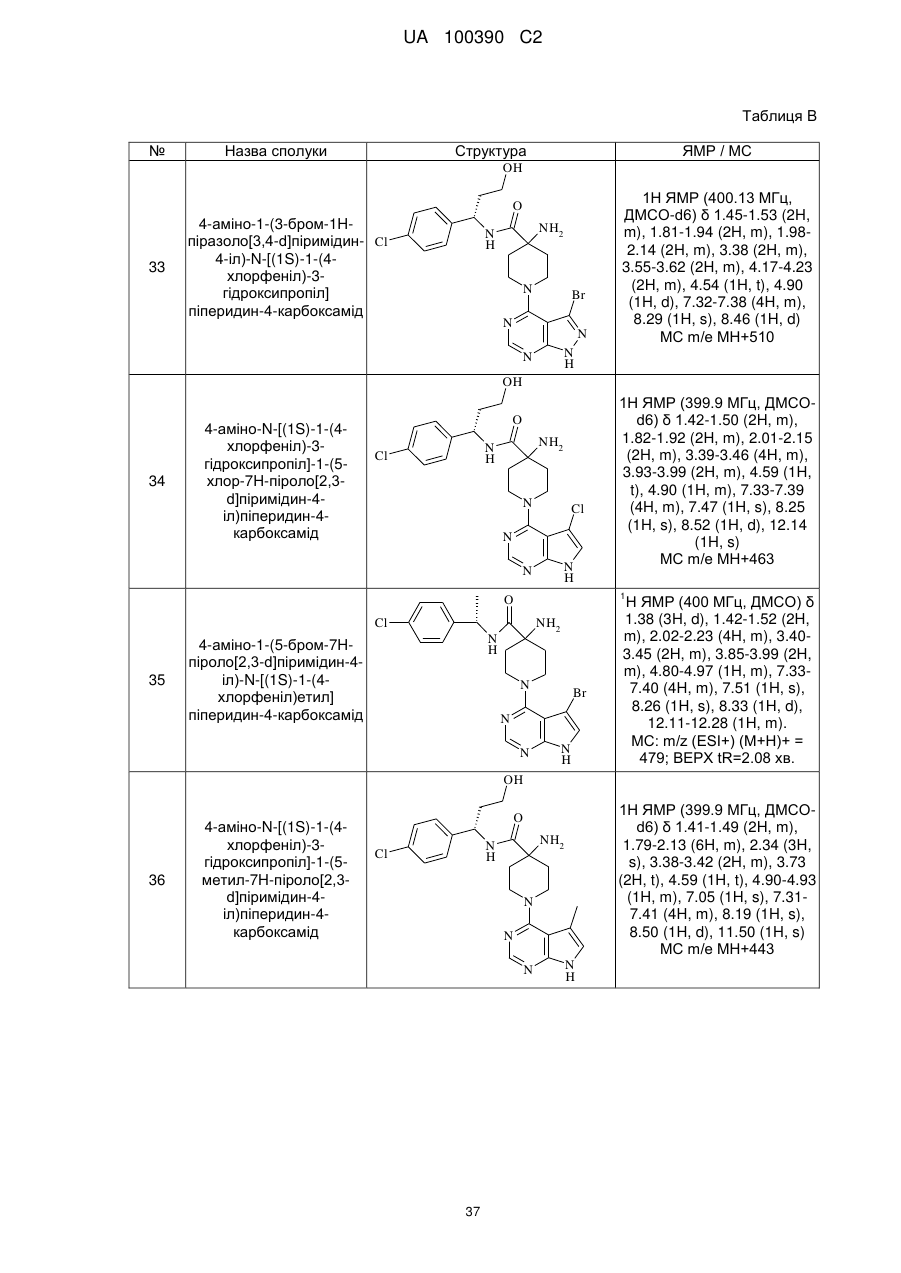
13. Спосіб за пунктом 12, де L1 означає хлор.
14. Сполука (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-піперидин-4-карбоксамід формули
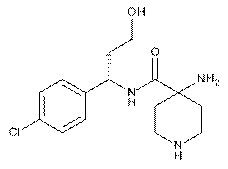 .
.
Текст
Реферат: Винахід стосується нової групи сполук формули (І) або їх солей: , (I) UA 100390 C2 (12) UA 100390 C2 1 2 1 4 5 де Y, Z , Z , R , R , R та n приймають значення, описані у описі винаходу, які можуть бути корисними при лікуванні або попередженні захворювання або медичного стану, опосередкованого протеїнкіназою В (РКВ), такого як рак. Винахід також стосується фармацевтичних композицій, які містять вищевказані сполуки, способів лікування захворювань, опосередкованих РКВ, з використанням вищевказаних сполук, та способів одержання сполук Формули (І). UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до нової групи біциклічних гетероциклів, які можуть бути корисними при лікуванні або попередженні захворювання або медичного стану, опосередкованого протеїнкіназою B (PKB, також відома як AKT). Отже, такі сполуки можуть бути корисними при лікуванні або попередженні ряду різних типів раку. Винахід також відноситься до фармацевтичних композицій, які включають вищезгадані сполуки, до способів одержання вищезгаданих сполук та до способів лікування захворювань, опосередкованих PKB із застосуванням вищезгаданих сполук. PKB є компонентом фосфатидил 3-кіназного (PI3K) сигнального шляху, який відіграє важливу роль в проліферації та виживанні клітин, у тому числі в клітинних відповідях на фактори росту. Після приєднання фактора росту, наприклад, епідермального фактора росту (EGF), до його рецепторної тирозинкінази на клітинній поверхні, наприклад EGF рецептору (EGFR), рецептор димеризується та піддається автофосфорилюванню. Ця подія автофосфорилювання дозволяє 85 кДа регуляторній суб'одиниці PI3K (p85) взаємодіяти з рецептором або безпосередньо, або через адаптерний білок, наприклад, зв'язаний з рецептором фактора росту білок 2 (GRB2), й таким чином активує 110 кДа каталітичну суб'одиницю PI3K (p110). Після активації, p110 каталізує фосфорилювання фосфатидилінозитол-4,5-бісфосфату (PIP2) з одержанням фосфатидилінозитол-3,4,5трифосфату (PIP3), молекули вторинного месенджера, яка прикріплює й фосфатидилінозитолзалежну кіназу 1 (PDK1) й PKB до плазматичної мембрани, де PDK1 фосфорилює та активує PKB. Відомі три ізоформи PKB (PKB/AKT1, PKB/AKT2 та PKB/AKT3), похідні від трьох різних генів. Активування PKB пов'язують з подіями в системі клітинних сигналів, які опосередковують проліферацію та виживання клітин, тоді як активування PKB пов'язують з інвазією, рухливістю та інсулін-опосередкованими процесами метаболізму. Активована PKB захищає клітини від апоптозу шляхом інактивації проапоптичних факторів, наприклад, BAD, прокаспази-9 та транскрипційного фактора forkhead (FKHR), та активації факторів транскрипції, що підвищуюче регулює антиапоптозні гени, наприклад циклічний-AMP відповідний елемент активуючого білка (CREB). PKB також може сприяти виживанню клітин шляхом інактивації p53 через фосфорилювання MDM2. Подібним чином, активована PKB індукує проліферацію клітин за допомогою активуючих білків, залучених до росту та метаболізму клітин, наприклад за допомогою шляху, що веде до активування мішені рапаміцину в клітинах ссавців (mTOR) та через глікоген-синтаза-кіназу-3 (GSK3). PKB-опосередкована стимуляція проліферації клітин та захист від апоптозу таким чином сприяє утворенню пухлин, й при раку звичайно знаходять генетичні порушення компонентів в межах PI3K шляху. Наприклад, мутацію або ампліфікацію генів, що кодують p110 ізоформи PI3K, находять при раку молочної залози, раку кишечнику, раку яєчників, раку голови та шиї, та плоскоклітинному раку шийки матки, раку шлунка та легень, ангіопластичних олігодендрогліомах, амапластичних астроцитомах, мультиформній гліобластомі та медулобластомах. Подібним чином, мутацію, ампліфікацію і/або надекспресію генів, що кодують ізоформи PKB, находять при пухлинах підшлункової залози, молочної залози та яєчника. Крім того, ген, що кодує PTEN (фосфатазу, яка відіграє роль, зворотну PI3K, що каталізує перетворення PIP3 на PIP2) інактивується в багатьох типах пухлин, у тому числі пухлинах яєчників, колоректальних пухлинах, пухлинах молочної залози, гліомі, меланомі, пухлинах легень, лейкеміях та лімфомах; це приводить до активування PKB/AKT. Приймаючи до уваги важливість PI3K сигнального шляху в проліферації та виживанні пухлинних клітин, будь-яка сполука, яка порушує цей шлях, у тому числі PKB інгібітори, можуть бути корисні при лікуванні раку. Докладні огляди PI3K сигнального шляху та його залучення до утворення пухлин забезпечені дослідниками Hennessy й ін., Nature Reviews / Drug Discovery (грудень 2005) т. 4, 988-1004. та Cully й ін., Nature reviews / Cancer (березень 2006) т. 6, 184-192. Потенціалозалежний калієвий канал, кодований за допомогою гену специфічних калієвих каналів серця людини (hERG), як передбачають, відіграє ключову роль в реполяризації потенціалу дії шлуночків серця. Зміни в його активності, викликувані або успадкованими мутаціями генної послідовності, або фармакологічною модифікацією, можуть приводити до збільшення тривалості потенціалу дії. Це може привести до збільшення інтервалу QT, що реєструється у людини на електрокардіограмі, та до потенціально фатальної аритмії серця, відомої як "піруетна шлуночкова тахікардія" (Vandenberg й ін. (2001). Trends Pharmacol. Sci. 22, 240-246). Згідно з сучасними нормативними рекомендаціям (CPMP/ICH/539/00), in vitro дослідження, що вивчаюче дії тестованих сполук в каналі hERG, могло би бути одним з елементів доклінічної стратегії, націленої на прогнозування ймовірності того, що нові хімічні одиниці будуть збільшувати інтервал QT, що реєструється у людини на електрокардіограмі. По 1 UA 100390 C2 5 10 15 суті, усунення hERG-блокуючої активності залишається важливим фактором в розробці кожного нового лікарського засобу. Був описаний ряд сполук, які націлені на шлях PI3K. Наприклад в документах WO2006/046023 та WO2006/046024 (Astex Therapeutics Limited) описуються пуринові, пуринонові та деазaпуринонові сполуки, які інгібують або модулюють активність протеїнкінази B (PKB) та протеїнкінази A (PKA). Тим не менше, до нашого часу існує потреба в подальших поліпшених засобах, що мають кращу активність по відношенню до PKB і/або корисні фізичні властивості (наприклад, більш високу розчинність в воді, більш високу проникність, і/або менше зв'язування з білком плазми крові) і/або сприятливі профілі токсичності (наприклад, знижену схильність до блокування hERG) і/або сприятливі метаболічні профілі у порівнянні з іншими відомими інгібіторами PKB. Заявниками було несподівано встановлено, що визначені біциклічні гетероциклічні похідні особливо ефективні при інгібуванні активності PKB, й тому можуть бути корисними при лікуванні хворобливих станів, в які залучена активність PKB, наприклад раку. Відповідно до першого аспекту винаходу, таким чином, забезпечується сполука Формули (I), або її фармацевтично прийнятна сіль: 1 NH2 R O (CH2)n N H 4 R 5 (I) N R 1 Z Y 2 Z N 20 25 30 35 40 N H де: Y означає CH або N; 1 2 6 6 Z -Z означає групу, вибрану із C(R )=CH, N=CH та C(R )=N; де 6 R означає водень, фтор, хлор, бром, ціано, метил, етил, дифторметил, трифторметил або циклопропіл; n приймає значення 0, 1 або 2; 1 R означає C1-4алкіл, C2-4алкеніл, C2-4алкініл, C1-4алкокси, C1-4алкоксіC1-4алкіл, фторC1-4алкіл, аміноC1-4алкіл, гідроксіC1-4алкіл, ціано, ціаноC1-4алкіл, C3-6циклоалкіл, 2 3 -(CH2)pNHCOCH3, -(CH2)pNHSO2CH3, -(CH2)pNHCONH2, -(CH2)pNHCONR R , 2 3 2 3 2 3 -(CH2)pNR R , -(CH2)pSO2NH2, -(CH2)pSO2NR R , -(CH2)pCONH2, -(CH2)pCONR R або -(CH2)p7 R ; де p приймає значення 0, 1, 2 або 3; 2 R означає водень або C1-3алкіл; 3 R означає C1-3алкіл; та 7 R означає феніл; 7 R означає 5 або 6 членне моноциклічне гетероарильне кільце, яке включає 1, 2 або 3 гетероатома, що вибрані з O, N або S; або 7 R означає моноциклічне 4, 5 або 6 членне гетероциклічне кільце, яке включає 1, 2 або 3 гетероатома, що вибрані з O, N або S; 7 де R необов'язково заміщений за допомогою 1 або 2 замісників, вибраних із C 1-4алкілу, трифторметилу, C1-4алкокси, фтору, хлору, брому та ціано; 4 R означає водень, фтор, хлор, бром, ціано або трифторметил; та 5 R означає водень, фтор, хлор або бром. У одному варіанті здійснення винаходу, забезпечується сполука Формули (I), або її фармацевтично прийнятна сіль: 2 UA 100390 C2 1 R NH2 O (CH2)n N H Cl (I) N 1 Z Y 2 Z N 5 10 N H де: Y означає CH або N; 1 2 Z -Z означає групу, вибрану із CH=CH, N=CH та CH=N; n приймає значення 0, 1 або 2; та 1 R означає C1-4алкіл, аміноC1-4алкіл, гідроксіC1-4алкіл, -(CH2)pNHCOCH3, 2 3 -(CH2)qNR R або C3-6циклоалкіл; де 2 R означає водень або C1-3алкіл; 3 R означає C1-3алкіл; та p та q незалежно означають 2 або 3. В подальшому варіанті здійснення винаходу, таким чином, забезпечується сполука Формули (I), або її фармацевтично прийнятна сіль: 1 NH2 R O (CH2)n N H Cl (I) N 1 Z Y 2 Z N 15 20 25 30 35 N H де: Y означає CH або N; 1 2 Z -Z означає групу, вибрану із CH=CH, N=CH та CH=N; 1 R означає C1-4алкіл, аміноC1-4алкіл або C3-6циклоалкіл; та n приймає значення 0, 1 або 2. Мається на увазі, що термін "C1-4алкіл" означає насичений вуглецевий ланцюг з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим. Тим не менше, посилання на окремі алкільні групи, такі як "пропіл", мають на увазі тільки групи з нерозгалуженим ланцюгом, а посилання на окремі алкільні групи з розгалуженим ланцюгом, такі як "трет-бутил", мають на увазі тільки групи з розгалуженим ланцюгом. Наприклад, "C 1-4алкіл" включає метил, етил, пропіл, ізопропіл та трет-бутил. Мається на увазі, що термін "C 2-4алкеніл" означає ненасичений вуглецевий ланцюг з 2-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, та містить принаймні один вуглець - вуглецевий подвійний зв'язок. Тим не менше, посилання на окремі алкенільні групи, такі як "пропеніл" мають на увазі тільки групи з нерозгалуженим ланцюгом, а посилання на окремі алкенільні групи з розгалуженим ланцюгом, такі як трет-бутеніл, мають на увазі тільки групи з розгалуженим ланцюгом. Наприклад, "C 2-4алкеніл" включає, але не обмежується перерахованим, етеніл, пропеніл, ізопропеніл, бутеніл та трет-бутеніл. Мається на увазі, що термін "C2-4алкініл" означає ненасичений вуглецевий ланцюг з 2-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, та містить принаймні один вуглець - вуглецевий потрійний зв'язок. Тим не менше, посилання на окремі алкінільні групи, такі як "пропініл" мають на увазі тільки групи з нерозгалуженим ланцюгом, а посилання на окремі розгалужені алкінільні групи, такі як трет-бутиніл, мають на увазі тільки групи з розгалуженим ланцюгом. Наприклад, "C2-4алкініл" включає, але не обмежується перерахованим, етиніл, пропініл, ізопропініл, бутиніл та трет-бутиніл. Мається на увазі, що термін "C 1-4 алкокси" означає насичений вуглецевий ланцюг з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, приєднаний 3 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 до кисню. Наприклад, "C1-6 алкокси" включає, але не обмежується перерахованим, метокси, етокси, пропокси та бутокси. Мається на увазі, що термін "C1-4алкоксіC1-4алкіл" означає насичений вуглецевий ланцюг з 14 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, приєднаний через кисень до іншого насиченого вуглецевого ланцюга з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим. Наприклад, "C1-4алкоксіC1-4алкіл" включає, але не обмежується перерахованим, метоксіетил, метоксипропіл, етоксипропіл, пропоксіетил та бутоксипропіл. Мається на увазі, що термін "фторC1-4алкіл" означає насичений вуглецевий ланцюг з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, де принаймні один із атомів водню заміщений фтором. Наприклад, "фторC1-4алкіл" включає, але не обмежується перерахованим, фторметил, фторетил, фторпропіл, фторізопропіл, фторбутил, фторізобутил, фтор-трет-бутил, трифторметил, пентафторетил, гептафторпропіл та нонафторбутил. Мається на увазі, що термін "аміноC1-4алкіл" означає насичений вуглецевий ланцюг з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, та включає одну первинну аміногрупу. Наприклад "аміноC1-4алкіл" включає амінометил, аміноетил, 2амінопропіл, 3-амінопропіл, 1-аміноізопропіл та 4-амінобутил. Мається на увазі, що термін "гідроксіC1-4алкіл" означає насичений вуглецевий ланцюг з 1-4 атомами вуглецю довжиною, який може бути нерозгалуженим або розгалуженим, та включає гідроксильну групу. Наприклад "гідроксіC 1-4алкіл" включає гідроксиметил, гідроксіетил, 2гідроксипропіл, 3-гідроксипропіл, 1-гідроксиізопропіл та 4-гідроксибутил. Мається на увазі, що термін "C3-6циклоалкіл" означає насичене 3-6 членне моноциклічне вуглецеве кільце. Наприклад "C3-6циклоалкіл" включає циклопропіл, циклобутил, циклопентил та циклогексил. Мається на увазі, що термін "гетероарильне кільце" означає 5 або 6 членне, повністю ненасичене, ароматичне моноциклічне кільце, яке включає 1, 2 або 3 гетероатома, що незалежно вибрані з азоту, кисню або сірки, приєднане через атом вуглецю кільця або атом азоту кільця, причем можливо приєднання по атому азота, наприклад, приєднання неможливе по атому азота піридинового кільца, але приєднання можливе через 1-азот піразольного кільця. Приклади 5 або 6 членних гетероарильних кілец включають, але не обмежуються перерахованим, пірол, фуран, імідазол, триазол, тетразол, піразин, піримідин, піридазин, піридин, піразол, ізоксазол, оксазол, 1,2,4 оксадіазол, ізотіазол, тіазол, 1,2,4-триазол та тіофен. Мається на увазі, що термін "гетероциклічне кільце" означає 4, 5 або 6 членне повністю насичене або частично насичене моноциклічне кільце, яке включає 1, 2 або 3 гетероатома, що вибрані з азоту, кисню або сірки, приєднане через атом вуглецю кільця або атом азоту кільця. Приклади 4, 5 або 6 членних гетероциклічних кілець включають азетидин, тетрагідрофуран, тетрагідропіран, піролін, піролідин, тіазолідин, морфолін, піперидин, піперазин, дигідропіридин, дигідропіримідин та азепан. 1 2 1 4 В подальших варіантах здійснення винаходу, кожне із наступних визначень Y, Z -Z , R , R , 5 6 R , R , n та p в пунктах (1) - (26) нижче, можуть використовуватися окремо або в комбінації з одниміз інших наступних визначень для обмеження максимально широкого визначення Формул (I), (IA) або (IB) у відповідних випадках. (1) Y означає N; (2) Z1-Z2 означає CH=CH; (3) Z1-Z2 означає C(Cl)=CH; 1 2 (4) Z -Z означає C(Br)=CH; (5) R1 означає C1-4алкіл; (6) R1 означає аміноC1-4алкіл; (7) R1 означає гідроксіC1-4алкіл; (8) R1 означає C3-6циклоалкіл; 1 (9) R означає C1-4алкоксіC1-4алкіл, фторC1-4алкіл, аміноC1-4алкіл, гідроксіC1-4алкіл, ціаноC1C3-6циклоалкіл, -(CH2)pNHCOCH3, -(CH2)pNHSO2CH3, -(CH2)pNHCONH2, 4алкіл, 2 3 2 3 2 3 7 (CH2)pNHCONR R , -(CH2)pNR R , -(CH2)pSO2NH2, -(CH2)pCONH2, -(CH2)pCONR R або -(CH2)p-R ; 1 7 7 (10) R означає -(CH2)p-R , де R вибирають із фенілу, піперидинілу, піперазинілу, 7 піролідинілу, морфолінілу, імідазолілу, ізоксазолілу, піразолілу та тіазолілу та R необов'язково заміщений за допомогою однієї метильної групи; 1 (11) R означає гідроксіетил; (12) n приймає значення 0; (13) n приймає значення 1; 4 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 (14) n приймає значення 1 або 2; (15) n приймає значення 0 або 1; (16) p приймає значення 1, 2 або 3; (17) R4 означає хлор, бром або ціано; (18) R4 означає хлор, бром; (19) R4 означає хлор; (20) R4 означає бром; (21) R5 означає водень; (22) R5 означає хлор; (23) R6 означає водень; (24) R6 означає метил; (25) R6 означає дифторметил; (26) R6 означає трифторметил. Відповідно до другого варіанту здійснення винаходу, забезпечується сполука або фармацевтично прийнятна сіль сполуки Формули (I), яка являє собою: 4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (R)-4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-((4-хлорфеніл)(циклопропіл)метил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(2-аміно-1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (S)-4-(амінометил)-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; (R)-4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-гідроксіетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; N-(3-ацетамідо-1-(4-хлорфеніл)пропіл)-4-аміно-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (R)-4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-(амінометил)-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(3-аміно-1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (R)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; (R)-4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (R)-4-(амінометил)-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 5 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 (S)-4-аміно-N-(1-(4-ціанофеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-1-(5-бром-7H-піроло[2,3-d]піримідин-4-іл)-N-(1-(4-хлорфеніл)-3гідроксипропіл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(1H-піразоло[3,4-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(3-гідрокси-1-фенілпропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(9H-пурин-6-іл)піперидин-4-карбоксамід; (S)-4-(амінометил)-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-бромфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-4-(диметиламіно)бутил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-(діетиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(5-циклопропіл-7H-піроло[2,3-d]піримідин4-іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-(метиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(4-хлорфеніл)(феніл)метил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-[2-аміно-1-(4-хлорфеніл)-2-оксоетил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; 4-аміно-1-(3-бром-1H-піразоло[3,4-d]піримідин-4-іл)-N-[(1S)-1-(4-хлорфеніл)етил]піперидин4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)етил]-1-(5-хлор-7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-1-(3-бром-1H-піразоло[3,4-d]піримідин-4-іл)-N-[(1S)-1-(4-хлорфеніл)-3гідроксипропіл]піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-гідроксипропіл]-1-(5-хлор-7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-1-(5-бром-7H-піроло[2,3-d]піримідин-4-іл)-N-[(1S)-1-(4-хлорфеніл)етил]піперидин-4карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-гідроксипропіл]-1-(5-метил-7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)етил]-1-(5-метил-7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-гідрокси-3-метілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-ціанофеніл)етил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-[(1S)-1-(3-хлорфеніл)-3-гідроксипропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-1-(7H-піроло[2,3-d]піримідин-4-іл)-N-{(1S)-1-[4-(трифторметил)феніл]етил}піперидин4-карбоксамід; 4-аміно-N-[(1R)-1-(4-бромфеніл)етил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-[1-(4-хлорфеніл)-2-фенілетил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-[1-(4-фторфеніл)етил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід; 4-аміно-N-[(4-хлорфеніл)(ціано)метил]-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-фенілетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід; 4-аміно-N-[1-(4-хлорфеніл)-4-піролідин-1-ілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[1-(4-хлорфеніл)-4-морфолін-4-ілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 6 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 4-аміно-N-[1-(4-хлорфеніл)-4-піперидин-1-ілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-4-піперидин-1-ілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1R)-1-(4-хлорфеніл)-4-піперидин-1-ілбутил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-(4-метилпіперазин-1-іл)пропіл]-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-морфолін-4-илпропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-піперидин-1-ілпропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-піперазин-1-ілпропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-(1H-імідазол-1-іл)пропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[(1S)-1-(4-хлорфеніл)-3-піролідин-1-ілпропіл]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-сульфамоїлетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-сульфамоїлетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; N-(2-ацетамідо-1-(4-хлорфеніл)етил)-4-аміно-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-(1H-імідазол-2-іл)етил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[1-(4-хлорфеніл)-2-(1H-піразол-1-іл)етил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-[1-(4-хлорфеніл)-2-(3-метилізоксазол-5-іл)етил]-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-(тіазол-2-іл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)-3-оксопропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-метоксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-сульфамоїлпропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(3-аміно-1-(4-хлорфеніл)-3-оксопропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-3-уреїдопропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; 4-аміно-N-(1-(4-хлорфеніл)-2-ціаноетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід; або 4-аміно-N-(1-(4-хлорфеніл)-3-(метилсульфонамідо)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід. Ясно, що, оскільки визначені вище сполуки Формули (I) існують в оптично активній або рацемічній формах завдяки асиметричному атому вуглецю, винахід включає в своє визначення будь-яку таку оптично активну або рацемічну форму, яка має властивість інгібувати активність PKB. Синтез оптично активних форм можна провести за допомогою стандартних методів органічної хімії, добре відомих з рівня техніки, наприклад за допомогою синтезу із оптично активних вихідних речовин абоза допомогою розщеплення рацемічної форми. Рацемічні сполуки та рацемічні проміжні сполуки для їх одержання накреслені в даному документі у вигляді плоских структур, тоді як стереоспецифічні сполуки та стереоспецифічні проміжні сполуки для їх одержання накреслені з відповідним чином зазначеною стереохімією. Винахід також відноситься до всіх без виключення таутомерних форм сполук Формули (I), які є інгібіторами активності PKB. У одному варіанті здійснення винаходу, сполука Формули (I) має конфігурацію, що показана в Формулі (IA): 7 UA 100390 C2 1 R NH2 O (CH2)n N H 4 R 5 (IA) N R 1 Z Y 2 Z N H 1 2 1 4 5 де Y, Z , Z , R , R , R та n приймають значення, описані вище. В другому варіанті здійснення винаходу, сполука Формули (I) має конфігурацію, що показана в Формулі (IB): 1 NH2 R O N (CH2)n N H 4 R 5 (IB) N R 1 Z Y 2 Z N H 1 2 1 4 5 де Y, Z , Z , R , R , R та n приймають значення, описані вище. Посилання на сполука Формули (I) в даному документі слід розуміти як таку, що в рівному ступені відноситься до сполуки Формули (I), (IA) або (IB). У одному варіанті здійснення винаходу, забезпечується сполука Формули (IA), або її фармацевтично прийнятна сіль: 1 NH2 R O (CH2)n N H Cl (IA) N N 5 1 Z Y 2 Z N 10 15 N H де: Y означає CH або N; 1 2 Z -Z означає групу, вибрану із CH=CH, N=CH та CH=N; n приймає значення 0, 1 або 2; та 1 R означає C1-4алкіл, аміноC1-4алкіл, гідроксіC1-4алкіл, -(CH2)pNHCOCH3, 2 3 -(CH2)qNR R або C3-6циклоалкіл; де 2 R означає водень або C1-3алкіл; 3 R означає C1-3алкіл; та p та q незалежно означають 2 або 3. В подальшому варіанті здійснення винаходу, таким чином, забезпечується сполука Формули (IA) або її фармацевтично прийнятна сіль: 8 UA 100390 C2 1 R NH2 O (CH2)n N H Cl (IA) N 1 Z Y 2 Z N 5 10 15 20 25 30 35 40 45 N H де: Y означає CH або N; 1 2 Z -Z означає групу, вибрану із CH=CH, N=CH та CH=N; 1 R означає C1-4алкіл, аміноC1-4алкіл або C3-6циклоалкіл; та n приймає значення 0, 1 або 2. У одному варіанті здійснення винаходу, забезпечується сполука Формули (I), (IA) або (IB), як визначено вище, або її фармацевтично прийнятна сіль, де сполука Формули (I), (IA) або (IB) є іншою, ніж (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід. Підходящою фармацевтично прийнятною сіллю сполуки Формули (I) є, наприклад, кислотноадитивна сіль сполуки відповідно до винаходу, яка є достатньо основною, наприклад, кислотноадитивна сіль з, наприклад, неорганічною або органічною кислотою, наприклад соляною, бромисто-водневою, сірчаною, фосфорною, трифтороцтовою, лимонною або малеїновою кислотою. Слід розуміти, що визначені сполуки відповідно до даного винаходу можуть існувати в сольватованій, наприклад гідратованій, а також в несольватованій формах. Ясно, що даний винахід охоплює всі такі сольватовані форми, які є інгібіторами активності PKB. Сполуки Формули (I) можуть вводиться у вигляді проліків, які розкладаються в тілі людини або тварини з одержанням сполуки Формули (I). Приклади проліків включають здатні до гідролізу in vivo складні ефіри сполуки формули (I). Різні форми проліків відомі в рівні техніки. Приклади таких похідних-проліків, див.: a) Design of Prodrugs, під ред. H. Bundgaard, (Elsevier, 1985) та Methods in Enzymology, т. 42, с. 309-396, під ред. K. Widder, й ін. (Academic Press, 1985); b) A Textbook of Drug Design and Development, під ред. Krogsgaard-Larsen та H. Bundgaard, глава 5 "Design and Application of Prodrugs", під ред. H. Bundgaard с. 113-191 (1991); c) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992); d) H. Bundgaard, й ін., Journal of Pharmaceutical Sciences, 77, 285 (1988); та N. Kakeya, й ін., Chem Pharm Bull, 32, 692 (1984). Відповідно до додаткового аспекту винаходу забезпечується фармацевтична композиція, яка включає сполуку Формули (I), або її фармацевтично прийнятну сіль, як визначено вище, спільно з фармацевтично-прийнятним розріджувачем або носієм. Композиції відповідно до винаходу можуть знаходитися в формі, придатній для перорального застосування (наприклад, у вигляді таблеток, пастилок, твердих або м'яких капсул, водних або масляних суспензій, емульсій, диспергувальних порошків або гранул, сиропів або еліксирів), для місцевого застосування (наприклад, у вигляді кремів, мазей, гелей, або водних або масляних розчинів або суспензій), для введення шляхом інгаляції (наприклад, у вигляді тонкоподрібненого порошку або рідкого аерозолю), для введення шляхом інсуфляції (наприклад, у вигляді тонкоподрібненого порошку) або для парентерального введення (наприклад, у вигляді стерильного водного або масляного розчину для внутрішньовенного, підшкірного або внутрішньом'язового дозування або у вигляді супозиторію для ректального дозування). Композиції відповідно до винаходу можуть бути одержані за допомогою звичайних способів з використанням звичайних фармацевтичних наповнювачів, добре відомих в рівні техніки. Так, композиції, призначені для пероральноговикористання, можуть містити, наприклад, один або декілька барвних, підсолоджувальних, ароматизуючих і/або консервуючих агентів. Сполука Формули (I) повинна вводиться теплокровній тварині звичайно в однократній дозі в 2 діапазоні 5-5000 мг/м площі тіла тварини, тобто приблизно 0.1-100 мг/кг, й це звичайно забезпечує терапевтично ефективну дозу. Форма однократної дози, така як таблетка або капсула, повинна звичайно містити, наприклад, 1-250 мг активного інгредієнта. Переважно 9 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовують добову дозу в діапазоні 1-50 мг/кг, наприклад, 4-7 мг/кг двічі на добу. Тим не менше, добова доза буде неодмінно варіюватися в залежності від суб'єкта, що одержує лікування, конкретного шляху введення, та серйозності хвороби, що підлягає лікуванню. Таким чином, практикуючий лікар, здійснюючий лікування якого-небудь окремого пацієнта, може визначити оптимальну дозу самостійно. Наприклад, фармацевтична композиція відповідно до даного винаходу, придатна для перорального введення, може включати 1-200 мг/мл сполуки Формули (I) (такої, як (S)-4-аміноN-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід) або її фармацевтично-прийнятної солі в 0.5 % гідроксипропілметилцелюлозі (HPMC). В смислі даного опису, термін "терапія", якщо спеціально не зазначено зворотне, також включає "профілактику". Терміни "терапевтичний" та "терапевтично" слід тлумачити відповідно. Як застосовується в даному документі, термін "лікування" має своє звичайне значення боротьби з захворюванням з метою повного або часткового зменшення одного, декількох або всіх його симптомів, або з метою усунення або компенсування патології, що лежить в його основі. Як застосовується в даному документі, термін "профілактика" має своє звичайне значення та включає первинну профілактику для запобігання розвитку захворювання, та вторинну профілактику, за допомогою якої пацієнт з вже розвиненим захворюванням тимчасово або постійно захищається від загострення або погіршення перебігу захворювання або від розвитку нових симптомів, пов'язаних з захворюванням. Завдяки своїй PKB інгібувальній активності, очікується, що сполуки Формули (I) відповідно до даного винаходу будуть корисними для лікування захворювань або медичних станів, опосередкованих виключно або частково активністю PKB, наприклад раку. Типи раку, які можуть бути чутливими до лікування з використанням сполук Формули (I) відповідно до даного винаходу включають, але не обмежуються перерахованими, рак яєчників, рак шийки матки, колоректальний рак, рак молочної залози, рак підшлункової залози, гліому, гліобластому, меланому, рак передміхурової залози, лейкемію, лімфому, не-ходжкінську лімфому, рак шлунка, рак легень, гепатоцелюлярний рак, рак шлунка, стромальні пухлини шлунково-кишкового тракту (GIST), гліому, рак щитовидної залози, рак жовчних протоків, рак ендометрію, рак нирки, анапластичну крупноклітинну лімфому, гостру мієлоїдну лейкемію (AML), множинну мієлому, меланому та мезотеліому. Рак молочної залози, та більш конкретно, люмінальний рак молочної залози, може бути особливо чутливим до лікування з використанням сполук відповідно до даного винаходу. Представляється, що для способів лікування раку, згаданих у даному документі, сполука Формули (I) повинна бути введена ссавцю, більш краще людині. Подібним чином, для застосувань сполуки Формули (I) для лікування раку, згаданих у даному документі, представляється, що сполука Формули (I) повинна бути введена ссавцю, більш краще людині. Відповідно до другого аспекту винаходу, таким чином, забезпечується сполука Формули (I) як визначено вище, або її фармацевтично прийнятну сіль, для застосування як лікарський засіб. Відповідно до додаткового аспекту винаходу, забезпечується сполука Формули (I), як визначено вище, або її фармацевтично прийнятна сіль для застосування при лікуванні захворювання, опосередкованого PKB. У одному варіанті здійснення винаходу, вищезгадане захворювання, опосередковане PKB являє собою рак. В подальшому варіанті здійснення винаходу, вищезгаданий рак вибирають із раку яєчників, раку шийки матки, колоректального раку, раку молочної залози, раку підшлункової залози, гліоми, гліобластоми, меланоми, раку передміхурової залози, лейкемії, лімфоми, не-ходжкінської лімфоми, раку шлунка, раку легень, гепатоцелюлярного раку, раку шлунка, стромальних пухлин шлунково-кишкового тракту (GIST), гліоми, раку щитовидної залози, раку жовчних протоків, раку ендометрію, раку нирки, анапластичної крупноклітинної лімфоми, гострої мієлоїдної лейкемії (AML), множинної мієломи, меланоми та мезотеліоми. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку молочної залози, не-ходжкінської лімфоми, раку підшлункової залози, гепатоцелюлярного раку, раку шлунка, раку передміхурової залози та раку легень. В одному окремому варіанті здійснення, вищезгаданий рак являє собою рак молочної залози, більш переважно люмінальний рак молочної залози. Відповідно до додаткового аспекту винаходу, забезпечується застосування сполуки Формули (I), як визначено вище, або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування захворювання, опосередкованого PKB. У одному варіанті здійснення винаходу, вищезгадане захворювання, опосередковане PKB, являє собою рак. В подальшому варіанті здійснення винаходу, вищезгаданий рак вибирають із раку яєчників, раку шийки матки, колоректального раку, раку молочної залози, раку підшлункової залози, гліоми, 10 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 гліобластоми, меланоми, раку передміхурової залози, лейкемії, лімфоми, не-ходжкінської лімфоми, раку шлунка, раку легень, гепатоцелюлярного раку, раку шлунка, стромальних пухлин шлунково-кишкового тракту (GIST), гліоми, раку щитовидної залози, раку жовчних протоків, раку ендометрію, раку нирки, анапластичної крупноклітинної лімфоми, гострої мієлоїдної лейкемії (AML), множинної мієломи, меланоми та мезотеліоми. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку молочної залози, не-ходжкінської лімфоми, раку підшлункової залози, гепатоцелюлярного раку, раку шлунка, раку передміхурової залози та раку легень. В одному окремому варіанті здійснення, вищезгаданий рак являє собою рак молочної залози, більш переважно люмінальний рак молочної залози. Відповідно до додаткового аспекту винаходу, забезпечується застосування сполуки Формули (I), як визначено вище, або її фармацевтично прийнятної солі, для виготовлення лікарського засобу для лікування раку. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку яєчників, раку шийки матки, колоректального раку, раку молочної залози, раку підшлункової залози, гліоми, гліобластоми, меланоми, раку передміхурової залози, лейкемії, лімфоми, не-ходжкінської лімфоми, раку шлунка, раку легень, гепатоцелюлярного раку, раку шлунка, стромальних пухлин шлунково-кишкового тракту (GIST), гліоми, раку щитовидної залози, раку жовчних протоків, раку ендометрію, раку нирки, анапластичної крупноклітинної лімфоми, гострої мієлоїдної лейкемії (AML), множинної мієломи, меланоми та мезотеліоми. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку молочної залози, не-ходжкінської лімфоми, раку підшлункової залози, гепатоцелюлярного раку, раку шлунка, раку передміхурової залози та раку легень. В одному окремому варіанті здійснення, вищезгаданий рак являє собою рак молочної залози, більш переважно люмінальний рак молочної залози. Відповідно до додаткового аспекту винаходу, забезпечується спосіб застосування сполуки Формули (I), як визначено вище, або її фармацевтично прийнятної солі, для лікування раку. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку яєчників, раку шийки матки, колоректального раку, раку молочної залози, раку підшлункової залози, гліоми, гліобластоми, меланоми, раку передміхурової залози, лейкемії, лімфоми, не-ходжкінської лімфоми, раку шлунка, раку легень, гепатоцелюлярного раку, раку шлунка, стромальних пухлин шлунково-кишкового тракту (GIST), гліоми, раку щитовидної залози, раку жовчних протоків, раку ендометрію, раку нирки, анапластичної крупноклітинної лімфоми, гострої мієлоїдної лейкемії (AML), множинної мієломи, меланоми та мезотеліоми. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку молочної залози, не-ходжкінської лімфоми, раку підшлункової залози, гепатоцелюлярного раку, раку шлунка, раку передміхурової залози та раку легень. В одному окремому варіанті здійснення, вищезгаданий рак являє собою рак молочної залози, більш переважно люмінальний рак молочної залози. Відповідно до додаткового аспекту винаходу, забезпечується спосіб лікування людини, яка страждає від захворювання, при якому є корисним інгібування PKB, що включає стадії введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки Формули (I), як визначено вище, або її фармацевтично прийнятної солі. У одному варіанті здійснення винаходу, захворювання, при якому є корисним інгібування PKB, є рак. В подальшому варіанті здійснення винаходу, вищезгаданий рак вибирають із раку яєчників, раку шийки матки, колоректального раку, раку молочної залози, раку підшлункової залози, гліоми, гліобластоми, меланоми, раку передміхурової залози, лейкемії, лімфоми, не-ходжкінської лімфоми, раку шлунка, раку легень, гепатоцелюлярного раку, раку шлунка, стромальних пухлин шлунково-кишкового тракту (GIST), гліоми, раку щитовидної залози, раку жовчних протоків, раку ендометрію, раку нирки, анапластичної крупноклітинної лімфоми, гострої мієлоїдної лейкемії (AML), множинної мієломи, меланоми та мезотеліоми. У одному варіанті здійснення винаходу, вищезгаданий рак вибирають із раку молочної залози, не-ходжкінської лімфоми, раку підшлункової залози, гепатоцелюлярного раку, раку шлунка, раку передміхурової залози та раку легень. В одному окремому варіанті здійснення, вищезгаданий рак являє собою рак молочної залози, більш переважно люмінальний рак молочної залози. Протиракове лікування, описане вище, може застосовуватися у вигляді монотерапії або додатково до сполуки відповідно до винаходу, можна застосовувати звичайне хірургічне лікування, променеву терапію або хіміотерапію. Така хіміотерапія може включати один або декілька наступних класів протипухлинних засобів:(i) інші антипроліферативні/протипухлинні лікарські засоби та їх комбінації, які застосовуються в медичній онкології, такі як алкілувальні засоби (наприклад, цис-платин, оксалиплатин, карбоплатин, циклофосфамід, азотний іприт, мельфалан, хлорамбуцил, бусульфан, темозоламід та нітрозосечовини); антиметаболіти (наприклад, гемцитабін та 11 UA 100390 C2 5 10 15 20 25 30 35 40 45 50 55 60 антифолати, такі як фторпіримідини, подібні 5-фторурацилу та тегафуру, ралтитрексед, метотрексат, арабінозид цитозину, та гідроксисечовини); протипухлинні антибіотики (наприклад, антрацикліни, подібні адріаміцину, блеоміцину, доксорубіцину, дауноміцину, епірубіцину, ідарубіцину, мітоміцину-C, дактиноміцину та мітраміцину); антимітотичні засоби (наприклад, алкалоїди барвінку, подібні вінкристину, вінбластину, віндезину та вінорелбіну та таксоїди, подібні таксолу та таксотеру та інгібітори кінази); та інгібітори топоізомерази (наприклад, епіподофілотоксини, подібні етопозиду та теніпозиду, амсакрину, топотекану та камфотецину); (ii) цитостатичні засоби, такі як антиестрогени (наприклад, тамоксифен, фульвестрант, тореміфен, ралоксифен, дролоксифен та йодоксифен), антіандрогени (наприклад, бікалутамід, флутамід, нілутамід та ципротерон ацетат), LHRH антагоністи або LHRH агоністи (наприклад, гозерелін, лейпрорелін та бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, анастрозол, летрозол, воразол та ексеместан) та інгібітори 5 редуктази, такі як фінастерид; (iii) антиінвазійні засоби (наприклад, інгібітори родини c-Src кінази, подібні 4-(6-хлор-2,3метилендіоксіаніліно)-7-[2-(4-метилпіперазин-1-іл)етокси]-5-тетрагідропіран-4-ілоксихіназоліну (AZD0530; міжнародна патентна заявка WO 01/94341) та N-(2-хлор-6-метилфеніл)-2-{6-[4-(2гідроксіетил)піперазин-1-іл]-2-метилпіримідин-4-иламіно}тіазол-5-карбоксаміду (дазатиніб, BMS354825; J. Med. Chem., 2004, 47, 6658-6661), та інгібітори металопротеїнази, подібні маримастату, інгібітори функції рецептора активатора плазміногену урокіназного типу або антитіл до гепаранази); (iv) інгібітори дії факторів росту: наприклад, такі інгібітори включають антитіла до фактору росту та антитіла до рецепторів фактору росту (наприклад, анти-erbB2 антитіло трастузумаб [Herceptin™], анти-EGFR антитіло панітумумаб, анти-erbB1 антитіло цетуксимаб [Erbitux, C225] та будь-які антитіла до фактору росту або рецепторам фактора росту, описані Stern й ін. Critical reviews in oncology/haematology, 2005, т. 54, сс. 11-29); такі інгібітори також включають інгібітори тирозинкінази, наприклад, інгібітори родини фактора росту епідермісу (наприклад, інгібітори родини EGFR тирозинкіназ, такі як N-(3-хлор-4-фторфеніл)-7-метокси-6-(3морфолінопропокси)хіназолін-4-амін (гефітиніб, ZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксіетокси)хіназолін-4-амін (ерлотиніб, OSI-774) та 6-акриламідо-N-(3-хлор-4-фторфеніл)-7(3-морфолінопропокси)-хіназолін-4-амін (CI 1033), інгібітори erbB2 тирозинкінази, такі як лапатиніб, інгібітори родини фактора росту гепатоцитів, інгібітори родини фактора росту тромбоцитів такі як іматиніб, інгібітори серинових /треонінових кіназ (наприклад, інгібітори Ras/Raf шляху передачі сигналів, такі як інгібітори фарнезилтрансферази, наприклад, сорафеніб (BAY 43-9006)), інгібітори передачі сигналів в клітинах за допомогою MEK і/або AKT кіназ, інгібітори родини фактора росту гепатоцитів, c-kit інгібітори, інгібітори abl кінази, інгібітори кінази IGF рецептора (інсуліноподібного фактора росту); інгібітори аурора-кінази (наприклад, AZD1152, PH739358, VX-680, MLN8054, R763, MP235, MP529, VX-528 та AX39459) та інгібітори циклін-залежної кінази, такі як CDK2 і/або CDK4 інгібітори; (v) антіангіогенні засоби, такі як ті, які інгібують дії фактору росту ендотелію судин [наприклад, антитіло до фактору росту ендотеліальних клітин судин бевацизумаб (Avastin™) та інгібітори тирозинкінази рецептора VEGF, такі як 4-(4-бром-2-фтораніліно)-6-метокси-7-(1метилпіперидин-4-ілметокси)хіназолін (ZD6474; приклад 2 в заявці WO 01/32651), 4-(4-фтор-2метиліндол-5-ілокси)-6-метокси-7-(3-піролідин-1-ілпропокси)хіназолін (AZD2171; приклад 240 в заявці WO 00/47212), ваталаніб (PTK787; WO 98/35985) та SU11248 (сунітиніб; WO 01/60814), сполуки, такі як ті, що розкриті в міжнародних патентних заявках WO 97/22596, WO 97/30035, WO 97/32856 та WO 98/13354, та сполуки, які діють за іншими механізмами (наприклад, ліномід, інгібітори дії інтегрину v3 та ангіостатин)]; (vi) речовини, що ушкоджують судини, такі як комбрестатин A4, та сполуки, розкриті в міжнародних патентних заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 та WO 02/08213; (vii) антисенсова терапія, наприклад, така, яка направлена на мішені, перераховані вище, такі як ISIS 2503, антисенсова терапія на основі гену ras; (viii) підходи генної терапії, включаючи, наприклад, підходи на основі заміни аберантних генів, такі як способи аберації p53 або аберації BRCA1 або BRCA2, GDEPT (пролікарська терапія, спрямована на ген ферменту) підходи з використанням деамінази цитозину, тимідинкінази або бактеріальної нітроредуктази та підходи на основі підвищення стійкості пацієнта до хіміотерапії або радіотерапії, такі як генна терапія резистентності до багатьох лікарських засобів; та (ix) імунотерапевтичні підходи, включаючи, наприклад, підходи підвищення імуногенності пухлинних клітин пацієнта за умов ex vivo та in vivo, такі як трансфекція цитокінами, такими як 12 UA 100390 C2 5 10 15 інтерлейкін 2, інтерлейкін 4 або фактор стимуляції колоній гранулоцитів-макрофагів, підходи зниження анергії T-клітин, підходи з використанням трансфектованих імунних клітин, таких як цитокін-трансфектовані дендритні клітини, підходи з використанням цитокін-трансфектованих ліній пухлинних клітин та підходи з використанням анти-ідіотипічних антитіл. Сполуку відповідно до винаходу або її сіль можна одержати за допомогою будь-якого способу, відомого як придатний для одержання таких сполук або структурно споріднених сполук. Функціональні групи можуть бути захищені, та захист може бути знятий з використанням звичайних способів. Приклади захисних груп, таких як захисні групи для аміногрупи та карбонової кислоти (а також засобів утворення захисту та наступного його зняття), див. T.W. Greene та P.G.M. Wuts, "Protective Groups in Organic Synthesis", Second Edition, John Wiley & Sons, New York, 1991. Визначені способи синтезу сполук Формули (I) забезпечені як додаткова відмітна ознака винаходу. Таким чином, відповідно до додаткового аспекту винаходу, забезпечується спосіб одержання сполуки Формули (I) або її фармацевтично прийнятної солі, який включає спосіб (a), (b), (c) або (d) (де змінні, якщо не визначено інше, приймають значення, описані вище для сполук Формули (I)): (a) реакцію кислоти Формули (II) з аміном Формули (III): 1 P NH O (CH2)n HO 1 R NH2 N 4 1 R Z Y 2 5 Z R N H N (II) (III) 1 де P означає придатну захисну групу, наприклад трет-бутоксикарбоніл; (b) реакцію карбоксаміду Формули (IV) з біциклічним гетероциклом Формули (V): 1 NH2 R O L1 (CH2)n 1 N Z H Y 2 4 Z R 5 N N N R H H 20 (V) (IV) де L1 означає придатну відхідну групу, наприклад хлор; (c) коли n приймає значення 1, гідрування сполуки Формули (VI): або 1 R O N N H 4 R 5 (VI) N R 1 Z Y 2 Z N H 1 (d) коли R означає амінометил, гідрування сполуки Формули (VII): N 25 13 UA 100390 C2 P N 1 NH O (CH2)n N H 4 R N 5 R 1 Z Y 2 Z N 5 10 15 20 25 30 N H (VII) 1 де P означає придатну захисну групу, наприклад трет-бутоксикарбоніл; й потім, за необхідності: (i) перетворення сполуки Формули (I) на іншу сполуку Формули (I); (ii) видалення будь-яких захисних груп; і/або (iii) утворення її фармацевтично прийнятної солі. Приклади перетворень сполуки Формули (I) на іншу сполуку Формули (I) добре відомі спеціалісту в даній галузі техніки, та включають взаємоперетворення функціональних груп, такі як гідроліз, гідрування, гідрогеноліз, окиснення або відновлення, і/або додаткову функціоналізацію за допомогою стандартних реакцій, таких як амід- або метал-каталізоване сполучення, або реакції нуклеофільного заміщення. Характерні умови реакцій для способів (a), (b), (c) та (d), згаданих раніше, є наступними: Спосіб (a) - кислоти Формули (II) та аміни Формули (III) можуть реагувати разом в присутності придатного реагенту сполучення, наприклад гексафторфосфату O-(7азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (HATU), та придатної основи, наприклад N, N'-діізопропілетиламіну (DIPEA), в придатному розчиннику, наприклад диметилацетаміді (DMA), та при придатній температурі, наприклад від 50 до 70C, більш краще, при приблизно 60C; Спосіб (b) – карбоксаміди Формули (IV) та гетероцикли Формули (V) можуть реагувати разом в присутності придатної основи, наприклад N, N'-діізопропілетиламіну (DIPEA), в придатному розчиннику, наприклад бутан-1-олі, та при придатній температурі, наприклад від 50 до 70C, більш краще, при приблизно 60C; Способи (c) та (d) – сполуки Формули (VI) або (VII), розчинені в придатному розчиннику, наприклад етанолі, можна гідрувати під атмосферою водню в присутності придатного каталізатора, наприклад, нікелю Ренея, та придатної основи, наприклад гідроксиду амонію. Сполуки Формули (II) можуть бути одержані відповідно до Схеми 1: 1 P 1 P NH O NH O (CH2)n 1 HO (CH2)n L HO 1 Z NaHCO3 Y + 2 (II) N Z N Температура флєгми 1 N H N Z H Y 2 Z (VIII) (V) N N H Схема 1 1 1 де P означає придатну захисну групу, наприклад трет-бутоксикарбоніл, L означає придатну відхідну групу, наприклад хлор, та всі інші змінні приймають значення, описані вище. Сполуки Формули (IV) можуть бути одержані відповідно до Схеми 2: 14 UA 100390 C2 P 1 P NH O HO R + DIPEA DMA 20°C 4 R 2 5 R (III) (VIIIa) NH O (CH2)n N H NH2 N P 1 1 R (CH2)n 4 1 R 5 N R P (IVa) 2 HCl Діоксан 20°C 1 R NH2 O (CH2)n N H 4 R 5 N H R (IV) 5 Схема 2 1 2 де P та P означають придатні захисні групи, наприклад трет-бутоксикарбоніл, та всі інші змінні приймають значення, описані вище. Сполуки Формули (VI) можуть бути одержані відповідно до Схеми 3: O 1 R N 1 R HO + P DIPEA DMA 60°C 4 R N O NH2 5 1 R (III) (IX) N N H 4 R 5 N R (X) P 1 DCM ТФО 1 R O N N H 4 1 DIPEA DMA 90°C R 5 N R R 1 L 2 Z 1 (VI) Z Y 2 10 N Z N N H N H (V) + N N H 1 Z Y O 4 R 5 N H R (Xa) Схема 3 1 де P означає придатну захисну групу, наприклад трет-бутоксикарбоніл, та всі інші змінні приймають значення, описані вище. Сполуки Формули (VII) можуть бути одержані відповідно до Схеми 4: 15 UA 100390 C2 P NH O O N ((CH3)3Si)2NLi ТГФ N2 ацетонціангідрин 4 R 5 R 25°C (CH2)n O NH2 1 (II) N + 1 4 Z Y R 2 Z 5 R N H N HATU DIPEA DMA 50°C P N 1 NH O (CH2)n N H 4 R N 5 R 1 (VII) Z Y 2 Z N 5 10 15 20 25 30 N H Схема 4 1 де P означає придатну захисну групу, наприклад трет-бутоксикарбоніл, та всі інші змінні приймають значення, описані вище. Сполуки Формул (III), (V), (VIII) та (IX) доступні для придбання, відомі в літературі, одержуються за допомогою стандартних способів, відомих в рівні техніки, або можуть одержуватися відповідно до способів, описаних тут. Наступні приклади наведені в цілях ілюстрації й не призначені для обмеження обсягу цієї заявки. Кожна сполука, що ілюструється, являє специфічний та незалежний аспект винаходу. Всі вихідні речовини є доступними для придбання сполуками, або вони відомі в літературі, або вони одержуються за допомогою стандартних способів, відомих в рівні техніки. Як правило, стосовно наступних Прикладів: (i) температури наведені в градусах Цельсія (°C); операції проводили при кімнатній температурі або температурі навколишнього середовища, тобто, при температурі в діапазоні від 18 до 25 °C; (ii) органічні розчини сушили над безводним сульфатом магнію або безводним сульфатом натрію; упарювання розчинника проводили з використанням роторного випарника при зниженому тиску (600-4000 Паскаль; 4.5-30 ммHg) з температурою бані аж до 60 °C; (iii) хроматографія означає флеш-хроматографію на силікагелі; тонкошарову хроматографию (ТШХ) проводили на силікагелівих пластинках; (iv) загалом, протікання реакцій контролювали за допомогою ТШХ та / або аналітичної РХ-МС, а час реакцій, якщо приведений, дано винятково в ілюстративних цілях. (v) кінцеві продукти мали задовільний спектр протонного ядерного магнітного резонансу (ЯМР) і/або мас-спектральні дані; (vi) виходи приведені винятково в ілюстративних цілях та не є неодмінно тими, які можна одержати за допомогою старанного удосконалення способу; процес одержання повторювали, якщо була потрібна більша кількість речовини; (vii) ЯМР дані, коли приведені, знаходяться у вигляді значення дельта для головних відмітних протонів, наведених в мільйонних частках (м.ч.) відносно тетраметилсилану (ТМС) як внутрішнього стандарту, визначеного при 500 МГц з використанням пердейтеродиметилсульфоксиду (ДМСО-d6) як розчинника, якщо не зазначено інше; 16 UA 100390 C2 5 10 15 20 25 30 використовувалися наступні скорочення: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; bs, широкий синглет; (viii) хімічні символи мають їх звичайні значення; використовували одиниці та символи СІ; (ix) масс-спектр (МС) та дані РХ-МС були генеровані на системі РХ-МС, де ВЕРХ компонент включав звичайно або обладнання Agilent 1100, Waters Alliance HT (2790 & 2795) або помпу HP1100 та діодну матрицю з автосамплером CTC та працювали на колонці Phenomenex Gemini C18 5 мкм, 50 × 2 мм (або подібній) з елююванням або кислотним елюентом (наприклад, з використанням градієнту між 0-95 % води / в ацетонітрилі з 5 %-ами 1 %-вої мурашиної кислоти в 50:50 суміші вода:ацетонітрил (об./об.)), або основний елюент (наприклад, з використанням градієнту між 0-95 % води / в ацетонітрилі з 5 %-ами 0.1 %-вого 880 аміаку в ацетонітрильній суміші); а МС компонент включав звичайно мас-спектрометр Waters ZQ, що сканує при підходящому діапазоні мас. Були отримані хроматограми та зняті інтенсивності основних піків МС з позитивним та негативним режимом електророзпилення (ESI), та повного УФ поглинання при 220-300 нм, та наведені значення m/z; як правило, представлені тільки іони, які показують масу, що узгоджується з вихідною сполукою, й, якщо не зазначено інше, наведене значення + (M+H) відповідає режиму визначення позитивних іонів, а (M-H) відповідає режиму визначення негативних іонів; (x) якщо не визначено інше, сполуки, що містять асиметрично заміщений атом вуглецю і/або атом сірки не розділяли; (xi) будь-які мікрохвильові реакції проводили або в мікрохвильовій печі Biotage Optimizer EXP, або в мікрохвильовій печі CEM Explorer; (xii) препаративну високоефективну рідинну хроматографію (ВЕРХ) виконували на приладі від "Gilson instrument" з використанням наступних умов: Колонка: кремнеземна C18 з оберненою фазою, наприклад, Waters "Xbridge", кремнезем 5 мкм, 19 × 100 мм, або 30 × 100 мм, з використанням суміші розчинників з полярністю, що зменшується, як елюент (зменшуване відношення Розчинник A - Розчинник B) Розчинник A: Вода с 1 % гідроксидом амонію Розчинник B: Ацетонітрил Швидкість потоку: 28 мл / хв або 61 мл / хв Градієнт: Пристосований спеціально для кожної сполуки – звичайно тривалістю 7-10 хв Довжина хвилі: 254 нм Скорочення Boc трет-бутоксикарбоніл CAS™ Хімічна реферативна служба ДХМ дихлорметан DIPEA N, N'-діізопропілетиламін DEA діетиламін DMA диметилацетамід ДМФА диметилформамід HATU гексафторфосфат O-(7азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію РХМС рідинна хроматографія – мас спектроскопія LDA діізопропіламід літію РХСТ рідинна хроматографія середнього тиску NМП N-метилпіролідинон OBD Optimum Bed Density ("оптимальна густина набивки") ПТФЕ політетрафторетилен SCX катіонообмінна (сильний катіон) НРХ надкритична рідинна хроматографія TBME т-бутилметиловий ефір TEA триетиламін ТФО трифтороцтова кислота 17 UA 100390 C2 ТГФ тетрагідрофуран Приклад 1: 4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід O NH2 N H Cl N N N H 4-(трет-Бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонову кислоту (Проміжна сполука 1) (362 мг), 1-(4-хлорфеніл)етанамін (172 мг), N-(3диметиламінопропіл)-3-етилкарбодіімід (231 мг) та 1-гідроксибензотриазол (163 мг) перемішували разом в ДМФА (2 мл) під азотом впродовж 16 годин. Реакційну суміш розподіляли між EtOAc (20 мл) та розчином солі (4 × 20 мл). Органіку об'єднували, сушили над MgSO4 та упарювали в вакуумі. Одержувану у результаті білу тверду речовину розчиняли в 1,4діоксані (5 мл) та додавали 4M розчин HCl в 1,4-діоксані (5 мл). Одержувану суміш перемішували впродовж 16 годин, потім розбавляли діетиловим ефіром (50 мл). Сирий продукт виділяли за допомогою фільтрування у вигляді HCl-солі, яку очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M аміаку/MeOH, та чисті фракції упарювали досуха. Речовину очищали за допомогою препаративної РХМС, використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксаміду у вигляді білої твердої речовини (168 мг, 42 %). 1H ЯМР (d6-ДМСО, 400МГц) 1.33-1.49 (m, 5H), 1.84-2.04 (m, 2H), 2.12-2.22 (br s, 2H), 3.54 (t, 2H), 4.39 (t, 2H), 4.81-4.92 (m, 1H), 6.55-6.59 (m, 1H), 7.13-7.18 (m, 1H), 7.31-7.39 (m, 4H), 8.12 (s, 1H), 8.30 (d, 1H), 11.62 (s, 1H). МС m/e MH+399. Приклад 2: (S)-4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксамід O N 5 10 15 20 25 NH2 N H Cl N N N H До 4-(трет-бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонової кислоти (Проміжна сполука 1) (0.361 г), (S)-1-(4-хлорфеніл)етанаміну (0.140 мл) та DIPEA (0.524 мл) в DMA (10 мл) при 25ºC під азотом однією порцією додавали гексафторфосфат O-(7азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (0.418 г). Одержуваний розчин перемішували при 60ºC впродовж 4 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M NH3/MeOH, та чисті фракції упарювали досуха. Цю сиру речовину потім обробляли 20 % розчином ТФО в ДХМ (10 мл) та перемішували при кімнатній температурі. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M аміаку/MeOH, та чисті фракції упарювали досуха. Речовину очищали за допомогою препаративної РХМС, використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням (S)-4-аміно-NN 30 35 18 UA 100390 C2 5 (1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду у вигляді білої твердої речовини (0.281 г, 70.4 %). 1H ЯМР (400.13 МГц, ДМСО-d6) δ 1.37 (3H, d), 1.42-1.45 (2H, m), 1.88-2.01 (2H, m), 2.27 (2H, s), 3.49-3.59 (2H, m), 4.34-4.44 (2H, m), 4.83-4.90 (1H, m), 6.57-6.58 (1H, m), 7.14-7.16 (1H, m), 7.32-7.38 (4H, m), 8.12 (1H, s), 8.30 (1H, d), 11.62 (1H, s). + МС m/e MH 399. Приклад 3: 4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід O NH2 N H Cl N N N H До 4-(трет-бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонової кислоти (Проміжна сполука 1) (0.181 г), 1-(4-хлорфеніл)пропан-1-аміну (0.085 г) та DIPEA (0.262 мл) в DMA (10 мл) при 25ºC під азотом однією порцією додавали гексафторфосфат O-(7азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (0.209 г). Одержуваний розчин перемішували при 60ºC впродовж 4 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха. Цю сиру речовину потім обробляли 20 % розчином ТФО в ДХМ (10 мл) та перемішували при кімнатній температурі впродовж 2 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха. Речовину очищали за допомогою препаративної РХМС, використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % аміаку) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксаміду у вигляді білої твердої речовини (0.138 г, 66.8 %). 1 H ЯМР (400.13 МГц, ДМСО-d6) δ 0.87 (3H, t), 1.42-1.55 (2H, m), 1.72-1.79 (2H, m), 1.91-2.05 (2H, m), 2.21 (2H, s), 3.54-3.62 (2H, m), 4.38-4.45 (2H, m), 4.65-4.70 (1H, m), 6.61 (1H, dd), 7.18 (1H, dd), 7.32-7.37 (4H, m), 8.31 (1H, d), 8.12 (1H, s). + МС m/e MH 413. Приклади 3A та 3B: (S)-4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід та (R)-4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксамід N 10 15 20 25 30 O O NH2 N H Cl Cl N N N N N 35 40 NH2 N H N H N N H Рацемічний 4-аміно-N-(1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксамід (Приклад 3) очищали за допомогою препаративної хіральної ВЕРХ. Фракції, що містять цільову сполуку, упарювали досуха з одержанням Ізомеру 1 (елююється першим, 41 мг) у вигляді білої твердої речовини, та Ізомеру 2 (елююється другим, 41 мг) у вигляді білої твердої речовини. Аналітичні дані були ідентичні таким вихідного зразка. Хіральний аналітичний ВЕРХ аналіз (з використанням 20 мкм колонки Chiralpak AS (250 мм x 4.6 мм), з елюентною сумішшю ізо-гексан/(EtOH/MeOH 50/50)/TEA 90/10/0.1, 1 мл/хв при 25C, інжектування 10 мкл 1 мг/мл розчину в EtOH) показував, що кожний енантіомер є відмінним один від одного та енантіомерно чистим (e.e. = 100 %). 19 UA 100390 C2 Приклад 4: 4-аміно-N-((4-хлорфеніл)(циклопропіл)метил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід O NH2 N H Cl N N N H До 4-(трет-бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонової кислоти (Проміжна сполука 1) (0.181 г), (4-хлорфеніл)(циклопропіл)метанаміну (Проміжна сполука 3) (0.091 г) та DIPEA (0.261 мл) в DMA (5 мл) при 25ºC додавали гексафторфосфат O(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (0.228 г). Одержуваний розчин перемішували при 50 °C впродовж 1 години. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха. Цю сиру речовину суспендували в дихлорметані (25 мл), та додавали ТФО (5 мл). Реакційну суміш перемішували впродовж 1 години, потім сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха з одержанням сирої речовини у вигляді білої твердої речовини. Речовину розтирали під холодним метанолом з одержанням чистого продукту, 4-аміно-N-((4-хлорфеніл)(циклопропіл)метил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксаміду, у вигляді білої твердої речовини (0.167 г, 79 %). 1 H ЯМР (400.13 МГц, ДМСО-d6) δ 0.27-0.37 (2H, m), 0.48-0.52 (2H, m), 1.18-1.24 (1H, m), 1.401.48 (2H, m), 1.88-2.02 (2H, m), 2.20 (2H, s), 3.50-3.59 (2H, m), 4.15 (1H, t), 4.36-4.42 (2H, m), 6.576.58 (1H, m), 7.14-7.16 (1H, m), 7.35-7.40 (4H, m), 8.12 (1H, s), 8.47 (1H, d), 11.62 (1H, s). + МС m/e MH 425. Приклад 5: 4-аміно-N-(2-аміно-1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід NH2 O N 5 10 15 20 NH2 N H Cl N N N 25 30 35 40 N H До трет-бутил 4-(2-аміно-1-(4-хлорфеніл)етилкарбамоїл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-ілкарбамату (Проміжна сполука 6) (0.514 г) в ДХМ (100 мл) при 25ºC додавали трифтороцтову кислоту (3 мл). Одержуваний розчин перемішували при 25 °C впродовж 3 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M NH 3/MeOH, та чисті фракції упарювали досуха. Сирий продукт очищали за допомогою препаративної ВЕРХ (колонка Waters XBridge Prep C18 OBD, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха. Речовину потім додатково очищали за допомогою флеш-хроматографії на кремнеземі, елюювання градієнтом 0-10 % метанольного аміаку (7н.) в ДХМ. Чисті фракції упарювали досуха з одержанням 4-аміно-N-(2аміно-1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду у вигляді безбарвної смоли (0.047 г, 11.4 %). 1H ЯМР (400.13 МГц, ДМСО-d6) δ 1.41-1.51 (2H, m), 1.86-1.94 (2H, m), 1.97-2.05 (2H, m), 2.772.86 (2H, m), 3.18 (2H, s), 3.51-3.59 (2H, m), 4.35-4.44 (2H, m), 4.70 (1H, t), 6.58 (1H, d), 7.15 (1H, d), 7.30-7.32 (2H, m), 7.35-7.37 (2H, m), 8.12 (1H, s), 8.41 (1H, s), 11.62 (1H, s). 20 UA 100390 C2 + МС m/e MH 414. Приклад 6: (S)-4-(амінометил)-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід O NH2 N H Cl N N N H До (S)-трет-бутил (4-(1-(4-хлорфеніл)етилкарбамоїл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-іл)метилкарбамату (Проміжна сполука 13) (0.257 г, 0.5 ммоль) в ДХМ (20 мл) при 25ºC додавали трифтороцтову кислоту (2 мл, 25.96 ммоль). Одержуваний розчин перемішували при 25 °C впродовж 1 години. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M NH3/MeOH, та чисті фракції упарювали досуха. Сирий продукт очищали за допомогою флеш-хроматографії на кремнеземі, елюювання градієнтом 0-10 % 7н. аміаку/MeOH в ДХМ. Чисті фракції упарювали досуха з одержанням (S)-4-(амінометил)-N-(1-(4хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (0.095 г, 46.0 %) у вигляді білої твердої речовини. 1H ЯМР (400.13 МГц, ДМСО-d6) δ 1.39 (3H, d), 1.43-1.50 (4H, m), 2.05-2.14 (2H, m), 2.69 (2H, s), 3.37-3.47 (2H, m), 4.20-4.25 (2H, m), 4.96-5.04 (1H, t), 6.55 (1H, d), 7.15 (1H, d), 7.37 (4H, s), 8.11 (1H, s), 8.49 (1H, d), 11.61 (1H, s). + МС m/e MH 413. Приклад 7: 4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід N 5 10 15 20 HO O Cl NH2 N H N N N 25 30 35 N H До трет-бутил 4-(1-(4-хлорфеніл)-4-гідроксибутилкарбамоїл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-ілкарбамату (Проміжна сполука 17) (140 мг, 0.26 ммоль) при 20 °C додавали трифтороцтову кислоту (2 мл, 25.96 ммоль) та одержуваний розчин перемішували впродовж 1 години. Розчин потім розбавляли метанолом, наносили на 10 г SCX колонку, та елюювали метанолом й, потім, 2н. NH3/MeOH. Фракції, що містять продукт, об'єднували, концентрували шляхом упарювання та очищали за допомогою препаративної ВЕРХ (колонка Waters XBridge Prep C18 OBD, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)-4гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (58.0 мг, 50.8 %) у вигляді безбарвної твердої речовини. 1H ЯМР (399.902 МГц, ДМСО) δ 1.28-1.51 (4H, m), 1.69-1.80 (2H, m), 1.90-2.03 (2H, m), 3.373.41 (2H, m), 3.50-3.58 (2H, m), 4.37-4.43 (3H, m), 4.71-4.76 (1H, m), 6.59 (1H, m), 7.16 (1H, m), 7.36 (4H, m), 8.13 (1H, s), 8.33 (1H, d), 11.64 (1H, s). + МС m/e MH 443. Приклади 7A та 7B: (S)-4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксамід та (R)-4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід 21 UA 100390 C2 HO HO O O NH2 N H Cl Cl N N N N N H N 5 10 15 20 NH2 N H N N H До 4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)піперидин-4-карбоксаміду (Проміжна сполука 72) (1.04 г, 3.19 ммоль) та 4-хлор-7H-піроло[2,3-d]піримідину (0.490 г, 3.19 ммоль) у етанолі (15.96 мл) при 25ºC додавали DIPEA (2.85 мл, 16.0 ммоль). Одержуваний розчин перемішували при 65ºC впродовж ночі. Сирий продукт аналізували за допомогою РХМС та упарювали досуха. Сиру тверду речовину потім очищали за допомогою іонообмінної хроматографії, використовуючи колонку SCX-2. Продукт елюювали із колонки з використанням 20 % 7н. аміаку в метанолі / ДХМ. Сиру суміш потім повторно очищали за допомогою флеш-хроматографії на кремнеземі (елюент 0-10 % 7н. аміаку / MeOH в ДХМ) та чисті фракції упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)-4-гідроксибутил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксаміду (63.9 %) (рацемат) у вигляді дрібнозернистої твердої речовини. Потім здійснювали хіральне розділення рацемату за допомогою надкритичної рідинної хроматографії (НРХ) з одержанням чистих енантіомерів з виходами 272 мг (19 %) та 245 мг (17 %) відповідно. ЯМР спектри обох енантіомерів були ідентичними. 1 H ЯМР (400.13 МГц, ДМСО) 1.38-1.42 (2H, m), 1.46-1.49 (2H, d), 1.74 (2H, s), 1.92-2.03 (2H, m), 2.19 (2H, s), 3.55-3.58 (2H, d), 4.38 (1H, s), 4.41 (2H, s), 4.75-4.76 (1H, d), 6.59 (1H, s), 7.17 (1H, s), 7.36 (4H, s), 8.15 (1H, s), 8.32-8.34 (1H, d), 11.65 (1H, s, обмін); + МС m/e MH 443; ВЕРХ tR=1.66 хв. Приклад 8: 4-аміно-N-(1-(4-хлорфеніл)-2-гідроксіетил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід HO O NH2 N H Cl N N N 25 30 35 N H трет-Бутил 4-(1-(4-хлорфеніл)-2-гідроксіетилкарбамоїл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-ілкарбамат (Проміжна сполука 18) (137 мг, 0.27 ммоль) обробляли трифтороцтовою кислотою (2 мл). Розчин перемішували впродовж 1 години при кімнатній температурі. Суміш концентрували при зниженому тиску. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Залишок загружали в колонку в метанолі та промивали метанолом. Цільовий продукт елюювали із колонки з використанням 2M аміаку в метанолі та чисті фракції упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)2-гідроксіетил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (111 мг, кількісн.) у вигляді безбарвної кристалічної твердої речовини. 1 H ЯМР (399.9 МГц, ДМСО-d6) δ 1.40-1.49 (2H, m), 1.85-2.09 (2H, m), 3.48-3.69 (4H, m), 4.354.48 (2H, m), 4.72-4.81 (1H, m), 4.90-4.96 (1H, m), 6.58 (1H, br, s), 7.12-7.18 (1H, m), 7.30-7.40 (4H, m), 8.13 (1H, s), 8.45-8.53 (1H, m), 11.64 (1H, s) m/z (ESI+) (M+H)+ = 415; ВЕРХ tR=1.57 хв. Приклад 9: (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід (E9) 22 UA 100390 C2 OH O Cl NH2 N H N N N H До (S)-трет-бутил 4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 22) (1.27 г, 2.40 ммоль) в дихлорметані (20 мл) додавали HCl (4M в діоксані) (3.00 мл, 12.00 ммоль). Одержувану суспензію перемішували при 20 °C впродовж 16 годин. Реакційну суміш фільтрували через ПТФЕ чашковий фільтр, та сиру тверду речовину очищали за допомогою препаративної ВЕРХ (колонка Waters XTerra C18, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % ТФО) та MeCN як елюенти. Фракції, що містять цільову сполуку, очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7M NH3/MeOH, та чисті фракції упарювали досуха з одержанням (S)-4-аміно-N(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (0.200 г, 19.4 %) у вигляді білої твердої речовини. 1H ЯМР (399.9 МГц, ДМСО-d6) δ 1.45 (2H, d), 1.86 (1H, d), 1.90-1.93 (1H, m), 2.19 (2H, s), 3.38 (2H, q), 3.51-3.58 (2H, m), 4.35-4.38 (2H, m), 4.53 (1H, t), 4.88 (1H, d), 6.58 (1H, t), 7.16 (1H, t), 7.32-7.38 (4H, m), 8.12 (1H, s), 8.43 (1H, d), 11.63 (1H, s), m/z (ESI+) (M+H)+ = 429; ВЕРХ tR=1.46 хв. Приклад 9 альтернативний шлях 1: (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід N 5 10 15 OH O Cl NH2 N H N N N 20 25 30 35 N H До (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)піперидин-4-карбоксаміду (Проміжна сполука 49) (1 г, 3.21 ммоль) та 4-хлор-7H-піроло[2,3-d]піримідину (0.493 г, 3.21 ммоль) в бутан1-олі (15 мл) додавали N-етилдіізопропіламін (1.676 мл, 9.62 ммоль). Одержуваний розчин перемішували при 60 °C впродовж 18 годин. Реакційну суміш розбавляли EtOAc (50 мл), та послідовно промивали водою (25 мл) та насиченим розчином солі (25 мл). Органічний шар сушили над MgSO4, фільтрували та упарювали з одержанням сирого продукту. Сирий продукт очищали за допомогою флеш-хроматографії на кремнеземі, елюювання градієнтом 0-6 % MeOH аміаку в ДХМ. Чисті фракції упарювали досуха з одержанням (S)-4-аміно-N-(1-(4-хлорфеніл)-3гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (842 мг) у вигляді білої піни. (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід перемішували в етилацетаті (7 мл) впродовж 18 годин. Тверду речовину збирали шляхом фільтрування, промивали невеликою кількістю етилацетату та сушили в вакуумній шафі при 55 °C впродовж 18 годин з одержанням (S)-4-аміно-N-(1-(4хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (0.585 г, 42.5 %) у вигляді білої твердої речовини. m/z (ES+) (M+H)+ = 429; ВЕРХ tR=1.60 хв. 23 UA 100390 C2 5 1H ЯМР (400.13 МГц, ДМСО-d6) δ 1.39-1.47 (2H, m), 1.80-2.02 (4H, m), 2.17 (2H, s), 3.35-3.40 (2H, m), 3.50-3.59 (2H, m), 4.34-4.41 (2H, m), 4.53 (1H, t), 4.88 (1H, d), 6.57 (1H, m), 7.14-7.16 (1H, m), 7.31-7.37 (4H, m), 8.12 (1H, s), 8.42 (1H, d), 11.62 (1H, s) Приклад 9 альтернативний шлях 2: (S)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід HO O NH2 N H N Cl N N H До 4-(трет-бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонової кислоти (Проміжна сполука 1) (4 г, 11.07 ммоль) та DIPEA (5.80 мл, 33.20 ммоль) в DMA (40 мл) однією порцією додавали (S)-3-аміно-3-(4-хлорфеніл)пропан-1-ол (Проміжна сполука 47) (2.055 г, 11.07 ммоль). Додавали HATU (4.63 г, 12.18 ммоль) та одержуваний розчин перемішували при 20 °C впродовж 24 годин. Реакційну суміш упарювали досуха, потім розбавляли EtOAc (300 мл), та послідовно промивали водою (50 мл) та насиченим розчином солі (50 мл). Органічний шар сушили над MgSO4, фільтрували та упарювали з одержанням сирого продукту. Сирий продукт очищали за допомогою флеш-хроматографії на кремнеземі, елюювання градієнтом 26 % MeOH аміаку в ДХМ. Чисті фракції упарювали досуха та розтирали з діоксаном (40 мл) з одержанням (S)-трет-бутил 4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 22) (4.82 г, 82 %) у вигляді білої твердої речовини. (S)-трет-бутил 4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-ілкарбамат (Проміжна сполука 22) (4.82 г, 82 %) суспендували в діоксані (40.0 мл) та додавали 4M хлороводень в діоксані (7.69 мл, 221.36 ммоль). Реакційну суміш перемішували при температурі оточуючого середовища впродовж 2 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 3.5M NH 3/MeOH, та чисті фракції упарювали досуха. Сирий продукт очищали за допомогою препаративної ВЕРХ (колонка Waters XBridge Prep C18 OBD, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням (S)-4-аміно-N(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (1.200 г, 25.3 %) у вигляді білої твердої речовини. m/z (ES+) (M+H)+ = 429; ВЕРХ tR=1.67 хв. 1 H ЯМР співпадає з попереднім. Приклад 10: N-(3-ацетамідо-1-(4-хлорфеніл)пропіл)-4-аміно-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід N 10 15 20 25 30 HN O O Cl NH2 N H N N N 35 N H До трет-бутил 4-(3-ацетамідо-1-(4-хлорфеніл)пропілкарбамоїл)-1-(7H-піроло[2,3-d]піримідин4-іл)піперидин-4-ілкарбамату (Проміжна сполука 28) (98 мг, 0.17 ммоль) в ДХМ (4 мл) при 20ºC 24 UA 100390 C2 5 10 додавали хлороводень (4M) в 1,4-діоксані (0.430 мл, 1.72 ммоль). Одержувану суспензію перемішували при 20 °C впродовж 70 годин. Реакційну суміш упарювали досуха. Сирий продукт очищали за допомогою препаративної ВЕРХ (колонка Waters XTerra C18, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням N-(3-ацетамідо-1-(4-хлорфеніл)пропіл)-4-аміно-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксаміду (15.00 мг, 18.5 %) у вигляді білої сухої плівки. 1H ЯМР (399.9 МГц, ДМСО-d6) δ 1.42-1.47 (2H, m), 1.79 (3H, s), 1.85 (1H, t), 1.89-1.93 (1H, m), 2.10 (2H, s), 3.00 (2H, t), 3.55 (2H, d), 4.36-4.40 (2H, m), 4.80 (1H, d), 6.58-6.60 (1H, m), 7.16 (1H, t), 7.34-7.39 (4H, m), 7.80 (1H, t), 8.13 (1H, s), 8.39 (1H, s), 11.64 (1H, s) невидимий NH2. m/z (ESI+) (M+H)+ = 470; ВЕРХ tR=1.56 хв. Приклад 11: 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксамід Cl N O N H NH2 N N N H N 15 20 25 До трет-бутил 4-(1-(4-хлорфеніл)-3-(диметиламіно)пропілкарбамоїл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 34) (0.045 г, 0.08 ммоль) у суміші ДХМ (5 мл) та метанолу (2 мл) при 22 ºC додавали хлороводень (4M в 1,4-діоксані, 1.01 мл, 4.05 ммоль). Одержуваний розчин перемішували при 22 °C впродовж 16 годин. Суміш упарювали, та залишок очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 2M NH 3/MeOH, та чисті фракції упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (0.034 г, 92 %) у вигляді безбарвної смоли. 1H ЯМР (399.902 МГц, CDCl3) δ 1.57 (2H, m), 1.66 (2H, br.s), 1.81 (1H, m), 2.02 (1H, m), 2.18 (6H, s), 2.18-2.36 (4H, m), 3.67 (3H, m), 4.50 (2H, m), 5.00 (1H, dt), 6.52 (1H, d), 7.05 (1H, d), 7.18 (2H, d), 7.29 (2H, d), 8.33 (1H, s), 9.07 (1H, d), 9.61 (1H, s). + МС m/e MH 456 Приклади 11A та 11B: (S)-4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід та (R)-4-аміно-N-(1-(4-хлорфеніл)-3(диметиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксамід Cl Cl N N O N H O NH2 N H NH2 N N N N N 30 35 N H N N H Хіральне розділення рацемічного 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (Приклад 11) (231 мг, 0.51 ммоль) здійснювали на колонці Chiralpak AD-H SFC (250 мм x 20 мм), з використанням надкритичної рідинної хроматографії, елюювання розчинником 7:3 CO 2/(EtOH+0.1 % DEA). Відповідні фракції ізомеру, що елююється першим, упарювали та залишок розтирали з діетиловим ефіром з 25 UA 100390 C2 5 10 15 одержанням 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксаміду (59 мг, 25 %) у вигляді білої твердої речовини. 1H ЯМР (399.902 МГц, ДМСО) δ 1.43 (2H, ddd), 1.83 (2H, dt), 1.86-2.01 (2H, m), 2.11 (6H, s), 2.14 (2H, t), 3.56 (2H, ddd), 4.39 (2H, ddd), 4.83 (1H, dt), 6.58 (1H, dd), 7.16 (1H, dd), 7.33 (2H, d), 7.37 (2H, d), 8.13 (1H, s), 8.61 (1H, d), 11.63 (1H, s). + МС m/e MH 456.5. Відповідні фракції ізомеру, що елююється другим, упарювали та залишок розтирали з діетиловим ефіром з одержанням 4-аміно-N-(1-(4-хлорфеніл)-3-(диметиламіно)пропіл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (43 мг, 19 %) у вигляді білої твердої речовини. 1H ЯМР (399.902 МГц, ДМСО) δ 1.43 (2H, ddd), 1.83 (2H, dt), 1.86-2.01 (2H, m), 2.11 (6H, s), 2.14 (2H, t), 3.56 (2H, ddd), 4.39 (2H, ddd), 4.83 (1H, q), 6.58 (1H, dd), 7.16 (1H, dd), 7.33 (2H, d), 7.37 (2H, d), 8.13 (1H, s), 8.61 (1H, d), 11.63 (1H, s). + МС m/e MH 456.4, 458.4 Приклад 12: 4-(амінометил)-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксамід Cl HO O N H NH2 N N N 20 25 30 35 40 N H До 4-((трет-бутоксикарбоніламіно)метил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбонової кислоти (Проміжна сполука 12) (100 мг, 0.27 ммоль) та N, N-діізопропілетиламіну (0.055 мл, 0.32 ммоль) в NМП (5 мл) при 22 ºC додавали гексафторфосфат O-(7азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (106 мг, 0.28 ммоль). Одержуваний розчин перемішували при 50 ºC впродовж 10 хвилин, потім охолоджували до температури оточуючого середовища. Додавали 3-аміно-3-(4-хлорфеніл)пропан-1-ол (Проміжна сполука 29) (49.5 мг, 0.27 ммоль) у вигляді розчину в NМП (2 мл), й суміш перемішували при 22 °C впродовж 16 годин. Додавали 4M HCl в діоксані (1 мл), й суміш перемішували при 22 ºC впродовж додаткових 24 годин. Суміш концентрували, та залишок очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 30 % (2M NH3 в MeOH) в ДХМ, та чисті фракції упарювали досуха з одержанням сирого продукту. Сирий продукт очищали за допомогою препаративної ВЕРХ (колонка Waters XBridge Prep C18 OBD, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % NH3) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням 4-(амінометил)-N-(1-(4хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбоксаміду (0.095 г, 81 %) у вигляді білої твердої речовини. 1H ЯМР (399.902 МГц, ДМСО) δ 1.47 (2H, m), 1.80-1.96 (2H, m), 2.09 (2H, m), 2.69 (1H, s), 3.27-3.45 (4H, m), 4.26 (2H, ddd), 5.02 (1H, dd), 6.56 (1H, d), 7.15 (1H, d), 7.33-7.39 (4H, m), 8.12 (1H, s), 8.44 (1H, d), 11.63 (1H, s). + МС m/e MH 556 Приклад 13: 4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід 26 UA 100390 C2 OH O NH2 N H Cl N N N H N 5 10 15 До суспензії трет-бутил 4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 36) (175 мг, 0.33 ммоль) в дихлорметані (7 мл) під аргоном додавали ТФО (0.7 мл). Одержуваний розчин перемішували при 20 °C впродовж 16 годин. Розчинники видаляли у вакуумі та реакційну суміш очищали за допомогою препаративної ВЕРХ, використовуючи колонку з оберненою фазою Waters X-Bridge (C-18, кремнезем 5 мікрон, діаметр 19 мм, довжина 100 мм) та суміші з полярністю, що зменшується, води (що містить 0.2 % карбонат амонію) та ацетонітрилу як елюент. Чисті фракції упарювали досуха з одержанням 4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-карбоксаміду (99 мг, 69.8 %) у вигляді білого порошку. 1H ЯМР (500 МГц, ДМСО-d6) δ 1.38-1.46 (2H, m), 1.81-1.91 (4H, m), 2.25 (2H, br s), 3.48 (2H, m), 3.35-3.54 (2H, m), 4.35-4.41 (2H, m), 4.57 (1H, t), 4.87 (1H, m), 6.58 (1H, d), 7.16 (1H, d), 7.317.37 (4H, m), 8.11 (1H, s), 8.45 (1H, d), 11.65 (1H, s). m/z (ESI+) (M+H)+ = 429; ВЕРХ tR=1.58 хв. Приклад 14: 4-аміно-N-(3-аміно-1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід NH2 O NH2 N H Cl N N N 20 25 N H До перемішуваної суспензії трет-бутил 4-(3-аміно-1-(4-хлорфеніл)пропілкарбамоїл)-1-(7Hпіроло[2,3-d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 38) (7.0 мг) в ДХМ (1 мл) під аргоном при 25 °C додавали трифтороцтову кислоту (0.05 мл). Одержувану суспензію перемішували при 25 °C впродовж 2 днів. Реакційну суміш упарювали досуха з одержанням диТФО солі 4-аміно-N-(3-аміно-1-(4-хлорфеніл)пропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин4-карбоксаміду у вигляді частково отверділого масла (13.0 мг). 1 H ЯМР (500 МГц, ДМСО-d6) δ 1.86 (1H, d), 2.01 (2H, m), 2.08 (1H, m) 2.41 (2H, m), 2.69 (2H, m), 2.85 (1H, m), 3.61 (2H, t), 4.63 (2H, t), 5.02 (1H, q), 6.82 (1H, s), 7.36 (1H, t), 7.41 (2H, d), 7.49 (2H, d), 7.93 (3H, s br), 8.32 (1H, s), 8.59 (3H, s br), 8.96 (1H, d). + МС m/e MH 428. Приклад 15: (R)-4-аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід 27 UA 100390 C2 OH O Cl NH2 N H N N N H N 5 10 15 До (R)-трет-бутил 4-(1-(4-хлорфеніл)-3-гідроксипропілкарбамоїл)-1-(7H-піроло[2,3d]піримідин-4-іл)піперидин-4-ілкарбамату (Проміжна сполука 42) (0.160 г, 0.30 ммоль) в ДХМ (3 мл) додавали HCl (4M в діоксані) (0.378 мл, 1.51 ммоль). Одержувану суспензію перемішували при 20 °C впродовж 3 годин. Реакційну суміш упарювали. Сирий продукт очищали за допомогою препаративної ВЕРХ (колонка Waters XTerra C18, кремнезем 5 мкм, діаметр 19 мм, довжина 100 мм), використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % аміаку) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням (R)-4аміно-N-(1-(4-хлорфеніл)-3-гідроксипропіл)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксаміду (0.051 г, 39.3 %) у вигляді білої твердої речовини. 1 H ЯМР (399.9 МГц, ДМСО-d6) δ 1.46 (2H, d), 1.86 (1H, d), 1.90-1.93 (1H, m), 2.10 (2H, m), 3.37 (1H, t), 3.55 (2H, d), 4.40 (2H, d), 4.53 (2H, m), 4.88 (1H, d), 6.58 (1H, t), 7.16 (1H, t), 7.32-7.38 (4H, m), 8.14 (1H, d), 8.43 (1H, d), 11.63 (1H, s) невидимий NH2. + МС m/e MH 429; ВЕРХ tR=1.46 хв. Приклад 16: (R)-4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід O NH2 N H Cl N N N 20 25 30 35 N H До 4-(трет-бутоксикарбоніламіно)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4-карбонової кислоти (Проміжна сполука 1) (0.361 г, 1 ммоль), (R)-1-(4-хлорфеніл)етанаміну (0.156 г, 1.00 ммоль) та DIPEA (0.524 мл, 3.00 ммоль) в DMA (10 мл) при 25ºC під азотом однією порцією додавали гексафторфосфат O-(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (0.418 г, 1.10 ммоль). Одержуваний розчин перемішували при 60ºC впродовж 4 годин. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха. Сиру речовину обробляли 10 % розчином ТФО в ДХМ (5 мл) та перемішували при кімнатній температурі. Сирий продукт очищали за допомогою іонообмінної хроматографії, використовуючи SCX колонку. Цільовий продукт елюювали із колонки з використанням 7н. аміаку/MeOH, та чисті фракції упарювали досуха. Сирий продукт очищали за допомогою препаративної РХМС, використовуючи суміші з полярністю, що зменшується, води (яка містить 1 % аміаку) та MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали досуха з одержанням (R)-4-аміно-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4-іл)піперидин-4карбоксаміду (0.211 г, 52.9 %) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, ДМСО) δ 1.37 (3H, d), 1.39-1.48 (2H, m), 1.86-2.02 (2H, m), 2.19 (2H, s), 3.49-3.58 (2H, m), 4.34-4.43 (2H, m), 4.83-4.91 (1H, m), 6.56-6.59 (1H, m), 7.14-7.16 (1H, m), 7.327.38 (4H, m), 8.12 (1H, s), 8.30 (1H, d), 11.62 (1H, s). + МС m/e MH 399. Приклад 17: (R)-4-(амінометил)-N-(1-(4-хлорфеніл)етил)-1-(7H-піроло[2,3-d]піримідин-4іл)піперидин-4-карбоксамід 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolo[2,3-d]pyrimidin derivatives as protein kinase b inhibitors, process for the preparation thereof and intermediates
Автори англійськоюJohnson, Paul, David, Leach, Andrew, Luke, Richard William, Arthur, Matusiak, Zbigniew, Stanley, Morris, Jeffrey, James
Назва патенту російськоюПроизводная пирроло[2,3-d]пиримидина как ингибитор протеинкиназы b, способ ее получения и промежуточные соединения
Автори російськоюДжонсон Поль Девид, Лич Эндрю, Лук Ричард Вилльям Артур, Матусяк Збигнев Стенли, Моррис Джеффри Джеймс
МПК / Мітки
МПК: A61P 35/00, A61K 31/519, C07D 487/04
Мітки: піроло[2.3-d]піримідину, сполуки, інгібітор, похідна, одержання, протеїнкінази, спосіб, проміжні
Код посилання
<a href="https://ua.patents.su/108-100390-pokhidna-pirolo23-dpirimidinu-yak-ingibitor-protenkinazi-b-sposib-oderzhannya-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідна піроло[2,3-d]піримідину як інгібітор протеїнкінази b, спосіб її одержання та проміжні сполуки</a>
Попередній патент: Мікросхема
Наступний патент: Спосіб і установка для регенерації аміновмісного розчину для промивання, що надходить при очищенні газа
Випадковий патент: Циклон з периферійним відводом частинок