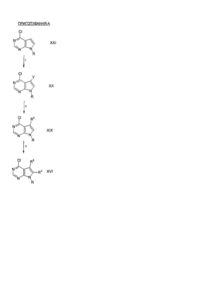
Спосіб оптичного розділення (1-бензил-4-метилпіперидин-3-іл)метиламіну і його використання для одержання похідних піроло[2,3-d]піримідину як інгібіторів протеїнкінази
Номер патенту: 80093
Опубліковано: 27.08.2007
Автори: Кьохер Крістіан, Вріс Тон, Уілкокс Гленн Ернест, Мунхгоф Майкл Джон, Фланаган Марк Едвард
Формула / Реферат
1. Спосіб розділення енатіомерів сполуки, що містить структуру формули:
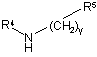 ,
,
або її фармацевтично прийнятних кислотно-адитивних солей, її фармацевтично прийнятних основно-адитивних солей і її вільної основи;
в якій у є 0, 1 або 2;
R4 вибирають з групи, що містить, водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2-С6)алкініл, де алкільні, алкенільні і алкінільні групи є, необов'язково, заміщеними дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1-С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2-С6)алкенілом, (С2-С6)алкінілом або (С1-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, де циклоалкільна група є, необов'язково, заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R5 є (С2-С9)гетероциклоалкілом, за умови, що коли (С2-С9)гетероциклоалкіл є гетероциклоалкільною групою, яка містить азот, кожен з атомів азоту є захищеним бензильною захисною групою, в якому гетероциклоалкільна група повинна бути заміщена від одного до п'яти разів карбокси, ціано, аміно, дейтерієм, гідрокси, (С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, аміно(С1-С6)алкілом, гідроксі(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)алкілом, (С1-С6)ацилоксі(С1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R15R16N-СO-(С1-С6)алкілом, (С1-С6)алкіл-S(О)m, R15R16NS(O)m, R15R16NS(O)m(С1-С6)алкілом, R15S(O)mR16N, R15S(О)mR16N(С1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу; або групою формули II
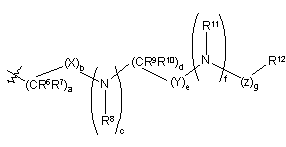 , ІІ
, ІІ
в якій
а є 0, 1, 2, 3 або 4;
b, с, е, f і g кожен, незалежно, 0 або 1;
d є 0, 1, 2 або 3;
Х є S(O)n, де n є 0, 1 або 2; киснем, карбонілом або -С(=N-ціано)-;
Y є S(O)n, де n є 0, 1 або 2; або карбонілом; і
Z є карбонілом, С(O)O-, C(O)NR-або S(O)n, де n є 0, 1 або 2;
R6, R7, R8, R9, R10 і R11 кожен, незалежно, вибирають з групи, що містить, водень або (С1-С6)алкіл, необов'язково, заміщений дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R12 є карбокси, ціано, аміно, оксо, дейтерієм, гідрокси, трифторметилом, (С1-С6)алкілом, трифторметил(С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, гідроксі(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)алкілом, (С1-С6)ацилоксі(С1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілом, R15C(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(O)m, (С1-С6)алкіл-S(O)m,-(С1-С6)алкілом, R15R16NS(O)m, R15R16NS(O)m(С1-С6)алкілом, R15S(O)mR16N, R15S(O)mR16N(С1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу;
де згаданий спосіб включає стадії:
а) змішування рацемічної суміші енантіомерів сполуки, що містить структуру згаданої формули, в розчиннику з розділювальним агентом, що має визначену стереоспецифічність, з утворенням розчину, і де згаданий розділювальний агент здатний зв'язувати, принаймні, один, але не всі згадані таутомери з утворенням осаду, що містить згаданий, принаймні, один із згаданих енантіомерів,
б) залишання суміші на деякий час, достатній для суттєвого осадження з розчину стереоспецифічного енатіомеру рацемічної суміші, і де інший із згаданих енантіомерів залишається у згаданому розчині;
в) в залежності від бажаного стереоспецифічного енантіомеру сполуки, або збирання осаду і його очищення, або відокремлення розчину, що містить інший із згаданих енантіомерів, і перекристалізацію енантіомеру, який присутній в згаданому розчині.
2. Спосіб згідно з пунктом 1, де згаданий розділювальний агент вибирають з винної кислоти і її похідних і аденокислоти і її похідних.
3. Спосіб згідно з пунктом 2, де згаданим похідним винної кислоти є толуоїл- і бензоїлвинні кислоти в стереоспецифічній конфігурації.
4. Спосіб згідно з пунктом 3, де похідним винної кислоти є ди-п-толуоїл-L-винна кислота.
5. Спосіб згідно з пунктом 2, де аденокислота містить (-)-фенцифос.
6. Спосіб згідно з пунктом 1, де сполукою є
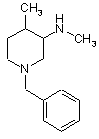 .
.
7. Спосіб згідно з пунктом 1, де сполуку перетворюють у кислотноадитивну сіль перед згаданою стадією розділення.
8. Спосіб згідно з пунктом 7, де згаданою основноадитивною сіллю є гідрохлоридна сіль.
9. Спосіб згідно з пунктом 8, де гідрохлоридну сіль сполуки одержують в розчиннику, що вибирають з групи, яка містить метанол, етанол, ізопропанол, ацетонітрил, тетрагідрофуран, воду, толуол, етилацетат, дихлорметан, дихлоретан і їх суміші.
10. Спосіб згідно з пунктом 9, де згаданим розчинником є етанол з незначною кількістю толуолу як співрозчинника.
11. Спосіб згідно з пунктом 1, де температурою, при якій проводять розділення і осадження, є кімнатна температура і час становить не більше ніж приблизно чотири години.
12. Спосіб згідно з пунктом 1, де розчинник вибирають з групи, що містить етилацетат, толуол, ацетонітрил, гептан, воду і їх суміші.
13. Спосіб згідно з пунктом 1, де для полегшення згаданого осадження додають затравку кристалів осадженого енантіомеру.
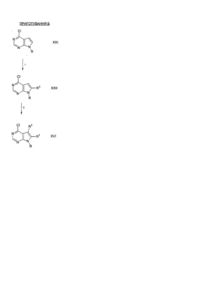
14. Спосіб одержання сполуки формули
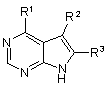
або її фармацевтично прийнятної солі; в якій
R1 є групою формули
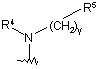 ,
,
в якій
у є 0, 1 або 2;
R4 вибирають з групи, що містить, водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2-С6)алкініл, де алкільні, алкенільні і алкінільні групи є, необов'язково, заміщеними дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1-С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2-С6)алкенілом, (С2-С6)алкінілом або (С2-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, де циклоалкільна група є, необов'язково, заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R5 є (С2-С9)гетероциклоалкілом, за умови, що коли (С2-С9)гетероциклоалкіл є гетероциклоалкільною групою, яка містить азот, кожен з атомів азоту є захищеним бензильною захисною групою, в якому гетероциклоалкільна група повина бути заміщена від одного до п'яти разів карбокси, ціано, аміно, дейтерієм, гідрокси, (С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, аміно(С1-С6)алкілом, гідроксі(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)алкілом, (С1-С6)ацилоксі(С1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R15R16N-CO-(С1-С6)алкілом, (С1-С6)алкіл-S(O)m, R15R16NS(O)m, R15R16NS(O)m(С1-С6)aлкiлoм, R15S(O)mR16N, R15S(O)mR16N(С1-С6)aлкiлoм, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу; або групою формули II
 , ІІ
, ІІ
в якій
а є 0, 1, 2, 3 або 4;
b, с, е, f і g кожен, незалежно, 0 або 1;
d є 0, 1, 2 або 3;
X є S(O)n, де n є 0, 1 або 2; киснем, карбонілом або -С(=N-ціано)-;
Y є S(O)n, де n є 0, 1 або 2; або карбонілом; і
Z є карбонілом, С(O)O-, C(O)NR- або S(O)n, де n є 0, 1 або 2;
R6, R7, R8, R9, R10 і R11 кожен, незалежно, вибирають з групи, що містить, водень або (С1-С6)алкіл, необов'язково, заміщений дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R12 є карбокси, ціано, аміно, оксо, дейтерієм, гідрокси, трифторметилом, (С1-С6)алкілом, трифторметил(С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С1-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, гідроксі(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)алкілом, (С1-С6)ацилоксі(С1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілом, R15C(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(O)m, (С1-С6)алкіл-S(O)m-(С1-С6)алкілом, R15R16NS(O)m, R15R16NS(O)m(С1-С6)aлкiлoм, R15S(O)mR16N, R15S(O)mR16N(С1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу;
R2 і R3 кожен, незалежно, вибирають з групи, що містить, водень, дейтерій, аміно, галоген, гідрокси, нітро, карбокси, (С2-С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільна, алкокси або циклоалкільна групи є, необов'язково, заміщеними від одного до трьох разів групами, що вибирають з галогену, гідрокси, карбокси, аміно, (С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2-С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 і R3 є кожен, незалежно, (С3-С10)циклоалкіл, (С3-С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (С1-С6)алкілсульфініл, (С1-С6)арилсульфініл, (С1-С6)алкілсульфоніл, (С6-С10)арилсульфоніл, (С1-С6)ацил, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарил, (C2-С9)гетероциклоалкіл або (С6-С10)арил, де гетероарильна, гетероциклоалкільна і арильна групи є, необов'язково, заміщеними від одного до трьох разів галогеном, (С1-С6)алкілом, (С1-С6)алкіл-СО-NН-, (С1-С6)алкокси-СО-NH-, (С1-С6)алкіл-СО-NН(С1-С6)алкілом, (С1-С6)алкоксі-СО-NН-(С1-С6)алкілом, (С1-С6)алкоксі-СО-NН-(С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілом, карбоксі(С1-С6)алкокси, бензилоксикарбоніл(С1-С6)алкокси, (С1-С6)алкоксикарбоніл(С1-С6)алкокси, (С6-С10)арилом, аміно, аміно(С1-С6)алкілом, (С1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1-С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілом, ((С1-С6)алкіл)2аміно(С1-С6)алкілом, гідрокси, (С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілом, (С1-С6)алкоксикарбонілом, (С1-С6)алкоксикарбоніл(С1-С6)алкілом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С5-С9)гетероциклоалкілом, аміно-CO-NH-, (С1-С6)алкіламіно-СО-NН-, ((С1-С6)алкіл)2аміно-СО-NH-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NН-, (С1-С6)алкіламіно-СО-NН-(С1-С6)алкілом, ((С1-С6)алкіл)2аміно-СО-NН-(С1-С6)алкілом, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілом, (С5-С9)гетероариламіно-СО-NН-(С1-С6)алкілом, (С1-С6)алкілсульфонілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілом, (С6-С10)арилсульфонілом, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С1-С6)алкілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілом, (C5-С9)гетероарилом або (С2-С9)гетероциклоалкілом;
де згаданий спосіб включає стадії:
а) змішування рацемічної суміші енантіомерних сполук формули
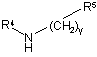 ,
,
де
у, R4 і R5 є такими, як визначено вище, в розчиннику з розділювальним агентом, що має визначену стереоспецифічність, з утворенням розчину, і де згаданий розділювальний агент здатний зв'язувати, принаймні, один, але не всі згадані таутомери з утворенням осаду, що містить згаданий, принаймні, один із згаданих енантіомерів,
б) залишання суміші на деякий час, достатній для суттєвого осадження з розчину стереоспецифічного енатіомеру рацемічної суміші, і де інший із згаданих енантіомерів залишається у згаданому розчині;
в) в залежності від бажаного стереоспецифічного енантіомеру сполуки, або збирання осаду і його очищення, або відокремлення розчину, що містить інший із згаданих енантіомерів, і перекристалізацію енантіомеру, який присутній в згаданому розчині;
г) взаємодію бажаного стереоспецифічного енантіомеру одержаного таким чином з сполукою формули
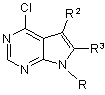 , XVI
, XVI
де
R є воднем або захисною групою і R2 і R3 є такими, як визначено вище;
д) видалення з R5 бензильної захисної групи, коли (С2-С9)гетероциклоалкіл є гетероциклоалкільною групою, яка містить азот, і
е) взаємодію R5 гетероциклоалкільної групи, яка містить азот, утвореної на стадії д),
зі сполукою, що містить групу формули II
 , ІІ
, ІІ
в якій
а є 0, 1, 2, 3 або 4;
b, с, е, f і g кожен, незалежно, 0 або 1;
d є 0, 1, 2, або 3;
Х є S(O)n, де n є 0, 1 або 2; киснем, карбонілом або -С(=N-ціано)-;
Y є S(O)n, де n є 0, 1 або 2; або карбонілом; і
Z є карбонілом, С(O)O-, C(O)NR- або S(O)n, де n є 0, 1 або 2;
R6, R7, R8, R9, R10 і R11 кожен, незалежно, вибирають з групи, що містить, водень або (С1-С6)алкіл, необов'язково, заміщений дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R12 є карбокси, ціано, аміно, оксо, дейтерієм, гідрокси, трифторметилом, (С1-С6)алкілом, трифторметил(С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, гідроксі(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)алкілом, (С1-С6)ацилоксі(С1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілом, R15C(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(O)m, (С1-С6)алкіл-S(O)m-(С1-С6)алкілом, R15R16NS(O)m, R15R16NS(O)m(С1-С6)алкілом, R15S(O)mR16N, R15S(O)mR16N(С1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу.
15. Сполука формули
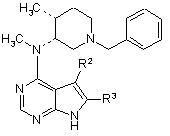 ,
,
де R2 і R3 кожен, незалежно, вибирають з групи, що містить, водень, дейтерій, аміно, галоген, гідрокси, нітро, карбокси, (С2-С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільна, алкокси або циклоалкільна групи є, необов'язково, заміщеними від одного до трьох разів групами, що вибирають з галогену, гідрокси, карбокси, аміно, (С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2-С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 і R3 є кожен, незалежно, (С3-С10)циклоалкіл, (С3-С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (С1-С6)алкілсульфініл, (С6-С10)арилсульфініл, (С1-С6)алкілсульфоніл, (С6-С10)арилсульфоніл, (С1-С6)ацил, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкіл або (С6-С10)арил, де гетероарильна, гетероциклоалкільна і арильна групи є, необов'язково, заміщеними від одного до трьох разів галогеном, (С1-С6)алкілом, (С1-С6)алкіл-СО-NН-, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілом, (С1-С6)алкоксі-СО-NН-(С1-С6)алкілом, (С1-С6)алкоксі-СО-NH-(С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілом, карбоксі(С1-С6)алкокси, бензилоксикарбоніл(С1-С6)алкокси, (С1-С6)алкоксикарбоніл(С1-С6)алкокси, (С6-С10)арилом, аміно, аміно(С1-С6)алкілом, (С1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1-С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілом, ((С1-С6)алкіл)2аміно(С1-С6)алкілом, гідрокси, (С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілом, (С1-С6)алкоксикарбонілом, (С1-С6)алкоксикарбоніл(С1-С6)алкілом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NH-, ціано, (C5-С9)гетероциклоалкілом, аміно-CO-NH-, (С1-С6)алкіламіно-СО-NН-, ((С1-С6)алкіл)2аміно-СО-NH-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NН-, (С1-С6)алкіламіно-СО-NН-(С1-С6)алкілом, ((С1-С6)алкіл)2аміно-СО-NН-(С1-С6)алкілом, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілом, (С5-С9)гетероариламіно-СО-NН-(С1-С6)алкілом, (С1-С6)алкілсульфонілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілом, (С6-С10)арилсульфонілом, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С1-С6)алкілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілом, (C5-С9)гетероарилом або (С5-С9)гетероциклоалкілом.
16. Сполука згідно з пунктом 15, в якій R2 і R3 є воднями.
17. Сполука згідно з пунктом 15, яка містить:
метил[(3R,4R)-4-метил-1-(пропан-1-сульфоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін;
(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти метиловий естер;
3,3,3-трифтор-1-{(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}пропан-1-он;
(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти диметиламід;
{(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбоніл}амінооцтової кислоти етиловий естер;
3-{(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил;
3,3,3-трифтор-1-{(3R,4R)-4-метил-3-[метил(5-метил-7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-пропан-1-он;
1-{(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}бут-3-ин-1-он;
1-{(3R,4R)-3-[(5-xлop-7H-пipoлo[2,3-d]пipимiдин-4-iл)мeтилaмiнo]-4-мeтилпiпepидин-1-іл}пропан-1-он;
1-{(3R,4R)-3-[(5-фтор-7Н-піроло[2,3-d]піримідин-4-іл)метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он;
(3R,4R)-N-ціано-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]-N'-пропілпіперидин-1-карбоксамідин і
(3R,4R)-N-ціано-4,N',N'-триметил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбоксамідин,
або їх фармацевтично прийнятні солі.
18. Сполука 3-{(3R,4R)-4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил або її фармацевтично прийнятна сіль.
19. Фармацевтична композиція для (а) лікування або попередження розладу або стану, яким є відторгнення трансплантованого органа, ксенотрансплантація, вовчак, розсіяний склероз, ревматоїдний артрит, псоріаз, діабет типу І і ускладнення, викликані діабетом, рак, астма, атопічний дерматит, аутоімунні захворювання щитовидної залози, виразковий коліт, хвороба Крона, хвороба Альцгеймера, лейкемія і інші аутоімунні захворювання, або (б) інгібування протеїнтирозинкінази або кінази Януса 3 (JAK3) у ссавця, включаючи людину, що містить ефективну, для такого розладу або стану, кількість сполуки згідно з пунктом 16 або її фармацевтично прийнятної солі, окремо або в комбінації з одним або більшою кількістю додаткових агентів, які модулюють імунну систему ссавця, або протизапальними агентами, і фармацевтично прийнятний носій.
20. Фармацевтична композиція за п. 19, де один або більшу кількість додаткових агентів, вибирають з групи, до якої входять циклоспорин А, рапаміцин, такролімус, лефлуномід, деоксиспергуалін, мікофенолат, азатіоприн, даклізумаб, муромонаб-СD3, антитімоцитний глобулін, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам, преднізолон і дексаметазон.
21. Спосіб інгібування протеїнтирозинкінази або кінази Януса 3 (JAK3) у ссавця, включаючи людину, що полягає у введенні згаданому ссавцю ефективної кількості сполуки згідно з пунктом 16 або її фармацевтично прийнятної солі, окремо або в комбінації з одним або більшою кількістю додаткових агентів, які модулюють імунну систему ссавця, або протизапальними агентами.
22. Спосіб за пунктом 21, де один або більшу кількість додаткових агентів, вибирають з групи, до якої входять циклоспорин А, рапаміцин, такролімус, лефлуномід, деоксиспергуалін, мікофенолат, азатіоприн, даклізумаб, муромонаб-CD3, антитімоцитний глобулін, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам, преднізолон і дексаметазон.
23. Спосіб лікування або попередження розладу або стану, яким є відторгнення трансплантованого органа, ксенотрансплантація, вовчак, розсіяний склероз, ревматоїдний артрит, псоріаз, діабет типу І і ускладнення, викликані діабетом, рак, астма, атопічний дерматит, аутоімунні захворювання щитовидної залози, виразковий коліт, хвороба Крона, хвороба Альцгеймера, лейкемія і інші аутоімунні захворювання у ссавця, включаючи людину, що полягає у введенні згаданому ссавцю ефективної, для лікування такого стану, кількості сполуки згідно з пунктом 16 або її фармацевтично прийнятної солі, окремо або в комбінації з одним або більшою кількістю додаткових агентів, які модулюють імунну систему ссавця, або протизапальними агентами.
24. Спосіб за пунктом 23, де один або більшу кількість додаткових агентів, вибирають з групи, до якої входять циклоспорин А, рапаміцин, такролімус, лефлуномід, деоксиспергуалін, мікофенолат, азатіоприн, даклізумаб, муромонаб-СD3, антитімоцитний глобулін, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам, преднізолон і дексаметазон.
25. Сполука формули
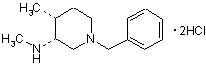 .
.
26. Сполука формули
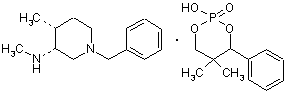 .
.
27. Сполука формули
 .
.
Текст
Представлений винахід стосується способів проведення розділення хіральної солі рацемічних сумішей енантіомерів і, зокрема, прекурсорів енантіомерів для одержання піроло[2,3-d]піримідинів, які є інгібіторами протеїнкіназ. Представлений винахід також стосується піроло[2,3-d]піримідинів і способів використання таких сполук, як інгібіторів протеїнкіназ, таких як фермент - кіназа Януса 3. Піроло[2,3-d]піримідини є інгібіторами протеїнкіназ, таких як кіназа Януса 3 (JAK3) і тому є корисними в терапії як імуносупресивні агенти для трансплантованих органів, при лікуванні вовчака, розсіяного склерозу, ревматоїдного артриту, псоріазу, діабету типу І і ускладнень викликаних діабетом, раку, астми, атопічного дерматиту, а утоімунних захворювань щитовидної залози, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії і інших станів при яких бажана імуносупресія. Піроло[2,3-d]піримідини, їх фармацевтичні композиції і способи використання описані в [заявці, що знаходиться на розгляді з №09/732669, що подана 8 грудня 2000], і визначена як вихідна для представленого винаходу. Опис згаданої заявки включений сюди як посилання у всій своїй повноті. Спочатку одержують рацемічні суміші піроло[2,3d]піримідинів, хоча окремі енантіомери, по суті, в чистій формі є переважними і в цей час є необхідними для використання в ліках. Можливо передбачити стереохімію сполук використовуючи стереоспецифічні прекурсори в їх синтезі. Способи представленого винаходу відповідно стосуються способів, по суті, розділення рацемічної суміші хіральної солі прекурсорів, що використовуються при одержанні окремих енантіомерних форм піроло[2,3-d]піримідинів. Представлений винахід стосується способів розділення енантіомерів прекурсорів, що використовуються при одержанні сполуки наступної формули і, зокрема, її R1 гр упи: або її фармацевтично прийнятної солі; в якій R1 є гр упою формули в якій у є 0, 1 або 2; R4 вибирають з групи, що містить, водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2-С6)алкініл, де алкільні, алкенільні і алкінільні групи є, необов'язково, заміщеними дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2-С6)алкенілом, (С2-С6)алкінілом або (С1-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, де циклоалкільна група є, необов'язково, заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R5 є (С2-С9)гетероциклоалкілом, де гетероциклоалкільні групи повинні бути заміщені від одного до п'яти разів карбокси, ціано, аміно, дейтерієм, гідрокси, (С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, аміно(С1С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, аміно(С1С6)алкілом, гідрокси(С 1-С6)алкілом, (С1-С6)алкокси(С 1-С6)алкілом, (С1-С6)ацилокси(С 1-С6)алкілом, нітро, ціано(С 1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1С6)ациламіно(С 1-С6)алкілом, (С1-С6)алкокси(С 1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С 1-С6)ацил(С1-С6)алкілом, (С1С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R 15R16N-CO-(С1-С6)алкілом, (С1-С6)алкілS(О)m, R15R16NS(O)m, R15R16NS(O) m(С1-С6)алкілом, R15S(O)mR16N, R15S(O)mR 16N(C1-C6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу; або групою формули II в якій а є 0, 1, 2, 3 або 4; b, с, e, f і g кожен, незалежно, 0 або 1; d є 0, 1, 2, або 3; X є S(O) n, де n є 0, 1 або 2; киснем, карбонілом або -С(=N-ціано)-; Y є S(O) n, де n є 0, 1 або 2; або карбонілом; Z є карбонілом, С(О)О-, C(O)NR- або S(O), де n є 0, 1 або 2; R6, R7, R8, R9, R10 і R11 кожен, незалежно, вибирають з групи, що містить, водень або (С1-С6)алкіл, необов'язково, заміщений дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С 1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R12 є карбокси, ціано, аміно, оксо, дейтерієм, гідрокси, трифторметилом, (C1-С6)алкілом, трифторметил(С 1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, гідрокси(С 1-С6)алкілом, (С1-С6)алкокси(С 1С6)алкілом, (С1-С6)ацилокси(С 1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С 1-С6)алкілом, нітро(С 1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-C6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілом, (С1-С6)алкокси(С 1С6)ациламіно, аміно(С1-С6)ацилом, аміно(С 1-С6)ацил(С1-С6)алкілом, (С1-С6)алкіламіно(С 1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1С6)ацилом, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілом, R15C(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(О)m, (С1-С6)алкіл-S(О)m-(С1С6)алкілом, R15R16NS(O)m, R15R16NS(O) m(С1-С6)алкілом, R15S(O)mR16N, R 15S(O)mR 16N(C1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу; R2 і R3 кожен, незалежно, вибирають з групи, що містить, водень, дейтерій, аміно, галоген, гідрокси, нітро, карбокси, (С2С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільна, алкокси або циклоалкільна групи є, необов'язково, заміщеними від одного до трьох разів групами, що вибирають з галогену, гідрокси, карбокси, аміно, (С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 і R3 кожен, незалежно, (С3-С10)циклоалкіл, (С3С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (C1С6)алкілсульфініл, (С6-С10)арилсульфініл, (С1-С6)алкілсульфоніл, (С6-С10)арилсульфоніл, (С1-С6)ацил, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкіл або (С6-С10)арил, де гетероарильна, гетероциклоалкільна і арильна групи є, необов'язково, заміщеними від одного до трьох разів галогеном, (С1-С6)алкілом, (С1-С6)алкіл-СО-NН-, (С1С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілом, (С1-С6)алкокси-СО-NН-(С1-С6)алкілом, (С1-С6)алкокси-СО-NН-(С1С6)алкокси, карбокси, карбокси(С 1-С6)алкілом, карбокси(С 1-С6)алкокси, бензилоксикарбоніл(С 1-С6)алкокси, (С1С6)алкоксикарбоніл(С 1-С6)алкокси, (С6-С10)арилом, аміно, аміно(С1-С6)алкілом, (С1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілом, ((С1-С6)алкіл)2аміно(С1С6)алкілом, гідрокси, (С1-С6)алкокси, карбокси, карбокси(С1-С6)алкілом, (С1-С6)алкоксикарбонілом, (C1-С6)алкоксикарбоніл(С 1С6)алкілом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С5-С9)гетероциклоалкілом, аміно-CO-NH-, (С1-С6)алкіламіноСО-NН-, ((С1-С6)алкіл)2аміно-СО-NH-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NН-, (С1-С6)алкіламіно-СО-NН(С1-С6)алкілом, ((С1-С6)алкіл)2аміно-СО-NН-(С1-С6)алкілом, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілом, (C5-C9)гетepoapиламіноCO-NH-(C1-C6)алкілом, (С1-С6)алкілсульфонілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (С6С10)арилсульфонілом, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С1-С6)алкілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (C5-С9)гетероарилом або (С2-С9)гетероциклоалкілом. Представлений винахід також стосується одержання стереоспецифічних фармацевтично прийнятних кислотно-адитивних солей сполук формули І. Кислотами, які використовуються при одержанні фармацевтично прийнятних кислотно-адитивних солей вищезгаданих основних сполук цього винаходу є такі, що утворюють нетоксичні кислотно-адитивні солі, тобто, солі, які містять фармакологічно прийнятні аніони, такі як гідрохлоридні, гідробромідні, гідройодидні, нітратні, сульфатні, бісуль фатні, фосфа тні, гідрофосфатні, ацетатні, лактатні, цитратні, гідроцитратні, тартратні, бітартратні, сукцинатні, малеатні, фумаратні, глюконатні, сахаратні, бензоатні, метансульфонатні, етансульфонатні, бензолсульфонатні, п-толуолсульфонатні та памоатні [тобто, 1,1-метилен-біс-(2-гідрокси-3-нафтоат)] солі. Винахід також стосується стереоспецифічних основно-адитивних солей формули І. Хімічними основами, що можуть бути використані при одержанні фармацевтично прийнятних основно-адитивних солей вищезгаданих сполук цього винаходу кислої природи є такі, що утворюють нетоксичні основні солі з такими сполуками. Такі нетоксичні солі включають, але не обмежуються похідними фармакологічно прийнятних катіонів, таких як катіони лужних металів (наприклад, калій і натрій) і катіони лужноземельних металів (наприклад, кальцій і магній), амонію або водорозчинних аміно-адитивних солей, таких як Nметилглюкамін-(меглумін), і нижчі алканоламонієві і інші основні солі фармацевтично прийнятних органічних амінів. Термін "алкіл", що використовується тут, якщо не вказано інше, включає насичені моновалентні вуглеводневі радикали, які мають лінійний, розгалужений або циклічний ланцюги або їх комбінацію. Термін "алкокси", що використовується тут, включає -О-алкільну гр упу, в якій алкіл такий, як зазначено вище. Термін "галоген", що використовується тут, якщо не вказано інше, включає хлор, фтор, бром та йод. Сполуки цього винаходу можуть містити подвійні зв'язки. Коли такі зв'язки присутні, сполуки винаходу існують у вигляді як цис, так і транс конфігурації і у вигляді їх сумішей. Якщо не вказано інше, алкільна і алкенільна групи згадані тут, так як і алкільний замісник інших гр уп згаданих тут (наприклад, алкокси), може бути лінійним або розгалуженим і він може також бути циклічним (наприклад, циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил) або бути лінійним або розгалуженим і містити циклічний замісник. Якщо не вказано інше, галоген включає фтор, хлор, бром і йод. (С2-С9)гетероциклоалкіл, коли використовується тут, означає піролідиніл, тетрагідрофураніл, дигідрофураніл, тетрагідропіраніл, піраніл, тіопіраніл, азирідиніл, оксираніл, метилендіоксил, хроменіл, ізоксазолідиніл, 1,3-оксазолідин-3-іл, ізотіазолідиніл, 1,3-тіазолідин-3-іл, 1,2-піразолідин-2-іл, 1,3-піразолідин-1-іл, піперидиніл, тіоморфолініл, 1,2-тетрагідротіазин2-іл, 1,3-тетрагідротіазин-3-іл, тетрагідротіадіазиніл, морфолініл, 1,2-тетрагідродіазин-2-іл, 1,3-тетрагідродіазин-1-іл, тетрагідроазепініл, піперазиніл, хроманіл та ін. Середньому фа хівцю в цій галузі повинно бути зрозуміло, що згадані (С2С9)гетероциклоалкільні групи зв'язані через атом вуглецю або sp3 гібридизований гетероатом азоту. (С2-С9)гетероарил, коли використовується тут, означає фурил, тієніл, тіазоліл, піразоліл, ізотіазоліл, оксазоліл, ізоксазоліл, піроліл, триазоліл, тетразоліл, імідазоліл, 1,3,5-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,3-оксадіазоліл, 1,3,5тіадіазоліл, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, піридил, піримідил, піразиніл, піридазиніл, 1,2,4-триазиніл, 1,2,3-триазиніл, 1,3,5-триазиніл, піразоло[3,4-b]піридиніл, хінолініл, птеридиніл, пуриніл, 6,7-дигідро-5Н-[1 ]піридиніл, бензо[b]тіофеніл, 5,6,7,8тетрагідрохінолін-3-іл, бензоксазоліл, бензотіазоліл, бензізотіазоліл, бензізоксазоліл, бензімідазоліл, тіанафтеніл, ізотіанафтеніл, бензофураніл, ізобензофураніл, ізоіндоліл, індоліл, індолізиніл, індазоліл, ізохіноліл, хіноліл, фталазиніл, хіноксалініл, хіназолініл, бензоксазиніл та ін. Середньому фа хівцю в цій галузі повинно бути зрозуміло, що згадані (С2С9)гетероарильні групи зв'язані через атом вуглецю або sp3 гібридизований гетероатом азоту. (С6-С10)арил, коли використовується тут, означає феніл або нафтил. Сполуки, що використовуються в цьому винаході включають всі конформаційні ізомери (наприклад, цис і транс ізомери). Сполуки, що використовуються в представленому винаході мають асиметричні центри і тому існують в різних енантіомерних і діастереомерних формах. Цей винахід стосується розділення оптичних ізомерів і стереоізомерів прекурсорів і, таким чином, сполук представленого винаходу, і їх сумішей, і всіх фармацевтичних композицій і способів лікування, що можуть бути використані або їх містять. В цьому відношенні, винахід включає і Е, і Z конфігурації. Сполуки формули І також можуть існувати як таутомери. Цей винахід стосується таких та утомекрів і їх сумішей. Зокрема, розділення рацемічних сумішей енантіомерів сполук, що використовується для забезпечення R1 замісника формули І, здійснюється шляхом обробки рацемічної суміші специфічним оптичним ізомером дизаміщеної винної кислоти або тартрату в прийнятному розчиннику, такому як етанол в присутності або ні води як співрозчинника. Розділення для одержанні бажаного надлишку енантіомеру 90% можливо у відповідності з способом представленого винаходу з використанням розділювальних агентів, таких як солі оптичних ізомерів винної кислоти і похідних винної кислоти, таких як ди-п-толуоїл-L-винна кислота, і (S)-(+)-андено кислоти (пенцифос, (S)-(+)-2-гідрокси-5,5-диметил-4-феніл-1,3,2-діоксифосфоринан-2-оксид). Взаємодія між антиподами розділювального матеріалу і специфічним енантіомером забезпечує розділення рацемічної суміші, під час якого забезпечується осадження розділювального матеріалу і енантіомеру одного з бажаних стереспецифічних матеріалів і де розчин енантіомеру, що залишився, можна відокремити. Таким чином, в залежності від бажаного окремого енантіомеру і способу розділення, що використовується, (тобто, з осаду або розчину), можна вибрати стереоспецифічну природу розділювального агенту; наприклад "L" форма розділювального агенту, такого як похідне тертрату, забезпечує висадження "R" форми R1 замісника і розчин містить "L" форму і навпаки. Згадані вище розділювальні агенти є ефективними при одержанні 3R,4R енантіомеру сполуки формули (або в осаді, або розчині, як описано): У відповідності з представленим винаходом спосіб розділення сполуки формули III проводять з використанням наступних стадій: а) змішування суміші сполуки формули III в прийнятному розчиннику з розділювальним агентом, що має визначену стереоспецифічність, протягом часу достатнього для протікання осадження з розчину стереоспецифічного ізомеру рацемічної суміші; б) в залежності від бажаної стереоспецифічної форми сполуки, збирання або осаду і його очищення, або збирання маткового розчину і перекристалізацію енантіомеру, що в ньому міститься. Розділення представленого винаходу включає перетворення суспензії в суспензію і з деякими матеріалами краще утворюється суспензія, а ніж розчин. Термін "розчин" охоплює як розчин, так і суспензію. Температурою при якій проводиться розділення і осадження є переважно кімнатна температура, тоді як час осадження не обмежується часом і переважно складає не більше ніж приблизно чотири години. Для того, щоб полегшити розділення, бажано використовувати енантіомери в рацемічній суміші, яка є стабільною формою і сполуку формули II, яка є більш стабільною в формі кислотноадитивної солі, такої як гідрохлоридна сіль, ніж форма вільної основи і переважно, що суміш рацемічної сполуки буде відповідно перетворюватись перед розділенням. Таким чином, наприклад, утворення гідрохлоридної солі сполуки формули II проводиться переважно в етанолі з незначною кількістю толуолу як співрозчинника. Альтернативно, можуть використовуватись при одержанні солей метанол, ізопропанол, ацетонітрил або тетрагідрофуран (або їх суміш з додаванням або без води як співрозчинника) з співрозчинниками, такими як толуол, етилацетат, дихлорметан, дихлоретан або тетрагідрофуран. НCl сіль є особливо переважною оскільки ця форма забезпечує добру очистку і збагачення інших стереомерів з попередньої стадії. Переважним розчинником заміщення для використання при розділенні є етилацетат. Толуол, ацетонітрил або гептани також є корисними як розчинники. Переважним розчинником виділення є ацетон. Іншими розчинниками корисними в цьому відношенні є ізолропанол, етанол, метиетилкетон, метилізопропілкетон, ацетонітрил і тетрагідрофуран. Розчинники також можуть бути використанні як співрозчинники з кожним іншим або з водою. Переважними розділювальними сполуками є винна кислота і її похідні, такі як толуоїл і бензоїлвинні кислоти в стереспецифічній конформації, як описано. Іншими розділювальними сполуками є стереоспециіфічна адено кислота і її похідні. Для полегшення осадження і перекристалізації додавання затравки є необов'язковим, але переважним, для того що б підвищити ее матеріалу при меншій кількості перекристалізацій. Для того, щоб проілюструвати методику і ефективність представленого винаходу приведені наступні приклади. Зрозуміло, що такі приклади розкриті в деталях нижче, але вони не повинні розглядатись як такі, що обмежують представлений винахід. Представлений винахід також стосується способу одержання сполуки формули або її фармацевтично прийнятної солі; в якій R1 є групою формули в якій у є 0, 1 або 2; R4 вибирають з групи, що містить, водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2-С6)алкініл, де алкільні, алкенільні і алкінільні групи є, необов'язково, заміщеними дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2-С6)алкенілом, (С2-С6)алкінілом або (С1-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, де циклоалкільна група є, необов'язково, заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (C1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R5 є (С2-С9)гетероциклоалкілом, де гетероциклоалкільні групи повинні бути заміщені від одного до п'яти разів карбокси, ціано, аміно, дейтерієм, гідрокси, (С1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, аміно(С1С6)алкілом, (C1-C6)алкокси-CO-NH, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, аміно(С1С6)алкілом, гідрокси(С 1-С6)алкілом, (С1-С6)алкокси(С 1-С6)алкілом, (D-С6)ацилокси(С 1-С6)алкілом, нітро, ціано(С 1-С6)алкілом, галоген(С1-С6)алкілом, нітро(С1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (С1С6)ациламіно(С 1-С6)алкілом, (С1-С6)алкокси(С 1-С6)ациламіно, аміно(С1-С6)ацилом, аміно(С 1-С6)ацил(С1-С6)алкілом, (С1С6)алкіламіно(С1-С6)ацилом, ((С1-С6)алкіл)2аміно(С1-С6)ацилом, R15R16N-CO-O-, R 15R16N-CO-(C1-C6)алкілом, (C1-C6)алкілS(O)m, R 15R16NS(O)m, R15R16NS(О)m(C 1-C6)алкілом, R15S(O)mR16N, R15S(O)mR 16N(С1-С6)-алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (С1-С6)алкілу; або групою формули II в якій а є 0, 1, 2, 3 або 4; b, с, e, f і g кожен, незалежно, 0 або 1; d є 0, 1, 2, або 3; X є S(O) n, де n є 0, 1 або 2; киснем, карбонілом або -С(=N-ціано)-; Y є S(O) n, де n є 0, 1 або 2; або карбонілом; і Z є карбонілом, С(О)О-, C(O)NR- або S(O), де n є 0, 1 або 2; R6, R7, R8, R9, R10 і R11 кожен, незалежно, вибирають з групи, що містить, водень або (С1-С6)алкіл, необов'язково, заміщений дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С 1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R12 є карбокси, ціано, аміно, оксо, дейтерієм, гідрокси, трифторметилом, (С1-С6)алкілом, трифторметил(С 1-С6)алкілом, (С1-С6)алкокси, галогеном, (С1-С6)ацилом, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкілом, (С1-С6)алкокси-СО-NН, (C1-С6)алкіламіно-СО-, (С2-С6)алкенілом, (С2-С6)алкінілом, (С1-С6)алкіламіно, гідрокси(С 1-С6)алкілом, (С1-С6)алкокси(С 1С6)алкілом, (С1-С6)ацилокси(С 1-С6)алкілом, нітро, ціано(С1-С6)алкілом, галоген(С 1-С6)алкілом, нітро(С 1-С6)алкілом, трифторметилом, трифторметил(С1-С6)алкілом, (С1-С6)ациламіно, (C1-C6)aцилaмiнo(C1-C6)aлкiлoм, (C1-С6)алкокси(С 1С6)ациламіно, aмiнo(C1-C6)aцилoм, aмiнo(C1-C6)aцил(C1-C6)aлкiлoм, (C1-C6)aлкiлaмiнo(C1-C6)aцилoм, ((С1-C6 алкіл)2аміно(C1C6)ацилом, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілом, R15C(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(О)m, (C1-C6)алкіл-S(O)m-(C1С6)алкілом, R15R16NS(O)m, R15R16NS(O) m(C1-C6)алкілом, R15S(O)mR16N, R 15S(O)mR 16N(C1-С6)алкілом, де m є 0, 1 або 2 і R15 і R16 кожен, незалежно, вибирають з водню або (C1-С6)алкілу; R2 і R3 кожен, незалежно, вибирають з групи, що містить, водень, дейтерій, аміно, галоген, гідрокси, нітро, карбокси, (С2С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільна, алкокси або циклоалкільна групи є, необов'язково, заміщеними від одного до трьох разів групами, що вибирають з галогену, гідрокси, карбокси, аміно (С1-С6)алкілтіо, (С1-С6)алкіламіно, ((C1-С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 і R3 кожен, незалежно, (С3-С10)циклоалкіл, (С3С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (C1С6)алкілсульфініл, (С6-С10)арилсульфініл, (С1-С6)алкілсульфоніл, (С6-С10)арилсульфоніл, (С1-С6)ацил, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкіл або (С6-С10)арил, де гетероарильна, гетероциклоалкільна і арильна групи є, необов'язково, заміщеними від одного до трьох разів галогеном, (С1-С6)алкілом, (С1-С6)алкіл-СО-NН-, (С1С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілом, (C1-С6)алкокси-СО-NН-(С1-С6)алкілом, (C1-C6)aлкoкcи-CO-NH-(C1C6)aлкoкcи, карбокси, карбокси(С 1-С6)алкілом, карбокси(С 1-С6)алкокси, бензилоксикарбоніл(С 1-С6)алкокси, (C1С6)алкоксикарбоніл(С 1-С6)алкокси, (С6-С10)арилом, аміно, аміно(С1-С6)алкілом, (C1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілом, ((С1-С6)алкіл)2аміно(С1С6)алкілом, гідрокси, (С1-С6)алкокси, карбокси, карбокси(С1-С6)алкілом, (С1-С6)алкоксикарбонілом, (С1-С6)алкоксикарбоніл(С 1С6)алкілом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С5-С9)гетероциклоалкілом, аміно-CO-NH-, (С1-С6)алкіламіноСО-NH-, ((С1-С6)алкіл)2аміно-СО-NH-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NН-, (С1-С6)алкіламіно-СО-NН(С1-С6)алкілом, ((С1-С6)алкіл)2аміно-СО-NН-(С1-С6)алкілом, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілом, (С5-С9)гетероариламіноСО-NН-(С1-С6)алкілом, (С1-С6)алкілсульфонілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (С6С10)арилсульфонілом, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С1-С6)алкілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (С5-С9)гетероарилом або (С2-С9)гетероциклоалкілом; де згаданий споdб включає стадії: а) змішування рацемічної суміші енантіомерних сполук формули де у, R4 і R5 є такими як визначено вище, в розчиннику з розділювальним агентом, що має визначену стереоспецифічність, з утворенням розчину, і де згаданий розділювальний агент здатний зв'язувати, принаймні, один, але не всі згадані таутомери з утворенням осаду, що містить згаданий, принаймні, один із згаданих енантіомерів, б) залишання суміші на деякий час, достатній для суттєвого осадження з розчину стереоспецифічного енатіомеру рацемічної суміші, і де інший із згаданих енантіомерів залишається у згаданому розчині; в) в залежності від бажаного стереоспецифічного енантіомеру сполуки, збирання або осаду і його очищення, або відокремлення розчину, що містить інший із згаданих енантіомерів, і перекристалізацію енантіомеру, що присутній в згаданому розчині; г) взаємодію бажаного стереоспецифічного енантіомеру одержаного таким чином з сполукою формули де R є воднем або захисною групою і R 2 і R3 є такими як визначено вище. Представлений винахід також стосується сполуки формули в якій R2 і R3 кожен, незалежно, вибирають з групи, що містить, водень, дейтерій, аміно, галоген, гідрокси, нітро, карбокси, (С2С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільна, алкокси або циклоалкільна групи є, необов'язково, заміщеними від одного до трьох разів групами, що вибирають з галогену, гідрокси, карбокси, аміно, (С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1 С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 і R3 кожен, незалежно, (Сз-С10)циклоалкіл, (СзС10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (С1С6)алкілсульфініл, (С6-С10)арилсульфініл, (С1-С6)алкілсульфоніл, (С6-С10)арилсульфоніл, (С1-С6)ацил, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкіл або (С6-С10)арил, де гетероарильна, гетероциклоалкільна і арильна групи є, необов'язково, заміщеними від одного до трьох разів галогеном, (С1-С6)алкілом, (С1-С6)алкіл-СО-NН-, (С1С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілом, (С1-С6)алкокси-СО-NН-(С1-С6)алкілом, (C1-C6)aлкoкcи-CO-NH-(C1C6)aлкoкcи, карбокси, карбокси(С 1-С6)алкілом, карбокси(С 1-С6)алкокси, бензилоксикарбоніл(С 1-С6)алкокси, (C1С6)алкоксикарбоніл(С 1-С6)алкокси, (С6-С10)арилом, аміно, аміно(С1-С6)алкілом, (C1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілом, ((С1-С6)алкіл)2аміно(С1С6)алкілом, гідрокси, (С1-С6)алкокси, карбокси, карбокси(С1-С6)алкілом, (С1-С6)алкоксикарбонілом, (C1-С6)алкоксикарбоніл(С 1С6)алкілом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С5-С9)гетероциклоалкілом, аміно-CO-NH-, (С1-С6)алюламіноСО-NН-, ((С1-С6)алкіл)2аміно-СО-NH-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NН-, (С1-С6)алкіламіно-СО-NН(С1-С6)алкілом, ((C1-C6алкіл)2аміно-СО-NН-(C1-C6)алкілом, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілом, (С5-С9)гетероариламіноСО-NН-(С1-С6)алкілом, (С1-С6)алкілсульфонілом, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (С6С10)арилсульфонілом, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С 1-С6)алкілом, (С1-С6)алктсульфонтаміно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілом, (С5-С9)гетероарилом або (С2-С9)гетероциклоалкілом. Представлений винахід також стосується особливо переважних сполук, що вибирають з групи, яка містить: Метил-[(3R,4R)-4-метил-1-(пропан-1-сульфоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін; (3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти метиловий естер; 3,3,3-Трифтор-1-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}пропан-1-он; (3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти диметиламід; {(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбоніл}аміно)оцтової кислоти етиловий естер; 3-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил; 3,3,3-Трифтор-1-{(3R,4R)-4-метил-3-[метил-(5-метил-7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-пропан-1-он; 1-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}бут-3-ин-1-он; 1-{(3R,4R)-3-[(5-Хлор-7Н-піроло[2,3-d]піримідин-4-іл)-метиламіно]-4-метилпіперидин-1-іл}пропан-1-он; 1-{(3R,4R)-3-[(5-Фтор-7Н-піроло[2,3-d]піримідин-4-іл)-метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он; (3R,4R)-N-ціано-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]-N'-пропіл-піперидин-1-карбоксамідин і (3R,4R)-N-ціано-4,N',N'-триметил-3-[метил-(7Н-піроло[2,3-dІ]піримідин-4-іл)аміно]піперидин-1-карбоксамідин. Представлений винахід також стосується фармацевтичної композиції для (а) лікування або попередження розладу або стану, яким є відторгнення трансплантованого органу, вовчак, розсіяний склероз, ревматоїдний артрит, псоріаз, діабет типу І і ускладнення викликані діабетом, рак, астма, атопічнйй дерматит, аутоімунні розлади щитовидної залози, виразковий коліт, хвороба Крона, хвороба Альцгеймера, лейкемія і інші аутоімунні захворювання або (б) інгібування протеїнтірозинкінази або кінази Януса 3 (JAK3) у сса вця, включаючи людину, що містить ефективну, для такого захворювання або стану, кількість описаної вище особливо переважної сполуки або її фармацевтично прийнятної солі, і фармацевтично прийнятний носій. Представлений винахід також стосується способу інгібування протеїнтірозинкінази або кінази Януса 3 (JAK3) у ссавця, включаючи людину, що полягає у введенні згаданому ссавцю ефективної кількості описаної вище особливо переважної сполуки або її фармацевтично прийнятної солі. Представлений винахід також стосується способу лікування або попередження розладу або стану, яким є відторгнення трансплантованого органу, вовчак, розсіяний склероз, ревматоїдний артрит, псоріаз, діабет типу І і ускладнення викликані діабетом, рак, астма, атопічний дерматит, аутоімунні розлади щитовидної залози, виразковий коліт, хвороба Крона, хвороба Альцгеймера, лейкемія і інші аутоімунні захворювання у сса вця, включаючи людину, що полягає у введенні згаданому ссавцю ефективної, для лікування такого стану, кількості описаної вище особливо переважної сполуки або її фармацевтично прийнятної солі. Наступні Схеми реакцій розкривають одержання сполук представленого винаходу. Якщо не вказано інше, R2, R3, R4 i R5 в Схемах реакцій і обговоренні, що йде потім, такі як зазначено вище. В реакції 1 Приготування А, 4-хлорпіроло[2,3-d]піримідин, сполуку формули XXI, в якій R є воднем або захисною групою, такою як бензолсульфоніл або бензил, перетворювали у 4-хлор-5-галогенпіроло[2,3-d]піримідин, сполуку формули XX, в якій Y є хлором, бромом або йодом, реакцією XXI з N-хлорсукцинімідом, N-бромсукцинімідом або N-йодсукцинімідом. Реакційну суміш нагрівали із зворотнім холодильником, в хлороформі, протягом часу від приблизно 1 години до приблизно 3 годин, переважно приблизно 1 годину. Альтернативно, в реакції 1 Приготування А, 4-хлорпіроло[2,3-d]піримідин формули XXI, в якій R є воднем, перетворювали у відповідний 4-хлор-5-нітропіроло[2,3-d]піримідин формули XX, в якому Y є нітро, реакцією XXI з азотною кислотою в сірчаній кислоті при температурі від приблизно -10°С до приблизно 10°С, переважно приблизно при 0°С, протягом часу від приблизно 5 хвилин до приблизно 15 хвилин, переважно приблизно 10 хвилин. Сполуку формули XXI, в якій Y є нітро, перетворювали у відповідний 4-хлор-5-амінопіроло[2,3-d]піримідин формули XX, в якому Y є аміно, реакцією XXI за умов добре відомих середньому фа хівцю в цій галузі, таких як гідрування на паладії або хлорид олова (IV) і хлорводнева кислота. В реакції 2 Приготування А, 4-хлор-5-галогенпіроло[2,3-d]піримідин, сполуку формули XX, в якій R є воднем, перетворювали у відповідну сполуку формули XIX, в якій R2 є (С1-С6)алкілом або бензилом, обробляючи XX N-бутиллітієм, при температурі приблизно -78°С, і вводячи у взаємодію, таким чином одержаного діаніонного інтермедіату, з алкілгалоїдом або бензилгалоїдом при температурі від приблизно -78°С до кімнатної температури, переважно при кімнатній температурі. Альтернативно, таким чином одержаний діаніон реагує з молекулярним киснем з утворенням відповідного 4-хлор-5гідроксипіроло[2,3-d]піримідину, сполуки формули XIX, в якій R2 є гідрокси. Сполуку формули XX, в якій Y є бром або йод і R є бензолсульфонатом, перетворювали у сполуку формули XIX, в якій R2 є (С6-С12)арилом або вінілом, обробляючи XX Nбутиллітієм, при температурі приблизно -78°С, з наступним додаванням хлориду цинку, при температурі приблизно -78°С. Відповідний органоцинковий інтермедіат одержаний таким чином піддавали взаємодії з арилйодидом або вінілйодидом в присутності каталітичної кількості паладію. Реакційну суміш перемішували при температурі від приблизно 50°С до приблизно 80°С, переважно приблизно при 70°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно приблизно 1 годину. В реакції 3 Приготування А, сполуку формули XIX перетворювали у відповідну сполуку формули XVI обробляючи XIX N бутиллітієм, дізопропіламіном літію або гідридом натрію, при температурі приблизно -78°С, в присутності полярного апротонного розчинника, такого як тетрагідрофуран. Аніонний інтермедіат одержаний таким чином піддавали взаємодії з (а) алкілгалоїдом або бензилгалоїдом, при температурі від приблизно -78°С до кімнатної температури, переважно при -78°С, коли R3 є алкілом або бензилом; (б) альдегідом або кетоном, при температурі від приблизно -78°С до кімнатної температури, переважно при -78°С, коли R3 є алкокси; і (в) хлоридом цинку, при температурі від приблизно -78°С до кімнатної температури, переважно при -78°С, і відповідний органоцинковий інтермедіат одержаний таким чином піддавали взаємодії з арилйодидом або вінілйодидом в присутності каталітичної кількості паладію. Одержану реакційну суміш перемішували при температурі від приблизно 50°С до приблизно 80°С, переважно приблизно при 70°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно приблизно 1 годину. Альтернативно, таким чином одержаний аніон піддавали реакції з молекулярним киснем для утворення відповідного 4-хлор-6-гідроксипіроло[2,3-d]піримідину, сполуки формули XVI, в якій R3 є гідрокси. В реакції 1 Приготування Б, 4-хлорпіроло[2,3-d]піримідин, сполуку формули XXI перетворювали у відповідну сполуку формули XXII, згідно до методики описаної вище в реакції 3 Приготування А. В реакції 2 Приготування Б, сполуку формули XXII перетворювали у відповідну сполуку формули XVI, згідно до методики описаної вище в реакціях 1 і 2 Приготування А. В реакції 1 Схема 1, 4-хлорпіроло[2,3-d]піримідин, сполуку формули XVII перетворювали у відповідну сполуку формули XVI, в якій R бензолсульфонілом або бензилом, обробляючи XVII бензолсульфонілхлоридом, бензилхлоридом або бензилбромідом в присутності основи, такої як гідрид натрію або карбонат калію, і полярному апротонному розчиннику, такому як диметилформамід або тетрагідрофуран. Реакційну суміш перемішували при температурі від приблизно 0°С до приблизно 70°С, переважно приблизно при 30°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно приблизно 2 години. В реакції 2 Схема 1, 4-хлорпіроло[2,3-d]піримідин, сполуку формули XVI перетворювали у відповідний 4-амінопіроло[2,3d]піримідин, сполуку формули XV конденсуючи XVI з аміном формули HNR4R5. Реакцію проводили в спирті, такому як третбутанол, метанол або етанол, або іншому висококиплячому розчиннику, такому як диметилформамід, триетиламін, 1,4діоксан або 1,2-дихлоретан, при температурі від приблизно 60°С до приблизно 120°С, переважно приблизно при 80°С. Звичайно, час реакції складає від приблизно 2 годин до приблизно 100 годин, переважно приблизно 48 годин. Коли R 5 є азотвмісною гетероциклоалкільною групою, кожен атом азоту може бути захищений захисною групою, такою як бензил. Видалення R5 захисних груп проводиться за умов прийнятних для кожної окремої захисної групи, що використовується, які не впливають на R захисну гр упу на піроло[2,3-d]піримідиновому кільці. Видалення R 5 захисної групи, коли бензил, проводять в спиртовому розчиннику, такому як етанол, в присутності водню і каталізатору, такого як гідроксид паладію на вугіллі , при температурах в інтервалі від кімнатної температури до приблизно 70°С R5 азотвмісна гетероциклоалкільна група, одержана таким чином, може бути введена у взаємодію з різними електрофілами формули II. Для одержання сечовини, електрофіли формули II, такі як ізоціанати, карбамати і карбамоїлхлориди взаємодіють з R5 азотом гетероалкільної групи в розчиннику, такому як ацетонітрил або диметилформамід, в присутності основи, такої як карбонат натрію або калію, при температурі від приблизно 20°С до приблизно 100°С протягом часу від приблизно 24 годин до приблизно 72 годин. Для одержання аміду і сульфонаміду, електрофіли формули II, такі як ацилхлориди і сульфонілхлориди, реагують з R5 азотом гетероалкільної групи в розчиннику, такому як метиленхлорид в присутності основи, такої як піридин при кімнатній температурі протягом часу від приблизно 12 годин до приблизно 24 годин. Одержання аміду також можна провести шляхом взаємодії карбонової кислоти з гетероалкільною групою в присутності карбодііміду, такого як 1-(3-диметиламінопропіл)-3-етилкарбодіімід в розчиннику, такому як метиленхлорид при кімнатній температурі від приблизно 12 до приблизно 24 годин, або з активованим естером, таким як N-гідроксисукцинімідовий естер, або 4-нітрофеніловий естер, в розчиннику, такому як метиленхлорид, тетрагідрофуран або етанол. Для одержання алкілу, електрофіли формули II, такі як a,b-незаміщені аміди, кислоти, нітрили, естери і a-галогенаміди, взаємодіють з R5 азотом гетероалкільної групи в розчиннику, такому як метанол при кімнатній температурі протягом часу від приблизно 12 годин до приблизно 18 годин. Одержання алкілу також можна провести за допомогою взаємодії альдегідів з гетероалкільною групою в присутності відновлюючого агенту, такого як ціаноборгідрид натрію, в розчиннику, такому як метанол, при кімнатній температурі протягом часу від приблизно 12 годин до приблизно 18 годин. В реакції 3 Схема 1, видаляли захисну груп у з сполуки формули XV, в якій R є бензолсульфонілом, одержуючи відповідну сполуку формули І, і реакцію проводили обробляючи XV лугом, таким як гідроксид натрію або гідроксид калію, в спирті, такому як метанол або етанол, або суміші розчинників, такій як спирт/тетрагідрофуран або спирт/вода. Реакцію проводили при кімнатній температурі протягом часу від приблизно 15 хвилин до приблизно 1 години, переважно 30 хвилин. Видалення захисної групи з сполуки формули XV, в якій R є бензилом, проводили обробляючи XV натрієм в аміаку при температурі приблизно -78°С протягом часу від приблизно 15 хвилин до приблизно 1 години. В реакції 1 Схема 2, 4-хлорпіроло[2,3-d]піримідин, сполуку формули XX, перетворювали у відповідний 4-амінопіроло[2,3d]піримідин, сполуку формули XXIV, згідно до методики описаної вище в реакції 2 Схема 1. В реакції 2 Схема 2, 4-аміно-5-гапогенпіроло[2,3-d]піримідин, сполуку формули XXIV, в якій R є бензолсульфонатом і Z є бромом або йодом, перетворювали у відповідну сполуку формули XXIII реакцією XXIV з (а) арилборною кислотою, коли R2 є арилом, в апротонному розчиннику, такому як тетрагідрофуран або діоксан, в присутності каталітичної кількості паладію (0), при температурі від приблизно 50°С до приблизно 100°С, переважно приблизно при 70°С, протягом часу від приблизно 2 годин до приблизно 48 годин, переважно приблизно 12 годин; (б) алкінами, коли R2 є алкінілом, в присутності каталітичною кількості йодиду міді (І) і паладію (0), і полярного розчинника, такого як диметилформамід, при кімнатній температурі, протягом часу від приблизно 1 години до приблизно 5 годин, переважно приблизно 3 години; і (в) алкенами або стіренами, коли R2 є вінілом або стіренілом, в присутності каталітичної кількості паладію в диметилформаміді, діоксані або тетрагідрофурані, при температурі від приблизно 80°С до приблизно 100°С, переважно приблизно при 100°С, протягом часу від приблизно 2 годин до приблизно 48 годин, переважно приблизно 48 годин. В реакції 3 Схема 2, сполуку формули XXIII перетворювали у відповідну сполуку формули XV, згідно до методики описаної вище в реакції 3 Приготування А. В реакції 1 Схема 3, сполуку формули XVII перетворювали у відповідну сполуку формули І, згідно до методики описаної вище в реакції 2 Схема 1. Сполуки представленого винаходу основної природи здатні утворювати широкий спектр різноманітних солей з різними неорганічними і органічними кислотами. Хоча, такі солі повинні бути фармацевтично прийнятними для призначення тваринам, також бажано з практичної точки зору спочатку виділити сполуки представленого винаходу з реакційної суміші у вигляді фармацевтично неприйнятної солі і потім просто перетворити сполуку у вільну основу обробляючи лужним реагентом і надалі перетворити вільну основу у фармацевтично прийнятну кислотноадитивну сіль. Кислотноадитивні солі сполук цього винаходу основної природи легко одержують взаємодією основної сполуки з прийнятною еквівалентною кількістю вибраної мінеральної або органічної кислоти у водному середовищі або прийнятному органічному розчиннику, такому як метанол або етанол. Шляхом обережного випарювання розчинника легко одержати бажану тверду сіль. Бажана сіль кислоти може також бути одержана з розчину вільної основи в органічному розчиннику додаванням до розчину прийнятної мінеральної або органічної кислоти. Ті сполуки представленого винаходу, що є кислотами за природою здатні утворювати основні солі з різноманітними фармацевтично прийнятними катіонами. Прикладами таких солей є солі лужних і лужноземельних металів і особливо, солі кальцію, натрію і калію. Всі такі солі одержують за відповідними методиками. В якості реагентів при одержанні фармацевтично прийнятних основних солей цього винаходу, використовують хімічні основи, що утворюють нетоксичні основні солі з сполуками представленого винаходу, що мають кислу природу. Такими нетоксичними основними солями є похідні наступних фармацевтично прийнятних катіонів, таких як натрій, калій, кальцій, магній та ін. Ці солі можуть легко бути одержані під час взаємодії відповідної кислотної сполуки з водним розчином, що містить бажаний фармацевтично прийнятний катіон і подальшим випарюванням одержаного розчину до суха, переважно, під вакуумом. Альтернативно, вони можуть також бути одержані змішуванням розчину нижчого спирту кислотної сполуки і бажаного алкоголяту лужного або лужноземельного металу і подальшим упарюванням одержаного розчину до суха за умов, що приведені вище. У будь якому випадку, переважно використовують сте хіометричні кількості реагенту для гарантування повного закінчення реакції і одержання максимального виходу бажаного кінцевого продукту. Композиції представленого винаходу можуть бути одержані у відповідності із загальноприйнятими методиками, використовуючи один або більшу кількість фармцевтично прийнятних носіїв. Таким чином, активні сполуки представленого винаходу можуть входити до складу композицій, що призначені для орального, букального, інтраназального, парентерального (наприклад, внутрішньовенного, внутрішньом'язового або підшкірного) або ректального введення або у формі прийнятній для призначення шляхом інгаляцію або інсуфляції. Активні сполуки винаходу можуть також входити до складу рецептур з пролонгованим вивільненням. Для орального введення, фармацевтичні композиції можуть представляти собою, наприклад, таблетки або капсули одержані у відповідності до загальноприйнятих методик з використанням фармацевтично прийнятних екціпієнтів, таких як зв'язувальні агенти (наприклад, прежелатинізований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або фосфат кальцію); змащувальні агенти (наприклад, стеарат магнію, тальк або кремній); дезінтегратори (наприклад, картопляний крохмаль або крохмальгліколят натрію); або зволожуючі агенти (наприклад, лаурілсульфат натрію). Таблетки можуть бути покриті оболонкою за методами добре відомими фахівцю. Рідкі рецептури для орального призначення можуть представляти собою, наприклад, розчини, сиропи або суспензії, або вони можуть бути сухими продуктами для розведення з водою або іншим придатним розчинником перед використанням. Такі рідкі рецептури можуть бути одержані використовуючи загальноприйняті процедури і використовуючи фармацевтично прийнятні наповнювачі, такі як суспендувальні агенти (наприклад, сироп сорбіту, метилцелюлозу або гідрогенізовані їстівні жири); емульсифікатори (наприклад, лецитин або акація); неводні розчинники (наприклад, мигдальну олію, естери жирів або етиловий спирт); і консерванти (наприклад, метил або пропіл пгідроксибензоат або сорбінову кислоту). Для букального введення, композиції можуть представляти собою таблетки або коржики одержані за загальноприйнятою методикою. Активні сполуки винаходу можуть бути рецептовані для парентерального призначення шляхом вливання, що включає використання загальноприйнятих методів катетеризації або інфузії. Рецептури для вливання можуть бути представлені у вигляді одиничних дозованих форм, наприклад, у вигляді ампул або у вигляді багатодозованих контейнерів, що містять консерванти. Композиції можуть також представляти собою суспензії, розчини, або емульсії в маслі або водному розчиннику, і можуть містити формуючі агенти, такі як суспендувальні, стабілізуючі і/або диспергувальні агенти. Альтернативно, активний інгредієнт може бути у вигляді порошку для розчинення перед використанням у придатному розчиннику, наприклад, стерильній піроген-вільній воді. Активні сполуки винаходу можуть також бути рецептовані у ректальні композиції, такі як супозиторії або клізми, наприклад, що містять загальноприйнятні супозиторійні основи, такі як какаове масло або інші гліцериди. Для інтраназального введення або введення за допомогою інгаляції, активні сполуки винаходу зазвичай вводяться у формі розчинів або суспензій з аерозольного балону, що видавлюється або впорскується пацієнту або у ви гляді аерозолю з аерозольного балону, або шляхом видавлювання, використовуючи придатний пропелант, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан, діоксид вуглецю або інший придатний газ. У випадку герметизованого аерозолю, одинична доза може бути визначена використовуючи клапан, що вивільнює визначену кількість. Герметизований контейнер або розпилювач можуть містити розчин або суспензію активної сполуки. Капсули і картриджі (виготовляють, наприклад, з желатину) для використання при інгаляції або вдуванні можуть містити порошкоподібну суміш сполуки винаходу і придатного порошкоподібного наповнювача, такого як лактоза або крохмаль. Пропонуєма доза активної сполуки винаходу для орального, парентерального, або букального введення дорослій людині для лікування станів зазначених вище (наприклад, ревматоїдного артриту) знаходиться в інтервалі від 0,1 до 1000мг активного інгредієнту на одиничну дозу, яка може бути введена, наприклад, від 1 до 4 разів на день. Аерозольні рецептури для лікування станів зазначених вище (наприклад, астми) для дорослої людини, переважно, пристосовано так, щоб кожна виміряна доза або "пшик" аерозолю містила від 20мкг до 1000мкг сполуки винаходу. П овна добова доза аерозолю повинна знаходиться в інтервалі від 0,1мг до 1000мг. Призначатися вона може декілька разів на день, наприклад, 2, 3, 4 або 8 разів, приймаючи, наприклад, 1, 2 або 3 дози кожен раз. Сполука формули (І) може призначатись у фармацевтично прийнятній формі або окремо, або в комбінації з одним або більшою кількістю додаткових агентів, які модулюють імунну систему ссавця або з протизапальними агентами, агентами, які включають, але не обмежується, циклоспорін А (наприклад, Сандіммун® або Неорал®, параміцин, FK-506 (такролімус), лефлуномід, деоксиспергуалін, мікофенолат (наприклад, Целцепт®), азатіопрін (наприклад, Імуран®), даклізумаб (наприклад, Зенапакс®, ОКТЗ (наприклад, Ортоклон®), AtGam, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам, і атизапальні стероїди (наприклад, преднізолон або дексаметазон); і такі агенти можуть вводитись, як частина тих самих або розділених дозованих форм, одним або різними шляхами, за одним або різними прописами згідно до стандартної фармацевтичної практики. FK506 (Такролімус) приймається орально по 0,10-0,15мг/кг ваги тіла, кожні 12 годин, крім перших 48 годин після операції. Рівень такролімусу контролюється по присутності в сироватці. Циклоспорін А (Сандімун у вигляді рецептур для орального або внутрішньовенного введення, або Неорал®, оральний розчин або капсули) приймається орально по 5мг/кг ваги тіла, кожні 12 годин крім 48 годин після операції. Рівень циклоспоріну А контролюється по наявності у крові. Активні агенти можуть бути сформовані для пролонгованого вивільнення згідно до методів добре відомих середньому фа хівцю в цій галузі. Приклади таких рецептур можуть бути знайдені в [патентах Сполучених Штатів 3538214, 4060598, 4173626, 3119742 і 3492397]. Здатність сполук формули І або їх фармацевтично прийнятних солей інгібувати кіназу Януса 3 і, відповідно, демонструвати їх ефективність для лікування розладів або станів, що характеризуються кіназою Януса 3 показані далі в дослідженнях in vitro. Біологічні дослідження. JAK3 (JH1:GST) Ферментаційні дослідження. У дослідженнях кінази JAK3 використовували протеїн експресований в бациловіросно-інфікованих клітинах SF9 (злити й протеїн GST і каталітичний домен людської JAK3) очищеної за допомогою афінної хроматографії на глутатіон-сепахарозі. Субстратом для реакції є полі-глутамінова кислота-тірозин (PGT (4:1), каталог Sigma # Р0275), нанесена на платівки Nunc Ma xi Sorp в концентрації 100пг/мл на ніч при температурі 37°С. Ранком після нанесення, платівки три рази промивали і до лунок, що містили 100мкл буфера кінази (50мМ HEPES, рН7,3, 125мМ NaCI, 24мМ МдD2)+0,2uМ АТР+1мМ Na ортованадату) додавали JAK3. Реакція продовжувалася 30 хвилин при кімнатній температурі і платівки три рази промивали. Рівень фосфорильованого тірозину в даних лунках підраховували використовуючи стандартну методику ELISA використовуючи антитіло антифосфотірозин (ICN PY20, кат. #69-151-1). Інгібування IL-2 людини, що залежить від проліферації Т-клітинних бластів. В цьому дослідженні вимірюють інгібуючу активність сполук на IL-2, що залежить від проліферації Т-клітинних бластів in vitro. Оскільки передача сигналів через IL-2 рецептор потребує JAK-3, клітиноактивні інгібітори JAK-3 повинні інгібувати IL-2, що залежить від проліферації Т-клітинних бластів. Клітини для цього дослідження виділяли з свіжої крові людини. Після відокремлення мононуклеарних клітин використовуючи Accuspin System-Histopaque-1077 (Sigma #A7054), первинні Т-клітини людини виділяли за допомогою негативного відбору використовуючи Lympho-Kwik T (One Lambda, Inc., Cat #LK-50T). Т-клітини культивували при 1-2´106/мл в середовищі (RPMI+10% ін активована нагріванням ембріональна сироватка телят (Hyclone Cat #A-111 1-L)+1% пеніцилін/стрептоміцин (Gibco)) і індукували проліферацію додаючи 10мкг/мл1 PHA (Murex Diagnostics, Cat #HA 16). Через 3 дні при 37°С в 5% СО2, клітини 3 рази промивали 3 в середовищі, ресуспендували до густини 1-2´106клітин/мл в середовищі плюс 100одиниць/мл рекомбінантного IL-2 людини (R&D Systems, Cat #202-IL). Через 1 тиждень клітини стають залежними від IL-2 і можуть витримуватись протягом до 3 тижнів шляхом додавання двічі на тиждень еквівалентних об'ємів середовища +100одиниць/мл IL-2. Для дослідження здатності сполук, що тестуються, інгібувати IL-2 залежну проліферацію Т-клітин, IL-2 залежні клітини промивали 3 рази, суспендували в середовищі і потім наносили (50,000клітин/лунка/0,1мл) в мікро титровану платівку з 96лунками з пласким дном (Falcon #353075). З 10мМ готового розчину сполуки, що тестується, в ДМСО, серію 2-кратних розведень сполуки додавали до трьох лунок починаючи з 10мкМ. Через одну годину, додавали 10одиниць/мл IL-2 до кожної лунки для тестування. Платівки потім інкубували при 37°С, 5% СО2 протягом 72 годин. Платівки потім доповнювали 3Нтімідином (0,5мкD/лунку) (NEN Cat #NET-027A) і інкубували додаючи 18 годин. Культури платівок віджимали використовуючи 96-луночно планшетний віджимач і визначали кількість 3Н-тімідину включеного в проліферацію клітин підраховуючи на сцинтиляційному лічильнику Packard Top Count. Дані аналізували використовуючи графік % інгібування проліферації до концентрації сполуки, що тестується. З цього графіку визначали IC50 значення (мкМ). Наступні приклади розкривають одержання сполук представленого винаходу, але не обмежуються його деталями. Температури плавлення не корегувалися. Дані ЯМР позначали в м.ч. (d) і відносно сигналу дейтерію з зразку розчинника (дейтерохлороформ, якщо не вказано інше). Комерційні реагенти використовували без попередньої очистки. Скорочення ТГФ стосується тетрагідрофурану. Скорочення ДМФА стосується N,N-диметилформаміду. Низькороздільну масспектроскопію (НРМС) знімали або на Hewlett Packard 5989®, використовуючи хімічну іонізацію (аміак), або на Fisons (або Micro Mass) платформі хімічної іонізації при атмосферному тиску (ХІАТ), на якій використовували 50/50 суміш ацетонітрил/вода з 0,1% мурашиної кислоти, в якості іонізуючого агенту. Термін кімнатна температура або температура оточуючого середовища означає 20-25°С. ПРИКЛАД 1 (одержання стабільних солей). (1-бензил-4-метилпіперидин-3-іл)метиламіну бісгідрохлорид. До розчину 23,4кг (1-бензил-4-метилпіперидин-3-іл)метиламіну в 10 літрах толуолу і 120 літрах етанолу при 3°С додавали 25 літрів 32% НCl у воді, підтримуючи температур у реакції нижче 10°С 100 літрів розчинника відганяли при парціальному тиску і додавали 215 літрів етилацетату при 30°С. Відганяли 210 літрів розчинника при парціальному тиску і додавали інші 215 літрів етилацетату і інші 210 літрів розчинника відганяли при парціальному тиску. Додавали 111 літрів ацетону при 35С°, суспензію охолоджували при 0°С і потім (1-бензил-4-метилпіперидин-3-іл)-метиламін бісгідрохлорид відфільтровували і промивали 55 літрами ацетону. Вологий залишок ресуспендували 3 рази в етанолі (10 об'ємним еквівалентам при кип'ятінні) для збільшення діастереомерного відношення цис:транс з 91:9 до більше ніж 97:3. Загальний вихід становив 19,4кг, вихід 62%. 1Н ЯМР (CD3OD, 400МГц): 7,55 (м, 5Н), 4,88 (с, 3Н), 4,52 (д, J=12,8Гц, 1Н), 4,45 (д, J=12,8Гц, 1Н), 3,76 (м, 1Н), 3,67 (м, 1Н), 3,40-3,00 (м, 3Н), 2,78 (3, 3Н), 2,55 (м, 1Н), 2,14 (м, 1Н), 1,90 (м, 1Н), 1,16(д, J=7,2Гц, 3Н). ПРИКЛАД 2 (Розділення) біс[(1-бензил-4-метилпіперидин-3-іл)метиламіну] ди-п-толуїл-L-тартрат. До розчину бісгідрохлориду 9,5кг (1-бензил-4-метилпіперидин-3-іл)метиламіну в 16 літрах води додавали 33 літра 2N гідроксиду натрію. З суміші випадав осад. Суспензію розводили в 43 літрах ізопропанолу і 11 літрах метанолу для розчинення твердої речовини. Додавали ди-п-толуїл-L-винну кислоту (6,3кг) з висадженням твердої речовини. Суспензію нагрівали із зворотнім холодильником до розчинення твердої речовини, потім повільно охолоджували до 72°С Додавали затравку біс[(1бензил-4-метилпіперидин-3-іл)метиламіну] ди-п-толуїл-L-тартрату (180 грам) і мутний розчин повільно охолоджували до 15°С. Тверду речовину фільтрували і промивали ізопропанолом одержуючи 5,9кг біс[(1-бензил-4-метилпіперидин-3іл)метиламіну] ди-п-толуїл-L-тартрату з 44% виходом. 1Н ЯМР (CD3OD, 400МГц): 8,04 (д, J=8,4Гц, 2Н), 7,30 (м, 7Н), 5,86 (с, 1Н), 4,91 (с, 3Н), 3,64 (д, J=12,8Гц, 1Н), 3,41 (д, J=12,8Гц, 1Н), 3,09 (с, 1Н), 2,90 (м, 2Н), 2,40 (с, 3Н), 2,22 (м, 2Н), 1,92 (м, 1Н), 1,57 (м, 2Н), 1,03 (д, J=7,2Гц, 3Н) ПРИКЛАД 3 (розділення Фенцифосу). До розчину 6,83 грам (31,3ммоль) в 250мл ІРА і 10мл води додавали 7,57г (+) фенцифосу (31,3ммоль) і суміш нагрівали із зворотнім холодильником до одержання прозорого розчину. При температурі приблизно 65°С додавали затравку кристалів з ее 90%. Кристалізація починалась в межах однієї години і суміш залишали для охолодження до кімнатної температури протягом ночі. Виділення давало 6,85г (47%) з ее 99%. Фільтрат концентрували, додавали ТВМЕ, воду і К2СО3 і шари розділяли. Органічний шар сушили (Na2SO4)) і розчинник випарювали. Одержане масло (3,99 грам) розчиняли в 200мл ІРА і 10мл води і додавали 4,4 грам (-)фенцифосу. Суміш нагрівали із зворотнім холодильником і залишали охолоджувати сь до кімнатної температури протягом ночі. Це давало 6 грам (41%) солі з ее 99,9+%. Аналіз проводили по вільному аміну. Вільний амін одержували обробляючи сіль ТВМЕ, водою і К2СО 3. Далі схематично показані способи Прикладів 1 - 3 (де Вn означає бензил (-СН2-С6Н5)): Обробка зразка. Сполуки формули III фільтрували крізь 0,2мкм нейлоновий 66 фільтрувальний диск. Методика: (Суміш 96% етанолу і 4% води як розчинник). 0,8711 грам сполуки формули III, фільтрату, розчиняли в 5,0мл 96:4 суміші етанол/вода. Додавали 1,544 грам ди-ртолуоїл-L-винної кислоти і суміш перемішували одержуючи прозорий розчин. Розчин залишали стояти при кімнатній температурі протягом приблизно 4 годин. Одержану суспензію фільтрували крізь паперовий фільтр Whatman #2 і промивали 4,0мл 96:4 сумішшю етанол/вода. Тверду речовину сушили на повітрі одержуючи 0,488 грам діастереомерної солі. 0,488 грам діастереомерної солі суспендували в 50мл води потім додавали 50мл метиленхлориду. рН суміші доводили приблизно до 9 використовуючи насичений розчин бікарбонату натрію після чого 1,0N гідроксид натрію. Після завершення регулювання рН, шари розділяли і метиленхлоридний шар фільтрували крізь паперовий фільтр Whatman #2. Розчинники видаляли при пониженому тиску одержуючи світло-оранжеве масло. Вагу не визначали. Це масло оцінювали за допомогою газової хроматографії. Аналітичне дослідження: 97,3% бажаного енантіомеру з нормалізованої відсоткової площини. ПРИКЛАД 5 Методика: (100% Етанол як розчинник). 0,8714 грам (1-бензил-4-метил-піперидин-3-іл)метиламіну розчиняли в 5,0мл 200 сухого етанолу. Додавали 1,544 грам ди-п-толуоїл-L-винної кислоти і суміш перемішували одержуючи прозорий розчин. Розчин залишали стояти при кімнатній температурі протягом приблизно 4 годин. Одержану суспензію фільтрували на паперовому фільтрі Whatman #2 і промивали 4,0мл 96:4 сумішшю етанол/вода. Тверду речовину сушили на повітрі одержуючи 0,628 грам діастереомерної солі. 0,628 грам діастереомерної солі суспендували в 50мл води і потім додавали 50мл метиленхлориду. рН суміші доводили приблизно до 9 використовуючи насичений розчин бікарбонату натрію після чого 1,0 N гідроксид натрію. Після завершення регулювання рН, шари розділяли і метиленхлоридний шар фільтрували крізь паперовий фільтр Whatman #2. Розчинники видаляли при пониженому тиску одержуючи світло-жовте масло. Вагу не визначали. Оцінку масла проводили за допомогою аналітичного дослідження: 90,5% бажаного енантіомеру з нормалізованої відсоткової площини. ПРИКЛАД 6 3-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл)-3-оксо-пропіонітрил Спосіб А (3R,4R)-(1-Бензил-4-метил-піперидин-3-іл)-метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін 4-Хлорпіроло[2,3-d]піримідин (5,37 грам, 34,9ммоль), одержували за способом Davoll, J. Am. Chem. Soc, 82, 131 (1960), яке включено сюди як посилання у всій своїй повноті, продукт з Прикладу 2 (6 грам, 27,5ммоль) і карбонат калію (11,4 грам, 82,5ммоль) об'єднували у воді (60мл). Суспензію нагрівали із зворотнім холодильником 90 годин. Суміш охолоджували до 90°С і додавали толуол (60мл). Біфазну суміш фільтрували крізь фільтр і шари розділяли. Водний шар екстрагували толуолом. Об'єднані толуольні шари промивали 1N NaOH, обробляли активованим вугіллям і фільтрували крізь фільтр. Толуол упарювали у вакуумі і залишок кристалізували з 1:1 суміші ізопропілацетат і гексани одержуючи 5 грам майже-білої твердої речовини; вихід 54%. НРМС: 336,1 (М+1). Спосіб Б Метил-((3R,4R)-4-метил-піперидин-3-іл)-(7Н-піроло[2,3-d]піримідин-4-іл)-амін Продукт Способу А (0,7 грам, 2,19ммоль) розчиняли в 15мл етанолу, додавали 1,5мл 2N хлорводневої кислоти і реакційну суміш дегаз ували потоком азоту. До реакційної суміші потім додавали 0,5 грам 20% гідроксиду паладію на вугіллі (50% води) (Aldrich) і одержану суміш збовтували (шейкер Парра) при тиску водню 50 псі при кімнатній температурі протягом 2 днів. Реакційну суміш фільтрували крізь Целіт, концентрували до суха у вакуумі і залишок очищали за допомогою флешхроматографії (силікагель; 5% метанолу в дихлорметані) одержуючи 0,48 грам (90%) вказаної в заголовку сполуки. НРМС: 246,1 (М+1). Спосіб В 3-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил До розчину, що перемішується, продукту з Способу Б (1,0г) розчиненого в 30мл етанолу додавали 0,82г ціанооцтової кислоти 2,5-діоксопіролідин-1-ілового естеру і одержану суміш перемішували при кімнатній температурі протягом 2г. Реакційну суміш фільтрували крізь Целіт® і концентрували у вакуумі. Залишок розчиняли в дихлорметані, промивали насиченим водним розчином бікарбонату натрію, сушили над сульфатом натрію, фільтрували і концентрували до суха у вакуумі одержуючи 1,1г (86%) вказаної в заголовку сполуки як жовту піну. НРМС: 313 (М+1). ПРИКЛАД 7 1-(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}етанон До розчину, що перемішується, продукту з Способу Б (0,03 грам, 0,114ммоль) розчиненого в 5мл 10:1 дихлорметан/піридин додавали ацетилхлорид (0,018 грам, 0,228ммоль) і одержану суміш перемішували при кімнатній температурі протягом 18 годин. Реакційну суміш розділяли між дихлорметаном і насиченим бікарбонатом натрію (NaHCO3). Органічний шар знову промивали насиченим NaHCO3, сушили над сульфатом натрію і концентрували до суха у вакуумі. Залишок очищали за допомогою препаративної тонкошарової хроматографії (ПТШХ) (силікагель; 4% метанол в дихлорметані) одержуючи 0,005г (15%) вказаної в заголовку сполуки як безбарвне масло. Вказані в заголовках прикладів 8-31 сполуки одержували за допомогою способу аналогічного тому, що описаний в Прикладі 7. ПРИКЛАД 8 (3R,4R)-[1-(2-Аміноетансульфоніл)-4-метилпіперидин-3-іл]метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 9 (3R,4R)-(1-Етансульфоніл-4-метилпіперидин-3-іл)метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 10 (3R,4R)-[1-(Бутан-1-сульфоніл)-4-метилпіперидин-3-іл]метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 11 (3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти ізобутиловий естер ПРИКЛАД 12 N-(2-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-сульфоніл}етил)пропіонамід ПРИКЛАД 13 (2-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-сульфоніл}етил)карбамінової кислоти метиловий естер ПРИКЛАД 14 N-(2-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-сульфоніл}етил)ізобутирамід ПРИКЛАД 15 (3R,4R)-(1-Метансульфонілпіперидин-3-іл)-метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 16 ((3R,4R)-1-Етансульфонілпіперидин-3-іл)-метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 17 (3R,4R)-Метил-[1-(пропан-1-сульФоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 18 (3R,4R)-[1-(Бутан-1-сульфоніл)піперидин-3-іл]метил-(7Н-піроло[2,3-d]піримідин-4-іл)амін ПРИКЛАД 19 2,2-Диметил-N-((3R,4R)-2-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1сульфоніл}етил)пропіонамід ПРИКЛАД 20 (3-{(3R,4R)-4-Метил-3-метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіл)карбамінової кислоти трет-бутиловий естер ПРИКЛАД 21 Метил-[(3R,4R)-4-метил-1 -(пропан-1-сульфоніл)піперидин-3-іл]-(7Н-піроло-[2,3-d]піримідин-4-іл)амін ПРИКЛАД 22 3-Аміно-1-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-пропан-1-он ПРИКЛАД 23 2-Метокси-1-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)-аміно]піперидин-1-іл}етанон ПРИКЛАД 24 2-Диметиламіно-1-{(3R,4R)-4-метил-3-[метил-(7Н-пІроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}етанон ПРИКЛАД 25 (3-((3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіл)карбамінової кислоти трет-бутиловий естер ПРИКЛАД 26 3,3,3-Трифтор-1-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}пропан-1-он ПРИКЛАД 27 N-(2-{(3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піримідин-1-іл}-2-оксоетил)ацетамід ПРИКЛАД 28 3-Етокси-1-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}пропан-1-он ПРИКЛАД 29 (3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти метиламід ПРИКЛАД 30 (3R,4R)-4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти діетиламід ПРИКЛАД 31 (3R,4R)-Метил-[4-метил-1-(2-метиламіноетансульфоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін
ДивитисяДодаткова інформація
Назва патенту англійськоюOptical resolution of (1-benzyl-4-methylpiperidin-3-yl) -methylamine and the use thereof for the preparation of pyrrolo 2,3-pyrimidine derivatives as protein kinases inhibitors
Назва патенту російськоюСпособ оптического разделения (1-бензил-4-метилпиперидин-3-ил)метиламина и его использование для получения производных пирроло[2, 3-d]пиримидина как ингибиторов протеинкиназы
Автори російськоюFlanagan, Mark, Edward
МПК / Мітки
МПК: A61P 19/02, A61P 1/04, A61P 25/00, C07D 211/56, A61P 3/10, A61P 37/08, A61K 45/00, C07B 57/00, A61P 35/00, A61P 37/02, A61P 17/00, A61P 37/06, C07D 487/04, A61K 31/519, A61P 43/00, A61P 17/06, A61P 35/02, A61P 29/00, A61P 11/06, A61P 25/28
Мітки: використання, спосіб, інгібіторів, піроло[2.3-d]піримідину, похідних, оптичного, розділення, 1-бензил-4-метилпіперидин-3-іл)метиламіну, протеїнкінази, одержання
Код посилання
<a href="https://ua.patents.su/16-80093-sposib-optichnogo-rozdilennya-1-benzil-4-metilpiperidin-3-ilmetilaminu-i-jjogo-vikoristannya-dlya-oderzhannya-pokhidnikh-pirolo23-dpirimidinu-yak-ingibitoriv-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Спосіб оптичного розділення (1-бензил-4-метилпіперидин-3-іл)метиламіну і його використання для одержання похідних піроло[2,3-d]піримідину як інгібіторів протеїнкінази</a>
Попередній патент: Спосіб (варіанти) та система для керування потоком між контролером базової станції і базовою приймально-передавальною станцією, пристрій керування обчислювальною машиною
Наступний патент: Пристрій для аналізу ртуті
Випадковий патент: Спосіб кількісного визначення ступеня гідроморфності та заболоченості ґрунту