Сполуки піроло[2.3-d]піримідину, фармацевтична композиція (варіанти), спосіб інгібування протеїнкіназ або janus кінази 3 (варіанти)
Номер патенту: 72290
Опубліковано: 15.02.2005
Автори: Блуменкопф Тодд Ендрю, Фленеген Марк Едвард, Манчхоф Майкл Джон
Формула / Реферат
1. Сполука формули
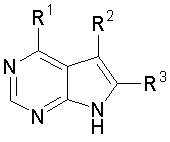 I
I
або її фармацевтично прийнятна сіль, в якій R1 є групою формули
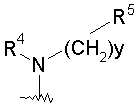 ,
,
де у дорівнює 0, 1 або 2;
R4 вибраний з групи, яка включає водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2-С6)алкініл, де алкільна, алкенільна та алкінільна групи необов'язково заміщені дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1-С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2-С6)алкенілом, (С2-С6)алкінілом або (С2-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, в якому циклоалкільна група є необов'язково заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R5 є (С2-С9)гетероциклоалкілом, в якому гетероциклоалкільні групи повинні бути заміщені від одного до п'яти замісниками, вибраними з карбокси, ціано, аміно, дейтерію, гідрокси, (С1-С6)алкілу, (С1-С6)алкокси, гало, (С1-С6)ацилу, (С1-С6)алкіламіно, аміно(С1-С6)алкілу, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкенілу, (С2-С6)алкінілу, (С1-С6)алкіламіно, аміно(С1-С6)алкілу, гідроксі(С1-С6)алкілу, (С1-С6)алкоксі(С1-С6)алкілу, (С1-С6)ацилоксі(С1-С6)алкілу, нітро, ціано(С1-С6)алкілу, гало(С1-С6)алкілу, нітро(С1-С6)алкілу, трифторметилу, трифторметил(С1-С6)алкілу, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкілу, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацилу, аміно(С1-С6)ацил(С1-С6)алкілу, (С1-С6)алкіламіно(С1-С6)ацилу, ((С1-С6)алкіл)2аміно(С1-С6)ацилу, R15R16N-CO-O-, R15R16N-СО-(С1-С6)алкілу, (С1-С6)алкіл-S-(O)m, R15R16NS(O)m, R15R16NS(O)m(С1-С6)aлкілу, R15S(O)mR16N, R15S(О)mR16N(С1-С6)алкілу, де m дорівнює 0, 1 або 2, і R15 та R16 кожний незалежно вибраний з водню або (С1-С6)алкілу;
або групою формули
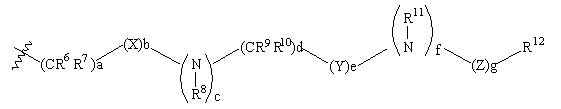 , (ІІ)
, (ІІ)
в якій а є 0, 1, 2, 3 або 4;
b, с, е, f та g кожний незалежно є 0 або 1;
d є 0, 1, 2 або 3;
X являє собою S(O)n, де n є 0, 1 або 2; кисень, карбоніл або -С(=N-ціано)-;
Y являє собою S(O)n, де n 0,1 або 2; або карбоніл; і
Z являє собою карбоніл, С(O)O-, C(O)NR- або S(O)n, де n є 0, 1 або 2;
R6, R7, R8, R9, R10 та R11 кожний незалежно вибраний з групи, яка складається з водню або (С1-С6)алкілу, необов'язково заміщеного дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1-С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1-С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно;
R12 являє собою карбокси, ціано, аміно, оксо, дейтерій, гідрокси, трифторметил, (С1-С6)алкіл, трифторметил(С1-С6)алкіл, (С1-С6)алкокси, гало, (С1-С6)ацил, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкіл, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкеніл, (С2-С6)алкініл, (С1-С6)алкіламіно, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)ацилоксі(С1-С6)алкіл, нітро, ціано(С1-С6)алкіл, гало(С1-С6)алкіл, нітро(С1-С6)алкіл, трифторметил, трифторметил(С1-С6)алкіл, (С1-С6)ациламіно, (С1-С6)ациламіно(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)ациламіно, аміно(С1-С6)ацил, аміно(С1-С6)ацил(С1-С6)алкіл, (С1-С6)алкіламіно(С1-С6)ацил, ((С1-С6)алкіл)2аміно(С1-С6)ацил, R15R16N-CO-O-, R15R16N-CO(С1-С6)алкіл, R15C(O)NH, R15OC(O)NH, R15NHC(O)NH, (С1-С6)алкіл-S(O)m, (С1-С6)алкіл-S(O)m-(С1-С6)алкіл, R15R16NS(O)m, R15R16NS(O)m(С1-С6)алкіл, R15S(О)mR16N, R15S(O)mR16(С1-С6)алкіл, де m є 0, 1 або 2, і R15 та R16 кожний незалежно вибраний з водню або (С1-С6)алкілу;
R2 та R3 кожний незалежно вибраний з групи, яка включає водень, дейтерій, аміно, гало, гідрокси, нітро, карбокси, (С2-С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3-С10)циклоалкіл, де алкільні, алкоксильні або циклоалкільні групи необов'язково заміщені від однієї до трьох групами, вибраними з гало, гідрокси, карбокси, аміно(С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С5-С9)гетероарилу, (С2-С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 та R3 кожний незалежно є (С3-С10)циклоалкілом, (С3-С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6-С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (С1-С6)алкілсульфінілом, (С6-С10)арилсульфінілом, (С1-С6)алкілсульфонілом, (С6-С10)арилсульфонілом, (С1-С6)ацилом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіно-СО-, (С5-С9)гетероарилом, (С2-С9)гетероциклоалкілом або (С6-С10)арилом, в яких гетероарильні, гетероциклоалкільні та арильні групи необов'язково заміщені від однієї до трьох групами, вибраними з гало, (С1-С6)алкілу, (С1-С6))алкіл-СО-NН-, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілу, (С1-С6)алкоксі-СО-NН-(С1-С6)алкілу, (С1-С6)алкоксі-СО-NН-(С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілу, карбоксі(С1-С6)алкокси, бензилоксикарбоніл(С1-С6)алкокси, (С1-С6)алкоксикарбоніл(С1-С6)алкокси, (С6-С10)арилу, аміно, аміно(С1-С6)алкілу, (С1-С6)алкоксикарбоніламіно, (С6-С10)арил(С1-С6)алкоксикарбоніламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С1-С6)алкілу, ((С1-С6)алкіл)2аміно(С1-С6)алкілу, гідрокси, (С1-С6)алкокси, карбокси, карбоксі(С1-С6)алкілу, (С1-С6)алкоксикарбонілу, (С1-С6)алкоксикарбоніл(С1-С6)алкілу, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С5-С9)гетероциклоалкілу, аміно-CO-NH-, (С1-С6)алкіламіно-СО-NН-, ((С1-С6)алкіл)2аміно-СО-NН-, (С6-С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-NH-, (С1-С6)алкіламіно-СО-NH(С1-С6)алкілу, ((С1-С6)алкіл)2аміно-СО-NН-(С1-С6)алкілу, (С6-С10)ариламіно-СО-NН-(С1-С6)алкілу, (С5-С9)гетероариламіноСО-NН-(С1-С6)алкілу, (С1-С6)алкілсульфонілу, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілу, (С6-С10)арилсульфонілу, (С6-С10)арилсульфоніламіно, (С6-С10)арилсульфоніламіно(С1-С6)алкілу, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С1-С6)алкілу, (С5-С9)гетероарилу або (С2-С9)гетероциклоалкілу.
2. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; с є 0; d є 0; е є 0; f є 0 і g є 0.
3. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; с є 0; d є 0; e є 0; f є 0 і g є 0.
4. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; с є 0; d є 0; e є 0; f є 0 і g є 0.
5. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою -С(=N=ціано)-; с є 0; d є 0; e є 0; f є 0 і g є 0.
6. Сполука за п. 1, в якій a є 0; b є 0; c є 0; d є 0; e є 0; f є 0; g є 1 i Z являє собою -С(O)-O-.
7. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою S(O)n; n є 2; с є 0; d є 0; е є 0; f є 0 і g є 0.
8. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою S(O)n; n є 2; с є 0; d є 2; е є 0; f є 1; g є 1 і Z являє собою карбоніл.
9. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою S(O)n; n є 2; с є 0; d є 2; е є 0; f є 1 і g є 0.
10. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; c є 1; d є 0; e є 1; Y являє собою S(О)n; n є 2; f є 0 і g є 0.
11. Сполука за п. 1, в якій а є 0; b є 1; X являє собою S(O)n; n є 2; с є 1; d є 0; е є 0; f є 0 і g є 0.
12. Сполука за п. 1, в якій а є 1; b є 1; Х являє собою карбоніл; c є 1; d є 0; e є 0 f є 0; і g є 0.
13. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою S(O)n; с є 0; d є 1; е є 1; Y являє собою S(О)n; n є 2; f є 0 і g є 0.
14. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою S(O)n; с є 0; d є 2, 3 або 4; е є 1; Y являє собою S(О)n; n є 2; f є 1 і g є 0.
15. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою кисень; с є 0; d є 2, 3 або 4; е є 1; Y являє собою S(О)n; n є 2; f є 1 і g є 0.
16. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою кисень; с є 0; d є 2, 3 або 4; е є 1; Y являє собою S(O)n; n є 2; f є 0 і g є 0.
17. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; с є 1; d є 2, 3 або 4; е є 1; Y являє собою S(О)n; f є 0 і g є 0.
18. Сполука за п. 1, в якій а є 0; b є 1; Х являє собою карбоніл; с є 1; d є 2, 3 або 4; е є 1; Y являє собою S(О)n; n є 2; f є 1 і g є 0.
19. Сполука за п. 1, в якій R12 являє собою ціано, трифторметил, (С1-С6)алкіл, трифторметил (С1-С6)алкіл, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С2-С6)алкініл, ціано (С1-С6))алкіл, (С1-С6)алкіл-S(O)n, де m є 0, 1 або 2.
20. Сполука за п. 1, де згадана сполука вибрана з групи, яка включає:
метил-[4-метил-1-(пропан-1-сульфоніл)-піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін;
метиловий естер 4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти;
3,3,3-трифтор-1-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-пропан-1-он;
диметиламід 4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти;
етиловий естер ({4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбоніл}аміно)оцтової кислоти;
3-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил;
3,3,3-трифтор-1-{4-метил-3-[метил-(5-метил-7Н-піроло[2,3-d]піримідин-4-іл)-аміно]-піперидин-1-іл}пропан-1-он;
1-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-бут-3-ин-1-он;
1-{3-[(5-хлор-7Н-піроло[2,3-d]піримідин-4-іл)метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он;
1-{3-[(5-фтор-7Н-піроло[2,3-d]піримідин-4-іл)метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он;
N-ціано-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]-N'-пропілпіперидин-1-карбоксамідин та
N-ціано-4,N',N'-триметил-3-[метил-(7Н-піроло[2.3-d]піримідин-4-іл)-аміно]-піперидин-1-карбоксамідин.
21. Фармацевтична композиція для (а) лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантації, вовчака, мультисклерозу, ревматоїдного артриту, псоріазу, діабету типу І та ускладнень, пов'язаних з діабетом, раку, астми, атопічного дерматиту, аутоімунних тироїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань або (b) інгібування протеїнкінази або Janus кінази 3 (JAK3) у ссавців, у тому числі людей, яка містить сполуку згідно з п. 1 або її фармацевтично прийнятну сіль у кількості, ефективній для лікування таких розладів або станів, та фармацевтично прийнятний носій.
22. Фармацевтична композиція для (а) лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантації, вовчака, мультисклерозу, ревматоїдного артриту, псоріазу, діабету типу І та ускладнень, пов'язаних з діабетом, раку, астми, атонічного дерматиту, аутоімунних тироїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань або (b) інгібування протеїнкінази або Janus кінази 3 (JAK3) у ссавців, у тому числі людей, яка містить сполуку згідно з п. 1 або її фармацевтично прийнятну сіль, саму або в комбінації з одним або декількома додатковими агентами, які модулюють імунну систему ссавця, або з антизапальними агентами, у кількості, ефективній для лікування таких розладів або станів, та фармацевтично прийнятний носій.
23. Спосіб інгібування протеїнкіназ або Janus кінази 3 (JAK3) у ссавця, у тому числі людини, який полягає в уведенні згаданому ссавцю ефективної кількості сполуки згідно з п. 1 або її фармацевтично прийнятної солі.
24. Спосіб лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантації, вовчака, мультисклерозу, ревматоїдного артриту, псоріазу, діабету типу І та ускладнень, пов'язаних з діабетом, раку, астми, атопічного дерматиту, аутоімунних тіроїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань у ссавців, у тому числі людей, який полягає в уведенні згаданому ссавцю сполуки згідно з п. 1 або її фармацевтично прийнятної солі у кількості, ефективній для лікування такого стану.
25. Спосіб інгібування протеїнкіназ або Janus кінази 3 (JAK3) у ссавця, у тому числі людини, який полягає в уведенні згаданому ссавцю ефективної кількості сполуки згідно з п. 1 або її фармацевтично прийнятної солі, самої або в комбінації з одним або декількома додатковими агентами, які модулюють імунну систему ссавця, або з антизапальними агентами.
26. Спосіб лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантації, вовчака, мультисклерозу, ревматоїдного артриту, псоріазу, діабету типу І та ускладнень, пов'язаних з діабетом, раку, астми, атопічного дерматиту, аутоімунних тироїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань у ссавців, у тому числі людей, який полягає в уведенні згаданому ссавцю сполуки згідно з п. 1 або її фармацевтично прийнятної солі, самої або в комбінації з одним або декількома додатковими агентами, які модулюють імунну систему ссавця, або з антизапальними агентами, у кількості, ефективній для лікування такого стану.
Текст
Даний винахід стосується сполук піроло[2,3-d]піримідину, які є інгібіторами протеїнкіназ, таких як, фермент Janus кіназа 3 (далі по тексту згадується як JAK3), і таких, які є корисними як імуносупресивні агенти при трансплантації органів, ксенотрансплантації, вовчанці, множинному склерозі, ревматоїдному артриті, псоріазі, діабетах типу І та ускладненнях при діабеті, раку, астмі, атопічних дерматитах, аутоімунних тироїдних розладах, виразковому коліті, хворобі Крона, хворобі Альцгеймера, лейкемії та інших показаннях, при яких повинна проводитися імуносупресія. Даний винахід також стосується способу використання таких сполук в лікуванні вищевказаних захворювань у ссавців, особливо у людей, та фармацевтичних композицій, що використовуються для цього. JAK3 є членом Janus сімейства протеїнкіназ. Хоча інші члени цього сімейства експресуються по суті всіма тканинами, експресія JAK3 обмежується гемопоетичними клітинами. Це узгоджується з її суттєвою роллю в передачі сигналів через рецептори до IL-2, IL-4, IL-7, IL-9 та IL-15 шляхом нековалентного зв'язування JAK3 з гама-ланцюгом, спільним для цих багатоланцюгових рецепторів. Були ідентифіковані XSCIO групи пацієнтів із строго зниженим рівнем JAK3 протеїну або з генетичними дефектами до загального гама-ланцюга, підтверджуючи те, що імуносупресія повинна бути результатом блокування передачі сигналів через JAK3 шлях. Дослідження на тваринах дали змогу припустити, що JAK3 грає не тільки важливу роль в визріванні В та Τ лімфоцитів, але й те, що JAK3 є суттєво необхідним для підтримання функціонування Τ клітин. Модуляція імунної активності через цей новий механізм може довести її придатнисть в лікуванні розладів, пов'язаних з проліферацією Т-клітин, таких як відторгнення трансплантату або а утоімунні захворювання. Даний винахід стосується сполуки формули або її фармацевтично прийнятної солі, в якій R1 є групою формули де у дорівнює 0, 1 або 2; R4 вибраний з групи, яка включає водень, (С1-С6)алкіл, (С1-С6)алкілсульфоніл, (С2-С6)алкеніл, (С2С6)алкініл, де алкільна, алкенільна та алкінільна групи необов'язково заміщені дейтерієм, гідрокси, аміно, трифторметилом, (С1-С4)алкокси, (С1-С6)ацилокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, нітро, (С2С6)алкенілом, (С2-С6)алкінілом або (С1-С6)ациламіно; або R4 є (С3-С10)циклоалкілом, в якому циклоалкільна група є необов'язково заміщеною дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1С6)ациламіно, (С1-С6)алкіламіно, (С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R5 є (С2-С9)гетероциклоалкілом, в якому гетероциклоалкільні групи повинні бути заміщені від одного до п'яти замісниками, вибраними з карбокси, ціано, аміно, дейтерію, гідрокси, (С1-С6)алкілу, (С1-С6)алкокси, гало, (С1-С6)ацилу, (С1-С6)алкіламіно, аміно(С1-С6)алкілу, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2С6)алкенілу, (С2-С6)алкінілу, (С1-С6)алкіламіно, аміно(С1-С6)алкілу, гідрокси(С 1-С6)алкілу, (С1-С6)алкокси(С 1С6)алкілу, (С1-С6)ацилокси(С 1-С6)алкілу, нітро, ціано(С1-С6)алкілу, гало(С 1-С6)алкілу, нітро(С 1-С6)алкілу, трифторметилу, трифторметил(С1-С6)алкілу, (С1-С6)ациламіно, (С1-С6)ациламіно(С 1-С6)алкілу, (С1С6)алкокси(С 1-С6)ациламіно, аміно(С1-С6)ацилу, аміно(С 1-С6)ацил(С1-С6)алкілу, (С1-С6)алкіламіно(С 1С6)ацилу, ((С1-С6)алкіл)2аміно(С1-С6)бацилу, R15R16N-CO-O-, R 1sR16N-CO-(С1-С6)алкілу, (С1-С6)алкіл-S-(О)m, R15R16NS(O) m, R15R16NS(O) m(С1-С6)алкілу, R15S(O) mR16N, R15S(О) mR16N(С1-С6)алкілу, де m дорівнює 0, 1 або 2, і R15 та R16 кожний незалежно вибраний з водню або (С1-С6)алкілу; або групою формули в якій а є 0, 1, 2, 3 або 4; b, с, e, f та g кожний незалежно є 0 або 1; d є 0, 1,2 або 3; X являє собою S(O) n, де n є 0, 1 або 2; кисень, карбоніл або -С(=N-ціано)-; Υ являє собою S(O) n, де N є 0, 1 або 2; або карбоніл; і Ζ являє собою карбоніл, С(О)О-, C(O)NR- або S(O)n, де N є 0, 1 або 2; R6, R7, R8, R9, R10 та R 11 кожний незалежно вибраний з групи, яка складається з водню або (С1С6)алкілу, необов'язково заміщеного дейтерієм, гідрокси, аміно, трифторметилом, (С1-С6)ацилокси, (С1С6)ациламіно, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, ціано, ціано(С1-С6)алкілом, трифторметил(С1С6)алкілом, нітро, нітро(С1-С6)алкілом або (С1-С6)ациламіно; R12 являє собою карбокси. ціано, аміно, оксо, дейтерій, гідрокси, трифторметил, (С1-С6)алкіл, трифторметил(С1-С6)алкіл, (С1-С6)алкокси, гало, (С1-С6)ацил, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, аміно(С1-С6)алкіл, (С1-С6)алкокси-СО-NН, (С1-С6)алкіламіно-СО-, (С2-С6)алкеніл, (С2-С6)алкініл, (С1С6)алкіламіно, гідрокси(С 1-С6)алкіл, (С1-С6)алкокси(С 1-С6)алкіл, (С1-С6)ацилокси(С 1-С6)алкіл, нітро, ціано(С1С6)алкіл, гало(С1-С6)алкіл, нітро(С 1-С6)алкіл, трифторметил, трифторметил(С1-С6)алкіл, (С1-С6)ациламіно, (С1-С6)ациламіно(С 1-С6)алкіл, (С1-С6)алкокси(С 1-С6)ациламіно, аміно(С 1-С6)ацил, аміно(С1-С6)ацил(С1С6)алкіл, (С1-С6)алкіламіно(С 1-С6)ацил, ((С1-С6)алкіл)2аміно(С 1-С6)бацил, R15R16N-CO-O-, R 15R16N-CO-(С1С6)алкіл, R15C(O)NH, R15OC(O)NH, R 15NHC(O)NH, (С1-С6)алкіл-S(О)m, (С1-С6)алкіл-S(О)m-(С1-С6)алкіл, R15R16NS(O) m, R15R16NS(O) m(С1-С6)алкіл, R15S(O)mR16N, R15S(O)mR16N(С1-С6)алкіл, де m є 0, 1 або 2, і R15 та R16 кожний незалежно вибраний з водню або (С1-С6)алкілу; R2 та R3 кожний незалежно вибраний з групи, яка включає водень, дейтерій, аміно, гало, гідрокси, нітро, карбокси, (С2-С6)алкеніл, (С2-С6)алкініл, трифторметил, трифторметокси, (С1-С6)алкіл, (С1-С6)алкокси, (С3С10)циклоалкіл, де алкільні, алкоксильні або циклоалкільні групи необов'язково заміщені від однієї до трьох групами, вибраними з гало, гідрокси, карбокси, аміно(С1-С6)алкілтіо, (С1-С6)алкіламіно, ((С1-С6)алкіл)kаміно, (С5-С9)гетероарилу, (С2-С9)гетероциклоалкілу, (С3-С9)циклоалкілу або (С6-С10)арилу; або R2 та R 3 кожний незалежно є (С3-С10)циклоалкілом, (С3-С10)циклоалкокси, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С6С10)ариламіно, (С1-С6)алкілтіо, (С6-С10)арилтіо, (С1-С6)алкілсульфінілом, (С6-С10)арилсульфінілом, (С1С6)алкілсульфонілом, (С6-С10)арилсульфонілом, (С1-С6)ацилом, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіламіноСО-, (C5-С9)гетероарилом, (С2-С9)гетероциклоалкілом або (С6-С10)арилом, в яких гетероарильні, гетероциклоалкільні та арильні групи необов'язково заміщені від однієї до трьох груп, вибраних з гало, (С1С6)алкілу, (С1-С6)алкіл-СО-NН-, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-(С1-С6)алкілу, (С1-С6)алкоксиСО-NН-(С1-С6)алкілу, (С1-С6)алкокси-СО-NН-(С1-С6)алкокси, карбокси, карбокси(С 1-С6)алкілу, карбокси(С 1С6)алкокси, бензилоксикарбоніл(С 1-С6)алкокси, (С1-С6)алкоксикарбоніл(С 1-С6)алкокси, (С6-С10)арилу, аміно, аміно(С1-С6)алкілу, (С1-С6)алкоксикарбоніламіно, (С6-С10)арил(С 1-С6)алкоксикарбоніламіно, (С1С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С1-С6)алкіламіно(С 1-С6)алкілу, ((С1-С6)алкіл)2аміно(С1-С6)алкілу, гідрокси, (С1-С6)алкокси, карбокси, карбокси(С1-С6)алкілу, (С1-С6)алкоксикарбонілу, (С1С6)алкоксикарбоніл(С 1-С6)алкілу, (С1-С6)алкокси-СО-NН-, (С1-С6)алкіл-СО-NН-, ціано, (С3С9)гетероциклоалкілу, аміно-CO-NH-, (С1-С6)алкіламіно-СО-NН-, ((С1-С6)алкіл)2аміно-СО-NН-, (С6С10)ариламіно-СО-NН-, (С5-С9)гетероариламіно-СО-МН-, (С1-С6)алкіламіно-СО-NН-(С1-С6)алкілу, ((С1С6)алкіл)2аміно-СО-NН-(С1-С6)алкілу, (С5-С10)ариламіно-СО-NН-(С1-С6)алкілу, (С5-С9)гетероариламіноСОNН-(С1-С6)алкілу, (С1-С6)алкілсульфонілу, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1С6)алкілу, (С6-С10)арилсульфонілу, (С6-С 10)арилсульфоніламіно, (С6-С1)арилсульфоніламіно(С 1-С6)алкілу, (С1-С6)алкілсульфоніламіно, (С1-С6)алкілсульфоніламіно(С 1-С6)алкілу, (C5-С9)гетероарилу або (С2С9)гетероциклоалкілу. Даний винахід також стосується фармацевтично прийнятних кислотно-адитивних солей сполуки формули І. Кислотами, які використовують для одержання фармацевтично прийнятних кислотно-адитивних солей вищезгаданих сполук даного винаходу, є такі, які утворюють нетоксичні кислотно-адитивні солі, тобто, солі, які містять фармакологічно прийнятні аніони, такі як, гідрохлорид, гідробромід, гідройодид, нітрат, сульфат, бісуль фат, фосфат, кислий фосфат, ацетат, лактат, цитрат, кислий цитрат, тартрат, бітартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, етансульфонат, бензолсульфонат, п-толуолсульфонат та памоат [тобто, 1,1'-метилен-бiс-(2-гідрокси-3-нафтоатні)]солі. Винахід також стосується основно-адитивних солей формули І. Хімічні основи, що можуть бути використані як реагенти для одержання фармацевтично прийнятних основно-адитивних солей цих сполук формули І, що є основними за природою, є такі, які утворюють нетоксичні основні солі з такими сполуками. Такі нетоксичні основні солі включають, але не обмежуються такими, що походять від таких фармакологічно прийнятних катіонів, як катіони лужних металів (наприклад, калію або натрію) та катіони лужноземельних металів (наприклад, кальцію та магнію), амонію або водорозчинних солей приєднання амінів, таких як, N-метилглюкамін (меглюмін), та нижчі алканоламонієві та інші основні солі фармацевтично прийнятних органічних амінів. Термін "алкіл", в даному контексті, якщо не вказано інакше, включає насичені моновалентні вуглеводневі радикали, що мають лінійні або розгалужені фрагменти або їх комбінацію. Термін "алкокси", в даному контексті включає О-алкільні групи, в яких "алкіл" є таким, як визначено вище. Термін "гало", в даному контексті, якщо не вказано інакше, включає фторо, хлоро, бромо або йодо. Сполуки даного винаходу можуть містити подвійні зв'язки. Коли такі зв'язки присутні, сполуки винаходу існують в цис- та тран-конфігураціях або у вигляді їх сумішей. Якщо не вказано інакше, алкільні та алкенільні групи, що згадуються тут, також як алкільні залишки інших гр уп, що згадуються тут, (наприклад, алкокси), можуть бути лінійними або розгалуженими і можуть бути також циклічними (наприклад, циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил) або лінійними, або розгалуженими і містити циклічні залишки. Якщо не вказано інакше, галоген включає фтор, хлор, бром та йод. (С2-С9)Гетероциклоалкіл у даному контексті стосуєтьсся піролідинілу, тетрагідрофуранілу, дигідрофуранілу, терагідропіранілу, піранілу, тіопіранілу, азиридинілу, оксираніл, метилендіоксилу, хроменілу, ізоксазолідинілу, 1,3-оксазолідин-3-ілу, ізотіазолідинілу, 1,3-тіазолідин-3-ілу, 1,2-піразолідин-2ілу, 1,3-піразолідин-1-ілу, піперидинілу, тіоморфолінілу, 1,2-тетрагідротіазин-2-ілу, 1,3-тетрагідротіазин-3ілу, тетрагідротіадіазинілу, морфолінілу, 1,2-тетрагідродіазин-2-ілу, 1,3-тетрагідродіазин-1-ілу, тетрагідроазепинілу, піперазинілу, хроманілу і т.ін. Фа хівцю в даній галузі буде зрозумілим, що зв'язок згаданих (С2-С9)гетероциклоалкільних кілець відбувається через вуглець або sp3 гібридизований гетероатом азоту. (С2-С9)Гетероарил у даному контексті стосуєтьсся фурилу, тієнілу, тіазолілу, піразолілу, ізотіазолілу, оксазолілу, ізоксазолілу, піролілу, тіазолілу, тетразолілу, імідазолілу, 1,3,5-оксадіазолілу, 1,2,4оксадіазолілу, 1,2,3-оксадіазолілу, 1,3,5-тіадіазолілу, 1,2,3-тіадіазолілу, 1,2,4-тіадіазолілу, піридилу, піримідилу, піразинілу, піридазинілу, 1,2,4-триазинілу, 1,2,3-триазинілу, 1,3,5-триазинілу, піразоло[3,4b]піридинілу, хінолінілу, птеридинілу, пуринілу, 6,7-дигідро-5Н-[1]піриндинілу, бензо[b]тіофенілу, 5,6,7,8тетрагідро-хінолін-3-ілу, бензоксазолілу, бензотіазолілу, бензізотіазолілу, бензізоксазолілу, бензімідазолілу, тіанафтенілу, ізотіанафтенілу, бензофуранілу, ізобензофуранілу, ізоіндолілу, індолілу, індолізинілу, індазолілу, ізохінолінілу, хінолінілу, фталазинілу, хіноксалінілу, хіназолінілу, бензоксазинілу; і т.ін. Фахівцю в даній галузі буде зрозумілим, що зв'язок згаданих (С2-С9)гетероциклоалкільних кілець відбувається через вуглець або sp3 гібридизований гетероатом азоту. (С6-С10)Арил у даному контексті стосується фенілу або нафтилу. Сполуки формули (І) можуть бути уведені у фармацевтично прийнятній формі або окремо, або у комбінації з одним або декількома додатковими агентами, що модулюють імунну систему ссавця, або з антизапальними агентами. Такі агенти включають, але не обмежуються ними, циклоспорин А (наприклад, сандімун (SandimmuneÒ) або неорал (NeoralÒ), рапаміцин, FK-506 (такролімус), лефлуномід, деоксиспергуалін, мікофенолат (наприклад, целсепт (CellceptÒ)), азатіоприн (наприклад, імуран (ImuranÒ)), даклізумаб (наприклад, зенапакс (ZenapaxÒ)), ОКТЗ (наприклад ортоклон (OrthocloneÒ)), АтГам, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам та антизапальні стероїди (наприклад, преднізолон або дексаметазон). Ці агенти можуть бути уведені як частина однієї або різних дозованих форм, однаковими або різними шляхами уведення і за однаковими або різними графіками уведення згідно зі стандартною фармацевтичною практикою. Сполуки даного винаходу включають всі конформаційні ізомери (наприклад, цис- та транс- ізомери). Сполуки даного винаходу мають асиметричні центри і, таким чином, існуюють в різних енантіомерних та діастереомерних формах. Даний винахід стосується використання усіх оптичних ізомерів та стереоізомерів сполук даного винаходу, їх сумішей та всіх фармацевтичних композицій та способів лікування, які можуть використовува ти або включати їх. У цьому відношенні винахід охоплює як Е, так Ζ конфігурації. Сполуки формули І можуть також існувати як таутомери. Даний винахід стосується використання усіх таких таутомерів та їх сумішей. Даний винахід також охоплює фармацевтичні композиції, які містять проліки сполук формули І. Даний винахід також стосується способів лікування або попередження розладів, які можуть лікуватися або попереджуватися шляхом інгібування протеїнкіназ, таких як фермент Janus кіназа 3, які полягають в уведенні проліків сполук формули І. Сполуки формули І, що мають вільні аміно, амідо, гідрокси або карбоксильні групи, можуть бути перетворені в проліки. Проліки включають сполуки, в яких амінокислотний залишок або поліпептидний ланцюг з двох або декількох (наприклад, двох, трьох або чотирьох) амінокислотних залишків, які ковалентно зв'язані, через пептид приєднується до вільних аміно, гідроксильних або карбоксильних груп сполук формули І. Амінокислотні залишки включають 20 амінокислот, що зустрічаються в природі, і які зазвичай позначаються трьома літерними символами, а також включають 4-гідроксипролін, гідроксилізин, демозин, ізодемозин, 3-метилгістидин, норвлін, бета-аланін, гамаамінобутиратна кислота, цитрулін, гомоцистеїн, гомосерин, орнітин та метіонинсульфон. Проліки також включають сполуки, в яких карбонати, карбамати, аміди та алкілові естери which are covalently bonded to the above substituents формули I through the карбоніл carbon prodrug sidechain. Переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; с є 0; d є 0; е є 0; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; с є 0; d є 1; е є 0; f є 0, і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; с є 1; d є 0; е є 0; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою -С(=N=ціано)-; с є 1; d є 0; e є 0; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 0; с є 0; d є 0; e є 0; f є 0; g є 1; і Ζ являє собою -С(О)-О-. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O)n; n 2; с 0; d 0; e 0; f 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O) n; n є 2; c є O; d є 2; e є 0; f є 1; g e 1; i Z являє собою карбоніл. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O) n; n є 2; с є 0; d є 2; e є 0; f є 1; g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; c є 1; d є 0; e є 1;Y являє собою S(O)n; n є 2; f є 0 ; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O) n; n є 2; с є 1; d є 0; e є 0; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 1; b is 1; X являє собою карбоніл; с 1; d 0; e 0; f 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O) n; c є 0; d є 1; e є 1;Y являє собою S(O)n ; n є 2; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою S(O) n; c є 0; d є 1; e є 1;Y являє собою S(O)n ; n є 2; f є 1; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою кисень; c є 0; d є 1; e є 1;Y являє собою S(O)n; n є 2; f є 1; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою кисень; c є 0; d є 1; e є 1;Y являє собою S(O)n; n є 2; f є 0; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; c є 1; d є 1; e є 1;Y являє собою S(O)n; f є 0; і g є 0 . Інші переважні сполуки формули І включають сполуки, в яких а є 0; b є 1; X являє собою карбоніл; c є 1; d є 1; e є 1;Y являє собою S(O)n; n є 2; f є 1 ; і g є 0. Інші переважні сполуки формули І включають сполуки, в яких R12 являє собою ціано, трифторметил, (С1-С6)алкіл, трифторметил(С 1-С6)алкіл, (С1-С6)алкіламіно, ((С1-С6)алкіл)2аміно, (С2-С6)алкініл, ціано(С 1С6)алкіл, (С1-С6)алкіл-S(О)m, де m є 0, 1 або 2. Особливо переважні сполуки формули І включають такі, в яких згадана сполука вибрана з групи, яка включає: Метил-[4-метил-1-(пропан-1-сульфоніл)-піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін; Метиловий естер 4-метил-3-[метил-(7Н-піроло(2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти; 3,3,3-Трифтор-1-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-пропан-1-он; Диметиламід 4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти; Етиловий естер ({4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1карбоніл}аміно)оцтової кислоти; 3-{4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил; 3,3,3-Трифтор-1-{4-метил-3-[метил-(5-метил-7Н-піроло[2,3-d]римідин-4-іл)-аміно]-піперидин-1-іл}пропан1-он; 1-{4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-бутин-3-ин-1-он; 1-{3-[(5-Хлор-7Н-піроло[2,3-d]піримідин-4-іл)метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он; 1-{3-[(5-Фтор-7Н-піроло[2,3-d]піримідин-4-іл)метиламіно]-4-метилпіперидин-1-іл}-пропан-1-он; N-ціано-4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]-N’-пропіл-піперидин-1-карбоксамідин; та N-Ціано-4,N',N'-триметил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)-аміно]-піперидин-1-карбоксамідин. Даний винахід також стосується фармацевтичної композиції для (а) для лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантации, вовчанки, мультисклерозу, ревматоїдного артриту, псоріазу, діабету типу І та ускладнень, пов'язаних з діабетом, раку, астми, атопічного дерматиту, аутоімунних тіроїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань або (b) інгібування протеїнкінази або Janus кіназа 3 (JAK3) у ссавців, у тому числі людей, яка містить сполуку формули І або її фармацевтично прийнятну сіль у кількості, ефективній для лікуваннятаких розладів або станів, та фармацевтично прийнятний носій. Даний винахід також стосується способу інгібування протеїн тирозин кіназ або Janus кіназа 3 (JAK3) у ссавців, у тому числі людей, який полягає в уведенні згаданому ссавцю ефективної кількості сполуки формули І або її фармацевтично прийнятної солі. Даний винахід також стосується способу лікування або попередження розладу або стану, вибраного з відторгнення трансплантованого органу, ксенотрансплантации, вовчанки, мультисклерозу, ревматоїдного артриту, псоріазу, діабету тип у І та ускладнень, пов'язаних з діабетом, раку, астми, атопічного дерматиту, аутоімунних тіроїдних розладів, виразкового коліту, хвороби Крона, хвороби Альцгеймера, лейкемії та інших аутоімунних захворювань у ссавців, у тому числі людей, який полягає в уведенні згаданому ссавцю сполуки формули І або її фармацевтично прийнятної солі ефективній для лікування таких станів. Наступні схеми реакцій ілюструють одержання сполук даного винаходу. Якщо не вказано інакше, R2, R3, A R та R5 в схемах реакцій та обговоренні, що йде нижче, є такими, як визначено вище. В реакції 1 Препаративного прикладу А 4-хлорпіроло[2,3-d]піримідинову сполуку формули XXI, в якій R є воднем або захисною групою, такою як бензолсульфоніл або бензил, перетворюють в 4-хлор-5галопіроло[2,3-d]піримідинову сполуку формули XX, в якій Υ є хлор, бром або йод, шляхом взаємодії XXI з N-хлоросукцинімідом, Ν-бромосукцинімідом або N-йодосукцинімідом. Реакційну суміш нагрівають до кипіння в хлороформі протягом часу від 1 години до приблизно 3 годин, переважно, близько 1 години. Альтернативно, в реакції 1 Препаративного прикладу А 4-хлорпіроло[2,3-d]піримідин формули XXI, в якій R є воднем, перетворюють у відповідний 4-хлор-5-нітропіроло[2,3-d]піримідин формули XX, в якій Υ є нітро, шляхом взаємодії XXI з азотною кислотою в сірчаній кислоти при температурі від приблизно -10°С до приблизно 10°С, переважно, близько 0°С, протягом часу від приблизно 5 хвилин до приблизно 15 хвилин, переважно, близько 10 хвилин. Сполуку формули XXI, в якій Υ нітро, перетворюють у відповідний 4-хлор-5амінопіроло[2,3-d]піримідин формули XX, в якій Υ є аміно, шляхом взаємодії XXI при різних умовах, відомих фа хівцю, таких як гідрування з використанням паладію або хлориду олова (IV) та хлороводневої кислоти. В реакції 2 Препаративного приклада А 4-хлоро-5-галопіроло[2,3-d]піримідинову сполуку формули XX, в якій R2 є воднем, перетворюють у відповідну сполуку формули XIX, в якій R2 є (С1-С6)алкілом або бензилом, шляхом обробки XX N-бутиллітієм при температурі близько -78°С та взаємодії діаніонової проміжної сполуки, утвореної таким чином, з алкілгалідом або бензилгалідом при температурі між приблизно -78°С та кімнатною температурою, переважно, при кімнатній температурі. Альтернативно, утворений таким чином діаніон піддають взаємодії з молекулярним киснем для утворення відповідної 4-хлоро-5-гідроксипіроло[2,3d]піримідинової сполуки формули XIX, в якій R2 являє собою гідрокси. Сполуку формули XX, в якій Υ є бромом або йодом, і R є бензолсульфонатом, перетворюють у сполуку формули XIX, в якій R2 є (С6С12)арилом або вінілом, шляхом обробки XX N-бутиллітієм при температурі близько -78°С, з наступним додаванням хлориду цинку при температурі близько -78°С. Утворену таким чином відповідну цинк органічну проміжну сполуку потім піддають взаємодії з арилйодидом або вінілйодидом в присутності каталітичної кількості паладію. Реакційну суміш перемішують при температурі в інтервалі від приблизно 50°С до приблизно 80°С, переважно, близько 70°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно, близько 1 години. В реакції 3 Препаративного приклада А сполуку формули XIX перетворюють у відповідну сполуку формули XVI шля хом взаємодії XIX з N-бутиллітієм, літій-діізопропіламіном або гідридом натрію при температурі близько -78°С в присутності полярного апротонного розчинника, такого як, тетрагідрофуран. Утворену таким чином аніонну проміжну сполуку в подальшому піддають взаємодії з (а) алкілгалідом або бензилгалідом при температурі від приблизно -78°С до кімнатної температури, переважно при -78 °С, коли R3 є алкілом або бензилом; (b) альдегідом або кетоном при температурі від приблизно -78°С до кімнатної температури, переважно при -78°С, коли R3 є алкокси; та (с) хлоридом цинку при температурі від приблизно -78°С до кімнатної температури, переважно при -78°С, і відповідну цинкорганічну проміжну сполуку, утворену таким чином, потім уводять в реакцію з арилйодидом або вінілйодидом в присутності каталітичної кількості паладію. Одержану реакційну суміш перемішують при температурі між приблизно 50°С та приблизно 80°С, переважно при 70°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно протягом 1 години. Альтернативно, утворений таким чином аніон піддають взаємодії з молекулярним киснем для утворення відповідної 4-хлор-6-гідроксипіроло[2,3-d]піримідинової сполуки формули XVI, в якій R3 є гідрокси. В реакції 1 Препаративного приклада В 4-хлоропіроло[2,3-d]піримідинову сполуку формули XXI перетворюють у відповідну сполуку формули XXII, згідно з процедурою, описаною вище в реакції 3 Препаративного приклада А. В реакції 2 Препаративного приклада В сполуку формули XXII перетворюють у відповідну сполуку формули XVI, згідно з процедурою, описаною вище в реакції 1 та 2 Препаративного приклада А. В реакції 1 Схеми 1, 4-хлоропіроло[2,3-d]піримідинову сполуку формули XVII перетворюють у відповідну сполуку формули XVI, в якій R є бензолсульфонілом або бензилом, шляхом обробки XVII бензолсульфонілхлоридом, бензилхлоридом або бензилбромідом в присутності основи, такої як гідрид натрію або карбонат калію, та полярного апротонного розчинника, такого як, диметилформамід або тетрагідрофуран. Реакційну суміш перемішують при температурі від приблизно 0°С до приблизно 70°С, переважно близько 30°С, протягом часу від приблизно 1 години до приблизно 3 годин, переважно близько 2 годин. В реакції 2 Схеми 1 4-хлоропіроло[2,3- d]піримідинову сполуку формули XVI перетворюють у відповідну 4-амінопіроло[2,3-d]піримідинову сполуку формули XV сполученням XVI з аміном формули HNR4RS. Реакцію проводять в спиртовому розчиннику, такому як, трет-бутанол, метанол або етанол, або в іншому висококиплячому розчиннику, такому як, диметилформамід, триетиламін, 1,4-діоксан або 1,2-дихлоретан, при температурі від приблизно 60°С до приблизно 120°С, переважно близько 80°С. Звичайний час реакції складає від приблизно 2 годин до приблизно 48 годин, переважно близько 16 годин. Коли R5 є гетероциклоалкільною групою, яка містить азот, кожний атом азоту повинен бути захищеним захисною групою, такою як бензил. Видалення R5 захисної групи проводять в умовах, придатних для того, щоб конкретна використовувана захисна група не впливала на захисну групу R на піроло[2,3-d]піримідиновому кільці. Видалення R5 захисної групи у випадку бензилу проводять у спиртовому розчиннику, такому як етанол, в присутності водню та каталізатору, такого як, гідроксид паладію на вугіллі. R5 Азотмістка гетероциклоалкільна група, утворена таким чином, може в подальшому піддаватися взаємодії з великою кількістю різних електрофільних сполук формули II. Для утворення сечовини електрофіли формули II, такі як ізоціанати, карбамати та карбамоїлхлориди піддають взаємодії з азотом R5 гетероалкільної групи в розчиннику, такому як, ацетонітрил або диметилформамід, в присутності основи, такої як, карбонат натрію або калію, при температурі від приблизно 20°С до приблизно 100°С протягом часу від приблизно 24 годин до приблизно 72 годин. Для утворення аміду та сульфонаміду електрофіли формули II, такі як, ацилхлориди та сульфонілхлориди піддають взаємодії з азотом R 5 гетероалкільної групи в розчиннику, такому як, метиленхлорид в присутності основи, такої як, піридин, при температурі оточуючого середовища протягом часу від приблизно 12 годин до приблизно 24 годин. Утворення аміду може бути проведено шляхом взаємодії карбонової кислоти з гетероалкільною групою в присутності карбодііміду, такого як, 1-(3диметиламінопропіл)-3-етилкарбодіімід, в розчиннику, такому як метиленхлорид при температурі оточуючого середовища протягом 12-24 годин. Для утворення алкілу електрофіли формули II, такі як a,bненасичені аміди, кислоти, нітрили, естери та a-галоаміди, піддають взаємодії з азотом R5 гетероалкільної групи в розчиннику, такому як метанол, при температурі оточуючого середовища протягом часу від приблизно 12 годин до приблизно 18 годин. Утворення алкілу може бути також проведене шляхом взаємодії альдегідів з гетероалкільною групою в присутності відновного агента, такого як ціаноборогідрид натрію, в розчиннику, такому як метанол, при температурі оточуючого середовища протягом часу від приблизно 12 годин до приблизно 18 годин. В реакції 3 Схеми 1 видалення захисної групи зі сполуки формули XV, в якій R є бензолсульфонілом, з одержанням відповідної сполуки формули І, проводять шляхом обробки XV лужною основою, такою як гідроксил натрію або гідроксид калію, в спиртовому розчиннику, такому як метанол або етанол, або змішаних розчинниках, таких як спирт/тетрагідрофуран або спирт/вода. Реакцію проводять при кімнатній температурі протягом часу від приблизно 15 хвилин до приблизно 1 години, переважно, 30 хвилин. Видалення захисної групи зі сполуки формули XV, в якій R є бензилом, проводять шляхом обробки XV натрієм в аміаку при температурі близько -78°С протягом часу від приблизно 15 хвилин до приблизно 1 години. В реакції 1 Схеми 2 4-хлоропіроло[2,3-d]піримідинову сполуку формули XX перетворюють у відповідну 4-амінопіроло[2,3-d]піримідинову сполуку формули XXIV, згідно з процедурою, описаною вище в реакції 2 Схеми 1. В реакції 2 Схеми 2 4-аміно-5-галопіроло[2,3-d]піримідинову сполуку формули XXIV, в якій R є бензолсульфонатом і Ζ є бромом або йодом, перетворюють у відповідну сполуку формули XXIII шляхом взаємодії XXIV з (а) арилборною кислотою, коли R2 є арилом, в апротонному розчиннику, такому як тетрагідрофуран або діоксан, в присутності каталітичної кількості паладію (0) при температурі від приблизно 50°С до приблизно 100°С, переважно близько 70°С, протягом часу від приблизно 2 годин до приблизно 48 годин, переважно близько 12 годин; (b) алкінами, коли R 2 є алкінілом, в присутності каталітичної кількості йодиду міді (І) або паладію (0), в полярному розчиннику, такому як диметилформамід, при кімнатній температурі протягом часу від приблизно 1 години до приблизно 5 годин, переважно близько 3 годин; і (с) алкенами або стиролами, коли R2 є вініл або стирил, в присутності каталітичної кількості паладію в диметилформаміді, діоксані або тетрагідрофурані, при температурі від приблизно 80°С до приблизно 100°С, переважно близько 100°С, протягом часу від приблизно 2 годин до приблизно 48 годин, переважно близько 48 годин. В реакції 3 Схеми 2 сполуку формули ХХНІ перетворюють у відповідну сполуку формули XV, згідно з процедурою, описаною вище в реакції 3 Препаративного приклада А. В реакції 1 Схеми 3 сполуку формули XVII перетворюють у відповідну сполуку формули І, згідно з процедурою, описаною вище в реакції 2 Схеми 1. Сполуки даного винаходу, що є основними за природою здатні до утворення численної кількості різних солей з різними неорганічними та органічними кислотами. Хоча такі солі повинні бути фармацевтично прийнятними для уведення тваринам, на практиці часто є необхідним спочатку виділити сполуку даного винаходу з реакційної суміші у вигляді фармацевтично неприйнятної солі, а потім просто перетворити останню назад у сполуку у вигляді вільної основи шляхом обробки лужним реагентом з наступним перетворенням цієї вільної основи у фармацевтично прийнятну кислотно-адитивну сіль. Кислотно-адитивні солі основних сполук даного винаходу легко одержують шляхом обробки основної сполуки по суті еквівалентною кількістю вибраної мінеральної або органічної кислоти у водному середовищі або в придатному органічному розчиннику, такому як, метанол або етанол. При обережному випарюванні розчинника легко одержують необхідні тверді солі. Необхідні кислі солі також можуть бути осаджені з розчину вільної основи в органічному розчиннику шляхом додавання до розчину відповідної мінеральної або органічної кислоти. Ті сполуки даного винаходу, що є кислими за природою, здатні утворювати основні солі з різними фармакологічно прийнятними катіонами. Приклади таких солей включають солі лужних металів або лужноземельних металів і, особливо, натрієві та калієві солі. Всі ці солі отримують за стандартними методиками. Хімічними основами, що використовують як реагенти для одержання фармацевтично прийнятних основних солей даного винаходу, є такі основи, які утворюють нетоксичні основні солі з кислотними сполуками даного винаходу. Такі нетоксичні основні солі включають солі, що походять від таких фармакологічно прийнятних катіонів, як натрій, калій, кальцій та магній, та ін. Такі солі легко можуть бути отримані шляхом обробки відповідних кислотних сполук водними розчинами, що містять необхідні фармакологічно прийнятні катіони, з наступним випарюванням одержаного розчину до сухого залишку, переважно при зниженому тиску. Альтернативно, вони можуть також бути одержані змішуванням нижчих алканольних розчинів кислотних сполук та необхідного алкоксиду лужного металу з наступним випарюванням одержаного розчину до сухого залишку таким самим чином, як описано раніше. В обох випадках застосовують переважно застосовують стехіометричні кількості реагентів для того, щоб забезпечити повноту протікання реакції та максимальні виходи необхідного кінцевого продукту. Композиції даного винаходу можуть бути одержані загальноприйнятими способами, використовуючи один або декілька фармацевтично прийнятних носіїв. Таким чином, активні сполуки винаходу можуть бути уведені в рецептури для перорального, буккального, інтраназального, парентерального (наприклад, внутрішньовенного, внутрішньом'язового або підшкірного) або ректального уведення або у формі, придатній для уведення шляхом інгаляції або інсуфляції. Активні сполуки винаходу можуть також бути уведені в рецептури пролонгованої дії. Для перорального уведення фармацевтичні композиції можуть приймати форму, наприклад, таблеток або капсул, одержаних стандартними засобами з фармацевтично прийнятними екcціпієнтами, такими як, в'яжучі агенти (наприклад, прежелатинований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або фосфат кальцію); змащувальні речовини (наприклад, стеарат магнію, тальк або кремнезем); дезінтегранти (наприклад, картопляний крохмаль або натрієва сіль крохмаль-гліколяту); або зволожувальні агенти (наприклад, лаурилсульфат натрію). На таблетки може бути нанесене покриття методами, добре відомими в цій галузі. Рідкі рецептури для перорального уведення можуть приймати форму, наприклад, розчинів, сиропів або суспензій, або вони можуть бути представлені у вигляді сухого продукту для змішування з водою або іншими придатними носіями перед використанням. Такі рідкі рецептури можуть бути приготовлені загальноприйнятими засобами з фармацевтично прийнятними добавками, такими як, суспендувальні агенти (наприклад, сироп сорбітолу, метилцелюлоза або гідрогеновані їстівні рослинні олії), емульсифікатори (наприклад, лецетин або гуміарабік); неводні носії (наприклад, мигдальна олія, естери олій або етиловий спирт); та консерванти (наприклад, метил- або пропіл-п-гідроксибензоати або сорбінова кислота). Для буккалького уведення композиція може бути у формі таблеток або лозенге, сформульованих загальноприйнятим способом. Активні сполуки винаходу можуть бути сформульовані в рецептури для парентерального уведення шляхом ін'єкцій, у тому числі використовуючи стандартні методики катетеризації або інфузії. Композиції для ін'єкцій можуть бути представлені у вигляді одиничної дозованої форми, наприклад, в ампулах або в багатодозових контейнерах з додатком консервантів. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії в масляних або водних носіях, і можуть містити допоміжні агенти, такі як суспендувальні агенти, стабілізатори і/або диспергатори. Альтернативно активний інгредієнт може бути у формі порошку для створення композиції з придатним носієм, наприклад, стерильною апірогенною водою, перед використанням. Актині сполуки винаходу можуть бути також сформульовані в ректальні композиції, такі як супозиторії або затримувальні клізми, наприклад, які містять стандартні основи для супозиторіїв, такі як масло какао або інші гліцериди. Для інтраназального уведення або уведення шляхом інгаляцій активні сполуки винаходу зр учним чином доставляються у формі розчину або суспензії з контейнера з помпою, що містить спрей, які видавлюються або накачуються пацієнтом, або у вигляді аерозольного спрею, який подається з контейнеру під тиском або за допомогою розпилювача, з використанням придатного пропеленту, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, діоксиду вуглецю або іншого придатного газу. У випадку аерозолю під тиском одинична доза може бути встановлена шляхом забезпечення контейнера клапаном, що нагнітає відміряну кількість. Контейнер під тиском або розпилювач можуть містити розчин або суспензію активної сполуки. Капсули та картріджі (зроблені, наприклад, з желатину) для використання в інгаляторі або інсуфляторі можуть мати таку рецептуру, до складу якої входить порошкова суміш сполуки винаходу та придатна порошкова основа, така як лактоза або крохмаль. Запропонована доза активних сполук винаходу для перорального, парентерального або буккального уведення середньостатистичній дорослій людині для лікування станів, згаданих вище (наприклад, ревматоїдного артриту), складає від 0,1 до 1000мг активного інгредієнту на одиничну дозу, яка може уводитися, наприклад, від 1 до 4 разів на день. Аерозольні композиції для лікування станів, згаданих вище (наприклад, астми), у середньостатистичної дорослої людини готуються переважно таким чином, що кожна відміряна доза або "пуф" аерозолю містять від 20мкг до 1000мкг сполуки винаходу. Загальна денна доза з аерозолю повинна бути в межах інтервалу від 0,1мг до 1000мг. Уведення може проводитися декілька разів на день, наприклад, 2, 3, 4 або 8 разів, даючи, наприклад, 1, 2 або 3 дози кожного разу. Сполука формули (І) уводиться в фармацевтично прийнятній формі або одна, або в комбінації з одним або декількома додатковими агентами, які модулюють імунну систему ссавця, або з антизапальними агентами, агентами, які включають, але не обмежуються ними: циклоспорин А (наприклад, сандімун (SandimmuneÒ) або неорал (NeoralÒ), рапаміцин, FK-506 (такролімус), лефлуномід, деоксиспергуалін, мікофенолат (наприклад, целсепт (CellceptÒ)), азатіоприн (наприклад, імуран (ImuranÒ)), даклізумаб (наприклад, зенапакс (ZenapaxÒ)), ОКТЗ (наприклад ортоклон (OrthocloneÒ)), АтГам, аспірин, ацетамінофен, ібупрофен, напроксен, піроксикам та антизапальні стероїди (наприклад, преднізолон або дексаметазон); і такі агенти можуть бути уведені як частина однієї й тієї ж або окремих дозованих форм, однаковими або різними шляхами уведення, одними й тим же або різними способами уведення згідно зі стандартною фармацевтичною практикою. FK506 (Такролімус) уводять перорально у дозі 0,10-0,15мг/кг ваги тіла кожні 12 годин на протязі перших 48 годин після оперативного втручання. Дозу контролюють за рівнем Такролімусу в сироватці. Циклоспорин А (сандімун перорального або внутрішньовенного призначення, або NeoralÒ, розчин для перорального уведення або капсули) дають перорального у дозі 5мг/кг ваги тіла, кожні 12 годин на протязі 48 годин після операції. Дозу контролюють за рівнем Циклоспорину А в крові. Активні агенти можуть бути сформульовані в рецептури пролонгованої дії згідно з методами, добре відомими фахівцю. Приклади таких рецептур можна відшукати в патентах US 3,538,214, 4,060,598, 4,173,626, 3,119,742 та 3,492,397. Здатність сполук формули І або їх фармацевтично прийнятних солей інгібувати Janus кіназу 3 і, відповідно, проявляти ефективність при лікуванні розладів та станів, що характеризуються Janus кіназою 3, ілюструється наступними in vitro дослідженнями. Біологічні дослідження Дослідження Ферементої активності JAK3 (JH1.-GST) В дослідженні JAK3 кінази використовується протеїн, експресований в бакуловірус-інфікованих SF9 клітинах (об'єднаний протеїн GST та каталітичний домен людської JAK3) очи щених афінною хроматографією на глутатіон-сефарозі. Субстратом для реакції є поліглутамінова кислота-тирозин (PGT (4:1), Sigma katalog # Р0275), нанесена на Nunc Maxi Sorp пластини в концентрації 100мкг/мл на ніч при температурі 37°С. Наступного ранку після покриття пластини тричі промивали і додавали JAK3 до лунок, які містили 100мкл кіназного буфера (50мМ HEPES, рН 7,3, 125мМ NaCI, 24мМ МgСІ2) + 0,2мкМ АТР + 1мМ ортованадату Na). Реакцію продовжували ще 30 хвилин при кімнатній температурі і пластини знову промивали тричі. Рівень фосфорильованого тирозину в даній лунці визначали за стандартним ELISA кількісним аналізом, використовуючи анти-фосфотирозинове антитіло (ICN PY20, кат. #69-151 -1). Інгібування бластної проліферації IL-2 залежних людських Т-клітин Цей дослід оцінює інгібіторний вплив сполук на бластну проліферацію IL-2 залежних Т-клітин in vitro. Оскільки для передачі сигналу через IL-2 рецептор необхідна JAK-3, клітинні активні інгібітори JAK-3 повинні інгібувати бластну проліферацію IL-2 залежних Т-клітин. Клітини для цього дослідження виділяли зі свіжої людської крові. Після відокремлення мононуклеарних клітин з використанням Accuspin System-Histopaque-1077 (Sigma # А7054), виділяли первинні людські Тклітини шляхом негативної селекції, використовуючи Lympho-Kwik Τ (One Lambda, Inc., Cat # LK-50T). Тклітини вирощували при концентрації 1-2x106/мл в Середовищі (RPMI + 10% інактивованої нагріванням ембріональної сироватки (Hyclone Cat # А-1111 -L) + 1% пеніцилін/стрептоміцин (Gibco)) і викликали проліферацію додаванням 10мкг/мл РНА (Murex Diagnostics, Cat # НА 16). Після культивування протягом 3 днів при 37°С в 5% СО2, клітини тричі промивали в Середовищі, ресуспендували до щільності 12x106клітин/мл Середовища плюс 100один./мл людської рекомбінантної IL-2 (R&D Systems, Cat # 202-IL). Через один тиждень клітини є IL-2 залежними і можуть зберігатися аж до 3 тижнів шляхом підкормки двічі на тиждень однаковими об'ємами Середовища + 100один./мл IL-2. Для дослідження здатності тестових сполук інгібувати проліферацію IL-2 залежних Т-клітин, IL-2 залежні клітини тричі промивали, ресуспендували в Середовищі і потім вносили в лунки (50,000клітин/лунка/0,1мл) плоскодонної 96-лункової мікротитрувальної пластини (Falcon # 353075). З 10мМ вихідного розчину тестової сполуки в ДМСО серійні 2-кратні розведення сполуки додавали до лунок в трьох серіях, починаючи з 10мкМ. Через одну годину додавали 10один./мл IL-2 до кожної тестової лунки. Пластини потім інкубували при 37°С, 5% СО2 протягом 72 годин. Пластини потім струшували з 3Нтимідином (0,5мкСі/лунка) (NEN Cat # NET-027 А) і додатково інкубували 18 годин. Пластини з культурою потім збирали &with a 96-well plate han/естер і кількість 3Н-тимідину, включеного в проліферовані клітини, визначали шляхом підрахунку на Packard Top Count сцинтиляційному лічильнику. Дані аналізували шляхом побудови графіку залежності % інгібування проліферації від концентрації досліджуваної сполуки. Значення ІСХ (мкМ) визначали з цього графіка. Наступні Приклади ілюструють одержання сполук даного винаходу, але не обмежуться їх деталями. Температури плавлення не коригувалися. Дані ЯМР наведені в мільйонних частках (5) и відносно сигналу дейтерія зразка розчинника (дейтеріохлороформ, якщо не обумовлено інше). Комерційні реагенти використовували без подальшого очищення. Аббревіатура ТГФ стосується тетрагідрофурану, ДМФ стосується N.N-диметилформаміду. Мас-спектри низького розділення (LRMS) реєстрували або на Hewlett Packard 5989Ò, використовуючи хімічну іонізацію (амоній), або на Fisons (або Micro Mass) платформі хімічної іонізації при атмосферному тиску (АРСІ), яка використовує 50/50 суміш ацетонітрил/вода з 0,1% мурашиної кислоти, як іонізуючий агент. Кімнатна температура або температура оточуючого середовища стосується 20-25°С. Приклад 1 1-{4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)-аміно]-піперидин-1-іл}етанон Метод А (1-Бензил-4-метилпіперидин-3-іл)метиламін При перемішуванні до розчину 1-бензил-4-метилпіперидин-3-ону (2,3г, 11,5ммоль), одержаного за методикою Іогіо, М.А. та Damia, G., Tetrahedron, 26, 5519 (1970) та Grieco та ін. Journal of the American Chemical Society, 107, 1768 (1985), (видозміненою шляхом використання 5% метанолу як сорозчинника), обидва джерела включені сюди як посилання, розчиненого в 23мл 2Μ метиламіну в тетрагідрофурані додвали 1,4мл (23ммоль) оцтової кислоти і одержану суміш перемішували в закритій трубці протягом 16 годин при кімнатній температурі. Додавали триацетоксіборогідрид натрію (4,9г, 23ммоль) і нову суміш перемішували при кімнатній температурі в закритій трубці протягом 24 годин, після чого реакцію гасили додаванням 1Ν розчину гідроксиду натрію (50мл). Потім реакційну суміш екстрагували 3x80мл етером, об'єднані етерні шари висушували над сульфатом натрію (Na2SO4) і концентрували до сухого залишку у вакуумі, одержуючи 1,7г (69%) вказаної у заголовку сполуки у вигляді твердої речовини білого кольору. LRMS: 219,1 (М+1). Метод В (1-Бензил-4-метилпіперидин-3-iл)метил(7Н-піроло[2,3-d]піримідин-4-іл)амін Розчин 4-хлорпіроло[2,3-d]піримідину (2,4 грамів, 15,9ммоль), одержаного за методом Davoll, J. Am. Chem. Soc, 82.131 (1960), що включений сюди як джерело інформації для довідки, і продукт Методу А (1,7 грамів, 7,95ммоль), розчинений в 2 еквівалентах триетиламіну, нагрівали в закритій трубці при 100°С протягом 3 днів. Після охолодження до кімнатної температури та концентрування під зниженим тиском залишок очищали флеш-хроматографією (кремнезем; 3% метанол в дихлорметані) з одержанням 1,3 грамів (50%) вказаної у заголовку сполуки у вигляді безбарвного масла. LRMS: 336,1 (М+1). Метод С Метил(4-метилпіперидин-3-іл)-(7Н-піроло[2,3-d]піримідин-4-іл)амін До продукту Методу В (0,7 грамів, 2,19ммоль), розчиненого в 15мл етанолу додавали 1,5мл 2N хлороводневої кислоти і реакційну суміш піддавали дегазації шляхом видалення азоту. До реакційної суміші потім додавали 0,5 грамів 20% гідроксиду паладію на вугіллі (50% вода) (Aldrich) і одержану суміш струшували (Parr-Shaker) при тиску 50psi в атмосфері водню при кімнатній температурі протягом 2 днів. Профільтровану через Celite реакційну суміш концентрували до сухого залишку у вакуумі і залишок очищали флеш-хроматографією (кремнезем; 5% метанол в дихлорметані) з одержанням 0,48 грамів (90%) вказаної у заголовку сполуки. LRMS: 246,1 (М+1). Метод D 1-{4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно1піперидин-1-іл}етанон До розчину продукту Методу С (0,03 грамів, 0,114ммоль), розчиненого в 5мл 10:1 дихлорметан/піридин, при перемішуванні додавали (0,018 грамів, 0,228ммоль) ацетилхлориду і одержану суміш перемішували при кімнатній температурі протягом 18 годин. Потім реакційну суміш розподіляли між дихлорметаном і насиченим розчином бікарбонату натрію (NaHCO3). Органічний шар промивали знову насиченим розчином NaHCO3, висушували над сульфатом натрію і концентрували до сухого залишку у вакуумі. Залишок очищали препаративною тонкошаровою хроматографією (PTLC) (кремнезем; 4% метанол в дихлорметані) з одержанням 0,005мг (15%) вказаної у заголовку сполуки у вигляді безбарвного масла. LRMS: 288,1 (М+1). Вказані в заголовках сполуки Прикладів 2-26 були одержані за методикою, аналогічною тій, що описана в Прикладі 1. Приклад 2 [1-(2-Аміноетансульфоніл)-4-метилпіперидин-3-іл]метил(7Н-піроло[2,3-d]піримідин-4-іл)амін [1-(2-Аміноетансульфоніл)-4-метилпіперидин-3-іл]-метиламін. LRMS: 353. Приклад 3 (1-Етансульфоніл-4-метилпіперидин-3-іл)метил(7Н-піроло[2,3-d]піримідин-4-іл)амін (1-Етансульфоніл-4-метилпіперидин-3-іл)метиламін. LRMS: 338. Приклад 4 [1-(Бутан-1-суль фоніл)-4-метилпіперидин-3-іл]метил(7Н-піроло[2,3-d]піримідин-4-іл)амін [1-(Бутан-1-суль фоніл)-4-метилпіперидин-3-іл]метиламін. LRMS: 366. Приклад 5 Ізобутиловий естер 4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміноїпіперидин-1-карбонової кислоти Ізобутиловий естер 4-метил-3-метиламінопіперидин-1-карбонової кислоти. LRMS: 346. Приклад 6 N-(2-(4-Метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-сульфоніл)-етил)пропіонамід N-[2-(4-Метил-3-метиламінопіперидин-1-сульфоніл)етил]пропіонамід. LRMS: 409. Приклад 7 Метиловий естер (2-(4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1сульфоніл}етил)карбамінової кислоти Метиловий естер [2-(4-метил-3-метиламінопіперидин-1-сульфоніл)етил]-карбамінової кислоти. iLRMS: 411. Приклад 8 N-(2-(4-Метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно)піперидин-1-сульфоніл}етил)-ізобутирамід N-[2-(4-Метил-3-метиламiнопiперидин-1-сульфоніл)етил]ізобутирамід. LRMS: 423. Приклад 9 (1-Метансульфонілпіперидин-3-іл)метил(7Н-піроло[2,3-d]піримідин-4-іл)амін (1-Метансульфонілпіперидин-3-іл)метиламін. LRMS: 310. Приклад 10 (1-Етансульфонілпіперидин-3-іл)метил(7Н-піроло[2,3-d]піримідин-4-іл)амін (1-Етансульфонілпіперидин-3-іл)метиламін. LRMS: 324. Приклад 11 Метил-[1-(пропан-1-сульфоніл)-піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін (1-Пропілсульфонілпіперидин-3-іл)метиламін. LRMS: 338. Приклад 12 [1-(Бутан-1-суль фоніл)піперидин-3-іл]метил(7Н-піроло[2,3-d]піримідин-4-іл)амін (1-Бутилсульфонілпіперидин-3-іл)метиламін. LRMS: 352. Приклад 13 2,2-Диметил-N-(2-{4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]пiперидин-1сульФоніл}етил)пропіонамід 2,2-Диметил-N-[2-(4-метил-3-метиламінопіперидин-1-сульфоніл)етил]пропіонамід. LRMS: 437. Приклад 14 3-(4-Метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3-оксопропіонітрил 3-(4-Метил-3-метиламінопіперидин-1-іл)-3-оксопропіонітрил. LRMS: 313. Приклад 15 трет-Бутиловий естер (3-{4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}-3оксопропіл)карбамінової кислоти трет-Бутиловий естер [3-(4-метил-3-метиламіно-піперидин-1-іл)-3-оксопропіл]-карбамінової кислоти. LRMS: 417. Приклад 16 Метил[4-метил-1-(пропан-1-сульфоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амiн Метил[4-метил-1-(пропан-1-сульфоніл)піперидин-3-іл]амін. LRMS: 352. Приклад 17 3-Аміно-1-(4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл)пропан-1-он 3-Аміно-1-(4-метил-3-метиламінопіперидин-1-іл)пропан-1-он. LRMS: 317. Приклад 18 2-Метокси-1-(4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-iл)етанон 2-Метокси-1-(4-метил-3-метиламінопіперидин-1-іл)етанон. LRMS: 318. Приклад 19 2-Диметиламіно-1-(4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл}етанон 2-Диметиламіно-1-(4-метил-3-метиламінопіперидин-1-іл)етанон. LRMS: 331. Приклад 20 трет-Бутиловий естер (3-{4-Метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл)-3оксопропіл)карбамінової кислоти трет-Бутиловий естер [3-(4-Метил-3-метиламінопіперидин-1-іл)-3-оксопропіл]-карбамінової кислоти. LRMS: 417. Приклад 21 3,3,3-Трифтор-1-{4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно1-піперидин-1-іл}пропан-1-он 3,3,3-Трифтор-1-(4-метил-3-метиламінопіперидин-1-іл)пропан-1-он. Приклад 22 N-(2-(4-Метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл)-2-оксоетил)-аиетамід N-[2-(4-Метил-3-метиламiнопiперидин-1-іл)-2-оксоетил]ацетамід. LRMS: 345. Приклад 23 3-Етокси-1-{4-метил-3-[метил-(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-іл)пропан-1-он 3-Етокси-1-(4-метил-3-метиламінопіперидин-1-іл)пропан-1-он. LRMS: 346. Приклад 24 Метиламід 4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти Метиламід 4-метил-3-метиламінопіперидин-1-карбонової кислоти. LRMS: 303. Приклад 25 Діетиламід 4-метил-3-[метил(7Н-піроло[2,3-d]піримідин-4-іл)аміно]піперидин-1-карбонової кислоти Діетиламід 4-метил-3-метиламіно-піперидин-1-карбонової кислоти. LRMS: 345. Приклад 26 Метил[4-метил-1-(2-метиламіноетансульфоніл)піперидин-3-іл]-(7Н-піроло[2,3-d]піримідин-4-іл)амін Метил[4-метил-1-(2-метиламіноетансульфоніл)піперидин-3-іл]амін. LRMS: 367.
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds of pyrrolo[2.3-d]pyrimidine, a pharmaceutical composition (variants), a method for inhibition of proteinkinases or janus kinase 3 (variants)
Назва патенту російськоюСоединения пирроло[2.3-d]пиримидина, фармацевтическая композиция (варианты), способ ингибирования протеинкиназ или janus киназы 3 (варианты)
МПК / Мітки
МПК: A61K 31/519, A61P 3/10, A61P 29/00, A61K 38/13, A61P 1/00, A61P 17/06, A61P 11/06, A61P 25/28, A61P 1/04, C07D 487/04, A61P 17/00, A61K 31/365, A61P 35/00, A61P 35/02, A61K 31/445, A61P 37/06, A61P 43/00, A61P 37/00
Мітки: фармацевтична, сполуки, кінази, піроло[2.3-d]піримідину, інгібування, варіанти, композиція, спосіб, janus, протеїнкіназ
Код посилання
<a href="https://ua.patents.su/12-72290-spoluki-pirolo23-dpirimidinu-farmacevtichna-kompoziciya-varianti-sposib-ingibuvannya-protenkinaz-abo-janus-kinazi-3-varianti.html" target="_blank" rel="follow" title="База патентів України">Сполуки піроло[2.3-d]піримідину, фармацевтична композиція (варіанти), спосіб інгібування протеїнкіназ або janus кінази 3 (варіанти)</a>
Попередній патент: Карбонізація целюлозних волокнистих матеріалів за наявності кремнієорганічних сполук
Наступний патент: Спосіб прокатування виливків з розширеними до площі з’єднання основною і головною частинами
Випадковий патент: Лікарський засіб для регулювання мейозу