Похідні вуглеводів та фармацевтична композиція на їх основі
Номер патенту: 49089
Опубліковано: 16.09.2002
Автори: Бастен Йоханнес Е'бертус Марія, Ван Букель Констант Адріан Антон, Дреф-Тромп Корнелія Марія, Петіту Моріс, Дюшоссуа Філіп
Формула / Реферат
1. Похідне вуглеводу формули (І)
,
де R1 - (С1-С4)алкоксил,
R2, R3 та R4, незалежно - (С1-С4)алкоксил чи ОSО3¯,
загальне число сульфатних груп 4, 5 чи 6,
зігнуті лінії являють собою зв'язки, що розташовані вище чи нижче площини шестичленного кільця, до якого вони приєднані,
або його фармацевтично прийнятна сіль.
2. Похідне вуглеводу за п. 1, яке відрізняється тим, що ділянка D має структуру
,
де R1 - метоксил, а R2, R3 та R4, незалежно - метоксил чи ОSО3¯.
3. Похідне вуглеводу за п. 2, яке відрізняється тим, що R2 - метоксил.
4. Похідне вуглеводу за п. 3, яке відрізняється тим, що R3 - метоксил.
5. Похідне вуглеводу за п. 4, яке відрізняється тим, що R4 - метоксил.
6. Похідне вуглеводу за будь-яким з пп. 1-5 для використання у терапії.
7. Фармацевтична композиція, яка містить похідне вуглеводу за будь-яким з пп. 1-5 та фармацевтично придатні допоміжники.
Текст
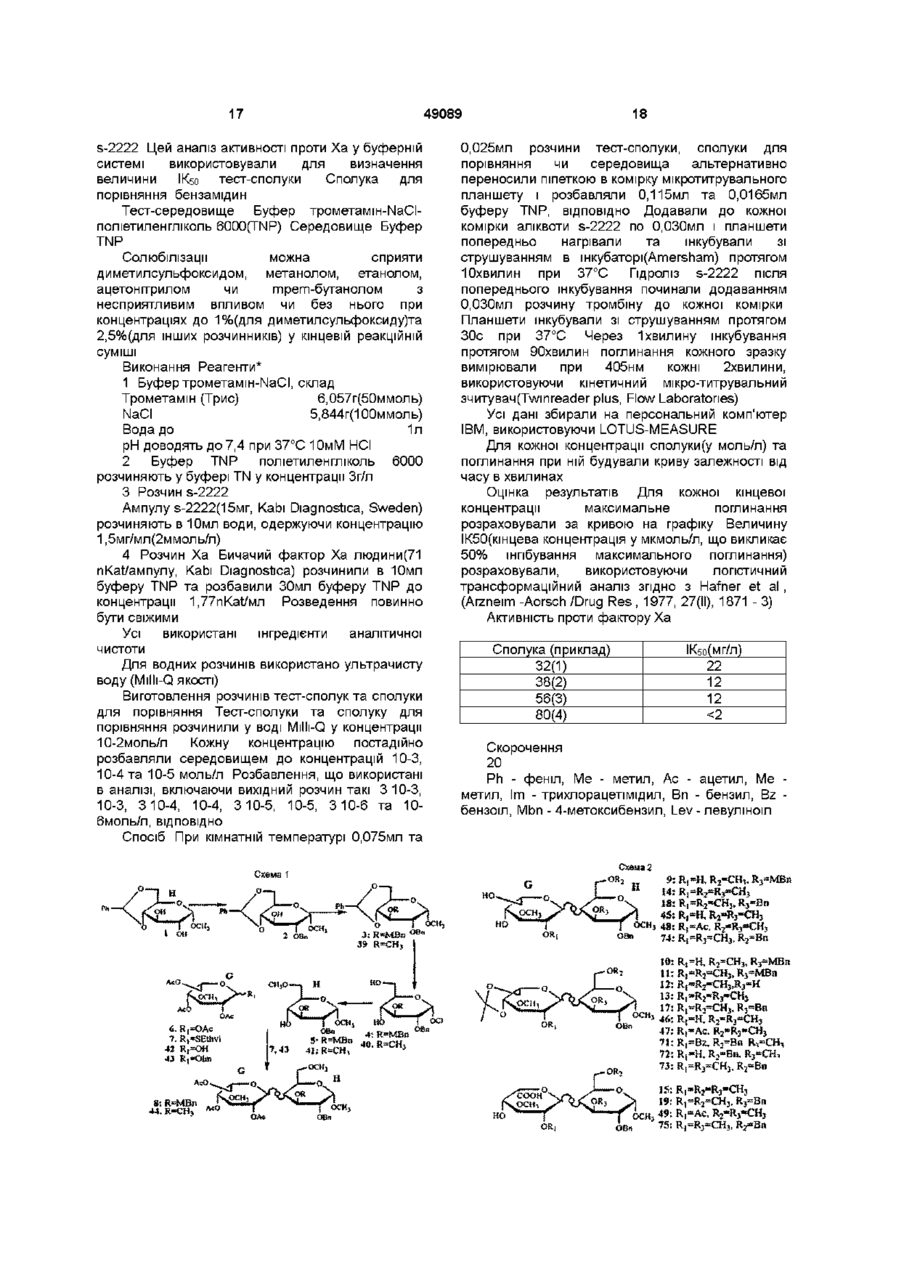
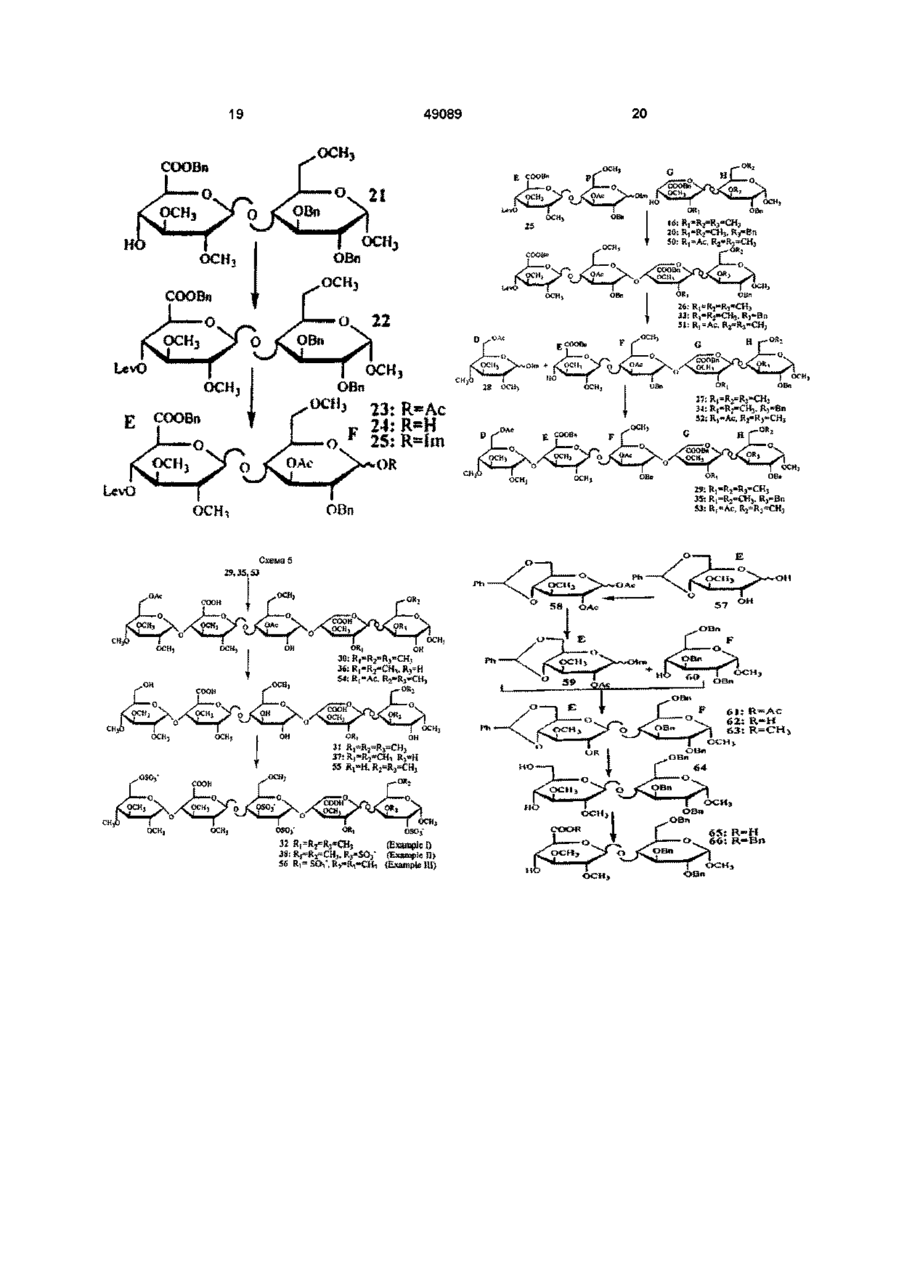
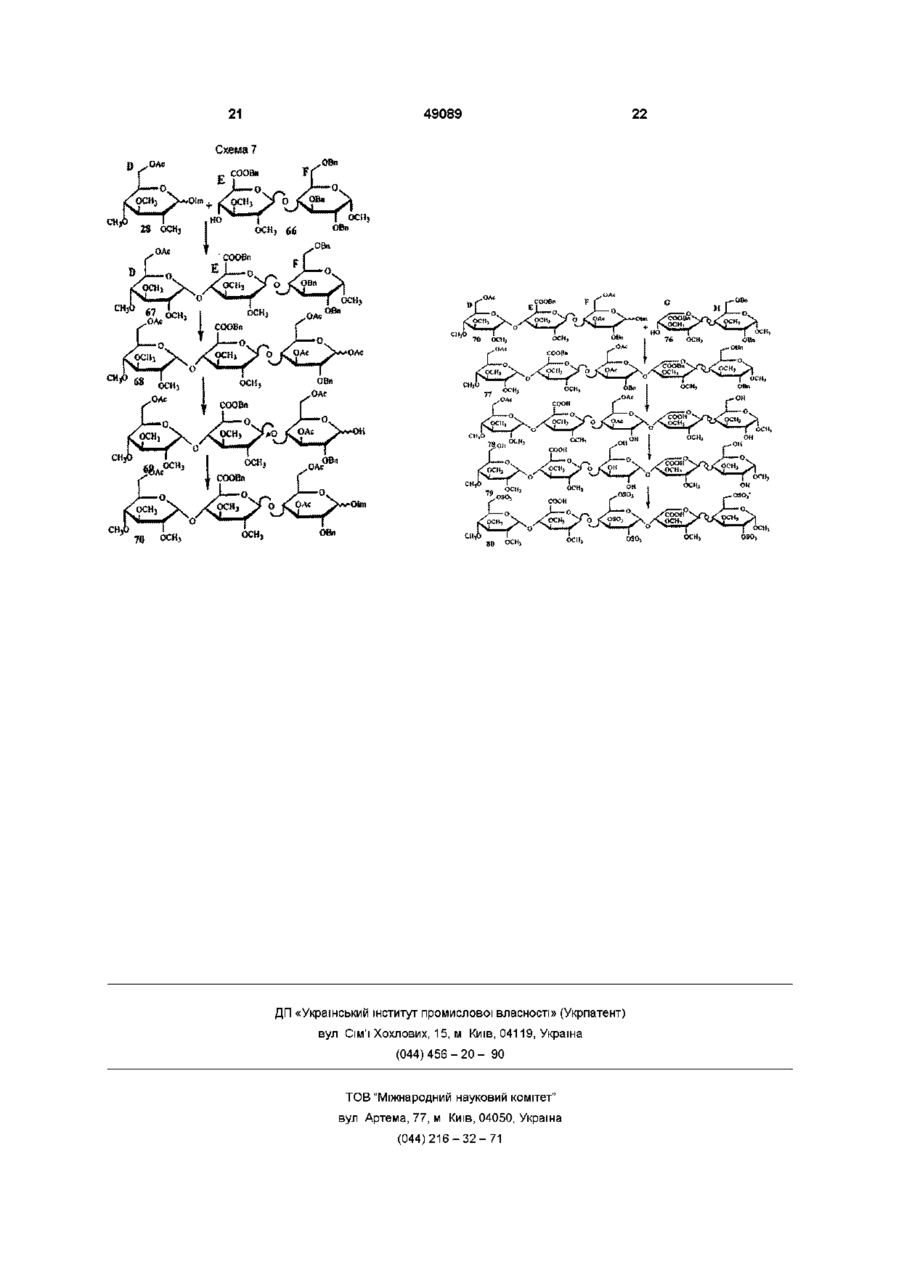
1 Похідне вуглеводу формули (І) де R1 - (Сі-С4)алкоксил, R , R та R4, незалежно - (Сі-С^алкоксил чи OSO 3 , загальне число сульфатних груп 4, 5 чи 6, зігнуті лінії являють собою зв'язки, що розташовані Згідно З винаходом запропоновано похідне вуглеводу, фармацевтичну композицію, що його містить, а також використання вказаного похідного вуглеводу у виробництві лікувального засобу Гепарин звичайно використовуваний антикоагулянт з таких біологічних джерел, як слизова кишок У присутності гепарину інактивація тромбіну антитромбіном ІІІ(АТ-ІІІ) значно зростає, включаючи зміни в конформації гепарину та АТ-ІІІ при комплексоутворенні Тромбін регулює останній ступінь каскаду коагуляції крові Першою функцією тромбіну є розщеплення фібриногену для вироблення мономерів тромбіну, які утворюють вище чи нижче площини шестичленного кільця, до якого вони приєднані, або його фармацевтично прийнятна сіль 2 Похідне вуглеводу за п 1, яке відрізняється тим, що ділянка D має структуру oscv де R1 - метоксил., ; R та R , незалежно метоксил чи OSO3 3 Похідне вуглеводу за п 2, яке відрізняється тим, що R2 - метоксил 4 Похідне вуглеводу за п З, яке відрізняється тим, що R3 - метоксил 5 Похідне вуглеводу за п 4, яке відрізняється тим, що R4 - метоксил 6 Похідне вуглеводу за будь-яким з пп 1-5 для використання у терапії 7 Фармацевтична композиція, яка містить похідне вуглеводу за будь-яким з пп 1-5 та фармацевтично придатні допоміжники о 0 0 о нерозчинний гель, фібринову пробку, внаслідок поперекової зшивки Структурні особливості гепарину, які потрібні для взаємодії з АТ-ІІІ, досліджували різними способами Частина полімеру гепарину виявляє тільки слабку спорідненість до АТ-ІІІ, в той час як інша частина є значно важливішою для приєднання до АТ-ІІІ Вивченням фрагментованого гепарину ідентифіковано пентасахаридний фрагмент, оцінений як мінімальна структура з високою спорідненістю, що приєднується до АТ-ІІІ [див наприклад, Physiological Reviews, 71(2), 488/9, 1991] У цьому фрагменті з високою 49089 спорідненістю наявні 8 сульфатних груп 4 з них, як виявлено, важливі для приєднання до АТ-ІІІ [Advanced in Carbohydrate Chemistry and Biochemistry, Vol 43, Eds R S Tipson&D Horton Publ Harcourt Brace Jovanovich В Casu(pp 51 127), параграф 6], а ІНШІ Є додатковими для високої спорідненості Цей висновок було підтверджено синтетичними аналогами пентасахаридного фрагменту [див наприклад, Angew Chem 32(12), 1671 -1818, 1993] Ідентифікація пентасахаридного фрагменту з високою спорідненістю призвела до виготовлення його синтетичного аналогу Невеликі синтетичні молекули вуглеводів глікозаміноглкжанового типу були визначені як потужні та селективні анти-Ха інгібітори Див наприклад, Європейський патент 84999 Пізніше подані патенти/патентні заявки показали багато варіантів цих молекул мають подібну і навіть вищу активність, а тим посилюють фармакологічні властивості, як-то розкриті в ЕР 529715 та ЕР 454220 споріднені з глікозамшоглюканом ПОХІДНІ вуглеводів Ці ПОХІДНІ вуглеводів позбавлені характерних функціональних груп глікозамшоглюкану вільних гідроксильних груп, N-сульфатних та ІМацетильних груп Крім того, всі розкриті в цій останній патентній заявці пентасахариди несуть щонайменше 7 сульфатних груп На антитромботичних олігосахаридних похідних було загалом встановлено, що для отримання КЛІНІЧНО прийнятного рівня антитромботичної активності потрібно щонайменше 7 сульфатних груп Однак, несподівано було виявлено клас споріднених з глікозамшоглюканом похідних вуглеводів, що мають тільки 4 - 6 сульфатних груп та все ж виявляють значну клінічну антитромботичну активність Крім того, сполуки згідно з винаходом виявляють послаблену побічну дію Наприклад, ризик кровотечі зменшується, а низький сульфатний вміст у сполуках не дає збільшення викликаної гепарином тромбоцитопенм(НІТ), яка є суворим побічним ефектом, що може призвести до загибелі пацієнта Крім того, сполуки згідно з винаходом мають час біологічного напівіснування, що дозволяє лікування раз на добу Лікування раз на добу, можна вважати, буде більш переважним, ніж, наприклад, лікування раз на тиждень, дозволяючи швидку адаптацію лікування, якщо стан пацієнта цього потребує Полегшується також при лікуванні раз на тиждень постачання лікарні, оскільки для лікування пацієнта не потрібно комплексних схем дозування Отже, сполуки згідно з винаходом виявляють неочікувані та тонко збалансовані фармакологічні властивості Згідно З винаходом запропоновано похідне вуглеводу формули(І) де Ri - (Сі-С^алкоксил, R2, R3 та R4, незалежно - (Сі-С4)алкоксил чи OSO3, загальне число сульфатних груп 4, 5 чи 6, зігнуті лінії представляють зв'язки, що розташовані вище чи нижче площини шестичленного кільця, до якого вони приєднані, або його фармацевтичне прийнятну сіль Сполуки згідно з винаходом також корисні при лікуванні та попередженні опосередкованих тромбіном чи асоційованих з ним хвороб, які включають ряд тромботичних та протромботичних станів, при яких активовано коагуляційний каскад, які включають без обмеження глибокий тромбоз вен, легеневу емболію, тромбофлебіт, закупорку артерій від тромбозу чи емболії, артеріальну реоклюзію протягом чи після анпопластики чи тромболізу, рестенозу, що супроводжує артеріальні поранення чи інвазивні кардіологічні процедури, післяопераційні тромбози та емболії вен, гострий чи хронічний атеросклероз, напад, інфаркт міокарду, рак та метастази та нейродегенеративні захворювання ПОХІДНІ вуглеводів згідно з виниходом можна використовувати як інгібітори проліферації клітин гладеньких м'язів та для лікування анпогенезу, раку та ретровірусних інфекції типу ВІЛ Крім того сполуки згідно з винаходом можна використовувати як антикоагулянти та антикоагулянтні покриття в екстракорпоральних кров'яних циклах, що потрібні при діалізі та хірурги Сполуки згідно з винаходом можна також використовувати як антикоагулянти in vitro та in vivo Кращі ПОХІДНІ вуглеводів згідно з винаходом мають формулу(І), де ділянка D має структуру де Ri - метоксил, a R2, R3 та R4, незалежно метоксил чи OSO3 У найкращих похідних вуглеводів R2 метоксил У особливо кращих похідних вуглеводів R3 -метоксил Найкращим похідним вуглеводу є той, де R4 - метоксил В (С1-С4)алкоксилі(С1-С4)алкіл є ЛІНІЙНИМ ЧИ розгалуженим алкілом, що має 1 - 4 атоми карбону, як-то метил, етил, і-пропіл, трет-бутил тощо Найкращим є метил Протиюнами, що компенсують заряджені групи, є фармацевтичне прийнятні іони типу гідрогену, а краще іони лужних та лужноземельних металів, типу натрію, кальцію чи магнію ПОХІДНІ вуглеводів згідно з винаходом можна виготовити добре відомими способами, що описано та використано для синтезів олігосахаридів Конкретні посилання на це зроблені у вищезгаданому Європейському патенті ЕР 529715 Придатний спосіб виготовлення похідних вуглеводів згідно з винаходом 49089 характеризуються способом, при якому протектовані моносахариди різної будови сполучають з отриманням протектованого дисахариду, після чого (a) протектований дисахарид одного типу сполучають з протектованим дисахаридом іншого типу з отриманням протектованого тетрасахариду, який сполучають з протектованим моносахаридом з отриманням протектованого пентасахариду, або (b) протектований моносахарид сполучають з протектованим дисахаридом з отриманням протектованого трисахариду, який сполучають з протектованим дисахаридом з отриманням протектованого пентасахариду, після цього протектувальні групи відщеплюють та сульфатують ВІЛЬНІ гідроксильні групи, після чого отриману сполуку перетворюють у фармацевтичне прийнятну сіль Моносахаридами є D-глюкоза, D-маноза, Dідоза, D-глюкуронова кислота чи D-ідуронова кислота, придатне функцюналізовані потрібними алкілами або тимчасовими протектувальними групами Придатні протектувальні групи добре ВІДОМІ фахівцям, кращі з них включають бензил та ацетил для гідроксильних груп, та бензил для карбоксильних груп уронових кислот 3 таким же успіхом можна використовувати такі ІНШІ протектувальні групи, як бензоїл, левулініл, алкоксифеніл, хлорацетил, тритил тощо Сполучення сахариду здійснюють відомими способами, наприклад, депротектуванням позиції 1 глікозил-донору та/або активацією цієї позицм(наприклад, створюючи бромідне, пентенільне, флуоридне, тюглікозидне чи трихлорацетамідне похідне) та сполученням активованого глікозил-донору з протектованим, як варіант, глікозил-акцептором Для лікування тромбозу вен чи інгібування проліферації клітин гладеньких м'язів сполуки згідно з винаходом можна призначати парентерально чи ентерально, а для людини переважно з добовим дозуванням 0,001 - 10мг/кг маси тіла Змішування з фармацевтично прийнятними допоміжниками описано, наприклад, в стандартних посиланнях, Gennaro et a, Remington's Pharmaceutical Sciences(18th ed , Mack Publishing Company, 1990, див особливо частину 8 Pharmaceutical Preparation and Their Manufacture (Фармацевтичні препарати та їх виробництво)), сполуки можна пресувати у такі тверді дозовані одиниці, як ПІЛЮЛІ, таблетки, або використовувати в капсулах чи супозиторіях 3 фармацевтичне прийнятними рідинами сполуки можна також застосовувати як препарати для ІН'ЄКЦІЙ у формі розчинів, суспензій, емульсій, або для розпилення, наприклад, назальних спреїв Для створення дозованих одиниць, наприклад, таблеток застосовують звичайні добавки, як-то наповнювачі, барвники, полімерні зв'язувальні засоби тощо Взагалі, можна застосовувати будьякі фармацевтично прийнятні добавки, що не впливають на функції активних сполук Придатні носи, з якими можна використовувати композиції, включають узяті в придатній КІЛЬКОСТІ лактозу, крохмаль, ПОХІДНІ целюлози тощо, або їх суміші Далі винахід ілюстровано прикладами Синтез з прикладу 1 (сполука 32) Синтез дисахариду GH(cxeMH 1 + 2 ) Сполука 2 Сполуку 1 (60г, комерційно доступна) розчинили в N,Nдиметилформаміді(858мл) разом з бензилбромідом(858мл) Після охолодження до +10°С краплями додали 20% водний розчин гідроксиду натрію і після перемішування протягом години температуру підняли до 20°С та перемішували суміш протягом 20годин Розчин виливали у суміш води з льодом і толуолу і екстрагували Органічний шар концентрували і сирий продукт очищали кристалізацією, отримавши 30,0г сполуки 2 ТШХ Rf = 0,60, толуол/етил ацетат, 7/3 за об'ємом Сполука 3 Сполуку 2(26,4г) розчинили в N,Nдиметилформаміді(211мл) Після охолодження на льоді додали під азотом гідрид натрію(2,5г), а потім краплями додали 4метоксибензилхлорид (13,3г) та перемішували суміш при кімнатній температурі протягом години, далі розбавляли її етилацетатом, ДВІЧІ промивали водою та концентрували, отримавши 40,7г сирого продукту З ТШХ Rf = 0,80, толуол/етил ацетат, 7/3 за об'ємом Сполука 4 Сполуку 3(34,9г) розчинили в 60% оцтовій кислоті та перемішували при 60°С протягом 4 годин, далі розбавляли суміш толуолом та концентрували і очищали хроматографією на силікагелі, отримавши 26,4г сполуки 4 ТШХ Rf = 0,07, толуол/етил ацетат, 7/3 за об'ємом Сполука 5 Сполуку 4(26,4г) розчинили під азотом в дихлорметані(263мл), при кімнатній температурі додали тетрафлуорборат триметилоксонію(11,6г) та 2,6-ди-треш-бутил-4метилпіридин(17,4г) Через 4 години суміш вилили у воду з льодом та екстрагували дихлорметаном Органічний шар промивали ІЧаНСОз, випарювали і очищали хроматографією на силікагелі, отримавши 18,5 г сполуки 5 ТШХ Rf = 0,25, толуол/етил ацетат, 7/3 за об'ємом Сполука 7 Сполуку 6(3-метил-1,2,4,6тетраацетилідоза)(48,4г) розчинили в толуолі(175мл) Додали під азотом етантюл(20мл) та діетилетерат трифлуориду бору(1М розчин в толуолі, 134мл), перемішували суміш годину і додали водний ІЧаНСОз(400мл) і перемішували ще годину, а потім виливали в етилацетат Органічний шар ДВІЧІ промивали водою та концентрували і очищали хроматографією на силікагелі, отримавши 29,6г сполуки 7 ТШХ Rf = 0,45, толуол/етил ацетат, 6/4 за об'ємом Сполука 8 Сполуку 5(17,5г) та сполуку 7(28,2г) розчинили в толуолі(525мл) під азотом і після додавання порошку молекулярних сит(0,4нм) охолодили до 20°С Додали краплями при 49089 безперервному току азоту свіжоприготований 0,1 М розчин М-йодсукциніміду(17,4г) та трифлуорметансульфонової кислоти(1,28мл) в дюксані/дихлорметані(1/1 за об'ємом) Через Юхвилин червону суміш фільтрували та послідовно промивали тіосульфатом натрію та водним ЫаНСОз Органічні шари концентрували у вакуумі, одержавши 30,0г сполуки 8 ТШХ Rf = 0,45, толуол/етил ацетат, 8/3 за об'ємом Сполука 9 Сполуку 8(30,0г) розчинили в дюксані/дихлорметані(460мл, 1/1 за об'ємом) Додали для омилення бутанолят калію, а через 15хвилин нейтралізували Dowex 50WX8H+-form та концентрували у вакуумі і очищали хроматографією на силікагелі, одержавши 17,4г сполуки 8 ТШХ Rf = 0,25, толуол/етил ацетат, 95/5 за об'ємом Сполука 10 Сполуку 9(17,4г) розчинили в N,Nдиметилформаміді(77мл) під азотом Додали 1,2диметоксипропан(26мл) та п-толуолсульфонову кислоту і перемішували ЗОхвилин, розбавляли водним МаНСОз та екстрагували етилацетатом, одержавши після випарювання розчиннику 19,7г сполуки 10 ТШХ Rf = 0,45, толуол/етил ацетат, 95/5 за об'ємом Сполука 11 Сполуку 10(18,5г) розчинили в N І\І-диметилформаміді(24,4мл) та охолодили до 0°С Додали під азотом гідрид натрію(1,47г, 60% дисперсія маслі) та йодметан(2,36мл), а через годину надлишок гідриду натрію нейтралізували та екстрагували дихлорметаном, одержавши після випарювання розчиннику 20,0г сполуки 11 ТШХ Rf = 0,85, толуол/етил ацетат, 95/5 за об'ємом Сполука 12 Сполуку 11 (18,4г) розчинили в дихлорметані(838мл) та воді(168мл) Додали 2,3дихлор-5,6-диціано-1,4-бензохшон(1,47г) та перемішували при 4°С протягом 18годин, потім вилили у водний МаНСОз та екстрагували дихлорметаном, одержавши після концентрування органічного шару 12,7г сполуки 12 ТШХ Rf = 0,40, толуол/етил ацетат, 95/5 за об'ємом Сполука 13 Сполуку 12 перетворили в сполуку 13 описаним для синтезу сполуки 11 способом ТШХ Rf = 0,48, толуол/етил ацетат, 1/1 за об'ємом Сполука 14 Сполуку 13(2,5г) розчинили в оцтовій кислоті(14,6мл) та воді(6,1мл) і перемішували при кімнатній температурі протягом ночі Випарювали з толуолом і очищали хроматографією на силікагелі, отримавши 1,9г сполуки 14 ТШХ Rf = 0,31, етилацетат, за об'ємом Сполука 15 Сполуку 14(1,7г) розчинили в дихлорметані(9мл) та додали 2,2,6,6-тетраметил-1 піперидинілокси(5мг), насичений розчин МаНСОз(5,8мл), бромід калію(32мг) та хлорид тетрабутиламонію(42мг) і охолодили до 0°С Додали суміш насиченого розчину хлориду натрію(6,5мл), насиченого розчину МаНСОз(3,2мл) і протягом 15хвилин додавали гіпохлорит 8 натрію(13М, 7,3мл), а через годину перемішування суміш розбавляли водою та тричі екстрагували дихлорметаном Органічні шари промивали розсолом, сушили сульфатом магнію, фільтрували та випарювали досуха, одержавши 1,74г сирої сполуки 15 ТШХ Rf = 0,14, дихлорметан/метанол, 9/1 за об'ємом Метил О-(бензил) 2 З-ді-О-метил-a-Lідопіранозилуронат)-(1 —> 4)-2-О-бензил 2 З-ді-Ометил-а-О-глюкопіранозид 16 До розчину сполуки 15(1,74г) в N Nдиметилформаміді, при кімнатній температурі додали під азотом бензоілбромід(1,66мл) та КНСОз(1,1 г) Через 1,5години перемішування додали воду та екстрагували етилацетатом Органічний шар випарювали і очищали хроматографією на силікагелі, отримавши 1,64г сполуки 16 ТШХ Rf = 0,50, толуол/етил ацетат, 1/1 за об'ємом Синтез дисахариду EF(cxeMH 2 + 3) Сполука 17 Сполуку 12(10 5г) розчинили в сухому г\І,І\І-диметилформаміді(178мл) і після охолодження до 0°С додали під азотом гідрид натрію(1,91г, 60% дисперсія маслі) та краплями бензилбромід(3,3мл) і через ЗОхвилин реакція закінчилася, а надлишок гідриду натрію нейтралізували Додали воду та суміш ДВІЧІ екстрагували етилацетатом Випарюванням розчиннику отримали 13,6г сполуки 17 ТШХ Rf = 0,50, толуол/етил ацетат, 1/1 за об'ємом Сполука 18 Сполуку 17 перетворили в сполуку 18 описаним для синтезу сполуки 14 способом ТШХ Rf = 0,68, толуол/етил ацетат, 9/1 за об'ємом Сполука 19 Сполуку 18 перетворили в сполуку 19 описаним для синтезу сполуки 15 способом ТШХ Rf = 0,14, толуол/етил ацетат, 9/1 за об'ємом Сполука 20 Сполуку 19 перетворили в сполуку 20 описаним для синтезу сполуки 16 способом ТШХ Rf = 0,38, толуол/етил ацетат, 85/15 за об'ємом Сполука 21 Сполуку 20(9,9г) розчинили в сухому метанолі(ЗООмл) і під азотом гріли під зворотним холодильником та краплями додавали 0,1 М розчин метоксиду натрію(65,2мл) і перемішували протягом Згодин, потім охолоджували до кімнатної температури та додавали 0,1 М розчин гідроксиду натрію(22,2мл) і перемішували протягом 1,5годин, нейтралізували Dowex50WX8H+-form та випарюванням розчиннику отримали сирий залишок Додали під азотом N,Nдиметилформамід(192мл) та порошок молекулярних сит(0,4нм), а потім КНСОз(3,2г) та бензилбромід (4,8мл) і перемішували протягом 5годин, після чого додавали етилацетат і промивали суміш водою, випарюванням розчиннику та очисткою сирого продукту хроматографією на силікагелі отримали 6,19г сполуки 21 та повернули 1,88г сполуки 20 ТШХ Rf = 0,74, дихлорметан/метанол, 9/1 за 49089 об'ємом Сполука 22 Сполуку 21 (6,2г) розчинили в дюксані(263мл), додали левулінову кислоту(2,1г), дициклогексилкарбодммід(3,75г) та 4диметиламшопіридин(0,2г) і перемішували під азотом протягом 2годин Додали ефір і відфільтрували осад Органічний шар промивали водним KHSO4, випарювали і очищали кристалізацією з діетилового ефіру/гептану, отримавши 6,2г сполуки 22 ТШХ Rf = 0,26, дихлорметан/ацетон, 95/5 за об'ємом Сполука 23 Сполуку 22(6,1 г) розчинили під азотом в оцтовому анпдриді(256мл) та охолодили до -20°С Краплями протягом ЗОхвилин додали суміш сульфатної кислоти(4,9мл) в оцтовому анпдриді(49мл) Через бОхвилин додавали ацетат натрію, доки рН не став нейтральним Додали етилацетат та воду Органічний шар випарювали і очищали хроматографією на силікагелі, отримавши 4,2г сполуки 23 ТШХ Rf = 0,63, дихлорметан/ацетон, 9/1 за об'ємом Сполука 24 Сполуку 23(4,2г) розчинили під азотом в тетрапдрофурані(256мл) та додали піперидин(4,1мл) Суміш перемішували при кімнатній температурі протягом ночі Додали етилацетат та промивали 0,5Н пдрохлоридною кислотою Органічний шар випарювали і залишок очищали хроматографією на силікагелі, отримавши 3,2г сполуки 24 ТШХ Rf = 0,33, дихлорметан/етилацетат, 1/1 за об'ємом О-(бензил 2 З-ді-О-метил-4-О-левуліноіл-р-Оглюкопіранозилуронат)-(1—>4)-3-О-ацетил-2-Обензил-6-О-метил-0-глюкопіранозил трихлорацетамідат 25 До розчину сполуки 24(1,59г) в дих-лорметані додали під азотом трихлорацетонітрил(1,1мл) та СБ2СОЗ(72МГ) Через годину перемішування CS2CO3 відфільтрували та випарювали фільтрат і очищали залишок хроматографією на силікагелі, отримавши 1,57г сполуки 25 ТШХ Rf = 0,60, толуол/етил ацетат, 3/7 за об'ємом Синтез тетрасахариду EFGH(cxeMa 4) Сполука 26 Суміш сполук 16(0 530мг) та 25(0 598мг) сушили співвипарюванням з сухим толуолом та розчиняли в сухому дихлорметані(178мл) і додали порошок молекулярних сит(0,4нм), охолодили до -20°С і перемішували протягом ЗОхвилин під азотом До утвореної суспензії додали триметилсиліл трифлуорметансульфонат(15молярних% по відношенню до сполуки 25) і через 10хвилин перемішування додали ЫаНСОз, суміш профільтрували і додали дихлорметан і воду Органічний шар екстрагували, концентрували та сирий продукт очищали хроматографією на силікагелі, отримавши 0,62г сполуки 26 ТШХ Rf = 0,47, толуол/етил ацетат, 3/7 за об'ємом Метил-О-(бензил 2 4-ді-О-метил-р-Оглюкопіранозилуронат)-(1—>4)-О-(3-0-ацетил-2-Обензил-6-О-метил-0-глкжопіранозил)-(1—>4)-(0 10 бензил 2 3-ді-О-метил-а-І_-ідопіранозилуронат(1 -^4)-2-О-бензил 3 б-ді-О-метил-a-Dглюкопіранозид 27 До розчину сполуки 26(0,58г) в піридині додали суміш оцтової кислоти (2,76мл) та пдразин-пдрату(0,32мл) в піридині(2,1мл) Через Эхвилин додали воду та дихлорметан, органічний шар промивали 1Н пдрохлоридною кислотою та водним ЫаНСОз і очищали хроматографією на силікагелі, отримавши 0,27г сполуки 27 ТШХ Rf = 0,45, толуол/етил ацетат, 3/7 за об'ємом Синтез пентасахариду DEFGH(cxeMa 4 + 5) Сполука 29 Суміш сполук 27(0,150мг) та 28(0,76мг) [Ref Bioorgamc&Medicinal Chemistry, vol 2, №11, 1267 1280, 1994] сушили співвипарюванням з сухим толуолом та розчиняли в сухому дихлорметані(7,5мл) і додали під азотом порошок молекулярних сит(0,4нм), охолодили до 20°С і перемішували протягом 20хвилин До утвореної суспензії додали триметилсиліл трифлуорметансульфонат(15молярних% по відношенню до сполуки 28) і через ЗОхвилин перемішування додали водний ЫаНСОз і суміш профільтрували Органічний шар промили водою, концентрували та отриманий сирий продукт очищали хроматографією на силікагелі, отримавши 136мг сполуки 29 ТШХ Rf = 0,33, толуол/етил ацетат, 4/6 за об'ємом Сполука ЗОСполуку 29 розбавили mpemбутанолом(8мл) та водою(1 мл) і додали 122мг 10% паладію на активованому вугіллі та перемішували в атмосфері водню протягом ночі, відфільтровували паладій на активованому вугіллі і концентрували, отримавши 84,5мг сполуки ЗО ТШХ Rf = ,33, етилацетат/піридин/оцтова кислота/вода, 13/7/1 6/4 за об'ємом Сполука 31 Сполуку ЗО розчинили в 0,3Н гідроксиді натрію(5мл) та перемішували протягом Згодин, нейтралізували 0,5Н пдрохлоридною кислотою і концентрували Залишок обезсолювали на колонці Sephadex G25 водою/ацетонітрилом(9/1 за об'ємом) та пропускали крізь коротку колонку Dowex 50WX8H+form та випарювали, отримавши 75,6мг сполуки 31 ТШХ Rf = 0,43, етилацетат/піридин/оцтова кислота/вода, 8/7/1 6/4 за об'ємом Гексанатрійова сіль метил О-(2,3,4-трі-Ометил-6-0-сульфо-а-0-глюкопіранозил)-(1—>4)(2 З-ді-О-метил-р-О-глюкопІранозилуронова кислота)-(1 —>4)-О-(6-О-метил-2 З-ді-О-сульфо-a-Dглюкопіранозил-(1 —>4)-О-(2 З-ді-о-метил-a-LІдопіранозилуронова кислота)-(1 —>4)-3 6-ді-Ометил-2-О-сульфо-а-0-глюкопІранозиду 32 Сполуку 31 (30,6мг) в сухому перегнаному N,Nдиметилформаміді (2,15мл) та додали тріетиламш-сульфотрюксид(120мг) під азотом і перемішували при 55°С протягом ночі Додали суспензію ЫаНСОз у воді та перемішували при кімнатній температурі протягом години і випарювали розчинник Залишок розчиняли у воді і обезсолювали на колонці Sephadex G25 водою/ацетонітрилом(9/1 за об'ємом) та виділений продукт елюювали крізь колонку Dowex 50WX8Na+ 11 водою, отримавши 42,5мг пентасахариду 32 [a] D 2 0 = +56,8(с = 1, вода) ХІМІЧНІ зсуви ненумерованих протонів 5,32, 5.22, 4,97, 4,89 та 4,24 чнм Синтез з прикладу И(сполука 38) Синтез тетрасахариду EFGH(cxeMa 4) Сполука 13 Сполуки 25 та 26 сполучили з утворенням сполуки 33 описаним для синтезу сполуки 26 способом ТШХ Rf = 0,47, толуол/етил ацетат, 3/7 за об'ємом Метил-О(бензил 2 4-ді-О-диметил-р-Оглюкопіранозилуронат) (1—>4)-О-(3-О-ацетил-2-Обензил-6-О-метил-а-0-глюкопіранозил-(1—>4)-0(бензил 2 3-ді-О-метил-а-І_ідопІранозилуронат(1 ->4)-2 3-ді-О-бензил-6-О-метил-а-0глюкопіранозид 34 Сполуку 33 перетворили в сполуку 34 описаним для синтезу сполуки 27 способом ТШХ Rf = 0,39, гептан/етилацетат, 3/7 за об'ємом Синтез пентасахариду 38 DEFGH(cxeMa 4 + 5) Сполука 35 Сполуки 34 та 28 сполучили з утворенням сполуки 35 описаним для синтезу сполуки 29 способом ТШХ Rf = 0,60, толуол/етил ацетат, 3/7 за об'ємом Сполука 36 Сполуку 35 перетворили в сполуку 36 описаним для синтезу сполуки ЗОспособом ТШХ Rf = 0,39, етилацетат/піридин/оцтова кислота/вода, 13/7/1 6/4 за об'ємом Сполука 37 Сполуку 36 перетворили в сполуку 37 описаним для синтезу сполуки 31 способом ТШХ Rf = 0,32, етилацетат/піридин/оцтова кислота/вода, 13/7/1 6/4 за об'ємом Гептанатрійова сіль метил О-(2 3 4-три-Ометил-6-О-сульфо-а-0-глюкопіранозил)-(1—>4)-0(2 З-ді-О-метил-р-О-глюкопіранозилуронова кислота)-(1 —>4)-О-(6-О-метил-2 З-ді-О-сульфо-a-Dглюкопіранозил-(1 —>4)-О-(2 З-ді-О-метил-a-Lідопіранозилуронова кислота)-(1—>4)-6-О-метил2 З-ді-О-сульфо-а-О-глюкопіранозиду 38 Сполуку 37 перетворили в сполуку 38 описаним для синтезу сполуки 32 способом [a] D 2 0 = +53,6(с = 1, вода) ХІМІЧНІ зсуви ненумерованих протонів 5,32, 5.23, 4,99, 4,9 та 4,23 чим Синтез з прикладу ІІІ(сполука 56) Синтез дисахариду GH(cxeMa 1 + 2 ) Сполука 39 Сполуку 2 перетворили в сполуку 39 описаним для синтезу сполуки 11 способом ТШХ Rf = 0,52, дихлорметан/ацетон, 98/2 за об'ємом Сполука 40 Сполуку 39(32,0г) розчинили в 538мл метанолу, додали 157г птолуолсульфонової кислоти та перемішували при кімнатній температурі протягом 1,5годин Після нейтралізації тріетиламіном суміш концентрували та отриманий сирий продукт очищали хроматографією на силікагелі, отримавши 11,9г сполуки 40 ТШХ Rf = 0,56, дихлорметан/метанол, 9/1 за об'ємом Сполука 41 Сполуку 40 перетворили в сполуку 41 описаним для синтезу сполуки 5 способом 49089 12 ТШХ Rf = 0,18, толуол/етил ацетат, 7/3 за об'ємом Сполука 42 Сполуку 41 перетворили в сполуку 42 описаним для синтезу сполуки 24 способом Сполука 43 Сполуку 42 перетворили в сполуку 43 описаним для синтезу сполуки 25 способом Сполука 44 Сполуки 43 та 41 сполучили з утворенням сполуки 35 описаним для синтезу сполуки 26 способом ТШХ Rf = 0,28, толуол/етил ацетат, 6/4 за об'ємом Сполука 45 Сполуку 44 перетворили в сполуку 45 описаним для синтезу сполуки 9 способом ТШХ Rf = 0,09, толуол/етил ацетат, 3/7 за об'ємом Сполука 46 Сполуку 45 перетворили в сполуку 46 описаним для синтезу сполуки 10 способом ТШХ Rf = 0,52, етилацетат Сполука 47 Сполуку 46(10,4г) під азотом розчинили в 102мл сухого піридину, додали суміш 34мл оцтового ангідриду та 102мл сухого піридину і Юмг диметиламшопіридину і перемішували при кімнатній температурі протягом години Суміш концентрували та співвипарювали з сухим толуолом, отримавши 11,9г сполуки 47 ТШХ Rf = 0,50, толуол/етил ацетат, 1/1 за об'ємом Сполука 48 Сполуку 47(11,9г) розчинили в 90мл метанолу, додали 180мг птолуолсульфонової кислоти та перемішували при кімнатній температурі протягом ночі Суміш розбавляли етилацетатом, ДВІЧІ промивали водою та концентрували і отриманий сирий продукт очищали хроматографією на силікагелі, отримавши 6,2г сполуки 48 ТШХ Rf = 0,28, толуол/етил ацетат, 3/7 за об'ємом Сполука 49 Сполуку 48 перетворили в сполуку 49 описаним для синтезу сполуки 15 способом ТШХ Rf = 0,24, дихлорметан/метанол, 9/1 за об'ємом Метил О-(бензил 2-О-ацетил-3-О-метил-а-І_ідопіранозилуронат)-(1 —>4)-2-О-бензил-3 6-О-ді-Ометил-а-О-глюкопІранозид 50 Сполуку 49 перетворили в сполуку 50 описаним для синтезу сполуки 16 способом ТШХ Rf = 0,37, дихлорметан/метанол, 9/1 за об'ємом Синтез тетрасахариду EFGH(cxeMa 4) Сполука 51 Сполуки 25 та 50 сполучили з утворенням сполуки 51 описаним для синтезу сполуки 26 способом ТШХ Rf = 0,37, дихлорметан/метанол, 98/2 за об'ємом Метил-О-(бензил 2 4-ді-О-диметил-р-Оглюкопіранозилуронат)-(1—>4)-О-(3-О-аиетил-2-Обензил-6-О-метил-а-0-глюкопіранозил-(1—>4)-0(бензил 2-О-ацетил-3-О-метил-а-І_ідопіранозилуронат-(1 —>4)-2-О-бензил-3 6-ді-Ометил-а-О-глюкопіранозид 52 Сполуку 51 перетворили в сполуку 52 описаним для синтезу сполуки 27 способом ТШХ Rf = 0,26, дихлорметан/метанол, 98/2 за об'ємом Синтез пентасахариду 56 DEFGH(cxeMa 4 + 5) 13 49089 Сполука 53 Сполуки 52 та 28 сполучили з утворенням сполуки 53 описаним для синтезу сполуки 29 способом ТШХ Rf = 0,63, дихлорметан/метанол, 98/2 за об'ємом Сполука 54 Сполуку 53 перетворили в сполуку 54 описаним для синтезу сполуки ЗО способом ТШХ Rf = 0,51, дихлорметан/метанол, 8/2 за об'ємом Сполука 55 Сполуку 54 перетворили в сполуку 55 описаним для синтезу сполуки 31 способом ТШХ Rf = 0,32, етилацетат/піридин/оцтова кислота/вода, 10/7/1 6/4 за об'ємом Гептанатрійова сіль метил О-(2 3 4-три-Ометил-6-О-сульфо-а-0-глюкопіранозил)-(1—>4)-0(2 З-ді-О-метил-р-О-глюкопіранозилуронова кислота)-(1 —>4)-О-(6-О-метил-2 З-ді-О-сульфо-a-Dглюкопіранозил-(1—>4)-О-(3-О-метил-2-О-сульфоa-L-ідопіранозилуронова кислота)-(1 —>4)-3 6-ді-Ометил-2-О-сульфо-а-0-глюкопіранозиду 56 Сполуку 55 перетворили в сполуку 56 описаним для синтезу сполуки 32 способом [a] D 2 0 = +50,2(с = 1, вода) ХІМІЧНІ зсуви ненумерованих протонів 5,32, 5,29 та 4,89 чнм Синтез з прикладу І\/(сполука 80) Синтез дисахариду EF(cxeMa 6) Сполука 58 Тріетиламш(43мл, ЗООммоль), 4диметиламшопіридин(156мг, 1,3ммоль) та оцтовий ангідрид (23мл, 290ммоль) додали до розчину 57(36,2г, 128ммоль) (Petrom et al ,Austr J Chem , 1988, 41, 91 - 102) в 360мл дихлорметану і через ЗОхвилин послідовно промивали 5% водним KHSO4) водою, насиченим водним МаНСОз, водою та сушили сульфатом натрію Випарюванням одержали сирий 58 ТШХ Rf = 0,41, циклогексан/етилацетат, 3/1 за об'ємом Сполука 59 Етаноламш(4,9мл, 80ммоль) додали при 4°С до розчину сирого 58(11,8г, 32ммоль) в 220мл тетрапдрофурану і через Ібгодин додали при 4°С під аргоном трихлорацетонітрил(65мл, 644ммоль) та К2СОз(8,Зг, 64,4ммоль) При кімнатній температурі через Ібгодин розчин фільтрували та концентрували і очищали хроматографією на колонці, елюент циклогексан/етилацетат (4/1), отримавши 59 з виходом 79% ТШХ Rf = 0,41 циклогексан/етилацетат (4/1) Сполука 61 Розчин триметилсиліл трифлату(0,04М в дихлорметані, 96мл, 3,8ммоль) додали краплями під аргоном до охолодженого(20°С) розчину донорного імідату 59(11,93г, 25ммоль) та акцептору 60(9,2г, 19,8ммоль) (Р І Garreg, H Hultberg, Carbohydr Res , 1961, 93, СЮ) в 190мл дихлорметану з вмістом порошку молекулярних сит(0,4нм) і через ЗОхвилин додали ЫзгСОз, розчин профільтрували, промили водою та сушили сульфатом натрію і концентрували Залишок перекристалізовували з діетилового етеру, отримавши 61 з виходом 82% Т пл 138°С Сполука 62 Натрій(373мг, 0,65ммоль) додали при 4°С до розчину сполуки 61 (1г, 1,3ммоль) в метанолі/дихлорметані(21) (мл) Суміш перемішували при кімнатній температурі протягом 14 години та нейтралізували смолою Dowex 50WX8H+, фільтрували і концентрували, отримавши сирий 62 Сполука 63 Гідрид натрію(40,5мг, 1,56ммоль) додали порціями до охолодженого до 0°С розчину сполуки 62 (950 мг) та йодметану (0,1 мл, 1,55 ммоль) в диметилформаміді (9 мл) Додали через 2 години при кімнатній температурі метанол, вилили суміш у воду і екстрагували етилацетатом, промивали водою, сушили сульфатом натрію і концентрували та очищали хроматографією на колонці, елюент циклогексан/етилацетат(3/1), отримавши чистий 63 з виходом 86%(відносно 62) Тпл 137°C(Et2O) Сполука 64 Розчин 63(1,16г, 1,56ммоль) в 1/3 воді/метанолі(40мл) гріли при 80°С у присутності п-толуолсульфонової кислоти(230мг, 1,56ммоль) Після нейтралізації через Згодний ЫаНСОз суміш концентрували та очищали хроматографією на колонці, елюент циклогексан/ацетон(3/1), отримавши 64 з виходом 89% ТШХ Rf = 0,38 циклогексан/ацетон(2/1) Метил-О(бензил 2,3-ді-О-метил-[3-0глюкопіранозилуронат)-(1—>4)-2 3 6-трі-О-бензилa-D-глюкопіранозид 66 До розчину 64(860мг, 1,56ммоль) в 4мл дихлорметану додали 2,2,6,6тетраметил-1-піперидинілокси(2,3мг), насичений водний розчин МаНСОз(2,5мл), бромід калію(13,5мг) та хлорид тетрабутиламонію (18 мг) і охолодили до 0°С Додали суміш насиченого розчину хлориду натрію (2,6 мл), насиченого розчину МаНСОз(1,4мл) і гіпохлорит натрію(1,ЗМ, 3,2мл), а через годину суміш екстрагували дихлорметаном, промивали водою, сушили сульфатом натрію та випарювали, одержавши сиру кислоту 65, яку обробляли бензилбромідом(1,6мл, 13ммоль)та КНСОз(650мг, 6,5ммоль) Через Ібгодин продукт екстрагували етилацетатом, промивали водою, сушили сульфатом натрію та випарювали, отримавши 66 з виходом 77% Сполука 67 Розчин триметилсиліл трифлату(0,04М в дихлорметані, 1,88мл, 0,075ммоль) додали краплями під аргоном до охолодженого(-20°С) розчину трихлорацетімідату 6-О-ацетил-2,3,4-трі-О-метил-0-глкжопіранози 28(290мг, 0,711 ммоль) (Р Wedterdum et al , Віoorgamc&Medicinal Chemistry, vol2, №11, 1267 1280, 1994) (11,93г, 25ммоль) та акцептору 66(300мг, 0,4ммоль) в 20мл дихлорметану з вмістом порошку молекулярних сит(0,4нм) і через ЗОхвилин додали твердий МаНСОз, розчин профільтрували та концентрували Залишок очищали хроматографією на колонці, елюент толуол/етилацетат(3/1), отримавши чистий 67 з виходом 56% ТШХ Rf = 0,32 толуол/етил ацетат (3/2) Сполука 68 До розчину 67 (201 мг, 0,20 ммоль) в оцтовому ангідриді при -20°С додали суміш сульфатної кислоти(1,59мл, 0,1/1 за об'ємом) в оцтовому ангідриді Через бОхвилин перемішування додавали ацетат натрію(780мг) Додали етилацетат та промили водою, сушили сульфатом натрію та випарювали і очищали хроматографією на колонці, елюент 15 49089 толуол/етилацетат(1/1), отримавши сполуку 68 з виходом 82% ТШХ Rf = 0,32 толуол/етил ацетат (1/1) Сполука 69 До розчину 68(125,4мг) в 5мл тетрапдрофурану додали бензиламш(0,58мл, 5,26ммоль) в оцтовому ангідриді Через 7годин при кімнатній температурі розчин промили 1М пдрохлоридною кислотою, водою, сушили та випарювали і очищали хроматографією на колонці, елюент толуол/етилацетат(3/2), отримавши чисту сполуку 69 з виходом 75% ТШХ Rf = 0,33 толуол/етил ацетат (2/3) О-(6-О-ацетил-2 3,4-трі-О-метил-а-Оглюкопіранозил-(1—>4)-О-(бензил 2 3-дІ-О-метил-рD глюкопіранозилуронат)-(1—>4)-3 6-ді-О-ацетил-2О-бензил-О-глюкопІранозил трихлора\л/етімшат 70 До розчину 69(89,2мг, 0,112ммоль) в 2мл диметилформаміду додали під аргоном трихлораце-тонітрил(0,069мл, 0,675ммоль) та С52СОз(66мг, 0,202ммоль) Через 2години розчин профільтрували та випарювали і залишок очищали хроматографією на колонці, елюент толуол/етилацетат(1/1), отримавши сполуку 70 з виходом 88% ТШХ Rf = 0,44 толуол/етил ацетат (1/1) Синтез дисахариду GH 76(схема 2) Сполука 72 Метоксид натрію(570мг, Юбммоль) додали до розчину 71 (2,5г, 3,53моль) (М Petitou et al, J Med Chem , 1997, 40, 1600 -1607) в 35мл 1/1 метанолу/дихлорметану і через 2години додали до нейтралізації Dowex 50WX8H+ та профільтрували Випарюванням та очисткою хроматографією на колонці, елюент циклогексан/етилацетат(2/1), отримали сполуку 72 з виходом 100% ТШХ Rf = 0,32, циклогексан/етилацетат, 2/1 за об'ємом Сполука 73 Метилйодид(0,41 мл, 6,61 ммоль) додали при 0°С до розчину 72(2г, З.Зммоль) та NaH в 20мл тетрапдрофурану і через 15хвилин продукт екстрагували дихлорметаном та промили розчин водою і сушили сульфатом натрію Випарюванням та очисткою хроматографією на колонці, елюент циклогексан/етилацетат(5/1), отримали чисту сполуку 73 з виходом 89% [а]о+ 12°(с 1, дихлорметан) Сполука 74 Водну трифлуороцтову кислоту(70%, 3,14мл) додали до розчину 73(1,76г, 2,84ммоль) в 16мл дихлорметану і через 50хвилин при кімнатній температурі розчин розбавляли дихлорметаном та промили розчин холодним насиченим водним розчином NaHCG-з, водою і сушили сульфатом натрію Випарюванням та очисткою хроматографією на колонці, елюент дихлорме-тан/ацетон(11/2), отримали сполуку 74 з виходом 88% [а]о + 10°(с 1, дихлорметан) Метил О-(бензил 2 З-ді-О-метил-a-Lідопіранозилуронат)-(1 —>4)-2 6-ді-О-бензил-З-Ометил-а-О-глюкопІранозид 76 До розчину 74(1,39г, 2,4ммоль) в 8мл тетрапдрофурану додали 2,2,6,6-тетраметил-1піперидинілокси(37,4мг), насичений водний розчин МаНСОз(14,4мл), бромід калію(120мг) та хлорид тетрабутиламонію(180мг) і охолодили до 0°С 16 Додали суміш насиченого розчину хлориду натрію(2,8мл), насиченого розчину МаНСОз(1,4мл) і гіпохлорит натрію(1,ЗМ, 3,2мл), а через годину суміш екстрагували дихлорметаном, промивали водою, сушили сульфатом натрію та випарювали, одержавши сиру кислоту 75, яку в 31 мл диметилформаміду обробляли бензилбромідом(2,84мл, 23,9ммоль) та КНСОз(1,2г, 12ммоль) Через 1 бгодин продукт екстрагували етилацетатом, промивали водою, сушили сульфатом натрію та випарювали і очисткою хроматографією на колонці, елюент циклогексан/етилацетат(3/2), отримали сполуку 76 з виходом 78% відносно 74 [а]о + 7,3°(с 1, дихлорметан) Сполука 77 Триметилсиліл трифлат(170мкл, 0,0068ммоль) додали при перемішуванні під аргоном до охолодженого(-20°С) розчину імідату 70(91 мг, 0,097ммоль) та 76(66,2мг, 0,097ммоль) в 2мл дихлорметану з вмістом порошку молекулярних сит(0,4нм) і через ЗОхвилин додали твердий МаНСОз, перемішували протягом ночі, розчин профільтрували, промили водою, висушили та концентрували Залишок очищали хроматографією на колонці, елюент циклогексан/ацетон(2/1), отримавши чистий 67 з виходом 56% ТШХ Rf = 0,32 циклогексан/ацетон(2/1) Октанатрійова сіль метил О-(2 3,4-три-Ометил-6-О-сульфо-а-0-глюкопіранозил)-(1—>4)-0(2 З-ді-О-метил-р-О-глюкопіранозилуронова кислота)-(1^4)-О-(2,3 б-трі-О-сульфо-a-Dглюкопіранозил-(1 —>4)-О-(2 З-ді-О-метил-a-Lідопіранозилуронова кислота)-(1—>4)-3-О-метил2 6-ді-О-сульфо-а-0-глюкопіранозиду 80 Розчин 77(50мг, 0,032ммоль) в диметилформаміді(5мл) перемішували протягом 1 бгодин під слабким током водню у присутності як каталізатору 10% Pd/C(50Mr) Після фільтрування та концентрування розчину одержали сполуку 78 До розчину вищеозначеної сирої сполуки додали водний NaOH(5M, 0,46мл) в 26мл метанолу, а через 5годин додали до нейтрального рН Dowex 50 і після концентрування розчину залишок перенесли на колонку Sephadex G25 і елюювали водою, одержавши концентруванням поєднаних фракцій сиру сполуку 79 Тріетиламш-сульфотрюксид(174мг, 0,96ммоль) додали до розчину сполуки 79 у бмл диметилформаміду та гріли при 55°С протягом 20годин Додали розчинений у воді МаНСОз(О.ЗЗмг) та перенесли на урівноважену з 0,2М NaCI колонку Sephadex G25(1,6x100см) Фракції поєднували, концентрували та обезсолювали на тій же урівноваженій з водою фільтраційній колонці Люфілізацією отримали пентасахарид 80 з виходом 95% відносно 77 [а]о = +49(с = 1, вода) Приклад V біологічна активність сполуки згідно 3 винаходом можна визначити антним аналізом на Ха Активувальний фактор Х(Ха) є фактором коагуляційного каскаду Активність сполуки згідно з винаходом проти Ха визначали спектрофотометричним вимірюванням швидкості викликаного Ха гідролізу хромогенного субстрату 49089 17 s-2222 Цей аналіз активності проти Ха у буферній системі використовували для визначення величини ІК50 тест-сполуки Сполука для порівняння бензамідин Тест-середовище Буфер трометамш-NaCIполіетиленгліколь 6000(TNP) Середовище Буфер TNP Солюбілізацм можна сприяти диметилсульфоксидом, метанолом, етанолом, ацетонітрилом чи mpem-бутанолом з несприятливим впливом чи без нього при концентраціях до 1%(для диметилсульфоксиду)та 2,5%(для інших розчинників) у кінцевій реакційній суміші Виконання Реагенти* 1 Буфер трометамш-NaCI, склад Трометамш (Трис) 6,057г(50ммоль) NaCI 5,844г(100ммоль) Вода до 1л рН доводять до 7,4 при 37°С 10мМ НСІ 2 Буфер TNP поліетиленгліколь 6000 розчиняють у буфері TN у концентрації Зг/л 3 Розчин s-2222 Ампулу є-2222(15мг, Kabi Diagnostica, Sweden) розчиняють в 10мл води, одержуючи концентрацію 1,5мг/мл(2ммоль/л) 4 Розчин Ха Бичачий фактор Ха людини(71 nKat/ампулу, Kabi Diagnostica) розчинили в Юмл буферу TNP та розбавили ЗОмл буферу TNP до концентрації 1,77пКаУмл Розведення повинно бути свіжими Усі використані інгредієнти аналітичної чистоти Для водних розчинів використано ультрачисту воду (Milh-Q якості) Виготовлення розчинів тест-сполук та сполуки для порівняння Тест-сполуки та сполуку для порівняння розчинили у воді Milh-Q у концентрації 10-2моль/л Кожну концентрацію постадійно розбавляли середовищем до концентрацій 10-3, 10-4 та 10-5 моль/л Розбавлення, що використані в аналізі, включаючи вихідний розчин такі 3 10-3, 10-3, 3 10-4, 10-4, 3 10-5, 10-5, 3 10-6 та 10бмоль/л, ВІДПОВІДНО 18 0,025мл розчини тест-сполуки, сполуки для порівняння чи середовища альтернативно переносили піпеткою в комірку мікротитрувального планшету і розбавляли 0,115мл та 0,0165мл буферу TNP, ВІДПОВІДНО Додавали до кожної комірки аліквоти s-2222 по 0,030мл і планшети попередньо нагрівали та шкубували зі струшуванням в 1нкубатор|(Атегэпат) протягом Юхвилин при 37°С Гідроліз s-2222 після попереднього інкубування починали додаванням 0,030мл розчину тромбіну до кожної комірки Планшети шкубували зі струшуванням протягом 30с при 37°С Через 1 хвилину інкубування протягом 90хвилин поглинання кожного зразку вимірювали при 405нм кожні 2хвилини, використовуючи кінетичний мікро-титрувальний зчитувач(Т\л/іпгеасіег plus, Flow Laboratories) Усі дані збирали на персональний комп'ютер IBM, використовуючи LOTUS-MEASURE Для кожної концентрації сполуки(у моль/л) та поглинання при ній будували криву залежності від часу в хвилинах Оцінка результатів Для кожної кінцевої концентрації максимальне поглинання розраховували за кривою на графіку Величину ІК50(кшцева концентрація у мкмоль/л, що викликає 50% інгібування максимального поглинання) розраховували, використовуючи лопстичний трансформаційний аналіз згідно з Hafner et al , (Arzneim -Aorsch /Drug Res , 1977, 27(ll), 1871 - 3) Активність проти фактору Ха Сполука (приклад) 32(1) 38(2) 56(3) 80(4) ІК50(мг/л) 22 12 12 49: R2=R3->CH, Э On B 75: R!=R,= СЩ, R,-Bn OR3 —o_ 8: R=MBn „ „ •M. R=CHj A s O 20 49089 19 H OCHi осн3 23: R«Ac 24: R*H 25: R=Im COn OB " O R OH „ .C, OBn OCH, , бен, OR, OB" Ї9:) 3S; R j - R 2 - C H 3 . Rj»Bn UvO Схема 5 29,33,53 61: R - A c 62: R * H 63: R = C H ; CCHj 32 R,=Rj«=R3«CH3 38: Rf«=Rj=CH3. R 3 -&D 3 " 56 R ^ S O ^ R ^ - R ^ C H , (Example 0 (Example ІЇ) (Examtrieffi) оси. 21 49089 22 ОСИ, У ОСН, оси, П J^OAC ^ г ° ОВл O* B ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 X.OCH
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbohydrate derivatives and pharmaceutical composition thereof
Назва патенту російськоюПроизводные углеводородов и фармацевтическая композиция на их основе
Автори російськоюPetitou, Maurice
МПК / Мітки
МПК: A61K 31/00, A61K 31/7028, A61P 43/00, A61P 7/00, C07H 15/04, C07H 3/00, C07H 11/00, A61K 31/70, A61P 7/02
Мітки: вуглеводів, похідні, основі, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/11-49089-pokhidni-vuglevodiv-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні вуглеводів та фармацевтична композиція на їх основі</a>
Попередній патент: Пристрій для лущення та шліфування зерна
Наступний патент: Спосіб нанесення антифрикційних покрить
Випадковий патент: Теплоакумулююча капсула