Похідні 4-(фенілпіперазинілметил)-бензаміду та їх застосування для лікування болю, тривожності або шлунково-кишкових розладів, спосіб їх одержання та фармацевтична композиція на їх основі
Номер патенту: 77672
Опубліковано: 15.01.2007
Автори: Томас Гудзік, Плобек Ніклас, Браун Віл'ям, Волпоул Крістофер
Формула / Реферат
1. Сполука формули І
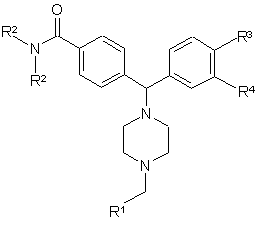 , (I)
, (I)
де
R1 вибирані з будь-якого замісника з групи:
(і) феніл
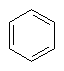 ,
,
(іі) піридиніл
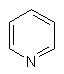 ,
,
(ііі) тієніл
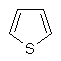 ,
,
(iv) фураніл
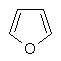 ,
,
(v) імідазоліл
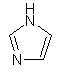 ,
,
(vi) триазоліл
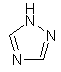 ,
,
(vii) піроліл
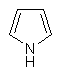 ,
,
(viii) тіазоліл
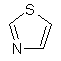 ,
,
(іх) піридил-N-оксид
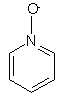 ,
,
де кожне R1 фенільне та R1 гетероароматичне кільце може бути, крім того, необов'язково та незалежно заміщеним 1, 2 або 3 замісниками, вибраними з CF3, метилу, йоду, брому, флуору та хлору,
R2 незалежно вибрано з етилу та ізопропілу;
R3 незалежно вибрано з гідрогену та флуору;
R4 незалежно вибрано з -ОН, -NH2 та -NHSO2R5; а
R5 незалежно вибрано з гідрогену, -CF3 та С1-С6алкілу,
або її солі або окремі її енантіомери та їх солі.
2. Сполука за п. 1, де R1 представляє феніл, піроліл, фураніл, тієніл або імідазоліл; R2 представляє етил або ізопропіл; R3 представляє гідроген або флуор; R4 представляє -NH2 або –NHSO2R5; a R5 представляє С1-С6алкіл.
3. Сполука за п. 1, де R1 представляє феніл, піроліл, фураніл, тієніл або імідазоліл; R2 представляє етил або ізопропіл; R3 представляє гідроген; R4 представляє -NHSO2R5; а R5 представляє С1-С6алкіл.
4. Сполука за п. 1, де гетероароматичні кільця є заміщеними CF3, метилом, йодом, бромом, флуором або хлором.
5. Сполука за п. 1, де гетероароматичні кільця є заміщеними метилом.
6. Сполука за п. 1, вибрана з групи:
4-[1-(4-бензилпіперазин-1-іл)-1-(4-флуор-3-гідроксифеніл)-метил]-N,N-діізопропілбензамід;
4-[1-(4-флуор-3-гідроксифеніл)-1-(4-тіофен-3-ілметилпіперазин-1-іл)-метил]-N,N-діізопропілбензамід;
4{1-(4-флуор-3-гідроксифеніл)-1-[4-(1Н-імідазол-2-ілметил)-піперазин-1-іл]-метил}-N,N-діізопропілбензамід;
4-[1-(3-амінофеніл)-1-(4-бензилпіперазин-1-іл)-метил]-N,N-діізопропілбензамід;
4-[1-(3-амінофеніл)-1-(4-тіофен-3-ілметилпіперазин-1-іл)-метил]-N,N-діізопропілбензамід;
4-{1-(3-амінофеніл)-1-[4-(1Н-імідазол-2-ілметил)-піперазин-1-іл]-метил}-N,N-діізопропілбензамід;
N,N-діізопропіл-4-[1-(3-метансульфоніламінофеніл)-1-(4-тіофен-3-ілметилпіперазин-1-іл)-метил]-бензамід;
4-([4-(3-фурилметил)-1-піперазиніл]{3-[(метилсульфоніл)аміно]феніл}-N,N-діізопропілбензамід;
4-{(3-амінофеніл)[4-(3-тієнілметил)-1-піперазиніл]метил}-N,N-діетилбензамід;
4-[(3-амінофеніл)(4-бензил-1-піперазиніл)метил]-N,N-діетилбензамід та
4-((4-бензил-1-піперазиніл){3-[(метилсульфоніл)аміно]феніл}метил)-N,N-діетилбензамід.
7. Сполука за будь-яким з попередніх пунктів у формі її гідрохлориду, дигідрохлориду, сульфату, тартрату, дитрифлуорацетату або цитрату.
8. Спосіб отримання сполуки формули І, де R4 представляє -ОН, що включає реакцію сполуки загальної формули II
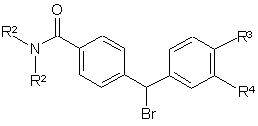 , (II)
, (II)
де R2 та R3 визначені за п. 1, а R4 представляє ОМе, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видалення Вос-захисної групи у стандартних умовах, з отриманням сполуки формули III
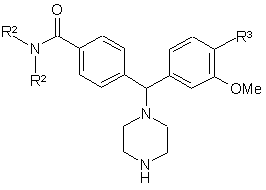 , (III)
, (III)
яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім розщеплення метилового етеру, використовуючи ВВr3 у дихлорметані, з отриманням сполуки формули І, де R4 представляє -ОН.
9. Спосіб отримання сполуки формули І, де R4 представляє –NН2, що включає реакцію сполуки загальної формули IV
 , (IV)
, (IV)
де R2 та R3 визначені за п. 1, a R4 представляє NO2, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видалення Вос-захисної групи у стандартних умовах, з отриманням сполуки формули V
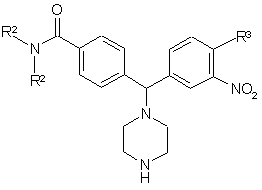 , (V)
, (V)
яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім відновлення нітрогрупи, використовуючи водень та паладій на активованому вугіллі, з отриманням сполуки формули І, де R4 представляє –NH2.
10. Спосіб отримання сполуки формули І, де R4 представляє –NHSO2R5, що включає реакцію сполуки загальної формули VI
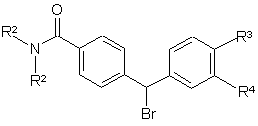 , (VI)
, (VI)
де R2 та R3 визначені за п. 1, а R4 представляє NO2, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім відновлення нітрогрупи гідруванням, використовуючи паладій на активованому вугіллі як каталізатор, метансульфонілування, використовуючи метансульфонілангідрид у дихлорметані у присутності триетиламіну, а далі видалення Вос-захисної групи у стандартних умовах, з отриманням сполуки формули VII
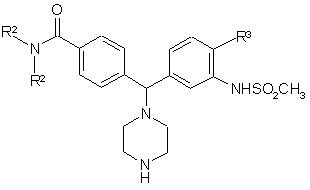 , (VII)
, (VII)
яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім відновлення нітрогрупи, використовуючи водень та паладій на активованому вугіллі, з отриманням сполуки формули І, де R4 представляє –NHSO2R5.
11. Сполука за будь-яким з пп. 1-7 для застосування у терапії.
12. Застосування сполуки формули І за п. 1 для виробництва медикаменту для застосування при лікуванні болю, тривожності, функціональних шлунково-кишкових розладів.
13. Фармацевтична композиція, що містить сполуку формули І за п. 1 як активний інгредієнт разом з фармакологічно та фармацевтично прийнятним носієм.
14. Спосіб лікування болю, при якому суб'єкту, що потребує терапії болю, уводять ефективну кількість сполуки формули І за п. 1.
15. Спосіб лікування функціональних шлунково-кишкових розладів, при якому суб'єкту, що потерпає від вказаного функціонального шлунково-кишкового розладу, уводять ефективну кількість сполуки формули І за п. 1.
Текст
1. Сполука формули І 2 C2 1 3 S N , (іх) піридил-N-оксид 77672 4 8. Спосіб отримання сполуки формули І, де R4 представляє -ОН, що включає реакцію сполуки загальної формули II O O R2 , де кожне R1 фенільне та R1 гетероароматичне кільце може бути, крім того, необов'язково та незалежно заміщеним 1, 2 або 3 замісниками, вибраними з CF3, метилу, йоду, брому, флуору та хлору, R2 незалежно вибрано з етилу та ізопропілу; R3 незалежно вибрано з гідрогену та флуору; R4 незалежно вибрано з -ОН, -NH 2 та -NHSO2R5; а R5 незалежно вибрано з гідрогену, -CF3 та С1С6алкілу, або її солі або окремі її енантіомери та їх солі. 2. Сполука за п.1, де R1 представляє феніл, піроліл, фураніл, тієніл або імідазоліл; R2 представляє етил або ізопропіл; R3 представляє гідроген або флуор; R4 представляє -NH2 або –NHSO2R5; a R5 представляє С 1-С6алкіл. 3. Сполука за п.1, де R1 представляє феніл, піроліл, фураніл, тієніл або імідазоліл; R2 представляє етил або ізопропіл; R3 представляє гідроген; R4 представляє -NHSO2R5; а R5 представляє С 1С6алкіл. 4. Сполука за п.1, де гетероароматичні кільця є заміщеними CF3, метилом, йодом, бромом, флуором або хлором. 5. Сполука за п.1, де гетероароматичні кільця є заміщеними метилом. 6. Сполука за п.1, вибрана з групи: 4-[1-(4-бензилпіперазин-1-іл)-1-(4-флуор-3гідроксифеніл)-метил]-N,N-діізопропілбензамід; 4-[1-(4-флуор-3-гідроксифеніл)-1-(4-тіофен-3ілметилпіперазин-1-іл)-метил]-N,Nдіізопропілбензамід; 4{1-(4-флуор-3-гідроксифеніл)-1-[4-(1Н-імідазол-2ілметил)-піперазин-1-іл]-метил}-N,Nдіізопропілбензамід; 4-[1-(3-амінофеніл)-1-(4-бензилпіперазин-1-іл)метил]-N,N-діізопропілбензамід; 4-[1-(3-амінофеніл)-1-(4-тіофен-3ілметилпіперазин-1-іл)-метил]-N,Nдіізопропілбензамід; 4-{1-(3-амінофеніл)-1-[4-(1Н-імідазол-2-ілметил)піперазин-1-іл]-метил}-N,N-діізопропілбензамід; N,N-діізопропіл-4-[1-(3метансульфоніламінофеніл)-1-(4-тіофен-3ілметилпіперазин-1-іл)-метил]-бензамід; 4-([4-(3-фурилметил)-1-піперазиніл]{3[(метилсульфоніл)аміно]феніл}-N,Nдіізопропілбензамід; 4-{(3-амінофеніл)[4-(3-тієнілметил)-1піперазиніл]метил}-N,N-діетилбензамід; 4-[(3-амінофеніл)(4-бензил-1-піперазиніл)метил]N,N-діетилбензамід та 4-((4-бензил-1-піперазиніл){3[(метилсульфоніл)аміно]феніл}метил)-N,Nдіетилбензамід. 7. Сполука за будь-яким з попередніх пунктів у формі її гідрохлориду, дигідрохлориду, сульфату, тартрату, дитрифлуорацетату або цитрату. R3 N N R2 R4 Br , (II) де R2 та R 3 визначені за п.1, а R4 представляє ОМе, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видалення Вос-захисної групи у стандартних умовах, з отриманням сполуки формули III O R2 R3 N R2 OMe N N H , (III) яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім розщеплення метилового етеру, використовуючи ВВr3 у ди хлорметані, з отриманням сполуки формули І, де R4 представляє -ОН. 9. Спосіб отримання сполуки формули І, де R4 представляє –NН2, що включає реакцію сполуки загальної формули IV O R2 R3 N R2 R4 Br , (IV) де R2 та R3 визначені за п.1, a R 4 представляє NO2, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видалення Вос-захисної групи у стандартних умовах, з отриманням сполуки формули V O R2 R3 N R2 NO2 N N H , (V) яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім відновлення нітрогрупи, використовуючи водень та паладій на активованому вугіллі, з отриманням сполуки формули І, де R4 представляє –NH2. 10. Спосіб отримання сполуки формули І, де R4 представляє –NHSO2R5, що включає реакцію сполуки загальної формули VI O R2 R3 N R2 R4 Br , (VI) де R2 та R 3 визначені за п.1, а R4 представляє NO2, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім відновлення нітрогрупи гідруванням, використовуючи паладій на активованому вугіллі як каталізатор, метансульфонілування, використовуючи метансульфонілангідрид у дихлорметані у 5 77672 6 присутності триетиламіну, а далі видалення Вос12. Застосування сполуки формули І за п.1 для захисної групи у стандартних умовах, з отриманвиробництва медикаменту для застосування при ням сполуки формули VII лікуванні болю, тривожності, функціональних шлуO нково-кишкових розладів. R2 R3 13. Фармацевтична композиція, що містить сполуN ку формули І за п.1 як активний інгредієнт разом з 2 R NHSO2CH3 фармакологічно та фармацевтично прийнятним N носієм. 14. Спосіб лікування болю, при якому суб'єкту, що N потребує терапії болю, уводять ефективну кільH , (VII) кість сполуки формули І за п.1. яку далі алкілують у відновних умовах зі сполукою 15. Спосіб лікування функціональних шлунково1 формули R -CHO, а потім відновлення нітрогрупи, кишкових розладів, при якому суб'єкту, що потервикористовуючи водень та паладій на активовапає від вказаного функціонального шлунковоному вугіллі, з отриманням сполуки формули І, де кишкового розладу, уводять ефективну кількість 4 5 R представляє –NHSO2R . сполуки формули І за п.1. 11. Сполука за будь-яким з пп.1-7 для застосування у терапії. Представлений винахід стосується нових сполук, способу їх отримання, їх застосування та фармацевтичних композицій, що містять нові сполуки. Нові сполуки є корисними у терапії, та зокрема для лікування болю, тривожності та функціональних шлунково-кишкових розладів. Рецептор δ ідентифіковано як такий, що грає роль у багатьох функціях організму, як-то циркуляторна та больова системи. Ліганди для рецептору δ можуть тому знайти потенційне застосування як аналгетики, та/або як антигіпертензивні засоби. Ліганди для рецептору δ також показані як такі, що виявляють імуномодуляторну активність. Ідентифікація щонайменше трьох відмінних сукупностей опіоїдних рецепторів (μ, δ та k) зараз добре встановлена та усі три знайдені у центральній та периферійній нервових системах багатьох видів, включаючи людину. Аналгезію спостережено в різних тваринних моделях при активації одного чи більше цих рецепторів. За кількома винятками, доступні зараз селективні опіоїдні δ-ліганди є пептидними за природою та непридатними для застосування системними шляхами. Одним прикладом непептидного δагоністу є SNC80 [BilskyEJ. et al, Journal of Pharmacology and Experimental Therapeutics, 273(1), pp.359-366 (1995)]. Однак, все ще існує потреба у селективних δ-агоністах, що мають не тільки посилену селективність, але також поліпшений профіль побічної дії. Таким чином, проблемою в основі представленого винаходу було знайти нові аналгетики, що мають посилену аналгетичну дію, але також з поліпшеним профілем побічної дії у порівнянні з μагоністами, а також мають посилену системну ефективність. Аналгетики, які ідентифіковані та існують у попередньому рівні техніки, мають багато недоліків у тому, що вони потерпають від поганої фармакокінетики та не є аналгетиками при застосуванні системними шляхами. Також документовано, що кращі сполуки δ-агоністів, описані у попередньому рівні техніки, показують значну конвульсивну дію при системному застосуванні. Нами виявлено деякі сполуки, що виявляють несподівано посилені властивості, серед іншого посилену δ-агоністичну потужність, потужність in vi vo, фармакокінетику, біозасвоюваність, стабільність in vitro та/або нижчу токсичність. Нові сполуки згідно з представленим винаходом визначені формулою І l де R1 вибирають з будь-чого одного з групи 7 77672 8 флуор; R4 представляє -NHSO2R5; a R5 представляє С1-С6алкіл, де усі втілення від а) до d) можуть, як варіант, бути заміщеними 1 або 2 кращими замісниками на фенільному кільці R1 та гетероароматичному кільці R1. В рамки винаходу включено також окремі енантіомери та солі сполук формули І, включаючи солі енантіомерів. Також в рамках представленого де кожне гетероароматичне кільце R1 може винаходу є суміші окремих енантіомерів, як-то ранеобов'язково та незалежно бути крім того заміцемічні суміші, а також солі сумішей окремих енащеними 1, 2 або 3 замісниками, незалежно вибрантіомерів. ними з лінійного та розгалуженого С 1-С6алкілу, Розділення рацемічних сумішей на окремі галогенованого С1-С6алкілу, NO2, CF3 , С1енантіомери добре відомі у рівні техніки та може С6алкоксилу, хлор у, флуор у, брому та йоду. бути проведеним, наприклад, розділенням на приR2 незалежно вибрано з етилу та ізопропілу; датній хіральній хроматографічній колонці. Отри3 R незалежно вибрано з гідрогену та флуору; мання солей добре відомі у рівні техніки, та може R4 незалежно вибрано з -ОН, -NH2 та бути проведеним, наприклад, змішуванням сполу5 NHSO2R ; a ки формули І у придатному розчиннику з потріб5 R незалежно вибрано з гідрогену, -CF 3 та С1ною протонною кислотою та виділення стандарт2 С6алкілу, за умови, що коли R ' представляє етил, ними засобами у рівні техніки. Солі сполук 1 4 a R представляє гідроген, то R не може бути формули І включають фармацевтично прийнятні ОН. солі, а також фармацевтично неприйнятні солі. Заміщення на фенільному кільці та на гетероНові сполуки з представленого винаходу є коароматичному кільці можуть відбуватися на будьрисними у терапії, особливо для лікування різних якому місці на вказаних кільцевих системах; больових станів, як-то хронічний біль, невропатичКоли фенільне кільце R1 та гетероароматичне ний біль, гострий біль, біль при раку, біль, викли1 кільце R є заміщеними, переважні замісники виканий ревматоїдним артритом, мігрень, вісцеральбирають з будь-чого одного з групи: CF3, метил, ний біль тощо. Цей перелік не слід вважати йод, бром, флуор та хлор, з яких метил є найкравичерпним. щим. Сполуки винаходу є корисними як імуномодуНаступним втіленням представленого винахолятори, особливо для автоімунних хвороб, як-то 1 ду є, таким чином, сполука формули І, де R виартрит, для пересадки шкіри, трансплантації оргазначено вище, а кожне фенільне кільце R1 та гетенів та подібних потреб при хірургії, для колагено1 роароматичне кільце R можуть незалежно бути вих хвороб, різних алергій, для застосування як крім того заміщеними метильною групою; антипухлинних та антивірусних засобів. Наступним втіленням представленого винахоСполуки винаходу є корисними при хворобли1 ду є сполука, представлена на Фіг.1, де R предвих станах де переродження або дисфункція опіоставляє феніл, піроліл, фураніл, тієніл або імідаїдних рецепторів є наявною чи включеною в цю золіл; R2 представляє етил або ізопропіл; R3 парадигму. Це може включати застосування міче4 представляє гідроген або флуор; R представляє ної ізотопами сполуки винаходу у діагностиці та NH2 або -NHSO2R5; a R5 представляє С 1-С6алкіл, застосуваннях для інтраскопії, як-то позитроняк варіант, з 1 або 2 переважними замісниками на емісійної томографії (PET). 1 фенільному кільці R та гетероароматичному кільСполуки винаходу є корисними для лікування 1 ці R . діареї, депресії, тривожності та споріднених зі Додатковим втіленням представленого винастресом розладів, як-то пост-травматичний стрес, ходу є сполука, представлена на Фіг.1, де R1 предпанічний розлад, генералізована тривожність, составляє феніл, піроліл, фураніл, тієніл або імідаціально-побутова фобія, та маніакально2 3 золіл; R представляє етил або ізопропіл; R нав'язливий розлад; неутримання сечі, різні психі4 5 представляє пдроген; R представляє -NHSO2R ; a чні хвороби, кашель, набряк легенів, різні шлункоR5 представляє С 1-С6алкіл, як варіант, з 1 або 2 во-кишкові розлади, наприклад, запор, функціонапереважними замісниками на фенільному кільці R1 льні шлунково-кишкові розлади, як-то синдром 1 та гетероароматичному кільці R . подразненого кишечнику та функціональна диспеІншими втіленнями представленого винаходу псія, хвороба Паркінсона та інші моторні розлади, 1 є сполуки, представлені на Фіг.1, де a) R предстатравматичні поранення мозку, інсульт, захист сер2 вляє феніл, піроліл, або фураніл; R представляє ця після інфаркту міокарду, поранення спини та 3 етил або ізопропіл; R представляє гідроген або фізична залежність від ліків, включаючи лікування 4 1 флуор; a R представляє -NH2, b) R представляє залежності від алкоголю, нікотину, опіоїдів та ін2 тієніл або імідазоліл; R представляє етил або ших ліків та для розладів симпатичної нервової 3 4 ізопропіл; R представляє гідроген або флуор; a R системи, наприклад, гіпертензії. 1 представляє -NH2; с) R представляє феніл, піроСполуки винаходу є корисними як аналгетики 2 ліл, фураніл, тієніл або імідазоліл; R представляє для застосування при загальній анестезії та моні3 етил або ізопропіл; R представляє гідроген або торингу при анестезії. Комбінації засобів з відмінфлуор; R4 представляє -NHSO2R5; a R5 представними властивостями часто використовують для 1 ляє С1-С6алкіл; та d) R представляє феніл, піродосягнення балансу впливів, необхідних для під2 ліл, фураніл, тієніл або імідазоліл; R представляє тримки стану анестезії (наприклад, амнезії, анал3 етил або ізопропіл; R представляє гідроген або гезії, релаксації м'язів та заспокоєння), включени 9 77672 10 ми у цю комбінацію є інгаляційні засоби анестезії, лукою формули R1-CHO, а потім відновленням гіпнотичні засоби, анксіолітики, нейром'язові блонітрогрупи, використовуючи водень та паладій на кератори та опіоїди. активованому вугіллі, отримуючи сполук у формули Також в рамки винаходу включено застосуІ, де R4 представляє -NH2. вання будь-якої сполуки формули І вище, для виОтримання метилсульфонанілідів: робництва медикаменту для лікування будь-якого Приклади 7-8 з обговорених вище станів. Сполуку формули І, де R4 представляє Наступним аспектом винаходу є спосіб лікуNHSO2R5 отримують реакцією сполуки загальної вання суб'єкту, що потерпає від будь-якого з обгоформули VI ворених вище станів, при якому ефективну кількість сполуки формули І вище, уводять пацієнту, Vl що потребує такого лікування. Способи отримання Сполуки представленого винаходу можна де R2 та R3 визначені за п.1 та R4 представляє отримувати, використовуючи наступний загальний NO2, з Вос-піперазином в ацетонітрилі у присутноспосіб. сті триетиламіну у стандартних умовах, а потім Отримання фенолів: відновленням нітрогрупи гідруванням, використоПриклади 1-3 вуючи паладій на активованому вугіллі як каталіСполуки формули І, де R4 представляє -ОН, затор, метансульфонілуванням, використовуючи отримують реакцією сполуки загальної формули II метансульфонілангідрид у дихлорметані у присутності триетиламіну, та далі видаленням Восзахисної групи у стандартних умовах, отримуючи ll сполуку формули VII де R2 та R 3 визначені на Фіг.1, a R4 представляє ОМе, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видаленням Вос-захисної групи у стандартних умовах, о тримуючи сполуку формули III Іll яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім розщепленням метилового етеру, використовуючи ВВr3 у ди хлорметані, отримуючи сполуку формули І, де R4 представляє -ОН. Отримання анілінів; Приклади 4-6 Сполуку формули І, де R4 представляє -NH2 отримують реакцією сполуки загальної формули IV lV 2 3 4 де R та R визначені на Фіг.1, a R представляє NO2, з Вос-піперазином в ацетонітрилі у присутності триетиламіну у стандартних умовах, а потім видалення Вос-захисної групи у стандартних умовах, отримуючи сполуку формули V V яку далі алкілують у відновних умовах зі спо Vll яку далі алкілують у відновних умовах зі сполукою формули R1-CHO, а потім відновленням нітрогрупи, використовуючи водень та паладій на активованому вугіллі, отримуючи сполук у формули І, де R4 представляє -NHSO2R 5. В рамки винаходу включено також окремі енантіомери та солі сполук формули І, включаючи солі енантіомерів. Сполуки формули І є хіральними сполуками, з діарилметилпіперазиновою групою, що є стереогенічним центром, дивись Фіг.1 нижче. I* Наступним втіленням представленого винаходу є таким чином (-)-енантіомер сполуки формули І, а також сіль вказаної сполуки. Наступним втіленням представленого винаходу є таким чином (+)-енантіомер сполуки формули І, а також сіль вказаної сполуки. Приклади Винахід далі детальніше описано нижченаведеними прикладами, які не обмежують винахід. 11 77672 12 мін (0,20мл, 1,4ммоль) розчиняли у MeCN (10мл). Схема 1: Отримання флуорфенолів; ПриклаБензибромід (0,14мл, 1,1ммоль) додавали з переди 1-3 мішуванням при 25°С. Після 12 годин розчин концентрували та очищали обернено-фазовою хроматографією (LiChroprep RP-18,10-80% MeCN у вод, 0,1% TFA). 0,53г вільної основи отримали після екстрагування СН 2СІ2/K2СО4 (водн.), сушки (K2СО4) та випарювання у вакуумі. Обробка трибромідом бору (4екв., 1М розчин у СН 2СІ2) у СН2СІ2 при -78°С, додавання води, концентрація у вакуумі та обернено-фазова хроматографія дали Приклад 1 як трифлуорацетат (0,35г, 50%). МС (ЕР) 504,22 (МН+). ІЧ (NaCI) 3222, 1677,1592, 1454,1346,1201,1135 (см -1). 1 Н ЯМР (CD3OD) δ=1,1, 1,5 (m, 12Н), 2,3 (m, 3Н), 2,9-3,8 (m, 7Н), 4,33 (s, 2H),4,75 (s, 1 Η), 6,60 (m, 1 Η), 6,83 (m, 1 Η), 6,94 (m, 1 Η), 7,24 (d, J=8Гц, 2Н), 7,47 (m, 7H). Аналіз, розраховано для C31H38FN 3O2 ´0,8C4H2F 6O4C:59,87, H:5,82, N:6,12. Виявлено С: 60,06, Н: 5,83, N: 6,19. Приклад 2: 4-[1-(4-Флуор-3-гідрокси-феніл)-1(4-тіофен-3-ілметил-піпеоазин-1-іл)-метил]-Ν,ΝІнтермедіат 1: 4-[(4-флуор-3діізопропілбензамід. метоксифеніл)(гідрокси)метил]-N,N-діізопропілІнтермедіат 2 (0,43г, 1,0ммоль) розчиняли у бензамід. МеОН (5мл) з 3-тіофен-карбоксальдегідом N,N-Діізопропіл-4-йодбензамід (6,0г, 18ммоль) (0,11мл, 1,2ммоль) та НОАс (57мкл, 1,0ммоль) та розчиняли у тетрагідрофурані (200мл) та охолоперемішували протягом 1 години. Ціаноборогідрид джували до -78°С під азотом. H-BuLi (14мл, 1,3Μ натрію (63мг, 1,0ммоль) додавали порціями протярозчин у гексан, 18ммоль) додавали краплями гом 6 годин та реакційну суміші перемішували при протягом 10 хвилин при -65 - -78°С. 4-флуор-325°С ще 12 годин перед обробкою концентрацією метоксибензальдегід (2,8г, 18ммоль) додавали у вакуумі та екстрагуванням (дихлорметан/K2СО3 краплями у розчині у тетрагідрофурані (5мл). (водн))). Очистка обернено-фазовою хроматограNH4CI (водн.) додавали після 30 хвилин. Після фією як у прикладі 1, дала 0,32г (0,62ммоль) як концентрації у вакуумі, екстрагування сумішшю вільну основу. Обробка трибромідом бору як у ЕtOАс/вода, сушки сульфатом магнію та випарюприкладі 1 та хроматографія дали Приклад 2 вання органічної фази залишок очищали хромато(0,20г, 26%) як трифлуорацетат. графією на силікагелі (0-75% ЕtOАс/гептан), отриМС (ЕР) 510,17 (МН+). муючи потрібний продукт (3,9г, 60%). ІЧ (NaCI) 3281, 1674, 1606, 1454, 1346, 1200, 1 Н ЯМР (CDCI3) δ 1,0-1,6 (гл, 12Н), 2,65 (d, 1135 (см -1). 1 J=4Гц, 1H), 3,4-3,9 (m, 2Н), 3,80 (8, 3Н), 6,10 (d, Н ЯМР (CD3OD) δ=1,1, 1,5 (m, 12Н), 2,30 (m, J=4Гц, 1Н), 6,76 (m, 1H), 6,95 (m, 1H), 7,04 (m, 1H), 2Н), 2,9-3,7 (m, 10Н), 4,37 (s, 2H), 4,75 (s, 1H), 6,60 6,76 (m, 1H), 7,25, 7,40 (2d, J=7,5Гц, 4Н). (m, 1H), 6,84 (m, 1H), 6,94 (m, 1H), 7,18 (m, 1H), Інтермедіат 2: 4-[(4-флуор-3-метоксиФеніл)(17,25, 7,48 (2.d, J=8,0Гц, 4Н), 7,55 (m, 1H),7,65(m, піперазиніл)метил]-N,N-діізопропілбензамід. 1H). Інтермедіат 1 (3,9г, 11ммоль) розчиняли у суАналіз, розраховано для C29H36FN2O2S´0,8 хому ди хлорметані (50мл) та обробляли SOBr2 C4H2F6O 4´х0,5 Н 2О, С:55,16, Н:5,55, N:5,99. (0,88мл, 11ммоль) при 0 до 25°С протягом 30 хвиВиявлено, С:55,12, Н:5,39, N:6,07. лин. Нейтралізація KНСО4 (водн.) та сушка Приклад 3: 4-{1-(4-флуор-3-гідрокси-феніл)-1(K2СО4) органічної фази супроводжували випарю[4-(1Н-імідазол-2-ілметил)-піперазин-1-іл]-метил}ванням розчиннику у вакуумі. Залишок та Et3N N,N-діізопропіл-бензамід. (1,8мл, 13ммоль) розчиняли у MeCN (50мл) та Застосовуючи той же спосіб, як у прикладі 2 перемішували з Вос-піперазином (2,1г, 11ммоль) реакція з 2-імідазол-карбоксальдегідом (0,10г, при 25°С протягом 12 годин. Концентрація у ваку1,1ммоль), а потім обробка трибромідом бору умі та хроматографія на силікагелі (0 до 50%(6екв.) дали Приклад 3 (0,18г, 25%) як трифлуораЕtOАс у гептані) дали 4,6г. 1,6г обробляли TFA у цетат. СН2СІ2 (1:1), концентрували у вакуумі, екстрагуваМС (ЕР) 494,23 (МН+). ли СН2СІ2/K2СО4 (водн.), сушили (K2СО4) та випаlЧ (NaCI) 3123, 1673,1592, 1454, 1350, 1201, рювали у вакуумі, отримуючи Ін термедіат 2 (1,3г, 1135 (см -1). 81% від інтермедіату 1). 1 Н ЯМР (CD3OD) δ=1,1,1,5 (m, 12Н), 2,7-3,8 (m, МС (ЕР) 428,21 (МН+). 10Н), 3,95 (s, 2H), 5,20 (m, 1H), 6,70 (m, 1H), 6,94 Приклад 1: 4-[1-(4-Бензил-піперазин-1-іл)-1-(4(m, 1H), 7,02 (m, 1H), 7,32, 7,58 (2d, J=8,0Гц, 4Н), флуор-3-гідрокси-феніл)-метил]-N,N-діізопропіл7,46 (s, 1H). бензамід. Аналіз, розраховано для C28H36FN5O2 ´1,2 Інтермедіат 2 (0,41г, 0,96ммоль) та триетилаC4H2F6O 4´0,7 Н 2О, С:50,51, Н:5,14, N:8,98. 13 Виявлено, C:50,44, H:5,18, N:9,11. Схема 2: Отримання анілінів; Приклади 4-6 77672 14 2,0ммоль) протягом 12 годин. Очистка оберненофазовою хроматографією, використовуючи такі ж умови, як у прикладі 1, дали Приклад 5 (0,13г, 20%) як дитрифлуорацетат. МС (ЕР) 491,28 (МН+). ІЧ (NaCI) 3408, 1673,1605, 1455, 1345, 1201,1134 (см -1). 1 Н ЯМР (CD3OD) δ=1,1, 1,5 (m, 12Н), 2,3 (m, 2H), 2,9-3,8 (m, 8H), 4,35 (s, 2H), 4,44 (s, 1H), 6,98 (m, 1Н), 7,16-7,32 (m, 6Н), 7,49 (d, J=8Гц, 2Н), 7,55 (m, 1H), 7,64 (m, 1H). Аналіз, розраховано для C29H38N4OS´1,3 C4H2F6O 4´0,6 H 2O, C:51,48, H:5,28, N:7,02. Виявлено, C:51,51, H:5,20, N:7,01. Приклад 6: 4-{1-(3-Аміно-феніл)-1-[4-[1Німідазол-2-ілметил)-піперазин-1-іл]-метил}-N,Nдіізопропіл-бензамід. Застосовуючи той же спосіб, як у прикладі 2, реакція інтермедіату 4 з 2-імідазолкарбоксальдегідом (0,10г, 1,1ммоль), а потім гідрування дали Приклад 6 (45мг, 7%) як дитрифлуорацетат МС (ЕР) 475,30 (МН+). Інтермедіат 3: 4-[Гідрокси(3-нітроФеніл)метил]ІЧ (2´TFA, NaCI) 3351, 1674, 1621, 1455, 1349, N,N-діізопропілбензамід. 1202, 1134 (см-1). Спосіб, як для інтермедіату 1, але після дода1 H ЯМР (2´TFA, CD3OD) δ=1,1, 1,5 (m, 12H), вання н-BuLi розчин канюлювали у розчин 32,9-3,8 (m, 8H), 4,35 (s, 2H), 4,44 (s, 1H), 6,98 (m, нітробензальдегіду (2,7г, 18ммоль) у толуо1H), 7,16-7,32 (m, 6H), 7,49 (d, J= 8Гц, 2H), 7,55 (m, лі/тетрагідрофурані (приблизно 1:1,100мл) при 1H), 7,64 (m, 1H). 78°С. Обробка та хроматографія дали інтермедіат Аналіз, розраховано для С 28Н38N6О´1,6 3 (2,4г, 37%). C4H2F6O 4´0,8 Η 2Ο, С:48,39, Н:5,05, Ν:9,84. 1 Н ЯМР (CDCI3) δ 1,1-1,7 (m, 12H), 3,90 (d, Виявлено, С:48,43, Н:5,06, N1:9,85. J=3,5Гц, 1Н), 3,4-3,9 (m, 2H), 5,91 (s, J=3,5Гц, 1H), Схема 3: Отримання метилсульфонанілідів; 7,27, 7,35 (2d, J=8Гц, 4H), 7,51 (m, 1H), 7,71 (m, Приклади 7-8 1H), 8,13 (m, 1H), 8,30 (s, 1H). Інтермедіат 4: N,N-діізопропіл-4-[(3нітрофеніл)(1-піперазиніл)метил]бензамід Застосовуючи той же спосіб, як для інтермедіату 2, інтермедіат 3 (2,4г, 6,7ммоль) дав Восзахищений інтермедіат 4 (2,83г, 81%). Обробка TFA кількісно дала інтермедіат 4, МС (ЕР) 425,23 (МН+). Приклад 4: 4-[1-(3-Аміно-Феніл)-1-(4-бензилпіперазин-1-іл)-метил]-N,N-діізопропіл-бензамід. Реакцію 7 (0,40г, 0,94ммоль) з бензибромідом як у прикладі 1 супроводжували гщруванням (Н2, 40фунт/кв.дюйм) з 10% Pd/C (50мг) у ЕtOН (25мл) та 2Η НСІ (1,2мл, 2,4ммоль) протягом 2 годин. Очистка обернено-фазовою хроматографією, використовуючи ті ж умови, як у прикладі 1, дали Приклад 4 (0,20г, 30%) як трифлуорацетат. МС (ЕР) 485,40 (МН+). ІЧ (NaCI) 3414, 1673, 1605, 1455, 1345, 1201, 1134 (см -1). 1Н ЯМР (CD3OD) δ=1,1,1,5 (m, 12Н), 2,3 (m, 2H), 2,9-3,8 (m, 8H), 4,31 (s, 2H), 4,47 (s, 1H), 7,02 (m, 1H), 7,21-7,52 (m, 12H). Аналіз, розраховано для С 31Н40N4О´1,2 C4H2F6O 4´0,5 Н 2O, С:56,04, Н:5,70, N-7,30. Виявлено, С:56,06, Н:5,67, N1:7,41. Приклад 5: 4-[1-(3-Амiно-фенiл)-1-(4-тіофен-3ілметил-піперазин-1-іл)-метил]-N,N-діізопропілбензамід. Реакцію інтермедіату 4 (0,40г, 0,94ммоль) з 3тіофен-карбоксальдегідом, як у прикладі 2, супроводжували гідруванням (Н2, 30фунт/кв.дюйм) з 10% Pd/C (50мг) у ЕtOН (25мл) та 2Η НСІ (1,0мл, Інтермедіат 5: N,N-діізопропіл-4-[{3[(метилсульфоніл)аміно]феніл}(1піперазиніл)метил]бензамід. Інтермедіат 3 дав Вос-захищений Інтермедіат 4, як описано для інтермедіату 4 ви ще. Восзахищений Інтермедіат 4 (1,21г, 2,3ммоль) гідрували воднем при 30фунт/кв.дюйм з 10% Pd/C (150мг) у АсОН (25мл) протягом 12 годин. Випарювання у вакуумі та екстрагування з СН2СІ2/K2СО 4 (водн.) дали 1,1г (2,3ммоль) інтермедіатний анілін, який розчиняли у MeCN/CH2CI2 (1:1,10мл). Et3N (0,48мл, 3,4ммоль), далі метансульфонілангідрид (0,41г, 2,4ммоль) додавали при 15 77672 16 0°С. Після нагрівання до кімнатної температури (0,40мл, 4,3ммоль) та MeОАс (60мкл, 1,0ммоль) та реакційну суміш обробляли екстрагуванням перемішували протягом 1 години. Ціаноборогідрид СН2СІ2/розсолом. Очистка хроматографією на синатрію (135мг, 2,1ммоль) додавали порціями пролікагелі (0-5% МеОН/СН2СІ2) дали Вос-захищений тягом 6годин та реакційну суміші перемішували Інтермедіат 5 (1,3г, 97%). Обробка TFA у СН2СІ2 при 25°С ще 12 годин перед обробкою концентракількісно дала Інтермедіат 5. цією у вакуумі та екстрагуванням (дихлормеМС (ЕР) 473,16 (МН+). тан/K2СO3 (водн)). Очистка хроматографією на Приклад 7: N,N-Діізопропіл-4-[1-(3силікагелі дала 3-тієнілметильне похідне (0,45г, метансульфоніламіно-феніл)-1-(4-тіофен-343%). Гідрування продукту (0,30г, 0,61ммоль) та ілметил-піперазин-1-іл)-метил]-бензамід. обернено-фазова хроматографія дали заголовну Спосіб відновного амінування як у прикладі 2. сполуку (0,17г, 35%) як трис-трифлуорацетат. Інтермедіат 5 (0,20г, 0,43ммоль) дав Приклад 7 МС (ЕР) 463,34 (МН+). (90мг, 26%) як дитрифлуорацетат. Дигідрохлорид ІЧ (NaCI) 3418, 1673, 1600, 1461, 1200, 1135 отримали після екстрагування вільної основи (см -1). 1 СH2Сl2/K2СО4 (водн.) та обробки 2екв. НСІ (водн.). Н ЯМР (CD3OD) δ=1,17, 1,31 (m, 6H), 2,45 (m, МС (ЕР) 569,21 (МН+). 2H), 3,11 (m, 2H), 3,24-3,66 (m, 10 годин), 4,47 (s, ІЧ (вільна основа, NaCI) 1604, 1455, 1340, 2Н), 4,62 (s, 1Н), 7,21 (m, 1Н), 7,31 (m, 1Н), 7,391151 (см -1). 7,56 (m, 5Н), 7,61-7,68 (m, 3Н), 7,77 (m, 1Н). 1 Н ЯМР (вільна основа, CDCI3) δ=0,9-1,7 (m, Приклад 10: 4-[(3-амінофеніл)(4-бензил-112Н), 2,5 (m, 8Н), 2,85 (s, 3Н), 3,55 (s, 2H), 3,8 (m, піперазиніл)метил]-N,N-діетилбензамід. 2H), 4,22 (s, 1H), 7,00-7,40 (m, 12H). N,N-дiетил-4-[(3-Нiтрофенiл)(1пiперазиніл)метил]бензамід (1,7г, 4,3ммоль) та Аналіз, розраховано для C30H40N4O3S2 ´2,6 НСІ, C:54,30, H:6,47, N:8,44. триетиламін (1,2мл, 8,6ммоль) розчиняли у MeCN (10мл). Бензибромід (0,56мл, 4,7ммоль) додавали Виявлено, С:54,33, Н:6,20, N:8,32. з перемішуванням при 25°С. Після 12 годин розчин Приклад 8: 4-[(4-[З-фурилметил)-1концентрували у вакуумі. Екстрагування (дихлорпіперазиніл]{3-[(метилсульфоніл)аміно]феніл}-N,Nметан/K2СО3 (водн)) та очистка хроматографією діізопропіл-бензамід. Застосовуючи той же спосіб, як для інтермедіна силікагелі дали бензилований продукт (1,4г, 2,9ммоль). Гідрування (водень, 40фунт/кв.дюйм) з ату 7, Інтермедіат 5 (0,21г, 0,45ммоль) дав При10% Pd/C (100мг) у ЕtOН (25мл) та 2Η НСІ (2,5мл, клад 8 (80мг, 32%) як вільну основу. 5ммоль) протягом 4 годин, а потім концентрація у МС (ЕР) 553,23 (МН+). вакуумі та обернено-фазова хроматографія дали ІЧ (вільна основа, NaCI) 1604, 1455, 1340, 1151(см -1). заголовну сполуку як трис-трифлуорацетат (0,9г, 1 26%). Н ЯМР (вільна основа, CDCI3) δ=1,0-2,6 (m, МС (ЕР) 457,26 (МН+). 20 Η), 2,91 (s, 3Н), 3,40 (s, 2Н), 4,22 (s, 1 Η), 6,39 ІЧ (NaCI) 3422, 1672, 1603, 1458, 1209, 1133 (s, 1 Η), 7,06-7,42 (m, 11H). (см -1). Аналіз, розраховано для C30H40N4O4S´2,8 НСІ, 1 Н ЯМР (CD3OD) δ=1,1,1,2 (m, 6H), 2,3 (m, 2H), С:55,03, 11:6:59, N:8,56. 2,9-3,6 (m, 10Н), 4,33 (s, 2H), 4,49 (s, 1H), 5,48 (s, Виявлено, С:54,93, Н:5,93, N:8,49. 2Н), 7,01 (m, 1Н), 7,24-7,34 (m, 5Н), 7,47 (m, 5Н), Схема 4: Отримання прикладів 9-11 7,52 (d, J=7,5Гц, 2Н). Приклад 11: 4-((4-бензил-1-піперазиніл){3[(метилсульфоніл)аміно]феніл}метил)-N,Nдіетилбензамід. Продукт з прикладу 10 (0,35г, 0,76ммоль) та триетиламін (0,12мл, 0,84ммоль) розчиняли у MeCN (10мл) та додавали метансульфоновий ангідрид (0,14г, 0,84ммоль) при 0°С. Після перемішування 10 хвилин при 25°С розчин концентрували у вакуумі та очищали оберненофазовою хроматографією, отримуючи заголовну сполуку як біс-трифлуорацетат (0,23г, 40%). МС (ЕР) 535,21 (МН+). ІЧ (NaCI) 3479, 1673, 1604, 1458, 1337, 1200, 1150 (см -1). 1 Н ЯМР (CD3OD) δ=1,18, 1,31 (m, 6Н), 2,41 (m, 2Н), 2,98 (s, 3Н), 3,13 (m, 2H), 3,28-3,65 (m, 8H), 4,44 (s, 2H), 4,57 (s, 1H), 5,57 (d, J=2Гц, 2Н), 7,15 (m, 1H), 7,30 (m, 1H), 7,37 (m, 1H), 7,42 (m, 2H), 7,54-7,60 (m, 6H), 7,63 (m, 2H). Приклад 9: 4-{('3-амiнофенiл([4-(3Фармацевтичні композиції тієнілметил)-1-піперазиніл]метил)-N,NНові сполуки згідно з представленим винаходiетилбензамiд. дом можна вживати перорально, внутрішньом'язоΝ,N-діетил-4-[(3-нітрофеніл)(1во, підшкірно, місцево, інтраназально, інтраперипіперазиніл)метил]бензамід (отримано аналогічно тонально, інтраторакально, внутрішньовенно, інтермедіату (4) у схемі 2) (0,85г, 2,1ммоль) розчиепідурально, інтратекально, інтрацеребровентриняли у МеОН (5мл) з 3-тіофенкарбоксальдегідом кулярно та ін'єкцією у суглоби. 17 77672 18 Переважним шляхом застосування є перорати. Гідрохлориди та сульфа ти є особливо перевальний, внутрішньовенний або внутрішньом'язовий. жними. Дозування залежатиме від шляху застосуванТермін композиція включає рецептур у активня, суворості хвороби, віку та маси пацієнта та ного компоненту з капсулювальним матеріалом як інших факторів, які звичайно приймає до уваги носієм, забезпечуючи капсулу, в якій активний лікар, коли визначає індивідуальний режим та рікомпонент (з іншими носіями чи без них) носієм, вень доз, який є найприйнятнішим для конкретного який є таким чином у поєднанні з ним. Подібно, є пацієнта. включеними облатки. Для отримання фармацевтичних композицій зі Таблетки, порошки, облатки, та капсули можна сполук представленого винаходу, ' інертні, фармазастосовувати як тверді дозовані форми, придатні цевтично прийнятні носії можуть бути твердими для перорального застосування. або рідкими. Тверді форми препаратів включають Рідкі форми композицій включають розчини, порошки, таблетки, гранули, здатні до дисперсії, суспензії та емульсії. Стерильні водні або воднокапсули, облатки, та супозиторії. пропіленгліколеві розчини активних сполук можна Твердим носієм може бути одна чи більше резгадати як приклад рідких препаратів, придатних човин, які можуть також діяти як розріджувачі, для парентерального застосування. Рідкі композиароматизатори, солюбілізатори, лубриканти, суції можна також сформувати у розчині у водноспендувальні засоби, зв'язувальні засоби, або деполіетиленгліколевому розчині. зинтегратори таблеток; ним може також бути капВодні розчини для перорального застосування сулю вальний матеріал. можна отримувати розчиненням активного компоУ порошках носієм є високодисперсний тверненту у воді та додаванням придатних барвників, дий матеріал, який знаходиться у суміші з високоароматизаторів, стабілізаторів та згущувачів, за дисперсним активним компонентом, у таблетках потребою. Водні суспензії для перорального заактивний компонент змішаний з носієм, що має стосування можна виробити диспергуванням висонеобхідні зв'язувальні властивості, у придатній кодисперсного активного компоненту у воді разом пропорції та спресований до бажаного розміру та з в'язким матеріалом, як-то природні синтетичні форми. камеді, смоли, метилцелюлоза, натрійДля отримання композиції супозиторію, низькарбоксиметилцелюлоза та інші суспендувальні коплавкий віск, як-то суміш гліцеридів жирних кисзасоби, що відомі у рівні техніки фармацевтичних лот та масла какао спершу плавлять та диспергукомпозицій. ють в цьому активний інгредієнт, наприклад, Переважно фармацевтичні композиції є у одиперемішуванням. Розплавлену гомогенну суміш ничній дозованій формі. У такій формі композицію далі виливають у форми зручного розміру та даподілено на одиничні дози, що містять прийнятні ють охолонути та затверднути. кількості активного компоненту. Одинична дозоваПридатними носіями є карбонат магнію, стеана форма може бути упакованим препаратом, упарат магнію, тальк, лактоза, цукор, пектин, декковка містить дискретні кількості препаратів, настрин, крохмаль, трагакант, метилцелюлоза, наприклад, пакетовані таблетки, капсули, та порошки трій-карбоксиметилцелюлоза, низькоплавкий віск, у склянках чи ампулах. Одинична дозована форма масло какао, та подібне. може також бути капсулою, облаткою, або таблетСолі включають, але без обмеження, фармакою самою по себе, або нею може бути прийнятне цевтично прийнятні солі. Приклади фармацевтиччисло будь-яких з цих упакованих форм. но прийнятних солей в рамках представленого Біологічна оцінка винаходу включають: ацетат, бензолсульфонат, Модель in vitro. бензоат, гідрокарбонат, гідротартрат, бромід, ацеКультура клітин тат кальцію, камзилат, карбонат, хлорид, цитрат, A. Клітини людини 293S, що експресують клодигідрохлорид, едетат, едизилат, естолат, езилат, новані μ-, δ- та k-рецептори людини та резистентфумарат, глюкаптат, глюконат, глютамат, гліколіаність до неоміцину, вирощували у суспензії при рсанілат, гексилрезорцинат, гідрабамін, гідробро37°С та 5% СО2 у стр ушуваних колбах з вмістом мід, гідрохлорид, гідроксинафтоат, ізетіонат, лакпозбавленого від кальцію середовища DMEM10% тат, лактобіонат, малат, малеат, манделат, FBS (сироватка зародка теляти), 5% BCS, 0,1% мезилат, метилбромід, метилнітрат, метилсульPlutonic F-68, та 600мкг/мл генетицину. фат, мукат, напсилат, нітрат, памоат (ембонат), B. Мозки мишей та щурів зважували та промипантотенат, фосфат/ди фосфат, полігалактуронат, вали в льодяному PBS (з вмістом 2,5мМ EDTA, саліцилат, стеарат, субацетат, сукцинат, сульфат, рН7,4). мозки гомогенізували політроном протягом танат, тартрат, теоклат, триетіодид, бензатин, 15с (миші) або 30с (щури) у льодяному лізисному хлорпрокаїн, холін, діетаноламін, етилендіамін, буфері (50мМ Трис, рН7,0, 2,5мМ EDTA, з фенілмеглумін, прокаїн, солі алюмінію, кальцію, літію, метилсульфонілфлуоридом, доданим безпосеремагнію, калію, натрію, та цинку. дньо перед застосуванням до 0,5М мМ з 0,5 Μ виПриклади фармацевтично неприйнятних сохідного розчину у суміші ДМСО:етанол). лей в рамках представленого винаходу включаОтримання мембран ють: гідройодид, перхлорат та тетрафлуорборат. Клітини гранулювали та ресуспендували у ліФармацевтично неприйнятні солі можуть бути зазісному буфері (50мМ Трис, рН7,0, 2,5мМ EDTA, з стосовуваними внаслідок їх переважних фізичних PMSF, доданим безпосередньо перед застосуванта/або хімічних властивостей, як-то кристалічності. ням до 0,1мМ з 0,1Μ ви хідного розчину у етанолі), Переважними фармацевтично прийнятними інкубували на льоді протягом 15 хвилин, гомогенісолями є гідрохлориди, сульфати та гідротартразували політроном протягом 30с. Суспензію 19 77672 20 центрифугували при 1000g (макс) протягом 10 дини/комірку. хвилин при 4°С. Надосадкову рідину зберігали на Функціональні аналізи льоді та гранули ресуспендували та центрифугуАгоністичну активність сполук вимірюють вивали як перед тим. Надосадкові рідини з обох значенням ступеню, до якого комплекс сполукицентрифугувань поєднували та центрифугували рецептор активує зв'язування GTP з G-білками, до при 46000g (макс) протягом 30 хвилин. Гранули яких приєднуються рецептори. У GTP зв'язування ресуспендували у холодному Трис-буфері (50мМ аналіз, GTPM^S поєднують з тест-сполуки 5. та Трис/СІ, рН7,0) та центрифугували знов. Кінцеві мембрани від клітин HEK-293S, що експресують гранули ресуспендували у мембранному буфері клоновані опіоїдні рецептори людини або з гомо(50мМ Трис, 0,32Μ са хароза, рН7,0). Аліквоти генізованого мозку щурів та мишей. Агоністи сти(1мл) у поліпропіленових туба х заморожували у мулюють зв'язування GTP[g]35S у ци х мембранах. суміші сухий лід/етанол та зберігали при -70°С до Величини ЕK50 та Емакс сполук визначають за кризастосування. Концентрацію білку визначали мовими доза-реакція. Праві зсуви кривої доза-реакція дифікованим аналізом Лоурі з додецилсульфатом дельта-антагоністом налтринадол здійснюють для натрію. перевірки, чи опосередкована агоністична активАналізи зв'язування ність дельта-рецепторами. Мембрани розморожували при 37°С, охолоПроцедура для мозку щурів GTP джували на льоді, тричі пропускали через голку Мембрани мозку щурів розморожують при 25-калібру, та розбавляли буфером для зв'язуван37°С, тричі пропускають через голку 25-калібру із ня (50мМ Трис, 3мМ MgCI2 , 1мг/мл BSA (альбумін затупленим кінцем та розбавляють у буфері для сироватки корови) (Sigma А-7888), рН7,4, який зв'язування (50мМ Гепес, 20мМ NaOH, 100мМ зберігали при 4°С після фільтрації через фільтр NaCI, 1мМ EDTA, 5мМ МgСІ2, рН7,4, Додають сві0,22м, та до якого додали безпосередньо перед жі: 1мМ DTT, 0,1% BSA (альбумін сироватки корозастосуванням 5мкг/мл апротиніну, 10мкМ бестави)). 120мкМ кінцевого GDP додають розбавлентину, 10мкМ дипротину А, без DTT). Аліквоти по нями мембран. Величини ЕК50 та Емакс сполук 100мкл додавали до охолоджених льодом оцінюють за 10-точковими кривими доза-реакція, 12´75мм поліпропіленових туб з вмістом 100мкл отриманими у 300мкл з прийнятною кількістю прийнятного радіоліганду та 100мкл тестованої мембранного білку (20мкг/комірку) та 100000сполуки при різних концентраціях. Загальне (33) та 130000dpm GTPg35S на комірку (0,11-0,14нМ). Оснеспецифічне (НС) зв'язування визначали у відсуновне та максимальне стимульоване зв'язування тності та присутності 10мкМ налоксону відповідно. визначають у відсутності та присутності 3мкМ Туби стр ушували та інкубували при 25°С протягом SNC-80 60-75 хвилин, після чого вміст швидко фільтруваРезультати аналізу ли під вакуумом та промивали приблизно Специфічне зв'язування (С3) було розрахова12мл/тубу льодяного промивочного буферу (50мМ но як 33-НС, а С3 у присутності різних тест-сполук Трис, рН7,0, 3мМ МgСІ2) через фільтри GF/B виражали як процент від контрольного С3. Вели(Whatman) попередньо просочені протягом щочини ІК50 та коефіцієнту Хілла (nн) для лігандів при найменше 2 годин у 0,1% поліетиленіміні. Радіоакзаміщенні специфічно зв'язаного радіоліганду бутивність (dpm), що залишилася на фільтрах, виміли розраховані за планом логіт-трансформації або рювали бета-лічильником після просочення програмами підгонки кривих, як-то Ligand, фільтрів протягом щонайменше 12 годин у мініскGraphPad Prism, SigmaPlot, або ReceptorFit. Велилянках з вмістом 6-7мл сцинтиляційної рідини. чини К1 були розраховані за рівнянням ЧенгаЯкщо аналіз проводять у 96-коміркових глибоких Прусоффа. Значення ± стандартна похибка велипланшетах, фільтрацію проводять на 96чин IК50, К та nн були представлені для тестованих коміркових просочених РЕІ уніфільтрах, які промилігандів у щонайменше трьох кривих заміщення, вали 3´1мл промивочного буферу, та сушили у біологічну активність сполук представленого винашафі при 55°С протягом 2 годин. Фільтр-планшети ходу показано у таблиці 2. підраховували лічильником TopCount (Packard) після додавання 50мкл МС-20 сцинтиляційної ріТаблиця 2 Біологічні результати Пр.№ 1-11 ІК50 0,50-13 HDELTA (нМ) ЕК50 0,32-104 % Емакс 94-106 Досліди рецепторного насичення Величини радіоліганду Кδ визначали проведенням аналізів зв'язування на мембранах клітин з прийнятними радіолігандами при концентрації в межах від 0,2 до 5 разів оціненого Кδ (до 10 разів якщо кількості потрібного радіоліганду є реальними). Специфічне зв'язування радіоліганду виражали у мкмоль/мг мембранного білку. Величини Кδ та Мозок щурів (н М) ЕК50 % Емакc 2,9-867 125-159 Мозок мишей (нМ) ЕК50 % Емакс 4,9-1441 126-154 Вмаксз з окремих експериментів отримали нелінійною підгонкою специфічно зв'язаного (3) проти нМ вільного (В) радіолігандів від окремих згідно з односайтовою моделлю. Визначення Механо-алодинії, використовуючи тестування Вон Фрея Тестування здійснювали між 08:00 та 16:00 годин, використовуючи спосіб, [описаний Chaplan et 21 77672 22 al. (1994)]. Щурів поміщали у клітки з плексигласу Щурам робили ін'єкції (підшкірно, інтраперитона верхній частині дна з дротяної сітки, яка дозвонально, внутрішньовенно або перорально) тестляла доступ до лапи, та давали призвичаїтися речовиною перед тестуванням Вон Фрея, час між протягом 10-15 хвилин. Зоною тестування була застосування тест-сполуки та тестом Вон Фрея середина підошви лівої задньої лапи, виключаючи змінювали залежно від природи тест-сполуки. менш чутливі подушечки лапи. Лапи торкалися Тест Вриттинга ворсинками Вон Фрея серії 8 з логарифмічно зросОцтова кислота викликатиме абдомінальні таючою жорсткістю (0,41, 0,69, 1,20, 2,04, 3,63, скорочення при інтраперитональному уведенні у 5,50, 8,51, та 15,14 грамів; Stoelting, HI, USA). Вормишей у мишей. Це далі поширюватиметься на їх синки Вон Фрея застосовували з-під низу сітчастої тіло у типовій картині. Коли вживають аналгетики, підлоги перпендикулярно поверхні підошви з доцей описаний рух спостерігають рідше та ліки вистатньою силою для виклику слабкого вигону відбирають як потенційний гарний кандидат. носно лапи, та тримали протягом приблизно 6-8с Повний та типовий рефлекс Вриттинга розгляПозитивну реакцію помічали, якщо лапа швидко дають тільки, коли наявні такі елементи: тварина відсмикувалася. Здригування негайно після видане рухається; нижча частина спини слабко пригнілення ворсинок також вважали позитивною реакчена; аспект підошов обох лап є помітним. У цьому цією. Пересунення розглядали як сумнівну реаканалізі сполуки представленого винаходу демонцію, та у таких випадках стимуляцію повторювали. струють значне інгібування реакцій Вриттинга пісПротокол тестування ля перорального дозування 1-100мкмоль/кг. Тварин тестували на післяопераційну добу 1 (і) Отримання розчинів для обробленої FCA гр упи. 50% поріг відсмикуОцтова кислота (АсОН): 120мкл оцтової кисвання визначали використовуючи спосіб Диксона лоти додають до 19,88мл дистильованої води для вверх-вниз (1980). Тестування починали з ворсинотримання кінцевого об'єму 20мл з кінцевою конками 2,04г, у середині серії. Стимули завжди були центрацією 0,6% АсОН. Розчин далі перемішують представленими послідовно, з підвищенням чи зі (при струшуванні) та готують для ін'єкції. зниженням. При відсутності відсмикування лапи і Сполука (ліків): Кожну сполуку отримують та реакції на спочатку вибрані ворсинки, застосовурозчиняють у найпридатнішому носії стандартнивали сильнішу стимуляцію; у випадку відсмикуванми способами. ня лапи, застосовували далі слабшу стимуляцію. (іі) Застосування розчинів Оптимальний розрахунок порогу за цим способом Сполуку (ліків) вживають перорально, інтрапепотребує 6 реакцій у безпосередній близькості ритонально (іп), підшкірно (пш) або внутрішньо50% порогу, а підрахунок цих 6 реакцій починали, венно (вв) при 10мл/кг (приймаючи до уваги сереколи відбувалася перша зміна реакції, наприклад, дню масу тіла мишей) за 20, 30 або 40 хвилин поріг був спочатку перейденим. У випадках де по(згідно з класом сполуки та її характеристиками) роги випадали з меж стимуляції, величини 15,14 до тестування. Коли сполуку вводять центрально: (нормальна чутливість) або 0,41 (максимально інтравентрикулярно (ів) або інтратекально (іт) об'алодинічна) були відповідно встановлені. Утвореєм 5мкл вживають. ну картину позитивних та негативних реакцій таАсОН вживають інтраперитонально (іп) двома булювали використовуючи позначки, етапами при 10мл/кг (приймаючи до уваги середX=відсмикування нема; О=відсмикування , та 50% ню масу тіла мишей) негайно до тестування. поріг відсмикування інтерполювали використовую(ііі) Тестування чи формулу: Тварин (миші) спостерігають протягом 20 хви50% Г ПОРІГ=10(Xf-kδ)/10,000 лин та число випадків (рефлексу Вриттинга) заноде Xf=величина останніх використовуваних товують та компілюють в кінці експерименту. Миворсинок Вон Фрея (логарифмічні одиниці); шей тримають в окремих клітках з контактною k=таблична величина [від Chaplan et al. (1994)] для підстилкою. Загалом 4 миші звичайно спостерігакартини позитивних/негативних реакцій; та ють одночасно: одну контрольну та три з дозою δ=значення різниці між стимуляціями (логарифміліків. чні одиниці). Тут δ=0,224. Для індикацій тривожності та подібних тривоПороги Вон Фрея перетворювали у проценти жності ефективність встановлено у конфліктному максимально можливої дії (% ММД) [згідно з тесті Геллера-Сейфтера на щура х. Chaplan et al. 1994]. Наступне рівняння використоДля індикації функціонального шлункововували для розрахунку % ММД: кишкового розладу ефективність можна встановити аналізом, [описаним Coutinho SV et al, у AmeriПоріг при обробці ліками(г ) - поріг алодинії(г ) ´ 100 %ММД = can Journal of Physiology - Gastrointestinal & Liver Контрольни поріг ( г ) - поріг алодинії(г ) й Physiology. 282(2):G307-16,2002 Feb], на щурах. Застосування тест-речовини Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-(phenyl-piperazinyl-methyl)-benzamide derivatives and use thereof for the treatment of pain, anxiety or gastrointestinal disorders, a process for preparation thereof and a pharmaceutical composition based thereon
Автори англійськоюBrown William, Walpole Christopher, Plobeck Niklas
Назва патенту російськоюПроизводные 4-(фенилпиперазинилметил)-бензамида и их применение для лечения боли, тревожности или желудочно-кишечных расстройств, способ их получения и фармацевтическая композиция на их основе
Автори російськоюБраун Вильям, Волпоул Кристофер, Плобек Никлас
МПК / Мітки
МПК: A61P 29/00, C07D 333/20, C07D 307/66, A61P 25/04, A61P 1/04, A61P 25/22, A61K 31/495, C07D 307/52, C07D 295/155, C07D 233/24, C07D 233/64, A61K 31/496, C07D 295/14
Мітки: фармацевтична, застосування, 4-(фенілпіперазинілметил)-бензаміду, композиція, болю, розладів, одержання, лікування, тривожності, основі, похідні, шлунково-кишкових, спосіб
Код посилання
<a href="https://ua.patents.su/11-77672-pokhidni-4-fenilpiperazinilmetil-benzamidu-ta-kh-zastosuvannya-dlya-likuvannya-bolyu-trivozhnosti-abo-shlunkovo-kishkovikh-rozladiv-sposib-kh-oderzhannya-ta-farmacevtichna-kompozic.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-(фенілпіперазинілметил)-бензаміду та їх застосування для лікування болю, тривожності або шлунково-кишкових розладів, спосіб їх одержання та фармацевтична композиція на їх основі</a>
Попередній патент: Кристалічна форма омепразолу
Наступний патент: Пристрій для визначення зусилля натискання
Випадковий патент: Система випуску відпрацьованих газів двигунів внутрішнього згоряння















