Похідні n-[феніл(піперидин-2-іл)метил]бензаміду, спосіб їх отримання та застосування у терапії
Номер патенту: 78025
Опубліковано: 15.02.2007
Автори: Веронік Корінн, МАРАБУ Бенуа, Севрен Мірей, Естенн-Буту Женев'єв, Медеско Флоран, Маґа Паскаль, Роже П'єр, Дарґазанлі Жіад
Формула / Реферат
1. Сполука, у формі чистого оптичного ізомеру (1R,2R) або (1S,2S), або у формі трео-діастереоізомеру загальної формули (І)
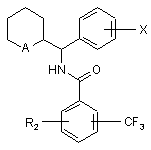 , (I)
, (I)
в якій А представляє
групу загальної формули N-R1, в якій R1 представляє атом гідрогену, лінійний або розгалужений (С1-С7)-алкіл, як варіант, заміщений одним або більше атомами флуору, або (С4-С7)-циклоалкіл, або (С3-С7)-циклоалкіл-(С1-С3)-алкіл, або феніл-( С1-С3)-алкіл, як варіант, заміщений одним або двома гідроксилами або метоксилами, або (С2-С4)-алкеніл, або (С2-С4)-алкініл, або
групу загальної формули N+(O-)R1, в якій R1 визначено вище, або, альтернативно,
групу загальної формули N+(R’)R1, в якій R' представляє лінійний або розгалужений (С1-С7)-алкіл, а R1 визначено вище,
Х представляє атом гідрогену або один чи більше замісників, вибраних з атомів галогенів і трифлуорметилу, лінійного або розгалуженого (С1-С4)-алкілу і (С1-С4)-алкоксилу,
R2 представляє атом гідрогену або один чи більше замісників, вибраних з атомів галогенів і трифлуорметилу, (С1-С4)-алкілу або (С1-С4)-алкоксилу, або аміногруп загальної формули NR3R4, в якій R3 і R4, кожна незалежно, представляє атом гідрогену або (С1-С4)-алкіл, або утворюють разом з атомом нітрогену, зв'язаним із ними, піролідинове, піперидинове або морфолінове кільце, або феніл, як варіант, заміщений атомом або групою, визначеною вище символом X, у вигляді вільної основи або кислотно-адитивної солі.
2. Сполука за п. 1, яка відрізняється тим, що А є групою загальної формули N-R1, в якій R1 є атомом гідрогену;
Х представляє атом гідрогену або один чи більше замісників, вибраних з атомів галогенів і трифлуорметилу, лінійного або розгалуженого (С1-С4)-алкілу і (С1-С4)-алкоксилу;
R2 представляє атом гідрогену або один чи більше замісників, вибраних з атомів галогенів і трифлуорметилу, (С1-С4)-алкілу або (С1-С4)-алкоксилу, або аміногруп загальної формули NR3R4, в якій R3 і R4, кожна незалежно, представляє атом гідрогену або (С1-С4)-алкіл, або утворюють разом з атомом нітрогену, зв'язаним із ними, піролідинове, піперидинове або морфолінове кільце, або феніл, як варіант, заміщений атомом або групою, визначеною вище символом X.
3. Сполука за п. 1, яка відрізняється тим, що А є групою загальної формули NR1, в якій R1 є метильною групою, Х є гідрогеном, R2 - як визначено в п. 1.
4. Сполука за п. 1, яка відрізняється тим, що має конфігурацію (1S, 2S), в якій R2 представляє один або більше атомів галогену або трифлуорметил.
5 Сполука за п. 1, яка відрізняється тим, що має конфігурацію (1R, 2R), в якій R2 представляє атом галогену й аміногрупу загальної формули NR3R4, як визначено в п. 1.
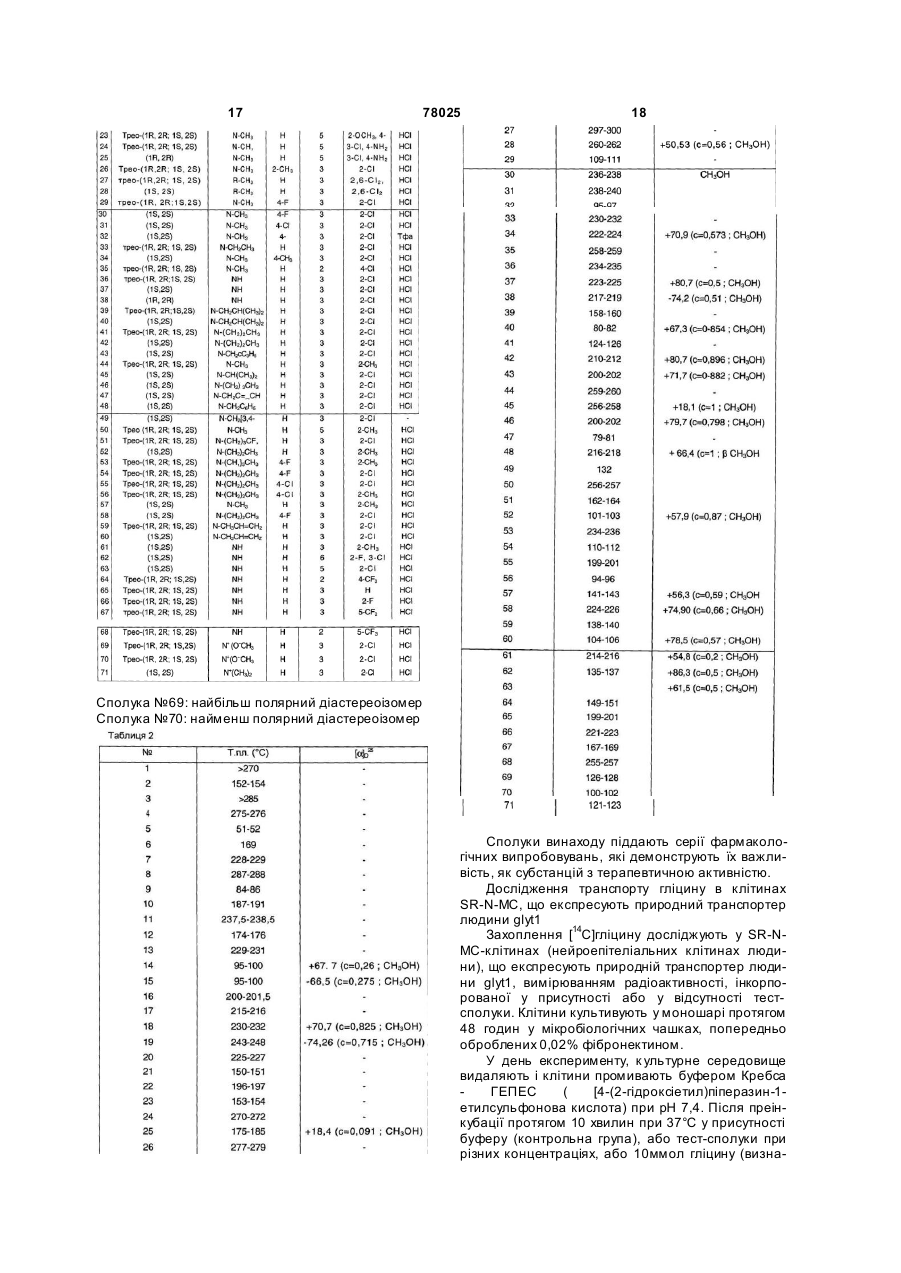
6. Сполука за п. 1, яка відрізняється тим, що її вибрано з групи:
-трео-2-хлор-N-[(1-етилпіперидин-2-іл)фенілметил]-3-трифлуорметилбензамід гідрохлорид;
-трео-2-хлор-N-[(1-етилпіперидин-2-іл) фенілметил]-3-трифлуорметилбензамід;
-2-хлор-N-[(1S)-[(2S)-1-метилпіперидин-2-іл]фенілметил]-3-трифлуорметилбензамід гідрохлорид;
-2-хлор-N-[(1S)-[(2S)-1-метилпіперидин-2-іл]фенілметил]-3-трифлуорметилбензамід;
-трео-4-аміно-3-хлор-n-[(1-метилпіперидин-2-іл)фенілметил]-5-трифлуорметилбензамід гiдрохлорид;
-трео-4-аміно-3-хлор-n-[(1-метилпіперидин-2-іл)фенілметил]-5-трифлуорметилбензамід;
-4-аміно-3-хлор-N-[(1R)-[(2R)-1-метилпіперидин-2-іл]фенілметил]-5-трифлуорметилбензамід гідрохлорид;
-4-аміно-3-хлор-N-(1R)-(2R)-1-метилпіперидин-2-іл]фенілметил]-5-трифлуорметилбензамід;
-трео-2-хлор-N-[феніл(піперидин-2-іл)метил]-3-трифлуорметилбензамід гідрохлорид;
-трео-2-хлор-N-[феніл(піперидин-2-іл)метил]-3-трифлуорметилбензамід;
-2-хлор-N-[(S)-феніл-[(2S)-піперидин-2-іл]метил]-3-(трифлуорметил)бензамід гідрохлорид;
-2-хлор-N-(S)-феніл-[(2S)-піперидин-2-іл]метил]-3-(трифлуорметил)бензамід;
-2-хлop-N-[[1-метил-1-оксидо-піперидин-2-іл](феніл)метил]-3-трифлуорметилбензамід;
-(2S)-2[(1S)-[[2-хлор-3-(трифлуорметил)бензоїл]аміно](феніл)метил]-1,1-диметилпіперидиній йодид.
7. Медикамент, який відрізняється тим, що містить сполуку за будь-яким одним з пп. 1 - 6.
8. Фармацевтична композиція, яка відрізняється тим, що містить сполуку за будь-яким одним з пп. 1 - 6, поєднану з наповнювачем.
9. Застосування сполуки за п. 1 у виробництві лікарського засобу для лікування розладів поведінки, пов'язаних із слабоумством, психозами, шизофренією (неповної та продуктивної форми), для лікування різних форм страху, тривоги, для лікування різних форм депресії, включно з психотичною депресією, для лікування розладів, викликаних зловживанням алкоголю чи відміною алкоголю, розладів статевої поведінки, розладів у споживанні їжі, для лікування мігрені, для лікування гострого та/або хронічного болю, для лікування хвороби Паркінсона, для лікування епілепсії та інших епілептичних синдромів на додаток до іншого протиепілептичного лікування.
Текст
1. Сполука, у формі чистого оптичного ізомеру (1R,2R) або (1S,2S), або у формі треодіастереоізомеру загальної формули (І) ЇХ C2 СПОСІБ UA (54) ПОХІДНІ N-[Ф ЕНІЛ(ПІП ЕРИД ИН-2-ІЛ)МЕТИЛ]БЕНЗАМІДУ, ЗАСТОСУВАННЯ У ТЕРАПІЇ (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 78025 4 рметилу, лінійного або розгалуженого (С1-С4)-2-хлор-N-[(1S)-[(2S)-1-метилпіперидин-2алкілу і (С1-С4)-алкоксилу, іл]фенілметил]-3-трифлуорметилбензамід гідроR2 представляє атом гідрогену або один чи більше хлорид; замісників, вибраних з атомів галогенів і трифлуо-2-хлор-N-[(1S)-[(2S)-1-метилпіперидин-2рметилу, (С1-С4)-алкілу або (С1-С4)-алкоксилу, або іл]фенілметил]-3-трифлуорметилбензамід; аміногруп загальної формули NR3R4, в якій R3 і R4, -трео-4-аміно-3-хлор-n-[(1-метилпіперидин-2кожна незалежно, представляє атом гідрогену або іл)фенілметил]-5-трифлуорметилбензамід (С1-С4)-алкіл, або утворюють разом з атомом нітгiдрохлорид; рогену, зв'язаним із ними, піролідинове, піпериди-трео-4-аміно-3-хлор-n-[(1-метилпіперидин-2нове або морфолінове кільце, або феніл, як варііл)фенілметил]-5-трифлуорметилбензамід; ант, заміщений атомом або групою, визначеною -4-аміно-3-хлор-N-[(1R)-[(2R)-1-метилпіперидин-2вище символом X, у вигляді вільної основи або іл]фенілметил]-5-трифлуорметилбензамід гідрокислотно-адитивної солі. хлорид; 2. Сполука за п. 1, яка відрізняється тим, що А є -4-аміно-3-хлор-N-(1R)-(2R)-1-метилпіперидин-2групою загальної формули N-R1, в якій R1 є атоіл]фенілметил]-5-трифлуорметилбензамід; мом гідрогену; -трео-2-хлор-N-[феніл(піперидин-2-іл)метил]-3Х представляє атом гідрогену або один чи більше трифлуорметилбензамід гідрохлорид; замісників, вибраних з атомів галогенів і трифлуо-трео-2-хлор-N-[феніл(піперидин-2-іл)метил]-3рметилу, лінійного або розгалуженого (С1-С4)трифлуорметилбензамід; алкілу і (С1-С4)-алкоксилу; -2-хлор-N-[(S)-феніл-[(2S)-піперидин-2-іл]метил]-3R2 представляє атом гідрогену або один чи більше (трифлуорметил)бензамід гідрохлорид; замісників, вибраних з атомів галогенів і трифлуо-2-хлор-N-(S)-феніл-[(2S)-піперидин-2-іл]метил]-3рметилу, (С1-С4)-алкілу або (С1-С4)-алкоксилу, або (трифлуорметил)бензамід; аміногруп загальної формули NR3R4, в якій R3 і R4, -2-хлop-N-[[1-метил-1-оксидо-піперидин-2кожна незалежно, представляє атом гідрогену або іл](феніл)метил]-3-трифлуорметилбензамід; (С1-С4)-алкіл, або утворюють разом з атомом ніт-(2S)-2[(1S)-[[2-хлор-3рогену, зв'язаним із ними, піролідинове, піпериди(трифлуорметил)бензоїл]аміно](феніл)метил]-1,1нове або морфолінове кільце, або феніл, як варідиметилпіперидиній йодид. ант, заміщений атомом або групою, визначеною 7. Медикамент, який відрізняється тим, що місвище символом X. тить сполуку за будь-яким одним з пп. 1 - 6. 3. Сполука за п. 1, яка відрізняється тим, що А є 8. Фармацевтична композиція, яка відрізняється групою загальної формули NR1, в якій R1 є метилтим, що містить сполуку за будь-яким одним з ьною групою, Х є гідрогеном, R2 - як визначено в пп. 1 - 6, поєднану з наповнювачем. п. 1. 9. Застосування сполуки за п. 1 у виробництві лі4. Сполука за п. 1, яка відрізняється тим, що має карського засобу для лікування розладів поведінконфігурацію (1S, 2S), в якій R2 представляє один ки, пов'язаних із слабоумством, психозами, шизоабо більше атомів галогену або трифлуорметил. френією (неповної та продуктивної форми), для 5 Сполука за п. 1, яка відрізняється тим, що має лікування різних форм страху, тривоги, для лікуконфігурацію (1R, 2R), в якій R2 представляє атом вання різних форм депресії, включно з психотичгалогену й аміногрупу загальної формули NR3R4, ною депресією, для лікування розладів, викликаяк визначено в п. 1. них зловживанням алкоголю чи відміною 6. Сполука за п. 1, яка відрізняється тим, що її алкоголю, розладів статевої поведінки, розладів у вибрано з групи: споживанні їжі, для лікування мігрені, для лікуван-трео-2-хлор-N-[(1-етилпіперидин-2ня гострого та/або хронічного болю, для лікування іл)фенілметил]-3-трифлуорметилбензамід гідрохвороби Паркінсона, для лікування епілепсії та хлорид; інших епілептичних синдромів на додаток до іншо-трео-2-хлор-N-[(1-етилпіперидин-2-іл) фенілмего протиепілептичного лікування. тил]-3-трифлуорметилбензамід; Сполуки винаходу відповідають загальній формулі (І) в якій А представляє одну з груп загальної формули N-R1t в якій Ri представляє атом гідрогену, або лінійний чи розгалужений (С1-С7)-алкіл, як варіант, заміщений одним або більше атомами флуор у, або (С4-С7)циклоалкіл, або (С3-С7)-циклоалкіл-(С1-С3)-алкіл, або феніл-(С1-С3)-алкіл, як варіант, заміщений одним або двома гідроксилами або метоксилами, або (С2-С4)-алкенілом або (С2-С4)-алкінілом, або групу загальної формули N+(O-)R1 в якій R1 визначено вище, або, альтернативно, групою загальної формули N+(R')R1, де R' представляє лінійний або розгалужений (С1-С7)-алкіл, а R1 визначено вище, X представляє атом гідрогену або один чи бі 5 78025 6 льше замісників, вибраних із атомів галогену і трифлуорметилу, лінійного або розгалуженого (С1С4)-алкілу і (С1-С4)-алкоксилу, R2 представляє атом гідрогену або один або більше замісників, вибраних з атомів галогену і трифлуорметилу, (С1-С4)-алкілу або (С1-С4)алкоксилу, або аміногруп загальної формули NR3R4, в якій R3 і R4 кожна незалежно представляє атом гідрогену або (С1-С4)-алкіл, або складають, зі зв'язаним з ними атомом нітрогену, піролідинове, піперидинове або морфолінове кільце, або феніл, як варіант, заміщений атомом або групою, які визначено вище символом X. Сполуки загальної формули (І) можуть існувати у вигляді трео-рацемату (1R, 2R; 1S, 2S) або у вигляді енантіомерів (1R, 2R) або (1S, 2S); вони Амід Вейнреба формули (IV) реагує з похідним можуть існувати у вигляді вільних основ або кисфеніллітію загальної формули (V), в якій X визналотно-адитивних солей. чено вище, в етерному розчиннику, як-то діетилоСполуки, що мають структур у, аналогічну сповому етері, між -30°С і кімнатною температурою; лукам винаходу, [описані у Патенті США 5254569] одержують кетон загальної формули (VI), який як анальгетики, діуретики, антиконвульсанти, превідновлюють до спирту трео-конфігурації загальної парати для знеболювання, седативні препарати, формули (VII) відновником, як-то K-Selectride® або церебропротектори, у відповідності з механізмом L-Selectride® (три-втор-бутилборогідридом калію дії на опіатні рецептори. Інші сполуки аналогічної або літію), в етері, як-то тетрагідрофуран, між структури, [описані у Патентній заявці ЕР 0499995] 78°С і кімнатною температурою. Карбамат загальяк 5-НТ3 - антагоністи, корисні в лікуванні психічної формули (VII) можна потім відновлювати до них розладів, неврологічних хвороб, шлункових тpeo-N-метиламіноспирту загальної формули (VIII) синдромів, нудоти і блювоти. дією змішаних гідридів, як-то літій-алюміній гідрид, Сполуки винаходу виявляють особливу активв етері, як-то тетрагідрофуран, між кімнатною темність, як специфічні інгібітори гліцинових транспопературою і температурою дефлегмації. Треортерів glyt1 і/або glyt2. спирт загальної формули (VIII) потім конвертують Сполуки, кращі як інгібітори транспортера у трео-інтермедіат загальної формули (II), де R1 glyt1, мають конфігурацію (1S, 2S) з R2, що предпредставляє метил, у два етапи: спиртову функціставляє один або більше атомів галогену або ональну групу спершу перетворюють у відщеплютрифлуорметилів, тим часом сполуки, кращі як вану гр упу, наприклад, у метил-сульфонатну, дією інгібітори транспортеру glyt2, мають конфігураметилсульфонілхлориду, в хлорованому розчинцію(1R, 2R) з R2, що представляє атом галогену і нику, як-то дихлорметан, і у присутності основи, аміногрупу загальної формули NR3R4· як-то триетиламіну, між 0°С і кімнатною темпераСполуки загальної формули (І), в якій А предтурою, і потім відщеплювана група реагує з рідким ставляє груп у загальної формули N-R1, де R1 відаміаком при -50°С у спирті, як-то етанолі, у гермерізняється від атома гідрогену, можуть бути одертичному середовищі, як-то автоклав, між -50°С і жані способом, ілюстрованим подалі схемою 1. кімнатною температурою. Також можливо зняти захист з карбамату загальної формули (VII) за допомогою сильної основи, як-то водного гідроксиду калію, в спирті, як-то метанолі, щоб одержати трео-аміноспирт загальної формули (IX), і потім виконати N-алкілування через галогеноване похідне формули R1Z, де R1 визначено вище, але не є атомом гідрогену, a Z представляє атом галогену, в присутності основи, як-то карбонату калію, в полярному розчиннику, Діамін загальної формули (II), в якій R1 і X вияк-то Ν,Ν-диметилформаміді, між кімнатною темзначені вище (з R1, що не є атомом гідрогену), пературою і 100°С. Одержаний таким чином спирт сполучають з активованою кислотою або з хлоранзагальної формули (X) потім обробляють, як опигідридом загальної формули (III), в якій Υ предстасано для спирту загальної формули (VIII). вляє відщеплювану груп у, як-то атом галогену, a Інший варіант способу, ілюстрований наступR2 визначено вище, використовуючи способи, віною схемою 3, може бути використаний у випадку, домі спеціалістам. де R1 представляє метил і X представляє атом Діамін загальної формули (II) може бути одергідрогену. Піридоксим формули (XI) кватернізують жаний способом, ілюстрованим далі схемою 2. дією метилтрифлуорметилсульфонату в етері, якто діетиловому етері, при кімнатній температурі. Одержану таким чином сіль піридинію формули (XII), потім піддаютьгідрогенізації під атмосферою водню, 7 78025 8 якій А представляє групу загальної формули N-R1 реакцією з алкіл галогенідом загальної формули R'-Z, в якій R' визначено вище, a Z представляє атом галогену, у полярному розчиннику, як-то ацетонітрилі, при температурі між кімнатною температурою і 100°С. Більш того, хіральні сполуки загальної формуу присутності каталізатору, як-то оксиду плали (І), що відповідають енантіомерам (1R, 2R) або тини, в суміші спирту і водної кислоти, як-то ета(1S, 2S) трео-діастереоізомеру, можуть також бути нолу і 1Η гідрохлоридної кислоти. Одержують діаодержані розділенням ра-цематів високоефективмін загальної формули (II), в якій R1 представляє ною рідинною хроматографією (ВЕРХ) на хіральметил і X представляє атом гідрогену, у вигляді ній колонці, або розділенням рацемату аміну загасуміші двох діастереоізомерів трео/еритро 9/1. Із льної формули (II) із застосуванням хіральної нього можливо утворити сіль, наприклад, зі щавкислоти, як-то винної кислоти, камфоросульфонолевою кислотою, і потім утворений оксалат очисвої кислоти, дибензоїлвинної кислоти, Νтити рекристалізацією із суміші спирту і е терного ацетиллейцину, фракційною і вибірковою рекриссольвенту, як-то метанолу і діетилового етеру, талізацією діастереоізомерної солі із спиртового щоб одержати чистий трео-діастереоізомер розчинника, або енантіоселективним синтезом (1R,2R; 1S,2S). згідно зі схемою 2 із застосуванням хірального Сполуки загальної формули (І), в якій А предаміду Вейнреба загальної формули (IV). ставляє груп у загальної формули NR1, де R1 предРацемічний або хіральний амід Вейнреба фоставляє атом гідрогену, можуть бути одержані рмули (IV) може бути одержаний способом, подібспособом, ілюстрованим далі схемою 4 ним [описаному в Eur. J. Med. Chem., 35, (2000), 979-988 і J. Med. Chem., 41, (1998), 591-601]. Феніллітій - сполука загальної формули (V), де X представляє атом гідрогену, є комерційно доступною. її заміщені похідні можуть бути одержані способом, що подібний [описаному у Tetra. Lett., 57, 33, (1996), 5905-5908]. Спосіб, подібний цьому [описано. у Патентній заявці ЕР-0366006]. Амін загальної формули (IX), в якій X представляє атом гідрогену, може бути одержаний у хіральних модифікаціях способом, [описаним у Патенті США Починаючи з аміну загальної формули (XIII), в 2928835]. Наприкінці, амін загальної формули (XIII) якій X визначено вище, сполучення виконують може бути одержаний способом, подібним [описаактивованою кислотою або хлорангідридом, що ному у Chem. Pharm. Bull., 32, 12, (1984), 4893визначено вище, загальної формули (III), способа4906 і Synthesis, (1976), 593-595]. ми, відомими фахівцям, щоб одержати сполуку Кислоти і хлорангідриди загальної формули загальної формули (XIV). Наприкінці, гідрогеніза(III) є комерційно доступні, за виключенням 4цію останнього виконують, наприклад, воднем у аміно-3-хлор-5-трифлуорметилбензойної кислоти. присутності каталізатору, як-то 5% платини на Останню можливо одержати хлоруванням 4-аміновугіллі, в кислотному розчиннику, як-то льодяній 5-трифлуорметилбензойної кислоти сульфурилхоцтовій кислоті, щоб наприкінці отримати сполуку лоридом у хлорованому розчиннику, як-то хлорозагальної формули (І), де R1 представляє атом формі, способом, подібним [описаному у Arzneim. гідрогену. Forsch., 34, IIа, (1984), 1668-1679]. Інший спосіб, згідно зі схемою 2, полягає у виНаступні приклади ілюструють отримання декористанні сполуки загальної формули (І), де R1 кількох сполук винаходу. Елементний мікроаналіз, представляє, як варіант, заміщений фенілметил, і спектри ІЧ, ЯМР і ВЕРХ на хіральній колонці підв знятті захисту з нітрогену піперидинового кільця, тверджують структури і енантіомерну чистоту оденаприклад, за допомогою окиснику або кислоти ржаних сполук. Льюіса, як-то триброміду бору, або гідрогенолізом, Номери, представлені у дужках заголовку приабо алкенілом, краще алілом, а потім зняттям закладу, відповідають номерам у 1-й колонці табли0 хисту комплексом Pd , щоб отримати сполуку заці, наведений пізніше. гальної формули (І), в якій R1 представляє атом У назвах сполуки, штри х "-" складає частину гідрогену. слова, а риска "_" слугує тільки для переносу в Сполуки загальної формули (І), де А предстакінці строки; у разі відсутності переносу, це забовляє груп у загальної формули N+(O-)R1, можуть ронено і не може бути замінено ні звичайним бути одержані зі сполуки загальної формули (І), в штри хом, ні пробілом. якій А представляє групу загальної формули N-R1 Приклад 1 (сполука №33). в якій R1 описано вище, реакцією з окисником, наТрео-2-Хлор-N-[(1-етилпіперидин-2приклад, з 3-хлорбензойною кислотою, у хлороваіл)фенілметил]-3-трифлуорметилбензамід гідроному розчиннику, як-то дихлорметані, при темпехлорид 1:1. ратурі між 0°С і кімнатною температурою. 1.1. 1,1-Диметилетил 2-бензоїлпіперидин-1Сполуки загальної формули (І), в якій А предкарбоксилат + ставляє груп у загальної формули N (R')R1, можуть 8,0г (29,4ммол) 1,1-диметилетил 2-(N-метоксибути одержані зі сполуки загальної формули (І), в N-метилкарбамоїл)піперидин-1-карбоксилату у 9 78025 10 100мл безводного діетилового етеру вводять у силікагелем, елюючи сумішшю дихлорметану і круглодонну колбу на 250мл під атмосферою арметанолу. Одержано 0,8г маслянистої сполуки. гону, середовище охолоджують до -25°С, добав1.5. трео-(1-етилпіперидин-2ляють краплями 16мл (2 9,4ммол) 1,8Μ розчину іл)фенілметиламін. феніллітію у суміші 70/30 циклогексану і діетило0,8г (3,65ммол) трео-(1-етилпіперидин-2вого етеру і перемішують 2 години. іл)фенілметанолу і 0,48мл (3,65ммол) триетиламіПісля гідролізу насиченим водним розчином ну в 20мл безводного дихлорметану вводять у гідроксиду натрію, відокремлюють водну фазу і круглодонну колбу на 100мл, під атмосферою арекстрагують етилацетатом, органічну фазу висугону, суміш охолоджують до 0°С, добавляють шують над сульфатом натрію, фільтрують і фільт0,28мл (3,63ммол) метилсульфонілхлориду і сумірат концентрують під зниженим тиском і залишок ші дають повільно повернутися до кімнатної темочищають хроматографією на колонці з силікагеператури протягом 2 годин і її концентрують під лем, елюючи сумішшю е тилацетату і циклозниженим тиском. гексану. Зріджений аміак вводять у автоклав з магнітОдержують 2г білої твердої речовини. ним перемішуванням, охолоджують до -50°С і до1.2. 1,1-Диметилетил треобавляють одержаний заздалегідь розчин метилсугідрокси(феніл)метил]піперидин-1-карбоксилат. льфонату у 10мл абсолютного етанолу, автоклав 2,0г (6,9ммол) 1,1-диметилетил 2закривають і перемішування підтримують 48 гобензоїлпіперидин-1-карбоксилат у 30мл безводнодин. го діетилового етеру вводять у круглодонну колбу Суміш переносять у круглодонну колбу, її конна 250мл під атмосферою аргону, розчин охолоцентрують під зниженим тиском і залишок очищаджують до -78°С, добавляють краплями 20,7мл ють хроматографією на колонці з силікагелем, (20,7ммол) 1Μ розчину літійтри-вторелюючи сумішшю дихлорметану і метанолу. бутилборогідриду у діетиловому етері і перемішуОдержано 0,3г маслянистої сполуки, яку викоють 3 години. ристовують, як таку, у наступнім етапі. Суміш гідролізують 16мл води і 16мл 35% во1.6. трео-2-Хлор-N(1-етилпіперидин-2дного розчину пероксиду гідрогену, суміші дають іл)фенілметил]-3-трифлуорметилбензамд гідроповернутися до кімнатної температури, перемішухлорид 1:1. ючи протягом 2 годин. 0,3г (1,37ммол) 2-хлор-ЗЇї розбавляють водою і етилацетатом, водну трифлуорметилбензойної кислоти, 0,26г фазу відокремлюють і екстрагують етилацетатом. (1,37ммол) 1-[3-(диметиламіно)пропіл]-3Після промивання об'єднують органічні фази, виетилкарбодііміду і 0,19г (1,37ммол) 1сушують над сульфатом натрію і випаровують гідроксибензотриазолу в 10мл дихлорметану вворозчинник під зниженим тиском, залишок очищадять у круглодонну колбу на 50мл і суміш переміють хроматографією на колонці з силікагелем, шують при кімнатній температурі 30 хвилин. елюючи сумішшю етилацетату і циклогексану. 0,3г (1,37ммол) трео-(1-етилпіперидин-2Одержують 2,0г маслянистого продукту. іл)фенілметиламіну добавляють у кілька мл дих1.3. трео-Феніл(піперидин-2-іл)метанол. лорметану і перемішують 5 годин. Суміш гідроліРозчин 2,0г (6,9ммол) 1,1-диметилетил треозують водою і екстрагують кілька разів дихлорме[гідрокси(феніл)метил]піперидин-1-карбоксилату в таном. Органічні фази після промивання водою і 40мл метанолу поміщають у круглодонну колбу на потім 1Η водним розчином гідроксиду натрію ви250мл, добавляють водний розчин 2г гранул гідросушують над сульфатом магнію, фільтрують і виксиду калію у 20мл вода і суміш нагрівають під паровують розчинник під зниженим тиском, зализворотнім холодильником 2 години. шок очищають хроматографією на колонці з Суміш охолоджують, розчинник випаровують силікагелем, елюючи сумішшю дихлорметану і під зниженим тиском, добавляють воду і екстрагуметанолу. ють кілька разів дихлорметаном. Після промиванОдержують 0,25г маслянистого продукту. ня об'єднаних органічних фаз, висушування над Продукт розчиняють у кількох мл пропан-2сульфатом магнію, фільтрації і випаровування олу, добавляють 5,9мл 0,1Η розчину гідрохлоридрозчиннику під зниженим тиском одержують г білої ної кислоти у пропан-2-олі, суміш концентрують під твердої речовини. зниженим тиском щоб зменшити об'єм розчиннику. Температура плавлення: 172-174°С. Наприкінці, після розтирання, виділяють 0,15г гід1.4. трео-(1-етилпіперидин-2-іл)фенілметанол. рохлориду у ви гляді білої твердої речовини. Розчин 1 г(5,2 ммол) трео-феніл(піперидин-2Температура плавлення: 230-232°С. іл)метанолу в 30мл безводного Ν,ΝПриклад 2 (сполука №18). диметилформаміду вводять у круглодонну колбу 2-Xnop-N-[(1S)-[(2S)-1-метилпіперидин-2на 100мл, добавляють 0,39мл (5,2ммол) броммеіл]фенілметил]-3-трифлуорметилбензамід пдротилу і 0,8г (5,8ммол) карбонату калію, суміш нагріхпорид 1:1. вають при 80°С 2 години, її охолоджують до кімна2.1. 1,1-Диметилетил (2S)-2-бензоїлпіперидинтної температури, гідролізують додаванням води і 1-карбоксилат. екстрагують кілька разів етилацетатом. Після про11,8г (43,3ммол) 1,1-диметилетил (2S)-2-(Nмивання об'єднаних органічних фаз водою і потім метокси-N-метилкарбамоїл)піперидин-1насиченим водним розчином гідроксиду натрію, карбоксилату у 100мл безводного діетилового висушування над сульфатом магнію, фільтрації і етеру вводять у круглодонну колбу на 500мл, під випаровування розчиннику під зниженим тиском атмосферою азоту, середовище охолоджують до залишок очищають хроматографією на колонці з 23°С, добавляють краплями 21,6мл розчину 11 78025 12 (43,2ммол) 1,8Μ феніллітію у суміші 70/30 циклоЗріджений аміак вводять у автоклав з магнітгексану і діетилового етеру, і суміш перемішують ним перемішуванням, охолоджують до -50°С, допри кімнатній температурі 3 години. бавляють розчин одержаного заздалегідь метилПісля гідролізу насиченим водним розчином сульфонату-сирцю у 30 абсолютного етанолу, гідроксиду натрію, водну фазу відокремлюють і автоклав закривають і перемішування підтримують екстрагують етилацетатом. Органічну фазу вису48 годин. шують над сульфатом натрію, фільтрують, концеСуміш переносять у круглодонну колбу і амін нтрують під зниженим тиском і залишок очищають виділяють у вигляді маслянистого продукту, який хроматографією на колонці з силікагелем, елюючи використовують, як такий, у наступнім етапі. сумішшю етилацетату і циклогексану. 2.5. 2-Хлор-N[(1S-[(2S)1-метилпіперидин-2Одержують 4,55г твердого продукту. іл]фенілметил]-3-трифлуорметил-бензамід гідроТемпература плавлення: 123-125°С. хлорид 1:1. Використовуючи спосіб описаний у підрозділі [a]25D= -25,4° (с=2,22; СН2СІ2) ен=97,2%. 1,6, починаючи з 1г (4,9ммол) 2-хлор-32.2. 1,1-Диметилетил (1S)-2-[(2S)трифлуорметилбензойної кислоти, 0,9г (4,9ммол) гідрокси(феніл)метил]піперидин-1-карбоксилат. 1-[3-(диметиламіно)пропіл]-3-етилкарбодіімід гід4,68г (16,2ммол) 1,1-диметилетил (2S)-2рохлориду, 0,66г (4,6ммол) 1бензоїлпіперидин-1-карбоксилату у 170мл безводного тетрагідрофурану вводять у круглодонну колгідроксибензотриазолу і 1г (4,9ммол) (1S-[(2S-(1метилпіперидин-2-іл)]фенілметиламіну, одержубу на 500мл, під атмосферою азоту, розчин охоють 0,45г основного продукту після очищення хролоджують до-78°С, 48,5мл (48,5ммол) добавляють матографією на колонці з силікагелем, елюючи краплями 1Μ розчин L-Selectride® (літійтри-вторсумішшю дихлорметану і метанолу. бутилборогідриду) у те трагідрофурані і суміш перемішують при кімнатній температурі 5 годин. Продукт розчиняють у кількох мл пропан-2олу, добавляють 10,9мл 1Η розчину гідрохлоридЇї повільно у холодному стані гідролізують ної кислоти у пропан-2-олі і суміш концентрують 34мл води і 34мл 35% водного розчину пероксиду під зниженим тиском, щоб зменшити об'єм розгідрогену, і суміші дають повернутися до кімнатної чиннику. температури, перемішуючи 2 години. Її розбавляють водою і етилацетатом, водну Наприкінці після розтирання виділяють 0,37г гідрохлориду у вигляді білої твердої речовини. фазу відокремлюють, її екстрагують етилацетаТемпература плавлення: 230-232°С. том. Після промивання об'єднують органічні фази, висушують над сульфатом натрію, фільтрують і [a]25D = +70,3° (с=0,825; СН3ОН) ен>99%. випарюють, залишок очищають хроматографією Приклад 3 (сполука №24). на колонці з силікагелем, елюючи сумішшю етилатрео-4-аміно-3-хлор-н-[(1-метилпіперидин-2цетату і циклогексану. іл)фенілметил]-5-трифлуорметилбенз-амід пдрохОдержано 4,49г блідої жовтої маслянистої репорид 1:1. човини. 3.1. 2-(Бензилоксіімінофенілметил)-1метилпіридинійтрифлуорметилсульфонат. [a]25D = +63,75° (с=0,8; СН2СІ2) ен=97,8%. 17,4мл (120ммол) метилтрифлуорметилсуль2.3. (1S)-[(2S)—метилпіперидин+2фонату добавляють краплями при 0°С до суспензії іл)]фенілметанол. 35г (120ммол) феніл(піридин-2-іл)метанон о2,96г (78,1ммол) літій алюміній гідриду в 50мл бензилоксиму в 200мл діетилового етеру, і суміш безводного тетрагідрофурану вводять у 200мл перемішують при кімнатній температурі 3 години. двогорлу колбу, під атмосферою азоту, суміш наУтворений залишок відокремлюють фільтрацією і грівають під зворотнім холодильником, 4,49г висушують під зниженим тиском. (15,4ммол) добавляють розчин 1,1-диметилетил Одержують 49г продукту, який використовують (1S)-2-[(2S)гідрокси(феніл)метил]піперидин-1у наступному етапі. карбоксилату в 35мл тетрагідрофурану і суміш 3.2. трео-(1-Метилпіперидин-2тримають під зворотнім холодильником 3,5 гоіл)фенілметиламін етандіоат2:1. дини. 14,8г (31,89ммoл) 2Її охолоджують, повільно гідролізують 0,1Μ (бензилоксіімінофенілметил)-1-метилпіридиній розчином калій-натрій тартрату і суміш тримають трифлуорме-тилсульфонату і 0,74г оксиду платини при перемішуванні протягом ночі. Її фільтрують і у 50мл етанолу і 50мл 1Η гідрохлоридної кислоти залишок промивають тетрагідрофураном, а потім вводять у колбу Парра, і гідрують 5 годин. фільтрат концентрують під зниженим тиском. Етанол випаровують під зниженим тиском, заОдержують 2,95г безбарвного маслянистого лишок екстрагують дихлорметаном, водну фазу продукту. відокремлюють, добавляють розчин аміаку і екст2.4. (1S)-[(2S)-(1-метилпіперидин-2рагують дихлорметаном. Після промивання об'єділ)]фенілметиламін. нані органічні фази, висушують над сульфатом 2,95г (14,4ммол) (1S)-[(2S)-(1-метилпіперидиннатрію, фільтрують, розчинник випаровують під 2-іл)]фенілметанолу і 2мл (14,4ммол) триетиламізниженим тиском і одержують 6,7г маслянистого ну в 70мл безводного дихлорметану вводять у продукту, що містіть 10% еритро-діастереоізомеру. круглодонну колбу на 250мл, під атмосферою азоЕтандіоат одержують розчиненням цих 6,7г ту, середовище охолоджують до 0°С, добавляють одержаного продукту у метанолі дією двох еквіва1,1мл (14,4ммол) метилсульфонілхлориду, і суміші лентів етандіонової кислоти, розчиненої у мінімадають повільно повернутися до кімнатної темпельній кількості метанолу. ратури через 2 години, і її концентрують під зниОдержану сіль очищають рекристалізацією із женим тиском. 13 78025 14 суміші метанолу і діетилового етеру. [a]25D = -11° (с=1; СН3ОН) ен>99%. Наприкінці виділяють 4,7г трео4.2. 4-Aмiнo-3-xлop-N-(1R)-[(2R)-1діастереоізомеру чистого етандіоату. метилпіпepидин-2-iл]фeнiлмeтил]-5Температура плавлення: 156-159°С. тpифлyopмeтил-бензамід пдрохпорид 1:1. 3.3. 4-Аміно-3-хлор-5-трифлуорметилбензойна Використовуючи способи, описані у пункті 3.4, кислота. наведеному вище, починаючи з 1,04г (4,37 ммол) 7,8г (40ммол) 4-аміно-54-аміно-3-хлор-5-трифлуорметилбензойної кислотрифлуорметилбензойної кислоти у 80мл хлороти, 0,46г (3,97ммол) 1-[3-(диметиламіно)пропіл]-3форму вводять у круглодонну колбу на 500мл у етилкарбодіімід гідрохлориду, 0,53г (3,97ммол) 1присутності 9,97мл (50ммол) сульфурилхлориду, і гідроксибензотриазолу і 1,5г (3,97ммол) (1R)-[(2R)суміш перемішують під зворотнім холодильником мeтилпiпepидин-2-iл]фeнiлмeтилaмiнy, одержують протягом ночі. 1,12г продукту у вигляді основи.. Розчинник випаровують під зниженим тиском, Цей продукт у вигляді гідрохлориду одержують залишок переносять у воду і водний аміак і суміш додаванням розчину 28,2мл 0,1Η гідрохлоридної екстрагують дихлорметаном. Водну фазу підкискислоти у пропан-2-олі до розчину 1,12г продукту у люють, утворений осадок виділяють фільтрацією і вигляді основи у кількох мл пропан-2-олу. Розчинвисушують під зниженим тиском. ник випарюють під зниженим тиском, одержану Одержують 9г продукту. тверду речовину збирають і висушують під знижеТемпература плавлення: 229-235°С. ним тиском. 3.4. трео-4-Аміно-3-хлор-N-[(1Наприкінці виділяють 0,9г білого твердого гідметилпіперидин-2-іл)фенілметил]-5рохлориду. трифлуорметилбензамід пдрохлорид 1:1. Температура плавлення: 175-185°С. 0,52г (2,15ммол) 4-аміно-3-хлор-5[a]25D = +18,4° (с=0,091; СН3ОН) ен=97,8%. трифлуорметилбензойної кислоти, 0,37г Приклад 5 (сполука №36). (1,96ммол) 1-[3-(диметиламіно)пропіл]-3трео-2-Хлор-N-[феніл(піперидин-2-іл)метил]-3етилкарбодіімід гідрохлориду, 0,26г (1,96ммол) 1трифлуорметилбензамід гідрохлорид 1:1. гідроксибензотриазолу в 5мл 1,2-дихлоретану 5.1. 2-Хлор-N-[феніл(піридин-2-іл)метил]-3вводять у круглодонну колбу на 100мл, і суміш трифлуорметилбензамід. перемішують при кімнатній температурі 10 хвилин. 1,61г(7,16ммол)2-хлор-3Добавляють розчин 0,4г (1,96ммол) трео-(1трифлуорметилбензойної кислоти, 1,4г (7,28ммол) метилпіперидин-2-іл)фенілметиламіну у 5мл 1,21-[3-(диметиламіно)пропіл]-3-етилкарбодіімід гіддихлоретану і суміш перемішують 12 годин. рохлориду, 0,218г (1,79ммол) 4Її гідролізують водою, добавляють гранули кадиметиламінопіридину в 60мл дихлорметану вволій гідроксиду до одержання основного рН, і суміш дять у круглодонну колбу на 250 мл, суміш переекстрагують дихлорметаном. Органічну фазу промішують 15 хвилин, добавляють розчин 1,1г мивають водою, висушують над сульфатом на(5,97ммол) феніл(піридин-2-іл)метиламіну в 60мл трію, фільтрують, розчинник випарюють під знидихлорметану і суміш перемішують при кімнатній женим тиском і залишок очищають температурі 24 години. хроматографією на колонці з силікагелем, елюючи Її гідролізують додаванням води, добавляють сумішшю дихлорметану і метанолу. 35% водний розчин гідроксиду натрію, органічну Виділяють 0,4г сполуки у вигляді основи. фазу відокремлюють, промивають водою і потім Її розчиняють у кількох мл пропан-2-олу, добанасиченим водним розчином гідроксиду натрію і вляють розчин 9,4мл 0,1Η гідрохло-ридної кислоти висушують над сульфатом магнію, фільтрують і у пропан-2-олі і розчинник випарюють під знижерозчинник випарюють під зниженим тиском. Залиним тиском. Залишок збирають і висушують у вашок очищають хроматографією на колонці з силікуумі. кагелем, елюючи сумішшю дихлорметану і метаОдержують 0,285г твердого продукту. нолу, і наприкінці виділяють 1,34г продукту у Температура плавлення: 270-272°С. вигляді жовтого масла, яку кристалізують і викориПриклад 4 (сполука №25). стовують, як таку, в наступнім етапі. 4-Аміно-3-хлор-N-[(1R)-[(2R)-15.2. трео-2-Хлор-N-[феніл(піперидин-2метилпіперидин-2-іл]фенілметил]-5іл)метил]-3-трифлуорметилбензамід гід-рохлорид трифлуорметилбензамід гідрохлорид 1:1. 1:1. 4.1. (1R)-[(2R)-(1-метилпіперидин-2Розчин 4,17г (10ммол) 2-хлор-Nіл)]фенілметиламін. [феніл(піперидин-2-іл)метил]-3Розчин 80г (390ммол) трео-(1-метилпіперидинтрифлуорметилбензаміду в 43мл льодяної оцтової 2-іл)фенілметиламіну у 300мл метанолу і розчин кислоти вводять у колбу Парра, добавляють 0,1г 68г (390ммол) N-ацетил-D-лейцину у 450мл мета5% паладію на вугіллі і гідрують при 0,35Мра при нолу вводять у кругло-донну колбу на 4л. Розчин 50°С протягом 3 годин. концентрують під зниженим тиском і залишок пеПісля повернення до кімнатної температури, рекристалізують із 1100мл пропан-2-олу. Одержакаталізатор видаляють фільтрацією, фільтрат но 72г солі (1R)-(2R)-(1-метилпіперидин+2концентрують під зниженим тиском, залишок пеіл)]фенілметиламіну. реносять у воду і етилацетат, добавляють конценПерекристалізацію повторюють три рази і натрований гідроксид натрію і суміш екстрагують прикінці одержують 15г солі (1R)-[(2R)-(1кілька разів етилацетатом. Органічну фазу промиметилпіперидин-2-іл)]фенілметиламіну. вають водою і потім насиченим водним розчином Температура плавлення: 171,5°С. гідроксиду натрію, висушують над суль фатом на 15 78025 16 трію, фільтрують і розчинник випарюють під знисередовище розділяють і водну фазу екстрагують женим тиском. Залишок очищають двома послідодвічі 30мл дихлорметану, об'єднані фази промивними хроматографуваннями на колонці з силікавають 100мл води і потім 100 мл насиченого розгелем, елюючи сумішшю від 100/0 до 95/5 чину хлориду натрію. Органічну фазу висушують дихлорметану і метанолу, щоб відокремити початнад сульфатом натрію, розчинники видаляють під кову речовину, що не прореагувала. зниженим тиском і залишок очищають хроматогВиділяють 0,8г трео-діастереоізомеру (менш рафією на колонці з силікагелем, елюючи сумішполярного). Його гідрохлорид одержують розчишю 90/10 дихлорметану і метанолу протягом 40 ненням у кількох мл пропан-2-олу і додаванням хвилин. 20мл 0,1Η розчину гідрохлоридної кислоти у проВиділяють 0,15г першого ізомеру N-оксиду пан-2-олі. Розчинник частково випарюють під зни(температура плавлення: 100-102°С) і 0,03г другоженим тиском, розтиранням одержують білу тверго ізомеру N-оксиду (температура плавлення: 126ду речовину, її збирають фільтрацією і висушують 128°С). під зниженим тиском. Приклад 8 (сполука №71). Наприкінці одержують 0,6г гідрохлориду. (2S)-2[(1S)-[[2-Хлор-3Температура плавлення: 234-235°С. (трифлуорметил)бензоїл]аміногруп](феніл)метил]Приклад 6 (сполука №37). 1,1-диметилпіперидиній йодид 2-Хлор-N-[(S)-феніл-[(2S)-піперидин-2Розчин 0,15г (0,36ммол) 2-хлор-N-[(1S)-[(2S)-1іл]метил]-3-(трифлуорметил)бензамід гідрометилпіперидин-2-іл]фенілметил]-3хлорид 1:1. трифлуорметилбензаміду в 20мл ацетонітрилу Розчин 8,36г (3екв.) 1,3-диметилбарбітурової вводять у 50мл двогорлу колбу з магнітним перекислоти у 100мл безводного дихлорметану ввомішуванням, циркуляцією аргону і холодильником, дять у 500мл двогорлу колбу з магнітним перемідобавляють 0,5мл йодметану і середовище нагрішуванням, циркуляцією аргону і холодильником. вають при 80°С протягом 2 годин. Добавляють 0,2г (0,01екв.) тетраРеакційне середовище концентрують наполокіс(трифенілфосфін)паладію і реакційне середовину, сіль амонію випадає в осад, її фільтрують і вище нагрівають до 35°С. висушують під зниженим тиском. Добавляють розчин 7,8г (19,18ммол) N-[(S)-[(2Виділяють 0,17г твердої жовтої речовини. S)-1-аллілпіперидин-2-іл](феніл)метил]-2-хлор-3Температура плавлення: 121-123°С. (трифлуорметил)бензаміду (одержаного способом Таблиця 1 ілюструє хімічні структури кількох з прикладу 1), і хід реакції контролюють тонкошасполук винаходу. ровою хроматографією. Добавляють 100мл насиУ колонці "А", сС3Н5 означає циклопропіл. У ченого розчину гідрокарбонату натрію, після випаколонці "CF3" представлене позиція CF3-групи у діння осаду середовище розділяють і водну фазу загальній формулі (І). У колонці "R2", C6H6 означає екстрагують двічі 100мл дихлорметану, об'єднані феніл. У колонці "Сіль", "-" означає сполуку у виорганічні фази промивають 100мл води і потім гляді основи. "НСІ" означає гідро хлорид, а "тфа" 100мл насиченим хлоридом натрію. представляє трифлуорацетат. Розчин висушують над сульфатом натрію, фіТаблиця 2 ілюструє фізичні властивості, темльтрують і розчинник випарюють під зниженим пературу плавлення і оптичну ротацію площини тиском. поляризації світла кількох сполук. Одержують 10,15г твердої бежевої речовини, яку очищають хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметану, що містить 0,4% розчину 33% аміаку. Виділяють 4,8г блідої твердої речовини. її розчиняють у 50мл пропан-2-олу і добавляють 125мл 0,1Η гідрохлоридної кислоти у пропан-2-олі, суміш концентрують під зниженим тиском щоб зменшити об'єм розчиннику Після розтирання, виділяють 4,33 г гідрохлориду у ви гляді білих кристалів. Температура плавлення: 223-225°С. [a]25D = +80,7° (с=0,5; СН3ОН) ен>98%. Приклад 7 (сполуки №69 і 70). 2-Χлορ-Ν-[[1-метил-1-оксидо-піперидин-2іл](феніл)метил]-3-трифлуорметилбензамід. 0,54г (1,3ммол) трео-2-хлор-N-(1метилпіперидин-2-іл)фенілметил]-3трифлуорметилбензаміду в 20мл безводного дихлорметану при 0°С вводять у кругло-донну колбу на 50мл з магнітним перемішуванням, добавляють розчин 0,28г (1,2екв.) 3-хлорбензойної кислоти у 5 мл дихлорметану, суміші дають повернутися до кімнатної температури з перемішуванням протягом 12 годин. Добавляють 30мл води, після випадіння осаду 17 78025 18 Сполука №69: найбільш полярний діастереоізомер Сполука №70: найменш полярний діастереоізомер Сполуки винаходу піддають серії фармакологічних випробовувань, які демонструють їх важливість, як субстанцій з терапевтичною активністю. Дослідження транспорту гліцину в клітинах SR-N-MC, що експресують природний транспортер людини glyt1 Захоплення [14С]гліцину досліджують у SR-NMC-клітинах (нейроепітеліальних клітинах людини), що експресують природній транспортер людини glyt1, вимірюванням радіоактивності, інкорпорованої у присутності або у відсутності тестсполуки. Клітини культивують у моношарі протягом 48 годин у мікробіологічних чашках, попередньо оброблених 0,02% фібронектином. У день експерименту, к ультурне середовище видаляють і клітини промивають буфером Кребса ГЕПЕС ( [4-(2-гідроксіетил)піперазин-1етилсульфонова кислота) при рН 7,4. Після преінкубації протягом 10 хвилин при 37°С у присутності буферу (контрольна група), або тест-сполуки при різних концентраціях, або 10ммол гліцину (визна 19 78025 20 чення неспецифічного захоплення), добавляють Зразки гомогенізують у буфері Кребса - ГЕПЕС ([410мкМ[14С]гліцину (специфічна активність (2-гідроксіетил)піперазин-1-етилсульфонова кис112мКі/ммол). Інкубацію продовжують 10 хвилин лота) рН7,4, при співвідношенні 25мл/г тканини. при 37°С, і реакцію зупиняють 2 промивками буЩоб визначити неспецифічне захоплення, фером Кребса - ГЕПЕС при рН 7,4. Інкорпоровану 50мкл гомогенату преінкубують 10 хвилин при клітинами радіоактивність визначають після доба25°С у присутності буферу Кребса - ГЕПЕС, рН 7,4 влення 100мкл рідкого сцинтилянту і перемішуі при різних концентраціях сполуки, що досліджування протягом 1 години. Підрахунок імпульсів ють, або 10мМ гліцину. Потім добавляють виконують лічильником Microbeta Tri-klux™. Ефек[14С]гліцин (специфічна активність = 112мКі/ммол) тивність сполуки визначають величиною ІК5о, конна 10 хвилин при 25°С і кінцевій концентрації центрацією сполуки, що зменшує на 50% специфі10мкМ. Реакцію зупиняють фільтрацією у вакуумі, чне захоплення гліцину, знайденою за різницею визначають радіоактивність рахуванням сцинтирадіоактивності, інкорпорованої контрольною груляції твердої речовини на лічильнику Microbeta Triпою й групою, що о тримувала 10мМ гліцин. lux™. Ефективність сполуки визначають ІК50, конСполуки винаходу у цьому тесті мають IK50 від центрацією, що здатна зменшити на 50% специфі0,0001 до 10мкМ. чне захоплення гліцину, визначеною різницею раДослідження ex vi vo інгібувальної активності діоактивності, інкорпорованою контрольною сполуки стосовно захоплення Г 14С1гліцину ν коргрупою й гр упою, яка отримувала 10мМ гліцину. тикальному гомогенаті мишей Сполуки винаходу в цьому тесті мають ІK50 від Підвищені дози досліджених сполук уводять 0,0001 до 10мкМ. перорально (приготовані розтиранням тестДослідження ex vi vo інгібувальної активності молекули в ступці у 0,5% розчині сполуки стосовно захоплення Г 14С1гліцину в гомоTween/Methocel™ у дистильованій воді) або інтрагенаті спинного мозку мишей перитональним шляхом (розчиненням тестПідвищені дози досліджених сполук (приготомолекули у фізіологічному розчині або розтиранвані розтиранням тест-молекули в ступці у 0,5% ням у ступці у 0,5% розчині Tween/Methocel™ у розчині Tween/Methocel™ у дистильованій воді) воді, відповідно до розчинності молекули) самцям уводять перорально або інтраперитональним мишей Iffa Credo OF1 по 20-25г на день експеришляхом (розчиненням тест-молекули у фізіологічменту. Контрольну груп у оброблюють носієм. Дози ному розчині або розтиранням у ступці у 0,5% розу мг/кг, шлях застосування й час лікування визначині Tween/Methocel™ у воді, відповідно до розчають відповідно до молекули, що досліджують. чинності молекули) самцям мишей Iffa Credo OF1 Після гуманного вбивства тварин декапітацією по 20-25г на день експерименту. Контрольну групу у призначений час після застосування, кору голооброблюють носієм. Дози у мг/кг, спосіб застосувного мозку кожної тварини швидко видаляють на вання й час лікування визначають відповідно до лід, зважують і зберігають при 4°С або заморожусполуки, що досліджують. ють при -80°С (в обох випадках, зразки зберігають Після гуманного вбивства тварини декапітацімаксимально 1 день). Кожен зразок гомогенізують єю у призначений час після уведення спинний моу буфері Кребса - ГЕПЕС при рН 7,4 при співвідзок кожної тварини швидко видаляють на лід, званошенні 10мл/г тканини. 20мкл кожного гомогенату жують і зберігають при 4°С або заморожують при інкубують 10 хвилин при кімнатній температурі у 80°С (в обох випадках, зразки зберігають максиприсутності 10мМ L-аланіну й буферу. Неспецифімально 1 день). Кожен зразок гомогенізують у бучне захоплення визначають добавленням 10мМ фері Кребса - ГЕПЕС при рН7,4 при співвідношенгліцину до контрольної групи. Реакцію зупиняють ні 25мл/г тканини. 50мкл кожного гомогенату фільтрацією у вакуумі й одержану радіоактивність інкубують 10 хвилин при кімнатній температурі у визначають підрахунком сцинтиляції твердої речоприсутності буферу. вини на лічильнику Microbeta Tri-lux™. Неспецифічне захоплення визначають добавІнгібітор захоплення [14С]гліцину зменшуватиленням 10мМ гліцину до контрольної групи. ме кількість радіоліганду, інкорпорованого у кожРеакцію зупиняють фільтрацією у вакуумі, й ний гомогенат. Активність сполуки визначають її одержану радіоактивність визначають підрахунком ЕД50, дозою, що інгібує захоплення [14С]гліцину на твердої сцинтиляції на лічильнику Microbeta Tri50% у порівнянні з контрольною групою. lux™. Найбільш сильнодіючі сполуки винаходу, у Інгібітор захоплення [14С]гліцину зменшуватицьому тесті, мають ЕД50 від 0,1 до 5 мг/кг при увеме кількість радіоліганду, інкорпорованого у кожденні інтраперитональним або пероральним шляний гомогенат. Активність сполуки визначає її хом. ЕД50, доза, що інгібує захоплення [14С]гліцину на Дослідження транспорту гліцину у гомогенаті 50% у порівнянні з контрольною групою. спинного мозку мишей Найкращі сполуки винаходу, введені інтрапеЗахоплення [14С]гліцину транспортером glyt2 ритональним або пероральним способом, в цьому досліджують у гомогенат спинного мозку мишей тесті мають ЕД50 від 0,1 до 20мг/кг. вимірюванням радіоактивності, інкорпорованої у Результати випробовувань сполук винаходу, присутності або у відсутності сполуки, що досліщо мають конфігурацію (1S, 2S) і їх. треоджують. рацематів, що мають конфігурацію (1R, 2R; 1S, 2S) Після гуманного вбивства тварин (самців миу загальній формулі (І), де R2 представляє один шей Iffa Credo OF1 вагою від 20 до 25г на день або більше атомів галогену або трифлуорметильексперименту), швидко видаляють спинний мозок них груп, показують, що вони є інгібіторами гліцикожної тварини, зважують і зберігають на льоду. нового транспортера glyt1, який присутній у мозку, 21 78025 22 in vitro і ех vivo. кронізованих або інакше оброблених активних Ці результати підказують, що сполуки винахоінгредієнтів фармацевтичний носій, який може ду можна використати для лікування розладів поскладатися з розріджувачів, як-то, наприклад, лакведінки, пов'язаних із слабоумством, психозами, този, мікрокристалічної целюлози, крохмалю, і особливо із шизофренією (неповної і продуктивної композиції ад'ювантів, як-то зв'язуючих, (полівінілформи), гострими або хронічними екстрапірамідапіролідону, гідроксипропілметилцелюлози і подібльними симптомами, викликаними нейролептиканих), поліпшуючи х сипучість засобів, як-то кремнеми, для лікування різних форм страху, нападів зему, змащувачів, як-то стеарату магнію, паніки, фобій, нав'язливо-невротичних розладів, стеаринової кислоти, глицерилтрибегенату, стеадля лікування різних форм депресій, включаючи рилфумарату магнію. Можуть бути добавлені тапсихічну депресію, для лікування розладів, викликож зволожувачі або поверхнево-активні сполуки. каних зловживанням алкоголю або припиненням Способом виготовлення може бути пряме превживання алкоголю, розладів сексуальної поведінсування, сухе гранулювання, вологе гранулювання ки, розладів харчування, та для лікування мігрені. або плавлення при нагріванні. Таблетки можуть Результати випробовувань сполук винаходу, бути непокритими, покритими, наприклад, сахарощо мають конфігурацію (1S, 2S), та їх рацемати, зою, або покриті різними полімерами або іншими що мають конфігурацію (1R.2R; 1S.2S), у загальної відповідними матеріалами. Вони можуть бути приформулі (І), де R2 представляє атом галогену і значеними для швидкого, затриманого або пролоаміногрупу NR3R4, показують, що вони є інгібітонгованого вивільнення активної складової з викорами гліцинового транспортеру glyt2, переважно ристанням полімерної матриці або специфічного присутнього у спинному мозку, in vitro і ex vivo. полімеру, використаного у покритті. Ці результати підказують, що сполуки виДля приготування желатинових капсул активнаходу можна використати для лікування тяжких ний інгредієнт змішують із сухим (просте змішум'язових контрактур, у ревматології, у гострій спивання, сухе або вологе гранулювання, або плавнальній патології, для лікування спазматичних лення при нагріванні), рідким або напівтвердим контрактур мозкового або церебрального похофармацевтичним носієм. дження, для симптоматичного лікування гострого Щоб мати швидку, пролонговану або затримата підгострого болю від середньої до помірної інну активність (наприклад, у формі з енеросолюбітенсивності, для лікування гострого і/або хронічнольним покриттям), желатинові капсули можуть го болю, нейрогенного болю, невгамовного болю, бути твердими або м'якими, або покритими плівдля лікування хвороби Паркінсона й симптомів кою чи інакше сформованими. паркінсонізму нейродегенеративного походження Композиція у формі сиропу, еліксиру або для або викликаного нейролептиками, для лікування застосування у вигляді крапель може містити акпервинної й вторинної загальної епілепсії, часткотивний інгредієнт разом із замінником цукру, кравої епілепсії з простою або складною симптоматоще безкалорійним, метилпарабеном або пропіллогією, змішаних форм та інших епілептичних синпарабеном, як антисептиком, модифікатором дромів, як додаткове до іншого запаху та барвником. протиепілептичного лікування, або у монотерапії Дисперсія порошку у воді і гранули можуть мідля лікування зупинки дихання підчас сну, і для стити активний інгредієнт у вигляді суміші з диспенейрозахисту. ргувальним засобом або зволожувачем, або дисТаким чином, предметом представленого випергатором, як-то полівінілпіролідоном, і із находу також є фармацевтичні композиції, що місзамінником цукру і коригентами запаху. тять ефективні дози, принаймні, однієї сполуки Для ректального застосування використовузгідно з винаходом, у вигляді фармацевтично приють супозиторії, одержані зі зв'язуючими, що плайнятної основи, або солі, або сольвату, і у вигляді вляться при ректальній температурі, наприклад, суміші, коли треба, із потрібним наповнювачем. маслом какао або поліетиленглі-колем. Названий наповнювачі відбирають відповідно Для парентерального застосування викорисдо фармацевтичної дозованої форми і бажаного товують суспензії у воді, ізотонічні розчини солі способу застосування. або стерильні розчини для ін'єкцій, що містять фаФармацевтичні композиції згідно з винаходом, рмацевитично сумісні диспергувальні засоби і/або відповідно, можуть бути призначені для пероральзволожувачі, наприклад, пропіленгліколь або буного, сублінгвального, підшкірного, внутрішньом'я тиленгліколь. зового, внутрішньовенного, місцевого, інтратрахеАктивний інгредієнт може також бути сформоального, інтраназального, підшкірного, ваний у вигляді мікрокапсул, як варіант, з одним ректального або внутрішньо-очного застосування. або більше носіями або додатками, або, альтернаОкремі форми для застосування можуть бути, тивно, із полімерною матрицею або з циклодекстнаприклад, у вигляді таблеток, желатинових каприном (пластирі, форми пролонгованого вивільсул, гранул, порошків, пероральних або ін'єкційних нення). розчинів або суспензій, пластирів або супозиторіїв. Композиції для місцевого застосування згідно Для місцевого застосування можливо передбачити з винаходом містять середовище, сумісне зі шкімазі, лосьйони і примочки для очей. рою. їх можна виготовляти, зокрема, у формі водНазвані окремі форми містять дози, щоб заних, спиртових або водно-спиртових розчинів, гебезпечити добове застосування від 0,01 до 20 мг лів, водно-масляних або масляно-водних активної складової на кг ваги тіла, відповідно до емульсій, що мають форму крему або гелю, мікромедичної форми. емульсій, аерозолів або, альтернативно, у формі Щоб приготувати таблетки, добавляють до мівезикулярних дисперсій, що містять іонні/або не 23 78025 24 іонні ліпіди. Ці медичні форми одержують спософормули (І) інші активні інгредієнти, що можуть бами, звичайними у цій галузі. бути корисними у лікуванні розладів і хвороб, наНаприкінці, фармацевтичні композиції згідно з ведених вище. винаходом можуть містити окрім -сполук загальної Комп’ютерна в ерстка Н. Лисенко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of n-[phenyl(piperidine-2-yl)methyl]benzamide, method of synthesis and use in therapy
Автори англійськоюEstenne-Bouhtou Genevieve, Marabout Benoit, Sevrin Mireille, Veronique, Corinne
Назва патенту російськоюПроизводные n-[фенил(пиперидин-2-ил) метил]бензамида, способ их получения и применение в терапии
Автори російськоюЭстенн-Буту Женевьев, МАРАБУ Бенуа, Севрен Мирей
МПК / Мітки
МПК: A61K 31/452, A61K 31/445, A61P 25/24, A61P 43/00, A61P 11/16, A61P 29/00, C07D 211/26, A61P 25/02, A61P 25/16, A61P 25/32, A61P 25/06, A61P 1/00, A61P 25/00, C07D 211/94, A61K 31/4458, A61P 25/18, A61P 25/28, A61P 25/22, A61P 25/04
Мітки: спосіб, застосування, терапії, отримання, похідні, n-[феніл(піперидин-2-іл)метил]бензаміду
Код посилання
<a href="https://ua.patents.su/12-78025-pokhidni-n-fenilpiperidin-2-ilmetilbenzamidu-sposib-kh-otrimannya-ta-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні n-[феніл(піперидин-2-іл)метил]бензаміду, спосіб їх отримання та застосування у терапії</a>
Попередній патент: Гербіцидна комбінація з ацильованими амінофенілсульфонілсечовинами
Наступний патент: Антибіотики флорфеніколового типу
Випадковий патент: Спосіб визначення якості напоїв, що містять спирт, та безалкогольних напоїв