Гідрофумарат r-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру, спосіб його одержання та інтермедіати
Формула / Реферат
1. Гідрофумарат R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру у кристалічній формі.
2. Спосіб одержання гідрофумарату R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру, який відрізняється тим, що:
а) метиловий естер R-(-)-4-бензилокси-3-(3-діізопропіламіно-1-фенілпропіл)-бензойної кислоти (3) розщеплюють гідрувальним засобом з утворенням метилового естеру R-(-)-3-(3-діізопропіламіно-фенілпропіл)-4-гідроксибензойної кислоти (5), після чого
б) одержану зазначену сполуку перетворюють за допомогою відновлювального засобу в R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенол (6), який
в) перетворюють за допомогою засобу ацилування в R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратний естер, який
г) перетворюють за допомогою фумарової кислоти в гідрофумарат R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру.
3. Застосування сполуки формули 3
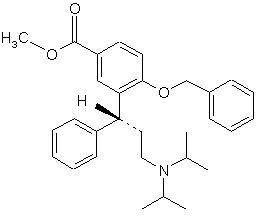
як високочистого, кристалічного, стабільного інтермедіату для одержання сполуки за п. 1.
4. Застосування сполуки формули 5
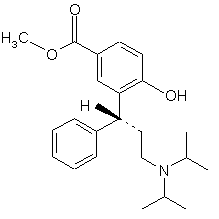
як високочистого, кристалічного, стабільного інтермедіату для одержання сполуки за п. 1.
5. Застосування сполуки формули 6
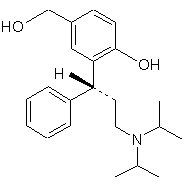
як високочистого, кристалічного, стабільного інтермедіату для одержання сполуки за п. 1.
Текст
1. Гідрофумарат R-(+)-2-(3-діізопропіламіно-1фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру у кристалічній формі. 2. Спосіб одержання гідрофумарату R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілізобутиратного естеру, який відрізняється тим, що: а) метиловий естер R-(-)-4-бензилокси-3-(3діізопропіламіно-1-фенілпропіл)-бензойної кислоти (3) розщеплюють гідрувальним засобом з утворенням метилового естеру R-(-)-3-(3діізопропіламіно-фенілпропіл)-4-гідроксибензойної кислоти (5), після чого б) одержану зазначену сполуку перетворюють за допомогою відновлювального засобу в R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенол (6), який в) перетворюють за допомогою засобу ацилування в R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілізобутиратний естер, який г) перетворюють за допомогою фумарової кислоти в гідрофумарат R-(+)-2-(3-діізопропіламіно-1фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру. 3. Застосування сполуки формули 3 2 3 Представлений винахід стосується високо чистих, кристалічних, стабільних сполук нових похідних 3,3-дифенілпропіламінів у формі їх солей, способу виробництва їх та високо чистих, стабільних, проміжних продуктів. З документу РСТ/ЄР99/03212 відомі нові похідні 3,3-дифенілпропіламінів. Це цінні проліки для лікування невтримання сечі та інших спазматичних ускладнень, які охоплюють нестачу активних речовин, наявну при неадекватному поглинанні активної. речовини біологічними мембранами або їх небажаному метаболізмі. Крім того ці нові проліки мають поліпшені фармакокінетичні характеристики порівняно з оксибутиніном та толтеродином. Кращі сполуки з групи цих нових похідних 3,3дифенілпропіламінів є естерами аліфатичних або ароматичних карбонових кислот загальної формули А, наведеної нижче у якій R є С1-С6алкілом, С3-С10циклоалкілом або незаміщеним чи заміщеним фенілом. Вони можуть існувати як оптичні ізомери, як рацемічні суміші та у формі своїх індивідуальних енантіомерів. Сполуки структурної формули А, однак, мають низьку розчинність у воді. Це обмежує їх пероральну біопридатність. Під кінець, моноестери структури, яку показано у формулі А, мають тенденцію до інтрамолекулярної трансестерифікації. Протягом довгого періоду зберігання тому вміст сполуки зі структурою загальної формули А зменшує зростання діестерів і можна детектувати вільні діоли. Загалом солі сполук загальної формули А можна отримати, якщо розчини сполук формули А (основний компонент) очищають розчинами кислот у придатних розчинниках, але солі, отримані у формі твердого продукту, можуть бути взагалі аморфними та/або гігроскопічними і їх не можна безпосередньо кристалізувати зі звичайних розчинників. Такі солі мають неадекватну хімічну стабільність при отриманні фармацевтичних препаратів як цінні фармацевтично активні речовини. Несподівано, зараз виявлено, що вищезгаданих недоліків можна позбавитися, якщо сполуки зі структурою загальної формули А, коли їх виготовлено певним реакційним процесом, перетворюють фізіологічно сумісною неорганічною або органічною кислотою загальної формули Н-Х, в якій "Х-" представляє відповідний кислотний залишок, у їх 77322 4 відповідну сіль загальної формули І Проблемою представленого винаходу є тому отримання високо чистих кристалічних стабільних сполук нових похідних 3,3-дифенілпропіламінів у формі їх солей, що позбавляють від встановлених недоліків та добре придатні для використання у фармацевтично-технічних композиціях і можуть бути переробленими у них. Крім того, проблемою представленого винаходу є спосіб виробництва таких висок чистих кристалічних стабільних сполук у формі їх солей, а також високо чистих стабільних інтермедіатів. Кінцевою проблемою винаходу є спосіб виробництва вищезгаданих сполук з високим виходом продуктів за цим способом та можливістю отримати відповідні інтермедіати хемо- або регіоселективно. Цю проблему розв'язано тим, що запропоновані високо чисті кристалічні стабільні сполуки 3,3дифенілпропіламініву формі їх солей загальної формули І у якій R є С1-С6алкілом, С3-С10циклоалкілом або незаміщеним чи заміщеним фенілом, а "Х-" представляє відповідний кислотний залишок фізіологічно сумісної неорганічної або органічної кислоти. Згідно з метою винаходу солі загальної формули І можуть містити відповідний кислотний залишок "Х-" нижченаведених кислот: гідрохлоридна кислота, гідробромідна кислота, фосфатна кислота, сульфатна кислота, нітратна кислота, оцтова кислота, пропіонова кислота, пальмітинова кислота, стеаринова кислота, малеїнова кислота, фумарова кислота, щавлева кислота, янтарна кислота, DL-яблучна кислота, L-(-)яблучна кислота, D-(+)-яблучна кислота, DL-винна кислота, L-(+)-винна кислота, D-(-)-винна кислота, лимонна кислота, L-аспарагінова кислота, L-(+)аскорбінова кислота, D-(+)-глюкуронова кислота, 2-оксопропіонова кислота (пірувинна кислота), фуран-2-карбонова кислота (муцинова кислота), 5 77322 6 бензойна кислота, 4-гідроксибензойна кислота, [(R)-3-(2-{1-[4-(1-циклопропілметаноїлокси)-феніл]саліцилова кислота, ванільна кислота, 4метаноїлокси}-5-гідроксиметил-феніл)-3гідроксицинамова кислота, галова кислота, гіпурофенілпропіл]-діізопропіламонію, хлорид [(R)-3-(2ва кислота (Н-бензоїл-гліцин), ацетсечова кислота {1-{4-(1-циклобутил-метаноїлокси)-феніл](N-ацетилгліцин), флоретинова кислота (3-(4метаноїлокси}-5-гідроксиметил-феніл)-3-фенілгідроксифеніл)-пропіонова кислота), фталева киспропіл]-діізопропіл-амонію, хлорид [(R)-3-(2-{1-[4лота, метансульфонова кислота або оротова кис(1-циклогексил-метаноїлокси)-фенілї]лота. метаноїлокси}-5-гідроксиметил-феніл)-3-фенілЗгідно з головною метою винаходу крім того проліл]-діізопропіл-амонію, хлорид [(R)-3-(2-{1-[4запропоновано сполуки загальної формули 2 з R(2,2-диметил-пропаноїлокси)-феніл]конфігурацією метаноїлокси}-5-гідроксиметил-феніл)-3-фенілпропіл]-діізопропіл-амонію, хлорид {(R)-3-(2-{1циклопропіл-метаноїлокси)-5-гідроксиметилфеніл]-3-феніл-пропіл}-діізолропіл-амонію, хлорид {(R)-3-[2-(1-циклобутил-метаноїлокси)-5гідроксиметил-феніл}-3-феніл-пропіл}-діізопропіламонію, хлорид {(R)-3-{2-(1-циклопентилметаноїлокси)-5-гідроксиметил-феніл]-3-фенілпропіл}-діізопропіл-амонію та хлорид {(R)-3-[2-(1циклогексил-метаноїлокси)-5-гідроксиметилфеніл]-3-феніл-пропіл}-діізопропіл-амонію. Для сполук представленого винаходу вираз у якій R є С1-С6алкілом, С3-С10циклоалкілом "алкіл" переважно встановлено для гідрогенової або незаміщеним чи заміщеним фенілом, а "Х-" групи з лінійним чи розгалуженим ланцюгом, що відповідний кислотний залишок фізіологічно сумісмає 1-6 С-атоми. Особливо переважними є метил, ної неорганічної або органічної кислоти. етил, пропіл, ізопропіл, бутил, ізобутил, пентил та Згідно з головною метою винаходу сполуки у гексил. Вираз "циклоалкіл" означає циклічні гідроформі їх солей загальної формули 2 можуть містигенові групи, що мають 3-10 атомів гідрогену, що ти відповідний кислотний залишок "Х-" нижченавеможуть також містити придатні замісники замість дених кислот: атомів гідрогену. гідрохлоридна кислота, гідробромідна кислота, Вираз "феніл" означає групу С6Н5-, що може фосфатна кислота, сульфатна кислота, нітратна бути заміщеною або незаміщеною. Придатними кислота, оцтова кислота, пропіонова кислота, пазамісниками можуть бути, наприклад, алкіл, алкокльмітинова кислота, стеаринова кислота, малеїносил, галоген, нітрогрупа та аміногрупа. Вираз "алва кислота, фумарова кислота, щавлева кислота, коксил" з огляду на алкільний компонент має таке янтарна кислота, DL-яблучна кислота, L-(-)ж значення, як наведене вище для "алкілу". Прияблучна кислота, D-(+)-яблучна кислота, DL-винна датними галогенами є атоми флуору, хлору, брому кислота, L-(+)-винна кислота, D-(-)-винна кислота, та йоду. лимонна кислота, L-аспарагінова кислота, L-(+)Представлений винахід також включає спосоаскорбінова кислота, D-(+)-глюкуронова кислота, би виготовлення сполуки згідно з винаходом зага2-оксопропіонова кислота (пірувинна кислота), льної формули І, а також цінних інтермедіатів. фуран-2-карбонова кислота (муцинова кислота), Спосіб характеризується хемо- та регіоселекбензойна кислота, 4-гідроксибензойна кислота, тивністю. саліцилова кислота, ванільна кислота, 4Сполуки загальної формули ІІІ, у яких R є С1гідроксицинамова кислота, галова кислота, гілуроС6алкілом, С3-С10циклоалкілом або незаміщеним ва кислота (Н-бензоїл-гліцин), ацетсечова кислота чи заміщеним фенілом, а X- - кислотний залишок (N-ацетилгліцин), флоретинова кислота (3-(4фізіологічно сумісної неорганічної або органічної гідроксифеніл)-пропіонова кислота), фталева кискислоти, виробляють так лота, метансульфонова кислота або оротова киса) сполуку формули III лота. Кращими сполуками представленого винаходу є солі гідрофумарат R-(+)-2-(3-діізопропіламіно-1феніллропіл)-4-гідроксиметилфеніл iзомасляного естеру та гідрат гідрохлориду R-(+)-2-(3діізопропіламіно-1-фенілпропiл)-4гідроксиметилфенілізомасляного естеру. Крім того, кращими є сполуки, в яких R - циклопропіл, циклобутил, циклопентил, циклогексил, 4-(1-цикло-пропіл-метаноїлокси)-феніл, 4-(1розщеплюють гідрувальним засобом з утвоциклобутил-метаноїлокси)-феніл, 4-(1ренням сполуки ФормулиV циклогексил-метаноїлокси)-феніл або 4-(2,2диметил-пропаноїлокси)-феніл, а X- означає хлорид. Особливу перевагу представляють хлорид 7 77322 8 аскорбінова кислота, D-(+)-глюкуронова кислота, 2-оксопропіонова кислота (пїрувинна кислота), фуран-2-карбонова кислота (муцинова кислота), бензойна кислота, 4-гідроксибензойна кислота, саліцилова кислота, ванільна кислота, 4гідроксицинамова кислота, галова кислота, гіпурова кислота (Н-бензоїл-гліцин), ацетсечоеа кислота (N-ацетилгліцин), флоретинова кислота (3-(4гідроксифеніл)-пропіонова кислота), фталева кислота, метансульфонова кислота або оротова кислота. після чого Згідно з переважною розробкою винаходу b) отриману сполуку формули V перетворюють описано спосіб виготовлення сполуки загальної відновником у сполуку формули VI формули 2 з R-конфігурацією яку c) перетворюють ацилувальним засобом у сполуку формули А, в якій R визначено вище, яку d) перетворюють фізіологічно сумісною неорганічною або органічною кислотою з утворенням сполуки формули І у якій R є С1-С6алкілом, С3-С10циклоалкілом або незаміщеним чи заміщеним фенілом, а Х- кислотний залишок фізіологічно сумісної неорганічної або органічної кислоти. Згідно з винаходом, для виготовлення сполуки загальної формули І використовують такі кислоти: гідрохлоридна кислота, гідробромідна кислота, фосфатна кислота, сульфатна кислота, нітратна кислота, оцтова кислота, пропіонова кислота, пальмітинова кислота, стеаринова кислота, малеїнова кислота, фумарова кислота, щавлева кислота, янтарна кислота, DL-яблучна кислота, L-(-)яблучна кислота, D-(+)-яблучна кислота, DL-винна кислота, L-(+)-винна кислота, D-(-)-винна кислота, лимонна кислота, L-аспарагінова кислота, L-(+) у якій R є С1-С6алкілом, С3-С10циклоалкілом або незаміщеним чи заміщеним феніл, а Х- - кислотний залишок фізіологічно сумісної неорганічної або органічної кислоти, таким чином а) сполуку формули 3 розщеплюють гідрувальним засобом з утворенням сполуки формули 5 після чого b) отриману сполуку формули 5 перетворюють відновником у сполуку формули 6 9 77322 10 у відповідну високочисту кристалічну стабільну яку сіль. с) перетворюють засобомацилування з одерЗалежно від використаного хлорангідриду жанням сполуки формули 1 отримують сполуки загальної формули 1 у якій R визначено вище, яку d) перетворюють фізіологічно сумісною неорганічною або органічною кислотою з утворенням сполуки формули 2 у якій R є С1-С6алкілом, С3-С10циклоалкілом або незаміщеним чи заміщеним фенілом, а X- кислотний залишок фізіологічно сумісної неорганічної або органічної кислоти. Переважно для одержання сполуки загальної формули 2 згідно зі способом використовують такі кислоти: гідрохлоридна кислота, гідробромідна кислота, фосфатна кислота, сульфатна кислота, нітратна кислота, оцтова кислота, пропіонова кислота, пальмітинова кислота, стеаринова кислота, малеїнова кислота, фумарова кислота, щавлева кислота, янтарна кислота, DL-яблучна кислота, L(-)-яблучна кислота, D-(+)-яблучна кислота, DLвинна кислота, L-(+)-винна кислота, D-(-)-винна кислота, лимонна кислота, L-аспарагінова кислота, L-(+)-аскорбінова кислота, D-(+)-глюкуронова кислота, 2-оксопропіонова кислота (пірувинна кислота), фуран-2-карбонова кислота (муцинова кислота), бензойна кислота, 4-гідроксибензойна кислота, саліцилова кислота, ванільна кислота, 4гідроксицинамова кислота, галова кислота, гіпурова кислота (Н-бензоїл-гліцин), ацетсечова кислота (N-ацетилгліцин), флоретинова кислота (3-(4гідроксифеніл)-пропіонова кислота), фталева кислота, метансульфонова кислота або оротова кислота. Особливо переважно на основі кристалічного метилового естеру R-(-)-4-беизилокси-3-(3діізопропіламіно-1-феніл-пропіл)бензойної кислоти виготовляють високочистий кристалічний інтермедіат, метиловий естер R-(-)-3-(3-днзопропіламінофеніл-пропіл)-4-гідрокси-бензойної кислоти, який відновлюють до R-(+)-2-(3-діїзопропіламіно-іфенілпропіл)-4-гідроксиметилфенолу, а під кінець ацилують придатним способом та далі перетворюють фізіологічно сумісною неорганічною або органічною кислотою при самовільній кристалізації у якій R є С1-С6алкілом, зокрема ізопропілом, С3-С10циклоалкілом або незаміщеним чи заміщеним фенілом. Для одержання сполуки згідно з винаходом у формі їх солей вирішальними є особливий реакційний процес через певні проміжні етапи та придатні для індивідуального впізнання інтермедіати. Це пояснено, використовуючи реакційну діаграму 1 (дивися Фіг.), в якій описано перетворення сполук з R-конфігураціею, але без цього обмеження. При цьому: 3 = метиловий естер R-(-)-4-бензилокси-3-(3діізопропіламіно-1-феніл-пропіл)-бензойної кислоти 4 = R-(+)-[4-бензилокси-3-(3-дІізопропіламіно1-феніл-пропіл)-феніл]-метанол 5 = метиловий естер R-(-)-3-{3діізопропіламіно-феніл-пропіл)-4-гідроксибензойної кислоти 6 = R-(+)-2-(3-діізолропіламіно-1-фенілпропіл)4-гідроксиметилфенол 1 = R-(+)-2-(3-діізолропіламіно-1-фенілпропіл)4-гідроксиметилфеніл-ізомасляний естер 2а = гідрофумарат R-(+)-2-(3-діізопропіламіно1-фенілпропіл)-4-гідроксиметилфенілізомасляного естеру 2b = гідрат гідрохлориду R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфеніл-ізомасляного естеру Згідно реакційного процесу, поясненого у втіленні на підготовчому етапі метиловий естер 3 (R(-)-4-бензилокси-3-(3-діізопропіламіно-1-фенілпропіл)-бензойної кислоти) виготовляють у кристалічно чистій формі. Використовуючи звичайні засоби, як-то ВВr3, АІСІ3, але переважно водень з нікелем Ренея у метанолі як розчиннику, при кімнатній температурі (кт), на підготовчому етапі 3 розщеплюють у метиловий естер {R-(-)-3-(3-діізопропіламіно-фенілпропіл)-4-гідроксибензойної кислоти, 5. Це дає високочисту кристалічну форму (температура плавлення 143,7°С). Під кінець, використовуючи придатний відновник, як-то NaBH4/EtOH, переважно LіАІН4, 5 відновлюють у інертному розчиннику при низькій температурі (-78°С- +10°С) та отримують сполуку 6, [R-{+)-2-(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенол). Сполуку 6 отримують у високочистому стані і її можна кристалізувати з придатного розчиннику, як-то етилацетат. Безбарвний компактний гранульований матеріал має температур плавлення 102,3°С. Це є неочікуваним тим, що 11 77322 сполуку β у рівні техніки описано як аморфну тверду речовину. Сполуку 6 далі ацилують з дуже гарним виходом, регіо- та хемоселективністю у фенольний естер. Цю реакцію проводять при кімнатній температурі або низькій температурі еквівалентом хлорангідриду у присутності основи у придатному розчиннику. Придатними розчинниками є етилацетат, дихлорметан, тетрагідрофуран, ацетонітрил або толуол. Реакцію переважно проводять з ізобутирилхлоридом як хлорангідридом, та триетиламіном як основою, при вищезгаданих температурах. Далі отриманий 1, ізомасляний естер (R-(+)-2-(3 діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу), має таку чистоту, що з розчинами фумарової кислоти у придатних розчинниках починається самовільна кристалізація з утворенням гідрофумарату 2а. Ця сіль має високу температуру плавлення 103°С, є стабільною при кімнатній температурі, є негігроскопічною і не містить кристалізуючих засобів. Її можна перекристалізовувати так часто, як потрібно. Якщо замість фумарової кислоти використовують безводну гідрохлоридну кислоту, наприклад, як ефірний розчин, також відбувається утворення солі кристалічного продукту 2b, отриманого гідрату гідрохлориду ізомасляного естеру (R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу. Після подальшої перекристалізації продукт 2b має температуру плавлення 97-106°С. Під кінець, продукт 2b можна особливо гарно отримувати наступними варіантами реакції інверсії, починаючи зі сполуки 6 на діаграмі реакцій 1. Продукт 2b можна тому отримати без додавання додаткової зв'язуючої кислоту основи, як пояснено у наступному. Розчини 6, (R-(+)-2-(3-діізопропіламіно-1фенілпропіл)-4-гідроксиметилфенолу), додають краплями у розчини ізобутиратхлориду так, щоб в умовах придатної полярності швидко викристалізовується безводний продукт 2b. 2b є дуже гігроскопічним. Якщо вищезазначені реакції проводять у вологому розчиннику, що містить щонайменше один молярний еквівалент води, отримують стабільний кристалічний продукт 2b з вмістом гідрату, що має вищезгадані характеристики плавлення. Сполуки згідно з винаходом загальних формул 1 та 2 підхожі як сипучий матеріал. Особливу перевагу мають високочисті сполуки загальних формул III, V, VI, 3, 5, 6 та 7, які можна отримати. Сполука формули III 12 Сполука формули V Сполука формули VI Сполука формули 3 Сполука формули 5 Сполука формули 6 Сполука формули 7 13 77322 14 приладі Mettler FP, або диференційним термоаналізом (DSC) на приладі Perkin Elmer, модель DSC7, використовуючи програму оцінки "Pyris". Виміри у видимому та ультрафіолетовому світлі проводили на спектрофотометрі моделі Lambda 7 (Perkin-Elmer) при товщині шару 1см. Специфічне поглинання визначали для 1% розчину (А1%1см). ІЧ спектри реєстрували на спектрометрі Perkin-Elmer FTIR Series 1610 (розділення 4см-1). Газову хроматографію/мас спектрометрію (ГХМС, значення m/z та відносну стосовно основного хлорид [(R)-3-{2-{1-[4-(2,2-диметиліона інтенсивність (%)) визначали на потрійному пропанотокси)-феніл]-метаноїлокси}-5-{(-[4-(2,2мас-спектрометрі Finnigan TSQ 700 способом видиметил-пропаноїлокси)-феніл]міру при позитивній (Р-СІ) або негативній (N-CI) метаноїлоксиметил}-феніл)-3-феніл-пропіл]хімічній іонізації з метаном або аміаком як реагендіізопропіламонію. тним газом або іонізацією електронним ударом. Вищезгадані сполуки III, V, VI, 3, 5, 6 та 7 осоГідрокси-слолуки вимірювали як похідні триметилбливо добре використовувати у кожному випадку силілового етеру. як високочисті, кристалічні стабільні інтермедіати у Сполучені рідинна хроматографія/мас спектвиробництві фармацевтично корисних сполук. рометрія (РХ-МС): Особливу перевагу мають сполуки для викоWater Integrity System, Thermabeam Mass ристання в якості інтермедіатів у виробництві гідDetector (El, 70eB), значення m/z та відносну інтенрофумарату ізомасляного естеру R-(+)-2-(3сивність (%) дано у кількісних межах 50-500о.а.м.. діізопроліламіно-1-фенілпроліл)-4II. Втілення гідроксиметилфенілу, гідрату гідрохлориду ізомасАрабські числа у дужках (3), (4), (5), (6) стосуляного естеру R-(+)-2-(3-діізопропІламіно-1ються ідентичних позначок у діаграмі реакцій 1. фенілпропіл)-4-гідроксиметил фенілу. 1. Виготовлення Під кінець, спосіб можна здійснити особливо метилового естеру R-(-)-4-бензилокси-3-(3кращим шляхом перетворенням сполуки загальної діізопропіламіно-1-феніл-пропіл)-бензойної кислоформули 6 (дивися діаграму реакцій 1) еквіваленти (3) том ізобутирилхлориду у присутності триетиламіну, використовуючи один з відповідних розчинників: етилацетат, дихлорметан, тетрагідрофуран, ацетонітрил або толуол, регiо- та хемоселективно, у ізомасляний естер R-(+)-2-(3-дІІзопропіламІно-1фенілпропіл)-4-гідроксиметилфенілу. Згідно з винаходом ізомасляний естер R-(+)-2(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу є особливо придатним для перетворення фумаровою кислотою або гідрохлоридною кислотою з утворенням відповідної солі. Розчин гідрохлориду R-(-)-4-бензилокси-3-(3Наступні втілення пояснюють винахід. діізопропіламіно-1-феніл-пропіл)-бензойної кислоЕксперимент ти (2,30кг, 4,77моль) у 26,4л метанолу та 0,25л I. Загальне концентрованої сульфатної кислоти гріють протяУсі сполуки повністю охарактеризовано 1H та 13 гом 16 годин з рециклуванням. Далі третю частину С ЯМР-спектроскопією (Bruker DPX 200). Встарозчиннику відганяли, охолоджували та при переновлені хімічні зсуви у 13С ЯМР-спектрах (50МГц, у мішуванні змішували з 5кг льоду та 2,5л 25% водчнм) стосуються резонансів розчиннику CDCI3 ного розчину карбонату натрію. Осад спочатку (77,10чнм). Дані 1H ЯМР (CDCI3; 200МГц, чнм) стоекстрагували 15л, а далі ще 5л дихлорметану. суються тетраметилсилану як внутрішнього станОрганічні фази очищали та концентрували на родарту). торному випарнику досуха. Отримували 1,99кг Тонкошарову хроматографію (DC, наведено (90,7% від теоретичного) темно-жовтого масла Rf) проводили на силікагелевих плівках Е. Merck чистотою приблизно 90% (DC, ЯМР). DC (1): 0,58. 5 10см (60F254), та плями проявляли флуоресце13 С-ЯМР (CDCI3): 20,55, 20,65, 36,83, 41,84, нцією видалених ділянок або розпиленням лужно43,83, 51,82, 70,12, 111,09, 122,46, 125,28, 127,49, го розчину перманганату калію. 128,02, 128,35, 128,50, 129,22, 129,49, 133,20, Абсорбентними системами були: (1), н136,39, 144,51, 159,87, 167,09. гексан/ацетон/триетиламін (70/20/10,% за масою); Перекристалізація (2), толуол/ацетон/метанол/оцтова кислота 69,0 масляного сировинного матеріалу розчи(70/5/20/5, % за масою). няли у 150мл киплячого метанолу. Після додаванОптичне обертання вимірювали на довжині ня 15мл дистильованої води це залишали при 0°С, хвилі 589,3нМ (D-лінія натрію), при кімнатній темпісля чого осаджувалися безбарвні кристали, які пературі, використовуючи етанол як розчинник відфільтровували, промивали невеликою кількістю (поляриметр: Perkin Elmer, тип 241), температури холодного метанолу та сушили у вакуумі. Вихід; плавлення (у °С) не коректували та визначали на 15 77322 16 41,8г (60,6% від теоретичного) безбарвних криста39,68, 42,36, 48,64, 51,42, 117,99, 120,32, 126,23, лів, температура плавлення 89,8°С; [І]n20=-30,7 127,81, 128,85, 129,39, 130,26, 132,21, 144,06, (с=1,0, етанол). 162,43, 167,35. 2. Виготовлення 4. Виготовлення R-(+)-[4-бензилокси-3-(3-діізопропіламіно-1R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)феніл-пропілфеніл]-метанолу (4) 4гідроксиметилфенолу (6) Сирий продукт (3) (28г) розчиняють у 230мл чистого діетилового етеру та при перемішуванні додають краплями у суспензію 1,8г алюмогідриду літію у діетиловому етері (140мл). Через 18 годин перемішування при кімнатній температурі додають 4,7мл води у формі крапель. Органічну фазу відділяють, сушать безводним сульфатом натрію, фільтрують та концентрують на роторному випарнику досуха. Отримують 26г (98,9% від теоретичного) R-(+)-[4-бензилокси-3-(3-діізопропіламіно-1-фенілпропіл)-феніл]-метанолу (4) як безбарвне масло. DC (2): 0,32; [I]n20=+6,3 (с=1,0, етанол). 13 С-ЯМР (CDCI3): 20,53, 20,61, 36,87, 41,65, 44,14, 48,82, 65,12, 70,09, 111,80, 125,77, 125,97, 126,94,127,55, 128,08, 128,37, 128,44, 133,27, 134,05, 134,27, 137,21, 144,84. 3. Виготовлення метилового естеру R-(-)-3-(3-діізопропіламінофеніл-пропіл)-4-гідрокси-бензойної кислоти (5) До перемішуваної суспензії 5г нікелю Ренея (промивали водою, далі метанолом) у 200мл метанолу, додають 10г (21,8ммоль) метилового естеру R-(-)-4-бензилокси-3-(3-діізопропіламіно-1феніл-пропіл)-бензойної кислоти (3). Після недовгого нагрівання для повного розчинення (3), апаратуру поміщають в атмосферу водню. Через три години перемішування при звичайному тиску та кімнатній температурі, тонкошарова хроматографія показала повне перетворення. Осад промивають азотом та після додавання деякої кількості активного вугілля фільтрують. Після концентрації метанольного розчину на роторному випарнику 6,0г (75% від теоретичного) метиловий естер R-(-)3-(3-діізопропіламінофеніл-пропІл)-4-гідроксибензойної кислоти (5) залишається у формі безбарвних кристалів чистотою 99,6 % (ВЕРХ). Температура плавлення 143,7°C; DSC 144,7°С [l]D20=-26,6 (С=0,93, етанол). 13 С-ЯМР (CDCI3): 18,74, 19,21, 19,62, 33,12, a) початок з проміжного етапу (4), R-(+)-[4бензилокси-3-(3-діізопропіламіно-1-феніл-пропіл)феніл]-метанол R-(+)-[4-бензилокси-3-(3-діізопропіламіно-1феніл-пропіл)-феніл]-метанол (19,7г, 45,7ммоль) розчиняють у 220мл метанолу та нікелю Ренея (5г). Апаратуру промивають газуватим воднем та осад перемішують до двох діб при кімнатній температурі. Після додавання ще 5г нікелю Ренея, перемішування продовжують ще дві доби при кімнатній температурі в атмосфері водню, а потім відфільтровують від каталізатору та концентрують досуха на роторному випарнику. Маслянистий блідо-жовтий залишок розчиняють у 100мл діетилового етеру, промивають двічі 100мл води кожного разу, сушать сульфатом натрію, фільтрують та концентрують досуха. 14,1г (90,4% від теоретичного) R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенолу отримують у формі кремової, аморфної твердої речовини. Стосовно перекристалізації дивися с). b) початок з проміжного етапу (5); метиловий естер R-(-)-3-(3-діізопроліламіно-феніл-пропІл)-4гідрокси-бензойної кислоти Розчин 370мг (1,0ммоль) метилового естеру R-(-)-3-(3-діізопропіламіно-феніл-пропіл)-4гідрокси-бензойної кислоти у 20мл безводного тетрагідрофурану повільно додають краплями при кімнатній температурі у перемішувану суміш сухого тетрагідрофурану (10мл) та 1Μ розчину алюмогідриду літію у тетрагідрофурані (3мл) (в захисній атмосфері азоту). Надлишок гідриду розкладають додаванням краплями насиченого розчину карбонату натрію. Після відділення органічної фази її концентрують на роторному випарнику та далі сушать у високому вакуумі. Отримують 274мг (74% від теоретичного) блідо-жовтого масла, що повільно твердне у аморфну масу. c) Перекристалізація: Сирий продукт 6 (1,0г) розчиняють у етилацетаті та знов концентрують на роторному випарнику. Діол, вивільнений при цьому від чужинних розчинників (діетиловий етер або тетрагідрофуран, дивися вище), має 1,5мл етилацетату, доданого при легкому нагрівання. Перемішування проводять до прозорості розчину, а потім охолоджують при кімнатній температурі та додають кілька затравочних кристалів. Їх отримують очисткою сирого 6 за допомогою ВЕРХ, збиранням головної фракції, концентрацією цього та сушкою залишку протягом кількох годин у високому вакуумі. При чітко визна 17 77322 18 ченому початку кристалізації, суміш залишають початку помутніння. Безбарвний гомогенний осад при - 10°С. Кристали відсмоктують холодними та спочатку залишають протягом 18 годин при кімнасушать у вакуумі. Отримують безбарвні кристали з тній температурі, та далі протягом кількох годин виходом 84%. при 0°С. Безбарвні кристали, що осадилися відсТемпература плавлення 102,3°C DC (1): 0,57 моктують, промивають невеликою кількістю цикло20 [l]D =+21,3 (с=1,0, етанол). гексану/2-бутанону (90:10, об'ємн.%)та сушать у 13 С-ЯМР (CDCI3): 19,58, 19,96, 33,30, 39,52, вакуумі при 30°С. 44,6г (83,1% від теоретичного) 42,10, 48,00, 65,40, 118,58, 126,31, 126,57, 127,16, Отримують гідрофумарат ізомасляного естеру R127,54, 128,57, 132,63, 132,83, 144,55, 155,52. (+)-2-(3-діізопропіламіно-1-фенілпропіл)45. Виготовлення гідроксиметилфенілу у формі безбарвних пластівізомасляного естеру R-(+)-2-(3ців. діізопропіламіно-1-фенілпропіл)-4Температура плавлення 98,8°С, друга кристагідроксиметилфенолу (1) лізація з того ж розчиннику забезпечує продукт з 5. Виготовлення температурою плавлення 103°С. ізомасляного естеру R-(+)-2-(3[I]n20=+6,0 (с=1,0, етанол). діізопропіламіно-1-фенілпропІл)-4Елементарний аналіз: Розраховано для гідроксиметилфенолу (1) C30H41NO7 (молекулярна маса 527,66) С 68,29 %, Η 7,83 %, Ν 2,65 %, 0 21,2 %, виявлено С 68,29 %, Η 7,90 %, Ν 2,72 %, 0 21,0 %. Виміри у видимому та ультрафіолетовому світлі при у нм (А1%1см): 191 (1306), 193 (1305), 200 (1143), 220 (456). ІЧ-спектр: 3380, 2978, 2939, 2878, 2692, 2514, 1756, 1702, 1680, 1618, 1496, 1468, 1226, 1040, 1019, 806, 1 H-ЯМР (CDCI3): 1,198, 1,285, 1,287 (СН3); 2,541 (СНС=О); 3,589 (NCH); 4,585 (СН2ОН); 6,832 Розчин R-(+)-2-(3-діізопропіламіно-1(=СН, фумарат); 6,84-7,62 (арил, = СН). фенілпропіл)-4-гідроксиметилфенолу (6) (65,0г, 13 С-ЯМР (CDCI3): 17,79, 18,95, 19,16 (СН3); 190,3ммоль) та триетиламіну (20,4г, 201,7ммоль) у 31,63 (СНСН2); 34,09 (СН-С=О); 41,87 (СНСН2); 750мл дихлорметану має розчин ізобутиратхлори45,83 (NCH2); 54,29 (NCH); 63,78 (ОСН2); 122,23, ду (23,4г, 201,7ммоль) у 250мл дихлорметану, до126,48, 126,77, 127,56, 140,46, 140,52, 142,35, даного при перемішуванні та охолодженні. Після 147,54 (Арил СН); 135,54 (=СН, фумарат); 170,48 додавання перемішують ще 15 хвилин при 0°С, (С=О, фумарат); 175,62 (і-Рr-С=О). далі протягом 30 хвилин при кімнатній температурі МС у прямому впуску, m/z (%): 411 (1), 396 (9), та далі почергово промивають водою (250мл) та 380 (1), 223 (2), 165 (2), 114 (100), 98 (4), 91(3), 5% водним розчином гідрокарбонату натрію. Ор84(3), 72 (10), 56 (7). ганічну фазу відділяють та концентрують на рото7. Виготовлення рному випарнику досуха. Ізомасляний естер R-(+)гідрату гідрохлориду ізомасляного естеру R2-(3-діізопропіламіно-1-фенілпропіл)-4(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу отримують як безбарвне в'ягідроксиметилфенілу зке масло; вихід: 77,1г (98,4 % від теоретичного). DC (І): 0,26; [I]D22=+2,7 (с=1,0, етанол). 13 С-ЯМР (CDCI3): 19,01, 19,95, 20,59, 21,12, 34,28, 36,89, 41,88, 42,32, 43,90, 48,78, 64,68, 122,57, 125,59, 126,16, 126,86, 127,96, 128,54, 136,88, 138,82, 143,92, 147,90, 175,96. 6. Виготовлення гідрофумарату ізомасляного естеру R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу. Розчин 41,87г (102ммоль) ізомасляного естеру R-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу у 90мл 2-бутаноні має фумарову кислоту (11,81г, 102ммоль), додану при нагріванні. Після розчинення кислоти, циклогексан (20-30мл) повільно додають при перемішуванні до Розчин масляного естеру R-(+)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілу (8,54г, 25,0ммоль) у 50мл дихлорметану повільно додають краплями при 0°С у перемішуваний розчин ізобутиратхлориду (2,66г, 25,0ммоль) у 100мл дихлорметану. Через годину охолодження видаляють, та знов перемішують протягом додаткової години. Після видалення летючих компоненти у вакуумі на роторному випарнику залишається безбарвна аморфно-тверда піна. Цей залишок розчиняють у ацетоні (17мл), додають 0,45-0,50г води та діетиловий етер (приблизно 20-25мл) до початку помутніння. Після недовгої обробки ультразвуком кристалізація починається самовільно і при перемішуванні повільно додають ще 80мл діетилового етеру. Осаджені 19 77322 20 безбарвні кристали відсмоктують та сушать протя165-6°С. 13 гом ночі у вакуумі пентоксидом фосфору. ОтримуС-ЯМР (DMSO-d6=39,7чим): 16,52, 16,68, ють 10,5г (93,7% від теоретичного) безбарвного 17,98, 18,11, 26,87, 31,46, 41,71, 45,33, 53,89, кристалічного гідрату гідрохлориду ізомасляного 53,98, 62,65, 122,61, 122,97, 125,94, 126,09, 126,57, естеру R-(+)-2-{3-діізопропіламіно-1-фенілпропіл)126,75, 127,87, 128,58, 131,80, 134,94, 141,02, 4-гідроксиметилфенілу з чистотою 97,0% (ВЕРХ). 142,69, 147,17, 155,32, 163,92, 176,21. Температура плавлення 97,1°С. R = С-С3Н5 [I]о=+4,3 (с=1,03, етанол) Гідрохлорид R-(+)-циклопропанкарбонової ки13 С-ЯМР (CDCI3): 16,94, 17,35, 18,24, 18,40, слоти-2-(3-діізопропіламіно-1-феніл-пропіл)-418,87, 19,05, 31,20, 33,99, 41,64, 45,41, 54,18, гідроксиметилфенілового естеру. 54,42, 63,83, 122,25, 126,50, 126,70, 126,96, 127,34, Безбарвна воскоподібна речовина. 13 128,60, 133,80, 140,55, 142,17, 147,68, 175,79. С-ЯМР (DMSO-d6=39,7чнм): 173,02, 172,49, 8. Фенольний моноестер 172,37, 153,10, 147,12, 142,72, 142,03, 140,78, 136,60, 134,79, 134,35, 129,55, 129,13, 128,80, 128,67, 127,87, 126,96, 126,74, 125,94, 125,84, 124,37, 123,71, 122,80, 62,64, 53,92, 45,34 41,65, 31,44, 18,05, 16,66, 12,84, 9,58, 9,28, 8,49, 7,89. Гідрохлооид R-(+)-циклобутанкаобонової кислоти-2-(3-діізопропіламіно-1-феніл-пропіл)гідроксиметилфенілового естеру Безбарвна воскоподібна речовина. 13 С-ЯМР (DMSO-d6=39,7чнм): 173,53, 147,12, 142,81, 140,74, 134,77, 128,65, 127,81, 126,74, Загальну обробку описано для виготовлення 125,99, 125,87, 122,75, 62,63, 53,92, 45,34, 41,42, фенольних моноестерів 37,38, 31,54, 25,04, 24,92, 18,03, 16,68, 16,61. У розчин 120,3мг (0,352ммоль) R-(+)-2-(3-діізоR = C-C5H9 пропіламіно-1-фенілпроліл)-4-гідроксифенолу (6) у Гідрохлорид R-(+)-циклопентанкарбонової ки5мл дихлорметану при перемішуванні при 0°С слоти-2-(3-діізопропіламіно-1-феніл-пропіл)-4додають краплями розчин кислоти хлорид гідроксиметилфенілового естеру (0,352ммоль) у 2мл дихлорметану. Далі додають Безбарвна воскоподібна речовина. триетиламін-дихлорметан (49,1мкл/0,353ммоль13 С-ЯМР (DMSO-d6=39,7чнм): 174,80, 147,22, 2мл). Через 18 годин при кімнатній температурі 142,86, 140,76, 134,72, 128,66, 127,80, 126,73, тонкошарова хроматографія виявляє, що перетво126,04, 125,88, 122,71, 62,62, 53,94, 45,37, 43,24, рення є повним. Осад промивають послідовно 5мл 41,39, 31,54, 29,78, 29,59, 25,64, 25,59, 18,07, вод, водною 0,1Η гідрохлоридною кислотою, 5мл 16,64. 5% водного розчину гідрокарбонату натрію, 5мл R = С-С6Н11 води, сушили сульфатом натрію та після фільтруГідрохлорид R-(+)-цикпогексанкарбонової кисвання концентрують досуха. Далі його сушать у лоти-2-(3-діізопропіламіно-1-феніл-пропіл)-4високому вакуумі до постійної маси. гідроксиметилФенілового естеру Наступні сполуки, як приклад, виробляють, виБезбарвна воскоподібна речовина. користовуючи цей спосіб: 13 С-ЯМР (DMSO-d6=39,7чнм): 174,08, 147,15, R = СН2СН(СН3)2 142,85, 140,77, 134,78, 128,66, 127,77, 126,74, R-(+)-3-метилмасляної кислоти-2-(3126,06, 125,87, 122,69, 62,61, 53,91, 45,36, 42,26 діізопропіламіно-1-феніл-пропіл)-4-гідрокси мети41,24, 31,53, 28,74, 28,62, 25,48, 25,04, 24,98, лфеніловий естер 18,05, 16,67, 16,60. Безбарвне масло, 70% вихід та >95% чистоти R = 4-(С2Н5СО2)-С6Н4 (ЯМР). 13 Гідрохлорид R-(+)-етилкарбонілокси-бензойної С-ЯМР (CDCl3): 20,45, 20,59, 22,54, 25,70, кислоти-2-(3-діізопропіламіно-1-феніл36,74, 42,18, 43,27, 43,96, 48,90, 64,67, 122,66, дропіл)гідроксиметилфенілового естеру 125,60, 126,20, 126,79, 127,95, 128,37, 136,83, Безбарвні кристали, температура плавлення 138,86, 143,83, 147,82, 171,37. DC (1): 0,76. 195-8°С. R = СН2С(СН3)3 1 H-ЯМР (DMSO-d6): 9,87 (s, 1H може бути заR-(+)-3,3-диметилмасляної кислоти-2-(3міщеним D2O, NH), 8,19-8,12 (m, 2H, Феніл-Н), 7,55 дiiзопропіламіно-1-феніл-пропіл)-4(d, J=1,0Гц, 1Н, Феніл-Н3), 7,41-7,13 (m, 9Н, Фенілгідроксиметилфеніловий естер, вільна основа Н), 5,28 (or s, 1H може буmи заміщеним D2O, OH), Безбарвне масло, 69,7% вихід та >95% чисто4,53 (s, 2H, СН2), 4,23 (t, J=7,6Гц, 1Н, СН), 3,61ти (ЯМР). 13 3,50 (m, 2H, 2 x СН(СН3)2), 2,97-2,74 (m, 2Н, СН2), С-ЯМР (CDCI3): 20,40, 20,53, 29,73, 30,99, 2,67 (q, J=7,4Гц, 2Н, СН2), 2,56-2,43 (m, 2Н, СН2), 36,62, 42,17, 44,01, 47,60, 49,01, 64,65, 1,23-1,13 (m, 15Н, 2 x СН(СН3)2, СН3). 122,64,125,60, 126,20, 126,80, 127,96, R = 4-(і-С3Н7СО2)-С6Н4 128,36,136,85, 138,90, 143,80, 147,82, 170,55. Гідрохлорид R-(+)-4-(ізопропілкарбонілокси)DC (1): 0,75. бензойної кислоти-2-(3-діізопропіламіно-1-фенілR = (СН3)3С пропіл)-4-гідроксиметилфенілового естеру Гідрохлорид R-(+)-3-півалової кислоти-2-(3Безбарвні кристали, температура плавлення діізопропіламіно-1-феніл-пропіл)-4202-4°С. гідроксиметилфенілового естеру 1 Н-ЯМР (DMSO-d6): 9,73 (s, 1Н може бути заБезбарвні кристали, температура плавлення 21 77322 22 міщеним D2O, NH), 8,19-8,12 (m, 2Н, Феніл-Н), 7,55 діізопропіламіно-1-феніл-пропіл)-4(d, J=1,4Гц, 1Н, Феніл-Н3), 7,42-7,14 (m, 9H, ФенілгідроксиметилФенілового естеру Н), 5,27 (br s, 1H може бути заміщеним D2O, OH), Безбарвні кристали, температура плавлення 4,53 (s, 2Н, СН2), 4,23 (t, J=7,5Гц, 1Н, СН), 3,61212-217°С. 1 3,50 (m, 2H, 2 x СН(СН3)2), 2,99-2,78 (m, 3Н, СН2, Н-ЯМР (DMSO-d6): 9,34 (s, 1Н, може бути заСН(СН3)2), 2,54-2,47 (m, 2Н, СН2), 1,29-1,13 (m, міщеним D2О, NH), 8,16-8,12 (m, 2H, феніл-Η), 7,54 18Н, 3 x СН(СН3)2). (d, J=1,4Гц, 1H, феніл-Н3), 7,39-7,14 (m, 9H, ФенілR = 4-(t-C4H9CO2)-C6H4 Η), 5,26 (t, 1H, може бути заміщеним D2O, ОН), R-(+)-4-(трет-бутилкарбонілокси)-бензойної 4,53 (d, J=4,2Гц, 2Н, СН2), 4,22 (t, J=7,5Гц, 1Н, СН), кислоти-2-(3-діізопропіламіно-1-феніл-пропіл)-43,62-3,48 (m, 2Н, 2 х СН(СН3)2), 3,00-2,60 (m, 3Н, гідроксиметилфеніловий естер, вільна основа. циклогексил-СН), СН2), 2,51-2,40 (m, 2Н, СН2), Безбарвне масло. 2,07-1,98 (m, 2Н, циклогексил - СН2), 1,80-1,11 (m, 1 Н-ЯМР (DMSO-d6): 8,19-8,12 (m, 2Н, феніл-Н), 20Н, 4 х циклогексил-СН2), 2 х СН(СН3)2) 7,45-7,33 (m, 3Н, феніл-Н), 7,25-7,09 (m, 7Н, фенілН), 5,20 (t, J=5,6Гц, 1Н, ОН), 4,50 (d, J=5,6Гц, 2H, 9. Ідентичні діестери CH2), 4,20 (t, J=7,5Гц, 1H, СН), 2,95-2,80 (m, 2Н, 2 x СН(СН3)2), 2,38-2,25 (m, 2Н, СН2), 2,09-2,03 (m, 2Н, СН2), 1,33 (s, 9Н, (СН3)3), 0,82-0,76 (m, 12Н, 2 x СН(СН3)2). Гідрохлорид: безбарвні кристали, температура плавлення 165-6°С. 1Н-ЯМР (CDCI3): 8,22-8,16 (m, 2H, феніл-Н), 8,02 (d, J=1,8Гц, 1Н, феніл-Н), 7,277,02 (m, 9H, феніл-Н), 4,83-4,60 (m, 2Н, СН2), 4,013,94 (m, 1H, СН), 3,66-3,54 (m, 2H) 3,18-2,80 (m, 3Н), 2,53-2,44 (m, 1Н) (2 x СН2, 2 x СН(СН3)2) 1,431,25 (m, 21Н, (СН3)3, 2 x СН(СН3)2). R = 4-(с-С3Н5СО2)-С6Н4 Загальну обробку описано для виготовлення Гідрохлорид R-(+)-4ідентичних діестерів. (циклопоопілкарбонілокси)-бензойної кислоти-2-(3У розчин 7,30г (21,4ммоль) R-(+)-2-(3-діізодіізопропіламіно-1-феніл-пропіл)-4пропіламіно-1-фенілпропіл)-4-гідроксифенолу (6) у гідроксиметилсренілового естеру. 100мл дихлорметану при перемішуванні при 0°С Безбарвні кристали, температура плавлення додають краплями розчин хлорангідриду 208-213°С. (49,2ммоль) у 50мл дихлорметану. Далі додають 1 Н-ЯМР (DMSO-d6): 9,04 (s, 1Н може бути затриетиламін-дихлорметан (6,86мл/49,2ммольміщеним D2O, NH), 8,15-8,09 (m, 2H, феніл-Н), 7,53 50мл). Через 1-3 години при кімнатній температурі (d, 1H, феніл-Н3), 7,42-7,13 (m, 9H, феніл-Н), 5,25 тонкошарова хроматографія виявляє, що перетво(brs, 1H може бути заміщеним D2O, ОН), 4,52 (s, рення є повним. Осад промивають послідовно 2Н, СН2), 4,23 (t, J=7,5Гц, 1Н, СН), 3,62-3,53 (m, відповідно 100мл води, водною 0,1Η гідрохлорид2Н, 2 х СН(СНЭ)2), 3,05-2,70 (m, 2H, CH2), 2,51-2,37 ною кислотою, 5мл 5% водного розчину гідрокар(m, 2Н, СН2), 2,01-1,89 (m, 1H, циклопропіл-СН), бонату натрію, 5мл води, сушать сульфатом на1,20-1,05 (m, 16Н, 2 х СН(СН3)2, 2 х циклопропіл трію та після фільтрування концентрують досуха. СН2). Далі це сушать у високому вакуумі до постійної 13 C-HMP (DMSO-d6=39,7чнм): 172,71, 163,93, маси. 154,92, 147,16, 142,69, 141,03, 134,97, 131,76, Наступні сполуки, як приклад, виробляють, ви128,60, 127,86, 126,76, 126,56, 126,06, 125,94, користовуючи цей спосіб: 122,95, 122,65, 62,65, 54,00, 53,89, 45,33, 41,63, R = Метил 31,49,18,10, 17,98, 16,69, 16,51, 12,86, 9,52. R-(-)-оцтової кислоти-2-(3-діізопропіламіно-1R = 4-(с-С4Н7СО2)-С6Н4 фенілпропіл)-4-ацетоксиметил-феніловий естер, Гідрохлорид R-(+)-4вільна основа (циклобутилкарбонілокси)-бензойної кислоти-2-(3Блідо-жовте масло, чистота (ВЕРХ): 95,2%. 13 діізопропіламіно-1-феніл-пропіл)-4С-ЯМР (CDCI3): 20,36, 20,69, 20,94, 20,99, гідроксиметилфенілового естеру 36,41, 42,27, 43,69, 48,79, 65,89, 122,89, 126,28, Безбарвні кристали, температура плавлення 127,17, 127,92, 128,36, 133,69, 136,95, 143,61, 201-6°С. 148,46, 168,97, 170,76. 1 Н-ЯМР (DMSO-d6): 9,50 (s, 1Н може бути заLC-MC: 425 (15%, М+), 410 (97%), 382 (4%), міщеним D2O, NH), 8,17-8,12 (m, 2H, феніл-Н), 7,54 308 (3%), 266 (7%), 223 (27%), 195 (13%), 165 (8%), (d, J=1,4Гц, 1Н, феніл-Н3), 7,42-7,14 (m, 9H, феніл114 (100%). Н), 5,25 (br s, 1H може бути заміщеним D2O, ОН), [ ]D20=-33,1 (с=1, CH3CN). DC (1): 0,79. 4,52 (s. 2Н, СН2), 4,23 (t, J=7,5Гц, 1Н, СН), 3,62R = Циклогексил 3,47 (m, 3Н, циклобутил-СН), 2 x СН(СН3)2), 3,00R-(+)-циклогексанкарбонової кислоти-2-(32,70 (m, 2Н, СН2), 2,51-2,26 (m, 6Н, СНm, 2 x цикдіізопропіламіно-1-феніл-пропіл)-4лобутил-СН2), 2,10-1,85 (m, 2Н, циклобуmил-СН2), циклогексилкарбонілоксиметил-феніловий естер 1,22-1,12 (m, 12Н, 2 х СН(СН3)2). Блідо-жовте масло, чистота (ЯМР): >95%. 13 R = 4-(c-C6H11CO2)-C6H4 С-ЯМР (CDCI3): 20,30, 25,17, 25,58, 25,73, Гідрохлорид R-(+)-428,97, 29,12, 41,70, 43,15, 44,03, 48,64, 65,37, (циклогексилкарбонілокси)-бензойної кислоти-2-(3122,67, 125,88, 126,24, 127,06, 127,31, 127,90, 23 77322 24 128,37, 134,03, 136,85, 143,55, 148,33, 174,20, 175,72. R' відрізняється від R" DC (1): 0,96. Загальну обробку описано для виготовлення R = Ізопропіл змішаних діестерів R-(+)-ізобутират-2-(3-діізопропіламІно-1-фенілУ розчин 5,30ммоль фенольного моноестеру пропіл)-4-ізобутирилоксиметил-феніловий естер загальної формули А у 40мл дихлорметану при Вільна основа: блідо-жовте масло, чистота перемішуванні при 0°С додають краплями розчин (ВЕРХ): 95,6%. хлорангідриду (5,83ммоль) у 15мл дихлорметану. 13 С-ЯМР (CDCI3): 18,96, 19,08, 20,59, 33,98, Далі додають триетиламін-дихлорметан 34,20, 36,86, 41,72, 43,72, 48,72, 65,58, 122,65, (0,589g/5,82ммоль-15мл). Через 18 годин при кім126,19, 126,73, 127,91, 128,11, 128,36, 133,91, натній температурі тонкошарова хроматографія 136,96, 143,81, 148,41, 175,15, 176,77. виявляє, що перетворення є повним. Осад промиDC (1): 0,74. вають послідовно відповідно 50мл води, водною Гідрофумарат: безбарвний сироп, чистота 0,1Н-гідрохлоридною кислотою, 5мл 5% водного 94,4% за ВЕРХ. розчину гідрокарбонату натрію, 5мл води, сушать 13 С-ЯМР (CDCI3): 17,89, 18,07, 18,94, 18,97, сульфатом натрію та після фільтрування концент19,07, 31,22, 33,93, 34,13, 41,78, 45,62, 53,93, рують досуха. Далі це сушать у високому вакуумі 65,33, 122,93, 126,82, 127,45, 127,53, 127,91, до постійної маси. 128,75, 134,74, 135,29, 135,42, 142,04, Наступні приклад виробляють, використовую148,44,170,24, 175,71, 176,79. чи цей спосіб R = 4-(t-C4H9CO2)-C6H4 R' = СН(СН3)2 R" = СН3 Гідрохлорид R-4-(тpет-бутилкарбонілокси)R-(+)-ізобутират-2-(3-діізопропіламіно-1-фенілбензойної кислоти-2-(3-діізопропіламіно-1-фенілпропіл)-4-ацетоксиметил-феніловий естер проліл)-4-(4-трет-бутилкарбонілоксиметилБезбарвне масло. бензойної кислоти) фенілового естеру DC (1): 0,56 1З Безбарвні кристали, температура плавлення С-ЯМР (CDCI3): 19,12, 20,65, 21,05, 34,24, 105-7°С. 37,02, 41,79, 43,79, 48,72, 65,98, 122,75, 125,98, 13 С-ЯМР (DMSO-d6): 16,49, 16,71, 17,97, 18,06, 126,22,127,94, 128,39, 128,84,133,55, 137,04, 26,84, 31,36, 38,45, 41,70, 45,24, 53,79, 53,96, 143,84, 148,58, 170,84, 175,18. 55,09, 66,11, 122,47, 122,62, 123,59, 126,42, 126,83, Гідрохлорид: безбарвні кристали 13 127,21, 127,70, 127,88, 128,02, 128,62, 131,17, С-ЯМР (CDCI3): 16,89, 17,04, 18,31, 18,92, 131,86, 134,48, 135,64, 142,52, 148,35, 154,86, 20,95, 31,49, 34,07, 41,64, 46,17, 54,55, 65,49, 155,39, 163,80, 165,09, 176,14, 176,19. 122,91, 126,61, 126,93, 127,48. 127,83, 128,74, 10. Змішані діестери 134,50, 134,88, 141,61, 148,44, 170,67, 175,63. [ ]D20=+14,6 (c=1, CHCI3). 25 Комп’ютерна верстка О. Гапоненко 77322 Підписне 26 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrofumarate of r-(+) -2-(3-diisopropylamino-1-phenylpropyl)-4-hydroxymethylphenylisobutirate ester, method for its production and intermediates
Назва патенту російськоюГидрофумарат r-(+) -2-(3-диизопропиламино-1-фенилпропил) -4-гидроксиметилфенилизобутиратного эфира, способ его получения и интермедиаты
Автори російськоюMeese, Claus
МПК / Мітки
МПК: C07C 219/00, C07C 229/38, A61K 31/24, A61P 13/00, C07C 215/00, A61P 13/06, C07B 61/00, C07C 213/00
Мітки: одержання, естеру, гідрофумарат, спосіб, інтермедіати, r-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного
Код посилання
<a href="https://ua.patents.su/13-77322-gidrofumarat-r-2-3-diizopropilamino-1-fenilpropil-4-gidroksimetilfenilizobutiratnogo-esteru-sposib-jjogo-oderzhannya-ta-intermediati.html" target="_blank" rel="follow" title="База патентів України">Гідрофумарат r-(+)-2-(3-діізопропіламіно-1-фенілпропіл)-4-гідроксиметилфенілізобутиратного естеру, спосіб його одержання та інтермедіати</a>
Попередній патент: Накопичувальна інформаційно-вимірювальна система силової установки літального апарата
Наступний патент: Спосіб відновлення тимчасових фронтальних зубів
Випадковий патент: Фортифікаційна панель












