Спосіб одержання дифторметилпіразолілкарбоксилатів
Номер патенту: 97498
Опубліковано: 27.02.2012
Автори: Кайл Міхаель, Райнхаймер Йоахим, Шмідт Себастіан Пер, Рак Міхаель, Льор Сандра, Дітц Йохен, Гроте Томас, Цірке Томас, Зукопп Мартін, Ломанн Ян Клаас
Формула / Реферат
1. Спосіб одержання дифторметилзаміщених піразол-4-ілкарбоксилатів загальної формули (І)
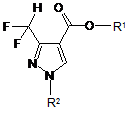 , (I)
, (I)
в якій
R1 означає C1-C8-алкіл, С3-С8-циклоалкіл, С1-С4-алкоксі-С1-С4алкіл, С3-С8-циклоалкоксі-С1-С4алкіл, С2-С8-алкеніл або бензил, при необхідності заміщений 1, 2 або 3 замісниками Ry1, незалежно один від іншого вибраними з С1-С4-алкілу, С1-С4-алкокси або нітро; і
R2 означає водень, С1-С4-алкіл, бензил або феніл, в якому обидва з останніх замісниківможуть бути незаміщеними або при необхідності заміщеними 1, 2 або 3 замісниками Ry2 , вибраними незалежно один від іншого з галогену, CN, нітро, С1-С4-алкілу, С1-С4-галоалкілу, С1-С4-алкокси або C1-C4-галоалкокси;
в якому
а) сполуку загальної формули (II)
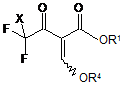 , (II)
, (II)
в якій X означає фтор, хлор або бром, R1 має одне з наведених раніше значень і R4 означає С1-С8-алкіл, С3-С8-циклоалкіл, С2-С8-алкеніл, бензил або феніл, піддають взаємодії з силановою сполукою загальної формули R3nSiCl(4-n), в якій n означає 1, 2 або 3, і замісники R3 незалежно один від іншого вибрані з C1-C8-алкілу або фенілу, і металом, який вибраний з металів груп 1, 2, 3, 4 і 12 Періодичної системи елементів і має окислювально-відновний потенціал менше ніж -0,7 V, в перерахуванні на нормальний водневий електрод (при 25 °С і 101,325 кПа); і
б) реакційну суміш із стадії а) піддають взаємодії зі сполукою загальної формули (III)
R2HN-NH2, (III)
в якій R2 має одне з наведених раніше значень.
2. Спосіб за пунктом 1, в якому метал являє собою магній.
3. Спосіб за одним з попередніх пунктів, в якому застосовують силанову сполуку загальної формули R3nSiCl(4-n), в якій n означає 2 або 3.
4. Спосіб за одним з попередніх пунктів, в якому в силановій сполуці замісники R3 незалежно один від іншого вибрані з С1-С4-алкілу.
5. Спосіб за пунктом 3 або 4, в якому силанову сполуку вибирають з триметилсилілхлориду, етилдиметилсилілхлориду, диметилпропілсилілхлориду, диметилізопропілсилілхлориду, n-бутилдиметилсилілхлориду, 2-бутилдиметилсилілхлориду, (2-метилпропіл)диметилсилілхлориду, диметилдихлорсилану, діетилдихлорсилану і трет-бутилдиметилсилілхлориду.
6. Спосіб за одним з попередніх пунктів, в якому R4 в формулі II вибирають з С1-С4-алкілу або бензилу.
7. Спосіб за одним з попередніх пунктів, в якому взаємодію на стадії а) істотно проводять у безводних умовах.
8. Спосіб за пунктом 7, в якому взаємодію на стадії а) проводять в розчиннику, вибраному з N-С1-С4-алкіллактамів, N-ді(С1-С4-алкіл)амідів аліфатичних С1-С4-карбонових кислот, N,N,N',N'-тетра(С1-С4-алкіл)алкілсечовин, 1,3-ді(С1-С4-алкіл)гексагідропіримідин-2-ону і 1,3-ді(С1-С4-алкіл)імідазолін-2-ону.
9. Спосіб за одним з попередніх пунктів, в якому взаємодію на стадії б) проводять у присутності води.
10. Спосіб за пунктом 9, в якому взаємодію на стадії б) проводять в суміші з С1-С4-алканолу і води.
11. Спосіб за одним з попередніх пунктів, в якому в формулах І та II R1 означає С1-С4-алкіл або бензил.
12. Спосіб за одним з попередніх пунктів, в якому сполуку загальної формули (III) вибирають з С1-С4-алкілгідразинів і гідразингідрату.
13. Спосіб одержання піразол-4-карбонової кислоти загальної формули (IV)
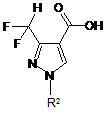 , (IV)
, (IV)
в якій R2 має одне з наведених вище значень, в якому здійснюють:
ііі) одержання сполуки формули І способом за одним з пунктів 1-10, і
iv) гідроліз сполуки І з одержанням карбонової кислоти IV.
14. Спосіб за пунктом 13, в якому основний гідроліз здійснюють в присутності водного розчину гідроксиду лужного металу або розчину гідроксиду лужноземельного металу.
15. Спосіб одержання анілідів піразол-4-карбонової кислоти загальної формули (V)
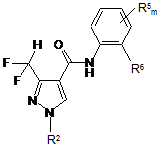 , (V)
, (V)
в якій
R2 має зазначені раніше значення;
R5 вибраний з галогену, С1-С6-алкілу, С1-С6-алкокси, С1-С6-алкілтіо, С1-С6-галоалкілу, C1-С6-галоалкокси або С1-С6-галоалкілтіо;
m означає 0, 1, 2, 3 або 4;
R6 вибраний з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, C1-С6-алкокси, С2-С6-алкенілокси, С2-С6-алкінілокси, в якому 6 зазначених вище залишків є незаміщеними або можуть бути частково або повністю галогеновані і/або можуть мати 1, 2, 3, 4 або 5 замісників Ray, в якому Ray незалежно один від іншого вибрані з ціано, нітро, гідрокси, меркапто, аміно, карбоксилу, С1-С6-алкокси, С2-С6-алкенілокси, С2-С6-алкінілокси, С1-С6-галоалкокси, C1-С6-алкілтіо, С1-С6-алкіламіно, ді(С1-С6-алкіл)аміно, С1-С6-алкілсульфонілу, С1-С6-алкілсульфоксилу, формілу, С1-С6-алкілкарбонілу, С1-С6-алкоксикарбонілу, формілокси і С1-С6-алкілкарбонілокси;
С3-С14-циклоалкіл або феніл, які є незаміщеними або 1, 2, 3, 4 або 5 залишків Rax можуть бути заміщені, в якому Rax незалежно один від іншого вибрані з галогену, ціано, нітро, гідрокси, меркапто, аміно, карбоксилу, С1-С6-алкілу, С1-С6-галоалкілу, С3-С6-циклоалкілу, С1-С6-алкокси, С2-С6-алкенілокси, С2-С6-алкінілокси, С1-С6-галоалкокси, С1-С6-алкілтіо, С1-С6-алкіламіно, ді(С1-С6-алкіл)аміно, С1-С6-алкілсульфонілу, С1-С6-алкілсульфоксилу, формілу, С1-С6-алкілкарбонілу, С1-С6-алкоксикарбонілу, формілокси і С1-С6-алкілкарбонілокси;
в якому здійснюють:
і) одержання піразолкарбоксилату формули I способом за одним з пунктів 1-10 і взаємодію піразолкарбоксилату формули І з аміносполукою формули VI
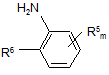 , (VI)
, (VI)
в якій m, R5 і R6 мають зазначені раніше значення; або
іі) одержання піразол-4-карбонової кислоти формули IV способом за пунктом 11, при необхідності переведення піразол-4-карбонової кислоти IV в її галогенід карбонової кислоти і наступну взаємодію піразол-4-карбонової кислоти формули IV або її галогеніду карбонової кислоти з аміносполукою формули VI.
16. Сполука формули А
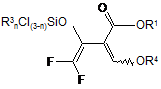 , (A)
, (A)
в якій R1 і R4 мають одне з наведених для формули II значень і R3 незалежно один від іншого вибрані з С1-С8-алкілу або фенілу.
Текст
1. Спосіб одержання дифторметилзаміщених піразол-4-ілкарбоксилатів загальної формули (І) H O O F R1 2 3 97498 8. Спосіб за пунктом 7, в якому взаємодію на стадії а) проводять в розчиннику, вибраному з N-С1-С4алкіллактамів, N-ді(С1-С4-алкіл)амідів аліфатичних С1-С4-карбонових кислот, N,N,N',N'-тетра(С1-С4алкіл)алкілсечовин, 1,3-ді(С1-С4алкіл)гексагідропіримідин-2-ону і 1,3-ді(С1-С4алкіл)імідазолін-2-ону. 9. Спосіб за одним з попередніх пунктів, в якому взаємодію на стадії б) проводять у присутності води. 10. Спосіб за пунктом 9, в якому взаємодію на стадії б) проводять в суміші з С1-С4-алканолу і води. 11. Спосіб за одним з попередніх пунктів, в якому в 1 формулах І та II R означає С1-С4-алкіл або бензил. 12. Спосіб за одним з попередніх пунктів, в якому сполуку загальної формули (III) вибирають з С1-С4алкілгідразинів і гідразингідрату. 13. Спосіб одержання піразол-4-карбонової кислоти загальної формули (IV) H O OH F F N N R2 , (IV) 2 в якій R має одне з наведених вище значень, в якому здійснюють: ііі) одержання сполуки формули І способом за одним з пунктів 1-10, і iv) гідроліз сполуки І з одержанням карбонової кислоти IV. 14. Спосіб за пунктом 13, в якому основний гідроліз здійснюють в присутності водного розчину гідроксиду лужного металу або розчину гідроксиду лужноземельного металу. 15. Спосіб одержання анілідів піразол-4карбонової кислоти загальної формули (V) R5m H O N H F F N R6 N R2 4 6 R вибраний з С1-С6-алкілу, С2-С6-алкенілу, С2-С6алкінілу, C1-С6-алкокси, С2-С6-алкенілокси, С2-С6алкінілокси, в якому 6 зазначених вище залишків є незаміщеними або можуть бути частково або повністю галогеновані і/або можуть мати 1, 2, 3, 4 або ay ay 5 замісників R , в якому R незалежно один від іншого вибрані з ціано, нітро, гідрокси, меркапто, аміно, карбоксилу, С1-С6-алкокси, С2-С6алкенілокси, С2-С6-алкінілокси, С1-С6-галоалкокси, C1-С6-алкілтіо, С1-С6-алкіламіно, ді(С1-С6алкіл)аміно, С1-С6-алкілсульфонілу, С1-С6алкілсульфоксилу, формілу, С1-С6-алкілкарбонілу, С1-С6-алкоксикарбонілу, формілокси і С1-С6алкілкарбонілокси; С3-С14-циклоалкіл або феніл, які є незаміщеними ax або 1, 2, 3, 4 або 5 залишків R можуть бути заміax щені, в якому R незалежно один від іншого вибрані з галогену, ціано, нітро, гідрокси, меркапто, аміно, карбоксилу, С1-С6-алкілу, С1-С6-галоалкілу, С3-С6-циклоалкілу, С1-С6-алкокси, С2-С6алкенілокси, С2-С6-алкінілокси, С1-С6-галоалкокси, С1-С6-алкілтіо, С1-С6-алкіламіно, ді(С1-С6алкіл)аміно, С1-С6-алкілсульфонілу, С1-С6алкілсульфоксилу, формілу, С1-С6-алкілкарбонілу, С1-С6-алкоксикарбонілу, формілокси і С1-С6алкілкарбонілокси; в якому здійснюють: і) одержання піразолкарбоксилату формули I способом за одним з пунктів 1-10 і взаємодію піразолкарбоксилату формули І з аміносполукою формули VI H2N R5m R6 , (VI) 5 6 в якій m, R і R мають зазначені раніше значення; або іі) одержання піразол-4-карбонової кислоти формули IV способом за пунктом 11, при необхідності переведення піразол-4-карбонової кислоти IV в її галогенід карбонової кислоти і наступну взаємодію піразол-4-карбонової кислоти формули IV або її галогеніду карбонової кислоти з аміносполукою формули VI. 16. Сполука формули А O R3nCl(3-n)SiO OR1 OR4 F , (V) в якій 2 R має зазначені раніше значення; 5 R вибраний з галогену, С1-С6-алкілу, С1-С6алкокси, С1-С6-алкілтіо, С1-С6-галоалкілу, C1-С6галоалкокси або С1-С6-галоалкілтіо; m означає 0, 1, 2, 3 або 4; , (A) в якій R і R мають одне з наведених для форму3 ли II значень і R незалежно один від іншого вибрані з С1-С8-алкілу або фенілу. Даний винахід відноситься до способу одержання дифторметил-заміщених піразол-4ілкарбоксилатів. Заявка WO 92/12970 описує (3-дифторметил1-метилпіразол-4-ил)карбоксаміди та їх застосу вання як фунгіцидів. Одержання здійснюють виходячи з складного 2,2-дифторацетооцтового ефіру, який поступово піддають взаємодії з триетилортоформіатом і з метилгідразином, причому одержують складний ефір 3-дифторметил-1 F 1 4 5 метилпіразол-4-карбонової кислоти, який потім омилюється до карбонової кислоти. Яку після перетворення в хлорангідрид кислоти піддають взаємодії з придатним аміном до одержання відповідного аміду. Однак виробництво необхідного як вихідний продукт 4,4-дифторованого ацетооцтового ефіру є порівняно коштовним і важким, і для цього способу представляє собою утруднення. Заявка WO 2005/044804 описує складні алкілові ефіри фторметилзаміщених гетероциклічних карбонових кислот, а також їх одержання за допомогою галогенного обміну у відповідних хлорметилзаміщених гетероциклічних ефірів карбонових кислот і їх подальшої переробки до одержання анілідів фторметилзаміщених гетероциклічних карбонових кислот. Однак, застосування фторуючих агентів є коштовним і пред'являє особливі вимоги до застережних заходів і до устаткування, що застосовується. Таким чином, в основі даного винаходу лежить задача надати альтернативні способи одержання (3-дифторметилпіразол-4-ил)карбоксилатів і їх похідних, які походять з продуктів, виробництво яких є менш коштовним, чим, наприклад, одержання 4,4-дифторацетооцтового ефіру. Несподівано було винайдено, що ця задача вирішується шляхом взаємодії 4,4,4-тригалогензаміщених похідних ацетооцтового ефіру, який в подальшому визначений формулою II з хлорсиланами в присутності магнію або інших металів 1, 2, 3, 4 або 12 групи Періодичної системи елементів і наступної взаємодії продукту реакції з гідразином або похідним гідразину. Отже, об'єктом даного винаходу є спосіб одержання дифторметил-заміщених піразол-4ілкарбоксилатів загальної формули І, в якій 1 R означає С1-С8-алкіл, С3-С8-циклоалкіл, С1С4-алкокси-С1-С4-алкіл, С3-С8-циклоалкокси-С1-С4алкіл, С2-С8-алкеніл або означає при необхідності заміщений бензил за допомогою 1, 2 або 3 замісy1 ників R незалежно один від іншого вибраних з С1С4-алкілу, С1-С4-алкокси або нітро; і 2 R означає водень, С1-С4-алкіл, бензил або феніл, причому обидва наведених останніми замісники можуть бути незаміщеними або при необхідності заміщеними за допомогою 1, 2 або 3 заміy2 сників R незалежно один від іншого вибраних з галогену, CN, нітро, С1-С4-алкілу, С1-С4-галоалкілу, С1-С4-алкокси або С1-С4-галоалкокси; причому піддають взаємодії а) сполуку загальної формули II 97498 6 1 в якій X означає фтор, хлор або бром, R має 4 одне з наведених раніше значень і R означає С1С8-алкіл, С3-С8-циклоалкіл, С2-С8-алкеніл, бензил або феніл, зі сполукою силану загальної формули 3 R nSiCI(4-n), в якій n означає 1, 2 або 3 і замісники 3 R незалежно один від іншого вибрані з С1-С8алкілу або фенілу, і металом, який вибраний з металів 1, 2, 3, 4 і 12 групи Періодичної системи елементів і окислювально-відновлювальний потенціал показує менше ніж -0,7 V, в перерахуванні на нормальний водневий електрод (при 25 °C і 101,325 кПа); і б) реакційну суміш з стадії а) піддають взаємодії зі сполукою загальної формули III 2 R HN-NH2 (III), 2 в якій R має одне з наведених раніше значень. Спосіб відповідно до винаходу має цілий ряд переваг. Він забезпечує піразолову сполуку формули II з високим виходом і, у випадку взаємодії з 2 заміщеними гідразинами III (R Η), з високою регіоселективністю. До того ж можна відмовитися від дорогих вихідних речовин, дифторметилкарбонільних сполук, таких як 2,2дифторацетооцтовий ефір і замість нього використовувати набагато більш дешеві трифторметилкарбонільні сполуки і галодифторметильні сполуки, такі як 2,2,2-трифторацетооцтовий ефір або 2хлор-2,2-дифторацетооцтовий ефір. Застосовними при визначенні змінних поняттями для органічних груп, як, наприклад, вираження "галоген", є збірні поняття, які як замісники означають окремі члени цих груп органічних одиниць. Префікс Сх-Су у відповідному випадку означає число можливих атомів вуглецю. Поняття "галоген" в кожному випадку означає фтор, бром, хлор або йод, особливо фтор, хлор або бром. Прикладами інших значень є: Поняття " С1-С6-алкіл", що застосовується як тут і в поняттях С1-С6-алкокси, С1-С6-алкіламіно, ді(С1-С6-алкіл)аміно, С1-С6-алкілтіо, С1-С6алкілсульфоніл, С1-С6-алкілсульфоксил, С1-С6алкілкарбоніл, С1-С6-алкоксикарбоніл, і С1-С6алкілкарбонілокси, означає насичену, нерозгалужену або розгалужену вуглеводневу групу, що включає від 1 до 6 атомів вуглецю, особливо від 1 до 4 атомів вуглецю, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2метилпропіл, 1,1-диметилетил, пентил, 1метилбутил, 2-метилбутил, 3-метилбутил, 2,2диметилпропіл, 1-етилпропіл, гексил, 1,1диметилпропіл, 1,2-диметилпропіл, 1метилпентил, 2-метилпентил, 3-метилпентил, 4метилпентил, 1,1-диметил бутил, 1,2диметилбутил, 1,3-диметилбутил, 2,2диметилбутил, 2,3-диметилбутил, 3,3диметилбутил, 1-етилбутил, 2-етилбутил, 1,1,2триметилпропіл, 1,2,2-триметилпропіл, 1-етил-1метилпропіл, 1-етил-2-метилпропіл і їх ізомери. С1С4-алкіл включає, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2-метилпропіл або 1,1-диметилетил. 7 Поняття "С1-С6-галоалкіл", що застосовується як тут і в галоалкільних одиницях С1-С6галоалкокси, описує нерозгалужені або розгалужені алкільні групи з від 1 до 6 атомами вуглецю, причому атоми водню цих груп частково або повністю заміщені атомами галогену, наприклад, С1С4-галоалкілом, таким як хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорофторметил, дихлорфторметил, хлордифторметил, 1-хлоретил, 1брометил, 1-фторетил, 2-фторетил, 2,2дифторетил, 2,2,2-трифторетил, 2-хлор-2фторетил, 2-хлор-2,2-дифторетил, 2,2-дихлор-2фторетил, 2,2,2-трихлоретил, пентафторетил тощо. Поняття "С1-С6-алкокси" описує нерозгалужені або розгалужені насичені алкільні групи, що включають від 1 до 6 атомів вуглецю, які зв'язані через атом кисню. Приклади включають С1-С6-алкокси, як, наприклад, метокси, етокси, ОСН2-С2Н5, ОСН(СН3)2, n-бутокси, ОСН(СН3)-С2Н5, ОСН2СН(СН3)2, ООC(СН3)3, n-пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1диметилпропокси, 1,2-диметилпропокси, 2,2диметилпропокси, 1-етилпропокси, n-гексокси, 1метил-пентокси, 2-метилпентокси, 3метилпентокси, 4-метилпентокси, 1,1диметилбутокси, 1,2-диметилбутокси, 1,3диметилбутокси, 2,2-диметилбутокси, 2,3диметилбутокси, 3,3-диметилбутокси, 1етилбутокси, 2-етилбутокси, 1,1,2триметилпропокси, 1,2,2-триметилпропокси, 1етил-і-метилпропокси, 1-етил-2-метилпропокси, тощо. Поняття "С1-С4-алкокси-С1-С4-алкіл", що застосовується як тут, описує С1-С4-алкільні радикали, причому атом вуглецю прив'язаний до С1-С4алкокси-радикала. Прикладами таких є СН2-ОСН3, СН2-ОС2Н5, n-пропоксиметил, СН2-ОСН(СН3)2, nбутоксиметил, (1-метилпропокси)метил, (2метилпропокси)метил, СН2-ОС(СН3)3, 2(метокси)етил, 2-(етокси)етил, 2-(n-пропокси)етил, 2-(1-метилетокси)етил, 2-(n-бутокси)етил, 2-(1метилпропокси)етил, 2-(2-метилпропокси)етил, 2(1,1-диметилетокси)етил, 2-(метокси)пропіл, 2(етокси)пропіл, 2-(n-пропокси)пропіл, 2-(1метилетокси)пропіл, 2-(n-бутокси)пропіл, 2-(1метилпропокси)пропіл, 2-(2-метилпропокси)пропіл, 2-(1,1-диметилетокси)пропіл, 3-(метокси)пропіл, 3(етокси)пропіл, 3-(n-пропокси)-пропіл, 3-(1метилетокси)пропіл, 3-(n-бутокси)пропіл, 3-(1метилпропокси)пропіл, 3-(2-метилпропокси)пропіл, 3-(1,1-диметилетокси)пропіл, 2-(метокси)бутил, 2(етокси)бутил, 2-(n-пропокси)бутил, 2-(1метилетокси)бутил, 2-(n-бутокси)бутил, 2-(1метилпропокси)бутил, 2-(2-метилпропокси)бутил, 2-(1,1-диметилетокси)бутил, 3-(метокси)бутил, 3(етокси)бутил, 3-(n-пропокси)бутил, 3-(1метилетокси)бутил, 3-(n-бутокси)бутил, 3-(1метилпропокси)бутил, 3-(2-метилпропокси)бутил, 3-(1,1-диметилетокси)бутил, 4-(метокси)бутил, 4(етокси)бутил, 4-(n-пропокси)бутил, 4-(1метилетокси)бутил, 4-(n-бутокси)бутил, 4-(1метилпропокси)бутил, 4-(2-метилпропокси)бутил, 4-(1,1-диметилетокси)бутил, тощо. 97498 8 Поняття "С1-С6-алкілкарбоніл", що застосовується як тут, описує нерозгалужену або розгалужену насичену алкільную групу, що включає від 1 до 6 атомів вуглецю, яка кінцево або внутрішньо зв'язана через атом вуглецю карбонільної одиниці. Поняття "С1-С6-алкоксикарбоніл", що застосовується як тут, описує нерозгалужену або розгалужену алкокси групу, що включає від 1 до 6 атомів вуглецю, яка зв'язана через атом вуглецю карбонільної одиниці. Поняття "С1-С6-алкілкарбонілокси", що застосовується як тут, описує нерозгалужені або розгалужені насичені алкільні групи, що включають від 1 до 6 атомів вуглецю, які кінцево або внутрішньо зв'язані через атом вуглецю карбонільної одиниці. Поняття "С2-С6-алкеніл", що застосовується як тут і для алкенільних одиниць С2-С6-алкенілокси, описує нерозгалужені і розгалужені ненасичені вуглеводневі радикали, що включають від 2 до 6 атомів вуглецю і щонайменше один вуглецьвуглецевий подвійний зв'язок, як, наприклад, етеніл, 1-пропеніл, 2-пропеніл, 1-метилетеніл, 1бутеніл, 2-бутеніл, 3-бутеніл, 1-метил-1-пропеніл, 2-метил-1-пропеніл, 1-метил-2-пропеніл, 2-метил2-пропеніл, 1-пентеніл, 2-пентеніл, 3-пентеніл, 4пентеніл, 1-метил-1-бутеніл, 2-метил-1-бутеніл, 3метил-1-бутеніл, 1-метил-2-бутеніл, 2-метил-2бутеніл, 3-метил-2-бутеніл, 1-метил-3-бутеніл, 2метил-3-бутеніл, 3-метил-3-бутеніл, 1,1-диметил2-пропеніл, 1,2-диметил-1-пропеніл, 1,2-диметил2-пропеніл, 1-етил-1-пропеніл, 1-етил-2-пропеніл, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5гексенил, 1-метил-1-пентеніл, 2-метил-1-пентеніл, 3-метил-1-пентеніл, 4-метил-1-пентеніл, 1-метил2-пентеніл, 2-метил-2-пентеніл, 3-метил-2пентеніл, 4-метил-2-пентеніл, 1-метил-3-пентеніл, 2-метил-3-пентеніл, 3-метил-3-пентеніл, 4-метил3-пентеніл, 1-метил-4-пентеніл, 2-метил-4пентеніл, 3-метил-4-пентеніл, 4-метил-4-пентеніл, 1,1-диметил-2-бутеніл, 1,1 -диметил-3-бутеніл, 1,2диметил-1-бутеніл, 1,2-диметил-2-бутеніл, 1,2диметил-3-бутеніл, 1,3-диметил-1-бутеніл, 1,3диметил-2-бутеніл, 1,3-диметил-3-бутеніл, 2,2диметил-3-бутеніл, 2,3-диметил-1-бутеніл, 2,3диметил-2-бутеніл, 2,3-диметил-3-бутеніл, 3,3диметил-1-бутеніл, 3,3-диметил-2-бутеніл, 1-етил1-бутеніл, 1-етил-2-бутеніл, 1-етил-3-бутеніл, 2етил-1-бутеніл, 2-етил-2-бутеніл, 2-етил-3-бутеніл, 1,1,2-триметил-2-пропеніл, 1-етил-1-метил-2пропеніл, 1-етил-2-метил-1-пропеніл і 1-етил-2метил-2-пропеніл. Поняття "С3-С14-циклоалкіл" що застосовується як тут, описує моноциклічні, біциклічні або поліциклічні вуглеводневі радикали, що включають від 3 до 8 атомів вуглецю, особливо від 3 до 6 атомів вуглецю. Приклади моноциклічних радикалів включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктил. Приклади біциклічних радикалів включають біцикло[2.2.1]гептил, біцикло[3.1.1]гептил, біцикло[2.2.2]октил і біцикло[3.2.1]октил. Прикладами трициклічних радикалів є адамантил і гомоадамантил. Подвійний зв'язок в сполуці II і рівним чином в подальшому визначених формулах А і В може 9 мати Е- або Z-конфігурацію (відповідно цис- або транс-конфігурацію, в перерахуванні на відносне 4 розташування групи OR і трифторацетилового залишку). В переважній формі здійснення способу відпо1 відно до винаходу R в формулах І і II означає С1С4-алкіл або бензил, зокрема метил, етил або ізо1 пропіл; особливо R означає етил. Далі для способу відповідно до винаходу є пе4 ревагою, якщо R в формулі II вибраний з С1-С4алкілу або бензилу і зокрема з метилу, етилу, ізо4 пропілу або бензилу; особливо R означає етил. В формулі II X зокрема означає фтор або хлор. В особливо переважній формі здійснення винаходу X означає фтор. 2 R переважно означає водень або С1-С4-алкіл; 2 особливо R означає метил. Внаслідок цього сполука загальної формули III переважно вибрана з С1-С4-алкілгідразину або гідразину; особливо сполука загальної формули III представляє собою метилгідразин або гідразингідрат. Всі описані тут взаємодії проводять в стандартних для подібного роду реакцій реакційних посудинах, причому проведення реакції може бути виконано як безперервно, так і дискретно. Як правило, дані реакції здійснюють без тиску. В низькокиплячих розчинниках відповідна реакція може бути проведена також і під тиском. Стадія а) Для здійснення стадії а) способу відповідно до винаходу піддають взаємодії сполуку формули II з силановою сполукою і з металом 1, 2, 3, 4 і 12 групи Періодичної системи елементів, який має окислювально-відновлювальний потенціал менше ніж 0,7 V, в перерахуванні на нормальний водневий електрод (при 25 °C і 101,325 кПа), переважно з металом 1, 2 або 3 головної групи Періодичної системи елементів або цинком або особливо з магнієм. Не прив'язуючись до теорії, припускають, що при цьому перш за все одержують силільований енол формули А, який можливо, залежно від вибраних умов реакції або при переробці реакції або в ході іншої взаємодії в стадії б) проміжно гідролізують до одержання сполуки В. Сполуки А є наявними в реакційному розчині і в деяких випадках можуть бути виділені. А тому сполуки А і їх розчини рівним чином є об'єктом даного винаходу. 1 3 4 Відносно переважних значень R , R і R в сполуках А сказане раніше і в подальшому відноситься аналогічним чином. В принципі взаємодія може бути здійснена по аналогії з реакцією, що описана в Organic Letters, 2001, 3 (20), 3103-3105, яка описує одержання 1етокси-3-триметилсилілокси-4,4-дифторбутадієну. Якщо X означає хлор або фтор, то взаємодія може бути проведена зокрема по аналогії з методами, описаними в Tetrahedron Letters, 1983, т. 24, №5, 97498 10 507-510. J. Chem. Soc. Perkin Trans. I, 1988, 11491153, J. Org. Chem. 1995, 60, 5570-5578, J. Org. Chem. 2006, 71, №15, 5468-5473 і US 5,618,951. Прикладами металів 1, 2, 3, 4 і 12 групи Періодичної системи елементів, які мають окислювально-відновлювальний потенціал менше ніж -0,7 V, наприклад, 95 % перетворення). Виявилося придатним, активування поміщеного в реакційній посудині металу перед додаванням сполуки II відповідно силанової сполуки, наприклад, шляхом обробки ультразвуком або хімічним 13 97498 шляхом, наприклад, шляхом обробки бромом, йодом, трихлорметаном або дибромметаном. Для подальшої взаємодії може бути проведена переробка реакційної суміші і виділення продукту реакції з стадії а). Для кількісного виділення сполук формули А дії, як правило, проводять при слабо основних або безводних умовах, щоб уникнути передчасного гідролізу. Якщо переробляють при додаванні води, то щонайменше частково відбувається гідроліз до сполуки В і одержують сполуку В, при необхідності в суміші зі сполукою А. Переважно уникають передчасного гідролізу сполуки А. Виділення сполук, що утворилися, для взаємодії в стадії б) не потрібно. Більш того, виявилось сприятливим, відмовитися від виділення продуктів реакції. І тому в переважній формі здійснення способу відповідно до винаходу подальша взаємодія в стадії б) відбувається без попереднього виділення продукту реакції А. Переважно перед наступною взаємодією надлишкову силанову сполуку видаляють частково або зокрема в значній мірі, тобто щонайменше до кількості, що залишилася, менше ніж 10 моль-%, в перерахуванні на використовувану сполуку II, або повністю, наприклад, шляхом дистиляції. При необхідності також видаляють інші леткі компоненти реакційної суміші, наприклад, розчинник частково або зокрема повністю. Використовувані в стадії а) сполуки загальної формули II є в продажі або можуть бути одержані, наприклад, по аналогії з реакцією для (2етоксиметилен-4,4,4-трифтор)ацетооцтового ефіру, описаною в Journal of Medicinal Chemistry, 2000, об'єми. 43, №21, з трис(галоген)ацетооцтового ефіру VII і придатного ортоформіату VIII, як правило, три-(С1-С4алкіл)ортоформіату. Реакція представлена на наведеній нижче схемі: 1 4 В цій схемі X, R і R мають зазначені раніше значення. Придатним для цього ортоформіатом 4 зокрема є триетилортоформіат (R =етил). Як правило, взаємодію VII з VIII проводять таким чином, що С1-С4-алканол, що утворюється при взаємодії видаляють з реакційної рівноваги, наприклад, тим що його відганяють або хімічно зв'язують, наприклад, тим що взаємодію проводять в присутності ангідриду карбонової кислоти, наприклад, С2-С4алканкарбонової кислоти, такої як оцтовий ангідрид. Як правило, для взаємодії сполуку VIII використовують в надлишку, в перерахуванні на стехіометрію реакції. Зокрема, використовують від 1,1 до 5 моль і особливо від 1,2 до 2 моль ортоформіату VIII, в перерахуванні на 1 моль сполуки VII. Взаємодія VII з VIII відбувається звичайно при підвищеній температурі, часто в межах від 80 до 180 °C, зокрема в межах від 100 до 150 °C. При необхідності можна додати кислоту, наприклад, органічну сульфокислоту, таку як ртолуолсульфокислоту, як каталізатор. В переваж 14 ній формі виконання взаємодія VII з ортоформіатом VIII відбувається в оцтовому ангідриді. Як правило, сполуку II перед її використанням в способі відповідно до винаходу очищують, зокрема відокремлюють від не вихідних речовин VII і/або VIII, що не вступають у взаємодію. Це можна здійснювати звичайним чином, наприклад, шляхом фракційної перегонки. Стадія б) Одержання дифторметил-заміщених піразол4-ілкарбоксилатів загальної формули І на стадії б) способу відповідно до винаходу відбувається шляхом взаємодії продукту реакції з стадії а), при необхідності після виділення або очищення одержаних при цьому сполук, або зокрема шляхом взаємодії одержаного в стадії а) реакційного розчину, переважно після відділення надлишкової силанової сполуки, зі сполукою гідразину формули IV. Взаємодія в стадії б) в принципі може бути здійснена по аналогії з описаною в WO 92/12970 взаємодією 3-(дифторметил-1-метилпіразол-4ил)етилкарбоксилату з метил гідразином. Переважно використовують гідразин або похідне гідразину загальної формули III, щонайменше в еквімолярних кількостях або в надлишку, причому більший надлишок сполуки III, наприклад, більш ніж 20 моль-%, в перерахуванні на один моль використовуваної в стадії а) сполуки II, як правило, не потрібний. Переважно використовують від 1,0 до 1,2 моль, зокрема близько від 1,01 до 1,1 моль сполуки гідразину III на кожний моль сполуки II. Переважно сполука гідразину формули III представляє собою С1-С4-алкілгідразин або гідразин відповідно гідразингідрат; особливо сполука загальної формули III представляє собою метилгідразин або гідразингідрат. Для взаємодії продукту реакції з стадії а) зі сполукою гідразину III, як правило, роблять так, що змішують продукт реакції з стадії а), переважно тим, що продукт реакції, при необхідності у вигляді розчину в органічному розчиннику, наприклад, у вигляді реакційного розчину, при необхідності після відділення надлишкової сипанової сполуки, вводять до сполуки гідразину формули III. Переважно поміщають сполуку гідразину формули III як розчин в органічному розчиннику або суміші розчинник/вода. Альтернативно також можна зробити так, що сполуку гідразину формули III, переважно як розчин в органічному розчиннику або суміші розчинник/вода, додають до продукту реакції з стадії а) або до розчину з нього в органічному розчиннику або суміші розчинник/вода. Для взаємодії в стадії б) придатними органічними розчинниками є, наприклад: - протонно полярні розчинники, наприклад, аліфатичні спирти з переважно від 1 до 4 атомами вуглецю, такі як метанол, етанол, n-пропанол, ізопропанол, n-бутанол, ізобутанол або трет.бутанол, - ароматичні вуглеводні, такі як бензол, толуол, ксилоли, кумол, хлорбензол, нітробензол або трет.-бутилбензол, 15 - апротонні полярні розчинники, наприклад, циклічні або ациклічні прості ефіри, такі як діетиловий ефір, трет.-бутилметиловий ефір (МТБЕ), тетрагідрофуран (ТГФ) або діоксан, циклічні або ациклічні аміди, такі як диметилформамід, диметилацетамід, N-метилпіролідон або тетраметилсечовина, або аліфатичні нітрили, такі як ацетонітрил або пропіонітрил, - а також суміші зазначених вище розчинників. Переважно взаємодія відбувається в протонно полярному розчиннику, зокрема в С1-С4-спирті і особливо переважно в метанолі, етанолі, або в ацетонітрилі, або в суміші протонно полярного розчинника з апротонно полярним розчинником або в суміші цих розчинників з водою. Переважно взаємодія в стадії б) відбувається в присутності води. При цьому вже достатніми є невеликі кількості води в 0,1 об'ємн.-%, в перерахуванні на загальну кількість розчинника (органічний розчинник + вода). Як правило, кількість води не перевищує 50 об'ємн.-%, часто 30 об'ємн.-%, зокрема 15 об'ємн.-%, в перерахуванні на загальну кількість органічного розчинника + вода і часто знаходиться в межах від 0,1 до 50 об'ємн.-%, переважно в межах від 0,5 до 30 об'ємн.-%, зокрема в межах від 1 до 15 об'ємн.-%, в перерахуванні на загальну кількість органічного розчинника + вода. В особливо переважній формі здійснення винаходу взаємодію в стадії б) здійснюють в суміші з С1С4-алканолу і води і, особливо в суміші метанолвода. Раніше сказане відноситься до об'ємного співвідношення алканолу до води. Переважно взаємодію проводять при температурах від -80 до +100 °C. Як правило, верхня межа температур є точкою кипіння відповідного розчинника при проведенні реакції без тиску. Переважно температура реакції не перевищує 60 °C і зокрема 40 °C. Часто з практичних причин реакцію проводять при кімнатній температурі. В особливій формі здійснення перед початком взаємодії спочатку встановлюють температуру від -60 до 0 °C, зокрема -60 до -20 °C і в ході реакції нагрівають до температури від 0 до 60 °C, зокрема від 10 до 40 °C. Залежно від температури реакції необхідна для повної взаємодії тривалість реакції типово знаходиться в межах від 1 до 48 годин і переважно в межах від 4 до 24 годин. Переробка реакційної суміші і одержання піразолової сполуки загальної формули І відбувається звичайним способом, наприклад, шляхом видалення розчинника, наприклад, шляхом дистиляції або шляхом водної екстрактивної переробки або шляхом комбінування цих заходів. Наступна очистка може здійснюватися, наприклад, шляхом кристалізації або за допомогою хроматографії. Однак часто продукт одержують вже чистим, що робить непотрібним наступний спосіб очищення. Стадія б) способу відповідно до винаходу надає сполуки загальної формули І з виходом від гарного до дуже гарного, як правило, щонайменше в 70 %. Інший об'єкт даного винаходу відноситься до способу одержання сполуки загальної формули IV 97498 16 2 в якій R має одне з наведених раніше значень. Спосіб одержання сполуки IV включає і) одержання сполуки формули І відповідно до способу згідно з винаходом, як описано і іі) гідроліз сполуки І. Гідроліз може бути проведений при кислотному каталізі або основний або іншим чином. Сполука І може використовуватися як така, тобто після виділення. Однак також є можливим одержану в стадії б) реакційну суміш, при необхідності після відділення летких компонентів, таких як розчинник, використовувати для гідролізу без подальшого очищення. Для основного гідролізу сполуки І типово обробляють сполуку формули І гідроксидом лужного металу, такого як гідроксид натрію, гідроксид калію або гідроксид літію, переважно водним розчином гідроксиду лужного металу, особливо водним розчином NaOH або водним розчином КОН, до повного гідролізу складного ефіру, переважно при нагріванні. При основному гідролізі молярне співвідношення сполуки формули І до основи типово знаходиться в межах від 0,8:1 до 1:10 і є зокрема приблизно еквімолярним (тобто воно знаходиться в межах від 0,9:1 до 1,2:1), однак також може бути вигідним більший надлишок основи, наприклад, до 5 моль на кожний моль сполуки І. Зазвичай основний гідроліз відбувається в розріджувачі відповідно розчиннику. Придатними розріджувачами відповідно розчинниками поряд з водою також є органічні розчинники, які є стабільними відносно лугу, а також їх суміші з водою. Прикладами лужностабільних органічних розчинників зокрема є зазначені вище С1-С4-алканоли, а також зазначені вище ациклічні і циклічні прості ефіри. Переважно гідроліз проводять в водній фазі, тобто в воді або суміші з води з одним з зазначених вище органічних розчинників, причому вміст органічного розчинника в водній фазі, як правило, типово не перевищує 30 об'ємн.-%, в перерахуванні на загальну кількість води і органічного розчинника. Переважно основний гідроліз проводять при температурах від 20 до 100 °C. Як правило, верхня межа температур є точкою кипіння застосовного розчинника при проведенні реакції без тиску. Переважно температура реакції не перевищує 100 °C і зокрема 90 °C. Як особливо вигідним виявилось здійснювати роботу при температурі вище точки кипіння спиртового компоненту складного ефіру. Наприклад виходячи зі сполуки загальної формули 1 І, в якій R означає етил, гідроліз проводять переважно при температурі в щонайменше 80 °C, наприклад, в межах від 80 до 100 °C. При цьому тривалість реакції залежить від температури реакції, концентрації і стабільності відповідного складноефірного зв'язку. Загалом, умови реакції вибирають 17 таким чином, що тривалість реакції знаходиться в межах від 1 до 12 год., зокрема в межах від 2 до 8 год. Кислотний гідроліз сполуки І може бути проведений по аналогії з відомими кислотними гідролізами складного ефіру, тобто в присутності каталітичних або стехіометричних кількостей кислоти і води (див., наприклад, J. March, Advanced Organic Chemistry, 2nd Ed., 334-338, McGraw-Hill, 1977 і процитовані там літературні джерела). Часто взаємодію проводять в суміші з води і апротонного органічного розчинника, наприклад, простого ефіру, такого як зазначені вище. Прикладами кислот є галогеноводневі кислоти, сірчана кислота, органічні сульфокислоти, такі як ртолуолсульфокислота, метансульфокислота, фосфорна кислота, а також кислотні смоли іонного обміну і тому подібні. Придатними каталізаторами гідролізу далі є йодиди лужних металів, такі як йодид літію, триметилйодсилан або суміші триметилхлорсилану з йодидами лужних металів, такими як йодид літію, йодид натрію або йодид калію. Виділення кислоти IV потім відбувається шляхом звичайного способу розділення, такого як, наприклад, осадження шляхом регулювання значення рН або екстракція. Згідно з винаходом сполуки загальної формули І вигідно придатні для синтезу цілого ряду сполук, які є придатними як діюча речовина, таких як, наприклад, для одержання 3дифторметилпіразол-4-карбоксамідів визначеної в подальшому формули V: 97498 18 ax заміщені, причому R незалежно один від іншого вибрані з галоген, ціано, нітро, гідрокси, меркапто, аміно, карбоксил, С1-С6-алкіл, С1-С6-галоалкіл, С3С6-циклоалкіл, С1-С6-алкокси, С2-С6-алкенілокси, С2-С6-алкінілокси, С1-С6-галоалкокси, С1-С6алкілтю, С1-С6-алкіламіно, ді(С1-С6-алкіл)аміно, С1С6-алкілсульфоніл, С1-С6-алкілсульфоксил, форміл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, формілокси і С1-С6-алкілкарбонілокси. 6 В формулі V R переважно вибраний з С1-С8алкіл, С1-С8-галоалкіл, С1-С6-алкокси, С1-С6галоалкокси, феніл і циклопропіл, причому феніл і циклопропіл можуть бути заміщені зазначеним вище способом. Відповідно до особливо переваж6 ної форми здійснення R означає феніл, який при необхідності може бути заміщений за допомогою ax ax 1, 2, 3, 4 або 5 залишків R . R зокрема вибраний з галоген, С1-С6-алкокси, С1-С6-алкілтіо, С1-С6алкілсульфоніл, С1-С6-алкілсульфоксил, С1-С6галоалкілтіо, С1-С6-галоалкілсульфоніл і С1-С65 галоалкілсульфоксил. R зокрема означає галоген. Спосіб включає одержання піразолкарбоксилату формули І відповідно до описаного тут способу і його взаємодія з аміносполукою формули VI 5 2 в якій 2 R має наведене раніше значення; 5 R вибраний з галогену, С1-С6-алкіл, С1-С6алкокси, С1-С6-алкілтіо, С1-С6-галоалкіл, С1-С6галоалкокси або С1-С6-галоалкілтіо; m означає 0, 1, 2, 3 або 4 і зокрема 0 або 1; 6 R вибраний з С1-С8-алкіл, С2-С6-алкеніл, С2С6-алкініл, С1-С6-алкокси, С2-С6-алкенілокси, С2С6-алкінілокси, причому 6 зазначених вище залишків є незаміщеними або частково або повністю можуть бути галогеновані і/або можуть мати 1, 2, ay ay 3, 4 або 5 замісників R , причому R незалежно один від іншого вибрані з ціано, нітро, гідрокси, меркапто, аміно, карбоксил, С1-С6-алкокси, С2-С6алкенілокси, С2-С6-алкініл-окси, С1-С6-галоалкокси, С1-С6-алкілтіо, С1-С6-алкіламіно, ді(С1-С6алкіл)аміно, С1-С6-алкілсульфоніл, С1-С6алкілсульфоксил, форміл, С1-С6-алкілкарбоніл, С1С6-алкоксикарбоніл, формілокси і С1-С6алкілкарбонілокси; С3-С14-циклоалкіл або феніл, які є незаміщеax ними або 1, 2, 3, 4 або 5 залишків R можуть бути 6 в якій m, R і R мають наведені раніше значення; або одержання піразол-4-карбонової кислоти формули IV згідно з описаним тут способом, при необхідності переведення піразол-4-карбонової кислоти IV в її галогенід карбонової кислоти IVa де R має зазначене раніше значення і Hal означає галоген, зокрема хлор, і наступну взаємодію піразол-4-карбонової кислоти формули IV або її галогеніду карбонової кислоти IVa з аміносполукою формули VI. Придатні методи одержання анілідів шляхом взаємодії карбонових кислот або складних ефірів карбонових кислот з ароматичними амінами є відомими для спеціаліста в даній галузі техніки, наприклад, з процитованого на початку рівня техніки, а також з J. March, Advanced Organic Chemistry, 2nd Ed., 382 f, McGraw-Hill, 1977 і Organikum, 21. изд-е Wiley-VCH, Weinheim 2001, cc. 481-484 і процитовані там літературні джерела, і можуть аналогічним чином розповсюджуватися на одержання сполук V відповідно до винаходу. Наприклад, можна піддавати взаємодії піразолкарбоксилати формули І, зокрема у яких 1 R =метил або етил, безпосередньо зі сполукою аніліну VI в сенсі амінолізу складного ефіру карбонової кислоти. Альтернативно можна піддавати взаємодії піразолкарбонову кислоту формули IV 19 безпосередньо зі сполукою аніліну VI в сенсі амінолізу карбонової кислоти. Однак часто діють таким чином, що піразолкарбонову кислоту формули IV спочатку переводять в її галоїдангідрид кислоти, наприклад, її хлорангідрид кислоти і потім галоїдангідрид кислоти IVa взаємодіє зі сполукою аніліну VI. Залежно від вибраного шляху синтезу реакція сполучення карбонової кислоти IV відповідно похідного карбонової кислоти І або IVa і похідного аніліну VI при необхідності може бути проведена в присутності каталізаторів, конденсаційних засобів, засобів, що зв'язують кислоту і/або при відокремленні води, наприклад, шляхом азеотропної дистиляції. Загалом, взаємодія галогеніду карбонової кислоти IVa зі сполукою аніліну VI відбувається в інертному розчиннику. Придатними розчинниками є аліфатичні вуглеводні, такі як пентан, гексан, циклогексан і петролейний ефір, ароматичні вуглеводні, такі як толуол, о-, m- і р-ксилол, галогеновані вуглеводні, такі як метиленхлорид, хлороформ і хлорбензол, прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, трет.-бутилметиловий ефір, діоксан, анізол і тетрагідрофуран, нітрили, такі як ацетонітрил і пропіонітрил, кетони, такі як ацетон, метилетилкетон, діетилкетон і трет.бутилметилкетон, спирти, такі як метанол, етанол, n-пропанол, ізопропанол, n-бутанол і трет.бутанол, а також метиленхлорид, диметилсульфоксид і диметилформамід, особливо переважно толуол, метиленхлорид і тетрагідрофуран. Також можуть застосовуватися суміші зазначених розчинників. Взаємодія IVa з VI відбувається звичайно в присутності основи. Як основи, загалом, придатні неорганічні сполуки, такі як гідроксиди лужних і лужноземельних металів, такі як гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид кальцію, оксиди лужних і лужноземельних металів, такі як оксид літію, оксид натрію, оксид кальцію і оксид магнію, гідриди лужних і лужноземельних металів, такі як гідрид літію, гідрид натрію, гідрид калію і гідрид кальцію, аміди лужних металів, такі як амід літію, амід натрію і амід калію, карбонати лужних і лужноземельних металів, такі як карбонат літію і карбонат кальцію, а також гідрокарбонати лужних металів, такі як гідрокарбонат натрію, крім того, органічні основи, наприклад, третинні аміни, такі як триметиламін, триетиламін, діізопропілетиламін і N-метилпіперидин, піридин, заміщені піридини, такі як колідин, лутидин і 4-диметиламінопіридин, а також бициклічні аміни. Особливо переважно застосовують триетиламін і піридин. Основи, загалом, використовують в еквімолярних кількостях, в перерахуванні на сполуку IVa. Однак вони можуть також застосовуватися в надлишку від 5 моль-% до 30 моль-%, переважно від 5 моль-% до 10 моль-%, або - у випадку застосування третинних амінів - при необхідності як розчинників. Вихідні продукти IVa і VI, загалом, взаємодіють один з іншим в еквімолярних кількостях. Може бути вигідним для виходу використання IVa в над 97498 20 лишку від 1 моль-% до 20 моль-%, переважно від 1 моль-% до 10 моль-%, в перерахуванні на VI. Ця взаємодія галогенідів піразолкарбонової кислоти IVa з сполуками аніліну VI відбувається звичайно при температурах від -20 °C до 100 °C, переважно від 0 °C до 50 °C. Взаємодія піразолкарбонових кислот IV з сполуками аніліну VI відбувається звичайно в присутності дегідруючого засобу. Як дегідруючі засоби придатні 1,1'-карбонілдіімідазол, біс(2-оксо-3оксазолідиніл)фосфорилхлорид, карбодііміди, такі як Ν,Ν'-дициклогексилкарбодіімід і N-(3диметиламінопропіл)-N'-етилкарбодіімід, солі фосфонію, такі як гексафторфосфат (бензотриазол1-ілокси)трис(диметиламіно)фосфонію, гексафторфосфат бромтрипіролідинофосфонію, гексафторфосфат бромтрис(диметиламіно)фосфонію і гексафторфосфат хлортрипіролідино-фосфонію, солі уронію і тіуронію, такі як гексафторфосфат O(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронію, гексафторфосфат O-(7-азабензотриазол-1-ил)Ν,Ν,Ν',Ν'-тетраметилуронію, тетрафторборат S-(1оксидо-2-піридил)-N,N,N',N'-тетраметилтіуронію, тетрафторборат O-(2-оксо-1(2Н)піридил)-N,N,N',N'тетраметилуронію, тетрафторборат O[(етоксикарбоніл)ціанометиленаміно]-Ν,Ν,Ν',Ν'тетраметилуронію, солі карбенію, такі як гексафторфосфат (бензотриазол-1илокси)дипіролідинокарбенію, гексафторфосфат (бензотриазол-1-илокси)дипіперидинокарбенію, тетрафторборат О-(3,4-дигідро-4-оксо-1,2,3бензотриазин-3-ил)-N,N,N',N'-тетраметилуронію, тетрафторборат хлор-Ν',Ν'біс(тетраметилен)формамідинію, гексафторфосфат хлордипіролідинокарбенію, тетрафторборат хлор-N,N,N',N'-бис(пентаметилен)формамідинію, солі імідазолію, такі як тетрафторборат 2-хлор-1,3диметилімідазолію, переважно 1,1'карбонілдіімідазол, бис(2-оксо-3оксазолідиніл)фосфорилхлорид, Ν,Ν'дициклогексилкарбодіімід і N-(3диметиламінопропіл)-N'-етилкарбодіімід. Оскільки взаємодію піразолкарбонових кислот IV зі сполуками аніліну VI проводять в присутності дегідруючого засобу, то переважно застосовують органічну основу. Як органічні основи придатні, наприклад, третинні аміни, такі як триметиламін, триетиламін, діізопропілетиламін і Nметилпіперидин, піридин, заміщені піридини, такі як колідин, лутидин і 4-диметиламінопіридин, а також бициклічні аміни. Особливо переважно застосовують триетиламін і піридин. Основи, загалом, використовують в надлишку від 10 моль-% до 200 моль-%, переважно від 50 моль-% до 150 моль-%, в перерахуванні на сполуку IV. Вихідні продукти IV і VI, загалом, взаємодіють один з іншим приблизно в еквімолярних кількостях. Може бути вигідним для виходу, використовувати одну зі сполук в надлишку від 1 моль-% до 20 моль-%, переважно від 1 моль-% до 10 моль-%. Дегідруючий засіб використовують, загалом, в надлишку від 5 моль-% до 100 моль-%, переважно від 5 моль-% до 60 моль-%, в перерахуванні на сполуку IV. 21 97498 Взаємодія IV з VI відбувається звичайно в розчиннику. Придатними розчинниками є аліфатичні вуглеводні, такі як пентан, гексан, циклогексан і петролейний ефір, ароматичні вуглеводні, такі як толуол, о-, m- і р-ксилол, галогеновані вуглеводні, такі як метиленхлорид, хлороформ і хлорбензол, прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, трет.-бутилметиловий ефір, діоксан, анізол і тетрагідрофуран, нітрили, такі як ацетонітрил і пропіонітрил, кетони, такі як ацетон, метилетилкетон, діетилкетон і трет.-бутилметилкетон, а також диметилсульфоксид і диметилформамід, особливо переважні метиленхлорид, толуол і тетрагідрофуран. Також можуть застосовуватися суміші зазначених розчинників. Надалі одержання дифторметил-заміщених складних ефірів піразол-4-іл-карбонової кислоти і їх подальша переробка пояснюються за допомогою прикладів. Приклад одержання 1: одержання складного етилового ефіру 2-етоксиметилен-4,4,4-трифторЗ-оксоолійноїкислоти В 500 мл чотиригорлечковій колбі з мішалкою змішували 78,3 г (0,425 моль) трифторацетоацетата (етиловий ефір 4,4,4-трифтор-3-оксоолійної кислоти), 103,3 г (0,638 моль) триетилортоформіату і 130,0 г (1,275 моль) оцтового ангідриду і нагрівали 6 годин до 120 °C. Потім при нормальному тиску відокремлювали спочатку низькокиплячі компоненти і по закінченню продукт дистилювали в вакуумі через колонку. Таким чином, одержували 91,8 г (вихід 90 %) зазначеної в заголовку сполуки у вигляді безбарвної рідини з чистотою >98 %. Приклад одержання 2: одержання складного ізопропілового ефіру 2-изопропоксиметилен-4,4,4трифтор-З-оксоолійної кислоти Одержання здійснювали аналогічно до прикладу одержання 1 з застосуванням ізопропілового ефіру 4,4,4-трифтор-3-оксоолійної кислоти і триізопропілортоформіату. Приклад 1: одержання складного етилового ефіру 3-дифторметил-1-метилпіразол-4карбонової кислоти В 500 мл тригорлечковій колбі, що оснащена магнітною мішалкою і термометром поміщали стружку магнію (4,9 г, 0,20 моль), триметилсилілхлорид (ТМС-СІ: 21,8 г, 0,20 ммоль) і безводний диметилформамід (ДМФ, 240 мл). Після активування магнію за допомогою ультразвуку в льодяній ванні додавали етиловий ефір 2етоксиметилен-4,4,4-трифтор-3-оксоолійної кисло 22 ти (25,3 г, 0,10 моль) протягом проміжку часу в 30 хв., причому температуру реакції утримували в межах від 0 до 10 °C. Через наступні 60 хв. при зниженому тиску видаляли надлишковий триметилсилілхлорид. В другій 500 мл тригорлечковій колбі при -50 °C поміщали водний розчин метилгідразину (37 %, 20,8 г, 0,12 моль) і етанол (320 мл). Туди ж протягом проміжку часу в 60 хв. додавали охолоджений реакційний розчин першої взаємодії, причому охолодження зберігали. Через ще 2 години при -50 °C реакційну суміш залишали нагріватися до кімнатної температури і перемішували наступні 10 годин. Реакційна суміш згідно з аналізом ГХ містила складний етиловий ефір 3дифторметил-1-метилпіразол-4-карбонової кислоти (ізомер а) в суміші зі складним етиловим ефіром 2-дифторметил-1-метилпіразол-3-карбонової кислоти (ізомер б) з співвідношенням ізомерів а:б в 82:18. Потім реакційну суміш концентрували при зниженому тиску. Залишок ресуспендували в 100 мл етилацетату і три рази промивали насиченим водним розчином кухонної солі, значення рН якої було встановлене шляхом додавання конц. соляної кислоти до рН 2. Органічну фазу при зниженому тиску звільняли від розчинника. Твердий залишок перекристалізовували з гексану. Складний етиловий ефір 3-дифторметил-1-метилпіразол-4карбонової кислоти одержували у вигляді безбарвного кристалічного порошку (15,3 г, 70 % вихід, 95 % чистота, чистота ізомерів а:b=94:6). 1 6 Н-ЯМР (d -ДМСО, 400 МГц): =1,27 (t, 3 Η, J=7,1 Hz), 3,92 (s, 3 Η), 4,23 (q, 2 Η, J=7,1 Hz), 7,21 (t, 1 H, J=53 Hz), 8,41 част. на млн. (s, 1 Η). Приклад 1а-1е: експерименти одержання складного етилового ефіру 3-дифторметил-1метилпіразол-4-карбонової кислоти в різних розчинниках при взаємодії проміжної сполуки А з метилгідразином. Аналогічно до прикладу 1 піддавали взаємодії складний ефір 2-етоксиметилен-4,4,4-трифтор-3оксоолійної кислоти, Мg і ТМС-СІ в ДМФ і надлишок ТМС-СІ видаляли при зниженому тиску. Потім склад піддавали взаємодії з водним розчином метилгідразину (37 %) в різних розчинниках до одержання складного етилового ефіру 3-дифторметил1-метилпіразол-4-карбонової кислоти. Наведена нижче таблиця 1 показує одержані суміші ізомерів залежно від розчинника і кількісне співвідношення реагентів. Таблиця 1 Приклад 1а 1b 1с 1d 1е Розчинник тип метанол етанол ацетонітрил толуол тетрагідрофуран Розчинник кількість 480 мл 320 мл 320 мл 480 мл 480 мл Приклад 2: одержання 3-дифторметил-1метилпіразол-4-карбонової кислоти Одержання здійснювалось аналогічно до прикладу 1, причому на відміну від прикладу 1 замість Ізомер а [%] 86 84 84 80 80 Ізомер б [%] 14 16 16 20 20 перекристалізації з гексану одержаний після водної екстрактивної переробки і видалення етилацетату твердий залишок обробляли наступним чином: 23 Твердий залишок змішували з 16 г 50 мас.-%им водним розчином їдкого натру і 100 мл етанолу і суміш при перемішуванні 4 год. кип'ятили зі зворотнім холодильником. Потім розчинник видаляли при зниженому тиску, і одержаний водний залишок доводили за допомогою 10 %-ої соляної кислоти до рН 1. При цьому одержували дикарбонову кислоту у вигляді твердої речовини, яку виділяли за допомогою фільтрації. Таким чином, одержували 3-дифторметил-1-метилпіразол-4-карбонову кислоту у вигляді світло-коричневого порошку. 1 6 Н-ЯМР (d -ДМСО, 400 МГц): =3,92 (s, 3 Η), 7,21 (t, 1 Η, J=53 Hz), 8,34 част. на млн. (s, 1 Η). Приклад 3: одержання складного етилового ефіру 3-дифторметил-1-метилпіразол-4карбонової кислоти В 500 мл тригорлечковій колбі, що оснащена магнітною мішалкою і термометром, поміщали стружку магнію (4,9 г, 0,20 моль). Після активування магнію шляхом поверхневого травлення йодом і наступного додавання безводного Nметилпіролідону (НМП, 240 мл) і триметилсилілхлориду (21,8 г, 0,20 ммоль) додавали складний етиловий ефір 2-етоксиметилен-4,4,4-трифтор-3оксоолійної кислоти (25,3 г, 0,10 моль) протягом проміжку часу в 30 хв. при температурі в межах від 30 до 40 °C. Через наступні 120 хв. надлишковий триметилсилілхлорид видаляли під зниженим тиском. В другій 500 мл тригорлечковій колбі при 50 °C поміщали водний розчин метилгідразину (37 %, 20,8 г, 0,12 моль) і етанолу (320 мл). Туди ж протягом проміжку часу в 60 хв. додавали охолоджений реакційний розчин першої взаємодії, причому охолодження зберігали. Через наступні 2 години при -50 °C реакційну суміш залишали нагріватися до кімнатної температури і перемішували наступні 10 годин. Реакційна суміш містила згідно з ГХ аналізом складний етиловий ефір 3дифторметил-1-метилпіразол-4-карбонової кислоти (ізомер а) в суміші зі складним етиловим ефіром 2-дифторметил-1-метилпіразол-3-карбонової кислоти (ізомер б) з співвідношенням ізомерів а:б в 84:16. Потім реакційну суміш концентрували під зниженим тиском. Як продукт одержували розчин складного етилового ефіру 3-дифторметил-1-метилпіразол-4карбонової кислоти в НМП, який може бути очищений шляхом екстракції або кристалізації аналогічно до прикладу 1 або аналогічно до прикладу 2 за допомогою кип'ятіння з розчином їдкого натру омилений до кислоти. Приклад 4: одержання 3-дифторметил-1метилпіразол-4-карбонової кислоти В 500 мл тригорлечковій колбі, що оснащена магнітною мішалкою і термометром поміщали стружку магнію (4,9 г, 0,20 моль), триметилсилілхлорид (32,6 г, 0,30 ммоль) і безводний 1,3диметил-2-імідазолідинон (ДМИ, 160 мл). Після активування магнію за допомогою йоду в льодяній ванні додавали складний метиловий ефір 2метоксиметилен-4,4,4-трифтор-3-оксоолійної кислоти (21,3 г, 0,10 моль) протягом проміжку часу в 30 хв., причому реакційну температуру утримували в межах від 20 до 30 °С. Через наступні 60 хв. при кімнатній температурі видаляли надлишковий 97498 24 триметилсилілхлорид під зниженим тиском. В другій 500 мл тригорлечковій колбі при -50 °C поміщали водний розчин метил гідразину (37 %, 14,8 г, 0,12 моль) і метанол (320 мл). Туди ж протягом проміжку часу в 60 хв. додавали охолоджений реакційний розчин першої взаємодії, причому охолодження зберігали. Через наступні 2 години при 50 °C реакційну суміш залишали нагріватися до кімнатної температури і перемішували наступні 10 годин. Реакційна суміш містила згідно з аналізом ГХ складний метиловий ефір 3-дифторметил-1метил піразол-4-карбонової кислоти (ізомер а) в суміші зі складним метиловим ефіром 2дифторметил-1-метилпіразол-3-карбонової кислоти (ізомер б) з співвідношенням ізомерів а:б в 90:10. Потім реакційну суміш концентрували під зниженим тиском. Залишок змішували з 120 г 10 %-ого розчину їдкого натру і перемішували 4 год. при 100 °C. Після підкислення водного розчину соляною кислотою до рН 1 і багаторазової екстракції за допомогою МТБЕ одержували органічний розчин, який містив 13,4 г зазначеної в заголовку сполуки (вихід ізомер а: 71 %). Зазначену в заголовку сполуку виділяли шляхом кристалізації у вигляді світло-коричневої твердої речовини. Приклад 5: одержання складного ізопропілового ефіру 3-дифторметил-1-метилпіразол-4карбонової кислоти В 500 мл тригорлечковій колбі, що оснащена магнітною мішалкою і термометром поміщали магнітну стружку (4,9 г, 0,20 моль), триметилсилілхлорид (21,8 г, 0,20 ммоль) і безводний диметилформамід (ДМФ, 250 мл). Після активування магнію за допомогою ультразвуку в льодяній ванні додавали складний ізопропіловий ефір 2ізопропоксиметилен-4,4,4-трифтор-3-оксоолійної кислоти (26,8 г, 0,10 моль) протягом проміжку часу в 30 хв., причому реакційну температуру утримували в межах від 0 до 10 °C. Через наступні 60 хв. видаляли надлишковий триметилсилілхлорид під зниженим тиском. В другій 500 мл тригорлечковій колбі при -50 °C поміщали водний розчин метилгідразину (37 %, 20,8 г, 0,12 моль) і етанол (320 мл). Туди ж протягом проміжку часу в 60 хв. додавали охолоджений реакційний розчин першої взаємодії, причому охолодження зберігали. Через наступні 2 години при -50 °C реакційну суміш залишали нагріватися до кімнатної температури і перемішували наступні 10 годин. Реакційна суміш містила згідно з аналізом ГХ складний ізопропіловий ефір 3дифторметил-1-метилпіразол-4-карбонової кислоти (ізомер а) в суміші зі складним ізопропіловим ефіром 2-дифторметил-1-метилпіразол-3карбонової кислоти (ізомер б) з співвідношенням ізомерів а:б в 83:17. Приклад 6: хлорид 3-дифторметил-1метилпіразол-4-карбонової кислоти Нагрівали розчин 293 г 3-дифторметил-1метилпіразол-4-карбонової кислоти, одержаний аналогічно до прикладу 2, в 700 г толуола до 90 °C і туди додавали протягом 3,5 год. 260 г тіонілхлориду. Залишали охолоджуватися і суміш концентрували в вакуумі, залишок змішували з 100 мл толуолу і знову концентрували в вакуумі. Залишок дистилювали через насадочну колонку при тиску в 25 97498 0,8 мбар і температурі верху в 109 °C, причому одержували 298,4 г хлорангідриду кислоти з чистотою в 99 % (вихід 92,1 %). Приклад 7: N-(3,4'-дихлор-5-фторбифент-2ил)амід 3-дифторметил-1-метилпіразол-4карбонової кислоти В 2-х л чотиригорлечковій колбі з мішалкою і краплинною лійкою розчиняли 208 г (0,788 моль) 2-аміно-3',4'-дихлор-5-фторбіфенілу (чистота 97 %) і 82,1 г (1,04 моль) піридину в 1100 мл сухого толуолу, нагрівали до 45 °C і туди ж протягом 30 хв. через краплинну лійку додавали 155 г (0,788 моль) одержаного згідно з прикладом 6 хлориду 3дифторметил-1-метилпіразол-4-карбонової кислоти. Краплинну лійку промивали невеликою кількістю толуолу і перемішували 1 год. при 75 °C. Потім екстрагували в теплі по черзі за допомогою 270 мл 5 мас.-%-ої водної соляної кислоти, 270 мл 10 мас.-%-ого водного розчину гідрокарбонату натрію і 270 мл деіонізованої води. Органічну фазу охолоджували при перемішуванні до кімнатної темпе 26 ратури. При цьому одержували продукт у вигляді твердої речовини, яку відсмоктували через скляний фільтр і проводили повторне промивання холодним толуолом (0 °C). Тверду речовину потім висушували в вакуумі. Таким чином, одержували 264 г зазначеної в заголовку сполуки у вигляді білої твердої речовини з чистотою >99 %. Аналогічно до прикладу 7 одержували зазначені в таблиці 2 аніліди піразол-4-карбонової кис2 лоти загальної формули V (R =СН3): Таблиця 2 Приклад 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 5 Rm 5-F 5-F 5-F 6 R 3,4-дихлорфеніл 1,1,2,3,3,3-гексафторпропокси 1,1,2,2-тетрафторетокси 4-(метоксииминометил)-3-фторфеніл 1,3-диметилбутил 4-хлор-3-фторфеніл 3-фтор-4-метилфеніл 2-(циклопропіл)-циклопропіл 2,4-дифторфеніл 2,5-дифторфеніл 2,4-дихлорфеніл 2,5-дихлорфеніл 3,5-дифторфеніл 3,5-дихлорфеніл 3-фторфеніл 3-хлорфеніл 2-фторфеніл 2-хлорфеніл 3,4,5-трифторфеніл 2,4,5-трифторфеніл Вихід [%] 88 89 92 82 86 45 90 81 96 80 88 82 79 95 72 79 63 69 93 89 Комп’ютерна верстка А. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing difluoromethyl pyrazolyl carboxylates
Автори англійськоюRack Michael, Smidt, Sebastian, Peer, Loehr Sandra, Keil Michael, Dietz Jochen, Rheinheimer Joachim, Grote Thomas, Zierke, Thomas, Lohmann Jan Klaas, Sukopp, Martin
Назва патенту російськоюСпособ получения дифторметилпиразолилкарбоксилатов
Автори російськоюРак, Михаэль, Шмидт Себастиан Пер, Льор Сандра, Кайль Михаэль, Дитц Йохен, Райнхаймер Йоахим, Гроте Томас, Цирке Томас, Ломанн Ян Клаас, Зукопп Мартин
МПК / Мітки
МПК: C07D 237/04, C07F 7/04
Мітки: одержання, спосіб, дифторметилпіразолілкарбоксилатів
Код посилання
<a href="https://ua.patents.su/13-97498-sposib-oderzhannya-diftormetilpirazolilkarboksilativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання дифторметилпіразолілкарбоксилатів</a>












