Диметилбензофурани та диметилбензопірани як 5-нт3-антагоністи, способи їх одержання, фармацевтична композиція
Номер патенту: 49792
Опубліковано: 15.10.2002
Автори: Ван Лерховен Віллі Жоан Каролус, Ван Деле Жорж Анрі Поль, Босманс Жан-Поль Рене Марі Андре
Формула / Реферат
1. Соединение в качестве активного ингредиента средства для лечения 5-НТ3 медиированных нарушений общей формулы І
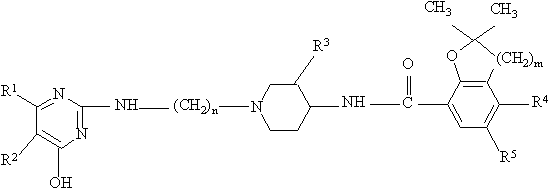
или его фармацевтически пригодная аддитивная соль кислоты, или стереохимический изомер этого соединения, где
R1 и R2 – атом водорода или R1 и R2 вместе образуют двухвалентный радикал формулы
-CH=CH-CH=CH-, (a),
-СН=С(Сl)-CH=CH-, (b),
-CH=CH-C(Cl)=СН-, (с);
n = 2, 3 или 4;
R3 - атом водорода или метоксигруппа;
m = 1 или 2;
R4 - атом водорода, аминогруппа или С1-С3-алкилкарбониламиногруппа;
R5 - атом водорода или галогена.
2. Соединение по п.1, где R3 представляет собой метоксигруппу и имеет цис-конфигурацию.
3. Соединение по п.2, представляющее собой левовращающее соединение.
4. Соединение по п.1, представляющее собой соединение выбранное из группы, включающей (-)-цис-4-амино-5-хлор-2,3-дигидро-N-[1-[3-[(3,4-дигидро-4-оксо-2-пиримидинил)амино]пропил]-3-метокси-4-пиперидинил]-2,2-диметил-7-бензофуранкарбоксамид или (-)-цис-4-амино-5-хлор-N-[1-[2-[(3,4-дигидро-4-оксо-2-пиримидинил)амино]этил]-2,3-дигидро-3-метокси-4-пиперидинил]-2,2-диметил-7-бензофуранкарбоксамид или их фармацевтически пригодные аддитивные кислые соли.
5. Соединение, представляющее собой левовращающий энантиомер общей формулы Ia
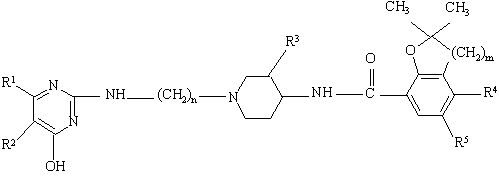
или его фармацевтически пригодная аддитивная соль кислоты, где
R1 и R2 - атом водорода или R1 и R2 вместе образуют двухвалентный радикал формулы:
-СН=СН-СH=СН-, (а),
-CH=C(Cl)-CH=CH-, (b) или
-СН=СН-С(Сl)=СН-, (c);
n - целое число, равное 2, 3 или 4;
R3 представляет собой метоксигруппу и имеет цис-конфигурацию;
m - целое число, равное 1 или 2;
R4 - атом водорода, аминогруппа или С1-С3-алкилкарбониламиногруппа;
R5 - атом водорода или галогена.
6. Соединение по п.5, представляющее собой (-)-цис-4-амино-5-хлор-2,3-дигидро-N-[1-[3-[(3,4-дигидро-4-оксо-2-пиримидинил)амино]пропил]-3-метокси-4-пиперидинил]-2,2-диметил-7-бензофуранкарбоксамид или (-)-цис-4-амино-5-хлор-N-[1-[2-[(3,4-дигидро-4-оксо-2-пиримидинил)амино]этил-2,3-дигидро-3-метокси-4-пиперидинил]-2,2-диметил-7-бензофуранкарбоксамид или его фармацевтически пригодную аддитивную соль кислоты.
7. Фармацевтическая композиция для лечения 5-НТ3 медиированных нарушений, отличающаяся тем, что содержит инертный носитель и в качестве активного компонента эффективное 5-НТ3-антагонистическое количество соединения по п.5.
8. Энантиомерно обогащенный или энантиомерно чистый цис-3-метокси-4-аминопиперидин формулы (ХІХ-а)
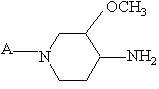
или его фармацевтически пригодная аддитивная соль кислоты, где
А - Р1, где Р1 - С1-С4-алкилкарбонил, С1-С4-алкилоксикарбонил, тригалогенметилкарбонил или фенилметил.
9. Способ получения энантиомерно обогащенного или энантиомерно чистого цис-3-метокси-4-аминопиперидина формулы (ХІХ-а)
 ,
,
где А - Р1, где Р1 - С1-С4-алкилкарбонил, С1-С4-алкилоксикарбонил, тригалогенметилкарбонил или фенилметил, отличающийся тем, что осуществляют реакцию рацемического 3-метокси-4-оксопиперидина формулы (ХХII-а), где А имеет указанные значения, с одним энантиомером хирального амина формулы (XXIII), где R8 - С1-С6-алкил или гидрокси-С1-С6-алкил и Аr - фенил, возможно замещенный галогеном, С1-С6-алкилом или С1-С6-алкилоксигруппой, с образованием промежуточного продукта формулы (XXI-a), где А, Аr и R8 имеют указанные значения, который гидрируют в присутствии катализатора, например палладия на угле, платины на угле или родия на угле,
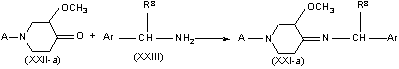
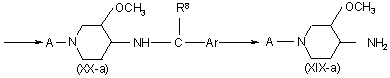 ,
,
с образованием диастереомерно обогащенного или диастереомерно чистого промежуточного продукта формулы (ХХ-а), где А, Аr и R8 имеют указанные значения, и последующим удалением хиральной вспомогательной группы Аr-CH(R8)- и, если нужно, превращают промежуточный продукт формулы (ХІХ-а) в его кислую аддитивную соль обработкой кислотой или, наоборот, превращают соль кислоты в свободное основание обработкой щелочью.
10. Способ получения левовращающего энантиомера формулы I-а
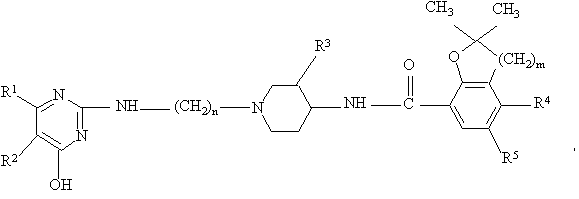
где R3, R4 и R5 имеют указанные значения, отличающийся тем, что осуществляютследующие стадии:
а) проводят реакцию энантиомерно обогащенного или энантиомерно чистого промежуточного продукта формулы (XIV-а), где Р1 - С1-С4-алкилкарбонил, С1-С4-алкилоксикарбонил, тригалогенметилкарбонил или фенилметил, с кислотой формулы (V) или ее функциональным производным с последующим удалением защитной группы P1 и получают энантиомерно обогащенный или энантиомерно чистый промежуточный продукт формулы (II-а), где R3, R4 и R5 и m имеют указанные значения
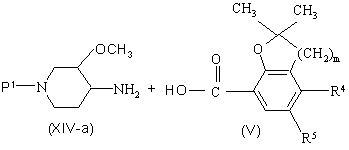
![]() ,
,
![]() b) N-алкилируют энантиомерно обогащенный или энантиомерно чистый промежуточный продукт формулы (II-a) реагентом формулы (XI), где Р подходящая защитная группа легкоудаляемая, например гидрогенолизом или гидролизом, W1 – удаляемая группа, такая как галоген или метансульфонилоксигруппа, с последующим удалением защитной группы P, получая энантиомерно обогащенный или энантиомерно чистый промежуточный продукт формулы (VII-а)
b) N-алкилируют энантиомерно обогащенный или энантиомерно чистый промежуточный продукт формулы (II-a) реагентом формулы (XI), где Р подходящая защитная группа легкоудаляемая, например гидрогенолизом или гидролизом, W1 – удаляемая группа, такая как галоген или метансульфонилоксигруппа, с последующим удалением защитной группы P, получая энантиомерно обогащенный или энантиомерно чистый промежуточный продукт формулы (VII-а)
![]()
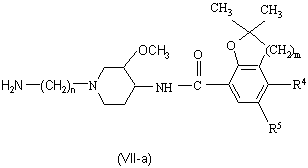 ,
,
с) проводят реакцию энантиомерно обогащенного или энантиомерно чистого промежуточного продукта формулы (VII-а), где R4 и R5, m и n имеют указанные значения, с реагентом формулы (VI), где R6 - водород или С1-С6-алкил и W2 представляет собой соответствующую удаляемую группу, такую как, например галоген, например хлор, бром или йод, сульфонилоксигруппу, например метансульфонилоксигруппу, метилбензолсульфонилоксигруппу, С1-С6-алкилоксигруппу, например метокси-, этокси-, С1-С6-алкилтиогруппу, например метилтио-, этилтио-, а R2 имеет указанные значения, и, если необходимо, отщепляют защитную эфирную группу для получения энантиомерно обогащенного или энантиомерно чистого соединения формулы (I-a)
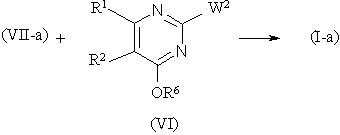
и, если нужно, осуществляют дальнейшую очистку энантиомерно обогащенного соединения формулы (I-а) для получения энантиомерно чистого соединения формулы (I-a) и, если далее нужно, превращают соединение формулы (I-а) в фармацевтически приемлемую аддитивную кислую соль обработкой кислотой или, наоборот, превращают аддитивную кислую соль в свободное основание обработкой щелочью.
Текст
B ЕP-0 389 087, опубликованном 26 сентября 1990г., описаны производные N-(З-гидрокси-4пиперидинил) (дигидробензофуран, дигидро-2Н-бензопиран или дигидробензодиоксин)карбоксамида и в ЕР-0 445 862, опубликованном 11 сентября 1991г., описаны производные N-(4-пиперидинил) (дигидробензофуран- или дигидробензо-2Нбензопиран)карбоксамида. В обеих заявках описана способность этих соединений стимулировать желудочно-кишечную перистальтику. Производные диметилдигидробензофурана и диметилдигидро-2Н-бензопирана настоящего изобретения проявляют 5-НТ3-антагонизм (антагонизм к 5-гидрокситриптамину у 5-НТ 3-рецепторов). Настоящее изобретение относится к способу лечения теплокровных животных, страдающи х 5-НТ3-медиированными нарушениями, например, тревожными состояниями, психозами, депрессивными состояниями, шизофренией, нарушениями познавательной способности, злоупотреблениями лекарственными средствами, мигренью, рвотой, синдромом раздраженной толстой кишки и аналогичными нарушениями, системным введением этому теплокровному животному эффективного 5-НТ3-антагонистического количества соединения формулы фармацевтически пригодной соли с кислотой или стереохимического изомера этого соединения; у которого R1 и R2 представляют собой водород, или R1 и R2 вместе образуют двухвалентный радикал формулы (а), (b) или (c): -СН=СН-СН=СН- (а), -СН=С(Сl)-СН=СН- (b) -СН=СН-С(Сl)=СН- (с); n представляет собой число 2, 3 или 4; R3 представляет собой водород или метоксигруппу; m представляет собой число 1 или 2; R4 представляет собой водород, аминогруппу или С1-3-алкилкарбониламиногруппу; и R5 представляет собой водород или галоген. Настоящее изобретение относится также к применению соединений формулы I и их фармацевтически пригодных солей с кислотами и стереохимических изомеров для получения лекарственного препарата, предназначенного для лечения 5-НТ3-медиированных нарушений, например, тревожных состояний, психоза, депрессивных состояний, шизофрении, нарушений познавательной способности, злоупотребления лекарственными средствами, мигрени, рвоты, синдрома раздраженной толстой кишки и аналогичных нарушений. В указанных выше и последующи х определениях термин галоген обозначает фтор, хлор, бром и иод, предпочтительно хлор; С1-4-алкил обозначает содержащие от 1 до 4 атомов углерода насыщенные углеводородные радикалы с нормальной или разветвленной цепью, например метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил или 1,1-диметилэтил, предпочтительно метил. С1-6-Алкил обозначает С 1-4-алкил и более высшие гомологи его, как, например, пентил и гексил. C1-3-Алкилкарбонил обозначает ациды нормального или разветвленного строения, например, метилкарбонил, этилкарбонил, пропилкарбонил, предпочтительно метилкарбонил. Применяемый выше термин фармацевтически пригодная соль с кислотой обозначает нетоксичные, терапевтически активные соли с кислотами, которые могут образовать соединения формулы (I). Соединения формулы (I), обладающие основными свойствами, можно превратить в соответствующие терапевтически активные, нетоксичные соли с кислотами обработкой свободного основания подходящим количеством соответствующей кислоты обычными методиками. Примерами подходящих кислот являются неорганические кислоты, такие как галогеноводородные кислоты, например, соляная, бромистоводородная и подобные кислоты, серная кислота, азотная кислота, фосфорная кислота и подобные кислоты, или органические кислоты, например, уксусная, продионовая, гидроксиуксусная, 2-гидроксилропионовая, 2оксопропионовая, пропандиовая, бутандиовая, (Z)-2-бутендиовая, (Е)-2-бутендиовая, 2гидроксибутандиовая, 2,3-дигидроксибутандиовая, 2-гидрокси-1,2,3-про-пантрикарбоновая, циклогексансульфаминовая, 2-гидроксибен-зойная, 4-амино-2-гидроксибензойная и подобные кислоты. Термин фармацевтически пригодные соли включает также сольваты, которые соединения формулы (I) могут образовать, например, алкоголяти, в частности гидраты. Соединения формулы (I) могут также находиться в виде их таутомерных форм. Предполагается, что такие формы, хотя они подробно не указываются выше, включены в объем настоящего изобретения. Применяемый выше термин стереохимические изомеры, обозначает различные изомерные формы, которые могут иметь соединения формулы (I). Если не оговорено особо или не указано иначе, по химическому определению соединения представляют собой смесь всех возможных стереохимических изомерных форм, причем эти смеси содержат все диастереомеры и/или энантиомеры основной молекулярной структуры. Предполагается, что все стереохимическая изомерные формы соединений формулы (I), как в чистом виде, так и в смеси друг с другом, включены в объем настоящего изобретения. Приводимый ниже термин "энантиомерно чистый" обозначает соединения, имеющие содержание энантиомера от, по меньшей мере, 94% (т.е. минимальное содержание одного энантиомера 97% и максимальное содержание другого энантиомера 3%) до 100% (т.е. содержание одного энантиомера 100% и отсутствие другого), в частности соединения, имеющие содержание энантиомера от 96% до 100%, более конкретно, соединения, имеющие содержание энантиомера от 98% до 100%. Термин "энантиомерно обогащенный" обозначает соединения, имеющие содержание энантиомера от более чем 0% до около 94%. Термины "диастереомерно обогащенные" и "диастереомерно чистые", которые будут приведены ниже, следует понимать аналогичным образом, но для содержания диастереомера в указанной смеси. Для применения в качестве 5-НТ3-антагонистов интересны соединения формулы (І), у которых представляет собой галоген, предпочтительно хлор. Для применения в качестве 5-НТ3-антагонистов интересны также соединения формулы (І), у которых R4 представляет собой водород или аминогруппу. Для применения в качестве 5-НТ3-антагонистов наиболее интересны соединения формулы (I), у которых R1 и R2 представляют собой водород; n представляет собой число 1 или 2; R3 представляет собой метоксигруппу и имеет цис-конфигурацию; m представляет собой 1; R4 представляет собой аминогруппу и R5 представляет собой галоген. В частности интересными для применения в качестве 5-НТ3-антагонистов являются соединения формулы (I), в которой R3 представляет собой метоксигруппу и имеет цисконфигурацию, которые являются левовращающими. Предпочтительными соединениями являются (-)-цис-4-амино-5-хлор-2,3-дигидро-N-[1-[3-[(3,4дигидро-4-оксо-2-пиримидинил)амино]пропил]-3-метокси-4-пиперидинил]-2,2-диметил-7бензофуранкарбоксамид и (-)-цис-4-амино-5-хлор-N-[1-[2-[(3,4-дигидро-4-оксо-2пиримидинил)амино]этил]-2,3-дигидро-3-метокси-4-пиперидинил-2,2-диметил-7-бензофуранкарбоксамид и их фармацевтически пригодные соли с кислотами. Соединения формулы (I), у которых R3 представляет собой метоксигруппу и имеют цисконфигурацию, представлены формулой (la). Указанные далее промежуточные продукты, у которых R3 представляет собой метоксигруппу и возможно имеет цис-конфигурацию, будут обозначены путем добавления буквы -а к их номерам. Дополнительным признаком настоящего изобретения является тот факт, что левовращающие энантиомеры соединений формулы (I), у которых R3 представляет собой метоксигруппу и имеет цис-конфигурацию, т.е. левовращающие энантиомеры соединений формулы (I-а), счи таются новыми соединениями. Соединения формулы (I) можно обычно получать известными способами, например, описанными в ЕР-389 037, и другими известными способами. Некоторые промежуточные продукты формул (II), (III), (ІV), (V), (VІ), (VІІ), (IX), (X) и (XIII) описаны в ЕР-0 389 037, ЕР-0 445 862 и ЕР-0 076 350. Некоторые способы получения соединений формулы (I), особенно соединений формулы (I-а) и новых промежуточных продуктов будут описаны ниже. В указанных способах получения продукты реакции можно выделить из реакционной смеси и, если необходимо, далее очищать методиками, обычно известными в данной области, например, экстракцией, перегонкой, кристаллизацией, растиранием и хроматографией. Для упрощения структурного изображения соединений формулы (I) и некоторых исходных соединений и промежуточных продуктов их радикал формулы далее будет обозначаться символом D и радикал формулы далее будет обозначаться символом L. Соединения формулы (I) можно получить N-алкилированием пиперидина формулы (II) промежуточным продуктом формулы (III) W1, приведенный в схеме реакции соединения (III) с (II) и последующих реакционных схемах, обозначает соответствующую удаляемую группу, такую, как галоген, например, хлор, бром или иод, или сульфонилоксигруппа, например, метансульфонилоксигруппа, 4метилбензолсульфонилоксигруппа и подобные удаляемые группы. Реакцию N-алкилирования соединения (II) соединением (III) обычно проводят известными способами алкилирования. Соединения формулы (I) можно также получить N-ацилированием амина формулы (IV) карбоновой кислотой формулы (V) или ее функциональным производным, например, ацилгалогенидом, симметричным или смешанным ангидридом или эфиром, предпочтительно активированным эфиром, известными методами. Может быть целесообразно защитить амино- или гидроксигруппы в процессе проведения реакции, чтобы избежать нежелательные побочные реакции. Подходящие защитные группы представляют собой легко удаляемые группы, например С1-4-алкилкарбонил, С1-4алкилоксикарбонил, фенилметил, третбутил и подобные защитные группы. Соединения формулы (I) можно также получить N-алкилированием промежуточного продукта формулы (VII) алкилирующим реагентом формулы (VI), в которой Р6 представляет cобой водород или С1-6-алкил и W2 представляет собой соответствующую удаляемую группу, такую как галоген, например, хлор, бром или иод; сульфонилоксигруппа, например, метансульфонилоксигруппа, 4метилбензолсульфонилоксигрулпа; С1-6-алкилоксигрупла, например, метоксигруппа, этоксигруппа; С1-6-алкилтиогруппа, например, метилтиогруппа, этилтиогруппа. Когда представляет собой С1-6-алкил, образуется промежуточный продукт формулы (VІІІ), который можно затем превратить в конечное соединение путем отщепления защитной простой эфирной группы. Такое отщепление можно осуществить обработкой промежуточного продукта формулы (VІІІ) кислотой, такой как галогеноводородная кислота, например, соляная кислота. Соединения формулы (I) можно альтернативно получить аминопиридина формулы (IX) промежуточным продуктом формулы (X). N-алкилированием 2 Реакция алкилирования соединений формулы (VІ) соединениями (VII) и соединений формулы (IX) соединениями (X) можно проводить известными способами, например, перемешиванием и иногда нагреванием реагентов без растворителя или в смеси с инертным органическим растворителем, таким как спирт, например, 2-пропанол, бутанол, диполярный апротонный растворитель, например, ацетонитрил, возможно в присутствии подходящего основания, например, карбоната калия. Соединения формулы (I) можно также превратить друг в друга известными реакциями превращений. Амидогруппы можно превратить в С 1-3-алкилкарбонилами-ногруппы известными реакциями N-ацилирования и, наоборот, С1-3-алкилкарбониламиногруппы можно превратить в аминогруппы известными реакциями гидролиза. Соединения формулы (I), у которых R5 представляет собой водород, можно превратить в соответствующие соединения, у которых R5 представляет собой галоген, при помощи известных методик галогенирования. Промежуточные продукты формулы (VII) можно получить N-алкилированием промежуточного продукта формулы (II) реагентом формулы (XI) с последующим удалением защитной группы P у подученного таким образом промежуточного продукта (XIII) по известным методикам реакций. В соединениях формул (XI) и (XIII) и други х промежуточных продуктах, содержащих группу P, приведенных схем P представляет собой подходящую защитную группу, легко удаляемую, например, гидрогенолизом или гидролизом. Предпочтительными защитными группами являются, например, С1-4-алкилкарбонилы, например, метилкарбонил, этилкарбонил; С1-4алкоксикарбонилы, например, этоксикарбонил, 1,1'-диметил-этилоксикарбонил; тригалогенметилкарбонилы, например, трифторметилкарбонил; дифенилметил; трифенилметил или арилметил, где арил представляет собой фенил, возможно имеющий до двух заместителей, выбранных из С1-4-алкоксигрупп и галогенов. Промежуточные продукты формулы (II) можно получить по известным методикам образования амидов реакцией соответственно замещенного пиперидина формулы (ХIV) с промежуточной кислотой формулы (V) или ее функциональным производным с последующим удалением защитной группы Р' известными методами. Р’ представляет собой легко удаляемую защитную группу и имеет такое же значение, как указанная выше гр уппа Р. Промежуточные продукты формулы (ХIV), у которых R3 представляет собой метоксигруппу и имеет цис-конфигурацию, т.е. 3-метокси-4-амднопиперидиды формулы (ХIV-а), можно получить, например, каталитическим гидрированием имина формулы (ХVI-а) с последующим превращением вторичного амина формулы (ХV-а) в З-метокси-4-аминопилеридины формулы (ХIV-а) гидрогенолизом. Имины формулы (ХVI-а) можно получить известными методами образования иминов из 3-метокси-4-окоопилеридина формулы (ХVII-а) и имина формулы (ХVIII). В промежуточных продуктах формул (ХVIII), (ХVI-а) и у (ХV-а) R7 представляет собой водород, С1-6-алкил или гидрокси-С 1-6-алкил и Ar представляет собой фенил, возможно замещенный галогеном, C1-6-алкилом, С1-6-алкилоксигруппой, или нафтил, возможно замещенный галогеном, C1-6-алкилом, С1-6-алкилоксигруппой. Последовательность реакций от промежуточного продукта формулы (ХVII-а) до образования промежуточного продукта формулы (ХIV-а) можно также проводить по методике в одной емкости. Энантиомерно обогащенные или энантиомерно чистые промежуточные продукты формул (ХV-а) и (ХIV-а) можно получить одним из следующи х способов. Исходный рацемический З-метокси-4-оксопиперидин формулы (ХVII-а) или соответствующий кеталь, такой как ди-С 1-6-алкилкеталь, например, 4,4-диэтокси-3-метоксидидерлдин, можно разделить на его энантиомеры и затем превратить в энантиомерно чистый цис-З-метокси-4аминопилеридин формулы (ХIV-а), как описано выше. Такое разделение на энантиомеры можно проводить, например, колоночной хроматографией с применением хиральной неподвижной фазы, например Chiracell OD. Альтернативно промежуточный имин формулы (ХVI-а) можно получить, применяя один из энантиомеров хирального амина формулы (ХVIII), в которой R7 имеет указанные выше значения, кроме водорода, причем эти амины представлены формулой (ХVІІІ-b), например, (-)-(R)-aаминобензолэтанолом или (+)-S-a-аминобензолэтанол, которые после гидрирования превращаются в диастереомерные амины формулы (ХV-а), которые можно, как обычно, разделить методами физического разделения, например, методиками селективной кристаллизации или хроматографическими методами. Удалением арилметила формулы АrСН(R7) у соответствующи х диастереомерных аминов формулы (ХV-а) гидрогенолизом получают соответствующие энантиомерные З-метокои-4-аминопиперидины формулы (ХIV-а). Однако, в процессе оптимизации указанной выше реакционной последовательности был найден другой путь получения энантиомерно чистых З-метокси-4-амияолиперидинов формулы (ХIV-а). При проведении реакции рацемического кетона, например, З-метокси-4-оксопиперидина формулы (ХVII-а), с энантиомерно чистым хиральным амином формулы (ХVІІІ-b), например, (-)(S)-a-метилбензиламином, и последующего гидрирования образованного таким образом имина формулы (ХVI-а) ожидаемое соотношение диастереомерных аминов формулы (ХV-а) составляет около 1:1. Однако, неожиданно было найдено, что после проведения указанной выше реакционной последовательности полученное диастереомерное соотношение значительно отличается от соотношения 1:1. Другими словами, амины формулы (ХV-а) были диастереомерно обогащенными или даже диастереомерно чистыми. Следовательно, в процессе реакционной последовательности один диастереомер превращается в другой конфигурационным обращением стереоцентра, имеющего метоксигруппу. Следовательно, найден новый и изобретательский способ получения новых энантиомерно обогащенных или энантиомерно чистых 3-метокси-4-аминопиперидинов формулы (ХIV-а) и, в более общем виде, промежуточных продуктов формулы (ХIХ-а) по методике описанной ниже более подробно. В формулах (ХIХ-а), (ХХ-а), (ХХI-а) и (ХХII-а) радикал А представляет собой водород, -(CH2)nNH2, -(СН2)n-NH-P, P’ или L, где n, P, P' и L имеют указанные выше значения. Реакцией рацемической смеси 3-метокси-4-оксопиперидина формулы (ХХII-а) с одним энантиомером хирального амина формулы (XXIII), у которого R8 представляет собой С1-6-алкил или гидрокси-С 16-алкил, Ar представляет собой фенил, возможно замещенный галогеном, С 1-6-алкилом, С 1-6алкилоксигруппой; или нафтил, возможно замещенный галогеном, C1-6-алкилом, С1-6алкилоксигруппой, получают диастереомерную смесь промежуточного имина формулы (ХХI-а). Эту реакцию можно проводить с применением известных методик образования иминов, например, перемешиванием реагентов при температуре кипения в инертном в реакционных условиях растворителе, таком как ароматический углеводород, например, метилбензол, с применением прибора Дина-Старка. Имин формулы (ХХI-а) можно выделить и, если необходимо, очистить, например, колоночной хроматографией, перегонкой или кристаллизацией. Затем ямин можно гидрировать перемешиванием его в атмосфере водорода в пригодном растворителе, таком как; спирт, например, метанол или этанол; простой эфир, например, тетрагидрофуран или 2,2'оксибиспропан; сложный эфир, например, етилацетат; ароматический углеводород, например, метилбензол, в присутствии подходящи х катализаторов, например, палладия на угле, платины на угле, родия на угле и подобных катализаторов, получая диастереомерно обогащенный или диастереомерно чистый амин формулы (ХХ-а). В альтернативном варианте промежуточный имин формулы (ХХI-а) не выделяют. В этом случае рацемическую смесь 3-метокси-4-оксопиперидина формулы (ХХII-а) обрабатывают одним из энантиомеров хирального амида формулы (XXIII) в условиях гидрирования, получая диастереомерно обогащенные или диастереомерно чистые промежуточные амины формулы (ХХа). Эту реакцию проводят в условиях, аналогичных описанным выше. Однако, в этом случае реакцию предпочтительно проводят в смеси с кислотой, например, уксусной кислотой, щавелевой кислотой, хлоруксусной кислотой, 2-гидрокси-1,2,3-пропантрикарбоновой кислотой и в частности (-)-[S-(R*,R*)-2,3-дигидроксибутандиовой кислотой, особенно, когда растворителем является спирт. В аминах формулы (XXIII) R8 представляет собой гидроксиметил, метил или этил, особенно метил, и Аr предпочтительно представляет собой незамещенный фенил или нафтил, особенно фенил. Предпочтительными аминами формулы (XXIII) являются энантиомеры aметилбензиламина, т.е. (-)-(S)-a-метилбензиламин или (+)-(R)-a-метилбензиламин. Иногда в процессе реакции гидрирования может образоваться небольшое количество транс3-метокси-4-аминосоединения, которое можно удалить кристаллизацией или хроматографией. Предпочтительный путь получения диастереомерно обогащенного или чистого амина формулы (XX-a) предусматривает получение сначала амина формулы (ХХI-а) с применением энантиомера a-метилбензиламина и последующее гидрирование имина формулы (ХХI-а) перемешиванием его в метилбензоле в атмосфере водорода с применением родиевого катализатора. Чтобы избежать нежелательное дальнейшее гидрирование некоторых функциональных гр упп у реагентов и продуктов реакции, полезно добавлять и реакционную среду яд для катализатора, например, тиофен, хинолин-серу и т.д. Повышенные давления и/или температуры могут повышать скорость реакции. Полученный промежуточный продукт формулы (ХХ-а) имеет соотношение диастереомеров, которое очень сильно отличается от соотношения 1:1. Другими словами, промежуточное соединение формулы (ХХ-а) диастереомерно обогащенное или диастереомерно чистое. Соответствующие диастереомерные формы можно затем, если нужно, далее разделять с применением обычных физических методов, например, хроматографией или фракционной кристаллизацией, возможно после образования соли. Полученные таким образом диастереомерно чистые амины формулы (ХХ-а) можно затем гидрогенолизом для удаления хиральной дополнительной группы Ar-СН(R8) превратить в энантиомерно чистые 3-метокси-4аминопиперидины формулы (ХIХ-а). Заслуживает внимания замечание, что конфигурация стереоцентра, имеющего метоксигруппу, определяется конфигурацией применяемого исходного энантиомерно чистого амина формулы (ХVIII). Следовательно, любую конфигурацию этого стереоцентра можно получить отбором одного или другого энантиомера амина формулы (XXIII). Можно далее отметить, что выбор кислоты, применяемой в процессе гидрирования имина, может также влиять в определенной степени на соотношение диастереомеров аминов формулы (ХIХ-а). Выбор катализатора также может оказывать влияние в определенной степени на количество образованного транс-4-амино-З-метоксисоединения. Диастереомерно обогащенные или диастереомерно чистые промежуточные продукты формулы (ХХ-а) и энантиомерно обогащенные или энантиомерно чистые промежуточные продукты формулы (ХХ-а) и их фармацевтически пригодные соли с кислотами считаются новыми соединениями. Новыми соединениями считаются также энантиомерно обогащенные дли энантиомерно чистые промежуточные продукты формул (II-а), (IV-а), (VIIа), (Х-а), (ХIII-а), (ХIV-а) и их фармацевтически пригодные соли с кислотами. Эти промежуточные продукты можно получить, как описано выше, из энантиомерно обогащенных или энантиомерно чистых промежуточных продуктов формулы (ХIV-а). С применением такой методики и описанных выше энантиомерно обогащенных или энантиомерно чистых промежуточный продуктов предложен новый и изобретательский способ получения энантиомерно обогащенных или энантиомерно чистых соединений формулы (I-а), особенно левовращаюцих энантиомеров соединений формулы (I-а). Очевидно, что диастереомерные рацематы цис- и трансизомеров соединений формул (I), (Iа) или любых други х промежуточных продуктов можно также расщепить на их оптические изомеры, цис-(+)-, циc-(-)-, транс-(+)- и транc-(-)-изомеры, при помощи известных методик. Диастереомеры можно разделить физическими способами разделения, например, селективной кристаллизацией и хроматографией, например, противоточным распределением. Энантиомеры можно разделить друг от друга селективной кристаллизацией их диаcтереомерных солей с энантиомерно чистыми кислотами или их энантиомерно чистыми производными. Соединения формулы (I) и их фармацевтически пригодные соли и стереоизомеры являются антагонистами 5-НТ3-рецептеров, что доказывается тем фактом, что они активны в проявлении, например, антагонизма химиорефлексу von Begold-Yarish, индуцированному серотонином (5-НТ) у крыс (Pharmacology and Foxicology, 70, 11, 17 - 22 (1992)). Этот тест описан ниже как пример 10. Соединения формулы (I), особенно соединения формулы (I-а), активны в течение долгого периода времени. Кроме того, настоящие соединения формулы (I), особенно соединения формулы (I-а), проявляют высокую степень безвредности для сердечно-сосудистой системы. Ввиду проявления 5-НТ3-антагонизма соединения изобретения можно выпускать в различных фармацевтических формах для целей введения. Для получения этих фармацевтических препаратов эффективное количество данного соединения в виде свободного основания или соли с кислотой, применяемого в качестве активного компонента, тесно смешивают с фармацевтически пригодным носителем. В зависимости от формы препарата, требуемого для введения, применяют различные формы носителя. Эти фармацевтические препараты желательно выпускать в виде уни фицированных доз, пригодных предпочтительно для введения перорально, ректальне или парентеральной инъекцией. Например, для получения препаратов в пероральной дозированной форме в качестве обычной фармацевтической среды можно применять, например, воду, гликоля, масла, спирты и подобные вещества в случае пероральных жидких препаратов, например, суспензий, сиропов, элексиров и растворов, или твердые носители, например, крахмалы, сахара, каолин, смазывающие вещества, связующие, дезинтегрирующие средства и подобные вещества в случае порошков, пилюль, капсул и таблеток. По причине легкости введения таблетки и капсулы являются наиболее благоприятной пероральной дозированной формой. Ясно, что в этом случае применяют твердые фармацевтические носители. Для парентеральных препаратов носитель обычно представляет собой стерильную воду, по меньшей мере, в большой части, хо тя можно включать другие компоненты, например, компоненты для повышения растворимости. Можно получить, например, инъецируемые растворы, в которых носитель представляет собой соляной раствор, раствор глюкозы или смесь соляного раствора и раствора глюкозы. Можно также получить инъецируемые суспензии, в этом случае можно применять соответствующие жидкие носители, суспендирующие средства и подобные средства. В препаратах, пригодных для чрескожного введения, носитель возможно содержит средство, усиливающее проникновение активного компонента, и/или подходящее смачивающее средство, возможно в комбинации с подходящими добавками любой природы в небольших количествах. Но эти добавки не должны оказывать значительное вредное действие на кожу. Эти добавки могут облегчать введение активного компонента в кожу и/или могут быть полезны для приготовления требуемых препаратов. Эти препараты можно вводить различными методами, например, в виде чрескожных повязок, нанесением пятен на кожу или в виде мазей. Соли соединений формулы (I) с кислотами благодаря их повышенной растворимости по сравнению с соответствующим основанием, явно более пригодны для приготовления водных препаратов. Особенно предпочтительно готовить указанные выше препараты в форме дозы на один прием для облегчения введения их и постоянства дозировки. Формой дозы на один прием в данном описании изобретения называют физически дискретные единицы, пригодные в качестве унифицированных доз, причем каждая единица содержит заданное количество активного компонента, рассчитанное для индуцирования желаемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных форм на один прием являются таблетки (включая таблетки с метками и оболочками), капсулы, пилюли, пакеты с порошком, облатки, инъецируемые растворы или суспензии, препараты в количестве чайных или столовых ложек и т.д., и такие формы в виде кратных этой дозе частей. Благодаря 5-НТ3-антагонистичеокой активности соединения формулы (I) и особенно новые соединения формулы (I-а) пригодны для лечения 5-НТ3-медиированных нарушений, например, тревожных состояний, психоза, депрессивного состояния (Arjneim, Forsch, 42(1), 239 - 246 (1992)), шизофрении, нарушений познавательной способности, например, недостаточной памяти (Arjneim. Forsch, 42(1) 246 - 249 (1992)), злоупотребления лекарственными средствами, мигрени, рвоты, например, индуцированной приемом цитотоксичних лекарственных средств и радиацией (Drugs 42(4), 551 - 568 (1991)), синдрома раздраженной толстой кишки, особенно диарреядоминирующего синдрома раздраженной толстой кишки, и аналогичных нарушений, следовательно, в настоящем изобретении предлагается способ лечения теплокровных животных, страдающих 5-НТ3-медиированными заболеваниями, например, лечения тревожных состояний, психоза, депрессивных состояний, шизофрении, нарушений познавательной способности, например, недостаточности памяти, злоупотребления лекарственными средствами, мигрени, рвоты, например, индуцированной цитотоксичними лекарственными средствами или радиацией, синдрома раздраженной толстой кишки, особенно диарреядоминирующего синдрома раздраженной толстой кишки, и аналогичных нарушений. Этот способ предусматривает системное введение теплокровным животным эффективного 5-НТ3-антагонистического количества соединения формулы (I), его фармацевтически пригодной соли о кислотой или стереоизомера. Настоящие соединения формулы (I) пригодны для приготовления лекарственного препарата, предназначенного для лечения 5-НТ3-медиированных нарушений. Новые соединения формулы (I-а) пригодны в качестве лекарственного средства. В общем, предполагается, что эффективное количество должно быть от около 0,001мг/кг до около 50мг/кг массы тела, предпочтительно от около 0,02мг/кг до около 5мг/кг массы тела. Способ лечения может включать также введение активного компонента по схеме, предусматривающей прием его 2 - 4 раза в день. Экспериментальная часть А. Получение промежуточных продуктов Пример 1 а) 3,4,4-Триметокси-1-(фенилметил)пиперидил (0,676моля) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, 98:2). Чистые фракции собирали и растворитель выпаривали. Этот остаток (смесь энантиомеров) разделяли на энантиомеры колоночной хроматографией на колонке с Chiracell OD (элюент: гексаны/2-пропанол, 98,5:1,5). Отбирали фракцию, соответствующую первому хроматографическому пику, и из нее выпаривали растворитель. Образец очищали перегонкой (т.кип. 120°C при 0,5мм рт.ст.), получая 56г (-)-3,4,4триметокси-1-(фенилметил)пиперидина с [a]D20 = -54,00° (с = 0,5% в метаноле) промежуточный продукт 1). Отбирали фракцию, соответствующую второму хроматографическому пику, и из нее выпаривали растворитель. Образец очищали перегонкой (т.кип. 120°С при 0,5мм рт.ст.), получая 64г (+)-3,4,4-триметокси-1-(фенилметил)пиперидин с [a]D20 = 49,60° (с = 0,5% в метаноле) (промежуточный продукт 2). b) Смесь промежуточного продукта 1 (0,21моля) в метаноле (600мл) гидрировали при 50°С применением в качестве катализатора 10% (3г) палладия на угле. После поглощения Н 2 (1экв) катализатор отделяли фильтрованием. В фильтрат добавляли оксид кальция (0,63моля). Реакционную смесь перемешивали при комнатной температуре. По каплям добавляли этилхлор формиат (0,63моля) и реакционную смесь перемешивали 2 часа при 50°С, затем при комнатной температуре в течение ночи, растворитель удаляли выпариванием. К остатку добавляли метилбензол. Суспензию фильтровали и фильтрат выпаривали. Остаток очищали перегонкой, получая 32,6г (63%) (-)-этил-3,4,4-триметокси-1-диперидинкарбоксилата с [a]D20 = 39,40° (c = 0,5% в метаноле) (промежуточный продукт 3). с) Смесь промежуточного продукта 3 (0,132моля), 4-метилбензолсульфокиcлоты (0,6г) в 2 пропаноле (180мл) и воде (30мл) перемешивали и кипятили с обратным холодильником 18 часов. Реакционную смесь охлаждали и добавляли N,N-диэтилэтанамин (0,6мл). Растворитель удаляли выпариванием (температур у поддерживали ниже 40°C). Остаток растворяли в CH2CI2. Этот раствор промывали два раза насыщенным раствором NaCI. Органический слой отделяли, сушили (MgSO 4), фильтровали и выпаривали для удаления растворителя. Остаток очищали перегонкой, получая 19,2г (-)-этил-3-метокси-4-окcо-1-пиперидинкарбоксилата (72,3%) с [a]D20 = 44,40° (с = 0,5% в метаноле) (промежуточный продукт 4). d) Смесь промежуточного продукта 4 (0,095моля) и бензолметанамина (0,11моля) в метаноле (200мл) гидрировали в атмосферных условиях с применением в качестве катализатора 10% (2г) палладия на активированном угле в присутствии 4%-ного раствора тиофена в 2',2оксибиспропане (2мл). После поглощения водорода катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток растворяли в метаноле (250мл) и полученную смесь гидрировали при 50°C с применением в качестве катализатора 10% (2г) палладия на активированном угле. После поглощения водорода (1экв) катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток очищали перегонкой (т. кип. 85°C при 0,1мм рт.ст.), получая 13,4г (70%) этил-(-)-цис-4-амино-3-метокси-1-пиперидинкарбоксилата с [a]D20 = -78,9 (с = 1% в метаноле) (промежуточный продукт 5). Аналогичным образом, но из промежуточного продукта 2 получали также (+)-этил-дис-4амино-3-метокси-1-пиперидин-карбоксилат с [a]D20 = -80,64° (с = 0,6% в метаноле) (промежуточный продукт 6). Пример 2 а) Смесь этил-3-метокои-4-оксо-1-пилеридинкарбоксилата (0,5моля), (-)-(S)-aметилбензолметанамина (0,53моля), моногидрата 4-метилбензолсульфокислоты (1,25г) и метилбензола (625мл) перемешивали и кипятили с обратным холодильником с применением прибора Дина-Старка в течение 3 часов, Реакционную смесь выпаривали и перегоняли, получая 121г (79,5%) (-)-этил-[цис(S)]-3-метокси-4-(1-фенилэтил)имин6]-1-пиперидинкарбоксилата (промежуточный продукт 7). b) Смесь промежуточного продукта 7 (0,4моля) и метилбензола (750мл) гидрировали при комнатной температуре и атмосферном давлении с применением в качестве катализатора родия на угле (5г). После поглощения водорода (1экв) катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток растворяли в 4-метил-2-пентаноне и превращали в соль с 4метилбензолсульфокислотой (1:1), применяя моногидрат 4-метилбензолсульфокислоты (1экв). Соль фильтровали и сушили. Эту фракцию перекристаллизовали два раза из смеси 2,2'оксибиспропан/метанол (250мл/180мл). Осажденный продукт фильтровали и сушили, получая 61,7г (32,5%) 4-метилбензолсульфоната (-)-этил-[цис (S)-3-метокси-4-[(1-фенилэтил)амино]-1пиперидинкарбоксилата (1:1) с [a]D20 = -62,16° (с = 1% в метаноле) (промежуточный продукт 8). Аналогичным образом, но применяя (+)-(R)-a-метил-бензолметанамин, получали 4метилбензолоульфонат (+)-этил-[цис(R)]-3-метокси-4-(1-фенилэтил)амино]-1-пиперидинкарбоксилата (1:1) с [a]D20 = 62,79° (с = 1% в метаноле) (промежуточный продукт 9). Пример 3 а) Смесь этил-3-метокси-4-окоо-1-диперидинкарбоксилата (0,2моля), (-)-(S)-aметилбензолметанамина (0,4моля) и (-)-[S-(R*,R*)-2,3-дигидроксибутандиовой кислоты (0,2моля) в метаноле (500мл) гидрировали при комнатной температуре и атмосферном давлении с применением в качестве катализатора 10% (2г) палладия на активированном угле в присутствии 4%-ного раствора тиофена в 2,2'-оксибиспропане (2мл). После поглощения Н2, (1экв) катализатор отделяли фильтрованием фильтрат выпаривали. Остаток распределяли между метилбензолом и H2O/NH4OH. Ор ганический слой отделяли, сушили (MgSO4) фильтровали и выпаривали для удаления растворителя. Остаток растворяли в 4-метил-2-пентаноне и превращали в соль с 4метилбензолсульфокислотой (1:1), применяя моногидрат 4-метилбензолсульфокислоты (1экв). Соль фильтровали и сушили. Э ту фракцию перекристаллизовывали из смеси 2,2'оксибиспропан/-СН3ОН (500мл/100мл). Смесь перемешивали 24 часа. Осадок отделяли фильтрованием и сушили (вакуум, 50°С), получая 32г 4-метилбензолсульфоната (-)-этил-[цис (S)]-3-метокси-4-[(1-фенилэтил)амино]-1-пиперидинкарбоксилата (1:1) с [a]D20 = -61,6°С (с = 0,5% в метаноле) (промежуточный продукт 8). Аналогичным образом, но с применением (+)-(R)-a-метилбензолметанамина, также получали 4-метилбензолсульфонат (+)-этил-[цис(R)]-3-метокси-4-[(1-фенилэтил)амино]-1пиперидинкарбоксилата (1:1) (промежуточный продукт 9). b) Промежуточный продукт 8 (0,067моля) превращали в свободное основание при помощи водного аммиака. Эту смесь экстрагировали метилбензолом. Органический слой отделяли, сушили (МgSO 4), фильтровали и выпаривали для удаления растворителя. Оставшееся свободное основание растворяли в метаноле (250мл) и гидрировали при комнатной температуре и атмосферном давлении с применением в качестве катализатора 10% (2г) палладия на активированном угле. После поглощения H2 (1экв) катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток очищали перегонкой (т. кип. 85°С при 0,1мм рт.ст.), получая 9,9г (79,2%) этил-(-)-цис-4-амино-3-метокси-1-пиперидинкарбоксилата (промежуточный продукт 5). Аналогичным образом, но из промежуточного продукта 9, также получали (+)-этил-цис-4 амино-3-метокси-1-пиперидинкарбоксилат (промежуточный продукт 6). Пример 4 а) Смесь 53,3г этил-3-метокси-4-оксо-1-пиперидинкарбоксилата (описан в ЕР-патенте 76 350), 33г (-)-(R)-a-аминобензолэтанола и 700мл этанола кипятили с обратным холодильником в течение ночи. После охлаждения реакционную смесь выпаривали и остаток перегоняли, получая 59,1г (92%) этил-(R)-4-[(2-гидрокси-1-фенилэтил)имино]-3-метокси-1-пиперидилкарбоксилата с т.кип. 180°С (давление 3,75 х 10-4Ра) (промежуточный продукт 10). b) Раствор 59,1г промежуточного продукта 10 в 500мл этанола гидрировали при нормальном давлении и при комнатной температуре с применением в качестве катализатора 2г платины на угле. После поглощения рассчитанного количества водорода катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток очищали на NH2-силикагеле (элюент: смесь хлористый метилен/циклогексан/метанол, 60:40:0,5). Чистые фракции собирали, из них выпаривали элюент, получая 18г (30%) этил-(-)-4(R)цис]4-[(2-гидрокси-1-фенилэтил)амино]-3метокси-1-пиперидинкарбоксилата в виде остатка. [a]D20 = -96,70° (с = 0,5% в метаноле) (промежуточный продукт 11). с) Раствор 18г промежуточного продукта 11 в 250мл метанола гидрировали при нормальном давлении и комнатной температуре с применением в качестве катализатора 2г палладия на угле (10%). После поглощения рассчитанного количества водорода катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток перегоняли, получая 6,2г (55%) этил-(-)-цис-4амино-3-метокси-1-пиперидинкарбоксилата (промежуточный продукт 5). Пример 5 а) 4-Амино-5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоновую кислоту (описана в ЕР0 389 037) (0,05моля) растворяли в смеси N,N-диэтилэтанамина (7мл) и трихлорметана (250мл). Этилкарбонохлоридат (0,05моля) добавляли по каплям при температуре ниже 10°С. Реакционную смесь перемешивали 30 минут при температуре ниже 10°С. Смесь добавляли в раствор промежуточного продукта 5 (0,047моля) в трихлорметане (250мл), перемешивали при 10°С. Реакционную смесь перемешивали 30 минут при комнатной температуре, затем промывали водой, 5%-ным NаОН и снова водой. Органический слой отделяли, сушили (МgSО 4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2CI2/CH3OH, 98:2). Чистые фракции собирали и растворитель выпаривали, получая 19г (94%) (+)-этил-цис-4-[(4-амино-5-хлор-2,3-дигидро-2,2-димиметил-7бензофуранил)карбониламино]-3-метокси-1-пиперидинкарбоксилата (промежуточный продукт 12). b) Смесь промежуточного продукта 12 (0,045моля) и едкого кали (0,45моля) в 2-пропаноле (300мл) перемешивали и кипятили с обратным холодильником в течение 12 часов. Реакционную смесь охлаждали и растворитель выпаривали, к остатку добавляли воду (100мл). Растворитель выпаривали. Остаток распределяли между дихлорметаном и водой. Органический слой отделяли, промывали водой, сушили (МgSO 4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2CI2/CH3OH/NH3), 97:3). Чистые фракции собирали и растворитель выпаривали. Остаток сушили (вакуум, 50°С), получая 12,5г (+)цис-4-амино-5-хлор-2,3-дигидро-N-(3-метокси-4-пиперидинил)-2,2-диметил-7бензофуранкарбоксамида (77,2%) с [a]D20 = 33,40° (c = 0,5% в метаноле) (промежуточный продукт 13). Пример 6 а) Смесь промежуточного продукта 13 (0,017моля), этил-(2-хлорэтил)карбамата (0,02моля) и N,N-диэтилэтанамина (0,022моля) в N,N-диметилформамиде (150мл) перемешивали 72 часа при 70°С. Реакционную смесь охлаждали и растворитель выпаривали. Остаток распределяли между дихлорметаном и водой. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали для удаления растворителя. Остаток очищали пропусканием через силикагель на стеклянном фильтре (элюент: CH2CI2/CH3OH, 97:3). Чистые фракции собирали и выпаривали растворитель, получая 5г (+)-этил-цис-[2-[4-[[(4-амино-5-хлор-2,3-дигидро-2,2-диметил-7бензофуранил)карбонил]амино]-3-метокси-1-пиперидинил]этил]карбамата (63%) с [a]D20 = 1,20° (с = 0,5% в метаноле) (промежуточный продукт 14). b) Смесь промежуточного продукта 14 (0,0106моля) и едкого кади (0,106моля) в 2-пропаноле (45мл) перемешивали и кипятили с обратным холодильником 4 часа. Смесь охлаждали, растворитель выпаривали и остаток перемешивали в воде, затем выпаривали снова. Остаток растворяли в дихлорметане и раствор промывали небольшим объемом воды, сушили (МgSО 4), фильтровали и растворитель выпаривали. Остаток очищали пропусканием через силикагель на стеклянном фильтре (элюент: CH2CI2/CH3OH/CH3OH/NH3), 90:9:1). Чистые фракции собирали и растворитель выпаривали, получая 3,2г (76%) (-)-цис-4-амино-N-[1-(2-аминоэтил)-3-метокси-4пиперидинил]5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида с [a]D20 = -1,50° (с = 0,2% в метаноле) (промежуточный продукт 15). Пример 7 а) Смесь промежуточного продукта 13 (0,023моля) и 2-пропенонитрила (0,028моля в 2пропаноле (150мл) перемешивали и кипятили с обратным холодильником 16 часов. Реакционную смесь охлаждали и растворитель выпаривали, получая 8г (85,5%) (-)-цис-4-амино-5-хлор-N-1-(2 циано-этил)-3-метокси-4-пиперидинил]-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида с [a]D20 = -1,60° (с = 0,5% в метаноле) (промежуточный продукт 16). b) Смесь промежуточного продукта 16 (0,02моля) в метаноле (250мл) и тетрагидрофуране (100мл) гидрировали при атмосферных условиях с применением в качестве катализатора никеля Ренея (3г). После поглощения водорода (2экв) катализатор отделяли фильтрованием и фильтрат выпаривали, получая 7г (85,2%) (-)-цис-4-амино-N-(1-(3-аминопропил)-3-метокси-4-дидеридинил5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида (промежуточный продукт 17). Пример 8 а) Промежуточный продукт 17 (0,769моля) растворяли в 1-бутаноле (2310мл) (требуется нагревание до 50°С). При 30°С добавляли (гетерогеннo) карбонат калия (1,538моля). Добавляли затем 2-хлор-4-метоксипиримидин (0,960моля) и реакционную смесь нагревали до температуры кипения (104°C). Реакционную смесь перемешивали и кипятили с обратным холодильником 11 часов. Смесь оставляли для охлаждения до 20°C и затем в нее добавляли воду (769мл) и смесь перемешивали 15 минут. Слои разделяли. Органический слой выпаривали (60°С при 1,66мм Нg), получая 458,9г (92,1%) (±)-цис-4-амино-5-хлор-2,3-дигидро-N-[3-метокcи-1-[3-[(4-метокcи-2пиримидинил)амино]ропил]-4-пиперидинил]-2,2-диметил-7-бензофуранкарбоксамида (промежуточный продукт 18). b) Соляную кислоту в 2-пропаноле (434мл) добавляли по каплям в течение 15 минут в раствор промежуточного продукта 18 (0,769моля) в 4-метил-2-пентаноне (3845мл), смесь перемешивали при 15 - 20°С (если было нужно, охлаждали ледяной баней). Реакционную смесь перемешивали 1 час при 15°C. Осадок отделяли фильтрованием, промывали 4-ме-тил-2пентанояом (769мл) и сушили (50°С, вакуум), получая 425,9г (93,6%) дигидрохлорида (±)-цис-4амино-5-хлор-2,3-дигидро-N-[3-метокси-1-[3-[(4-метокси-2-пиримидинил)амино]пропил]-4пиперидинил]-2,2-диметил-7-бензофуранкарбоксамида (промежуточный продукт 19). В. Получение конечных соединений Пример 9 Смесь промежуточного продукта 17 (0,017моля) и 2-метилтио-4-пиримидинона (0,022моля) в ацетонитриле (300мл) перемешивали и кипятили с обратным холодильником в течение 16 часов. Добавляли дополнительное количество 2-метилтио-4-пиримидинона (2г) и реакционную смесь перемешивали и кипятили с обратным холодильником 16 часов. Реакционную смесь охлаждали, растворитель выпаривали. Остаток очищали пропусканием через силикагель на стеклянном фильтре (элюент: CH2CI2/СН3ОН/(СН3ОН/NH3), 90:9:1). Чистые фракции собирали и растворитель выпаривали. Остаток растирали в 2,2'-оксибиспропане. Твердую часть отделяли фильтрованием и сушили (комнатная температура, вакуум), получая 2,65г (29,7%) (-)-цис-4-амино-5-хлор-2,3дигидро-N-[1-[3-[(3,4-дигидро-4-оксо-2-пиримидинил)амино]пропил]-3-метокси-4-пиперидинил]2,2-диметил-7-бензофуранкарбоксамида с т.пл. 164,3°С и [a]D20 = -17,54° (с = 1% в метаноле) (соединение 1). Аналогичным образом были получены: Таблица 1 Соед. № 1 2 3 4 5 6 7 8 9 10 11 R3 OCH3 OCH3 OCH3 OCH3 OCH3 OCH3 H H H H H R4 NH2 NH2 NH2 NH2 NH2 NH2 NH2 NH2 NH2 H H n 3 2 3 2 3 2 2 3 3 2 3 m 1 1 1 1 1 1 1 1 2 1 2 Физические данные цис; т.пл. 164,3°С: [a]D20 = -17,54° (с = 1% в метаноле) цис; т.пл. 179,9°С: [a]365 20 = -156,45° (с = 0,1% в СН3ОН)) цис; т.пл. 164,3°С: [a]D20 = 17,21° (с = 1% в СН3ОН) цис; [a]36520 = 158,53° (с = 0,1% в СН3 ОН) цис; 2,5Н2О/т.пл. 163,8°С цис; т.пл. 198,8°С т.пл. 204,4°С Н2О/т.пл. 165,8°С т.пл. 211,1°С т.пл. 126,9°С т.пл. 106,1°С Пример 10 Смесь 4,15г 2-хлор-4-гидроксихиназолина, 4,57г 4-амнно-N-[1-(3-аминопропил)-4пиперидинил]-5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида (описан в ЕР-0 445 862) и 0,80г оксида кальция перемешивали в течение 1 часа при 140°С. Реакционную смесь растворяли в смеси дихлорметана и метанола. Весь раствор промывали водой, сушили, фильтровали и выпаривали. Остаток очищали два раза колоночной хроматографией (силикагель; CH2Cl2/CH3OH(NH3), 90:10; CH2Cl2/CH3OH(NH3), 88:12). Элюент целевой фракции выпаривали и остаток кипятили в 2,2'-оксибиспропане. Продукт фильтровали и сушили, получая 3,2г (50,8%) 4амино-5-хлор-2,3-дигидро-N-[1-[3-[4-гидрокси-2-хиназолинил)амино]пропил]-4-пиперидинил]-2,2диметил-7-бензофуранкарбоксамида с т. пл. 159,6°С (соединение 12). Аналогичным образом получали: Таблица 2 Соед. № 12 13 14 15 16 17 18 19 20 R3 H H H OCH3 OCH3 OCH3 OCH3 H H R4 NH2 NH2 NH2 NH2 -NH-CO-CH3 H H H H n 3 4 2 3 3 3 2 2 3 Физические данные т. пл. 159,6°С т. пл. 152,3°С т. пл. 160°С (разложение) цис/1/2Н2О/т. пл. 185,6°С цис; Н2О/т. пл. 181,2°С цис; т. пл. 140,5°С цнс; т. пл. 150,0°С т. пл. 238,1°С т. пл. 131,1°C Пример 11 Смесь 2,6г 2,6-дихлор-4-хиназолинола (описан в J. Med. Chem., 1968, p. 130), 3,7г 4-амино-N[1-(2-аминоэтил)-4-пиперидинил]-5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида (описан в ЕР-0 445 862), 0,8г оксида кальция и 3,64г N,N-диметилацетамида перемешивали 3 часа при 140°С. После охлаждения реакционную смесь выпаривали и остаток растворяли в смеси дихлорметана и метанола. Целый продукт промывали водой. Частично осажденный продукт отделяли фильтрованием (первая фракция). Органический слой декантировали, сушили, фильтровали и выпаривали (вторая фракция). Объединенную фракцию очищали два раза колоночной хроматографией (силикагель: CН2Cl2/CH3OH(NH3), 95:5; CH 2Cl2/CH3OH, 92:8). Элюент целевой фракции выпаривали и остаток кристаллизовали из ацетонитрила. Продукт фильтровали при 0°С и сушили в вакууме при 60°С, получая 1г (18,3%) 4-амино-5-хлор-N-[1-[2-[(6хлор-4-гидрокси-2-хиназолинил)амино]этил]-4-пиперидинил]-2,3-дигидро-2,2-диметил-7бензофуранкарбоксамида с т. пл. 206,6°С (соединение 21). Аналогичным образом были получены: Таблица 3 Соед. № 21 22 23 24 R1, R2 -СН=СН-С(Сl)=СН-СН=С(Сl)-СН=СН-СН=С(Сl)-СН=СН-СН=СН-С(Сl)=СН R3 H H OCH3 OCH3 n 2 2 3 3 Физические данные т. пл. 206,6°C т. пл. 242,4°С т. пл. 215,5°С; цис 1/2 Н2О/т. пл. 237,9°С; цис; Пример 12 Воду (2880мл) добавляли в промежуточный продукт 19 (0,72моля) для полного растворения его. Затем до каплям добавляли соляную кислоту (193мл). Реакционную смесь нагревали до температуры кипения (95°С) и затем перемешивали и кипятили с обратным холодильником 24 часа. При кипячении добавляли дополнительно соляную кислоту (128,6мл). Реакционную смесь перемешивали и кипятили с обратным холодильником 2,5 часа. Нагревание прекращали и добавляли дихлорметан (360мл). Слои разделяли и в водную фазу добавляли дихлорметан (1060мл). Двухфазную смесь подщелачивали при 20 - 250 добавлением гидроксида аммония (433мл) до pH выше 10 в течение периода 30 минут, причем требовалось наружное охлаждение. Смесь сначала представляла собой гомогенную систему, затем при рН 6 - 7 образовался осадок, который растворялся при более высоких значениях pH. Слои разделяли. Водный слой экстрагировали дихлорметаном (360мл). Органические экстракты объединяли, сушили и выпаривали (40°С, вакуум). Остаток сушили (40°С, вакуум), получая 321,2г (88,3%) (-)-цис-4амино-5-хлор-N-[1-[3-[3,4-дигидро-4-оксо-2-пиримидинил)амино]пропил]-3-метокси-4пиперидинил]-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксамида (соединение 1). С. Фармакологический пример Пример 13 Определение по методике von Begold-Jarish Самопроизвольно гипертензивные самцы крыс (±6 месяцев) анестезировали ингаляцией эфиром и бедренную вену и артерию рассекали и каннюлировали полиэтиленовым катетером. Для индуцирования местной анестезии в рану вокруг каннюлей вводили лидокаин (20%). Животных помещали в клетки Bollman и артериальный катетер соединяли с датчиком тензиометрического измерения кровяного давления и анализировали систолическое давление. Когда животные полностью просыпались, им вводили инъекцией контрольный серотонин (0,04мг/кг) через катетер бедренной вены. Ответная реакция систолического кровяного давления на внутривенную инъекцию серотонина обычно развивается в три фазы: 1) короткое и острое понижение (рефлекс von Begold-Jarish), 2) повышение, и 3) долго длящееся повышение систолического кровяного давления. Ингибирование первого острого, понижения кровяного давления (рефлекс von Begold-Jarish) рассматривается как критерий 5-НТ3-антагонизма. Через некоторое время после контрольной инъекции серотонина внутрибрюшинной инъекцией вводили испытываемое соединение. Через 30 минут серотонин инъецировали снова внутривенно и регистрировали наличие или отсутствие первого короткого и острого понижения давления. Ту же процедуру повторяли через 60 минут. Соединения испытывали при различных дозах. Наименьшую активную доз у (L AD), которая приведена в таблице 4, можно определить как дозу (в мг/кг массы тела), при которой, по меньшей мере, половина испытываемых животных проявляет ингибирование рефлекса von Begold-Jarish. Соединение № 5 7 9 12 14 19 21 11 8 24 23 16 17 6 10 1 2 Таблица 4 (мг/кг) 0,04 0,04 0,16 0,16 0,01 0,01 0,16 0,16 0,04 0,16 0,16 0,16 0,04 0,01 0,01 0,04 0,04 D. Примеры препаратов Примерами типичных фармацевтических препаратов в дозах на один прием, пригодных для системного или местного введения теплокровным животным в соответствии с настоящим изобретением, служат следующие составы. Термин "Активный компонент" (А.1.), применяемый во всех этих примерах, относится к соединению формулы (I), его фармацевтически пригодной соли с кислотой или стереохимическому изомеру. Пример 14 Пероральные растворы 9г Метил-4-гидроксибензоата и 1г пропил-4-гидроксибензоата растворяют в 4л кипящей очищенной воды. В 3л этого раствора растворяют сначала 10г 2,3-дигидроксибутандиовой кислоты и затем 20г А.1. Последний раствор объединяют с остальной частью первого раствора и в объединенную часть добавляют 12л 1,2,3-пропантриола и 3л 70%-ного раствора сорбита. В 0,5л воды растворяют 40г натриевой соли сахарина и добавляют 2мл малиновой и 2мл крыжовниковой эссенции. Последний раствор объединяют с первым, добавляют сколько требуется воды для достижения общего объема 20л, получая пероральный раствор, содержащий 5мг А.1. в одной чайной ложке (5мл). Полученный раствор помещают в подходящие емкости. Пример 15 Капсулы Смесь 20г А.1., 6г лаурилсульфа та натрия, 56г крахмала, 56г лактозы, 0,8г коллоидного диоксида кремния и 1,2г стеарината магния энергично перемешивают. Полученной смесью затем наполняют 1000 подходящих отвержденных желатиновых капсул, каждая полученная капсула содержит 20мг А.1. Пример 16 Таблетки с оболочкой Приготовление сердцевины таблеток. Смесь 100г A.1., 570г лактозы и 200г крахмала хорошо смешивают и затем увлажняют раствором 5г додецилсульфата натрия и 10г поливинилпирролидона в около 200мл воды. Влажную порошкообразную смесь просеивают, сушат и просеивают снова. Затем добавляют 100г микрокристаллической целлюлозы и 15г гидрогенизированного растительного масла. Всю массу хорошо перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая из которых содержит 10мг активного компонента. Покрытие оболочкой В раствор 10г метилцеллюлозы в 75мл денатурированного этилового спирта добавляют раствор 5г этилцеллюлозы в 150мл дихлорметана. Затем добавляют 75мл дихлорметана и 2,5мл 1,2,3-пропантриола. Расплавляют 10г полиэтиленгликоля и добавляют в 75мл дихлорметана. Последний раствор добавляют в первый и затем добавляют 2,5г октадеканоата магния, 5г поливинилдирролидона и 30мл концентрированной суспензии красящего средства и всю массу гомогенизируют. Сердцевины таблеток покрывают полученной таким образом смесью в устройстве для образования оболочек.
ДивитисяДодаткова інформація
Назва патенту англійськоюDimethylbenzofurans and dimethylbenzopyrans as 5-нт3 antagonists, methods of their synthesis, pharmaceutical formulation
Автори англійськоюBosmans Jean-Paul Rene Marie Andre
Назва патенту російськоюДиметилбензофураны и диметилбензопираны как 5-нт3-антагонисты, способы их получения, фармацевтическая композиция
Автори російськоюБосманс Жан-Поль Рене Мари Андре
МПК / Мітки
МПК: A61P 1/08, C07D 211/58, A61P 25/24, A61P 25/04, C07D 405/14, A61P 25/30, A61P 25/18, A61K 31/505, A61P 43/00, A61K 31/506, C07D 401/12, A61P 25/26
Мітки: 5-нт3-антагоністи, одержання, композиція, способи, фармацевтична, диметилбензофурани, диметилбензопірани
Код посилання
<a href="https://ua.patents.su/14-49792-dimetilbenzofurani-ta-dimetilbenzopirani-yak-5-nt3-antagonisti-sposobi-kh-oderzhannya-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Диметилбензофурани та диметилбензопірани як 5-нт3-антагоністи, способи їх одержання, фармацевтична композиція</a>
Попередній патент: Спосіб визначення дефіциту вологості деревини інтактних рослин
Наступний патент: Спосіб одержання n-гідроксіалкіламінометилфосфонової кислоти (варіанти) та n-фосфонометилгліцину і їх солей
Випадковий патент: Пристрій для сочетаної вакуум-лазерної терапії












