Трициклічні d3-піперидини, композиція на їх основі та спосіб їх одержання (варіанти)
Номер патенту: 70961
Опубліковано: 15.11.2004
Автори: Мертенс Жозефус Каролус, Брекен Міреї, Кенніс Людо Едмон Жозефін
Формула / Реферат
1. Трициклічні 3-піперидини формули
(І)
і їх N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де:
Alk являє собою С1-6алкандіїл;
n являє собою 1 або 2;
Х являє собою -О-, -S-, -S(=O)- або -S(=O)2-;
кожний R1 незалежно являє собою водень, галоген, C1-6алкіл, нітро, гідрокси або C1-4алкілокси;
D являє собою радикал формули
,
де кожний m незалежно являє собою 0, 1 або 2;
кожний Y незалежно являє собою –СН2-, -О-, -S- або -NR3-;
R2 та R3 кожний незалежно являє собою водень або С1-6алкіл та
кожний R4 незалежно являє собою галоген або С1-6алкіл.
2. Сполука за пунктом 1, де D являє собою радикал формули (a), (b), (c), (d),
(е), (f) або (g), де m являє собою 0; кожний Y незалежно являє собою –СН2-, -О-, -S- або -NR3- та R2 і R3 кожний незалежно являє собою водень або С1-6алкіл.
3. Сполука за будь-яким з пунктів 1 або 2, де n являє собою 1 та R1 являє собою водень, хлор, фтор, метил, метокси або нітро.
4. Сполука за будь-яким з пунктів 1 - 3, де Х являє собою -О- або -S-.
5. Сполука за будь-яким з пунктів 1 - 4, де Alk являє собою метилен, 1,2-етандіїл, 1,3-пропандіїл, 1,4-бутандіїл або 1,5-пентандіїл.
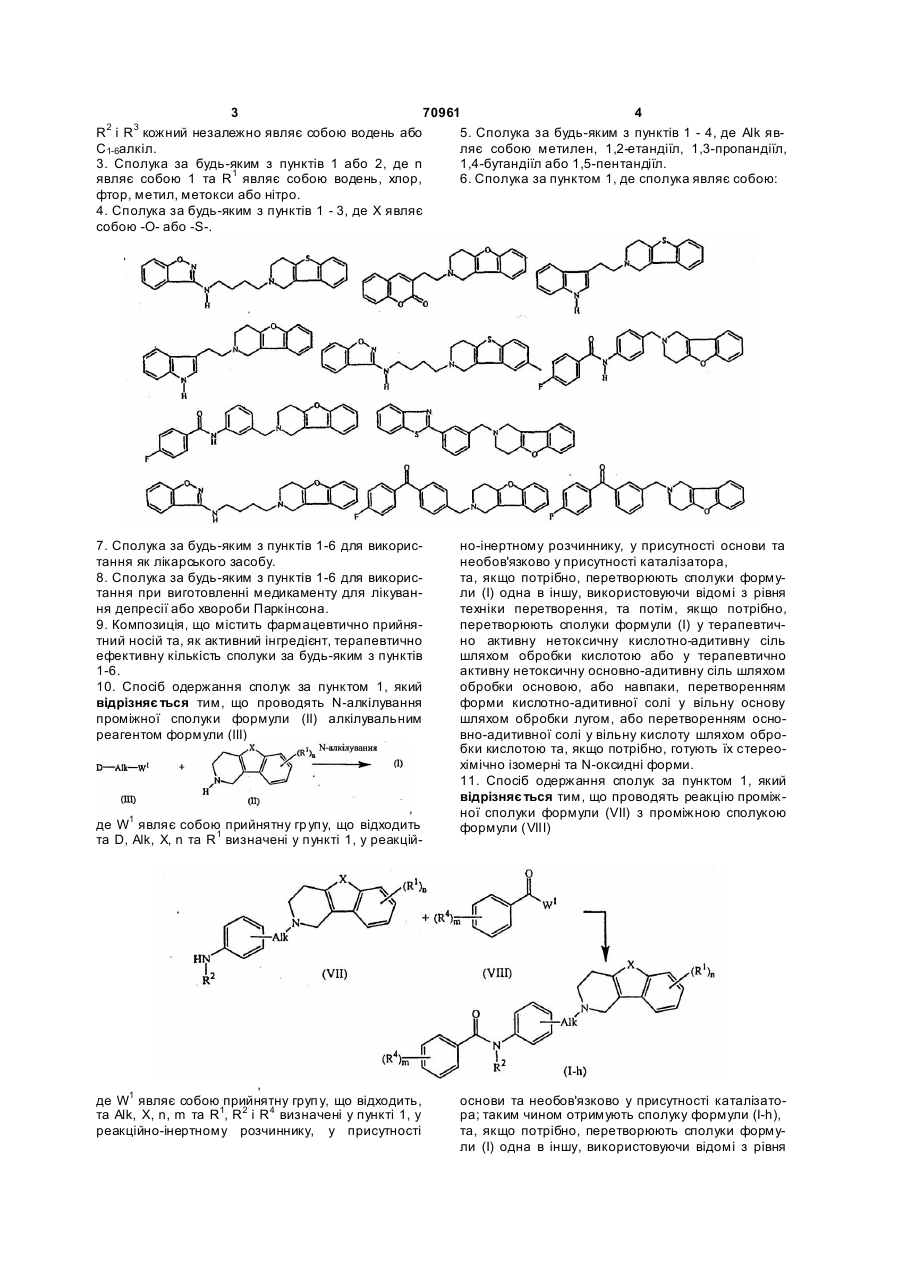
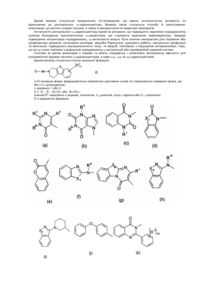
6. Сполука за пунктом 1, де сполука являє собою:
.
7. Сполука за будь-яким з пунктів 1-6 для використання як лікарського засобу.
8. Сполука за будь-яким з пунктів 1-6 для використання при виготовленні медикаменту для лікування депресії або хвороби Паркінсона.
9. Композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пунктів 1-6.
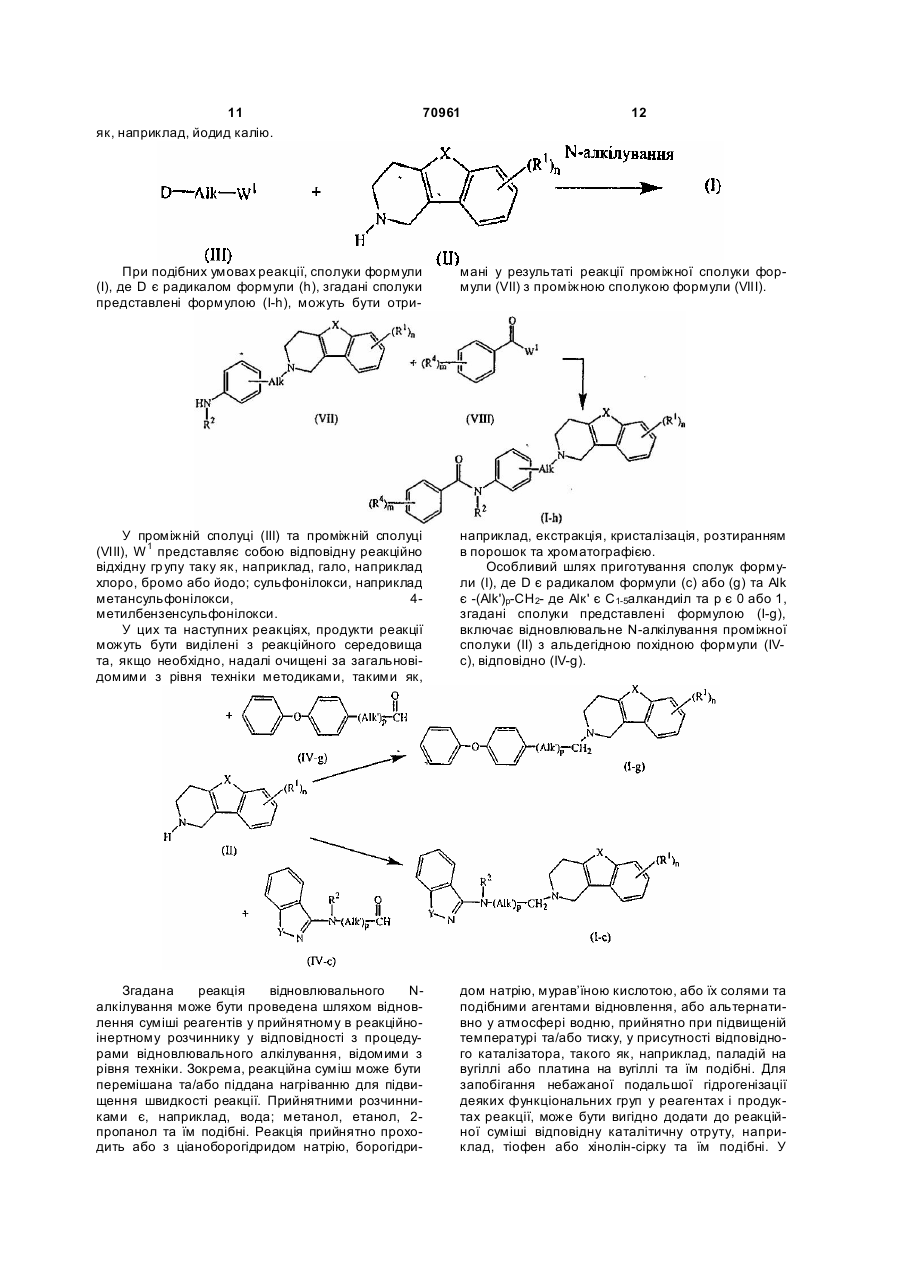
10. Спосіб одержання сполук за пунктом 1, який відрізняється тим, що проводять N-алкілування проміжної сполуки формули (II) алкілувальним реагентом формули (III)
,
де W1 являє собою прийнятну групу, що відходить та D, Alk, X, n та R1 визначені у пункті 1, у реакційно-інертному розчиннику, у присутності основи та необов'язково у присутності каталізатора,
та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня техніки перетворення, та потім, якщо потрібно, перетворюють сполуки формули (І) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або у терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, перетворенням форми кислотно-адитивної солі у вільну основу шляхом обробки лугом, або перетворенням основно-адитивної солі у вільну кислоту шляхом обробки кислотою та, якщо потрібно, готують їх стереохімічно ізомерні та N-оксидні форми.
11. Спосіб одержання сполук за пунктом 1, який відрізняється тим, що проводять реакцію проміжної сполуки формули (VII) з проміжною сполукою формули (VIII)
,
де W1 являє собою прийнятну групу, що відходить, та Alk, X, n, m та R1, R2 і R4 визначені у пункті 1, у реакційно-інертному розчиннику, у присутності основи та необов'язково у присутності каталізатора; таким чином отримують сполуку формули (I-h),
та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня техніки перетворення, та потім, якщо потрібно, перетворюють сполуки формули (І) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або у терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, перетворенням форми кислотно-адитивної солі у вільну основу шляхом обробки лугом, або перетворенням основно-адитивної солі у вільну кислоту шляхом обробки кислотою та, якщо потрібно, готують їх стереохімічно ізомерні та N-оксидні форми.
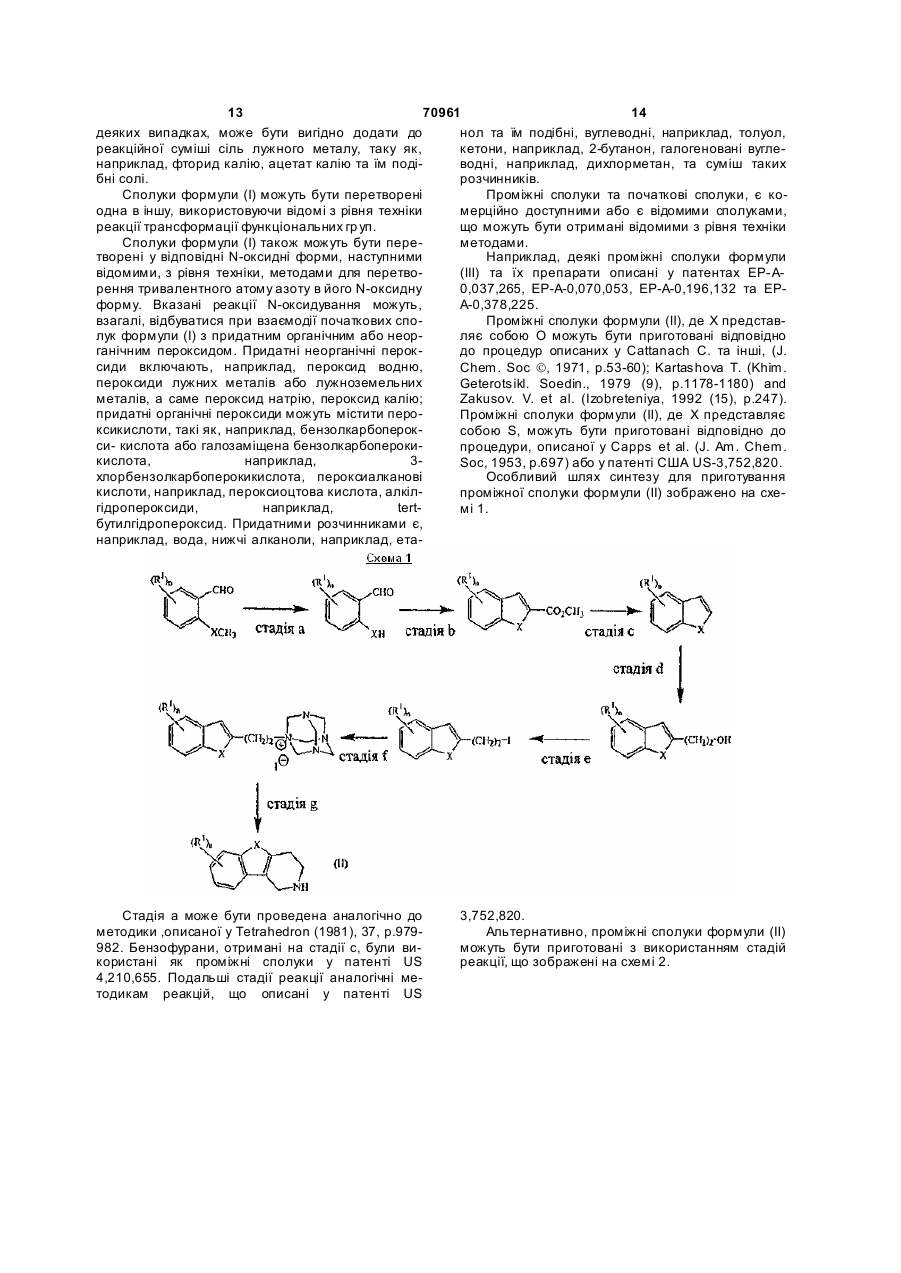
12. Спосіб одержання сполук за пунктом 1, який відрізняється тим, що проводять відновлювальне N-алкілування проміжної сполуки (II) з альдегідними похідними формули (IV-c) або (IV-g)
,
де Alk' - С1-6алкандіїл та р є 0 або 1 та X, Y, n та R1 визначені у пункті 1, шляхом відновлення суміші реагентів у прийнятному реакційно-інертному розчиннику у відповідності з процедурами відновлювального алкілування, відомими з рівня техніки, таким чином отримують сполуку формули (І-c) або (I-g),
та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня техніки перетворення, та потім, якщо потрібно, перетворюють сполуки формули (І) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або у терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, перетворенням форми кислотно-адитивної солі у вільну основу шляхом обробки лугом, або перетворенням основно-адитивної солі у вільну кислоту шляхом обробки кислотою та, якщо потрібно, готують їх стереохімічно ізомерні та N-оксидні форми.
Текст
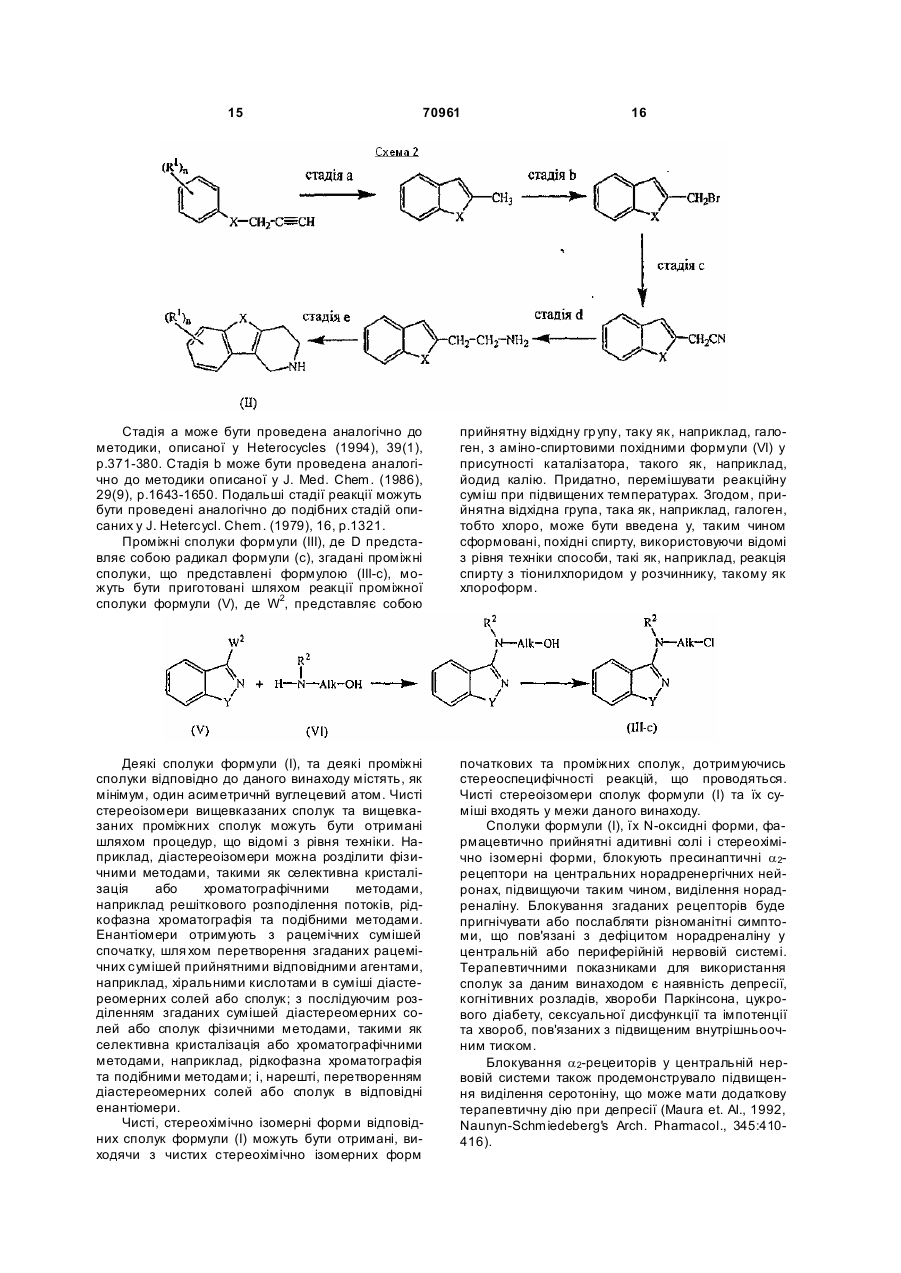
1. Трициклічні D 3-піперидини формули 2 де кожний m незалежно являє собою 0, 1 або 2; кожний Y незалежно являє собою –СН2-, -О-, -Sабо -NR3-; R2 та R3 кожний незалежно являє собою водень або С1-6алкіл та , кожний R4 незалежно являє собою галоген або С 16алкіл. 2. Сполука за пунктом 1, де D являє собою радикал формули (a), (b), (c), (d), (е), (f) або (g), де m являє собою 0; кожний Y незалежно являє собою –СН2-, -О-, -S- або -NR3- та 3 70961 4 R2 і R3 кожний незалежно являє собою водень або 5. Сполука за будь-яким з пунктів 1 - 4, де Alk явС1-6алкіл. ляє собою метилен, 1,2-етандіїл, 1,3-пропандіїл, 3. Сполука за будь-яким з пунктів 1 або 2, де n 1,4-бутандіїл або 1,5-пентандіїл. являє собою 1 та R1 являє собою водень, хлор, 6. Сполука за пунктом 1, де сполука являє собою: фтор, метил, метокси або нітро. 4. Сполука за будь-яким з пунктів 1 - 3, де Х являє собою -О- або -S-. 7. Сполука за будь-яким з пунктів 1-6 для використання як лікарського засобу. 8. Сполука за будь-яким з пунктів 1-6 для використання при виготовленні медикаменту для лікування депресії або хвороби Паркінсона. 9. Композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пунктів 1-6. 10. Спосіб одержання сполук за пунктом 1, який відрізняє ться тим, що проводять N-алкілування проміжної сполуки формули (II) алкілувальним реагентом формули (III) , де W1 являє собою прийнятну гр упу, що відходить та D, Alk, X, n та R1 визначені у пункті 1, у реакцій , де W1 являє собою прийнятну груп у, що відходить, та Alk, X, n, m та R1, R2 і R4 визначені у пункті 1, у реакційно-інертному розчиннику, у присутності но-інертному розчиннику, у присутності основи та необов'язково у присутності каталізатора, та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня техніки перетворення, та потім, якщо потрібно, перетворюють сполуки формули (І) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або у терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, перетворенням форми кислотно-адитивної солі у вільну основу шляхом обробки лугом, або перетворенням основно-адитивної солі у вільну кислоту шляхом обробки кислотою та, якщо потрібно, готують їх стереохімічно ізомерні та N-оксидні форми. 11. Спосіб одержання сполук за пунктом 1, який відрізняє ться тим, що проводять реакцію проміжної сполуки формули (VII) з проміжною сполукою формули (VIII) основи та необов'язково у присутності каталізатора; таким чином отримують сполуку формули (I-h), та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня 5 70961 6 техніки перетворення, та потім, якщо потрібно, вно-адитивної солі у вільну кислоту шляхом оброперетворюють сполуки формули (І) у терапевтичбки кислотою та, якщо потрібно, готують їх стереоно активну нетоксичну кислотно-адитивну сіль хімічно ізомерні та N-оксидні форми. шляхом обробки кислотою або у терапевтично 12. Спосіб одержання сполук за пунктом 1, який активну нетоксичну основно-адитивну сіль шляхом відрізняє ться тим, що проводять відновлювальне обробки основою, або навпаки, перетворенням N-алкілування проміжної сполуки (II) з альдегідниформи кислотно-адитивної солі у вільну основу ми похідними формули (IV-c) або (IV-g) шляхом обробки лугом, або перетворенням осно , де Alk' - С1-6алкандіїл та р є 0 або 1 та X, Y, n та R 1 визначені у пункті 1, шляхом відновлення суміші реагентів у прийнятному реакційно-інертному розчиннику у відповідності з процедурами відновлювального алкілування, відомими з рівня техніки, таким чином отримують сполуку формули (І-c) або (I-g), та, якщо потрібно, перетворюють сполуки формули (І) одна в іншу, використовуючи відомі з рівня техніки перетворення, та потім, якщо потрібно, перетворюють сполуки формули (І) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або у терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, перетворенням форми кислотно-адитивної солі у вільну основу шляхом обробки лугом, або перетворенням основно-адитивної солі у вільну кислоту шляхом обробки кислотою та, якщо потрібно, готують їх стереохімічно ізомерні та N-оксидні форми. Даний винахід відноситься до трициклічних D3піперидинів, що мають антагоністичну активність по відношенню до центрального a 2адреноцептору. Винахід також відноситься до способу їх приготування, до композицій, що вміщують згадані сполуки, а також до їх використання як медичних препаратів. Антагоністи центрального a 2-адреноцептору відомі якречовини, що підвищують виділення норадреналіну, шляхом блокування пресинаптичних a 2-рецепторів, що проявляють інгібуючий контроль над виділенням нейромедіатору. Завдяки підвищенню концентрації норадреналіну, a 2-антагоністи можуть бути клінічно використані для лікування або профілактики депресій, когнітивних розладів, хвороби Паркінсона, цукрового діабету, сексуальної дисфункції та імпотенції, підвищеного внутрішньоочного тиску, та хвороб, пов'язаних з порушеною ентерокінезією, тому, що всі ці стани, пов'язані з дефіцитом норадреналіну у центральній або периферійній нервовій системі. Сполуки за даним винаходом є новими та мають специфічну і селективну зв'язуючу а фінність для різноманітних відомих підтипів a 2адреноцепторів, а саме a 2А, a 2В та a 2Садреноцепторів. Даний винахід стосується сполук загальної формули їх N-оксидних форм, фармацевтично прийнятних адитивних солей та стереохімічно ізомерних форм, де: Alk представляє собою С 1-6алкандиіл; n представляє собою 1 або 2; X представляє собою -О-, -S-, -S(=O)- або S(=O)2-; кожний R1 незалежно представляє собою водень, галоген, С1-6алкіл, нітро, гідрокси або С1-4алкілокси; D представляє собою радикал формули 7 70961 де кожний m незалежно представляє собою 0, 1 або 2; кожний Υ незалежно представляє собою -СН2-, -О-, -S- або -NR3-; R2 та R3 кожний незалежно представляє собою водень або С1-6алкіл; та кожний R4 незалежно представляє собою гало або С1-6алкіл. Використаний в попередніх визначеннях термін "галоген" є загальним для фторо, хлоро, бромо та йодо. Термін "С1-4алкіл" означає прямі та розгалужені насичені вуглеводні, що мають від 1 до 4 атомів вуглецю такі як, наприклад, метил, етил, пропіл, бутил, 1-метилетил, 1,1-диметилетил, 2метилпропіл та їм подібні. Термін "С1-6алкіл" вказує на наявність радикалів С 1-4алкілу і їх вищих гомологів, що мають 5 або 6 атомів вуглецю таких як, наприклад, пентил, гексил та їм подібні. Термін "С1-5алкандиіл" означає бівалентні радикали алкандиілу, прямого чи розгалуженого ланцюгу, що містять від 1 до 5 атомів вуглецю таких як, наприклад, метилен, 1,2-етандиіл, 1,3-пропандиіл, 1,4бутандиіл, 1,5-пентандиіл та їм подібні. "С16алкандиіл" вказує на наявність С 1-5алкандиілу та їх ви щих гомологів, що мають 6 атомів вуглецю таких як, наприклад, 1,6-гександиіл та т.п. Адитивні солі, згадані вище, як передбачається, включають терапевтично активні форми адитивних солей, що можуть утворити сполуки формули (І) з відповідними кислотами такими як, наприклад, неорганічні кислоти, такі як галогено 8 водневі кислоти, наприклад хлороводнева або бромоводнева кислоти; сірчана кислота; азотна кислота; фосфорна та їм подібні кислоти; або органічні кислоти, наприклад, оцтова кислота, пропанова кислота, гідроксиоцтова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, ртолуенсульфонова кислота, цикламова кислота, саліцилова кислота, р-аміносаліцилова кислота, памова кислота та їм подібні кислоти. Згадані вище фармацевтично прийнятні адитивні солі, як передбачається, включають терапевтично активні нетоксичні основи, а саме, форми адитивних солей з металом або аміном, що можуть утворити сполуки формули (І). Згадані солі можуть бути прийнятно отримані обробкою сполук формули (І), що містять атоми кислотного водню, прийнятними органічними та неорганічними основами такими як, наприклад, солі амонію, солі лужно- та лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію та їм подібні, солі з органічними основами, наприклад, солі бензатину, N-метил-D-глюкаміну, гідрабаміну, і солі з аміно кислотами типу, наприклад, аргініну, лізину та їм подібними. Навпаки, вказані форми солей можуть бути перетворені у форму вільної кислоти чи основи обробкою прийнятною кислотою чи основою. 9 70961 10 Термін "адитивна сіль", що використовується вище, також включає сольвати, що можуть утворювати сполуки формули (І), та згадані сольвати, як передбачається, включені у межи даного винаходу. Прикладами таких сольватів є, наприклад, гідрати, алкоголяти та їм подібні. Цікавою групою сполук є ті сполуки формули N-оксидні форми сполук формули (І), як пе(І), де n є 1 та R1 представляє собою водень, хлоредбачається, включають ті сполуки формули (І), ро, фторо, метил, метокси або нітро, особливо R1 де один або декілька атомів азоту окисленні до, представляє собою водень, хлоро, метил та метотак званих, N-оксида. кси. Такожцікавими є сполуки формули (І), де n є Термін "стереохімічно ізомерні форми", що тут 2 та обидва R1 представляють собою метокси. використовується, визначає всі можливі ізомерні У випадку, коли R1 є іншим ніж водень, тоді R1 форми, які можуть мати сполуки формули (І). Якприйнятно приєднаний до трициклічної кільцевої що не згадано або не вказано інше, хімічне познасистеми у 6- або 7- положенні. чення сполуки означає суміш усіх можливих стеІншою цікавою групою сполук є ті сполуки фореохімічно ізомерних форм, вказані суміші, містять рмули (І), де Alk представляє собою метилен, 1,2усі діастереомери та енантіомери основної молеетандиіл, 1,3-пропандиіл, 1,4-бутандиіл або 1,5кулярної структури. пентандиіл, особливо метилен, 1,2-етандиіл, 1,3Деякі з сполук формули (І) можуть також існупропандиіл, 1,4-бутандиіл, зокрема 1,2-етандиіл. вати в їх та утомерних формах. Такі форми, хоча Крім того, цікавою групою сполук є ті сполуки не явно зазначені у вищезгаданій формулі, також формули (І), де D представляє собою радикал належать до об'єму патентних домагань даного формули (a), (b), (c), (e), (f), (g), (h), (і) або (j), більш винаходу. особливо, (а), (с), (j), (h), (і) або (j). Щораз, при використанні нижче, термін "споСполуки формули (І), де D є іншим ніж (а) та луки формули (І)" включає також N-оксидні форми, іншим ніж (b) є, також, особливо цікавими. фармацевтично прийнятні адитивні солі та всі стеОсобливими сполуками є ті сполуки формули реоізомерні форми. (І), де X представляє собою -О- або -S-, більш Прийнятно, D представляє собою радикал особливо, -О-. формули (a), (b), (c), (d), (e), (f) або (g) де m предІншими особливими сполуками є ті сполуки ставляє собою 0; кожний Υ незалежно представформули (І), де Υ представляє собою -О- або -S-. 3 2 3 ляє собою -СН2-, -О-, -S- або -NR - ; та R та R Бажаними сполуками є ті сполуки формули (І), кожний незалежно представляє собою водень або де n є 1, R1 представляє собою водень, хлоро, С1-6алкіл. метил або метокси, та X представляє собою -ОПри використанні нижче, при посиланні на поабо -S-. 1 ложення замісника R , використовується наступна Найбільш переважними є сполуки, зображені нумерація: нижче ,або їх N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічні ізомерні форми: Сполуки формули (І), взагалі, можуть приготовлятися N-алкілуванням проміжної сполуки формули (II) з алкілувальним реагентом формули (III) відповідно до процедури, описаної в патентах ЕРА-0,037,265, ЕР-А-0,070,053, ЕР-А-0,196,132 та в ЕР-А-0,378,255. Зокрема N-алкілування може бути проведене в реакційно-інертному розчиннику, такому, як, наприклад, метилізобутилкетон, Ν,Νдиметилформамід або Ν,Ν-диметилацетамід у присутності основи, такої як, наприклад, триетиламін, карбонат натрію або бікарбонат натрію, та необов'язково у присутності каталізатору, такого 11 як, наприклад, йодид калію. 70961 12 При подібних умовах реакції, сполуки формули (І), де D є радикалом формули (h), згадані сполуки представлені формулою (I-h), можуть бути отри мані у результаті реакції проміжної сполуки формули (VII) з проміжною сполукою формули (VIII). У проміжній сполуці (III) та проміжній сполуці (VIII), W 1 представляє собою відповідну реакційно відхідну гр упу таку як, наприклад, гало, наприклад хлоро, бромо або йодо; сульфонілокси, наприклад метансульфонілокси, 4метилбензенсульфонілокси. У цих та наступних реакціях, продукти реакції можуть бути виділені з реакційного середовища та, якщо необхідно, надалі очищені за загальновідомими з рівня техніки методиками, такими як, наприклад, екстракція, кристалізація, розтиранням в порошок та хроматографією. Особливий шлях приготування сполук формули (І), де D є радикалом формули (с) або (g) та Alk є -(Alk')p-CH2- де Аlк' є С1-5алкандиіл та p є 0 або 1, згадані сполуки представлені формулою (I-g), включає відновлювальне N-алкілування проміжної сполуки (II) з альдегідною похідною формули (IVc), відповідно (IV-g). Згадана реакція відновлювального Nалкілування може бути проведена шляхом відновлення суміші реагентів у прийнятному в реакційноінертному розчиннику у відповідності з процедурами відновлювального алкілування, відомими з рівня техніки. Зокрема, реакційна суміш може бути перемішана та/або піддана нагріванню для підвищення швидкості реакції. Прийнятними розчинниками є, наприклад, вода; метанол, етанол, 2пропанол та їм подібні. Реакція прийнятно проходить або з ціаноборогідридом натрію, борогідри дом натрію, мурав’їною кислотою, або їх солями та подібними агентами відновлення, або альтернативно у атмосфері водню, прийнятно при підвищеній температурі та/або тиску, у присутності відповідного каталізатора, такого як, наприклад, паладій на вугіллі або платина на вугіллі та їм подібні. Для запобігання небажаної подальшої гідрогенізації деяких функціональних груп у реагентах і продуктах реакції, може бути вигідно додати до реакційної суміші відповідну каталітичну отруту, наприклад, тіофен або хінолін-сірку та їм подібні. У 13 70961 14 деяких випадках, може бути вигідно додати до нол та їм подібні, вуглеводні, наприклад, толуол, реакційної суміші сіль лужного металу, таку як, кетони, наприклад, 2-бутанон, галогеновані вугленаприклад, фторид калію, ацетат калію та їм подіводні, наприклад, дихлорметан, та суміш таких бні солі. розчинників. Сполуки формули (І) можуть бути перетворені Проміжні сполуки та початкові сполуки, є коодна в іншу, використовуючи відомі з рівня техніки мерційно доступними або є відомими сполуками, реакції трансформації функціональних гр уп. що можуть бути отримані відомими з рівня техніки Сполуки формули (І) також можуть бути переметодами. творені у відповідні N-оксидні форми, наступними Наприклад, деякі проміжні сполуки формули відомими, з рівня техніки, методами для перетво(III) та їх препарати описані у патентах ЕР-Арення тривалентного атому азоту в його N-оксидну 0,037,265, ЕР-А-0,070,053, ЕР-А-0,196,132 та ЕРформу. Вказані реакції N-оксидування можуть, А-0,378,225. взагалі, відбуватися при взаємодії початкових споПроміжні сполуки формули (II), де X представлук формули (І) з придатним органічним або неорляє собою О можуть бути приготовані відповідно ганічним пероксидом. Придатні неорганічні перокдо процедур описаних у Cattanach С. та інші, (J. сиди включають, наприклад, пероксид водню, Chem. Soc Ó, 1971, р.53-60); Kartashova Τ. (Khim. пероксиди лужних металів або лужноземельних Geterotsikl. Soedin., 1979 (9), р.1178-1180) and металів, а саме пероксид натрію, пероксид калію; Zakusov. V. et al. (Izobreteniya, 1992 (15), р.247). придатні органічні пероксиди можуть містити пероПроміжні сполуки формули (II), де X представляє ксикислоти, такі як, наприклад, бензолкарбопероксобою S, можуть бути приготовані відповідно до си- кислота або галозаміщена бензолкарбоперокипроцедури, описаної у Capps et al. (J. Am. Chem. кислота, наприклад, 3Soc, 1953, p.697) або у патенті США US-3,752,820. хлорбензолкарбоперокикислота, пероксиалканові Особливий шлях синтезу для приготування кислоти, наприклад, пероксиоцтова кислота, алкілпроміжної сполуки формули (II) зображено на схегідропероксиди, наприклад, tertмі 1. бутилгідропероксид. Придатними розчинниками є, наприклад, вода, нижчі алканоли, наприклад, ета Стадія а може бути проведена аналогічно до методики ,описаної у Tetrahedron (1981), 37, р.979982. Бензофурани, отримані на стадії с, були використані як проміжні сполуки у патенті US 4,210,655. Подальші стадії реакції аналогічні методикам реакцій, що описані у патенті US 3,752,820. Альтернативно, проміжні сполуки формули (II) можуть бути приготовані з використанням стадій реакції, що зображені на схемі 2. 15 70961 16 Стадія а може бути проведена аналогічно до методики, описаної у Heterocycles (1994), 39(1), p.371-380. Стадія b може бути проведена аналогічно до методики описаної у J. Med. Chem. (1986), 29(9), p.1643-1650. Подальші стадії реакції можуть бути проведені аналогічно до подібних стадій описаних у J. Hetercycl. Chem. (1979), 16, p.1321. Проміжні сполуки формули (III), де D представляє собою радикал формули (с), згадані проміжні сполуки, що представлені формулою (ІІІ-с), можуть бути приготовані шляхом реакції проміжної сполуки формули (V), де W2, представляє собою прийнятну відхідну гр упу, таку як, наприклад, галоген, з аміно-спиртовими похідними формули (VI) у присутності каталізатора, такого як, наприклад, йодид калію. Придатно, перемішувати реакційну суміш при підвищених температурах. Згодом, прийнятна відхідна група, така як, наприклад, галоген, тобто хлоро, може бути введена у, таким чином сформовані, похідні спирту, використовуючи відомі з рівня техніки способи, такі як, наприклад, реакція спирту з тіонилхлоридом у розчиннику, такому як хлороформ. Деякі сполуки формули (І), та деякі проміжні сполуки відповідно до даного винаходу містять, як мінімум, один асиметричнй вуглецевий атом. Чисті стереоізомери вищевказаних сполук та вищевказаних проміжних сполук можуть бути отримані шляхом процедур, що відомі з рівня техніки. Наприклад, діастереоізомери можна розділити фізичними методами, такими як селективна кристалізація або хроматографічними методами, наприклад решіткового розподілення потоків, рідкофазна хроматографія та подібними методами. Енантіомери отримують з рацемічних сумішей спочатку, шля хом перетворення згаданих рацемічних сумішей прийнятними відповідними агентами, наприклад, хіральними кислотами в суміші діастереомерних солей або сполук; з послідуючим розділенням згаданих сумішей діастереомерних солей або сполук фізичними методами, такими як селективна кристалізація або хроматографічними методами, наприклад, рідкофазна хроматографія та подібними методами; і, нарешті, перетворенням діастереомерних солей або сполук в відповідні енантіомери. Чисті, стереохімічно ізомерні форми відповідних сполук формули (І) можуть бути отримані, виходячи з чистих стереохімічно ізомерних форм початкових та проміжних сполук, дотримуючись стереоспецифічності реакцій, що проводяться. Чисті стереоізомери сполук формули (І) та їх суміші входять у межи даного винаходу. Сполуки формули (І), їх N-оксидні форми, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, блокують пресинаптичні a 2рецептори на центральних норадренергічних нейронах, підвищуючи таким чином, виділення норадреналіну. Блокування згаданих рецепторів буде пригнічувати або послабляти різноманітні симптоми, що пов'язані з дефіцитом норадреналіну у центральній або периферійній нервовій системі. Терапевтичними показниками для використання сполук за даним винаходом є наявність депресії, когнітивних розладів, хвороби Паркінсона, цукрового діабету, сексуальної дисфункції та імпотенції та хвороб, пов'язаних з підвищеним внутрішньоочним тиском. Блокування a 2-рецеиторів у центральній нервовій системи також продемонструвало підвищення виділення серотоніну, що може мати додаткову терапевтичну дію при депресії (Maura et. ΑΙ., 1992, Naunyn-Schmiedeberg's Arch. Pharmacol., 345:410416). 17 70961 18 капсул та пілюль. Завдяки легкому введенню, табТакож було показано, що блокування a 2летки та капсули мають найбільші переваги серед рецепторів може спричиняти підвищення позаклітинної DOPAC (3,4-дигідро-фенилоцтова кислота), оральних форм одиничного дозування, в яких використовується твердий носій. Для парентеральяка є метаболітом допаміну та норадреналіну. них композицій, носій звичайно містить стерильну Беручи до уваги корисність сполук, що є об'єкводу, як мінімум у великому процентному співвідтами даного винаходу, у лікуванні хвороб пов'язаношенні, до якої можуть бути додані інші інгредієнних дефіцитом норадреналіну у центральній нервовій системі, а саме депресій та хвороб ти, наприклад, інгредієнти, що підвищують розчинність. Розчини для ін'єкцій також можуть бути Паркінсона, даний винахід забезпечує спосіб лікуприготовані на основі розчину солі, розчину глюковання теплокровних тварин, що страждають від зи, або суміші розчину солі і розчину глюкози. Розподібних хвороб, зокрема депресії та хвороби Пачини для ін'єкцій, що містять сполуки формули (І), ркінсона, згаданий спосіб включає систематичне призначення терапевтично ефективної кількості можуть бути приготовані на олії для тривалої дії. Прийнятними оліями для цих цілей є, наприклад, сполуки формули (І) або її фармацевтично прийнарахісова олія, кунжутна олія, бавовняна олія, куятної адитивної солі. курудзяна олія, соєва олія, синтетичні ефіри гліцеСполуки за даним винаходом є, також, корисрину, жирні кислоти з довгим ланцюгом та суміші ними при лікуванні хвороби Альцхеймера та слацих та інших олій. Суспензії для ін'єкцій можуть боумства тому, що відомо, що a 2-антагоністи стибути приготовані на основі придатного рідкого номулюють виділення ацетилхоліну (Tellez et al. сія, суспензуючого агента, та їм подібних. В компо1997, J. Neurochem. 68:778-785). зиціях, прийнятних для підшкірного призначення, В загальному визначенні, передбачається, що носій може необов'язково містити агент, що підсиефективна терапевтична денна кількість може лює проникнення, та/або зволожуючий агент, що бути від 0,01мг/кг до 4мг/кг ваги тіла. необов'язково містить добавки будь-якої природи, Даний винахід, таким чином, також відноситьв менших кількостях, які не спричиняють серйознося до сполук формули (І) як вказано вище, для го подразнення шкіри. Такі добавки можуть полегвикористання їх як медичних препаратів. Більш шувати призначення на шкіру та/або є допоміжнитого, даний винахід також відноситься до викорисми для приготування бажаної композиції. Такі тання сполук формули (І) для виробництва медичкомпозиції можуть бути призначені різними шляних препаратів для лікування хвороби Паркінсона. хами, наприклад, як трансдермальний пластир, як Ex vi vo так же як in vitro дослідження сигналькраплеве нанесення на шкіру або як мазь. Адитивної трансдукції рецепторів та дослідження по зв'яні солі (І), завдяки їх підвищеній розчинності у воді зуванню рецепторів можуть бути використані для у порівнянні з відповідними формами у вигляді оцінки антагонізму a 2-адреноцепторів сполуками вільної основи та вільної кислоти, є очевидно даного винаходу. Оборотність втрати настановнобільш прийнятними при приготуванні водних комго рефлексу, що спостерігається у пацюків після позицій. внутрішньовенної ін'єкції ксилазину, та пригнічення Особливі переваги дає використання вищетремтінь, викликаних у пацюків резерпіном, мозгаданих фармацевтичних композицій у формах жуть бути використані як показники блокади центодиничного дозування для більш легкого признарального a 2-адреноцептору in vivo. чення та універсальності дозування. Під формою Сполуки за даним винаходом також мають одиничного дозування, що використовується у здатність проникати у центральну нервову систеописі та формулі, мають на увазі фізично дискретму. ні одиниці, що прийнятно підходять для одиничноДля призначення пацієнтам, сполуки даного го використання, кожна з яких містить попередньо винаходу можуть бути використані для приготувизначену кількість активного інгредієнту для вання різних фармацевтичних композицій, що місстворення бажаного терапевтичного ефекту та тять фармацевтично прийнятний носій, та терапенеобхідну кількість фармацевтично прийнятного втично ефективну кількість сполуки формули (І) як носію. Прикладами таких дозованих одиниць є активний інгредієнт. Для приготування фармацевтаблетки (включаючи серцевині або покриті таблетичної композиції за даним винаходом, ретельно тки), капсули, пілюлі, порошкові пакети, брикети, змішують ефективну кількість окремої сполуки, як розчини або суспензії для ін'єкцій, повні чайні ложактивного інгредієнту, у формі адитивної солі або ки, повні столові ложки та їм подібні, та їх різномавільної кислоти чи основи, з фармацевтично принітні різновиди. йнятним носієм, що може варіюватися у широких Наступні приклади наведені для того, щоб межах в залежності від бажаної форми признапроілюструвати даний винахід. чення. Бажано, щоб ці фармацевтичні композиції Експериментальна частина були у формі одиничного дозування, переважно, А. Приготування проміжних сполук для орального, підшкірного призначення або паПриклад А1 рентеральних ін'єкцій. Для прикладу, приготування Суміш О-фенилгідроксиламін гідрохлориду композицій в формі орального дозування, може (1:1) (0,625моль) та 4,4-піперидиндіол гідрохлорибути використане будь-яке з звичайних фармацевду (1:1) (0,682моль) у 2-пропанолі (615мл) перемітичних середовищ, таких, як, наприклад, вода, шували при температурі 20°С. НСІ (353мл) додагліколі, олія, спирти та їм подібні, у випадку оральвали по краплям при температурі 20°С. Реакційна них рідких препаратів, таких як суспензії, сиропи, суміш обережно нагрівали до температури відгону еліксіри, розчини; або тверді носії, такі як крохмалі, з оберненим холодильником. Реакційну суміш пецукри, каолін, мастила, зв'язувачи, дезінтегруючі ремішували та нагрівали з оберненим холодильагенти та їм подібні в випадку порошків, таблеток, 19 70961 20 ником протягом 3 годин, потім охолодили до кімчинник випарували. Залишок перемішали у 2натної температури. Осадок відфільтрували, пропропанолі, потім від -фільтрували. Твердий залимили діізопропіловим ефіром, та висушили. Цю шок висушили та повторно перетворили у вільну фракцію кристалізували з води (1600мл). Бажаній основу 20% NaOH. Виділений органічний шар висполуці дозволили викристалізовуватися протягом сушили, відфільтрували та розчинник випарували. перемішування. Осадок відфільтрували, промили Залишок розчинили у 2-пропанолі та перетворили 2-пропанолом та діізопропиловим ефіром, потім у соляну кислоту (1:1) з НСІ/2-пропанол. Осадок висушили, що дало 84г (64%) 1,2,3,4відфільтрували та висушили, що дало 13,1г (50%) тетрагідробензо-фуро[3,2-с]піридин гідрохлориду 1,2,3,4-тетрагідро-7-метокси-[1]бензотіено[3,2(1:1) (проміжна сполука 1). с]піридину (проміжна сполука 6). Приклад А2 Аналогічно отримали: a) Бутил літій (0,27моль 2,5Μ розчину) дода1,2,3,4-тетрагідро-8-метил-[1]бензотіено[3,2вали по краплям до 6-метокси-бензо[b]тіофену с]піридин гідрохлорид (проміжна сполука 18). [приготованого аналогічно до способу описаного у Приклад A3 J. Med. Chem. 1989, 32(12), 2548-2554] (0,25моль) a) Суміш 3-хлоро-1,2-бензізоксазол у те трагідрофурані (1000мл), перемішували при (0,08моль), 4-аміно-1-бутанола (0,24моль) та йотемпературі -30°С. Суміш перемішували протягом диду калію (1г.) перемішували протягом 4 днів при 10 хвилин при температурі -30°С. Етилен оксид температурі 80°С. Реакційна суміш була о холо(0,38моль у 100мл тетрагідгофурану) додавали по джена, розчинена у СН 2Сl2 та очищена за допомокраплям при температурі -30°С. Суміші дозволили гою колонкової хроматографії на силікагелі (елюнагрітися до кімнатної температури та перемішуент: СН2Сl2/СН3ОН 95/5). Очи щені фракції зібрали вали протягом 3 годин. Суміш була підкислена та розчинник випарували, що дало 15,4г (93%) 4розбавленим розчином НСl. Розчинник випарува(1,2-бензісокзазол-3-іламіно)-1-бутанолу (проміжна ли. Залишок розбавили водою та цю суміш екстрасполука 7). гували СН 2Сl2. Виділені органічні шари висушили, b) SOCІ2 (0,048моль) охолодили до 0°С. Розвідфільтрували та розчинник випарували. Заличин проміжної сполуки 7 (0,048моль) у СНСІ3 шок було перемішано у гексані, відфільтровано та (20мл) додали по краплям та реакційна суміш біла висушено, що дало 41,3г 6-метоксибензо[b]тіофенперемішана протягом ночі при кімнатній темпера2-етанолу (проміжна сполука 2). турі. Розчинник випарували. Залишок промили b) Метансульфонілхлорид (0,21моль) було доводою. Реакційну суміш екстрагували СН 2Сl2. Видано до суміші проміжної сполуки (2) (0,19моль) та ділений органічний шар висушили, відфільтруватриетиламіну (0,21моль) у СН 2Сl2 (1000мл), перели, та розчинник випарували, що дало 10,4г N-(4мішано при температурі 0°С. Реакційну суміш пехлорбутил)-1,2-бензісокзазол-3-аміну (проміжна ремішували протягом 4 годин при кімнатній темпесполука 8). ратурі, потім злили у воду. Розділений органічний с) Реакція під N2. Розчин етандіол дихлориду шар висушили, відфільтрували та розчинник випа(0,026моль) у СН 2Сl2 (60мл) перемішували при рували. Залишок розтерли в порошок у діізопротемпературі -60°С. Диметилсульфоксид (3,8мл) пилефірі, відфільтрували та висушили, що дало додавали по краплям та перемішували протягом 50,5г (94%) 6-метоксибензо[b]тіофен-2-етанол ме10 хвилин при температурі -60°С. Розчин 4-(1,2тансульфонату (естер) (проміжна сполука 3). бензісоксазол-3-іламіно)-1-бутанол (0,024моль) у c) Суміш проміжної сполуки (3) (0,18моль) та СН2Сl2 (120мл) додавали по краплям при темпеNal (0,45моль) у 2-пропанону (1000мл) перемішуратурі -60°С та суміш перемішували протягом одвали та нагрівали з оберненим холодильником нієї години при температурі -60°С. Ν,Νпротягом 9 годин, потім охолодили до кімнатної диетилетанамін (13,7мл) додавали по краплям та температури та розчинник випарували. Залишок реакційну суміш перемішували протягом 10 хвилин промили водою та екстрагували СН 2Сl2. Виділений при температурі -60°С, потім дозволили нагрітися органічний шар висушили, відфільтрували та роздо кімнатної температури. Суміш вилили у воду чинник випарували, що дало 57г 2-(2-иодоетил)-6(250мл). Суміш перемішували протягом 10 хвилин. метоксибензо[b]тіофену (проміжна сполука 4). Виділений органічний шар висушили, відфільтруd) Проміжна сполука (4) (0,18моль) була дозовали та розчинник випарували. Залишок розтерли вано додана до суміші 1,3,5,7у порошок під гексаном, відфільтрували та висутетраазатрицикло[5.1.1.13,5]декану (0,45моль) у шили, що дало 3,9г 4-(1,2-бензісоксазол-3СНСІ3 (600мл). Реакційну суміш перемішували та іламіно)бутанол (80%) (проміжна сполука 9). нагрівали з оберненим холодильником протягом Приклад А4 ночі, потім охолодили до кімнатної температури. До перемішаної суміші 58,5г. 1Н-індол, Осадок відфільтрували та висушили, що дало 107,5мл 1-бромо-3-хлорпропану, 15мг N,N,N54,2г 1-[2-(метоксибензо[b]тіофен-2-іл)етил]триетилбензенметанаміній хлориду та 450мл бен1,3,5,7-тетраазатрицикло [5.1.1.15,7]деканія йодизолу додавали по краплям, протягом 30 хвилин, ду (проміжна сполука 5). 250мл дисперсію гідриду натрію ,60% при темпее) суміш проміжної сполуки (5) (0,12моль) та ратурі 40°С. Після завершення цієї процедури, НСІ (0,50моль) у етанолі (171мл) перемішували перемішування було продовжено, при температурі протягом 2 днів при кімнатній температурі. Додат40°С, протягом однієї години. Іншу кількість 15мл кову кількість НСІ (10мл) та етанолу (40мл) додали 1-бромо-3-хлорпропану додавали по краплям та та реакційну суміш перемішували та нагрівали з перемішування продовжувалося протягом 1 годиоберненим холодильником протягом однієї години, ни при температурі 50°С. Після охолодження, реапотім охолодили до кімнатної температури. Розкційну суміш вилили у воду. Отриманий продукт 21 70961 22 екстрагували бензолом. Екстракт виділили, висурозчинник випарували, що дало 22г 6-хлоро-1-(4шили, відфільтрували та випарили. Залишок був флуоро-2-гідроксифенил)-1-гексанону, оксим перегнаний, що дало 80мл (83%) 1-(3(проміжна сполука 15). хлорпропил)-1H-індолу (проміжна сполука 10); c) Проміжну сполуку (15) (0,077моль) у тетратемпература кипіння 120-125°С. гідрофурані (200мл) нагрівали до температури Приклад А5 60°С. Розчин 1,1’-карбонілбіс[1H-імідазола] а) Суміш 1,2,3,4-тетрагідробензофуро[3,2(0,16моль) у тетрагідрофурані (600мл) додавали с]піридин гідрохлориду (1:1) (0,05моль), 1по краплям та результуючу реакційну суміш пере(хлорметил)-4-нітробензол (0,05моль), Na2CO3 (7г) мішували та піддавали нагріванню з оберненим та йодид калію (0,1г) у 4-метил-2-пентанон (250мл) холодильником протягом 2 годин. Реакційну суміш перемішали та нагрівали з оберненим холодильохолоджували до кімнатної температури та розником протягом 8 годин. Суміші дозволили охолочинник випарували. Залишок промили водою, подитися до кімнатної температури. Реакційну суміш тім підкислили НСI. Цю суміш екстрагували СН 2Сl2. відфільтрували та випарували. Маслянистий заВиділений органічний шар висушили, відфільтрулишок розчинили у CH 3CN/діізопропіловом ефірі вали та розчинник випарували. Залишок очистили та перемішали. Осадок відфільтрували та висуза допомогою колонкової хроматографії на силікашили, що дало 8г 1,2,3,4-тетрагідро-2-[(4гелі (елюент: СН2Сl2 100%). Дві бажані групи франітрофенил)метил]бензофуро[3,2-с]піридину (прокцій зібрали та їх розчинник випарували, що дало міжна сполука 11). Фільтрат перемішали з НСI/26,4г 3-(5-хлорпентил)-6-флуоро-1,2-бензісоксазолу пропанолом. Осадок відфільтрували та висушили, (проміжна сполука 16) та 11,1г 2-(5-хлорпентил)-6що дало 9г 1,2,3,4-тетрагідро-2-[(4флуоробензоксазолу (проміжна сполука 17). нітрофенил)метил]бензофуро[3,2-с]піридин гідроПриклад А7 хлориду (НСI) (проміжна сполука 12). Суміш 2-(4-хлорпентил)-3-(2-гідроксиетил)b) Суміш проміжної сполуки (11) (0,027моль) у 4(3H)-хіназолінону (0,068моль) та НВr у воді 46% 2-метоксіетанолі (300мл) гідрогенізували при кім(200мл) перемішували та нагрівали з оберненим натній температурі в присутності платини на актихолодильником протягом 90 хвилин. Додали вованому вуглеці, 5% (2г) як каталізатора у прису300мл води. Кристалізований продукт відфільтрутності розчину тіофен у (2мл). Після поглинення Н2 вали та висушили (фракція 1). Фільтрат (масло) (3 еквівалента), каталізатор відфільтрували та отверджували (фракція 2). Обидві фракції з'єднафільтрат випарували. Залишок перемішали у дііли, що дало 23,5г (78%) 3-(2-брометил)-2-(4зопропиловом ефірі + невелика кількість CH3CN та хлорфенил)-4(3H)-хіназолінон моногідробромиду; обробляли НСi/2-нропанолом. Сіль соляної кислотемпература плавлення 214,0°С (проміжна сполути (1:2) відфільтрували та висушили, що дало вика 19). хід 8,5г 4-[(3,4-дігідро-бензофуро[3,2-с]піридинВ. Приготування заключних композицій 2(1H)-іл)метил]бензоламін моногідрохлориду Приклад В1 (проміжна сполука 13). a) Суміш 1,2,3,4-тетрагідробензотіено[3,2Приклад А6 с]піридина [приготований аналогічно до процедури а) Реакція у атмосфері N2·BF3·Et2 O (215мл) описаної у J. Am. Chem. Soc, 1953, p.697] охолодили до температури 0°С. Додали 3(0,12моль) та 4-фенокси бензальдегіда флуорофенол (0,25моль). Додали 6(0,012моль) у метанолі (100мл) гідрогенізували у хлорогексаноіл хлорид (0,051моль) та результуюприсутності паладію на активованому вуглеці (1г) чу реакційну суміш перемішували протягом 15 як каталізаторі, у присутності тіофену (1мл 4% хвилин при температурі 0°С, потім дозволили нарозчину). Після поглинення Н2 (1 еквівалент), кагрітися до кімнатної температури. Потім реакційну талізатор відфільтрували та фільтрат випарували. суміш перемішували протягом ночі при темпераЗалишок перетворили у сіль (Е)-2-бутендіонової турі 130°С. Суміш охолоджували до кімнатної темкислоти (1:1), відфільтрували та висушили, що ператури. Протягом охолодження додавали воду. дало 4,1г (84%) 1,2,3,4-тетрагідро-1-[(4Суміш двічі екстрагували 2,2'-оксибіспропаном. феноксифенил)метил][1]бензотіено[3,2-с]піридин Виділений органічний шар висушували, відфільт(Е)-2-бутендіоату (1:1) (сполука 1). рували та розчинник випарували. Залишок очищуb) суміш проміжної сполуки (6) (0,0059моль) та вали за допомогою колонкової хроматографії на 4-феноксибензальдегіду (0,0076моль) з ацетатом силікагелі (елюент: СН2Сl2/гексан 50/50), потім калію (1г) у метанолі (150мл) гідрогенізували при HPLC (елюент: СН2Сl2/гексан 50/50). Чисті фракції температурі 50°С в присутності платини на актизібрали та розчинник випарували, що дало 52,2г 6вованому вуглеці (1г) як каталізатора, у присутнохлоро-1-(4-флуоро-2-гідроксифенил)-1-гексанону сті тіофену (1мл 5% розчину). Після поглинення Н2 (проміжна сполука 14). (1 еквівалент) каталізатор відфільтрували та фільb) Суміш проміжної сполуки (14) (0,21моль) та трат випарували. Залишок промили водою та ексгідроксиламіну (0,25моль) у піридині (100мл) петрагували СН2Сl2. Виділений органічний шар виремішували протягом 2 днів при кімнатній темпесушили, відфільтрували та розчинник випарували. ратурі, потім вилили у IN HCI (450мл). Суміш пеЗалишок кристалізували з 2-пропанолу, відфільтремішували протягом 10 хвилин, потім рували та висушили, що дало 1,2г (50%) 1,2,3,4екстрагували етилацетатом. Виділений органічний тетрагідро-7-метокси-2-[(4шар висушили, відфільтрували та розчинник випафеноксифенил)метил][1]-бензотіено[3,2-с]піридину рували. Залишок очистили за допомогою колонко(сполука 2). вої хроматографії на силікагелі (елюент: c) Суміш 8-хлоро-1,2,3,4СН2Сl2/СН3ОН 99/1). Бажані фракції зібрали та тетрагідробензотіено[3,2-с]піридин гідрохлориду 23 70961 24 (1:1) (0,01моль), 4-феноксибензалдегіду КІ у 4-метил-2-пентаноні (200мл) перемішували та (0,01моль) та ацетату калію (1г) у метанолі нагрівали з оберненим холодильником протягом (150мл)) гідрогенізували при температурі 50°С. ночі та потім охолодили до кімнатної температури. Після поглинення Н 2 (1 еквівалент), каталізатор Розчинник випарували. Залишок промили Н2О та відфільтрували та фільтрат випарували. Залишок суміш екстрагували СН 2Сl2. Органічний шар було промили водою та екстрагували СН 2Сl2. Виділений виділено, висушено, відфільтровано та розчинник органічний шар висушили, відфільтрували та розвипарували. Залишок очистили за допомогою кочинник випарували. Залишок перетворили у сіль лонкової хроматографії на силікагелі (елюент: соляної кислоти (1:1), відфільтрували та висушиСН2Сl2/СН3ОН 90/10). Чисті фракції зібрали та ли, що дало 2,9г 1,2,3,4-тетрагідро-8-метил-2-[(4розчинник випарували. Залишок перетворили у феноксифенил)метил]-[1]-бензотіено[3,2-с]піридин сіль (Е)-2-бутендіонової кислоти (2:1). Осадок відгідрохлориду (69%) (сполука 10). фільтрували та висушили, що дало 2,0г 2-[5-(6Приклад В2 флуоро-2-бензоксазоліл)пентил]-1,2,3,4а) Проміжну сполуку (10) (0,100г) додали до тетрагідробензофуро[3,2-с]піридин (Е)-2розчину проміжної сполуки (1) (0,00048моль) та бутендіоату (1:1) (40%) (сполука 16). Na2CO3 (0,100г) у N,N-диметилацетаміді (1мл) та Приклад В3 результуюча реакційна суміш перемішували проОцтова кислота (0,0049моль) була додана до тягом ночі при температурі 80°С. Бажану сполуку проміжної сполуки (18) (0,0049моль) у 1,2виділили та очистили за допомогою рідинної хродіхлоретан (50мл). Проміжна сполука (9) матографії високого тиску (HPLC) на немодифіко(0,0049моль) була додана та суміш перемішували ваному силікагелі типу Kromasil Spherical (елюент: до повного розчинення. NaHB(OAc)3 (0,0049моль) СН2Сl2/(СН2Сl2/СН3ОН 90/10)/СН3ОН (0 хвилин) додали та реакційну суміш перемішували протя100/0/0, (10,50 хвилин) 0/100/0, (12,50 хвилин) гом ночі при кімнатній температурі. Реакційну су50/0/50, (14,00 хвилини) 0/0/100, (15,01-20,00 хвиміш промили 10% водним розчином NaOH (50мл). лин) 100/0/0). Чисті фракцій зібрали та розчинник Виділили шари. Водна фаза була повторно екствипарували, що дало 0,045г 1,2,3,4-тетрагідро-2рагована СН2Сl2. Виділений органічний шар вису[3-(1H-індол-1-іл)пропил]бензофуро[3,2-с]піридине. шили, відфільтрували та розчинник випарували. (сполука 4). Залишок очистили за допомогою колонкової хроb) Суміш 1,2,3,4-тетрагідробензотіено[3,2матографії на силікагелі (елюент: СН2Сl2/СН3ОН с]піридину [приготованого аналогічно до процеду95/5). Чисті фракції зібрали та розчинник випарури описаної у J. Am. Chem. Soc, 1953, p.697] вали. Залишок перетворили у сіль соляної кислоти (0,01моль), проміжна сполукa (8) (0,02моль) та (1:1), відфільтр ували та висушили, що дало 1,3г Nтриетиламін (0,03моль) у Ν,Ν-диметилацетаміді (1,2-бензісоксазол-3-іл)-1,2,3,4-тетрагідро-8-метил(50мл) перемішували при температурі 70°С, потім [1]бензотіено[3,2-с]піридин-2-бутанамін гідрохлоохолоджували до кімнатної температури та розриду (1:1) (57%) (сполука 11). чинник випарували. Залишок промили водою та Приклад В4 екстрагували СН 2Сl2. Виділений органічний шар Суміш 4-флуоробензоіл хлориду (0,01моль), висушили, відфільтрували та розчинник випарувапроміжна сполука (13) (0,01моль) та Na2CO3 (4г) у ли. Залишок очищали за допомогою колонкової СНСІ3 (100мл) перемішували та нагрівали з оберхроматографії на силікагелі (елюент: неним холодильником протягом 30 хвилин. Осадок СН2Сl2/СН3ОН 90/10). Бажані фракції зібрали та відфільтрували усмоктуванням та осадок на фільрозчинник випарували. Залишок перетворили у трі перемішали у воді, потім відфільтрували, песіль (Е)-2-бутендіонової кислоти (2:1). Осадок відремішали у CH3CN, відфільтрували, промили дііфільтрували та висушили, що дало 0,38г (9%) Nзопропиловим ефіром та потім висушили, що дало (1,2-бензисоксазол-3-іл)-1,2,3,4-тетрагідро[3,22,4г N-[4-[(3,4-дигідробензофуро[3,2-с]піридинс]піридин-2-бутанамін (Е)-2-бутендіоату (2:1) (спо2(1Н)-іл)метил]фенил]-4-флуоробензаміду (сполулука 7). ка 14). c) Na2CO3 (0,1г) додали до розчину 1,2,3,4Таблиця 1 демонструє сполуки формули (І), тетрагідро-бензотіено[3,2-с]-піридину [приготоващо були приготовані відповідно до одного з вищеного аналогічно до процедури описаної у J. Am. наведених прикладів. Chem. Soc, 1953, p.697] (0,00044моль) та 3-(2брометил)-1Н-індолу (0,100г) у метилізобутилієтоні (2мл) та результуючу реакційну суміш перемішували протягом ночі при температурі 100°С. Бажані сполуки виділили та очистили за допомогою рідинної хроматографії високого тиску (HPLC) на немодифікованому силікагелі типу Kromasil Spherical (елюент: СН2Сl2/(СН2Сl2/СН3ОН 90/10)СН3ОН (0 хвилин) 100/0/0, (10,50 хвилин) 0/100/0, (12,50 хвилин) 50/0/50, (14,00 хвилини) 0/0/100, (15,01-20,00 хвилин) 100/0/0). Чисті фракцій зібрали та розчинник випарували, що дало 0,045г 1,2,3,4-тетрагідро-2-[2-(1H-індол-3іл)етил][1]бензотіено[3,2-с]піридину (сполука 8). d) суміш проміжної сполуки (1) (0,01моль), проміжна сполука (17) (0,012моль), Na2CO3 (3г) та 25 70961 26 тягом інкубації, рецептор зв'язується радіолігандом. При досягненні рівноважного зв'язування, радіоактивність зв'язана з рецептором відділяється від незв'язаної, та активність зв'язування рецептору вираховується. Взаємодія сполук, що випробовуються, з рецептором оцінюється у експериментах по конкурентному зв'язуванню. Різноманітні концентрації сполуки, що випробовується, додавали до інкубаційної суміші, що містила препарат рецептору та радіоліганд. Зв'язування радіолігандом буде інгібуватися сполукою, що випробовується, пропорційно до його зв'язуючої афінності та концентрації цієї сполуки. Радіоліганд, що використовувався для зв'язування a 2А, a 2B та a 2С рецепторів, є 3Н-рауволскін, та препарат рецептору, що використовува вся, представляє собою клітину Chinese Hamster Ovary (CHO), що експресує клоновані людські a 2А, a 2B та a 2С рецептори. Сполуки з номерами 1 та 5-23 мали значення ІС50 (концентрація за якою 50% рецепторів інгібовані) для кожного з трьох рецепторів принаймні 106 М. Інші сполуки мали значення ІС 50 для кожного з трьох рецепторів принаймні 10-5М. D. Приклади фармацевтичної композиції «Активний інгредієнт» (А.І.), який використовується у цих прикладах, відноситься до сполук формули (І), або їх фармацевтично прийнятних адитивних солей чи стереохімічних ізомерних форм. Приклад D.1: Капсули 20г. А.I., 6г лаурилсульфата натрію, 56г крохмалю, 56г лактози, 0,8г колоїдного діоксиду кремнію, та 1,2г стеарата магнію разом енергійно перемішали. Результуючою сумішшю була послідовно заповнені 1000 відповідних твердих желатинових капсул, кожна з яких містить 20мг А.I. Приклад D.2: таблетки, що покриті оболонкою Одержання серцевини таблетки Суміш 100г А.I., 570г лактози та 200г крохмалю добре змішали та потім зволожували розчином, що містив 5г додецисулфату та 10г полівінілпіролідону у приблизно 200мл води. Вологу суміш просіяли, висушили та просіяли знову. Потім додали до неї 100г мікрокристалічної целюлози та 15г гідрогенізованої рослинної олії. Усю масу добре перемішали та спресували у таблетки, що дало 10000 таблеток, кожна містила 10мг активного інгредієнту. Одержання покриття До розчину 10г метилцелюлози у 75мл денатурованого етилового спирту додали розчин, що містив 5г етилцелюлози у 150мл дихлорметану. Потім додали 75мл дихлорметану та 2,5мл 1,2,3пропантриолу. 10г поліетиленгліколю розплавили та розчинили у 75мл дихлорметану. Цей розчин C. Фармакологічні приклади додали до вищезгаданого розчину та потім додали Приклад C.1: In vitro зв'язуюча афінність для 2,5г магнію октадеканоату, 5г полівінілпіролідону a 2 рецепторів та 30мл концентрованої забарвленої суспензії та Взаємодія сполук формули (І) з a 2 рецепторасуміш гомогенізували. Серцевина таблеток була ми була оцінена у in vitro експериментах по зв'язупокрита цією одержаною сумішшю у спеціальному ванню радіолігандом. апараті. Загалом, низька концентрація радіоліганду, з Приклад D.3: Оральний розчин високою зв'язуючою афінністю для конкретного 9г метил 4-гідроксибензоату та 1г пропил 4рецептору, була інкубована разом з препаратом гідроксибензоату розчинили у 4 літрах кип'яченої тканини, збагаченої конкретним рецептором або очищеної води. У 3 літра х цього розчину розчинипрепаратом клітин, що експресують клоновані ли перші 10 грамів 2,3-дигідроксибутандіонової людські рецептори у буферному середовищі. Про 27 70961 28 кислоти та після цього, 20 грамів А.І. Останній розПриклад D.4: Розчин для ін'єкцій чин об'єднали з залишеною частиною колишнього 1,8г метил 4-гідроксибензоату та 0,2г пропил розчину та 12 літрів 1,2,3-пропантриолу та 3 літра 4-гідроксибензоату розчинили у приблизно 0,5 70% розчину сорбіту були додатково додані. 40 літрах кип'яченої води для ін'єкцій. Після охолограмів сахарину натрію розчинили у 0,5 літрах водження до приблизно 50°С, перемішуючи додали ди та додали 2мл малини та 2мл екстракту аґрусу. 4г молочної кислоти, 0,05г пропіленгликолю та 4г Останній розчин об'єднали з колишнім, та додали А.I. Розчин охолодили до кімнатноїтемператури води q.s. до об'єму у 20 літрів, що забезпечує ората додали води для ін'єкцій q.s. до 1 літру, що дальний розчин, що містить 5мг активного інгредієнло розчин, що містить 4мг/мл А.І. Розчин стериліту на повну чайну ложку (5мл). Результуючим роззували шляхом фільтрації та наповнили їм стеричином заповнили прийнятні контейнери. льні контейнери. Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic d3-piperidines, composition based thereon and a method for the preparation thereof (variants)
Автори англійськоюKennis Ludo Edmond Josephine
Назва патенту російськоюТрициклические d3-пиперидины, композиция на их основе и способ их получения (варианты)
Автори російськоюКеннис Людо Эдмон Жозефин
МПК / Мітки
МПК: A61P 43/00, A61K 31/4365, A61P 27/06, A61K 31/4355, A61P 25/00, C07D 491/048, A61P 25/28, A61P 3/10, A61P 25/16, C07D 491/04, C07D 495/04, A61P 15/10, A61P 25/24
Мітки: одержання, d3-піперидини, композиція, варіанти, спосіб, трициклічні, основі
Код посилання
<a href="https://ua.patents.su/14-70961-triciklichni-d3-piperidini-kompoziciya-na-kh-osnovi-ta-sposib-kh-oderzhannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Трициклічні d3-піперидини, композиція на їх основі та спосіб їх одержання (варіанти)</a>
Попередній патент: 4-амінозаміщені-2-заміщені-1,2,3,4-тетрагідрохіноліни як інгібітори протеїну, який переносить холестериловий етер
Наступний патент: Спосіб одержання 5-[4-[[3-метил-4-оксо-3,4-дигідрохіназолін-2-іл]метокси]бензил]тіазолідин-2,4-діону та проміжної сполуки
Випадковий патент: Пристрій для регулювання змінної напруги