Феноксифенілалкансульфонати, спосіб їх одержання та лікарський засіб на їх основі
Номер патенту: 75369
Опубліковано: 17.04.2006
Автори: Ленферс Ян-Бернд, Люстіг Клеменс, НААБ Пауль, де Врі Жан-Марі-Віктор, Майєр Хайнрих, Хайль Маркус, МАУЛЕР Франк, Денцер Дірк, Фьорсте Арнд
Формула / Реферат
1. Похідні феноксифенілалкансульфонату загальної формули (І)
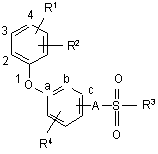 (І),
(І),
де
R1 означає атом водню, алкільну групу з числом атомів вуглецю від одного до чотирьох, атом галогену, трифторметильну групу, трифторметоксигрупу, ціаногрупу або нітрогрупу,
R2 означає атом галогену, трифторметильну групу, трифторметоксигрупу, ціаногрупу або нітрогрупу,
R3 означає алкільну групу з числом атомів вуглецю від чотирьох до семи і ця група може бути від одного до декількох разів заміщена атомами фтору або хлору,
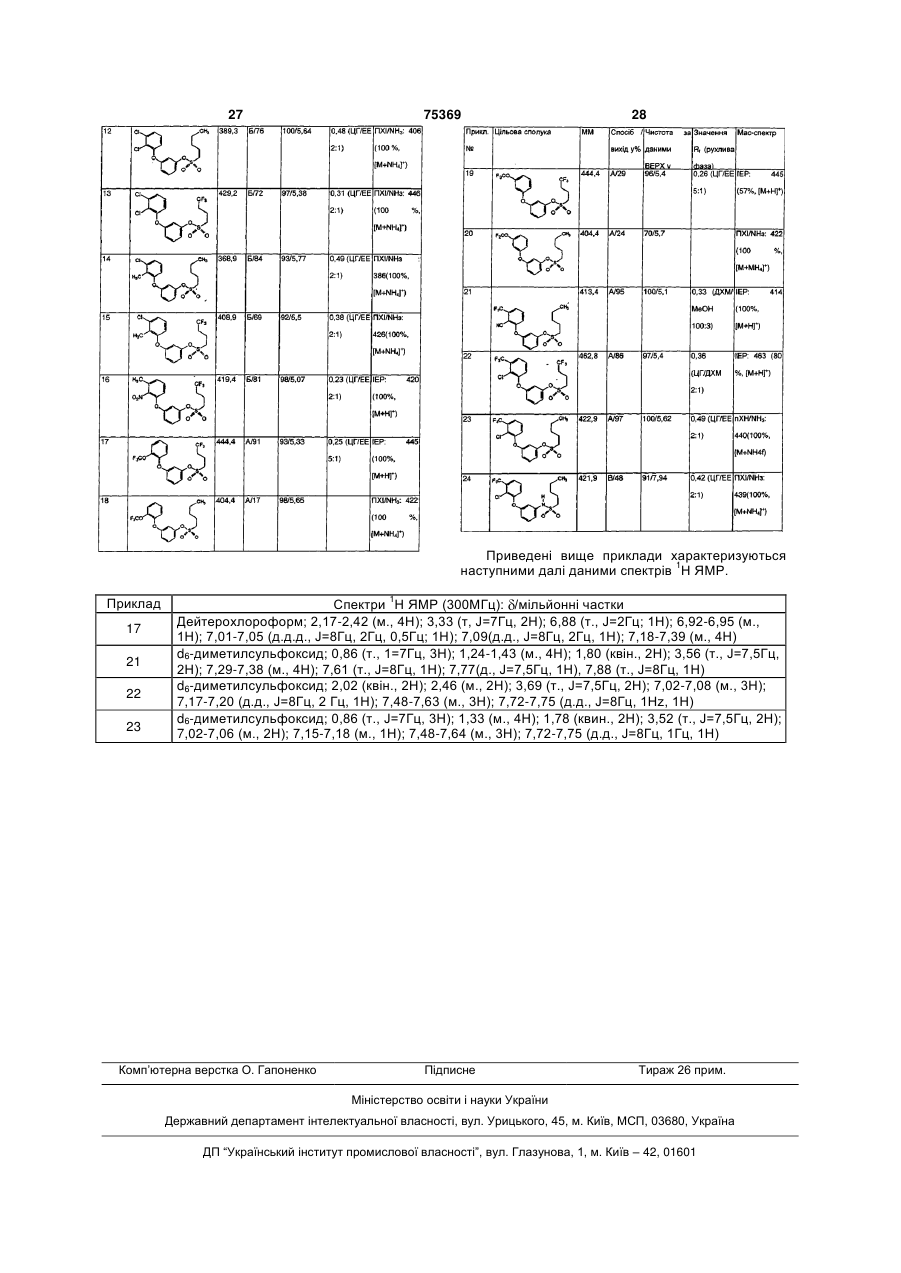
R4 означає атом водню або галогену і
А означає атом кисню або NH-групу,
і їх солі і амонієві сполуки.
2. Сполуки за п. 1, де
R1 означає атом водню, фтору, хлору, метильну групу, трифторметильну групу, трифторметоксигрупу, ціаногрупу або нітрогрупу,
R2 означає атом фтору, трифторметильну групу, трифторметоксигрупу, ціаногрупу або нітрогрупу,
R3 означає н-бутильну, н-пентильну групу, 4,4,4-трифторбут-1-ильну групу або 5,5,5-трифторпент-1-ильну групу,
R4 означає атом водню і
А означає атом кисню,
і їх солі.
3. Сполуки за п. 1 або 2, де R1, R2, R3, R4 і А мають наведені в п. 1 або 2 значення, у фенільному ядрі з замісниками R1 і R2 атом водню знаходиться в положенні 4,
і їх солі і амонієві сполуки.
4. Сполуки за п. 1 або 2, де
R1, R2, R3, R4 і А мають наведені в п. 1 або 2 значення і
R1 і R2 займають у фенільному кільці положення 2 і 3,
і їх солі і амонієві сполуки.
5. Сполуки за будь-яким з пп. від 1 до 3, де
R1, R2, R3, R4 і А мають наведені в пп. від 1 до 4 значення й
А знаходиться в положенні с бензольного залишку.
6. Спосіб одержання сполук за п. 1, який відрізняється тим, що сполуки загальної формули (II)
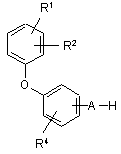 (ІІ),
(ІІ),
де R1, R2, R4 і А мають наведені в п. 1 значення,
в інертному розчиннику в присутності прийнятної основи і, якщо це необхідно, у присутності каталізатора міжфазного переносу вводять у реакцію зі сполуками загальної формули (III),
![]() (III),
(III),
де
X1 означає прийнятну відхідну групу, і
R3 має зазначене вище значення,
і цільовий продукт виділяють у вільному вигляді, у вигляді солі або амонієвої сполуки.
7. Лікарський засіб, що містить принаймні одну із сполук за одним з пп. 1 - 5 у суміші з принаймні одним фармацевтично прийнятним переважно нетоксичним носієм або розріджувачем.
Текст
1. Похідні феноксифенілалкансульфонату загальної формули (І) R1 4 3 R2 2 (І), b O 1 O a c R3 A S 2 (19) 1 3 75369 4 6. Спосіб одержання сполук за п. 1, який відрізнязатора міжфазного переносу вводять у реакцію зі ється тим, що сполуки загальної формули (II) сполуками загальної формули (III), R1 1 (III), X SO2 R3 R2 (ІІ), O A H R4 де R1, R2, R4 і А мають наведені в п. 1 значення, в інертному розчиннику в присутності прийнятної основи і, якщо це необхідно, у присутності каталі Винахід відноситься до нових феноксифенілалкансульфонатів, до способів їх одержання, до їх застосування для одержання лікарських засобів для лікування і/або для профілактики хвороб, зокрема, для лікування больових синдромів і нейродегенеративних захворювань. Серед речовин, що містяться в коноплі (Cannabis sativa) найважливішим у фармакологічному відношенні є 9-тетрагідроканнабінол, що обумовлює основні ефекти коноплі на центральну нервову систему людини. Потенційні історичні і сучасні терапевтичні застосування препаратів коноплі включають поряд з іншими аналгезію, блювоту, анорексію, глаукому і порушення рухових функцій. Дотепер були ідентифіковані два підтипи каннабіноїдних рецепторів і один варіант зі сполученням функцій. СВ1- і СВ2-рецептори мають сім трансмембранних регіонів і відносяться до сімейства рецепторів, пов'язаних з G-білками. СВ1-рецептор і варіант зі сполученням функцій СВІа локалізовані переважно в центральній нервовій системі. СВ2рецептор виявляється переважно в периферичних тканинах, зокрема в лейкоцитах, у селезінці й у макрофагах. Дотепер були відомі багато структурних класів агоністів каннабіноїдних рецепторів: такі класичні 9 каннабіноїди, як, наприклад, -тетрагідроканнабінол, такі некласичні каннабіноїди, як, наприклад, аміноалкіл-індоли, а також ейкозаноїди. До останнього відноситься ендогенний агоніст СВ1-рецепторів анандамід. У міжнародних завках на патенти №А98/37061, №А-00/10967 і №А-00/10968 описуються визначені арилоксифенілалкансульфонати в якості агоністів каннабіноїдних рецепторів для лікування нейродегенеративних захворювань. У патенті США №3462473, у статтях Biochem. Pharmacol· 1972, 21, 1127-1134, Fed. Proc. Fed. Amer. Soc. Exp. Bio!. 1971, 30, 841-847, і J. Pharm. Sei. 1973, 62, 1780-1784, розкриваються визначені п-феноксифенілалкансульфонати і їх гіпохолестеринемічна або, відповідно, гіполіпідемічна дія. Крім того, відомі визначені феноксифенілалкансульфонати і їх застосування як гербіцидів (1), де X1 означає прийнятну відхідну групу, і R3 має зазначене вище значення, і цільовий продукт виділяють у вільному вигляді, у вигляді солі або амонієвої сполуки. 7. Лікарський засіб, що містить принаймні одну із сполук за одним з пп. 1 - 5 у суміші з принаймні одним фармацевтично прийнятним переважно нетоксичним носієм або розріджувачем. антимікробних засобів (2), засобів для зниження адгезії (3), сенсибілізаторів для термобумаги (4) і синтетичних проміжних продуктів (5): (1) завка на європейський патент №0023725; патент США №3929903; патент США №4415354; Chem. Absir. 1979, 91, 175034 (патент Японії №А-54066631); Chem. Abstr. 1981, 94, 156552 (патент Японії №А55154953); Chem. Abstr. 1981, 95, 168773 (патент Японії №А-56046859); Chem. Abstr. 1981, 95, 168789 (патент Японії №А-56079665); Chem. Abstr. 1989, 111, 2678 (патент Японії №А-63104903); (2) завка на патент ФРН №А-1493776; завка на патент ФРН №А-2131754; Патент США №3629477; патент США №3772445; патент США №3850972; завка на патент Швейцарії №У-450347; завка на патент Швейцарії №У-459656; Chem. Abstr. 1975, 83, 72725 (патент Японії №У-50003375); (3) патент США №3346612; (4) патент США №4837197; (5) Chem. Abstr. 1997, 727, 26629 (патент Японії №A09087210); Tetrahedr. 1990, 46, 4161-4164; J. Am. Chem. Soc. 1998, 39, 435-436. Задача дійсного винаходу полягала в одержанні агоністів каннабіноїдних рецепторів з поліпшеною дією. Дана задача вирішується відповідно винаходу новими сполуками. Відповідно до цього дійсний винахід відноситься до нових сполук загальної формули (l) де R1 означає атом водню, алкільну групу з числом атомів вуглецю від одного до чотирьох, атом галогену, трифторметильну групу, трифторметоксигрупу, ціаногрупу або нітрогрупу, 5 75369 6 R2 означає атом галогену, трифторметильну втор-бутильну, трет-бутильну, ізопентильну, нгрупу, трифторметоксигрупу, ціаногрупу або нітропентильну, гексильну або гептильну групу. Перегрупу, вага віддається н- бутильній, н-пентильній і нR3 означає алкільну групу з числом атомів вуггексильній групам. лецю від чотирьох до семи, котра може бути від Поняття галогену в рамках винаходу включає одного до декількох разів заміщена атомами фтоатоми фтору, хлору, брому і йоду. Перевага віддару або хлору, ється атомам хлору або фтору. R4 означає атом водню або галогену й А ознаПеревага віддається сполукам загальної форчаєатом кисню або NH-групу. мули (l), де R1 означає атом водню, фтору, хлору, Відповідні винаходу сполуки можуть існувати в метильну групу, трифторметильну групу, трифтостереоізомерних формах, що відрізняються як рметоксигрупу, ціаногрупу або нітрогрупу, R2 озназображення і його дзеркальне відображення (еначає атом фтору, трифторметильну групу, трифтонтіомери) або ж не так, як зображення і його дзеррметоксигрупу, ціаногрупу або нітрогрупу, R3 кальне відображення (діастереомери). Винахід означає н-бутильну, н-пентильну групу, 4,4,4відноситься як до енантіомерів або діастереометрифтор-1-бутильну групу або 5,5,5-трифторпентрів, так і до будь-яких їхніх сумішей. Ці суміші ена1-ильну групу, нтіомерів або діастереомерів можуть бути роздіR4 означає атом водню і лені відомими способами на стереоізомерно А означає атом кисню. однорідні складові. Особлива перевага віддається сполукам форВідповідні винаходу сполуки можуть також мули (l), знаходитися у виді їхніх солей. У загальному виде падку тут варто назвати солі з органічними або R1, R2, R3, R4 і А мають приведені вище знанеорганічними основами або кислотами. У рамках чення, а у фенільному ядрі з замісниками R1 і R2 дійсного винаходу перевага віддається безпечним атом водню знаходиться в положенні 4. з фізіологічної точки зору солям. Прийнятні з фізіЦе може бути відображене в наступній форологічної точки зору солі сполук можуть бути мулі: представлені солями речовин з мінеральними кислотами, з карбоновими кислотами або із сульфокислотами. Особливо переважні, наприклад, солі з хлорводневою кислотою, бромводневою кислотою, сірчаною кислотою, фосфорною кислотою, метансульфокислотою, етансульфокислотою, толуолсульфокислотою, бензолсульфокислотою, нафталіндисульфокислотою, оцтовою кислотою, пропіоновою кислотою, молочною кислотою, винною кислотою, лимонною кислотою, фумаровою кислотою, малеїновою кислотою або з бензойною кислотою. Найбільш переважні сполуки загальної форПрийнятними з фізіологічної точки зору солямули (l), де ми можуть бути також солі сполук з металами або R1, R2, R3, R4 і А мають приведені вище знаїх амонійні солі. Особливо переважні, наприклад, 1 2 чення, тоді як R і R займають у фенільному ядрі натрієві, калієві, магнієві або кальцієві солі, а таположення 2 і 3. Положення R1 і R2 у фенільному кож солі амонію, що є похідними аміаку або таких ядрі можуть бути представлені наступними форорганічних амінів, як, наприклад, етиламін, димулами або, відповідно, триетиламін, ди- або, відповідно, триетаноламін, дициклогексиламін, диметиламіноетанол, аргінін, лізин, етилендіамін або 2фенілетиламін. До дійсного винаходу відносяться також амонійні сполуки, що можуть бути отримані в результаті перетворення вільних амінів за допомогою алкілування. У рамках дійсного винаходу замісники в загальному випадку мають приведене далі значення. Алкільна група з числом атомів вуглецю від одного до чотирьох у рамках винаходу означає лінійний або розгалужений алкільний залишок з числом атомів вуглецю від одного до чотирьох. Як приклад варто назвати метильну, етильну, нпропільну, ізопропільну, н-бутильну, ізобутильну, втор-бутильну і трет-бутильну групу. Алкільна група з числом атомів вуглецю від чотирьох до семи в рамках винаходу означає лінійний або розгалужений алкільний залишок з числом атомів вуглецю від чотирьох до семи. Як приклад варто назвати н-бутильну, ізобутильну, Точно також найбільш переважні сполуки загальної формули (l), де R1, R2, R3, R4 і А мають приведені вище значення, тоді як А знаходиться в положенні с бензольного залишку. Положення А в бензольному залишку може бути відображене наступною формулою: 7 Найбільш переважні сполуки загальної формули (l), де R1, R2, R3, R4 і А мають приведені вище значення, тоді як R1 і R2 займають в фенільному кільці положення 2 і 3, а А знаходиться в положенні с бензольного залишку. Положення R1, R2 i А можуть бути представлені наступними формулами: 75369 8 де R1, R і R4 мають приведені вище значення, а) Y означає гідроксильну групу і X означає прийнятну відхідну групу, або навпаки б) Υ означає прийнятну відхідну групу, і X означає гідроксильну групу, і Ε означає нітрогрупу або групу формули -OR5, де R5 означає прийнятну захисну групу для гідроксильної групи, при цьому взаємодію проводять в інертному розчиннику в присутності прийнятної основи і, якщо це необхідно, у присутності сполуки одновалентної міді або двовалентної міді, одержуючи спочатку сполуки загальної формули (Vl) Крім того, розроблений спосіб одержання сполук загальної формули (l), який відрізняється, тим, що сполуки загальної формули (ll) де R1, R2, R4 і А і Е мають приведені вище значення i тоді [А] ця речовина у випадку, коли Ε означає нітрогрупу, у прийнятних умовах звичайними способами відновлюють з утворенням сполуки загальної формули (llа) де R1, R2, R4 і А мають приведені вище значення, в інертному розчиннику в присутності прийнятної основи і, якщо це необхідно, у присутності каталізатора міжфазного переносу вводять у реакцію зі сполукам загальної формули (lll), де Х1 означає прийнятну відхідну групу, і R3 має зазначене вище значення. Сполуки загальної формули (ll) являють собою нові речовини і їх можна одержати за аналогією з загальновідомими способами в результаті взаємодії сполуки загальної формули (lV) із сполукам загальної формули (V) де R1, R2 і R4 мають приведені вище значення, або [Б] у випадку, коли Ε означає групу формули O-R5, у прийнятних умовах звичайними способами видаляють захисну групу R5 з утворенням сполуки загальної формули (llб) 9 75369 10 або змінюються незначно. Підходящими для способу (ll)+(lll) (l) інертні розчинники представлені, наприклад, такими простими ефірами, як, наприклад, діетиловий ефір, моно- або диметиловий ефір гліколя, діоксан або тетрагідрофуран, або такими вуглеводнями, як бензол, толуол, ксилол, циклогексан або продукти перегонки нафти, або такими галогензаміщеними вуглеводнями, як дихлорметан, хлороформ, чотирьох-хлористий вуглець, а також диметилсульфоксидом, диметилформамідом, гексаметилR1, R2 і R4 мають приведені вище значення. триамідом фосфорної кислоти, етилацетатом, Сполуки загальної формули (ll) можуть бути піридином, триетиламіном або піколіном. Можна також отримані в результаті взаємодії сполуки також використовувати суміші названих розчиннизагальної формули (lV) із сполукою загальної фоків, у тому числі і з водою. Особлива перевага відрмули (Vll) дається дихлорметану, дихлорметану з водою, тетрагідрофурану, діоксану і діоксану з водою. Як основи для реакції (ll)+(lll) (l) підходять органічні аміни, зокрема такі триалкіламіни з числом атомів вуглецю в алкільних групах від одного до шести, як, наприклад, триетиламін або диізопропілетиламін, або такі гетероцикли, як піридин, метилпіперидин, піперидин або N-метилморфолін, такі гідроксиди або карбонати лужних або, відповідно, де лужноземельних металів, як, наприклад, гідроксид R1, R2, R4, A, X і Υ мають приведені вище знанатрію, гідроксид калію, карбонат натрію, карбонат чення, калію, або такі алкоголяти, як, наприклад, метилат при цьому взаємодію проводять в інертному натрію або етилат натрію. Особлива перевага відрозчиннику в присутності прийнятної основи і, якдається триетиламіну, піридину і гідроксиду нащо це необхідно, у присутності сполуки одновалетрію. У загальному випадку основи вводять у реантної міді або двовалентної міді. кцію в кількості від 0,1мол до 5мол, переважно від Відповідні винаходу способи можуть бути ілю1мол до 3мол, у кожному окремому випадку з розстровані, наприклад, наступною схемою реакцій: рахунку на 1моль сполук загальної формули (ll). Якщо це необхідно, спосіб (ll)+(lll) (l) може бути реалізований і в присутності каталізатора міжфазного переносу. Як каталізатор міжфазного переносу підходять, наприклад, солі четвертинного амонію, перевага віддається брому тетрабутиламонію. Як відхідна група Х1 підходить, наприклад, галоген, переважно це хлор. Взаємодії можуть бути проведені при нормальному тиску, але також і при підвищеному або при зниженому тиску (наприклад, у межах від 0,5 до 3бар). У загальному випадку роботу проводять при нормальному тиску. Спосіб (ll)+(lll) (l) реалізують у температурному інтервалі від 0°С до 100°С, переважно від 0°С до 30°С. У ролі прийнятних інертних розчинників для способів (lV)+(V) (Vl) і (lV)+(Vll) (ll) виправдало себе використання, наприклад, таких сполук: такі органічні розчинники, як, наприклад, діетиловий ефір, моно- або диметиловий ефір гліколя, діоксан або тетрагідрофуран, або такі вуглеводні, як бензол, толуол, ксилол, циклогексан або продукти перегонки нафти, або такі галогензаміщені вуглеводні, як дихлорметан, хлороформ, чотирьоххлористий вуглець, а також диметилсульфоксид, диметилформамід, N-метилпіролідон, гексаметилтриамід фосфорної кислоти, етилацетат, піридин, триетиламін або піколін. Можна також використовувати суміші названих розчинників, у тому числі і з водою. Особлива перевага віддаінертні розчинники в контексті винаходу являється піридину, N-метилпіролідону, диметилфорють собою такі розчинники, що не піддаються пемаміду і диметилсульфоксиду. ретворенням в обраних умовах протікання реакцій При необхідності, способи lV)+(V) (Vl) і 11 75369 12 534 і 1295, і, відповідно, цитована в цьому джерелі (lV)+(Vll) (ll) можуть бути реалізовані також у прилітература; Synthesis 1990. 1145-1147]. сутності сполуки одновалентної або двовалентної Несподівано відповідні винаходу сполуки поміді. Перевага віддається йодиду одновалентній казали цінний спектр фармакологічної активності, міді й оксиду двовалентної міді. що не можна було передбачати заздалегідь. На роль основ для способів lV)+(V) (Vl) і Вони виділяються як високоефективні агоністи (lV)+(Vll) (ll) підходять карбонати і бікарбонати каннабіноїдних рецепторів з високою метаболичлужних металів, зокрема карбонат натрію і калію, ною стабільністю i з високою біодоступністю при гідроксиди лужних металів, зокрема гідроксид наприйомі їх через рот. Відповідно до цього вони трію, або органічні аміни, зокрема такі триалкілаособливо добре підходять для оральної терапії. міни з числом атомів вуглецю в алкільних групах У якості єдиних лікарських засобів або в поєдвід одного до шести, як, наприклад, триетиламін. нанні з іншими лікарськими засобами вони можуть Особлива перевага віддається гідроксиду калію, бути використані для профілактики і лікування гідроксиду натрію і карбонату калію. гострих і/або хронічних больових синдромів [їх У загальному випадку основи вводять у реаккласифікація представлена в "Classification of цію в кількості від 0,1мол до 5мол, переважно від Chronic Pain, Descriptions of Pain Syndromes and 1мол до 3мол, у кожнім окремому випадку з розраDefinitions of Pain Terms", 2-е вид., Мески і Бегдак, хунку на 1моль сполук загальної формули (lV) або, iASP-Press, Сіетл, 1994], а також нейродегенеравідповідно, (V). тивних захворювань, зокрема для лікування болю, Для ролі відхідної групи X у способі викликаного раковими захворюваннями, і таких (lV)+(V) (Vl) у варіанті а) і, відповідно, Υ у способі хронічних нейропатичних больових синдромів, як, (lV)+(V) (Vl) у варіанті б) підходить, наприклад, наприклад, при діабетичній нейропатії, постгерпегалоген або така сульфонатна група, як, наприсній невралгії, ушкодженнях периферичних нервів, клад, трифлатна. Перевага віддається фтору, при центральних болях (наприклад, як наслідок хлору або брому. церебральної ішемії) і тригемінальній невралгії, і Взаємодії можуть бути проведені при нормапри такому іншому хронічному болю, як, наприльному тиску, але також і при підвищеному або клад, люмбаго, біль у спині або ревматичний біль. при зниженому тиску (наприклад, у межах від 0,5 Поряд з цим, дані речовини підходять також для до 5бар). У загальному випадку роботу проводять терапії первинних гострих больових синдромів при нормальному тиску. будь-якого походження і вторинних больових синРеакції проводять у температурному інтервалі дромів, що походять від них, а також для терапії від 20°С до 200°С, переважно від 100°С до 160°С. гострих больових синдромів, що перейшли в хроСпособи відновлення ароматичної нітрогруппи нічні. для стадії процесу (lV) (llа) відомі [наприклад, це Для комбінування з відповідними з винаходом R.C.Larock, "Comprehensive Organic сполуками з метою лікування гострих і/або хронічTransformations", Нью Йорк, 1989, с.411-415, і циних больових синдромів підходять, наприклад, тована в цьому джерелі література]. опіати, наприклад, трамадол, морфін, дигідрокодеВведення захисних груп для гідроксильних їн, декстропропоксифен, трицикличні антидепрефункцій, а також способи їхнього Відщеплення санти, наприклад, амітриптилін, антиконвульсанти, відомі [наприклад, T.W.Green, P.G.M.Wuts, наприклад, карбамазепін, габапентин, нестероїднї "Protective Groups in Organic Synthesis", 2-і изд. протизапальні засоби, наприклад, аспірин, ібупНью Йорк. 1991, і цитована в цьому джерелі літерофен, напроксен, включно Сох-2-інгібітори, наратура; J. Org. Chem. 1999, 64, 9719-9721]. 5 приклад, рофекоксиб, целекоксиб. Як захисну групу R для реакційної послідовТочно також підходять сполуки для терапії пеності (lV)+(V) (Vl) (llб) підходять, наприклад, рвинних і/або вторинних хворобливих станів мозметильна, бензильна, алільна, метоксиметильна, ку, наприклад, під час або після церебральних 2-триметилсиліл-етоксиметильна або триметилсисудинних спазмів, мігрені, гіпоксії і/або аноксії, які лільна групи. Перевага віддається метильній і бене мають названого вище генеза, перинатально нзильній групам. асфіксії, аутоімунних захворювань, захворювань, Сполуки загальної формули (lll) можуть бути пов'язаних з обміном речовин, або захворювань придбані комерційними шляхом, вони відомі з ліорганів, що можуть мати походження від ушкотератури або можуть бути синтезовані відомими з джень мозку, а також ушкоджень мозку внаслідок літературних джерел способами [порівн., наприпервинних захворювань мозку, наприклад, судомклад, J. Chem. Soc. З 1968. 1265; Chem. Ber. 1967, них станів і атеро-і/або артеріосклеротичних змін. 100. 1696: фторовані хлориди алкансульфокислот Сполуки відповідно до винаходу підходять також можуть бути отримані, наприклад, відповідно до для лікування таких хронічних або психічних недузаявки на міжнародний патент №А-98/37061 або гів, як, наприклад, депресія, виразка шлунка, таких заявки на патент ФРН №А-1942264]. нейродегенеративних захворювань, як, наприклад, Сполуки загальних формул (lV), (V) і (Vll) відохвороба Альгеймера, Паркінсона або Хантингтона, мі або ж вони можуть бути отримані відомими спорозсіяний склероз, аміотрофічний латеральний собами. склероз, дегенерація нервів у результаті гострих Сполуки загальних формул (lV) і (V) можуть і/або хронічних вірусних або бактеріальних інфекбути придбані комерційними шляхом, вони відомі з цій і мультиінфарктної деменції. літературних джерел або вони можуть бути отриКрім того, вони можуть бути використані в лімані за аналогією з відомими з літератури спосокарських засобах для лікування блювоти, нудоти, бами [порівн., наприклад, J.March, "Advanced глаукоми, астми, анорексії, конвульсій, ревматизOrganic Chemistry", 4-е вид., Уайлі, 1992, с.з. 531 13 75369 14 му, загальмованості і порушень рухових функцій. (25ммоль/л трифосфату, pH 7,8 з 2ммоль/л дитіоРечовини відповідно до винаходу підходять треїтолу, 10% гліцерину, 3% Тритону Х100). Відратакож для лікування захворювань, викликаваних зу після цього додають розчин субстрату для любактеріальною і/або вірусною інфекцією, внаслідок циферази (2,5ммоль/л аденозинтрифосфату, прямих і/або опосередкованих змін імунної систе0,5ммоль/л люциферину, 0,1ммоль/л коферменту ми або, відповідно внаслідок порушень регуляції А, 10ммоль/л трицину, 1,35ммоль/л сульфату магза участю імунної системи, наприклад, при локанію, 15ммоль/л дитіотреїтолу, pH 7,8), швидко льних або системних аутоімунних захворюваннях струшують і визначають активність люциферази в (наприклад, Lupus erythematodes у всіх її варіансистемі камер Хамаматцу. тах), при запальних і/або , що мають аутоімунне Для інактивації Gj-білків піддослідні культури походження захворюваннях суглобів (наприклад, перед проведенням досліду обробляють протягом при первинному хронічному поліартриті, при запа16 годин дією 5нг/мол (кінцева концентрація) токленнях, обумовлених травмами), при запальних сину pertussis. і/або, що мають аутоімунне походження захворюЗначення концентрацій інгібування lC50 розраваннях кісткового і м'язового апарата, при запальховують за допомогою програми GraphPadPrism них і/або, що мають аутоімунне походження пато(Рівняння Хілла, версія: one-site competition). логічних процесах у внутрішніх органах Речовина за прикладом 17 показує в цьому (наприклад, при хворобі Крона, виразковому коліті, досліді значення lC50 рівне 0,81нмоль/л. гломерулонефриті), у зовнішніх органах (напри2. Дослід на hСВ2-люцифеоази репортерного клад, при алергійних реакціях на антигени, що нагена пацюків дходять з повітрям,) і в центральній нервовій сисПроводять стабільну трансфекцію клітин темі (наприклад, при розсіяному склерозі, хворобі СНОluс9 СВ2-рецептором людини. Трансфекцію, Альцгеймера, психічних захворюваннях), а також в селекцію клонів і вирощування досліджуваного органах чуття, при первинних і/або вторинних і/або матеріалу проводять за аналогією з роботами на аутоімунних захворюваннях кровотворної системи СВ1-рецепторі пацюків. Для фармакологічної хаі самої імунної системи (наприклад, при реакціях рактеризації клітин і для іспиту речовин викорисвідторгнення, при СНlД), а також при захворювантовують наступну далі послідовність експерименнях шкіри запального і/або імунологічного похотальних операцій. Основні культури вирощують у дження в людині і тварин. Крім того, ці речовини 50% модифікованому Дальбекко середовищі мають вплив при опосередкованих симптомах цих lгл/50% F-12 (DMEM/F12) з 10% FCS при 37°С в захворювань, наприклад, біль. Переважно їх викоатмосфері з 10% діоксидом вуглецю й у кожному ристовують для лікування болю, спазмів, церебокремому випадку після закінчення терміну від ральних ішемій і травм черепа/мозку. двох до трьох днів поділяють їх як 1:10. ПіддослідДія відповідних сполук in vitro на каннабіноїдні ні культури висівають по 5000 клітин на комірку, рецептори може бути проілюстрована наступними використовуючи пластинки з 96 комірками, у серебіологічними дослідженнями. довище DMEM/F12 з 5% FCS і дорощують їх про1. Дослід на СВІ-люиисЬеоззі репортеоного тягом 70 годин при 37°С. Після цього культури гена пацюків відокремлюють від середовища і заміняють його Основні культури Репортер лінії клітин пацювільним від сироватки середовищем Ultra-CHO ків-СНОСВ1 одержують по описаній у заявці на (Bio-Whittaker). Розчинені в диметилсульфоксиді міжнародний патент №А-98/37061, с 55 і їв., меторечовини (кінцева концентрація 200х) за допомодиці. гою піпетки додають до піддослідних культур (макДля скринінгу речовин використовують настусимальна кінцева концентрація диметилсульфокпну далі послідовність експериментальних операсиду в досліджуваній суміші дорівнює 0,5%) і через цій. Основні культури вирощують у 50% модифіко20 хвилин додають форсколін. Після цього інкубуваному Дальбекко середовищі !гл/50% F-12 ють культури в на протязі трьох з половиною годин (DMEM/F12) з 10% FCS при 37°С в атмосфері з у камері для вирощування при 37°С. Потім вида10% діоксиду вуглецю й у кожному окремому виляють супернатанти, а клітини лізують за допомопадку після закінчення терміну від двох до трьох гою 25мкл лізуючого реагенту (25ммоль/л трифоднів поділяють їх як 1:10. Піддослідні культури сфату, pH 7,8 з 2ммоль/л дитіотреїтолу, 10% висівають по 5000 клітин на комірку, використовугліцерину, 3% Тритону ХІ00). Відразу після цього ючи пластинки з 96 комірками, і дорощують їх прододають 50мкл розчину субстрату для люцифератягом 70 годин при 37°С. Після цього культури зи з подвоєною концентрацією (5ммоль/л аденообережно промивають сольовим розчином з фосзинтрифосфату, 1ммоль/л люциферину, фатним буфером і приводять у вихідний стан за 0,2ммоль/л коферменту А, 10ммоль/л трицину, допомогою вільного від сироватки середовища 1,35ммоль/л сульфату магнію, 15ммоль/л дитіотUttra-CHO (Bio-Whittaker). Розчинені в диметилсуреїтолу, pH 7,8), швидко струшують і визначають льфоксиді речовини однократно розбавляють у активність люциферази у вимірювальній системі середовищі і за допомогою піпетки додають до камер з фотопомножувачем (Хамаматцу). піддослідних культур (максимальна кінцева концеЗначення концентрацій інгібування 1Сзо рознтрація диметилсульфоксиду в досліджуваній сураховують за допомогою програми міші дорівнює 0,5%). Через 20 хвилин додають GraphPadPrism (Рівняння Хілла, версія: one-site форсколін і після цього інкубують культури протяcompetition). гом трьох годин у камері для вирощування при 3. Зв'язування з кортикальними мембранами 37°С. Потім видаляють супернатанти, а клітини пацюків лізують за допомогою 25мкл лізуючого реагенту По стандартним методикам готують мембран 15 75369 16 ний білок з різних тканин або, відповідно, клітин. Метаболична стабільність сполук відповідно За допомогою піпетки одержують суміш буфера, до винаходу може бути визначена за допомогою міченого ліганда, диметилсульфоксида або дослімікросом печінки пацюка [за аналогією з J. джуваної речовини, потім додають 100мкг білка, Pharmacol. Exp. Ther. 1997, 253, 46-58]. Для визнадобре перемішують суміш і інкубують у водяній чення микросомальної стабільності і розрахунку на лазні протягом 60 хвилин при 30°С. Після закіноснові ефекту первинного перетворення в печінці чення часу інкубації реакцію зупиняють додаван(реакції фази l) максимально можливої біодоступням у кожну трубочку охолодженого в льоді інкуності (Fmax) інкубують речовину в невеликій конбаційного буфера. Після фільтрування центрації з микросомальним білком протягом 15 промивають, використовуючи 3/4мол інкубаційного хвилин з додаванням кофакторів при 31°С. інкубабуфера. Фільтри переносять у мініфлакони, радіоцію і відбір проб проводять на модифікованому активність визначають у рідинному сцинтиляційавтоматі фірми Канберра Пакард. ному лічильнику. Як показує порівняння з прикладом із завки на Метаболічна стабільність сполук відповідно до міжнародний патент №А-98/37061, що сполуки винаходу може бути показана за допомогою навідповідно до винаходу в цьому досліді більш меступних далі дослідів in vitro. таболiчно стабільні. 4. Вивчення микросомальної стабільності Таблиця 1 Приклад 304 із заявки на міжнародний патент №А-98/37061 Приклад 15 Приклад 17 Біодоступність сполук відповідно до винаходу, а також інші фармакокінетичні параметри можуть бути визначені in vivo наступним чином. 5. Фармакокінетика в пацюку а) Внутрішньовенна інфузія Речовину вливають за допомогою бранули безпосередньо в кровоток через латеральну вену хвоста протягом 15 хвилин. Для точного введення обраної дози й об'єму використовують калібрований шприц на 20мл. Для інфузії використовують насос виробництва Браун Мельзунген №152440/1. б) Пероральне введення Дозу речовини вводять у виді болюсу через шлунковий зонд. в) Відбір проб і дослідження крові і плазми Проби крові відбирають у тварин з катетером (яремна вена) у гепаринізовані трубочки. Кров центрифугують і відповідним чином готують плазму для аналітичного дослідження (рідинна хроматографія з мас-спектроскопією, масспектроскопія). До проведення аналізу плазму зберігають при температурі менш -15°С г) Результати фармакокінетичних досліджень Микросомальні дані (мікросоми печінки пацюка) дозволяють припустити максимально можливу біодоступність до 100%. Отримані в дослідах in vivo (на пацюках) фармакокінетичні параметри для прикладу 22: Пероральні дані (доза 3мг/кг): AUCnorm 0,102кггодина/л, Cmax,norm - 0,0198кг/л, tmax - 2,29г, t½ - 2,36г, F - 33%. Внутрішньовенні дані (доза 0,3мг/кг): AUCnorm 0,307кг-година/л, Cmax,norm - 0,5978кг/л, Vss - 4,12/кг, R1 СН3 31 Η R2 СН3 СН3 OCF3 Fmax [%] 2 4 40 t½ - 1,64. Прийняті позначення: AUCnorm приведена до дози 1мг/кг поверхня під криво, залежності концентрації в плазмі від часу; Cmax,norm - приведена до дози 1мг/кг максимальна концентрація в плазмі після однократного введення; tmax - час, протягом якого досягається максимальна концентрація в плазмі після однократного введення; t½ - час напіввиведення; F - біодоступність, у даному випадку це частка від дози у відсотках, що має системну дію в порівнянні з внутрішньовенним введенням; Vss - ефективний об'єм розподілу в стаціонарному стані. Дія in vivo сполук відповідно до винаходу може бути представлена, наприклад, у , наступних далі дослідах на тваринах. 6. Гіпотермія (на пацюках) Ефект агонізму in vivo на СВ1-рецептор демонструється в експерименті на гіпотермію на пацюку. Через п'ять хвилин після визначення ректальної температури тіла за допомогою температурного зонда Oesophagus вводять (перорально) досліджувану речовину. Контрольна група одержує також перорально тільки розчинник для досліджуваних речовин (Cremophore EL 1-10% + дистильована вода). Температуру тіла вимірюють через 120 і 240 хвилин після перорального введення. Чисельність групи для кожного дозування складає 5-7 тварин (пацюків). 17 Гіпотермія на пацюках - ефект агонізму 75369 18 або ніс, наприклад за допомогою аерозоля, або зовнішньо через шкіру. У загальному випадку виявилося, що для доПриклад EU-10сa) [мг/кг] сягнення ефективних результатів найкраще вво22 10 дити речовини в кількостях від приблизно 0,001 до 10мг/кг, при введенні через рот переважно від а) Ефективна доза для зниження температури приблизно 0,005 до 1мг/кг маси тіла. тіла на 1°С Проте в окремих випадках може з'явитися необхідність у відхиленні від названих кількостей, а Можливість використання сполук відповідно до саме, у залежності від маси тіла або, відповідно, винаходу для лікування больових синдромів може від способу введення, від індивідуальної реакції на бути продемонстрована наступними далі дослідамедикамент, від виду його лікарської форми і від ми на тварин. часу або, відповідно, від інтервалу часу, коли від7. Аксотомія розгалужень сідничного нерва на бувається його введення. Так, наприклад, у деяких пацюках (модель хронічного болю) випадках можна брати менше, ніж зазначені мініПри анестезії за допомогою пентабарбиталу мальні кількості, тоді як в інших випадках прихопрепарують трифуркацию сідничного нерва, після диться перевищувати названі вище верхні межі. У перев'язування нервів поруч з аксотомованою дівипадку використання підвищених кількостей можлянкою аксотомують відгалуження малогомілковона рекомендувати розподіл їх на кілька окремих го нерва і великогомілкового нерва. На контрольдоз протягом дня. Визначення часу утримання них тваринах проводять симуляцію операції. Після вихідних сполук і одержуваних речовин за допомооперації в аксотомованих тварин розвивається гою ВЕРХ проводять у наступних умовах: хронічна механічна гіпералгезія. Цю гіпералгезію Стовпчик: Kromasil 3 18 60*2; об'єм проби, що визначають за допомогою датчика тиску (електвводиться, 1,00мкл; швидкість подачі 0,75мл/хв; ронний анестезіометр Фрея виробництва ПТС lnc.елюент: А=0,01моль/л фосфорної кислоти у воді, Life Science instruments, Woodiand Hills, CA, США) Б=ацетонітрил; градієнт [t(xb) - А/Б]: 0 - 90/10; 0,5 у порівнянні з тваринами, на яких операція тільки 90/10; 4,5 -10/90, 6,5 -10/90, 7,5 - 90/10. симулювалася. Використовувані скорочення Введення речовин здійснюють у різні періоди ДХМ дихлорметан часу перед виміром больового ефекту при різних ЕА етилацетат способах уведення (внутрішньовенно, інтрапериЦТ циклогексан тонеально, перорально, i.t, i.c.v., трансдермально). ИЕР іонізація електророзпиленням Речовина за прикладом 22 знижує гіпералгеИЕУ юызащя при електронному ударі зію в модельному досліді при мінімальній ефектиПХИ пряма хімічна іонізація вній дозі 1мг/кг, перорально ( введення за 60 хвиRf показник утримання при тонкошаровій лин перед дослідом).хроматографії Можливість використання сполук відповідно до Rt час утримання (при ВЕРХ) винаходу, наприклад, для лікування нейродегенеMM молекулярна маса ративних захворювань може бути показана в моВихідні сполуки дельному досліді перманентної фокальної церебПриклад І ральної ішемії на пацюках (МСА-О) або в 3-Метокси-1-(3-метил-2-нітрофенокси)бензол модельному досліді субдуральної гематоми на (Синтез дифенілових ефірів, спосіб А) пацюках (SDH) (заявка на міжнародний патент До приблизно 600мл піридину додають 14,7г №А-98/37061, с.60.). (96,0ммоль) 3-метил-2-нітрофенолу, 53,9г Нові активні речовини можуть бути відомими (288ммоль) 3-броманізолу і 18,3г (96,0ммоль) карспособами переведені в такі звичайні лікарські бонату калію і нагрівають до температури близько форми, як таблетки, драже, пігулки, грануляти, 140°С. Суміші дають небагато знову охолонути і аерозолі, сиропи, емульсії, суспензії і розчини, з додають 18,3г (96ммоль) йодиду одновалентної використанням інертних, нетоксичних, прийнятних міді. Реакційну масу близько 60 годин перемішуз фармацевтичної точки зору носіїв або розчинниють при температурі близько 140°С. Після видаків. лення розчинника у вакуумі залишок розчиняють у Для цього терапевтично ефективна сполука в толуолі і знову упарюють. Залишок розчиняють в кожному окремому випадку повинна знаходитися в дихлорметані і фільтрують через інфузорну земконцентрації від приблизно 0,5 до 90мас.% від лю. Після промивання невеликою кількістю дихлозагальної суміші, тобто в кількостях, що достатні рметану послідовно промивають 5н соляною кисдля досягнення зазначених меж дозування. лотою, 2н розчином гідроксиду натрію, 5н соляною Лікарські форми одержують, наприклад, розкислотою, водою і розчином хлориду натрію. Після веденням активних речовин розчинниками і/або сушіння над сульфатом магнію упарюють у вакуумі носіями з застосуванням, якщо це необхідно, емуй очищають отриманий сирий продукт перегонкою льгаторів і/або диспергаторів, причому у випадку з кульковим дефлегматором. використання, наприклад, як розріджувача води, Вихід 3,50г (13%; чистота за даними ВЕРХ можуть бути також використані органічні розчинни94%). ки в якості солюбілізаторів. Значення Rf 0,28 (циклогексан/етилацетат Введення проводять звичайними способами, 5:1). переважно через рот, через шкіру або парентераМас-спектр (іонізація при електронному ударі): льно, зокрема перорально або внутришньовенно. 259 (100%, [М]+). Можливо також інгаляційне введення через рот 19 75369 20 ВЕРХ: час утримання 4,94хв. йонних часток) = 3,72 (с., 3Н), 6,62-6,87 (м., 3Н), 1 7,08 (д., J=8Гц, 1Н), 7,33 (т., J=8Гц, 1Н), 7,44 (д., Н-ЯМР (300МГц, дейтерохлороформ): (міJ=8Гц, 1Н), 7,57 (т., J=8Гц, 1Н). льйонних часток) = 2,37 (с., 3Η), 3,78 (с., 3Н), 6,1Приклад IV 6,65 (м., 2Н), 6,67-6,74 (м., 1Н), 6,83 (д., J=8Гц, 1-[2-хлор-3-(трифторметил)фенокси]-31Н), 6,99 (д., J=8Гц, 1Н), 7,14-7,32 (м.,2Н). нітробензол (Синтез дифенілових ефірів, спосіб Г) Приклад ІІ В атмосфері аргону до 10мл диметилформа3-метокси-1-[2міду додають 1,00г (5,09ммоль) 2-хлор-3(трифторметил)фенокси]бензол (трифторметил)фенолу, 0,72г (5,09ммоль) три(Синтез дифенілових ефірів, спосіб Б) фторнітробензолу і 0,70г (5,09ммоль) карбонату До приблизно 450мл піридину додають 50,0г калію. Суміш приблизно 16 годин кип'ятять зі зво(222ммоль) 2-бромбензотрифториду, 27,6г ротним холодильником. Після охолодження дода(222ммоль) 3-метоксифенолу і 30,7г (222ммоль) ють до реакційної маси 50мл 2н гідроксиду натрію і карбонату калію і нетривалий час нагрівають при перемішують ще одну годину, потім додають 20мл температурі близько 100°С. Дають небагато знову розчину хлориду натрію і перемішують ще 30 хвиохолонути і додають 17,7г (222ммоль) оксиду дволин. Потім екстрагують дихлорметаном, сушать валентної міді. Реакційну масу близько 48 годин органічну фазу над сульфатом магнію й упарюють перемішують при нагріванні зі зворотним холодиу вакуумі. Очищення проводять хроматографією льником (температура лазні близько 140°С). Після на силікагелі, використовуючи як рухливу фазу видалення розчинника у вакуумі залишок розчициклогексан/етилацетат 20:1, одержують 0,69г няють у дихлорметані і струшують з 2н соляною (42%; чистота за даними ВЕРХ 100%) цільової кислотою. Після цього органічну фазу промивають сполуки. 1н розчином гідроксиду натрію і водою. Після суЗначення Rf 0,39 (циклогексан/етилацетат шіння над сульфатом магнію упарюють у вакуумі й 2:1). очищають отриманий сирий продукт перегонкою з Мас-спектр (іонізація при електронному ударі): кульковим дефлегматором. 317 (100%, [М]+). Вихід 37,2г (62%; чистота за даними ВЕРХ ВЕРХ: час утримання 5,22хв. 98%). 1 Значення Rf 0,47 (циклогексан/етилацетат Н-ЯМР (300МГц, d6-диметилсульфоксид): 5:1). (мільйонних часток) = 7,51 (д.д., J=8Гц, 2Гц, 1Н), Мас-спектр (іонізація при електронному ударі): 7,56-7,83 (м., 5Н), 8,05 (д.д., J=8Гц, 2Гц, 1Н). 268 (100 %, [М]+). Наступні далі приклади V-Χlll одержують по ВЕРХ: час утримання 5,14хв. аналогічних схемах у відповідності зі способами 1 одержання вихідних сполук А або Б з відповідних Н-ЯМР (200Мгц, дейтерохлороформ): (мільвихідних продуктів. йонних часток) = 3,79 (сю, 3Η), 6,56-6,65 (м., 2Н), 6,71 (д.д.д., J=8Гц, 2Гц, 1Гц, 1Н), 6,97 (д., J=8Гц, 1Н), 7,17 (т., J=8Гц, 1Н), 7,25 (т., J=8Гц, 1Н), 7,46 (т.д., J=8Гц, 1Гц, 1Н), 7,66 (д., J=8Гц, 1Н). Приклад ІІІ 1-[2-ціано-3-(трифторметил)фенокси]-3метоксибензол (Синтез дифенілових ефірів, спосіб В) В атмосфері аргону до безводного диметилформаміду додають 10,7г (52,1ммоль) 2-хлор-6(трифторметил)бензонітрилу [приклад 5 у заявці на патент ФРН №А-3836159; 2-хлор-6(трихлорметил)бензонітрил може бути отриманий з 2,6-диметилбензонітрила за прикладом 3 у заявці на патент ФРН №А-2214058], додають 7,19г (52,1ммоль) карбонату калію і 6,46г (52,1ммоль) 3метоксифенолу і 5 годин перемішують при 100°С. Після цього додають 500мол 2н гідроксиду натрію і 200мл насиченого розчину хлориду натрію. Два рази екстрагують ефіром приблизно по 300млл, сушать об'єднані органічні фази над сульфатом магнію, упарюють у вакуумі і проводять флешхроматографію на 450г силікагелю, використовуючи як рухливу фазу толуол. Фракції з продуктом упарюють до сухого стану і додають до олії, що залишається, небагато ефіру, залишають для кристалізації, відсмоктують і промивають пентаном. Вихід 9,36г (57%; чистота за даними ВЕРХ 96%). Значення Rf 0,39 (толуол). Температура плавлення 68°С ВЕРХ: час утримання 4,89хв. 1 Н-ЯМР (200Мгц, дейтерохлороформ): (міль 21 75369 22 нагрітися до кімнатної температури. Реакційну суміш виливають у 300мл води з льодом, три рази екстрагують суміш дихлорметаном, органічну фазу два рази промивають насиченим розчином бікарбонату натрію й один раз розчином хлориду натрію. Сушать над сульфатом магнію і проводять очищення за допомогою флеш-хроматографії на приблизно 400г силікагелю з дихлорметаном. До отриманого маслянистого продукту додають пентан і залишають для кристалізації. Вихід 7,75м (96%, чистота за даними ВEРХ 96%). Значення Rf 0,16 (дихлорметан). Температура плавлення 108°С. ВEРХ: час утримання 4,41хв. 1 Н-ЯМР (300Мгц, дейтерохлороформ): (мільйонних часток) = 5,13 (c., 1Η), 6,59-6,78 (м., 3Н), 7,11 (д., J=8Гц, 1Н), 7,28 (т., J=8Гц, 1Н), 7,45 (д., J=8Гц, 1Н), 7,58 (т., J=8Гц,1Н). Приклад XVI 3-[2-хлор-3-(трифторметил)фенокси]фенол (Відщеплення метильної групи в простому ефірі, спосіб В) У 6мл крижаної оцтової кислоти розчиняють 600мг (1,98ммоль) 3-метокси-1-[2-хлор-3(трифторметил)фенокси]бензолу, додають 3,60мл Приклад XlV 48% водної бромводневої кислоти і 4 години кип'я3-(3-Метил-2-нітрофенокси)фенол тять зі зворотним холодильником. Після охоло(Відщеплення метильної групи в простому дження розбавляють водою й екстрагують етилаефірі, спосіб А) цетатом. Органічні фази три рази промивають В атмосфері аргону до 2мл безводного дихловодою, сушать над сульфатом магнію й упарюють рметану додають 500мг (1,93ммоль) 1-метокси-3у вакуумі. Хроматографією на силікагелі із суміш(3-метил-2-нітрофенокси)бензолу і охолоджують шю дихлорметан/циклогексан 2:1 як рухливою розчин до -20°С. При цій температурі додають фазою одержують 484мг (81%, чистота за даними 5,8мл розчину триброміду бора в дихлорметані з ВЕРХ 96%) цільової сполуки. концентрацією 1моль/л. Температурі дають підняЗначення Rf 0,39 (циклогексан/етилацетат тися до 0°С i перемішують 1 годину. Після дода2:1). вання води три рази екстрагують дихлорметаном. Мас-спектр (іонізація при електронному ударі): Об'єднані органічні фази промивають розчином 288 ([М]+). бікарбонату натрію, сушать над сульфатом магнію ВЕРХ: час утримання 4,80хв. 1 й упарюють у вакуумі. Після очищення хроматогН-ЯМР (300Мгц, d6-диметилсульфоксид): рафією на силікагелі із сумішшю циклогек(мільйонних часток) = 6,37 (т., J=2Гц), 6,44 (д.д.д., сан/етилацетат 30:1 як рухлива фаза одержують J=8Гц, 2Гц, 1Гц, 1Н), 6,59 (д.д.д., J=8Гц, 2Гц, 1Гц, 424мг (89%) цільової сполуки. 1Н), 7,20 (т., J=8Гц, 1Н), 7,39 (д.д., J=8Гц, 1Гц, 1Н), Значення Rf 0,18 (циклогексан/етилацетат 7,56 (т., J=8 ц, 1Н), 7,68 (д.д., J=8Гц, 1Гц, 1Н), 9,69 2:1). (с, 1Н). Мас-спектр (іонізація при електронному ударі): Приклад XVII 245 ([М]+). 3-[3-(Трифторметил)фенокси]фенол ВЕРХ: час утримання 4,40хв. (Відщеплення бензильної групи в простому 1 Н-ЯМР (300Мгц, дейтерохлороформ): (мільефірі, спосіб Г) йонних часток) = 2,37 (c., 3Н), 4,88 (ш.с, 1Н), 6,54 В апаратурі для гідрування в 135мл тетрагід(т., J=2Гц, 1Н), 6,57-6,66 (м., 2Н), 6,85 (д., J=8Гц, рофурану і 15мл етанолу суспендують 1,70г 1Н), 7,01 (д., J=8Гц, 1Н), 7,19 (т., J=8Гц, 1Н), 7,27 (4,72ммоль) 3-бензилокси-1-[3(т., J=8Гц, 1Н). (трифторметил)фенокси]бензолу і після додаванПриклад XV ня 170мг 10% паладію на вугіллі протягом ночі 3-[2-ціано-3-(трифторметил)фенокси]-фенол гідрують при нормальній температурі і тиску водню (Відщеплення метильної групи в простому 1атм. Для виділення продукту відфільтровують ефірі, спосіб Б) каталізатор через інфузорну землю, фільтрат упаВ атмосфері аргону в безводному дихлормерюють і флеш-хроматографують на 130г силікагетані розчиняють 10,0г (34,1ммоль) 1-(2-ціано-3лю з градієнтом циклогексан/етилацетат від 10:1 трифторметилфенокси)-3-метоксибензолу і додадо 1:1. ють 13,9г (37,5ммоль) йодиду н-тетрабутиламонію. При видаленні розчинника одержують 1,27г Охолоджують до -78°С и повільно додають по кра(99%, чистота за даними ВЕРХ 95%) цільової споплях 120мл розчину трихлориду бора в дихлормелуки. тані з концентрацією 1моль/л, підтримуючи темпеЗначення Rf 0,28 (циклогексан/етилацетат ратуру не вище -70°С. Протягом двох годин дають 5:1). 23 75369 24 Мас-спектр (іонізація при електронному ударі): 1:1). 270 ([М]+). Мас-спектр (іонізація при електророзпиленні): ВЕРХ: час утримання 4,78хв. 288 (22 %, [М+Н]+). 1 ВЕРХ: час утримання 4,41хв. Н-ЯМР (200Мгц, дейтерохлороформ): (міль1 Н-ЯМР (300МГц, d6-диметилсульфоксид): йонних часток) = 4,97 (c., 1Η), 6,53 (т., J=2Гц, 1Н), 6,56-6,67 (м., 2Н), 6,85-7,01 (м., 3Н), 7,22 (т., J=8Гц, (мільйонних часток) = 5,28 (c., 2Η), 6,11-6,19 (м., 1Н), 7,34 (т., J=8Гц, 1Н). 2Н), 6,38 (д.д.д, J=8Гц, 2Гц, 1Гц, 1Н), 7,03 (т., Наступні далі приклади XVlll-XXV одержують J=8Гц, 1Н), 7,33 (д.д., J=8Гц, 1Гц, 1Н), 7,54 (т., аналогічно відповідно до методик А, В або Г. J=8Гц, 1Н), 7,63 (д.д., J=8Гц, 1Гц). Приклад XXVll 1-[2-ціано-3-(триаторметил)фенокси]-3гідроксибензол (Синтез дифенілового ефіру за методикою Д) У 170мл N-метилпіролідоне частково розчиняють 44,0г (0,4мол) резорцину, додають гідроксид калію [не менш, ніж 85%, 34,5г (0,52мол)] і після цього додають 2-хлор-6(трифторметил)бензонітрил [20,5г (0,1мол)]. Цю суміш 2,5 години перемішують при 60-65°С. Після додавання 300мл толуолу і 400мл води відокремлюють водну фазу і ще раз екстрагують 300мл толуолу. Об'єднані органічні фази сушать над сульфатом магнію і після фільтрації упарюють. Після екстракції маслянистого залишку 150мл води, фільтрації і висушування одержують злегка коричневаті кристали. Приклади одержання Вихід 22г (79% від теорії; порівняти з прикладом XV). Приклад 1 Приклад XXVl 3-[2-хлор-3-(триФторметил)фенокси]анілін В атмосфері аргону до 7мол метанолу додають 630мг (1,98ммоль) 1-[2-хлор-3-(трифторметил)фенокси]-3-нітробензолу, 625мг (9,09ммоль) форміату амонію і 31,5мг 10% паладію на вугіллі як каталізатору. Суміш 2 година нагрівають зі зворотним холодильником. Після охолодження фільтрують через інфузорну землю, промивають метанолом і упарюють фільтрат. Знову розчиняють в дихлорметані, три рази екстрагують водою, сушать органічні фази над сульфатом магнію і знову упарюють. Хроматографічною очисткою на силікагелі із сумішшю циклогексан/етилацетат 6:1 як рухливою фазою одержують 458мг (72%, за даними ВЕРХ чистота 90 %) цільової сполуки. Значення Rf 0,48 (циклогексан/етилацетат 3-[2-Ціано-3-(трифторметилфенокси]феніл4,4,4-трифтор-1-бутансульфонат (Синтез ефірів сульфокислот, спосіб А) В атмосфері аргону в 60мл дихлорметана розчиняють 7,70г (27,6ммоль) 3-[2-ціано-3(трифторметил)фенокси]фенолу, потім до цього розчину додають 4,32г (13,1ммоль) броміду тетрабутиламонію і 3,95мл 45% розчину гідроксиду натрію. При температурі 0°С відразу доливають розчин 6,64г (31,5ммоль) 4,4,4-трифторбутан-1сульфохлориду в 20мл дихлорметану. Розчин, що офарблюється в кольори від жовтого до оранжевого, перемішують протягом однієї години. Після цього розбавляють водою і три рази екстрагують дихлорметаном. Об'єднані органічні фази промивають розчином хлориду натрію і сушать над сульфатом магнію. Очищення проводять за допомогою флеш-хроматографії на 360г силікагелю, використовуючи послідовний градієнт концентрацій рухливої фази циклогексан/дихлорметан від 1:1 до 1:4. Після упарювання на роторному випарнику залишається маслянистий залишок, що кристалізується після додавання пентану. Вихід: перша фракція 9,21г (74%, чистота за даними ВЕРХ 100%), друга фракція 2,29г (18%, чистота за даними ВЕРХ 97%). Значення Rf 0,56 (дихлорметан). 25 75369 26 Температура плавлення 60-61°С. нти 4,4,4-трифторбутансульфохлориду і переміМас-спектр (іонізація електророзпиленням): шують ще три дні. Після цього реакційну масу три 454 ([М+Н]+). рази екстрагують 2н соляною кислотою й один раз ВЕРХ: час утримання 5,08хв. насиченим розчином хлориду натрію. Органічну 1 фазу сушать над сульфатом магнію й упарюють у Н-ЯМР (300Мгц, дейтерохлороформ): (мільвакуумі. При хроматографічному очищенні на силійонних часток) = 2,2-2,5 (м., 4Н), 3,39 (т., J=7Гц, кагелі із сумішшю дихлорметан/циклогексан 7:2 як 2Н), 7,0-7,3 ( м., 4Н), 7,50 (т., J=8Гц, 1Н), 7,53 (д., рухлива фаза одержують 96мг (54%, за даними J=8Гц, 1Н), 7,64 (д., J=8Гц). ВЕРХ чистота дорівнює 90%) цільової сполуки. Приклад 2 Значення Rf 0,33 (циклогексан/етилацетат 2:1). Мас-спектр (пряма хімічна іонізація/NН3): 479 (100 %, [M+NH4]+). ВЕРХ: час утримання 8,34хв. 1 Н-ЯМР (300Мгц, d6-диметилсульфоксид): (мільйонних часток) = 1,80-1,93 (м., 2Н), 2,31-2,50 (м., 2Н), 3,25 (т., J=8Гц, 2Н), 6,75 (д.д., J=8Гц, 2Гц, 1Н), 6,85 (т., J=2Гц, 1Н), 7,03 (д.д., J=8Гц, 1Гц), 7,38 (т., J=8Гц, 1Н), 7,43 (д.д., J=8Гц, 1Гц, 1Н), 7,58 3-(3-Метил-2-нітро-фенокси)феніл-н(т., J=8Гц, 1Н), 7,72 (д.д., J=8Гц, 1Гц, 1Н), 10,04 (с, пентансульфонат (Синтез ефірів сульфокислот, 1Н). спосіб Б) Наступні далі приклади від 4 до 24 одержують До 200мг (0,82ммоль) 3-(3-метил-2-нітроаналогічно відповідно до прикладів одержання по фенокси)фенолу в 5мл дихлорметану при кімнатметодиках А, Б або В з відповідних вихідних споній температурі спочатку додають 1мол 40% розлук. чину гідроксиду тетрабутиламонію, потім після перемішування протягом п'яти хвилин додають 153мг (0,90ммоль) н-пентансульфохлориду. Після перемішування протягом 1,5 години додають 0,5мол 10% розчину бікарбонату натрію, фільтрують суміш через картридж Extretut (3г) (Мерк, Дармштадт, номер для замовлення 115095) і кілька разів промивають картридж дихлорметаном. При хроматографічному очищенні на силікагелі із сумішшю циклогексан/етилацетат 30:1 як рухлива фаза, одержують 255мг (82%, за даними ВЕРХ чистота дорівнює 99 %) цільової сполуки. Значення Rf 0,35 (циклогексан/етилацетат 2:1). Мас-спектр (іонізація електророзпиленням): 380 (100 %, [М+Н]+). ВЕРХ: час утримання 5,29хв. 1 Н-ЯМР (300Мгц, дейтерохлороформ): (мільйонних часток) = 0,93 (т., J=7Гц, 3Н), 1,30-1,51 (м., 4 Н), 1,89-2,02 (м., 2Н), 2,39 (а, 3Н), 3,18-3,28 (м., 2Н), 6,85-7,42 ( м., 7Н). Приклад 3 N-{3-[2-хлор-3-(трифторметил)фенокси]феніл}4,4,4-трифторбутан-1-сульфонамід (Синтез аміду сульфокислоти, спосіб В) В атмосфері аргону в 1мл дихлорметану розчиняють 100мг (0,35ммоль) 3-[2-хлор-3(трифторметил)фенокси] аніліну. Додають 106мг (1,04ммоль) триетиламіну і розчин 77мг (0,37ммоль) 4,4,4-трифторбутан-1-сульфохлориду в 1мл дихлорметану і перемішують при кімнатній температурі. Через 4 дні додають ще 0,3 еквівале 27 75369 28 Приведені вище приклади характеризуються наступними далі даними спектрів 1Н ЯМР. Приклад 17 21 22 23 Спектри 1Н ЯМР (300МГц): /мільйонні частки Дейтерохлороформ; 2,17-2,42 (м., 4Н); 3,33 (т, J=7Гц, 2Н); 6,88 (т., J=2Гц; 1Н); 6,92-6,95 (м., 1Н); 7,01-7,05 (д.д.д., J=8Гц, 2Гц, 0,5Гц; 1Н); 7,09(д.д., J=8Гц, 2Гц, 1Н); 7,18-7,39 (м., 4Н) d6-диметилсульфоксид; 0,86 (т., 1=7Гц, 3Н); 1,24-1,43 (м., 4Н); 1,80 (квін., 2Н); 3,56 (т., J=7,5Гц, 2Н); 7,29-7,38 (м., 4Н); 7,61 (т., J=8Гц, 1Н); 7,77(д., J=7,5Гц, 1Н), 7,88 (т., J=8Гц, 1Н) d6-диметилсульфоксид; 2,02 (квін., 2Н); 2,46 (м., 2Н); 3,69 (т., J=7,5Гц, 2Н); 7,02-7,08 (м., 3Н); 7,17-7,20 (д.д., J=8Гц, 2 Гц, 1Н); 7,48-7,63 (м., 3Н); 7,72-7,75 (д.д., J=8Гц, 1Hz, 1H) d6-диметилсульфоксид; 0,86 (т., J=7Гц, 3Н); 1,33 (м., 4Н); 1,78 (квин., 2Н); 3,52 (т., J=7,5Гц, 2Н); 7,02-7,06 (м., 2Н); 7,15-7,18 (м., 1Н); 7,48-7,64 (м., 3Н); 7,72-7,75 (д.д., J=8Гц, 1Гц, 1Н) Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenoxyphenyl alkane sulfonates, a method for the preparation thereof and medicament based thereon
Автори англійськоюHeil, Markus, Voerste Arnd, Denzer Dirk
Назва патенту російськоюФеноксифенилалкансульфонаты, способ их получения и лекарственное средство на их основании
Автори російськоюФёрсте Арнд, Денцер Дирк
МПК / Мітки
МПК: A61K 31/18, A61P 37/02, A61P 25/04, A61P 25/18, A61P 25/06, A61P 1/04, A61P 11/06, C07B 61/00, A61P 25/00, A61P 29/00, A61P 27/06, A61P 25/20, A61P 25/28, A61P 1/08, C07C 309/00, A61P 9/10, A61P 25/08, C07C 303/00, C07C 311/09, A61P 25/16, C07C 311/08, A61P 1/14, A61K 31/277, A61K 31/255
Мітки: основі, лікарський, феноксифенілалкансульфонати, спосіб, засіб, одержання
Код посилання
<a href="https://ua.patents.su/14-75369-fenoksifenilalkansulfonati-sposib-kh-oderzhannya-ta-likarskijj-zasib-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Феноксифенілалкансульфонати, спосіб їх одержання та лікарський засіб на їх основі</a>
Попередній патент: Пристрій для одержання плазми, спосіб іонізації, застосування способу і застосування пристрою (варіанти)
Наступний патент: Поліморфні форми 5-[4-[2-[n-метил-n-(2-піридил)аміно]етокси] бензил] тіазолідин-2,4-діон малеату
Випадковий патент: Гранулятор