Застосування саратину для інгібування адгезії тромбоцитів
Номер патенту: 77402
Опубліковано: 15.12.2006
Автори: Барнес Крістофер, Фреч Маттіас, Хофманн Ув, Глейц Йоханнес, Стріттматтер Фольфганг
Формула / Реферат
1. Застосування поліпептиду Cаратину для виробництва медичних препаратів, для інгібування акумулювання тромбоцитів після ушкодження судини або ендартеректомії.
2. Застосування за п. 1, коли ушкодження судини пов'язане з атеросклерозом, васкулопатією серцевого трансплантата, коронарним рестенозом після коронарного втручання, балонною ангіопластикою, уведенням стента, ротаблацією, ендартеректомією, включаючи ендартеректомію сонної артерії, шунтуванням за допомогою діалізного трансплантата та інших трансплантованих анастомозів, нестабільною ангіною, гострим інфарктом міокарда, інсультом, легкою формою гіпертрофії або легкою формою простатичної гіпертрофії.
3. Спосіб інгібування адгезії тромбоцитів, при якому Cаратин призначають місцево через катетер або при якому Cаратин вводять у ендолюмінальну оболонку катетера, повернену місцево до тканини.
4. Спосіб за п. 3, при якому Cаратин вводять у полімер, який застосовують місцево і який забезпечує тривалий місцевий вихід Cаратину.
5. Спосіб за п. 4, при якому полімер, що містить Cаратин, призначають місцево через катетер.
6. Спосіб за п. 3, при якому Cаратин вводять у стент або покриття стента, що поміщають місцево на/або усередину тканини.
7. Спосіб за п. 3, при якому Cаратин уводять у внутрішньосудинний трансплантат або у покриття внутрішньосудинного трансплантата, що поміщають місцево на/або усередину тканини.
Текст
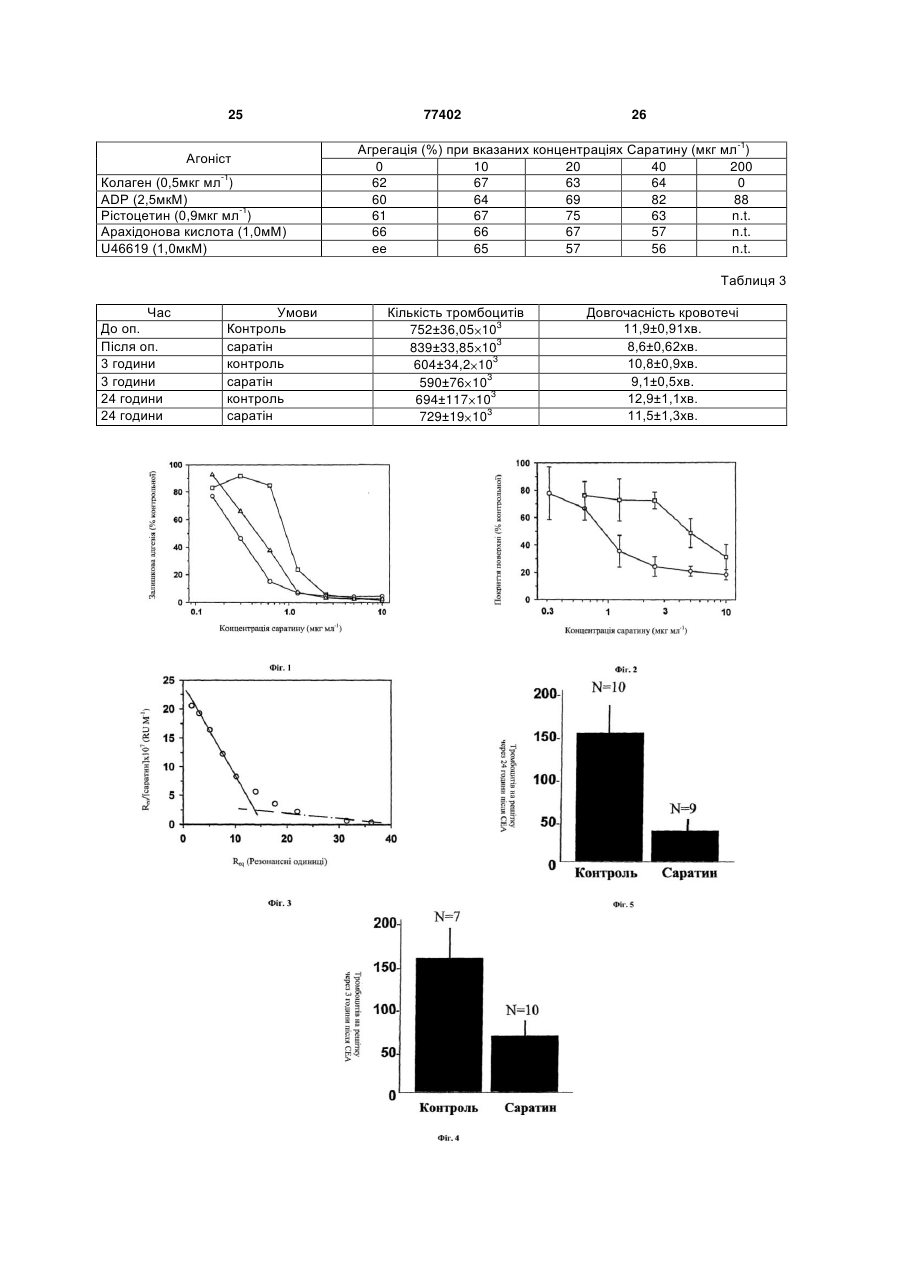
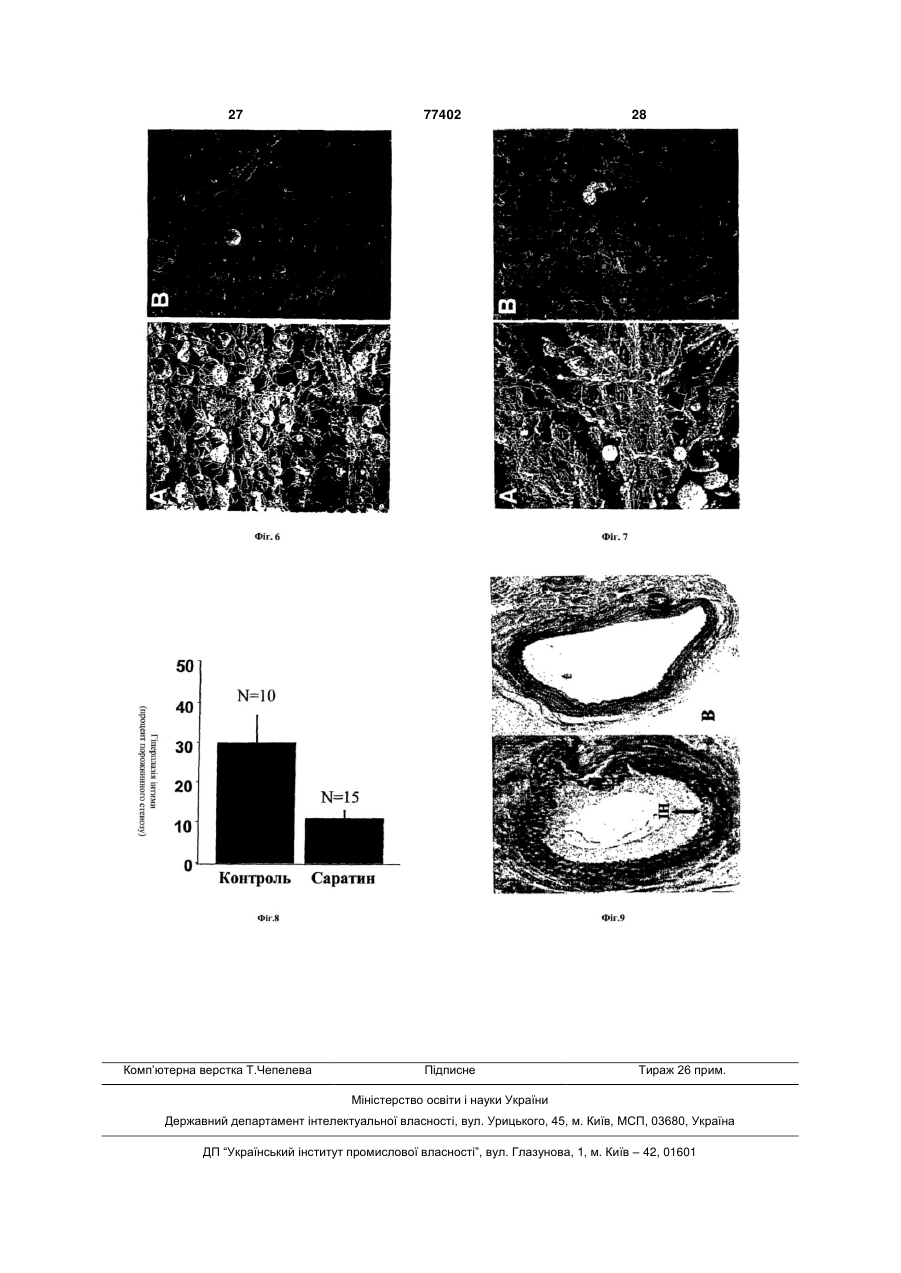
1. Застосування поліпептиду Cаратину для виробництва медичних препаратів, для інгібування акумулювання тромбоцитів після ушкодження судини або ендартеректомії. 2. Застосування за п. 1, коли ушкодження судини пов'язане з атеросклерозом, васкулопатією серцевого трансплантата, коронарним рестенозом після коронарного втручання, балонною ангіопластикою, C2 2 (19) 1 3 77402 4 хірургії, але приблизно в 30-40% пацієнтів, у яких водити до ускладнень, включаючи тромбоз та розспостерігалися явні поліпшення при первинному виток гіперплазії інтими, які обумовлюють ускладрозширенні артерії, згодом, через 3-9 місяців, винення, що зводять нанівець ефект від втручання, никає повторне звуження судини (рестеноз). Якщо або створюють нові проблеми. рестеноз виявляється у важкій формі, пацієнту Клінічні дослідження свідчать, що після ендарможе знадобитися повторна ангіопластика, часто теректомії сонної артерії, безпосередньо в післяоіз імплантацією стента, котрий у судині виконує пераційний період у 1-10% пацієнтів виникають функцію розпірки. інсульти, обумовлені, головним чином, утворенням В інших випадках може знадобитися реконсттромбів у зоні ендартеректомії з наступною церебрукція артерії за допомогою шунтивної хірургії, ральною емболізацією [Stroke 1984; 15; 950-55]. котра пов'язана із більш високим ризиком. Притім, Акумулювання тромбоцитів може також приводити що у світі щорічно проводиться більш 800 000 до рестенозу, пов'язаного з розвитком гіперплазії операцій РТСА, соціально-економічні наслідки цих інтими, який може виникати протягом двох років 30-40% випадків рестенозу стали об'єктом серйозпісля операції. Були повідомлення, що через 2-5 ного занепокоєння хірургів-кардіологів. років після ендартеректомії в 10-20% пацієнтів Рестеноз часто є результатом розтягання та виникає рестеноз, обумовлений гіперплазією інтизминання балоном стінки артерії, та існує можлими, потовщенням інтими та зменшенням діаметра вість, що направляючий провід катетерів, викориссудин - про це свідчить дуплексне ультразвукове товуваних у таких процедурах, у процесі розгорсканування сонної артерії [J. Vase. Surg. 1986; тання заподіє ушкодження та може привести до 3; 10-23]. проліферації клітин гладкої мускулатури артерії, На клітинному і молекулярному рівні, реакцією що обумовлює повторне закриття артерії ("рестестінки судини на механічні травми, хірургічне втруноз") через декілька місяців. чання, уведення стента, уведення трансплантоваЧерез можливі ускладнення, пов'язаних із ресної судини (артеріального або артеріальнотенозом та погрозою переміщення ембола від вивенозного трансплантата, тобто діалізного трансразкового атеросклеротичного ушкодження тканиплантата) є складна комбінація запалення, міграції ни, що пов'язано з важкими наслідками, клітин гладкої мускулатури, проліферації та транзастосування повторної ангіопластики в сонній сформації міофібробластів; ці явища виникають артерії суворо обмежено варіантами мінімального безпосередньо після травми [Futura 1997; p.289інвазивного втручання. 317]. Якщо в результаті захворювання артерія сиРаніше намагалися лікувати закупорку сонних льно ушкоджена, що може збільшуватися відклаартерій, які ведуть до мозку, шляхом втручань денням кальцію, втручання може також, у деякій іншого типу. мірі, обумовлювати додаткове ушкодження з осеЕндартеректомія сонної артерії - хірургічний редковою ендотеліалізацією та уразливість основметод усунення закупорки сонних артерій, і у суних компонентів позаклітинного матриксу, таких як динній хірургії США він використовується найчасколаген та еластин. У деяких пацієнтів поява надтіше. Результати випробувань, проведених у багалишку тромбоцитів та фібриногену може приводитьох центрах, продемонстрували ефективність цієї ти до гострої тромботичної закупорки. методики при лікуванні позачерепної сонної хвоДослідження, проведені на моделях пацюків роби як у симптоматичних пацієнтів, так і пацієнтів, після ендартеректомії сонної артерії [Neurosurg що не виявляють симптомів захворювання [JAMA 1985; 16: 773-79], а також на моделях емболекто1995; 273:1421-28; N Engl. J. Med. 1991; 325:445мії балонних ушкоджень [Lab. Invest 1983; 49: 32753], крім того, методи ендартеректомії використо33] показали, що при ушкодженні судини обдиравуються для лікування захворювань закупорки ються клітини ендотелію та починається адгезія судин, розташованих в інших місцях [Vase. Surg. тромбоцитів до незахищеного субендотелію. Ме1999; 33:461-70]. тодом скануючої електронної мікроскопії Spallone При ендартеректомії сонну артерію розрізають та ін. [Neurosurg 1985; 16: 773-79] установили, що та атеросклеротичне ушкодження тканини видачерез п'ять хвилин після ендартеректомії сонної ляють із судини через розріз. У хірургії здійснюють артерії в пацюка, в ушкодженій зоні формується роздвоєння сонної артерії через розріз у шиї пацімоношар тромбоцитів. Через п'ятнадцять хвилин єнта та поміщають затиски по обидва боки місця після травми спостерігається агрегація тромбоцизакупорки, щоб ізолювати його, потім роблять розтів та формування тромбів. Через тридцять хвиріз, щоб розкрити артерію. Видаляють закупорку, лин після ендартеректомії ця область виявляється ізольовану область промивають та видаляють з покритою активованими тромбоцитами, фібрином порожнини рідину, потім артерію закривають за та червоними кров'яними клітинами. Утворення допомогою накладення шва. Затиски видаляють, тромбів досягає піка через три години після травщоб відновити кровотік через артерію. Інвагінація ми, та спостерігається товстий фібринота можливі забруднення затисків можуть послужитромбоцитний шар. Тромбоцити є найважливішити причиною серйозних проблем, що виникають ми учасниками цього процесу утворення тромбів, а після відкриття сонної артерії та поновлення кроотже невід'ємними компонентами тромбозу, але, вотоку в ізольованій раніше області. крім того, вони також відіграють важливу роль у Хоча ендартеректомія є ефективним методом розвитку гіперплазії інтими. терапії, після неї часто залишається адвентиція, Дослідження з використанням тромбопенічних та значні області незахищеного тромбогенного пацюків свідчать, крім того, що в них спостерігасубендотелію. Незважаючи на ефективність ендається значно менша товщина інтими після ушкортеректомії сонної артерії, ця операція може придження сонної артерії в порівнянні з контрольними 5 77402 6 пацюками [Proc. Natl Acad. SCI, USA 1989; 86: для здійснення міцної адгезії, активації та агрегації 8412-16]. Коли тромбоцити прилипають до незатромбоцитів вимагаються, крім того, прямі взаєхищеного субендотелію ушкодженої судини, вони модії між колагеном та іншими рецепторами на активуються та вивільняють свої гранули. Ці граповерхні тромбоциту [Thromb. Haemost 1997; нули містять вазоактивні та тромботичні фактори 78(1): 434-438, Thromb. Haemost 1997; 78(1): 439(серотонін, ADP, фібриноген, фактор Von 444]. У число прямих рецепторів колагену на троWillebrands, тромбоксан А2) , а також фактори ромбоцитах входять GP VI [Blood 1987; 69(6):1712сту (породжений тромбоцитом фактор росту, тра1720, Thromb. Haemost 1999; 81(5): 782-792, J Clin. нсформуючий ріст фактор-бета та фактор епідерInvest 1989; 84(5): 1440-1445], GP la/IIa (α2/β1) [J. мального росту) [Circulation 1985; 72: 735-40]. Clin. Invest. 1989; 84(5): 1440-1445, Nature 1985; Точні механізми, за якими тромбоцити прискорю318(6045): 470-472], і, у меншому ступені, GP IV ють розвиток гіперплазії інтими, цілком поки неяс(CD36) [J. Biol. Chem. 1989; 264(13): 7576-7583] і, ні. Результати досліджень дозволяють припустити, можливо, навіть p65 [J. Clin. Invest. 1997; 100 (3): що тромбоцити, у першу чергу, поставляють фак514-521]. Встановлено, що під час відсутності зв'ятор, що викликає хемотаксис для міграції серезування тромбоцитів при участі vWF, ці рецептори динних клітин гладкої мускулатури в напрямку до є занадто слабкими медіаторами, щоб осаджувати інтими в другій фазі розвитку гіперплазії інтими тромбоцити на колагені з потоку [Br. J. Haematol [Vase. Surg, 1991; 13: 885-91]. Інші дослідження, з 1986; 63(4): 681-691]. Нарешті, vVW у комбінації з використанням антитіл анти-PDGF, продемонструфібриногеном сприяє структуруванню та подальвали найважливішу роль, яку PDGF грають в акушій активації тромбоцитів через зв'язування з GP мулюванні неоінтимальних клітин гладкої мускулаIlb/IIIa тромбоциту [J. Clin. Invest. 2000; 105(6): 783тури після ушкодження судини [Science 1991; 253: 791], що забезпечує стабільність та міцність, необ1129-32]. Інший механізм, за яким тромбоцити мохідні для розвитку тромбу. жуть підсилювати розвиток гіперплазії інтими, поВ останні роки, після відкриття GP ІІb/ІІІа тролягає в активації каскаду коагуляції та наступного мбоциту та антагоністів рецептора ADP, у протиаакумулювання тромбіну в зоні ушкодження. Регрегаційній терапії з'явився великий прогрес зультати деяких досліджень свідчать про мітоге[Coronary Art Dis 1999; 10(8): 553-560, J. Am, Coll. ничний вплив тромбіну на клітини гладкої мускулаSurg. 2000; 191 ((1): 76-92]. Проте, розроблені метури [J. Clin. Invest. 1993; 91: 94-98, J. Vase. Surg. тоди не призначені для інгібування початкової ад1990; 11: 307-13]. Крім того, встановлено, що трогезії тромбоцитів до схильних до цього волокнах мбін є чинником, який стимулює активацію тромколагену, і, незважаючи на ефективність антагонібоцитів. Безвідносно до точного механізму, адгезія стів GP ІІb/ІІІа в ослабленні взаємодій тромбоцитта активація тромбоцитів у зоні ушкодження судитромбоцит, тромбоцити по колишньому налипають ни відіграють важливу роль у розвитку тромбозу та на ушкоджені ділянки стінки судини [Blood 1993; гіперплазії інтими, а отже, інгібування адгезії та 81(5): 1263-1276, Circulation 1995; 91(5): 1354активації тромбоцитів може сприяти запобіганню 1362]. Далі, активація тромбоцитів майже завжди або зменшенню швидкості розвитку тромбозу та спричиняє більш широкі наслідки, чим агрегація та гіперплазії інтими. гострий тромбоз, прогресування підгострої та хроМедіатором прилипання тромбоцитів до ушконічної гіперплазії інтими повинно бути, принаймні, дженої стінки артерії є, у першу чергу, фактор von частково, піддане впливу мітогеничних медіаторів, Willebrand (vWF), мультимерний глікопротеїн, що таких як продукований тромбоцитом фактор росту вивільняється з клітин ендотелію та циркулює в (PDGF), який вивільняється активацією тромбоциплазмі, де функціонує як переносник протеїну для тів. Справді, було встановлено, що інгібування фактора VIII [Annu. Tev. Biochem. 1998; 67: 395PDGF зменшує гіперплазію інтими в різних видів 424]. Високомультимеризований vWF теж циркутварин [Science 1991; 253(5024): 1129-1102, лює, замкнений усередині альфа-гранул тромбоCirculation 1999; 99(25): 3292-3299]. цитів, з яких він вивільняється після активації троПрипустити, що vWF має велике патофізіоломбоциту [Annu. Tev. Biochem. 1998; 67: 395-424]. В гічне значення, можна виходячи з факту підвиумовах підвищеного зрушення, котрі зустрічаються щення кількості циркулюючих vWF у пацієнтів з в зоні атероматичного запалення або механічного гострим інфарктом міокарда [Thromb Haemost ушкодження, vWF може, через свій домен A3, 2000; 84: 204-209, Circulation 1998; 98(4): 294-299], утворювати зв'язки з вихідними на поверхню волопричому рівні vWF позитивно корелюють з погакнами колагену [Biochemistry 1986; 25 (26): 8357ним прогнозом [Circulation 1998; 98(4): 294-299]. 8361, Blood 1987; 70(5); 1577-1583, J. Biol. Chem. Крім того, дослідження in vivo свідчать, що нейт1987; 262(28): 13835-13841]. Потім зв'язаний з коралізація антитіл анти-vWF приводить до інгібулагеном vWF, у свою чергу, зв'язує тромбоцити вання експериментального тромбозу, що підтверчерез антигенну детермінанту, що з'являється в джує важливу роль vWF у формуванні тромбів залежності від зрушення в домені А1 vWF, що вза[Thromb. Haemost 1998; 79(1): 202-210]. Далі, у ємодіє з тромбоцитом GPIMX/V [Blood 1985; 65(1): міру ще більшого поширення в лікуванні гострих 85-90, Blood 1985; 65(4): 823-831, Br. J. Haematol коронарних синдромів методів ангіопластики, які 1986; 63(4): 681-691]. Таким чином, vWF відіграє неминуче приводять до ушкодження стінки судини роль містка між колагеном та тромбоцитами, і це є та уразливості колагену, стає ще більш актуальнеобхідною умовою для здійснення адгезії тромною розробка способів як можна більш раннього боцитів до колагену в потоці [J. Lab. Clin. Med, фармакологічного втручання в каскад адгезія1974; 83 (2): 2 96-300]. Проте, прокатування тромактивація-агрегація тромбоцитів. боциту по vWF приводить до слабкої адгезії, та Два основних напрямки в сучасній терапії, ко 7 77402 8 тра має метою обмеження адгезії та активації Оцінка ефективності як LAPP, так і Каліна при тромбоцитів, а також наступного тромбозу та гіпетестуванні в моделях тромбозу in vivo, мала перерплазії інтими, полягають у використанні антитромінний успіх. Виявлено, що LAPP не може гальмумбоцитних агентів та антитромботичних признавати формування тромбу на покритих колагеном чень. Хоча такі лікарські препарати, як аспірин, трансплантатах артеріально-венозної розвилки в ефективно блокують синтез Тромбоксану А2 за бабуїна, незважаючи на застосування доз, що інгірахунок інгібування містків циклооксигенази, вони бують ініційовану колагеном агрегацію [Arterioscler не запобігають індукованій колагеном адгезії та Thromb 1993, 13(11): 1593-1601], тоді як Калін чиактивації тромбоцитів, які стимулюють розвиток нив залежну від дози інгібуючу дію на формування гіперплазії інтими. Застосування гепарину як антитромбів у моделі венозного тромбозу хом'яка тромботичного агента сполучено з ускладненнями [Blood 1995, 85(3): 712-719]. та обмеженнями, включаючи непередбачену реаУ цій галузі знань відомі нетромбогенні та анкцію на дозу, необхідну для надійного лаборатортитромбогенні покриття для стентів та катетерів. ного моніторингу, обмежену активність проти зв'яНетромбогенні покриття та продукти засновані на заного з тромбом тромбіну, множинні зони модифікованих та вищих полімерах, приклади інгібування, залежність від антитромбіну III, ризик описані [в заявках WO9301221 та W09830615]. сильної кровотечі, так само, як і необхідність у Антитромботичні та антирестенозні покриття безупинному уливанні. Очевидно, що ідеальний являють собою, у загальному випадку, біосумісні терапевтичний агент повинний робити специфічну покриття, що можуть також служити джерелами до зони та локалізовану дію, без системного розмісцевого постачання лікарських препаратів. поділу або загальної коагулопатії. Покриття засновані, головним чином, на гідроВиявилося, що найважливіші ефекти, які ініцігелях, їхні приклади описані в патентній літературі, юють каскад подій, що приводять до тромбозу та присвяченій методикам виготовлення різних типів наступної гіперплазії інтими, виникають у резульгідрогелів та покрить для медичних пристроїв, у таті взаємодій між незахищеним колагеном субентому числі, такі приклади наведені [в заявках дотелію в зоні ушкодження судини та моношаром WO9211896, WO9811828, WO0147572, ЕР0887369 тромбоцитів, які налипнули на незахищений колата WO0139811]. ген. Отже, специфічний інгібітор адгезії тромбоциПрофіль виходу терапевтичних речовин, що ту до колагену субендотелію може запобігати, або містяться в покритті, можна регулювати, наприпринаймні, гальмувати розвиток тромбозу та гіпеклад, за допомогою варіювання товщини полімеррплазії інтими. них шарів, або шляхом вибору специфічних поліУ літературі описано, що деякі видобуті з п'явмерних покрить, що володіють підібраними фізикоки речовини здатні інгібувати взаємодії колагенхімічними властивостями (такими, як заряд, гідротромбоцит [Blood 1995; 85(3): 705-711, Platelets фобність, гідрофільність) та/або шляхом готування 2000; 11(2): 83-86, J. Biol. Chem. 1992; 267(10): покрить у виді різних шарів. Фахівцям відомі кри6893-6898, J. Biol. Chem. 1992; 267(10): 6899-6904, терії вибору полімеру та оптимізації швидкості Blood Coagul Fibrinolysis 1991, 2(1): 179-184]. Відовиходу. Інші покриття [описані в роботі Fischell мо, що дестабілаза, ізопептидаза, що виявляє (Circulation, 1996, 94: 1494-95), Topol та ін. активність у плані деполімерізації фібрину, виді(Circulation, 1998, 98: 1802-20) та McNair та ін. у лена з Hirudo medicinalis, інгібує агрегацію тромметодиці Technology, 1996, 16-22]. боцитів, викликувану різними агоністами, включаЗастосування стентів, проводів та катетерів у ючи колаген, але вважається, що вона утворює серцево-судинній системі є загальноприйнятою зв'язки безпосередньо з мембраною тромбоциту практикою, тому ушкодження судин, емболізація [Platelets 2000; 11(2): 83-86]. Антитромбоцитний та наступний рестеноз є головним об'єктом занепротеїн п'явки (LAPP), протеїн з масою =13кДа зі покоєння кардіологів у процесі катетеризації або слини Haementeria officinalis, інгібує адгезію тромхірургічного втручання, а також у післяопераційний боцитів до колагену при статичних умовах [J. Biol. період. Альтернативні методи, такі як ендартерекChem. 1992; 267(10): 6899-6904, Thromb. Haemost томія, сполучені з виникненням порівнянних про1999, 82(3):1160-1163] та при прискореній протоці блем. Кожна процедура, пов'язана з маніпулюван[Arterioscler Thromb. Vase. Biol 1995, 15(9): 1424ням артеріями, тобто - судинна хірургія та 1431], і робить вплив як на vWF, так і на зв'язуванангіопластика, допускає розвиток гіперплазії інтиня тромбоциту з колагеном, медіатором якого є GP ми. Користь, яку можуть принести способи запобіІа/ІІа [Thromb. Haemost 1999, 82(3): 1160-1163]. гання або гальмування розвитку гіперплазії інтими Калін являє собою протеїн ~ 65кДа з Hirudo неможливо переоцінити, а переваги способу, що medicinal is, що має аналогічну дію. Калін теж інгідозволяє досягати цих ефектів без побіжного бує взаємодії колаген-тромбоцит як у статичних, створення системних ефектів, є ще більш очевидтак і в динамічних умовах [Blood 1995; 85(3): 705ними. 711, Blood Coagul Fibrinolysis 1991, 2(1): 179-184, Таким чином, очевидна необхідність розробки Thromb. Haemost 1999, 82(3): 1160-1163]. Крім тополіпшених фармацевтичних препаратів та спосого, як LAPP, так і Калін є потенційними інгібіторами бів інгібування самих ранніх подій у патофізіології ініційованої колагеном агрегації тромбоцитів, які (тобто адгезії тромбоцитів) та очікується, що досяінгібують агрегацію при концентраціях, близьких гнення в цій сфері дозволять значно знизити рівні до тих, що блокують утворення зв'язків vWF з козахворюваності та смертності, пов'язаних з такими лагеном [J. Biol. Chem. 1992; 267(10): 6893-6898, процедурами, як ангіопластика та хірургічне втруBlood Coagul Fibrinolysis 1991, 2(1): 179-184, Blood чання. 1995, 85(8):712-719]. У загальному випадку, даний винахід включає 9 77402 10 введення недавно описаного інгібітора адгезії трансплантатів. Винахід відноситься також до спотромбоцитів Саратину усередину або на обрану собів призначення Саратину в композиціях, з яких зону усередині або на порожнині тканин, тобто, у із часом вимивається регульована кількість Сарасудинну систему або органи, за таких умов, щоб тину в локалізованій зоні. Саратин можна було застосовувати місцево, як Зокрема, одне з втілень даного винаходу відтопічний агент або єднальне покриття на поверхні, носиться до застосувань катетерних пристроїв для для запобігання та інгібування небажаної тромбодоставки Саратину до потрібної зони; за допомотичної та/або рестенозної реакції на ушкодження гою катетерів Саратин можна також застосовувати стінки судини, включаючи ушкодження, обумовлені усередині тканин самостійно або разом з іншими стентами, діалізними трансплантатами, іншими терапевтичними агентами поза полімерною матсудинними трансплантатами, та для лікування рицею. Основні вимоги до застосовуваного полірубців, що формуються при легких травмах, а тамерного матеріалу за даним способом полягають кож для лікування та пасивації нестабільних атеу його біосумісності та здатності вивільняти лікарросклеротичних осередків. ські речовини, яку можна пристосувати для спеСаратин являє собою недавно описаний [WO цифічного застосування. 0056885] рекомбінантний протеїн 12кД, спершу Контрольованого місцевого вивільнення Саравиділений з п'явки. Протеїн інгібує залежне від тину можна досягти шляхом одного тільки просоvWF утворення зв'язків тромбоцитів з колагенами чування, одного тільки іонтофорезу та однієї тільстінки артерії при умовах підвищеного зрушення, ки електропорації, або для ефективного та саме цей аспект винаходу робить Саратин прививільнення та введення Саратину усередину податним для інгібування артеріального тромбозу. рожнини судини можна використовувати комбінаІнший новий аспект полягає в тому, що Саратин цію іонтофорезу та електропорації. Переважно, можна застосовувати як топічний агент в зоні якщо катетер придатний для виконання процедуушкодження, що приводить до гальмування тромри, спрямованої на підтримку високої концентрації бозу та/або гіперплазії інтими без яких би то ні лікарського препарату в обраній ділянці простору було системних ефектів. Це представляє методику судини, так, що це приводить до поліпшеного покзі специфічними ефектами, що цілком підходить риття судини одним Саратином або його комбінадля застосування рівною мірою як хірургами, так і цією з додатковими лікарськими речовинами. кардіологами. Даний винахід особливо корисний для місцеСаратин можна комбінувати з безліччю різнового постачання Саратину протягом або після манітних терапевтичних агентів для постачання на процедур кардіологічного втручання, таких як ангімісці. Прикладами речовин, застосовуваних у коопластика, імплантація стента та ендартеректомія. ронарних артеріях, є антитромботичні агенти, такі Рекомбінантний Саратин, що підходить для як простациклін та саліцилати, тромболітичні агензастосування за даним винаходом, експресували ти, такі як стрептокіназа, урокіназа, активатор плата виділили. з Hansenula polymorpha; було виявзміногену тканин (ТРА) та анісоїльований комлено, що він діє через блокування утворення зв'язплекс, що активує, плазміноген-стрептокіназа ків vWF з колагеном та ефективно запобігає адгезії (APSAC), судинорозширювальні агенти, такі як тромбоцитів до колагену при підвищеному зрунітрати, ліки, що блокують кальцій у каналах, аншенні. Саратин робив залежне від дози інгібувантипроліфераційні агенти, такі як колхіцин, та алкіня зв'язування очищеного людського vWF з людлувальні агенти, інтеркаляційні агенти, фактори ськими колагенами типу І та типу III модулювання росту, такі як інтерлейкіни, трансфо(ІС50=0,23±0,004 та 0,81±0,04мкг мл-1 відповідно) рмуючий ріст фактор-бета та аналоги виділеного з та з колагеном шкіри теляти (ІС50=0,44±0,008мкг тромбоциту фактора росту, моноклонні антитіла, мл-1). Крім того, Саратин виявив аналогічну інгібуорієнтовані проти факторів росту, протизапальні ючу здатність проти зв'язування з цими колагенаагенти, як стероїдні, так і нестероїдні, та інші агенми vWF плазми людини, гризунів та свиней. У проти, що можуть модулювати тони судин, їхні функточній камері, при умовах підвищеного зрушення ції, артеріосклероз, і реакцію загоєння ушкодження (2700сек-1) , Саратин виявляв залежну від дози та судини або органа, що виникло у результаті втрусильну інгібуючу дію на формування агрегатів чання. У комбінації або покриття за даним винахотромбоцитів на покритій колагеном поверхні дом можна також включати антибіотики. Більш (ІС50=0,96±0,25мкг мл-1) , але при зниженому зрутого, покриття можна застосовувати для доставки шенні (1300 сек"1) на кривій залежності від дози фармацевтичних препаратів орієнтовно, усередиспостерігалося зрушення вправо (ІС50=5,2±1,4мкг ну стінки судини. За допомогою введення діючої мл-1). Резонансним аналізом поверхневих плазморечовини в здатний розбухати полімер, цей активнів на людському колагені типу III виявлені єднаний агент можна вивільняти при розбуханні полільні Саратин сайти як з високою, так і з низькою меру. спорідненістю (Kd=5 10-8Μ та 2 10-6Μ відповідно), В одному з втілень даного винаходу, покриття та хоча низькі концентрації Саратину, що інгібувавиготовляють з гідрогелю, такого як оксид поліели адгезію тромбоцитів при підвищеному зрушенні тилену, альбумін, гідрофільні поліметакрилати та (тобто насичення єднальних сайтів з високою спогідрофільні поліуретани. рідненістю), не чинили дії на залежну від vWF агДаний винахід відноситься, крім того, до зарегацію тромбоцитів, індуковану колагеном, було стосування Саратину та його похідних, наприклад, виявлено, що високі концентрації (тобто, насиченчерез пристрої для доставки ліків у потрібне місня єднальних сайтів з низькою спорідненістю) інгіце/катетери або через стенти та покриття стентів, бують агрегацію тромбоцитів. Ці дані свідчать, що а також через судинні трансплантати та покриття Саратин є сильним інгібітором залежної від vWF 11 77402 12 адгезії тромбоцитів до колагену, що створює оснота ІН. ву для його терапевтичного потенціалу як антитРезультати експериментів по антиадгезійній ромботичного агента. дії Саратину на тромбоцити, які оцінювали після Крім того, дослідженнями встановлено, що проходження двох різних післяопераційних періоСаратин виявляє сильну та залежну від дози інгідів, свідчать, що кількість тромбоцитів, які налипбуючу дію на зв'язування VWF не тільки з колагенули на стінку судини через 3 години (Фіг.4) та ном шкіри теляти, але і з людським колагеном тичерез 24 години (Фіг.5) після ендартеректомії сонпів І та III, кожний з який у достатку присутній в ної артерії, у пацюків, оброблених Саратином, субендотеліальних шарах стінки артерії, і, як ввабуло значно меншим, чим у пацюків з контрольної жається, відіграє важливу роль у взаємодіях тромгрупи. боцитів зі стінкою судини [Thromb Haemost 1997, Адгезія тромбоцитів через 3 години була зме78(1): 434-438]. Оскільки взаємодії колаген-vWFншена на 59% (64±17,2 у порівнянні з 155±33,4 GP Ib/IX/V відбуваються тільки при досить підвиPLT на решітку, Р=0,05) та на 77% через 24 години щеному зрушенні, важливим аспектом даного ви(35±11,3 у порівнянні з 149±36,6 PLT на решітку, находу була демонстрація факту, що Саратин Ρ=0,0110). У контрольній групі адгезія тромбоцитів ефективний не тільки при статичних умовах, але була аналогічною через 3 години та через 34 готакож і в середовищі, яке найбільш наближене до дини, однак у групі, обробленій Саратином, адгезія ситуації, що зустрічається in vivo. У проточній казменшилася від 64 до 35 тромбоцитів на решітку. мері, яка дозволяє змінювати сили, зрушення для На Фіг.6 та 7 представлені типові картини енмоделювання такого середовища, Саратин чітко дартеректомізованої поверхні, обробленої та неінгібував акумулювання тромбоцитів до колагену, опрацьованої топічним Саратином, отримані за особливо при більш високих зрушеннях. Зсув допомогою скануючої електронної мікроскопії при вправо кривої залежності від дози в результаті 2000-кратному збільшенні. На Фіг.6А показана конзменшення зрушення є істотним, тому з цього мотрольна поверхня через 3 години після ендартережна зробити висновок, що ефективність Саратину ктомії сонної артерії, яка свідчить про достаток in vivo може бути локалізована в зонах високого клітинного матеріалу, фібринових ниток, числензрушення, де в результаті змін зверненої до крові них червоних кров'яних клітин та численних тромендотеліальної поверхні, наприклад, у зв'язаних з боцитів, помітних зовсім чітко. На Фіг.6В показана атеросклеротичними осередками або механічним оброблена Саратином поверхня через 3 години втручанням, відбувається порушення ламінарності після ендартеректомії сонної артерії. Відзначено кров'яного потоку. недолік клітинних елементів та майже вільна поДослідженням резонансу поверхневих плазверхня колагену. На Фіг.7А показана контрольна монів із Саратином встановлено, що колаген може поверхня через 24 години після ендартеректомії захоплювати Саратин двома незалежними єднасонної артерії, тромбоцити видні як маленькі білі льними сайтами, один з високою спорідненістю, а точки. На Фіг.7В показана оброблена Саратином другий - з низькою спорідненістю. Здатність Сараповерхня через 24 години після ендартеректомії тину інгібувати зв'язування vWF з колагеном пояссонної артерії. У випадку обробки Саратином спонюється насиченням єднального сайта з високою стерігається виразне зменшення адгезії тромбоспорідненістю, в якого значення ІС50 складають цитів. Застосування топічного Саратину після ендарблизько 5 10-8М, тобто, дорівнюють константі дитеректомії сонної артерії значно гальмує розвиток соціації для цього сайта. Оскільки незалежна від гіперплазії інтими в порівнянні з контрольною груvWF індукована колагеном агрегація тромбоцитів пою. Відсоток порожнинного стенозу, що викорисінгібувалася тільки великими дозами Саратину, товується як міра ІН, був значно меншим у випадку (більше 100мкм), можна припустити, що насичення застосування Саратину, чим у контрольній групі. єднальних колаген сайтів з низькою спорідненістю Це зниження формування ІН корелювало з інгібуасоційоване з інгібуванням прямих взаємодій кованням адгезії PLT. У вирахуванні порожнинного лаген-рецептор колагену. стенозу, у контрольних пацюків спостерігалося Іншим предметом даного винаходу є ефект, 29,8±6,8%, р=0,0042 порожнинного стенозу проти що складається у тому впливі, що Саратин чинить 10,9±1,8% порожнинного стенозу в обробленої на локальне оточення ендартеректомізованої суСаратином групи (Фіг.6). В обробленого Саратидини без необхідності системного розподілу та без ном пацюка діаметр порожнини був на 18,9% бізміни функції тромбоциту або зміни коагуляції, що льше, ніж у контрольних пацюків. Результати гісробить його ідеальною методикою для топічного тологічного аналізу свідчать, що через два тижні застосування під час процедур судинної хірургії та після ендартеректомії сонної артерії в 5 з 15 контрадіологічного втручання. рольних пацюків (15%) розвився повноцінний троУ цьому аспекті даного винаходу, дію терапевмбоз сонної артерії при тім, що тромбоз сонної тичного Саратину досліджували на моделі ендарартерії спостерігався в 0 пацюків з 15 особин, обтеректомії сонної артерії пацюків (СЕА), описаної роблених Саратином (0%). Вірогідний аналіз хіраніше [J. Vase. Surg. 1998, 28: 909-918]. Передбаквадрат дає імовірність успішного результату чається, що активація PLT є першим етапом роз16,238, це означає, що імовірність розвитку тромвитку тромбозу та рестенозу після СЕА, обумовбозу з закупоркою в контрольної групи в 16 разів лених ІН. Було виявлено, що місцеве більше, ніж у пацюків, оброблених Саратином застосування Саратину на поверхні з боку порожΡ=0,0156. нини зменшує кількість тромбоцитів, що налипаВ обробленої Саратином групи не спостерігають на ендартеректомізовану артерію і, таким чилося підвищеної кровотечі уздовж лінії накладеноном, гальмує розвиток післяопераційного тромбозу 13 77402 14 го на артерію шва. В оброблених Саратином паляопераційних черепномозкових подій та інсультів цюків не виявлено значних змін у тривалості кропісля ендартеректомії сонної артерії. Поліпшення вотечі та числі системних тромбоцитів у порівнянні рівня гіперплазії інтими та порожнинний стеноз з контрольними пацюками через 3 та 24 години демонструється, крім того, важливим фактом змепісля ендартеректомії. ншення відсотка тромбозу в пацюків, оброблених Модель СЕА знаходиться в близькій відповідСаратином. У 33% контрольних пацюків виявлявся ності з операцією СЕА людини, й отже, на підставі тромбоз, тоді як у жодній з оброблених Саратином отриманих результатів можна запропонувати спосонних артерій тромбозу не спостерігалося. Особсіб зменшення шкідливого впливу адгезії та агреливо важливе клінічне значення має характерну гації тромбоцитів у зоні ендартеректомії без сисдля цього агента відсутність системних ефектів. темного впливу на функцію тромбоцитів або Місцеве застосування Саратину не робить впливу зниження гемостазу. Просте, топічне застосування на випадки системної кровотечі або кількості троСаратину в процесі СЕА пацюків, зменшує адгезію мбоцитів. На цій підставі можна зробити висновок, та агрегацію тромбоцитів, а також - наступний ресщо зменшення адгезії тромбоцитів та наступне тоноз у порожнині сонної артерії, обумовлений зниження тромбозу та гіперплазії інтими є резульгіперплазією інтими. татом місцевого впливу. Виявлення цих нових, У Таблиці 3 приведені результати по тривалопов'язаних із Саратином, фактів має важливе знасті кровотечі та кількості тромбоцитів. Статистично чення в тому відношенні, що спектр клінічних зазначимого розходження між довгочасностями кростосувань для методик, що можуть здійснювати вотечі до та після операції не спостерігалося. Крім місцеве інгібування шкідливих ефектів адгезії та того, не спостерігалося статистично значимого активації тромбоцитів без порушення механізму розходження між числом тромбоцитівв оброблесистемного гемостазу дуже широкий. них Саратином та контрольних пацюків. Раніше було зазначено, що різні терапевтичні Ми довели значне зменшення адгезії та акувтручання індукують локальні. ушкодження, які мулювання тромбоцитів після ушкодження судини, можна ідеально обробляти негайно й місцево. Зааналогічного ендартеректомії. Зменшення адгезії лишені без обробки, ушкоджені клітини ініціюють тромбоцитів спостерігалося як відразу після ендасерію процесів, втягнутих у згортання, додаткову ртеректомії (3 години), так і через 24 години. Через активацію та клітинну реакцію вивільнення цитокі24 години ефект був більш значним, чим ми очікунів, індукування проліферації та інші біологічно вали, та цей ефект обумовлений не прямим інгіактивні процеси. Ці складні, взаємозалежні процебуючим впливом Саратину на колаген (період наси важко зупинити, якщо вони вже почалися. піврозпаду Саратину в сироватці складає 90 Важливий аспект даного винаходу полягає в хвилин), а пов'язаний, скоріше, з вихідним інгібутому, що Саратин розташовано безпосередньо на ванням агрегації тромбоцитів та наступним поруоброблюваних тканинах. Іншим аспектом місцевошенням каскаду активації тромбоцитів. Якщо інгіго застосування є мінімізація потенційних пробується вихідне прилипання тромбоцитів до блем, пов'язаних із системними ефектами лікарсьнезахищеного колагену, то не може початися і ких препаратів, застосовуваних для втручання. каскад активації тромбоцитів. Дані, представлені В ідеалі, лікування Саратином можна признана Фіг.4 та 5, демонструють, що місцеве застосучати одночасно з придатним терапевтичним втрування Саратину на свіжеушкодженій судині може в чанням, яке можна здійснювати шляхом уведення значній мірі інгібувати адгезію тромбоцитів. СараСаратину в покриття на хірургічних пристроях, тин інгібував адгезію тромбоцитів на 60% та 75% таких як балонний катетер, або інші пристрої або через 3 та 24 години відповідно. Це інгібування їхні деталі. Інший аспект може також включати визначається по видимих розходженнях в осабезпосереднє покриття Саратином ушкоджених дженні клітинних елементів, що спостерігаються судин. між контрольними та обробленими Саратином Крім того, за даним винаходом можна застоартеріями через 3 години та 24 години (Фіг.7 та 8). совувати і звичайні способи постачання Саратину, Ми припускаємо, що це зменшення клітинної реактакі як тип вільної рідини., що включає комбінації з ції обумовлено інгібуванням адгезії тромбоцитів. іншими терапевтичними агентами. Проте, застосуЦе представляє унікальний варіант терапії для вання матриці полімер/гідрогель має визначені інгібування адгезії тромбоцитів до ушкодженої переваги перед постачаннями вільною рідиною. судини. Через два тижні після ендартеректомії Постачання агенту, що був введений у полімерну сонної артерії у контрольних пацюків був значно матрицю, не вимагає додаткових порожнин у доменший діаметр порожнини, чим в особин, обробпоміжному катетері для транспортування вільної лених Саратином (Фіг.9). Кількість осередків розрідини з лікарським розчином до місця обробки та витку гіперплазії інтими в оброблених Саратином назад. пацюків був значно знижений, що корелює зі змеКрім того, полімерна матриця виключає ризик ншеними адгезією та акумулюванням тромбоцитів. витоку лікарського розчину зі струмом крові, що Виявлення зменшення числа осередків гіперплазії може відбуватися при нещільному заповненні баінтими та тромбозу, що пов'язане зі зниженням лоном сегментів судини, що обумовлює ризик підадгезії тромбоцитів, забезпечує клінічно важливі дання нецільових тканин впливу високих концентграниці та наслідки зменшеної адгезії тромбоцитів. рацій лікарського препарату. Це свідчить, що специфічне до осередків несистеЗагальним технічним рішенням щодо місцевомне інгібування адгезії та агрегації тромбоцитів го застосування Саратину або на медичному приприводить до зменшення швидкості розвитку трострої, або у вигляді покриття на ушкодженій судимбозу та закупорки, а отже, зменшує відсоток пісні, є, наприклад, уведення Саратину в полімерне 15 77402 16 або гідрогелеве покриття. каталізатори 2,2-азобіс(2-метилпропілнітрил) або Щодо полімерних композицій, використовуваазобісбутіронітрил (AIBN). Застосування цих ініціаний тут термін "гідрогель" охоплює синтетичні поторів не обмежено конкретною методикою полімелімери з порами або порожнинами різних розмірів ризації або конкретним кінцевим продуктом. Ната ємкостей, та змінними фізико-хімічними властиприклад, ініціатори типу вільних радикалів можна востями, особливо - зарядом або гідрофільзастосовувати в покриттях, та активовані опроміною/гідрофобною природою гелевої матриці, які ненням ініціатори можна використовувати при фоможна варіювати в процесі виготовлення покриття рмуванні твердих об'єктів. або пристрою з покриттям. Фахівцям відома безліч На додаток до у великій мірі схожим фракціям синтетичних еластомерів та полімерних матеріамоноефіру та метакрилатного мономеру, суміш лів, що зустрічаються в природі. Саратин можна мономерів можна зміцнити слідовими кількостями вводити в матрицю в процесі одержання полімеру, алкілакрилату з більш довгими ланцюгами або або додавати після покриття або формування посомономеру метакрилатного ефіру, такого як циклімеру в бажану форму. Крім того, для формуванлогексилметакрилат, триметилоллропантриметакня полімерних матриць, застосовуваних за даним рилат або етиленгліколю диметакрилат. Такі довинаходом, можна використовувати багато з відодаткові сомономери зміцнюють сітчасту структуру мих, численних, різних полімерних матеріалів та у випадках, коли бажано зміцнити доданий поліспособів виготовлення. Приклади придатних полімер. Слідові кількості цих сомономерів, у загальмерних матеріалів або комбінацій включають, але ному випадку, складають менш 0,1ваг.% усієї суне обмежуються цим, біосумісні та/або полімери, міші мономерів. що розкладаються мікроорганізмами. Гідрогелеві полімери, що застосовуються за Були вивчені деякі алкілалкіл- та ціаноакриладаним винаходом, можна формувати таким чином, ти в аспекті їхнього хірургічного застосування, та щоб одержувати об'єкти, що зшиті внутрішніми виявилося, що особливо придатними є деякі ізобувпливами в достатній мірі, щоб остаточний об'єкт тилціаноакрилати. не вимагав додаткових мономерів, що зшивають. Типовий гідрогелевий полімер можна одержаДодатковими прикладами полімерів, що розкти із суміші мономерів, що містить 40-60 вагових ладаються мікроорганізмами, є полі(лактиди), почасток очищеного моноефіру гідроксіалкілалкілаклігліколіди, поліангідриди, поліортоефіри, поліакрилату, що має єдиний олефіновий подвійний тали, полідигідропірани, поліціаноакрилати та їхні зв'язок, 40-60 вагових часток метакрилатного мосополімери, а також поліетиленгліколь. Вони мономеру, що містить один олефіновий подвійний жуть приймати форму сополімерних гідрогелів або зв'язок та 0,001-5 вагових часток ініціатора поліструктурованих полімерних мереж, у які ліки, примеризації. Полімеризацію можна робити за станзначені для концентрованого постачання в потрібдартними методиками полімеризації в масі, поліну зону, можна або вводити в процесі полімеризамеризації в розчині, полімеризації в суспензії або ції, або, у випадку визначених гідрогелів, полімеризації в емульсії. Вибір методики полімезавантажувати згодом. Кращими матрицями моризації залежить від необхідного обсягу полімеру жуть бути ті, котрі створені відповідно до молекута природи кінцевого продукту, який потрібно оделярних характеристик агента, щоб контролювати ржати. Типовий гідрогелевий продукт може бути його дифузію назовні. описаний молярним відношенням моноефіру до Найрізноманітніші типи катетерів та інших меметакрилатного мономеру в діапазоні від 1:1 до дичних пристроїв, покритих Саратином, можна 2,3:1, переважно 1,5:1, в якому діаметр пір полімесконструювати та застосовувати відповідно до ру перевищує 90 ангстрем. індивідуальних терапевтичних потреб, для задоОскільки моноефір гідроксіалкілакрилату має волення яких вони були сконструйовані, або для єдиний олефіновий подвійний зв'язок, перелік вирішення більш специфічної задачі доставки запридатних сполук включає, але не обмежується вантаженого Саратином полімеру в потрібне місними, 2-гідроксіетилметакрилат, гліцерилметакрице. Даний винахід пройшов тестування на балонлат, 2-гідроксипропілметакрилат, гліцидилметакному катетері, що продається за назвою Blue рилат, 2-гідроксіетилакрилат; та 2medical Devices BV GO, що поставляється компагідроксипропілакрилат. Придатними метакриловинією Blue medical, але сфера його застосування не ми мономерами є метакрилова кислота, метакриобмежується даним типом катетера. ламид 5 та метакрилонітрил. Інші приклади Вибір ініціатора полімеризації може залежати Приклад 1 від методики полімеризації або кінцевого признаЗв'язування очищеного vWF та тромбоциту з чення полімеру. Наприклад, якщо полімер передколагеном у статичних умовах бачається сформувати у вигляді твердого об'єкта, Утворення зв'язків vWF з колагеном досліджуможна використовувати ініціатори типу вільних вали на мікротитрувальних пластинках, відповідно радикалів. до відомих методик [Blood 1995, 85 (3): 705-711]. У число кращих ініціаторів цього типу входять Різні колагени - людський колаген типів І та III та біфункціональні поліефіри, такі як 2,5-диметил-2,5колаген шкіри теляти (Sigma) - покрили сполукою з біс(2-етилгексоїлперокси)гексан або третинного 50мкл колагену, розчиненого в 50мл оцтової кисбутилу пероксипівілат. Альтернативно, якщо осталоти, що нанесли по 125мкг мл-1 на 96-ямкові мікточним призначенням полімеру є його застосуванротитрувальні пластинки, та витримували протяня у вигляді покриття, що наносять у вигляді сумігом ночі в присутності 200мкл PBS, щоб ші мономерів та полімеризують in situ, ініціатором підштовхнути ренатурацію. Після блокування неможуть бути активовані опроміненням типу УФ покритих ділянок за допомогою BSA, очищений 17 77402 18 людський vWF (1,25мкг мл-1 для пластинок, покрикості венозного зрушення 300сек-1, Саратин витих колагеном типу І та колагеном шкіри теляти; явився нездатним інгібувати адгезію розбризканих 0,625мкг мл-1 для пластинок, покритих колагеном тромбоцитів аж до 10мкг мл-1 (дані не привоIII) або розведену звичайну плазму (людська пладяться). зма: 1/80 на колаген І та III, 1/40 на колаген шкіри Приклад 3 теляти; плазма хом'яка, миші та свині: 1/80 на коАналіз зв'язування за допомогою резонансу лаген III; 1/20 на колаген І та колаген шкіри теляти) поверхневих плазмонів (SPR) додали в ямки в присутності Саратину та інкубуВзаємодії протеїнів ідентифікували та охараквали протягом 2 годин (розведена плазма) або 1 теризували за допомогою SPR на установці ВІАсогодини (очищений vWF). Зв'язування залишкового ге 3000 (BlAcore, Freiburg, Germany). Відповідно до vWF з колагеном визначали після наступного етаінструкції постачальника апаратури, були викориспу промивання за допомогою антисироватки кротані паруючі агенти. Зв'язування із сенсором CM 5 лика анти-vWF (Dako, Copenhagen, Denmark), трабуло зроблено через активовані карбоксилатні нспонованої пероксидазою хрону, що проробили групи, щоб вивільнити амінові групи людського та вимірили поглинання світла при 492нм. колагену типу III (Sigma). Підганяння рН та хімічні Якщо мікротитрувальні пластинки піддавали реакції спарювання провели при стандартних умопопередньому інкубуванню з людським колагеном вах [Anal Biochem. 1991, 198(2): 268-277, JAI Press І, людським колагеном III та колагеном шкіри теляLtd., 1992]. Для спарювання колаген розбавили до ти, наступне інкубування очищеного vWF у прису0,125мкг мл-1 у 10мМ ацетатного буфера (рН4,5), тності Саратину було сполучено з залежним від що привело до появи 331 резонансної одиниці дози інгібуванням утворення зв'язків vWF-колаген, (RU) іммобілізованого матеріалу. Цю матрицю та значення ІС50 складали 0,23±0,004, 0,81±0,04 та використовували для вивчення зв'язування очи0,44±0,008мкг мл-1 відповідно (Фіг.1). Якщо очищещеного рекомбінантного Саратину, що був розчиний vWF був замінений розведеною звичайною нений у 20мМ Hepes (рН7,4), 150мМ NaCl, 5мМ людською плазмою, інгібуюча здатність Саратину EDTA, 0,005% Tween 20. Всі експерименти по зв'язберігалася (Таблиця 1). Саратин інгібував також зуванню проводили при 25°С. Титрування із Саразв'язування vWF з різними колагенами, що тестутином робили при варіюванні концентрацій від вали в розведеній плазмі свині, хом'яка та миші, та 7,8нм до 10мкм. Одержані експериментальні знавиявив відчутну найвищу ефективність проти колачення плато RU були нанесені за рівнянням: гену І (Таблиця 1). Req/концентраціяСаратину=(-Кд Req)+(Кд Rmaх). Приклад 2 Титрування Саратину на іммобілізованому на Адгезія тромбоцитів при підвищеному зруповерхні колагені привело до залежного від коншенні центрації зв'язування. Далі, максимальна кількість З урахуванням важливості сил зрушення для Саратину, зв'язаного з колагеном на поверхні датконтролю залежної від vWF адгезії тромбоцитів до чика, обумовила появу більш високого сигналу, колагену [J. Lab. Clin. Med. 1974, 83(2): 296-300], у чим максимальний сигнал, розрахована для модепроточній камері були проведені перфузійні дослілі зв'язування 1:1. Це вказує на існування більш, дження для вивчення інгібуючої дії Саратину в ніж одного єднального сайту для Саратину на коумовах потоку, аналогічних тим, що зустрічаються лагені типу III, далі цей висновок був підтверджев ушкоджених або уражених хворобою артеріях. ний фактом, що підганяння даних по Ленгмюру до Колаген шкіри теляти нанесли на пластикові покмоделі зв'язування 1:1 не дають позитивних реривні стекла за описаною раніше методикою зультатів. [Blood 1995, 85(3); 705-711]. Перфузії здійснювали Аналіз Скетчарда даних SPR свідчить про ісу перфузійній камері з рівнобіжними пластинками з нування двох різних єднальних сайтів, що мають двома тримачами покривних стекол, висота камезначно відмінну спорідненість до Саратину (Фіг.3). ри складала 0,4, 0,6 або 1,0мм, а ширина - 1,0см, у Розрахунок констант рівноваги привів до одержанпульсуючому потоці (роликовий насос, Watson ня константи дисоціації 5 10-8М для сайта з висоMariow 603 S, VEL, Leuven, Beligjum) при приблизкою спорідненістю та 2 10-6М для єднального сай-1 них швидкостях зрушення 2700, 1300 та 300с та з низькою спорідненістю. відповідно. Збережену від згортання здорову кров Приклад 4 (0,2 IU мл-1 гепарину з низькою молекулярною ваАгрегація тромбоцитів гою, Clexane) розприскали по покритим колагеном Специфічність Саратину до функції тромбоципокривним стеклам на 5хв., після чого промиті поту оцінили шляхом дослідження агрегації у збагакривні стекла підфарбували Grunwald-Gfemsa та ченій тромбоцитами плазмі з використанням як оцінили осадження тромбоцитів за допомогою агоністів колагену, ADP, ристоцетину, арахідонової оптичної мікроскопії та аналізу зображень за відокислоти або аналогів тромбоксану U46619. Цитрамою методикою [Blood 1995, 85 (3): 705-711], з товану кров (3,13%) здорових донорів, що не використанням покриття поверхні як кількісного приймали ліків центрифугували (15хв., 100г), щоб параметру. одержати збагачену тромбоцитами плазму, до якої -1 При швидкості зрушення 2700сек , спостерідодали Саратин (кінцева концентрація 0-200мкг галося залежне від дози Саратину інгібування адмл-1) за 1хв. до індукування агрегації тромбоцитів гезії тромбоцитів зі значеннями ІС50=0,96±0,25мкг колагеном (0,5мкг мл-1 ), ADP (2,5мкМ), ристоцетимл-1 (Фіг.2). Проте, при більш помірній швидкості ном (0,9мг мл-1), арахідоновою кислотою (1,0мМ) зрушення 1300сек-1, спостерігалося виразне зруабо U46619 (1,3мкМ). Для кожного агоніста спошення вправо на кривій залежності від дози, зі стерігався максимум агрегації (амплітуда) після -1 значеннями ІС50=5,2±1,4мкг мл (Фіг.2). При швидпроходження 5-хвилинного періоду. 19 77402 20 Саратин виявився нездатним інгібувати макSomerville, NJ), починаючи від далекого кінця. Дасимальну агрегацію по всім тестованим агоністам, лекий турнікет видалили першим, щоб оцінити включаючи колаген, при кінцевій концентрації аж гемостаз лінії шва після видалення ближнього тудо 40мкг мл-1 (Таблиця 2). Проте, Саратин міг часрнікета. Тривалість застосування Саратину склатково інгібувати індуковану колагеном агрегацію дала 5 хвилин, що відповідає часу, що потрібно -1 тромбоцитів при 100мкг мл (не показано) , та цілдля закриття артерії. Будь-яку кровотечу лінії шва ком інгібувати при 200мкг мл-1, хоча на агрегацію обережно тампонували стерильним кінчиком бадо ADP Саратин не оказував впливу навіть при вовняного аплікатора до досягнення гемостазу. концентрації 200мкг мл-1. Ендартеректомізовану сонну артерію оцінювали Приклад 5 ручним Doppler, щоб підсилити наочність. Потім Модель СЕА пацюка зовнішній шар мускулів та шкіру зашивали бігучим У моделі СЕА пацюка, в якій використовується 3-0 швом, що розсмоктується. відкрита методика з артеріотомією, використовуПриклад 7 вали пряме видалення інтими, частин середовища Адгезія тромбоцитів та шва артерії. Одна група пацюків одержувала У підгрупах адгезії тромбоцитів, пацюків поСаратин, у той час, як інша група використовувавторно анестезували, збирали ендартеректомізолася для контролю. Виміри кінцевої точки включавані сонні артерії та фіксували їх у 4% розчині ли 1) адгезію PLT, 2) швидкість тромбозу, 3) розглютальдегіду через 3 години або через 24 години виток гіперплазії інтими. Саратин застосовували після ендартеректомії сонної артерії. Протягом безпосередньо до поверхні ендартеректомізованої процедури збору, сегменти сонної артерії були поверхні сонної артерії перед закриттям артерії. тривалий час відкритими уздовж області шва, таЕлектронні мікрознімки (2000 X) препарованих ким чином, залишаючи незахищеною ендартерексонних артерій використовували для кількісного томізовану область. Потім артерії постфіксували аналізу агрегації PLT. Загальні кількості PLT розтетроксидом осмію, дегідратували в серії градараховували с використанням стандартизованої ційних спиртів, важливі точки висушували за допалетки. ІН та тромбоз аналізували за допомогою помогою СО2 (1072 psi та 31,1°С), покривали золокомп'ютеризованого морфометричного аналізу то-паладієм та поміщали у скануючий електронний підфарбованих еластином сегментів сонної артерії мікроскоп (JEOL JSM 5410, JEOL, USA Peabody, з прямим виміром площі ІН. MA). Ендартеректомізовані області сканували при Приклад 6 2000-кратному збільшенні, та одержали фотограОперація ендартеректомії сонної артерії. фії зображень. Фотографічні зображення були поТварин присипляли ізофлюраном у скляному годжені та упорядковані в комбінацію, що дозвоковпачку, зважували, та потім анестезували комбіляє візуалізацію більшої зони, чим це можна було нацією кетаміну (100мг/кг) та ацепромазину малезробити за допомогою єдиного поля монітору скаату (1мг/кг) внутрішньоочеревинно. Після того, як нуючого електронного мікроскопа. Після монтажу адекватність анестезії підтверджувалася відсутніскомбінації фотографій, її накрили прозорою палеттю реакції на роздратування задньої лапи, підшкікою. Такі ж палетки були використані для фотогрно в області верхньої частини середини спини рафій усіх зразків. Для підрахунку загальної кільвводили 4см3 звичайного саліну, що служив джекості тромбоцитів використовували 116 квадратів релом рідини (1см3/кг) для компенсації втрати крона кожній фотографії. Число 116 - це максимальне ві в ході операції. Потім область шиї виголювали число квадратів, які можна було напевно знайти на та обробляли 7%-м ізопропіловим спиртом. Із завсіх комбінаціях фотографій. Підрахунок тромбостосуванням стерильної методики та препараційцитів робили наосліп два спостерігачі. Приклад 8 ного мікроскопу ( 40, sz40 Olympus, Olympus Гіперплазія інтими America Inc., Melville, NY) робили цервікальний Через два тижні після ендартеректомії сонної розріз. Відокремлювали зовнішні мускули та робиартерії, пацюків із групи гіперплазії інтими анестели розсічення до рівня правої сонної артерії. Позували та оголювали ендартеректомізовану сонну тиличні нерви в області артерії довільним чином артерію. Черевну порожнину розкрили по середній відтинали для збереження фарингеальної функції лінії, та розкрили периферичну аорту та внутрішню та запобігання післяопераційного респіраторного порожню вену. Зробили поперечний надріз порожризику. ньої вени, та периферичну аорту канюлювали каПісля адекватного впливу на сонну артерію, тетером №20 для уливання нормального саліну ближній та далекий контроль розвилки, приблизно при 100мм Hg доти, поки вихідний з порожньої на 1,5-см відстані, здійснили за допомогою наклавени потік не ставав чистим. Наступним етапом дення 3-0 турнікетів із шовного шовку. За допомобуло уливання в рівному об’ємі 10% формаліну, гою корнеального леза зробили артеріотомію та що містить буферний розчин, при 100мм Hg, для розтягли до довжини 6мм за допомогою мікронозавершення методу перфузії-фіксації. Односантижиць. За допомогою голки №27, інтиму процараметровий сегмент оперованої сонної артерії відітпали поперечно по судині по двох рівнобіжних лінули та помістили в 10% формалін до наступної ніях, що відстоять одна від одної приблизно на обробки для гістології. Артерії блокували парафі2мм. Інтиму та серединний шар видалили мікропіном, секціонували та підфарбували еластином за нцетом. Саратинова група пацюків одержувала по допомогою барвника Verhoeff та Van Gieson. Для 5мкл розчину Саратину, застосованого безпосестандартизації області секціонування, відбирали редньо на ендартеректомізовану поверхню. Артекратні сегменти через інтервали 3мкм, кожний з ріотомію закрили бігучим 10-0 швом з моноволоякий розташовувався уздовж лінії безупинного 10конного нейлону (MS/9, Ethilon, Ethicon Inc., 21 77402 22 0 нейлонового шва, що закриває артеріотомію. фосфатного буферного розчину при 37°С. ВиміПідфарбовані еластином стекла сфотографували рювали час, що пройшов від моменту надрізу до за допомогою цифрового фотоапарата KODAK DC зупинки кровотечі, та визначали його як тривалість 120 Zoom (Eastman KODAK Company, Rochester, кровотечі. Кількість тромбоцитів визначали шляNY). На цей момент повинні вже були бути помітні хом добору 1-1,5см3 зразків крові з яремної вени, будь-які тромбозні сегменти. Нетромбозні зобрааналізували зразки в аналізаторі крові Coulter ження завантажили в комп'ютер, області порожнин STKS та виражали результати у вигляді дасонних артерій проаналізували за допомогою проних 103. грами National Institutes of Health (Bethesda, MD), Приклад 10 Image Software, Version 0.99f. Цей пакет програм Статистичні методи дозволив нам окреслити внутрішню область гіперПредставлено значення ± стандартна похибка. плазії інтими і, таким чином, одержати точну оцінку Для порівняння кількості налиплих тромбоцитів, площі поперечного переріза порожнини судини. відсотка порожнинного стенозу та тривалості кроКрім того, була визначена зовнішня область гіпервотеч в оброблених Саратином та контрольних плазії інтими. Різницю між двома областями (зовпацюків, зробили непарний аналіз t-тест із викоринішня площа гіперплазії інтими мінус дана порожстанням програми Stat View [SAS Institute Inc. Сагу, нина) визначили як абсолютну площу гіперплазії NC 27513] версія 5.0. Відношення правдоподібносінтими. Оскільки артеріальний поперечний переріз ті в аналізі хі-квадратів використовували для оцінмав індивідуальні варіації форми, значення були ки імовірності успішного результату для розвитку виражені як відношення абсолютної площі гіперптромбозу через два тижні після ендартеректомії лазії інтими до зовнішньої границі гіперплазії інтисонної артерії. Для оцінки розходжень доопераційми, та про їх згадується як про відсоток порожнинної та післяопераційної кількостей тромбоцитів ного стенозу. Це відношення представляє частку використовували 2 2 конфігурацію точок плану площі порожнини, зайняту гіперплазією інтими, та факторного експерименту, оброблених по моделі дозволяє робити порівняння поперечних перерізів ANОVA. артерій різних розмірів (4). Між вимірами, що наПриклад 11 осліп робили два спостерігачі, виявлялися мінімаЕкспериментальні тварини льні розбіжності. Пацюків Sprague-Dawley (350-400г) об'єднали Приклад 9 в групи для ендартеректомії сонної артерії, призТривалість кровотеч та кількість тромбоцитів начені для двох головних цілей. 1) Оцінка адгезії Щоб оцінити вплив Саратину на кількість систромбоцитів та 2) Оцінка швидкості порожнинного темних тромбоцитів та тривалість кровотеч, була стенозу, обумовленого гіперплазією інтими, та обмірювана кількість системних тромбоцитів та швидкості тромбозу. В плані досягнення цих двох тривалість кровотеч у 12 пацюків. При необхідносголовних цілей, пацюків розділили на контрольних ті одержати зразки доопераційної крові кожного та оброблених Саратином тварин. Усіх пацюків пацюка, у них приходилося відбирати по 1-1,5см3 піддали ендартеректомії сонної артерії (див. нижкрові, що представляє значну частку загального че), оброблені Саратином пацюки одержали місобсягу крові тварини. З урахуванням цього факту, цеве призначення 5мкл розчину Саратину на пологічно було очікувати . зменшення кількості тромверхню порожнини сонної артерії відразу після боцитів після операції як у контрольних, так і в видалення інтими/шару середовища. Група адгезії оброблених Саратином пацюків. Тому, щоб оцінитромбоцитів складалася з електронномікроскопічти вплив Саратину на кількість тромбоцитів, ми ної оцінки через 3 години після ендартеректомії визначали різницю між кількостями тромбоцитів сонної артерії (n=17) та через 24 години після ендля кожного пацюка шляхом вирахування доопедартеректомії сонної артерії (n=19). Групу гіперпраційної кількості тромбоцитів з післяопераційної лазії інтими (n=25) присипляли через два тижні кількості тромбоцитів, та визначали розходження. після ендартеректомії сонної артерії. Розходження кількості тромбоцитів проаналізуваПриклад 12 ли з використанням 2 2 конфігурації точок плану Готування покритих Саратином гідрогелевих факторного експерименту, оброблених по моделі катетерів ANOVA, та продемонстрували відсутність статисПоверхні матеріалів на основі РА-12 активуватично значимих розходжень кількостей тромбоцили шляхом занурення пристроїв у розчин 2 мольтів між контрольними та обробленими Саратином них % макроініціатора полі(октадецен-алтпацюками. У всіх пацюків перед операцією були малеїноцтової кислоти ангідрид) з перефіром (11визначені кількості тромбоцитів та тривалості кро18 мольних %) , розчиненим у ізопропанолі, та вотеч. Шість пацюків піддали ендартеректомії сон0,5моля етиленгліколю або диметакрилату ної артерії, та через три години після операції при(EGDMA)/1моль макроініціатора. Потім висушуваспали та вимірили тривалості кровотеч та кількість ли покриття макроініціатор/EGDMA. Покриття відтромбоцитів, а інші 6 пацюків приспали через 24 палювали ще 5 разів по 10хв. при 120°С, що спригодини після операції та вимірили тривалості крояло поліпшенню фіксації макроініціатора на вотеч та кількість тромбоцитів. Три пацюки з кожповерхні і, таким чином, поліпшувало структуруної тимчасової групи одержували топічний Саравання. тин, а інші три пацюки використовувалися для Для оптимізації умов нанесення покриття, законтролю. стосовували вирощування гідрогелевих покрить на Тривалості кровотеч визначали за допомогою пластинках носія РА-12. Перед нанесенням покпоперечного надрізу дистальних 2мм хвоста париття, пластинки промивали ізопропанолом або цюків та занурення приблизно 4см хвоста в розчин ацетоном та висушували. 23 77402 24 Для покриття гідрогелем використовували баФіг.5. Число тромбоцитів, що прилипли до нелонний катетер типу Blue Medical Devises GO (казахищеної поверхні субендотелію через 24 години тетер RX PTC A) , що складається з Vestamid (РАпісля ендартеректомії сонної артерії, зіставлення 12). Водяні розчини 5 мольних % акрилової кислоданих по групі із застосуванням Саратину (n=9) та ти 100мл та 0,2 біс 0,8 мольних % метилен-бісконтрольній групі (n=10). Дані означають ±SE. акрилової змішали та використовували для покТромбоцити підраховували за допомогою скануюриття пластинок або катетерів. Після полімеризачого електронного мікроскопа. Тварини Саратиноції, пристрій з покриттям промивали водою та ще вой групи одержували по 5мкл розчину Саратину 24 години в буфері PBS. місцево, на незахищену поверхню субендотелію. Після цього полімер відпалювали в печі при Зірочка вказує, що значення Ρ складає 0,01. 60-80°С від 0,5 до 3 годин. Фіг.6. Електронна мікрофотографія (2000 ) Товщина висушених гідрогелевих покрить знаендартеректомізованої сонної артерії пацюка чеходилася в інтервалі від 1 до 4мкм, розбухання рез 3 години після ендартеректомії сонної артерії. гідрогелю у водяному розчині варіювалося від 10 А, контрольна поверхня. В, поверхня, до якої місдо 50г гідрогелю вологого/1г гідрогелю сухого. цево застосовували Саратин (5мкл). На контрольПри зануренні (30хв.) у буферований буфером ній поверхні видні численні елементи клітин, вклюPBS рН7,4 розчин Саратину, використовували чаючи волокна фібрину, червоні кров'яні клітини та концентрації 50мкг мл-1. тромбоцити. На обробленій Саратином поверхні Для готування розчинів для покрить викорисвидне значне зменшення кількості клітинних елетовували органічні розчинники, а при напилюванні ментів. на балонний катетер використовували стандартне Фіг.7. Електронна мікрофотографія (2000 ) маломасштабне устаткування для нанесення покендартеректомізованої сонної артерії пацюка черить, що поставляє EFD. рез 3 години після ендартеректомії сонної артерії. Фіг.1. Вплив Саратину на зв'язування очищеА, контрольна поверхня. В, поверхня, до якої місного людського vWF з людським колагеном типу І цево застосовували Саратин (5мкл). На контроль(кружки), колагеном типу III (квадратики), колагеній поверхні видні численні червоні кров'яні клітином шкіри теляти (трикутники). Для колагену типу І ни та тромбоцити. На обробленій Саратином ІС50=0,23±0,004мкг мл-1, для колагену типу III поверхні видне значне зменшення адгезії тромбо0,81±0,04мкг мл-1 та для колагену шкіри теляти цитів. -1 0,44±0,008мкг мл . Фіг.8. Відсоток порожнинного стенозу, вторинФіг.2. Вплив зрушення на інгібування Саратиного стосовно гіперплазії інтими, через 2 тижні ном формування агрегатів тромбоцитів на людсьпісля ендартеректомії сонної артерії. Показані обкому колагені типу III у проточній камері in vitro. роблена Саратином (n=15), та контрольна групи Кружки означають швидкість зрушення 2700сек-1 (n=10). Тварини Саратинової групи одержували по -1 (ІС50=0,96±0,25мкг мл ), квадратики означають 5мкл розчину Саратину місцево, на незахищену швидкість зрушення 1300сек-1 поверхню субендотелію. Зірочка вказує, що зна-1 (ІС50=5,2±1,4мкг мл ). чення Ρ складає 0,004. Фіг.3. Аналіз Скетчарда даних по зв'язуванню Фіг.9. Поперечний переріз сонної артерії свідСаратину з іммобілізованим людським колагеном, чить про зменшення гіперплазії інтими в оброблеотриманих методом резонансу поверхневих плазних Саратином артеріях (В) у порівнянні з неопрамонів, свідчить про наявність на колагені III єднацьованими артеріями (А) контрольних пацюків, ІН= льних Саратин сайтів з високою спорідненістю гіперплазія інтими. (Kd=5 10-8Μ, суцільна лінія) та низькою спорідненіТаблиця 1. Концентрації ІС50 Саратину, необстю (10=2 10-6Μ, пунктирна лінія). хідні для інгібування адгезії тромбоцитів у PRP з Фіг.4. Число тромбоцитів, що прилипли до нерізних видів, що утворюють зв'язки з людським захищеної поверхні субендотелію через 3 години колагеном типів І та III, а також колагеном шкіри після ендартеректомії сонної артерії, зіставлення теляти. даних по групі із застосуванням Саратину (n=7) та Таблиця 2. Вплив Саратину на максимальну контрольній групі (n=10). Дані означають ±SE. агрегацію тромбоцитів (%) у PRP, індуковану різТварини Саратинової групи одержували по 5мкл ними агоністами, кінцева концентрація реагентів розчину Саратину місцево, на незахищену повервідповідає зазначеній. хню субендотелію. Зірочка вказує, що значення Ρ Таблиця 3. Доопераційні та післяопераційні складає 0,05. тривалості кровотечі та кількості тромбоцитів. Таблиця 1 Джерело плазми Людина Свиня Хом'як Миша Колаген типу l 0,2 0,2 0,4 0,1 ІС50 Саратину (мкг мл-1) Колаген типу III 0,9 0,5 n.t. 0,6 Колаген. Шкіри теляти 0,3 0,5 7,0 0,3 Таблиця 2 25 Агоніст Колаген (0,5мкг мл-1) ADP (2,5мкМ) Рістоцетин (0,9мкг мл-1) Арахідонова кислота (1,0мМ) U46619 (1,0мкМ) 77402 26 Агрегація (%) при вказаних концентраціях Саратину (мкг мл-1) 0 10 20 40 200 62 67 63 64 0 60 64 69 82 88 61 67 75 63 n.t. 66 66 67 57 n.t. ее 65 57 56 n.t. Таблиця 3 Час До оп. Після оп. 3 години 3 години 24 години 24 години Умови Контроль саратін контроль саратін контроль саратін Кількість тромбоцитів 752±36,05 103 839±33,85 103 604±34,2 103 590±76 103 694±117 103 729±19 103 Довгочасність кровотечі 11,9±0,91хв. 8,6±0,62хв. 10,8±0,9хв. 9,1±0,5хв. 12,9±1,1хв. 11,5±1,3хв. 27 Комп’ютерна верстка Т.Чепелева 77402 Підписне 28 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of saratin for inhibition platelet adhesion
Назва патенту російськоюПрименение саратина для ингибирования адгезии тромбоцитов
МПК / Мітки
МПК: A61K 38/17, A61P 7/02
Мітки: тромбоцитів, саратину, адгезії, застосування, інгібування
Код посилання
<a href="https://ua.patents.su/14-77402-zastosuvannya-saratinu-dlya-ingibuvannya-adgezi-trombocitiv.html" target="_blank" rel="follow" title="База патентів України">Застосування саратину для інгібування адгезії тромбоцитів</a>
Попередній патент: Пристрій для сприйняття радіального навантаження від передньої частини вала приводу вентилятора турбореактивного двигуна з подовжньою віссю
Наступний патент: Система лобового освітлення автомобіля
Випадковий патент: Спосіб отримання сухого знежиреного молока