Заміщені піперидином і піперазином n-гідроксиформаміди як інгібітори металопротеїназ
Номер патенту: 73155
Опубліковано: 15.06.2005
Автори: Н'юком Ніколас Джон, Даувелл Роберт Йан, Такер Говард, Фінлі Моріс Реймонд Версчойл, Барлаам Бернар Крістоф, Вотерсон Дейвід
Формула / Реферат
1. Сполука формули І або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo:
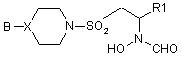 , (I)
, (I)
де В - фенільна група монозаміщена у 3-й або 4-й позиції галогеном або трифлуорметилом, або двозаміщена у 3-й або 4-й позиції галогеном (тим же або іншим); або В - 2-піридильна або 2-піридилоксильна група, монозаміщена у 4-й, 5-й або 6-й позиції галогеном, трифлуорметилом, ціаногрупою або С1-4алкілом; або В - 4-піримідинільна група, як варіант, заміщена у 6-й позиції галогеном або С1-4алкілом;
Х - атом карбону або нітрогену;
R1 - триметил-1-гідантоїн-С2-4алкільна або триметил-3-гідантоїн-С2-4алкільна група; або R1 - феніл або С2-4алкілфеніл, монозаміщений у 3-й або 4-й позиції галогеном, трифлуорметилом, тіо- або С1-3алкільною, або С1-3алкоксильною групою; або R1 - феніл-SO2NНС2-4алкіл; або R1 - 2-піридил або 2-піридил-С2-4алкіл; або R1 - 3-піридил або 3-піридил-С2-4алкіл; або R1 - 2-піримідин-SСH2СН2; або R1 - 2- або 4-піримідиніл-С2-4алкіл, як варіант, монозаміщений галогеном, трифлуорметилом, С1-3алкілом, С1-3алкоксилом, 2-піразинілом, як варіант, заміщеним галогеном або 2-піразиніл-С2-4алкілом, як варіант, заміщеним галогеном.
2. Сполука за п. 1 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що:
В - фенільна група монозаміщена у 3-й або 4-й позиції галогеном або трифлуорметилом, або двозаміщена у 3-й або 4-й позиції галогеном (тим же або іншим); або В - 2-піридильна або 2-піридилоксильна група, монозаміщена у 5-й або 6-й позиції галогеном, трифлуорметилом або ціаногрупою; або В - 4-піримідинільна група, як варіант, заміщена у 6-й позиції галогеном або С1-4алкілом;
Х - атом карбону або нітрогену;
R1 - триметил-1-гідантоїн-С2-4алкільна або триметил-3-гідантоїн-С2-4алкільна група; або R1 - феніл або С2-4алкілфеніл, монозаміщений у 3-й або 4-й позиції галогеном, трифлуорметилом, тіо- або С1-3алкільною, або С1-3алкоксильною групою; або R1 - феніл-SO2NНС2-4алкіл; або R1 - 2-піридил або 2-піридил-С2-4алкіл; або R1 - 3-піридил або 3-піридил-С2-4алкіл; або R1 - 2-піримідин-SСН2СН2; або R1 - 2- або 4-піримідиніл-С2-4алкіл, як варіант, монозаміщений галогеном, трифлуорметилом, С1-3алкілом, С1-3алкоксилом, 2-піразинілом або 2-піразиніл-С2-4алкілом.
3. Сполука за п. 1 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що В вибрано з групи, яку утворюють 4-хлорфеніл, 4-флуорфеніл, 4-бромфеніл, 4-трифлуорфеніл, 5-хлор-2-піридил, 5-флуор-2-піридил, 5-бром-2-піридил, 5-трифлуорметил-2-піридил, 5-ціано-2-піридил і 5-метил-2-піридил.
4. Сполука за п. 3 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що В - 4-флуорфеніл, 5-хлор-2-піридил або 5-трифлуорметил-2-піридил.
5. Сполука за будь-яким з попередніх пп. або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що Х - атом нітрогену.
6. Сполука за будь-яким з попередніх пп. або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що R1 вибрано з групи, яку утворюють 3-хлорфеніл, 4-хлорфеніл, 3-піридил, 2-піридилпропіл, 2- або 4-піримідинілетил (як варіант, монозаміщений флуором), 2- або 4-піримідинілпропіл, 2-(2-піримідиніл)пропіл (як варіант, монозаміщений флуором).
7. Сполука за п. 6 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що R1 - 2-піримідинілпропіл, 2-(2-піримідиніл)пропіл (як варіант, монозаміщений флуором) або 5-флуор-2-піримідинілетил.
8. Сполука за п. 1 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що вона вибрана з групи, яку утворюють
N-[1-([4-(4-бромфеніл)піперазин]сульфонілметил)-4-піримідин-2-ілбутил]-N-гідроксиформамід,
N-[1-([4-(5-хлорпіридин-2-іл)піперазин]сульфонілметил)-3-(5-флуорпіримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-бромпіридин-2-іл)піперазин)сульфоніл}метил)-4-(піридин-2-іл)бутил]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(5-флуорпіримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1S)-1-({[4-(4-флуорфеніл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)-бутил]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1R)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-трифлуорметилпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1R)-1-({{4-(5-трифлуорметилпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-бромпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1R)-1-({[4-(5-бромпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1S)-1-({[4-(5-трифлуорметилпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-N-гідроксиформамід,
N-({[4-флуорфенілпіперазин]сульфоніл}метил)-3-[(5-флуорпіримідин-2-іл)пропіл]-N-гідроксиформамід,
N-[(1R або 1S)-({[4-хлорфенілпіперазин]сульфоніл}метил)-3-(3R або 3S)-(5-флуорпіримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1R або 1S)-({[4-бромфенілпіперазин]сульфоніл}метил)-3-[(3R або 3S)-(5-флуорпіримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1R або 1S)-({[4-хлорфенілпіперидин]сульфоніл}метил)-3-(3R або 3S)-(5-флуорпіримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1R або 1S)-({[3,4-дихлорфенілпіперазин]сульфоніл}метил)-3-(3R або 3S)-(5-флуор-піримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1R або 1S)-({[4-(5-ціанопіридин-2-іл)піперазин]сульфоніл}метил)-3-{(3R або 3S)-(5-флуорпіримідин-2-іл)бутил]-N-гідроксиформамід,
N-[(1S)-({[4-(4-флуорфеніл)піперазин]сульфоніл}метил)-3-(3S)-(5-флуорпіримідин-2-іл)бутил]-N-гідроксиформамід,
1-({[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}метил)-3-(5-хлорпіридин-3-іл)пропіл(гідрокси)формамід.
9. Сполука за будь-яким з попередніх пп. або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що сполука формули І є найактивнішим енантіомером.
10. Сполука за будь-яким з попередніх пп. або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, яка відрізняється тим, що сполука формули І є S-енантіомером або S,S-енантіомером.
11. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, призначені для використання у терапевтичному лікуванні тіла людини або тварини.
12. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, призначені для використання як терапевтичний засіб.
13. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або попередник, що здатний до гідролізу in vivo, яка відрізняється тим, що її використовують у виготовленні медикаменту, призначеного для лікування хворобливого стану, опосередкованого одним або більше ензимами металопротеїнази.
14. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або попередник, що здатний до гідролізу in vivo, яка відрізняється тим, що її використовують у виготовленні медикаменту, призначеного для використання у лікуванні артриту.
15. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або попередник, що здатний до гідролізу in vivo, яка відрізняється тим, що її використовують у виготовленні медикаменту, призначеного для використання у лікуванні атеросклерозу.
16. Сполука формули І за п. 1 або її фармацевтично прийнятні сіль або попередник, що здатний до гідролізу in vivo, яка відрізняється тим, що її використовують у виготовленні медикаменту, призначеного для використання у лікуванні хронічних обструктивних легеневих захворювань.
17. Фармацевтична композиція, яка містить сполуку формули І, вказану в п. 1, або її фармацевтично прийнятні сіль або естер, що здатний до гідролізу in vivo, і фармацевтично прийнятний носій.
18. Спосіб лікування хворобливого стану, опосередкованого металопротеїназою, при якому вводять теплокровній тварині терапевтично ефективну кількість сполуки формули І або її фармацевтично прийнятних солі або естеру, здатного до гідролізу in vivo.
19. Спосіб за п. 18, при якому лікують хворобливий стан, опосередкований одним або більше з таких ензимів: ММП13, агреканаза, ММП9, ММП12.
20. Спосіб одержання сполуки формули І або її фармацевтично прийнятних солі або естеру, здатного до гідролізу in vivo,
при якому здійснюють введення сполуки формули II в реакцію з сполукою формули R1CHO для одержання алкену формули III, перетворенням цього алкену в сполуку формули IV і перетворення сполуки формули IV в сполуку формули І, і, як варіант, утворення після цього фармацевтично прийнятної солі або естеру, здатного до гідролізу in vivo, з сполуки формули І, згідно з схемою:
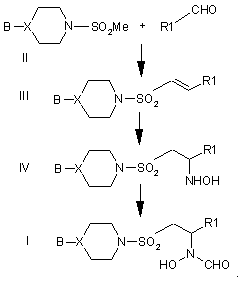
21. Спосіб одержання сполуки формули І або її фармацевтично прийнятних солі або естеру, здатного до гідролізу in vivo,
при якому здійснюють введення сполуки формули II в реакцію з сполукою формули R1COOR з одержанням сполуки формули VIII, перетворення сполуки формули VIII у сполуку формули IX, перетворення сполуки формули IX в алкен формули III, перетворення цього алкену в сполуку формули IV і потім перетворення сполуки формули IV в сполуку формули І, і, як варіант, утворення після цього фармацевтично прийнятних солі сполуки І або її естеру, здатного до гідролізу in vivo, згідно з схемою:
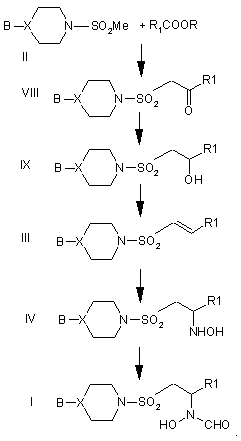
Текст
Винахід стосується сполук, придатних для інгібування металопротеїназ, зокрема, у фармацевтичних композиціях, а також їх використання. Сполуки винаходу є інгібіторами одного або кількох ензимів протеїназ. Металопротеази є надродиною протеїназ (ензимів), кількість яких значно зросла протягом останніх років. Структурно і функціонально ці ензими були класифіковані на родини і підродини, як це описано у N.M. Hooper (1994) FEBS Letters 354:1-6. Прикладами металопротеїназ можуть бути такі матричні металопротеїнази (ММП), як колагенази (ММП1б ММП8б ММП13), желатинази (ММП2, ММП9), стромелізини (ММП3, ММП10, ММП11), матрилізин (ММП7), металоеластаза (ММП12), енамелізин (ММП19), МТ-ММПи (ММП14, ММП15, ММП16, ММП17); репролізин або адамалізин, або родина MDC, яка включає такі секретази і шедази, як конвертуючі TNF ензими (ADAM10 і ТАСЕ); астицинова родина, яка включає такі . ензими, як обробляюча проколаген протеїназа (РСР); і інші металопротеїнази, наприклад, агреканаза; конвертуюча ендотелій родина ензимів і родина, що конвертує ангіотензин. Вважають, що металопротеїнази є важливим фактором у багатьох фізіологічних хворобливих процесах, які включають таку перебудову тканини, як ембріональний розвиток, утворення кісток і перебудову матки під час менструації. Причиною цього є здатність металопротеїназ розщеплювати велику кількість типів таких матричних субстратів, як колаген, протеоглікан і фібронектин. Металопротеїнази, як вважається, є важливими у процесах обробки або секреції важливих біологічних клітинних медіаторів, наприклад, фактора некрозу пухлини (TNF); і посттрансляційної протеолізної обробки, або розщеплення таких біологічно важливих протеїнів мембрани, як рецептор CD23 низької афіності ІдЕ (більш повний перелік можна знайти у N.M. Hooper et al., (1997) Biochem J. 321:265-279). Металопротеїнази пов'язані з багатьма хворобливими станами. Інгібування активності однієї або кількох металопротеїназ може суттєво допомогти у лікуванні таких станів, як різні запалювальні і алергічні захворювання, наприклад, запалення суглобів (особливо ревматоїдний артрит, остеоартрит і подагра), запалення шлунково-кишкового тракту (особливо запалення кишечника, виразковий коліт і гастрит), запалення шкіри (особливо псоріаз, екзема, дермитит); пухлинні метастази або інвазії; хвороби, пов'язані з неконтрольованою деградіцією позаклітинної матриці, наприклад, остеоартрит; кісткові резорптивні хвороби (наприклад, остеопороз і хвороба Паже); захворювання, пов'язані з аберантним ангіогенезом; переродження колагену, пов'язане з діабетом, періодонтальною хворобою (гінгівіт), виразка роговиці, виразка шкіри, постопераційні стани (наприклад, прорив прямої кишки) і заживлення пошкоджень шкіри; деміелінаційні захворювання центральної і периферійної нервової системи (наприклад, множинний склероз); хвороба Альцгеймера; переродження позаклітинної матриці, пов'язане з серцево-судинними захворюваннями (наприклад, рестеноз і атеросклероз); і хронічні хвороби утруднення дихання, COPD (наприклад, роль таких ММП, як ММП12, розглянута у Anderson і Shinagawa, 1999, Current Opinion in Anti-inflammatory і Immunomodulatory Investigational Drugs, 1(1): 29-38. Серед відомих інгбіторів металопротеїнази різні класи сполук мають різну силу дії і селективність при інгібуванні різних металопротеїназ. Ми виявили новий клас сполук, які є інгібіторами металопротеїназ, зокрема ММП-13 і ММП-9. Сполуки винаходу мають лікувальну дію і/або фармакінетичні якості. ММП13, або колагеназа 3, була спочатку клонована з бібліотеки сДНК, одержаної з пухлини грудей (J.M.P. Freije et al., (1994), Journal of Biological Chemistry, 269(24): 16766-16773). Аналіз PSR-RNA РНК з широкого набору тканин показав, що експресія ММП13 обмежується карциномою грудей, оскільки вона не була виявлена у фіброаденомах грудей, нормальних або спокійних, у плаценті, печінці, яєчниках, матці, простаті або паротидній залозі або у лініях клітин раку грудей (T47-D, MCF-7 і ZR75-1). Після цих спостережень ММП13 була виявлена у трансформованих кератиноцитах епідерми (N. Johansson et al., (1997), Cell Growth Differ., 8(2): 243-250), у карциномах лускатих клітин (N. Johansson et al., (1997), Am. J. Pathol., 151(2): 499-508), і епідермальних пухлинах (К. Airola et al., (1997), J. Invest. Dermatol., 109(2): 225-231). Ці результати дозволяють припустити, що ММП13 виробляється трансформованими епітеліальними клітинами і, можливо, беруть участь у деградації позаклітинної матриці і взаємодії клітина-матриця, пов'язаних з метастазами, особливо, згідно з спостереженнями, з пошкодженнями, викликаними інвазійним раком грудей, і з злоякісним розростанням епітелію при карциногенезі шкіри. Нещодавно опубліковані дані вказують, що ММП впливає на перетворення інших з'єднувальних тканин. Наприклад, специфічність ММП13 до субстратів і селективність до деградації колагену типу II дозволяє припустити, що вона бере участь у первісній осифікації і скелетному ремоделюванні (P.G. Mitchell et al., (1996), J. Clin. Invest., 97(3): 761-768; V. Knauper et al., (1996), The Biochemical Journal, 271: 1544-1550; M.StahleBackdahl et al., (1997), Lab. Invest., 76(5): 717-728; N. Johansson et al., (1997), Dev. Dyn., 208(3): 387-397), у таких деструктивних кісткових захворюваннях, як ревматоїдний і остеоартрит (D. Wernicke et al., (1996), J. Rheumatol., 23: 590-595; P.G. Mitchell et al., (1996), J. Clin. Invest., 97(3): 761-768; O. Lindy et al., (1997), Arthritis Rheum, 40(8): 1391-1399) і у асептичному послабленні протезу стегна (S. Imai et al., (1998), J. Bone Joint Surg. Br., 80(4): 701-710). Був відзначений зв'язок ММП13 з хронічним періодонтитом у дорослих, оскільки був виявлений у епітелії хронічно запаленої слизової (V.J. Uitto et al.,(1998), Am. J. Pathol., 152(6): 1489-1499), і з ремоделюванням колагенної матриці у хронічних ранах (М. Vaalamo et al., (1997), J. Invest. Dermatol., 109(1): 96-101). ММП9 (желатиназа В; колагеназа типу IV, 92кДа; желатиназа 92кДа) є протеїном секреції, який був спочатку очищений і потім клонований, з встановленням послідовності, у 1989 (S.M. Wilhelm et al., (1989), J. Biol. Chem., 264(29): 17213-17221). Публікація erratum - J. Biol. Chem., (1990), 265(36): 22570). Останній огляд щодо ММП9 дає детальну інформацію про цю протеазу: Т.Н. Vu & Z. Werb (1998), Matrix Metalloproteinases, Ed. W.C. Parks & R.P. Mecham., pp 115-148. Academic Press. ISBN 0-12-545090-7). Авторами були відзначені такі особливості. Експресія ММП9 нормально обмежується нечисленними типами клітин, включаючи трофобласти, остеокласти, нейтрофіли і макрофаги. її експресія у цих і інших клітинах може бути індукована кількома медіаторами, включаючи піддання клітин дії факторів росту або цитокінам. Ці медіатори часто ініціюють запалювальну реакцію. Як і інші ММП секреції, ММП9 вивільняється як неактивний проензим, який у подальшому розщеплюється з утворенням ензиматично активного ензима. Протеази, потрібні для такої активації in vivo, невідомі. Баланс між активною ММП9 і неактивним ензимом in vivo регулюється взаємодією з ТІМР-1 (інгібітор тканини протоїнази-1), протеїном природного походження. ТІМР-1 приєднується до Стермінального регіона ММП9, викликаючи інгібування каталітичного домена ММП9. Баланс індукованої експресії про-ММП9, розщеплення про- на активну ММП9 і присутності ТІМР-1 визначає рівень каталітично активної ММП9 у локальному сайті. Протеолітично активна ММП9 атакує субстрати, які включають желатин, еластин і природні колагени типів IV і V; вона не виявляє активності проти природного колагену типу І, протеогліканів або ламінинів. Є дані, що виявляють роль ММП9 у різних фізіологічних і патологічних процесах. Участь у фізіологічних процесах включає інвазію ембріональних трофобластів через епітелій матки на ранніх стадіях імплантації ембріона; ММП9 бере деяку участь у рості і розвитку кісток і у міграції запалювальних клітин з судин у тканини. Підвищену експресію ММП9 спостерігали у певних патологічних станах, наприклад, при артриті, метастазах пухлин, склерозі Альцгеймера і множинному склерозі і розриві тканини при атеросклерозі, який веде до гострих коронарних станів, наприклад, інфаркту міокарду. Об'єктом винаходу є сполуки загальної формули B-X-(CH2)m-(CR1R2)n-W-COY, призначені для використання у виготовленні медикаменту для профілактики станів, пов'язаних з матричними металопротеїназами. Бажаною є сполука формули N-{1S-[4-(4-хлорфеніл)піперазин-1сульфонілметил]-2-метилпропіл}-N-гідроксиформамід. Ми знайшли сполуки, які є потужними інгібіторами ММП13 і мають бажаний профіль активності. Першим об'єктом винаходу є сполука формули 1 де В - фенільна група монозаміщена у 3-й або 4-й позиції галогеном або трифлуорметилом, або двозаміщена у 3-й або 4-й позиції галогеном (тим же або іншим); або В репрезентує 2-піридильну або 3піридилоксильну групу, монозаміщену у 4-й, 5-й або 6-й позиції галогеном, трифлуорметилом, ціаногрупою або С1-4алкілом; або В репрезентує 4-піримідинільну групу, як варіант, заміщену у 6-й позиції галогеном або С1-4алкілом; X - атом карбону або нітрогену; R1 - триметил-1-гідантоїн-С2-4алкільна або триметил-3-гідантоїн-С2-4алкільна група; феніл або С24алкілфеніл, монозаміщений у 3-й або 4-й позиції галогеном, трифлуорметилом, тіо- або С1-3алкільною, або С13алкоксильною групою; феніл-SО2NНС2-4алкіл; 2-піридил або 2-піридил-С2-4 алкіл; 3-піридил або 3-піридил-С22-піримідин-SСН2СН2; 2- або 4-піримідиніл-С2-4 алкіл, монозаміщений одним галогеном, 4алкіл; трифлуорметилом, C1-3алкілом, С1-3алкоксилом, 2-піразинілом, як варіант, заміщеним галогеном або 2піразиніл-С2-4алкілом, як варіант, заміщеним галогеном; Будь-яка згадана вище алкільна група може бути одноланцюговою або розгалуженою. Бажаними є сполуки, у яких: В - 4-хлорфеніл, 4-фторфеніл, 4-бромфеніл або 4-трифлуорфеніл; 2-піридил або 2-піридилоксил, монозаміщений у 4-й або 5-й позиції такими сполуками, як 5-хлор-2-піридил, 5-фтор-2-піридил, 5-бром-2піридил, 5-трифлуорметил-2-піридил, 5-ціано-2-піридил, 5-метил-2-піридил; особливо, 4-фторфеніл, 5-хлор-2піридил або 5-трифлуорметил-2-піридил; X - атом нітрогену; R1 - 3-хлорфеніл, 4-хлорфеніл, 3-піридил, 2-піридилпропіл, 2- або 4-піримідинілетил (як варіант, заміщений фтором), 2- або 4-піримідинілпропіл, 2-(2-піримідиніл)пропіл (як варіант, заміщений фтором); особливо 2-піримідинілпропіл, 2-(2-піримідиніл)пропіл (як варіант, заміщений фтором) або 5-фтор-2піримідинілетил. Серед сполук формули І особливу підгрупу утворюють сполуки, у яких В - фенільна група, монозаміщена у 3-й або 4-й позиції галогеном або трифлуорметилом, або двозаміщена у 3-й або 4-й позиції галогеном (тим же або іншим); або В - 2-піридильна або 3-піридилоксильна група, монозаміщена у 4-й, 5-й або 6-й позиції галогеном, трифлуорметилом або ціаногрупою; або В - 4-піримідинільна група, як варіант, заміщена у 6-й позиції галогеном або С 1-4алкілом; X - атом карбону або нітрогену; R1 - триметил-1-гідантоїн-С2-4алкільна або триметил-3-гідантоїн-С2-4алкільна група; або R1 - феніл або С2-4алкіл-феніл, монозаміщений у 3-й або 4-й позиції галогеном, трифлуорметилом, тіо- або С1-3алкільною або С1-3алкоксильною групою; або R1 - фенілSО2NНС2-4алкіл; або R1 - 2-піридил або 2-піридил-С2-4алкіл; або R1 - 3-піридил або 3-піридил-С2-4алкіл; або R1 - 2-піримідин-SСН2СН2; або R1 - 2- або 4-піримідиніл-С2-4алкіл, як варіант, монозаміщений галогеном, трифлуорметилом, С1-3алкілом, C1-3алкоксилом, 2-піразинілом, як варіант, заміщеним галогеном або 2піразиніл- С2-4алкілом; будь-яка з цих алкільних груп може бути одноланцюговою або розгалуженою. Слід відзначити, що замісники і їх кількість у В і/або R1 обрані таким чином, щоб уникнути стерично небажених комбінацій. Кожний з наведених прикладів сполук є незалежним об'єктом винаходу. Якщо сполуки формули І мають оптично активні центри, винахід включає індивідуальні оптично активні форми і їх комбінації, а також їх відповідні рацемати. Рацемати можуть бути розділені на окремі оптично активні форми з допомогою відомих процедур [див. Advanced Organic Chemistry, 3-d Ed, J. March, pp 104-107], наприклад, утворенням дистереомеричних похідних, що мають зручні оптично активні додаткові екземпляри, з подальшим відділенням і розщепленням цих додаткових екземплярів. Сполуки згідно з винаходом можуть містити один або більше асиметрично заміщених атомів карбону. Наявність таких асиметричних (хіральних) центрів може породити стереоізомери. В об'єм винаходу входять ці стереоізомери, включаючи енантіомери і діастереомери і їх суміші, включаючи рацемічні суміші. У прикладах розглянуті ізоляція і характеризація певних енантіомерів. Вони можуть бути приготовлені реакцією рацемічного матеріалу з хіральним додатком, з сепарацією утворених діастереомерів хроматографією і з подальшим розщепленням хірального додатку. Діастереомер, елюйований з колонки другим (за описаних вище умов), після розщеплення дає енантіомер, що має вищу активність при випробуванні. Ми вважаємо, що у кожному випадку активний стереомер має S-стереохімію, але не обмежуємось цим визначенням. Активний енантіомер характеризується його похідною, елюйованою другою з сепараторної колонки. При використанні різних сполук формули І, різних колонок і/або розчинів може порушити порядок елюювання найактивнішого енантіомера. У прикладах розглянуті ізоляція і характеризація певних діастереомерів. Хроматографічна сепарація з подальшим випробуванням показали, що більш активний діастереомер елююється з сепараторної колонки першим (тобто більш активний діастереомер елююється з колонки першим). При використанні різних сполук формули І, різних колонок і/або розчинів може порушити порядок елюювання найактивнішого діастереомера. Ми вважаємо, що сполуки формули І з двома хіральними центрами мають S,S-стереохімію, але не обмежуємось цим визначенням. Коли сполуки формули І мають таутомери, ми розглядаємо всі таутомеричні форми і їх комбінації і включаємо їх в об'єм винаходу як втілення. Як уже відзначалось, сполуки винаходу є інгібіторами металопротеїнази, зокрема інгібіторами ММЛ13. Кожна сполука формули І є окремим незалежним втіленням винаходу. Не зв'язуючи себе теоретичними міркуваннями, ми вважаємо, що сполуки винаходу мають селективну інгібуючу дію у будь-яких випадках інгібування ММП1. На необмежуючому прикладі можна показати 100-1000-разову селективність відносно інгібіторної активності ММП1. Деякі сполуки винаходу можуть бути використані як інгібітори агреканази, тобто інгібітор деградації агрекану. Інші сполуки винаходу можуть бути використані як інгібітори ММП9 і/або ММП12. Сполуки винаходу можуть бути фармацевтично прийнятними солями, включаючи такі кислотно адитивні солі, як-то гідрохлоридні, гідробромідні, цитратні і малеатні солі і солі фосфорної і сульфурової кислот. У іншому варіанті придатними є такі основні солі, як солі лужних металів, наприклад, натрію або калію, солі лужноземельних металів, наприклад, кальцію або магнію і органічні аміносолі, наприклад, триетиламін. Вони можуть також бути естерами, здатними до гідролізу in vivo. Ці естери є фармацевтично прийнятними естерами, які зазнають гідролізу у тілі людини з утворенням материнської сполуки. Такі естери можуть бути ідентифіковані введенням сполуки, наприклад, внутрішньовенно тестовим тваринам з подальшим аналізом рідин тіла тварини. Придатні in vivo карбоксильні естери включають метоксиметил, а гідроксильні включають форміл і ацетил, бажано, ацетил. При використанні сполуки формули І або її фармацевтично прийнятних солі або естеру, здатного до гідролізу in vivo, для лікування (включаючи профілактику) тварин, зокрема людини, їх виготовляють у вигляді композицій згідно з стандартною фармацевтичною практикою. Отже, ще одним об'єктом винаходу є фармацевтична композиція, яка включає сполуку формули І або її фармацевтично прийнятну сіль, або естер, здатний до гідролізу in vivo і фармацевично прийнятного носія. Фармацевтичні композиції згідно з винаходом можна вводити у будь-який стандартний спосіб, якого вимагає лікування, наприклад, орально, локально, парентерально, під'язично, назально, вагінально, ректально або інгаляцією. Сполуки винаходу можна виготовляти у будь-якій відомій формі, наприклад, у вигляді таблеток, капсуль, водних або масляних розчинів, суспензій, емульсій, кремів, мазей, желе, носових уприскувань, суппозиторіїв, тонкодисперсних порошків або аерозолей для інгаліції і стерильних водних або масляних розчинів, суспензій або емульсій для парентерального введення (включаючи внутрішньовенне, внутрішньом'язове або інфузією). На додаток до сполук винаходу фармацевтична композиція згідно з винаходом для лікування однієї або кількох з вищезазначених захворювань може включати один або більше інших фармакологічних агентів або може вводитись разом з ними (одночасно або у послідовності). Нормальна денна доза фармацевтичних композицій згідно з винаходом становить для людини 0,5-75мг на кг маси тіла (бажано, 0,5-30мг/кг). Денну дозу можна вводити частинами. Точна доза сполуки і спосіб введення залежать від маси, віку і статі пацієнта, а також від конкретного хворобливого стану, згідно з терапевтичними вимогами. Типова одинична доза містить приблизно 1-500мг сполуки винаходу. Отже, іншим об'єктом винаходу є сполука формули І або її фармацевтично прийнятна сіль, або естер, здатний до гідролізу in vivo, призначені для використання у способі лікування тіла людини або тварини, зокрема, їх використання для лікування захворювань або станів, медіаторами яких є ММП13 і/або агреканаза, і/або ММП9, і/або ММП12. Ще одним об'єктом винаходу є спосіб лікування медіованих металопротеїназою хворобливих станів, який включає введення теплокровній тварині терапевтично ефективної кількості сполуки формули І або її фармацевтично прийнятної солі, або естеру, здатного до гідролізу in vivo. Хворобливі стани, медіатором яких є металопротеїназа, включають артрит (наприклад остеоартрит, атеросклероз, хронічні захворювання з утрудненням дихання. Об'єктом винаходу є також процес приготування сполуки формули І або її фармацевтично прийнятної солі, або естеру, здатного до гідролізу in vivo, який включає введення сполуки формули II в реакцію з належною сполукою формули R1CHO для одержання алкену формули II з подальшим його перетворенням у сполуку формули IV, яка є пропрепаратом сполуки формули І, і, як варіант, включає утворення фармацевтично прийнятної солі, або естеру, здатного до гідролізу in vivo, з сполуки формули І, згідно з наведеною нижче схемою: Сполуку формули II можна одержати введенням сполуки формули V в реакцію з сполукою формули VI, у якій В' є пропрепаратом В, а X' репрезентує X або пропрепарат X, придатний для реакції з В'. Сполуку II можна також приготувати з сполуки VII за схемою: Деякі з вихідних матеріалів є комерційно доступними. Наведена далі таблиця містить деталі альдегідних проміжних сполук і їх номери у Хімічних Рефератах. RCHO Номери у Реєстрі Хімічних Рефератів 3-(2-піримідинілтіо)пропіональдегід 155957-56-5 3-(2-піразиніл)бутиральдегід 177615-94-0 3-фенілсульфоніламідопропанол 57483-28-0 4-(4-метоксифеніл)бутиральдегід 160093-24-3 4-(3-метоксифеніл)бутиральдегід 113504-55-5 Альдегіди, що не мають Номера Реєстру Хімічних Рефератів 3-(2-піримідил)пропіональдегід. До розчину 2-бромпіримідину (7,95г, 0,55М) у ацетонітрилі (150мл) додають пропаргіловий спирт (4,2г, 0,075М), біс(трифеніл-фосфін)паладій(ІІ)хлорид (750мг, 1мМ), іодид міді (100мг, 0,5М) і триетиламін (25мл, 0, 25М), суміш перемішують і гріють 2год. при 70°С. Додають пропаргіловий спирт (2,1г, 0,038М), біс-(трифенілфосфін)паладій(ІІ)хлорид (375мг, 0,5мМ) і іодид міді (50мг, 0,25М) і реакційну суміш гріють з перемішуванням ще 1год. при 70°С. Реакційну суміш випарюють до сухості, залишок адсорбують на силікагелі і хроматографують. Елюювання етилацетатом дає 3-(2-піримідил)проп-2-ін-3-ол у вигляді жовтої твердої речовини (4,45г, 66%). ЯМР (CDCI 3) 2,9(1Н, t), 4,5(2H, d), 7,3(1Н, d), 8,8(2H, t). MS-МН+135. 3-(2-піримідил)проп-2-ін-3-ол (4,45, 0,033М) розчиняють у етилацетаті (140мл), додають 10% Pd/C (890мг) і суміш перемішують в атмосфері гідрогену протягом 6год. Реакційну суміш фільтрують через Celite і фільтрат випаровують, одержуючи 3-(2-піримідил)пропан-1-ол у вигляді жовтого масла (4,15г, 91%). ЯМР (CDCI 3) 2,1(1Н, m), 3,2(2Н, t), 3,8(2Н, t), 7,2(1H, t), 8,7(2H, d). MS-MH+139. Для одержання 3-(2-піримідил)пропіональдегіду 3-(2-піримідил)пропан-1-ол окиснюють згідно з наведеною далі процедурою Сверна. До оксалілхлориду (14,3мл), розчиненого у ДХМ (700мл) додають ДМСО (21,3мл) при температурі -60°С. Через 15хвил. повільно додають спирт (20,8г), розчинений у ДХМ (20мл), а ще через 30хвил. - триетиламін (125мл). Через 15хвил. суміш доводять до кімнатної температури, після чого додають воду (100мл). Розчини розділяють і органічний шар промивають водою (3х150мл), сушать (MgSO4) і випаровують, одержуючи масло, яке очищують флеш-хроматографією з елюентом етилацетат/метанол (5%), одержуючи продукт у вигляді масла (8,71г, 43%). ЯМР (CDCI 3) 3,0(2Н, t), 3,4(2Н, t), 7,1 (1Н, t), 8,7(2Н, d), 9,9(1Н, s). За описаною вище процедурою одержують такі альдегіди: 4-(2-піримідил)бутиральдегід), використовуючи 3-бутин-1-ол замість пропаргілового спирту. ЯМР (CDCI 3) 9,8(1Н, s), 8,6(2H, m), 7,15(1Н, m), 3,0(2Н, m), 2,5(2Н, m), 2,2(2Н, m). 3-(2-піразиніл)пропіональдегід, використовуючи 2-бромпіразин замість 2-бромпіримідину. ЯМР (d6-ДМСО) 9,77(s, 1Н), 8,61(d, 1Н), 8,54(dd, 1Н), 8,46(d, 1Н), 3,10(t, 2Н), 2,92(t, 2H). 4-(2-піразиніл)бутиральдегід, використовуючи 2-бромпіразин замість 2-бромпіримідину і 3-бутин-1-ол замість пропаргілового спирту. ЯМР (d6-ДМСО) 9,68(s, 1H), 8,56(m, 2Н), 8,49(m, 1Н), 2,80(t, 2Н), 2,5(m, 2Н), 1,96 (m, 2Н). 4-(4-трифлуорметилпіримідин-2-іл)бутанал, використовуючи 2-хлор-4-трифлуор-піримідин (номер у реєстрі CAS - 33034-67-2) замість 2-бромпіримідину і 3-бутино-1-ол замість пропаргілового спирту. 1Н ЯМР (CDCI 3): 9,80(s, 1Н), 8,92(d, 1Н, J = 5,0Гц), 7,47 (d, 1H, J = 5,0Гц), 3,11(dd, 2H, J = 7,5, 7,5Гц), 2,60(dd, 2H, J = 6,1, 6,1Гц), 2,21(m, 3Н); 4-(5-фторпіримідин-2-іл)бутанал, використовуючи 2-хлор-5-фторпіримідин (номер у реєстрі CAS - 6280242-0) замість 2-бромпіримідину і 3-бутино-1-ол замість пропаргілового спирту. 1Н ЯМР (CDCI 3): 9,90(s, 1H), 8,52(s, 2H, J = 5,0Гц), 7,47,3,47(m, 2H), 3,33(dd, 2H, J = 6,8, 6,8Гц), 3,02(m, 2H). 4-(4-метоксипіримідин-2-іл)бутанал, використовуючи 2-хлор-4-метоксипіримідин (номер у реєстрі CAS 22536-63-6) замість 2-бромпіримідину і 3-бутино-1-ол замість пропаргілового спирту. 1 Н ЯМР (CDCI 3): 9,80(s, 1Н), 8,34(d, 1Н, J = 5,0Гц), 6,55(d, 1H, J = 5,0Гц), 3,97(s, 3Н), 2,91 (dd, 2H, J = 6,8, 6,8Гц), 2,58(m, 2H), 2,20(m, 2H). 4-(5-етилпіримідин-2-іл)бутанал, використовуючи 2-хлор-5-етилпіримідин (номер у реєстрі CAS - 11119681-7) замість 2-бромпіримідину і 3-бутино-1-ол замість пропаргілового спирту. 1Н ЯМР (CDCI 3): 9,79(s, 1H), 8,51 (s, 2H), 2,99(dd, 2H, J = 7,4, 7,4Гц), 2,54(m, 4H), 2,17 (p,1H, J = 7,4Гц), 1,04(t, 2H, J = 7,2Гц). 5-(2-піримідил)пентанал, використовуючи 2-бромпіримідин замість пропаргілового спирту. ЯМР (CDCI 3): 9,8(1Н, s), 8,65(2Н, m), 7,1 (1Н, m), 3,0(2Н, m), 2,5(2Н, m), 1,9(2Н, m), 1,7(2Н, m). 3-(5-бромпіримідин-2-іл)пропанал, використовуючи 2-іод-5-бромпіримідин замість 2-бромпіримідину. 1 Н ЯМР (CDCI 3): 9,90(s, 1H), 8,70(s, 2H), 3,30(dd, 2H), 3,0(dd, 2H). 4-(4-піримідил)бутан-1-ал. 2,4-дихлорпіримідин (4,47г, 0,03М ) розчиняють у триетиламіні (250мл) в атмосфері аргону. Додають (Ph3P)2PdCI 2 (420мг, 0,006М, Cul (28мг, 0,00015М) і 3-бутин-1-ол (2,36мл, 0,03М ) і суміш при кімнатній температурі перемішують 18год. Після випаровування до сухості додають воду (250мл) і екстрагують ДХМ. Об'єднані органічні фази сушать і випаровують до сухості. Залишок масла хроматографують з елюентом ізогексан/етилацетат (1:1) і одержують 4-(2-хлор-4-піримідил)-3-бутин-1-ол у вигляді масла (3,3г). ЯМР (CDCI 3): d 8,5, (d 1Н); 7,3, (d 1Н ); 3,9, (t 2Н ); 2,8, (m 2Н); 1,6, (s 1Н). MS-МН+ 183. Цей матеріал гідрують, як це було описано вище, але у присутності одного еквівалента триетиламіну, і одержують бажаний насичений спирт, який окиснюють описаним вище окисненням Свема і одержують бажаний 4-(4-піримідил)-бутан-1-ал. ЯМР (CDCI 3): d 9,8, (s 1H); 9,1; (s 1H); 8,5, (d 1H); 7,1, (d 1H); 2,8, (t 2H); 2,5, (t 2H); 2,1, (m 2H). Мас-спектр - МН+149. 3-(5-фторпіримідин-2-іл)пропанал. До розчину (Е)-1-етокси-3-(5-фторпіримідин-2-іл)проп-2-енілетилового естеру і (Z)-1-етокси-3-(5-фторпіримідин-2-іл)проп-2-еніл-етилового естеру (9,7г, 43ммоль) у сухому етанолі (100мл) при кімнатній температурі в атмосфері аргону з перемішуванням додають 10% паладію на активованому вугіллі (1,0г). Реакційну колбу евакуюють і заповнюють гідрогеном, суміш перемішують 18год. при кімнатній температурі, фільтрують через целітову прокладку і випаровують під зниженим тиском, одержуючи жовте масло (8,7г, 89%). До розчину цього масла (15г, 66ммоль) у ТГФ (200мл) при кімнатній температурі додають водний розчин гідрохлоридної кислоти (36мл 2М розчину, 72ммоль) і реакцію перемішують 3год. при кімнатній температурі, після чого розводять етилацетатом (100мл) і доводять pH суміші до 9 доданням насиченого водного розчину гідрокарбонату натрію (100мл). Шари розділяють і водну фазу екстрагують етилацетатом (3х100мл). Об'єднані органічні екстракти сушать (Na2SO4), фільтрують і випаровують під зниженим тиском, одержуючи 3-(5-фторпіримідин-2-іл)пропанал (16г), який використовують без очищення. 1 Н ЯМР (CDCI 3): 9,90(s, 1H), 8,50 (s, 2Н), 3,33 (dd, 2Н, J = 6,9, 6,9Гц), 3,00 (dd, 2Н, J = 6,9, 6,9Гц). Вихідний матеріал одержують у такий спосіб: до розчину 2-хлор-5-фторпіримідину (номер 62802-42-0 у реєстрі CAS) (9,0г, 68ммоль) і 1-трибутилстаніл-3,3-діетоксипроп-1-ену (42,8г, 102ммоль, суміш E:Z-ізoмерів (5:1)) у сухому ДМФ (140мл) в атмосфері сухого аргону додають послідовно твердий карбонат калію (9,4г, 68ммоль), хлорид тетраетиламонію (11,2г, 68ммоль) і хлорид біс(трифенілфосфінпаладію(ІІ) (2,4г, 3,4ммоль). Суміш гріють 3год. при 120°С, потім охолоджують до кімнатної температури і розводять водою (100мл) і діетилетером (150мл). Цю суміш фільтрують через целітову прокладку, шари розділяють і водну фазу екстрагують діетилетером (3х100мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і випаровують під зниженим тиском. Флеш-хроматографія (силікагель, 10% етилацетату у гексані) дає блідожовте масло і суміш Е- і Z-ізомерів (3:1, 9,7г, 63%). Е-ізомер: 1Н ЯМР (CDCI 3): 8,53 (s, 2Н), 6,99(dd, 1Н, J = 15,4, 4,1Гц), 6,86(d, 1Н, J = 15,4Гц), 5,14(d, 1H, J =4,1Гц), 3,56(m, 4H), 1,24(t, 6H, J = 7,1Гц). Z-ізомер: 1H ЯМР (CDCI 3): 8,57 (s, 2H), 6,65(d, 1H, J = 12,1Гц), 6,49(d, 1H, J = 7,5Гц), 6,09(dd, 1H, J = 12,1, 7,5Гц), 3,70(m, 4H), 1,21(t, 6H, J = 7,1Гц). У подібний спосіб, використовуючи належним чином заміщений 2-хлорпіримідин, одержують такі альдегіди: 3-(4-метоксипіримідин-2-іл)пропанал. 1Н ЯМР (CDCI 3): 9,82(s, 1H), 8,34(d, 1H, J = 8,4Гц), 6,55(d, 1H, J = 7,4Гц), 3,91 (s, 3Н), 3,28 (dd, 2H, J = 7,4, 7,4Гц), 2,99(dd, 2H, J = 7,4, 7,4Гц). 3-(4-трифлуорметилпіримідин-2-іл)пропанал. 1 Н ЯМР (CDCI 3): 9,92(s, 1Н), 8,90(d, 1Н, J = 5,0Гц), 7,47(d, 1H, J = 5,0Гц), 3,43 (dd, 2H, J = 6,8, 6,8Гц), 3,07(dd, 2H, J = 6,8, 6,8ГЦ). 3-(5-етилпіримідин-2-іл)пропанал. 1Н ЯМР (CDCI3): 9,91 (s, 1H), 8,49(s, 2H), 3,31 (dd, 2Н, J = 6,9, 6,9Гц), 2,98(dd, 2H, J = 6,9, 6,9Гц), 2,61 (q, 2H, J = 7,6Гц), 1,26(t, 3Н, J = 7,6Гц). 3,5,5-триметил-1-пропанолгідантоїн Розчин 3,5,5-триметилгідантоїну (CAS - 6345-19-3) (3,5г, 0,025моль), 2-(2-брометил)-1,3-діоксолану (4,8мл, 0,041моль), К2СО3 (8,5г, 0,062моль), хлориду бензил-триметиламонію (2,23г, 0,012моль) у MeCN (100мл) витримують під зворотним холодильником 24год. Після охолодження реакції до кімнатної температури її фільтрують, фільтрат випаровують у вакуумі, залишок вносять у ДХМ і промивають водою (х3) перед випаровуванням у вакуумі. Залишок азеотропують толуолом (х3) і одержують жовте масло (5,4г). Це масло перемішують у ТГФ (30мл) з конц. НСІ (4мл) при кімнатній температурі протягом 20год., потім нейтралізують водним NaHCO3 і екстрагують ДХМ (х8). Об'єднану органіку сушать над Na2SO4 і випаровують у вакуумі, одержуючи жовте масло (4,3г). 1Н ЯМР (CDCI 3): 9,82(s, 1Н), 3,62(t, 2Н), 3,04(s, 3Н), 2,90(m, 2H), 1,37(s, 6H). 1,5,5-триметил-3-пропаналгідантоїн 1,5,5-триметилгідантоїн (CAS -6851-81-6) (5,0г, 35,0моль) додають до суміші NaOEt (0,02г, 0,298ммоль, каталітичний) і EtOH (8мл) і перемішують під аргоном. Суміш доводять до 30°С перед повільним доданням акролеїну (2,35мл) і реакція екзотермує до 45°С. Реакцію охолоджують до кімнатної температури і перемішують ще 2год. Додають АсОН (0,136мл, 2,4ммоль) і силікагель (3,5г) перед випаровуванням у вакуумі. Продукт хроматографують на силікагелі (елюент: 5% ацетону/ДХМ) і одержують прозоре масло (6,2г). Подальше очищення залишка на алюмінії (елюент ДХМ) дає прозоре масло (2,7г). 1Н ЯМР (CDCI 3): 9,78(s, 1Н), 3,88(t, 2Н), 2,86(s, 3Н), 2,82(m, 2H), 1,37(s, 6H). Подібним чином одержують 1,5,5-триметил-3-бутаналгідантоїн (М+Н 213). 3-(3-хлорфеніл)бутиральдегід. Суміш 3-хлоріодбензолу (2,38г), ацетату паладію (20мг), бікарбонату натрію (1,01г) і кротилового спирту (1,28мл) у N-метилпіролідоні (4мл) перемішують і гріють 2год. при 150°С. Реакційну суміш охолоджують, додають воду (50мл) і екстрагують діетилетером (2х50мл). Об'єднані органічні екстракти сушать і видаляють розчинник. Залишок очищують хроматографією через силікагель з сумішшю етилацетату і метиленхлориду (1:20) як елюентом і одержують бажану сполуку у вигляді масла (519мг), М-Н = 181. 3-(2-піридил)бутиральдегід. Одержують окисненням за Свемом відповідного спирту (CAS 90642-86-7). 3-(5-фторпіримідин-2-іл)бутанал Концентровану гідрохлоридну кислоту з перемішуванням додають до розчину 2-[2-(1,3-діоксолан-2-іл)-1метилетил]-5-фторпіримідину (1,1г) у ТГФ (10мл) при кімнатній температурі, перемішують 3год. і додають твердий гідрокарбонат натрію до одержання нейтрального pH. Суміш вливають у касету Чемелюта (Chemelute) і промивають етилацетатом (3х20мл), об'єднану органіку сушать над Na2SO4 і випаровують у вакуумі, одержуючи 3-(5-фторпіримідин-2-іл)бутанал (300мг, 35%), який використовують без очищення. Вихідний матеріал одержують у такий спосіб: 2-[2-(1,3-діоксолан-2-іл)-1-метилетил}-5-фторпіримідин До суспензії активованого цинку "Rieke" у ТГФ (21мл, 1,53М) з перемішуванням додають 2-(2-бромпропіл)1,3-діоксолан (6,6г) у ТГФ (50мл), після спостереженого підйому температури з 21°С до 40°С гріють при 40°С протягом 1год., залишають охолодитись до кімнатної температури перед доданням 2-хлор-5-фторпіримідину (3г) і хлориду [1,2-біс(дифенілфосфін)-пропан]дихлорнікелю(ІІ) (368мг). Суміш перемішують 4год. при кімнатній температурі, фільтрують через целітову прокладку і фільтрат випаровують під зниженим тиском. Флеш-хроматографія (силікагель, гаксан - 25% етилацетату у гексанах дає блідожовте масло (1,1г). 1Н ЯМР (d6-ДМСО): 8,81 (s, 2Н), 4,73(dd, 1Н), 3,66-3,87(m, 4Н), 3,21-3-30(m, 1Н), 2,19 (ddd, 1Н), 1,83(ddd, 1Н), 1,27(d, 3Н); m/z 213 (М+1).. 2-(2-бромпропіл)-1,3-діоксолан Кротональдегід (9,18г, 108ммоль) краплями додають з перемішуванням до розчину бромтриметилсилану (24г, 156ммоль) при 0°С, перемішують 1год. при 0°С, розігрівають до кімнатної температури і перемішують ще 1год. Додають етиленгліколь (9,5г, 156ммоль) і р-толуолсульфонову кислоту (100m г), розчин гріють під зворотним холодильником і апаратом Діна-Старка видаляють воду. Після цього суміш охолоджують до кімнатної температури і промивають насиченим водним розчином гідрокарбонату натрію. Залишок очищують дистиляцією у вакуумі, одержуючи 2-(2-бромпропіл)-1,3-діоксолан (18,8г, 40-42°С, 1мм Hg, 89%). 1Н ЯМР (CDCI 3): 5,05(dd, 1H), 4,18-4,33(m, 1H), 3,84-4,0(m, 4H), 2,25(ddd, 1Н), 2,03(ddd, 1Н), 1,75(d, 3Н). У подібний спосіб, використовуючи належним чином заміщені 2-хлорпіримідин і 1,3-діоксолан, одержують такі альдегіди: 3-(5-хлорпіримідин-2-іл)пропанал 1 Н ЯМР (CDCI 3): 9,90(s, 1H), 8,60(s, 2H), 3,32(dd, 2H), 3,04(dd, 2H). 3-(5-хлорпіримідин-2-іл)бутанал 1 Н ЯМР (CDCI 3): 9,85(s, 1H), 8,60(s, 2H), 3,65(m, 1H), 3,14 (dd, 1H), 2,75 (dd, 1H), 1,39 (d, 3Н). 3-(2-(6-хлорпіразиніл)пропанол 3-[2-(6-хлорпіразиніл]пропаналдіетилацетал (200мг, 0,82ммоль) витримують з 2N гідрохлоридною кислотою (450мкл) у ТГФ (2,5мл) при кімнатній температурі протягом 18год. Після корекції pH до 8 насиченим водним бікарбонатом натрію реакцію екстрагують (х3) етилацетатом, органіку сушать (безводний сульфат натрію), фільтрують і концентрують у вакуумі. Одержане темнокоричневе масло (137мг, 98%) використовують без очищення. 1 Н ЯМР (CDCI 3): 9,85(1Н, s); 8,4(2Н, 2 х s); 3,5(2H, t); 3,0(2H, t). Початковий матеріал одержують у такий спосіб: 3-[2-(6-хлорпіразиніл)]пропаналдіетилацетал 3-[2-(6-хлорпіразиніл)]пропіналдіетилацетал (5,5г, 22,9ммоль) у етанолі (55мл) дегазують аргоном і додають оксид платини(ІV) (52мг, 0,23ммоль). Реакційну посудину евакуюють і створюють атмосферу гідрогену. Через 2 дні реакційну суміш концентрують у вакуумі і очищують флеш-хроматографією, елююючи з градієнтом 0-50% етилацетату у ізогексані, що дає 3-[2-(6-хлорпіразиніл)]пропаналдіетилацетал у вигляді блідожовтого масла (1,17г, 21%). 1 Н ЯМР (CDCI 3): d 8,4(1Н, s); 8,35(1H, s); 4,5(1H, t); 3,75-3,55(2H, m); 3,55-3,4(2H, m); 2,9(2H, dd); 2,1(2H, dd); 1,2(6H, t). 3-[2-(6-хлорпіразиніл)]пропіналдіетилацетал До розчину 2,6-дихлорпіразину (1г, 6,7ммоль) і пропіональдегіддіетилацеталу (1,1мл, 7,4ммоль) у ацетонітрилі (10мл) при кімнатній температурі в атмосфері аргону додають дихлорид біс(трифенілфосфін)паладію(ІІ) (94мг, 0,13ммоль) і іодид міді(І) (51мг, 0,27ммоль) і потім триетиламін (4,7мл, 33,6ммоль). Реакцію перемішують при кімнатній температурі протягом ночі. Розчин видаляють у вакуумі і залишок очищують флеш-хроматографією, з елюентом 10-20% етилацетату у ізогексані, одержуючи 3-[2-(6хлорпіразиніл)]пропіналдіетилцетал у вигляді жовтого масла (660мг, 41%). 1 Н ЯМР (CDCI 3): d 8,6(1Н, s); 8,55(1Н, s); 5,5(1Н, s); 3,9-3,75(2H, m); 3,7-3,4(2Н, m); 1,25(6H, t). m/s (Еl+) 241/243 (МН+). Альтернативний спосіб приготування сполуки формули І або її фармацевтично прийнятної солі, або естеру, здатного до гідролізу in vivo, включає введення сполуки формули II в реакцію з сполукою формули R1COOR для одержання сполуки формули VIII, перетворення її у сполуку формули IX, перетворення сполуки формули IX в алкен формули III, який потім перетворюється у сполуку формули IV, яка є пропрепаратом сполуки І, і, як варіант, включає утворення фармацевтично прийнятної солі сполуки І, або її естеру, здатного до гідролізу in vivo. Відповідні естери формули R1COOR можуть бути придбані комерційно або одержані за допомогою процедури, подібної до описаної у Прикладі 10. Зрозуміло, що можна використовувати будь-який естер формули R1COOR (де R1 була визначена раніше): R може бути будь-якою групою, наприклад, алкілом, аралкілом, гетероалкілом тощо. Сполуки винаходу можуть бути оцінені через наведені далі випробування. Випробування ізольованого ензима Родина матричних протоїназ, яка включає, наприклад, ММП13 Рекомбінантна людська проММП13 може бути експресована і очищена, як це було запропоновано у V. Knauper et al., (1996), The Biochemical Journal, 271: 1544-1550 (1996). Очищений ензим може бути використаний для спостереження активних інгібіторів: очищену проММП13 активували амінофенілртутною кислотою (АФРК) (1мМ) протягом 20год. при 21°С. Активовану ММП13 (11,25нг на кожний аналіз) інкубували 45год. при 35°С у аналітичному буфері (0,1М Tris-HCI, pH 7,5, містить 0,1М NaCI, 20мМ СаСІ 2, 0,02mМ ZnCI and 0.05% (маса/об'єм) Brij 35 з використанням синтетичного субстрата - 7-метоксикумарин-4іл)ацетил.Рrо.Lеu.СІу.Lеu.N-3-(2,4-динітрофеніл-L-2,3-діаміно-пропіоніл.АІа.Аrg.NН2 - у присутності або відсутності інгібіторів. Активність визначали, виміряючи флюоресценцію на lех = 328нм і lеm = 393нм. Інгібування (у %%) обчислювали за таким співвідношенням: інгібування (%) дорівнює [Флюоресценціяплюс інгібітор - Флюоресценціяфонова], поділене на [Флюоресценціямінус інгібітор + Флюоресценціяфонова]. Подібний протокол може бути використаний для інших експресованих і очищених ММП з використанням субстратів і буферів, оптимальних для даної ММП [див., наприклад, С. Graham Knight efal., (1992) FEBS Lett. 296(3):263-266]. Родина адамалізину, яка включає, наприклад, конвертазу TNF Здатність сполук інгібувати ензим конвертазу проTNF була оцінена з використанням частково очищеного ізольованого зразка ензима, одержаного з мембрани ТНР-1, як це було запропоновано у К. М. Mohler et a1., (1994) Nature 370:218-220. Активність очищеного ензима і його інгібування визначають інкубуванням частково очищеного ензима у присутності або відсутності тестових сполук з використанням субстрата - 4¢,5¢диметоксифлюоресцеїнSеr.Рrо.Lеи.АІа.GІn.АІа.VаІ.Аrg.Sеr.Sеr.Sеr.Аrg.Суs(4-(3-сукцин-імід-1-іл)-флюоресцеїнNН2 в аналітичному буфері (50мМ Tris HCI, pH 7,4 з 0,1% (маса/об'єм) Triton X-100 і 2мМ СаСІ 2 при 26°С протягом 18год.. Рівень інгібування визначається, як для ММП13, але з lех = 490нм і lеm = 530нм. Субстрат був синтезований у такий спосіб. Пептична частина субстрату була побудована на Fmoc-NH-Rink-MBHAполістироловій смолі вручну або на автоматичному синтезаторі пептидів з використанням Fmoc-амінокислоти і гексафторфосфату О-бензотріазол-1-іл-N,N,N',N'-тетраметилуронію (ГБТМ), як з'єднуючого агента з щонайменше 4- або 5-разовим надлишком Fmoc-амінокислоти і ГБТМ. SeR1 і Pro2 були подвійно з'єднані. Був застосований такий бічний захисний ланцюг: SeR1(But), Gln5(Trityl), Arg8,12(Pmc або Pbf), Ser9,10,11(Trityl), Cys13(Trityl). Після побудови N-термінальну захисну Fmoc-групу видаляли обробкою Fmoc-пептидної смоли ДМФ. Одержана пептидна смолу була ацильована 1,5-2-годинною обробкою 1,5-2 еквівалентами 4',5'диметоксифлюоресцеїн-4(5)-карбонової кислоти (Khanna & Ullman, (1980) Anal Biochem., 108:156-161), попередньо активованої діізопропілкарбодіімідом і 1-гідробензотріазолом у ДМФ. Диметоксифлюоресцеїнпептид був одночасно позбавлений захисту і відщеплений від смоли обробкою трифлуороцтовою кислотою, що містила 5% води і 5% триетилсилану. Диметоксифлюоресцеїн-пептид був ізольований випарюванням, перетиранням з діетилетером і фільтруванням. Ізольований пептид був введений в реакцію з 4-(N-малеїмідо)флюоресцеїном у ДМФ DMF з діізопропілетиламіном. Продукт був очищений швидкісною хроматографією і зрештою ізольований з водної оцтової кислоти висушуванням виморожуванням. Продукт був характеризований MALDI-TOF MS і амінокислотним аналізом. Природні субстрати Активність сполук винаходу як інгібіторів деградації агрекану може бути випробувана методами, наприклад, запропонованими у Е. С. Аrner et al., (1998) Osteoarthritis and Cartilage 6:214-228; (1999), Journal оГВіоІоgісаІ Chemistry, 274 (10), 6594-6601 з використанням описаних тут антитіл. Потентність сполук як інгібіторів колагенази може бути визначена згідно з Т. Cawston and A. Barrett (1979) Anal. Biochem. 99:340-345. Інгібування активності металопротеїнази у клітині/тканині Випробування на інгібування шедаз мембрани, наприклад, конвертази TNF Здатність сполук винаходу інгібувати клітинну обробку продукування TNFa може бути оцінена у клітинах ТНР-1 з використанням ELISA для виявлення вивільненої, як це описано у K.M. Mohler et al, (1994) Nature 370:218-220. Подібним чином можуть бути випробувані обробка або розщеплення інших молекул мембрани з використанням належних клітинних ліній і протитіл для виявлення відщепленого протеїну (N. М. Hooper et al., (1997) Biochem. J. 321:265-279). Тест на інгібування інвазії, базованої на клітині Здатність сполуки винаходу інгібувати міграцію клітин при випробуванні на інвазію може бути визначена згідно з А. Albini et al., (1987) Cancer Research, 47:3239-3245. Тест на інгібування повної активності шедази TNF крові Здатність сполук винаходу інгібувати продукування TNF визначається у повному аналізі крові людини, де LPS використовується для вивільнення TNFa. Гепариновану кров людини (10 одиниць/мл), одержану від волонтерів, розбавляють (1:5) середовищем (RPMI1640 + бікарбонат, пеніцилін, стрептоміцин і глютамін) і інкубують (160мкл) 20-ма мкл тестової сполуки (тричі) у ДМСО або іншому придатному носії протягом 30хвил. при 37°С (зволожений інкубатор) перед доданням 20мкл LPS (E. соlі, 0111:В4; кінцева концентрація 10мкг/мл). Кожний аналіз включає контроль розведеної крові, інкубованої лише з середовищем (6 гнізд/плата) або відомим інгібітором TNF як стандартом. Плати були інкубовані протягом 6год. при 37°С (зволожений інкубатор), центрифуговані (2000об./хвил., 10хвил., 4ОС) з подальшим відбором плазми (50-100мкл) і зберіганням у 96 гніздових платах при -70°С перед подальшим аналізом концентрації TNF зп допомогою ELISA. Тест на здатність інгібувати деградацію хряща in vitro Здатність сполуки винаходу інгібувати деградацію агрекану або колагену хряща визначається згідно з К М. Bottomley et al., (1997) Biochem J. 323:483-488. Фармакодинамічний тест Щоб оцінити властивості вивільнення і біодоступність сполук винаходу, виконують фармакодинамічний тест ex vivo, у якому використовуються випробування на синтетичному субстраті, описаному вище, або ВЖХ, або мас-спектрографічним аналізом. Цей тест дозволяє оцінити швидкість вивільнення для багатьох видів тварин. Тваринам (наприклад, щурам, мармозет) внутрішньовенно або перорально вводять дозу розчинної композиції сполуки (наприклад, 20% ДМСО, 60% PEG400 (маса/об'єм) і у певній часовій послідовності (наприклад, 5, 15, 30, 60, 120, 240, 480, 720, 1220хвил.) беруть зразки крові з відповідної посудини у 10од. гепарину. Фракції плазми одержують центрифугуванням і осадженням протеїнів плазми ацетонітрилом (кінцева коцентрація 80% (маса/об'єм)). Через 30хвил. при -20°С протеїни плазми відокремлюються центрифугуванням, а поверхневу фракцію випаровують до сухості у швидкісному випаровувачі Savant. Осад реконструюють у аналітичному буфері і потім аналізують на вміст сполуки, використовуючи аналіз синтетичного субстрату. Для сполуки, що оцінюється, будують криву залежності реакції від концентрації. На активність перевіряються послідовні розбавлення екстрактів реконструйованої плазми і, використовуючи криву залежності реакції від концентрації, обчислюють кількість сполуки у первісному зразку плазми з урахуванням повного показника розбавлення плазми. Випробування in vivo Тест на антиТNF-дію Здатність сполук винаходу інгібувати TNF ex vivo була перевірена на щурах. Групі самців щура Wistar Alderley Park (AP) (180-210г) вводять дозу сполуки (6 щурів) або носія препарату (10 щурів), наприклад, перорально, інтраперитонально або підшкірно). Через 90хвил. щурів умертвляють, підвищуючи концентрацію СО2, відбирають кров через задню порожнисту вену у 5 одиниць гепарину натрію/мл крові. Зразки крові негайно розміщують на льоду і центрифугують при 2000об./хвил. 10хвил. при 4°С і збирають заморожені при 20°С зразки плазмі для подальшого оцінювання їх дії на продукування TNF стумульованою LPS людською кров'ю. Зразки плазми щура розморожують і 175мкл кожного зразка вносять до форматованої структури у 96Uгніздовій платі. Додають 50мкл гепаринованої людської крові у кожне гніздо, перемішують і інкубують 30хвил. при 30°С (зволожений інкубатор). В гнізда додають LPS (25мкл; кінцева концентрація 10мкг/мл) і інкубують ще 5,5год. Контрольні гнізда інкубують лише з 25мкл середовища. Плати центрифугують 10хвил. при 2000об./хвил., і 200мкл поверхневої фракції переносять у 96-гніздову плату і заморожують при -20°С для подальшого аналізу концентрації TNF у ELISA. За допомогою спеціальної програми обчислюють дані аналізу для кожної сполуки/дози: Інгібування ТNFa (%) = (Середнє TNFa (контр.) - Середнє TNFa (оброленого) х100)/ (Середнє TNFa (контр.)) Тест на антиартритну дію Активність сполуки як антиартритного препарата оцінюють на індукованому колагеном артриті [див. D. Е. Trentham et al., (1977) J. Exp. Med. 146: 857]. У цій моделі розчинний у кислоті природний колаген типу II викликає артрит у щурів при введенні з незавершеним заповнювачем Фройнда (Freund). Подібним чином артрит можна викликати у приматів. Тест на протиракову дію Активність сполуки як протиракового агента може бути оцінена згідно з методикою, запропонованою І. J. Fidler (1978), Methods in Cancer Research, 15: 399-439, з використанням клітинної лінії В16 [див. В. Hibner ef al., Abstract 283, p. 75, 10th NCI-EORTC Symposium, Amsterdam, June 16-19, 1998]. Далі наведено приклади, що ілюструють винахід. Приклад 1 N-[1-([4-(4-бромфеніл)піперазин]сульфоніл)-4-піримідин-2-ілбутил]-N-гідрокси-формамід До розчину N-[1-([4-(4-бромфеніл)піперазин]сульфонілметил)-4-піримідин-2-ілбутил]-гідроксиламіну (497мг, 1,0ммоль) у ТГФ (5мл) і мурашиної кислоти (2,5мл), охолодженого до 0°С, з перемішуванням додають суміш оцтового ангідриду (566мкл, 6,0ммоль) і мурашиної кислоти (2,0мл). Суміш перемішують при 0°С протягом 1год. і доводять до кімнатної температури. Розчинники видаляють роторним випаровуванням і задишок очищують хроматографією (50г Silica Bond Elute, елюент - 0-15% метанолу/ дихлорметан), чисті фракції випаровують і кристалізують з етилацетату, одержуючи N-[1-([4-(4бромфеніл)піперазин]сульфонілметил)-4-піримідин-2-ілбутил]гідроксиформамід у вигляді білого порошку (262мг, 51%). ЯМР (300 МГц ДМСО-d6) d/часток на млн: 9,87(s, 1Н*), 9,55(s, 1H*), 8,70(m, 2H), 8,29(s, 1Н*), 7,98(s, 1Н*), 7,33(m, 3Н), 6,92(dd, 2Н), 4,68(m, 1Н*), 4,13 (m, 1Н), 3,55-3,31(m, 5Н, часткове затемнення), 3,25-3,09(m, 7H, часткове затемнення), 1,80-1,50(m, 4H). * ротамерні сигнали MS: ES+, (M+H)+ = 512, 514 (картина ізотопа Br). Приготування вихідного матеріалу: і) До розчину гідрохлориду 1-(4-бромфеніл)піперазину (5,09г, 18,3ммоль) і триетиламіну (7,67мл) у ДХМ (100ml) краплями додають хлорид метансульфонілу (2,83мл, 36,3ммоль). Суміш перемішують 1год. при кімнатній температурі і потім додають ДХМ (100мл). Органіку промивають водою (2х), розсолом, сушать (Na2SO4) і випаровують у вакуумі, одержуючи жовту тверду речовину, яку кристалізують з етанолу і промивають діетилом. Це дає 1-(4-бромфеніл)-4-(метансульфонілпіперазин (4,74г, 81%) у вигляді білого пухнастого порошку. 1 Н ЯМР (300МГц CDCI 3) d/часток на млн: 7,38(d, 2Н), 6,91 (d, 2Н), 3,21 (m, 8Н), 2,89(s, 3Н) MS: ES+, (M+H)+ = 318, 320 (картина ізотопа Br). іі) До 1-(4-бромфеніл)-4-(метансульфоніл)піперазину (902мг, 2,0ммоль), суспендованого у безводному ТГФ (15мл) у атмосфері нітрогену і охолодженого до -20 - -30°С, послідовно додають біс(триметилсиліл) літію (1,0М уn ТГФ, 4,0мл), хлортриметилсилан (217мг, 2,0ммол, 253мкл) і 4-піримідин-2-ілбутанал (300мг, 2,0ммоль). Суміш перемішують 1год. при -20°С, гасять насиченим розчином хлориду амонію і витримують протягом ночі при кімнатній температурі. Розчини видаляють у вакуумі, залишок розділяють між ДХМ (15мл) і водою (5мл), органіку розділяють і хроматограмують (50г Silica Bond Elute, елюент - градієнт 0®100% етилацетат/гексан), одержуючи 2-(5-[4-(4бромфеніл)піперазин]сульфонілпент-4-еніл)-піримідин у вигляді білої кристалічної речовини (759мг, 84%). MS: ES+, (M+H)+ = 451, 453 (ізотоп Br) ііі) До розчину 2-((Е)-5-[4-(4-бромфеніл)піперазин]сульфонілпент-4-еніл)піримідину (451мг, 1,0ммоль) у ТГФ (10мл) з перемішуванням додають гідроксиламін (50%-й розчин у воді, 500 мкл) і суміш перемішують протягом ночі. Розчини видаляють у вакуумі, азеотропують толуолом (Зх) і одержують глІ-[1-([4-(4бромфеніл)піперазин]сульфоніл-метил)-4-піримідин-2-ілбутил]гідроксиламін (497мг, кількісний) MS: ES+, (M+H)+ = 484, 486 (ізотоп Br) Приклад 2 N-[1-([4-(5-хлорпіридин-2-іл)піперазин]сульфонілметил)-3-(5-фторпіримідин-2-іл)пропіл]-Nгідроксиформамід Оцтовий ангідрид (0,51мл) додають до мурашиної кислоти (2,0мл), охолодженої до 0°С і додають розчин 2-[4-[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл-3-(гідроксиаміно)-бутил]-5-хлорпіримідин (0,485г) у ТГФ (11мл). Розчин перемішують 3год. при кімнатній температурі і потім випаровують у вакуумі, залишок азеотропують толуолом і потім розчиняють у метанолі і гріють при 40°С 30хвил. Розчин випаровують до сухості, додають діетилетер і перемішують при кімнатній температурі 10хвил., тверду речовину фільтрують, сушать у вакуумі і одержують N-[1-([4-(5-хлорпіридин-2-іл)піперазин]сульфоніл-метил)-3-(5-фторпіримідин-2іл)пропіл]-N-гідроксиформамід (0218г), точка плавл. 154-155°С. ЯМР (d6-ДМСО 373°К): 2,20(m, 2Н), 2,95(m, 2Н), 3,23(dd, 1Н), 3,30(m, 4Н), 3,49(dd, 1Н), 3,60(m, 4Н), 4,42(vbs, 1Н), 6,88(d, 1Н), 7,59(dd, 1Н), 8,05(vbs, 1Н), 8,12(dd, 1Н), 8,71 (s, 2Н), 9,40(vbs, 1H); m/z 473 (М+1). Приготування вихідного матеріалу: (і) 1-(5-хлорпіридин-2-іл)-4-(метилсульфоніл)піперазин (0,600г) перемішують у безводному ТГФ (22мл) під аргоном, потім охолоджують до -10°С перед доданням біс(триметилсиліл)аміду літію (4,8мл 1,0М розчину у ТГФ). Суміш перемішують при -10°С 30хвил. і додають розчин діетилхлорфосфату (0,345мл). Суміш перемішують при -10°С 15хвил., додають 3-(5-фторпіримідин-2-іл)пропанал (0,334г) і перемішують при -10°С ще 30хвил. Суміш доводять до кімнатної температури, потім промивають водним хлоридом амонію і екстрагують етилацетатом. Органічні шари сушать над Na2SO4. Очищення залишка на кремнеземі з елюентом 70% етилацетат/30% гексан дає суміш 2-((Е)-4-[4-(5-хлорпіридин-2-іл)піперазин]сульфонілбут-3-еніл)-5фторпіримідину і 2-((2)-4-[4-(5-хлорпіридин-2-іл)піперазин]сульфонілбут-3-еніл)-5-фторпіримідину (0,44г, 6:4). 1 Н ЯМР (CDCI 3): 8,55 (d, 1H), 8,48, (s, 1H), 7,46, (dd, 1H), 6,85, (m, 1H), 6,60, (d, 1H), *6,45, (m, 1Н), 6,15, (d, 1Н), *6,03, (d, 1Н), 3,61, (m, 4Н), 3,28, (m, 2Н), 3,15, (m, 4Н), *2,81, (m, 2Н); MS (ES+): 412,3(МН+). * - нижчий ізомер. (іі) До розчину 2-((Е)-4-[4-(5-хлорпіридин-2-іл)піперазин]сульфонілбут-3-еніл)-5-фторпіримідину і 2-((2)-4-[4(5-хлорпіридин-2-іл)піперазин]сульфонілбут-3-еніл)-5-фторпіримідину (0,44г) у ТГФ (5мл), додають гідроксиламін (1,0мл, 50%-й водний розчин). Суміш перемішують 18год., потім розбавляють ЕtOАс(10мл) і промивають насиченим розчином хлориду амонію (10мл). Органічний шар сушать над Na2SO4 і випаровують у вакуумі, одержуючи 2-[4-[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл-3-(гідроксиаміно)-бутил]-5-фторпіримідин (0,483г). 1 Н ЯМР (CDCI3): 8,45(s, 2H), 8,08(d, 1H), 7,39(dd, 1H), 6,55(d, 1H), 5,76(bs, 2H), 3,59 (m, 4H), 3,46(m, 1H), 3,42(m, 2H), 3,33(m, 4H), 3,10(m, 4H), 2,82(m, 1H), 2,15(m, 1H), 2,01 (m, 1Н); MS (ES+): 445,3(МН+). Приклад 3 Готують такі сполуки: Для синтезу сполук необхідно мати піперазин і піперидинсульфонаміди, які можна знайти у продажу або виготовити, як це описано далі: 1-(4-фторфеніл)-4-(метансульфоніл)піперазин До розчину 1-(4-фторфеніл)піперазину (35г, 194ммоль) і піридину (17,5мл) у сухому ДХМ (200мл) при 0°С краплями додають метансульфонілхлорид (20мл, 258ммоль). Суміш перемішують 3год. при кімнатній температурі, промивають водою і екстрагують дихлорметаном (2х100мл). Органічні шари сушать над MgSO4 і випаровують у вакуумі. Залишок перетирають і промивають метанолом, одержуючи 1-(4-фторфеніл)-4(метансульфоніл)піперазин (39,35г) у вигляді білих кристалів. 1 Н ЯМР (CDCI 3): 7,00(m, 2Н), 6,90(m, 2Н), 3,40(m, 4Н), 3,20(m, 4Н), 2,83(s, 3Н). Арил/гетероарилпіперазини описані у літературі і є у продажу. 1-(6-хлорпіримідин-4-іл)-4-мезилпіперазин Суміш 4,6-дихлорпіримідину (39,4г), 1-мезилпіперазингідрохлориду (55,7г) і триетиламіну (116мл) в етанолі (500мл) перемішують під зворотним холодильником 4год. і при кімнатній температурі ще 12год..Тверду речовину відділяють, збирають фільтруванням, суспензію промивають етанолом (2х80мл, 160мл), потім діетилетером (150мл) і сушать, одержуючи 1-(6-хлорпіримідин-4-іл)-4-мезилпіперазин у вигляді кремової твердої речовини (71,9г), точка пл. 200-202°С ЯМР (d6-ДМСО): 2,88(8, 3Н), 3,18(m, 4Н), 3,80(m, 4Н), 7,04(s, 1Н), 8,38(m, 1Н); m/z 277,3 (М+1). Використовуючи подібну процедуру, 1-мезилпіперазингідрохлорид (CAS(161357-89-7)) вводять в реакцію з відповідним хлорпіридином для одержання таких сполук: 2-(4-піперидинілокси)-5-хлорпіридин і) NaH (2,88г, 66ммоль, 55%-на дисперсія у мінеральному маслі) перемішують у сухому DME (200мл) під аргоном. Краплями протягом 30хвил. додають суміш 2,5-дихлорпіридину (8,87г, 60ммоль) і 4гідроксипіперидину (6,67г, 66ммоль), розчинену у сухому DME (200мл), після чого гріють 48год. при 82°С під аргоном. Реакцію повільно гасять водою перед видаленням більшої частини ТГФ, екстрагують водну фазу ДХМ (х3), органічні шари сушать з Na2SO4 і випаровують у вакуумі, одержуючи 2-(4-піперидинілокси)-5хлорпіридин у вигляді жовтого масла (12,7г, кількісний). 1 Н ЯМР (ДМСО): 8,17(d, 1H), 7,76(dd, 1H), 6,81 (d, 1H), 4,96(m, 1H), 2,93(m, 2H), 2,53(m, 2Н), 1,91 (m, 2Н), 1,46 (m, 2Н); MS (ES+): 213,3 (МН+), 225,3 (MNa+). У такий спосіб одержують 2-(4-піперидинілокси)-5-бромпіридин МН+ 257,3. Приклад 4 - розділення N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-N-гідроксиформамід До карбамату 1 (3,8г, 5,66ммоль), розчиненого у ТГФ (76мл) додають метанол (76мл), воду (38мл), і до цього розчину додають літійгідроксидмоногідрат (2,37г, 56,6ммоль). Після двогодинного перемішування при кімнатній температурі розчинники видаляють піл зниженим тиском і залишок розчиняють у воді (250мл), промивають етилацетатом (200мл) і діетилетером (2х250мл). Додають насичений водний хлорид амонію, до досягнення pH 8 у водному шарі, який потім екстрагують дихлорметаном (3х250мл). Об'єднані дихлорметанові екстракти сушать (MgSO4) і випаровуванням одержують білий порошок (2,2г, 83%). Хіральна ВЖХ з використанням колонки Chiralpak AS показує 96%-ий вихід продукту (з S-стереохімією). Mpt (3 ЕtOН) 124,5126,5°С; [a]D25 = -17,2 (MeOH); ЯMP CDCI 3 d 9,9 (br s, 1H)*: 8,7(m, 2H); 8,5(s, 1H)*; 8,1(br s, 1H); 8,0(s, 1Н)*; 7,5(dd, 1Н); 7,2(m, 1Н); 6,6(d, 1Н); 4,9(m, 1Н)*; 4,2(m, 1Н)*; 3,7-3,5(m, 4Н); 3,5(m, 1Н)*; 3,4-3,2(m, 4Н); 3,3(m, 1Н)*; 3,12,9(m, 3Н); 2,0-1,6(m, 4Н). MS для C19H25CIN6O4S: (M+H) за розрахунком 469, одержано 469. * ротамерні сигнали Операція А До реверсного гідроксамату 2 (18,76г, 40ммоль), розчиненого у ДХМ (300мл) і охолодженого до 0°С, додають триетиламін (10,4мл, 75ммоль) і потім (4S)-4-бензил-2-оксазолідинон-3-карбонілхлорид (10,55г, 44ммоль) [номер CAS - 139149-49-8]. Після тригодинного перемішування при -3 - 0°С суміш промивають водою (250мл), сушать (MgSO4) і випаровуванням одержують бежеву піну (27,1г). Діастереомери розділяють препаративною ВЖХ з елюентом етилацетат/ЕtOН (5%). Діастереомер більшої полярності був ізольований з виходом 35%. MS для C30H34CIN7O7S: (M+H) за розрахунком 672, одержано 672. Сполуку 2 одержують як у Прикладі 2: (М+Н 469), темп, плавл. 131-134°С; ЯМР (ДМСО) 9,8(11-1, br), 8,7(2H, m), 8,3 і 7,9(1Н, s), 8,1(2Н, s), 7,6(1Н, m), 6,9(1Н, m), 4,1(1Н, br m), 3,6(4Н, m), 3,2(4Н, m), 2,8(2Н, m), 1,8(4Н, m). Приклад 5 Наведені сполуки одержують, як у Прикладі 4: N-[(1S)-1-({[4-(5-бромпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піридин-2-іл)бутил]-N-гідроксиформамід ЯМР CDCI 3 d 11,9(br s, 1H)*; 8,5(s, 1H)*; 8,5-8,4(m, 1H); 8,2(m, 1H); 8,1 (s, 1H)*; 7,8-7,7(m, 1H); 7,6(m, 1H); 7,3-7,2(m, 2H); 6,6(m, 1H); 5,0-4,9(m, 1H)*; 4,3-4,2(m, 1H)*; 3,7-3,6(m, 4H); 3,6(m, 1H)*; 3,4-3,3(m, 4H); 3,3(m, 1H)*; 3,1(dd, 1H)*, 2,9(m, 1H)*, 2,9-2,8(m, 2H); 2,1-1,6(m, 4H). MS для C20H26BrN5О4S: (М+Н) за розрахунком 514, одержано 514. * ротамерні сигнали [a]D25 = -14(c=2,3, МеОН) Рацемічний вихідний матеріал одержують, як у Прикладі 2. М+Н = 512/514. N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(5-фторпіримідин-2-іл)пропіл]-Nгідроксиформамід 1 Н ЯМР (ДМСО, 373К): 9,44(br s, 1Н), 8,70(s, 2Н), 8,10(d, 1Н, J = 2,6Гц), 8,05(br s, 1Н), 7,57(dd, 1Н, J = 9,1, 2,6Гц), 6,86(d, 1Н, J = 9,1Гц), 4,40(br s, 1H), 3,59(dd, 4H, J = 5,3, 5,0Гц), 3,47(dd, 1H, J = 14,6, 7,4Гц), 3,28(dd, 4H, J = 5,3, 5,0Гц), 3,24(dd, 1H, J = 14,6, 4,3Гц), 2,93(m, 2H), 2,16(m, 2H). MS (ESI): 473 (MH+). ad =-11,03 (МеОН, с= 1,242). Рацемічний вихідний матеріал готують, як у Прикладі 2. N-[(1S)-1-({[4-(4-фторфеніл)піперазин]сульфоніл]метил)-4-(піримідин-2-іл)-бутил]-N-гідроксиформамід M+H 452,44; ЯМР CDCI 3 d 9,9(br s, 1H)*; 8,7(m, 2H); 8,5(s, 1H)*; 8,05(s, 1H)*; 7,2(m, 1H); 7,0-6,9(m, 4H); 4,9(m, 1H)*; 4,2(m, 1H)*; 3,5-3,4(m, 4H); 3,5(m, 1H)*; 3,2-3,1(m, 4H); 3,3(m, 1H)*; 3,1-2,9(m, 3H); 2,0-1,6(m, 4H). * - ротамеричні сигнали Рацемічний вихідний матеріал готують, як у Прикладі 3. ЯМР (ДМСО) 10,0(1Н, br s), 8,6(2Н, m), 8,2(1Н, d), 7,2(1Н, m), 6,9(4Н, m), 4 9 і 4,2(1Н, br), 3,4(6H, m), 3,0(6Н, m), 1,9(4Н, m). Приклад 6 - хроматографічне розділення N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-Nгідроксиформамід і N-[(1R)-1-({[4-(5-хлорпіридин-2-іл)піперазин]-сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-Nгідроксиформамід N-[(1S)-1-({[4-(5-хлорпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-Nгідроксиформамід, одержаний у рацемічній формі, розділяють на одиночні енантіомерні форми хроматографічним розділенням на пакеті колонок з використанням Chiralpak AD No. AD00CJ- НК002 і елюентом етанолом. Біологічну активність має сполука, елюйована з колонки другою. Вона має S-стереохімію. Енантіамер, елюйований першим - МН+ 455, Енантіамер, елюйований другим - МН+ 455. Рацемічний вихідний матеріал готують, як у Прикладі 3. МН+ = 455. ЯМР (ДМСО) 9,9, 9,6(1Н br s), 8,6(2Н, m), 8,3 і 7,9(1Н, s), 8,1(114, dd), 7,3(1Н, m), 6,9(1Н, d), 4,7 і 4,2(1Н, широке m), 3,6(4Н, m), 3,4-3,2(6Н, m), 2,8(2Н, m), 2,1(2H, m). Приклад 7 - додаткові приклади хроматографічного розділення Ці сполуки були розділені, як у Прикладі 6: N-[(1S)-1-({[4-(5-трифлуорметилпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин-2-іл)пропіл]-Nгідроксиформамід і N-[(1R)-1-({[4-(5-трифлуорметилпіридин-2-іл)піперазин]сульфоніл}метил)-3-(піримідин2іл)пропіл-N-гідроксиформамід Енантіамер, елюйований першим - М+Н 489,5, Енантіамер, елюйований другим - М+Н 489,5. Рацемічний вихідний матеріал готують, як у Прикладі 3. N-[(1S)-1-({[4-(5-бромпіридин-2-іл)піперазин]сульфоніл}метил)-4-(піримідин-2-іл)бутил]-Nгідроксиформамід і N-[(1R)-1-({[4-(5-бромпіридин-2-іл)піперазин]-сульфоніл}метил)-4-(піримідин-2-іл)бутил]-Nгідроксиформамід Енантіамер, елюйований першим - М+Н 513/515, Енантіамер, елюйований другим - М+Н 513/515. Рацемічний вихідний матеріал готують, як у Прикладі 2, М+Н 513/515. Приклад 8 Готують такі сполуки: ** - сполуку (S-енантіомер) готують, як у Прикладі 6, з використанням колонки Chiralpak AD (250мм х 4,6мм) № AD00CE-JJ122 і елюента MeOH/MeCN (15:85). Діастереомери А і В відповідаюь порядку елюювання силікагелевої колонки 3-5%-м етанолом у ДХМ (діастереомер А є першою фракцією, діастереомер В - другою). Приклад 9 Дані ЯМР для сполук Прикладу 8: N-[(1S)-1-({[4-(5-трифлуорметилпіридин-2-іл)піперазинісульфоніл}метил)-4-(піримідин-2-іл)бутил]-Nгідроксиформамід ЯМР CDCI 3 d 10,1(br s, 1Н)*; 8,7(m, 2Н); 8,5(s, 1Н)*; 8,4(br s, 1Н): 8,1 (s, 1Н)*; 7,7(dd, 1Н); 7,2(m, 1Н); 6,7(d, 1Н); 4,9(m, 1Н)*; 4,2(m, 1Н)*; 3,9-3,7(m, 4Н); 3,6(m, 1Н)*, 3,4-3,2(m, 4Н); 3,3(m, 1Н)*; 3,1-2,9(m, 3Н); 2,0-1,6(m, 4H). * - ротамерні сигнали. N-({[4-фторфенілпіперазин]сульфоніл}метил)-3-[(5-фторпіримідин-2-іл) пропіл]-N-гідроксиформамід 1 Н ЯМР (ДМСО, 373К): 9,46(br s, 1H), 8,73(s, 2H), 7,08-6,96(m, 4H), 4,42(br s, 1H), 3,50(dd, J = 14,8, 7,5Гц, 1Н), 3,35(m, 4Н), 3,28(dd, J = 14,8, 4,4Гц, 1Н), 3,18(m, 4Н), 2,97(m, 2Н), 2,21 (m, 2Н). N-[(1R або 1S)-({[4-хлорфенілпіперазин]сульфоніл}метил)-3-[(3R або 3S)-(5-фторпіримідин-2-іл)бутил]-Nгідроксиформамід (єдиний діастереомер А) 1 Н ЯМР (CDCI 3) (2 ротамери у приблизно рівних пропорціях): 8,72(s, 0,5H), 8,57(d, 2H), 8,25(s, 0,5H), 7,89(s, 0,5H), 7,23(dd, 2H), 6,83(dd, 2H), 4,94(sext, 0,5H), 4,30(m, 0,5Н), 3,57(dd, 0,5H), 3,44(m, 2H), 3,37(m, 2,5H), 3,16(m, 5,5H), 3,02(dd, 0,5H), 2,52(ddd, 0,5Н), 2,35(ddd, 0,5H), 2,02(dt, 0,5H), 1,89(ddd, 0,5H), 1,40(dd, 3Н). N-[(1R або 1S)-({[4-бромфенілпіперазин]сульфоніл}метил)-3-[(3R або 3S)-(5-фторпіримідин-2-іл)бутил]-Nгідроксиформамід (єдиний діастереомер А) 1 Н ЯМР (CDCI 3) (2 ротамери у приблизно рівних пропорціях): 8,72(s, 0,5Н), 8,57(d, 2Н), 8,25(s, 0,5Н), 7,89(s, 0,5Н), 7,38(dd, 2Н), 6,80(dd, 2Н), 4,94(sext, 0,5Н), 4,30(m, 0,5Н), 3,57(dd, 0,5Н), 3,44(m, 2Н), 3,37(m, 2,5Н), 3,16(m, 5,5Н), 3,02(dd, 0,5Н), 2,52(ddd, 0,5Н), 2,35(ddd, 0,5Н), 2,02(dt, 0,5Н), 1,89(dt, 0,5Н), 1,40(dd, 3Н). N-(1R або 1S)-({[4-хлорфенілпіперидин]сульфоніл}метил)-3-[(3R або 3S)-(5-хлорпіримідин-2-іл)бутил]-Nгідроксиформамід (єдиний діастереомер А) 1 Н ЯМР (CDCI 3) (2 ротамери у приблизно рівних пропорціях): 8,69(s, 0,5Н), 8,57(d, 2Н), 8,25(s, 0,5Н), 7,89(s, 0,5Н), 7,27(затемнення), 7,13(dd. 2Н), 4,91(sext, 0,5Н), 4,30(m, 0,5Н), 3,87(m, 2Н), 3,57(dd, 0,5Н), 3,35(dd, 0,5Н), 3,18(m, 1,5Н), 3,00(dd, 0,5Н), 2,85(m, 2Н), 2,55(m, 1,5Н), 2,35(ddd, 0,5Н), 2,06(dt, 0,5Н), 1,88(m, 2,5Н), 1,7(затемнення), 1,40(dd, 3Н). N-[(1R або 1S)-({[3,4-дихлорфенілпіперазин]сульфоніл}метил)-3-[(3R або 3S)-(5-хлорпіримідин-2-іл)бутил]N-гідроксиформамід (єдиний діастереомер А) 1 Н ЯМР (CDCI 3) (2 ротамери у приблизно рівних пропорціях): 8,62(s, 0,5Н), 8,55(d, 2Н), 8,22(8, 0,5Н), 7,86(s, 0,5Н), 7,28(m, 1Н), 6,95(m, 1Н), 6,73(m, 1Н), 4,92(sext, 0,5Н), 4,30(m, 0,5Н), 3,57(dd, 0,5Н), 3,44(m, 2Н), 3,37(m, 2,5Н), 3,16(m, 5,5Н), 3,02(dd, 0,5Н), 2,52(ddd, 0,5Н), 2,37(ddd, 0,5Н), 2,04(dt, 0,5Н), 1,89(dt, 0,5Н), 1,40(dd, 3Н). N-[(1R або 1S)-({[4-(5-ціанопіридин-2-іл)піперазин]сульфоніл}метил)-3-[(3R або 3S)-(5-фторпіримідин-2іл)бутил]-N-гідроксиформамід (єдиний діастереомер А) 1 Н ЯМР (CDCI 3) (2 ротамери у приблизно рівних пропорціях): 8,72(s, 0,5Н), 8,55(s, 2Н), 8,41 (s, 1Н), 8,22(s, 0,5Н), 7,86(s, 0,5Н), 7,65(m, 1Н), 6,61 (dd, 1H), 4,92(m, 0,5Н), 4,30(m, 0,5Н), 3,78(m, 4Н), 3,57(dd, 0,5Н), 3,38(m, 2Н), 3,30(m, 2,5Н), 3,16(m, 1,5Н), 3,02(dd, 0,5Н), 2,52(m, 0,5Н), 2,37(m, 0,5Н), 2,04(dt, 0,5Н), 1,84(dt, 0,5Н), 1,40(dd, 3Н). N-[(1S)-({[4-(4-фторфенілпіперазин]сульфоніл}метил)-3-[(3S)-(5-фторпіримідин-2-іл)бутил]-Nгідроксиформамід 1 Н ЯМР (ДМСО-d6): 9,9, 9,53(2s, 1H), 8,78(s, 2H), 7,98(d, 1H), 7,12-6,91(m, 4H), 4,8, 4,17(2s, 1Н), 3,13(m, 4Н), 3,0(m, 1Н), 1,86(m, 1Н), 1,22(m, 3Н). Приклад 10 1-({[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}метил)-3-(5-хлорпіридин-3-іл)пропіл-(гідрокси)формамід До мурашиної кислоти (400мкл, 10,8ммоль) при 0°С додають оцтовий ангідрид (102мкл, 1,1ммоль) і суміш перемішують при кімнатній температурі 15хвил., потім охолоджують до 0°С і шприцем краплями додають розчин 1-(4-хлорфеніл)-4-([4-(5-хлорпіридин-3-іл)-2-(гідроксиаміно)бутил]сульфоніл}піперазину (100мг, 0,22ммоль) у ТГФ. Після 1,5-годинного перемішування при кімнатній температурі леткі компоненти видаляють у вакуумі, залишок азеотропують толуолом (2мл), потім розчиняють у метанолі (5мл) і перемішують при 40°С протягом 1год. Після охолодження до кімнатної температури розчин випаровують, і залишок розчиняють у метанолі (0,5мл). Додають діетилетер (5мл) мутну суспензію перемішують 1год. при кімнатній температурі. Твердий осад фільтрують, промивають діетилетером і сушать у вакуумі, одержуючи білувату тверду речовину (48мг, 0,099ммоль). 1 Н ЯМР (ДМСО, 373К): 9,55(br s, 1Н), 8,43(1, 1Н), 8,41(d, 1Н), 8,17(brs, 1Н), 7,76(dd, 1Н), 7,25(m, 2Н), 6,96(m, 2Н), 4,35(brs, 1Н), 3,49(dd, 1Н), 3,34(m, 4Н), 3,25(m, 5Н), 2,67(m, 2Н), 2,02(m, 2Н). MS (ESI): 487,06, 489,04, 490,08 (МН+ 2 х СІ). Приготування вихідного матеріалу: (і) етил-3-(5-хлорпіридин-3-іл)пропаноат З перемішуванням до розчину етил(2Е)-3-(5-хлорпіридин-3-іл)проп-2-еноату (338мг, 1,6ммоль) [номер CAS - 63083-45-2] у сухому етанолі (10мл) при 0°С у атмосфері аргону додають твердий борангідрид натрію (67мг, 1,75ммоль). Реакційну суміш доводять до кімнатної температури і перемішують 4год., після чого додають твердий борангідрид натрію (67мг, 1,75ммоль). Після 18-годинного перемішування додають насичений водний розчин хлориду амонію (5мл), леткі компоненти видаляють у вакуумі і залишок розділяють між водою (10мл) і етилацетатом (10мл). Шари розділяють і водну фазу екстрагують етилацетатом (3х10мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і концентрують у вакуумі. Флеш-хроматографія (силікагель, 20-100% етилацетату у гексані) дає бажану сполуку (132мг, 0,62ммоль) і насичений спирт (70мг). 1 Н ЯМР (CDCI 3): 8,43(m, 1Н), 8,34(m, 1Н), 7,55(m, 1Н), 4,16(q, 2H), 2,96(dd, 2H), 2,63(dd, 2H). (іі) 1-{[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}-4-(5-хлорпіридин-3-іл)бутан-2-он З перемішуванням до розчину 1-(4-хлорфеніл)-4-(метилсульфоніл)піперазину (235мг, 0,85ммоль) у сухому ТГФ (7,5мл) при -10°С у атмосфері аргону протягом 4хвил. краплями додають розчин LiHMDS (1,71мл 1,0М розчину у ТГФ, 1,71ммоль). Розчин перемішують при цій температурі 40хвил., після чого краплями через трубку протягом 5хвил. додають розчин етил-3-(5-хлорпіридин-3-іл)пропаноату (201мг, 0,94ммоль) у ТГФ (1мл). Реакцію перемішують при -10°'С ще 30хвил. перед гасінням насиченим водним розчином хлориду амонію (5мл). Леткі компоненти видаляють у вакуумі і залишок екстрагують СН2СІ 2 (3x5мл.). Об'єднані органічні екстракти промивають водою (10мл) і розсолом (10мл) перед сушінням (MgSO4), фільтрують і концентрують у вакуумі. Флеш-хроматографія (силікагель, 50% етилацетату у гексані) дає бажану сполуку (228мг, 0,52ммоль) і відновлений етил-3-(5-хлорпіридин-3-іл)пропаноат (74мг, 0,35ммоль). 1 Н ЯМР (CDCI 3): 8,46(m, 1H), 8,38(m, 1H), 7,58(m, 1H), 7,21 (m, 2H), 6,83(m, 2H), 3,96(s, 2Н), 3,37(m, 4Н), 3,17(m, 6Н), 2,95(dd, 2Н); MS (ESI): 442,07, 444,06, 445,1 (МН+ 2 х СІ). (ііі) 1-{[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}-4-(5-хлорпіридин-3-іл)бутан-2-ол З перемішуванням до розчину 1-{[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}-4-(5-хлорпіридин-3-іл)бутан-2ону (228мг, 0,51ммоль) у системі розчинів СН2СІ 2/МеOН (1:1, мл) при кімнатній температурі однією порцією додають боргідрид натрію. Реакцію перемішують 40хвил. перед гасінням водною гідрохлоридною кислотою (1М, 2мл). Шари розділяють і водну фазу екстрагують СН2СІ 2 (3x5мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і концентрують у вакуумі. Продукт фільтрують через силікагелеву пробку з елюентом 50% етилацетату у гексані, і одержують бажану сполуку (111мг, 0,25ммоль). 1 Н ЯМР (CDCI 3): 8,47(m, 1H), 8,40(m, 1H), 7,59(m, 1H), 7,21 (m, 2H), 6,86(m, 2H), 4,21(m, 1H), 3,45(m, 4H), 3,24(m, 4H), 3,11(m, 2H), 2,88(m, 2H), 1,89(m, 2H). (iv) 1-(4-хлорфеніл)-4-{[(1Е)-4-(5-хлорпіридин-3-іл)бут-1-еніл]сульфоніл}піперазин З перемішуванням до розчину 1-{[4-(4-хлорфеніл)піперазин-1-іл]сульфоніл}-4-(5-хлорпіридин-3-іл)бутан-2олу (111мг, 0,25ммоль) у сухому СН2СІ 2 (2,5мл) при кімнатній температурі в атмосфері аргону додають триметиламінгідрохлорид (2мг, 0,02ммоль), триетиламін (52мкл, 0,25ммоль), потім метансульфонілхлорид (21мкл, 0,25ммоль). Реакцію перемішують 30хвил. при кімнатній температурі, потім гасять доданням насиченого водного розчину бікарбонату натрію (5мл). Шари розділяють і водну фазу екстрагують етилацетатом (3x6мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і концентрують у вакуумі. Залишок розчиняють у СН2СІ 2 (2,5мл) і обробляють триетиламіном (100мкл, 1,36ммоль). Через 30хвил. реакцію гасять доданням насиченого водного розчину бікарбонату натрію (5мл). Шари розділяють і водну фазу екстрагують етилацетатом (3x6мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і концентрують у вакуумі. Одержаний сирий матеріал використовують у наступній операції. MS (ESI): 446,06, 428,06, 430,07 (МН+ 2 х СІ) (v) 1-(4-хлорфеніл)-4-{[4-(5-хлорпіридин-3-іл)-2-(гідроксиаміно)бутил]-сульфоніл}піперазин З перемішуванням до розчину 1-(4-хлорфеніл)-4-([(1Е)-4-(5-хлорпіридин-3-іл)бут-1еніл]сульфоніл}піперазину (з попередньої операції) у ТГФ (10мл) при кімнатній температурі додають розчин гідроксиламіну (2мл, 50%-й розчин у воді). Реакцію перемішують 3год при кімнатній температурі перед гасінням насиченим водним розчином хлориду амонію (5мл). Шари розділяють і водну фазу екстрагують етилацетатом (3 х 10мл). Об'єднані органічні екстракти сушать (MgSO4), фільтрують і концентрують у вакуумі. Залишок очищують флеш-хроматографією (кремнезем, 100%-й етилацетат) і одержують бажану сполуку (100мг, 0,22ммоль).
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted by piperidine and piperazine n-hydroxyformamides as metalloproteinase inhibitors
Автори англійськоюBarlaam Bernard Christophe, Finlay, Maurice, Raymond, Verschoyle, Tucker Howard, Waterson David
Назва патенту російськоюЗамещенные пиперидином и пиперазином n-гидроксиформамиды как ингибиторы металлопротеиназ
Автори російськоюБарлаам Бернар Кристоф, Такер Говард, Вотерсон Дейвид
МПК / Мітки
МПК: A61K 31/496, C07D 213/61, A61P 35/04, A61P 37/08, C07D 241/16, C07D 241/12, A61P 43/00, A61K 31/4545, A61P 3/10, A61P 19/00, A61P 9/10, A61P 25/28, C07D 233/74, C07D 213/64, A61P 9/08, C07D 295/22, C07D 401/14, C07D 239/26, A61K 31/495, C07D 213/74, A61P 1/02, A61P 19/08, A61P 27/02, A61P 11/00, A61P 19/02, A61K 31/506, A61P 17/00, A61P 29/00, C07D 401/12
Мітки: піперидином, заміщені, металопротеїназ, n-гідроксиформаміди, інгібітори, піперазином
Код посилання
<a href="https://ua.patents.su/20-73155-zamishheni-piperidinom-i-piperazinom-n-gidroksiformamidi-yak-ingibitori-metaloprotenaz.html" target="_blank" rel="follow" title="База патентів України">Заміщені піперидином і піперазином n-гідроксиформаміди як інгібітори металопротеїназ</a>
Попередній патент: Пневмоімпульсна машина для сепарації насіння за густиною
Наступний патент: Спосіб обробки місця культивування рослини з застосуванням дифлуфензопіру
Випадковий патент: Пристрій для подрібнення












