Спосіб отримання олмесартану медоксомілу
Номер патенту: 96575
Опубліковано: 25.11.2011
Автори: Пекавар Аніка, Осолнік Рената, Жупанчіч Сілво, Врбінц Міха
Формула / Реферат
1. Спосіб отримання олмесартану медоксомілу, який включає:
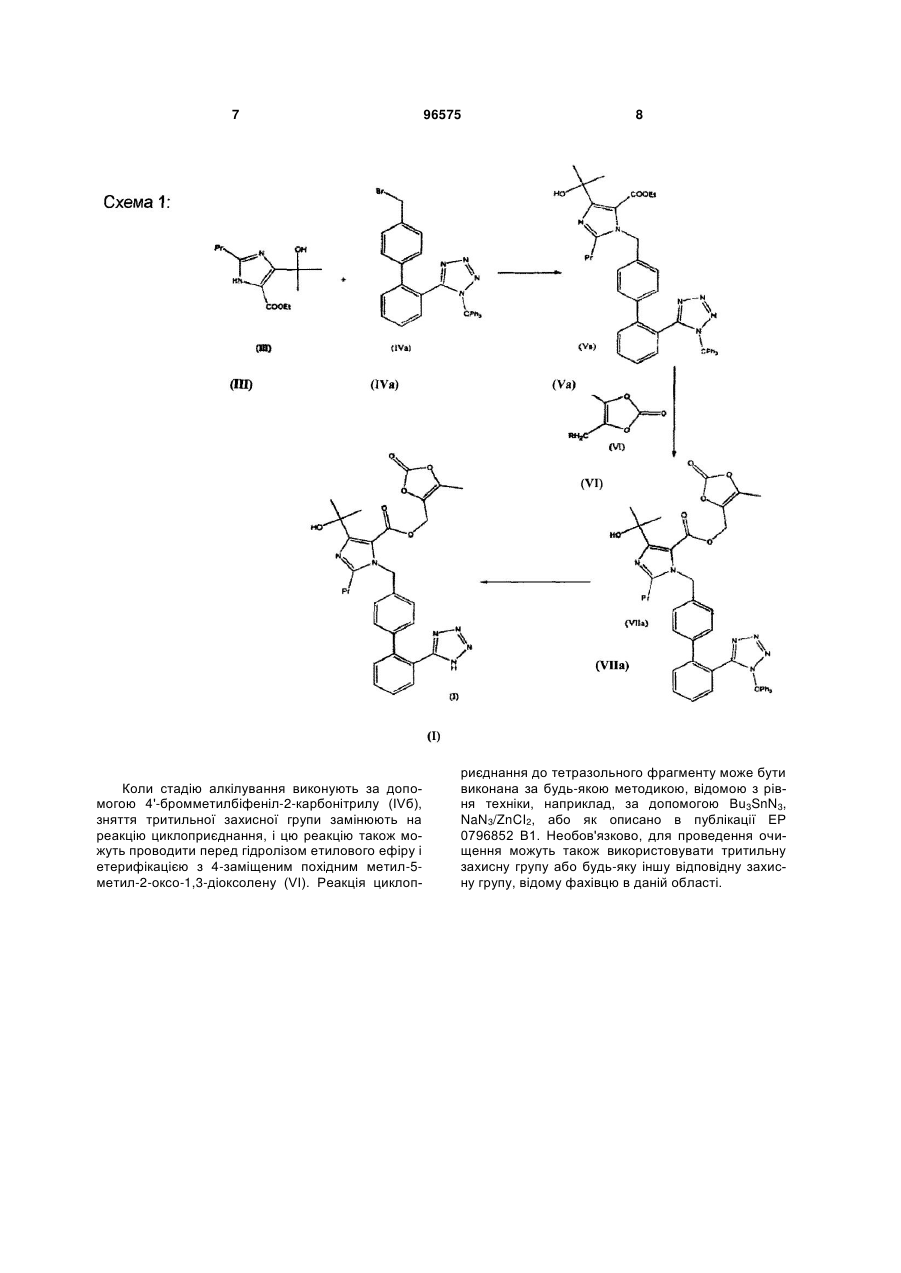
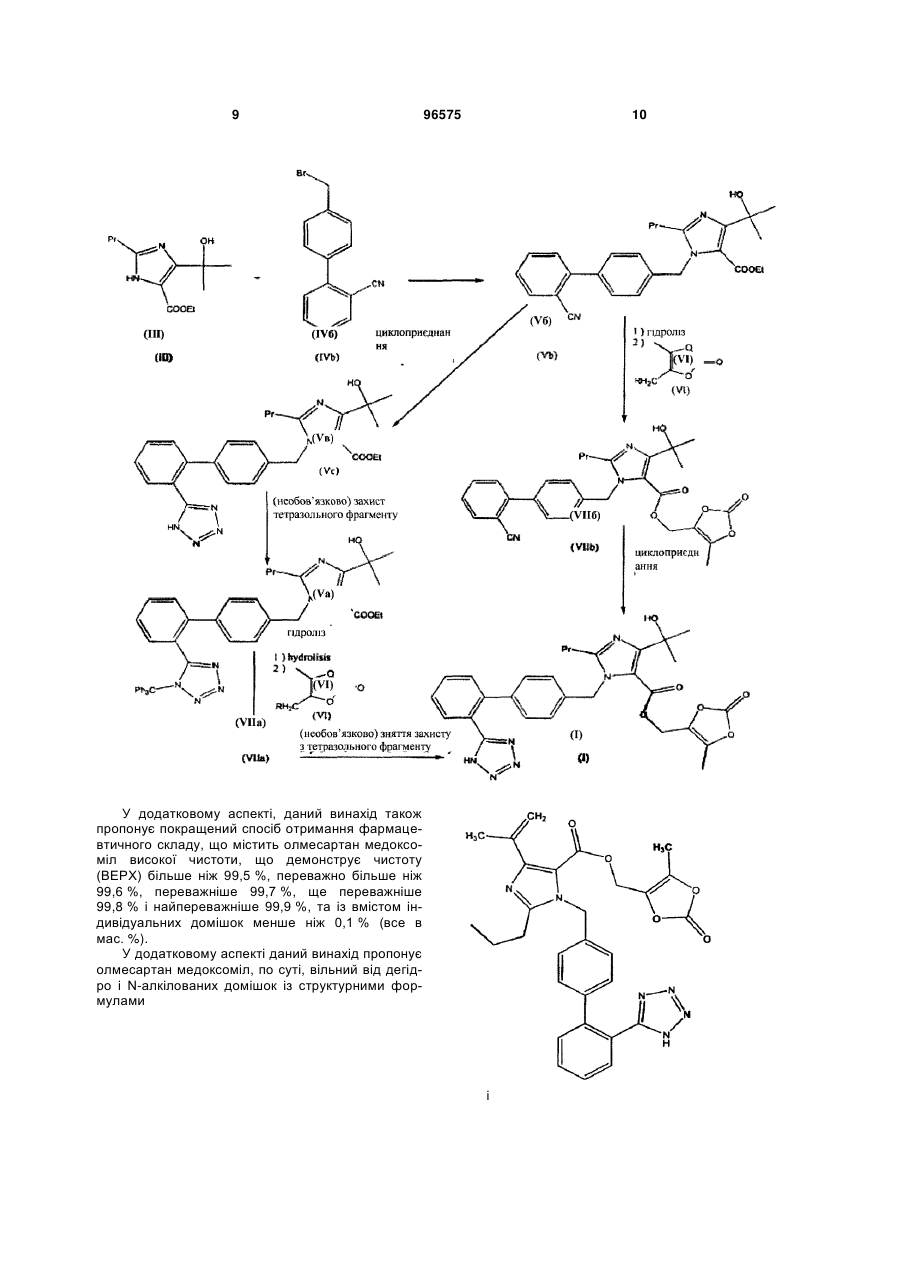
алкілування етил-4-(1-гідрокси-1-метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5-іл)феніл]бензилброміду (IVa) або 4'-бромметилбіфеніл-2-карбонітрилу (IVб) в органічному розчиннику у присутності основи, причому ацетонітрил використовують як розчинник в реакції і як розчинник при кристалізації, з отриманням сполуки етил-4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4-[2-(тритилтеразол-5-іл)феніл]феніл}-метилімідазол-5-карбоксилат (Va)
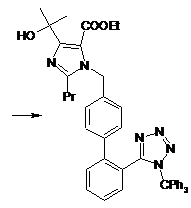
або етил-4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4-[2-ціанобіфеніл}метилімідазол-5-карбоксилат (V6)
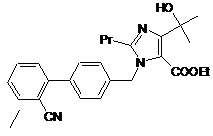 ; і
; і
перетворення сполуки (Va або Vб), що утворюється, в олмесартан медоксомілу.
2. Спосіб за п. 1, який відрізняється тим, що органічний розчинник, який використовують як розчинник в реакції і як розчинник при кристалізації, частково відганяють.
3. Спосіб за п. 1 або 2, в якому продукт реакції алкілування етил-4-(1-гідрокси-1-метилетил)-2-пропілімідазол-5-карбоксилату (II) з 4-[2-(тритилтетразол-5-іл)феніл]бензилбромідом (IVa) або 4'-бромметилбіфеніл-2-карбонітрилом (IVб) кристалізують з реакційної суміші.
4. Спосіб за п. 1, в якому продукт реакції алкілування етил-4-(1-гідрокси-1-метилетил)-2-пропілімідазол-5-карбоксилату (III) з 4-[2-(тритилтетразол-5-іл)феніл]бензилбромідом (IVa) або 4'-бромметилбіфеніл-2-карбонітрилом (IVб) після фільтрування суспендують у воді і перекристалізовують з того ж розчинника, що розчинник, який використовується в реакції алкілування.
5. Спосіб за пп. 1-4, який при виконанні стадії алкілування за допомогою 4'-бромметилбіфеніл-2-карбонітрилу (IVб) включає стадію реакції циклоприєднання, що приводить до утворення тетразольного фрагмента, яка може бути проведена до або після гідролізу етилового ефіру і етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3-діоксолену (VI).
6. Спосіб за пп. 1-5, в якому основою, що використовується, є карбонат калію.
7. Спосіб отримання олмесартану медоксомілу, який включає однореакторний спосіб, що складається з гідролізу етилового ефіру (V), етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3-діоксолену (VI)
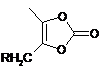 ,
,
переважно 4-хлорметил-5-метил-2-оксо-1,3-діоксоленом, і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу.
8. Спосіб отримання олмесартану медоксомілу за пп. 1 і 7, який включає:
і) стадію алкілування етил-4-(1-гідрокси-1-метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5-іл)феніл]бензилброміду (IVa) в ацетонітрилі і у присутності карбонату калію як основи, і
іі.) однореакторний спосіб, що складається з гідролізу етилового ефіру, етерифікації з 4-хлорметил-5-метил-2-оксо-1,3-діоксоленом, і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу.
9. Спосіб за пп. 7 або 8, де гідроліз етилового ефіру і етерифікацію з 4-хлорметил-5-метил-2-оксо-1,3-діоксоленом виконують в диметилацетаміді.
10. Спосіб за пп. 7 або 8, в якому зняття тритильної захисної групи з тритилованого олмесартану медоксомілу проводять у присутності кислоти, вибраної з органічної кислоти, неорганічної кислоти, їхніх похідних та їхніх сумішей і співрозчинника.
11.Спосіб за п. 10, в якому співрозчинник може бути вибраний із спиртів, кетону, нітрилів або води.
12. Спосіб за п. 11, в якому концентрація співрозчинника складає до 30 % (об./об.), переважно до 20 % (об./об.).
13. Спосіб за п. 10, в якому зняття тритильної захисної групи з тритилованого олмесартану медоксомілу проводять в етилацетаті у присутності соляної кислоти.
14. Спосіб за п. 1, який відрізняється тим, що після завершення зняття захисту з тетразольного фрагмента в етилацетаті реакційну суміш охолоджують, переважно до кімнатної температури, і нейтралізують водним розчином неорганічної основи до значення рН не більше 6, переважно до значення рН від 3 до 5, і виділяють продукт.
15. Спосіб за п. 14, який відрізняється тим, що фази розчинників розділяють, причому водну фазу можуть повторно екстрагувати органічним розчинником, переважно етилацетатом, об'єднані органічні фази концентрують і охолоджують, і олмесартан медоксомілу, що випав в осад, виділяють.
16. Спосіб за п. 14, який відрізняється тим, що трифенілкарбінол залишають розчиненим в реакційній суміші і не осаджують.
17. Спосіб за пп. 7 або 8, в якому реакційну суміш після зняття захисної групи нейтралізують до значення рН не більше 6.
Текст
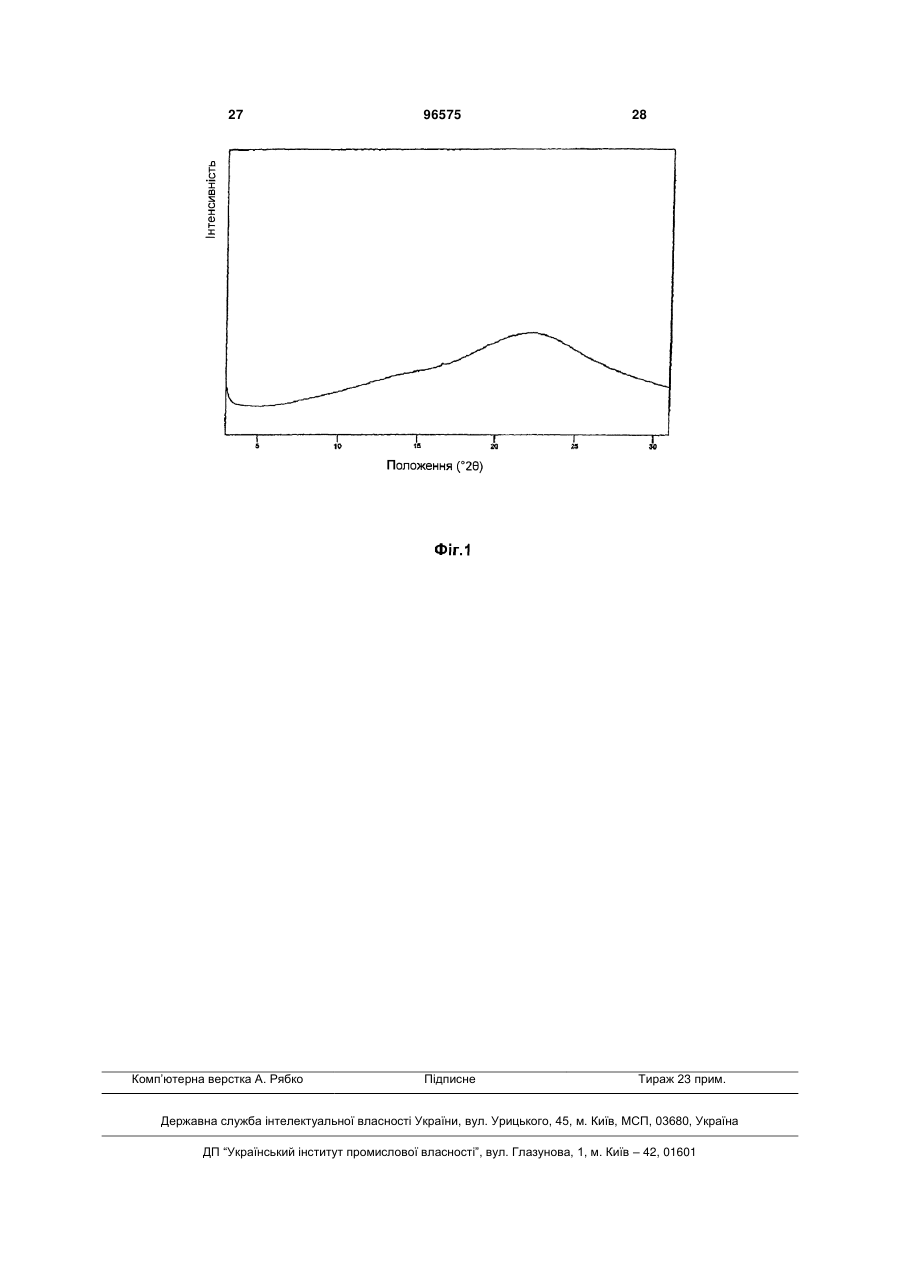
1. Спосіб отримання олмесартану медоксомілу, який включає: алкілування етил-4-(1-гідрокси-1-метилетил)-2пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5-іл)феніл]бензилброміду (IVa) або 4'-бромметилбіфеніл-2-карбонітрилу (IVб) в органічному розчиннику у присутності основи, причому ацетонітрил використовують як розчинник в реакції і як розчинник при кристалізації, з отриманням сполуки етил-4-(1-гідрокси-1метилетил)-2-пропіл-1-{4-[2-(тритилтеразол-5іл)феніл]феніл}-метилімідазол-5-карбоксилат (Va) 2 3 5. Спосіб за пп. 1-4, який при виконанні стадії алкілування за допомогою 4'-бромметилбіфеніл-2карбонітрилу (IVб) включає стадію реакції циклоприєднання, що приводить до утворення тетразольного фрагмента, яка може бути проведена до або після гідролізу етилового ефіру і етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3діоксолену (VI). 6. Спосіб за пп. 1-5, в якому основою, що використовується, є карбонат калію. 7. Спосіб отримання олмесартану медоксомілу, який включає однореакторний спосіб, що складається з гідролізу етилового ефіру (V), етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3діоксолену (VI) O O RH2C O , переважно 4-хлорметил-5-метил-2-оксо-1,3діоксоленом, і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу. 8. Спосіб отримання олмесартану медоксомілу за пп. 1 і 7, який включає: і) стадію алкілування етил-4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензилброміду (IVa) в ацетонітрилі і у присутності карбонату калію як основи, і іі.) однореакторний спосіб, що складається з гідролізу етилового ефіру, етерифікації з 4хлорметил-5-метил-2-оксо-1,3-діоксоленом, і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу. Даний винахід відноситься до покращуваного способу отримання олмесартану і його фармацевтично прийнятних солей і ефірів як активних інгредієнтів лікарського препарату для лікування гіпертонії і пов'язаних з нею хвороб і станів. У медицині олмесартан медоксоміл, хімічно описаний як (5-метил-2-оксо-1,3-діоксолен-4іл)метил-4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4[2-(тетразол-5-іл)феніл]феніл}метилімідазол-5карбоксилат, широко застосовують для лікування гіпертонії і пов'язаних хвороб і станів через його здатність інгібірувати ангіотензин-перетворюючий фермент. Будучи антагоністом рецепторів ангіотензину II, олмесартан медоксоміл позбавлений побічних ефектів антагоністів кальцію, проявляє високу стабільність і очевидні лікувальні ефекти. У публікації ЕР 0503785 В1 розкритий спосіб отримання олмесартан медоксомілу, що включає серед іншого реакцію (5-метил-2-оксо-1,3діоксолен-4-іл)метил-4-(1-гідрокси-1-метилетил)-2пропілімідазол-5-карбоксилату і 4-[2тритилтетразол-5-іл)феніл]бензил броміду в N,Nдиметилацетаміді у присутності карбонату калію, або реакцію етил 4-(1-гідрокси-1-метилетил)-2пропілімідазол-5-карбоксилату і 4-[2 96575 4 9. Спосіб за пп. 7 або 8, де гідроліз етилового ефіру і етерифікацію з 4-хлорметил-5-метил-2-оксо1,3-діоксоленом виконують в диметилацетаміді. 10. Спосіб за пп. 7 або 8, в якому зняття тритильної захисної групи з тритилованого олмесартану медоксомілу проводять у присутності кислоти, вибраної з органічної кислоти, неорганічної кислоти, їхніх похідних та їхніх сумішей і співрозчинника. 11.Спосіб за п. 10, в якому співрозчинник може бути вибраний із спиртів, кетону, нітрилів або води. 12. Спосіб за п. 11, в якому концентрація співрозчинника складає до 30 % (об./об.), переважно до 20 % (об./об.). 13. Спосіб за п. 10, в якому зняття тритильної захисної групи з тритилованого олмесартану медоксомілу проводять в етилацетаті у присутності соляної кислоти. 14. Спосіб за п. 1, який відрізняється тим, що після завершення зняття захисту з тетразольного фрагмента в етилацетаті реакційну суміш охолоджують, переважно до кімнатної температури, і нейтралізують водним розчином неорганічної основи до значення рН не більше 6, переважно до значення рН від 3 до 5, і виділяють продукт. 15. Спосіб за п. 14, який відрізняється тим, що фази розчинників розділяють, причому водну фазу можуть повторно екстрагувати органічним розчинником, переважно етилацетатом, об'єднані органічні фази концентрують і охолоджують, і олмесартан медоксомілу, що випав в осад, виділяють. 16. Спосіб за п. 14, який відрізняється тим, що трифенілкарбінол залишають розчиненим в реакційній суміші і не осаджують. 17. Спосіб за пп. 7 або 8, в якому реакційну суміш після зняття захисної групи нейтралізують до значення рН не більше 6. тритилтетразол-5-іл)феніл]бензил броміду в Ν,Νдиметилформаміді у присутності гідриду натрію. У прикладі 70 розкрито алкілування етил 4-(1гідрокси-1-метилетил)-2-пропілімідазол-5карбоксилату p 4'-бромметилбіфеніл-2карбонітрилом в N,N-диметилацетаміді у присутності трет-бутоксиду калію. Загальним для всіх розкритих способів є те, що алкілований продукт піддають колоночній хроматографії для досягнення прийнятної чистоти. Описано, що для отримання ефіру одержаний продукт гідролізують за допомогою гідроксиду лужного металу, сіль виділяють і далі етерифікують. На останній стадії видаляють тритильну захисну групу шляхом реакції тритильного ефіру медоксомілу в оцтовій кислоті. У публікації J. Med. Chem., 39 (1996), 323-338 описано, що стадію алкілування 4-[2тритилтетразол-5-іл)-феніл]бензилу броміду або його аналогів в імідазольну проміжну сполуку виконують в N,N-диметилацетаміді у присутності трет-бутоксиді калію. До реакційної суміші додають етанол і воду, і продукт екстрагують в етанол. Очищення продукту виконують з використанням колоночної флеш-хроматографії (етанол/гексан, 1:2) і, можливо, з додатковою кристалізацією з 5 ізопропілового ефіру, гексану, етанолу або їхніх сумішей. У публікації ЕР 0796852 В1 автори розкривають безпечніше і легше отримання 5-заміщених тетразолів без застосування Bu3SnN3. Спосіб включає реакцію нітрилу з неорганічною сіллю азиду в ароматичному вуглеводневому розчиннику у присутності солі аміну. У публікації WO 2004/085428 описаний новий спосіб отримання олмесартан медоксомілу. При цьому способі проводять розкриття кільця в 4,4диметил-2-пропіл-1-{4-[2-(трифеніл-метилтетразол-5-іл)феніл]феніл}метил-4,6дигідрофуран[3,4d]імідазол-6-оні, і утворену в результаті 4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4[2-(трифеніл-метил-тетразол-5іл)феніл]феніл}метилімідазол-5-карбонову кислоту потім конденсують з 4-бром (або -хлор) метил-5метил-2-окси-1,3-діоксигетероциклопентеном під дією лугу. Після зняття трифенілметильної захисної групи одержують олмесартан медоксоміл. Публікація WO2004/083213 відноситься до сполук, представлених наступною формулою (II), і їхніх фармацевтично прийнятних солей, а також до способу їх отримання. Вони використовуються як проміжні сполуки для отримання антагоністів рецепторів ангіотензину II, наприклад, олмесартан медоксомілу. Загальні недоліки способів попереднього рівня техніки полягають в тому, що запропоновані способи, окрім застосування колоночної хроматографії, включають додаткові стадії виділення, які, як визнано, зменшують вихід і роблять будь-який спосіб трудомістким. Також застосування деяких розчинників, наприклад, оцтової кислоти, на останніх стадіях реакції вимагає додаткових стадій кристалізації/очищення, оскільки відомо, що особливо оцтова кислота може приводити до утворення стійких домішок в процесі сушки, і її також важко видалити з фармацевтично активної сполуки, коли вона присутня як залишковий розчинник. Зважаючи на недоліки попереднього рівня техніки мета даного винаходу полягає в забезпеченні альтернативного способу отримання олмесартан медоксомілу, який може бути швидко здійснений, є економічним і дає бажану сполуку з високою чистотою. Вищезазначену проблему вирішують створенням покращуваного способу синтезу для виготовлення олмесартану і фармацевтично прийнятних солей і складних ефірів, який включає стадію алкі 96575 6 лування етил 4-(1-гідрокси-1-метилетил)-2пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5-іл)феніл]бензил броміду (IVa) або 4'-бромметилбіфеніл-2-карбонітрилу (IVб) в органічному розчиннику і у присутності основи, де ацетонітрил використовують як розчинник в реакції, так і як розчинник при кристалізації. Згідно першому втіленню, даний винахід відноситься до покращуваного способу синтезу для виготовлення олмесартан медоксомілу, який включає: - стадію алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензил броміду (IVa) в органічному розчиннику і у присутності основи, де один і той же розчинник використовують як розчинник в реакції і як розчинник при кристалізації, і - однореакторний спосіб, що складається з гідролізу етилового ефіру V, етерифікації з 4заміщеним похідним метил-5-метил-2-оксо-1,3діоксолену (VI), і подальшого зняття захисної тритильної групи без будь-яких стадій виділення в ході способу. Згідно другого втілення, даний винахід відноситься до покращуваного синтезу для виготовлення олмесартан медоксомілу, який включає: - стадію алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4'-бромметилбіфеніл-2-карбонітрилу (IV6) в органічному розчиннику і у присутності основи, де один і той же розчинник використовують як розчинник в реакції і як розчинник при кристалізації, і - спосіб, що складається з гідролізу етилового ефіру, етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3-діоксолену (VI), і подальшої реакції циклоприєднання ціаністого фрагменту з перетворенням в тетразольну групу. Було несподівано виявлено, що при отриманні олмесартан медоксомілу стадія алкілування приводить до набагато вищих виходів і нижчого вмісту домішок, якщо її проводити в ацетонітрилі як розчинник і у присутності основи, вибраної, наприклад, з карбонатів або гідроксидів, наприклад, карбонату калію, карбонату натрію, гідроксиду калію, гідроксиду натрію і гідроксиду літію, замість застосування N,N-диметилформаміду як розчинника, відомого в рівні техніки. Крім того, виявилось, що ацетонітрил також чудово підходить як розчинник при кристалізації, так що екстракція другим, відмінним розчинником, що не змішується з водою, може бути пропущена, так само як і очищення продукту колоночною хроматографією. Головним чином ця особливість ацетонітрилу також бути відповідним середовищем для кристалізації, робить спосіб дуже вигідним для промислового виробництва, оскільки очищення з використанням колоночної хроматографії рідко застосовується в промисловому масштабі. 7 Коли стадію алкілування виконують за допомогою 4'-бромметилбіфеніл-2-карбонітрилу (IVб), зняття тритильної захисної групи замінюють на реакцію циклоприєднання, і цю реакцію також можуть проводити перед гідролізом етилового ефіру і етерифікацією з 4-заміщеним похідним метил-5метил-2-оксо-1,3-діоксолену (VI). Реакція циклоп 96575 8 риєднання до тетразольного фрагменту може бути виконана за будь-якою методикою, відомою з рівня техніки, наприклад, за допомогою Bu3SnN3, NaN3/ZnCI2, або як описано в публікації ЕР 0796852 В1. Необов'язково, для проведення очищення можуть також використовувати тритильну захисну групу або будь-яку іншу відповідну захисну групу, відому фахівцю в даній області. 9 96575 10 У додатковому аспекті, даний винахід також пропонує покращений спосіб отримання фармацевтичного складу, що містить олмесартан медоксоміл високої чистоти, що демонструє чистоту (ВЕРХ) більше ніж 99,5 %, переважно більше ніж 99,6 %, переважніше 99,7 %, ще переважніше 99,8 % і найпереважніше 99,9 %, та із вмістом індивідуальних домішок менше ніж 0,1 % (все в мас. %). У додатковому аспекті даний винахід пропонує олмесартан медоксоміл, по суті, вільний від дегідро і N-алкілованих домішок із структурними формулами і 11 відповідно. Далі описані переважні втілення даного винаходу. На Фіг.1 представлена типова порошкова дифракційна рентгенограма аморфного олмесартан медоксомілу. Даний винахід відноситься до покращуваного синтезу для виготовлення олмесартан медоксомілу, який включає алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензил броміду (IVa) або 4'бромметилбіфеніл-2-карбонітрилу (IVб) в органічному розчиннику, і у присутності основи, де один і той же розчинник, ацетонітрил, використовують і як розчинник в реакції і як розчинник при кристалізації. У другому аспекті даного винаходу розкритий однореакторний спосіб, який слідує за стадією алкілування, що складається з гідролізу етилового ефіру (Va), етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3-діоксолену і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу. Якщо реакцію алкілування виконують за допомогою 4'бромметилбіфеніл-2-карбонітрилу (IVб), другий аспект даного винаходу включає спосіб, що складається з гідролізу етилового ефіру, етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3діоксолену (VI), і подальшої реакції циклоприєднання ціаністого фрагменту з утворенням тетразольної групи. Перше втілення даного винаходу відноситься до покращуваного синтезу для виготовлення олмесартан медоксомілу, який включає: і. стадію алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензил броміду (IVa) в органічному розчиннику і у присутності основи, де один і той же розчинник використовують як розчинник в реакції і як розчинник при кристалізації, і іі. однореакторний спосіб, що включає гідроліз етилового ефіру, етерифікацію з 4-заміщеним по 96575 12 хідним метил-5-метил-2-оксо-1,3-діоксолену (VI), і подальше зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу. Друге втілення даного винаходу відноситься до покращуваного синтезу для виготовлення олмесартан медоксомілу, який включає: - стадію алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4'-бромметилбіфеніл-2-карбонітрилу (IVб) в органічному розчиннику і у присутності основи, де один і той же розчинник використовують як розчинник в реакції і як розчинник при кристалізації, і - спосіб, що включає гідроліз етилового ефіру, етерифікацію з 4-заміщеним похідним метил-5метил-2-оксо-1,3-діоксолену (VI), і подальшу реакцію циклоприєднання ціаністого фрагменту з утворенням тетразольної групи. Коли стадію алкілування виконують за допомогою 4'-бромметилбіфеніл-2-карбонітрилу (IVб), зняття тритильної захисної групи замінюють на реакцію циклоприєднання, яку можна виконувати перед гідролізом етилового ефіру і етерифікацією за допомогою 4-заміщеної похідного метил-5метил-2-оксо-1,3-діоксолену (VI). Можливо, після завершення стадії алкілування етил 4-(1-гідрокси-1-метилетил)-2-пропілімідазол5-карбоксилату (III) за допомогою 4-[2(тритилтетразол-5-іл)феніл]бензил броміду (IVa) або 4'-бром-метилбіфеніл-2-карбонітрилу (IVб), органічний розчинник частково випаровують, щоб полегшити кристалізацію продукту. Якщо потрібно, алкілований продукт (Va-в) можна також суспендувати у воді і перекристалзовувати з того ж самого розчинника, який використовують в реакції алкілування. У переважному втіленні, даний винахід відноситься до покращуваного синтезу для отримання олмесартан медоксомілу, який включає: і. стадію алкілування етил 4-(1-гідрокси-1метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензил броміду (IVa) в ацетонітрилі і у присутності карбонату калію у якості основи з отриманням сполуки Va, де ацетонітрил використовують як розчинник в реакції і як розчинник при кристалізації, і іі. однореакторний спосіб, що складається з гідролізу етилового ефіру, етерифікації з 4заміщеним похідним метил-5-метил-2-оксо-1,3діоксолену (VI), переважно 4-хлорметил-5-метил2-оксо-1,3-діоксоленом, і подальше зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу, де зняття тритильної захисної групи виконують в ЕtOАс і у присутності НСІ і співрозчинника. Можливо, після завершення реакції алкілування ацетонітрил частково випаровують, щоб полегшити кристалізацію продукту (Va). Якщо необхідно, продукт також можна суспендувати у воді і перекристалізовувати з ацетонітрилу. Несподівано виявилось, що застосування одного і того ж органічного розчинника, ацетонітрилу, як розчинника в реакції і як розчинника при кристалізації в реакції алкілування 4-(1-гідрокси-1 13 метилетил)-2-пропілімідазол-5-карбоксилату (III) за допомогою 4-[2-(тритилтетразол-5іл)феніл]бензил броміду (IVa) привело до набагато вищого виходу (88 %) і нижчого вмісту домішок, не дивлячись на те, що стадія екстракції другим розчинником, що не змішується з водою, пропущена, так само як очищення продукту колоночною хроматографією. Продукти, етил 4-(1-гідрокси-1метилетил)-2-пропіл-1-{4-[2-(тритилтеразол-5іл)феніл]феніл}-метилімідазол-5-карбоксилат (Va) і етил 4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4-[2ціанобіфеніл}метилімідазол-5-карбоксилат (Vб), виділяють кристалізацією. Можливо, реакційну суміш концентрують приблизно до 1/3 початкового об'єму і охолоджують до температури нижче за 25 °C. Після того, як продукт, що випав в осад, відфільтрований, його суспендують у воді для видалення надлишку неорганічної основи. Продукт можна перекристалізовувати з органічного розчинника, наприклад, ацетонітрилу. У другому аспекті даного винаходу розкритий однореакторний спосіб, який слідує за стадією алкілування, що складається з гідролізу етилового ефіру, етерифікації з 4-заміщеним похідним метил-5-метил-2-оксо-1,3-діоксолену, і подальшого зняття тритильної захисної групи без яких-небудь стадій виділення в ході способу. 4-заміщена похідна метил-5-метил-2-оксо-1,3-діоксолену (VI) є сполукою, де Re відповідною відхідною групою, наприклад, галоген, такий як хлор, бром і йод, птолуолсульфонілокси-(тозилат), пбромбензолсульфонілокси-(брозилат), пнітробензолсульфонілокси-(нозилат) або метилсульфонілокси-(мезилат)-группу. У переважному втіленні використовують 4-хлорметил-5-метил-2оксо-1,3-діоксолен. Етил 4-(1-гідрокси-1-метилетил)-2-пропіл-1-{4[2-(тритилтетразол-5-іл) феніл]феніл}-метилімідазол-5-карбоксилат (Va) розчиняють у відповідному розчиннику і додають першу основу, і реакційну суміш перемішують протягом 24 годин, переважно протягом 4-12 годин, при температурі між 15 °C і 30 °C, переважно при температурі навколишнього середовища. Після завершення гідролізу етильного фрагменту, 4-заміщена похідна метил-5-метил-2-оксо1,3-діоксолену, переважно 4-хлорметил-5-метил-2оксо-1,3-діоксолен, можуть просто додавати до реакційної суміші, разом з іншою основою, без попереднього виділення солі, що утворюється. Перед додаванням суміш охолоджують, переважно до температури 10 °C або нижче, переважніше до 5 °C або нижче, і обидва реагенти додають при вибраній температурі. Реакційну суміш нагрівають протягом 5 годин, переважно протягом 2 годин, при температурі від кімнатної температури до 100 °C, переважно при температурі від 20 до 70 °C, переважніше від 30 до 40 °C. Як розчинники для гідролізу і стадії етерифікації можна використовувати Ν,Ν-диметилацетамід, інші амідні розчинники, нітрили або будь-який інший полярний і такий, що змішується з водою розчинник. У переважному втіленні цим розчинником є ДМА. 96575 14 Як перші основи використовують гідроксиди лужних металів, алкоксиди металів або карбонати, в кількості 1-1,5 еквівалентів. У переважному втіленні як першу основу використовують гідроксид натрію. У якості інших основ використовують гідроксиди лужних або лужноземельних металів, алкоксиди металів або карбонати, в кількості 0,5-1,5 еквівалентів. У переважному втіленні у якості іншої основи використовують карбонат калію. У переважному втіленні, даний винахід пропонує олмесартан медоксоміл, по суті вільний від дегідро- і N-алкілованих домішок. Даний винахід також пропонує спосіб синтезу олмесартан медоксомілу, що включає дегідро- і N-алкіловані домішки в кількості не більше 0,2 %, переважно не більше 0,10 %, який включає: - аналіз і відбір комерційних партій 4заміщеної похідного метил-5-метил-2-оксо-1,3діоксолену, або очищення 4-заміщеної похідного метил-5-метил-2-оксо-1,3-діоксолену і аналіз очищеного продукту. - застосування партій похідного діоксолену з чистотою більше ніж 90 %, переважно більше ніж 95 %. Після завершення стадії етерифікації реакційну суміш охолоджують до температури нижче за 15 °C, до реакційної суміші додають другий розчинник, що не змішується з водою, разом з невеликою кількістю сольового розчину і екстрагують. Органічні фракції збирають, промивають сольовим розчином і сушать над осушувачем, наприклад, безводим сульфатом натрію або магнію (VI). Екстракції проводять при температурі нижче за 25 °C. Як розчинники, що не змішуються з водою, для екстракції можуть бути вибрані розчинники з низькою розчинністю олмесартан медоксомілу, наприклад, складні ефіри, прості ефіри, галогеновані вуглеводні. Розчинником, що переважно не змішується з водою, є етилацетат. На стадії зняття тритильної захисної групи другий розчинник, що не змішується з водою, який додають після стадії етерифікації, можуть частково випаровувати, і додавати кислоту, вибрану з органічної кислоти, неорганічної кислоти, їхніх похідних і їхніх сумішей, і співрозчинник. Співрозчинник може бути вибраний із спиртів, кетону, нітрилів або води. Концентрація співрозчинника складає до 30 % (об./об.), переважно до 20 % (об. /об.). Переважно, співрозчинником є МеОН або ЕtOН. Як розчинники для стадії зняття тритильної захисної групи використовують ті ж самі розчинники, що і для згаданої вище стадії екстракції. Переважно розчинником для стадії зняття тритильного фрагменту є етилацетат. Реакційну суміш нагрівають до температури від 15 до 30 °C, переважно реакцію проводять при кімнатній температурі протягом часу до 5 годин, переважно протягом 3 годин. Кислота може бути вибрана з НСІ, HBr, HI, H2SO4, H3PO4 або інших відповідних неорганічних кислот. Переважно, додають НСІ у вигляді розчину у воді або в органічному розчиннику або в газоподібній формі. 15 Після завершення процесу зняття захисту реакційну суміш охолоджують, переважно до кімнатної температури, і нейтралізують розчином неорганічної основи до значення рН не більше 6, переважно до значення рН від 3 до 5. Фази розділяють, і водну фазу можуть повторно екстрагувати органічним розчинником. Зібрані органічні фази сушать, фільтрують і концентрують. Суміш охолоджують, і осаджують продукт. Кінцевий продукт (І) фільтрують і промивають свіжим органічним розчинником, і побічний продукт реакції (трифенілкарбінол), залишається повністю розчиненим у фільтраті. Відповідними неорганічними основами, що використовуються для нейтралізації, є NaOH, КОН, LiOH, Ca(OH)2, Na2CO3, NaHCO3, K2CO3, KHCO3, неорганічні фосфати. Переважно використовують водний розчин NaOH. Сирий продукт можна перекристалізовувати з органічних розчинників, таких як ацетати, кетони, спирти, нітрили і їхні суміші. Кристалічні форми продуктів, перекристалізовані з вищезазначених розчинників, були тими ж, як описано в публікації Annual Report of Sankyo Research Laboratories Vol. 55 (2003). Якщо розчин олмесартан медоксомілу поволі кристалізують з ізобутанолу або тетрагідрофурану (ТГФ), то одержують нову форму олмесартан медоксомілу, яка характеризується інтервалом температури плавлення 182-184 °C і дифракційною рентгенограмою з піками при 7,4, 9,0, 9,6, 11,6, 12,0, 13,4, 16,0, 17,9, 21,1±0,2 градуса кута 2. Порошкові дифракційні рентгенограми одержували на порошковому дифрактометрі Phillips PW3040/60 X'Pert PRO; випромінювання CuKα 1,541874A, 3°
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of olmesartan medoxomil
Автори англійськоюZuppancic Silvo, Pecavar Anica, Vrbinc Miha, Vrbinc, Miha, Osolnik Renata
Назва патенту російськоюСпособ получения олмесартана медоксомила
Автори російськоюЖупанчич Силво, Пекавар Аника, Врбинц Миха, Осолник Рената
МПК / Мітки
МПК: C07D 405/14
Мітки: медоксомілу, спосіб, отримання, олмесартану
Код посилання
<a href="https://ua.patents.su/14-96575-sposib-otrimannya-olmesartanu-medoksomilu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання олмесартану медоксомілу</a>
Попередній патент: Використання івабрадину для одержання ліків, призначених для лікування ендотеліальної дисфункції
Наступний патент: Спосіб утилізації тепла відпрацьованих газів теплової установки клушина і пристрій для його здійснення
Випадковий патент: Спосіб прямого темплатного синтезу гетерометалевих комплексів