Похідні 13-бензолсульфонілгідразонантрацикліну і спосіб одержання 13-деоксіантрациклінів (варіанти)
Формула / Реферат
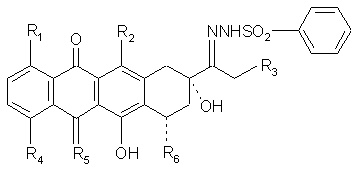
1. Сполука формули:
 ,
,
де:
R1, R2 і R3 є Н або ОН;
R4 є Н, ОН, алкіл або О-алкіл;
R5 є О або NH; і
R6 є Н, ОН або цукровий фрагмент.
2. Сполука за пунктом 1, де згадувана сполука - похідне антрацикліну, вибране із групи, що складається з наступних: доксорубіцин, даунорубіцин, епірубіцин, ідарубіцин, анаміцин і карміноміцин.
3. Спосіб одержання сполуки за пунктом 1, за яким здійснюють реакцію 13-кетоантрацикліну або його кислої солі з бензолсульфонілгідразидом в спиртовому розчиннику при приблизно 35-50 °С протягом приблизно 10-24 годин.
4. Спосіб одержання 13-деоксіантрациклінів, за яким здійснюють:
1) утворення спиртового розчину 13-бензол- або заміщеного бензолсульфонілгідразонантрацикліну;
2) додавання відновлювального агента і кислоти до згадуваного розчину;
3) нагрівання розчину без струшування або перемішування для відновлення 13-бензол- або заміщеного бензолсульфонілгідразонантрацикліну; і
4) нейтралізацію розчину водною основою, одержуючи таким чином 13-деоксіантрациклін і осади.
5. Спосіб за пунктом 4, за яким додатково здійснюють стадію фільтрування осаду, екстрагування 13-деоксіантрацикліну із осаду і екстрагування 13-деоксіантрацикліну із фільтрату.
6. Спосіб за пунктом 4, де нагрівання здійснюють при приблизно 55-64 °С, відновлювальний агент - ціаноборогідрид, і згадувана кислота - п-толуолсульфонова кислота.
7. Спосіб за пунктом 6, за яким нагрівання здійснюють при приблизно від 59 °С до приблизно 60 °С.
8. Спосіб за пунктом 4, за яким 13-бензол- або заміщений бензолсульфонілгідразонантрациклін - похідне антрацикліну, вибране із групи, що складається з доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину.
9. Спосіб одержання 5-іміно-13-деоксіантрациклінів, за яким здійснюють:
1) одержання 13-деоксіантрацикліну за пунктом 4;
2) розчинення 13-деоксіантрацикліну в спирті; і
3) перетворення 13-деоксіантрацикліну у відповідний 5-іміно-13-деоксіантрациклін з аміаком при температурі менше ніж приблизно 20 °С.
10. Спосіб за пунктом 9, за яким стадію перетворення 13-деоксіантрацикліну у відповідний 5-іміно-13-деоксіантрациклін з аміаком здійснюють при приблизно 1-4 °С протягом від 1 до 4 днів.
11. Спосіб за пунктом 9, за яким 13-деоксіантрациклін вибраний із групи, що складається з 13-деоксиформ доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину.
12. Спосіб за пунктом 9, за яким 13-деоксіантрациклін синтезують із відповідного 13-бензолсульфонілгідразонантрацикліну.
13. Спосіб одержання 13-деоксіантрациклінів, за яким здійснюють:
1) утворення спиртового розчину 13-бензол- або заміщеного бензолсульфонілгідразонантрацикліну;
2) додавання відновлювального агента і кислої піридинової солі до розчину; і
3) нагрівання розчину для відновлення 13-бензол- або заміщеного бензолсульфонілгідразонантрацикліну.
14. Спосіб за пунктом 13, за яким кисла піридинова сіль є піридин-п-толуолсульфонатом і відновлювальний агент - ціаноборогідридом.
15. Спосіб за пунктом 13, за яким додатково проводять стадію гідролізу відновленого 13-бензол- або заміщеного бензолсульфонілгідразонантрацикліну, одержуючи таким чином 13-деоксіантрациклін.
16. Спосіб за пунктом 13, за яким нагрівання здійснюють при приблизно 65-75 °С.
17. Спосіб за пунктом 13, за яким 13-бензол- або заміщений бензолсульфонілгідразонантрациклін - похідне антрацикліну, вибране із групи, що складається з доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину.
18. Спосіб одержання 5-іміно-13-деоксіантрациклінів, за яким здійснюють:
1) одержання 13-деоксіантрацикліну за пунктом 13; і
2) перетворення 13-деоксіантрацикліну у відповідний 5-іміно-13-деоксіантрациклін з аміаком при температурі менше ніж приблизно 20 °С.
19. Спосіб за пунктом 18, за яким стадію перетворення 13-деоксіантрацикліну у відповідний 5-іміно-13-деоксіантрациклін з аміаком здійснюють при температурі приблизно 1-4 °С протягом 1-4 днів.
20. Спосіб за пунктом 18, за яким 13-деоксіантрациклін вибраний із групи, що складається з 13-деоксиформ доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину.
21. Спосіб за пунктом 18, за яким 13-деоксіантрациклін синтезують із відповідного 13-бензолсульфонілгідразонантрацикліну.
Текст
1. Сполука формули: R1 СПОСІБ (19) 1 І 3 91349 4 14. Спосіб за пунктом 13, за яким кисла піридинова сіль є піридин-п-толуолсульфонатом і відновлювальний агент - ціаноборогідридом. 15. Спосіб за пунктом 13, за яким додатково проводять стадію гідролізу відновленого 13-бензолабо заміщеного бензолсульфонілгідразонантрацикліну, одержуючи таким чином 13деоксіантрациклін. 16. Спосіб за пунктом 13, за яким нагрівання здійснюють при приблизно 65-75 °С. 17. Спосіб за пунктом 13, за яким 13-бензол- або заміщений бензолсульфонілгідразонантрациклін похідне антрацикліну, вибране із групи, що складається з доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину. 18. Спосіб одержання 5-іміно-13деоксіантрациклінів, за яким здійснюють: 1) одержання 13-деоксіантрацикліну за пунктом 13; і 2) перетворення 13-деоксіантрацикліну у відповідний 5-іміно-13-деоксіантрациклін з аміаком при температурі менше ніж приблизно 20 °С. 19. Спосіб за пунктом 18, за яким стадію перетворення 13-деоксіантрацикліну у відповідний 5-іміно13-деоксіантрациклін з аміаком здійснюють при температурі приблизно 1-4 °С протягом 1-4 днів. 20. Спосіб за пунктом 18, за яким 13деоксіантрациклін вибраний із групи, що складається з 13-деоксиформ доксорубіцину, даунорубіцину, епірубіцину, ідарубіцину, анаміцину і карміноміцину. 21. Спосіб за пунктом 18, за яким 13деоксіантрациклін синтезують із відповідного 13бензолсульфонілгідразонантрацикліну. Даний винахід стосується композицій і способів одержання 13-деоксиантрациклінів, і, більш конкретно, застосування 13бензолсульфонілгідразонантрациклінових проміжних сполук для синтезу і виділення 13деоксиантрациклінів, способів одержання 13бензолсульфонілгідразонантрациклінів. Даний винахід також стосується нових 13бензолсульфонілгідразонових проміжних сполук і способів одержання цих проміжних сполук. Найвідомішими протираковими антрацикліновими лікарськими засобами є доксорубіцн і даунорубіцин, які містять 13-кетогрупу. Доксорубіцин, розкритий в патенті США №3,590,028, має широкий спектр протиракового застосування і використовується при лікуванні лейкемії, лімфоми і солідних пухлин. Даунорубіцин, описаний в патенті США №3,616,242, придатний для лікування гострої лейкемії. Проте, використання цих лікарських засобів обмежується серйозними побічними ефектами кардіотоксичності, таким чином, що загальна кількість лікарського засобу, який може бути даний пацієнтові, не може перевищувати 550мг/М2 (Е.А. Lefrak та інші, Cancer, 32:302,1973). Навіть при такій рекомендованій максимальній загальній кумулятивній дозі (430-650мг/М2) у 60% пацієнтів спостерігається значна та персистентна серцева дисфункція, а у 14% розвивається застійна серцева недостатність (A. Dresdale та інші, Cancer, 52:51,1983). Таким чином, не зважаючи на те, що ці лікарські засоби є придатними для інгібування росту ракових пухлин, пацієнт може померти від застійної серцевої недостатності внаслідок важких кардіотоксичних побічних ефектів лікарських засобів. Також було виявлено, що кардіотоксичність цих антрациклінів викликається метаболічним відновленням 13-кетогрупи до 13дигідроалкогольного метаболіту (P.S. Mushlin та інші, Fed. Proa, 45: 809, 1986). У досліджуваних системах, в яких доксорубіцин суттєво не метаболізувався до 13-дигідроалкогольного метаболіту (доксорубіцинол), ніяких істотних кардіотоксичних ефектів не спостерігається (P.S. Mushlin та інші, Fed. Proa, 44:1274, 1985; R.D. Olson та інші, Fed. Proa, 45:809,1986). Навпаки, 13дигідрометаболіти, доксорубіцинол і даунорубіцинол, спричиняють кардіотоксичність в таких же досліджуваних системах при відносно низьких концентраціях (1-2мкг/мл, R.D. Olson та інші, Proceed. Am. Assoc. Cancer Res., 26:227,1985; R.D. Olson та інші, Proceed. Am. Assoc. Cancer Res. 28:441,1987). Якщо доксорубіцин залишається у досліджуваних системах навіть протягом коротких періодів часу, відбуваються деякі метаболічні конверсії, і 13-дигідрометаболіт утворюється в достатній кількості, внаслідок чого починає розвиватися кардіотоксичність (L. Rossini та інші, Arch. Toxicol. Suppl., 9:474, 1986; Μ.. Del Tocca та інші, Pharmacol. Re. Commun., 17:1073, 1985). Таким чином, посилюються важливі докази того, що кардіотоксичність лікарських засобів, таких як доксорубіцин і даунорубіцин, є наслідком потужних кардіотоксичних ефектів, що викликаються їх 13дигідрометаболітами (P. Mushlin та інші, FASEB Journal, 2:А1133, 1988; R. Воuсек та інші, J. Biol. Chem., 262:15851,1987; і R. Olson та інші, Proc. Natl. Acad. Sci., 85:3585, 1988). Нещодавно було виявлено, що 13деоксиформи доксорубіцину, даунорубіцину або інших подібних антрациклінів не будуть метаболічно перетворюватись на кардіотоксичні 13дигідроформи, і що 5-кетогрупа може бути перетворена на форму, яка буде менш придатною для утворення вільних радикалів, забезпечуючи таким чином додаткову покращену безпечність. Зокрема, див. WO 99/08687, патенти США №№5,984,896 і 5,942,605 і PCT/US 99/04704, розкриття яких включено тут як посилання. Перший документально підтверджений спосіб одержання певних 13-деоксиантрациклінів з 13-пметилбензолсульфонілгідразонантрациклінів мав відносно низькі виходи, приблизно 10% (див. Smith, та інші, J. Med. Chem. 1978 21, 280-283). Покращені способи синтезу 13 5 деоксиантрациклінів з 13-пметилбензолсульфонілгідразон-антрациклінів з підвищеними виходами розкрито в WO99/08687 і патенті США №5,984,896. Проте, ці способи використовують відносно великий надлишок реагентів і мають відносно тривалий час здійснення. Окрім того, вихід хоча і збільшений, є менший, ніж оптимальний для комерційного виробництва. До того ж, використання 13-пметилбензолсульфонілгідразонантрациклінів надає приблизно 3% або більше цієї стартової речовини в 13-деоксиантрацикліновому продукті. Використання 13-n-Fбензолсульфонілгідразонантрациклінів відоме, але синтез 13-п-F-, 13-п-СІ-, або 13-пнітробензолсульфонілгідразонантрациклінів від їх прекурсорів 13-кетоантрациклінів приводить до нижчого виходу, у порівнянні з 13-пметилбензолсульфонілгідразон антрациклінами і також надає нижчий вихід 13-деоксиантрациклінів. Композиції і способи даного винаходу забезпечують збільшений вихід і чистоту 13деоксиантрациклінів від відповідних 13кетоантрациклінів. Один аспект даного винаходу має відношення до сполук, представлених формулою: , де R1, R2 і R3 є Н або OH; F4 є Н, ОН, алкіл, або О-алкіл; R5 є О або NH; і R
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and processes for preparing 13-deoxy-anthracyclines
Автори англійськоюWalsh Gerald M., Olson Richard D.
Назва патенту російськоюПроизводные 13-бензолсульфонилгидразонантрациклина и способ получения 13-деоксиантрациклинов (варианты)
Автори російськоюВолш Джеральд М., Ольсон Ричард Д.
МПК / Мітки
МПК: C07H 1/00
Мітки: 13-деоксіантрациклінів, 13-бензолсульфонілгідразонантрацикліну, варіанти, похідні, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/9-91349-pokhidni-13-benzolsulfonilgidrazonantraciklinu-i-sposib-oderzhannya-13-deoksiantracikliniv-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні 13-бензолсульфонілгідразонантрацикліну і спосіб одержання 13-деоксіантрациклінів (варіанти)</a>