Похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну та спосіб їх отримання
Номер патенту: 105415
Опубліковано: 12.05.2014
Автори: Сипченко Володимир Віталійович, Ковтуненко Володимир Олексійович, Потіха Людмила Михайлівна
Формула / Реферат
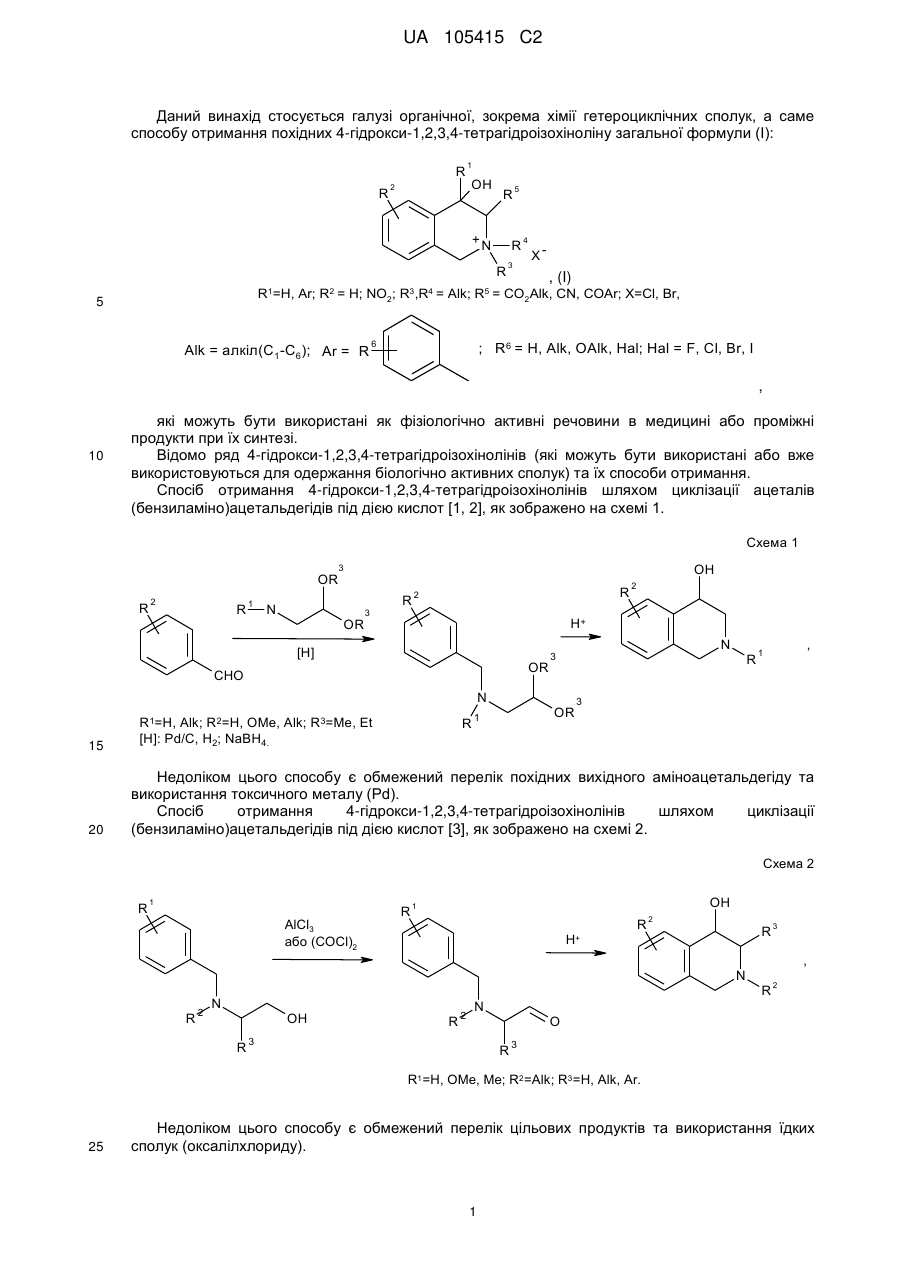
1. Похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І), які є четвертинними солями і можуть мати замісники при С(4) та С(3):
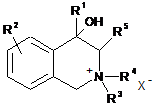 , (I)
, (I)
де
![]() ;
;
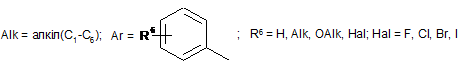 .
.
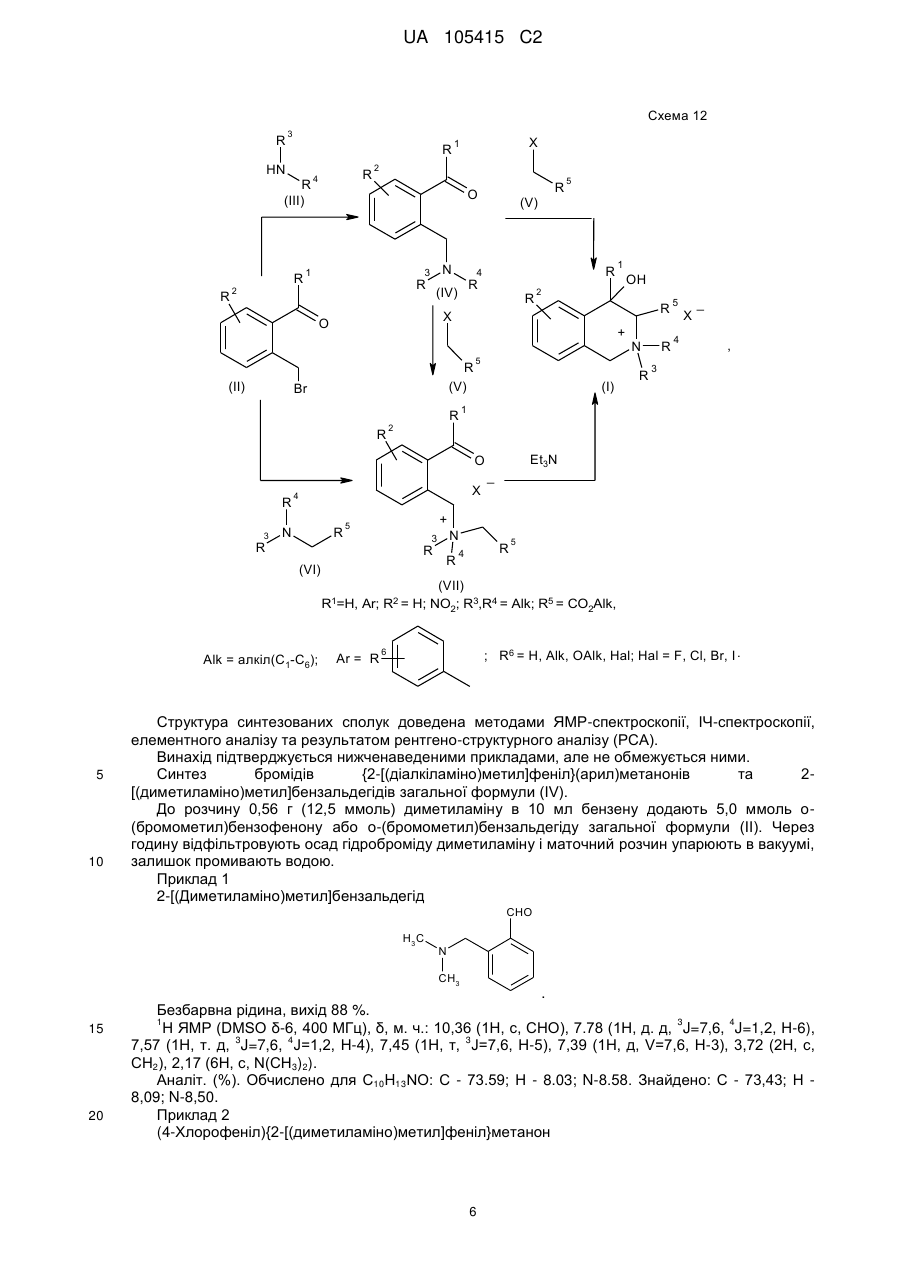
2. Спосіб отримання похідних 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І), який полягає у тому, що добудову тетрагідропіридинового циклу до бензенового здійснюють шляхом внутрішньомолекулярної конденсації в солях (2-R-карбонілфеніл)-N,N,N-триалкілметанамонію:

![]() ,
,
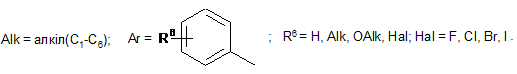
3. Спосіб за п. 2, який відрізняється тим, що при взаємодії (2-R-карбонілфеніл)метилбромідів загальної формули (II) з вторинними амінами загальної формули (III) одержують о-(діалкіламінометил)похідні загальної формули (IV), які алкілують галогенметилпохідними загальної формули (V) і одержують похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І).
4. Спосіб за п. 2, який відрізняється тим, що вторинні аміни загальної формули (III) алкілують (2-R-карбонілфеніл)метилбромідами загальної формули (II) та галогенметилпохідними загальної формули (V) і одержують галогеніди (2-R-карбонілфеніл)-N,N,N-триалкілметанамонію загальної формули (VII), які перетворюють в похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І) шляхом нагрівання в основному середовищі.
5. Спосіб за п. 2, який відрізняється тим, що похідні N,N-діалкілсаркозину загальної формули (VI) алкілують (2-R-карбонілфеніл)метилбромідами загальної формули (II) і одержують галогеніди (2-R-карбонілфеніл)-N,N,N-триалкілметанамонію загальної формули (VII), які перетворюють в похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І) шляхом нагрівання в основному середовищі.
Текст
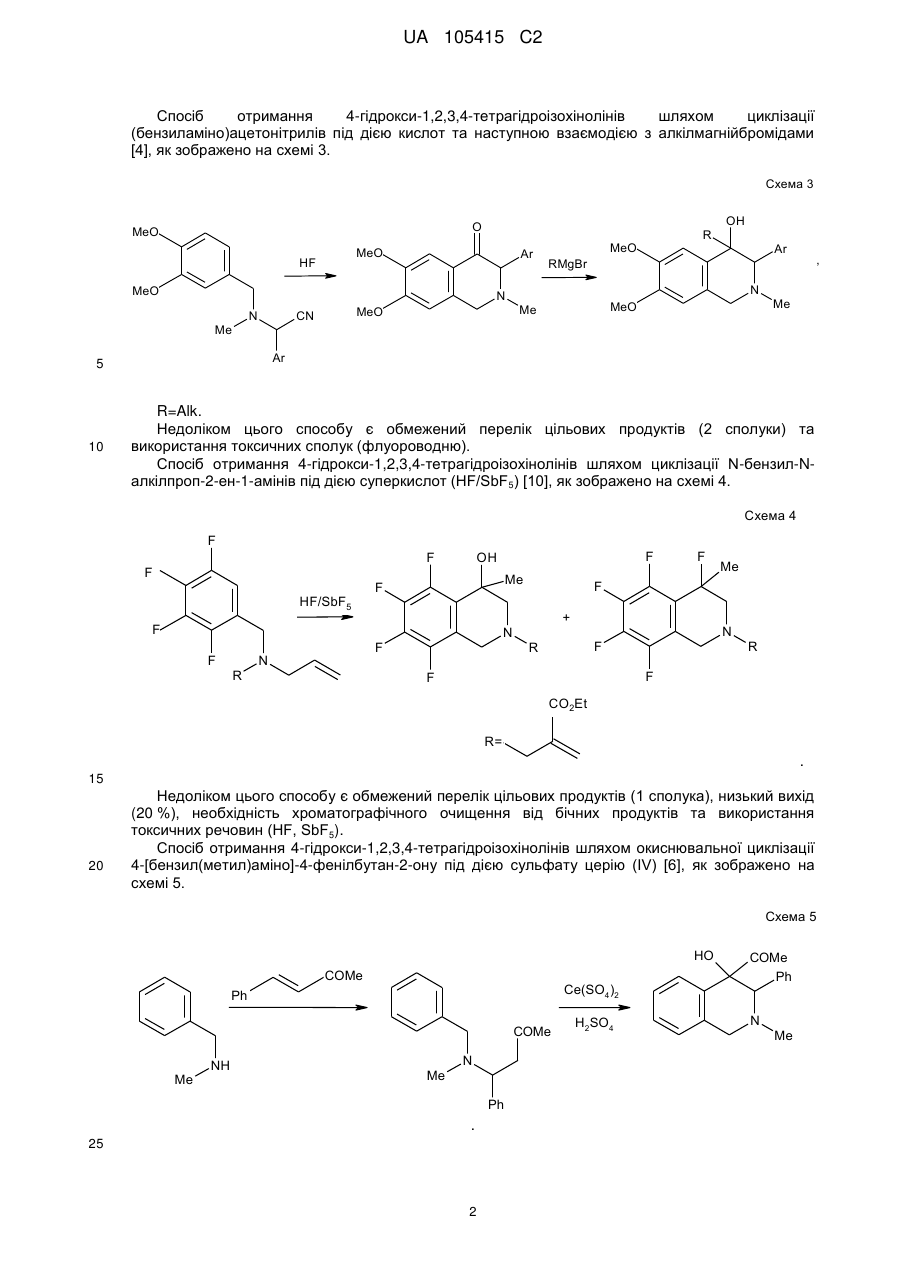
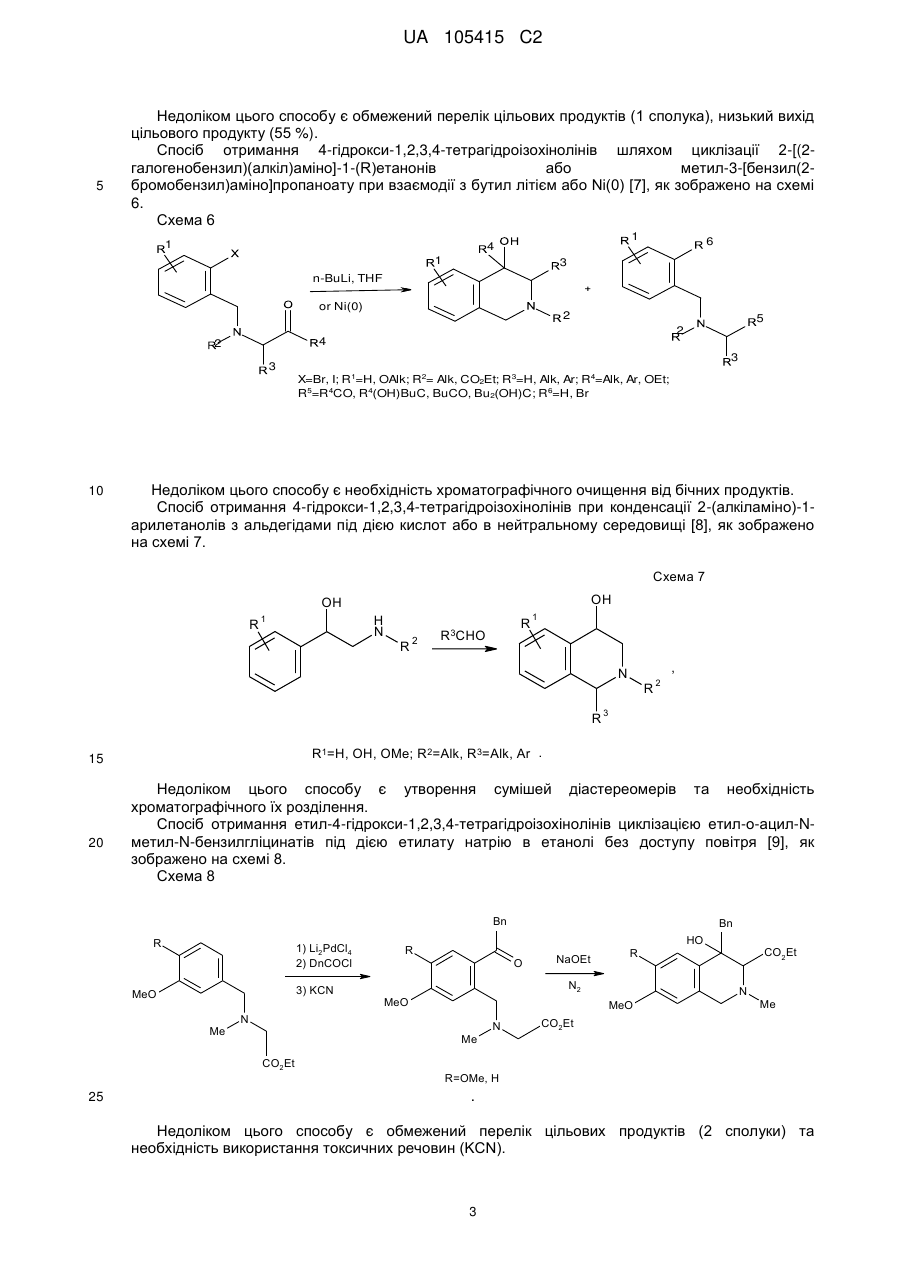
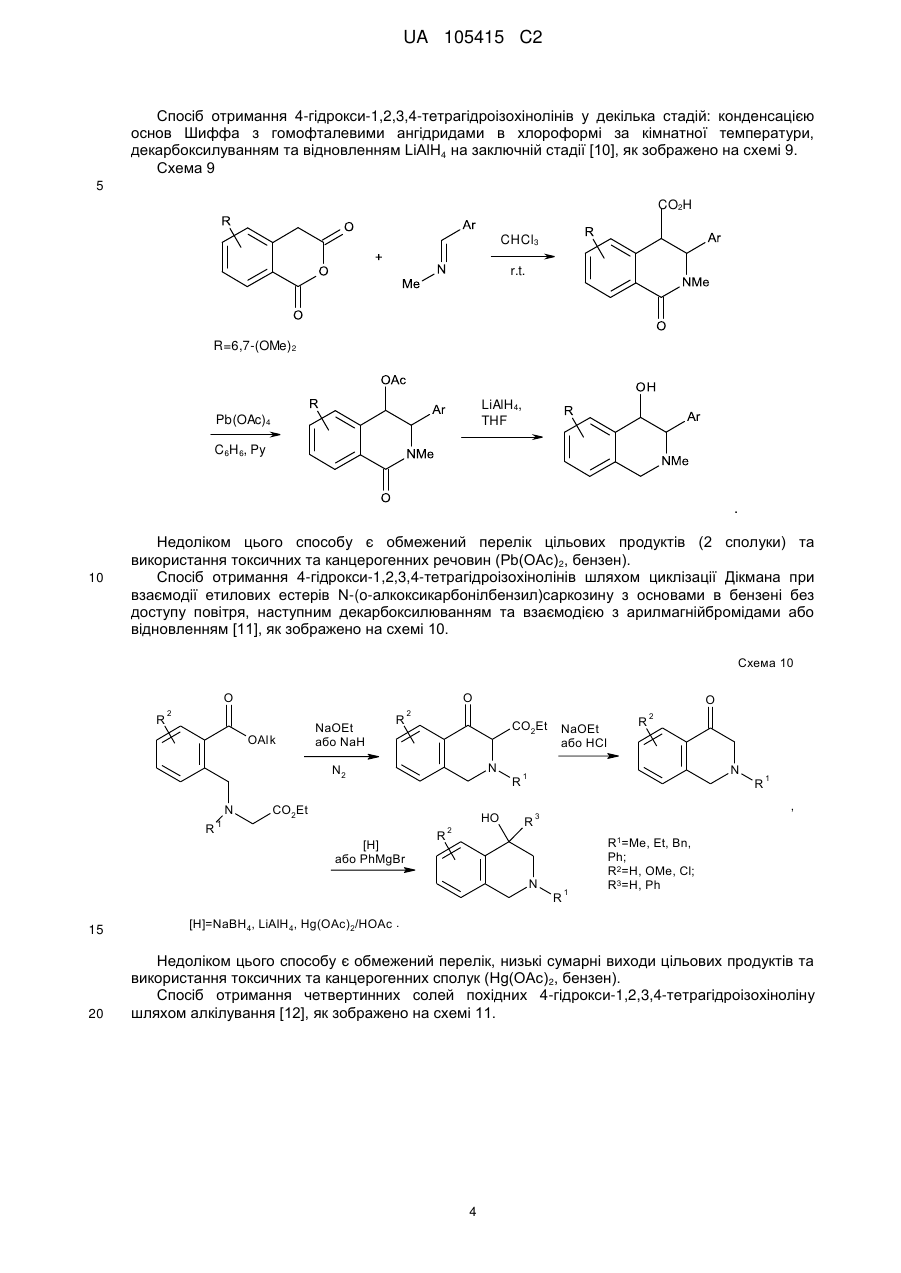
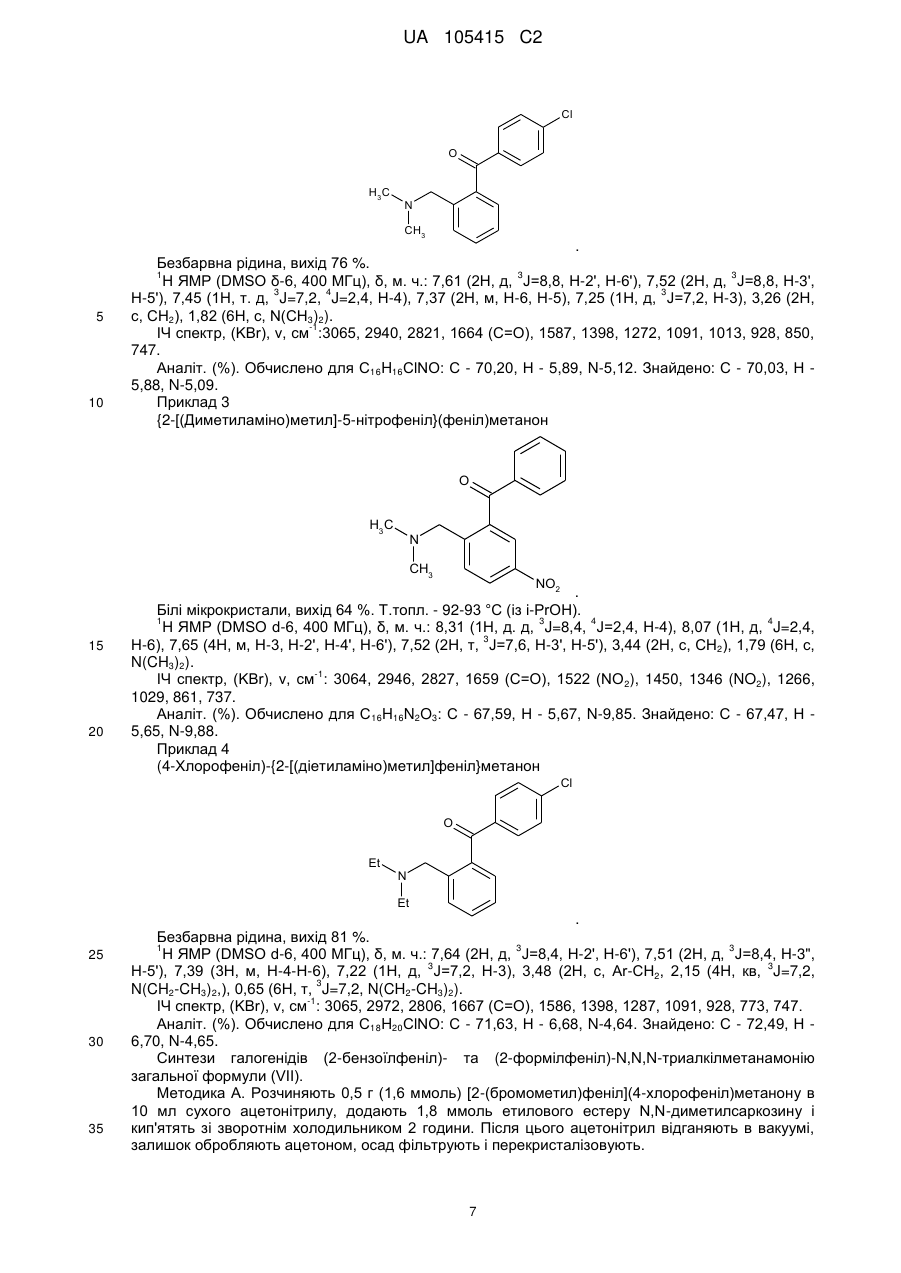
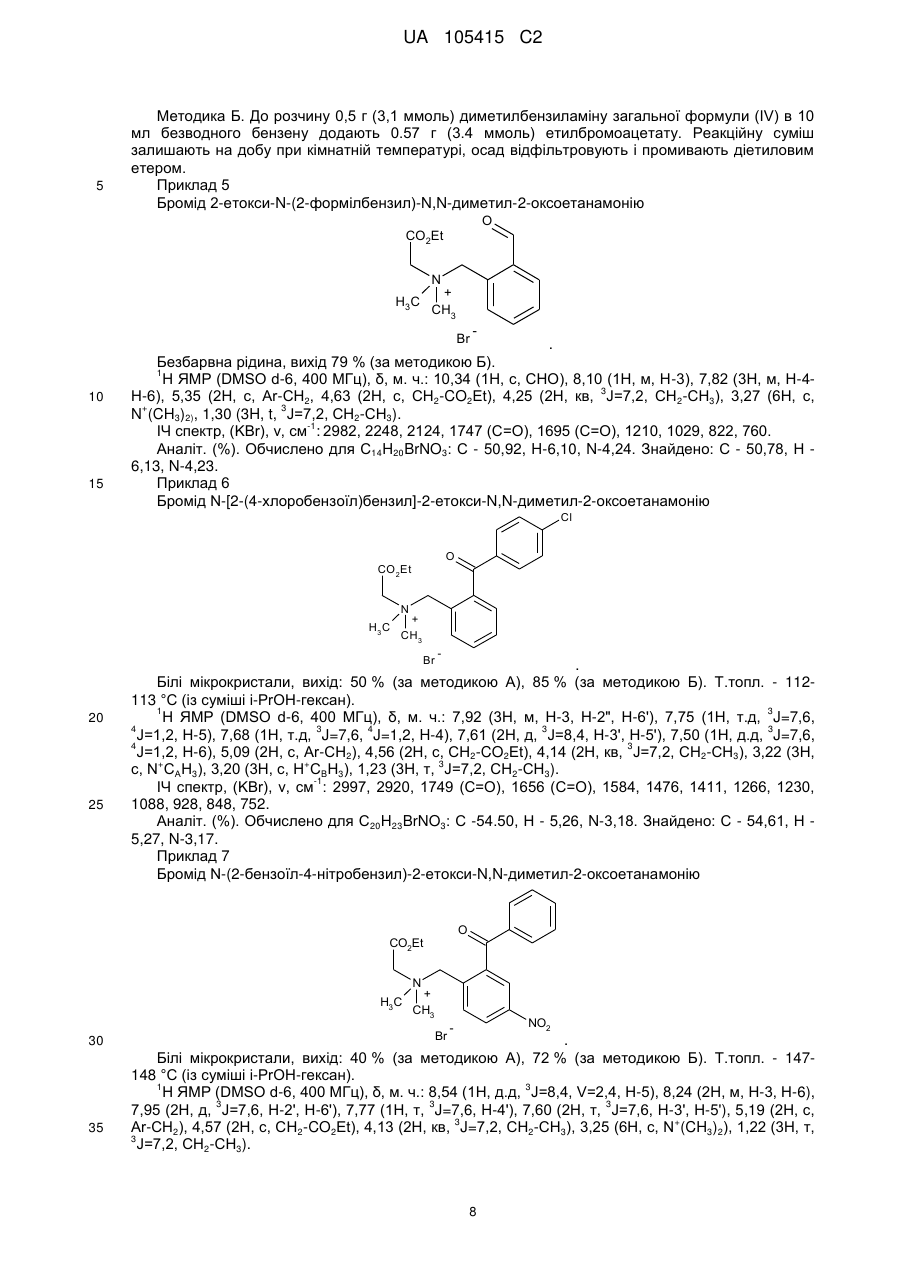
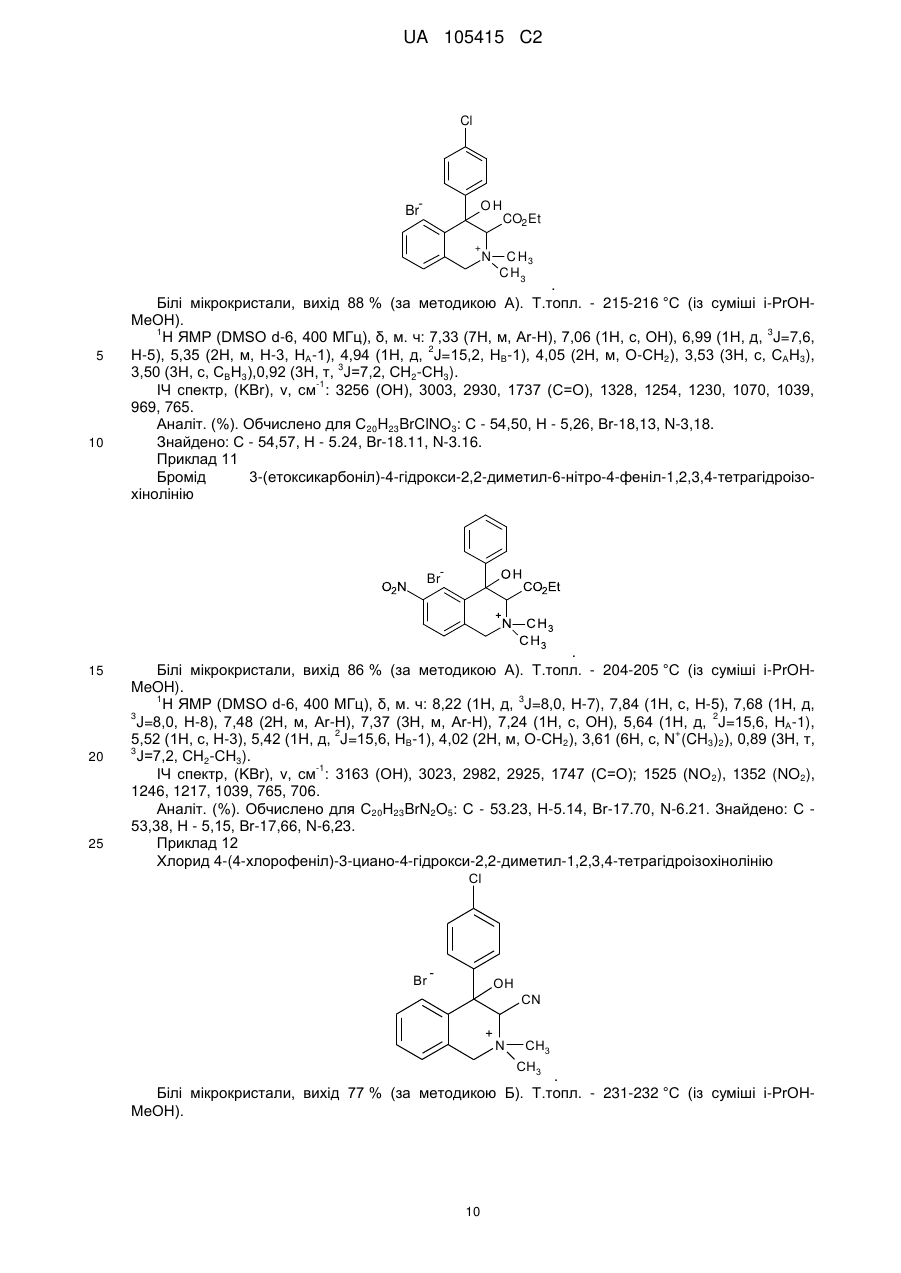
Реферат: Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме похідних 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І) та способу їх отримання R R 2 1 OH R +N 5 R R 3 4 X , (I) де R1=H, Ar; R2 = H; NO2; R3,R4 = Alk; R5 = CO2Alk, CN, COAr; X=Cl, Br Alk = алкіл(С1-С6); Ar = R 6 , ; R6 = H, Alk, OAlk, Hal; Hal = F, Cl, Br, I , які можуть бути використані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. UA 105415 C2 (12) UA 105415 C2 UA 105415 C2 Даний винахід стосується галузі органічної, зокрема хімії гетероциклічних сполук, а саме способу отримання похідних 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І): R R 2 1 OH R +N 5 R R 3 4 X , (I) R1=H, Ar; R2 = H; NO2; R3,R4 = Alk; R5 = CO2Alk, CN, COAr; X=Cl, Br, 5 Alk = алкіл(С1-С6); Ar = R 6 ; R6 = H, Alk, OAlk, Hal; Hal = F, Cl, Br, I , 10 які можуть бути використані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. Відомо ряд 4-гідрокси-1,2,3,4-тетрагідроізохінолінів (які можуть бути використані або вже використовуються для одержання біологічно активних сполук) та їх способи отримання. Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації ацеталів (бензиламіно)ацетальдегідів під дією кислот [1, 2], як зображено на схемі 1. Cхема 1 OR R 2 R 1 OH 3 R N OR R 2 3 H+ [H] OR CHO N R1=H, 15 20 R2=H, Alk; OMe, Alk; [H]: Pd/C, H2; NaBH4. R3=Me, 2 Et R N 3 OR 1 R , 1 3 Недоліком цього способу є обмежений перелік похідних вихідного аміноацетальдегіду та використання токсичного металу (Pd). Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації (бензиламіно)ацетальдегідів під дією кислот [3], як зображено на схемі 2. Cхема 2 R 1 AlCl3 або (COCl)2 R OH 1 R 2 R H+ 3 , N R 2 N OH R R 2 N 3 R 2 O R 3 R1=H, OMe, Me; R2=Alk; R3=H, Alk, Ar. 25 Недоліком цього способу є обмежений перелік цільових продуктів та використання їдких сполук (оксалілхлориду). 1 UA 105415 C2 Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації (бензиламіно)ацетонітрилів під дією кислот та наступною взаємодією з алкілмагнійбромідами [4], як зображено на схемі 3. Cхема 3 O MeO MeO HF Ar MeO N Me MeO OH Ar , RMgBr N MeO Me Me Ar 5 10 MeO CN N R R=Alk. Недоліком цього способу є обмежений перелік цільових продуктів (2 сполуки) та використання токсичних сполук (флуороводню). Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації N-бензил-Nалкілпроп-2-ен-1-амінів під дією суперкислот (HF/SbF5) [10], як зображено на схемі 4. Cхема 4 F F F HF/SbF5 Me F R N F N F Me F + F F F OH N F R R F F CO2Et R= . 15 20 Недоліком цього способу є обмежений перелік цільових продуктів (1 сполука), низький вихід (20 %), необхідність хроматографічного очищення від бічних продуктів та використання токсичних речовин (HF, SbF5). Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом окиснювальної циклізації 4-[бензил(метил)аміно]-4-фенілбутан-2-ону під дією сульфату церію (IV) [6], як зображено на схемі 5. Cхема 5 HO COMe Ce(SO4)2 Ph COMe Me NH Me N Ph . 25 2 H2SO4 COMe Ph N Me UA 105415 C2 5 Недоліком цього способу є обмежений перелік цільових продуктів (1 сполука), низький вихід цільового продукту (55 %). Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації 2-[(2галогенобензил)(алкіл)аміно]-1-(R)етанонів або метил-3-[бензил(2бромобензил)аміно]пропаноату при взаємодії з бутил літієм або Ni(0) [7], як зображено на схемі 6. Схема 6 1 1 4 1 6 3 n-BuLi, THF or Ni(0) 2 5 2 4 2 3 3 1 2 3 4 X=Br, I; R =H, OAlk; R = Alk, CO2Et; R =H, Alk, Ar; R =Alk, Ar, OEt; R5=R4CO, R 4(OH)BuC, BuCO, Bu 2(OH)C; R 6=H, Br 10 Недоліком цього способу є необхідність хроматографічного очищення від бічних продуктів. Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів при конденсації 2-(алкіламіно)-1арилетанолів з альдегідами під дією кислот або в нейтральному середовищі [8], як зображено на схемі 7. Схема 7 OH OH R H N 1 R 2 R R3CHO 1 , N R 2 3 R1=H, OH, OMe; R2=Alk, R3=Alk, Ar . 15 20 R Недоліком цього способу є утворення сумішей діастереомерів та необхідність хроматографічного їх розділення. Спосіб отримання етил-4-гідрокси-1,2,3,4-тетрагідроізохінолінів циклізацією етил-о-ацил-Nметил-N-бензилгліцинатів під дією етилату натрію в етанолі без доступу повітря [9], як зображено на схемі 8. Схема 8 Схема 8 Bn R 1) Li2PdCl4 2) DnCOCl 3) KCN MeO Me R Bn O NaOEt R N2 MeO Me N CO2Et N MeO N HO Me CO2Et CO2Et R=OMe, H 25 . Недоліком цього способу є обмежений перелік цільових продуктів (2 сполуки) та необхідність використання токсичних речовин (KCN). 3 UA 105415 C2 Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів у декілька стадій: конденсацією основ Шиффа з гомофталевими ангідридами в хлороформі за кімнатної температури, декарбоксилуванням та відновленням LiAlH4 на заключній стадії [10], як зображено на схемі 9. Схема 9 5 CO2H CHCl3 r.t. R=6,7-(OMe)2 LiAlH 4, THF Pb(OAc)4 C6H6, Py . 10 Недоліком цього способу є обмежений перелік цільових продуктів (2 сполуки) та використання токсичних та канцерогенних речовин (Рb(ОАс) 2, бензен). Спосіб отримання 4-гідрокси-1,2,3,4-тетрагідроізохінолінів шляхом циклізації Дікмана при взаємодії етилових естерів N-(o-алкоксикарбонілбензил)саркозину з основами в бензені без доступу повітря, наступним декарбоксилюванням та взаємодією з арилмагнійбромідами або відновленням [11], як зображено на схемі 10. Схема 10 O O R 2 OAlk NaOEt або NaH R CO2Et N N2 N R 1 O 2 CO2Et HO [H] або PhMgBr R 2 R 20 R N 1 R R 1 , 3 N 15 NaOEt або HCl 2 R 1 R1=Me, Et, Bn, Ph; R2=H, OMe, Cl; R3=H, Ph [H]=NaBH4, LiAlH4, Hg(OAc)2/HOAc . Недоліком цього способу є обмежений перелік, низькі сумарні виходи цільових продуктів та використання токсичних та канцерогенних сполук (Hg(OAc)2, бензен). Спосіб отримання четвертинних солей похідних 4-гідрокси-1,2,3,4-тетрагідроізохіноліну шляхом алкілування [12], як зображено на схемі 11. 4 UA 105415 C2 Схема 11 R 1 R 2 OH R 1 R 2 OH I Mel N + Me R2=H, Ph 5 10 15 20 25 30 N Me Me . Недоліком цього способу є обмежений перелік (2 сполуки) та низький вихід цільового 2 продукту в одному з випадків (43 %, R =Н). На сьогодні відомо ряд похідних 4-гідрокси-1,2,3,4-тетрагідроізохінолінів, що виявляють високий рівень біологічної активності й запатентовані як інгібітори росту ендокринно-залежних пухлин [2], інгібіторів засвоєння норепінефрину, допаміну та серотоніну для лікування неврологічних та психічних розладів [13]; вихідних для одержання Cotarnine та ефективного інгібітору секреції шлункової кислоти [12]. Представники ряду 4-арил-1,2,3,4-ізохінолінів знайдено в природі (алкалоїди (-)-cerylline та nomifensine) і запропоновано використовувати як антидепресанти та гіпотензивних засобів [14]. Похідні 1,2,3,4-тетрагідроізохінолін-3-карбонової кислоти відомі як потенційні засоби для профілактики і лікування респіраторних розладів як антагоністів мускаринових рецепторів [15]. Поєднання в одній структурі тетрагідроізохінолінів декількох типів фармакофорних замісників може привести до появи нових типів біологічної активності та розширити коло їх практичного застосування. В основу винаходу поставлено задачу створити нові похідні 1,2,3,4-тетрагідроізохінолінів, а саме розробити спосіб отримання похідних 4-гідрокси-1,2,3,4-тетрагідроізохінолін-3-карбонової кислоти та (4-гідрокси-1,2,3,4-тетрагідроізохінолін-3-іл)(R)метанону загальної формули (І), який позбавлений основних недоліків відомих способів синтезу: використання токсичних та канцерогенних речовин і необхідності хроматографічного очищення цільового продукту. Поставлена задача вирішується трьома шляхами: 1) взаємодією похідних (2-R-карбонілфеніл)метилбромідів загальної формули (II) з вторинними амінами загальної формули (III) та наступним алкілуванням о(діалкіламінометил)похідних загальної формули (IV) галогенметилпохідними загальної формули (V), як зображено на схемі 12; 2) взаємодією похідних (2-R-карбонілфеніл)метилбромідів загальної формули (II) з вторинними амінами загальної формули (III) та наступним алкілуванням о(діалкіламінометил)похідних загальної формули (IV) галогенметилпохідними загальної формули (V) та циклізацією четвертинних солей загальної формули (VII) в основному середовищі, як зображено на схемі 12; 3) взаємодією сполук загальної формули (II) з похідними N,N-діалкілсаркозину загальної формули (VI) та наступною циклізацією галогенідів (2-бензоїлфеніл)- та (2-формілфеніл)-N,N,Nтриалкілметанамонію загальної формули (VII) в основному середовищі, як зображено на схемі 12. 35 5 UA 105415 C2 Схема 12 R 3 R HN R (III) R R R 4 2 O 1 N 3 R 2 (V) R R R (V) R R OH 2 R (I) 4 X _ , 3 1 2 X 4 R R 5 R N 5 Et3N O N 1 + R 3 5 X Br R R 4 R (IV) O (II) X 1 _ + 5 N 3 R (VI) R R 4 5 (VII) R1=H, Ar; R2 = H; NO2; R3,R4 = Alk; R5 = CO2Alk, Alk = алкіл(С1-С6); 5 10 Ar = R ; R6 = H, Alk, OAlk, Hal; Hal = F, Cl, Br, I . 6 Структура синтезованих сполук доведена методами ЯМР-спектроскопії, ІЧ-спектроскопії, елементного аналізу та результатом рентгено-структурного аналізу (РСА). Винахід підтверджується нижченаведеними прикладами, але не обмежується ними. Синтез бромідів {2-[(діалкіламіно)метил]феніл}(арил)метанонів та 2[(диметиламіно)метил]бензальдегідів загальної формули (IV). До розчину 0,56 г (12,5 ммоль) диметиламіну в 10 мл бензену додають 5,0 ммоль о(бромометил)бензофенону або о-(бромометил)бензальдегіду загальної формули (II). Через годину відфільтровують осад гідроброміду диметиламіну і маточний розчин упарюють в вакуумі, залишок промивають водою. Приклад 1 2-[(Диметиламіно)метил]бензальдегід CHO H3C N CH3 15 20 . Безбарвна рідина, вихід 88 %. 1 3 4 Н ЯМР (DMSO δ-6, 400 МГц), δ, м. ч.: 10,36 (1Н, с, СНО), 7.78 (1Н, д. д, J=7,6, J=1,2, Н-6), 3 4 3 7,57 (1Н, т. д, J=7,6, J=1,2, Н-4), 7,45 (1Н, т, J=7,6, Н-5), 7,39 (1Н, д, V=7,6, Н-3), 3,72 (2Н, с, СН2), 2,17 (6Н, с, N(CH3)2). Аналіт. (%). Обчислено для C10H13NO: С - 73.59; Н - 8.03; N-8.58. Знайдено: С - 73,43; Н 8,09; N-8,50. Приклад 2 (4-Хлорофеніл){2-[(диметиламіно)метил]феніл}метанон 6 UA 105415 C2 Cl O H3 C N CH3 5 10 . Безбарвна рідина, вихід 76 %. 1 3 3 Н ЯМР (DMSO δ-6, 400 МГц), δ, м. ч.: 7,61 (2Н, д, J=8,8, Н-2', Н-6'), 7,52 (2Н, д, J=8,8, Н-3', 3 4 3 Н-5'), 7,45 (1H, т. д, J=7,2, J=2,4, Н-4), 7,37 (2Н, м, Н-6, Н-5), 7,25 (1Н, д, J=7,2, Н-3), 3,26 (2Н, с, СН2), 1,82 (6Н, с, N(СН3)2). -1 ІЧ спектр, (KBr), v, см :3065, 2940, 2821, 1664 (С=О), 1587, 1398, 1272, 1091, 1013, 928, 850, 747. Аналіт. (%). Обчислено для C16H16ClNO: С - 70,20, Н - 5,89, N-5,12. Знайдено: С - 70,03, Н 5,88, N-5,09. Приклад 3 {2-[(Диметиламіно)метил]-5-нітрофеніл}(феніл)метанон O H3C N CH3 15 20 NO2 . Білі мікрокристали, вихід 64 %. Т.топл. - 92-93 °С (із i-РrOН). 1 3 4 4 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 8,31 (1Н, д. д, J=8,4, J=2,4, Н-4), 8,07 (1Н, д, J=2,4, 3 Н-6), 7,65 (4Н, м, Н-3, Н-2', Н-4', Н-6'), 7,52 (2Н, т, J=7,6, Н-3', Н-5'), 3,44 (2Н, с, СН2), 1,79 (6Н, с, N(CH3)2). -1 ІЧ спектр, (KBr), v, см : 3064, 2946, 2827, 1659 (C=О), 1522 (NO 2), 1450, 1346 (NO2), 1266, 1029, 861, 737. Аналіт. (%). Обчислено для C 16H16N2O3: С - 67,59, Н - 5,67, N-9,85. Знайдено: С - 67,47, Н 5,65, N-9,88. Приклад 4 (4-Хлорофеніл)-{2-[(діетиламіно)метил]феніл}метанон Cl O Et N Et 25 30 35 . Безбарвна рідина, вихід 81 %. 1 3 3 H ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 7,64 (2Н, д, J=8,4, Н-2', Н-6'), 7,51 (2Н, д, J=8,4, Н-3", 3 3 Н-5'), 7,39 (3Н, м, Н-4-Н-6), 7,22 (1Н, д, J=7,2, Н-3), 3,48 (2Н, с, Аr-СH2, 2,15 (4Н, кв, J=7,2, 3 N(CH2-CH3)2,), 0,65 (6Н, т, J=7,2, N(CH2-CH3)2). -1 ІЧ спектр, (KBr), v, см : 3065, 2972, 2806, 1667 (С=О), 1586, 1398, 1287, 1091, 928, 773, 747. Аналіт. (%). Обчислено для C18H20ClNO: С - 71,63, Н - 6,68, N-4,64. Знайдено: С - 72,49, Н 6,70, N-4,65. Синтези галогенідів (2-бензоїлфеніл)- та (2-формілфеніл)-N,N,N-триалкілметанамонію загальної формули (VII). Методика А. Розчиняють 0,5 г (1,6 ммоль) [2-(бромометил)феніл](4-хлорофеніл)метанону в 10 мл сухого ацетонітрилу, додають 1,8 ммоль етилового естеру N,N-диметилсаркозину і кип'ятять зі зворотнім холодильником 2 години. Після цього ацетонітрил відганяють в вакуумі, залишок обробляють ацетоном, осад фільтрують і перекристалізовують. 7 UA 105415 C2 5 Методика Б. До розчину 0,5 г (3,1 ммоль) диметилбензиламіну загальної формули (IV) в 10 мл безводного бензену додають 0.57 г (3.4 ммоль) етилбромоацетату. Реакційну суміш залишають на добу при кімнатній температурі, осад відфільтровують і промивають діетиловим етером. Приклад 5 Бромід 2-етокси-N-(2-формілбензил)-N,N-диметил-2-оксоетанамонію O CO2Et N + CH3 H3C Br 10 15 . Безбарвна рідина, вихід 79 % (за методикою Б). 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 10,34 (1Н, с, СНО), 8,10 (1Н, м, Н-3), 7,82 (3Н, м, Н-43 Н-6), 5,35 (2Н, с, Аr-СH2, 4,63 (2Н, с, СН2-CO2Et), 4,25 (2Н, кв, J=7,2, СН2-СН3), 3,27 (6Н, с, + 3 N (CH3)2), 1,30 (3H, t, J=7,2, СН2-СН3). -1 ІЧ спектр, (KBr), v, см : 2982, 2248, 2124, 1747 (С=О), 1695 (C=О), 1210, 1029, 822, 760. Аналіт. (%). Обчислено для C14H20BrNO3: С - 50,92, H-6,10, N-4,24. Знайдено: С - 50,78, Н 6,13, N-4,23. Приклад 6 Бромід N-[2-(4-хлоробензоїл)бензил]-2-етокси-N,N-диметил-2-оксоетанамонію Cl O CO2Et N H3C + CH3 Br 20 25 . Білі мікрокристали, вихід: 50 % (за методикою А), 85 % (за методикою Б). Т.топл. - 112113 °C (із суміші i-РrOН-гексан). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 7,92 (3Н, м, Н-3, Н-2", Н-6'), 7,75 (1H, т.д, J=7,6, 4 3 4 3 3 J=1,2, Н-5), 7,68 (1Н, т.д, J=7,6, J=1,2, H-4), 7,61 (2Н, д, J=8,4, Н-3', Н-5'), 7,50 (1Н, д.д, J=7,6, 4 3 J=1,2, Н-6), 5,09 (2Н, с, Аr-СН2), 4,56 (2Н, с, CH2-CO2Et), 4,14 (2Н, кв, J=7,2, СН2-СН3), 3,22 (3Н, + + 3 с, N САН3), 3,20 (3Н, с, H СBН3), 1,23 (3Н, т, J=7,2, СН2-СН3). -1 ІЧ спектр, (KBr), v, см : 2997, 2920, 1749 (С=О), 1656 (С=О), 1584, 1476, 1411, 1266, 1230, 1088, 928, 848, 752. Аналіт. (%). Обчислено для C20H23BrNO3: С -54.50, Н - 5,26, N-3,18. Знайдено: С - 54,61, Н 5,27, N-3,17. Приклад 7 Бромід N-(2-бензоїл-4-нітробензил)-2-етокси-N,N-диметил-2-оксоетанамонію O CO2Et N H3 C 30 35 + CH3 Br NO2 . Білі мікрокристали, вихід: 40 % (за методикою А), 72 % (за методикою Б). Т.топл. - 147148 °C (із суміші i-РrOН-гексан). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 8,54 (1Н, д.д, J=8,4, V=2,4, Н-5), 8,24 (2H, м, Н-3, Н-6), 3 3 3 7,95 (2Н, д, J=7,6, Н-2', Н-6'), 7,77 (1H, т, J=7,6, H-4'), 7,60 (2H, т, J=7,6, Н-3', Н-5'), 5,19 (2Н, с, 3 + Аr-СН2), 4,57 (2Н, с, CH2-CO2Et), 4,13 (2Н, кв, J=7,2, СН2-СН3), 3,25 (6Н, с, N (CH3)2), 1,22 (3Н, т, 3 J=7,2, СН2-СH3). 8 UA 105415 C2 -1 5 ІЧ спектр, (KBr), v, см : 2987, 2920, 1742 (C=О), 1682 (С=О), 1525 (NO 2), 1349 (NO2), 1264, 1233, 1207, 1034, 861. Аналіт. (%). Обчислено для C20H23BrN2O5: С - 53,23, Н - 5,14, N-6,21. Знайдено: С - 53,16, Н 5.16, N-6,20. Приклад 8 Бромід N-[2-(4-хлоробензоїл)бензил]-N,N-диметил-2-оксо-2-фенілетанамонію Cl O CO2Et N H3C + CH3 Br 10 15 20 . Одержаний за методикою Б при нагріванні протягом 3-х год. Білі мікрокристали, вихід 38 %. Т.топл. - 183-184 °C (із суміші і-РrОН-гексан). 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 87,96-7,65 (8Н м, Аr-Н), 7,51 (5H, м, Ar-H), 5,35 (2Н, с, + СН2-C=О), 5,15 (2Н, с, Аr-СH2), 3,30 (6Н, с, N (СН3)2). -1 ІЧ спектр, (KBr), v, см : 3008, 2915, 1690 (С=О), 1659 (С=О), 1584, 1266, 1091, 931, 902, 754. Аналіт. (%). Обчислено для С24H23ВrСlNО2: С - 60,97, Н - 4,90, N-2,96 Знайдено: С - 60,94, Н - 4,93, N-2,95. Синтези галогенідів 4-гідрокси-1,2,3,4-тетрагідроізохінолінію загальної формули (І). Методика А. До 8 мл ацетону нагрітого до кипіння при перемішуванні додають 1,5 ммоль солі загальної формули VII і 0,5 мл триетиламіну. Суміш кип'ятять 5-10 хв., продовжуючи перемішування. Після охолодження осад відфільтровують, промивають ацетоном і перекристалізовують. Методика Б. Суміш 1,9 ммоль аміну загальної формули VI і 0.58 г (7,6 ммоль) хлороацетонітрилу нагрівають 1 годину при 80-90 °C. Після охолодження реакційної маси осад відфільтровують, промивають ацетоном. Приклад 9 Бромід 3-(етоксикарбоніл)-4-гідрокси-2,2-диметил-1,2,3,4-тетрагідроізохінолінію Br 25 30 35 . Білі мікрокристали, вихід 58 % (за методикою А). Т.топл. - 202-203 °C (із суміші i-РrOНМеОН). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 7,62 (1Н, д, J=7,6, Н-5), 7,44 (2Н, м, Н-6, Н-7), 7,23 3 3 2 (1H, д, J=7,6, Н-8), 6,80 (1Н, д, J=6,4, ОН), 5,30 (2Н, м, Н-3, Н-4), 4,95 (1Н, д, J=16,0, НА-1), 4,90 2 3 (1Н, д, J=16,0, НB-1), 4,33 2H, м, О-СН2), 3,55 (3Н, с, САН3), 3,37 (3Н, с, СВН3), 1,36 (3Н, т, J=7,2, СН2-СН3). -1 ІЧ спектр, (KBr), v, см : 3220 (ОН), 2956, 1752 (С=О), 1460, 1434, 1248, 1215, 1075,933,771. Аналіт. (%). Обчислено для C14H20BrNO3: С - 50,92, Н - 6,10, Вr-24,20, N-4,24. Знайдено: С - 50,81, Н - 6,12, Вr-24,14, N-4,23. Приклад 10 Бромід 4-(4-хлорофеніл)-3-(етоксикарбоніл)-4-гідрокси-2,2-диметил-1,2,3,4тетрагідроізохінолінію 9 UA 105415 C2 Cl Br OH CO2 Et + 5 10 N C H3 C H3 . Білі мікрокристали, вихід 88 % (за методикою А). Т.топл. - 215-216 °C (із суміші i-РrOНМеОН). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 7,33 (7Н, м, Аr-Н), 7,06 (1Н, с, ОН), 6,99 (1Н, д, J=7,6, 2 Н-5), 5,35 (2Н, м, Н-3, НА-1), 4,94 (1Н, д, J=15,2, НB-1), 4,05 (2Н, м, О-СН2), 3,53 (3Н, с, САН3), 3 3,50 (3Н, с, СВН3),0,92 (3Н, т, J=7,2, СН2-СН3). -1 ІЧ спектр, (KBr), v, см : 3256 (ОН), 3003, 2930, 1737 (С=О), 1328, 1254, 1230, 1070, 1039, 969, 765. Аналіт. (%). Обчислено для C20H23BrClNO3: С - 54,50, Н - 5,26, Вr-18,13, N-3,18. Знайдено: С - 54,57, Н - 5.24, Вr-18.11, N-3.16. Приклад 11 Бромід 3-(етоксикарбоніл)-4-гідрокси-2,2-диметил-6-нітро-4-феніл-1,2,3,4-тетрагідроізохінолінію Br 15 20 25 . Білі мікрокристали, вихід 86 % (за методикою А). Т.топл. - 204-205 °C (із суміші i-PrOHMeOH). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 8,22 (1Н, д, J=8,0, Н-7), 7,84 (1Н, с, Н-5), 7,68 (1Н, д, 3 2 J=8,0, Н-8), 7,48 (2Н, м, Аr-Н), 7,37 (3Н, м, Аr-Н), 7,24 (1Н, с, ОН), 5,64 (1H, д, J=15,6, НА-1), 2 + 5,52 (1Н, с, Н-3), 5,42 (1Н, д, J=15,6, НB-1), 4,02 (2Н, м, О-СH2), 3,61 (6Н, с, N (CH3)2), 0,89 (3Н, т, 3 J=7,2, СН2-СН3). -1 ІЧ спектр, (KBr), v, см : 3163 (ОН), 3023, 2982, 2925, 1747 (C=О); 1525 (NO 2), 1352 (NO2), 1246, 1217, 1039, 765, 706. Аналіт. (%). Обчислено для C20H23BrN2O5: С - 53.23, H-5.14, Вr-17.70, N-6.21. Знайдено: С 53,38, Н - 5,15, Вr-17,66, N-6,23. Приклад 12 Хлорид 4-(4-хлорофеніл)-3-циано-4-гідрокси-2,2-диметил-1,2,3,4-тетрагідроізохінолінію Cl Br OH CN + N CH3 CH3 . Білі мікрокристали, вихід 77 % (за методикою Б). Т.топл. - 231-232 °C (із суміші i-РrOНМеОН). 10 UA 105415 C2 1 5 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 7,55-7,37 (7Н, м, ОН, Аr-Н), 7,33 (1Н, д, J=7,6, Н-8), 3 2 2 7,01 (1Н, д, J=7,6, Н-5), 6,94 (1Н, с, Н-3), 5,46 (1Н, д, J=15,2, НA-1), 5,09 (1Н, д, J=15,2, НB-1), 3,65 (3Н, с, CАH3), 3,39 (3Н, с, СВН3). -1 ІЧ спектр, (KBr), v, см :3106 (ОН), 2941, 2879, 2258 (CN), 1494, 1367, 1075, 962, 763. Аналіт. (%). Обчислено для C18H18Cl2N2O: С - 61,90, Н - 5,19, Сl-20,30, N-8,02. Знайдено: С - 61,97, Н - 5,16, Сl-20,25, N-8,01. Приклад 13 Хлорид 3-ціано-4-гідрокси-2,2-диметил-6-нітро-4-феніл-1,2,3,4-тетрагідро-ізохінолінію Br OH O2 N CN + N CH3 CH3 10 15 20 . Білі мікрокристали, вихід 48 % (за методикою Б). Т.топл. - 215-217 °C (із суміші i-РrOНМеОН). 1 3 4 4 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 8,31 (1Н, д.д, J=8,4, J=2,0, Н-7), 7,88 (1Н, д, J=2,0, Н3 5), 7,85 (1Н, с, ОН), 7,69 (1H, д, J=8,4, H-8), 7,56 (2Н, м, Аr-Н), 7,47 (3Н, м, Аr-Н), 6,49 (1Н, с, Н2 2 3), 5,69 (1H, д, J=15,6, HA-1), 5,35 1Н, д, J=15,6, НB-1), 3,71 (3Н, с, САН3), 3,44 (3Н, с, СВН3). -1 ІЧ спектр, (KBr), v, см : 3101(ОН), 2961, 2884, 2253 (CN), 1532 (NO 2), 1463, 1349 (NO2), 1068, 967, 902, 737, 708. Аналіт. (%). Обчислено для С18Н18СlN3O3: С - 60,09, Н - 5,04, Сl-9,85, N-11,68. Знайдено: С - 60,22, Н - 5,02, Сl-9,88, N-11,63. Приклад 14 Бромід 4-(4-хлорофеніл)-3-(етоксикарбоніл)-4-гідрокси-2,2-діетил-1,2,3,4-тетрагідроізохінолінію Cl Br OH CO2Et + N Et Et 25 30 35 . До розчину 0,48 г (1,6 ммоль) (4-хлорофеніл){2-[(діетиламіно)метил]феніл}метанону в 1 мл сухого ацетонітрилу додають 0,53 г (3,2 ммоль) етилбромоацетату. Реакційну суміш залишають на 40 днів при кімнатній температурі. Осад відфільтровують, промивають ацетоном. Білі мікрокристали, вихід 55 %. Т.топл. - 207-208 °C (із суміші i-PrOH-MeOH). 1 3 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 7,45 (7Н, м, Аr-Н), 7,12 (1Н, с, ОН), 7,03 (1Н, д, J=7,6, 2 2 Н-5), 5,30 (1Н, д, J=15,6, НА-1), 4,87 (1Н, д, J=15,6, НB-1), 4,79 (1Н, с, Н-3), 4,33 (1Н, м, + + + N СAНAНB-СН3), 4,06 (3Н, м, ОСН2СН3, N СBHAНB-СН3), 3,86 (1Н, м, N СAНAНB-СН3), 3,73 (1H, м, + 3 + 3 + N СBНAHB-СН3), 1,38 (3Н, т, J=7,2, N СН2СAН3), 1,28 (3Н, т, J=7,2, N CH2CBH3), 0,94 (3Н, т, 3 J=7,2, ОСН2СН3). -1 ІЧ спектр, (KBr), v, см : 3214 (ОН), 2977, 1749 (С=О), 1463, 1315, 1210, 1093, 1068, 1013, 773. Аналіт. (%). Обчислено для C22H27BrClNO3: С - 56,36, Н - 5,80, N-2,99. Знайдено: С - 56,49, Н - 5,81, N-3,01. Приклад 15 Бромід 3-бензоїл-4-гідрокси-2,2-диметил-1,2,3,4- тетрагідроізохінолінію. 11 UA 105415 C2 Br OH COPh + N CH3 CH3 5 10 15 20 25 30 35 40 45 50 . До розчину 0,32 г (2,0 ммоль) 2-[(диметиламіно)метил]бензальдегіду в 5 мл ацетону додають 0,4 г (2.0 ммоль) фенацилброміду. Реакційну суміш залишають на добу при кімнатній температурі, осад, що утворився, відфільтровують, промивають ацетоном і перекристалізовують. Білі мікрокристали, вихід 68 %. Т.топл. - 184-185 °C (із суміші i-РrОН-МеОН). 1 3 2 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч: 8,30 (2Н, д, J=7,6, Н-2', Н-6'), 7,79 (1Н, т, J=7,6, Н-4'), 3 3 7,63 (3Н, м, Аr-Н), 7,44 (2Н, м, Аr-Н), 7,27 (1H, д, J=7,2, Аr-Н), 6,66 (1Н, д, J=7,2, ОН), 5,81 (1Н, 3 2 2 д, J=8,8, Н-3), 5,33 (1Н, д, J=15,2, НA-1), 5,16 (1H, м, Н-4), 4,92 (1Н, д, J=15,2, НB-1), 3,36 (3Н, с, САН3), 3,34 (3Н, с, СBН3). -1 ІЧ спектр, (KBr), v, см : 3176 (ОН), 3008, 2930, 1681 (С=О), 1592, 1446, 1225, 1043, 973, 769, 744. Аналіт. (%). Обчислено для C18H20BrNO2: С - 59,68, H-5,56, Вr-22,06, N-3,87. Знайдено: С - 59,85, Н - 5,59, Вr-22,02, N-3,88. Кристалографічні дані: Кристали моноклінні, C18H20NO2Br, при 293 K, а=9,6826(2) Å, 3 b=15,1146 (3) Å, с=12,0563 (3) Å, α=90°, β=110,687 (3)°, γ=90°, V=1650,67 (6) Å , Z=4, просторова 3 -1 група P2(1)/n, doбp=1,458 мг/м , μ(МоКα)=2,497 мм , F(000)=744. Параметри елементарної комірки і інтенсивності 25027 відбиттів (4037 незалежних, R int=0,0268) виміряні на дифрактометрі "Xcalibur 3" (МоКα випромінювання, CCD-детектор, графітовий монохроматор, ωсканування, 2θмакс=60°). Структура розшифрована прямим методом по комплексу програм SHELXTL. Положення атомів Гідрогену виявлені із різницевого синтезу електронної густини і уточнені по моделі "наїздника" з Uізо=nUекв негідрогенового атома, зв'язаного з даним 2 Гідрогеном. Структура уточнена по F повноматричним МНК в анізотропному приближенні для не водневих атомів до wR2=0,0689 (R1=0.0316 по 4037 відбиттям з І>2σ(І), GoF=1,024). Таким чином, результатом винаходу є спосіб синтезу солей 4-гідрокси-1,2,3,4тетрагідроізохінолінію загальної формули (І), які поєднують в своїй структурі декілька фармакофорних груп (4-ОН, 4-Аr, 3-CO2Et, 3-COPh, 3-CN). Список посилань: 1. Bobbitt, J.M. // Advances in Heterocyclic Chemistry; Katritzky, A.R., Boulton, A.J., Ed.; Academic Press: New York-1973. - Vol. 15. - P. 99. 2. F. Jourdan, M. Kimberley, M. Leese, B. V. L. Potter, A. Purohit, M.J. Reed // Compound // WO Patent 2008/117061, 2008. 3. S. Hanessian, M. Mauduit, E. Demont, C. Talbot // Synthesis of desymmetrized enantiopure dihydro-methano-diarylazocines: topologically interesting eyeteaser molecules // Tetrahedron-2002. Vol. 58. - P. 1485-1490. 4. D. Seréphin, M. A. Linch, O. Duval // A Simple and Efficient Synthetic Route to Benzo[c]phenanthridines. // Tetrahedron Lett.-1995. - Vol. 36. - P. 5731.-5134. 5. E. Vardelle, A. Martin-Mingot, M.-P. Jouannetaud, C. Bachmann, J. Marrot, and S. Thibaudeau // Substitution Effect on the Cylization/Fluorination Reaction of N-Dienes in Superacid // J. Org. Chem.-2009. - Vol. 74. - P. 6025-6034. 6. U. Holzgrabe und E. Inkmann // Cer(1V)oxidationen von P-Aminoketonen, 8. Mitt.: Synthese von im Piperidinteil verschieden substituierten 1,2,3,4-Tetrahydroisochinolinen // Arch. Pharm. (Weinheim).-1993. - B. 326. - S. 209-215. 7. M. Kihara, M. Ikeuchi, K. Jinno, M. Kashimoto, Y. Kobayashi, and Y. Nagao // Diastereoselective synthesis and optical resolution of 3,4-substituted tetrahydroisoquinolin-4-ols. // Tetrahedron.-1993. - Vol. 49, No. 5. - P. 1017-1024. 8. Т.В. Алпатова, А.Д. Климова, В.И. Кулинский, В.С. Мирзоян, А.Т. Мирзоян, B.Г. Яшунский // Синтез и радиозащитные свойства некоторых 6-окси-1,2,3,4-тетрагидроизохинолинов. // Хим.Фарм. Журн.-1984. - Т. 18, № 4. - С. 444-449. 9. P.W. Clark, Н. J. Dyke, S.F. Dyke, G. Perry // Palladium assisted organic reactions. V. The reactions of DI-m-chloro-bis(N,N-dialkylamine-2-C, N)Dipalladium (II) complexes with acyl chlorides. // J. Organomet. Chem.-1983. - Vol. 253. - P. 399-413. 12 UA 105415 C2 5 10 10. M. Cushman, P. Mohan // Synthesis and Antitumor Activity of Structural Analogues of the Anticancer Benzophenanthridine Alcaloid Fagaronine Chloride. // J. Med. Chem.-1985. - Vol. 28. - P. 1031-1036. 11. G. Grethe, N. Caldwell, H.L. Lee, W. Paterson, and M.R. Uskokovic. 7-Halo-4-isoquinolones // US Patent 3629265, 1971. 12. T.J. Schwan and M.M. Goldenberg. 4-Acetoxy-1,2,3,4-tetrahydro-2,2-dimethyl-6,7methylenedioxyisoquinolinium iodide // US Patent 4125529, 1978. 13. P. B. Fernandes, R.B. Mailman, D.E. Nichols, R.N. Postlethwait // Co-administration of Dopamine-Receptor Binding Compounds // US Patent 2007/0155720, 2007. 14. G. Grethe, M.R. Uskokovic // 4-Phenyl Isoquinolines and Process for Preparing Same. // US Patent 3666763, 1972. 15. N. Kumar, M. Salman, K. Kaur, A. Chung, S. Sinha // Muscarinic Receptor Antagonists. // US Patent 2008/0255188, 2008. ФОРМУЛА ВИНАХОДУ 15 1. Похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І), які є четвертинними солями і можуть мати замісники при С(4) та С(3): R R 2 1 OH R +N R R 20 5 3 4 X , (I) де R1=H, Ar; R2 = H; NO2; R3,R4 = Alk; R5 = CO2Alk, CN, COAr; X=Cl, Br Alk = алкіл(С1-С6); Ar = R 25 6 ; ; R6 = H, Alk, OAlk, Hal; Hal = F, Cl, Br, I . 2. Спосіб отримання похідних 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І), який полягає у тому, що добудову тетрагідропіридинового циклу до бензенового здійснюють шляхом внутрішньомолекулярної конденсації в солях (2-R-карбонілфеніл)-N,N,Nтриалкілметанамонію: 13 UA 105415 C2 Схема 12 R 3 R HN R (III) R R R 4 2 O 1 N 3 R 2 (V) R R R (V) R R OH 2 R (I) _ 4 X 3 1 2 X 4 R R 5 R N 5 Et3N O N 1 + R 3 5 X Br R R 4 R (IV) O (II) X 1 _ + 5 3 R (VI) N R 4 R 5 (VII) , де R1=H, Ar; R2 = H; NO2; R3,R4 = Alk; R5 = CO2Alk, CN, COAr; X=Cl, Br Alk = алкіл(С1-С6); 5 10 15 Ar = R 6 , ; R6 = H, Alk, OAlk, Hal; Hal = F, Cl, Br, I . 3. Спосіб за п. 2, який відрізняється тим, що при взаємодії (2-R-карбонілфеніл)метилбромідів загальної формули (II) з вторинними амінами загальної формули (III) одержують о(діалкіламінометил)похідні загальної формули (IV), які алкілують галогенметилпохідними загальної формули (V) і одержують похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І). 4. Спосіб за п. 2, який відрізняється тим, що вторинні аміни загальної формули (III) алкілують (2-R-карбонілфеніл)метилбромідами загальної формули (II) та галогенметилпохідними загальної формули (V) і одержують галогеніди (2-R-карбонілфеніл)-N,N,N-триалкілметанамонію загальної формули (VII), які перетворюють в похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І) шляхом нагрівання в основному середовищі. 5. Спосіб за п. 2, який відрізняється тим, що похідні N,N-діалкілсаркозину загальної формули (VI) алкілують (2-R-карбонілфеніл)метилбромідами загальної формули (II) і одержують галогеніди (2-R-карбонілфеніл)-N,N,N-триалкілметанамонію загальної формули (VII), які перетворюють в похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну загальної формули (І) шляхом нагрівання в основному середовищі. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 217/26, C07D 217/22
Мітки: отримання, похідні, 4-гідрокси-1,2,3,4-тетрагідроізохіноліну, спосіб
Код посилання
<a href="https://ua.patents.su/16-105415-pokhidni-4-gidroksi-1234-tetragidroizokhinolinu-ta-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-гідрокси-1,2,3,4-тетрагідроізохіноліну та спосіб їх отримання</a>