Спосіб одержання азолів або їх кислотно-адітівних солей, або їх стереоізомерів
Формула / Реферат
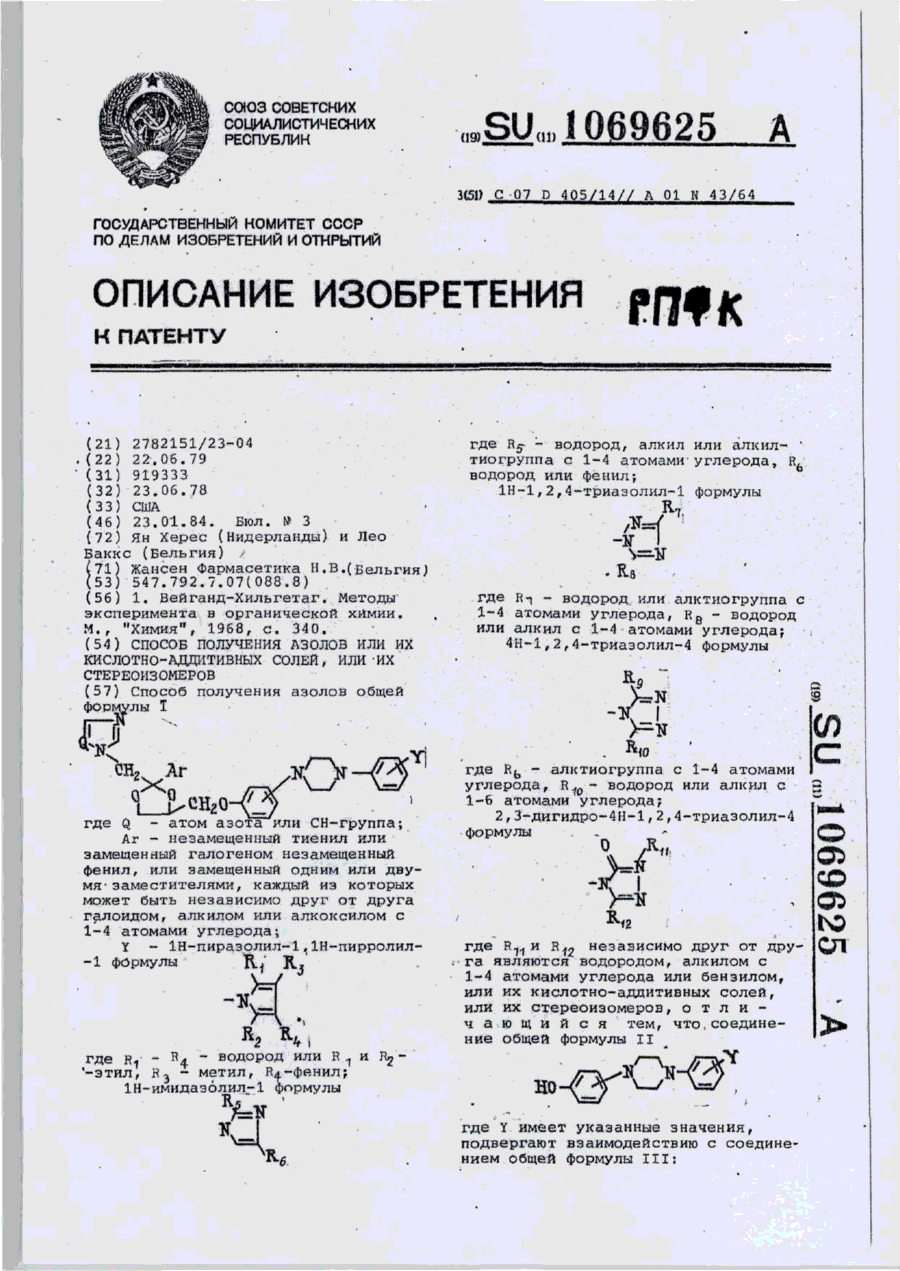
Способ получения азолов общей формулы І
где Q — атом азота или СН — группа; Аr — незамещенный тиенил или замещенный галогеном незамещенный фенил, или замещенный одним или двумя заместителями, каждый из которых может быть независимо друг от друга галоидом, алкилом или алкоксилом с 1—4 атомами углерода; Y—1Н-пиразолил-1, 1Н-пирролил-1 формулы
где R1— R4 — водород или R1 и R2— этил, R3 — метил, R4 — фенил; 1Н-имидазолил-1 формулы
где R5 — водород, алкил или алкилтиогруппа с 1—4 атомами углерода, R6 — водород или фенил; 1 -Н-1,2,4-триазолил-1 формулы
где R7 — водород или алктиогруппа с 1 —4 атомами углерода, R8 — водород или алкил с 1—4 атомами углерода; 4Н-1,2,4,-триазолил-4 формулы
где R6 — алктиогруппа с 1—4 атомами углерода, R10 — водород или алкил с 1 —6 атомами углерода: 2,3-дигидро-4Н-1,2,4-триазолил-4 формулы
где R11 и R12 независимо друг от друга являются водородом, алкилом с 1—4 атомами углерода или бензилом, или их кислотно-аддитивных солей, или их стереоизомеров, отличающийся тем, что соединение общей формулы 2
где Y имеет указанные значения, подвергают взаимодействию с соединением общей формулы 3:
где Аr и Q имеют указанные значения; W — галоид, алкилсульфонилоксигруппа с 1—4 атомами углерода или арилсульфонилоксигруппа с 6—10 атомами углерода, при 80—180 0С в инертном органическом растворителе, предпочтительно в присутствии основания, с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли, или стереоизомера.
Текст
Способ получения азолов общей формулы 1 З ч --, . • где Q - атом азота или СН-группа; Аг - незамещенный тиенил или замещенный галогеном незамещенный фенил, или замещенный одним или двумя- заместителями, каждый из которых может быть независимо друг от друга галоидом, алкилом или алкоксилом с 1-4 атомами углерода; Y - ІН-пиразолил-1,1Н-пирролил-1 формулы К.^' где Rg- - водород, алкил или алкил- ' тиогруппа с 1-4 атомами углерода, R, водород или фенил; 1Н-1,2г4-триаэолил-1 формулы -К где R-] - водород или алктиогруппа с 1-4 атомами углерода, R 8 - водород или алкил с 1-4 атомами углерода; , 4И-1,2,4-триазолил-4 формулы о \ где R b - алктиогруппа с 1-4 атомами углерода, й, - водород или алкил с :-\ 1-6 атомами углерода; 2,3-ДИГИДРО-4Н-1,2,4-триазолил-4 формулы Я Не " R. и R^2 независимо друг от другде 2 га являются водородом, алкилом с 1-4 атомами углерода или бензилом, или их кислотно-аддитивных солей, или их стереоиэомеров, о т л и ч а ю щ и й с я тем, что,соединение общей формулы II где R 1 - Н. - водород или R1 и '-этил, R 3 - метил, R&-фенил; 1Н - ими да з 6л ил_-1 формулы где Y имеет указанные значения, подвергают взаимодействию с соединением общей формулы III: со 1069625 Г или арилсульфонилоксигруппа с 6-10 атомами углерода, при 8 0 - 1 J 0 ° C В инертном органическом растворителе, предпочтительно в присутствии основания, с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли, или стереоиэомера. где Аг И Q имеют указанные значения; И - галоид, алкилсульфонилоксигруппа с 1-4 атомами углерода Приоритет по признакам. 23.06.78 при Q-все значения\ А все значения; Y - все. значения. 1 где R^ - водород, алкил или алктиоИзобретение относится к способам группа с 1-4 атсмами углерода, В.* получения новых производных азолов, водород или фенил; обладающих противогрибковой и про1Н-1,2,4-триазолил-1 формулы тивобактериальной активностью, которые могут найти применение в меди-т 5. циие. Известна реакция О-алкилирования фенолов алкилгалогенидами, алкил-' и арилсульфон шіоксипроиз водными в инертном растворителе при повышенной . 0 1 где R-j - водород или алктиогруппа с температуре, предпочтительно в при1-4 атомами углерода, Rfi - водород сутствии акцептора - основания [1]. или алкил с 1-4 атомами углерода; Цель изобретения - получение но4Н-1,2,4-триазолил-4 формулы вых производных азолов, обладающих ценными противогрибковыми и противо15 бактериальяыми свойствами. Поставленная цель достигается основанным на известной реакции способом получения производных азолов общей формулы 20 где Е -ал^тиогруппа с 1-4 атомами К э углерода, R1O водород или алкил с 1-6 атомами у г л е р о д а ; 2,3-ДИГИДРО-4Н-1,2,4-триазолил-4 Єїї2 Аг формулы а» : С сил Л^ 2" 25 о атом азота или СН группа; где Q • Аг - незамещенный тиенил или замещенный галогеном незамещенный фенил, или замещенный одним или дву30 R 12 мя заместителями, каждый из которых может быть независимо друг от друга где R ^ H R 1 2 независимо друг от галоидом, алкилом или алкоксилом с друга являются водородом, алкилом 1-4 атомами углерода; с 1-4 атомами углерода или бензилом, Y - 1Н-пиразолил-1,1Н-пирролил-1 35 или их кислотно-аддитивных солей, или их стереоизомеров. Формулы Способ заключается в том, что соединение общей формулы 40 (II) где R| - R^ " водорода или R. и * этил, 8j - метил и R 4 - фенил? 1Н-имидазолил-1 формулы R. где Y имеет указанные значения, подвергают взаимодействию с соединением общей формулы 1069625 Г/ дик ислота, 1,4-бутандикислота, (2)-2-бутеидикислота, (Е)-2-бутен'дикислота, 2~окси-1,4-бутандикислота, '2,3-диокси~1,4-бутандикислота, 2-окси-1,2,3-пропантрикарбоновая, бензойная, З-фенил-2-пропеновая, с£-оксибензолуксусная, метансульфоновая, этансульфокислота, 2-оксиэтані сульфокислота, 4-метилбензолсульфогде Аг и Q имеют указанные значекислота, 2-оксибензойная, 4-аминония; - 10 -2-оксибензойная, 2-феноксибензойная W - галоид, алкилсульфонилок или 2-ацетилоксибенэойная кислоты. сигруппа с 1-4 атомами углерода или Соли, в свою очередь, могут быть арилсульфонилоксигруппа с 6-10 атопереведены в соответствующие свободмами углерода, ные основания обычным способом, напри 80-130°С в инертном растворитепример путем взаимодействия с щеле, предпочтительно в присутствии лочью, например гидроокисью натрия основания, с последующим выделеили калия. нием целевого продукта в виде осноСоединения формулы I и их кислотвания или кислотно-аддитивной соли, но-аддитивные соли могут использоили стереоизомера,,, , ваться для борьбы с грибками и бакВ качестве растворителя обычно 20 териями. Так, установлено, что укаиспользуют Й,N-диметилформамид, занные соединения и их кислотноNjN-диметилаиетамид, гексаметилфосаддитивные соли обладают высокой фортриамид, диметилсульфоксид, активностью по отношению к ряду 4-метил-2-пентанон и т.п., которые грибков, таких как Microsporum „ могут использоваться и в смеси с сапі з зCtenomyce s mentagropbytes, другими инертными растворителями, Trichophyton rubrura, Phialophora например ароматическими углеводороyerrucosa , Crypto coccus neoforraans, дами, такими как бензол, толуол, Candida ( tropicalis, Candida albicans диметилбензолы. В качестве основа-^ Mucor species, Aspergilleus Lumiya- , ния обычно используют гидрид или 30 tu^ Sporotricum schenckii и Saproleкарбонат щелочного металла. •gnia species ,a также по отношению к В ряде случаев является целебактериям, таким ка'к CrysipeloVrix сообразным вначале перевод замещенinsidosa, Staphylococei, например ного фенола формулы II в его соль Staphylococeus heraolyticus и Streptoпутем обработки гидридом или гидроокисью натрия и последующим взаимо- 35 cocci, например Streptococcus 'pyogenes . действием с алкилирующим агентом формулы III. Учитывая их значительную локальную Ряд исходных и промежуточных "и системную антибактериальную активсоединений, используемых по предность, соединения, получаемые по • лагаемому способу, являются изве40 предлагаемому способу,, могут с успестными, другие же могут быть полухом использоваться для подавления н чены аналогичными способами. предотвращения роста грибков и бактерий . В частности, они могут эффекСоединения формулы 1 содержат, тивно использоваться для обработки по крайней мере, два асимметричных атома углерода и могут существовать -с объектов, пораженных микроорганизмами . в различных стереоиэомерных формах. Получение промежуточных соединеДиастереоизомерные цис- и трансний . формы соединений) формулы I могут быть выделены обычными способами, П р и м е р 1. Смесь 13,4 вес.ч. такими как селективная кристаллиза- ->и дигидрохлорида р (4-метоксифенил)ф ) ция и хроматография, в частности -пиперазина, 7,9 вес.ч, 1~хлор-4колоночная хроматография. -нитробензола, 10 вес.ч. карбоната Цис- и транс-диастереоизомерные калия и 90 вес.ч. п,N-диметилформрацематы могут быть далее разделеамида перемешивают при кипячении ны на их оптические изомеры: 55 с обратным холодильником в течение цис(+), цис(-), транс(+) и транс(-) суток, после чего разбавляют ее воСоединения формулы I могут быть дой и экстрагируют продукт дважды переведены в их кислотно-аддитивхлороформом. Объединенные вытяжки ные соли путем обработки кислотой, высушивают, фильтруют и упаривают. такой как хлористоводородная, бро60 Остаток растирают в 4-метил-2-петамистоводородная или йодистоводородноне. Продукт отфильтровывают и ная, серная, азотная, фосфорная или перекристаллизовывают из 1, 4-диоктиоциановая, уксусная, пропановая, сана. В результате получают 10,5 вес.ч молочная, 2-оксипропановая, 2-оксо(67%) 1-{4-метоксифенил)-4-{4-питропропановая, этандикислота, пропан£5 Фенил)пиперазина, т.пл. 195,1°С. I T Аг 1069620 ;метанимидамида эквивалентное колиСмесь из 12 вес.ч. 1-(4-метоксичество гидрохлорида этанимидамида, фенил)-(4-нитрофенил)-пиперазииа тюлучают 4- [4- [4-( 4-метоксифенил )-1200 вес.ч. метанола и 225 вес.ч, -*пиперазинил]фенил]-5-метил-4Нтетрагидрофурана гидрируют при нор-1,2,4-триазол-З-тиол, т.пл. 260,3°С. мальном давлении и комнатной температуре в присутствии 2 вес.ч. П р_и м е р 4. Смесь 9 вес.ч. палладиевого катализатора на активи4-|4-[4-(4-метоксйфенил)-1-пиперарованном угле (10%). После поглощезинш^фенил]-4Й-1, 2, 4-триаэол-З-тиния расчетного количества водорода ола, 2 вес.ч. гидроокиси натрия и . • катализатор отфильтровывают и промы160 вес.ч. метанола перемешивают вают ї^її-диметилацетамидом. Фильтрат 10 при нагревании до полного растворевыливают в воду. Выпадающий в осадок ния твердых компонентов. Затем к смепродукт отфильтровывают и перекрисси добавляют 3,3 вес.ч* диметилсульталлизовйватт из 1-бутанола. В рефата и продолжают перемешивание в тезультате получают 8 вес.ч. (74%) чение 3 ч при комнатной температуре. 4-[4-(4-метоксифенил)-1-пиперазинил1 после чего выливают реакционную смесь ( " 5 в воду.Выпадающий в осадок продукт, 1 фениламина, т.пл* 191,8°С. отфильтровывают и перекристаллизовыП р и м е р 2. К перемешиваемой ватат из 1-бутанола. В результате поИ охлаждаемой льдом смеси 5 вес.ч. лучают 5,3 в е с ч . 1-(4-метоксифенил)I ,її-метаитетрабис-(циклогексилакина) f -4-[4- [Зя(іиетилтио)-4Н-1,2,4-триазол26,2 вес.ч, сероуглерода и 40 вес.ч. пиридина добавляют 6 вес.ч. 4~[4-(4- 20 -4^ил]фенил]пиперазина, т.пл. 180°С. -метоксифенил)-1-пипераэинил]фенилТаким же способом получают 1-(4амина и перемешивают еще в течение -метоксифенил)-4-{4-[з-метил-5-(метилтио)~4Н-1,2,4-триазол-4-ил]фенил]пи1 ч при охлаждении на ледяной бане, перазиндигидрохлорид, т.пл. 210 б С. а затем в течение 2 ч при комнатной 25 температуре. П р и м е р 5. Смесь 50 вес.ч. 2-(4-нитрофенил)гидрази.нкарботиоамида росле этого добавляют ЗЬ вес.ч. и 270 вес.ч. толуола подвергают азео2 - 2-юкси-бис-гтопапа и перемешивают тропной дистилляции до полного, удале"в течение 30 мин.Выпадающий в осадок ния из нее водь!1; Затем к ней добавпродукт отфильтровывают и перекристаллизовывают из 4~метил-2-пентанова .30 ляют 26 вес.ч. уксусного ангидрида и перемешивают все при кипячении с Затем продукт еще раз перекристалобратным холодильником в течение 3 ч. лизовывают из 1,4-диоксана. В резуль Реакционную смесь охлаждают, выпавтате получают 2,45 вес.ч. 1-(4-изо. ший1 в осадок продукт отфильтровытиоцианатофенил)-4-(4-метоксифенил)пииеразина, т.пл. 180,б°С. 35 вают, промывают изопропанолом и перекристаллиэовывают из этанола, высуСмесь 47,8 вес.ч. 1-(4-иэотиоциашивают при 100°С. В результате полунатофенил)-4-(4-метоксифенил)гашерачают 31,5 вес.ч. 2-(амннотиоксометил)зина, І00 вес.ч. гидрата гидразина -1-(4-нитрофенил)гидразида уксусной и 400 аес.ч. 1,4-диоксаиа перемерикислоты, т.пл. 2 41,5 °С. вают и кипятят в течение 1 ч с об40 ратным холодильником, после чего Проводя ацетилирование таким же ее охлаждают и выливают в воду. образом и используя эквивалентные ;Выпадающий в осадок продукт отфильтколичества соответствующих исходных ровывают ,промывают водой и метанолом соединений, получают моногидрат и высушивают. В результате получают 2-(амииотиоксометил)-!-{4-нитрофенил) 46 вес.ч. (89%) N- {4- [4-(4-метокси~ 45 гидразида масляной кислоты, т.пл. фенил)-1~липеразинил]фенил]гидразин197, 2°С и 2-(аминотиоксометил)-1- . карботиомида. -(4-нитрофенил)гидразид пропионовой кислоты, т.пл, 216,1 а С. П р и м е р 3. Смесь 23 вес.ч. П р и м е р 6. 40 вес.ч. 2-(амиN-[4[4-(4-метоксифеншт)-1-пиперази50 нотиоксометил)-1-(4-нитрофєнил)гид-і нил]фенил]гидразинкарботиоамида, разида уксусной кислоты растворяют 23 вес.ч. ацетата метанимидамида и в смеси 10 вес.ч. гидроокиси натрия 80 вес.ч. 1-бутанола перемешивают и и 400 вес.ч. воды и перемешивают по-. 'кипятят в течение часа с обратным лученный раствор в течение 30 мин холодильником. Затем реакционную 55 при комнатной температуре. Реакционсмесь охлаждают, выливают в воду и ную смесь подкисляют концентриродобавляют 2.2 -окси-бис-пропан. Выванной соляной кислотой. Выпадающий падающий в осадок продукт отфильтроз осадок продукт отфильтровывают, .вывают,промывают водой и метанолом промывают водоя и 2-пропанолом и : перекристаллизовывают из 1-бутар 60 перекристаллизовывают из 1,4-диоксанола. В результате получают j на. В результате получают 22,4 вес.ч 17,7 вес.ч. 4-[4- [4-(4-метоксифе5-мєтил-1-(4-нитрофенил)-1Н-І,2,4нил)-1-пиперазинил]фенил]~4Н-1,2,4-триазол-3-тиола, т.пл. 202,1"С. -•рриазол-3-тиола, т.кл. 231,9°С. Аналогично получают 1-(4-нитроПроводят процесс таким же образом, но используя вместо ацетата 65 фенил)-5-пропил-1Н-1,2,4-триазол 1069625 -3-тиол, т.пл. 190,7°С и 5-этил-1~ -(4-нитрофенил)-1Н-1,2,4-триазол-3-тиол, т.пл. 206,1°С. I П р и м е р 7 . К 80 вес.ч. метанола добавляют 4,7 вес.ч. 5-метил~1-(4-нитрофенил)-1Н-1,2,4-гриазол-3-тиола и 1,2 вес.ч. гидроокиси натрия и все вместе перемешивают до полного растворения твердых компонентов. Затем добавляют 2,66 вес.ч. диметилсульфата и продолжают перемешивание в течение еще часа при комнатной температуре. Затем добавляют к реакционной смеси 100 вес.ч. воды. Выпадающий в осадок продукт отфильтровывают, промывают водой, высушивают и перекристаллизовывают из 2,2' -окси-бис-пропана. В результате получают 3,3 вес.ч. (бб%7 5-метил-3-(метилтио)-1-(4-ыитрофенил)-1Н-1,2,4-триазода, т.пл. 121-125°С. Осуществляя S-метилирование таким же образом и используя эквивалентные количества соответствующих исходных соединений, получают 5-этил-3-{мегил тио)-1-( 4-нитрофенил)-1Н-1,2, 4-триазол, т. пл. 77,8°С и 3-(метилтио)-1-(4-нитрофе:шл)-1Н-1,2,4-триазол, т. пл. 140°С. П р и м е р 8, Смесь 2,5 вес.ч. 5-метил-3-(метилтио)-1-(4-нитрофенил)~1Н-1,2,4-триазола и 120 вес.ч. метанола гидрируют при нормальном давлении и комнатной температуре в присутствии 2 вес.ч. платинового катализатора на активированном угле (10%). После поглощения расчетного количества водорода катализатор отфильтровывают, а фильтрат упа' ривают. Остаток перекристаллизовывают из смеси 4-метил-2-пентанона 'и петролейного эфира. Продукт отфильтровывают и высушивают. В результате получают 1,5 вес.ч. (68%) 4-[5-метил-3-(метилтио)-1Н-1,2,4-триазол-1-ил]фениламина, т.пл. 130136°С. Проводят гидрирование таким же образом, получают также 4-[3-(метилтио)-1Н-1,2,4-триазол-1-ил ]фениламин. П р и м е р 9. Смесь 41 вес.ч. 5-метил-3-(метилтио)-1-(4-нктрофенил)-1Н-1,2,4-триазола и 80 вес.ч. метанола гидрируют при нормальном давлении и комнатной температуре в присутствии 1 вес.ч. палладиевого катализатора на активированном угле (10%). После поглощения расчетного количества водорода катализатор отфильтровывают, а фильтрат упаривают. Остаток перекристаллизовывают из 1,і' -окси-бис-бутана. Продукт отфильтровывают и высушив а ю т . В результате получают 33 вес.ч. (91%) 4-[5-этил-3-(метилтио)-1Н-1,2,4-триазол-1-ил]фенил. амина, т. пл. 131,7°С. 8 Таким же образом получают 4-(2-метил-ІН-имидазол-1-ил)фениламин, т. пл. 105°С. П р и м е р 10. Смесь 20 вес.ч. 4-[5-метил-3-(метилтио)-1Н-1,2,4-триазол-1-ил]фениламина, 15 вес.ч. никеля Ренея и 400 вес.ч. метанола перемешивают при кипячении с обратным холодильником в течение 2 ч. Никель Ренея отфильтровывают и добав10 ляют 15 вес.ч. свежего катализатора, после чего продолжают перемешивание в тех же условиях в течение еще 4 ч. Реакционную смесь затем фильтруют, промывают на фильтре метанолом и фильтрат упаривают. J5 Остаток перекристаллиэовывают из і смеси 4-метил-2~пентанона, 2,2 -окси-бис-пропана и петролейного эфира, В результате получают 7,6 вес.ч. (47%) 4-(5-метил-1Н-1,2,4-триазол-1-ил)фениламина, т. пл. 145°с, П р и м е р 11. Смесь 35 вес.ч. 1-(4-нитрофенил)-5-пропил-1И-1/2,4-триазол-3-тиола, 83 вес.ч. концентрированной азотной кислоты и 150 вес.ч -- воды перемешивают и нагревают до , 60°С. В ходе перемешивания смеси дают охладиться до комнатной температуры, после чего ее оставляют при перемешивании при комнатной темпера30 туре на ночь. Выпадающий в осадок продукт отфильтровывают, промывают водой и добавляют к горячему раствору 20 вес.ч. карбоната калия в 200 вес.ч. воды при 100°С. Реакцион35 ную смесь перемешивают, давая ей остыть до комнатной температуры. Выпадающий в осадок продукт отфильтровывают , высушивают и перекристаллизовывают из смеси 4-метил-2~пента~ нона и 2,2і -окси-бис-пропана. Про40 дукт отфильтровывают и перекристаллизовывают из 4-метил-2-пентанона. В результате получают 19,8 вес.ч; 3,3і -дитио-бис-[1-( 4-нитрофенил)-5--. -пропил-1Н-1,2,4-триазола], т.пл. 45 171,5°С. 20 вес.ч. З, 31 -дитио-бис-'|1-( 4-нитрофенил )-5-пропил-1Н-1,2,4-триазолаД растворяют в 100 вес,ч. уксусной кислоты при перемешивании и нагревании , после чего добавляют к раствору по каплям 55 вес.ч. 30%-ного раствора перекиси водорода. В ре- . зультате температура смеси повышается до кипения. После окончания добавления перекиси водорода перемешивание продолжают при кипячении с обратным холодильником в течение 1 ч. Реакционную смесь затем охлаждают и выливают в смесь измельчен60 ного льда и 50%-ного раствора гидроокиси натрия. Выпадающий в осадок продукт отфильтровывают и растворяют в хлористом метилене. Раствор промывают раствором сульфата натрия, высушивают, фильтруют и упаривают. Ос" • 65 1069625 10 таток подвергают хроматографической перекристаллизовывают из 4-метил-2очистке на колонке, заполненной си-пентанеша. В результате получают ликагелем, используя в качестве элюб,3 вес.ч. 2,4-дигидро-2,5-диметилента хлороформ. Чистые фракции объе-4-(4-нитрофенил)-ЗН-1,2,4-триазолдиняют и упаривают. Остаток перево-3-она, т.пл. 153,2°С. дят в хлористоводородную соль в > Смесь 9 вес.ч. 2,4-дигидро-2,5изопропаноле. Соль отфильтро-диметил-4-(4-нитрофенил)-ЗН-1,2,4вывают и перекристаллизовывают в -триазол-3-она и 200 вес.ч. метанола этаноле. В результате получают гидрируют при нормальном давлении и 3,9 вес.ч. (19%) 1-(3-нитрофенил)-5комнатной температуре в присутствии ч -пропил-1Н-1 , 2 ,'4-триазола моногидро- ^0 3 вес.ч. никеля Ренея. После поглохлорида, т.пл. 178,7°С. щения расчетного количества водорода катализатор отфильтровывают, а Смесь 38,3 вес.ч. 1-(4~нитрофенил) фильтрат упаривают. Остаток расти-5-пропил-1Н-1,2,4-триазола моногидро 1 рают в 2, 2' -окси-бис-пропане, Прохлорида и 400 вес.ч. метанола гидрируют при нормальном давлении и ком- 15 .дукт отфильтровывают и высушивают. натной температуре в присутствии В результате получают 7,5 вес.ч".Звес.ч. палладиевого катализатора (95%) 4-(4-аминофенил)-3,4-дигидрона активированном угле (10%). і~2,5-диметил-ЗН-1,2,4-триазол-З-она, ; После поглощения расчетного колит.пл. 160°С. ш чества водорода катализатор от20 фильтровывагот, а фильтрат упариваП р и м е р 13. Смесь 52 вес.ч. ют. Остаток растворяют в воде и нейтИ-{4-[4-(4~метоксифеиил)-1-пиперарализуют бикарбонатом натрия. Прозиниліфенилїгидразкнкарбоксамида, дукт экстрагируют хлористым метиле53 вес.ч, этанимидамидгидрохлорида ном. Экстракт промывают водой, высу-. 25 и 135 вес.ч. її,w-диметилфсрмамида шивают, фильтруют и упаривают.Остаперемешивают при 130°С в течение ток переводят в хлористоводородную 3 ч. Реакционную смесь затем охлажсоль в изопропаноле. Соль отфильтдают и выливают в воду.Выпадающий в ровывают и высушивают. В результаосадок продукт отфильтровывают, проте _ получают 3 5 вес „ч, (91%) 4-(5- Q мквают водой и метанолом и перекрис3 -пропил~1Н-1,2 г 4-триазол-1-ил)феиилталлизовывают из И,М-диметилформамиамина гидрохлорида, да, Продукт отфильтровывают и перекристаллизовывают из 1,4-диоксана, П р и м е р 12. Смесь 4 вес.ч. В результате получают 19,5 вес.ч. N-(4-нитрофенил}гидразинкарбоксами.2,*-дигидро-4- £4- [4-(4-метоксифенил)~ да г 5 вес.ч. этанимидамидгидрохлори- ^с -1-пиперазинил]фенил]-5-метил-ЗНда и 5 вес.ч. ацетата натрия пере-1,2,4-триа.зол-З-она, т.пл. 298,4 С. мешивают при 140°С в течение 4 ч. П р и м е р 14. 19,2 вес.ч. 2,4Реакционную смесь охлаждают, добав-дигидро-4- ?4-[4-(4-метоксифенил)-1ляют к ней воду и продолжают пере-пиперазинил]фёнил \-ЗН-1,2,4-триазолмешивание до выпадения кристаллов. Продукт отфильтровывают и перекрис- 40 -3-она растворяют в 450 вес.ч. диметилсульфоксида при температуре таллиэовывают из изопропанола. В ре^100°С. К полученному раствору добавзультате получают 1,5 вес.ч. (34% ) ляют затем 3,1 вес.ч.' 50%-ной суспен2,4-дигидро-5-метил-4{4-нитрофенил)зии гидрида натрия и продолжают пе-ЗН-1,2,4-триазол-З-она, т. пл. 226,1°С. 45 ремешивание до тех пор, пока температура смеси не достигнет 50°С, после чего к ней добавляют 8,2 вес.ч. К перемешиваемому раствору диметилсульфата и оставляют на ночь 13,5 вес.ч. 2,4-дигидро-5-метил-4при коми атной температуре и переме-(4-нитрофенил)-ЗН-1,2,4-триазолшивании. Реакционную смесь выливают -3-она в 100 вес.ч. диметилсульфок^ в воду и экстрагируют продукт хлоросида добавляют 2 вес.ч. 78%-ной формом. Экстракт высушивают и упарисуспензии гидрида натрия и продолвают . Остаток очищают хроматографией жают перемешивание до прекращения на колонке, заполненной силикагелем, вспенивания, после чего добавляют к с использованием в качестве элюента смеси по каплям 8,1 вес.ч. диметил55 смеси хлороформа и метанола (в объемсульфата. После окончания добавленом соотношении 98:2). Чистые фракции ния диметипсульфата перемешивание объединяют и отгоняют из них растворипродолжают еще в течение 3 ч при тель , Остаток перекристаллизовывают „комнатной температуре. Реакционную из н-бутанола. В результате получают смесь выливают в воду и продукт триж5,8 вес.ч, 2,4-дигидро-4- [4-[4-(4-меды экстрагируют хлороформом. Объеди- 60 токсифенил)~1-пиперазинил]фенил]-2•ненные вытяжки промывают водой, вы~метил-ЗН-1,2,4-триазол-З-она, т.пл. 245,7°С. суживают и упаривают. Остаток перекристаллизовывают из смеси иэопропиП р и м е р 15. 10 вес.ч. 2,4-дилового спирта и 2,21 -окси-бис-пропана. Продукт отфильтровывают и 65 гидро-4- [4-[4-(4~метоксифенил)-1-пи 11 1069625 перазинил]фенил.}-ЗН-1,2,4-триазол-З-она растворяют в 300 вес.ч. диметилсульфоксида при Ю 0 ° С , добавляют к полученному раствору 1,6 вес.ч. 50%-ной суспензии гидрида натрия и перемешивают смесь, давая ей охда5 диться до 50°С. Затем к ней добавляют 3,9 вес.ч. 1-бромпропана и остав, лягот при комнатной температуре и перемешивании на ночь. Реакционную смесь выливают затем в воду и экстю рагируют продукт хлороформом. Экстракт промывает водой, высушивают и упаривают. Остаток подвергают хроматографической очистке на колонке, заполненной силикагелем, с использо- «с ванием в качестве элгоента смеси хлороформа, с использованием в качестве элюента смеси хлороформа и метанола (при объемном соотношении 98:2). Чистые фракции объединяют и упаривают. Остаток растирают в изопропаноПродукт отфильтровывает и высуг ле, шивают. В результате получают 7,5 вес.ч. (65%) 2,4-дигидро-4-[4_[4-( 4-метоксифенил)-1-пиперазинил]- „ фенил]-2-пропил-ЗН-1,2,4-триаэол-3-он'а. 12 Проводя те же операции и используя эквивалентные количества соответствующих исходных соединений, получают 1-[4~(іН-имидазол-1-ил)фенил]-4-(4-метоксифенил)пипераэин, т.пл. 2 5 5 - 2 5 6 ° С Ї 1-(4-метоксифенил) -4-[4-{ 1Н-1,2,4-триазол-1-и-л)фенил]пиперазин. т. пл, 230,3°С; 1-(4-метоксифенил)-4-{4-[3-'метилтио)-1Н-1,2,4-триазол-1-ил]фенил пиперае зин; т. пл. 186,5 С; 1-(4-метоксифенил )-4-^4-£S-метил-З-(метилтио)-1Н-1,2,4-триазол-1-илЗфенил]пиперазин, т. пл. 153,3с; 1-(4-метоксифенил - 4 - 4-(5-метил-1Н-1f2,4-триазол-1-ил)фенил]пипераэин, т. пл. .191,1°С ; 2,4-ДИГИДРО-4-[4-[4-С 4-метоксифенил )-1-пиперазинил]фенил}-2,5-диметил-ЗН-1,2,4-триазол-З-ои, е т. пл. 19б,7 С; 1-(4-метоксифепил)--4-[4-( 5-прспил-ІІІ-і ,2 ,4-триазол~1-ил)фенил]пипераэин, т. пл. 196,3°С? 1-{4-[5-этил-3-{метилтио)-1Н-1,2,4-триазол-1-ил]фенил]-4-(4-метоксифенил)пипераэин, т. пл. 142,3°С и 1-(4-метоксифенил)-4-[4-(2-метил-1Н-пмидазол-1-нл)феиил]пиперазин, т. пл. -178,5°С. ' П р и м е р 17. Смесь б вес.ч. Проводя S-алкилирование таким же "4-[4-(4-метоксифенил)-1-пиперазин1образом и используя эквивалентные фениламина, 3,6 вес,ч. фенилоксикарколичества соответствующих исходных бонилхлорида, 75 вес.ч. пиридина и соединений, получают 2-этил-2,4-ди- ^0 98 вес.ч. хлористого метилена перегидро-4- (4- [4~(4-метоксифенил)-1мешивают при нагревании до полного -пиперазинил]-фенилt-5-метил-ЗН- , растворения твердых компонентов, -1,2,4-триазол-З-он, т. ил. 179,8 С, после чего перемешивание продолжают 2,4-дигидро-4-{4-[4-(4-метоксифенил)• в течение еще 30 мин. Реакционную -1-пиперазинил}фенил]-5-метил~235 смесь выливают затем в 500 вес.ч. -пропил-ЗН-1,2,4-триазол-З-он, т.пл. воды, добавляют 210 вес.ч. 2,2 -окси144,5°С и 2-этил~2,4-дигидро-4~ [4-бис-пропана и перемешивают в тече-[4-(4-метоксифенил)-1-шшеразинил]ние некоторого времени. Выпадаюфенил]-ЗЫ-1,2,4-триазол-З-ои, т.пл. щий в осадок продукт отфильтровывают Й 210,2 С. 40 и перекристаллизовывают из н-бутаноП р и м е р 16. Смесь 12 ? 5 вес.ч ла. В результате получают 5,2 вес.ч. К,Н-бис-(2-хлорэтан)-4-метоксифенил(61%) фенил [4- [4-(4-метоксифенил)амина,_ 8 вес.ч. 4-(1Н-пиразол-1-ил)-1-пиперазинил]фенил]карбамата, т.пл, фениламина, 2 вес.ч. йодистого калия, 80 вес.ч. ацетона и 100 вес.ч. 45 ] 204,5°С. Смесь 3,2 вес.ч. фенил [4- [4-( 4-меводы перемешивают при кипячении с токсифенил) -1-пипераэинил]фенил?каробратным холодильником в течение бамата, 50 вес.ч. гидрата гидразина 24 ч и затем охлаждают. Выпадающий . и 100 вес.ч. 1,4-диоксана перемешив осадок продукт отфильтровывают вают при кипячении с обратным холо(фильтрат собирают), промывают водойс « дильником в течение 3 ч. Реакционную и ацетоном. В результате получают смесь затем охлаждают и выливают в 6 вес.ч. продукта. воду. Выпадающий в осадок продукт отфильтровывают и перекристаллизовываФильтрат нейтрализуют раствором ют из К,К-диметилформамида.В результ бикарбоната натрия и экстрагируют 55. тате получают 1,7 вес.ч. (63%) И- [4хлороформом. Экстракт высушивают, -[4-{4-метоксифенил)-1-пиперазинилJфильтруют и упаривают. Остаток расфенил]гидразинкарбоксамида, т. пл, тирают в ацетоне. Продукт отфильт300°С. ровывают и промывают метанолом. В результате получают 2 вес.ч. продукСмесь 3,4 вес.ч. її-[4- [4-(4-мєтокта. Объединенные фракции (6 и 60 сифенил)-1-пиперазинил]фенил] гидра2 вес.ч.) перекристаллиэовывают 'из зинкарбоксамида, 3 вес.ч. ацетата н-бутанола. В результате получают метаиимидамида и 10 вес.ч. диметил7,1 вес.ч. 1~(4-метоксифенил )-4сульфоксида перемешивают при 100°С -[4-(1Н-пиразол}-1-ил}фенилпиперав течение 2 ч. Реакционную смесь затем охлаждают и выливают в смесь 4зина, т. пл. 207,7 С. 65 1 3 1069625 14 пил-ЗН-1„2,4-триазоЯ-З-он, т.пл. -метил-2-пентанона и 2, 2''-oкcи-биc258,2°С; ~n£Юпaнa. Выпадающий в осадок продукт отфильтровывают и перекристалли2 , 4-дигидро-4-{>4- [4-( 4-оксифенил )зовывают из Ы,Н-диметилформамида (с -1-пиперазинил^фенил}-2-метил-ЗНдобавкой активированного у г л я ) , В -1,2,4-триазол-З-он; результате получают 1 в е с . ч . (28%) 2-этил-2,4-дигидро-4-[4-[4-(4-ок2,4-дигидро-4-[4- [4-(4-метоксифенил)™ сифенил )-1-пиперазинилJфенилJ-3H-1-пиперазинил]фенилї-ЗН-1,2,4-три-1,2,4-триазол-З-он, т.пл. 217°С; азол-3-она, т . п л . 300°С. 4- [4- [4-(5-пропил-ІН-і,2,4-триаэол-1-ил)фенил]-1-пиперазинил]феП р и м е р 18. Смесь 30 в е с . ч . 4-[4-(4~метоксифенил)-1-пиперази10 нол, т. пл. 225,6°С. нил]фениламина и 300 в е с . ч . 48%-ного Получение целевых продуктов. раствора бромистоводородной кислоты П р и м е р 19. К'перемешиваеперемешивают при кипячении с обратмому раствору 3 вес.ч. 4-[4-(4-аминым холодильником в течение 10 сут. нофенил)-1-пипераэинил]фенола в Реакционную смесь затем упаривают 50 вес.ч. диметилсульфоксида добав15 ляют 0,5 вес.ч. 50%-ной суспензии гиди остаток подщелачивают гидроокисью натрия. Смесь фильтруют и остаток рида натрия. Смесь перемешивают-при подкисляют уксусной кислотой. Выпа50°С до прекращения вспенивания, дающий в осадок- продукт отфильтровыпосле чего добавляют к ней 4,1 вес.ч. вают и перекристаллизовывают из 1,4цис-[2-(2,4-дихлорфенил)-2-(1Н-имида20 зол-2-илметил)-1,3-диоксолан-4-ил-диоксана. В результате получают 12 в е с . ч . (44% ) 4-[4-(4-амипофенил)метил ]метансульфоната и продолжают 1 -1~пиперазинил]фенола. перемешивать при 70°С в течение еще 2 ч. Реакционную смесь затем охлажПроводя те же операции и испольдают и выливают в воду. Продукт зую эквивалентные количества соот25 экстрагируют хлористым метиленом. ветствующих исходных соединений, Экстракт промывают разбавленным получают: раствором гидроокиси натрия, высу4-[4- [4-(1Н-пиразол-1-ил)фенил]шивают и упаривают. Остаток подверга-1-пиразинил]фенол; ют хроматографнческой очистке на 4- [4- [4-( 1Н-имидазол)- 1-ил)фенил] 30 колонке, заполненной силикагелем, -1-пиперазинил Jфенол, т . п л . 26 0°С,' с использованием в качестве элюента 4- [А~ £4-(1Н-1, 2-тpиaэoл-•l-ил)смеси хлороформа и метанола в объемфeнил]-l-пипepaзинил]фeнoл, ном соотношении 98:2. Чистые фракции -т. пл. 275,б°С;объединяют и упаривают. Остаток пе4 - [ 4 - [ з - (3-(метилтио)-1Н-1,2,4рекристаллизовывают из изопропанола. 35 В результате получают 1,3 вес.ч, -триазол-1-ил]фенил]-1-пиперазинил] 6 фенол, т . пл. 225,5 С; (22%) цис-4-[4-{4-[2-(2,4-дихлор4- [4- {4-(5-метил-3-(метилтио)-1Нфенил)-2-(ІН-имидазол-1-ил-метил)-1,2,4-триазол-1-ил]фенилj-1-пипера-1,З-диоксолан-4-илмєтокси]фенил]зинил]фенол, т . п л . 255,8 С; -1-пиперазинил-фениламина, т.пл, 4-[3- [4- [3-метил-5-(метилтио).-4Н- 40 174,4°С. -1, 2-триазол-4-ил]фекил]-1-пиперазинил]фенол; 4- [4- [4-(5-метил-ІН-і,2,4-триазолП р-и м е р 20. К раствору ' -1-ил)фенил]-1-пипераэинил}фенол, і 3,2 вес.ч. 4-{4-[4-(1Н-пиразол-1т . п л . 281,1°С; 45 -ил)фенил]-1-пиперазинил]фенола 4- [4-[4- [3-(метилтио)-4Н-1,'2,4в 100 вес.ч. диметилсульфоксида -т.риазол-4-ил] фенил)-1-пиперазинил]добавляют 0,32 вес.ч. 78%-ной сусфенол; пензии гидрида натрия и перемешивают смесь при 50°С до прекращения 2,4-дигидро-4-[4- [4-{4-оксифенил)вспенивания, после чего добавляют -1-пиперазинил]фенил]-2,5-димeтил-ЗHк ней 4,1 вес.ч. цис-[2-{2,4-дихлор- l , 2, 4-триазол-З-он, т . п л . 260°С; фенил)-2-(ІН-имидазол-2-илметил)2,4-ДИГИДРО-4-[4- [4-(4-оксифенил)-1,3-диоксолан-4-илметил]метансульфо-1-пиперазинил]фенил] -2-пропил-ЗНната и продолжают перемешивание при -1,2,4-триазол-З-он; 100 е С в течение 3 ч. Реакционную А-[А- [4-(2-метил-1Н-имидазол-155 смесь затем охлаждают, выливают в -ил)фенил]-1-пиперазинил]фенол, воду и продукт экстрагируют хлористым т.пл. >300°С; метиленом. Экстракт промывают раз4- [4- (4-[5-этил-З-(метилтио)-ІНбавленным раствором гидроокиси натрия, . -1,2 , 4-триазол-1-ил] фенил^-1-ґіиперавысушивают и упаривают. Остаток под^инил ]фонол, т . п л . 232, (? С; 2-этил-2,47Дигидро-4-[4~ [4-(4-ок- 60 вергают хроматографической очистке на колонке, заполненной силикагелем, сифенил)-1-пиперазинил] фенил] -5-мес использованием в качестве элюента тил- ЗИ-1 , 2,4-триазол-З-он, т . п л . смеси хлороформа и метанола в объемг — — і ном Соотношении 98:2. Чистые фракции 2, 4-ДИГИДРО-4- [4- [4-( 4-оксифенил )1-пиперазинил]фенил^5-метил-2-про65 объединяют и упаривают. 15 1069625 Остаток подвергают хроматографической очистке на колонке, заполненной силикаге^м, с использованием в качестве элюента смеси толуола и этанола в объемном соотношении 95:5. Чистые фракции объединяют и упаривают. Остаток перекристаллизовывают иэ толуола. В результате получают '' ( 2,2 в е с . ч . {34%} цис-1- [4-[2-(2,4 5 -дихлорфенил)-2-(1Н-имидазол-1-ил-метил)-1,З-диоксолан-4-ил-метокси]- 10 -фенил]-4~Г4-(1Н-пиразол-1-ил}фенилЗ' пиперазина, т.пл. 195,1°С. Проводя те же операции и используя эквивалентные количества соответ- 15 ствующих исходных соединений, получают : цис-1-[А-[2-(2, 4-дихлорфенил)-2-(1Н-имидазол-2-илметил)-1,3-диоксолан-4-илметокси]-фенилJ-4-[4-(1Н-ими20 дазол-1-ил)фенил]пиперазин, т.пл. 166,7°С; ЦИС-1-{4-2-(2,4-дихлорфенил)-2-(ІН-имидазол-l- илметнл -1,3-диоксолан-4-илметоксиЗ-фенил]-4-[4-(1Н~ -1/2 / 4-триазол-1-ил)фенилЗпиперазин, 25 т.пл. 175,3°С; Цие-1-[4-[2-(2,4-дихлорфенил)-2-(1Н-имидазоп-1-илметил)-1,3-диоксолан-4~илметоксиЗ-фенил}-4-{4-[3-(метнлтио)-1Н-1,2,4-триазол-1-ил] 30 фенил]пиперазин, т.пл. 178,3°С; цис-1-f4-[2~(2 f 4-дихлорфенил)-2-^ -(1Н-имидазол-1-илметил )-1,3-диоксо^ лан-4-илметокси фенил]-А- [4-[3-метил 5(метилтио)-4Н'1 / 2,4-триазол-4-ил] - 3 5 фенил ]пиперазин, т.пл. 127,8°С? цис-1- [4-[2-(2,4-дихлорфенил)-2-(1Н-имидазол-2-илметил)~1,3-диоксолан-4-илметокси]фенил]-4- {4-Г5-метил | -3-(метилтио)-1Н-1,2,4-триаэол-1-ил] 40 фенил]пиперазин, т.пл. 188,9°С> цис-1- [4-[2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксо~ лаы-4-илметокси]фенилj— 4 f4—[3-(ме— тио)-4Н-1,2,4-триаэол-4-ил]фенил] 45 ,2,4триаэол тилтиоа з и т.пл. 1 7 6 4 пиперазин,н т п л 176,4 °С} ер цис-4- {4-[4- [4-[2~(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3іі ] •^адоксолан-'4- аям©токсйЗфвнил1--1-^гій 16 -ІН-имидазол-1-ил)ФенилЗпипераэин, т. пл, 180,1°С; цис-4- [4 —(4— {4-(2-(2,4-дихлорфенил}-2-(1Н-имидаэол-1-ил-меткл)-1,3-диоксолан-4-илметоксиЗфенил]-1-пипераэинил фенил}-2,4-дигидро~ЗН-1, 2,4-триазол-3-он, т.пл. 212,8°С; *цис-4- f4- [4- [4- [2- ( 2 , 4-дихлорфенил)-2-(1Н-имида"эол-1-ил-метил)-1,3-диоксолан-4-илметокси]фенил]-1-пипоразинил]фенил ]-2-этил~2,4-дигидро-ЗН-1,2,4-триазол-З-он, т . п л . ' 2 0 4,7°С цис-4- f4- f4-{4-^2-( 2,4-дихлорфенил)-2-(1Н-имидазол-1-ил-метил)-1,3-диоксолан-4-илметоксиЗфенил]-1-пипе разинил]фенил]-2,4™дигидрогидро-5-метил-2-пропил~ЗН-1,2,4-триазол-З-он-моногидрат, т.пл. 15 3,9 °С\ цис-1- {4- [2-(2,4-дихлорфенил)-2-(1М-имидазол-1-илметил)-1,3-диоксолан-4-илметоксиЗфеиил ]-4~[4-[5-этил-3-(метилтио)-1Н-1,2,4-триазол-1-ил 3 фенил^пиперазин, т.пл. 136,3°С; цис-1- [4- [2-{2,4-дихлорфенил)-2-(ІН-іімидазол-1-илметшО-ї ,3-диоксолан-4~илметокси")фепил J-4-f 4-( 5-пропил-lH-l,2,4»гриаэол-Г~ил)фенил]~ пиперазин, т.пл. 150,4°С; цис-4- [4-[4~ {4- [2-(2,4-дихлор~ фенил)-2-(1Н-имидазол-1-ил-метил)-1Г 3-диоксолан-4-илметоксиг]фенил j - 1 -пиперазинил]фенил]-2-этил-2,4-дигидро-5-метил-ЗН-1,2,4-триазоп-З-он моногидрат, т.пл. 135,5°С. П р и м е р 2 1 . К перемешиваемому раствору 8 вес.ч. 4- [4-(4-аминофенил Ь-1-пиперазинил]фенола в 100 вес.ч. диметилсульфоксида добавь ляют 1 / 5 вес.ч. 50%-ной суспензии гидрида натрия и продолжают перемешивание до прекращения вспенивания, после чего добавляют 12,3 вес.ч. цис-[2-(2,4-дихлорфенил)-2-(1И-1,2,4-триазол~1-илметил)-1,3-диоксошан-4-илметил^метансульфоната и переІмешивают смесь при 5 0 °С в течение еще 4 ч. Реакционную смесь затем охлаждают и выливают в воду. Продукт трижды экстрагируют хлористым метиленом. Объединенные вытяжки промывают разбавленным раствором гидроокиси натрия и обрабатывают активированным углем, который затем отфильтровывают, а фильтрат упари перазим]фенил }-2,4-дигидро-2,5-диметил-ЗН-1,2,4-триазол-З-он, т.пл. 149,3°С; цис-4- [4- [4-{4- [2-(2,4-дихлорвают. Остаток очищают с помощью хрофенил )~2~(1Еї-имидазол-1-ил-метил)матографии на колонке, заполненной -1,3-диоксолан-4-~илметокси]фенилЗ-1-пиперазинилЗфенил3-2,4-дигидро-2- 55 силикагелем, с использованием в качестве элюента смеси хлороформа и -пропил-ЗН-1,2,4-триазол-З-он, метанола в объемном соотношении т.пл. 185,7°С; 9 8:2, Чистые фракции объединяют и цис-1- [4-[2-(2,4-дихлорфенил)~2•упаривают. Остаток перекристалли-(1Н-имидазол-1-илметил)-1,3-диоксозовывают из н-бутанола. В реэуль- . лан-4-илметокси 3~Ф е нил]-4-Г 4 ~(5-метате получают 5,1 в е с ч , цис-4-[4- [4тил-1Н-1,2,4-триазол-1~илІфенил^пи-[2-(2,4-дихлорфенил)-2-(1Н-1,2,4~ перазин, т . п л . 154,1°С; -триаэол-1-илметил)-1,3-диоксоланцис-1-{4-[2-(2,4-дихлорфенил)-2-4-илметокси]фенил}-1-пипераэинил]г -(1Н-имидазол-1-илметил)-1,3-диоксофениламина^ т . п л . 186,8°С. лан-4-илметокси}фенил]-^-^4-(2-меткл 17 1069,625 18 П р и м е р 22, К перемешиваецис-4- {4- [4- [2~( 2,4-дихлорфенил)мому раствору 3 вес.ч. 4~£4-[4-(1Н-2-(1Н-1,2,4-триазол~1-илметил)-1,3-1,2,4-триазол-1-ил)фенил]-1-пипера-диоксолан-4~илметокси]фенил]-1эннил\фенола в 100 вес,ч. дкметил-пиперазинил]-фенил]~2,4-дигидросульфоксида добавляют 0,3 вес.ч. -2,5-диметил-Зн-1,2,4-триазол-З-он78%-ной суспензии гидрида натрия 5 -моногидрат, т.пл. І 61,9 °С; й продолжают перемешивание до прекцис-4- [4- [4-{4- [2-{ 2, 4-дихлорращения вспенивания. Затем к смеси фенил )~2~(1Н-1,2,4-триазол-1-илметил) добавляют 3,7 вес.ч. цис-[2-(2,4-1,3-диоксолан-4-йлметокси]фенил]-1~дихлорфенил)-2-(1Н~1,2,4-триазол-1-пиперазинил]фенилj-2,4-дигидро-2-илмєтил)~1,З-дноксодан-4-илметил)Ю -пропил-ЗН-1,2,4-триазол-З-он, т . п л . метансульфоната и продолжают пере167,3°С; мешивание при 100°С в течение 3 ч. цис-1- {4-[2-(2,4-дйхлорфенил)-2Реакционную смесь затем охлаждают -Цн~1,2,4-триазол-1-илметил)-1,3и выливают в воду. Продукт экстра-диоксолан-4-илметоксиЗфенил]-4-[4гируют трижды хлористым метиленом. • -( 2-метил-ІН-имидазол-l-ил)фенил]j g Объединенные вытяжки промывают 'пипераэин, т . п л . 175,6°С; разбавленным раствором гидроокиси цис-4-[4-[4- [2-(2,4-дихлорфенил)натрия, высушивают и упаривают. -2-(1Н-1,2,4-триазол-1-илметил)-1,3-диоксолан-4-илметокси ]фенил]-1-пиОстаток перекристаллизовывают из ^„ перазинил]фенил]-2,4-Дигидро-2-метилн-бутанола. Продукт отфильтроваW -ЗН~1 F 2,4-триазол-З-он, т.пл.193,8 °С; вают и высушивают. В результате цис-4- [4- [4- [4- 2-(2,4-дихлорполучают 4,3 вес.ч. V75% ) цис-1-{4фенил)-2-( 1Н-1,2,4-триаэол-1-илметил) -[2-£2,4~дихлорфенил)-2-(1Н-1,2,4-1,З-диоксолан-4-илметокси ]фенилj-1-триазол-1-илметил)-1,3-диоксолан-4~ -илметокси фенил]-4- [4- 1Н-1, 2 ,4-три;~с -пиперазинил]фенил]-2-этил-2,4-дигидро-5-метил-ЗН-1,2,4-триазол-З-он, азол-1-ил)фенил]пиперазина, т.пл, т . п л . 178,3°С; ; 219,6°С. цис-4- [3- [4- [4- [2- ( 2 , 4-дихлорфеАналогично, используя эквивалентнил)-2-( 1Н-1,2,4-триаэол-1-илметил)ные количества соответствующих -1,3-диоксолан-4-илметокси]фенил]исходных соединений, получают: -1-пиперазинил]фенил]-2,4-дигидро-5цис-1-[4-[2-(2,4-дихлорфенил)-2-метил-2-пропил-ЗН-1,2,4-триаэол-З-(1Н-1,2, 4-триаэол-1-илметил)-1,3-он-моногидрат, т . пл. 165,5 С; '-диоксолан-4-илметокси]фенилj-4цис-4-(4-[4- {4-[2-(2 г 4-дихлорфе- f4-( 1H-пиразол-1-ил )ф'енил]пйпераниЛ)-2-(1Н-1,2,4-триаэол-1-илметил)зин, т.пл, 183,3°С-Т 35 -1,3-диоксолан-4-илметоксиЗфенил}-1цис-1~{4~[2-(2,4-дихлорфенил)-2-пиперазинил]^>енил1-2-этил-2,4-дигид-(1И-1,2,
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess of preparation of azoles, their acidic-additive salts or their stereoisomers
Автори англійськоюJan Heeres
Назва патенту російськоюСпособ получения азолов или их кислотно-аддитивных солей, или их стереоизомеров
Автори російськоюЯн Херес
МПК / Мітки
МПК: A01N 43/64, C07D 405/14
Мітки: кислотно-адітивних, солей, одержання, спосіб, стереоізомерів, азолів
Код посилання
<a href="https://ua.patents.su/16-2701-sposib-oderzhannya-azoliv-abo-kh-kislotno-aditivnikh-solejj-abo-kh-stereoizomeriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання азолів або їх кислотно-адітівних солей, або їх стереоізомерів</a>