Хінолінові і хіноксалінові сполуки, фармацевтична композиція, спосіб інгібування (варіанти) та спосіб лікування (варіанти)
Номер патенту: 66361
Опубліковано: 17.05.2004
Автори: Спада Альфред П., Персонс Пол Е., Майерс Майкл, Магвір Мартін П.
Формула / Реферат
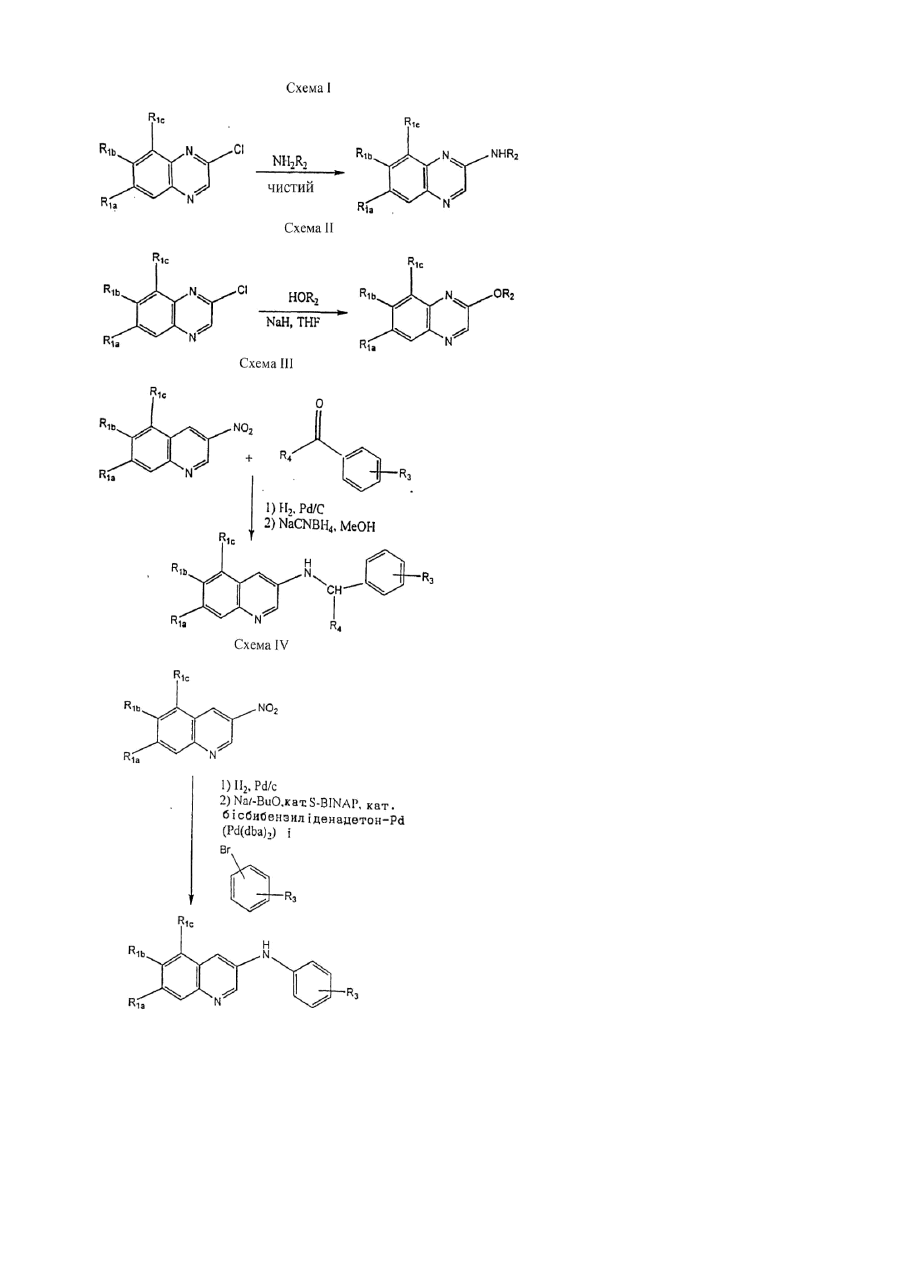
1. Хінолінові і хіноксалінові сполуки формули I:
, (І)
де
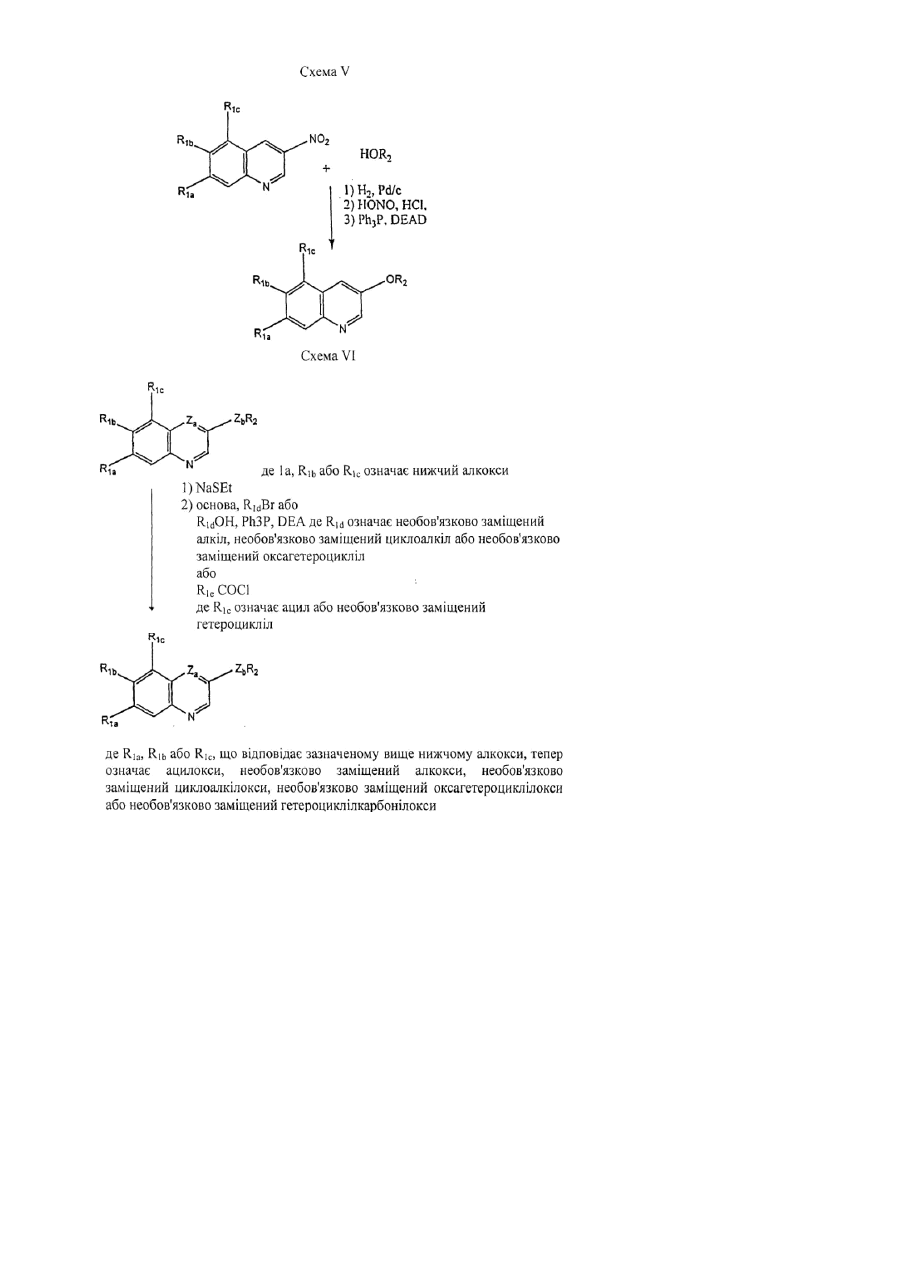
R1a являє собою необов'язково заміщений алкіл, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений оксагетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси або галоген;
R1b являє собою водень, необов'язково заміщений алкіл, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений оксагетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси або галоген;
R1c являє собою водень, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, необов'язково заміщений гетероциклілкарбонілокси, галоген, ціано, R5R6N- або ацилR5N-;
R2 являє собою
;
R3 являє собою водень, орто- або парафтор або метанижчий алкіл, нижчий алкокси, галоген або карбамоїл;
R5 і R6 незалежно являють собою водень або алкіл або R5 і R6, взяті разом з атомом азоту, до якого R5 і R6 приєднані, утворюють азагетероцикліл;
Zd являє собою N або СН; і
Zb являє собою NH або О,
або їх N-оксид, гідрат, сольват, проліки або сіль, за умови, що R1a і R1b обидва не є необов'язково заміщеним алкілом.
2. Сполука формули 1 за п.1, в якій R1a являє собою необов'язково заміщений нижчий алкокси, необов'язково заміщений моноциклічний циклоалкілокси, необов'язково заміщений гетероциклілкарбонілокси або необов'язково заміщений моноциклічний оксагетероциклілокси.
3. Сполука за п. 2, в якій R1a являє собою необов'язково заміщений нижчий алкокси або необов'язково заміщений моноциклічний оксагетероциклілокси.
4. Сполука за п. 3, в якій R1a являє собою метокси, етокси, 2-(етоксі)етокси, 2-(4-морфолініл)етокси або фуранілокси.
5. Сполука за п. 1, в якій R1b являє собою водень, необов'язково заміщений нижчий алкокси, необов'язково заміщений моноциклічний циклоалкілокси, необов'язково заміщений гетероциклілкарбонілокси або необов'язково заміщений моноциклічний оксагетероциклілокси.
6. Сполука за п. 5, в якій R1b являє собою водень або необов'язково заміщений нижчий алкокси.
7. Сполука за п. 6, в якій R1b являє собою метокси або етокси.
8. Сполука за п. 1, в якій R1a і R1b являють собою нижчий алкокси.
9. Сполука за п. 8, в якій R1a і R1b являють собою метокси або етокси.
10. Сполука за п. 1, в якій R1c являє собою водень або необов'язково заміщений нижчий алкокси.
11. Сполука за п.10, в якій R1c являє собою водень, метокси або етокси.
12. Сполука за п. 1, в якій R3 являє собою водень, орто- або парафтор або метаметил, трифторметил, метокси, фтор, хлор, бром або карбамоїл.
13. Сполука за п. 1, в якій Za являє собою N.
14. Сполука за п. 1, в якій Za являє собою СН.
15. Сполука за п. 1, в якій Zb являє собою NH.
16. Сполука за п. 1, в якій Zb являє собою О.
17. Сполука за п. 1, що являє собою:
2-аніліно-6-хіноксалінол;
2-аніліно-6-ізопропоксихіноксалін;
2-фенокси-6-метоксихіноксалін;
2-(3-карбамоїлфеніламіно)-6-метоксихіноксалін;
2-(2-фторфеніламіно)-6,7-діетоксихіноксалін;
2-(3-трифторметилфеніламіно)-6,7-діетоксихіноксалін;
феніл-[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін;
(6-метоксихіноксалін-2-іл)-(3-метилфеніл)амін;
6-метокси-2-феніламінохіноксалін;
2-аніліно-6-етоксихіноксалін;
2-(3-метоксифеніламіно)-6,7-діетоксихіноксалін;
2-(4-фторфеніламіно)-6,7-діетоксихіноксалін;
6,7-діетокси-2-феноксихіноксалін;
2- феніламіно-6,7-діетоксихіноксалін;
(6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін;
2-(3-фторфеніламіно)-6,7-діетоксихіноксалін;
(3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін;
(6,7-диметоксихіноксалін-2-іл)феніламін і
(3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл)амін,
або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
18. Сполука за п. 1, що являє собою:
феніл-[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін;
(6-метоксихіноксалін-2-іл)-(3-метилфеніл)амін;
6-метокси-2-феніламінохіноксалін;
2-аніліно-6-етоксихіноксалін;
2-(3-метоксифеніламіно)-6,7-діетоксихіноксалін;
2-(4-фторфеніламіно)-6,7-діетоксихіноксалін;
6,7-діетокси-2-феноксихіноксалін;
2-феніламіно-6,7-діетоксихіноксалін;
(6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін;
2-(3-фторфеніламіно)-6,7-діетоксихіноксалін;
(3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін;
(6,7-диметоксихіноксалін-2-іл)феніламін і
(3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл)амін, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
19. Сполука за п. 1, яка являє собою феніл-[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін або його N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль.
20. Сполука за п. 1, яка являє собою (6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін або його N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль.
21. Сполука за п. 1, яка являє собою (3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін або його N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль.
22. Сполука за п. 1, яка являє собою (3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл)амін або його N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль.
23. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
24. Спосіб інгібування активності тирозинкінази фактора росту PDGF, що включає контактування сполуки за п. 1 з композицією, що містить тирозинкіназу PDGF.
25. Спосіб інгібування активності тирозинкінази Lck, що включає контактування сполуки за п. 1 з композицією, що містить тирозинкіназу Lck.
26. Спосіб інгібування проліферації клітин, диференціації або вивільнення медіатору у пацієнта, який страждає від порушення, що характеризується такими проліферацією і/або диференціацією, і/або вивільненням медіатору, що включає введення вказаному пацієнту фармацевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
27. Спосіб за п. 26, в якому порушенням є лейкоз, рак, гліобластома, псоріаз, запальні захворювання, захворювання кістки, фіброзні захворювання, артрит, фіброз легені, фіброз нирки, фіброз печінки, атеросклероз або рестеноз після ангіопластики коронарної артерії, стегнової артерії або артерії нирки.
28. Спосіб лікування пацієнта, схильного до патології, пов'язаної з гіперпроліферативним порушенням, що включає введення вказаному пацієнту фармацевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
29. Спосіб за п. 28, в якому патологією, пов'язаною з гіперпроліферативним порушенням, є рак, сприйнятливий до лікування шляхом інгібування тирозинкінази фактора росту PDGF.
30. Спосіб за п. 29, в якому рак являє собою рак головного мозку, рак яєчника, рак товстої кишки, рак передміхурової залози, рак легенів, саркому Капоши або злоякісну меланому.
31. Спосіб за п. 28, в якому вказаною патологією є рестеноз.
32. Спосіб за п. 31, в якому сполуку за п. 1 вводять за допомогою нанесення покриття на розширювальному пристрої (стенті), де покриття містить сполуку за п. 1.
33. Спосіб лікування запалення у пацієнта, який страждає від нього, що включає введення вказаному пацієнту фармацевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
34. Спосіб лікування ревматоїдного артриту, розсіяного склерозу, системного червоного вовчака, хвороби «трансплантат проти господаря», астми, запального захворювання кишечнику або панкреатиту, що включає введення пацієнту, потребуючому такого лікування, інгібуючої тирозинкіназу Lck кількості сполуки за п. 1.
Текст
Цей винахід стосується інгібування проліферації клітин і/або продукування клітинного матриксу, і/або пересування клітин (хемотаксису) і/або активації і проліферації Т-клітин шляхом використання хінолінових і хіноксалінових сполук, що є корисними інгібіторами білкової тирозинкінази (TKIs). Клітинна передача сигналів відбувається за допомогою системи взаємодій, що включає контакт клітини з клітиною, клітини з матриксом або позаклітинним рецептором із субстратом. Позаклітинний сигнал часто передається до інших частин клітини через опосередковане тирозинкіназою фосфорилювання, що впливає на білки субстрату за клітинною мембраною, зв'язаної з комплексом, що передає сигнал. Прикладом ферментів тирозинкіназ, залучених до клітинної передачі сигналів, є конкретний ряд рецепторів-ферментів, таких, як інсуліновий рецептор, рецептор епідермального фактора росту (EGF-B) або рецептор тромбоцитарного фактора росту (PDGF-R). Для ефективного ферментативного фосфорилювання субстратни х білків, що містять тирозинові залишки, потрібно аутофосфорилювання ферменту. Відомо, що ці субстрати відповідальні за різноманітні клітинні акти, що включають клітинну проліферацію, продукування клітинного матриксу, клітинну міграцію, апоптоз і т.д. Зрозуміло, що некероване репродукування клітин, перепродукування матриксу або погано регульована запрограмована загибель клітин (апоптоз) викликає багато хворобливих станів. Ці хворобливі стани включають різноманітні типи клітин і означають такі захворювання, як лейкоз, рак, гліобластома, псоріаз, запальні захворювання, фібрози, атеросклероз і рестеноз, що виникає після ангіопластики коронарних, стегнових або ниркових артерій, або фібропроліферативне захворювання, таке, як артрит, фіброз легкого, нирки і печінки. Крім того, після коронарного шунтування створюються умови для нерегульованої клітинної проліферації. Вважають, що інгібування активності тирозинкінази буде корисним для регулювання некерованого репродукування клітин, перепродукування матриксу або погано регульованої запрограмованої загибелі клітин (апоптозу). Відомо також, що визначені інгібітори тирозинкінази можуть взаємодіяти з більш ніж одним типом ферменту тирозинкінази. Декілька ферментів тирозинкінази дуже важливі для нормального функціонування організму. Наприклад, було б бажаним інгібувати дію інсуліну в більшості звичайних випадків. Таким чином, сполуки, що інгібують активність тирозинкінази рецептора PDGF-R при концентраціях нижче концентрацій, ефективних в інгібуванні кінази інсулінового рецептора, могли б давати цінні агенти для селективного лікування захворювань, що характеризуються проліферацією клітин і/або продукуванням клітинного матриксу і/або пересуванням клітин (хемотаксисом), таких, як рестеноз. Цей винахід стосується модулювання і/або інгібуванню передачі сигналів у клітинах, проліферації клітин, продукування позаклітинного матриксу, хемотаксису, регуляції аномального росту клітин і запальної реакції клітин. Більш конкретно цей винахід стосується застосування заміщених хіноксалінів, що мають здатність вибірково інгібувати диференціацію, проліферації або вивільнення медіатору шляхом ефективного інгібування активності тирозинкінази рецептора тромбоцитарного фактора росту (PDGF-R) і/або активності Lck тирозинкінази. У ряді літературних джерела описані інгібітори тирозинкінази, що вибірково діють стосовно ферментів рецепторів тирозинкінази, таких, як EGF-R або PDGF-R, або нерецепторним цитозольним тирозинкіназам, таким, як v-abl, p561ck або c-src. У недавніх оглядах Spada and Myers (Exp. Patents 1995, 5(8), 805) і Bridges (Exp. Patents 1995, 5(12), 1245) дано короткий опис літератури стосовно інгібіторів тирозинкіназ і інгібіторів, вибіркових стосовно EGF-R, відповідно. Крім того, Law and Lydon дали коротке повідомлення про протипухлинну активність інгібіторів тирозинкіназ (Emerging Drugs: The Prospect For Improved Medicines 1996, 241-260). Відомі інгібітори активності тирозинкінази PDGF-R включають інгібітори на основі хіноліну, описані Maguire et al. (J. Med. Chem., 1994, 37, 2129) і by Dolle et al. (J. Med. Chem., 1994, 37, 2627). Клас інгібіторів на основі феніламінопіримідину був недавно описаний Traxler et al. в ЕР 564409 і Zimmerman, J.; and Traxler, P. et al. (Biorg. & Med. Chem. Lett. 1966, 6(11), 1221-1226) і Buchdunger, E. et al. (Prog. Nat. Acad. Sci. 1995, 92, 2558). Незважаючи на прогрес у даній області, ще не існує засобів із цих класів сполук, що були б схвалені для застосування на людях для лікування проліферативних захворювань. Взаємозв'язок між багатофакторним захворюванням рестенозом і PDGF і PDGF-R досить описано в науковій літературі. Однак недавні розробки у вивченні фіброзів легень (Antoniades, H.N. et al. J. Clin. In vest. 1990, 86, 1055), нирки і печінки (Peterson, Т. Hepatology, 1993, 17, 486) показали, що важливу роль у цих захворюваннях також відіграють PDGF і PDGF-R. Наприклад, гломерулонефрит є основною причиною ниркової недостатності, і, як показано Shultz et al. 1988, 255, F674) і Floege et al. 1991, 86, 334), PDGF був ідентифікований як потужний мітоген in vitro для мезангіальних клітин. Як повідомлялося Thornton, S.C.; et al. (Clin. Exp. Immun. 1981, 86, 79), TNP-альфа і PDGF (отримані від людей, хворих ревматоїдним артритом) є основними цитокінами, залученими в процес проліферації синовільних клітин. Крім того, вже ідентифіковані конкретні типи пухлинних клітин (див. Silver, В., BioFactors, 1992, 3, 217), такі, як гліобластома і саркома Капоші (Kaposi), що здійснюють надекспресію білка PDGF або рецептора, що веде до некерованого росту пухлинних клітин через аутокринний або паракринний механізм. Таким чином, очікується, що інгібітор PDGF тирозинкінази буде корисний для лікування різноманітних, мабуть, неродинних хворобливих станів людини, що можна характеризувати залученням у їх етіологію PDGF і/або PDGF-R. Роль різних нерецепторних тирозинкіназ, таких, як р56Iск (далі "Lck"), у станах, які відносяться до запальних, що включають активацію і проліферацію Т-клітин, вже описана Hanke, et al. (Inflamm. Res. 1995, 44, 357) і Bolen and Brugge (Ann. Rev. Immunol, 1997, 15, 371). Ці запальні стани включають алергію, аутоімунну хворобу, ревматоїдний артрит і відторгнення трансплантата. В іншому недавньому огляді коротко описані різні класи інгібіторів тирозинкіназ, включаючи сполуки, що мають інгібуючу активністю щодо Lck (Groundwater, et al. Progress in Medicinal Chemistry, 1996, 33, 233). Інгібітори активності Lck тирозиикіназ включають деякі природні продукти, що звичайно є невибірковими інгібіторами тирозипкіназ, такі, як ставроспорин, геністеїн, деякі флавони і ербстатин. Недавно одержано повідомлення про дамнакантол, що є інгібітором Lck (Faltynek, et al, Biochemistry, 1995, 34, 12404). Приклади синтетичних інгібіторів Lck включають: ряд дигідрокси-ізохінолінових інгібіторів, що, як повідомлено (Burke, et al, J. Med. Chem. 1993, 36, 425), мають активність при низькій концентрації в межах від мікромолярної до субмікромолярної, і похідну хіноліну, що, як виявлено, є набагато менш активною щодо Lck (IC50=610мкМ). Дослідниками був також розкритий ряд 4-заміщених хіназолінів, що інгібують Lck при низькій концентрації в межах від мікромолярної до субмікромолярної (Myers et al, WO 95/15758 і Myers et al, Bioorg. Med. Chem. Lett. 1997, 7, 417). Дослідники з фірми Pfizer (Hanke, et al, J. Biol. Chem. 1996, 271, 695) розкрили два специфічних піразолопіримідинових інгібітори, відомих як РР1 і РР2, що мають активність при низьконаномолярній концентрації стосовно Lck і Fyn. (інша кіназа родини Src). He повідомлялося про інгібітори Lck, що відносяться до сполук на основі хіноліну або хіноксаліну. Тому очікують, що хіноліновий або хіноксаліновий інгібітор активності тирозинкінази Lck може бути корисним для лікування різноманітних неродинних хворобливих станів людини, що можна характеризувати залученням у їхній етіологію передачі сигналів через тирозинкінази Lck. Цей винахід стосується сполуки формули І: де R1а означає необов'язково заміщений алкіл, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений оксагетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси або галоген; R1b означає водень, необов'язково заміщений алкіл, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений оксагетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси або галоген; R1c означає водень, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, необов'язково заміщені гетероциклілкарбонілокси, галоген, ціано, R5R6N- або ацилR5N-; R2 означає R3 означає водень, орто- або парафтор, мета-нижчий алкіл, нижчий алкокси; галоген або карбамоїл; R4 означає водень або нижчий алкіл; R5 і R6 незалежно означають водень або алкіл або R5 і R6, узяті разом з атомом азоту, до якого R5 і R6 приєднані, утворять азагетероцикліл; Za означає N або СН; і Zb означає NH або О, або її N-оксиду, гідрату, сольвату, пролікарського засобу або солі, за умови, що R 1а і R1b не означають обидва необов'язково заміщений алкіл. Цей винахід також стосується фармацевтичної композиції, що містить фармацевтично ефективну кількість сполуки формули І і фармацевтично прийнятний носій. Цей винахід далі стосується проміжних сполук, придатним для одержання сполук формули І, способів одержання проміжних сполук і сполук формули І і застосування сполуки формули І для лікування пацієнта, що страждає або піддається порушенням або станам, що включають клітинну диференціацію, проліферацію, продукування точного матриксу або вивільнення медіатору. Використані вище і у всьому описі винаходи терміни мають, якщо не зазначено інше, такі значення. Визначення "Пацієнт" означає ссавець, включаючи людину. "Ефективна кількість" означає кількість сполуки згідно з даним винаходом, ефективна в інгібуванні активності тирозинкінази PDGF-R і активності Lck тирозинкінази, що забезпечує необхідний терапевтичний ефект. "Алкіл" означає аліфатичну вуглеводневу груп у, що може бути з розгалуженою або нерозгалуженою, і мати від приблизно 1 до приблизно 10 вуглецеви х атомів. Переважним алкілом є "нижчий алкіл", що має від приблизно 1 до приблизно 3 вуглецеви х атомів, причому більш переважним є метил. Розгалужений ланцюг означає, що до лінійного алкільного ланцюга приєднані одна або декілька нижчих алкільних гр уп, таких, як метил, етил або пропіл. Алкільна група є також необов'язково заміщеною алкокси, галогеном, карбокси, гідрокси або R5R6N- (де R5 і R6 незалежно означають водень або алкіл або R5 і R6, узяті разом з атомом азоту, до якого R5 і R6 приєднані, утворюють азагетероцикліл), а більш переважно необов'язково заміщеною фтором. Приклади алкілу включають метил, фторметил, дифторметил, трифторметил, етил, н-пропіл, ізопропіл, бутил, вторбутил, третбутил, аміл і гексил. "Циклоалкіл" означає неароматичну моноциклічну кільцеву систему, що має від приблизно 3 до приблизно 7 вуглецевих атомів. Переважні моноциклічні циклоалкіли включають циклопентил, циклогексил і циклогептил; більш переважними є циклогексил і циклопентил. "Арил" означає ароматичний карбоциклічний радикал, що містить від приблизно 6 до приблизно 10 вуглецевих атомів. Прикладом арилу є феніл або нафтил або феніл або нафтил, заміщені одним або кількома замісниками арильної групи, що можуть бути однаковими або різними, причому, замісник арильної групи, включає водень, гідрокси, галоген, алкіл, алкокси, карбокси, алкоксикарбоніл або Y1 Y2 NCO-, де Y1 і Y2 незалежно означають водень або алкіл. "Гетероарил" означає приблизно 5-10-членну ароматичну моноциклічну або поліциклічну вуглеводневу кільцеву систему, в якій один або кілька вуглецевих атомів є елементом(ами), відмінним(и) від вуглецю, наприклад азотом, киснем або сіркою. Гетероарил може бути також заміщеним одним або кількома вищезгаданими "замісниками арильної групи". Приклад гетероарильної групи включає заміщений піразиніл, фураніл, тієніл, піридил, піримідиніл, ізоксазоліл, ізотіазоліл, оксазоліл, тіазоліл, піразоліл, фуразаніл, піроліл, імідазо[2,1-b]тіазоліл, бензофуразаніл, індоліл, азаіндоліл, бензімідазоліл, бензотієніл, хінолініл, імідазоліл і ізохінолініл. "Гетероцикліл" означає приблизно 4-7-членну моноциклічну кільцеву систему, у якій один або кілька атомів у кільцевій системі є елементом(ами), (відмінним(и) від вуглецю й вибраним(и) з-поміж азоту, кисню або сірки. Наявність "аза" або "окса" у якості приставки перед гетероциклілом означає, що в якості кільцевого атома присутній принаймні азот або кисень відповідно. Приклади моноциклічних гетероциклільних груп включають піперидил, піролідиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, 1,3-діоксоланіл, 1,4-діоксаніл, тетрагідрофураніл, тетрагідротіофеніл, тетрагідротіопіраніл і подібні. Приклади гетероциклільних фрагментів включають хінуклідил, пентаметиленсульфід, тетрагідропіраніл, тетрагідротіофеніл, піролідиніл, тетрагідрофураніл або 4-піперидинопіперидин. "Гетероциклілкарбонілокси" означає гетероцикліл-(С(О)О-групу, у якій гетероцикліл має вказані вище значення. Прикладом гетероциклілкарбонілоксигрупи с [1,4']-біпіперидин-1’-ілкарбонілокси (4піперидинопіперидин-1-ілкарбонілокси). "Ацил" означає Н-СО- або алкіл-СО-груиу, в якій алкільна група така, як описано вище. Переважні ацили містять нижчий алкіл. Приклади ацильних груп включають форміл, ацетил, пропаноїл, 2метилпропаноїл, бутаноїл і капроїл. "Алкокси" означає алкіл-О-групу, у якій алкільна група така, як описано вище. Переважним алкокси є "нижчий алкокси", що має від приблизно 1 до приблизно 3 вуглецевих атомів; більш переважним є метокси. Алкокси може бути необов'язково заміщений однією або кількома групами, що включають алкокси, карбокси, алкоксикарбоніл, карбоксиарил абоR5R6N- (де R5 і R6 - такі, як визначено вище). Приклади алкоксигруп включають метокси, етокси, н-пропокси, ізопролокси, н-бутокси, гептокси, 2-(морфолін-4-іл)етокси і 2-(етокси)етокси. "Циклоалкілокси" означає циклоалкіл-О-групу, у якій циклоалкільна група така, як описано вище. Прикладами циклоалкілоксигрупи є циклопентилокси або циклогексилокси. "Гетероциклілокси" означає гетероцикліл-О-групу, в якій гетероциклільна група така, як описано вище. Приклади гетероциклілоксигрупи включають пентаметиленсульфідокси, тетрагідропіранілокси, тетрагідротіофенілокси, піролідинілокси або тетрагідрофуранілокси. "Арилокси" означає арил-О-групу, у якій арильна група така, як описано вище. "Гетероарилокси" означає гетероарил-О-групу, в якій гетероарильна група така, як описано вище. "Ацилокси" означає ацил-О-групу, в якій ацильна група така, як описано вище. "Карбокси" означає НО(О)С-(карбонова кислота)групу. "R5R6N-" означає заміщену або незаміщену аміногрупу, в якій R5 і R6 такі, як визначено вище. Приклади групи включають аміно (H2N), метиламіно, етилметиламіно, диметиламіно і діетиламіно. "R5R6NCO-" означає заміщену або незаміщену карбамоїльну гр упу, в якій R5 і R6 такі, як визначені вище. Прикладами групи є карбамоїл (H2NCO-) і диметиламінокарбамоїл (Me2NCO-). "AцилR5N-" означає ациламіногрупу, в якій R5 і ацил - такі, як визначені вище. "Галоген" означає фтор, хлор, бром або йод. Переважними є фтор, хлор або бром, а більш переважними фтор або хлор. "Пролікарський засіб" означає форму сполуки формули І, придатну для введення пацієнту, яка не викликає токсичності, подразнення, алергійної реакції і подібного й ефективну для певного використання; такі форми включають кетальну, складно-ефірну і цвітер-іонну форми. Пролікарський засіб трансформується in vivo у ви хідну сполуку зазначеної вище формули, наприклад, гідролізом у крові. Докладний опис даний у роботі Т. Higuchi and V. Stella, Prordrugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, і в роботі Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987; обидва матеріали включені в даний опис у якості посилання. "Сольват" означає фізичну асоціацію сполуки згідно з даним винаходом з однією або кількома молекулами розчинника. Ця фізична асоціація включає різні ступені утворення іонного і ковалентного зв'язків, включаючи утворення водневого зв'язку. У деяких випадках сольват може бути виділений, наприклад, коли одна або кілька молекул розчинника впроваджені в кристалічні решітки кристалічної твердої речовини. Термін "сольват" включає як сольвати у вигляді розчину, так і виділені сольвати. Типові сольвати включають етанолати, метанолати і подібні сполуки. "Гідрат" - це сольват, у якому молекула(и) розчинника означає(ють) Н2О. Переважні варіанти втілення винаходу Переважною сполукою згідно з даним винаходом є сполука формули І, у якій R 1а означає необов'язково заміщений нижчий алкокси, необов'язково заміщений моноциклічний циклоалкілокси, необов'язково заміщений гетероциклілкарбонілокси або необов'язково заміщений моноциклічний оксагетероциклілокси; більш переважно R1а означає необов'язково заміщений нижчий алкокси або необов'язково заміщений моноциклічний оксагетероциклілокси, а ще більш переважно R1а означає метокси, етокси, 2-(етокси)етокси, 2-(4-морфолініл)етокси або фуранілокси. Іншою переважною сполукою згідно з даним винаходом є сполука формули І, у якій R 1b означає водень, необов'язково заміщений нижчий алкокси, необов'язково заміщений моноциклічний циклоалкілокси, необов'язково заміщений гетероциклілкарбонілокси або необов'язково заміщений моно циклічний оксагетероциклілокси, більш переважно R1b означає водень або необов'язково заміщений нижчий алкокси, а ще більш переважно R1b означає метокси або етокси. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, у якій R1a і R1b означають нижчий алкокси, причому більш переважним нижчим алкокси є метокси або етокси. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, у якій R1c означає водень або необов'язково заміщений нижчий алкокси, а більш переважно R1c означає водень, метокси або етокси. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій R2 означає Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій R2 означає Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій R3 означає водень, орто- або парафтор або метаметил, трифторметил, метокси, фтор, хлор, бром або карбамоїл. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій R4 означає водень або метил. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій Za означає N. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій Za означає СН. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій Zb означає NH. Наступною переважною сполукою згідно з даним винаходом є сполука формули І, в якій Zb означає О. Переважні сполуки згідно з даним винаходом включають: 2-аніліно-6-хіноксалінол; 2-((R)-a-метилбензиламіно)-6,7-діетоксихіноксалін; 2-аніліно-6-ізопропоксихіноксалін; 2-фенокси-6-метоксихіноксалін; (3-бромбензил)-(6,7-диметоксихіноксалін-2-іл)амін; 2-(3-карбамоїлфеніламіно)-6-метоксихіноксалін; 2-(2-фторфеніламіно)-6,7-діетоксихіноксалін; 2-(3-трифторметилфеніламіно)-6,7-діетоксихіноксалін; Феніл-[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін; Бензил-(6,7-диметоксихіноксалін-2-іл)амін; 2-((S)-a-метилбензиламіно)-6,7-діетоксихіноксалін; 2-бензиламіно-6,7-діетоксихіноксалін; (6-метоксихіноксалін-2-іл)-(3-метилфеніл)амін; 6-метокси-2-феніламінохіноксалін; 2-аніліно-6-етоксихіноксалін; 2-(3-метоксифеніламіно)-6,7-діетоксихіноксалін; 2-(4-фторфеніламІно)-6,7-діетоксихіноксалін; 6,7-діетокси-2-феноксихіноксалін; 2-феніламіно-6,7-діетоксихіноксалін; (6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін, 2-(3-фторфеніламіно)-6,7-діетоксихіноксалін; (3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін; (6,7-диметоксихіноксалін-2-іл)феніламін; і (3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл)амін. Більш переважними сполуками є такі: Феніл[[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін; Бензил-(6,7-диметоксихіноксалін-2-іл)амін; 2-((S)-a-метилбензиламіно)-6,7-діетоксихіноксалін; 2-бензиламіно-6,7-діетоксихіноксалін; (6-метоксихіноксалін-2-іл)-(3-метилфеніл)амін; 6-Метокси-2-феніламінохіноксалін; 2-аніліно-6-етоксихіноксалін; 2-(3-метоксифеніламіно)-6,7-діетоксихіноксалін; 2-(4-фторфеніламіно)-6,7-діетоксихіноксалін; 6,7-діетокси-2-феноксихіноксалін; 2-феніламіно-6,7-діетоксихіноксалін; (6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін; 2-(3-фторфеніламіно)-6,7-діетоксихіноксалін; (3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін; (6,7-диметоксихіноксалін-2-іл)феніламін; і (3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл)амін. Слід розуміти, що цей винахід охоплює усі відповідні комбінації окремих переважних груп, згаданих у даному описі. Сполуки згідно з даним винаходом можуть бути отримані з використанням методик, відомих із літератури, із відомих сполук або легко одержуваних проміжних сполук. Приклади загальних методик наведені нижче. Крім того, сполуки формули І одержують у відповідності зі схемами І-VI, де змінні мають описані вище значення, за винятком тих змінних, які фахівець у даній області хімії оцінив як несумісні з описуваним методом. 1. Загальні методики: 2. Взаємодія 2-хлорзаміщеного хіноксаліну й амінів або анілінів Суміш 2-хлор-6,7-диметоксихіноксаліну (1екв.) і аміну (приблизно 1-5екв.) нагрівають при температурі приблизно 160-180°С протягом від приблизно трьох годин до всієї ночі. Темно-коричневий залишок розчиняють у суміші метанол-метилен-хлорид (0%-10%) і хроматографують на силікагелі з елююванням сумішшю гексан-етилацетат або метанол-метиленхлорид (0%-100%), одержуючи в результаті цільовий продукт. Цільовий продукт може бути додатково очищений перекристалізацією в метанолі, метиленхлориді або суміші метанол-вода. 2. Взаємодія 2-хлорзаміщеного хіноксаліну і спиртів або фенолів Суспензію спирту або меркаптану (1екв.) і гідриду натрію (приблизно 1-3екв.) у безводному ДМФ/ТГФ (0%-50%) кип'ятять із зворотним холодильником протягом 1 години, після чого добавляють 2-хлор-6,7диметоксихіноксаліну (1екв.). Отриману суміш кип'ятять із зворотним холодильником протягом приблизно однієї-чотирьох годин. Нейтралізують суспензію до приблизно рН 5-8 і розподіляють її між метиленхлоридом і розсолом. Залишок після концентрування метиленхлориду хроматографують на силікагелі, елююючи сумішшю гексан-етилацетат або метанол-метиленхлорид (0%-10%), з одержанням цільового продукту. 3. Реакція відновлювального амінування з амінохінолінами й альдегідами або кетонами Відповідним чином заміщений 3-амінохінолін (1екв.) перемішують із 1екв. відповідного альдегіду або кетону в метанолі (або іншій підхожій суміші розчинників) доти, поки ТШХ не покаже завершення утворення іміну. Добавляють надлишковий NaCNBH 4 або NaBH4 або інший відповідний відновлювач і суміш перемішують, поки ТШХ не покаже повне використання проміжного іміну. Суміш концентрують і залишок хроматографують на силікагелі сумішшю гексан-етилацетат (0-100%) або хлороформ-метанол (0-20%), з одержанням цільового продукту. 4. Взаємодія 3-амінозаміщених хінолінів і бромфенільних сполук Відповідним чином заміщений 3-амінохінолін (1 екв.) перемішують із приблизно 1,4екв. сильної основи, такої, як трет-бутоксид натрію, 1екв. відповідної бромфенільної сполуки і каталітичних кількостей 2,2'-біс (дифенілфосфіно)-1,1’-бінафтилу (S-B1NAP) і біс(дибензиліденацетон)паладію (Pd(dba)2) в інертному органічному розчиннику, такому, як толуол, в атмосфері інертного газу такого, як аргон, і нагрівають до приблизно 80°СС протягом ночі. Суміш охолоджують, розбавляють розчинником, таким, як ефір, фільтрують, концентрують і хроматографують сумішшю 50% EtOAc-гексан з одержанням цільового продукту. 5. Утворення простого ефіру з 3-гідроксизаміщених хінолінів в умовах реакції Міцунобу (Mitsunobu) Розчин відповідним чином заміщеного гідроксихіноксаліну (при приблизно 0-25°С) у ТГФ обробляють 1екв. кожного з бажаних спиртів, трифенілфосфіном і нарешті діетилазодикарбоксилатом (DEAD) або відповідним еквівалентом. Хід реакції контролюють за допомогою ТШХ і по закінченні реакції (від приблизно 1 до приблизно 24 годин) суміш концентрують і залишок хроматографують на силікагелі з одержанням цільового продукту. 6. Деалкілування хіноліну або хіноксаліну, заміщеного нижчим алкокси з наступним алкілуванням Відповідний хінолін або хіноксалін, заміщений нижчим алкокси, (1екв.) у ДМФ обробляють надлишковою кількістю етантіолату натрію (звичайно приблизно 2 або більше еквівалентів) і реакційну суміш перемішують при нагріванні протягом приблизно 1-24 годин. Суміш розподіляють між водою і етилацетатом. Екстракційна обробка з наступною хроматографією, якщо необхідно, дає відповідний цільовий продукт: гідроксизаміщений хінолін або хіноксалін. Гідроксизаміщений хінолін або хіноксалін може бути алкілований із використанням умов реакції Міцунобу, докладно описаних вище. Альтернативно просте алкілування з використанням методів, добре відомих у даній області хімії, реакційно-здатним алкіл- або бензилгалогенідом із використанням NaH або іншої відповідної основи у відповідному розчиннику дає цільовий алкіловании продукт. 7. Окислення азоту в хіноліні або хіноксаліні до відповідного N-оксиду Іміновий (=N-) фрагмент у хіноліновій або хіноксаліновій сполуці формули (І) може бути перетворений у відповідну сполуку, в якій іміновий фрагмент окислений до N-оксиду, переважно взаємодією з перкислотою, наприклад пероцтовою кислотою в оцтовій кислоті або м-хлор-пероксибензойною кислотою в інертному розчиннику, такому, як дихлорметан, при температурі в межах від приблизно кімнатної температури до температури кипіння, переважно при підвищеній температурі. Сполуки згідно з даним винаходом можуть бути використані у формі вільної основи або вільної кислоти або у формі їх фармацевтично прийнятної солі. Усі форми охоплено обсягом даного винаходу. Коли сполуки згідно з даним винаходом заміщені основною групою, утворюються кислотно-адитивні солі, що є більш зручною формою для застосування; практично застосування сполуки у формі солі, власне кажучи, рівнозначно застосуванню сполуки у формі вільної основи. Кислоти, що можуть бути використані для одержання кислотно-адитивних солей, включають переважно ті, що при зв'язуванні з вільною основою утворюють фармацевтично прийнятні солі, тобто солі, аніони яких не токсичні для пацієнта у фармацевтичних дозах солей, завдяки чому корисні інгібуючі дії на PDGF, властиві вільній основі, і не викликають шкідливих побічних дій, обумовлених аніонами. Хоча фармацевтично прийнятні солі зазначених основних сполук є переважними, не всі кислотно-адитивні солі корисні в якості джерела форми вільної основи, навіть якщо конкретна сіль як така потрібна лише в якості проміжного продукту, як, наприклад, у випадку, коли сіль одержують лише для цілей очищення й ідентифікації або коли її використовують у якості проміжного продукту для одержання фармацевтично прийнятної солі іонообмінними методами. Фармацевтично прийнятними солями, включеними в обсяг даного винаходу, є солі, похідні від таких кислот: мінеральні кислоти, такі, як хлороводнева кислота, сірчана кислота, фосфорна кислота і сульфамінова кислота, і органічні кислоти, такі, як оцтова кислота, лимонна кислота, молочна кислота, винна кислота, малонова кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, циклогексилсульфамінова кислота, хінна кислота і подібні. Відповідні кислотно-адитивні солі включають такі: гідрогалогеніди, наприклад гідрохлорид і гідробромід, сульфат, фосфат, нітрат, сульфамат, ацетат, цитрат, лактат, тартарат, малонат, оксалат, саліцилат, пропіонат, сукцинат, фумарат, малеат, метилен-біс-b-гідроксинафтоат, гентизати, мезилати, изетиноати і ди-п-толуоїлтартратметансульфонат, етансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат і хінат, відповідно. Відповідно до іншої ознаки даного винаходу кислотно-адитивні солі сполук згідно з даним винаходом одержують взаємодією вільної основи з відповідною кислотою з застосуванням або адаптацією відомих методів. Наприклад, кислотно-адитивні солі сполук згідно з даним винаходом одержують або розчиненням вільної основи у водному або водно-спиртовому розчині або інших відповідних розчинниках, що містять відповідну кислоту, і виділенням солі випарюванням розчину, або взаємодією вільної основи і кислоти в органічному розчиннику, причому в цьому випадку сіль виділяється безпосередньо або вона може бути отримана шляхом концентрування розчину. Сполуки згідно з даним винаходом можуть бути регенеровані з кислотно-адитивних солей шляхом застосування або адаптації відомих методів. Наприклад, вихідні (родоначальні) сполуки згідно з даним винаходом можуть бути регенеровані з їхніх кислотно-адитивних солей обробкою лугом, наприклад водним розчином бікарбонату натрію або водним розчином аміаку. У випадку сполуки згідно з даним винаходом, заміщеної кислотною групою, можуть бути утворені основно-адитивні солі, що є більш зручною формою для застосування; практично застосування сполуки у формі солі, власне кажучи, рівнозначно застосуванню сполуки у формі вільної кислоти. Основи, що можуть бути використані для одержання основно-адитивних солей, включають переважно ті, що при з'єднанні з вільною кислотою дають фармацевтично прийнятні солі, тобто солі, катіони яких не токсичні для організму тварини у фармацевтичних дозах солей, завдяки чому корисна інгібуюча дія на PDGF, властива вільній кислоті, не супроводжується шкідливими побічними ефектами, обумовленими катіонам. Фармацевтично прийнятними солями, що включають, наприклад солі лужних і лужноземельних металів, в об'ємі даного винаходу є солі, похідні від таких основ: гідрид натрію, гідроксид натрію, гідроксид калію, гідроксид кальцію, гідроксид алюмінію, гідроксид літію, гідроксид магнію, гідроксид цинку, аміак, триметиламіак, триетиламіак, етилендіамін, н-метилглюкамін, лізин, аргінін, орнітин, холін, N,N'дибензилетилендіамін, хлорпрокаїн, діетаноламін, прокаїн, н-бензилфенетиламін, діетиламін, піперазин, тріс(гідроксиметил)амінометан, гідроксид тетраметиламмонію і подібні. Солі металів сполук згідно з даним винаходом можуть бути отримані контактуванням гідриду, гідроксиду, карбонату або подібної реакційноздатної сполуки обраного металу у водному або органічному розчиннику зі сполукою у формі вільної кислоти. Використовуваним водним розчинником може бути вода або суміш води з органічним розчинником, переважно спиртом, таким, як метанол або етанол, кетоном, таким, як ацетон, аліфатичним простим ефіром, таким, як тетрагідрофуран, або складним ефіром, таким, як етилацетат. Такі реакції звичайно проводять при температурі навколишнього середовища, але при необхідності їх можна проводити при нагріванні. Солі сполук з амінами згідно з даним винаходом можуть бути отримані контактуванням аміну у водному або органічному розчиннику зі сполукою у формі вільної кислоти. Відповідні водні розчинники включають воду і суміші води зі спиртами, такими, як метанол або етанол, простими ефірами, такими, як тетрагідрофуран, нітрилами, такими, як ацетонітрил, або кетонами, такими, як ацетон. Аналогічним способом можуть бути о тримані солі з амінокислотами. Сполуки згідно з даним винаходом можуть бути регенеровані з основно-адитивних солей шляхом застосування або адаптації відомих методів. Наприклад, вихідні (родоначальні) сполуки згідно з даним винаходом можуть бути регенеровані з їхніх основно-адитивних солей обробкою кислотою, наприклад хлороводневою кислотою. Крім користі, як таких, у якості активних сполук, солі сполук згідно з даним винаходом корисні також для очищення сполук, наприклад із використанням різниці в розчинності між солями і родоначальними сполуками, побічними продуктами і/або вихідними матеріалами, методами, добре відомими фахівцям у даній області хімії. Сполуки згідно з даним винаходом можуть містити асиметричні центри. Ці асиметричні центри можуть незалежно мати R або S конфігурацію. Для фахівців у даній області хімії очевидно також, що деякі сполуки формули І можуть мати геометричну ізомерію. Геометричні ізомери включають цис- і трансформи сполук згідно з даним винаходом, тобто сполуки, що мають алкенільні фрагменти або замісники в кільцевих системах. Крім того, біциклічні кільцеві системи включають ендо- і екзоізомери. Даний винахід охоплює окремі геометричні ізомери, стереоізомери, енантіомери і їх суміші. Такі ізомери можуть бути виділені з їхніх сумішей шляхом застосування або адаптації відомих методів, наприклад методів хроматографії і методів перекристалізації, або можуть бути отримані окремо з відповідних ізомерів їхніх проміжних сполук, наприклад шляхом застосування або адаптації методів, описаних у даному описі. Вихідні матеріали і проміжні сполуки одержують шляхом застосування або адаптації відомих методів, наприклад таких, як описані в посилальних прикладах, або їхніх очевидних хімічних еквівалентів, або методами, описаними відповідно до винаходу в даному описі. Даний винахід далі проілюстрований прикладами, що не обмежують його обсяг і описують одержання сполук згідно з даним винаходом. Крім того, що наступні приклади означають способи, використовувані для синтезу сполук згідно з даним винаходом. Приклад 1 2-(3-фторфеніламіно)-6,7-діетоксихіноксалін До 0,25г (0,989мМоль) 2-хлор-6,7-діетоксихіноксаліну добавляють 2мл м-фтораніліну. Цю суміш нагрівають в атмосфері протягом ночі до 120°С. Одержану суміш хроматографують (СН2СI2:ЕtOН=30:1) з одержанням частково очищеного продукту. Цю тверду речовину розтирають із етилацетатом з одержанням 0,175г продукту у вигляді коричнювато-жовтої твердої речовини з виходом 54,1% (т.пл. 193°С). Елементний аналіз. Обчислено для C18H18N3O 2F*0,25Н2О: С, 65,15; Н, 5,62; N, 12,66. Знайдено: С, 65,30; Н, 5,30; N, 12,41. Приклад 2 2-аніліно-6-метоксихіноксалінгідрохлорид До 2-хлор-6-метоксихіноксаліну (0,93г, 4,8мМоль) в атмосфері аргону добавляють анілін (1,3мл, 14,3мМоль). Реакційну суміш нагрівають при 120°С протягом 2 годин, а потім при 150°С протягом 1,5 годин. Суміш охолоджують і добавляють СН 2СІ2. Отриману суспензію перемішують і оранжеву тверду речовину відфільтровують, промивають сумішшю CH2Cl2-Et2О і потім інтенсивно перемішують у Н2 О протягом 40 хвилин, фільтрують і промивають Et2O з одержанням світло-жовтої твердої речовини. Наступні сполуки одержують аналогічним способом із відповідного вихідного матеріалу. 2-(3-карбамоїлфеніламіно)-6-метоксихіноксалін, т.пл. 247°С. Елементний аналіз. Обчислено для C16H14N4 O2*0,25Н2О: С, 64,31; Н, 4,89; N, 18,75. Знайдено: С, 64,24; Н, 5,04; N,18,75; 2-(2-фторфеніламіно)-6,7-діетоксихіноксалін, т.пл. 184°С. Елементний аналіз. Обчислено для C18H18FN 3O2 : С, 66,04; Н, 5,54; F, 5,80; N, 12,84. Знайдено: С, 65,75; Н, 5,61; N, 12,68; 2-(3-трифторметилфеніламіно)-6,7-діетоксихіноксалін, т.пл. 158°С. Елементний аналіз. Обчислено для C19H18F 3N3O 2: С, 60,47; Н, 4,81; F, 15,10; N, 11,14. Знайдено: С, 60,27; Н, 4,84; N, 10,97; (6-метоксихіноксалін-2-іл)-(3-метилфеніл)амін, т.пл. 133-135°С. Елементний аналіз. Обчислено для C16H15N3 O: С, 72,43; Н, 5,70; N, 15,84. Знайдено: С, 72,43; Н, 5,79; N, 15,77; 6-метокси-2феніламінохіноксалін, т.пл. 152-153°С. Елементний аналіз. Обчислено для C15H13N3O: С, 71,70; Н, 5,21; N, 16,72. Знайдено: С, 71,70; Н, 5,16; N, 16,80; 2-аніліно-6-етоксихіноксалін, т.пл. 118-120°С. Елементний аналіз. Обчислено для C16H15N3O*0,63Н2О: С, 69,48; Н, 5,92; N, 15,19. Знайдено; С, 69,24; Н, 5,97; N, 15,14; 2-(3-метоксифеніламіно)-6, 7-діетоксихіноксалін, т.пл. 173°С. Елементний аналіз. Обчислено для С19Н21N3 О3: С, 67,24; Н, 6,24; N, 12,38. Знайдено: С, 67,02; Н, 6,23; N, 12,21; 2-(4-фторфеніламіно)-6,7-діетоксихіноксалін, т.пл. 242°С. Елементний аналіз. Обчислено для C18H18FN 3O2 ·0,50Н2О: С, 64,27; Н, 5,69; N, 12,49. Знайдено: С, 64,21; Н, 5,39; N, 12,24; 2-феніламіно-6,7-діетоксихіноксалін, т.пл. 239°С; (6,7-диметоксихіноксалін-2-іл)-(3-фторфеніл)амін, т.пл.99-100°С. Елементний аналіз. Обчислено для C16H14FN 3O3 : С, 64,21; Н, 4,71; F, 6,35; N, 14,04. Знайдено: С, 64,35; Н, 4,61; N,13,84; 2-(3-фторфеніламіно)-6,7-діетоксихіноксалін, т.пл. 193°С. Елементний аналіз. Обчислено для C18H18FN 3O2 ·0,25Н2О: С, 65,15; Н, 5,62; N, 12,66. Знайдено: С, 65,30; Н, 5,30. (3-бромфеніл)-(6,7-диметоксихіноксалін-2-іл)амін, т.пл. 197-198°С. Елементарний аналіз. Обчислено для C16H14BrN3O 2: С, 53,35; Н, 3,92; Вr, 22,18; N, 11,67. Знайдено: С, 53,39; Н, 3,82; N, 11,64; (6,7-диметоксихіноксалін-2-іл)феніламін, т. пл. 88-90°С. Елементний аналіз. Обчислено для C 16H15N3O2: С, 68,31; Н, 5,37; N, 14,94. Знайдено: С, 68,02; Н, 5,52; N,14,91; і (3-хлорфеніл)-(6,7-диметоксихіноксалін-2-іл) амін, т.пл. 187-188°С. Елементний аналіз. Обчислено для C18H14CIN3 O2: С, 60,86; Н, 4,47; СІ, 11,23; N, 13,31. Знайдено: С, 60,85; Н, 4,59, N, 12,36. Приклад 3 2-бензиламіно-6,7-діетоксихіноксалін До 0,3г (1,19мМоль) 2-хлор-6,7-діетоксихіноксаліну добавляють 2мл бензиламіну. Цю суміш нагрівають в атмосфері азоту протягом ночі до 120°С. Одержану суміш розподіляють між СН 2Сl2 і насиченим розчином NaHCO3. Органічний шар концентрують і залишок хроматографують (CH2Cl:EtOH=30:1) з одержанням 0,337г продукту у вигляді жовтої твердої речовини з виходом 87,6% (т.пл. 136°С). Елементарний аналіз. Обчислено для C19H21N3O2 : С, 70,57; Н, 6,54; N, 12,99. Знайдено: С, 70,54; Н, 6,66; N, 12,80. Наступні сполуки одержують аналогічним способом із відповідних вихідних матеріалів. (3-бромбензил)-(6,7-диметоксихіноксалін-2-іл)амін, т.пл. 199-206°С. Елементний аналіз. Обчислено для C17H16BrN3 O2: С, 54,56; Н, 4,31; Вr, 21,35; N, 11,23. Знайдено: С, 49,90; Н, 4,00; N, 10,14; Бензил-(6,7-диметоксихіноксалін-2-іл)амін, т.пл. 210-214°С. Елементарний аналіз. Обчислено для C17H17N3 O2: С, 69,14; Н, 5,80; N, 14,23. Знайдено: С, 61,78; Н, 5,47; N, 12,64; і 2-бензиламіно-6,7-діетоксихіноксалін, т.пл. 136°С. Елементний аналіз. Обчислено для C19H21N3O2 : С, 70,57; Н, 6,55; N, 12,99. Знайдено: С, 70,54; Н, 6,66; N, 12,80. Приклад 4 2-((R)-a-метилбензиламіно)-6,7-діетоксихіноксалін До 0,3г (1,19мМоль) 2-хлор-6,7-діетоксихіноксаліну добавляють 2мл (R)-(+)-a-метилбензиламіну. Цю суміш нагрівають в атмосфері азоту протягом трьох днів до 120°С. Отриману суміш розподіляють між СНСІ3 і насиченим розчином NaHCO3. Органічний шар концентрують і залишок хроматографують (СН2СІ2:ЕtOН=30:1) з одержанням 0,118г продукту у вигляді жовтої твердої речовини з виходом 29,4% (т.пл. 55-56°С). Елементний аналіз. Обчислено для C20H23N3O2 ·0,25Н2О: С, 70,26; Н, 6,93; N, 12,29. Знайдено: С, 70,56; Н, 6,80; N, 12,35. Наступну сполуку одержують аналогічним способом із відповідних ви хідних матеріалів. 2-((S)-a-метилбензиламіно)-6,7-діетоксихіноксалін, т.пл. 55-58°С. Елементний аналіз. Обчислено для C20H23N3 O2·0,25Н2О: С, 70,26; Н, 6,93; N, 12,29. Знайдено: С, 70,49; Н, 6,89; N, 12,23. Приклад 5 2,7-бісциклогексилокси-6-метоксихіноксалін До розчину NaH (0,32г, 8мМоль) у ДМФ (5мл) в атмосфері добавляють краплями циклогексанол (0,7мл, 6,7мМоль). Суміш перемішують при кімнатній температурі протягом 25 хвилин, після чого добавляють порціями 2-хлор-6,7-диметоксихіноксалін. Реакційну суміш перемішують 15 хвилин при кімнатній температурі, 2 години при 90°С і 1 годину при 110°С. Суміш охолоджують, гасять додаванням Н 2О. Органічний шар промивають водою і розсолом, сушать (MgSO4) і хроматографують (10% ЕtOАс/гексан) з одержанням воскоподібної білої твердої речовини (т.пл. 75-78°С). Елементний аналіз. Обчислено для C21H28N2 O3: C, 70,76; Н, 7,92; N, 7,86. Знайдено: С, 70,81; Н, 7,79; N, 7,70. Наступну сполуку одержують аналогічним чином із відповідних вихідних матеріалів. 2-фенокси-6метоксихіноксалін, т.пл. 79-81°С; і 6,7-діетокси-2-феноксихіноксалін, т.пл. 130-131°С. Елементний аналіз. Обчислено для C18H18N2O3 : С, 69,66; Н, 5,85; N, 9,03. Знайдено: С, 69,53; Н, 5,82; N, 8,91. Приклад 6 Циклогексил-(6,7-диметоксихіноксалін-2-ілметил)амін До 0,067М розчину 6,7-диметокси-2-хіноксалінкарбоксальдегида в суміші (2:1) МеОН-1,2-ди хлоретан (7,5мл, 0,5мМоль) добавляють циклогексиламін (0,11мл, 0,9мМоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі, після чого добавляють NaBH4 (0,038г, 1мМоль) і перемішують реакційну суміш протягом ночі. Потім суміш концентрують і хроматографують (50% EtOAc/гексан приблизно 5% МеОН у EtOAc/гексан). Масло розчиняють у суміші EtOAc/гексан і обробляють НСI у ЕtOН). Отриманий розчин концентрують і твердий продукт розтирають з одержанням білої твердої речовини після висушування у вакуумі при 60%С (т.пл. 185-190°С, розклад.). Елементний аналіз. Обчислено для С17Н23N3 О2·НСІ: С, 60,44; Н, 7,16; N, 12,44. Знайдено: С, 60,48; Н, 6,88; N, 12,07. Приклад 7 Циклогексил-(6-метокси-7-морфолін-4-іл-хіноксалін-2-іл)амін Використовують методику, описану в Buchwald, et al, J. Am. Chem. Soc, 1996, 118, 7215. До толуолового розчину 2-циклогексиламіно-6-метокси-7-бромхіноксаліну (0,1г, 0,3мМоль) в атмосфері аргону добавляють морфолін (0,1г, 0,3мМоль, трет-бутоксид натрію (0,04г, 0,42мМоль) S-(-)-BINAP (кат., 0,001г) і Pd(dba)2 (кат., 0,001г). Реакційну суміш нагрівають до 80°С протягом ночі. Суміш охолоджують, розбавляють Et2O, фільтрують, концентрують і хроматографують (50% ЕtOАс/гексан). Продукт перекристалізовують із суміші EtOAc/гексан з одержанням (у двох зборах) жовтої твердої речовини (т.пл. 194-196°С). Елементний аналіз. Обчислено для C19H26N4O2 : С, 66,64; Н, 7,65; N, 16,36. Знайдено: С, 66,60; Н, 7,60; N, 16,51. Приклад 8 3-циклогексилокси-6,7-диметоксихінолін До ТГФ розчину (30мл) при 0°С добавляють 3-гідрокси-6,7-диметоксихінолін (0,237г, 1,15мМоль), циклогексанол (0,347г, 3,46мМоль), Ph3P (0,908г, 3,46мМоль). Порціями добавляють діетилазодикарбоксилат, поки розчин не набуде темно-червоного кольору (0,663г, 3,81мМоль). Через 4 години розчин концентрують і залишок хроматографують (50% EtOAc у гексані). Продукт перекристалізовують із суміші ізопропанол/гексан з одержанням хлороводневої солі у вигляді білої твердої речовини (т.пл. 229-232°С, розклад.). Приклад 9 2-аніліно-6-хіноксалінол Методом, описаним у Feutrill, G.I.: Mirrington, R.N. Tet. Lett. 1970, 1327, перетворюють арилметиловий ефір у похідну фенолу. До 2-аніліно-6-метоксихіноксаліну (0,27г, 1,07мМоль) в атмосфері аргону в ДМФ добавляють натрієву сіль етантіолу (0,19г, 2мМоль). Реакційну суміш нагрівають до 110°С протягом ночі. Суміш концентрують і розподіляють між attic і сумішшю Н 2О/5% винна кислота, так що рН водного шару стає рівним приблизно 4. Органічний шар промивають водою (4 рази) і потім 2,5% NaOH (4 рази). Основні шари об'єднують, промивають EtOAc (2 рази), знову підкислюють 5%-ний винною кислотою і багаторазово промивають порціями EtOAc. Органічні шари об'єднують, промивають розсолом, сушать (Na2SO4) і концентрують. Отриману тверду речовину хроматографують (50% EtOAc/гексан). Шляхом розтирання продукту з Et2 O одержують зразок для аналізу у вигляді жовтого порошку (т.пл. 211-213°С). Елементний аналіз. Обчислено для C14H11N3O: С, 70,88; Н, 4,67; N, 17,71. Знайдено: С, 70,64; Н, 4,85; N, 17,58. Приклад 10 Феніл-[6-(тетрагідрофуран-3(R)-ілокси)хіноксалін-2-іл]амін До ТГФ розчину при 0°С в атмосфері аргону добавляють 2-аніліно-6-хіноксалінол (0,23г, 0,97мМоль). Добавляють порціями (S)-(+)-3-гідрокситетрагідрофуран (0,086мл, 1,3мМоль) і трифенілфосфін (0,31г, 1,2мМоль). Добавляють порціями DEAD (0,18мл, 1,2мМоль). Реакційній суміші дають зігрітися до кімнатної температури і перемішують 1,5 години. Суміш концентрують і розподіляють між EtOAc і Н2О. Органічний шар промивають водою, розсолом, сушать (MgSO 4 і концентрують. Отримане жовте масло хроматографують (50% EtOAc/гексан) і розчиняють у Et2O/IPA (ізопропанол). Добавляють краплями розчин HCl/Et2O і отриманий червоно-оранжевий порошок висушують у вакуумі. Порошкоподібний продукт перетворюють у вільноосновну форму, перемішуючи в МеОН із промитої (3хН2О, 5 хМеОН) основною іонообмінною смолою. Суміш перемішують 30 хвилин, фільтрують, концентрують і перекристалізовують із суміші EtOAc/гексаы з одержанням (у двох зборах) продукту (т.пл. 173-175°С). Елементний аналіз. Обчислено для C18H17N3O2 : C, 70,35; Н, 5,57; N, 13,67. Знайдено: С, 70,19; Н, 5,60; N, 13,66. Приклад 11 2-аніліно-6-ізопропоксихіноксалінгідрохлорид До NaH (0,033г, 0,84мМоль) в атмосфері аргону добавляють 1мл ДМФ. Добавляють порціями 2-анілін6-хіноксалінол (0,1г, 0,42мМоль) у 1,5мл ДМФ. Через 30 хвилин добавляють краплями 2-бромпропан і розчин нагрівають до 50°С протягом 1,5 годин. Охолоджену реакційну суміш гасять водою і розподіляють між EtOAc і Н2О, промивають Н 2О (3 рази), розсолом, сушать (MgSO4) і концентрують. Отриманий залишок хроматографують (30% EtOAc/гексан) з одержанням 0,05г діалкілованого продукту і 0,1г зазначеної в заголовку сполуки. Аналітичний зразок хлороводневої солі одержують додаванням ІРА/НСІ до Et2O/ІРА розчину вільної основи з одержанням хлороводневої солі (т.пл. 205-210°С, розклад.). Елементний аналіз. Обчислено для C17H17N3O HCL: С, 64,65; Н, 5,74; N, 13,31. Знайдено: С, 64,51; Н, 5,90; N, 13,09. Приклад 12 3-циклогексилокси-6,7-диметоксихимоксалину 1-оксид Суміш 2-циклогексилокси-6,7-диметоксихіноксаліну (110мг, 0,38мМоль) і метахлорбензойної перкислоти (70%, 113мг, 0,46мМоль) і 10мл метиленхлориду перемішують при кімнатній температурі протягом дня. Після фільтрування розчин концентрують і залишок хроматографують на силікагелі (20% етилацетатгексан) з одержанням цільового продукту (т.пл. 167-169°С). Аналогічним чином одержують транс-4-(6,7-диметокси4-оксихіноксалін-2-іламіно) циклогексанол (т.пл. 220-222°С). Елементний аналіз. Обчислено для C16H21N3 O4·0,2Н2 О: С, 59,42; Н, 6,69; N, 12,99. Знайдено: С, 59,43; Н, 6,64; N, 12,95. Приклад 1 одержання проміжної сполуки 4-бром-5-метоксибензол-1,2-діамінгідрохлорид До розчину EtOAc (50мл) і 5-бром-4-метокси-2-нітрофеніл-аміну (2,5г, 10мМоль) в атмосфері аргону добавляють 5% Pd/C (0,5г). Реакційну суміш гідр ують при тиску 50фунт/кв.дюйм (3,5кг/см 2) протягом 1 години. Суміш фільтрують через Целіт у розчин НСІ/ІРА/EtOAc і шар Целіту промивають додатковим EtOAc. Отриманий осад відфільтровують з одержанням білої твердої речовини. Приклад 2 одержання проміжної сполуки 7-бром-6-метоксихіноксалін-2-ол і 6-бром-7-метоксихіноксалін-2-ол До розчину МеОН (15мл) в атмосфері аргону добавляють подрібнені в порошок гранули NaOH (0,86г, 51мМоль) і 4-бром-5-метоксибензол-1,2-діаміндигідрохлорид (2,7г, 9,3мМоль). Суміш перемішують 10 хвилин, після чого добавляють порціями розчин 45% етиленгліоксалату в толуолі (2,7г, 12мМоль). Реакційну суміш кип'ятять із зворотним холодильником протягом 1 години, після чого охолоджують. Добавляють воду і потім суспензію фільтрують. Отриману тверду речовину промивають послідовно Н 2О, МеОН, ІРА і Et 2O з одержанням жовтого порошку. Приклад 3 одержання проміжної сполуки 7-бром-2-хлор-6-метоксихіноксалін і 6-бром-2-хлор-7-метоксихіноксалін До суміші 7-бром-6-метоксихіноксалін-2-олу і 6-бром-7-метоксихіноксалін-2-олу (1г, 3,9мМоль) добавляють РОСІ3 (5мл). Реакційну суміш кип'ятять із зворотним холодильником протягом 1 години, виливають у крижану воду, фільтрують і потім промивають водою з одержанням світло-рудуватокоричневої твердої речовини. Відношення 7-бром-2-хлор-6-метоксихіноксалін: 6-бром-2-хлор-7метоксихіноксалін дорівнює приблизно 7:1 відповідно до аналізу методом 1Н ЯМР. Приклад 4 одержання проміжної сполуки 5-хлор-4-метокси-2-нітроанілін До розчину N-[-(5-хлор-4-метокси-2-нітрофеніл)ацетаміду (2г, 8,2мМоль) у 5н. НСI (20мл) добавляють 1,4-діоксан (10мл) і суміш перемішують при 60°С протягом 1,5 годин. Реакційну суміш концентрують і розподіляють між EtOAc і 2н. NaOH. Водні шари промивають EtOAc (3 рази), розсолом, сушать (MgSO 4), адсорбують на силікагель і хроматографують (70% EtOAc/гексан) з одержанням оранжевого порошку. Приклад 5 одержання проміжного продукту 4-хлор-5-метоксибензол-1,2-діаміндигідрохлорид До розчину EtOAc (25мл) і 5-хлор-4-метокси-2-нітрофеніл-аміну (1,6г, 7,9мМоль) в атмосферу аргону добавляють 5% Pd/C (0,5г). Реакційну суміш гідр ують при тиску 50фунт/кв.дюйм (3,5кг/см 2) протягом 1 години. Суміш фільтрують в атмосфері азоту через Целіт у розчин 1н. HCl/Et2O у EtOAc і шар Целіту промивають додатковим EtOAc. Отриманий осад відфільтровують з одержанням білої твердої речовини. Приклад 6 одержання проміжної сполуки 7-хлор-6-метоксихіноксалін-2-ол і 6-хлор-7-метоксихіноксалін-2-ол До розчину 4-хлор-5-метоксибензол-1,2-діаміндигідрохлориду (1,8г, 7,2мМоль) у EtOAc (15мл) в атмосфері аргону добавляють TEA (триетаноламін) (2,5мл, 18мМоль) при 0°С. Суміш перемішують 20 хвилин, після чого добавляють порціями розчин 45% етиленгліоксалату в толуолі (2,1г, 9,3мМоль). Реакційну суміш нагрівають до кімнатної температури, кип'ятять із зворотним холодильником протягом 1,5 годин, після чого охолоджують. Добавляють воду і потім суспензію фільтрують і промивають послідовно Н2О, ІРА і Et2O з одержанням світло-жовтого порошку. Продукт декілька разів азеотропують із толуолом і висушують у вакуумі перед застосуванням. Приклад 7 одержання проміжної сполуки 2,7-дихлор-6-метоксихіноксалін і 2,6-дихлор-7-метоксихіноксалін До суміші 7-хлор-6-метоксихіиоксалін-2-олу і 6-хлор-7-метоксихіноксалін-2-олу (1г, 4,7мМоль) із використанням хлор-кальцієвої (СаСI2) трубки добавляють РОСI3 (5мл). Реакційну суміш кип'я тять із зворотним холодильником протягом 30 хвилин, виливають у холодний насичений розчин NaHCO3, фільтрують і потім промивають водою з одержанням твердої речовини. Співвідношення 2,7-дихлор-6метоксихіноксалін: 2,6-дихлор-7-метоксихіноксалін становить приблизно 6:1 відповідно до аналізу методом 1 H ЯМР. Сполуки формули І, як описано вище, інгібують проліферацію клітин і/або продукування клітинного матриксу, і/або пересування клітин (хемотаксис) за допомогою інгібування активності тирозинкінази PDGFR. Некероване розмноження клітин, перепродукування матриксу або погано регульована запрограмована загибель клітин (апоптоз) викликають багато хворобливих станів. У ці хворобливі стани залучені найрізноманітніші типи клітин і вони включають такі захворювання, як лейкоз, рак, гліобластома, псоріаз, запальні хвороби, захворювання кісток, фібрози, атеросклероз і рестеноз, що трапляється після ангіопластики коронарних, стегнови х або ниркових артерій, або фібропроліферативне захворювання, таке, як артрит, фіброз легень, нирки і печінки. Зокрема, як було повідомлено, PDGF і PDGF-R бер уть участь у деяких типах раків і пухлин, таких як рак головного мозку, рак яєчників, рак товстої кишки, рак передміхурової залози, рак легень, саркома Капоші і злоякісна меланома. Крім того, після коронарного шунтування створюються умови клітинної проліферації з порушеною регуляцією. Вважають, що інгібування активності тирозинкінази буде корисним у регуляції некерованого репродукування клітин, перепродукування матриксу або погано регульованої запрограмованої загибелі клітин (апоптоза). Даний винахід стосується модулювання і/або інгібування передачі сигналів у клітинах, проліферації клітин, продукування клітинного матриксу, пересування клітин (хемотаксису), регуляції аномального росту клітин і запальної реакції клітин. Більш конкретно даний винахід стосується застосування заміщених хінолінів і хіноксалінів, що мають здатність селективно інгібувати диференціацію, проліферацію, продукування матриксу, хемотаксис або вивільнення медіатора шляхом ефективного інгібування активності тирозинкінази рецептора тромбоцитарного фактора росту (PDGF-R). Ініціювання ауто фосфорилювання, тобто фосфорилювання самого рецептора фактора росту, і фосфорилювання хазяїна внутрішньоклітинних субстратів є біохімічним процесом, що залучається до передачі сигналів у клітинах, проліферацію клітин, продукування матриксу, хемотаксис і вивільнення медіатора. Завдяки ефективному інгібуванню активності тирозинкінази Lck, сполуки згідно з даним винаходом також корисні при лікуванні опору трансплантації й автоімунних захворювань, таких, як ревматоїдний артрит, розсіяний склероз і системна червона волчанка, при відторгненні трансплантата, при стані, названому "трансплантат проти хазяїна" при гіперпроліферативних порушеннях, таких, як пухлини і псоріаз і при захворюваннях, у яких клітини приймають про-запальні сигнали, таких, як астма, запальна хвороба кишечнику і панкреатит. Для лікування опору трансплантації сполуки згідно з даним винаходом можуть бути використані або профілактично, або у відповідь на несприятливу реакцію людини на пересаджений орган або тканину. При профілактичному застосуванні сполуку згідно з даним винаходом вводять пацієнту або в тканину, що пересаджується, або орган перед операцією трансплантації. Профілактичне лікування може також включати введення лікарського засобу після операції трансплантації, але до виявлення яких-небудь ознак несприятливої реакції на трансплантацію. При введенні у відповідь на несприятливу реакцію сполуку згідно з даним винаходом вводять безпосередньо пацієнту, щоб протистояти опорові трансплантації після виявлення зовнішніх ознак опору. Відповідно до іншої ознаки даного винаходу пропонується спосіб лікування пацієнта, що страждає або піддається станам, що можуть бути ослаблені або відвернені введенням інгібітора активності тирозинкінази PDCF-R і/або активності тирозинкінази Lck, наприклад, описаним вище станам, який включає введення пацієнту е фективної кількості сполуки формули І або композиції, що містить сполуку формули І, або її фармацевтично прийнятної солі. Використовуваний у даному описі термін «лікування» включає як профілактичну терапію, так і лікування станів, що розвилися. Даний винахід охоплює фармацевтичні композиції, що містять фармацевтично прийнятну кількість принаймні однієї зі сполук формули І разом із фармацевтично прийнятним носієм, наприклад допоміжною речовиною, розріджувачем, покриттям і наповнювачем. На практиці сполуки або композиції для лікування відповідно до даного винаходу можуть бути введені будь-яким із багатьох відповідних способів, наприклад шляхом інгаляції, місцево, парентерально, ректально або перорально; більш переважним є пероральный спосіб введення. Більш конкретні способи введення включають внутрішньовенний, внутрішньом'язовий, підшкірний, внутрішньоочний, внутрішньосуглобовий, у товсту кишку, перитонеальний, трансепітеліальний, включаючи черезшкірний, офтальмологічний, під'я зичний, трансбукальний, дермальний, окулярний, інгаляційний у ніс шляхом інсуфляції і аерозольний. Сполуки формули І можуть бути подані у формах, що дозволяють введення найбільш відповідним способом, і винахід стосується також фармацевтичних композицій, що містять принаймні одну сполуку згідно з даним винаходом, придатних для застосування в якості лікарського засобу для пацієнта. Ці композиції можуть бути приготовлені звичайними методами з використанням однієї або декількох фармацевтично прийнятних допоміжних речовин або наповнювачів. Допоміжні речовини включають, крім іншого, розріджувачі, стерильні водні середовища і різні нетоксичні органічні розчинники. Композиції можуть перебувати у формі таблеток, пігулок, гранул, порошків, водних розчинів або суспензій, розчинів для ін'єкції, еліксирів або сиропів і можуть містити одну або декілька речовин, обраних із групи, що містить підсолоджувальні агенти, такі, як сахароза, лактоза, фруктоза, сахарин або Нутрасвіт (NutrasweetÒ), коригенти, такі, як м'ятне масло, вінтергренове масло або вишневі чи апельсинові коригенти, барвники або стабілізатори, такі, як метил- або пропілпарабен, для одержання фармацевтично прийнятних препаратів. Вибір носія й утримування активної речовини в носії звичайно визначають відповідно до розчинності і хімічних властивостей продукту, конкретним способом введення і запобіжних заходів, застосовуваним у фармацевтичній практиці. Наприклад, для виготовлення таблеток, пастилок, пігулок, капсул і подібних препаративних форм можуть бути використані наповнювачі, такі, як лактоза, цитрат натрію, карбонат кальцію, фосфат дикальцію і розпушувальні речовини, такі, як крохмаль, альгінові кислоти і деякі комплексні силікагелі, об'єднані зі змащувальними речовинами, такими, як стеарат магнію, лаурилсульфат натрію і тальк. Для приготування капсул доцільно використовува ти лактозу і рідкий носій, такий, як високомолекулярні поліетиленгліколі. Різні інші матеріали можуть бути присутні у якості покриттів або для якоїсь іншої зміни фізичної форми дозованої одиниці. Наприклад, таблетки, пілюлі або капсули можуть бути покриті шелаком, цукром або тим і іншим. При використанні водних суспензій вони можуть містити емульгуючі речовини або речовини, що сприяють утворенню суспензії. Можуть бути також використані розріджувачі, такі, як сахароза, етанол, поліоли, такі, як поліетиленгліколь, пропіленгліколь і гліцерин, і хлороформ або їх суміші. Крім того, активна сполука може бути включена в композиції і препаративні форми з продовженою дією. При пероральному введенні активна сполука може бути введена, наприклад, з інертним розріджувачем або з засвоюваним їстівним носієм, може бути включена у тверді або м'які желатинові капсули, може бути спресована в таблетки або може бути введена безпосередньо з їжею або об'єднана з наповнювачем і використана у формі таблеток, що проковтуються, букальних таблеток, пастилок, капсул, еліксирів, суспензій, сиропів, облаток і подібних. Для парентерального введення використовують емульсії, суспензії або розчини сполук згідно з даним винаходом в рослинному маслі, наприклад кунжутному, арахісовому або маслиновому маслі, або водноорганічні розчини, такі, як вода і пропіленгліколь, у використовуваних для ін'єкцій органічних складних ефірах, таких, як етилолеат, а також стерильні водні розчини фармацевтично прийнятних солей. Ін'єкційні форми повинні бути настільки текучими, щоб їх можна було легко вводити за допомогою шприца, причому належна текучість може бути забезпечена, наприклад, шляхом застосування оболонки, такої, як лецитин, шляхом забезпечення необхідного розміру часток у випадку дисперсії і шляхом застосування поверхневоактивних речовин. Пролонговане всмоктування ін'єкційних композицій може бути забезпечене шляхом застосування засобів, що затримують всмоктування, наприклад моностеарату алюмінію і желатину. Розчини солей продуктів згідно з даним винаходом особливо придатні для введення шляхом внутрішньом'язової або підшкірної ін'єкції. Розчини активної сполуки у вигляді вільної основи або фармакологічно прийнятної солі можуть бути придатні у воді, підхожим чином змішаній з поверхневоактивною речовиною, такою, як гідроксипропілцелюлоза. Може бути також приготовлена дисперсія в гліцерині, рідких поліетиленгліколях і їх сумішах і в маслах. Водні розчини, що містять також розчини солей у чистій дистильованій воді, можуть бути використані для внутрішньовенного введення за умови, що їх рН належним чином відрегульований, що їм додані належні буферні властивості і вони зроблені ізотонічними за допомогою достатньої кількості глюкози або хлориду натрію і що вони стерилізовані шляхом нагрівання, опромінення, мікрофільтрування і/або за допомогою різних антибактеріальних і протигрибкових засобів, наприклад парабенів, хлорбутанолу, фенолу, сорбінової кислоти, тимеросалу і подібних. Стерильні ін'єкційні розчини готують шляхом введення активної сполуки в необхідній кількості у відповідний розчинник із різними іншими компонентами, переліченими вище, коли вони потребуються, із наступною стерилізацією фільтруванням. Звичайно дисперсії готують шляхом введення різних стерилізованих активних компонентів у стерильний носій, що містить основне середовище дисперсії й інші необхідні компоненти з тих, що зазначені вище. У випадку стерильних порошків для приготування стерильних ін'єкційних розчинів переважними методами приготування є вакуумне сушіння і ліофільне сушіння, що дають порошок активної складової плюс будь-яку іншу необхідну складову із попередньо стерильно відфільтрованого розчину. Для місцевого введення можуть бути використані гелі (на основі води або спирту), креми або мазі, що містять сполуки згідно з даним винаходом. Сполуки згідно з даним винаходом можуть бути також введені в гелеву або матричну основу для нанесення на пластир, яка могла б забезпечити можливість регульованого вивільнення сполуки крізь черезшкірний бар'єр. Для введення шляхом інгаляції сполуки згідно з даним винаходом можуть бути розчинені або суспендовані у відповідному носії для застосування в розпилювачі або для суспензії, або розчинів в аерозольній формі або можуть бути абсорбовані чи адсорбовані на відповідному твердому носії для застосування в інгаляторі для сухого порошку. Тверді композиції для ректального введення включають супозиторії, що виготовлені відповідно до відомих методів і містять принаймні одну сполуку формули І. Композиції згідно з даним винаходом можуть бути також приготовлені з забезпеченням опору швидкому виведенню через стінки судини (артерії або вени) шляхом конвекції і/або дифузії, завдяки чому збільшується час перебування вірусних часток у бажаному місці дії. Для продовженого вивільнення може бути використане періадвентиційне депо, що містить сполуку згідно з даним винаходом. Одним таким придатним депо для введення сполуки згідно з даним винаходом може бути співполімерна матриця, така, як етилен-вінілацетат, або гель полівінілового спирту, оточений оболонкою із Силастика (Silastic). Альтернативно, сполука згідно з даним винаходом може бути доставлена локально із силіконового полімеру, імплантованого в адвентиційну оболонку. Альтернативний спосіб мінімізації вимивання сполуки згідно з даним винаходом під час черезшкірної трансваскулярної доставки включає застосування недифузійних мікрочастинок, що виділяють лікарський засіб. Мікрочастинки можуть бути складені із найрізноманітніших синтетичних полімерів, таких, як, наприклад, полілактид, або природних речовин, що включають білки і полісахариди. Такі мікрочастинки забезпечують можливість оперативного маніпулювання змінними, що включають сумарну дозу лікарського засобу і кінетику її вивільнення. Мікрочастинки можна ефективно вводити через артеріальну або венозну стінку за допомогою пористого балонного катетера або балона на стенті (розширювачі) і утримувати в стінці судини і періадвентиціальній тканині протягом, принаймні, близько двох тижнів. Препаративні форми і методики локальної доставки лікарських засобів у конкретне місце всередині судини описані в роботі Reissen et al. (J. Am. Coil. Cardlol. 1994; 23; 1234-1244), включеній у даний опис у якості посилання. Композиція згідно з даним винаходом може також містити гідрогель, приготовлений із будь-якого біосумісного або нецитотоксичного (гомо або гетеро) полімеру) такого, як гідрофільний полімер поліакрилової кислоти, що може діяти як губка, що усмоктує лікарський засіб. Такі полімери уже описані, наприклад, у заявці WO 93/08845, що включена в даний опис у якості посилання. Деякі з них, такі, зокрема, як ті, що отримані з етилену і/або пропіленоксиду, комерційно доступні. При застосуванні сполук згідно з даним винаходом для лікування патологій, зв'язаних із гіперпроліферативними порушеннями, ці сполуки можуть бути введені різними шляхами. Для лікування рестенозу сполуки згідно з даним винаходом вводять безпосередньо в стінку кровоносної судини з використанням балона для ангіопластики, покритого гідрофільною плівкою (наприклад, гідрогелем), яку насичують сполукою, або за допомогою будь-якого іншого катетера, що містить інфузійну камеру для сполуки, що, таким чином, може бути точно доведена до місця, що підлягає лікуванню, і дає можливість ефективно вивільнити сполуку саме в місці розташування клітин, де необхідне лікування. Цей спосіб введення забезпечує можливість швидкого введення сполуки в контакт із клітинами, що потребують лікування. Спосіб лікування згідно з даним винаходом переважно полягає у введенні сполуки згідно з даним винаходом в місце, що підлягає лікуванню. Наприклад, композиція, що містить гідрогель, може бути накладена безпосередньо на поверхню тканини, що підлягає лікуванню, наприклад, при хірургічному втр учанні. Зручно вводити гідрогель у необхідне місце усередині судини, шляхом покриття ним катетера, наприклад балонного катетера, і доставки до стінки судини, переважно під час ангіопластики. Є особливо доцільним введення насиченого гідрогелю у місці, що підлягає лікуванню, за допомогою балонного катетера. При просуванні катетера в напрямку до наміченої судини балон може бути оснащений захисною оболонкою для мінімізації змивання лікарського засобу після введення катетера в потік крові. Інший варіант здійснення даного винаходу стосується введення сполуки за допомогою перфузійних балонів. Ці перфузійні балони, що забезпечують можливість підтримувати кровотік і тим самим зменшувати небезпеку виникнення ішемії міокарда при роздуванні балона, забезпечують також можливість доставки сполуки в потрібне місце при нормальному тиску протягом відносно тривалого часу (більше двадцяти хвилин), що може бути необхідним для її оптимальної дії. Альтернативно можна використовувати каналізований балонний катетер ("каналізований балонний катетер для ангіопластики", Mansfield Medical, Boston Scientific Corp., Watertown, MA). Останній складається із традиційного балона, покритого шаром із 24 перфорованих каналів, що заливаються завдяки незалежному просвіту через додатковий інфузійний отвір. Різні типи балонних катетерів, такі, як здвоєний балон, пористий балон, мікропористий балон, балон із каналами, балон на стенті і гідрогелевий катетер, що усі можуть бути використані для практичної реалізації винаходу, описані в роботі Reissen et al. (1994), яка включена у даний опис у якості посилання. Особливо переважним є застосування перфузійного балонного катетера, оскільки він забезпечує як можливість зберігати балон роздутим протягом тривалого періоду часу зі збереженням властивостей полегшеного ковзання, так і конкретну локалізацію гідрогелю одночасно. Інший аспект даного винаходу стосується фармацевтичної композиції, що містить сполуку згідно з даним винаходом і полоксамер, такий, як Полоксамер (Poloxamer) 407-нетоксичний біосумісний поліол, комерційно доступний (BASF, Parsippany, NJ). Полоксамер, просочений сполукою згідно з даним винаходом, може бути накладений безпосередньо на поверхню тканини, що підлягає лікуванню, наприклад під час хірургічного втручання. Полоксамер має, власне кажучи, такі ж переваги, як гідрогель, хоча має більш низьку в'язкість. Застосування канального балонного катетера з полоксамером, просоченим сполукою згідно з даним винаходом, має особливу перевагу. У цьому випадку одночасно забезпечуються можливість зберігати балон роздутим протягом тривалого періоду часу зі збереженням властивостей полегшеного ковзання і конкретної локалізації полоксамера. Відсотковий вміст активної складової в композиціях можна змінювати, причому необхідно, щоб вона була присутня у кількості, що забезпечує необхідну дозу. Очевидно, що можна вводити декілька одиничних дозованих форм приблизно в один і той же час. Використовувана доза може бути визначена лікарем або кваліфікованим медичним професіоналом і залежить від необхідного терапевтичного ефекту, способу введення, тривалості лікування і стану пацієнта. Для дорослих дози становлять звичайно від приблизно 0,001 до приблизно 50, переважно від приблизно 0,001 до приблизно 5мг/кг маси тіла в добу при інгаляції, від приблизно 0,01 до приблизно 100, переважно 0,1-70, більш переважно 0,5-10мг/кг маси тіла в добу при пероральному введенні і від приблизно 0,001 до 10, переважно 0,01-10мг/кг маси тіла на добу при внутрішньовенному введенні. У кожному конкретному випадку дози визначають відповідно до характерних особливостей пацієнта, що підлягає лікуванню, такими, як вік, маса, загальний стан здоров'я й інші характеристики, що можуть впливати на ефективність сполуки згідно з даним винаходом. Сполуки композиції згідно з даним винаходом можна вводити так часто, як потрібно для досягнення необхідного терапевтичного ефекту. Деякі пацієнти можуть швидко реагувати на більш високу або більш низьку дозу, причому для них можуть виявитися достатніми набагато більш слабкі підтримуючі дози. Для інших пацієнтів може виявитися необхідним тривале лікування при нормі 1-4 дози в добу, відповідно до фізіологічних потреб кожного конкретного пацієнта. Як правило, активний продукт можна вводити перорально 1-4 рази на добу. Але, звичайно, для інших пацієнтів може бути необхідним призначення не більш, ніж однієї або двох доз на добу. Сполуки згідно з даним винаходом можуть бути також використані в поєднанні з іншими терапевтичними засобами або в поєднанні із застосуванням терапевтичних методів до певних фармакологічних станів, що можуть бути полегшені шляхом застосування таких сполук формули І. Сполуки згідно з даним винаходом можуть бути використані для лікування рестенозу після ангіопластики з використанням будь-якого пристрою, такого, як балон, висічення або лазерні процедури. Сполуки згідно з даним винаходом можуть бути використані для лікування рестенозу після установки стенту в кровоносній системі або 1) для первинного лікування закупорки судин, або 2) у випадку, коли ангіопластика з використанням якогось пристосування не здатна забезпечити прохідності артерії. Сполука може бути використана перорально, парентерально, шляхом місцевого застосування при введенні спеціального пристосування або у вигляді належним чином виготовленого покриття на розширювачі (стенті). Сполуки згідно з даним винаходом можуть бути використані для лікування рестенозу в поєднанні з будь-яким протизгортальним, антитромбоцитарним, антитромботичним або профібрінолітичним засобом. Часто пацієнтів лікують до, під час і після хірургічного втр учання засобами зазначених класів, щоб безпечно виконати хірургічну операцію або запобігти несприятливим ефектам тромбоутворення. Деякі приклади класів засобів, відомих у якості протизгортальних, антитромбоцитарних, антитромботичних або профібрінолітичних засобів, включають будь-які препарати гепарину, низькомолекулярні гепарини, пентасахариди, антагоністи фібриногенових рецепторів, інгібітори тромбіну, інгібітори фактора Ха або інгібітори фактора VІla. Сполуки згідно з даним винаходом можуть бути використані в поєднанні з будь-яким гіпотензивним засобом або засобом, що регулює холестерин або липіди при лікуванні рестенозу або атеросклерозу паралельно з лікуванням високого кров'яного тиску або атеросклерозу. Деякі приклади засобів, придатних для лікування високого кров'яного тиску, включають сполуки таких класів: бета-блокаторы, інгібітори АСІ (ферменту, що перетворює ангіотензин, АПФ), антагоністи кальцієвих каналів і антагоністи альфарецепторів. Деякі приклади засобів, придатних для лікування підвищених рівнів холестерину або розрегульованих рівнів ліпідів, включають сполуки, відомі як інгібітори редуктази HMGCo, сполуки класу фібратів. Сполуки згідно з даним винаходом можуть бути використані для лікування різних форм раку або окремо або в поєднанні з відомими сполуками для лікування раку. Зрозуміло, що даний винахід охоплює комбінації сполук згідно з даним винаходом з одним або декількома зі згаданих вище лікарських засобів. Сполуки в обсязі даного винаходу показують значну фармакологічну активність в тестах, описаних у літературі, результати яких, як вважають, корелюються з фармакологічною активністю в людей та інших ссавців. Наступні результати фармакологічних тестів in vitro і in vivo є типовими для характеристики сполук згідно з даним винаходом. Фармацевтичні композиції і фармакологічні тести Сполуки згідно з даним винаходом проявляють значну активність як інгібітори білкових тирозинкіназ і мають терапевтичну цінність у якості клітинних антипроліферативних засобів для лікування деяких станів, що включають псоріаз, атеросклероз і рестеноз. Сполуки згідно з даним винаходом забезпечують модулювання і/або інгібування передачі сигналів у клітинах і/або проліферації клітин і/або продукування матриксу, хемотаксису і/або запальної реакції клітин і можуть бути використані для запобігання або затримки прояву або повторного прояву або лікування таких станів. Для визначення ефективності сполук згідно з даним винаходом використовують описані нижче фармакологічні тести, що прийняті в даній області медицини і, як відомо, корелюють із фармакологічною активністю в ссавців. Сполуки згідно з даним винаходом були тестовані, і результати, отримані в різних тестах, як думають, відповідають корисній активності у відношенні медіатора диференціації клітин. Результати цих випробувань, треба думати, дають достатню інформацію фахівцям в області фармакології і медичної хімії, для визначення параметрів застосування досліджуваних сполук в одному або декількох терапевтичних способах, описаних у даному описі. 1. Аналіз ауто фосфорилювання тирозинкінази PDGF-R методом ELISA Зазначений у заголовку аналіз виконують так, як описано в Dolle et al. (J. Med. Chem 1994, 37, 2627), що включений у даний опис у якості посилання, за винятком того, що використовують клітинний лізат, отриманий із клітин гладких м'язів аорти людини (HAMSC), як описано нижче. 2. Загальна методика аналізу мітогенезу. Клітини гладких м'язів аорти людини (пасаж 4-9) поміщають у лунки 96-лункового планшету в живильне середовище з концентрацією 6000клітин/лунку і дають їм зростати 2-3 дня. При приблизно 80%-ном злитті ріст клітин зупиняють безсироваточним середовищем (SFM). Через 24 години депривації сироватки середовище видаляють і заміняють тестованою сполукою в носії, SFM (200мкл на лунку). Сполуки розчиняють у клітинній культурі DMSO (ДМСО) при концентрації 10мМ і роблять додаткові розведення в SFM. Через 30 хвилин попередньої інкубації зі сполукою клітини стимулюють PDGF у концентрації 10нг/мол. Визначення здійснюють з дублюванням зі стимульованими і нестимульованими лунками при кожній концентрації сполуки. Через чотири години добавляють 1мкКі 3Н тимідину/лунку. Культивування закінчують через 24 години після додавання фактора росту. Клітини піднімають трипсином і збирають на фільтрувальний папір, користуючись автоматизованим збирачем клітин (Wallac MachII96). Фільтрувальний папір аналізують за допомогою сцинтиляційного лічильника (Wallac Betaplate) для визначення мітки, введеної в ДНК. 3. Аналіз хемотаксису Із АТСС одержують клітини гладких м'язів аорти людини (HASMC) при більш ранніх пасажах. Клітини культивують у Clonetics SmGM 2 SingleQuots (використовують середовище і клітини при пасажах 4-10). При 80%-ном злитті клітин у середовище добавляють флуоресцентний зонд, кальцеїн AM (5мМ, Molecular Probe), і клітини інкубують 30 хвилин. Після промивання сольовим розчином із буфером HEPES клітини піднімають трипсином і нейтралізують буфером MCDB 131 (Gibco) із 0,1% BSA (бичачий сироватковий альбумін), 10мМ глутаміном і 10% сироваткою плоду корови. Після центрифугування клітини промивають ще раз і ресуспендують у тому ж самому буфері без сироватки плоду корови при концентрації 30000 клітин на 50мл. Клітини інкубують при різних концентраціях сполуки формули І (кінцева концентрація в ДМСО = 1%) протягом 30 хвилин при 37°С. Для дослідження хемотаксису використовують модифіковані камери Бойдена з 96 лунками (Neuroprobe, Inc.) і полікарбонатную мембрану з розміром пор 8нм (Poretics, CA.. Мембрану покривають колагеном (Sigma C3657, 0,1мг/мл). У нижню камеру поміщають PDGF-bb (3нг/мл) у буфері зі сполукою формули І і без неї. У верхню камеру поміщають клітини (30000) з інгібітором і без нього. Клітини інкубують протягом 4 годин. Фільтрувальну мембрану знімають і видаляють клітини, що знаходяться на верхньому боці мембрани. Після висушування визначають флуоресценцію на мембрані, використовуючи Cytofluor II (МіІіроrе) при довжині хвилі збудження й емісії 485 і 530нм, відповідно. У кожному експерименті середню міграцію клітин одержують із шести повторень. Відсоток інгібування визначають за контрольними значеннями з обробкою ДМСО. За п'ятьма оцінками обчислюють залежне від концентрації інгібування, значення ІС 50. Результати означають як середнє значення ± SEM (середня квадратична помилка вимірювання) від п'ятьох таких експериментів. Очищення EGF-рецептора грунтується на методиці Ярдена і Шлессінгера (Yarden and Schlessinger). Клітини А431 культивують у ємностях площею 80см 2 до злиття (2х107 клітин на ємність). Клітини промивають два рази PBS (фосфатно-сольовим буферним розчином) і збирають за допомогою 11,0мМоль EDTA, що містить PBS, 1 годину при 37°С, і центрифугують при 600g протягом 10 хвилин. Клітини солюбілізують у 1мл на 2х107 клітин холодного солюбілізаційного буфера (50мМоль буфера Hepes, рН 7,6, 1% Triton Х-100, 150мМоль NaCl, 5мМоль EGTA, 1мМоль PMSF, 50мг/мл апротиніну, 25мМоль бензамідина, 5мг/мл інгібітора лейпепсина і 10мг/мл інгібітору соєвого трипсину) протягом 20 хвилин при 4°С. Після центрифугування при 100000g протягом 30 хвилин супернатант завантажують на WGA-агарозную колонку (100мл упакованої смоли на 2х107 клітин) і струшують протягом 2 годин при 4°С. Неабсорбований матеріал видаляють і смолу промивають два рази HTN буфером (50мМоль буфера Hepes, рН 7,6, 0,1% Triton Х-100, 150мМоль NaCl), два рази HTN буфером, що містить 1М NaCl, і два рази HTNG буфером (50 буфера Hepes/ рН 7,6, 0,1% Triton Х-100, 150мМоль NaCl і 10% гліцерин). EGF-рецептор елююють періодично HTNG буфером, що містить 0,5М N-ацетил-D-глюкозамін (200мл на 2х107 клітин). Елюйований матеріал зберігають аліквотами при -70°С і перед застосуванням розводять TMTNG буфером (50мМоль Tris-Mes буфера, рН 7,6, 0,1% Triton Х-100, 150мМоль NaCl і 10% гліцерин). 5. Інгібування аутофосфорилювання-EGF-R Клітини А431 культивують до злиття на чашках Петрі з культурою людської тканини, покритою фібронектином. Після дворазового промивання охолодженим льодом розчином PBS клітини лізують шляхом додавання 500мл/чашку лізисного буфера (50мМоль Hepes, р 7,5, 150мМоль NaCl, 1,5мМоль MgCl, 1мМоль EGTA, 10% гліцерин, 1% Тритон Х-100, 1мМоль PMSF, 1мг/мл апротиніну, 1мг/мл лейпептину) і інкубують протягом 5 хвилин при 4°С. Після стимулювання EGF (500мг/мл, 10 хвилин при 37°С) проводять імуноосаждення за допомогою анти EGF-R (Аb 108) і реакцію аутофосфорилювання зразка (50мл аліквоти, 3мКі [g-32Р]АТФ) у присутності 2 або 10мМ сполуки згідно з даним винаходом протягом 2 хвилин при 4°С. Реакцію зупиняють шляхом додавання гарячого електрофорезного буфера для зразка. Проводять SDAPAGE аналіз (7,5% ел.) із наступною ауторадіографією і визначають кількісні результати реакції шляхом денситометричного сканування рентгенівських плівок. а. Культура клітин Клітини, позначені HER 14 і К721А, одержують шляхом трансфекції клітин NIH3T3 (клон 2.2) (із С Fryling, NCI, NIH), що не містять ендогенних EGF-рецепторів, із кДНК-ланками дикого типу EGF-рецептора або мутантного EGF-рецептора, у якого відсутня тирозинкіназна активність (у якому Лиз 721 у місці зв'язування АТФ замінений залишком Ала відповідно). Усі клітини культивують в DMEM із 10% сироваткою теляти (Hyclone, Logan, Utah). б. Селективність стосовноРКА і РКС визначають із використанням комерційних наборів а. Колориметричний набір Pierce для аналізу РКА, формат Spinzyme Короткий протокол: 1U ферменту РКА (бичаче серце)/аналітична пробірка субстрат пептиду (міченого барвником) Кемптид 45 хвилин при 30°С Спектральна поглинальна здатність при 570нм b. Колориметричний набір Pierce для аналізу РКС, формат Spinzyme Короткий протокол: 0,025U Ферменту РКС (головний мозок пацюка)/аналітична пробірка субстрат пептиду (міченого барвником) Нейрогранін 30 хвилин при 30°С Поглинання при 570нм 7. Вимірювання інгібуючої активності стосовно тирозинкінази р56lck Інгібуючу активність стосовно тирозинкінази р56lck визначають відповідно до методики, розкритої в патенті США №5714493, включеному в даний опис у якості посилання. Альтернативно інгібуючу активність стосовно тирозинкінази визначають наступним методом. Субстрат (тирозинвмісний субстрат, Biot-(bАlа)3Lys-Val-Glu-Lys-Ile-Gly-Glu-Gly-Thr-Tyr-Glu-Val-Val-Tyr-Lys-(NH 2), розпізнаваний р561ск, 1мкМ) спочатку фосфорилюють у присутності або за відсутності заданої концентрації тестованої сполуки заданою кількістю ферменту (фермент продукують експресією гена р56lck у дріжджову конструкцію), очищеного від клонованих дріжджів (очищення ферменту здійснюють наступними класичними методами), у присутності АТФ (10нкМ), MgCl2 (2,5мМ), МgСl2 (2,5мМ), NaCl (25мМ), DTT (0,4мМ) у Hepes 50мМ, рН 7,5, протягом 10 хвилин при температурі навколишнього середовища. Загальний об'єм реакційної суміші становить 50мкл і реакції проводять у чорному флуропланшеті з 96 лунками. Реакцію зупиняють додаванням 150мкл стоп-буфера (100мМ Hepes, рН 7,5, KF 400мМ, EDTA 133мМ, BSA 1г/л), що містить антитіло для тирозину, мічене криптатом європію (PY20-K), при 0,8мкг/мл і мічений алофікоціаніном стрептавідин (XL665) при 4мкг/мол. Мічення стрептавідину й антитіл для тирозину проводили в Cis-Bio International (Франція). Суміш обраховували за допомогою лічильника Packard Discovery, здатного вимірювати перенос однорідної флуросценції з часовим розрізненням (збудження при 337нм, зчитування при 620нм і 665нм). Відношення сигналу при 665нм до сигналу при 620нм є показником концентрації фосфорильованого тирозину. Контроль одержують шляхом заміни ферменту буфером. Характерний сигнал являє собою різницю між відношенням, отриманим без інгібітора, і відношенням із контролем. Обчислюють характерний сигнал у відсотках. Обчислюють ІС50 для 10 концентрацій інгібітора дублювано, користуючись програмним забезпеченням Xlfit. Реперною сполукою є ставроспорин (Sigma), що має lС50=30±6нм (n=20). Результати, отримані описаними вище експериментальними методами, доводять, що сполуки згідно з даним винаходом мають корисну інгібуючу активність стосовно білкової тирозинкінази рецептора HDGF і інгібуючу здатність стосовно тирозинкінази р56lck і тому мають терапевтичну цінність. Результати описаних вище фармакологічних тестів можуть бути використані для визначення дози і способу введення для конкретного терапевтичного методу. Даний винахід може бути здійснений в інших конкретних видах у межах його обсягу або істотних ознак.
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline and quinpxaline compounds which inhibit platelet-derived growth factor and/or p56
Назва патенту російськоюХинолиновые и хиноксалиновые соединения, ингибирующие тирозинкиназы тромбоцитарного фактора роста и/или p56
МПК / Мітки
МПК: A61P 35/00, A61K 31/5377, C07D 241/44, C07D 241/52, C07D 241/54, A61K 31/498, A61P 9/10, A61P 35/02, A61P 17/06, A61P 43/00, C07D 405/12, C07D 215/20, C07D 215/38, A61P 9/00, A61K 31/47, C07D 403/04, C07D 453/00, A61P 29/00, C07D 405/10, A61P 19/08, C07D 241/42
Мітки: сполуки, спосіб, хінолінові, хіноксалінові, композиція, варіанти, фармацевтична, інгібування, лікування
Код посилання
<a href="https://ua.patents.su/16-66361-khinolinovi-i-khinoksalinovi-spoluki-farmacevtichna-kompoziciya-sposib-ingibuvannya-varianti-ta-sposib-likuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Хінолінові і хіноксалінові сполуки, фармацевтична композиція, спосіб інгібування (варіанти) та спосіб лікування (варіанти)</a>
Попередній патент: Спосіб одержання масляної емульсії (варіанти), емульсія, препарат для годування риб
Випадковий патент: Пристрій для зчитування інформації з магнітного носія