Похідні індолінону та способи їх одержання
Формула / Реферат
1. Сполука формули
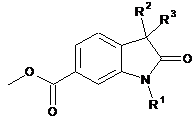 ,
,
у якій R1 означає атом водню або Сl-СН2-СО-групу, a R2 і R3 кожний означає атом водню або R2 і R3 разом являють собою  -групу,
-групу,
за умови, що, якщо R1 означає атом водню, то R2 і R3 разом являють собою
 -групу.
-групу.
2. Сполука формули
 .
.
3. Сполука формули
 .
.
4. Сполука формули
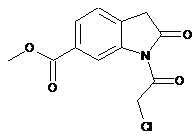 .
.
5. Спосіб одержання сполуки формули
 ,
,
який включає стадію каталізованого основою дехлорацетилування сполуки формули
 .
.
6. Спосіб за п. 5, у якому сполуку формули

одержують за реакцією сполуки формули
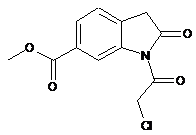
зі сполукою формули
 .
.
7. Спосіб за п. 6, у якому сполуку формули

одержують за реакцією сполуки формули
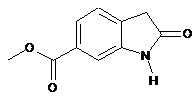
зі сполукою формули
 .
.
8. Спосіб за п. 7, у якому сполуку формули
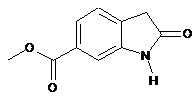
одержують за допомогою наведених нижче стадій:
(і) етерифікація сполуки формули

з утворенням сполуки формули
 ;
;
(іі) реакція продукту реакції (і) з диметиловим ефіром малонової кислоти з утворенням сполуки формули
 ;
;
(ііі) проведення циклізації продукту реакції (іі) за допомогою реакції гідрування.
9. Спосіб одержання сполуки формули
 ,
,
що включає стадію реакції сполуки формули

зі сполукою формули
 .
.
10. Спосіб одержання сполуки формули
 ,
,
що включає стадію реакції сполуки формули
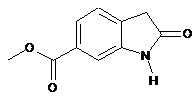
зі сполукою формули
 .
.
Текст
Реферат: У заявці описані похідні індолінону, а саме сполуки формули R 2 R 3 O O N O R 1 , 1 2 3 2 у якій R означає атом водню або Сl-СН2-СО-групу, a R і R кожний означає атом водню або R O 3 і R разом являють собою -групу, O 1 2 3 за умови, що, якщо R означає атом водню, то R і R разом являють собою групу, а також спосіб їх одержання. UA 97872 C2 UA 97872 C2 Даний винахід відноситься до особливих похідних індолінону, а саме, до сполук формули 1 2 3 у якій R означає атом водню або СІ-СН2-СО-групу, a R і R кожний означає атом водню або 2 3 R і R разом являють собою 5 10 15 20 25 30 35 -групу, 1 2 3 за умови, що, якщо R означає атом водню, то R і R разом являють собою групу, і до способу їхнього одержання. Зазначені вище похідні індолінону є проміжними продуктами, придатними для синтезу лікарських речовин, таких як розкритих, наприклад, у наступних заявках: WO 01/027081, WO 04/013099, WO 04/017948, WO 04/096224 і WO 06/067165. У цих заявках розкриті лікарські речовини й використання цих лікарських речовин або їх фармацевтично прийнятних солей у фармацевтичній композиції, призначеній для лікування онкологічних або неонкологічних захворювань шляхом придушення проліферації клітин-мішеней, окремо або у комбінації з іншими терапевтичними засобами. Механізм дії, за яким відбувається проліферація клітинмішеней, по суті являє собою механізм інгібування різних рецепторів тирозинкінази й, зокрема, інгібування рецептора судинного ендотеліального фактора росту (РСЕФР). Хоча у зазначених вище заявках уже описаний спосіб одержання лікарських речовин, об'єктом даного винаходу є новий і поліпшений спосіб одержання проміжних продуктів, придатних для синтезу зазначених лікарських речовин. Таким чином, у порівнянні зі способами, уже описаними у попередньому рівні техніки, спосіб, запропонований у даному винаході, поряд з іншими має зазначені нижче помітні переваги. Першою перевагою є більше високий загальний вихід, який можна забезпечити за допомогою нового й поліпшеного способу. Цей більше високий загальний вихід означає підвищення загальної ефективності способу. Це також спричиняє економічну перевагу. Другою перевагою є те, що новий і поліпшений спосіб, запропонований у даному винаході, є менше шкідливим для навколишнього середовища, чим способи, відомі з попереднього рівня техніки. Ця перевага заснована на тому факті, що стадії способу проводять при більше високих концентраціях. Третьою перевагою, яку можна відзначити, є застосовність нового й поліпшеного способу, запропонованого у даному винаході, для великомасштабного виробництва. Ця застосовність характеризується наявністю надійних стадій реакцій, тобто стадій реакцій, менше чутливих до кількостей вихідних речовин. Ці переваги забезпечують необхідну високу чистоту активного фармацевтичного інгредієнта. Спосіб, запропонований у даному винаході, представлений на наведеній нижче загальній схемі синтезу 1. 1 UA 97872 C2 У даному винаході використовують наведену нижче номенклатуру. Спеціальна назва, використана у Відповідна назва за номенклатурою ІЮПАК (Міжнародний даній заявці на патент союз теоретичної й прикладної хімії) "ХЛОРІМІД" метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилат "ХЛОРЕНОЛ" (Е- або Z-ізомер) метил-1-(хлорацетил)-3-[метокси(феніл)метилен]-2оксоіндолін-6-карбоксилат "ЕНОЛІДОЛ" (Е- або Z-ізомер) метил-3-[метокси(феніл)метилен]-2-оксоіндолін-6карбоксилат 5 Таким чином, спосіб, запропонований у даному винаході, включає наведені нижче стадії реакцій. І. Синтез 6-метоксикарбоніл-2-оксіндолу 6-Метоксикарбоніл-2-оксиндол можна синтезувати способами, описаними на наведених нижче схемах синтезу А або В. Ці способи описані у попередньому рівні техніки. 10 15 20 25 Таким чином, 6-метоксикарбоніл-2-оксіндол можна одержати за трьохстадійною методикою, що включає етерифікацію 3-нітробензойної кислоти з наступним електрофільним заміщенням з використанням метилового ефіру хлороцтової кислоти, що приводить до утворення метилового ефіру 4-метоксикарбонілметил-3-нітробензойної кислоти, і кінцеву послідовність реакцій гідрування-внутрішньомолекулярного амідування. 6-Метоксикарбоніл-2-оксіндол також можна одержати за описаною вище чотирьохстадійною методикою. Спочатку проводять подовження ланцюга 4-метил-3-нітробензонітрилу й відновлювальну циклізацію отриманої (4-ціано-2-нітрофеніл)оцтової кислоти з утворенням оксіндольного ядра, синтез закінчують замиленням нітрильної групи й наступною етерифікацією карбоксильної функціональної групи. Альтернативно, 6-метоксикарбоніл-2-оксіндол також можна синтезувати способом синтезу 2-оксіндолів, описаним у патенті US 6469181. Альтернативно, 6-метоксикарбоніл-2-оксіндол можна синтезувати способом, описаним на наведеній нижче схемі синтезу С 30 2 UA 97872 C2 5 10 15 20 25 30 35 40 45 50 Стадії реакцій схеми синтезу С, які також є об'єктом даного винаходу, додатково описані у наведеному нижче експериментальному прикладі 1, який не слід розглядати в якості обмежуючого даний винахід. ІІа. Реакція б-метоксикарбоніл-2-оксіндолу з ангідридом хлороцтової кислоти з утворенням "хлоріміду" (метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилату) Реакцію 6-метоксикарбоніл-2-оксіндол з ангідридом хлороцтової кислоти або іншим відповідним чином активованим похідним хлороцтової кислоти, наприклад, хлорацетилхлоридом, переважно проводять у висококиплячому апротонному розчиннику, наприклад, толуолі, ксилолі або бутилацетаті, при температурі у діапазоні від приблизно 80 до приблизно 130°С. Кристалізацію ініціюють шляхом додавання неполярного розчинника, наприклад, циклогексану або метилциклогексану, при температурі у діапазоні від приблизно 80 до приблизно 100°С, і закінчують при температурі у діапазоні від приблизно -5°С до кімнатної температури. Тверду речовину збирають, промивають, переважно - полярними розчинниками, такими як спирти, найбільше переважно - метанолом, і сушать і одержують "хлорімід". Алкілуючі реагенти, такі як хлорацетилхлорид або ангідрид хлороцтової кислоти можна придбати у різних фірм-постачальників. Фірмою-постачальником великих кількостей ангідриду хлороцтової кислоти є, наприклад, SF-Chem (Switzerland). Описана вище стадія реакції ІІа і продукт цієї реакції, тобто "хлорімід" (метил-1(хлорацетил)-2-оксоіндолін-6-карбоксилат), також є об'єктом даного винаходу. lІb. Реакція "хлоріміду" з триметилортобензоатом з утворенням "хлоренолу" (метил-1(хлорацетил)-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату) Реакцію метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилату з триметилортобензоатом проводять у висококиплячому апротонному розчиннику, такому як бутилацетат, Ν,Νдиметилформамід, ксилол, або, переважно - толуол, при температурі у діапазоні від приблизно 100 до приблизно 140°С. Реакції сприяють зв'язуючі метанол реагенти, такі як оцтовий ангідрид. У ході реакції летучі речовини можна відганяти із заміною вилучених речовин на використовуваний у реакції розчинник або без такої заміни. Кристалізацію закінчують при температурі у діапазоні від температури навколишнього середовища приблизно до -10°С. Тверду речовину збирають і промивають, переважно - розчинниками, такими як толуол, ксилол і/або етилацетат. Після сушіння одержують "хлоренол". Оцтовий ангідрид можна придбати у різних фірм-постачальників. Триметил-ортобензоат можна придбати у фірми AMI Drugs & Speciality Chemicals India Inc. Описана вище стадія реакції lib і продукт цієї реакції, тобто "хлоренол" (метил-1(хлорацетил)-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилат), також є об'єктом даного винаходу. Не. Реакція "хлоренолу" з основами з утворенням "енолідолу" (метил-3[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату) Каталізуєме основою дехлорацетилування метил-1-(хлорацетил)-3[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату проводять у протонних розчинниках, таких як спирти, наприклад, ізопропанол або, переважно - метанол, при температурі у діапазоні приблизно від 70°С до температури навколишнього середовища. Як каталізатори можна використовувати неорганічні основи, такі як гідроксиди лужних металів, або органічні основи, такі як метоксид натрію. Кристалізацію закінчують при температурі у діапазоні від температури навколишнього середовища приблизно до -10°С. Тверду речовину збирають і промивають, переважно - спиртами, найбільше переважно - метанолом. Після сушіння одержують "енолідол". Описана вище стадія реакції Не і продукт цієї реакції, тобто "енолідол" (метил-3[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилат), також є об'єктом даного винаходу. Таким чином, першим об'єктом даного винаходу є сполука формули 1 2 3 у якій R означає атом водню або СІ-СН2-СО-групу, і R і R усі означають атом водню, 3 UA 97872 C2 2 3 або R і R разом означають 2 1 -групу, за умови, що, якщо R означає атом водню, 3 то R і R разом означають -групу. Іншим об'єктом даного винаходу є сполука формули 5 Іншим об'єктом даного винаходу є сполука формули Іншим об'єктом даного винаходу є сполука формули Іншим об'єктом даного винаходу є наведений нижче спосіб D одержання сполуки формули 10 який включає стадію каталізуємого основою дехлорацетилування сполуки формули Іншим об'єктом даного винаходу є наведений нижче спосіб D1, заснований на описаному вище способі D, і в якому сполуку формули 15 одержують за реакцією сполуки формули зі сполукою формули 20 Іншим об'єктом даного винаходу є наведений нижче спосіб D2, заснований на описаному вище способі D1, і в якому сполуку формули 4 UA 97872 C2 одержують за реакцією сполуки формули зі сполукою формули 5 10 Іншим об'єктом даного винаходу є наведений нижче спосіб D3, заснований на описаному вище способі D2, і в якому сполуку формули одержують за допомогою наведеної нижче послідовності реакцій: (і) етерифікація сполуки формули з утворенням сполуки формули 15 (іі) реакція продукту реакції (і) з диметиловим ефіром малонової кислоти з утворенням сполуки формули (ііі) проведення циклізації продукту реакції (іі) за реакцією гідрування. Іншим об'єктом даного винаходу є спосіб одержання сполуки формули 20 що включає стадію реакції сполуки формули зі сполукою формули Іншим об'єктом даного винаходу є спосіб одержання сполуки формули 25 5 UA 97872 C2 що включає стадію реакції сполуки формули зі сполукою формули 5 10 Даний винахід більше докладно описаний за допомогою наведених нижче прикладів, які ілюструють додаткові варіанти здійснення, і їх не слід розглядати в якості обмежуючих даний винахід. У наведених нижче прикладах описаний синтез лікарської речовини, 3-Ζ-[1-(4-(N-((4метилпіперазин-1-іл)-метилкарбоніл)-N-метиламіно)-аніліно)-1-фенілметилен]-6метоксикарбоніл-2-індолінону, розкритого у WO 01/027081, WO 04/013099, WO 04/017948, WO 04/096224 і WO 06/067165. Цей синтез здійснюють відповідно до наведеної нижче загальної схеми синтезу 2. 15 На наведеній вище загальній схемі синтезу 2 і у наведені нижче прикладах використовують наведену нижче номенклатуру. Спеціальна назва, Відповідна хімічна назва, використана у даній використана у даній заявці на Відповідна назва за номенклатурою ІЮПАК заявці на патент патент "ХЛОРІМІД" метил-1-(хлорацетил)-2-оксоіндолін-6карбоксилат "ХЛОРЕНОЛ" метил-1-(хлорацетил)-3(Е- або Z-ізомер) [метокси(феніл)метилен]-2-оксоіндолін-6карбоксилат "ХЛОРАЦЕТИЛ" хлорацетил-N-метил-4N-(4-нітроаніліно)-N-метил-2-хлорацетамід нітроанілін "НІТРОАНІЛІН" N-(4-нітрофеніл)-N-метил-2-(4метилпіперазин-1-іл)ацетамід "АНІЛІН" N-(4-амінофеніл)-N-метил-2-(4метилпіперазин-1-іл)ацетамід 6 UA 97872 C2 "ЕНОЛІДОЛ" (Е- або Z-ізомер) "АНІЛІНО" 5 10 15 20 25 метил-3-[метокси(феніл)метилен]-2оксоіндолін-6-карбоксилат метил (3Z)-3-[[(4-{мeтил[(4-мeтилпiпepaзин-1іл)ацетил]аміно}феніл)аміно](феніл)метилен]2-оксоіндолін-6-карбоксилат 3-Ζ-[1-(4-(Ν-((4метилпіперазин-1-іл)метилкарбоніл)-Nметиламіно)-аніліно)-1фенілметилен]-6метоксикарбоніл-2індолінон Приклад 1: Синтез 6-метоксикарбоніл-2-оксиндолу способом, описаним на схемі синтезу С. Синтез метилового ефіру 4-хлор-3-нітробензойної кислоти 20 кг 4-Хлор-3-нітробензойної кислоти (99,22 моля) суспендують у 76 л метанолу. Протягом 15 хв додають 5,9 кг тіонілхлориду (49,62 моля) і суміш кип'ятять зі зворотним холодильником протягом приблизно 3 год. Після охолодження приблизно до 5°С продукт виділяють центрифугуванням і сушать при 45°С. Вихід: 19,0 кг (88,8% від теоретичного). Чистота (ВЕРХ (високоефективна рідинна хроматографія)): 99,8%. Синтез диметилового ефіру [4-(метоксикарбоніл)-2-нітрофеніл]-пропандикарбонової кислоти 12,87 кг Диметилового ефіру малонової кислоти (97,41 моля) додають до гарячого (75°С) розчину 10,73 кг трет-амілату натрію (97,41 моля) у 35 л 1-метил-2-піролідинону (NMP). При 75°С додають розчин 10 кг метилового ефіру 4-хлор-3-нітробензойної кислоти (46,38 моля) у 25 л 1-метил-2-піролідинону. Після перемішування при температурі, рівній приблизно 75°С, протягом 1,5 год і охолодження до 20°С суміш підкисляють до рН 1 за допомогою 100 л розведеної хлористоводневої кислоти. Після перемішування при температурі, рівній приблизно 5°С, протягом 1,5 год продукт виділяють центрифугуванням і сушать при 40°С. Вихід: 13,78 кг (95,4% від теоретичного). Чистота (ВЕРХ): 99,9%. Синтез 6-метоксикарбоніл-2-оксиндолу Розчин 13 кг диметилового ефіру [4-(метоксикарбоніл)-2-нітрофеніл]-пропандикарбонової кислоти (41,77 моля) у 88 л оцтової кислоти гідрують у присутності 1,3 кг 10% Pd/C при 45°С і 2 тиску, рівному 40-50 фунт-сила/дюйм . Після зупинки гідрування реакційну суміш нагрівають при 115°С протягом 2 год. Каталізатор відфільтровують і при температурі, рівній приблизно 50°С, додають 180 л води. Продукт виділяють після охолодження до 5°С, центрифугування й сушіння при 50°С. Вихід: 6,96 кг (87,2% від теоретичного). Чистота (ВЕРХ): 99,8%. Приклад 2: Синтез "хлоріміду" (метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилату) 30 35 40 Методика 1 6-Метоксикарбоніл-2-оксиндол (400 г; 2,071 моля) при кімнатній температурі суспендують у толуолі (1200 мл). До цієїсуспензії додають ангідрид хлороцтової кислоти (540 г; 3,095 моля). Суміш кип'ятять зі зворотним холодильником протягом 3 год, потім охолоджують до 80°С і протягом 30 хв додають метилциклогексан (600 мл). Потім отриману суспензію протягом 60 хв охолоджують до кімнатної температури. Матковий розчин відокремлюють і тверду речовину промивають охолодженим льодом метанолом (400 мл). Кристали сушать і одержують 515,5 г 1 (93,5 %) "хлоріміду" у вигляді білої твердої речовини. Н-ЯМР (ядерний магнітний резонанс) (500 МГц, ДМСО-d6) δ: 8,66 (s, 1 Η, 6-Н); 7,86 (d, J = 8,3 Гц, 1 Η, 8-Η); 7,52 (d, J = 8,3 Гц, 1 Η, 913 Η); 4,98 (s, 2 Η, 15-Η2); 3,95 (s, 3 Η, 18-Η3); 3,88 (s, 2 Η, 3-H2). С-ЯМР (126 МГц, ДМСО-d6) δ: 7 UA 97872 C2 5 10 15 20 25 30 35 40 45 50 174,7 (С-2); 36,0 (С-3); 131,0 (С-4); 140,8 (С-5); 115,7 (С-6); 128,9 (С-7); 126,1 (С-8); 124,6 (С-9); 166,6 (С-10); 165,8 (С-13); 46,1 (С-15); 52,3 (С-18). МС (мас-спектроскопія): m/z 268 (М+Н) . Аналіз: Розраховано для C12H10CINO4: С, 53,85; Н, 3,77; СІ, 13,25; N, 5,23. Знайдено: С, 52,18; Н, 3,64; СІ, 12,89; N, 5,00. Методика 2 6-Метоксикарбоніл-2-оксиндол (10 г; 0,052 моля) при кімнатній температурі суспендують у нбутилацетаті (25 мл). До цієї суспензії протягом 3 хв додають розчин ангідриду хлороцтової кислоти (12,8 г; 0,037 моля) у н-бутилацетаті (25 мл). Суміш кип'ятять зі зворотним холодильником протягом 2 год, потім охолоджують до 85 °С і додають метилциклогексан (20 мл). Потім отриману суспензію охолоджують до кімнатної температури й перемішують протягом ще 2 год. Матковий розчин відокремлюють і тверду речовину при температурі навколишнього середовища промивають метанолом (400 мл). Кристали сушать і одержують 12,7 г (91,5 %) "хлоріміду" у вигляді жовтуватої твердої речовини. Приклад 3: Синтез "хлоренолу" (метил-1-(хлорацетил)-3-[метокси(феніл)метилен]-2оксоіндолін-6-карбоксилату) Методика 1 Метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилат (12,0 г; 0,045 моля) при температурі навколишнього середовища суспендують у толуолі (60 мл). До цієї суспензії додають оцтовий ангідрид (16,2 г; 0,157 моля). Суміш нагрівають до температури, рівної не нижче 104°С, і протягом 60 хв додають триметилортобензоат (20,0 г; 0,108 моля). У ході додавання й наступного перемішування при такій же температурі протягом 3 год летучі речовини, що містяться у реакційній суміші, відганяють. Концентрацію реакційної суміші підтримують постійною шляхом заміни відігнаних речовин толуолом (40 мл). Суміш охолоджують до 5°С, перемішують протягом ще 1 год і фільтрують. Тверду речовину послідовно промивають толуолом (14 мл) і сумішшю толуолу (8 мл) і етилацетату (8 мл). Після сушіння виділяють 16,3 г 1 (91,7 %) "хлоренолу" у вигляді жовтуватих кристалів. Н-ЯМР (500 МГц, ДМСО-d6) δ: 8,73 (d, J = 1,5 Гц, 1 Η, 6-Η); 8,09 (d, J = 8,0 Гц, 1 Η, 9-Η); 7,90 (dd, J = 8,1; 1,5 Гц, 1 Η, 8-H); 7,61 - 7,48 (m, 5 13 Η, 21-Η, 22-Η, 23-Н, 24-Н, 25-Н); 4,85 (s, 2 Η, 18-Η2); 3,89 (s, 3 Н, 27-Нз); 3,78 (s, 3 Η, 15-Η3). СЯМР (126 МГц, ДМСО-d6) δ: 165,9 (С-2 + С16); 103,9 (С-3); 127,4; 128,6; 130,0; 135,4 (С-4 + С-5 + С-7 + С-20); 115,1 (С-6); 126,1 (С-8); 122,5 (С-9); 166,7 (С-10); 173,4 (С-13); 58,4 (С-15); 46,4 (С+ 18); 128,6 (С-21 + С-22 + С-24 + С-25); 130,5 (С-23); 52,2 (С-27). МС: m/z 386 (М+Н) . Аналіз: Розраховано для C2oHi6ClN05: С, 62,27; Η, 4,18; СІ, 9,19; Ν, 3,63. Знайдено: С, 62,21; Η, 4,03; СІ, 8,99; Ν, 3,52. Методика 2 Метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилат при температурі навколишнього середовища (12,0 г; 0,045 моля) суспендують у ксилолі (60 мл). До цієї суспензії додають оцтовий ангідрид (16,2 г; 0,157 моля). Суміш кип'ятять зі зворотним холодильником, протягом 40 хв додають триметилортобензоат (20,0 г; 0,108 моля) і нагрівання продовжують протягом ще 4 год. Суміш охолоджують до 0°С і матковий розчин відокремлюють. Тверду речовину послідовно промивають ксилолом (14 мл) і сумішшю ксилолу (8 мл) і етилацетату (8 мл). Після сушіння виділяють 14,3 г (81,0 %) "хлоренолу" у вигляді жовтих кристалів. Методика 3 Метил-1-(хлорацетил)-2-оксоіндолін-6-карбоксилат (12,0 г; 0,045 моля) при температурі навколишнього середовища суспендують у толуолі (60 мл). До цієї суспензії додають оцтовий ангідрид (16,2 г; 0,157 моля). Суміш кип'ятять зі зворотним холодильником, протягом 40 хв додають триметилортобензоат (20,0 г; 0,108 моля) і нагрівання продовжують протягом ще 3 год. Суміш охолоджують до 0°С і матковий розчин відокремлюють. Тверду речовину послідовно 8 UA 97872 C2 промивають толуолом (14 мл) і сумішшю толуолу (8 мл) і етилацетату (8 мл). Після сушіння виділяють 15,3 г (87,3 %) "хлоренолу" у вигляді бежевих кристалів. Приклад 4: Синтез "енолідолу" (метил-3-[метокси(феніл)метилен]-2-оксоіндолін-6карбоксилату) 5 10 15 20 25 30 35 40 Методика 1 Розчин гідроксиду калію (0,41 г, 0,006 моля) у метанолі (4 мл) при 63 °С додають до суспензії метил-1-(хлорацетил)-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату (8,0 г; 0,020 моля) у метанолі (32 мл). Потім суміш перемішують протягом 30 хв, охолоджують до 0°С і перемішування продовжують протягом 2 год. Після фільтрування тверду речовину промивають метанолом (24 мл) і сушать і одержують 6,0 г (94,6 %) "енолідолу" у вигляді жовтих кристалів. 1 Н-ЯМР (500 МГц, CDCI3) δ: 8,08 (s, 1 Η, 1-Η); 7,88 (d, J = 7,8 Гц, 1 Η, 9-H); 7,75 (m, 1 Η, 8-Η); 7,52 - 7,56 (m, 3 Η, 18-Η, 19-Η, 20-Н); 7,40 - 7,45 (m, 3 Н, 6-Н, 17-Н, 21-Н); 3,92 (s, 3 Н, 23-Η3); 3,74 (s, 13 3 Н, 13-Н3). С-ЯМР (126 МГц, CDCI3) δ: 168,8 (С-2); 107,4 (С-3); 130,8 (С-4); 138,2 (С-5); 109,4 (С-6); 128,2 і 128,3 (С-7, С-16); 123,5 (С-8); 123,1 (С-9); 170,1 (С-11); 57,6 (С-13); 167,2 (С-14); + 128,7 і 128,9 (С-17, С-18, С-20, С-21); 130,5 (С-19); 52,1 (С-23). МС (m/z): 310 (Μ + Н) . Аналіз: Розраховано для C18H15NO4: С, 69,89; Η, 4,89; Ν, 4,53. Знайдено: С, 69,34; Η, 4,92; Ν, 4,56. Методика 2 Суспензію метил-1-(хлорацетил)-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату (7,0 г; 0,018 моля) у метанолі (28 мл) кип'ятять зі зворотним холодильником. До цієї суспензії протягом 3 хв додають розчин метоксиду натрію у метанолі (0,24 г, 30 % (мас/мас), 0,001 моля). Потім суміш перемішують протягом 30 хв, охолоджують до 5°С і перемішування продовжують протягом 2 год. Після фільтрування тверду речовину промивають метанолом (9 мл) і сушать і одержують 5,4 г (89,7 %) "енолідолу" у вигляді жовтих кристалів. Методика 3 Суспензію метил-1-(хлорацетил)-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату (8,0 г; 0,021 моля) у метанолі (32 мл) кип'ятять зі зворотним холодильником. До цієї суспензії по краплях додають розчин метоксиду натрію у метанолі (0,74 г, 30 % (мас/мас), 0,004 моля), додатково розведений метанолом (4 мл). Потім суміш перемішують протягом 90 хв, охолоджують до 0°С і перемішування продовжують протягом 2 год. Після фільтрування тверду речовину промивають метанолом (24 мл) і сушать і одержують 5,9 г (91,2 %) "енолідолу" у вигляді жовтих кристалів. Приклад 5: Синтез "хлорацетилу" (N-(4-нітроаніліно)-N-метил-2-хлорацетаміду) Методика 1 Суспензію N-метил-4-нітроаніліну (140 г; 0,920 моля) в етилацетаті (400 мл) нагрівають до 70°С. До цієї суспензії протягом 90 хв додають хлорацетилхлорид (114 г; 1,009 моля). Потім отриманий розчин кип'ятять зі зворотним холодильником протягом 1 год, охолоджують до 60°С і додають метилциклогексан (245 мл). Потім суспензію охолоджують до 0°С і перемішують протягом ще 1 год. Реакційну суміш фільтрують, промивають метилциклогексаном (285 мл) і 9 UA 97872 C2 5 10 15 20 25 30 35 40 45 50 речовину, що випала в осад, сушать і одержують 210,4 г (92,7 %) "хлорацетилу" у вигляді білих 1 кристалів. Н-ЯМР (500 МГц, ДМСО-d6) δ: 8,29 (d, J = 8,5 Гц, 2 Η, 1-Η + 3-Η); 7,69 (d, J = 8,5 Гц, 2 13 Η, 4-Η + 6-Η); 4,35 (s, 2 Η, 9-Η2); 3,33 (s, 3 Η, 12-Η3). С-ЯМР (126 МГц, ДМСО-d6) δ: 124,6 (С-1 + С-3); 145,6 (С-2); 127,4 (С-4 + С-6); 148,6 (С-5); 165,6 (С-8); 42,7 (С-9); 37,2 (С-12).МС (m/z): 229 + (Μ + Н) . Аналіз: Розраховано для C9H9CIN2O3: С, 47,28; Н, 3,97; Ν, 12,25. Знайдено: С, 47,26; Н, 3,99; СІ, 15,73; Ν, 12,29. Методика 2 Суспензію М-метил-4-нітроаніліну (20,0 г; 0,131 моля) в етилацетаті (20 мл) нагрівають до 60°С. До цієї суспензії протягом 15 хв додають розчин ангідриду хлороцтової кислоти (26,0 г; 0,151 моля) в етилацетаті (60 мл). Потім отриманий розчин кип'ятять зі зворотним холодильником протягом 1 год, охолоджують до 75°С і додають метилциклогексан (80 мл). Після внесення затравлення при 60°С суспензію охолоджують до 0°С і перемішують протягом ще 1 год. Реакційну суміш фільтрують, промивають метилциклогексаном (40 мл) і речовину, що випала в осад, сушать і одержують 25,9 г (83,3 %) "хлорацетилу" у вигляді сірих кристалів. Приклад 6: Синтез "нітроаніліну" (N-(4-нітрофеніл)-N-метил-2-(4-метилпіперазин-1іл)ацетаміду) і "аніліну" (N-(4-амінофеніл)-N-метил-2-(4-метилпіперазин-1-іл)ацетаміду) Методика 1 Суспензію N-(4-нітроаніліно)-N-метил-2-хлорацетаміду (20,0 г; 0,087 моля) у толуолі (110 мл) нагрівають до 40°С. Протягом 30 хв по краплях додають 1-метилпіперазин (21,9 г; 0,216 моля). Після промивання краплинної лійки толуолом (5 мл) реакційну суміш перемішують при 5 5 °С протягом 2 год, охолоджують до температури навколишнього середовища й промивають водою (15 мл). Органічний шар розбавляють ізопропанолом (100 мл) і додають Pd/C (10%; 1,0 г). Після наступного гідрування (Н2, 4 бар) при 20°С каталізатор видаляють. Приблизно 4/5 об'єму отриманого розчину випарюють при 50°С. Отриманий залишок розчиняють в етилацетаті (20 мл) і толуолі (147 мл), нагрітих до 80°С, потім охолоджують до 55°С і вносять затравлення. Потім реакційну суміш охолоджують до 0°С і перемішують при такій же температурі протягом 3 год. Після фільтрування тверду речовину промивають охолодженим льодом толуолом (40 мл) і 1 сушать і одержують 20,2 г (88,0 %) "аніліну" у вигляді білих кристалів. H-ЯМP (500 МГц, ДМСОd6) δ: 6,90 (d, J = 8,5 Гц, 2 Η, 4-Η + 6-Н); 6,65 (d, J = 8,5 Гц, 2 Η, 1-Н + 3-Н); 5,22 (2 Η, 19-Η2); 3,04 (s, 3 Η, 9-Η3); 2,79 (s, 2 Η, 11-H2); 2,32 (m, 4 Η, 13-Η2 + 17-Η2); 2,23 (m, 4 Η, 14-Η2 + 16-Η2); 2,10 (s, 13 3 Н, 18-Η3). С-ЯМР (126 МГц, ДМСО-d6) δ: 114,0 (С-1 + С-3); 148,0 (С-2); 127,6 (С-4 + С-6); 131,5 (С-5); 168,9 (С-8); 36,9 (С-9); 58,5 (С-11); 52,4 (С-13 + С-17); 54,6 (С-14 + С-16); 45,7 (С-18). + МС (m/z): 263 (Μ + Н) . Аналіз: Розраховано для C14H22N4O: С, 64,09; Η, 8,45; Ν, 21,36. Знайдено: С, 64,05; Η, 8,43; Ν, 21,39. Методика 2 Суспензію N-(4-нітроаніліно)-N-метил-2-хлорацетаміду (14,5 г; 0,063 моля) в етилацетаті (65 мл) нагрівають до 40°С. Протягом 30 хв по краплях додають 1-метилпіперазин (15,8 г; 0,156 моля). Після промивання краплинної лійки етилацетатом (7 мл) реакційну суміш перемішують при 50°С протягом 90 хв, охолоджують до температури навколишнього середовища й промивають водою (7 мл). Органічний шар розбавляють ізопропанолом (75 мл) і сушать над сульфатом натрію. Після відділення твердої речовини додають Pd/C (10%; 2,0 г) і розчин гідрують (Н2, 5 бар) при температурі навколишнього середовища без охолодження. Потім каталізатор видаляють фільтруванням і розчинник випарюють при 60°С. Отриманий залишок розчиняють в етилацетаті (250 мл) і перекристалізовують. Після фільтрування й сушіння виділяють 10,4 г (60,4 %) "аніліну" у вигляді білих кристалів. Приклад 7: Синтез "аніліно" (3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)-метилкарбоніл)-Nметиламіно)-аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону) 10 UA 97872 C2 5 10 15 20 25 Методика 1 Суспензію метил-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату (10,0 г; 0,032 моля) і N-(4-амінофеніл)-N-метил-2-(4-метилпіперазин-1-іл)ацетаміду (8,6 г; 0,032 моля) у суміші метанолу (72 мл) і Ν,Ν-диметилформаміду (18 мл) кип'ятять зі зворотним холодильником. Після кип'ятіння зі зворотним холодильником протягом 7 год суспензію охолоджують до 0°С і перемішування продовжують протягом ще 2 год. Тверду речовину відфільтровують, промивають метанолом (40 мл) і сушать і одержують 15,4 г (88,1 %) "аніліно" у вигляді жовтих 1 кристалів. Н-ЯМР (500 МГц, ДМСО-d6) δ: 11,00 (s, 1 Η, 23-Η); 12,23 (s, 19-H); 7,61 (t; J = 7,1 Гц, 1 Η, 33-Η); 7,57 (t, J = 7,5 Гц, 2 Η, 32-H + 34-Н); 7,50 (d, J = 7,7 Гц, 2 Η, 31-Η + 35-Η); 7,43 (d, J = 1,6 Гц, 1 Η, 29-H); 7,20 (dd, J = 8,3; 1,6 Гц, 1 Η, 27-Η); 7,13 (d, J = 8,3 Гц, 2 Η, 14-Η + 18-Н); 6,89 (d, 8,3 Гц, 2 Η, 15-Η + 17-Н); 5,84 (d, J = 8,3 Гц, 1 Η, 26-Η); 3,77 (s, 3 Η, 40-Η3); 3,06 (m, 3 Η, 12-Нз); ІЗ 2,70 (m, 2 Η, 8-H2); 2,19 (m, 8 Η, 2-Η2, 3-Η2, 5-Н2, 6-Н2); 2,11 (s, 3 Н, 7-Н3). С-ЯМР (126 МГц, ДМСО-d6) δ: 54,5 (С-2 + С-6); 52,2 (С-3 + С-5); 45,6 (С-7); 59,1 (С-8); 168,5 (С-9); 36,6 (С-12); 140,1 (С-13); 127,6 (С-14 + С-18); 123,8 (С-17 + С-15); 137,0 (С-16); 158,3 (С-20); 97,5 (С-21); 170,1 (С-22); 136,2 (С-24); 128,9 (С-25); 117,2 (С-26); 121,4 (С-27); 124,0(С-28); 109,4 (С-29); 131,9 (С-30); 128,4 (С-31+ С-35); 129,4 (С-32 + С-34); 130,4 (С-33); 166,3 (С-37); 51,7 (С-40). МС + (m/z): 540 (Μ + Н) . Аналіз: Розраховано для C31H33N5O4: С, 69,00; Н, 6,16; Ν, 12,98. Знайдено: С, 68,05; Н, 6,21; Ν, 12,81. Методика 2 Суспензію метил-3-[метокси(феніл)метилен]-2-оксоіндолін-6-карбоксилату (20,0 г; 0,064 моля) і N-(4-амінофеніл)-N-метил-2-(4-метилпіперазин-1-іл)ацетаміду (17,1 г; 0,065 моля) у метанолі (180 мл) кип'ятять зі зворотним холодильником протягом 7,5 год. Отриману суспензію протягом 1 год охолоджують до 10°С і перемішування продовжують протягом ще 1 год. Після фільтрування тверду речовину промивають охолодженим льодом метанолом (80 мл) і сушать і одержують 31,0 г (89,0 %) "аніліно" у вигляді жовтих кристалів. ФОРМУЛА ВИНАХОДУ 30 1. Сполука формули R 2 R 3 O O N O R 1 , 1 2 3 2 у якій R означає атом водню або Сl-СН2-СО-групу, a R і R кожний означає атом водню або R і O 35 3 R разом являють собою -групу, 1 2 3 за умови, що, якщо R означає атом водню, то R і R разом являють собою O -групу. 11 UA 97872 C2 2. Сполука формули O O O N H O . 3. Сполука формули O O O N O 5 O Cl . 4. Сполука формули O O N O O Cl . 5. Спосіб одержання сполуки формули O O O N H O , який включає стадію каталізованого основою дехлорацетилування сполуки формули O O O N O 10 O Cl . 6. Спосіб за п. 5, у якому сполуку формули O O O N O O Cl одержують за реакцією сполуки формули 12 UA 97872 C2 O O N O O Cl зі сполукою формули O O O . 7. Спосіб за п. 6, у якому сполуку формули O O N O O 5 Cl одержують за реакцією сполуки формули O O N H O зі сполукою формули O Cl 10 O Cl O . 8. Спосіб за п. 7, у якому сполуку формули O O N H O одержують за допомогою наведених нижче стадій: (і) етерифікація сполуки формули Cl H O O 15 O + N O з утворенням сполуки формули Cl O + O N O O ; (іі) реакція продукту реакції (і) з диметиловим ефіром малонової кислоти з утворенням сполуки формули O O O O NO2 O O 20 ; (ііі) проведення циклізації продукту реакції (іі) за допомогою реакції гідрування. 9. Спосіб одержання сполуки формули 13 UA 97872 C2 O O O N O O Cl , що включає стадію реакції сполуки формули O O N O O Cl зі сполукою формули O O 5 O . 10. Спосіб одержання сполуки формули O O N O O Cl , що включає стадію реакції сполуки формули O O N H O 10 зі сполукою формули O Cl O O Cl . Комп’ютерна верстка Т. Чепелева Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolinone derivatives and process for their manufacture
Автори англійськоюMerten, Joern, Renner, Svenja, Reichel, Carsten
Назва патенту російськоюПроизводные индолинона и способы их получения
Автори російськоюМертен Йорн, Реннер Свенья, Райхель Карстен
МПК / Мітки
МПК: C07D 209/34
Мітки: індолінону, способи, похідні, одержання
Код посилання
<a href="https://ua.patents.su/16-97872-pokhidni-indolinonu-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні індолінону та способи їх одержання</a>












