Сполуки 5,6-дигідро-1н-піридин-2-ону
Номер патенту: 100120
Опубліковано: 26.11.2012
Автори: Мерфі Дуглас Ерік, Блаттер Фріц, Тран Чин В'єт, Рубсам Френк, Чен Ліджіан, Джоу Юефен, Драґовіч Пітер Ес., Куцера Дейвід, Віртелхаус Мартін
Формула / Реферат
1. Сполуки Формули І
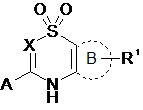 , І
, І
де
X являє собою N або CR3,
А являє собою
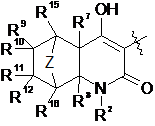
або
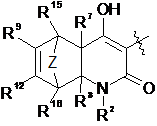 ,
,
кільце В являє собою 6-членний арил або гетероцикліл, необов'язково заміщений 1-3 складовими R1, де R1 являє собою Н, галоген, нітро, -CHR4-S(O)2R5, -C(S(O)2R5)=CHR4-, -NR5R6, -NR4S(O)2R5 або -NR4S(O)2NR5R6, де R4, R5 і R6 незалежно являють собою Н, С1-С6алкіл, С3-C8циклоалкіл, С(О)О-(С1-С6алкіл), арил або гетероцикліл, або R4 і R5 або R5 і R6, об'єднані з атомом(ами), до якого(их) вони приєднані, утворюють 5- або 6-членне кільце гетероциклілу,
R2 являє собою Н, С1-С6алкіл, С3-C8циклоалкіл, -С1-С6алкілен(С3-С8циклоалкіл), -С1-С6алкілен(арил), -С1-С6алкілен(гетероцикліл), арил або гетероцикліл,
R3 являє собою Н, галоген або C1-С6алкіл,
Z являє собою -(CR13R14)n- або О,
n дорівнює 1 або 2,
R7 і R8 незалежно являють собою Н або С1-С6алкіл,
R9, R10, R11, R12, R13, R14, R15 і R16 незалежно являють собою Н, С1-С6алкіл, гідрокси або галоген,
де зазначена вище алкільна, алкіленова, арильна, циклоалкільна або гетероциклільна складова, що передбачена в R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15 і R16, кожна є необов'язково та незалежно заміщеною 1-3 замісниками, вибраними з алкіламіну,
аміно,
арилу, циклоалкілу, гетероциклілу,
С1-С6алкілу, С1-С6галогеналкілу, С1-С6гідроксіалкілу, С1-С6алкокси, С1-С6алкіламіну, С1-С6діалкіламіну, С2-С6алкенілу або С2-С6алкінілу, кожен з яких може бути перерваний одним або більше гетероатомами,
карбоксилу,
ціано,
галогену,
гідрокси,
кето,
нітро,
-С(О)ОН, -C(O)NH2, -С(О)(С1-С6алкіламін), -С(О)(С1-С6діалкіламін), -С(О)2-(С1-С6алкіл), -С(О)2-(С3-С8циклоалкіл), -С(О)2-(арил), -С(О)2-(гетероцикліл), -С(О)2-(С1-С6алкілен)арилу, -С(О)2-(С1-С6алкілен)гетероциклілу, -С(О)2-(С1-С6алкілен)циклоалкілу, -С(О)(С1-С6алкіл), -С(О)(С3-С8циклоалкіл), -С(О)(арил), -С(О)(гетероцикліл), -С(О)(С1-С6алкілен)арилу, -С(О)(С1-С6алкілен)гетероциклілу і -С(О)(С1-С6алкілен)циклоалкілу,
де кожний із зазначених вище необов'язкових замісників може бути також необов'язково заміщений 1-5 замісниками, вибраними з аміно, ціано, галогену, гідрокси, нітро, С1-С6алкіламіну, С1-С6діалкіламіну, С1-С6алкілу, С1-С6алкокси, С1-С6алкенілу і С1-С6гідроксіалкілу, де кожний алкіл є необов'язково заміщеним одним або більше галогеновими замісниками,
або їх фармацевтично прийнятні солі або стереоізомери.
2. Сполука за п. 1, де кільце В є вибраним з
 ,
, 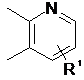 ,
, 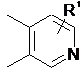 ,
, 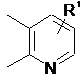 та
та 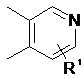 .
.
3. Сполука за п. 2, де кільце В являє собою
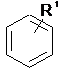 , та
, та
R1 являє собою Н, галоген, нітро, -CHR4-S(O)2R5, -C(S(O)2R5)=CHR4-, -NR5R6, -NR4S(O)2R5 або -NR4S(O)2NR5R6.
4. Сполука за п. 3, де R1 являє собою -NR4S(O)2R5, a R4 і R5 незалежно являють собою Н, С1-С6алкіл або С3-C8циклоалкіл.
5. Сполука за п. 4, де R1 є вибраним з
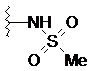 ,
, 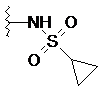 та
та 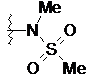 .
.
6. Сполука за п. 1, де R2 є вибраним з
![]() ,
, 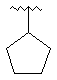 ,
, 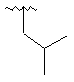 ,
, 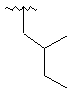 ,
, 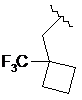 ,
, 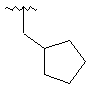 ,
, 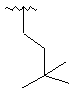 ,
,
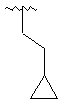 ,
, 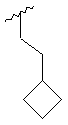 ,
, 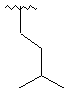 ,
, 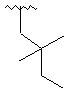 ,
, 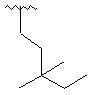 ,
, 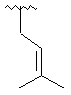 ,
, 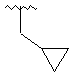 ,
,
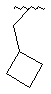 ,
, 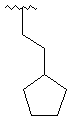 ,
, 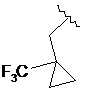 ,
, 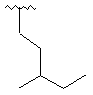 ,
,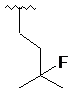 ,
, 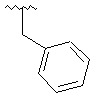 ,
, 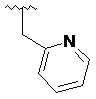 ,
,
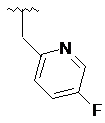 ,
,  ,
,  ,
, 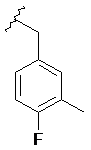 ,
, 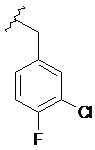 та
та  .
.
7. Сполука за п. 6, де R2 є вибраним з
![]() ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
, 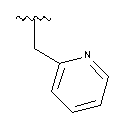 ,
, 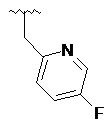 ,
,  ,
,  ,
,  ,
, 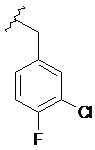 та
та  .
.
8. Сполука за п. 7, де R2 є вибраним з
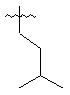 ,
, 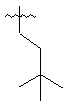 ,
, 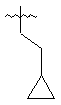 та
та 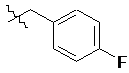 .
.
9. Сполука за п. 1, де R3 є вибраним з водню або С1-С6алкілу.
10. Сполука за п. 9, де R3 є вибраним з
![]() та
та ![]() .
.
11. Сполука за п. 1, де R7 і R8 являють собою Н.
12. Сполука за п. 1, де R9, R10, R11, R12, R13, R14, R15 і R16 нeзaлeжнo є вибраними з
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
,
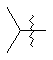 ,
, 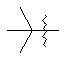 ,
, ![]() та
та ![]() .
.
13. Сполука за п. 12, де R9, R10, R11, R12, R13, R14, R15 і R16 незалежно є вибраними з
![]() ,
, ![]() ,
, ![]() та
та ![]() .
.
14. Сполука за п. 13, де R9, R10, R11, R12, R13, R14, R15 і R16 являють собою Н або гідрокси.
15. Сполука за п. 14, де R9, R10, R11, R12, R13, R14, R15 і R16 являють собою Н.
16. Сполука за п. 1, де n дорівнює 1.
17. Сполука, вибрана з:
(рац-діекзо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діендо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діендо)-N-{3-[3-(5-фторопіридин-2-ілметил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1S,2S,7R,8R)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2R,7S,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1S,2R,7S,8R)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діендо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1S,2R,7S,8R)-3-(4-фторо-3-метилбензил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(4-фторо-3-метилбензил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(3,3-диметилбутил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1S,2R,7S,8R)-3-(4-фторобензил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(4-фторо-3-метилбензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(3,4-дифторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(3,4-дифторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(4-фторо-3-метилбензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду,
(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідрокси-5-(7-йодо-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-5-[7-(1,1-діоксо-4,5-дигідро-1H-1l6-тіофен-2-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-5-[7-(1,1-діоксотетрагідро-1l6-тіофен-2-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(2-циклопропілeтил)-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду,
(рац-діекзо)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-5-[7-(1,1-діоксо-1l6-ізотіазолідин-2-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-N-[3-(6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо [1,2,4]тіадіазин-7-іл]-метансульфонаміду,
(1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,4]тіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-5-(7-аміно-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(рац-діекзо)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзo)-N-{3-[3-(3,3-диметилбутил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-6-гідрокси-5-(7-йодо-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-3-(3-метилбутил)-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-6-гідрокси-5-(7-йoдo-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-3-(3-метилбутил)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду циклопропансульфонової кислоти,
(рац-діекзо)-N-{3-[3-(3,3-диметилбутил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,4]тіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,4]тіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,4]тіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду,
{3-(1R,2S,7R,8S)-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду циклопропансульфонової кислоти,
(1R,2S,7R,8S)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-бензолсульфонаміду,
{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-діекзо)-циклопропансульфонової кислоти,
{3-[3-(3,3-диметилбутил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-діекзо)-циклопропансульфонової кислоти,
N-[3-(1R,2S,7R,8S)-3-циклопентил-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду,
{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-діекзо)-циклопропансульфонової кислоти,
{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-діекзо)-циклопропансульфонової кислоти,
N-[3-(1R,2S,7R,8S)-(3-циклопентил-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл]-метансульфонамід-N-ізопропілу карбамату,
(рац-діекзо)-N-[3-(3-циклопентил-6-гідроксі-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду,
N-{3-[(2S,7R)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
цис-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
рац-N-{3-[(1R,2R,7S,8S,9S,11R)-3-[(4-фторофеніл)метил]-6-гідроксі-4-оксо-3-азатетрацикло[6.3.2.02,7.09,11]тридец-5-ен-5-іл]-1,1-діоксо-4Н-1l6,2,4-бензотіадіазин-7-іл}-метансульфонаміду,
рац-N-{3-[(1R,2S,7R,8S,9S,11R)-3-[(4-фторофеніл)метил]-6-гідроксі-4-оксо-3-азатетрацикло[6.3.2.02,7.09,11]тридец-5-ен-5-іл]-1,1-діоксо-4Н-1l6,2,4-бензотіадіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-5-(1,1-діоксо-7-піролідин-1-іл-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-3-іл)-6-гідрокси-3-(3-метилбутил)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-аміду піридин-3-сульфонової кислоти,
(1R,2S,7R,8S)-N-{3-[3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-сульфаміду,
(1R,2S,7R,8S)-N-[3-(3-бензил-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду,
(1R,2S,7R,8S)-N-[3-(6-гідроксі-3-ізобутил-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл)-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду,
(1R,2S,7R,8S)-N-{3-[3-(3-хлоро-4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(рац-діекзо)-N-{3-[6-гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(3-фторо-4-метилбензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-5-(7-бpoмо-1,1-діоксо-1,4-дигідро-1l6-піридо[2,3-е][1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-піридо[2,3-е][1,2,4]тіадіазин-7-іл}-метансульфонаміду,
(1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1l6-піридо[2,3-е][1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1l6-піридо[4,3-е][1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
(1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1l6-піридо[3,2-е][1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6-гідроксі-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-ону,
N-{3-[(1R,2S,7R,8S)-3-(2-циклопропілетил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6,9-дигідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-аргінінової солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-лізинової солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, гемімагнієвої солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, натрієвої солі, і
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, калієвої солі.
18. Сполука за п. 17, вибрана з
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-аргінінової солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-лізинової солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, гемімагнієвої солі,
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, натрієвої солі, і
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, калієвої солі.
19. Сполука за п. 17, вибрана з
N-{3-[(1S,2S,7R,8R)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду,
N-{3-[(2S,7R)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду і
N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду або їх фармацевтично прийнятних солей.
20. Сполука за п. 19, що є N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонамідом або його фармацевтично прийнятною сіллю.
21. Сполука за п. 20 в кристалічній формі.
22. Сполука за п. 21, де кристалічна форма має:
рентгенодифракцію (2-тета) з найбільш сильними лініями, що спостерігаються при кутах 6,2°, 17,9°, 19,7°, 20,5°, 22,6° і 24,8°±0,3°, з лініями меншої інтенсивності при 12,4°, 16,5°, 18,7°, 21,6°, 23,2°, 24,1°, 25,6°, 26,6°, 27,1°, 28,5° i 29,3°; і
характеристичні інфрачервоні смуги поглинання при 1617, 1524, 1321, 1260, 1229, 1217 і 1163 см-1, з другорядними смугами при 1498, 1465, 1147, 836, 727 і 406 см-1.
23. Фармацевтично прийнятна композиція, що містить сполуку у відповідності з будь-яким з пп. 1-22 і фармацевтично прийнятний носій.
24. Сполука, вибрана з:
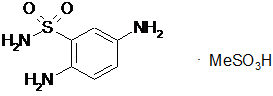 ,
, 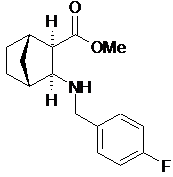 ,
, 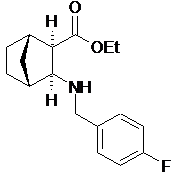 ,
,
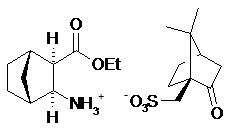 ,
, 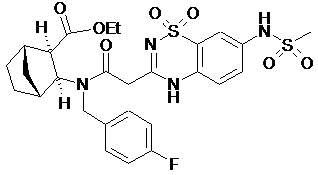 ,
,
 і
і  .
.
25. Спосіб інгібування реплікації вірусу гепатиту С, який включає піддавання вірусу гепатиту С дії терапевтично ефективної кількості сполуки у відповідності з будь-яким з пп. 1-22.
26. Спосіб за п. 25, де інгібування реплікації здійснюють у присутності одного або декількох додаткових терапевтичних агентів, вибраних з групи, що складається з антибіотика, протиблювотного агента, антидепресанту, протигрибкового агента, протизапального агента, противірусного агента, протиракового агента, імуномодуляторного агента, a-інтерферону, b-інтерферону, рибавірину, алкілувального агента, гормону, цитокіну і модулятора toll-подібних рецепторів.
27. Спосіб лікування або профілактики інфекції вірусу гепатиту С у ссавця, який потребує цього, який включає введення ссавцю терапевтично або профілактично ефективної кількості сполуки у відповідності з будь-яким з пп. 1-22.
28. Спосіб за п. 27, де ссавець - це людина.
29. Спосіб за п. 27, який також включає введення ссавцю одного або декількох додаткових терапевтичних агентів.
30. Спосіб за п. 29, де додатковий терапевтичний агент вибирають з групи, що складається з антибіотика, протиблювотного агента, антидепресанту, протигрибкового агента, протизапального агента, противірусного агента, протиракового агента, імуномодуляторного агента, a-інтерферону, b-iнтерферону, рибавірину, алкілувального агента, гормону, цитокіну і модулятора toll-подібних рецепторів.
31. Спосіб за п. 27, де сполука являє собою N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}метансульфонамід або його фармацевтично прийнятну сіль.
32. Спосіб за п. 31, в якому вводять додатковий терапевтичний агент, що являє собою ITMN-191, або його фармацевтично прийнятну сіль.
33. Спосіб одержання N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду формули
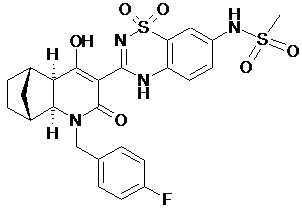 ,
,
при якому здійснюють:
(і) реакцію (рац-діекзо)-3-азатрицикло[4.2.1.02,5]нонан-4-ону формули:
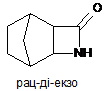
з (1S)-(+)-10-камфорсульфоновою кислотою у присутності етилацетату і етанолу з утворенням (1R,2S,3R,4S)-3-етоксикарбонілбіцикло[2.2.1]гепт-2-иламінію (1’S)-(+)-10-камфорсульфонату формули:
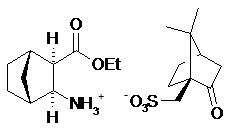 ;
;
(іі) реакцію відновного амінування шляхом додавання 4-фторобензальдегіду до камфорсульфонатної сполуки з етапу (і) та відновлення одержаного іміну з утворенням етилового естеру (1S,2R,3S,4R)-3-(4-фторобензиламіно)біцикло[2.2.1]гептан-2-карбонової кислоти формули:
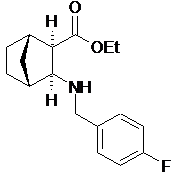 ;
;
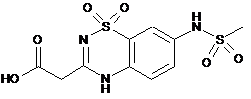
(ііі) сполучання естерної сполуки з етапу (іі) з (7-метансульфоніламіно-1,1-діоксо-1,4-дигідро-1l6-бензо[1.2.4]тіадіазин-3-іл)оцтовою кислотою формули:

з утворенням етилового естеру (1S,2R,3S,4R)-3-{(4-фторобензил)-[2-(7-метансульфоніламіно-1,1-діоксо-1,4-дигідро-1l6-бензо[1.2.4]тіадіазин-3-іл)ацетил]аміно}-біцикло[2.2.1]гептан-2-карбонової кислоти формули:
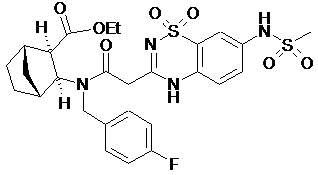 , i
, i
(iv) циклізацію естерної сполуки з етапу (ііі) з утворенням N-{3-[(1R,2S,7R,8S)-3-(4-фторобензил)-6-гідроксі-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1l6-бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду формули:
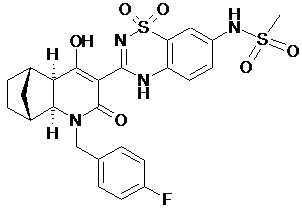 .
.
34. Спосіб за п. 33, де на етапі (і) здійснюють:
(a) розкриття кільця азетидинону трициклічної сполуки формули:
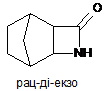
з утворенням біциклічної сполуки формули:
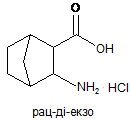 ;
;
(b) обробку біциклічної сполуки з етапу (а) тіонілхлоридом і етанолом з утворенням естеру формули:
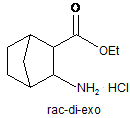 ; і
; і
(c) додавання основи і потім додавання розчину (1S)-(+)-10-камфорсульфонової кислоти з утворенням камфорсульфонатної сполуки формули:
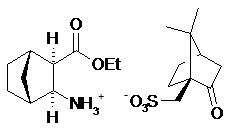 .
.
35. Спосіб за п. 34, де розкриття кільця на етапі (а) здійснюють у присутності водного розчину хлористоводневої кислоти.
36. Спосіб за п. 33, де відновлення іміну на етапі (іі) здійснюють ціаноборогідридом натрію, борогідридом натрію, триацетоксиборогідридом натрію або гідрогенуванням за допомогою паладієвого або платинового каталізатора.
37. Спосіб за п. 33, де реакцію сполучання на етапі (ііі) здійснюють у присутності 4-диметиламінопіридину або N-метилморфоліну і 1-[3-(диметиламіно)пропіл]-3-етилкарбодііміду гідрохлориду.
38. Спосіб за п. 33, де реакцію циклізації на етапі (iv) здійснюють у присутності етоксиду натрію в етанолі або триетиламіні.
Текст
Реферат: Винахід стосується сполук 5,6-дигідро-1H-піридин-2-ону і фармацевтичних композицій, які містять такі сполуки, що корисні в лікуванні інфекції вірусу гепатиту С. UA 100120 C2 (12) UA 100120 C2 UA 100120 C2 5 10 15 20 25 30 35 40 45 ГАЛУЗЬ ТЕХНІКИ Винахід спрямовано на сполуки 5,6-дигідро-1H-піридин-2-ону та на фармацевтичні композиції, що містять такі сполуки, які є корисними при лікуванні вірусної інфекції гепатиту C. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Гепатит С є головною проблемою охорони здоров'я в усьому світі. Світова Організація охорони здоров'я оцінює, що 170 мільйонів людей є хронічними носіями вірусу гепатиту С (HCV), з них 4 мільйони носіїв знаходяться тільки в Сполучених Штатах. В Сполучених Штатах інфекція вірусу гепатиту С складає 40% хронічних захворювань печінки, а захворювання на HCV є найбільш загальною причиною трансплантації печінки. Інфекція HCV призводить до хронічної інфекції, а у біля 70% інфікованих осіб розвиваються хронічні гістологічні зміни в печінці (хронічний гепатит) з 10-40% ризиком цирозу і оціночним ризиком у 4% появи печінковоклітинного раку впродовж життя. Центр контролю захворювань (Center for Disease Control) дає оцінку, що кожного року в Сполучених Штатах нараховується 35000 нових випадків інфікування HCV і приблизно десять тисяч смертей пояснюються хворобою HCV. Сучасним стандартом догляду є лікування комбінацією пегілованого інтерферону/рибавірину, що коштує 31000 доларів на рік. Ці ліки мають важкі проблеми з дозуванням і побічними ефектами, що робить неможливим їх застосування у майже половини діагностованих пацієнтів. Лікування пегілованим інтерфероном пов'язане із загрозою виникнення симптомів, подібних грипу, дратівливості, нездатності до концентрації, виникнення ідеї суїциду і лейкоцитопенії. Рибавірин пов'язують з гемолітичною анемією та з уродженими вадами розвитку. Загальна реакція на цю стандартну терапію є низькою: приблизно одна третина пацієнтів не виявляє реакції. Значна частина з тих, хто реагує, повторно захворює впродовж шести місяців після закінчення 6-12-місячного лікування. Як наслідок, показник довготривалої реакції стосовно усіх пацієнтів, що піддавалися лікуванню, становить тільки біля 50%. Відносно низький показник реакції і значні побічні ефекти сучасної терапії ліками проти HCV, до того ж, пов'язані з негативними довготривалими ефектами хронічної інфекції HCV, приводять до продовження існування медичної потреби в поліпшеній терапії. Є лише невелика кількість противірусних фармацевтичних засобів для лікування хвороб, викликаних РНК-вірусами, таких як HCV, і, як описано вище, вони часто пов'язані з численними несприятливими ефектами. У цілому ряді публікацій були описані інгібітори NS5B, корисні при лікуванні інфекції гепатиту С. Див., наприклад, публікацію заявки на патент США № US 2008/0031852 (де описані сполуки [1,2-b]піридазинону); публікацію заявки на патент США № US 2006/0189602 (що розкриває певні піридазинони); публікацію заявки на патент США №. US 2006/0252785 (що розкриває вибрані гетероцикли) і міжнародні публікації №№ WO 03/059356, WO 2002/098424 і WO 01/85172 (в кожній описується певний клас заміщених тіадіазинів). Незважаючи на те, що в певних випадках є доступними медичні засоби для зменшення симптомів захворювання, існує лише невелика кількість ліків, які ефективно інгібують реплікацію вірусів, які є причиною захворювання. Важливість і поширеність захворювань від РНК-вірусів, включаючи, але не обмежуючись тільки нею, хронічну інфекцію вірусу гепатиту C, та ще й у поєднанні з обмеженою можливістю використання та ефективністю сучасних противірусних фармацевтичних засобів створили нездоланну і триваючу потребу в нових фармацевтичних засобах для лікування цих захворювань. СУТЬ ВИНАХОДУ Цей винахід описує нові сполуки 5,6-дигідро-1H-піридин-2-ону та їх фармацевтично прийнятні солі, які є корисними при лікуванні або профілактиці вірусної інфекції гепатиту C у пацієнта, який потребує цього, яке включає введення пацієнту терапевтично або профілактично ефективної кількості сполуки 5,6-дигідро-1H-піридин-2-ону. У загальному аспекті винахід стосується сполук Формули І 50 O O S X A 55 B R1 I N H де 3 X являє собою N або CR , A являє собою 1 UA 100120 C2 R9 R10 R11 R15 R7 OH R8 N R2 Z R12 R16 O Або R15 9 R R7 OH R8 N R2 Z R12 5 10 15 20 25 30 35 40 45 R16 O , кільце B являє собою 6-членний арил або гетероцикліл, необов’язково заміщений 1-3 1 1 4 5 5 4 5 6 складовими R , де R являє собою H, галоген, нітро, -CHR -S(O)2R , -C(S(O)2R )=CHR -, -NR R , 4 5 4 5 6 4 5 6 -NR S(O)2R або -NR S(O)2NR R , де R , R і R незалежно являють собою H, C1-C6 алкіл, C3-C8 4 5 5 6 циклоалкіл, C(O)O-(C1-C6 алкіл), арил або гетероцикліл, або R і R або R і R , об'єднані з атом(ами), до якого(их) вони приєднані, утворюють 5- або 6-членне кільце гетероциклілу, 2 R являє собою H, C1-C6 алкіл, C3-C8 циклоалкіл, -C1-C6 алкілен(C3-C8 циклоалкіл), -C1-C6 алкілен(арил), -C1-C6 алкілен(гетероцикліл), арил або гетероцикліл, 3 R являє собою H, галоген або C1-C6 алкіл, 13 14 Z являє собою –(CR R )n- або O, n дорівнює 1 або 2, 7 8 R і R незалежно являють собою H або C1-C6 алкіл, 9 10 11 12 13 14 15 16 R , R , R , R , R , R , R і R незалежно являють собою H, C1-C6 алкіл, гідрокси або галоген, де зазначена вище алкільна, алкіленова, арильна, циклоалкільна або гетероциклільна 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 складова, що передбачена в R , R , R , R , R , R , R , R , R , R , R , R , R , R , R і R , кожна є необов’язково та незалежно заміщеною 1-3 замісниками, вибраними з алкіламіну, аміно, арилу, циклоалкілу, гетероциклілу, C1-C6 алкілу, C1-C6 галогеналкілу, C1-C6 гідроксіалкілу, C1-C6 алкокси, C1-C6 алкіламіну, C1-C6 діалкіламіну, C2-C6 алкенілу або C2-C6 алкінілу, де кожен з яких може бути перерваний одним або більше гетероатомами, карбоксилу, ціано, галогену, гідрокси, кето, нітро, -C(O)OH, -C(O)NH2, -C(O)(C1-C6 алкіламін), -C(O)(C1-C6 діалкіламін), -C(O)2-(C1-C6 алкіл), C(O)2-(C3-C8 циклоалкіл), -C(O)2-(арил), -C(O)2-(гетероцикліл), -C(O)2-(C1-C6 алкілен)арилу, C(O)2-(C1-C6 алкілен)гетероциклілу, -C(O)2-(C1-C6 алкілен)циклоалкілу, -C(O)(C1-C6 алкіл), -C(O)(C3-C8 циклоалкіл), -C(O)(арил), -C(O)(гетероцикліл), -C(O)(C1-C6 алкілен)арилу, -C(O)(C1C6 алкілен)гетероциклілу і -C(O)(C1-C6 алкілен)циклоалкілу, де кожний із зазначених вище необов’язкових замісників може бути також необов’язково заміщений 1-5 замісниками, вибраними з аміно, ціано, галогену, гідрокси, нітро, C1-C6 алкіламіну, C1-C6 діалкіламіну, C1-C6 алкілу, C1-C6 алкокси, C1-C6 алкенілу і C1-C6 гідроксіалкілу, де кожний алкіл є необов’язково заміщеним одним або більше галогеновими замісниками, або їх фармацевтично прийнятних солей, гідратів, сольватів, таутомерів або їх стереоізомерів. В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де кільце B є вибраним з 2 UA 100120 C2 та . В іншому варіанті здійснення кільце B являє собою R1 5 , 1 10 4 5 5 4 5 6 4 5 де R являє собою H, галоген, нітро, -CHR -S(O)2R , -C(S(O)2R )=CHR -, -NR R , -NR S(O)2R 4 5 6 або -NR S(O)2NR R . 1 В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де R являє 4 5 4 5 собою -NR S(O)2R , де R і R незалежно являють собою H, C1-C6 алкіл або C3-C8 циклоалкіл. 1 В іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R є вибраним з та 15 В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де R вибраним з 2 є 2 є та 20 В іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R вибраним з 3 UA 100120 C2 та 2 В іще іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R є вибраним з 5 та 3 10 В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де R є вибраним з водню або C1-C6 алкілу. 3 В іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R є вибраним з та 7 15 8 В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де R і R являють собою H. 9 10 11 В одному варіанті здійснення цей винахід відноситься до сполук Формули I, де R , R , R , 12 13 14 15 16 R , R , R , R і R незалежно є вибраними з та 20 9 10 10 11 В подальшому варіанті здійснення цей винахід відноситься до сполук Формули I, де R , R , 12 13 14 15 16 R , R , R , R , R і R незалежно є вибраними з 11 та 9 В іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R , R , R , 13 14 15 16 R , R , R , R і R являють собою H або гідрокси. 9 10 В іще іншому варіанті здійснення цей винахід відноситься до сполук Формули I, де R , R , 11 12 13 14 15 16 R , R , R , R , R і R являють собою H. В одному варіанті здійснення n дорівнює 1. В іншому варіанті здійснення цей винахід відноситься до сполук, вибраних з: 2,7 (рац-ді-екзо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-ендо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, (рац-ді-ендо)-N-{3-[3-(5-Фторопіридин-2-ілметил)-6-гідроксі-4-оксо-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 2,7 N-{3-[(1S,2S,7R,8R)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен12 25 30 35 4 UA 100120 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1R,2R,7S,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1S,2R,7S,8R)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, (рац-ді-екзо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 2,7 (рац-ді-екзо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-ендо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, N-{3-[(1S,2R,7S,8R)-3-(4-Фторо-3-метилбензил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, (рац-ді-екзо)-N-{3-[3-(4-Фторо-3-метилбензил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, (рац-ді-екзо)-N-{3-[3-(3,3-Диметилбутил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, N-{3-[(1S,2R,7S,8R)-3-(4-Фторобензил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, N-{3-[(1R,2S,7R,8S)-3-(4-Фторо-3-метилбензил)-6-гідроксі-4-оксо-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 2,7 N-{3-[(1R,2S,7R,8S)-3-(3,4-Дифторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец6 5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1R,2S,7R,8S)-3-(3,4-Дифторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец6 5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду, N-{3-[(1R,2S,7R,8S)-3-(4-Фторо-3-метилбензил)-6-гідроксі-4-оксо-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-Nметилметансульфонаміду, 6 (1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-5-(7-йодо-1,1-діоксо-1,4-дигідро-1λ 2,7 бензо[1,2,4]тіадіазин-3-іл)-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 6 6 (1R,2S,7R,8S)-5-[7-(1,1-діоксо-4,5-дигідро-1H-1λ -тіофен-2-іл)-1,1-діоксо-1,4-дигідро-1λ 2,7 бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4ону, 6 6 (1R,2S,7R,8S)-5-[7-(1,1-діоксотетрагідро-1λ -тіофен-2-іл)-1,1-діоксо-1,4-дигідро-1λ 2,7 бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4ону, 2,7 (1R,2S,7R,8S)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, (рац-ді-екзо)-N-{3-[3-(2-Циклопропілетил)-6-гідроксі-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 2,7 (1R,2S,7R,8S)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду, (рац-ді-екзо)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 6 6 (1R,2S,7R,8S)-5-[7-(1,1-діоксо-1λ -ізотіазолідин-2-іл)-1,1-діоксо-1,4-дигідро-1λ 2,7 бензо[1,2,4]тіадіазин-3-іл]-3-(4-фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4ону, 2,7 (1R,2S,7R,8S)-N-[3-(6-Гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-5-іл)-1,1-діоксо6 1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду, 6 (1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-3-іл)-3-(4-фторобензил)-6 5 UA 100120 C2 2,7 5 10 15 20 25 30 35 40 45 50 55 60 гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,4]тіазин-7-іл}-метансульфонаміду, 6 (1R,2S,7R,8S)-5-(7-Аміно-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-3-іл)-3-(42,7 фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 (рац-ді-екзо)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-екзо)-N-{3-[3-(3,3-Диметилбутил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека6 5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 6 (рац-ді-екзо)-6-Гідрокси-5-(7-йодо-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-3-іл)-3-(32,7 метилбутил)-11-окса-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 6 (1R,2S,7R,8S)-6-Гідрокси-5-(7-йодо-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-3-іл)-3-(32,7 метилбутил)-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 {3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду циклопропансульфонової кислоти, 2,7 (рац-ді-екзо)-N-{3-[3-(3,3-Диметилбутил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека6 5,9-дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,4]тіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-екзо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,4]тіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-екзо)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,4]тіазин-7-іл}-метансульфонаміду, 2,7 (рац-ді-екзо)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,96 дієн-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-N-метилметансульфонаміду, 2,7 {3-(1R,2S,7R,8S)-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду циклопропансульфонової кислоти, 2,7 (1R,2S,7R,8S)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-бензолсульфонаміду, 2,7 {3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-ді-екзо)-циклопропансульфонової кислоти, 2,7 {3-[3-(3,3-Диметилбутил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,9-дієн-5-іл]-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-ді-екзо)-циклопропансульфонової кислоти, 2,7 N-[3-(1R,2S,7R,8S)-3-Циклопентил-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл)-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду, 2,7 {3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,9-дієн-5-іл]-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-ді-екзо)-циклопропансульфонової кислоти, 2,7 {3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундека-5,9-дієн-5-іл]-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду (рац-ді-екзо)-циклопропансульфонової кислоти, 2,7 N-[3-(1R,2S,7R,8S)-(3-Циклопентил-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл)-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонамід-N-ізопропілу карбамату, 2,7 (рац-ді-екзо)-N-[3-(3-Циклопентил-6-гідроксі-4-оксо-11-окса-3-аза-трицикло[6.2.1.0 ]ундец-56 ен-5-іл)-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду, 2,7 N-{3-[(2S,7R)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.2.0 ]додец-5-ен-5-іл]6 1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 цис-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.2.0 ]додец-5-ен-5-іл]-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 9,11 (2R,7S)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-тетрацикло[6.3.2.0 .0 ]тридец-56 ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 9,11 (2S,7R)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-тетрацикло[6.3.2.0 .0 ]тридец-56 ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 6 (1R,2S,7R,8S)-5-(1,1-діоксо-7-піролідин-1-іл-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-3-іл)-62,7 гідрокси-3-(3-метилбутил)-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 {3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-56 іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-аміду піридин-3-сульфонової кислоти, 2,7 (1R,2S,7R,8S)-N-{3-[3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-сульфаміду, 6 UA 100120 C2 2,7 5 10 15 20 25 30 35 40 45 50 55 60 (1R,2S,7R,8S)-N-[3-(3-Бензил-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-5-іл)-1,16 діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду, 2,7 (1R,2S,7R,8S)-N-[3-(6-Гідроксі-3-ізобутил-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-5-іл)6 1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл]-метансульфонаміду, (1R,2S,7R,8S)-N-{3-[3-(3-Хлоро-4-фторобензил)-6-гідроксі-4-оксо-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, (рац-ді-екзо)-N-{3-[6-Гідрокси-3-(3-метилбутил)-4-оксо-11-окса-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-Nметилметансульфонаміду, N-{3-[(1R,2S,7R,8S)-3-(3-Фторо-4-метилбензил)-6-гідроксі-4-оксо-3-аза2,7 6 трицикло[6.2.1.0 ]ундец-5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}метансульфонаміду, 6 (1R,2S,7R,8S)-5-(7-Бромо-1,1-діоксо-1,4-дигідро-1λ -піридо[2,3-e][1,2,4]тіадіазин-3-іл)-3-(42,7 фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -піридо[2,3-e][1,2,4]тіадіазин-7-іл}-метансульфонаміду, 6 (1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1λ -піридо[2,3-e][1,2,4]тіадіазин-3-іл)-3-(42,7 фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 6 (1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1λ -піридо[4,3-e][1,2,4]тіадіазин-3-іл)-3-(42,7 фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 6 (1R,2S,7R,8S)-5-(1,1-діоксо-1,4-дигідро-1λ -піридо[3,2-e][1,2,4]тіадіазин-3-іл)-3-(42,7 фторобензил)-6-гідроксі-3-аза-трицикло[6.2.1.0 ]ундец-5-ен-4-ону, 2,7 N-{3-[(1R,2S,7R,8S)-3-(2-Циклопропілетил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец6 5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6,9-дигідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец6 5-ен-5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-аргінінової солі, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, L-лізинової солі, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, гемімагнієвої солі, 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, натрієвої солі, і 2,7 N-{3-[(1R,2S,7R,8S)-3-(4-Фторобензил)-6-гідроксі-4-оксо-3-аза-трицикло[6.2.1.0 ]ундец-5-ен6 5-іл]-1,1-діоксо-1,4-дигідро-1λ -бензо[1,2,4]тіадіазин-7-іл}-метансульфонаміду, калієвої солі. Винахід також спрямований на фармацевтично прийнятні солі і фармацевтично прийнятні сольвати сполук Формули I. Також описані переважні способи одержання сполук Формули I. В одному аспекті цей винахід охоплює спосіб лікування або профілактики інфекції вірусу гепатиту С у ссавця, який потребує цього, переважно у людини, яка потребує цього, який включає введення пацієнту терапевтично або профілактично ефективної кількості сполуки Формули 1. В одному варіанті здійснення цей винахід охоплює спосіб лікування або профілактики інфекції вірусу гепатиту С введенням пацієнту, який потребує цього, терапевтично або профілактично ефективної кількості сполуки формули I, що є інгібітором полімерази NS5B HCV. В іншому аспекті цей винахід охоплює спосіб лікування або профілактики інфекції вірусу гепатиту С у пацієнта, який потребує цього, який включає введення пацієнту терапевтично або профілактично ефективної кількості сполуки Формули I і фармацевтично прийнятного екципієнта, носія або наповнювача. В іншому аспекті цей винахід охоплює спосіб лікування або профілактики інфекції вірусу гепатиту С у пацієнта, який потребує цього, який включає введення пацієнту терапевтично або профілактично ефективної кількості сполуки Формули I і додаткового терапевтичного агента, переважно додаткового антивірусного агента або імуномодуляторного агента. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Там, де наступні терміни застосовуються у цьому описі винаходу, вони застосовуються так, як визначено нижче. Терміни "що включає", "що має" та "включаючи", "маючи" застосовуються тут у їх відкритому, необмежувальному сенсі. 7 UA 100120 C2 5 10 15 20 25 Якщо інше не вказано, термін "алкіл", як застосовується тут, включає C 1-C12 насичені одновалентні вуглеводневі радикали, що мають нерозгалужені, розгалужені або циклічні складові (включаючи сконденсовані та біциклічні складові, з'єднані місточковим зв'язком, та спіроциклічні складові), або комбінацію вищезгаданих складових. Стосовно алкільної групи, то, щоб вона мала циклічні складові, група повинна мати принаймні три атоми вуглецю. Термін "алкілен", як застосовується тут, якщо інше не вказано, включає C 1-C12 двовалентний радикал, що походить з алкілу, як приклад -CH2CH2CH2CH2-. Термін "алкеніл", як застосовується тут, якщо інше не вказано, включає C 1-C12 алкільні складові, що мають принаймні один подвійний зв'язок вуглець-вуглець, де алкіл є таким, як визначено вище, і включає E і Z ізомери згаданої алкенільної складової. Термін "алкініл", як застосовується тут, якщо інше не вказано, включає C 1-C12 алкільні складові, що мають принаймні один потрійний зв'язок вуглець-вуглець, де алкіл є таким, як визначено вище. Термін "алкокси", як застосовується тут, якщо інше не вказано, включає О-алкільні групи, де алкіл є таким, як визначено вище. Термін "Me" позначає метил, "Et" позначає етил, "Ac" позначає ацетил. Термін "циклоалкіл", як застосовується тут, якщо інше не вказано, відноситься до неароматичних, насичених або частково насичених, моноциклічних або сконденсованих, спіро або несконденсованих біциклічних або трициклічних вуглеводнів, на які посилаються тут, що містять взагалі від 3 до 10 атомів вуглецю, переважно 5-8 атомів вуглецю в кільці. Приклади циклоалкілів включають моноциклічні кільця, що мають 3-7, переважно 3-6, атомів вуглецю, такі як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і подібні. Ілюстративними прикладами циклоалкілів є ті, що походять від наступних, але не обмежуючись тільки ними: , , ,, , та 30 35 40 45 50 , , , , , , , , . Термін "арил", як застосовується тут, якщо інше не вказано, включає органічний радикал, що походить від ароматичного вуглеводню за рахунок видалення одного водню, такий як феніл або нафтил, який містить загалом від 6 до 10 атомів вуглецю. Термін "гетероциклічний" або "гетероцикліл", як застосовується тут, якщо інше не вказано, включає ароматичні (наприклад, гетероарили) та неароматичні гетероциклічні групи, що містять від одного до чотирьох гетероатомів, кожний вибраний з O, S і N, де кожна гетероциклічна група має від 4 до 10 атомів в її кільцевій системі, та за умови, що кільце згаданої групи не містить два суміжні атоми O. Неароматичні гетероциклічні групи включають групи, що мають тільки 3 атоми в їх кільцевій системі, тоді як ароматичні гетероциклічні групи повинні мати принаймні 5 атомів в їх кільцевій системі. Гетероциклічні групи включають бензо-сконденсовані кільцеві системи. Прикладом 4-членної гетероциклічної групи є азетидиніл (походить від азетидину). Прикладом 5-членної гетероциклічної групи є тіазоліл і прикладом 10-членної гетероциклічної групи є хінолініл. Прикладами неароматичних гетероциклічних груп є піролідиніл, тетрагідрофураніл, дигідрофураніл, тетрагідротієніл, тетрагідропіраніл, дигідропіраніл, тетрагідротіопіраніл, піперидино, морфоліно, тіоморфоліно, тіоксаніл, піперазиніл, азетидиніл, оксетаніл, тієтаніл, гомопіперидиніл, оксепаніл, тієпаніл, оксазепініл, діазепініл, тіазепініл, 1,2,3,6-тетрагідропіридиніл, 2-піролініл, 3-піролініл, індолініл, 2H-піраніл, 4H-піраніл, діоксаніл, 1,3-діоксолaніл, піразолініл, дитіаніл, дитіоланіл, дигідропіраніл, дигідротієніл, дигідрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3-азабіцикло[3.1.0]гексаніл, 3азабіцикло[4.1.0]гептаніл, 3H-індоліл і хінолізиніл. Прикладами ароматичних гетероциклічних груп є піридиніл, імідазоліл, піримідиніл, піразоліл, триaзоліл, піразиніл, тетразоліл, фурил, тієніл, ізоксазоліл, тіазоліл, оксазоліл, ізотіазоліл, піроліл, хінолініл, ізохінолініл, індоліл, бензимідазоліл, бензофураніл, циннолініл, індазоліл, індолізиніл, фталазиніл, піридазиніл, 8 UA 100120 C2 5 10 триaзиніл, ізоіндоліл, птеридиніл, пуриніл, оксадіазоліл, тіадіазоліл, фуразаніл, бензофуразаніл, бензотіофеніл, бензотіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл і фуропіридиніл. Вищезгадані групи, коли походять від груп, перелічених вище, можуть бути Cприєднаними або N-приєднаними, де це можливо. Наприклад, група, що походить від піролу, може бути пірол-1-іл (N-приєднаною) або пірол-3-іл (C-приєднаною). Далі, група, що походить від імідазолу, може бути імідазол-1-іл (N-приєднаною) або імідазол-2-іл (C-приєднаною). 4-10членний гетероцикл може бути необов'язково заміщеним на будь-якому атомі(ах) вуглецю, сірки або азоту кільця однією або двома оксо-групами на кільце. Прикладом гетероциклічної групи, де 2 атоми вуглецю кільця є заміщеними оксо складовими, є 1,1-діоксо-тіоморфолініл. Інші ілюстративні приклади 4-10-членного гетероциклу є ті, що походять від наступних, але не обмежуються тільки ними: H N O O NH N H , O , N H , N H , O , S N , , N H , O N H NH N H , O 15 , N N N N H , , O O , N , N H , N H , , та . 20 25 30 Якщо інше не вказано, "алкіл," "алкілен," "алкеніл," "алкініл," "арил," "циклоалкіл" або "гетероцикліл" кожний є необов’язково і незалежно заміщений 1-3 замісниками, вибраними з алкіламіну, аміно, арилу, циклоалкілу, гетероциклілу, C 1-C6 алкілу, C1-C6 галогеналкілу, C1-C6 гідроксіалкілу, C1-C6 алкокси, C1-C6 алкіламіну, C1-C6 діалкіламіну, C2-C6 алкенілу або C2-C6 алкінілу, де кожен з яких може бути перерваний одним або більше гетероатомами, карбоксилу, ціано, галогену, гідрокси, нітро, -C(O)OH, -C(O)2-(C1-C6 алкіл), -C(O)2-(C3-C8 циклоалкіл), -C(O)2(арил), -C(O)2-(гетероцикліл), -C(O)2-(C1-C6 алкілен)арилу, -C(O)2-(C1-C6 алкілен)гетероциклілу, C(O)2-(C1-C6 алкілен)циклоалкілу, -C(O)(C1-C6 алкіл), -C(O)(C3-C8 циклоалкіл), -C(O)(арил), -C(O)(гетероцикліл), -C(O)(C1-C6 алкілен)арилу, -C(O)(C1-C6 алкілен)гетероциклілу і -C(O)(C1-C6 алкілен)циклоалкілу, де кожний з цих необов’язкових замісників може бути також необов’язково заміщений 1-5 замісниками, вибраними з аміно, ціано, галогену, гідрокси, нітро, C 1-C6 алкіламіну, C1-C6 діалкіламіну, C1-C6 алкілу, C1-C6 алкокси, C1-C6 алкенілу і C1-C6 гідроксіалкілу, де кожний алкіл є необов’язково заміщеним одним або більше галогеновими замісниками, наприклад, CF3. Термін "імуномодулятор" означає природні або синтетичні продукти, спроможні 9 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 модифікувати нормальну або порушену імунну систему шляхом стимуляції або супресії. Термін "профілактика" означає спроможність сполуки або композиції винаходу запобігати хворобі, визначеній тут, у пацієнтів, яким поставили діагноз цієї хвороби або які мають ризик розвитку такої хвороби. Термін також охоплює запобігання наступному розвитку хвороби у пацієнтів, які вже страждають від цієї хвороби або які вже мають симптоми такої хвороби. Терміни "пацієнт" або "суб’єкт" означають тварину (наприклад, корову, коня, вівцю, свиню, курча, індика, перепела, кішку, собаку, мишу, щура, кроля, морську свинку тощо) або ссавця, включаючи химерних та трансгенних тварин та ссавців. При лікуванні або профілактиці вірусної інфекції гепатиту С термін "пацієнт" або "суб’єкт" переважно означає мавпу або людину, більш переважно - людину. У специфічному варіанті здійснення пацієнт або суб’єкт є інфікованим або зазнає впливу вірусу гепатиту С. У певних варіантах здійснення пацієнт - це немовля людини (віком 0 - 2 роки), дитина людини (віком 2 - 17 років), підліток людини (віком 12 - 17 років), доросла людина (віком 18 років та старше) або літня людина (віком 70 років та старше). Крім того, термін "пацієнт" включає пацієнтів з імунним ризиком, таких як ВІЛ-позитивні пацієнти, ракові пацієнти, пацієнти, що зазнають імунотерапію або хіміотерапію. В особливому варіанті здійснення пацієнт є здоровою людиною, тобто у нього немає симптомів інших вірусних інфекцій. Термін "терапевтично ефективна кількість" означає кількість сполуки винаходу, яка є достатньою для забезпечення успішного лікування або профілактики вірусного захворювання, для уповільнення або мінімізації симптомів, пов’язаних з вірусною інфекцією або індукованим вірусом захворюванням, або для лікування або ослаблення захворювання або інфекції або їх причин. Зокрема, терапевтично ефективна кількість означає кількість, яка є достатньою для забезпечення успішного лікування in vivo. Коли його застосовують у зв’язку з деякою кількістю сполуки винаходу, цей термін переважно охоплює нетоксичну кількість, яка покращує загальну терапію, зменшує або запобігає симптомам або причинам захворювання або підвищує терапевтичну ефективність іншого терапевтичного агента або синергічно діє разом з іншим терапевтичним агентом. Термін "профілактично ефективна кількість" означає кількість сполуки винаходу або іншого активного інгредієнта, яка є достатньою для профілактики інфекції, рецидиву або розповсюдження вірусної інфекції. Термін "профілактично ефективна кількість" може означати кількість, яка є достатньою для профілактики початкової інфекції або рецидиву або розповсюдження інфекції або захворювання, пов’язаного з цією інфекцією. Коли цей термін застосовується у зв’язку з деякою кількістю сполуки винаходу, він переважно охоплює нетоксичну кількість, яка покращує загальну профілактику або підвищує профілактичну ефективність іншого профілактичного або терапевтичного агента або синергічно діє разом з іншим профілактичним або терапевтичним агентом. Термін "у комбінації" означає застосування більш ніж одного профілактичного та/або терапевтичного агента одночасно або послідовно та за способом, при якому їх відповідні ефекти є адитивними або синергічними. Термін "лікування" означає: і) запобігання виникненню хвороби, розладу або стану у тварини, яка може бути схильною до хвороби, розладу та/або стану, проте у неї іще не діагностували наявність цієї хвороби; іі) інгібування хвороби, розладу або стану, тобто припинення її розвитку, та ііі) ослаблення хвороби, розладу або стану, тобто спричинення регресіїї хвороби, розладу та/або стану. Терміни "R" і "S" означають специфічну стереохімічну конфігурацію замісника при асиметричному атомі вуглецю в хімічній структурі, яку наведено. Термін "рац" означає, що сполука являє собою рацемат, який визначається як еквімолярна суміш пари енантіомерів. "Рац" сполука не виявляє оптичної активності. Хімічна назва або формула рацемата відрізняється від найменувань або формул енантіомерів префіксом (±)- або рац- (або рацем-) або позначками RS і SR. Терміни "ендо" (endo) і "екзо" (exo) є дескрипторами відносної орієнтації замісників, приєднаних до невузлових атомів в біцикло[x.y.z]алкані (x ≥ y > z > 0). Терміни "син" (syn) і "анти" (anti) є дескрипторами відносної орієнтації замісників, приєднаних до вузлових атомів в біцикло[x.y.z]алкані (x ≥ y > z > 0). 10 UA 100120 C2 anti syn [CH2]z-1 [CH2]x-1 [CH2]y-1 exo endo 5 10 Термін "екзо" надається замісникові (наприклад, Br, приєднаному до C-2 в прикладі нижче), що є орієнтованим у напрямку містка з найвищим номером (місток z, наприклад, C-7 в прикладі нижче); якщо цей замісник орієнтований від містка з найвищим номером, йому надається характеристика "ендо". Термін "син" ("syn") надається замісникові, приєднаному до містка з найвищим номером (місток z, наприклад, F приєднаний до C-7 в прикладі нижче) і орієнтованому у напрямку містка з найнижчим номером (місток x, наприклад, C-2 і C-3 в прикладі нижче); якщо цей замісник орієнтований від містка з найнижчим номером, то йому надається характеристика "анти". 2-екзо-бромо-7-син-фторо-біцикло[2.2.1]гептан 2-екзо-бромо-7- син-фторо-біцикло[2.2.1]гептан 2-ендо-бромо-7-анти-фторо-біцикло[2.2.1]гептан 15 20 25 Терміни "цис" і "транс" є дескрипторами, які показують взаємне розташування двох лігандів, приєднаних до різних атомів, що зв'язані подвійним зв'язком і входять до складу кільця. Говорять, що два ліганди розташовані у цис-конфігурації один до одного, якщо вони лежать з однієї сторони площини. Якщо вони знаходяться з протилежних сторін, то їх відносне положення описується як "транс". Відповідна вказана площина подвійного зв'язку є перпендикулярною до відповідних σ-зв'язків і проходить через подвійний зв'язок. Для кільця це означає площину кільця(ець). Сполуки винаходу можуть демонструвати явище таутомерії. Незважаючи на те, що Формула І не може виразно показати усі можливі таутомерні форми, слід розуміти, що Формула І призначена для того, щоб представити будь-яку таутомерну форму зображеної сполуки, та також не слід обмежуватися лише специфічною формою сполуки, зображеної на структурних формулах. Для ілюстрації і в жодному разі не обмежуючи ряд таутомерів, сполуки Формули І можуть існувати як наступні: 11 UA 100120 C2 Де Де або сполуки Формули I можуть існувати як наступні: Де Де 5 Деякі сполуки винаходу можуть існувати як єдині стереоізомери (тобто, суттєво вільні від інших стереоізомерів), рацемати та/або суміші енантіомерів та/або діастереомерів. Усі такі єдині стереоізомери, рацемати та їх суміші входять до обсягу цього винаходу. Переважно, щоб 12 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки винаходу, які є оптично активними, застосовувалися в оптично чистій формі. Як взагалі зрозуміло для фахівців у галузі, оптично чиста сполука, що має один хіральний центр (тобто, один асиметричний атом вуглецю) є такою, що складається по суті з одного з двох можливих енантіомерів (тобто є енантіомерно чистою), та оптично чиста сполука, що має більш ніж один хіральний центр, є такою, що вона є як діастереомерно чистою, так і енантіомерно чистою. Переважно, сполуки цього винаходу застосовуються у формі, яка є принаймні на 90% вільною від інших енантіомерів або діастереомерів цих сполук, тобто у формі, що містить принаймні 90% єдиного ізомеру (80% надлишку енантіомеру ("е.е.") або надлишку діастереомеру ("d.e.")), більш переважно принаймні 95% (90% надлишку енантіомеру або надлишку діастереомеру), навіть більш переважно принаймні 97,5% (95% надлишку енантіомеру або надлишку діастереомеру) та найбільш переважно принаймні 99% (98% надлишку енантіомеру або надлишку діастереомеру). Крім того, Формула І призначена охоплювати сольватовані, а також несольватовані форми ідентифікованих структур. Наприклад, Формула І включає сполуки вказаної структури як у гідратованій, так і у негідратованій формах. Інші приклади сольватів включають структури у комбінації з ізопропанолом, етанолом, метанолом, ДМСО (DMSO), етилацетатом, пентилацетатом, оцтовою кислотою або етаноламіном. Окрім сполук Формули І цей винахід включає фармацевтично прийнятні проліки, фармацевтично активні метаболіти та фармацевтично прийнятні солі таких сполук та метаболітів. "Фармацевтично прийнятні проліки" являють собою сполуку, яка може перетворюватися за певними фізіологічними умовами або через сольволіз у визначену сполуку або у фармацевтично прийнятну сіль такої сполуки до того, як вона буде демонструвати свої фармакологічні властивості. Звичайно проліки мають такий склад, щоб досягти поліпшеної хімічної стійкості, поліпшеної прийнятності та сприятливості, поліпшеної біологічної придатності, подовження тривалості дії, поліпшеної селективності щодо органів, удосконаленої технології виготовлення ліків (наприклад, підвищеної розчинності у воді) та/або зниження побічних ефектів (наприклад, токсичності). Проліки можна легко одержати зі сполук Формули І, застосовуючи способи, відомі у галузі, такі як описані у Burger’s Medicinal Chemistry and Drug Chemistry, 1, 172178, 949-982 (1995). Дивись також Bertolini et al., J. Med. Chem., 40, 2011-2016 (1997); Shan, et al., J. Pharm. Sci., 86 (7), 765-767; Bagshawe, Drug Dev. Res., 34, 220-230 (1995); Bodor, Advances in Drug Res., 13, 224-331 (1984); Bundgaard, Design of Prodrugs (Elsevier Press 1985); Larsen, Design and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds., Harwood Academic Publishers, 1991); Dear et al., J. Chromatogr. B, 748, 281-293 (2000); Spraul et al., J. Pharmaceutical & Biomedical Analysis, 10, 601-605 (1992); та Prox et al., Xenobiol., 3, 103-112 (1992). Термін "фармацевтично активний метаболіт" призначений позначати фармакологічно активний продукт визначеної сполуки або її солі, який виробляється як наслідок метаболізму у тілі. Після потрапляння в організм більшість ліків являють собою субстрати для хімічних реакцій, які можуть змінювати їх фізичні властивості та біологічні ефекти. Ці метаболічні конверсії, які звичайно впливають на полярність сполук Формули І, змінюють спосіб, за яким ліки розповсюджуються у тілі та виводяться з нього. Проте, у деяких випадках метаболізм ліків є необхідним для терапевтичного ефекту. Наприклад, протиракові ліки класу анти-метаболітів повинні перетворюватися на їх активні форми, після того, як вони потраплять у ракову клітину. Оскільки більшість ліків зазнають метаболічної трансформації певного типу, біохімічні реакції, які відіграють роль у метаболізмі ліків, можуть бути численними та різноманітними. Головне місце метаболізму ліків - це печінка, проте інші тканини можуть також брати участь. Характерною ознакою багатьох цих трансформацій є те, що продукти метаболізму або "метаболіти" є більш полярними, ніж первинні ліки, хоча і полярні ліки іноді утворюють менш полярний продукт. Речовини з високими коефіцієнтами розподілення ліпід/вода, які легко проходять крізь мембрани, також легко дифундують назад з сечі ниркового канальця крізь клітини епітелію ниркового канальця у плазму. Отже, такі речовини звичайно мають низький нирковий кліренс та тривалу стійкість у тілі. Якщо ліки перетворюються у ході метаболізму у більш полярну сполуку, сполуку з більш низьким коефіцієнтом розподілення, їх реабсорбція з канальця значно знизиться. Крім того, специфічні секреторні механізми для аніонів та катіонів у проксимальних ниркових канальцях та у паренхіматозних печінкових клітинах діють на високополярні речовини. Як специфічний приклад, фенацетин (ацетофенетидин) та ацетанілід обидва являють собою м’які болезаспокійливі та жарознижувальні агенти, проте вони трансформуються в організмі у більш полярний та більш ефективний метаболіт, р-гідроксіацетанілід 13 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ацетамінофен), який широко застосовується сьогодні. Коли дозу ацетаніліду дають пацієнтові, наступні метаболіти досягають максимуму та розкладаються у плазмі послідовно. Протягом першої години ацетанілід являє собою головний компонент плазми. Протягом другої години, коли рівні ацетаніліду падають, концентрація метаболіту ацетамінофену досягає максимуму. Зрештою, через декілька годин головним компонентом плазми стає наступний метаболіт, який є інертним та може виводитися з організму. Отже, концентрація одного або більше метаболітів у плазмі, а також самих ліків, може бути важливою з фармакологічної точки зору. Термін "фармацевтично прийнятна сіль" призначений позначати сіль, що зберігає біологічну ефективність вільних кислот та основ визначеної сполуки та яка не є небажаною з біологічної точки зору або з будь-якої іншої точки зору. Сполука винаходу може мати достатньо кислотну, достатньо основну або обидві функціональні групи та внаслідок цього може реагувати з будьякими з ряду неорганічних або органічних основ та неорганічних або органічних кислот, утворюючи фармацевтично прийнятну сіль. Приклади фармацевтично прийнятних солей включають ті солі, які одержуються шляхом реакції сполук цього винаходу з мінеральною або органічною кислотою або неорганічним лугом, такі як сульфати, піросульфати, бісульфати, сульфіти, бісульфіти, фосфати, моногідрофосфати, дигідрофосфати, метафосфати, пірофосфати, хлориди, броміди, йодиди, ацетати, пропіонати, деканоати, каприлати, акрилати, форміати, ізобутирати, капроати, гептаноати, пропіолати, оксалати, малонати, сукцинати, суберати, себакати, фумарати, малеати, бутен-1,4-діоати, гексин-1,6-діоати, бензоати, хлорбензоати, метилбензоати, динітробензоати, гідроксибензоати, метоксибензоати, фталати, сульфонати, ксиленсульфонати, фенілацетати, фенілпропіонати, фенілбутирати, цитрати, лактати, γ-гідроксибутирати, гліколати, тартрати, метан-сульфонати, пропансульфонати, нафтален-1-сульфонати, нафтален-2-сульфонати та манделати. Якщо сполука винаходу є основою, бажану фармацевтично прийнятну сіль можна одержати за будь-яким придатним способом, доступним у галузі, наприклад, шляхом обробки вільної основи неорганічною кислотою, такою як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо, або органічною кислотою, такою як оцтова кислота, малеїнова кислота, бурштинова кислота, мигдальна кислота, фумарова кислота, малонова кислота, піровиноградна кислота, щавлева кислота, гліколева кислота, саліцилова кислота, піранозидилова кислота, така як глюкуронова кислота або галактуронова кислота, альфа-оксикислота, така як лимонна кислота або винна кислота, амінокислота, така як аспарагінова кислота або глютамінова кислота, ароматична кислота, така як бензойна кислота або корична кислота, сульфонова кислота, така як р-толуолсульфонова кислота або етансульфонова кислота тощо. Якщо сполука винаходу є кислотою, бажану фармацевтично прийнятну сіль можна одержати за будь-яким придатним способом, наприклад, шляхом обробки вільної кислоти неорганічною або органічною основою, такою як амін (первинний, вторинний або третинний), гідроксид лужного металу або гідроксид лужноземельного металу тощо. Ілюстративні приклади придатних солей включають органічні солі, що походять з амінокислот, таких як гліцин та аргінін, аміаку, первинних, вторинних та третинних амінів, циклічних амінів, таких як піперидин, морфолін та піперазин, та неорганічні солі, що походять з натрію, кальцію, калію, магнію, марганцю, заліза, міді, цинку, алюмінію та літію. У випадку, коли агенти являють собою тверді речовини, фахівці у галузі зрозуміють, що сполуки та солі винаходу можуть існувати у різних кристалічних, со-кристалічних або поліморфних формах, усі з яких, як передбачається, знаходяться в обсязі цього винаходу та визначених формул. СПОСОБИ ЛІКУВАННЯ ТА ПРОФІЛАКТИКИ ВІРУСНОЇ ІНФЕКЦІЇ ГЕПАТИТУ С Цим винаходом пропонуються способи лікування або профілактики вірусної інфекції гепатиту С у пацієнта, якому це необхідно. Цим винаходом також пропонуються способи введення терапевтично ефективної кількості сполуки Формули І або комбінації таких сполук у кровотік пацієнта під час лікування та/або профілактики вірусної інфекції гепатиту С. Величина профілактичної або терапевтичної дози сполуки Формули І цього винаходу або її фармацевтично прийнятної солі, сольвату або гідрату під час гострого або хронічного лікування або профілактики інфекції буде різною, проте, залежною від природи та суворості інфекції та способу введення активного інгредієнта. Доза та у деяких випадках частота введення дози буде також різнитися залежно від інфекції, яку слід лікувати, віку, ваги тіла та реакції окремого пацієнта. Придатні схеми приймання лікарського засобу фахівець у галузі може легко вибрати, враховуючи такі фактори. Способи цього винаходу є особливо придатними для лікування пацієнтів-людей. Зокрема, 14 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 способи та дози цього винаходу можуть бути корисними для пацієнтів з імунною загрозою, включаючи, проте не обмежуючись тільки ними, ракових пацієнтів, ВІЛ-інфікованих пацієнтів та пацієнтів з імунодегенеративним захворюванням. Крім того, способи можуть бути корисними для пацієнтів з імунною загрозою, захворювання яких в даний момент знаходиться у стані ремісії. Способи та дози цього винаходу є також корисними для пацієнтів, які зазнають іншого противірусного лікування. Профілактичні способи цього винаходу є особливо корисними для пацієнтів з ризиком вірусної інфекції. Ці пацієнти включають, проте не обмежуючись тільки ними, робітників охорони здоров’я, наприклад, лікарів, медичних сестер, робітників системи хоспісу; військовий персонал; вчителів; співробітників закладів догляду за дітьми; пацієнтів, що подорожують або мешкають за кордоном, особливо у країнах третього світу, включаючи робітників соціальної допомоги, місіонерів та іноземних дипломатів. Зрештою, способи та композиції включають лікування резистентних пацієнтів або пацієнтів, стійких до лікування, наприклад стійких до інгібіторів ревертази, інгібіторів протеази тощо. Дози Токсичність та ефективність сполук винаходу можна визначити шляхом стандартних фармацевтичних процедур на клітинних культурах або на експериментальних тваринах, наприклад, для визначення LD50 (середня летальна доза (летальна доза для 50% популяції)) та ED50 (середня ефективна доза (терапевтично ефективна доза для 50% популяції)). Співвідношення доз між токсичними та терапевтичними ефектами - це терапевтичний індекс, та його можна визначити як співвідношення LD 50/ED50. Дані, отримані з аналізів клітинних культур та дослідів на тваринах можна застосовувати для визначення діапазону доз сполук для застосування до людей. Доза таких сполук знаходиться переважно у межах діапазону циркулюючої концентрації, який включає ED 50 з незначною токсичністю або зовсім без токсичності. Доза може різнитися у межах цього діапазону залежно від лікарської форми, що застосовується, та способу введення, який використовують. Для будьякої сполуки, яка застосовується у способі винаходу, терапевтично ефективну дозу можна оцінити початково завдяки аналізам клітинних культур. Дозу можна визначити на тваринних моделях так, щоб досягти діапазону циркулюючої концентрації у плазмі, який включає IC 50 (тобто, концентрація сполуки тесту, при якій досягається напівмаксимальне інгібування симптомів), як визначено у клітинній культурі; альтернативно, дозу сполук Формули І можна визначити на тваринних моделях, щоб досягти діапазону циркулюючої концентрації цієї сполуки у плазмі, що відповідає концентрації, необхідній для досягнення фіксованої величини реакції. Таку інформацію можна застосовувати для того, щоб більш точно визначити корисні дози для людей. Рівні у плазмі можна вимірити, наприклад, шляхом рідинної хроматографії високого розрізнення. Протоколи та композиції винаходу переважно випробуються in vitro, а потім in vivo щодо визначення бажаної терапевтичної або профілактичної активності до того, як застосовувати до людей. Наприклад, аналізи in vitro, які можна застосовувати для того, щоб визначити, чи є показаним введення за специфічним терапевтичним протоколом, включають аналізи клітинних культур in vitro, при яких клітини, які реагують на дію сполук Формули І, піддають дії ліганду, та величину реакції виміряють відповідним способом. Оцінка сполук Формули І потім здійснюється відповідно до потентності сполук та ступеню конверсії проліків сполук Формули І. Сполуки для застосування у способах винаходу можна випробувати на придатних системах тваринних моделей до випробування на людях, включаючи, проте не обмежуючись тільки ними, щурів, мишей, курчат, корів, мавп, кролів, хом’ячків тощо. Сполуки можна потім застосовувати у відповідних клінічних випробуваннях. Величина профілактичної або терапевтичної дози проліків сполуки Формули І цього винаходу або її фармацевтично прийнятної солі, сольвату або гідрату під час гострого або хронічного лікування або профілактики інфекції або стану буде різнитися залежно від природи та суворості інфекції та способу введення активного інгредієнта. Доза та, можливо, частота введення дози будуть також різнитися залежно від інфекції, яку слід лікувати, віку, ваги тіла та реакції окремого пацієнта. Фахівець у галузі може легко вибрати придатні схеми введення лікарського засобу, враховуючи усі ці фактори. В одному варіанті здійснення доза, що вводиться, залежить від специфічної сполуки, яку слід застосовувати, та ваги та стану пацієнта. Також, доза може різнитися для різних певних сполук Формули І; придатні дози можна передбачити на підставі вищезгаданих вимірювань in vitro та на основі вимірювань із застосуванням тварин, так що дрібніші дози будуть придатними для тих сполук Формули І, що демонструють ефективність при більш низьких концентраціях порівняно з іншими сполуками Формули І, коли ці концентрації вимірюють у системах, які описано або на які посилаються у цьому описі. Взагалі, доза на добу знаходиться у діапазоні від приблизно 0,001 до 100 мг/кг, 15 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно приблизно від 1 до 25 мг/кг, більш переважно приблизно від 5 до 15 мг/кг. Для лікування людей, інфікованих вірусом гепатиту С, вводиться приблизно від 0,1 мг до 15 г на добу, з розподілом приблизно на 1 - 4 рази на добу, переважно від 100 мг до 12 г на добу, більш переважно від 100 до 8000 мг на добу. Крім того, рекомендовану щодобову дозу можна вводити циклами як єдині агенти або у комбінації з іншими терапевтичними агентами. В одному варіанті здійснення щодобова доза вводиться єдиною дозою або порівну розподіленими дозами. У спорідненому варіанті здійснення рекомендовану щодобову дозу можна вводити один раз на тиждень, двічі на тиждень, тричі на тиждень, чотири рази на тиждень або п’ять разів на тиждень. У переважному варіанті здійснення сполуки винаходу вводяться так, щоб забезпечити системне розповсюдження сполуки в організмі пацієнта. У спорідненому варіанті здійснення сполуки винаходу вводяться з метою системного ефекту в організмі. В іншому варіанті здійснення сполуки винаходу вводяться перорально, крізь слизову оболонку (включаючи сублінгвальне (під язик), букальне (крізь щоку), ректальне, назальне або вагінальне введення), парентерально (включаючи підшкірну, внутрішньом’язову, болюсну, внутрішньоартеріальну або внутрівенну ін’єкцію), трансдермально або місцево. У специфічному варіанті здійснення сполуки цього винаходу вводяться крізь слизову оболонку (включаючи сублінгвальне, букальне, ректальне, назальне або вагінальне введення), парентерально (включаючи підшкірну, внутрішньом’язову, болюсну, внутрішньоартеріальну або внутрівенну ін’єкцію), трансдермально або місцево. У подальшому специфічному варіанті здійснення сполуки винаходу вводяться перорально. У подальшому специфічному варіанті здійснення сполуки винаходу не вводяться перорально. Різні терапевтично ефективні кількості можна застосовувати до різних типів інфекцій, що буде добре відомим для звичайних фахівців у галузі. Аналогічним чином, кількості, що є достатніми для лікування або профілактики інфекцій, але не є достатніми спричиняти шкідливі ефекти або є достатніми зменшувати шкідливі ефекти, пов’язані з традиційними видами терапії, також охоплюються вище описаними кількостями доз та розкладом частоти доз. Комбінована терапія Специфічні способи винаходу також включають введення додаткового терапевтичного агента (тобто, терапевтичного агента, відмітного від сполуки винаходу). У певних варіантах здійснення цього винаходу сполуки винаходу можна застосовувати у комбінації з принаймні одним іншим терапевтичним агентом. Терапевтичні агенти включають, проте не обмежуються тільки ними, антибіотики, протиблювотні агенти, антидепресанти та протигрибкові агенти, протизапалювальні агенти, противірусні агенти, протиракові агенти, імуномодуляторні агенти, αінтерферони, β-інтерферони, рибавірин, алкілувальні агенти, гормони, цитокіни або модулятори toll-подібних рецепторів. У одному варіанті здійснення винахід охоплює введення додаткового терапевтичного агента, який є специфічним для вірусу гепатиту С або який демонструє активність проти вірусу гепатиту С. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з антибіотиками. Наприклад, їх можна змішувати з макролідом (наприклад, тобраміцином (Tobi®)), цефалоспорином (наприклад, цефалексином (Keflex®)), цефрадином (Velosef®), цефуроксимом (Ceftin®), цефпрозилом (Cefzil®), цефаклором (Ceclor®), цефіксимом (Suprax®) або цефадроксилом (Duricef®)), кларитроміцином (наприклад, кларитроміцином (Biaxin®)), еритроміцином (наприклад, еритроміцином (EMycin®)), пеніциліном (наприклад, пеніциліном V (V-Cillin K® або Pen Vee K®)) або хінолоном (наприклад, офлоксацином (Floxin®), ципрофлоксацином (Cipro®) або норфлоксацином (Noroxin®)), аміноглікозидними антибіотиками (наприклад, апраміцином, арбекацином, бамберміцинами, бутирозином, дибекацином, неоміцином, ундециленатом, нетилміцином, паромоміцином, рибостаміцином, сизоміцином та спектиноміцином), амфенікольними антибіотиками (наприклад, азидамфеніколом, хлорамфеніколом, фторфеніколом та тіамфеніколом), анзаміциновими антибіотиками (наприклад, рифамідом та рифампіном), карбацефемами (наприклад, лоракарбефом), карбапенемами (наприклад, біапенемом та іміпенемом), цефалоспоринами (наприклад, цефаклором, цефадроксилом, цефамандолом, цефатризином, цефазедоном, цефозопраном, цефпімізолом, цефпірамідом та цефпіромом), цефаміцинами (наприклад, цефбуперазоном, цефметазолом та цефміноксом), монобактамами (наприклад, азтреонамом, карумонамом та тигемонамом), оксацефемами (наприклад, фломоксефом та моксалактамом), пеніцилінами (наприклад, амдиноциліном, амдиноциліну півоксилом, амоксициліном, бакампіциліном, бензилпеніциліновою кислотою, бензилпеніциліном натрію, епіциліном, фенбеніциліном, флоксациліном, пенамциліном, пенетамату гідройодидом, пеніцилін обенетаміном, пеніциліном О, пеніциліном V, пеніцилін V бензатином, пеніцилін V гідрабаміном, 16 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 пенімепіцикліном та фенцигіциліном калію), лінкозамідами (наприклад, кліндаміцином та лінкоміцином), амфоміцином, бацитрацином, капреоміцином, колістином, ендурацидином, енвіоміцином, тетрациклінами (наприклад, апіцикліном, хлортетрацикліном, кломоцикліном та демеклоцикліном), 2,4-діамінопіримідинами (наприклад, бродимопримом), нітрофуранами (наприклад, фуралтадоном та фуразолхлоридом), хінолінами та їх аналогами (наприклад, циноксацином, клінафлоксацином, флумехіном та грепаглоксацином), сульфонамідами (наприклад, ацетилсульфаметоксипіразином, бензилсульфамідом, ноприлсульфамідом, фталілсульфацетамідом, сульфахризоідином та сульфацитином), сульфонами (наприклад, діатимосульфоном, глюкосульфоном натрію та соласульфоном), циклосерином, мупіроцином та туберином. Сполуки Формули І цього винаходу можна також вводити та виготовляти у комбінації з протиблювотними агентами. Придатні протиблювотні агенти включають, проте не обмежуються тільки ними, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцин моноетаноламін, алізаприд, азасетрон, бензхінамід, біетанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металлатал, метопімазин, набілон, оксиперндил, піпамазин, скополамін, сульпірид, тетрагідроканабіноли, тіетилперазин, тіопроперазин, тропісетрон та їх суміші. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з антидепресантом. Придатні антидепресанти включають, проте не обмежуються тільки ними, бінедалін, кароксазон, циталопрам, диметазан, фенкамін, індалпін, інделоксазину гідрохлорид, нефопам, номіфензин, окситриптан, оксипертин, пароксетин, сертралін, тіазесим, тразодон, бенмоксин, іпроклозид, іпроніазид, ізокарбоксазид, ніаламід, октамоксин, фенелзин, котинін, роліциприн, роліпрам, мапротилін, метраліндол, міансерин, міртазепін, адиназолам, амітриптилін, амітриптиліноксид, амоксапін, бутриптилін, кломіпрамін, демексиптилін, дезипрамін, дибензепін, диметакрин, дотієпін, доксепін, флуацизин, іміпрамін, іміпраміну Nоксид, іприндол, лофепрамін, мелітрацен, метапрамін, нортриптилін, ноксиптилін, опіпрамол, пізотилін, пропізепін, протриптилін, хінупрамін, тіанептин, триміпрамін, адрафініл, бенактизин, бупропіон, бутацетин, діоксадрол, дулоксетин, етоперидон, фебарбамат, фемоксетин, фенпентадіол, флуоксетин, флувоксамін, гематопорфірин, гіперицин, левофацетоперан, медифоксамін, мілнаципран, мінаприн, моклобемід, нефазодон, оксафлозан, пібералін, пролінтан, пірисукцидеанол, ритансерин, роксиндол, рубідію хлорид, сульпірид, тандоспірон, тозалінон, тофенацин, толоксатон, транілципромін, L-триптофан, венлафаксин, вілоксазин та зимелдин. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з протигрибковими агентами. Придатні протигрибкові агенти включають, проте не обмежуються тільки ними, амфотерицин В, ітраконазол, кетоконазол, флуконазол, інтратекал, флуцитозин, міконазол, бутоконазол, клотримазол, ністатин, терконазол, тіоконазол, циклопірокс, еконазол, галопрогрин, нафтифін, тербінафін, ундециленат та гризеофулдин. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з протизапалювальним агентом. Корисні протизапалювальні агенти включають, проте не обмежуються тільки ними, нестероїдні протизапалювальні ліки, такі як саліцилова кислота, ацетилсаліцилова кислота, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфазалазин, ацетамінофен, індометацин, суліндак, етодолак, мефенамова кислота, меклофенамат натрію, толметин, кеторолак, диклофенак, ібупрофен, напроксен, напроксен натрію, фенопрофен, кетопрофен, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, набуметом, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон та німесулід; антагоністи лейкотрієну, включаючи, проте не обмежуючись тільки ними, зилеутон, ауротіоглюкозу, натрійтіомалат золота та ауранофін; стероїди, включаючи, проте не обмежуючись тільки ними, алклометазону дипропріонат, амцинонід, беклометазону дипропіонат, бетаметазон, бетаметазону бензоат, бетаметазону дипропіонат, бетаметазону натрійфосфат, бетаметазону валерат, клобетазолу пропіонат, клокортолону півалат, гідрокортизон, похідні гідрокортизону, дезонід, дезоксиматазон, дексаметазон, флунізолід, флукоксинолід, флурандренолід, гальциноцид, медризон, метилпреднізолон, метилпреднізолону ацетат, метилпреднізолону натрійсукцинат, мометазону фуроат, параметазону ацетат, преднізолон, преднізолону ацетат, преднізолону натрійфосфат, преднізолону тебуатат, преднізон, триамцинолон, триамцинолону ацетонід, триамцинолону діацетат та триамцинолону гексацетонід; та інші протизапалювальні агенти, включаючи, проте не обмежуючись тільки ними, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон та бензбромарон. 17 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з іншим противірусним агентом. Корисні противірусні агенти включають, проте не обмежуються тільки ними, інгібітори протеази, нуклеозидні інгібітори ревертази, ненуклеозидні інгібітори ревертази та нуклеозидні аналоги. Противірусні агенти включають, проте не обмежуються тільки ними, зидовудин, ацикловір, гангцикловір, відарабін, ідоксуридин, трифлуридин, левовірин, вірамідин та рибавірин, а також фоскарнет, амантадин, римантадин, сахінавір, індинавір, ампренавір, лопінавір, ритонавір, альфа-інтерферони, бета-інтерферони, адефовір, клевадин, ентекавір та плеконарил. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з імуномодуляторним агентом. Імуномодуляторні агенти включають, проте не обмежуються тільки ними, метотрексат, лефлуномід, циклофосфамід, циклоспорин А, мікофенолату мофетил, рапаміцин (сиролімус), мізорибін, дезоксиспергуалін, брехінар, малононітрилоаміди (наприклад, лефлунамід), модулятори рецепторів Т-клітин та модулятори рецепторів цитокінів, пептидні міметики та антитіла (наприклад, гуманізовані антитіла, химерні, моноклональні, поліклональні, фрагменти Fvs, ScFvs, Fab або F(ab)2 або епітоп-зв’язувальні фрагменти), молекули нуклеїнових кислот (наприклад, молекули антисмислової нуклеїнової кислоти та потрійні спіралі), дрібні молекули, органічні сполуки та неорганічні сполуки. Приклади модуляторів рецепторів Т-клітин включають, проте не обмежуються тільки ними, анти-Т-клітинні рецепторні антитіла (наприклад, анти-CD4 антитіла (наприклад, cM-T412 (Boehringer), IDECCE9.1® (IDEC та SKB), mAB 4162W94, Orthoclone та OKTcdr4a (Janssen-Cilag)), анти-CD3 антитіла (наприклад, Nuvion (Product Design Labs), OKT3 (Johnson & Johnson) або Rituxan (IDEC)), анти-CD5 антитіла (наприклад, анти-CD5 рицин-зв’язаний імунокон’югат), анти-CD7 антитіла (наприклад, CHH-380 (Novartis)), анти-CD8 антитіла, моноклональні анти-CD40 антитіла ліганду (наприклад, IDEC-131 (IDEC)), анти-CD52 антитіла (наприклад, CAMPATH 1H (Ilex)), анти-CD2 антитіла, анти-CD11а антитіла (наприклад, Xanelim (Genentech)) та анти-Ве7 антитіла (наприклад, IDEC-114 (IDEC)), CTLA4-імуноглобулін та модулятори toll-подібних рецепторів (TLR). Приклади модуляторів рецепторів цитокінів включають, проте не обмежуються тільки ними, розчинні цитокінні рецептори (наприклад, позаклітинний домен рецептора TNF-α (фактора некрозу пухлини-) або його фрагмент, позаклітинний домен рецептора IL-1β або його фрагмент та позаклітинний домен рецептора IL-6 або його фрагмент), цитокіни або їх фрагменти (наприклад, інтерлейкін (IL)-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL10, IL-11, IL-12, IL-15, TNF-α, інтерферон (IFN)-α, IFN-β, IFN-γ та GM-CSF), антитіла проти рецепторів цитокінів (наприклад, антитіла проти рецепторів IFN, антитіла проти рецепторів IL-2 (наприклад, Zenapax (Protein Design Labs)), антитіла проти рецепторів IL-4, антитіла проти рецепторів IL-6, антитіла проти рецепторів IL-10 та антитіла проти рецепторів IL-12), антитіла проти цитокінів (наприклад, антитіла проти IFN, антитіла проти TNF-, антитіла проти IL-1β, антитіла проти IL-6, антитіла проти IL-8 (наприклад, ABX-IL-8 (Abgenix)) та антитіла проти IL-12. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з агентом, який інгібує вірусні ферменти, включаючи, проте не обмежуючись тільки ними, інгібітори протеази вірусу гепатиту С, такі як BILN 2061, SCH-503034, ITMN-191 або VX-950, та інгібітори полімерази NS5b, такі як НМ107 (та його проліки НМ283), R1626, R7078, BILN1941, GSK625433, GILD9128 або HCV-796. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з агентом, який інгібує полімеразу вірусу гепатиту С, таким який описано у Wu, Curr Drug Targets Infect Dіsоrd. 2003; 3(3):207-19, або у комбінації зі сполуками, які інгібують функцію гелікази вірусу, такими які описано у Bretner M, et al Nucleosides Nucleotides Nucleic Acids. 2003; 22(5-8):1531, або з інгібіторами інших специфічних для вірусу гепатиту С мішеней, такими, які описано у Zhang X. IDrugs. 2002;5(2):154-8. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з агентом, який інгібує вірусну реплікацію. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з цитокінами. Приклади цитокінів включають, проте не обмежуються тільки ними, інтерлейкін-2 (IL-2), інтерлейкін-3 (IL-3), інтерлейкін-4 (IL-4), інтерлейкін-5 (IL-5), інтерлейкін-6 (IL-6), інтерлейкін-7 (IL-7), інтерлейкін-9 (IL-9), інтерлейкін-10 (IL-10), інтерлейкін-12 (IL-12), інтерлейкін-15 (IL-15), інтерлейкін-18 (IL-18), одержаний з тромбоцитів фактор росту (PDGF), еритропоетин (Еро), епідермальний фактор росту (EGF), фактор росту фібробластів (FGF), гранулоцитарно-макрофагальний колонієстимулювальний фактор (GM-CSF), гранулоцитарний колонієстимулювальний фактор (G-CSF), макрофагальний колонієстимулювальний фактор (MCSF), пролактин та інтерферон (IFN), наприклад, IFN- та IFN-. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з 18 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 гормонами. Приклади гормонів включають, проте не обмежуються тільки ними, гормон, що виділяє лютеїнізуючий гормон (LHRH), гормон росту (GH), гормон, що виділяє гормон росту, адренокортикотропний гормон (АКТГ (АСТН)), соматостатин, соматотропін, соматомедин, паращитовидний гормон, фактор, що виділяє гіпоталамус, інсулін, глюкагон, енкефаліни, вазопресин, кальцитонін, гепарин, гепарини з низькою молекулярною масою, гепариноїди, синтетичні та природні опіоїди, інсулін-стимулюючий тироїдний гормон та ендорфіни. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з βінтерферонами, які включають, проте не обмежуються тільки ними, інтерферон-бета-1а, інтерферон-бета-1b. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з інтерферонами, які включають, проте не обмежуються тільки ними, інтерферон--1, інтерферон--2а (роферон), інтерферон--2b, інтрон, Peg-Intron, Pegasys, консенсусний інтерферон (інферген) та альбуферон. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з агентами, що сприяють абсорбції, особливо тими, які улучають у лімфатичну систему, включаючи, проте не обмежуючись тільки ними, глікохолат натрію, капрат натрію; N-лаурил-β-D-мальтопіранозид; ЕДТК; змішану міцелу; та ті, про які повідомлялося у роботі Muranishi Crit. Rev. Ther. Drug Carrier Syst., 7-1-33, яку повністю включено сюди шляхом посилання. Також можна застосовувати інші відомі агенти, що підсилюють абсорбцію. Отже, винахід також охоплює фармацевтичну композицію, яка містить одну або більше сполук Формули І цього винаходу та один або більше агентів, що сприяють абсорбції. Сполуки Формула I цього винаходу можна вводити або виготовляти у комбінації з інгібітором цитохром-P450-монооксигенази, таким як, але не обмежуючись тільки ним, ритонавіром або його фармацевтично прийнятною сіллю, естером і проліками, щоб поліпшити фармакокінетику (наприклад, підвищений період напіврозпаду, підвищений період до досягнення піку концентрації у плазмі, підвищені рівні у крові) сполуки Формули I, які метаболізуються цитохромP450-монооксигеназою. Таким чином, винахід також охоплює фармацевтичну композицію, яка включає сполуки Формули I винаходу і один або більше інгібіторів цитохром-P450монооксигенази. Сполуки Формули I цього винаходу можна вводити у комбінації з їжею, щоб посилити поглинання сполуки Формули I у шлунково-кишковому тракті та для підвищення біодоступності сполук Формули I. Сполуки Формули І цього винаходу можна вводити або виготовляти у комбінації з алкілувальним агентом. Приклади алкілувальних агентів включають, проте не обмежуються тільки ними, азотні гірчиці, етиленіміни, метилмеламіни, алкілсульфонати, нітрозосечовини, триазени, мехлоретамін, циклофосфамід, іфосфамід, мелфалан, хлорамбуцил, гексаметилмелаїн, тіотепа, бусульфан, кармустин, стрептозоцин, дакарбазин та темозоломід. Сполуки Формули І цього винаходу та інші терапевтичні агенти можуть діяти на додаток або, більш переважно, синергійно. У переважному варіанті здійснення композиція, що містить сполуку винаходу, вводиться одночасно з введенням іншого терапевтичного агента, який може бути частиною тієї ж самої композиції або бути у іншій композиції, яка не включає сполуки винаходу. В іншому варіанті здійснення винаходу сполуку винаходу вводять перед або після введення іншого терапевтичного агента. В окремому варіанті здійснення сполуку винаходу вводять пацієнтові, який раніше не лікувався або у цей час не лікується іншим терапевтичним агентом, особливо противірусним агентом. В одному варіанті здійснення способи винаходу включають введення однієї або більше сполук Формули І цього винаходу без додаткового терапевтичного агента. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ ТА ЛІКАРСЬКІ ФОРМИ Фармацевтичні композиції та єдині одиничні лікарські форми, які включають сполуку Формули І цього винаходу або її фармацевтично прийнятну сіль або гідрат, також охоплюються цим винаходом. Окремі лікарські форми цього винаходу можуть бути придатними для перорального введення, введення крізь слизову оболонку (включаючи сублінгвальне, букальне, ректальне, назальне або вагінальне введення), парентерального введення (включаючи підшкірні, внутрішньом’язові, болюсну, внутрішньоартеріальну або внутрівенну ін’єкції), введення крізь шкіру або місцевого введення. Фармацевтичні композиції та лікарські форми винаходу звичайно також містять один або більше фармацевтично прийнятних ексципієнтів. Також передбачаються стерильні лікарські форми. В альтернативному варіанті здійснення фармацевтична композиція, яка охоплюється цим варіантом здійснення, включає сполуку Формули І цього винаходу або її фармацевтично прийнятну сіль або гідрат та принаймні один додатковий терапевтичний агент. Приклади 19 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 додаткових терапевтичних агентів включають, проте не обмежуються тільки ними, агенти, перелічені раніше. Композиція, форма та тип лікарських форм винаходу будуть звичайно різнитися залежно від їх застосування. Наприклад, лікарська форма, яку застосовують при лікуванні гострого захворювання або спорідненого захворювання, може містити більшу кількість одного або декількох активних інгредієнтів, які вона містить, порівняно з лікарською формою, яку застосовують при лікуванні хронічного стану того ж самого захворювання. Подібно до цього лікарська форма для парентерального введення може містити меншу кількість одного або декількох активних інгредієнтів, які вона містить, порівняно з лікарською формою для перорального введення, яку застосовують для лікування того ж самого захворювання або розладу. Ці та інші способи, якими специфічні лікарські форми охоплюються цим винаходом, будуть різнитися один від одного, будуть добре зрозумілими для фахівців у галузі. Дивись, наприклад, Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Приклади лікарських форм включають, проте не обмежуються тільки ними, таблетки; краплі; капсули, такі як м’які еластичні желатинові капсули; саше; пастилки, коржики; дисперсії; супозиторії; мазі; припарки; пасти; порошки; пов’язки; креми; пластири; розчини; бляшки; аерозолі (наприклад, назальні спреї або інгалятори); гелі; рідкі лікарські форми, придатні для перорального введення або введення крізь слизову оболонку пацієнтові, включаючи суспензії (наприклад, водні або неводні рідкі суспензії, емульсії типа "олія у воді" або рідкі емульсії "вода в олії"), розчини та еліксири; рідкі лікарські форми, придатні для парентерального введення пацієнтові; та стерильні тверді речовини (наприклад, кристалічні або аморфні тверді речовини), які можна перетворити у рідкі лікарські форми, придатні для парентерального введення пацієнтові. Звичайні фармацевтичні композиції та лікарські форми включають один або декілька носіїв, ексципієнтів або розріджувачів. Придатні ексципієнти є добре відомими для фахівців у галузі фармації, та у цьому описі запропоновані необмежувальні приклади придатних ексципієнтів. Чи є певний ексципієнт придатним для включення у фармацевтичну композицію або лікарську форму, залежить від численних факторів, які є добре відомими у цій галузі та які включають, проте не обмежуючись тільки ними, способи, за якими лікарські форми будуть вводитися пацієнтові. Наприклад, лікарські форми для перорального введення, такі як таблетки, можуть містити ексципієнти, які непридатні для застосування у лікарських формах для парентерального введення. Придатність певного ексципієнта може також залежати від специфічних активних інгредієнтів у лікарській формі. Цей винахід також охоплює безводні фармацевтичні композиції та лікарські форми, які включають активні інгредієнти, оскільки вода може сприяти розщепленню деяких сполук. Наприклад, додавання води (наприклад, 5%) широко застосовується у галузі фармакології як засіб для моделювання довготермінового зберігання з метою визначити характеристики, такі як термін зберігання або стійкість фармацевтичних складів протягом часу. Дивись, наприклад, Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. Фактично, вода та тепло прискорюють розпад деяких сполук. Отже, вплив води на фармацевтичний склад може бути дуже важливим, оскільки волога та/або вологість звичайно враховуються під час виробництва, обробки, пакування, зберігання, транспортування та застосування фармацевтичних складів. Безводні фармацевтичні композиції та лікарські форми винаходу можна приготувати, застосовуючи безводні інгредієнти або інгредієнти з низьким вмістом вологи та при умовах низької вологи та низької вологості. Безводну фармацевтичну композицію слід виготовляти та зберігати так, щоб зберігалася її безводна природа. Отже, безводні композиції переважно упаковують, застосовуючи матеріали, про які відомо, що вони захищають від води, так що їх можна включити у придатні набори фармацевтичних складів. Приклади придатних пакувальних матеріалів включають, проте не обмежуються тільки ними, герметичну фольгу, пластик, контейнери для одиничної дози (наприклад, пляшечки), блістерні упаковки та упаковки у вигляді стрічок. Винахід далі охоплює фармацевтичні композиції та лікарські форми, які включають одну або декілька сполук, які знижують швидкість, при якій буде відбуватися розпад активного інгредієнта. Такі сполуки, які називаються у цьому описі "стабілізаторами", включають, проте не обмежуються тільки ними, антиоксиданти, такі як аскорбінова кислота, буфери рН або сольові буфери. Подібно до кількості та типів ексципієнтів, кількість та специфічні типи активних інгредієнтів у лікарській формі можуть різнитися залежно від факторів, таких як, проте не обмежуючись тільки ними, спосіб, за яким вони будуть вводитися пацієнтам. Проте, звичайні лікарські форми 20 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу включають сполуки Формули І цього винаходу або їх фармацевтично прийнятні солі або гідрати, у кількості від 0,1 мг до 1500 мг на одиницю, щоб дози становили від приблизно 0,01 до 200 мг/кг на добу. Лікарські форми для перорального введення Фармацевтичні композиції винаходу, які є придатними для перорального введення, можна представити у вигляді дискретних лікарських форм, таких як, проте не обмежуючись тільки ними, таблетки (наприклад, жувальні таблетки), таблетки у вигляді капсул, капсули та рідини (наприклад, ароматизовані сиропи). Такі лікарські форми містять попередньо визначену кількість активних інгредієнтів, та їх можна приготувати за способами, що є добре відомими у галузі фармації. Дивись взагалі Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Звичайні лікарські форми для перорального введення винаходу виготовляють шляхом змішування активного(-их) інгредієнта(-ів) в однорідну суміш з принаймні одним ексципієнтом згідно з традиційними у фармакології способами. Ексципієнти можуть мати широку різноманітність форм залежно від форми препарату, який необхідно ввести. Наприклад, ексципієнти, придатні для застосування у пероральних рідних або аерозольних лікарських формах, включають, проте не обмежуються тільки ними, воду, гліколі, олії, спирти, ароматизатори, консерванти та барвники. Приклади ексципієнтів, придатних для застосування у твердих пероральних лікарських формах (наприклад, порошки, таблетки, капсули та таблетки у вигляді капсул) включають, проте не обмежуються тільки ними, крохмалі, цукри, мікрокристалічну целюлозу, розріджувачі, гранулювальні агенти, змащувальні агенти, зв’язувальні агенти та дезінтегратори. Завдяки тому, що їх легко вводити, таблетки та капсули являють собою найбільш переважні пероральні лікарські одиничні форми, у випадку яких застосовуються тверді ексципієнти. За бажанням на таблетки можна нанести покриття, застосовуючи стандартні водні та неводні способи. Такі лікарські форми можна виготовити будь-яким способом фармації. Взагалі, фармацевтичні склади та лікарські форми виготовляють шляхом однорідного та ретельного змішування активних інгредієнтів з рідкими носіями, тонко здрібненими твердими носіями або з тими та іншими, а потім надання їм бажаної форми, якщо це необхідно. Наприклад, таблетку можна виготовляти шляхом пресування або формування. Спресовані таблетки можна приготувати у придатному пристрої шляхом пресування активних інгредієнтів у вільній плинній формі, таких як порошок або гранули, необов'язково змішаних з ексципієнтом. Сформовані таблетки можна виготовити шляхом формування у придатному пристрої суміші сполуки у вигляді порошку, зволоженого інертним рідким розріджувачем. Приклади ексципієнтів, які можна застосовувати у лікарських формах для перорального введення винаходу, включають, проте не обмежуються тільки ними, зв’язувальні агенти, наповнювачі, дезінтегратори та змащувальні агенти. Зв’язувальні агенти, які є придатними для застосування у фармацевтичних композиціях та лікарських формах, включають, проте не обмежуються тільки ними, кукурудзяний крохмаль, картопляний крохмаль або інші види крохмалю, желатин, природні та синтетичні смоли, такі як аравійська камедь, альгінат натрію, альгінова кислота, інші альгінати, порошкоподібний трагакант, гуарова смола, целюлозу та її похідні (наприклад, етилцелюлозу, ацетилцелюлозу, карбоксиметилцелюлозу кальцію, карбоксиметилцелюлозу натрію), полівінілпіролідон, метилцелюлозу, попередньо желатинований крохмаль, гідроксипропілметилцелюлозу (наприклад, №№ 2208, 2906, 2910), мікрокристалічну целюлозу та їх суміші. Приклади наповнювачів, придатних для застосування у фармацевтичних композиціях та лікарських формах, описаних у цьому описі, включають, проте не обмежуються тільки ними, тальк, карбонат кальцію (наприклад, гранули або порошок), мікрокристалічну целюлозу, порошкоподібну целюлозу, декстрати, каолін, маніт, кремнієву кислоту, сорбіт, крохмаль, попередньо желатинований крохмаль та їх суміші. Кількість зв’язувального агента або наповнювача у фармацевтичних композиціях винаходу звичайно становить від приблизно 50 до приблизно 99 масових відсотків фармацевтичної композиції або лікарської форми. Придатні форми мікрокристалічної целюлози включають, проте не обмежуються тільки ними, матеріали, що продаються як AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICELPH-105 (які можна отримати у FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) та їх суміші. Специфічним зв’язувальним агентом є суміш мікрокристалічної целюлози та карбоксиметилцелюлози натрію, яка продається як AVICEL RC-581. Придатні безводні ексципієнти або ексципієнти або добавки з низьким вмістом вологи включають AVICEL-PH103™ та Starch 1500 LM. Дезінтегратори застосовуються у композиціях винаходу для того, щоб таблетки розпадалися 21 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 під впливом водного середовища. Таблетки, що містять надмірно багато дезінтегратора, можуть розпадатися під час зберігання, проте, ті таблетки, що містять занадто мало дезінтегратора, можуть не розпадатися з бажаною швидкістю або у бажаних умовах. Отже, достатню кількість дезінтегратора, яка не є ані занадто великою, ані занадто малою, щоб шкідливо змінювати виділення активних інгредієнтів, слід застосовувати для утворення твердих лікарських форм для перорального введення цього винаходу. Кількість дезінтегратора, який застосовується, різниться залежно від типу фармацевтичного складу, та її легко визначить звичайний фахівець у галузі. Звичайні фармацевтичні композиції містять від приблизно 0,5 до приблизно 15 масових відсотків дезінтегратора, особливо від приблизно 1 до приблизно 5 масових відсотків дезінтегратора. Дезінтегратори, які можна застосовувати у фармацевтичних композиціях та лікарських формах винаходу включають, проте не обмежуються тільки ними, агар-агар, альгінову кислоту, карбонат кальцію, мікрокристалічну целюлозу, кроскармелозу натрію, кросповідон, полакрилін калію, крохмальний гліколят натрію, картопляний крохмаль або крохмаль тапіоки, попередньо желатинований крохмаль, інші крохмалі, глини, інші альгіни, інші целюлози, смоли та їх суміші. Змащувальні агенти, які можна застосовувати у фармацевтичних композиціях та лікарських формах винаходу, включають, проте не обмежуються тільки ними, стеарат кальцію, стеарат магнію, мінеральну оливу, легку мінеральну оливу, гліцерин, сорбіт, маніт, поліетиленгліколь, інші гліколі, стеаринову кислоту, натрію лаурилсульфат, тальк, гідрогенізовану рослинну олію (наприклад, кокосову олію, бавовняну олію, соняшникову олію, кунжутну олію, оливкову олію, кукурудзяну олію та соєву олію), стеарат цинку, етилолеат, етиллауреат, агар та їх суміші. Додаткові змащувальні агенти включають, наприклад, силоїдний силікагель (AEROSIL 200, виготовляється W.R. Grace Co., Baltimore, MD), коагульований аерозоль синтетичного діоксиду кремнію (розповсюджується Degussa Co., Plano, TX), CAB-O-SIL (пірогенний діоксид кремнію, який продається Cabot Co., Boston, MA) та їх суміші. Якщо вони взагалі застосовуються, змащувальні агенти звичайно застосовуються у кількості, яка становить менш ніж 1 масовий відсоток від фармацевтичних композицій або лікарських форм, у які їх включено. Лікарські форми з уповільненим вивільненням Активні інгредієнти винаходу можна вводити за допомогою засобів регульованого вивільнення або за допомогою засобів доставки, які є добре відомими для звичайних фахівців у галузі. Приклади включають, проте не обмежуються тільки ними, засоби, описані у Патентах США №№ 3845770; 3916899; 3536809; 3598123 та 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 та 5733566, кожний з яких включено сюди шляхом посилання. Такі лікарські форми можна застосовувати для здійснення повільного або регульованого вивільнення одного або декількох активних інгредієнтів, застосовуючи при цьому, наприклад, гідропропілметилцелюлозу, інші полімерні матриці, гелі, проникні мембрани, осмотичні системи, багатошарові покриття, мікрочастинки, ліпосоми, мікрокульки або їх комбінацію, щоб отримати бажаний профіль вивільнення у різноманітних пропорціях. Придатні фармацевтичні склади регульованого вивільнення, відомі для звичайних фахівців у цій галузі, включаючи ті, що описані у цьому описі, можна легко вибрати для застосування з активними інгредієнтами винаходу. Винахід, отже, охоплює єдині одиничні лікарські форми, придатні для перорального введення, такі як, проте не обмежуючись тільки ними, таблетки, капсули, гелеві ковпачки та таблетки у вигляді капсули, які є адаптованими для регульованого виділення. Усі фармацевтичні продукти регульованого вивільнення мають загальну мету удосконалення терапії ліками порівняно з терапією нерегульованими аналогами. Ідеально, застосування оптимального розробленого препарату регульованого вивільнення у медичній практиці характеризується тим, що мінімальна кількість лікарської речовини застосовується для лікування або регулювання стану за мінімальну кількість часу. Переваги фармацевтичних складів регульованого вивільнення включають тривалішу активність ліків, знижену частоту дозування та підвищену піддатливість пацієнта. Крім того, фармацевтичні склади регульованого вивільнення можна застосовувати, щоб впливати на час початку дії або інші характеристики, такі як рівні ліків у крові, що у свою чергу, дозволяє впливати на появу побічних (наприклад, шкідливих) ефектів. Більшість фармацевтичних складів регульованого вивільнення розроблено так, щоб спочатку виділялася така кількість ліків (активного інгредієнта), яка швидко викликає бажаний терапевтичний ефект, а потім поступово та безперервно виділялася решта ліків для того, щоб підтримувати цей рівень терапевтичного або профілактичного ефекту протягом більш тривалого періоду часу. Для того, щоб у організмі підтримувався цей постійний рівень ліків, ліки повинні виділятися з лікарської форми зі швидкістю, завдяки якій буде заміщуватися кількість ліків, які метаболізувалися та виділилися з організму. Регульованому вивільненню активного інгредієнта 22 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть сприяти різні умови, включаючи, проте не обмежуючись тільки ними, рН, температуру, ферменти, воду або інші фізіологічні умови або сполуки. Лікарські форми для парентерального введення Парентеральні лікарські форми можна вводити пацієнтам різними способами, включаючи, проте не обмежуючись тільки ними, підшкірну, внутрівенну (включаючи болюсне введення), внутрішньом’язову та внутрішньоартеріальну ін’єкції. Оскільки їх введення звичайно обминає природний захист пацієнтів проти домішок, парентеральні лікарські форми є переважно стерильними або здатними до стерилізування перед введенням пацієнтові. Приклади парентеральних лікарських форм включають, проте не обмежуються тільки ними, готові для ін’єкції розчини, сухі та/або ліофілізовані продукти, готові для розчинення або суспендування у фармацевтично прийнятному наповнювачі для ін’єкції (розчинні порошки), готові для ін’єкції суспензії та емульсії. Придатні наповнювачі, які можна застосовувати для виготовлення парентеральних лікарських форм винаходу, є добре відомими фахівцям у галузі. Приклади включають, проте не обмежуються тільки ними, воду для ін’єкції USP; водні наповнювачі, такі як, проте не обмежуючись тільки ними, фізіологічний розчин для ін’єкцій, розчин для ін’єкцій Рінгера, декстроза для ін’єкцій, декстроза з фізіологічним розчином для ін’єкцій та розчин Рінгера з лактатом; водорозчинні наповнювачі, такі як, проте не обмежуючись тільки ними, етиловий спирт, поліетиленгліколь та поліпропіленгліколь; та неводні наповнювачі, такі як, проте не обмежуючись тільки ними, кукурудзяна олія, бавовняна олія, кокосова олія, кунжутна олія, етилолеат, ізопропілміристат та бензилбензоат. Сполуки, які підвищують розчинність одного або декількох активних інгредієнтів та які описано у цьому описі, також можна включити у парентеральні лікарські форми винаходу. Лікарські форми для трансдермального ведення Трансдермальні лікарські форми включають пластири "резервуарного типу" або "матричного типу", які можна наносити на шкіру та залишати їх протягом певного періоду часу для того, щоб проникла бажана кількість активних інгредієнтів. Придатні ексципієнти (наприклад, носії та розріджувачі) та інші матеріали, які можна застосовувати для виготовлення трансдермальних та місцевих лікарських форм, які охоплюються цим винаходом, є добре відомими для фахівців у фармацевтичній галузі та залежать від певної тканини, на яку буде наноситися дана фармацевтична композиції або лікарська форма. Враховуючи цей факт, звичайні ексципієнти включають, проте не обмежуються тільки ними, воду, ацетон, етанол, етиленгліколь, пропіленгліколь, бутан-1-3-діол, ізопропілміристат, ізопропілпальмітат, мінеральну оливу та їх суміші. Залежно від специфічної тканини, яку слід лікувати, додаткові компоненти можна застосовувати до, разом з або після лікування активними інгредієнтами винаходу. Наприклад, агенти, що сприяють проникненню, можна застосовувати для покращення доставки активних інгредієнтів у тканину. Придатні агенти, що сприяють проникненню, включають, проте не обмежуються тільки ними, ацетон; різні спирти, такі як етанол, олеїл та тетрагідрофурил; алкілсульфоксиди, такі як диметилсульфоксид; диметилацетамід; диметилформамід; поліетиленгліколь; піролідони, такі як полівінілпіролідон; сорти Kollidon (Povidone, Polyvidone); сечовину та різні водорозчинні або нерозчинні цукрові естери, такі як Tween 80 (полісорбат 80) та Span 60 (сорбітан моностеарат). рН фармацевтичної композиції або лікарської форми або тканини, на яку наноситься фармацевтична композиція або лікарська форма, можна також відрегулювати з метою покращення доставки одного або декількох активних інгредієнтів. Подібно до цього, полярність носія-розчинника, його іонну силу або тонічність можна відрегулювати для покращення доставки. Сполуки, такі як стеарати, можна також додати до фармацевтичних композицій або лікарських форм, щоб змінити на краще гідрофільність або ліпофільність одного або декількох активних інгредієнтів, так щоб покращити доставку. Стосовно цього стеарати можуть служити ліпідним носієм для фармацевтичного складу поряд з емульгаторами або поверхневоактивними речовинами та поряд з агентом, який сприяє доставці або проникненню. Різні солі, гідрати або сольвати активних інгредієнтів можна застосовувати для подальшого регулювання властивостей отриманої композиції. Лікарські форми для місцевого введення Лікарські форми для місцевого введення винаходу включають, проте не обмежуються тільки ними, креми, лосьйони, мазі, гелі, розчини, емульсії, суспензії або інші форми, відомі фахівцям у галузі. Дивись, наприклад, Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990); та Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Придатні ексципієнти (наприклад, носії та розріджувачі) та інші матеріали, які можна 23 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовувати для отримання трансдермальних та місцевих лікарських форм, які охоплюються цим винаходом, є добре відомими фахівцям у фармацевтичній галузі та залежать від певної тканини, на яку буде наноситися дана фармацевтична композиція або лікарська форма. Враховуючи цей факт, звичайні ексципієнти включають, проте не обмежуються тільки ними, воду, ацетон, етанол, етиленгліколь, пропіленгліколь, бутан-1-3-діол, ізопропілміристат, ізопропілпальмітат, мінеральну оливу та їх суміші. Залежно від специфічної тканини, яку слід лікувати, додаткові компоненти можна застосовувати до, разом з або після лікування активними інгредієнтами винаходу. Наприклад, агенти, що сприяють проникненню, можна застосовувати для покращення доставки активних інгредієнтів у тканину. Придатні агенти, що сприяють проникненню, включають, проте не обмежуються тільки ними, ацетон; різні спирти, такі як етанол, олеїл та тетрагідрофурил; алкілсульфоксиди, такі як диметилсульфоксид; диметилацетамід; диметилформамід; поліетиленгліколь; піролідони, такі як полівінілпіролідон; сорти Kollidon (Povidone, Polyvidone); сечовину та різні водорозчинні або нерозчинні цукрові естери, такі як Tween 80 (полісорбат 80) та Span 60 (сорбітан моностеарат). Лікарські форми для введення крізь слизову оболонку Лікарські форми для введення крізь слизову оболонку винаходу включають, проте не обмежуються тільки ними, офтальмологічні розчини, спреї та аерозолі або інші форми, відомі фахівцям у галузі. Дивись, наприклад, Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990); та Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Лікарські форми, придатні для лікуванні слизових тканин у ротовій порожнині, можна виготовити у вигляді рідин для полоскання роту або у вигляді пероральних гелів. В одному варіанті здійснення аерозоль включає носій. В іншому варіанті здійснення аерозоль не включає носій. Сполуки Формули І цього винаходу можна також вводити безпосередньо у легені шляхом інгаляції. Для введення шляхом інгаляції сполуку Формули І цього винаходу можна зручно доставити у легені за допомогою ряду різних пристроїв. Наприклад, дозувальний інгалятор ("MDI"), в якому застосовуються ємності, що містять придатний диспергатор, який кипить при низькій температурі, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан, діоксид вуглецю або інший придатний газ, можна застосовувати для доставки сполуки Формули І безпосередньо у легені. Пристрої MDI можна отримати від ряду постачальників, таких як 3M Corporation, Aventis, Boehringer Ingleheim, Forest Laboratories, GlaxoWellcome, Schering Plough та Vectura. Альтернативно, пристрій для інгаляції сухого порошку (DPI) можна застосовувати для введення сполуки Формули І у легені (дивись, наприклад, Raleigh et al., Proc. Amer. Assoc. Cancer Research Annual Meeting, 1999, 40, 397, що включено сюди шляхом посилання). Пристрої DPI звичайно застосовують механізм, такий як викид газу, утворюючи хмару сухого порошку у контейнері, який потім може вдихатися пацієнтом. Пристрої DPI є також добре відомими у галузі, та їх можна придбати у ряду виробників, які включають, наприклад, Fіsоns, Glaxo-Wellcome, Inhale Therapeutic Systems, ML Laboratories, Qdose та Vectura. Популярним варіантом є система DPI багаторазової дози ("MDDPI"), яка дозволяє здійснювати доставку більш ніж однієї терапевтичної дози. Пристрої MDDPI можна придбати у компаній, таких як AstraZeneca, GlaxoWellcome, IVAX, Schering Plough, SkyePharma та Vectura. Наприклад, капсули та картриджі із желатину для застосування в інгаляторі або інсуфляторі можна виготовити так, щоб вони містили для цих систем порошкову суміш сполуки та придатної порошкової основи, такої як лактоза або крохмаль. Інший тип пристрою, який можна застосовувати для доставки сполуки Формули І у легені, це пристрій для розпилювання рідини, який постачається, наприклад, Aradigm Corporation. Системи для розпилювання рідини застосовують сопла з надзвичайно малими отворами для розпилювання фармацевтичних складів рідких ліків, які можна потім інгалювати безпосередньо у легені. У переважному варіанті здійснення розпилювач застосовується для доставки сполуки Формули І у легені. Розпилювачі утворюють аерозолі з рідких лікарських складів, застосовуючи, наприклад, ультразвукову енергію для утворення дрібних частинок, які можна легко інгалювати (дивись, наприклад, Verschoyle et al., British J. Cancer, 1999, 80, Suppl 2, 96, яку включено сюди шляхом посилання). Приклади розпилювачів включають пристрої, які постачаються Sheffield/Systemic Pulmonary Delivery Ltd, (дивіться: Armer et al., патент США № 5954047; van der Linden et al., патент США № 5950619; van der Linden et al., патент США № 5970974, які включено сюди шляхом посилання), Aventis та Batelle Pulmonary Therapeutics. В одному варіанті здійснення електрогідродинамічний ("EHD") аерозольний пристрій 24 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовується для доставки сполуки Формули І у легені. Аерозольні пристрої EHD застосовують електричну енергію для того, щоб розпилювати розчини або суспензії рідких ліків (дивись, наприклад, Noakes et al., патент США № 4765539; Coffee, патент США № 4962885; Coffee, Заявку PCT, WO 94/12285; Coffee, Заявку PCT, WO 94/14543; Coffee, Заявку PCT, WO 95/26234, Coffee, Заявку PCT, WO 95/26235, Coffee, Заявку PCT, WO 95/32807, які включено сюди шляхом посилання). Електрохімічні властивості фармацевтичного складу зі сполукою Формули І можуть бути важливими параметрами для оптимізації під час доставки цих ліків у легені за допомогою аерозольного пристрою EHD, та таку оптимізацію звичайно здійснюють фахівці у цій галузі. Аерозольні пристрої EHD можуть більш ефективно доставляти ліки у легені, ніж існуючі технології пульмонарної доставки. Інші способи внутрішньопульманарної доставки сполук Формули І є добре відомими для фахівців у цій галузі та вони знаходяться у межах цього винаходу. Рідкі фармацевтичні склади, придатні для застосування з розпилювачами, пристроями для розпилювання рідини та аерозольними пристроями EHD, будуть звичайно включати сполуку Формули І з фармацевтично прийнятним носієм. Переважно, щоб фармацевтично прийнятний носій був рідиною, такою як спирт, вода, поліетиленгліколь або перфторвуглець. За бажанням можна додати інший матеріал, щоб змінити аерозольні властивості розчину або суспензії сполуки Формули І. Переважно, щоб цей матеріал був рідиною, такою як спирт, гліколь, полігліколь або жирна кислота. Інші способи виготовлення розчинів або суспензій рідких ліків, придатних для застосування в аерозольних пристроях, є відомими для фахівців у цій галузі (дивись, наприклад, Biesalski, патент США №5112598; Biesalski, патент США № 5556611, які включено сюди шляхом посилання). Сполуку Формули І можна також виготовляти у вигляді композицій для ректального або вагінального введення, таких як супозиторії або утримуюча клізма, наприклад, які містять традиційні для супозиторіїв основи, такі як кокосове масло або інші гліцериди. Окрім фармацевтичних складів, описаних раніше, сполуку Формули І можна також виготовляти у вигляді препаратів пролонгованої дії. Такі фармацевтичні склади пролонгованої дії можна вводити шляхом імплантації (наприклад, підшкірної або внутрішньом’язової) або шляхом внутрішньом’язової ін’єкції. Отже, наприклад, сполуки можна виготовляти з придатними полімерними або гідрофобними матеріалами (наприклад, як емульсію у придатній олії) або іонообмінними смолами, або у вигляді помірно розчинних похідних, наприклад, у вигляді помірно розчинної солі. Альтернативно можна застосовувати інші системи фармацевтичної доставки. Ліпосоми та емульсії є добре відомими прикладами наповнювачів для доставки, які можна застосовувати для доставки сполук Формули І. Певні органічні розчинники, такі як диметилсульфоксид, можна також застосовувати, хоча звичайно за рахунок суттєвішої токсичності. Сполуку Формули І можна також доставляти у системі регульованого вивільнення. В одному варіанті здійснення можна застосовувати помпу (Sefton, CRC Crit. Ref Biomed Eng., 1987, 14, 201; Buchwald et al., Surgery, 1980, 88, 507; Saudek et al., N. Engl. J. Med., 1989, 321, 574). В іншому варіанті здійснення можна застосовувати полімерні матеріали (дивись Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem., 1983, 23, 61; дивись також Levy et al., Science, 1985, 228, 190; During et al., Ann. Neurol., 1989, 25, 351; Howard et al., J. Neurosurg. 71, 105 (1989)). У іще іншому варіанті здійснення систему регульованого вивільнення можна розташувати близько від мішені сполук цього винаходу, наприклад, близько від легенів, при цьому потребується лише частина системної дози (дивись, наприклад, Goodson, в Medical Applications of Controlled Release, дивись вище, vol. 2, pp. 115 (1984)). Можна застосовувати іншу систему регульованого вивільнення (дивись, наприклад, Langer, Science, 1990, 249, 1527). Придатні ексципієнти (наприклад, носії та розріджувачі) та інші матеріали, які можна застосовувати для виготовлення лікарських форм для введення крізь слизову оболонку, які охоплюються цим винаходом, є добре відомими для фахівців у фармацевтичній галузі та залежать від певного місця або способу, яким дана фармацевтична композиція або лікарська форма буде вводитися. Враховуючи це, звичайні ексципієнти включають, проте не обмежуються тільки ними, воду, етанол, етиленгліколь, пропіленгліколь, бутан-1,3-діол, ізопропілміристат, ізопропілпалмітат, мінеральну оливу та їх суміші, які є нетоксичними та фармацевтично прийнятними. Приклади таких додаткових інгредієнтів є добре відомими у цій галузі. Дивись, наприклад, Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990). рН фармацевтичної композиції або лікарської форми, або тканини, на яку наноситься 25 UA 100120 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтична композиція або лікарська форма, можна також відрегулювати з метою покращення доставки одного або декількох активних інгредієнтів. Подібно до цього, полярність носія-розчинника, його іонну силу або тонічність можна відрегулювати для покращення доставки. Сполуки, такі як стеарати, можна також додати до фармацевтичних композицій або лікарських форм, щоб змінити на краще гідрофільність або ліпофільність одного або декількох активних інгредієнтів, так щоб покращити доставку. Стосовно цього стеарати можуть служити ліпідним наповнювачем для фармацевтичного складу поряд з емульгаторами або поверхневоактивними речовинами та поряд з агентом, який сприяє доставці або проникненню. Різні солі, гідрати або сольвати активних інгредієнтів можна застосовувати для подальшого регулювання властивостей отриманої композиції. НАБОРИ Цим винаходом пропонується фармацевтична упаковка або набір, який включає один або декілька контейнерів, які містять сполуку Формули І, що є корисною для лікування або профілактики вірусної інфекції гепатиту С. В інших варіантах здійснення винахід пропонує фармацевтичну упаковку або набір, який включає один або декілька контейнерів, які містять сполуку Формули І, що є корисною для лікування або профілактики вірусної інфекції гепатиту С, та один або декілька контейнерів, які включають додатковий терапевтичний агент, включаючи, проте не обмежуючись тільки ними, ті, які перелічені раніше, зокрема, противірусний агент, інтерферон, агент, який інгібує вірусні ферменти, або агент, який інгібує вірусну реплікацію, переважно додатковий терапевтичний агент є специфічним до вірусу гепатиту С або демонструє активність проти вірусу гепатиту С. Винаходом пропонується фармацевтична упаковка або набір, який включає один або декілька контейнерів, що містять один або декілька інгредієнтів фармацевтичних композицій винаходу. Необов'язково до цих контейнерів може додаватися інструкція у формі, яку визначає урядова установа, що регулює виробництво, застосування або продаж фармацевтичних препаратів або біологічних продуктів, при цьому ця інструкція містить дозвіл установи щодо виробництва, застосування або продажу для введення людині. Агенти винаходу можна одержати, застосовуючи шляхи реакції та схеми синтезу, які описано нижче, застосовуючи загальні процедури, відомі у галузі, застосовуючи початкові матеріали, які є легко доступними. Синтез сполук, які не наведено як приклади, згідно з цим винаходом можна успішно виконати шляхом модифікацій, очевидних фахівцям у галузі, наприклад, шляхом відповідного захисту груп, що уводяться, шляхом заміни на інші придатні реагенти, відомі у науці, або шляхом виконання звичайних модифікацій умов реакції. Альтернативно, зрозуміло, що інші реакції, відмінні від описаних тут та які є загально відомими у галузі, можна буде застосовувати для одержання інших сполук винаходу. Одержання сполук У схемах синтезу, описаних нижче, якщо не вказано інше, усі температури позначаються у градусах Цельсію, а усі частини та відсотки вказано за масою. Реагенти купували у комерційних постачальників, таких як Aldrich Chemical Company або Lancaster Synthesis Ltd., та їх застосовували без подальшого очищення, якщо не вказано інше. Усі розчинники були придбані у комерційних постачальників, таких як Aldrich, EMD Chemicals або Fisher, та застосовували у тому вигляді, в якому їх отримали. Реакції, описані нижче, виконували взагалі в умовах позитивного тиску аргону або азоту при кімнатній температурі (якщо не зазначається інше) у безводних розчинниках, а до реакційних колб пристосували гумові перегородки для введення субстратів та реагентів шприцом. Скляний посуд висушували у печі та/або висушували шляхом нагрівання. Реакції проаналізували шляхом тонкошарової хроматографії (TLC, ТШХ) та/або РХ-МС (LCMS) або HPLC (рідинна хроматографія високого розрізнення) та їх припиняли, звертаючи увагу на витрату початкового матеріалу. Аналітичну тонкошарову хроматографію (TLC) виконували на скляних планшетах, попередньо покритих силікагелем 60 F 254 розміром 0,25 мм (EMD Chemicals) та за нею спостерігали за допомогою ультрафіолетового випромінювання (254 нм) та/або з йодом на силікагелі та/або нагріванням з барвником для TLC, таким як етанолова фосфомолібденова кислота, розчин нінгідрину, розчин перманганату калію або розчин сульфату церію. Препаративну тонкошарову хроматографію (prepTLC) виконували на скляних планшетах, попередньо покритих силікагелем 60 F254 розміром 0,5 мм (20 × 20 см, від Thomson Instrument Company), та за нею спостерігали за допомогою ультрафіолетового випромінювання (254 нм). Змішування звичайно виконували шляхом збільшення об’єму реакційної суміші удвічі розчинником, що застосовується у реакції, або екстракційним розчинником з наступним промиванням вказаними водними розчинами, застосовуючи 25% від об’єму, використаному при 26 UA 100120 C2 5 10 15 20 25 30 екстракції, якщо не вказано інше. Розчини продукту висушували над безводним Na 2SO4 та/або Mg2SO4 до фільтрування та випаровування розчинників в умовах зниженого тиску на роторному випарнику та спостерігали як розчинники видалялися в умовах вакууму. Колоночну хроматографію здійснювали з позитивним тиском, застосовуючи силікагель Merck silica gel 60 з пористістю у 230-400 або нейтральний оксид алюмінію з пористістю у 50-200 меш, флешхроматографію ISCO, застосовуючи попередньо завантажені селікагелеві колонки RediSep, або колоночну хроматографію Analogix, застосовуючи попередньо завантажені селікагелеві колонки SuperFlash. Гідрогеноліз виконували в умовах тиску, вказаного у прикладах, або при тиску навколишнього середовища. 1 13 Спектри Н-ЯМР та С-ЯМР реєстрували на апараті Varian Mercury-VX400 при 400 МГц. -1 Спектри ЯМР отримали стосовно розчинів CDCl3 (надані у ppm (млн )), застосовуючи -1 -1 хлороформ як контрольний стандарт (7,27 млн для протона та 77,00 млн для вуглецю), -1 -1 -1 CD3OD (3,4 та 4,8 млн для протонів та 49,3 млн для вуглецю), ДМСО-d6 (2,49 млн для -1 протона) або тетраметилсилан як внутрішній стандарт (0,00 млн ), коли він був доречним. Інші розчинники для ЯМР застосовувалися за необхідністю. Для позначення максимальної мультиплетності застосовуються наступні абревіатури: с (синглет), д (дублет), т (триплет), к (квартет), м (мультиплет), шир. (розширений), шир. с (широкий синглет), дд (дублет дублетів), дт (дублет триплетів). Константи взаємодії, якщо наводяться, визначаються у Герцах (Гц). Інфрачервоні (IR) спектри реєструвалися на спектрометрі ATR FT-IR Spectrometer як чисті -1 оливи, як тверді речовини, та коли їх наведено, вони визначаються у хвильових числах (см ). Мас-спектри, які наведено, являють собою (+)-ES або APCI (+) LC/MS(+) (рідинна хроматографія/мас-спектроскопія), яку проводив відділ аналітичної хімії фірми Anadys Pharmaceuticals, Inc. Елементний аналіз був проведений Atlantic Microlab, Inc., з м. Норкросс, штат Джорджія. Точки плавлення (Т. пл.) (mp) визначали на відкритому капілярному апараті, та вони не корегувалися. Значення енантіомерних надлишків (ee) визначили шляхом HPLC-аналізу з використанням колонок Chiralpak AS-RH, 2,1 × 150 мм, 5 мікрон, λ = 312 нм або AS-RH, 4,6 × 250 мм, 5 мікрон, λ = 310 нм (Chiral Technologies Inc.). Колонка AS-RH, 2,1 × 150 мм, 5 мікрон: подвійне градієнтне розділення HPLC. Розчинник A: 0,1% мурашина кислота у воді, Розчинник B: 0,1% мурашина кислота в ацетонітрилі. Введені шляхом ін’єкції 10 мкл зразка, розчиненого в 50% метанолу – 50% води [0,1 мг/мл]. Час (хв.) 0,0 5,0 5,5 6,0 12,0 35 45 Потік (мл/хв.) 0,3 0,3 0,3 0,3 0,3 Колонка AS-RH, 4,6 × 250 мм, 5 мікрон: подвійне градієнтне розділення HPLC. Розчинник A: 0,05 % TFA у воді, Розчинник B: 0,05 % TFA у ацетонітрилі. Введені шляхом ін’єкції 3-5 мкл зразка, розчиненого в ацетонітрилі [1 мг/мл]. Час (хв.) 0,0 8,0 10,0 11,0 13,0 40 %B 55 95 95 55 55 %B 50 95 95 50 50 Потік (мл/хв.) 0,8 0,8 0,8 0,8 0,8 В наданих схемах синтезу та в описаних експериментальних процедурах застосовано багато звичайних хімічних абревіатур, 2,2-DMP (2,2-диметоксипропан), Ac (ацетил), ACN (ацетонітрил), Bn (бензил), BnOH (бензиловий спирт), Boc (трет-бутоксикарбоніл), Boc2O (дитрет-бутил дикарбонат), Bz (бензоїл), CSI (хлоросульфонілу ізоціанат), DBU (1,8діазабіцикло[5.4.0]ундец-7-ен), DCC (N,N’-дициклогексилкарбодіімід), DCE (1,2-дихлороетан), DCM (дихлорометан), DEAD (діетилазодикарбоксилат), DIEA (діізопропілетиламін), DMA (N,Nдиметилацетамід), DMAP (4-(N,N-диметиламіно)піридин), DMF (N,N-диметилформамід), DMSO (диметилсульфоксид), EDC (1-(3-диметиламінопропіл)-3-етилкарбодіімід, гідрохлорид), Et (етил), EtOAc (етилацетат), EtOH (етанол), HATU (O-(7-азабензотриазол-1-іл)-1,1,3,3тетраметилуронію гексафторофосфат), HBTU (O-бензотриазол-1-іл-N,N,N’,N’-тетраметилуронію 27 UA 100120 C2 5 10 15 гексафторофосфат), HF (фтороводень), HOAc (оцтова кислота), HOBT (1гідроксибензотриазолу гідрат), HPLC (рідинна хроматографія високого розрізнення), IPA (ізопропіловий спирт), KHMDS (калію біс(триметилсиліл)амід), KN(TMS) 2 (калію t біс(триметилсиліл)амід), KO Bu (трет-бутоксид калію), LDA (діізопропіламін літію), MCPBA (3хлоропербензойна кислота), Me (метил), MeCN (ацетонітрил), MeOH (метанол), NaBH(OAc)3 (триацетоксиборогідрид натрію), NaCNBH3 (ціаноборогідрид натрію), NaH (гідрид натрію), NaN(TMS)2 (біс(триметилсиліл)амід натрію), NaOAc (ацетат натрію), NaOEt (етоксид натрію), Phe (фенілаланін), PPTS (p-толуолсульфонат піридинію), PS (з полімерним носієм), Py (піридин), pyBOP (бензотриазол-1-ілокси)трипіролідинoфосфонію гексафторофосфат), TEA (триетиламін), TFA (трифторооцтова кислота), TFAA (трифторооцтовий ангідрид), THF (тетрагідрофуран), TLC (тонкошарова хроматографія), Tol (толуоїл), Val (валін) тощо. Схема 1 надає загальну процедуру, яка може застосовуватися для одержання насичених сполук 5,6-дигідро-1H-піридин-2-ону Формули I. Схема 1 R = аліфатична або ароматична група, яка видаляється 20 25 Проміжні сполуки - естери насичених циклічних N-заміщених-β-амінокислот, які можуть бути одержані за одним зі способів, наведених на схемах 3, 4, 6, 7 або 8, можуть бути сконденсовані з карбоновокислотною проміжною сполукою (або її сіллю, наприклад, натрієвою сіллю), застосовуючи стандартні умови поєднання пептидів, використовувані для утворення амідних зв'язків, такі як DCC, з одержанням показаного аміду. Можна провести замикання кільця у цій проміжній сполуці з виділенням, або без нього, у присутності основи (наприклад, триетиламіну) з одержанням бажаних насичених сполук 5,6-дигідро-1H-піридин-2-ону. Схема 2 надає загальну процедуру, яка може застосовуватися для одержання ненасичених сполук 5,6-дигідро-1H-піридин-2-ону Формули I. 28
ДивитисяДодаткова інформація
Назва патенту англійською5,6-dihydro-1h-pyridin-2-one compounds
Автори англійськоюTran, Chinh, Viet, Ruebsam, Frank, Murphy, Douglas, Eric, Dragovich, Peter, S., Zhou, Yuefen, Chen, Lijiang, Kucera, David, Blatter, Fritz, Viertelhaus, Martin
Назва патенту російськоюСоединения 5, дигидро-1 пиридин-2-она
Автори російськоюТран Чин Вьет, Рубсам Фрэнк, Мерфи Дуглас Эрик, Драгович Питер Ес., Джоу Юэфен, Чен Лиджиан, Куцера Дэйвид, Блаттер Фриц, Виртелхаус Мартин
МПК / Мітки
МПК: A01N 43/66
Мітки: сполуки, 5,6-дигідро-1н-піридин-2-ону
Код посилання
<a href="https://ua.patents.su/160-100120-spoluki-56-digidro-1n-piridin-2-onu.html" target="_blank" rel="follow" title="База патентів України">Сполуки 5,6-дигідро-1н-піридин-2-ону</a>
Попередній патент: Застосування 3-альфа-андростандіолу в поєднанні з агоністом 5-нt1а для лікування сексуальної дисфункції
Наступний патент: Рослина капусти качанної (brassica oleracea), стійка до albugo candida
Випадковий патент: Фармацевтична композиція для орального введення суспендованого комплексу чотиривалентної платини












