Тієнопіридазинони, спосіб їх одержання та використання у модуляції автоімунної хвороби
Номер патенту: 80175
Опубліковано: 27.08.2007
Автори: Расул Рухсана Таснеем, Купер Мартін Едвард, Інґолл Ентоні Говард, іл Саймон Дейвід
Формула / Реферат
1. Сполука формули (І):
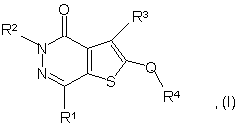
в якій:
R1 є С1-6алкілом, С2-6 алкенілом або С3-6циклоалкілом, як варіант, заміщеним С1-6алкілом, причому кожен з них, як варіант, заміщений одним або більше атомами галогену;
R2 є С1-6алкілом;
R3 є групою CO-G або SO2-G, де G є 5- або 6-членним кільцем, яке містить атом нітрогену і другий гетероатом, вибраний з оксигену і сульфуру і суміжний до нітрогену, і яке, як варіант, заміщене 1-3 групами, вибраними з гідроксилу і С1-4алкілу;
Q є групою CR5R6, де R5 є гідрогеном, С1-6алкілом або флуором, a R6 є гідрогеном, ОН або флуором, або R5 і R6 разом утворюють групу =О, за умови, що R5 не є флуором, коли R6 є ОН;
R4 є 5-10-членною моно- або біциклічною ароматичною кільцевою системою, з 0-4 гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфуру, як варіант, заміщеною 1-4 групами, незалежно вибраними з галогену, С1-4алкілу, (полі)галоген-С1-4алкілу, С1-4алкокси, (полі)галоген-С1-4алкокси, С1-4алкілсульфонілу, (полі)галоген-С1-4алкілсульфонілу, оксогрупи, тіоксогрупи, ціаногрупи, гідроксиметилу, метилтіо, -NR7R8, -CO-NR7R8, -SO2NR7R8 або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфуру і нітрогену, і яка сама може бути заміщена 1-4 групами, вибраними з галогену, С1-4алкілу, (полі)галоген-С1-4алкілу, С1-4алкокси, (полі)-галогенС1-4алкокси, С1-4алкілсульфонілу, (полі)галоген-С1-4алкілсульфонілу, оксогрупи, тіоксогрупи, ціаногрупи, гідроксиметилу, метилтіо, -NR7R8, -CO-NR7R8, -SO2-NR7R8;
R7 і R8 є незалежно гідрогеном, С1-4алкілом; або R7 і R8 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати 5-7-членне насичене гетероциклічне кільце;
і її фармацевтично прийнятні солі і сольвати.
2. Сполука за п. 1, яка відрізняється тим, що в ній R1 є С1-6алкілом або С3-6циклоалкілом.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що в ній R2 є метилом.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що в ній R3 є групою CO-G.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що в ній Q є СН2.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що в ній R4 є 5-членним ароматичним кільцем з двома гетероатомами, як варіант, заміщеними, як це було визначено у п. 1.
7. Сполука за п. 6, яка відрізняється тим, що в ній R4 є групою субформули (і)
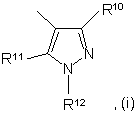
в якій
R10 і R11 незалежно вибрані з Н, С1-6алкілу або галогенС1-6алкілу, a R12 вибрана з Н, С1-6алкілу або галогенС1-6алкілу, або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфуру і нітрогену.
8. Сполука за п. 7, яка відрізняється тим, що в ній R10 і R11 є метилом.
9. Сполука формули (І), яка відрізняється тим, що вибрана з таких сполук: 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]-карбоніл]-5-метил-7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-5-метил-7-(2-метилпропіл)тієно[2,3-d]піридазин-4(5H)-он,
2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етил-3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]-карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
7-циклопропіл-2[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4-іл)метил]-5-етил-3-[[(4,S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідроксиметил-2-ізоксалідиніл]карбоніл]-5-метил-7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метил-7-(2-метилпропіл)-тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етил-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
3-[[(4S)-4-гідроксіізоксазолідиніл]карбоніл]-5-метил-7-(2-метилпропіл)-2-(1Н-піроло[2,3-b]піридин-3-ілметил)тієно[2,3-d]піридазин-4(5Н)-он,
3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-5-метил-7-(2-метилпропіл)-2-[(1,3,5-триметилпіразол-4-іл)метил]-тієно[2,3-d]піридазин-4(5Н)-он,
2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4-іл]метил]-7-етил-3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4-іл]метил]-7-етил-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метилтієно[2,3-d]піридазин-4(5Н)-он,
7-етил-3-{[(4S)-4-гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-5-метил-2-(1Н-піроло[2,3-b]піридин-3-ілметил)тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1-(2-піридиніл)-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метил-7-(1-метилетил)-тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5-метил-7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он,
2-[(3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2-ізоксалідиніл]карбоніл]-5-метил-7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он
і їх фармацевтично прийнятних солей.
10. Сполука за будь-яким з пп. 1-9, призначена для використання у терапії.
11. Фармацевтична композиція, яка містить сполуку формули (І) або фармацевтично прийнятну сіль, визначені у будь-якому з пп. 1-9, разом із фармацевтичним носієм.
12. Спосіб створення імуносупресії, зокрема, у лікуванні відторгнення алотрансплантата, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-9.
13. Спосіб лікування або зниження ризику хвороби дихальних шляхів, зокрема астми або хронічної обструктивної легеневої хвороби, у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання,
який включає введення цьому пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-9.
14. Спосіб одержання сполуки формули (І), в якому проводять:
(а) для сполук формули (І), в яких R3 є COG, реакцію сполуки формули (II):
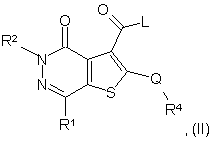
в якій R1, R2, R4 і Q є такими, як були визначені у формулі (І) або є їх захищеними похідними, зі сполукою формули (III):
G-H, (III)
в якій G є такою, як була визначена у формулі (І), у присутності засобу сполучення, або
(b) для сполук формули (І), в яких R3 є SO2-G, реакцію сполуки формули (IV):
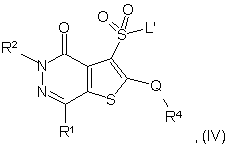
в якій R1, R2, R4 і Q є такими, як були визначені у формулі (II), і L і L’ є відщеплюваними групами, зі сполукою формули (III), визначеною вище, і, як варіант, після операцій (а) або (b) у будь-якому порядку
видалення будь-яких захисних груп і
утворення фармацевтично прийнятної солі.
15. Спосіб за п. 14, який відрізняється тим, що в ньому додатково проводять операцію перетворення групи R3 або R4 сполуки формули (І) в інші групи R3 або R4 відповідно.
Текст
1. Сполука формули (І): O R3 R2 N Q N S R4 , (I) R1 в якій: R1 є С1-6алкілом, С2-6 алкенілом або С 36циклоалкілом, як варіант, заміщеним С 1-6алкілом, причому кожен з них, як варіант, заміщений одним або більше атомами галогену; R2 є С1-6алкілом; R3 є гр упою CO-G або SO2-G, де G є 5- або 6членним кільцем, яке містить атом нітрогену і другий гетероатом, вибраний з оксигену і сульфур у і суміжний до нітрогену, і яке, як варіант, заміщене 1-3 групами, вибраними з гідроксилу і С 1-4алкілу; Q є гр упою CR5R6, де R5 є гідрогеном, С1-6алкілом або флуором, a R6 є гідрогеном, ОН або флуором, або R5 і R6 разом утворюють групу =О, за умови, що R5 не є флуором, коли R6 є ОН; R4 є 5-10-членною моно- або біциклічною ароматичною кільцевою системою, з 0-4 гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, як варіант, заміщеною 1-4 групами, незалежно вибраними з галогену, С1-4алкілу, (полі)галоген-С 1-4алкілу, С1-4алкокси, (полі)галоген-С1С1-4алкілсульфонілу, (полі)галоген-С 14алкокси, 4алкілсульфонілу, оксогрупи, тіоксогрупи, ціаног 2 (11) 1 3 80175 4 8. Сполука за п. 7, яка відрізняється тим, що в ній ізоксалідиніл]карбоніл]-5-метил-7-(1R10 і R11 є метилом. метилетил)тієно[2,3-d]піридазин-4(5Н)-он 9. Сполука формули (І), яка відрізняється тим, і їх фармацевтично прийнятних солей. що вибрана з таких сполук: 2-[(3,5-диметил-1Н10. Сполука за будь-яким з пп. 1-9, призначена для піразол-4-іл)метил]-3-[[(4S)-4-гідроксі-2використання у терапії. ізоксазолідиніл]-карбоніл]-5-метил-7-(111. Фармацевтична композиція, яка містить сполуметилетил)тієно[2,3-d]піридазин-4(5Н)-он, ку формули (І) або фармацевтично прийнятну сіль, 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4визначені у будь-якому з пп. 1-9, разом із фармагідроксі-2-ізоксазолідиніл]карбоніл]-5-метил-7-(2цевтичним носієм. метилпропіл)тієно[2,3-d]піридазин-4(5H)-он, 12. Спосіб створення імуносупресії, зокрема, у 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етил-3лікуванні відторгнення алотрансплантата, який [[(4S)-4-гідроксі-2-ізоксазолідиніл]-карбоніл]-5включає введення пацієнту терапевтично ефектиметилтієно[2,3-d]піридазин-4(5Н)-он, вної кількості сполуки формули (І) або її фармаце7-циклопропіл-2[(3,5-диметил-1Н-піразол-4втично прийнятної солі, визначених у будь-якому з іл)метил]-3-[[(4S)-4-гідроксі-2пп. 1-9. ізоксазолідиніл]карбоніл]-5-метилтієно[2,313. Спосіб лікування або зниження ризику хвороби d]піридазин-4(5Н)-он, дихальних шляхів, зокрема астми або хронічної 7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4обструктивної легеневої хвороби, у пацієнтів, що іл)метил]-5-етил-3-[[(4,S)-4-гідроксі-2страждають від цих хвороб або мають підвищений ізоксазолідиніл]карбоніл]-тієно[2,3-d]піридазинризик захворювання, 4(5Н)-он, який включає введення цьому пацієнту терапевти2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-4чно ефективної кількості сполуки формули (І) або гідрокси- метил-2-ізоксалідиніл]карбоніл]-5-метилїї фармацевтично прийнятної солі, визначених у 7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он, будь-якому з пп. 1-9. 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3-[[(4S)-414. Спосіб одержання сполуки формули (І), в якогідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5му проводять: метил-7-(2-метилпропіл)-тієно[2,3-d]піридазин(а) для сполук формули (І), в яких R3 є COG, реак4(5Н)-он, цію сполуки формули (II): 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етил-3O O L [[(4S)-4-гідрокси-4-метил-2R2 ізоксазолідиніл]карбоніл]-5-метилтієно[2,3d]піридазин-4(5Н)-он, N 7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4Q N іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2S R4 ізоксазолідиніл]карбоніл]-5-метилтієно[2,3R1 d]піридазин-4(5Н)-он, , (II) 3-[[(4S)-4-гідроксіізоксазолідиніл]карбоніл]-5в якій R1, R2, R4 і Q є такими, як були визначені у метил-7-(2-метилпропіл)-2-(1Н-піроло[2,3формулі (І) або є їх захи щеними похідними, зі споb]піридин-3-ілметил)тієно[2,3-d]піридазин-4(5Н)-он, лукою формули (III): 3-[[(4S)-4-гідроксі-2-ізоксазолідиніл]карбоніл]-5G-H, (III) метил-7-(2-метилпропіл)-2-[(1,3,5в якій G є такою, як була визначена у формулі (І), у триметилпіразол-4-іл)метил]-тієно[2,3-d]піридазинприсутності засобу сполучення, або 4(5Н)-он, (b) для сполук формули (І), в яких R3 є SO2-G, реа2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4кцію сполуки формули (IV): іл]метил]-7-етил-3-[[(4S)-4-гідроксі-2O O ізоксазолідиніл]карбоніл]-5-метилтієно[2,3O S L' d]піридазин-4(5Н)-он, R2 2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4N іл]метил]-7-етил-3-[[(4S)-4-гідрокси-4-метил-2Q ізоксазолідиніл]карбоніл]-5-метилтієно[2,3N S d]піридазин-4(5Н)-он, R4 7-етил-3-{[(4S)-4-гідрокси-4-метилізоксазолідин-2R1 , (IV) іл]карбоніл}-5-метил-2-(1Н-піроло[2,3-b]піридин-3в якій R1, R2, R4 і Q є такими, як були визначені у ілметил)тієно[2,3-d]піридазин-4(5Н)-он, формулі (II), і L і L’ є відщеплюваними групами, зі 2-[(3,5-диметил-1-(2-піридиніл)-1Н-піразол-4сполукою формули (III), визначеною вище, і, як іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2варіант, після операцій (а) або (b) у будь-якому ізоксазолідиніл]карбоніл]-5-метил-7-(1-метилетил)порядку тієно[2,3-d]піридазин-4(5Н)-он, видалення будь-яких захисних гр уп і 2-[(3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4утворення фармацевтично прийнятної солі. іл)метил]-3-[[(4S)-4-гідрокси-4-метил-215. Спосіб за п. 14, який відрізняється тим, що в ізоксазолідиніл]карбоніл]-5-метил-7-(1ньому додатково проводять операцію перетворенметилетил)тієно[2,3-d]піридазин-4(5Н)-он, ня групи R3 або R4 сполуки формули (І) в інші гру2-[(3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4пи R3 або R4 відповідно. іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2 5 80175 Винахід стосується тієнопіридазинонів, способів їх приготування, фармацевтичних композицій, що містять їх, і їх використання у терапії. Винахід також стосується їх використання у модуляції автоімунної хвороби. Т-клітини грають важливу роль в імунній реакції, однак при автоімунних хворобах Т-клітини невідповідним чином активуються проти певних тканин і проліферації, викликаючи, наприклад, запалення, пов'язане з ревматоїдним артритом. Інгібування проліферації Т-клітин є сприятливим у модуляції автоімунної хвороби. Винахід стосується сполук, які є корисними у модуляції автоімунної хвороби. в якій: R1–С1-6алкіл, С2-6валкеніл С 1-6алкілС 36циклоалкіл або С 3-6циклоалкіл, як варіант, заміщений С1-6алкілом, причому кожна з цих R1, як варіант, заміщена одним або більше атомами галогену; R2 – С1-6алкіл; R3 - група CO-G або SO2-G, де G є 5-або 6членним кільцем, яке містить атом нітрогену і другий гетероатом, вибраний з оксигену і сульфур у і суміжний до нітрогену, і яке, як варіант, заміщене 1-3 групами, вибраними з гідроксилу і С 1-4алкілу; Q - CR5R6, де R5 - гідроген, С1-6алкіл або флуор, a R6 є гідрогеном, ОН або флуором, або R 5 і R6 разом утворюють гр упу =О за умови, що R5 не є флуором, коли R6 є ОН; R4 є 5-10-членною моно- або біциклічною ароматичною кільцевою системою, з 0 -4 гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, як варіант, заміщеною 1-4 групами, незалежно вибраними з галогену, С1-4алкілу, (полі)галоген-С 1-4алкілу, С1-4алкокси, (полі)галоген-С1С1-4алкілсульфонілу, (полі)галоген-С 14алкокси, 4алкілсульфонілу, оксогрупи, тіоксогрупи, ціаногрупи, гідроксиметилу, метилтіо, -NR7R8, -CONR7R8, -SO2NR7R8 або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену, і яка сама може бути заміщена 1-4 групами, вибраними з галогену, С1-4алкілу, (полі)галоген-С 1-4алкілу, С1(полі)-галогенС 1-4алкокси, С14алкокси, (полі)галоген-С 14алкілсульфонілу, 4алкілсульфонілу, оксогрупи, тіоксогрупи, ціаногрупи, гідроксиметилу, метилтіо, -NR7R8, -CONR7RS, -SO2-NR7R8 ; R7 і R8 є незалежно гідрогеном, С1-4алкілом; або R7 і R8 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати 5-7-членне насичене гетероциклічне кільце; і її фармацевтично прийнятних солей і сольватів. Бажано, коли R1 - С1-6алкіл або С3-6циклоалкіл. 6 Наприклад, R1 може бути вибрана з етилу, ізопропілу, ізобутилу або циклопропілу. Більш бажано, коли R1 - ізобутил, ізопропіл або циклопропіл. Бажано, коли R2 - С1-3алкіл, наприклад, етил або метил, більше бажано, метил. Відповідно, G у групі R3 є 5-членним кільцем з атомом оксигену, наприклад, є ізоксазолідиніловим кільцем. Бажано, щоб кільце G було заміщене єдиним гідрокси-замісником, який може не бути приєднаний до кільцевого атому карбону, з'єднаного з кільцевим гетероатомом. Група G, бажано, має зв'язок з групами CO або SO2 через її кільцевий атом нітрогену. Прикладами групи G є 4гідроксиізоксазолідин-2-іл або 4-гідрокси-4-метилізоксазолідин-2-іл. Бажано, коли R3 є гр упою CO-G, визначеною вище, в якій кільце G має зв'язок через атом нітрогену. Більше бажано, коли R3 є групою CO-G, де G є 5-членним кільцем, описаним вище. Найкраще, коли R3 є 4-гідроксиізоксазолідин-2ілкарбоніломом або 4-гідрокси-4-метилізоксазолідин-2-іл карбонілом. Бажано, коли Q є CR5R6, де R5 - гідроген, С16 6алкіл, a R - гідроген. Бажано, коли Q є СН 2. Прикладами 5-10-членних моно- або біциклічних ароматичних кільцевих систем для R4 є тієніл, фураніл, піроліл, піролопіридин, імідазоліл, піридил, піразиніл, піримідил, піридазиніл, триазиніл, оксазоліл, тіазоліл, ізоксазоліл, піразоліл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл і хінолініл. Коли R4 є біциклічною ароматичною кільцевою системою, її прикладом є піролопіридин. Бажано, щоб R4 була 5-членним ароматичним кільцем з двома гетероатомами, як варіант, заміщеним, як це було визначено вище. Прикладом R4 є, як варіант, заміщене піразольне кільце. Бажано, коли R4 є заміщеним піразольним кільцем. Придатними замісниками є перелічені вище, але, зокрема, вибраніз С1-6алкілу або галоген-С 16алкілу або 5-6-членнеої ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену. Наприклад, R4 може бути групою субформули (і) в якій R10 і R11 незалежно вибрані з Н, С112 вибрана з Н, 6алкілу або галоген-С 1-6алкілу, a R С1-6алкілу або галоген-С 1-6алкіл або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену. У R10 і R11 вибрані з Η або С 1-3алкілу, наприклад, метилу, зокрема, обидві R10 і R11 є С13алкілом, наприклад, метилом. Відповідно, R12 вибрана з Н, С1-3алкілу (наприклад, метилу) або 5-6-членної ароматичної кільце 7 80175 8 вої системи, в якій до 3 кільцевих атомів можуть d]піридазин-4(5Н)-он, бути гетероатомами, незалежно вибраними з окси7-етил-3-{[(45)-4-гідрокси-4гену, сульфур у і нітрогену. Коли R12 є 5-6-членною метилізоксазолідин-2-іл]карбоніл}-5-метил-2-(1Нароматичною кільцевою системою, її прикладами піроло[2,3-b]піридин-3-ілметил)тієно[2,3є піридил (наприклад, 2-піридил), піримідиніл (наd]піридазин-4(5Н)-он, приклад, 2-піримідиніл) або тіазоліл (наприклад, 22-[(3,5-диметил-1-(2-піридиніл)-1Н-піразол-4тіазоліл). іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2Бажано, коли R12 є Н. ізоксазолідиніл]карбоніл-5-метил-7-(1-метилетил)У втіленні винаходу R4 - піразольне кільце, затієно[2,3-d]піридазин-4(5Н)-он, міщене алкілом, наприклад, С1-6алкілом, або гало2-[(3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4ген-С1-6алкілом, наприклад, трифлуорметильними іл)метил)-3-[[(4S)-4-гідрокси-4-метил-2замісниками і/або також заміщене 2ізоксазолідиніл]карбоніл-5-метил-7-(1піримідинільною або 2-піридильною групою. метилетил)тієно[2,3-d]піридазин-4(5Н)-он, Коли R7 і R8 утворюють 5-7-членне насичене 2-[(3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4гетероциклічне кільце, приклади такого кільця іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2включають морфолін, піперидин, піперазин і піроізоксалідиніл]карбоніл-5-метил-7-(1лідин. метилетил)тієно[2,3-d]піридазин-4(5Н)-он Бажані сполуки формули (І) включають: і їх фармацевтично прийнятні солі. 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3Алкільні групи, одиночні або як частина іншої [[(4S)-4-гідрокси-2-ізоксазолідиніл]-карбоніл-5групи, можуть бути лінійними або розгалуженими. метил-7-(1-метилетил)тієно[2,3-d]піридазин-4(5Н))Якщо не вказано інше, вони можуть містити 1-6, он, бажано, 1-4 атоми карбону. 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3Прикладами (полі)галогенС1-4алкільних груп є [[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]-5галогенС 1-4алкільні групи, наприклад, хлор- або метил-7-(2-метилпропіл)тієно[2,3-d]піридазин-4(5)флуорметил, а також дигалогенС 1-4алкільні групи, он, наприклад, дифлуор-або дихлорметил, і тригало2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етилгенС1-4алкільні групи, наприклад, трифлуорметил. 3-[[(4S)-4-гідрокси-2-ізоксазолідиніл]-карбоніл]-5Зрозуміло, що сполуки формули (І) або їх солі метилтієно[2,3-в]піридазин-4(5Н)-он, можуть виявляти таутомерію; креслення у цьому 7-циклопропіл-2[(3,5-диметил-1Н-піразол-4описі репрезентують лише одну з можливих тауіл)метил]-3-[[(4S)-4-гідрокси-2томерних форм. Винахід включає будь-яку таутоізоксазолідиніл]карбоніл]-5-метилтієно[2,3мерну форму. d]піридазин-4(5Н)-он, Деякі сполуки формули (1) можуть існувати у 7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4стереоізомерних формах. Винахід включає всі іл)метил]-5-етил-3-[[(4,S)-4-гідрокси-2геометричні і оптичні ізомери сполук формули (1) і ізоксазолідиніл]карбоніл]-тієно[2,3-d]піридазинїх суміші, включаючи рацемати. Вони також утво4(5Н)-он, рюють аспект винаходу. 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3Солями, придатними для використання у фа[[(4S)-4-метил-2-ізоксалідиніл]карбоніл]-5-метил-7рмацевтичній композиції, можуть бути фармацев(1-метилетил)тієно[2,3-d]піридазин-4(5Н)-он, тично прийнятні солі, але і інші солі можуть бути 2-[(3,5-диметил-1Н-тразол-4-іл)метил]-3-[[(4S)корисними у виготовленні сполук формули І і їх 4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-5фармацевтично прийнятних солей. Фармацевтичметил-7-(2-метилпропіл)-тієно[2,3-d]піридазинно прийнятні солі винаходу можуть, наприклад, 4(5Н)-он, включати кислотоадитивні солі сполук формули І, 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етилдостатньо основні для утворення таких солей. Такі 3-[[(4S)-4-гідрокси-4-метил-2кислотоадитивні солі включають, наприклад, солі з ізоксазолідиніл]карбоніл]-5-метилтієно[2,3неорганічними або органічними кислотами, які даd]піридазин-4(5Н)-он, ють фармацевтично прийнятні аніони, наприклад, 7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4з гідрогалогеновими (зокрема, гідрохлоридною або іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2гідробромідною кислотою, бажано, гідрохлоридізоксазолідиніл]карбоніл]-5-метилтієно[2,3ною) або з сульфатними або фосфатними кислоd]піридазин-4(5Н)-он, тами, або з трифлуороцтовою, лимонною або ма3-[[(4S)-4-гідроксиізоксазолідиніл]карбоніл-5леїновою кислотами. Придатні солі включають метил-7-(2-метилпропіл)-2-(1Н-піроло[2,3гідрохлориди, гідроброміди, фосфа ти, сульфати, b]піридин-3-ілметил)тієно[2,3-d]піридазин-4(5Н)-он, гідросульфати, алкілсульфонати, арилсульфона3-[[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]ти, ацетати, бензоати, цитрати, малеати, фумара5-метил-7-(2-метилпропіл)-2-[(1,3,5ти, сукцинати, лактати і тартрати. Крім того, коли триметилпіразол-4-іл)метил]-тієно[2,3-d]піридазинсполуки формули І є достатньо кислотними, фар4(5Н)-он, мацевтично прийнятні солі можуть бути утворені з 2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4неорганічними або органічними основами, які даіл]метил]-7-етил-3-[[(4S)-4-гідрокси-2ють фармацевтично прийнятний катіон. Такі солі з ізоксазолідиніл]карбоніл]-5-метилтієно[2,3неорганічними або органічними основами включаd]піридазин-4(5Н)-он, ють, наприклад, солі лужних металів, наприклад, 2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4сіль натрію або калію, солі лужно-земельних меіл]метил]-7-етил-3-[[(4S)-4-гідрокси-4-метил-2талів, наприклад, кальцію або магнію сіль, амонієві ізоксазолідиніл]карбоніл]-5-метилтієно[2,3солі або, наприклад, сіль з метиламіном, димети 9 80175 10 ламіном, триметиламіном, піперидином, морфоліном або трис-(2-гідроксиетил)аміном. Бажані солі включають кислотоадитивні солі, наприклад, гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат або р-толуолсульфонат, або солі лужних металів, наприклад, натрію або калію. Згідно з подальшим аспектом, винахід включає спосіб приготування сполуки формули (І), який включає: в якій R1, R2, R4 і Q є такими, що були визна(а) для сполук формули (І), в яких R3 є COG: чені у формулі (II), a R13 є галогеном, наприклад, реакцію сполуки формули (II): бромом або йодом, бажано, бромом, з придатним реагентом Гриньяра з подальшою обробкою діоксидом карбону. Реакцію бажано проводити, застосовуючи примусовий реагент Гриньяра, наприклад, хлорид ізопропілмагнію, у розчиннику, наприклад, ТГФ при зниженій температурі, наприклад, від приблизно 0°С до приблизно 25°С, бажано, від приблизно 0°С до приблизно 5°С, і гасити діоксидом карбону при температурі від приблизно 0°С до приблизно 25°С. Сполуки формули (V), в яких Q є CR5, можна в якій R1, R2, R4 і Q є такими, що були визнаотримати реакцією сполуки формули (VI): чені у формулі (І) або є їх захи щеними похідними, з сполукою формули (III): G-H (III), де G є такою, що була визначена у формулі (І), у присутності засобу сполучення, або (b) для сполуки формули (І), де R3 є SO2-G: реакцію сполуки формули (IV): в якій R1, R2, R4 і Q є такими, що були визначені у формулі (II), a L і L' є відщеплюваними групами, з сполукою формули (III), визначеною вище, і, як варіант, після операцій (а) або (b) у будьякому порядку: - видалення будь-яких захисних груп і - утворення фармацевтично прийнятної солі. Коли сполука формули (III) є атомом нітрогену, з'єднаним з Η-групою, бажана сполука формули (II) має гідрокси як відщеплювану гр уп у L, після чого реакцію можна провести, застосовуючи амідне сполучення. Реакцію сполук (II) і (III) можна проводити у присутності засобу сполучення, наприклад, діетилхлорфосфату і Nгідроксибензотриазолу і основи, наприклад, органічного аміну, зокрема, триетиламіну. Реакцію проводять у придатному розчиннику, наприклад, ДХМ або ацетонітрилі при температурі від приблизно 0°С до приблизно 35°С, бажано, від приблизно 15°С до приблизно 25°С. Придатні відщеплювані групи L і L' включають галогени, наприклад, флуор, хлор або бром, або у випадку сполуки формули (IV), ними може бути ангідридна група, наприклад, ангідрид сульфонової кислоти або ацетилангідрид. Сполуки формули (II) можна отримати реакцією сполуки формули (V): в якій R1, R2, R4 і Q є такими, що були визначені у формулі (II), a R13 є такою, що була визначена для формули (V), з сильною кислотою, наприклад, трифлуороцтовою, у присутності гідридного джерела, наприклад, триетилсилану. Реакцію проводять, як варіант, у присутності галогенкарбонового розчинника, наприклад, ДХМ, при температурі від приблизно 0°С до приблизно 35°С, бажано, від приблизно 15°С до приблизно 25°С. Сполуки формули (VI) можна отримувати реакцією сполуки формули (VII): в якій R1 і R2 є такими, що були визначені у формулі (II), a RJ3 є такою, що була визначена у формулі (V), з алкіламідом літію, наприклад, діізопропіламідом літію, у апротонному розчиннику, наприклад, ТГФ. Реакцію проводять при температурі від приблизно -10°С до приблизно 25°С, бажано, від приблизно 0°С до приблизно 5°С, з подальшою обробкою сполукою формули (VIII): R4-CO-R5 (VIII) де R4 і R5 є такими, що були визначені у формул (І) або є їх захи щеними похідними, при температурі від приблизно 0°С до приблизно 50°С, бажано, від приблизно 10°С до приблизно 30°С. Сполуки формули (VII) можна отримувати обробкою сполуки формули (IX): 11 80175 12 формулі (V), можна отримати з сполуки формули (XIV): в якій R1 і R2 є такими, що були визначені у формулі (II), з галогенувальним засобом, наприклад, бромом, в інертному розчиннику, наприклад, водній оцтовій кислоті при температурі від приблизно 20°С до приблизно 100°С, бажано, від приблизно 50°С до приблизно 100°С. Сполуки формули (IX) можна отримати реакцією сполуки формули (X): в якій R1 є такою, що була визначена у формул (II), з сполукою формули (XI): R2-NHNH2 (XI) в якій R2 є такою, що була визначена у формулі (II). Реакцію можна проводити у полярному розчиннику, наприклад, етанолі, при температурі від приблизно 20°С до приблизно 125°С, бажано, від приблизно 50°С до приблизно 100°С. Сполуки формули (X) можна отримати обробкою тіофен-3-карбонової кислоти основою, бажано, алкіламідом літію, наприклад, діізопропіламідом літію. Реакцію проводять у апротонному розчиннику, наприклад, ТГФ, при температурі від приблизно -78°С до приблизно 25°С, бажано, від приблизно -50°С до приблизно 10°С. Аніон обробляють сполукою формули (XII): R1-C(O)L" (XII) в якій R1 є такою, що була визначена у формулі (II), a L" є відщеплюваною групою, наприклад, Ο,Ν-диметилгідроксиламіновою, при температурі від приблизно 0°С до приблизно 50°С, бажано, від приблизно 10°С до приблизно 30°С. Сполуки формули (IV) можна отримати з сполуки формули (V) обробкою реагентом Гриньяра, визначеним вище, і гасінням діоксидом сульфуру при температурі від приблизно -50°С до приблизно 100°С, з подальшим окисленням отриманого інтермедіату і хлор уванням, наприклад, пентахлоридом фосфору. Сполуки формули (V), в яких Q є CF2, тобто які є сполукою формули (XIII): в якій R1, R2 і R4 є такими, що були визначені у формулі (II), a R13 є такою, що була визначена у в якій R1, R2 і R4 є такими, що були визначені у формулі (II), a R13 є такою, що була визначена у формулі (V), обробкою флуорувальним засобом, наприклад, діетиламіно-сульфуртри флуоридом в інертному розчиннику, наприклад, ДХМ, при температурі від приблизно -30°С до приблизно 50°С. Сполуки формули (XIV) отримують з сполуки формули (VI), визначеної вище, в якій R5 є гідрогеном, застосовуючи окислювач, наприклад, перрутенат тетрапропіламонію, у присутності Nметилморфолін-N-оксиду у розчиннику, наприклад, ДХМ, при температурі від приблизно -20°С до приблизно 50°С. Вихідні матеріали, зазначені вище є комерційно доступними або можуть бути отримані з застосуванням традиційної хімії, відомої фа хівцям. В іншому варіанті, сполуки формули (І) можна перетворити в інші сполуки формули (І) застосовуючи звичайні хімічні способи. Наприклад, сполуки формули (І), де R4 є гр упою субформули (і), в якій R12 є гідрогеном, можна перетворити у сполуки формули (і), де R12 не є гідрогеном, реакцією з сполукою формули (XV) R12’-U" (XV) в якій R12 не є гідрогеном, a L'" є відщеплюваною групою, наприклад, галогеном, зокрема, бромом. Таку реакцію можна проводити в органічному розчиннику, наприклад, ацетонітрилі або діоксані. За необхідності реакцію можна провести у присутності основи, наприклад, карбонату лужного металу, зокрема, карбонату калію, у присутності каталізатора, наприклад, солі міді, зокрема, йодиду міді. Реакцію можна також проводити в інертній атмосфері, наприклад, нітрогені. Інші реакції, зокрема, для перетворення однієї групи R3 або R4 в іншу, є відомими фахівцям. Корисність сполук винаходу полягає в їх фармакологічній активності у людей і тварин. їх призначають як фармакологічні засоби у лікуванні (профілактиці) автоімунних, запальних, проліферативних і гіперпроліферативних хвороб і імунологічно опосередкованих хвороб, включаючи відторгнення трансплантованих органів або тканин і СНІД. Прикладами таких станів є : (1) (респіраторні шляхи) обструктивна хвороба дихальних шляхів; астма, зокрема, бронхіальна, алергічна, внутрішня, зовнішня і пилова, хронічна або стійка (наприклад, застаріла астма і надчутливість дихальних шляхів)); хронічна обструктивна легенева хвороба (ХОЛХ) (наприклад, незворотна ХОЛХ); бронхіт; гострий, алергічний, атрофічний риніт або хронічний риніт (наприклад, творожистий риніт, гіпертрофічний риніт, гнійний риніт, сикатив 13 80175 14 ний риніт), медикаментозний риніт, мембранний Винахід, крім того, включає спосіб лікування, риніт (включаючи крупозний, фібринозний і псевабо зниження ризику хвороб дихальних шляхів домембранний риніт), сезонний риніт (включаючи (наприклад, астми або ХОЛХ) у пацієнтів, що нервовий риніт (сінна пропасниця) і вазомоторний страждають від цих хвороб або мають підвищений риніт); саркоїдоз; хвороби, пов'язані з фермерсьризик захворювання, який включає введення цьокими легенями; фіброїдні легені і пов'язані з ними му пацієнту терапевтично ефективної кількості хвороби і ідіопатична внутрішньотканинна пневсполуки формули (1) або її фармацевтично прийнмонія; ятної солі, визначених вище. (2) (кістки і суглоби) ревматоїдні артрити, сеУ зазначеній вище терапії доза сполуки, яку ронегативні спондилоартропатії (наприклад, анківводять, залежить від типу сполуки, способу ввелозний спондиліт, псоріазний артрит і хвороба дення, типу терапії і розладу, для якого призначеРейтера), хвороба Бесе, синдром Сйоргена і сисно терапію. Однак, взагалі для створення імуносутемний склероз; пресії денна доза сполуки формули (1) має (3) (шкіра) псоріаз, атопікальний дерматит, костановити від 0,1мг/кг, бажано, від 0,3мг/кг, більш нтактний дерматит, інші екзематичні дерматити, бажано, від 0,5мг/кг, найкраще від 1мг/кг до 30мг/кг себорейний дерматит, Lichen planus, пемфігус, маси пацієнта (включно). При лікування хвороб бульйозний пемфігус, бульйозний епідермолізис, дихальних шля хів денна доза сполуки формули (1) кропивниця, ангіодерми, васкуліти, еритеми, шкірні має становити від 0,001мг/кг до 30мг/кг маси паціеозинофілії, хронічні шкірні виразки, увеліт, виразєнта. кове ареатакомне облисіння і весінній кон'юнктиСполуки формули (1) і її фармацевтично привіт; йнятні солі можна застосовувати як такі, але най(4) (шлунково-кишечний тракт) коеліатична частіше вони мають вводитись у формі фармацевхвороба, проктит, еозинофільний гастроентерит, тичної композиції, яка містить сполуку формули (1) мастоцитоз, хвороба Крона, виразковий коліт; харабо її сіль/сольват (активний інгредієнт) разом з чові алергії з дією, віддаленою від кишечнику (нафармацевтично прийнятним ад'ювантом, розріприклад, мігрень, риніт і екзема); джувачем або носієм. Залежно від способу вве(5) (інші тканинні і системні хвороби) множиндення, фармацевтична композиція переважно ний склероз, атеросклероз, СНІД, еритематозна включає від 0,05 до 99% (за масою), бажано менволчанка; системна волчанка, еритематоз; тироїше 80%(за масою), наприклад, від 0,10 до 70% (за дит Ха шімото, бульбоспинадьний параліч, діабет масою), більш бажано, менше 50% (за масою) типу І, нефротичний синдром, еозинофілія fascitis, активного інгредієнта, від повної маси композиції. синдром гіпер-ІgЕ, лепроматозна проказа, сезарОтже, винахід також стосується фармацевтичний синдром і ідіопатична тромбоцитопенія ної композиції, яка містить сполуку формули (1) pupura; або фармацевтично прийнятну сіль, визначені (6) (відторгнення аллотрансплантату) гостре і вище, разом з фармацевтично прийнятними ад'юхронічне, після, наприклад, трансплантації нирки, вантом, розріджувачем або носієм. серця, печінки, легені, кісткового мозку, шкіри і Винахід, крім того, стосується способу пригороговиці; і хронічна хвороба несприяття трансплатування фармацевтичної композиції винаходу, нтату; і який включає змішування сполуки формули (1) або (7) рак. її фармацевтично прийнятної солі, визначених Відповідно, винахід стосується сполуки форвище, з фармацевтично прийнятними ад'ювантом, мули (1) або її фармацевтично прийнятної солі, розріджувачем або носієм. визначених вище і призначених для використання Фармацевтичну композицію винаходу можна у терапії вводити локально (наприклад, у легені і/або дихаЩе одним аспектом винаходу є використання льні шляхи, на шкіру) у формі розчинів, суспензій, сполуки формули (1) або її фармацевтично прийнгептафлуоралканових аерозолів і сухи х порошкоятної солі, визначених вище, у виготовленні медивих композицій; або системно, наприклад, оралькаменту для використання у терапії. ним введенням у формі таблеток, капсул, сиропів, Тут термін "терапія" також включає "профілакпорошків або гранул, або парентеральним вветику", якщо не визначено інше. Терміни "терапевденням у формі розчинів або суспензій, або підтичний" і "терапевтично" слід розуміти відповідно. шкірно, або ректально у формі супозиторіїв, або Профілактика є особливо доречною стосовно трансдермально. пацієнтів, які вже страждали від певних хвороби Здатність сполук інгібувати стимульовану або стану, або вважаються більш сприйнятливими РМА/іономіцином проліферацію мононуклеарних до них. Особи, яким загрожує ризик захворювання клітин у периферійній крові можна оцінити, наприданими хворобою або станом загалом включають клад, застосовуючи описану нижче процедуру. тих, що мають родинну історію таких захворювань, Винахід ілюструється наведеними далі Приабо тих, в яких шляхом генетичного тестування кладами, в яких, якщо не зумовлено інше: або скринінгу була виявлена особлива чутливість (і) випарювання проводять обертальним випадо розвитку таких хвороби або стану. рюванням у вакуумі і процедури обробки провоВинахід також включає спосіб створення імудять після видалення фільтруванням твердих заносупресії (наприклад, у лікуванні відторгнення лишків, наприклад, висушуючи х засобів; алотрансплантату), який включає введення паціє(іі) операції проводять при зовнішній темперанту терапевтично ефективності кількості сполуки турі, тобто при 18-25°С і в атмосфері інертного формули (1) або її фармацевтично прийнятної газу, наприклад, аргону або нітрогену; солі, визначених вище . (ііі) вихід наведено лише для ілюстрації, і він 15 80175 16 не завжди є максимально можливим; (33,09г) в оцтовій кислоті (100мл) і воді (100мл), (iv) стр уктура кінцевих продуктів формули (І) який краплями протягом 5хвил. обробляють бропідтверджуються ядерним (звичайно протонним) мом (8,16мл) з перемішуванням під азотом. Суміш магнітним резонансом (ЯМР) і масгріють при 70°С 6год., потім охолоджують, розбавспектрографією; значення хімічного зсуву протонляють розчином сульфіту натрію і екстрагують ного магнітного резонансу виміряють за дельтаетилацетатом. Органічні екстракти сушать над шкалою, а множинності піків позначено: s - сингбезводним сульфатом магнію, фільтрують і випалет; d - дублет; t - триплет; m - мультиплет; br рюють під зниженим тиском. Залишок очищають широкий; q -квартет, quin - квінтет; колонною хроматографією на кремнеземі з елюен(ν) інтермедіати взагалі не одержують повної том етилацетат/і-гексан (1:19) і потім етилацетат/іхарактеризації, а чистота оцінюється тонкошарогексан (1:4), отримуючи бажану сполуку як тверду вою хроматографією (ТШХ), рідинною хроматогречовину (13,0г). рафією високого розрізнення (РХВР), масMC (ESI) 287 і 289 [М+Н]+ спектрометрією (MC), інфрачервоним (ІЧ) або d 1HCDCI3 1,35 (6Н, d), 3,01 (1Н, septet), 3,82 ЯМР-аналізом; (3Н, s), 7,71 (1Н, s). Абревіатури d) 1-(дифенілметил)-3.5-диметил-(1 H)Диметилформамід - ДМФ піразол-4-карбоксальдегід Тетрагідрофуран - ТГФ До гарячого розчину 1-(дифенілметил)-3,5Приклад 1 диметил-(1Н)-піразолу (25,0г) у ДМФ (22мл) крап2-[(3.5-диметил-1Н-піразол-4-іл)метил]-3лями з перемішуванням під азотом додають фос[[(4S)-4-гідрокси-2-ізоксазолідиніл]-карбоніл-5форилхлорид (8,87мл) і суміш гріють при 100°С метил-7-(1-метилетил)тієно[2.3-d]піридазин-4(5Н)3год., потім охолоджують, розбавляють водою і он ДХМ і підлужують 50%-м гідроксидом натрію з охолодженням льодом/водою, після чого екстрагують ДХМ, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом етилацетат/і-гексан (1:19) і потім етилацетат, отримуючи бажану сполуку як а) 2-(2-метил-1-оксопропіл)-3-тіофенкарбонова тверду речовину (12,61г). кислота d 1НДМСО2,49 (3Н, S), 3,58(3Н, s), 6,91 (1Н, s), До розчину тіофен-3-карбонової кислоти 7,19-7,22 (4Н, m), 7,29-7,38 (6Н, m), 9,89 (1H.s). (26,65г) у ТГФ (300мл) при 0-5°С з перемішуванe) 3-бром-2-[[1-дифенілметил)-3.5-диметилням під азотом краплями додають 2М діізопропі1Н-піразол-4-іл]гідроксиметил]-5-метил-7-(1ламід літію (229мл) і суміш перемішують 15хвил. метилетил)-тієно[2.3-d]піридазин-4(5Н-он Краплями протягом 1год. додають розчин ΝДо розчину продукту частини с) (13,0г) у ТГФ метокси-Ν,2-диметилпропанаміду (30г) у ТГФ (100мл) краплями при 0-5°С з перемішуванням під (150мл). Після цього реакційну суміш залишають азотом додають 2М діізопропіламіду літію (24,9мл) нагрітись до кімнатної температури і перемішують і суміш перемішують 20хвил. Додають краплями 2год., потім виливають у воду, шари розділяють і розчин продукту частини d) (14,4г) у ТГФ (50мл), водний шар промивають етером. Водний шар підсуміш залишають нагрітись до кімнатної темперакислюють конц. хлоридною кислотою і екстрагують тури і перемішують 3год., після чого виливають у етилацетатом, органічні екстракти сушать над розчин бікарбонату натрію і екстрагують етилацебезводним сульфатом магнію, фільтрують і випататом, органічні екстракти промивають водою, рюють під зниженим тиском, отримуючи бажану сушать над безводним сульфатом магнію, фільтсполуку як тверду речовину (38,91г). 1 рують і випарюють під зниженим тиском. Залишок d НДМСО 1,10 (6H,d), 3,30 (1H,m), 7,37 (1Н, d), очищають колонною хроматографією на кремне7,85 (1H,d). земі з елюентом етилацетат/і-гексан (1:4), потім b) 5-метил-7-(1 -метилетил)-тієно[2.3етилацетат/і-гексан (1:2), отримуючи бажану споd]піридин-4(5Н)-он. луку як тверду речовину (17,42г). Отримують з розчину продукту частини а) MC (ESI) 577 і 579 [М+Н]+ (38,91г) і метилгідразину (11,48мл) в етанолі d 1НДМСО 1,30 (6Н, d), 2,00 (3Н, s), 2,27 (3Н, s), (200мл), який гріють при кипінні під зворотним хо3,13 (1Н, septet), 3,65 (3Н, s), 5,88 (1Н, d), 6,51 (1Н, лодильником 2год. і концентрують під зниженим d), 6,75 (1Н, s), 7,10-7,12 (2Н, m), 7,17-7,20 (2Н, m), тиском. Залишок очищають колонною хроматог7,25-7,35 (6Н, m). рафією на кремнеземі з елюентом етилацетат/іf) 3-бром-2-[1-(дифенілметил)-3.5-диметил-1Нгексан (1:4) і потім етилацетат/і-гексан (1:1), отрипіразол-4-ілметил1-5-метил-7-(1-метилетил)муючи бажану сполуку як тверду речовину тієно[2.3-d]піридазин-4(5Н)-он (33,09г). До розчину продукту частини є) (17,42г) у ДХМ MC (ESI) 209 [М+Н]+ 1 (36мл) і трифлуороцтової кислоти (72мл) додають d HCDCI3 1,39(6Н, d), 3,13 (1Н, septet), 3,85 (3Н, триетилсилан (36мл) і суміш з перемішуванням під s), 7,59 (1Н, d), 7,75 (1Н, d). азотом гріють при 40°С 48год. Розчинник видаляc) 2-бром- 5-метил-7-(1-метилетил)-тієно[2.3 ють під зниженим тиском, залишок розчиняють в d]піридазин-4(5Н)-он етилацетаті, промивають послідовно насиченим Отримують з розчину продукту частини b) розчином бікарбонату натрію і водою, сушать над 17 80175 18 сульфатом магнію, фільтрують і випарюють під 2,98-3,04 (1Н, m), 3,48-4,16 (9Н, m), 4,67-4,79 (1Н, зниженим тиском. Залишок твердої речовини пеm), 5,51-5,55 (1Н, m), 12,16 (1Н, s, br) ретирають з і-гексаном, збирають фільтруванням і Приклад 2 сушать, отримуючи бажану сполуку (16,19г). 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-3MC (ESI) 561 і 563 [М+Н]+ [[(4S)-4-гідрокси-2-ізоксазолідиніл]-карбоніл]-5метил-7-(2-метилпропіл)-тієно[2.3-d]піридазинd 1НДМСО 1,23 (6Н, d), 2,04 (3Н, s), 2,20 (3В, s), 4(5Н)-он 2,98 (1Н, septet), 3,66 (3Н, s), 3,97 (2Н, s), 6,79 (1Н, s), 7,16-7,18 (4Н, m), 7,27-7,36 (6Н, m). д) 2-[1-(дифенілметил)-3,5-диметил-1Нпіразол-4-ілметил]-4.5-дигідро-5-метил-7-(1метилетил)-4-оксотієно[2.3-d]піридазин-3карбонова кислота До розчину продукту частини f) (16,19г) у безводному ТГФ (200мл) краплями при 0-5°С з переа) 2-бром-5-метил-7-(2-метилпропілтієно[2.3мішуванням під азотом додають 2М розчин хлориd]піридазин-4(5Н)-он Отримують з 5-метил-7-(2ду ізопропілмагнію (15,87мл) і суміш перемішують метилпропіл)тієно[2,3-d]піридазин-4(5Н)-ону (WO при 0°С 30хвил., потім гасять потоком діоксиду 929695) за процедурою Прикладу 1, частини с), як карбону протягом 2год., залишають нагрітись до тверду речовину. кімнатної температури, концентрують під знижеMC(ESI)301 i 303[M+H]+. ним тиском, розбавляють 1М хлоридною кислоd 1НСDСL3 0,98 (6Н, d), 2,19 (1Н, septet), 2,59 тою, екстрагують етилацетатом, органічні екстрак(2Н, d), 3,82 (3Н, s), 7,69 (1Н, s). ти промивають водою, суша ть над безводним b) 3-бром-2-[[1-дифенілметил)-3,5-диметилсульфатом магнію, фільтрують і випарюють під 1Н-піразол-4-іл]гідроксиметил]-5-метил-7-(2зниженим тиском, отримуючи бажану сполуку як метилпропіл)-тієно[2.3-d]піридазин-4(5Н)-он тверду речовину (15,18г). + Отримують з продукту частини а) за процедуMC (ESI) 527 [М+Н] рою Прикладу 1, частини e), як тверду речовину. 1 d НДМСО 1,26 (6Н, d), 2,03 (3Н, s), 2,17 (3Н, s), d 1НДМСО 0,94-0,96 (6Н, m), 1,99 (3Н, s), 2,11 3,07 (1Н, septet), 3,82 (3Н, s), 4,40 (2Н, s), 6,82 (1Н, (1Н, septet), 2,26 (3Н, s), 2,61-2,68 (2Н, m), 3,66 s), 7,15-7,20 (4Н, m), 7,28-7,38 (6Н, m), 16,24 (1Н, s, (3Н, s), 5,88 (1Н, d), 6,53 (1Н, d), 6,91 (1Н, s), 7,10br) 7,20 (4Н, m), 7,25-7,38 (6Н, m). h) 2-[3,5-диметил-1Н-піразол-4-ілметил]-4.5c) 3-бром-2-[[1-(дифенілметил)-3.5-диметилдигідро-5-метил-7-(1-метилетил)-4-оксотієно[2,31Н-піразол-4-іл]метил-5-метил-7-(2-метилпропіл)d]піридазин-3-карбонова кислот тієно[2.3-d]піридазин-4(5Н)-он До розчину продукту частини д) (15,18г) в етаОтримують з продукту частини b) за процедунолі (100мл) і мурашиній кислоті (50мл) під азотом рою Прикладу 1, частини f), отримуючи бажану додають каталітичну кількість 10% паладію на сполуку як тверду речовину. алюмінії і суміш перемішують при зовнішній темMC(ESI) 575 і 577 [М+Н]+ пературі 18год. Каталізатор видаляють фільтруd 1НДМСО 0,88 (6Н, d), 1,99 (3Н, s), 1,99-2,04 ванням, під азотом додають свіжий каталізатор і (1Н, m), 2,15 (3Н, s), 3,66 (3Н, s), 3,97 (2Н, s), 6,80 суміш перемішують 24год., потім фільтрують і роз(1Н, s), 7,15-7,37 (6Н, m). чинник видаляють під зниженим тиском, отримуюd) 2-[[1-(дифенілметил)-3.5-диметил-1Нчи бажану сполуку як тверду речовину (8,23г). піразол-4-іл]метил]-4.5-дигідро-5-метил-7-(2MC (ESI) 361 [М+Н]+ метилпропіл)-4-оксотієно[2.3-d]піридазин-3d 1НДМСO1,24 (6Н, d), 2,08 (6Н, s), 3,10 (1Н, карбонова кислота pent), 3,81 (3Н, s), 4,36 (2Н, s). Отримують з продукту частини с) за процедуі) 2-[3,5-диметил-1Н-піразол-4-ілметил]-3рою Прикладу 1, частини г), як тверду речовину. [[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]-5MC(ESI) 541 [М+Н]+ метил-7-(1-метилетил)тієно[2.3-d]піридазин-4(5Н)e) 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-4.5он дигідро-5-метил-7-(2-метилпропіл)-4-оксотієно[2,3До суспензії продукту частини h) (7,13г), (S)-4d]піридазин-3 -карбонова кислота ізоксазолідинолгідрохлориду (2,73г) і 1Отримують з продукту частини d) за процедугідроксибензотриазолу (3,33г) в ацетонітрилі рою Прикладу 1, частини h), як тверду речовину. (250мл) додають триетиламін (12,12мл), потім діеMC(ESI) 375 [М+Н]+ тилхлорфосфат (3,16мл) і суміш перемішують d 1НДМСО 0,89 (6Н, d), 2,07-2,13 (7Н, m), 2,62 18год. при зовнішній температурі під азотом, потім (2Н, d), 3,81 (3Н, s), 4,34 (2Н, s). концентрують під зниженим тиском, розбавляють f) 2-[(3.5-диметил-І1Н-піразол-4-іл)метил]-3насиченим розчином бікарбонату натрію і екстра[[(4S)-4-гідрокси-2-ізоксазолідинілу карбоніл]-5гують етилацетатом. Органічні екстракти промиметил-7-(2-метилпропіл)-тієно[2.3d]піридазинвають водою, сушать над безводним сульфатом 4(5Н)-он магнію, фільтрують і випарюють під зниженим тисОтримують з продукту частини e) за процедуком. Залишок очищають колонною хроматографірою Прикладу 1, частини і), як тверду речовину. єю на кремнеземі з елюентом етилацетат/метанол МС(АРСІ) 446 [М+Н]+ (49:1), потім етилацетат/метанол (19:1), отримуюd 1НДМСО 0,89-0,91 (6Н, m), 2,04-2,12 (7Н, m), чи бажану сполуку як тверду речовину (2,1г). + 2,55-2,58 (2Н, m), 3,48-4,16 (9Н, m), 4,63-4,80 (1Н, MC (APCI) 432 [М+Н] m), 5,52 (1Н, s, br) d 1НДМСО 1,23-1,26 (6Н, m), 2,07-2,11 (6Н, m), 19 80175 20 Приклад 3 Отримують з продукту частини є) за процеду2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7-етилрою Прикладу 1, частини f), як тверду речовину. 3-[[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]-5MC (ESI) 547 і 549 [М+Н]+ метилтієно[2.3d]піридазин-4(5Н)-он d 1НСОСІЗ 1,28 (3Н, t), 2,10 (3Н, s), 2,18 (3Н, s), 2,74 (2Н, q), 3,80 (3Н, s), 3,93 (2Н, s), 6,91 (1Н, s), 7,15 (4Н, m), 7,33 (6Н, m) g) 2-[[1 -(дифeнілмeтил)-3.5-димєтил-1 Нпіразол-4-ілІметил]7-етил-4.5-дигідро-5-метил-4оксотієно[2.3-d]піридазин-3-карбонова кислота Отримують з продукту частини f) за процедурою Прикладу 1, частини г), як тверду речовину. a) N-метокси-N-метилпропанамід MC(ESI) 513 [M+H]+ До розчину пропаноїлхлориду (15мл) у ДХМ d 1HCDCl3 1,34 (3Н, t), 2,07 (3Н, s), 2,15 (3Н, s), (250мл) під азотом при 0°С з перемішуванням до2,79 (2Н, q), 3,93 (3Н, s), 4,55 (2Н, s),6,64 (1Н, s), дають Ν,Ο-диметилгідроксиламін (17г) і триетила7,17 (4Н, m), 7,32 (6Н, m) мін (72мл). Суміш залишають нагрітись до кімнатh) 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-7ної температури протягом 5год. і потім етил-4.5-дигідро-5-метил-4-оксотієно[2,3 – фільтрують, фільтрат випарюють під зниженим d]піридазин-3 -карбонова кислота тиском і перетирають з діетилетером, потім випаОтримують з продукту частини г) за процедурюють під зниженим тиском, отримуючи бажану рою Прикладу 1, частини h), як тверду речовину. сполуку у ви гляді масла (17,7г) MC (ESI) 347 [М+Н]+ d 1НСОСІЗ 1,14 (3Н, t), 2,43 (2Н, q), 3,08 (3Н, s), d 1НДМСО 1,22 (3Н, t), 2,08 (6Н, s), 2,79 (2Н, q), 3,67 (3Н, s). 3,81 (3Н, s), 4,32 (2Н, s). b) 2-(1-оксопропіл)-3-тіофенкарбонова кислота і) 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-7Отримують з тіофен-3-карбонової кислоти і етил-3-[[(4S)-4-гідрокси-2-ізоксазолідиніл]продукту частини а) за процедурою Прикладу 1, карбоніл]-5-метилтієно[2.3-d]піридазин-4(5Н)-он частини а), як тверду речовину. Отримують з продукту частини h) за процеду1 d HCDCI3 1,91 (3Н, t), 3,18 (2H,q), 7,64 (1H,d), рою Прикладу 1, частини і), як тверду речовину. 7,98 (1H,d). MC(ESI)418[M+H]+ с) 5-метил-7-етилтієно[2,3d]піридазин-4(5Н)-он d 1НДМСО 1,23 (3Н, m), 2,05 (3Н, m), 2,13 (3Н, Отримують з продукту частини b) за процедуm), 2,74 (2Н, m), 3,33 (3Н, s), 3,51-4,16 (6Н, m), рою Прикладу 1, частини b), як тверду речовину. 4,61-4,82 (1Н, m), 5,55 (1Н, m). 1 d HCDCI3 1,38 (3Н, t), 2,86 (2Н, q), 3,85 (3Н, s), Приклад 4 7,60 (1Н, d), 7,75 (1Н, d). 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-4d) 2-бром-7-етил-5-метилтієно[2,3-d]піридазиніл)метил]-3-[[(4S)-4-гідрокси-24(5Н)-он ізоксазолідиніл]карбоніл]-5-метилтієно[2.3Отримують з розчину продукту частини с) d]піридазин-4(Н)-он (4,8г) у ДХМ (50мл), який обробляють метансульфоновою кислотою (0,8мл) і 1,3-дибром-5,5диметилгідрантоїном (3,5г). Суміш перемішують під азотом у темряві протягом 20год. Додають ще метансульфо-нову кислоту (0,8мл) і 1,3-дибром5,5-диметилгідрантоїн (3,5г) і суміш перемішують ще 20год. С уміш розбавляють з ДХМ і послідовно промивають розчином тіосульфату натрію (´2), a) N-метокси-N-метилпотім розсолом, сушать над безводним сульфатом цикпопропанкарбоксамід магнію, фільтрують і випарюють під зниженим тисОтримують з циклопропанкарбонілхлориду за ком. Залишок очищають колонною хроматографіпроцедурою Прикладу 3, частини а) у вигляді масєю на кремнеземі з елюентом ізола. гексан/етилацетат (9:1) і потім ізоd 1HCDCI3 0,81 (2Н, m), 0,99 (2Н, m), 2,14 (1Н, гексан/етилацетат (8:2), отримуючи бажану сполуm), 3,21 (3Н, s), 3,67 (3Н, s). ку як тверду речовину (3г). b) 2-(циклопропілкарбоніл)-3-тіофенкарбонова d 1НСOСl3 1,35 (3Н, t), 2,77 (2Н, q), 3,82 (3Н, s), кислота 7,70 (1Н, s). Отримують з тіофен-3-карбонової кислоти і e) 3-бром-2-[(1-(дифенілметил)-3,5-диметилпродукту частини а) за процедурою Прикладу 1, 1Н-піразол-4-іл]гідроксиметил]-7-етил-5частини а), як тверду речовину. метилтієно[2.3-d]піридазин-4(Н)-он d 1HCDCI31,31 (2Н, m), 1,48 (2Н, m), 2,59 (1Н, m), Отримують з продукту частини d) за процеду7,70 (1Н, d), 7,98 (1Н, d). рою Прикладу 1, частини є), як тверду речовину. с) 7-циклопропіл-5-метилтієно[2.3-d]піридазинMC (ESI) 563 і 565 [М+Н]+ 1 (5Н)-он d HCDCI31,35 (3Н, t), 2,15 (3Н, s), 2,23 (3Н, s), Отримують з продукту частини b) за процеду2,81 (2Н, q), 3,80 (3Н, s), 6,04 (1Н, s), 6,56 (1Н, s), рою Прикладу 1, частини b), як тверду речовину. 7,08-7,17 (4Н, m), 7,26-7,35 (6Н, m) MC (ESI) 207 [M+H]+ f) 3-бром-2-[[1-(дифенілметил)-3,5-диметилd 1НСDСІЗ 1,02 (2Η, m), 1,08 (2Н, m), 2,02 (1Н, 1Н-піразол-4-іл]метил]-7-етил-5-метил-тієно[2.3m), 3,78 (3Н, s), 7,59 (1Н, d), 7,75(1 Η, d). d]піридазинn-4(5Н)-он 21 80175 22 а) 2-бром-7-циклопропіл-5-метилтієно[2.3d]піридазин-4(5Н)-он Отримують з швидкоперемішаного розчину продукту частини с) (9,0г) у насиченому розчині бікарбонату натрію (150мл), обробляють бромом (6,7мл) і через 25хвил. краплями з перемішуванням додають розчин метабісульфіту натрію і обробляють ультразвуком утворену тверду речовиа) 7-циклопропіл-5-етилтієно[2,3-d]піридазинну. Цю тверду речовину фільтрують, промивають 4(5Н)-он водою, сушать у вакуумній печі і очищають колонОтримують з суспензії продукту Прикладі 4, ною хроматографією на кремнеземі з елюентом частини b) (12,0г) в етанолі (150мл), яку обробляізо-гексан/етилацетат (9:1), отримуючи бажану ють триетиламіном (19мл) і оксалатом етилгідрасполуку як тверду речовину (8,0г). зину (9,9г). d 1HCDCI31,04 (4Н, m), 1,84 (1Н, m), 3,77 (3Н, s), Суміш гріють при кипінні під зворотним холо7,69 (1Н, s). дильником 6год., потім залишають охолонути і e) 3-бром-7-циклопропіл-2-[[1-(дифенілметил)випарюють під зниженим тиском. Отримане масло 3.5-диметил-1Н-піразол-4-іл]-гідроксиметил]-5розділяють між 1N розчином гідроксиду натрію і метилтієно[2.3-d]піридазин-4(5Н)-он ДХМ. Органічний шар відділяють, промивають 1N Отримують з продукту частини d) за процедурозчином гідроксиду натрію, розсолом і потім ворою Прикладу 1, частини є), як тверду речовину. дою, сушать над безводним сульфатом магнію, MC (ESI) 575 і 577 [М+Н]+ фільтрують і випарюють під зниженим тиском, d 1HCDCI31,05 (4H,m), 1,92 (1Н, m), 2,17 (3Н, s), отримуючи бажану сполуку у вигляді ма-сла(10,8г). 2,24 (3Н, s), 3,75 (3В, s), 6,06 (1Н, s), 6,57 (1Н, s), MC (ESI) 221 [M+H]+ 7,15 (4Н, m), 7,32 (6Н, m). d 1HCDCI31,02 (2Η, m), 1,11 (2Н, m), 1,38 (3Н, t), f) 3-бром-7-циклопропіл-2-[[1-(дифенілметил)2,02 (1Н, m), 4,24 (2Н, q), 7,58 (1Н, d),7,75(1H,d). 3.5-диметил-1Н-піразол-4-іл]метил]-5b) 2-бром-7-циклопропіл-5-етилтієно[2,3метилтієно[2.3-d]піридазин-4(5Н)-он d]піридазин-4(5Н)-он Отримують з продукту частини e) за процедуОтримують з продукту частини а) за процедурою Прикладу 1, частини f), як тверду речовину. рою Прикладу 4, частини d), як тверду речовину. MC (ESI) 559 і 561 [М+Н]+ MC (ESI) 299 і 301 [М+Н]+ d 1НСDСІЗ 0,98 (4Н, m), 1,83 (1Н, m), 2,13 (3Н, s), d 1НСDСІЗ 1,04 (4Н, m), 1,37 (3Н, t), 1,84 (1Н, гл), 2,19 (3Н, s), 3,75 (3Н, s), 3,94 (3Н, s), 6,61 (1Н, s), 4,20 (2Н, q), 7,70 (1Н, s). 7,16 (4Н, m), 7,31 (6Н, m). с) 3-бром-7-циклопропіл-2-[[1-(дифенілметил)д) 7-циклопропіл-2-[[1-(дифенілметил)-3.53.5-диметил-1Н-піразол-4-іл]-гідроксиметил]-5диметил-1Н-піразол-4-іл]метил]-4.5-дигідро-5етилтієно[2.3-d]піридазин-4(5)-он метил-4-оксотієно[2.3-d]піридазин-3-карбонова Отримують з продукту частини d) за процедукислота рою Прикладу 1, частини e), як тверду речовину. Отримують з продукту частини f) за процедуMC (ESI) 895 і 591 [М+Н]+ рою Прикладу 1, частини д), як тверду речовину. + d 1HCDCI31,01 (2H,m), 1,05 (2Н, m), 1,37 (3Н, t), MC (ESI) 525 [М+Н] 1 1,92 (1Н, m), 2,18 (3Н, s), 2,24 (3Н, s), 4,19 (2Н, m), d HCDCI31,06 (4Н, m), 1,87 (1Н, m), 2,05 (3Н, s), 6,06 (1Н, s), 6,57 (1Н, s), 7,09 (2Н, m), 7,12 (2Н, m), 2,19 (3Н, s), 3,84 (3Н, s), 4,56 (2Н, s), 6,63 (1Н, s), 7,31 (6Н, m). 7,18 (4Н, m), 7,35 (6Н, m). d) 3-бром-7-циклопропіл-2-[[1-(дифенілметил)h) 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-43,5-диметил-1Н-піразол-4-іл]метил]-5іл]метил]-4t5-дигідро-5-метил-4-оксотієно[2.3етилтієно[2,3-d]піридазин-4(5Н)-он d]піридазин-3-карбонова кислота Отримують з продукту частини с) за процедуОтримують з продукту частини г) за процедурою Прикладу 1, частини f), як тверду речовину. рою Прикладу 1, частини h), як тверду речовину. MC (ESI) 573 і 575 [М+Н]+ MC (ESI) 359 [М+Н]+ 1 d 1НСОСІЗ 0,97-1,05 (4Н, m), 1,35 (3Н, t), 1,82 d НДМСO 0,95 (4Н, m), 2,18 (6Н, s), 2,20 (1Н, m), (1Н, m), 2,12 (3Н, s), 2,1,7 (3Н, s), 3,94 (2Н, s), 4,19 3,77 (3Н, s), 4,39 (2Н, s). (2Н, q), 6,61 (1Н, s), 7,16 (4Н, m), 7,35 (6Н, m). і) 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-4e) 7-циклопропіл-2-[[1-(дифенілметил)-3,5іл]метил]-3-[[(4S)-4-гідрокси-2диметил-1Н-піразол-4-іл]метил]-5-етил-4,5ізоксазолідиніл]карбоніл]-5-метилтієно[2.3дигідро-4-оксотієно[2,3-d]піридазин-3-карбонова d]піридазин-4(5Н)-он кислота Отримують з розчину частини h) за процедуОтримують з продукту частини d) за процедурою Прикладу 1, частини і), як тверду речовину. рою Прикладу 1, частини g), як тверду речовину. MC (ESI) 430 [М+Н]+ MC (ESI) 539 [М+Н]+ d 1НДМСО0,92 (4Н, m), 2,03 (3Н, m), 2,14 (3Н, m), d 1HCDCI3 1,04 (4Н, m), 1,39 (3Н, t), 1,88 (1Н, m), 3,32 (3Н, s), 3,50-4,14 (6Н, m), 4,56-4,79 (1Н,m), 2,06 (3Н, s), 2,15 (3Н, s), 4,28 (2Н, q), 4,56 (2Н, s), 5,54 (1Н,m) 6,65 (1Н, s), 7,17 (4Н, m), 7,34 (6Н, m). Приклад 5 f) 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-47-циклопропіл-2-[(3,5-диметил-1Н-піразол-4іл)метил]-5-етил-4.5-дигідро-4-оксотієно[2,3іл)метил]-5-етил-3-[[(4S)-4-гідрокси-2d]піридазин-3-карбонова кислота ізоксазолідиніл]карбоніл]-тієно[2.3-d]піридазинОтримують з продукту частини є) за процеду4(5Н)-он 23 80175 24 рою Прикладу 1, частини h), як тверду речовину. фією на кремнеземі з градієнтним елюентом від MC (ESI) 373 [М+Н]+ ДХМ до 5% метанолу у ДХМ. Хіральну чистоту g) 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-4продукту підвищують рекристалізацією двічі з ацеіл)метил]-5-етил-3-[[(4S)-4-гідрокси-2тонітрилу, отримуючи бажану сполуку як безбарвізоксазолідиніл]карбоніл]-тієно[2.3-d]піридазинну тверду речовину (1,92г). 4(5Н)-он РХВР: (9010ΤΉΙΡ.Μ) 50мм колонка chiracel AD, Отримують з розчину продукту частини f) ее >99%. (260мг) у ДХМ (4мл), який обробляють (5)-4d 1HCDCI3 1,52 (3Н, s), 3,59 (1H, d), 3,81 (1H, d), ізоксазолідинолгідрохлоридом (105мг), РуBrOР 3,88 (1H, d), 4,04 (1H, s), 4,34 (1H, d), 3,92 (3Н, s), (285мг) і триетиламіном (0,23мл) і перемішують 7,45 (1H, d), 7,49 (1H, t), 7,62 (1H, t), 8,00 (1H, d). при кімнатній температурі 3 дні. Реакційну суміш а) (4S)-4-метил-4-ізоксазолідинолгідрохлорид безпосередньо очищають колонною хроматограОтримують з розчину продукту частини с) фією на кремнеземі з елюентом ДХМ/метанол (4,9г) у 2Н хлоридній кислоті (30мл), який гріють 98:2, потім ДХМ/метанол 96:4 і потім препаративпід азотом при кипінні під зворотним холодильниною зворотно фазовою РХВР, застосовуючи ацеком для 4год. Після охолодження осад видаляють тонітрил/водн. амоній, отримуючи бажану сполуку фільтруванням і рідини концентрують до сухості у як тверду речовину (80мг). вакуумі. MC (ESI) 444 [М+Н]+ Залишок перетирають з ацетонітрилом, отриd 1НДМСО 0,93 (4Н, m), 1,37-1,43 (3Н, m), 1,97муючи бажану сполуку як білу тверду речовину 2,16 (7Н, m), 3,58-3,94 (9Н, m), 5,39-5,60 (1Н, m), (1,79г). 12,17 (1H, bs) d 1НДМСO1,42 (3Н, s), 3,29 (1Н, d), 3,41 (1Н, dd), Приклад 6 3,87 (1Н, d), 4,05 (1Н, dd). 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-3e) 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-3[[(4S)-4-гідрокси-4-метил-2[[(45)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл-5-метил-7-(1-метилетил)ізоксазолідиніл]карбоніл-5-метил-7-(1-метилетил)тієно[2.3-d]піридазин-4(5Н-он тієно[2.3-d]піридазин-4(5Н)-он До розчину продукту частини d) (85мг), продукту Прикладу 1, частини h), (201мг) і РуВrоР (285мг) у ДХМ (5мл) додають триетиламін (0,23мл) і суміш перемішують при кімнатній температурі під азотом 18год., потім концентрують у вакуумі і залишок очищають колонною хроматографією на кремнеземі з елюентом етилацетат/метанол (50:1), отримуючи бажану сполуку як тверду речоa) 2-[[(2S)-2-метилоксираніл]метокси]-1Нвину (129мг). ізоіндол-1,3(2Н)-діон MC (APCI) 446 [М+Н]+ Суміш N-гідроксифталіміду (5,3г), [(2S)-2d 1НДМСО 1,18-1,44 (9Н, m), 2,08 (6Н, d), 2,98метилоксиран-2-іл]метил 3-нітробензол3,10 (2Н, m), 3,57-4,00 (8Н, m), 5,40 (0,66Н, s), 5,76 сульфонату (5,9г) і триетиламіну (10,6мл) у ДХМ (0,33Н, S), 12,15 (1Н, s, br). (15мл) перемішують 24год. під азотом при зовнішПриклад 7 ній температурі. Реакційну суміш є виливають у 2-[(3.5-диметил-1Н-піразол-4-іл)метилІ-3кремнеземну колонку і елююють ДХМ, отримуючи [[(4S)-4-гідрокси-4-метил-2бажану сполуку як безбарвну тверду речовину ізоксазолідиніл]карбніл]-5-метил-7-(2(3,1г). метилдпропіл)-тієно[2.3-піридазин-4(5Н)-он + MC (APCI) 234 [М+Н] 1 d HCDCI31,63 (3Н, s), 2,69 (1Н, d), 2,76 (1Н, d), 4,17 (1Н, d), 4,21 (1Н, d), 7,73-7,78 (2Н, m), 7,827,87 (2Н, m) b) 2-[[(2R)-3-хлор-2-гідрокси-2мeтилпропіл]окси]-1Н-ізоіндол-1,3(2Н)-діон Продукт частини а) (3,0г) обробляють конц. хлоридною кислотою (12мл) і перемішують при а) 2-[(3.5-диметил-1-піразол-4-іл)метил]-3зовнішній температурі 2год. Суміш розділяють між [[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]водою і ДХМ, органіку суша ть і очищають хроматокарбоніл]-5-метил-7-(2-метилпропіл)-тієно[2.3графією (EtOAc), отримуючи бажану сполуку як d]піридазин-4(5Н)-он безбарвну тверду речовину (3,3г). 1 Отримують з продукту Прикладу 2, частини e) d НДМСO 1,29 (3Н, S), 3,67 (1Н, d), 3,76 (1Н, d), за процедурою Прикладу 6, частини e), як тверду 4,09 (1Н, d), 4,15 (1Н, d), 7,86 (4Н, S), 5,24(1 H,s). речовину. c) Ме тиловий естер 2-[[(4S)-4-гідрокси-4МС(АРСІ) 460 [М+Н]+ метил-2-ізоксазолідиніл]карбоніл]-бензойної кисd 1НДМСО 0,90 (6Н, d), 1,27-1,44 (3Н, m), 2,04лоти 2,12 (7Н, m), 2,55-2,59 (2Н, m), 3,57-3,93 (9Н, m), Отримують з розчину продукту частини b) 5,40 (0,66Н, s), 5,59 (0,33Н, s), 12,16 (1Η, s). (3,3г) у метанолі (25мл), який обробляють триетиПриклад 8 ламіном (3,4мл) і гріють під азотом при кипінні під 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-7-етилзворотним холодильником протягом 3год. Суміш 3-[[(4S)-4-гідрокси-4-метил-2концентрують до сухості і очищають хроматогра 25 ізоксазолідиніл]карбоніл]-5-метилтієно[2.3d]піридазин-4(5Н)-он 80175 а) 2-[(3.5-диметил-1Н-піразол-4-іл)метил]-7етил-4.5-дигідро-5-метил-4-оксотієно[2.3d]піридазин-3-карбонова кислота Отримують з продукту Прикладу 3, частини г) (1,0г) у трифлуороцтовій кислоті (10мл) при кипінні під зворотним холодильником протягом 20год. Суміш випарюють під зниженим тиском, азеотропують з ДХМ (´3), залишок перетирають з водою і потім з етером, і тверду речовину збирають і сушать, отримуючи бажану сполуку як тверду речовину (580мг). MC (ESI) 347 [М+Н]+ d 1НДМСO 1,22 (3Н, t), 2,03 (6Н, s), 2,80 (2Н, q), 3,83 (3Н, s), 4,39 (2Н, s). b) 2-[(3,5-диметил-1Н-піразол-4-іл)метил]-7етил-3-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-5-метилтієно[[2.3d]піридазин-4(5Н)-он Отримують з продукту частини а) за процедурою Прикладу 6, частини є), як тверду речовину. MC (ESI) 432 [М+Н]+ d 1НДМСО 1,21 (3Н, m), 1,25-1,44 (3Н, m), 2,07 (6Н, bs), 2,75 (2Н, m), 3,63-3,94 (9Н, m), 5,39-5,60 (1Н, m), 12,16 (1Н, bs). Приклад 9 7-циклопропіл-2-[(3,5-диметил-1Н-піразол-4іл)метил]-3-[[(5)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-5-метилтієно[2.3d]піридазин-4(5Н)-он а) 7-циклопропіл-2-[(3.5-диметил-1Н-піразол-4іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-5-метилтієно[2.3d]піридазин-4(5Н)-он Отримують з продукту Прикладу 4, частини h), за процедурою Прикладу 6, частини e), як тверду речовину. MC (ESI) 444 [М+Н]+ d 1НДМСО 0,93 (4Н, m), 1,37-1,43 (3Н, m), 1,972,16 (7Н, m), 3,58-3,94 (9Н, m), 5,39-5,60 (1Н, m), 12,17 (1Н, m). Приклад 10 3-[[(4S)-4-гідроксиізоксазолідиніл]карбоніл-5метил-7-(2-метилппропіл)-2-1Н-піроло[2,3b]піридин-3-ілметил)тієно[2,3-d]піридазин-4(5Н)-он 26 а) 3-бром-2-[гідрокси[1-(фенілсульфоніл)-1Нпіроло[2,3-b]піридин-3-іл]метил]-5-метил-7-(2метилпропіл)-тієно[2,3-d]піридазилі-4(5Н)-он До розчину продукту Прикладу 2, частини а) (0,22г) у безводному ТГФ (5мл) при -78°С під азотом з перемішуванням додають 2,0М LDA (0,44мл). Через 20хвил. додають розчин 1(фенілсульфоніл)-піроло[2,3-b]піридин-3карбоксальдегіду (0,23г) у безводному ТГФ (5мл) і суміш перемішують при кімнатній температурі 18год., потім виливають у воду і екстрагують етилацетатом. Органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етил ацетат (1:1), отримуючи бажану сполуку (0,2г). MC (ESI) 587 і 589 [М+Н]+ b) 3-бром-5-метил-7-(2-метилпропіл)-2-[[1фенілсульфоніл]-1H-піроло[2,3-b]-піридин-3іл]метил]-тієно[2,3-d]піридазин-4(5Н)-он До розчину продукту частини а) (0,2г) у ДХМ (0,5мл) додають триетилсилан (0,5мл) і трифлуороцтову кислоту (1,0мл) і суміш перемішують при 40°С 24год., потім концентрують у вакуумі, розбавляють розчином гідрокарбонату натрію і екстрагують ДХМ. Органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етилацетат (3:1), отримуючи бажану сполуку (0,17г). MC (ESI) 571 і 573 [М+Н]+ d 1HCDCI30,94 (6Η, d), 2,12 (1Н, septet), 2,52 (2Н, d), 3,82 (3Н, s), 4,30 (2Н, s), 7,14-7,19 (1Н, m), 7,477,61 (3Н, m), 7,66 (1Н, s), 7,76 (1Н, dd), 8,20 (2Н, d), 8,45 (1Н, dd). с) 4.5-дигідро-5-метил-7-(2-метилпропіл)-4оксо-2-[[1-(фенілсульфоніл)-1Н-піроло[2.3b]піридин-3-іл]метил]-тієно[2.3-d]піридазин-3карбонова кислота До розчину продукту частини b) (0,17г) у безводному ТГФ (8мл) додають 2,0М хлориду ізопропілмагнію (0,164мл) при 0°С і суміш перемішують 5хвил., потім гасять потоком діоксиду карбону протягом 45хвил., виливають у воду, підкислюють розбавленою хлоридною кислотою і екстрагують ДХМ. Органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку як тверду речовину (0,16г). MC (ESI) 537 [М+Н]+ d) 4.5-дигідро-5-метил-7-(2-метилпропіл)-4оксо-2-(1Н-піроло[2.3-b]піридин-3-ілметил)тієно[2,3-d]піридазин-3-карбонова кислота Розчин продукту частини с) (0,16г) у метанолі (5мл) обробляють гідроксидом калію (50мг) і гріють при кипінні під зворотним холодильником 1,5год., 27 80175 28 потім концентрують у вакуумі, підкислюють розбатієно[2.3-d]піридазин-3-карбонова кислота вленою хлоридною кислотою і екстрагують ДХМ. Отримують з продукту частини b) за процедуОрганічні екстракти промивають водою, сушать рою Прикладу 10, частини с), як тверду речовину. над безводним сульфатом магнію, фільтрують і MC (ESI) 389 [М+Н]+ випарюють під зниженим тиском, отримуючи баd 1НДМСО 0,88 (6Н, d), 2,00 (3Н, s), 2,06 (1Н, жану сполуку як тверду речовину (0,10г). septet), 2,14 (3Н, s), 2,56 (2Н, d), 3,68 (3Н, s), 3,82 MC (ESI) 397 [М+Н]+ (3Н, s), 4,36 (2Н, s), 16,20 (1Н, s, br). e) 3-[[(4S)-гідроксиізоксалідин-2-іл]карбоніл]-5d) 3-[[(4S)-4-гідрокси-2метил-7-(2-метилпропіл)-2-(1Н-піроло[2.3ізоксазолідиніл]карбоніл]-5-метил-7-(2b]піридин-3-ілметил)-тієно[2.3-d]піридазин-4(5Н)метилпропіл)-2-[(1,3,5-[[метилпіразол-4-іл)метил]он тієно[2.3-d]піридазин-4(5Н)-он До перемішаної суспензії продукту частини d) Отримують з продукту частини с) за процеду(50мг) у ДХМ (2мл) під азотом додають 1рою Прикладу 10, частини e), як тверду речовину. гідроксибензотриазолгідрат (39мг) і через 15хвил. MC (APCI) 460 [М+Н]+ додають EDCI (48мг) і суміш перемішують ще d 1НДМСО 0,90 (6Н, d), 2,00-2,14 (7Н, m), 2,56 1год. Додають (S)-4-Ізоксазолідинолгідрохлорид (2Н, d), 3,48-4,16 (12Н, m), 4,60-4,82 (1Н, m), 5,50(32мг) і триети-ламін (53мкл) і суміш перемішують 5,60 (1Н, m). протягом ночі, потім розбавляють водою і екстраПриклад 12 гують ДХМ. Органічні екстракти промивають во2-[[3.5-диметил4-(2-піридиніл)-1Н-піразол-4дою, сушать над безводним сульфатом магнію, іл]метил-7-етил-3-[[(4S)-4-гідрокси-2фільтрують і випарюють під зниженим тиском. Заізоксазолідиніл]карбоніл]-5-метил-тієно[2.3лишок очищають колонною хроматографією на d]піридазин-4(5Н)-он кремнеземі з елюентом етилацетат/метанол (50:1), отримуючи бажану сполуку як тверду речовину (19мг). МС(АРСІ)468[М+Н]+ d 1НДМСО 0,85-0,87 (6Н, m), 1,99-2,05 (1Н, septet), 2,50 (2Н, m), 3,55-3,62 (1Н, m), 3,66 (3Н, d), 3,73-3,78 (1Н, m), 3,95-3,98 (1Н, m), 4,14-4,19 (1Н, m), 4,30-4,39 (2Н, m), 4,67 (0,4Н, m), 4,81 (0,6Н, m), 5,55 (1Н, s, br), 7,00-7,03 (1Н, m), 7,45-7,49 (1Н, у), a) 2-бром-7-етил-5-метилтієно[2.3-d]піридазин7,89-7,94 (1Н, m), 8,20-8,21 (1Н, m), 11,59(1Н, s). 4(5Н)-он Приклад 11 Отримують з продукту Прикладу 3, частини b), 3-[[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]за процедурою Прикладу 4, частини d), як тверду 5-метил-7-(2-метилпропіл)-2-[(1,3,5речовину. триметилпіразол-4-іл)метил]-тієно[2.3-d]піридазинMC (ESI) 273 і 275 [М+Н]+ 4(5Нr)-он d 1HCDCI3 1,35 (3Н, t), 2,77 (2Н, q), 3,82 (3Н, s), 7,70 (1Н, s). b) 3-(1,3-дитіан-2-іліден)-2.4-пентандіон До розчину 2,4-пентандіону (10,5мл) у ДМФ (200мл) додають карбонат калію (42,5г) потім дисульфід карбону (9,3мл). До суміші краплями протягом 40хвил. додають 1,3-дибромпропан і перемішують при зовнішній температурі в атмосфері a) 3-бром-2-[гідрокси(1,3,5-триметил-1Назоту протягом 20год., потім додають лід/воду піразол-4-іл)метил-5-метил-7-(2-метилпропіл)(200мл) і суспензію перемішують 1год. Тверду ретієно[2.3-d]піридазин-4(5Н)-он човину збирають фільтруванням, промивають воОтримують з продукту Прикладу 2, частидою і потім рекристалізують з етанолу, отримуючи ни а) і 1,3,5-піразол-4-карбоксальдегіду за процебажану сполуку як тверду речовину (23,3г). дурою Прикладу 10, частини а). MC(ESI) 217 [M+H]+ MC (ESI) 439 і 441 [М+Н]+ d 1HCDCI3 2,28 (2Н, pentet), 2,34 (6Н s), 2,95 (4Н, 1 d НДМСО 0,93-0,96 (6Н, m), 2,01 (3Н, s), 2,13 t). (1Н, septet), 2,17 (3Н, s), 2,59-2,69 (2Н, m), 3,61 c) 3-(1,3-дитіан-2-іл)-2,4-пентандіон (3Н, s), 3,66 (3Н, s), 5,84 (1Н, d), 6,43 (1Н, d). До охолодженої льодом суспензії продукту чаb) 3-бром-5-метил-7-(2-метилпропіл)-2-[(1,3,5стини b) (23,3г) у сухому метанолі порціями додатриметил-1Н-піразол-4-іл)метил]-тієно[2.3ють магнієву стр ужку (9,0г) і суміш перемішують d]піридазин-4 (5Н)-он 18год. при зовнішній температурі в атмосфері азоОтримують з продукту частини а) за процедуту. С уміш випарюють під зниженим тиском, потім рою Прикладу 10, частини b). додають воду (500мл) і суміш підкислюють до pH1 MC(ESI)423 I 425[M+H]+ конц. хлоридною кислотою з перемішуванням. d 1НДМСО 0,88 (6Н, d), 2,01 (3Н, в), 2,05 (1Н, Водну суміш екстрагують ДХМ (´2) і об'єднані орseptet), 2,17 (3Н, в), 2,50-2,54 (2Н, m), 3,66 (3Н, s), ганічні екстракти сушать над безводним сульфа3,67 (3Н, s), 3,93 (3Н, s). том магнію, фільтрують і випарюють під зниженим c) 4.5-дигідро-5-мeтил-7-(2-мeтилпропіл)-4тиском. Залишок очищають колонною хроматогоксо-2-[(1,3,5-триметил-1Н-піразол-4-іл]метил]рафією на кремнеземі з елюентом ізо 29 80175 30 гексан/етилацетат (9:1) і потім рекристалізують з 2,73 (2Н, quartet), 3,67 (3Н, s), 4,07 (2Н, s), 7,35 (ІН, ізопропілового спирту, отримуючи бажану сполуку m), 7,83 (1Н, m), 7,96 (1Н, m), 8,47 (1Н, m). як тверду речовину (4,0г). h) 2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол4-іл]метил]-7-етил-4,5-дигідро-5-метил-4d 1HCDCI3 2,03 (2Η, m), 2,25 (6Н s), 2,78 (2Н, m), оксотієно[2.3-d]піридазин-3-карбонова кислота 2,94 (2Н, m), 4,32 (1Н, d), 4,51 (1Н, d). До розчину продукту частини г) (485мг) у безd) 2-[4-(1,3-дитіан-2-іл)-3.5-диметил-1Нводному ТГФ (20мл) при 0-5°С з перемішуванням піразол-1-іл]-піридин Отримують з розчину продукту частини с) під азотом краплями додають 2М розчин хлориду ізопропілмагнію (0,58мл) і суміш перемішують при (2,8г) і 2-піридилгідразину (1,55г) в етанолі (20мл), 0°С 30хвил., потім гасять потоком діоксиду карбодля чого перемішують при зовнішній температурі ну протягом 2,5год. і залишають нагрітись до кім19год. і потім гріють при кипінні під зворотним хонатної температури. Додають 2М хлоридну кислолодильником 1год. Після випарювання залишок очищають колонною хроматографією на кремнету і коригують pH до 3 1Μ розчином гідроксиду натрію. Водну суміш екстрагують етилацетатом, земі з елюентом ізо-гексан/етилацетат (8:2), отриорганічні екстракти сушать над безводним сульмуючи бажану сполуку як тверду речовину (1,4г). фатом магнію, фільтрують і випарюють пiд знижеMC (ESI) 292 [М+Н]+ ним тиском. Залишок перетирають з етером, d 1НСОСІЗ 1,92 (1Н, s), 2,16 (1Н, m), 2,44 (3Н, s), отримуючи бажану сполуку як тверду речовину 2,74 (3Н, s), 2,88 (2Н, dt), 3,06 (2Н, m), 5,26 (1Н5 s), (175мг). 7,17 (1Н, m), 7,77 (2Н, m), 8,42 (1Н, m) MC (ESI) 424 [М+Н]+ e) 3,5-диметил-1 -(2-піридиніл)-1Н-піразол-4d 1НДМСО 1,18 (3Н, t), 2,15 (3Н, s), 2,56 (3Н, s), карбоксальдегід 2,82 (2Н, quartet), 3,83 (3Н, s), 4,51 (2Н, s), 7,35 Отримують з розчину продукту частини d) в (1Н, m), 7,85 (1Н, m), 7,94 (1Н, m), 8,48 (1Н, m). ацетонітрилі (80мл) і воді (10мл) з доданням Nі) 2-[[3.5-диметил-1-(2-піридиніл)-1Н-піразол-4бромсукциніміду (1,22г) при 0°С. Суміш перемішуіл]метил]-7-етил-3-[[(4S)-4-гідрокси-2ють 1,5год., потім додають ще N-бромсукциніміду ізоксазолідиніл]карбоніл]-5-метилтієно[2.3(0,5г) і суміш перемішують ще 1,5год. Додають ще d]піридазин-4(5Н)-он N-бромсукциніміду (0,2г) і суміш є перемішують ще Отримують з продукту частини h) за процеду45хвил. і потім гасять розчином сульфіту натрію. рою Прикладу 5, частини г), як тверду речовину. Суміш екстрагують етилацетатом і органічний розMC (ESI) 495 [М+Н]+ чин промивають водою, потім розсолом, сушать над безводним сульфатом магнію, фільтрують і d 1НДМСО 1,22 (3Н, t), 2,15 (3Н, в), 2,57 (3Н, s), випарюють під зниженим тиском, отримуючи ба2,66 (2Н, m), 3,30 (3Н, m), 3,49-4,18 (6Н, m), 4,56жану сполуку як тверду речовину. 4,81 (1Н, m), 5,52 (1Н, m), 7,32 (1Н, dt), 7,81 (1Н, d), MC (ESI) 202 [М+Н]+. 7,96 (1Н, dt), 8,45 (1H, d). Приклад 13 d 1НДМСО 2,43 (3Н, s), 2,83 (3Н, s), 7,46 (1Н, m), 2-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-47,83 (1Н, d), 8,04 (1Н, td), 8,55 (1Н, m), 10,10 (1Н, s). іл]метил]-7-етил-3-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл)карбоніл]-5-метилтієно[2.3f) 3-бром-2-[[3,5-диметил-1-(2-піридиніл)-1Нd]піридазин-4(5Н)-он піразол-4-іл]гідроксиметил]-7-етил-5метилтієно(2,3-d]піридазин-4(5Н)-он До розчину продукту частини а) (930мг) у ТГФ (10мл) краплями при -78°С з перемішуванням під азотом додають щойно отриманий діізопропіламід літію (1,6мл n-бутиллітій у гексанах і 0,62мл діізопропіламіну у ТГФ 10мл), і суміш перемішують 20хвил. Краплями додають суспензію продукту частини є) (705мг) у ТГФ (10мл), суміш залишають нагрітись до кімнатної температури, перемішують 3год., потім виливають у розчин бікарбонату наа) 2-[[3,5-диметил-1-(2-піридиніл-1Н-піразол-4іл]метил]-7-eтил-3-[[(4S)-4-гідрокси-4-метил-2трію і екстрагують етилацетатом (´3), органічні ізоксазолідиніл]карбоніл]-5-метилтієно[2.3екстракти сушать над безводним сульфатом магd]піридазин-4(5Н)-он нію, фільтрують і випарюють під зниженим тиском. Отримують з продукту Прикладу 12, частини h) Залишок перетирають з етером, отримуючи бажаза процедурою Прикладу 6, частини e), як тверду ну сполуку як тверду речовину (800мг). речовину. MC (ESI) 474 і 476 [М+Н]+ MC (ESI) 509 [М+Н]+ d 1НДМСО 1,28 (3Н, t), 2,12 (3Н, s), 2,63 (3Н, s), d 1НДМСО 3,22 (3Н, t), 1,33-1,44 (3Н, m), 2,17 2,82 (2Н, quartet), 3,66 (3Н, s), 5,98 (1Н, m), 6,67 (3Н, m), 2,57 (3Н, s), 2,76 (2Н, m), 3,56410 (9Н, m), (1Н, m), 7,33 (1Н, m), 7,76 (1Н, m), 7,95 (1Н, m), 5,27-5,58 (1Н, m), 7,5 (1Н, m), 7,81 (1Н, m), 7,94 8,46 (1Н, m). (1Н, m), 8,46 (1Н, m). g) 3-бром-2-[[3.5-диметил-1-(2-піридиніл)-1НПриклад 14 піразол-4-іл1метил1-7-етил-5-метил-тієно[2,37-етил-3{[(4S)-4-гідрокси-4d]піридазин-4(5Н)-он метилізоксазолідин-2-іл]карбоніл}-5-метил-2-(1НОтримують з продукту частини f) за процедупіроло[2.3-b]піридин-3-ілметил)тієно[2,3рою Прикладу 1, частини f), як тверду речовину. d]піридазин-4(5Н)он MC(ESI)458 i 460[M+H]+ d 1НДМСО 1,19 (3Н, t), 2,17 (3Н, в), 2,59 (3Н, в), 31 80175 32 фат (0,035мл) і суміш перемішують при зовнішній температурі під азотом 1,5год. Додають (4S)-4метил-4-ізоксазолідинолгідрохлорид (0,033г) і суміш перемішують 20год. при зовнішній температурі під азотом, потім розбавляють насиченим розчином бікарбонату натрію і екстрагують ДХМ (´3). а) 2-бром-7-етил-5-метилтієно[2,3-d]піридазинОрганічні екстракти сушать над безводним суль4(5Н)-он фатом магнію, фільтрують і випарюють під знижеОтримують з продукту Прикладу 3, частини с), ним тиском. Залишок очищають колонною хромаза процедурою Прикладу 4, частини d), як тверду тографією на кремнеземі з елюентом речовину. ДХМ/метанол (98:2), потім ДХМ/метанол (96:4), + MC (ESI) 273/275 [М+Н] отримуючи бажану сполуку як тверду речовину d 1HCDCI3 1,35 (3Н, t), 2,77 (2Н, q), 3,82 (3Н, s), (0,05г). 7,70 (1Н, s). MC (ESI) 454 [М+Н]+ b) 3-бром-7-етил-2-{гідрокси[1d 1НDМСO 1,17 (3H,m), 1,32-1,46 (3H,m), 2,70 (фенілсульфоніл)-1Н-піроло[2,3-b]піридин-3(2H,q), 3,65 (3H,m), 3,72-3,83 (4H,m), 4,36 (2H, m), іл]метил}-5-метилтієно[2.3-d]піридазин-4(5Н)-он 5,23-5,62 (1H, m), 7,02 (1H, m), 7,48 (1H, m), 7,92 Отримують з продукту частини а) за процеду(1H, m), 8,20 (1H, dd), 11,58(1H,bs). рою Прикладу 10, частини а), як тверду речовину. Приклад 15 MC(ESI) 5591561[M+H]+ 2-[(3.5-диметил-1-(2-піридиніл)-1Н-піразол-4d 1НДМСO 1,16 (3Н, t), 2,79 (2Н, q), 3,65 (3Н, s), іл)метил]-3-[[(4S)-4-гідрокси-4-метил-26,62 (1Н, m), 7,06 (1Н, m), 7,33 (1Н, m), 7,62 (2Н, ізоксазолідиніл]карбоніл]-5-метил-7-(1-метилетил)m), 7,74 (1Н, m), 7,84 (1Н, s), 8,02 (1Н, dd), 8,10 тієно[2,3-d]піридазин-4(5Н)-он (2Н, m), 8,38 (1Н, m). с) 3-бром-7-етил-5-метил-2-{[1(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-3іл]метил}-тієно[2.3-d]піридазин-4(5Н)-он Отримують з продукту частини b) за процедурою Прикладу 10, частини b), до як тверду речовину. MC (ESI) 543/545 [М+Н]+ d 1НДМСО 1,18 (3Н, t), 2,65 (2Н, q), 3,64 (3Н, s), a) 3-бром-2-[[3.5-диметил-1-(2-піридиніл)-1Н4,42 (2Н, s), 7,35 (1Н, m), 7,61 (2Н, m), 7,71 (1Н, m), піразол-4-іл]гідроксиметил]-7-(1-метилетил)-57,95(1Н, s), 7,98 (1Н, dd), 8,07 (2Н, m), 8,39 (1Н, m). метилтієно[2.3-d]піридазин-4(5Н)-он d) 7-етил-5-метил-4-оксо-2-{[1Отримують з продукту Прикладу 1, частини с) (фенілсульфоніл)-1Н-піроло[2.3-d]піридин-3за процедурою Прикладу 12, частини f), як тверду іл]метил}-4,5-дигідротієно[2.3-d]піридазин-3речовину. карбонова кислота MC (APCI) 489 і 491 [М+Н]+ Отримують з продукту частини с) за процедуd 1НСDСІЗ 1,35 (60, d), 2,35 (3Н, s), 2,75 (1Н, s), рою Прикладу 10, частини с), як тверду речовину. + 2,87 (1Н, bs), 3,07 (1Н, m), 3,80 (3Н, s), 6,21 (1Н, s), MC (ESI) 509 [М+Н] 7,21 (1Н, m), 8,78 (2Н, m). d 1НДМСО 1,25 (3Н, m), 2,73 (2Н, m), 3,71 (3Н, s), b) 3-бром-2-[[3,5-диметил-1-(2-піридиніл)-1Н4,82 (2Н, s), 7,26 (1Н, m), 7,63 (3Н, m), 7,74 (1Н, m), піразол-4-іл]метил]-7-(1-метилетил-57,98 (1Н, s), 8,04 (2Н, m), S,37 (1H, m). метилтієно[2,3-d]піридазин-4(5Н)-он e) 7-етил-5-метил-4-оксо-2-(1Н-піроло[2.3Отримують з продукту частини а) за процедуb]піридин-3-ілметил)-4.5-дигідротієно[2.3рою Прикладу 1, частини f), як тверду речовину. d]піридазин-3-карбонова кислота MC (ESI) 472 і 474 [М+Н]+ Розчин продукту частини d) (023г) у метанолі d 1HCDCI3 1,28 (60, d), 2,26 (3Н, s), 2,62 (3Н, s), (10мл) обробляють гідроксидом калію (76мг) і грі2,94 (1Н, m), 3,81 (3Н, s), 4,01 (2Н, s), 7.19 (1Н, m), ють при кипінні під зворотним холодильником 7,81 (1Н, m), 7,88 (1Н, dd), 8,44 (1Н, m). 3год., потім концентрують у вакуумі, розбавляють c) 2-[[3.5-диметил-1-(2-піридиніл)-1Н-піразолводою і екстрагують етилацетатом (´2). Водний 4-іл]метил]-7-етил-4,5-дигідро-5-метил-4шар підкислюють до pH 5 льодяною оцтовою кисоксотієно[2.3-d]піридазин-3-карбонова кислота лотою і екстрагують етилацетатом (´3). Об'єднані Отримують з продукту частини b) за процедуорганічні екстракти сушать над безводним сульрою Прикладу 12, частини h) як тверду речовину. фатом магнію, фільтрують і випарюють під знижеMC(ESI) 438 [М+Н]+ ним тиском, отримуючи бажану сполуку як тверду d 1НСDСІЗ 1,30 (6Н, d), 2,23 (3Н, s), 2,59 (3Н, s), речовину (0,064г). + 3,05 (1H,m), 3,94 (3Н, s), 4,64 (2Н, s), 7.20 (1Н, dd), MC (ESI) 369 [М+Н] 7,83 (1Н, td), 7,91 (1Н, d), 8,45 (1Н, dd), 16,82 (1Н, f) 7-етил-3-{[(4S)-4-гідрокси-4s) метилізоксазолідин-2-іл]карбоніл}-5-метил-2-(1Нd) 2-[(3.5-диметил-1-(2-піридиніл)-1Н-піразолпіроло[2,3-b]піридин-3-ілметил)тієно[2.34-іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2d]піридазин-4(5Н)-он ізоксазолідиніл]карбоніл-5-метил-7-(1-метилетил)До розчину продукту частини e) (0,08г) і 1тієно[2.3-d]піридазин-4(5Н)-он гідроксибензотриазолу (0,037г) у ДМФ (2мл) додаОтримують з продукту частини с) за процедують триетиламін (0,135мл) і потім діетилхлорфос 33 80175 34 рою Прикладу 5, частини г), як тверду речовину. (0,95г) і транс-діаміноциклогексану (0,06мл), зміMC (ESI) 523 [М+Н]+ шуючи під азотом. Додають карбонат калію (0,222г) і сухий діоксан (2мл) і суміш гріють при d 1HCDCI3 1,31 (6Н, m), 1,51 (3Н, s), 2,27 (3Н, s), 110°С 3 дні. Після випарювання залишок очища2,62 (3Н, s), 3,00 (1Н, у), 3,44 (1Н, d), 3,79 (3Н, s), ють колонною хроматографією на кремнеземі з 3,81 (1Н, d), 3,97 (1Н, d), 4,11 (2Н, dd), 4,56 (1Н, d), елюентом етилацетат/метанол (98:2), потім пре6,13 (1Н, s), 7,18 (1Н, t), 7,82 (2Н, m), 8,44(1Η, d). паративною зворотнофазовою РХВР, застосовуюПриклад 16 2-[(3.5-диметил-1-(2-піримідиніл)-1Н-піразол-4чи аце-тонітрил/водний амоній, і отримують бажану сполуку як тверду речовину (0,023г). іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2MC(ESI) 529 [М+Н]+ ізоксазолідиніл)карбоніл-5-метил-7-(1-метилетил)тієно[2.3-d]піридазин-4(5Н)-он d 1HCDCI3 1,31 (6Н, t), 1,51 (3Н, s), 2,25 (3Н, s), 2,67 (3Н, s), 3,00 (1Н, m), 3,41 (1Н, d), 3,79 (3Н, s), 3,80 (1Н, d), 3,97 (1Н, d), 4,09 (2Н, dd), 4,55 (1Н, d), 6,10 (1Н, s), 7,06 (1H,d),7,53(1H,d). Фармакологічні дані Інгібування РМА/іономіцин-стимульованої проліферації мононуклеарних клітин у периферійній крові Це дослідження проводили у 96-коміркових плоскодонних мікротитрувальних планшетах. СпоОтримують з продукту Прикладу 6 (0,9г) і 2луки отримували як 10мМ маточні розчини у димебромпіримідину (0,64г) в ацетонітрилі (3мл) з натилсульфоксиді, з яких у 50-разовому розбавленні, гріванням у мікрохвильовій печі при 130°С протяотриманому у RPMI, були отримані послідовні гом 15хвил. Після випарювання залишок очищарозбавлення цього розчину. 10мкл 50-разово розють колонною хроматографією на кремнеземі з бавленого маточного розчину, або його розбавелюентом етилацетат/метанол (20:1), отримуючи лень додавали до комірки, отримуючи концентрабажану сполуку як тверду речовину (0,032г). ції, починаючи з 9,5мкМ і нижче. У кожну комірку MC (ESI) 524 [М+Н]+ вносили 1´105 РВМС, о триманого з периферийної d 1HCDCI3 1,31 (6Н, t), 1,52 (3Н, s), 2,32 (3Н, s), крові одного донора-людини, у середовищі 2,66 (3Н, s), 2,97 (1Н, m), 3,40 (1Н, d), 3,83 (1Н, d), RPMI1640 з доданням 10% сироватки людини, 3,98 (1Н, d), 4,13 (2Н, dd), 4,56 (1Н, d), 6,12 (1Н, b), 2мМ глютаміну і пеніциліну/стрептоміцину. Дода7,19 (1Н, t), 8,77 (2H,d). вали ацетат форболміристрату (РМА) (кінцева Приклад 17 концентрація 0,5нг/мл) і іономіцин (кінцева концен2-[(3.5-диметил-1-(2-тіазоліл)-1Н-піразол-4трація 500нг/мл), і, отже, кінцевий об'єм аналізу іл)метил]-3-[[(4S)-4-гідрокси-4-метил-2становив 0,2мл. Клітини інкубували при 37°С у ізоксазолідиніл]карбоніл]-5-метил-7-(1-метилетил)зволоженій атмосфері з 5% ді-оксиду карбону протієно[2.3-d]піридазин-4(5Н)-он тягом 72год. Для кінцевих 6год. інкубування додавали 3Н-тимідин (0,5мКі). Рівень радіоактивності, внесений клітинами, є мірою проліферації. У цьому випробування сполуки Прикладів показали значення ІА50 менше 1´10-6М. Зокрема, для Прикладів 3, 7, 12 PIA50 становило 8,2, 7,6 і 8,8. Отримують з продукту Прикладу 6 (0,222г), 2-бромтіазолу (0,222г), йодиду міді (І) Комп’ютерна в ерстка В. Мацело Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45,м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюThienopyridazinones, process for their preparation and their use in the modulation of autoimmune disease
Автори англійськоюGuile Simon David, Ingall Anthony Howard
Назва патенту російськоюТиенопиридазиноны, способ их получения и использование в модуляции автоимунной болезни
Автори російськоюГил Саймон Дейвид, Инголл Энтони Говард
МПК / Мітки
МПК: A61K 31/50, C07D 495/04
Мітки: одержання, автоімунної, використання, тієнопіридазинони, спосіб, модуляції, хвороби
Код посилання
<a href="https://ua.patents.su/17-80175-tiehnopiridazinoni-sposib-kh-oderzhannya-ta-vikoristannya-u-modulyaci-avtoimunno-khvorobi.html" target="_blank" rel="follow" title="База патентів України">Тієнопіридазинони, спосіб їх одержання та використання у модуляції автоімунної хвороби</a>





















