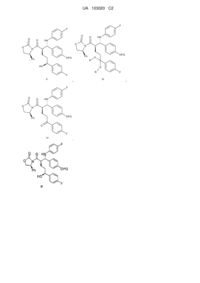
Проміжні сполуки для одержання (3r,4s)-1-(4-фторфеніл)-3-[(3s)-3-(4-фторфеніл)-3-гідроксипропіл]-4-(4-гідроксифеніл)-2-азетидинону
Номер патенту: 103020
Опубліковано: 10.09.2013
Автори: Славікова Маркета, Гаїцек Йосеф, Степанкова Хана, Зезула Йосеф
Формула / Реферат
1. Спосіб одержання (4S)-3-{(2R,5S)-5-(4-фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4-гідроксифеніл)метил]-5-гідроксипентаноїл}-4-феніл-1,3-оксазолідин-2-онів загальної формули II
 ,
,
в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрилабо тритил,
який відрізняється тим, що кетальоксазолідиди загальної формули III
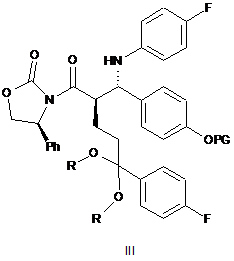 ,
,
в якій PG має визначене вище значення і R являє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, або R+R разом являють собою двовалентний алкіл, необов'язково заміщений 1 або 2 алкільними групами,
піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 0 до 100 °C, і одержаний кетоноксазолідид загальної формули IV
 ,
,
в якій PG має визначене вище значення,
відновлюють асиметричними реактивами у інертному органічному розчиннику в інтервалі температур від -30 до +40 °C.
2. Спосіб за п. 1, який відрізняється тим, що для зняття захисту як кислотний реактив використовують органічну кислоту, вибрану з групи, що включає п-толуолсульфонову кислоту, метансульфонову кислоту і оцтову кислоту, або неорганічну кислоту, вибрану з групи, що включає хлорводневу і сірчану кислоту.
3. Спосіб за п. 1 або 2, який відрізняється тим, що зняття захисту здійснюють у суміші води і водорозчинного розчинника, вибраного з групи, що включає тетрагідрофуран, ацетон, метилетилкетон, ізобутилметилкетон, метанол і етанол, в інтервалі температур від 20 до 100 °C, переважно від 50 °C до температури кипіння суміші.
4. Спосіб за п. 1, який відрізняється тим, що для відновлення як асиметричний реактив використовують боран у присутності хірального ліганду.
5. Спосіб за п. 1 або 4, який відрізняється тим, що як джерело борану використовують борановий комплекс з диметилсульфідом, тетрагідрофураном, диметиланіліном або діетиланіліном.
6. Спосіб за будь-яким з пп. 1, 4, і 5, який відрізняється тим, що як хіральний ліганд використовують 2-заміщений (R)-СВS-оксазаборолідин у кількості від 5 до 20 моль %.
7. Спосіб за п. 6, який відрізняється тим, що 2-заміщений (R)-СВS-оксазаборолідин є (R)-2-метил-СВS-оксазаборолідином або (R)-2-(о-толіл)-СВS-оксазаборолідином.
8. Спосіб за будь-яким з пп. 1, 4, 5, 6 і 7, який відрізняється тим, що відновлення здійснюють у присутності каталітичної кількості протонної кислоти або кислоти Льюїса, вибраної з групи, що включає метансульфонову кислоту, п-толуолсульфонову кислоту, трифтороцтову кислоту і ефірат трифториду бору.
9. Спосіб за будь-яким з пп. 1, 4, 5, 6, 7 і 8, який відрізняється тим, що інертний органічний розчинник вибирають з групи, що включає тетрагідрофуран, 2-метилтетрагідрофуран, трет-бутилметиловий етер, толуол або дихлорметан і їх суміші.
10. Спосіб за будь-яким з пп. 1 і 4-9, який відрізняється тим, що відновлення здійснюють при від -25 до -15°С і/або при від 20 до 30 °C.
11. Спосіб за п. 1, який відрізняється тим, що при відновленні як асиметричний реактив використовують водень у присутності хірального каталізатора.
12. Спосіб за п. 1 або 11, який відрізняється тим, що як джерело водню використовують газоподібний водень, мурашину кислоту або її солі з амінами або ізопропіловий спирт.
13. Спосіб за будь-яким з пп. 1, 11 і 12, який відрізняється тим, що як хіральний каталізатор використовують комплекс перехідних металів з залізом, родієм або рутенієм або їх комбінацію у присутності хірального ліганду.
14. Спосіб за будь-яким з пп. 1 і 11-13, який відрізняється тим, що як хіральний каталізатор використовують комплекс перехідних металів з залізом, родієм або рутенієм або їх комбінацію з хіральним лігандом, вбудованим у молекулу.
15. Спосіб за будь-яким з пп. 1 і 11-14, який відрізняється тим, що хіральний каталізатор одержують in situ.
16. Спосіб за будь-яким з пп. 1 і 11-14, який відрізняється тим, що як хіральний каталізатор використовують (R)-4-ізопропіл-2-[(R)-2-(дифенілфосфіно)фероцен-1-іл]оксазоліну хлорид трифенілфосфінорутенію(ІІ).
17. Спосіб одержання О-захищених (4S)-3-{(2R)-5-(4-фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4-гідроксифеніл)метил]-5-оксопентаноїл}-4-феніл-1,3-оксазолідин-2-онів загальної формули IV
 ,
,
в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, трет-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил,
який відрізняється тим, що (S)-3-[5-(4-фторфеніл)-1,5-оксопентил]-4-фенілоксазолідин-2-ону формули V

кеталізують за допомогою реакції з одноатомним спиртом загальної формули VI
![]() ,
,
в якій R являє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений,
у присутності прискорювача в інтервалі температур від 10 до 100 °C (стадія 1),
одержаний кетальоксазолідид загальної формули VII
 ,
,
в якій R має визначене вище значення,
піддають взаємодії з захищеним іміном загальної формули VIII
 ,
,
в якій PG має визначене вище значення,
у присутності кислоти Льюїса і сильної органічної основи в інертному органічному розчиннику в інтервалі температур від -40 до 0 °C (стадія 2), і одержаний кетальоксазолідид загальної формули III
 ,
,
в якій R і PG мають визначені вище значення,
піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 10 до 100 °C (стадія 3).
18. Спосіб за п. 17, який відрізняється тим, що як прискорювач на стадії 1 використовують сильну мінеральну або органічну кислоту, вибрану з групи, що включає сірчану кислоту і п-толуолсульфонову кислоту, у присутності агента, що видаляє воду, вибраного з групи, що включає молекулярні сита і триалкілортоформіат.
19. Спосіб за п. 17 або 18, який відрізняється тим, що на стадії 1 реакцію здійснюють при температурі від 50 °C до температури кипіння суміші.
20. Спосіб за п. 17, який відрізняється тим, що на стадії 2 як кислоту Льюїса використовують i-пропоксидтрихлорид титану або n-бутоксидтрихлорид титану у кількості від 1 до 2 еквівалентів і як сильну органічну основу використовують діізопропілетиламін у кількості від 2 до 5 еквівалентів.
21. Спосіб за п. 17 або 20, який відрізняється тим, що на стадії 2 використовують кислоту Льюїса у кількості від 1,1 до 1,4 еквівалента і діізопропілетиламін у кількості від 2,1 до 4 еквівалентів.
22. Спосіб за будь-яким з пунктів 17, 20 і 21, який відрізняється тим, що на стадії 2 інертні органічні розчинники вибирають з групи, що включає дихлорметан, дихлоретан, толуол, тpeт-бутилметиловий етер і їх суміші, в інтервалі температур від -40 до 0 °C, переважно при від -35 до -15 °C.
23. Спосіб за будь-яким з пунктів 17 і 20-22, який відрізняється тим, що імін загальної формули VII одержують in situ на стадії 2 за допомогою реакції N-(4-гідроксибензиліден)-4-фтораніліну (VII, PG=Н) з PG-X захисними реактивами.
24. Спосіб за п. 17, який відрізняється тим, що як кислотний реактив на стадії 3 використовують органічну кислоту, вибрану з групи, що включає п-толуолсульфонову кислоту, метансульфонову кислоту і оцтову кислоту, або неорганічну кислоту, вибрану з групи, що включає хлорводневу і сірчану кислоти.
25. Спосіб за п. 17 або 24, який відрізняється тим, що зняття захисту на стадії 3 здійснюють у суміші води і водорозчинного розчинника, вибраного з групи, що включає тетрагідрофуран, 2-метилтетрагідрофуран, ацетон, ізобутилметилкетон, метанол, етанол і їх суміші, переважно у інтервалі температур від 20 °C до температури кипіння суміші.
26. Спосіб за будь-яким з пунктів 17, 24 і 25, який відрізняється тим, що зняття захисту на стадії 3 здійснюють, використовуючи каталітичну п-толуолсульфонову кислоту у водному ацетоні, хлорводневу кислоту у метанолі або етанолі або оцтову кислоту у водному тетрагідрофурані.
27. Кетоноксазолідиди загальної формули IV
 ,
,
в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил.
28. Застосування кетоноксазолідидів загальної формули IV, як визначено у пункті 27, у синтезі езетимібу.
29. Кетоноксазолідид формули IVa
 .
.
30. Кетоноксазолідид формули IVb
 .
.
31. Кетоноксазолідид формули IVc
 .
.
32. Кетоноксазолідид формули IVd
 .
.
33. (S)-Спирти оксазолідидів загальної формули II
 ,
,
в якій PG являє собою водень або гідроксил-захисну групу, вибрану згрупи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил.
34. Застосування (S)-спиртів оксазолідидів загальної формули II, як визначено у пункті 33, у синтезі езетимібу.
35. Спирт оксазолідиду формули ІІа
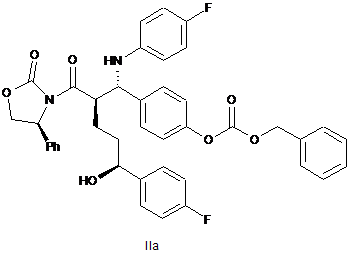 .
.
36. Спирт оксазолідиду формули ІІb
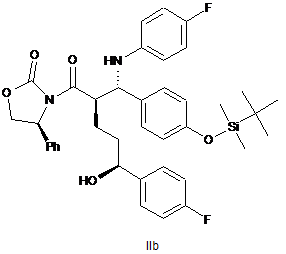 .
.
37. Спирт оксазолідиду формули ІІс
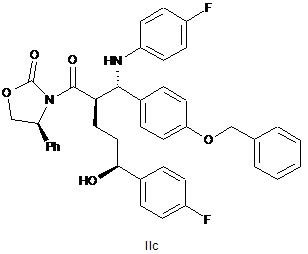 .
.
38. Спирт оксазолідиду формули ІІd
 .
.
Текст
Реферат: Спосіб одержання (S)-спиртів оксазолідидів загальної формули II, в якій PG являє собою водень або гідроксильну захисну групу, таку як триметилсиліл, трет-бутилдиметилсиліл, бензилоксикарбоніл, тpeт-бутоксикарбоніл, бензил, бензгідрил або тритил, в якій кетальоксазолідид загальної формули III, де PG має визначене вище значення і R означає алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, такий як метил, етил, ізопропіл або бутил, або R+R разом представляють двовалентний алкіл, або заміщений з 1 або 2 алкільними групами, наприклад, 1,2-етилен, 1,2-пропілен, 1,2-бутилен, 1,3-пропілен або 2,2диметил-1,3-пропілен, піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 0 до 100 °C (стадія А), і одержаний кетоноксазолідид загальної формули IV, в якій PG має визначене вище значення, відновлюють асиметричними реактивами у інертному органічному розчиннику в інтервалі температур від -30 до +40 °C (стадія В). UA 103020 C2 (12) UA 103020 C2 F F O O O O O O HN HN N N Ph OPG Ph R OPG O HO O R F F II , F O O O HN N OPG Ph O F IV . III , UA 103020 C2 5 Галузь винаходу Винахід стосується нового способу одержання О-захищених (4S)-3-{(2R,5S)-5-(4фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4-гідроксифеніл)метил]-5-гідроксипентаноїл}-4-феніл1,3-оксазолідин-2-онів. Рівень техніки (3R,4S)-1-(4-фторфеніл)-3-[(3S)-3-(4-фторфеніл)-3-гідроксипропіл)]-4-(4-гідроксифеніл)-2азетидинон формули (І), 10 15 20 25 30 35 40 45 50 відомий під міжнародною непатентованою назвою езетиміб, описаний у патенті США № 5,631,365 як гіполіпідемічний засіб, що знижує всмоктування кишечником холестерину та інших стеролів. Згідно з Патентами США 5,739,321 і 5,886,171 езетиміб одержують наступним чином, до N(4-бензилоксибензиліден)-4-фтораніліну додають (S)-4-гідроксибутанолід з використанням аморфного льоду низької густини (LDA) при -78 °С, одержаний діол розщеплюють перйодатом, до одержання альдегіду, що взаємодіє з 0-триметилсиліленолом 4-фторацетофенону, утворюючи алдол. Алдол зневоднюють, одержуючи ненасичений кетон, подвійний зв'язок якого, або також бензильну захисну групу одночасно гідрують на паладієвому каталізаторі. Потім кетон асиметрично відновлюють бораном у присутності хірального ліганду, одержуючи езетиміб або його О-бензильну похідну, які гідрують на паладієвому каталізаторі. Недолік цього способу полягає у необхідності працювати при дуже низьких температурах і багатократному використанні дорогих каталізаторів паладієвого типу. Спосіб виробництва езетимібу, що описаний у Патенті США № 5,856,473 починається з 5-(4фторфеніл)-4-пентенової кислоти, яку перетворюють на хлорид, використовуючи оксалілхлорид, і надалі за допомогою реакції з (S)-4-феніл-2-оксазолідиноном, на ацилоксазолідид. Останній додають до N-(4-бензилоксибензиліден)-4-фтораніліну, використовуючи тетрахлорид титану у присутності діізопропілетиламіну, одержуючи продукт, який циклізують, використовуючи бістриметилсилілацетамід і каталітичний TBAF, одержуючи олефіназетидинон. Цей алкен перетворюють на кетон за допомогою дії Pd(OAc) 2 і бензохінону у присутності перхлорної кислоти. Кетон знову асиметрично відновлюють бораном у присутності хірального ліганду і зрештою здійснюють гідрування О-бензильної захисної групи. Суттєвий недолік даного способу знову ж полягає у багатократному використанні дорогих каталізаторів паладієвого типу і використанні токсичного оксалілхлориду. Відповідно до вищезазначеного Патенту США № 5,631,365 езетиміб одержують наступним чином, із (S)-4-феніл-2-оксазолідинону і хлориду естеру глутарової кислоти синтезують (S)-N-(4метоксикарбонілбутаноїл)оксазолідид і потім його додають у присутності тетрахлориду титану до зазначеного вище N-(4-бензилоксибензиліден)-4-фтораніліну, і одержаний продукт циклізують за допомогою дії бістриметилсилілацетаміду і каталітичного TBAF, одержуючи естер азетидинону. В результаті гідролізу естеру у лужному середовищі одержували кислоту, яку перетворювали на хлорангідрид, за допомогою реакції якого з реактивом Гріньяра у присутності ZnCI2 і Pd(PPh3)4 одержували кетон. Останній асиметрично відновлюють дибораном у присутності хірального ліганду і зрештою здійснюють гідрування О-бензильної захисної групи на паладієвому каталізаторі. В даному випадку також суттєвий недолік полягає в необхідності використання дорогих каталізаторів паладієвого типу, а також використання токсичного оксалілхлориду. Спосіб виробництва езетимібу відповідно до міжнародної публікації W0 2006/137080 є подібним до визначеного вище способу і він також має подібні недоліки. Хлорид метилового естеру глутарової кислоти одержують за допомогою дії оксалілхлориду на відповідну кислоту і взаємодії з (S)-4-феніл-2-оксазолідиноном з одержанням (S)-N-(4метоксикарбонілбутаноїл)оксазолідиду. Останній додають у присутності тетрахлориду титану до вищезазначеного N-(4-бензилоксибензиліден)-4-фтораніліну і одержаний продукт циклізують за допомогою дії бістриметилсилілацетаміду і каталітичного TBAF до одержання естер 1 UA 103020 C2 5 10 15 20 25 30 35 азетидинону. За допомогою гідролізу естеру у лужному середовищі одержували кислоту, яку, використовуючи оксалілхлорид, перетворювали на ацилхлорид, за допомогою реакції якого з реактивом Гріньяра у присутності ZnCI2 і ацетату перехідного металу, такого як паладій, одержували кетон. Кетон асиметрично відновлюють дибораном у присутності хірального ліганду і зрештою здійснюють гідрування О-бензильної захисної групи на паладієвому каталізаторі. Даний спосіб також демонструє суттєвий недолік багатократного використання дорогих каталізаторів паладієвого типу, а також багатократного використання токсичного оксалілхлориду. Спосіб одержання езетимібу відповідно до міжнародної публікації WO 2007/072088 починається з 4-(4-фторбензоїл)бутанової кислоти, яку спочатку перетворюють на етиленкеталь і потім за допомогою реакції з (S)-4-феніл-2-оксазолідиноном, на (S)-3-[4-[2-(4-фторфеніл)-[1,3]діоксолан-2-іл]бутаноїл]-4-фенілоксазолідин-2-он. Його додаванням до О-силільованого N-(4гідроксибензиліден)-4-фтораніліну за допомогою дії ізопропоксиду трихлориду титану одержували продукт, який циклізували, використовуючи бістриметилсилілацетамід і каталітичний TBAF, до одержання кетальазетидинону, і шляхом зняття захисту, до одержання кетоназетидинону з використанням монтморилоніту К10. Одержаний таким чином силільований кетон відновлювали дибораном у присутності хірального (R)-о-толіл-СВS-оксазаборолідину. Одержаний О-силільований езетиміб з de > 98 % зрештою піддавали зняттю захисту використовуючи, сірчану кислоту в ізопропіловому спирті. Спосіб одержання відповідно до міжнародної публікації WO 2007/119106 включає не тільки вищезазначений кеталь, (S)-3-[4-[2-(4-фторфеніл)-[1,3]-діоксолан-2-іл]бутаноїл]-4фенілоксазолідин-2-он, а і також його аналог, одержаний із 1,3-пропандіолу. Їх додаванням до О-бензильованого або триметилсилільованого N-(4-гідроксибензиліден)-4-фтораніліну за допомогою дії ізопропоксиду трихлориду титану, одержували продукти, які циклізували до одержання кетальазетидинонів з використанням бістриметилсилілацетаміду і каталітичного TBAF і потім піддівали зняттю захисту до одержання кетоназетидинонів з використанням птолуолсульфонової кислоти в ацетоні. Одержаний таким чином бензилоксикетон, відновлювали бораном у присутності хірального (R)-2-метил-СВS-оксазаборолідину і піддавали послідовному зняттю захисту шляхом гідрування на Pd/C. Езетиміб альтернативно одержували за допомогою того ж самого CBS відновлення гідроксикетону. Подібний спосіб синтезу езетимібу із 5- і 6-членних кеталів і захищених імінів також описаний у міжнародній публікації патентної заявки WO 2007/120824. Загальною проблемою цих трьох способів є хіміоселективність і діастереоселективність CBS відновлення кетонів з використанням борану і наступний трудомісткий процес кінцевого очищення одержаного езетимібу. Розкриття винаходу Винахід стосується способу одержання (S)-спирт-оксазолідидів загальної формули II 40 в якій PG представляє собою водень або гідроксильну захисну групу, таку як триметилсиліл, mpem-бутилдиметилсиліл, бензилоксикарбоніл, mpem-бутоксикарбоніл, бензил, бензгідрил або тритил, суть якого полягає в тому, що кетальоксазолідид загальної формули III 2 UA 103020 C2 5 10 15 20 25 30 35 в якій PG означає визначене вище значення і R представляє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, такий як метил, етил, ізопропіл або бутил, або R+R разом представляють собою двовалентний алкіл, необов'язково заміщений 1 або 2 алкільними групами, наприклад, 1,2-етилен, 1,2-пропілен, 1,2-бутилен, 1,3-пропілен або 2,2-диметил-1,3пропілен, піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника при температурі, що знаходиться в інтервалі від 0 до 100° (стадія А), і одержаний кетоноксазолідид загальної формули IV в якій PG має визначене вище значення, відновлююють асиметричними реактивами у інертному органічному розчиннику в інтервалі температур від -30 до +40 °С (стадія В). Було виявлено, що О-захищені (4S)-3-{(2R)-5-(4-фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4гідроксифеніл)метил]-5-оксопентаноїл}-4-феніл-1,3-оксазолідин-2-они (що згадуються надалі як кетоноксазолідиди) загальної формули IV і О-захищені (4S)-3-{(2R,5S)-5-(4-фторфеніл)-2-[(S)[(4-фторфеніл)аміно](4-гідроксифеніл)метил]-5-гідроксипентаноїл}-4-феніл-1,3-оксазолідин-2они (згадані надалі як (в)-спирти оксазолідидів) загальної формули II, в якій PG має визначене вище значення, є новітніми і представляють собою важливі проміжні сполуки у промислово придатному виробництві езетимібу формули І. Серед цих сполук загальних формул II і IV перевага надається тим, в яких PG представляє собою триметилсилільну, третбутилдиметилсилільну, бензилоксикарбонільну, mpem-бутоксикарбонільну, бензильну, бензгідрильну або тритильну групи, і серед них особлива перевага надається бензилоксикарбонільній, mpem-бутилдиметилсилільній і бензильній групам. Винахідниками також було знайдено, що спосіб відновлення кетонів загальної формули IV до (S)-спиртів загальної формули II з використанням CBS борану є не тільки високо діастереоселективним, а і також високо хіміоселективним. Досягнення високої хіміоселективності стає можливим внаслідок того, що молекули загальних формул II і IV не мають чутливої азетидинонової групи. Цей факт забезпечує переваги способу виробництва езетимібу формули І із захищених кетоноксазолідидів загальної формули III через кетоноксазолідиди загальної формули IV і (3S)-спирти оксазолідидів загальної формули II. Стадія А. Кеталь загальної формули III, в якій PG і R мають визначені вище значення, гідролізують за допомогою дії кислотних реактивів таких як органічні кислоти, наприклад, птолуолсульфонової кислоти, метансульфонової кислоти, оцтової кислоти або неорганічні кислоти, наприклад, хлорводневої кислоти, у суміші води і водорозчинного розчинника, такого 3 UA 103020 C2 5 10 15 20 25 30 35 як тетрагідрофуран, ацетон, метилетилкетон або ізобутилметилкетон, або спирт, наприклад, метанол або етанол, в інтервалі температур від 20 до 100°С, переважно при від 50 °С до температури кипіння суміші. Стадія В. Кетони загальної формули IV, в якій PG і R мають визначені вище значення, відновлюють асиметричними реактивами у інертному органічному розчиннику в інтервалі температур від -30 до +40 °С. Як асиметричний реактив використовують боран у присутності хірального ліганду або джерело водню у присутності хірального каталізатора. Якщо боран використовують у присутності хірального ліганду, джерелом борану може бути борановий комплекс, наприклад, з диметилсульфідом, тетрагідрофураном, диметиланіліном або діетиланіліном, і як хіральний ліганд може використовуватися 2-заміщений (R)-СВSоксазаборолідин, такий як (R)-2-метил-СВS-оксазаборолідин або (R)-2-(о-толіл)-СВSоксазаборолідин у кількості від 1 до 100 моль%, переважно від 5 до 25 моль%. Відновлення проводять у присутності каталітичної кількості протонової або кислоти Льюіса, такої як метансульфонова кислота, п-толуолсульфонова кислота, трифтороцтова кислота, етерат бортрифториду або -хлордіізопінокамфенілборан. Прийнятними інертними органічними розчинниками є наприклад, тетрагідрофуран, 2метилтетрагідрофуран, mpem-бутилметиловий етер, толуол або дихлорметан або їх суміші. Відновлення переважно проводять при температурах від -25 до -15 °С або при від 20 до +30 °С. Якщо асиметричний реактив, що містить джерело водню, використовують у присутності хірального каталізатора, то цей випадок відноситься до асиметричного гомогенного відновлення. Як джерело водню можуть використовуватися або водень сам по собі або його джерело, таке як мурашина кислота або її солі, наприклад, триетиламонійформіат або ізопропіловий спирт. Як хіральний каталізатор використовують комплекс перехідних металів, наприклад, заліза, родію і рутенію і їх комбінації, у присутності хірального ліганду, або комплекс вищезазначених перехідних металів з хіральним лігандом вбудованим у молекулу, переважно наприклад, хлоридом (R)-4-ізопропіл-2-[(R)-2-(дифенілфосфіно)фероцен-1іл]оксазолінтрифенілфосфінрутенію (ІІ). Перевага надається одержанню хіральних каталізаторів in situ. Даний винахід також стосується нового способу одержання О-захищених (4S)-3-{(2R)-5-(4фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4-гідроксифеніл)метил]-5-оксопентаноїл}-4-феніл-1,3оксазолідин-2-онів (згаданих надалі як кетоноксазолідиди) загальної формули IV в якій PG представляє собою водень або гідроксильну захисну групу таку як триметилсиліл, mpem-бутилдиметилсиліл, бензилоксикарбоніл, mpem-бутокси карбоніл, бензил, бензгідрил або тритил, починаючи з (S)-3-[5-(4-фторфеніл)-1,5-оксопентил]-4-фенілоксазолідин-2-ону формули V 40 який кеталізують з одноатомним спиртом загальної формули VI 4 UA 103020 C2 5 10 15 в якій R представляє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, такий як метил, етил, ізопропіл або бутил, у присутності прискорювача в інтервалі температур від 10 до 100 °С (стадія 1), з одержанням в результаті кетальоксазолідиду загальної формули VII в якій R означає визначені вище значення, піддають взаємодії з захищеним іміном загальної формули VIII в якій PG має визначене вище значення, у присутності кислоти Льюіса і сильної органічної основи у інертному органічному розчиннику в інтервалі температур від -40 до 0 °С (стадія 2), і в результаті одержують кетальоксазолідид загальної формули III 20 25 30 в якій R, а також PG мають визначені вище значення, піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 0 до 100 °С (стадія 3). Винахідниками було знайдено, що кетоноксазолідиди загальної формули IV, в якій PG представляє собою водень або гідроксильну захисну групу, таку як триметилсиліл, mpemбутилдиметилсиліл, бензилоксикарбоніл, mpem-бутоксикарбоніл, бензил, бензгідрил або тритил, переважно може бути одержаний за допомогою способу, в якому використвується захист карбонілу у сполуці формули V у формі діалкілацеталів загальної формули VII. Важлива перевага способу полягає в тім, що ацетальоксазолідиди формули III, одержані за допомогою реакції з імінами загальної формули VIII дуже легко піддаються кислотному зняттю захисту, з одержанням цільових кетонів загальної формули IV. Даний спосіб одержання кетоноксазолідидів формули IV складається з трьох стадій, які детально описані нижче. 5 UA 103020 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 1. (S)-3-[5-(4-фторфеніл)-1,5-оксопентил]-4-фенілоксазолідин-2-он формули V кеталізують за допомогою реакції з R-OH спиртами загальної формули VI, в якій R означає алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, такий як метил, етил, ізопропіл або бутил, у присутності прискорювача в інтервалі температур від 10 до 100 °С, переважно від 50 °С до температури кипіння суміші. Як прискорювач використовують сильну мінеральну або органічну кислоту, таку як сірчана кислота або п-толуолсульфонова кислота у присутності агента, для видалення води, такого як молекулярні сита, переважно триалкілортоформіату, такого як триметилортоформіат або триетилортоформіат. Переважним чином, триметилортоформіат використовують з висококиплячими спиртами R-OH і одержаний в результаті метанол відокремлюють за допомогою ректифікації. Стадія 2. (S)-кетальоксазолідиди загальної формули VII, в якій R має визначене вище значення, піддають взаємодії з захищеними імінами загальної формули VIII, в якій PG є воднем або гідроксильною захисною групою, такою як триметилсиліл, трет-бутилдиметилсиліл, бензилоксикарбоніл, mpem-бутоксикарбоніл, бензил, бензгідрил або тритил, у присутності кислоти Льюіса, наприклад, тетрахлориду титану або алкоксиду трихлориду титану, у кількості від 1 до 2 еквівалентів, переважно 1,1 до 1,4 еквівалентів. Додавання здійснюють у присутності сильної органічної основи, переважно діізопропілетиламіну, у кількості від 2 до 5 еквівалентів, у інертному органічному розчиннику такому як дихлорметан, дихлоретан, толуол, mpemбутилметиловий етер, тетрагідрофуран, 2-метилтетрагідрофуран, в інтервалі температур від 40 до 0 °С, переважно при -35 до -15 °С. Процедура може бути переважно здійснюватись за допомогою реакції, що проходить в одній реакційній посудині, таким чином, що перший захищений імін загальної формули VIII одержують in situ за допомогою реакції іміну VIII (PG = Н) з захисними агентами PG-X, в яких PG має визначене вище значення, а X є групою, що відходить, такою як хлор, і потім до нього додають ацетальоксазолідид формули VII за допомогою визначеного вище способу. Стадія 3. Кеталь загальної формули III, в якій PG і R мають визначені вище значення, гідролізують за допомогою дії кислотних реактивів, таких як органічні кислоти, наприклад, птолуолсульфонова кислота, метансульфонова кислота, оцтова кислота, або неорганічні кислоти, наприклад, хлорводнева кислота, у суміші води і водорозчинного розчинника, такого як тетрагідрофуран, ацетон, метилетилкетон або ізобутилметилкетон, або спирт, наприклад, метанол або етанол, в інтервалі температур від 10 до 100 °С, переважно від 20 °С до температури кипіння суміші. Наступні приклади ілюструють основний спосіб згідно з винаходом, але ніяким чином його не обмежують. Приклад 1 Одержання (S)-3-[5,5-диметокси-5-(4-фторфеніл)-1-оксопентил]-4-фенілоксазолідин-2-ону До суспензії 15,0 г (42,15 ммоль) (S)-3-[4-(4-фторбензоїл)-1-оксобутил]-4-фенілоксазолідин2-ону у метанолі (300 мл) додавали триметилортоформіат (22,2 г, 0,21 моль, 5 екв.) і птолуолсульфонову кислоту (0,25 г). Суміш перемішували при кімнатній температурі протягом 18 годин і одержаний розчин потім нагрівали при температурі кипіння протягом 5 годин. Після охолодження, додавали толуол (400 мл) і 9% розчин NaHCO3 (170 мл). Відокремлену водну фазу екстрагували толуолом (100 мл). Об'єднані органічні фази промивали водою (150 мл) і випаровували після висушування. Вихід: 17,5 г склоподібної речовини. ВЕРХ: степінь чистоти 95,5 %. 1 Н-ЯМР (250 МГц, CDCI3): 7,44-7,19 (м, 7Н), 6,99 (т, J = 8,8 Гц, 2Н), 5,33 (дд, J = 8,7 Гц, J = 3,6 Гц, 1Н), 4,59 (т, J = 8,8 Гц, 1Н), 4,19 (дд, J = 8,9 Гц, J = 3,6 Гц, 1Н), 3,10 (с, 3Н), 3,08 (с, 3Н), 2,79 (т, J = 7,4 Гц, 2Н), 1,93-1,82 (м, 2Н), 1,36-1,20 (м, 2Н). Одержання сполуки загальної формули IV (PG = Cbz) До суспензії N-(4-гідроксибензиліден)-4-фтораніліну (3,73 г; 17,35 ммоль) у дихлорметані (46 мл) додавали діізопропілетиламін (9,5 мл, 55,5 ммоль) при перемішуванні і охолодженні до 5 °С і потім додавали 50% толуоловий розчин бензилхлорформіату (6,5 мл, 19,08 ммоль; 1,1 екв.) протягом 5 хвилин. Одержаний розчин залишали нагріватись до 10 °С протягом 1 години, хід реакції контролювали за допомогою ТШХ. Потім розчин охолоджували до -30 °С і при перемішуванні додавали розчин (S)-3-[5,5-диметокси-5-(4-фторфеніл)-1-оксопентил]-4фенілоксазолідин-2-ону (5,58 г, що відповідають 13,44 ммоль) у дихлорметані (25 мл) протягом 5 хвилин. Суміш потім охолоджували до -33 °С і після 45 хвилин перемішування починали додавати протягом 30 хвилин розчин ТіСІ3(Оi-Рr), який попередньо одержували шляхом змішування ТіСІ4 (1М розчин у СН2СІ2; 13,0 мл, 13,0 ммоль) і Ті(Оi-Рr)4 (1,32 мл, 4,4 ммоль) у СН2СІ2 (21 мл) при 10 °С, з наступним перемішуванням протягом 45 хвилин. Одержаний темний розчин перемішували при тій же температурі протягом 3 годин і потім додавали оцтову кислоту 6 UA 103020 C2 5 10 15 20 25 30 35 40 45 50 55 60 (3,6 мл) протягом 5 хвилин і продовжували перемішування при -33 °С протягом 5 хвилин. Потім до реакційної суміші додавали 0,46М розчин цитрату мононатрію (90 мл). Реакційну суміш інтенсивно перемішували протягом 30 хвилин, органічну фазу відокремлювали і водну фазу екстрагували, використовуючи СН2СІ2 (40 мл). Об'єднані органічні фази промивали водою (40 мл), сушили (Na2SO4) і випаровували у ротаційному вакуумному випаровувачі. До одержаного після випаровування залишку (13,3 г) додавали метанол (70 мл) і суспензію нагрівали до температури кипіння протягом 1 години і потім витримували при кімнатній температурі протягом 2 годин. Відокремлений продукт відфільтровували і промивали, використовуючи МеОН (2х 20 мл), і сушили при 45 °С. Темп, плавлення 178-179 °С. Вихід: 5,55 г (58,6 %) сполуки формули IV (PG = Cbz). ВЕРХ: степінь діастереоізомерної чистоти 98,7 %. 1 Н-ЯМР (250 МГц, CDCI3): 7,87 (м, 2Н), 7,50-7,34 (м, 6Н), 7,27-6,99 (м, 10Н), 6,74 (т, J = 8,7 Гц, 2Н), 6,37 дд, J = 9,0 Гц, J = 4,4 Гц, 2Н), 5,42 (дд, J = 8,5 Гц, J = 3,5 Гц, 1Н), 5.26 (с, 2Н), 5,03 (д, J = 9,8 Гц, 1Н), 4,65 (т, J = 8,6 Гц, 1Н), 4,59 (дт, J = 8,5 Гц, J = 4,6 Гц, 1Н), 4,47 (м, 1Н), 4,18 (дд, J = 8,8 Гц, J = 3,5 Гц, 1Н), 2,88 (дт, J = 7,3 Гц, J = 1,4 Гц, 2Н), 2,21 (м, 1Н), 1,85 (м, 1Н). Одержання сполуки формули II (PG = Cbz) До розчину кетону загальної формули IV (PG = Cbz) (6,00 г, 8,51 ммоль) у сухому ТГФ (200 мл) додавали 1М розчин (R)-Me-CBS каталізатора (2,12 мл, 2,12 ммоль, 25 моль %) при кімнатній температурі в атмосфері аргону. Реакційну суміш перемішували протягом 10 хвилин і потім краплями додавали 1М розчин BH3. Me2S у СН2СІ2 (11,9 мл, 11,9 ммоль, 1,4 екв.) протягом 1 години. Після перемішування протягом наступних 40 хвилин після перевірки за допомогою ТШХ реакцію припиняли шляхом повільного додавання метанолу (20 мл) при охолодженні до 10 °С. Потім додавали 1М водну НСІ (50) і дихлорметан (100 мл), і після перемішування протягом 10 хвилин органічну фракцію відокремлювали, промивали водою (50 мл) і сушили сульфатом натрію. Шляхом фільтрації і випаровування одержували неочищений продукту вигляді піноподібної твердої речовини, яку кип'ятили з метанолом (120 мл) і потім кристалізували протягом ночі. Осаджені кристали відсмоктували, промивали метанолом (15 мл) і сушили. Вихід: 5,62 г, тобто, 93,4 % спирту загальної формули II (R = Cbz). Темп, плавлення 165-167 °С, ВЕРХ: степінь діастереоізомерної чистоти 98,6 %. 1 Н-ЯМР (250 МГц, CDCI3): 7,47-7,35 (м, 5Н), 7,27-7,03 (м, 11Н), 6,99 (т, J = 8,7 Гц, 2Н), 6,73 (т, J = 8,7 Гц, 2Н), 6,34 (м, 2Н), 5,39 (дд, J = 8,5 Гц, J = 3,3 Гц, 1Н), 5,26 (с, 2Н), 4,97 (д, J = 10,1 Гц, 1Н), 4,65 (т, J = 8,7 Гц, 1Н), 4,60-4,49 (м, 2Н), 4,37 (дд, J = 10,1 Гц, J = 8,4 Гц, 1Н), 4,18 (дд, J = 8,8 Гц, J= 3,4 Гц, 1Н), 1,86 (д, J = 3,4 Гц, 1Н), 1,85-1,41 (м, 4Н). 1 Н-ЯМР (250 МГц, CD3SOCD3): 7,50-7,36 (м, 7Н), 7,30 (м, 2Н), 7,25-7,07 (м, 7Н), 7,06 (т, J = 8,7 Гц, 2Н), 6,79 (т, J = 8,8 Гц, 2Н), 6,55 (дд, J = 9,1 Гц, J = 4,5 Гц, 2Н), 6,10 (д, J = 9,7 Гц, 1Н), 5,55 (дд, J = 8,5 Гц, J = 4,5 Гц, 1Н), 5,27 (с, 2Н), 4,75 (т, J = 8,7 Гц, 1Н), 4,53-4.27 (м, 3Н), 4,08 (дд, J = 8,7 Гц, J = 4,6 Гц, 1Н), 1,47 (м, 2Н), 1,29 (м, 2Н). Приклад 2 Одержання сполуки загальної формули IV (PG = Вn) Суспензію кеталю загальної формули III (R + R = СН 2СН2, PG = Вn) (8,5 г, 12,06 ммоль) і птолуолсульфонової кислоти (0,5 г) у суміші ацетону (320 мл) і води (35 мл) нагрівали до кипіння під час перемішування. Після завершення реакції при цій температурі (ТШХ, 4 години) реакційну суміш концентрували до приблизно 1/2 об'єму і кристалізували при кімнатній температурі. Кристали відсмоктували, промивали холодним ацетоном (15 мл) і сушили при 50 °С. Темп, плавлення 176,5-178 °С. Вихід: 7,59 г, тобто, 95,3 % кетону загальної формули IV (PG = Вn). ВЕРХ: степінь діастереоізомерної чистоти 98,8 %. 1 Н-ЯМР (250 МГц, CDCI3): 7,86 (м, 2Н), 7,49-7,25 (м, 6Н), 7,21-6,99 (м, 8Н), 6,85 (d se str, J = 8,8 Гц, 2H), 6,74 (т, J = 8,8 Гц, 2Н), 6,39 дд, J = 9,0 Гц, J = 4,5 Гц, 2Н), 5,45 (дд, J = 8,5 Гц, J = 3,3 Гц, 1Н), 4,99 (с, 2Н), 4,65 (т, J = 8,6 Гц, 1Н), 4,55 (дт, J = 8,8 Гц, J = 4,5 Гц, 1Н), 4,40 (м, 1Н), 4,18 (дд, J = 8,8 Гц, J = 3,4 Гц, 1Н), 2,88 (т, J = 7,3 Гц, 2Н), 2,17 (м, 1Н), 1,80 (м,1Н). Приклад 3 Одержання сполуки формули II (PG = Вn) 2,00 г (3,03 ммоль) сполуки загальної формули IV (PG = Вn) розчиняли у 100 мл сухого ТГФ в інертній атомосфері. При кімнатній температурі і при перемішуванні до цього розчину додавали 1М розчин (R)-2-метил-СВS-оксазаборолідину у толуолі (0,75 мл, 0,25 екв.). Суміш перемішували протягом 10 хвилин і потім додавали краплями 1М розчин BH 3.Me2S у дихлорметані (4,24 мл) при кімнатній температурі протягом 1 години. Після завершення додавання, реакційну суміш перемішували протягом наступних 30 хвилин (ТШХ), потім обережно розкладали метанолом (7 мл) і після перемішування протягом 30 хвилин, розбавляли 7 UA 103020 C2 5 10 15 20 25 30 35 40 45 50 55 60 1М розчином НСІ (25 мл). Суміш екстрагували дихлорметаном (100 мл) і об'єднані органічніфракції промивали водою (40 мл), і сушили над безводним сульфатом натрію. Органічні розчинники випаровували у вакуумному випаровувачі і неочищений продукт кип'ятили з метанолом (80 мл), і потім кристалізували при кімнатній температурі протягом 3 годин. Виділені кристали відсмоктували, промивали метанолом (10 мл) і сушили при 50 °С. Вихід: 1,57 г (78,5 %) спирту загальної формули II (PG = Вn), темп, плавлення 172,5-174 °С. ВЕРХ: степінь діастереоізомерної чистоти 98,7 %. 1 Н-ЯМР (250 МГц, CDCI3): 7,44-7,28 (м, 5Н), 7,22-7,01 (м, 9Н), 6,96 (т, J = 8,8 Гц, 2Н), 6,83 (д, J = 8,6 Гц, 2Н), 6,71 (т, J = 8,6 Гц, 2Н), 6,35 (м, 2Н), 5,39 (дд, J = 8,4 Гц, J = 3,3 Гц, 1Н), 5,00 (с, 2Н), 4,84 (д, J = 9,8 Гц, 1Н), 4,61 (т, J = 8,7 Гц, 1Н), 4,58-4,45 (м, 2Н), 4,30 (т, J= 9,1 Гц, 1Н), 4,16 (дд, J=8,8H4, J= 3,3 Гц, 1Н), 1,86 (д, J = 3,5 Гц, 1Н), 1,81-1,54 (м, 3Н), 1,43 (м, 1Н). Приклад 4 Одержання сполуки формули IV (PG = Cbz) Суспензію кеталю загальної формули III (R + R = СН 2СН2СН2, PG = Cbz) (3,83 г, 5,02 ммоль) і n-толуолсульфонової кислоти (0,21 г) у суміші ацетону (120 мл) і води (22 мл) нагрівали до кипіння під час перемішування, і витримували при цій температурі протягом 3 годин (ТШХ). Реакційну суміш концентрували у ротаційному вакуумному випаровувачі до одержання приблизно 1/2 об'єму і кристалізували при кімнатній температурі. Кристали відсмоктували, промивали холодним ацетоном (5 мл) і сушили при 40 °С. Темп, плавлення 178,5-179,5 °С. Вихід: 3,44 г, тобто, 97,2 % кетону загальної формули IV (R = Cbz). ВЕРХ: степінь чистоти 98,2%. Приклад 5 До суспензії N-(4-гідроксибензиліден)-4-фтораніліну (4,30 г; 20,0 ммоль) і тритилхлориду (5,91 г, 21,2 ммоль; 1,06 екв.) у дихлорметані (65 мл) додавали діізопропілетиламін (10,1 мл, 59,0 ммоль) при перемішуванні і охолодженні до 10 °С протягом 5 хвилин. Одержаний розчин залишали нагріватись до кімнатної температури, одночасно хід реакції контролювали за допомогою ТШХ. Після завершення реакції розчин охолоджували до -5 °С і додавали розчин (S)-3-[4-[2-(4-фторфеніл)-[1,3]діоксан-2-іл]-1-оксобутил]-4-фенілоксазолідин-2-ону (6,62 г, 16,0 ммоль) у дихлорметані (15 мл) при перемішуванні протягом 5 хвилин. Потім суміш охолоджували до -32 °С, і після перемішування протягом 10 хвилин починали додавати розчин ТіСІ3(Оi-Рr) протягом 20 хвилин, який попередньо одержували шляхом змішування ТіСl4 (1М розчин у СН2СІ2; 15,5 мл, 15,5 ммоль) і Ті(Оi-Рr)4 (1,54 г, 5,17 ммоль) у СН2СІ2 (25 мл) при 10 °С, з наступним перемішуванням протягом 30 хвилин. Одержаний темний розчин перемішували при тій же температурі протягом 2,5 годин і потім додавали оцтову кислоту (4,5 мл) протягом 5 хвилин, і розчин перемішували при -30 °С протягом наступних 10 хвилин. Потім до реакційної суміші додавали 0,46М розчин цитрату мононатрію (120 мл, або навпаки, реакційну суміш виливали в цей буфер), а також метиленхлорид (50 мл). Реакційну суміш інтенсивно перемішували протягом 20 хвилин, органічну фазу відокремлювали і водну фазу екстрагували, використовуючи СН2СІ2 (50 мл). Об'єднані органічні фази промивали водою (50 мл), насиченим сольовим розчином (40 мл) і випаровували у ротаційному вакуумному випаровувачі. До одержаного після випаровування залишку додавали метанол (200 мл) і 10% водну хлорводневу кислоту (4,5 мл), і суміш перемішували при температурі 25°С протягом ночі. Відокремлений продукт відфільтровували, промивали, використовуючи ЕtOН (2x10 мл) і сушили. Одержаний продукт перекристалізовували із етилацетату (120 мл), кристали відсмоктували, промивали етилацетатом і сушили при 45°С. Темп, плавлення 210-213 °С. Вихід: 4,69 г (51,4 %) сполуки розчину IV (PG = Н). ВЕРХ: степінь діастереоізомерної чистоти 98,6 %. 1 Н-ЯМР (250 МГц, CD3SOCD3): 7,95 (дд, J = 8,6 Гц, J = 5,7 Гц, 2Н), 7,38-7,26 (м, 4Н), 7,257,05 (м, 5Н), 6,80 (т, J = 8,9 Гц, 2Н), 6,68 (д, J = 8,5 Гц, 2Н), 6,56 (м, 2Н), 6,00 (д, J = 9.4 Гц, 1Н), 5,55 (дд, J = 8,6 Гц, J = 4,5 Гц, 1Н), 4,76 (т, J = 8,6 Гц, 1Н), 4,50-4,30 (м, 2Н), 4,10 (дд, J = 8,7 Гц, J = 4,5 Гц, 1Н), 2,93 (т, J = 7,3 Гц, 2Н), 1,69 (м, 2Н). Приклад 6 Одержання сполуки загальної формули II (PG = Н) До розчину кетону загальної формули IV (PG = Н) (1,00 г, 1,59 ммоль) у ТГФ (35 мл) додавали 1М толуоловий розчин (R)-2-метил-СВS-оксазаборолідину (0,8 мл, 0,8 ммоль; 50 моль%). Після перемішування при кімнатній температурі протягом 15 хвилин додавали краплями 1М розчин BH3.Me2S у СН2СІ2 (3,2 мл, 2 моль екв.) протягом 1 години і розчин перемішували при кімнатній температурі протягом наступних 30 хвилин, хід реакції контролювали за допомогою ТШХ. Реакцію зупиняли шляхом додавання МеОН (5 мл) при температурі 0 °С і перемішуванні при тій же температурі протягом 15 хвилин. Потім додавали 8 UA 103020 C2 5 10 15 20 25 30 35 1М НСІ (5 мл) і воду (20 мл), і суміш перемішували при 0 °С протягом наступних 10 хвилин. Органічну фазу відокремлювали і водну фазу екстрагували дихлорметаном (40 і 15 мл). Об'єднані органічні фази промивали водою (15 мл) і випаровували у ротаційному вакуумному випаровувачі. Одержаний після випаровування кристалічний залишок перекристалізовували із етанолу (10 мл). Після відстоювання при кімнатній температурі протягом 1 години і при 10 °С протягом 1 години виділені кристали відсмоктували, промивали етанолом і сушили; темп. Плавлення 195-197 °С. Вихід: 0,75 г (75 %) сполуки формули II (PG = Н). ВЕРХ: степінь діастереоізомерної чистоти 98,3 %. 1 Н-ЯМР (250 МГц, CD3SOCD3): 9,29 (с, 1Н), 7,30 (д, J = 7,6 Гц, 2Н), 7,25-7,00 (м, 9Н), 6,78 (т, J = 8,9 Гц, 2Н), 6,66 (д, J = 8,4 Гц, 2Н), 6,53 (дд, J = 8,9 Гц, J = 4,5 Гц, 2Н), 5,91 (д, J = 9,2 Гц, 1Н), 5,54 (дд, J = 8,5 Гц, J = 4,3 Гц, 1Н), 5,09 (д, J = 4,4 Гц, 1Н), 4,74 (т, J = 8,7 Гц, 1Н), 4,40-4,21 (м, 3Н), 4,08 (дд, J = 8,8 Гц, J = 4,4 Гц, 1Н), 1,54-1,27 (м, 4Н). Приклад 7 Одержання сполуки загальної формули II (PG = Cbz) До суспензії спирту загальної формули II (PG = Н) (1,50 г; 2,62 ммоль) у дихлорметані (30 мл) додавали триетиламін (0,29 г, 2,88 ммоль) і DMAP (12 мг) при перемішуванні і охолодженні при 5 °С. Потім додавали краплями 50% толуоловий розчин бензилхлорформіату (1,00 мл, 2,9 ммоль, 1,1 екв.) протягом 10 хвилин. Одержаний розчин залишали нагріватись до 10 °С протягом 1 години, хід реакції контролювали за допомогою ТШХ. Після у сукупності 2 годин, до реакційної суміші додавали воду (25 мл) і відділену органічну фазу промивали, використовуючи 1N водну НСІ (10 мл), 9% водну NaHCO3 (15 мл) і знову водою (15 мл), і сушили (Na 2SO4). Одержаний після випаровування кристалічний залишок кип'ятили з метанолом (12 мл) і залишали стояти при кімнатній температурі протягом 1 години. Кристали відсмоктували, промивали метанолом і сушили. Вихід: 1,69 г сполуки формули II (PG = Cbz), тобто, 91,1%. ВЕРХ: степінь чистоти 98,3 %. Приклад 8 Одержання сполуки загальної формули IV (PG = Cbz) До суспензії кетону загальної формули IV (PG = Н) (5,97 г; 9,5 ммоль) у дихлорметані (100 мл) додавали триетиламін (1,15 г, 11,39 ммоль) і DMAP (15 мг) при перемішуванні. Потім, протягом охолодження до 5 °С, додавали краплями 50% толуоловий розчин бензилхлорформіату (3,88 г, 11,39 ммоль; 1,2 екв.) протягом 10 хвилин. Одержаний розчин залишали нагріватись до 15 °С протягом 1 години, хід реакції контролювали за допомогою ТШХ. Після у сукупності 2 годин, реакційну суміш промивали, використовуючи 1N водну НСІ (30 мл), 9% водну NaHCO3 (2х30 мл) і знову водою (40 мл), і сушили (Na 2SO4). Одержаний після випаровування кристалічний осад кип'ятили з метанолом (100 мл) протягом 30 хвилин і залишали відстоюватись при кімнатній температурі протягом 1 години. Кристали відсмоктували, промивали метанолом і сушили. Темп, плавлення 178,5-179 °С. Вихід: 6,45 г (96,4%) сполуки загальної формули II (PG = Cbz). ВЕРХ: степінь чистоти 98,6 %. 40 ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання (4S)-3-{(2R,5S)-5-(4-фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4гідроксифеніл)метил]-5-гідроксипентаноїл}-4-феніл-1,3-оксазолідин-2-онів загальної формули II F O O O HN N OPG Ph HO F 45 II , 9 UA 103020 C2 в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил або тритил, який відрізняється тим, що кетальоксазолідиди загальної формули III F O O O HN N Ph R OPG O O R 5 10 F III , в якій PG має визначене вище значення і R являє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, або R+R разом являють собою двовалентний алкіл, необов'язково заміщений 1 або 2 алкільними групами, піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 0 до 100 °C, і одержаний кетоноксазолідид загальної формули IV F O O O HN N OPG Ph O F IV 15 20 25 30 , в якій PG має визначене вище значення, відновлюють асиметричними реактивами у інертному органічному розчиннику в інтервалі температур від -30 до +40 °C. 2. Спосіб за п. 1, який відрізняється тим, що для зняття захисту як кислотний реактив використовують органічну кислоту, вибрану з групи, що включає п-толуолсульфонову кислоту, метансульфонову кислоту і оцтову кислоту, або неорганічну кислоту, вибрану з групи, що включає хлорводневу і сірчану кислоту. 3. Спосіб за п. 1 або 2, який відрізняється тим, що зняття захисту здійснюють у суміші води і водорозчинного розчинника, вибраного з групи, що включає тетрагідрофуран, ацетон, метилетилкетон, ізобутилметилкетон, метанол і етанол, в інтервалі температур від 20 до 100 °C, переважно від 50 °C до температури кипіння суміші. 4. Спосіб за п. 1, який відрізняється тим, що для відновлення як асиметричний реактив використовують боран у присутності хірального ліганду. 5. Спосіб за п. 1 або 4, який відрізняється тим, що як джерело борану використовують борановий комплекс з диметилсульфідом, тетрагідрофураном, диметиланіліном або діетиланіліном. 6. Спосіб за будь-яким з пп. 1, 4, і 5, який відрізняється тим, що як хіральний ліганд використовують 2-заміщений (R)-СВS-оксазаборолідин у кількості від 5 до 20 моль %. 10 UA 103020 C2 5 10 15 20 25 7. Спосіб за п. 6, який відрізняється тим, що 2-заміщений (R)-СВS-оксазаборолідин є (R)-2метил-СВS-оксазаборолідином або (R)-2-(о-толіл)-СВS-оксазаборолідином. 8. Спосіб за будь-яким з пп. 1, 4, 5, 6 і 7, який відрізняється тим, що відновлення здійснюють у присутності каталітичної кількості протонної кислоти або кислоти Льюїса, вибраної з групи, що включає метансульфонову кислоту, п-толуолсульфонову кислоту, трифтороцтову кислоту і ефірат трифториду бору. 9. Спосіб за будь-яким з пп. 1, 4, 5, 6, 7 і 8, який відрізняється тим, що інертний органічний розчинник вибирають з групи, що включає тетрагідрофуран, 2-метилтетрагідрофуран, третбутилметиловий етер, толуол або дихлорметан і їх суміші. 10. Спосіб за будь-яким з пп. 1 і 4-9, який відрізняється тим, що відновлення здійснюють при від -25 до -15 °С і/або при від 20 до 30 °C. 11. Спосіб за п. 1, який відрізняється тим, що при відновленні як асиметричний реактив використовують водень у присутності хірального каталізатора. 12. Спосіб за п. 1 або 11, який відрізняється тим, що як джерело водню використовують газоподібний водень, мурашину кислоту або її солі з амінами або ізопропіловий спирт. 13. Спосіб за будь-яким з пп. 1, 11 і 12, який відрізняється тим, що як хіральний каталізатор використовують комплекс перехідних металів з залізом, родієм або рутенієм або їх комбінацію у присутності хірального ліганду. 14. Спосіб за будь-яким з пп. 1 і 11-13, який відрізняється тим, що як хіральний каталізатор використовують комплекс перехідних металів з залізом, родієм або рутенієм або їх комбінацію з хіральним лігандом, вбудованим у молекулу. 15. Спосіб за будь-яким з пп. 1 і 11-14, який відрізняється тим, що хіральний каталізатор одержують in situ. 16. Спосіб за будь-яким з пп. 1 і 11-14, який відрізняється тим, що як хіральний каталізатор використовують (R)-4-ізопропіл-2-[(R)-2-(дифенілфосфіно)фероцен-1-іл]оксазоліну хлорид трифенілфосфінорутенію(ІІ). 17. Спосіб одержання О-захищених (4S)-3-{(2R)-5-(4-фторфеніл)-2-[(S)-[(4-фторфеніл)аміно](4гідроксифеніл)метил]-5-оксопентаноїл}-4-феніл-1,3-оксазолідин-2-онів загальної формули IV F O O O HN N OPG Ph O F IV 30 , в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, трет-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил, який відрізняється тим, що (S)-3-[5-(4-фторфеніл)-1,5-оксопентил]-4-фенілоксазолідин-2-ону формули V O O O N F 35 O Ph V кеталізують за допомогою реакції з одноатомним спиртом загальної формули VI 11 UA 103020 C2 R-OH VI , в якій R являє собою алкіл з 1-4 атомами вуглецю, нерозгалужений або розгалужений, у присутності прискорювача в інтервалі температур від 10 до 100 °C (стадія 1), одержаний кетальоксазолідид загальної формули VII R R O O O O N F 5 O Ph VII , в якій R має визначене вище значення, піддають взаємодії з захищеним іміном загальної формули VIII O PG N F 10 VIII , в якій PG має визначене вище значення, у присутності кислоти Льюїса і сильної органічної основи в інертному органічному розчиннику в інтервалі температур від -40 до 0 °C (стадія 2), і одержаний кетальоксазолідид загальної формули III F O O O HN N Ph R OPG O O R F III 15 20 25 , в якій R і PG мають визначені вище значення, піддають зняттю захисту за допомогою дії кислотних реактивів у суміші води і водорозчинного розчинника в інтервалі температур від 10 до 100 °C (стадія 3). 18. Спосіб за п. 17, який відрізняється тим, що як прискорювач на стадії 1 використовують сильну мінеральну або органічну кислоту, вибрану з групи, що включає сірчану кислоту і птолуолсульфонову кислоту, у присутності агента, що видаляє воду, вибраного з групи, що включає молекулярні сита і триалкілортоформіат. 19. Спосіб за п. 17 або 18, який відрізняється тим, що на стадії 1 реакцію здійснюють при температурі від 50 °C до температури кипіння суміші. 20. Спосіб за п. 17, який відрізняється тим, що на стадії 2 як кислоту Льюїса використовують iпропоксидтрихлорид титану або n-бутоксидтрихлорид титану у кількості від 1 до 2 еквівалентів і як сильну органічну основу використовують діізопропілетиламін у кількості від 2 до 5 еквівалентів. 12 UA 103020 C2 5 10 15 20 21. Спосіб за п. 17 або 20, який відрізняється тим, що на стадії 2 використовують кислоту Льюїса у кількості від 1,1 до 1,4 еквівалента і діізопропілетиламін у кількості від 2,1 до 4 еквівалентів. 22. Спосіб за будь-яким з пунктів 17, 20 і 21, який відрізняється тим, що на стадії 2 інертні органічні розчинники вибирають з групи, що включає дихлорметан, дихлоретан, толуол, тpeтбутилметиловий етер і їх суміші, в інтервалі температур від -40 до 0 °C, переважно при від -35 до -15 °C. 23. Спосіб за будь-яким з пунктів 17 і 20-22, який відрізняється тим, що імін загальної формули VII одержують in situ на стадії 2 за допомогою реакції N-(4-гідроксибензиліден)-4-фтораніліну (VII, PG=Н) з PG-X захисними реактивами. 24. Спосіб за п. 17, який відрізняється тим, що як кислотний реактив на стадії 3 використовують органічну кислоту, вибрану з групи, що включає п-толуолсульфонову кислоту, метансульфонову кислоту і оцтову кислоту, або неорганічну кислоту, вибрану з групи, що включає хлорводневу і сірчану кислоти. 25. Спосіб за п. 17 або 24, який відрізняється тим, що зняття захисту на стадії 3 здійснюють у суміші води і водорозчинного розчинника, вибраного з групи, що включає тетрагідрофуран, 2метилтетрагідрофуран, ацетон, ізобутилметилкетон, метанол, етанол і їх суміші, переважно у інтервалі температур від 20 °C до температури кипіння суміші. 26. Спосіб за будь-яким з пунктів 17, 24 і 25, який відрізняється тим, що зняття захисту на стадії 3 здійснюють, використовуючи каталітичну п-толуолсульфонову кислоту у водному ацетоні, хлорводневу кислоту у метанолі або етанолі або оцтову кислоту у водному тетрагідрофурані. 27. Кетоноксазолідиди загальної формули IV F O O O HN N OPG Ph O F IV 25 30 , в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил. 28. Застосування кетоноксазолідидів загальної формули IV, як визначено у пункті 27, у синтезі езетимібу. 29. Кетоноксазолідид формули IVa F O O O HN N O O Ph O O F IVa . 30. Кетоноксазолідид формули IVb 13 UA 103020 C2 F O O O HN N O Ph Si O F IVb . 31. Кетоноксазолідид формули IVc F O O O HN N O Ph O F IVc . 32. Кетоноксазолідид формули IVd F O O O HN N OH Ph O F 5 IVd . 33. (S)-Спирти оксазолідидів загальної формули II 14 UA 103020 C2 F O O O HN N OPG Ph HO F II 5 , в якій PG являє собою водень або гідроксил-захисну групу, вибрану з групи, що включає триметилсиліл, тpeт-бутилдиметилсиліл, бензилоксикарбоніл, трет-бутоксикарбоніл, бензил, бензгідрил і тритил. 34. Застосування (S)-спиртів оксазолідидів загальної формули II, як визначено у пункті 33, у синтезі езетимібу. 35. Спирт оксазолідиду формули ІІа F O O O HN N O O O Ph HO F IIa . 36. Спирт оксазолідиду формули ІІb F O O O HN N O Ph Si HO F 10 IIb . 37. Спирт оксазолідиду формули ІІс 15 UA 103020 C2 F O O O HN N O Ph HO F IIc . 38. Спирт оксазолідиду формули ІІd F O O O HN N OH Ph HO F IId . Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюIntermediates for the preparation of (3r, 4s)-1-(4-fluorophenyl)-3-[(3s)-3-(4-fluorophenyl)-3-hydroxypropyl)]-4-(4-hydroxyphenyl)-2-azetidinone
Автори англійськоюStepankova, Hana, Hajicek, Josef, Slavikova Marketa, Zezula, Josef
Автори російськоюСлавикова Маркета
МПК / Мітки
МПК: C07D 263/26, C07D 205/08
Мітки: сполуки, 3r,4s)-1-(4-фторфеніл)-3-[(3s)-3-(4-фторфеніл)-3-гідроксипропіл]-4-(4-гідроксифеніл)-2-азетидинону, одержання, проміжні
Код посилання
<a href="https://ua.patents.su/18-103020-promizhni-spoluki-dlya-oderzhannya-3r4s-1-4-ftorfenil-3-3s-3-4-ftorfenil-3-gidroksipropil-4-4-gidroksifenil-2-azetidinonu.html" target="_blank" rel="follow" title="База патентів України">Проміжні сполуки для одержання (3r,4s)-1-(4-фторфеніл)-3-[(3s)-3-(4-фторфеніл)-3-гідроксипропіл]-4-(4-гідроксифеніл)-2-азетидинону</a>
Попередній патент: Курильний виріб (варіанти), паперова обгортка для курильного виробу, яка має оброблені ділянки для зниження характеристик здатності до займання, та спосіб її формування
Наступний патент: Система і спосіб обслуговування безпечної передачі коротких повідомлень і передачі мультимедійних повідомлень (варіанти)
Випадковий патент: Спосіб хірургічного лікування хронічних тріщин прямої кишки