Птеридинові сполуки для лікування псоріазу
Номер патенту: 72590
Опубліковано: 15.03.2005
Автори: Гардінер Стюарт, Уолтерс Ян, Боннерт Роджер, Хант Фрейзер
Формула / Реферат
1. Сполука формули (I) або її фармацевтично прийнятна сіль або сольват:
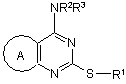 (І),
(І),
в якій:
А являє собою групу формули (а) або (b):
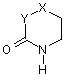 (a),
(a),
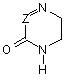 (b),
(b),
R1 являє собою С3-С7 карбоциклічну, C1-C8 алкільну, C2-C6 алкенільну або C2-C6 алкінільну групу, останні чотири групи необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SО2R10, -SО2NR5R6, -NR8SО2R10, арильну або гетероарильну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR10, -SR10, -SО2R10, -SО2NR5R6, -NR8SО2R10, C1-C6 алкільної або трифторметильної груп;
один з R2 і R3 являє собою водень, а інший являє собою C3-C4 алкіл, заміщений однією або більше гідроксильними групами;
R4 являє собою водень, C1-C6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR11 і -NR12R13;
R5 і R6 незалежно являють собою атом водню або C1-C6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR14 і -NR15R16, -CONR15R16, -NR15COR16, -SО2NR15R16, NR15SO2 R16
або
R5 і R6 разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членну насичену гетероциклічну кільцеву систему, що необов'язково включає додатковий гетероатом, вибраний з атомів кисню і азоту, вказана кільцева система може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з фенілу, -OR14, -COOR14, -NR15R16, -CONR15R16, -NR15COR16, -SО2NR15R16, -NR15SО2R16 або C1-C6 алкілу, необов'язково заміщеного одним або більше замісниками, незалежно вибраними з атомів галогену і груп -NR15R16 і -OR17;
R10 являє собою C1-C6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR17 і -NR15R16;
X являє собою О, S або NR8;
Y являє собою CR18R19;
Z являє собою CR20, де R20 являє собою C1-C6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR21 і -NR22R23, або ацильну групу, вибрану з CО2R21 або CONR22R23; і
кожний з R7, R8, R9, R11, R12, R13, R14, R15, R16, R17, R18, R19, R21, R22 і R23 незалежно являють собою атом водню, C1-C6 алкільну або фенільну групу.
2. Сполука за п. 1, в якій R1 являє собою необов'язково заміщену бензильну групу.
3. Сполука за п. 1 або 2, в якій один з R2 і R3 являє собою водень, а інший являє собою C3-C4 алкіл, заміщений однією або більше гідроксильними групами.
4. Сполука за будь-яким з пп. 1-3, в якій один з R2 і R3 являє собою водень, а інший являє собою СН(СН3)СН2ОН, CH(Et)CH2OH, С(CH3)2CH2OH або СН(СН2ОН)2.
5. Сполука за будь-яким з пп. 1-3, в якій один з R2 і R3 являє собою водень, а інший являє собою СН(СН3)СН2ОН.
6. Сполука за будь-яким з пп. 3-5 у формі (R)-ізомеру.
7. Сполука за будь-яким з пп. 1-6, в якій А являє собою групу формули (b), а Z = CR20.
8. Сполука за п. 7, в якій R20 являє собою водень.
9. Сполука за п. 1, вибрана з наступних сполук:
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[(фенілметил)тіо]-6Н-піримідо[5,4-b][1,4]тіазин-7(8Н)он;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон;
(2R)-2-[[2-[[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4-птеридиніл]аміно]пропанамід;
2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон;
2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон;
1,1-диметилетиловий ефір [(2R)-2-[[2-[[(3-хлор-2-фторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4-птеридиніл]аміно]пропіл]карбамінової кислоти;
моногідрохлорид 4-[[(1R) -2-аміно-1-метилетил]аміно]-2-[[(3-хлор-2-фторфеніл)метил]тіо]-7(8Н)-птеридинону;
2-[[(3-хлор-4-метоксифеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон;
монотрифторацетат 4-[(2-аміноетил)аміно]-2-[[(3-хлор-4-метоксифеніл)метил]тіо]-7(8Н)-птеридинону;
2-[[(2-фтор-4-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2-фтор-3-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(3-фтор-2-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[[4-(дифторметокси)феніл]метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(4-гідроксифеніл)метил]тіо]-7(8Н)-птеридинон;
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(3-метилфеніл)метил]тіо]-7(8Н)-птеридинон;
2-[(1,3-бензодіоксол-4-ілметил)тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2,4-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(3-хлорфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон;
4-[[2-гідрокси-1-(гідроксиметилетил)]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон;
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(5-метил-2-фураніл)метил]тіо]-7(8Н)-птеридинон;
2-[[(2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(2-тієніл)метил)тіо]-7(8Н)-птеридинон;
2-[[(2-фторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметилетил)]аміно]-7(8Н)-птеридинон;
4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-2-[(2-тієнілметил]тіо]-7(8Н)-птеридинон;
2-[[(2-фтор-5-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон;
2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон;
4-[(2-аміноетил)аміно]-2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-7(8Н)-птеридинон;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)-1-метилетил]аміно]-7(8Н)-птеридинон;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-метил-7(8Н)-птеридинон;
етиловий ефір 2-[[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7-оксо-6-птеридин карбонової кислоти;
2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-(трифторметил)-7(8Н)-птеридинон;
натрієва сіль 2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинону;
2-[(2,3-дифторбензил)тіо]-4-(етиламіно)-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-(ізопропіламіно)-7(8Н)-птеридинон;
(+/-)-4-(втор-бутиламіно)-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон;
2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)ацетамід;
(+/-)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон;
(S)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон;
(+/-)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон;
(R)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(3-гідроксипропіл)аміно]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксіетил)(метил)аміно]-7(8Н)-птеридинон;
3-[{2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}(метил) аміно]пропаннітрил;
(R)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]амін}-7(8Н)-птеридинон;
(S)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(4-(гідроксибутил)аміно]-7(8Н)-птеридинон;
(+/-)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1,1-диметилетил)аміно]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[етил(2-гідроксіетил)аміно]-7(8Н)-птеридинон;
(+/-)-4-[(3-аміно-2-гідроксипропіл)аміно]-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон;
(+/-)-2-[(2,3-дифторбензил)тіо]-4-[(1,3-диметилбутил)аміно]-7(8Н)-птеридинон;
(1R,2R)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксициклопентил)аміно]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(5-гідроксипентил)аміно]-7(8Н)-птеридинон;
(+/-)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)бутил]аміно}-7(8Н)-птеридинон;
(+/-)-метил 2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл} аміно)пропаноат;
2-[(2,3-дифторбензил)тіо]-4-[(3-гідрокси-2,2-диметилпропіл)аміно]-7(8Н)-птеридинон;
(1R,2R)-2-[(2,3-дифторбензил)тіо]-4-{[2-гідрокси-1-(гідроксиметил)пропіл] аміно}-7(8Н)-птеридинон;
4-[біс(2-гідроксіетил)аміно]-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-{[2-(2-гідроксіетоксі)етил]аміно}-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(2,2-диметоксіетил)аміно]-7(8Н)-птеридинон;
4-{[2-(діетиламіно)етил]аміно}-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон;
(S)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон;
(R)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)-3-метилбутил]аміно}-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-[(6-гідроксигексил)аміно]-7(8Н)-птеридинон;
2-[(2,3-дифторбензил)тіо]-4-{[3-(диметиламіно)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон;
(S)-етил 2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)-3-гідроксипропаноат;
і їх фармацевтично прийнятних солей і сольватів.
10. Спосіб одержання сполуки формули (I) за п. 1, який включає дію на сполуку формули (IIА):
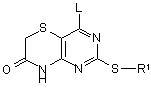 (IIA) ,
(IIA) ,
де R1 визначений в формулі (I) або являє собою його захищене похідне, а L являє собою групу, що видаляється, аміном HNR2R3, і далі, необов`язково, в будь-якому порядку:
видалення будь-яких захисних груп,
одержання фармацевтично прийнятної солі.
11. Спосіб одержання сполуки формули (I) за п. 1, який включає дію на сполуку формули (IIB):
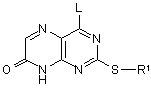 (IIB),
(IIB),
де R1 визначений в формулі (I) або являє собою його захищене похідне, а L являє собою групу, що видаляється, аміном HNR2R3, і далі, необов`язково, в будь-якому порядку:
видалення будь-яких захисних груп,
одержання фармацевтично прийнятної солі.
12. Спосіб одержання сполуки формули (I) за п. 1, який включає дію на сполуку формули (IIC):
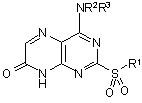 (IIC),
(IIC),
де R1, R2 і R3 визначені в формулі (I) або являють собою їх захищені похідні, тіолом R1SH, і далі, необов`язково, в будь-якому порядку:
видалення будь-яких захисних груп,
одержання фармацевтично прийнятної солі.
13. Спосіб одержання сполуки формули (I) за п. 1, який включає дію на сполуку формули (IID):
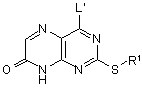 (IID),
(IID),
де R1 визначений в формулі (I) або являє собою його захищене похідне, а L' являє собою групу, що видаляється, аміном HNR2R3, і далі, необов'язково, в будь-якому порядку:
видалення будь-яких захисних груп,
одержання фармацевтично прийнятної солі.
14. Проміжна сполука формули (ІІА) або (IIB), або (ІІС), або (IID) за пп. 10-13.
15. Фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, або сольват за будь-яким з пп. 1-9, в поєднанні з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм.
16. Спосіб виготовлення фармацевтичної композиції за п. 15, який включає змішування сполуки формули (I) або її фармацевтично прийнятної солі, або сольвату за будь-яким з пп. 1-9 з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм.
17. Сполука формули (I) або її фармацевтично прийнятна сіль, або сольват за будь-яким з пп. 1-9 для застосування в терапії.
18. Застосування сполуки формули (I) або її фармацевтично прийнятної солі, або сольвату за будь-яким з пп. 1-9 для виробництва лікарського засобу для застосування в терапії.
19. Спосіб лікування хемокін-опосередкованого захворювання, при якому хемокін зв'язується з одним або більше хемокіновими рецепторами, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (IA) або її фармацевтично прийнятної солі, або сольвату:
 (ІА),
(ІА),
в якій:
А являє собою групу формули (а) або (b):
 (a),
(a),
 (b),
(b),
R1 являє собою С3-С7 карбоциклічну, С1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SО2R10, -SО2NR5R6, -NR8SO2R10, арильну або гетероарильну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR10, -SR10, -SО2R10, -SО2NR5R6, -NR8SО2R10, С1-С6 алкільної або трифторметильної груп;
R2 являє собою водень або С3-С7 карбоциклічну групу, С1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SО2R10, -SО2NR5R6 або NR8SО2R9;
R3 являє собою водень або С2-С6 алкіл, необов'язково заміщений одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR10 і –NR11R12;
або
R2 і R3 являють собою 3-8-членне кільце, що необов'язково містить один або більше атомів, вибраних з О, S, NR8, і саме необов'язково заміщене C1-С3 алкілом, галогеном або OR4;
R4 являє собою водень, С1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR11 і -NR12R13;
R5 і R6 незалежно являють собою атом водню або С1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR14 і -NR15R16, -CONR15R16, -NR15COR16, -SО2NR15R16, NR15SО2R16
або
R5 і R6 разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членну насичену гетероциклічну кільцеву систему, що необов'язково включає додатковий гетероатом, вибраний з атомів кисню і азоту, вказана кільцева система може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з фенілу, -OR14, -COOR14, -NR15R16, -CONR15R16, -NR15COR16, -SО2NR15R16, -NR15SO2R16 або С1-С6 алкілу, необов'язково заміщеного одним або більше замісниками, незалежно вибраними з атомів галогену і груп -NR15R16 і -OR17;
R10 являє собою С1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR17 і -NR15R16;
X являє собою О, S або NR8;
Y являє собою CR18R19;
Z являє собою CR20, де R20 являє собою С1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR21 і -NR22R23, або ацильну групу, вибрану з CО2R21 або CONR22R23; і
кожний з R7, R8, R9, R11, R12, R13, R14, R15, R16, R17, R18, R19, R21 R22 і R23 незалежно являють собою атом водню, С1-С6 алкільну або фенільну групу.
20. Спосіб за п. 19, при якому хемокіновий рецептор належить до підродини хемокінових рецепторів СХС.
21. Спосіб за п. 19 або 20, при якому хемокіновий рецептор являє собою рецептор CXCR2.
22. Спосіб лікування запального захворювання у пацієнта, який страждає вказаним захворюванням або який входить до групи ризику розвитку вказаного захворювання, що включає введення пацієнту терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, або сольвату за будь-яким з пп. 1-9.
23. Спосіб за п. 22, при якому захворюванням є псоріаз, захворювання, при якому ангіогенез пов'язаний з підвищеними рівнями хемокіну CXCR2, або ХОЗЛ.
24. Спосіб за п. 22, при якому захворюванням є псоріаз.
25. Застосування сполуки формули (I):
 (І),
(І),
в якій:
А являє собою групу формули (а) або (b):
 (a),
(a),
 (b),
(b),
де R1 являє собою бензил, необов'язково заміщений одним або більше замісниками, незалежно вибраними з атомів галогенів, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR10, -SR10, -SО2R10, -SО2NR5R6, -NR8SО2R10, С1-С6 алкільної або трифторметильної груп;
R2 являє собою водень або С3-С7 карбоциклічну групу, С1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SО2NR5R6 або NR8SО2R9;
R3 являє собою водень або С2-С6 алкіл, необов'язково заміщений одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR10 і –NR11R12;
або
R2 і R3 являють собою 3-8-членне кільце, що необов'язково містить один або більше атомів, вибраних з О, S, NR8, і саме необов'язково заміщене С1-С3 алкілом, галогеном або OR4;
R4 являє собою водень, С1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR11 і -NR12R13;
R5 і R6 незалежно являють собою атом водню або С1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR14 і -NR15R16, -CONR15R16, -NR15COR16, -SО2NR15R16, NR15SО2R16
або
R5 і R6 разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членну насичену гетероциклічну кільцеву систему, що необов'язково включає додатковий гетероатом, вибраний з атомів кисню і азоту, вказана кільцева система може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з фенілу, -OR14, -COOR14, -NR15R16, -CONR15R16, -NR15COR16, - SО2NR15R16, -NR15SО2R16 або С1-С6 алкілу, необов'язково заміщеного одним або більше замісниками, незалежно вибраними з атомів галогену і груп -NR15R16 і -OR17;
R10 являє собою С1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR17 і -NR15R16;
X являє собою О, S або NR8;
Y являє собою CR18R19;
Z являє собою CR20, де R20 являє собою С1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісниками, незалежно вибраними з атомів галогенів, фенілу, -OR21 і - NR22R23, або ацильну групу, вибрану з CО2R21 або CONR22R23;
і
кожний з R7, R8, R9, R11, R12, R13, R14, R15, R16, R17, R18, R19, R21, R22 і R23 незалежно являють собою атом водню, С1-С6 алкільну або фенільну групу, для виробництва лікарського засобу для лікування хемокін-опосередкованого захворювання.
Текст
Даний винахід відноситься до визначених гетероциклічних сполук, способів і проміжних сполук, які використовуються при їх одержанні, фармацевтичних композицій, які містять їх, і їх застосування в терапії. Хемокіни грають важливу роль в імунних і запальних відповідях при різних захворюваннях і порушеннях, включаючи астму і алергічні захворювання, а також при аутоімунних патологічних процесах, таких як ревматоїдний артрит і атеросклероз. Вказані секретовані малі молекули являють собою суперсімейство білків 8-14кДа, що збільшується, які характеризуються консервативним мотивом цистеїну. У цей час суперсімейство хемокінів включає три групи, що демонструють характерні структурні мотиви, сімейства С-Х-С, С-С і С-Х3-С. Сімейства С-Х-С і С-С мають схожу послідовність і відрізняються один від одного на основі єдиного включення амінокислоти між NH-проксимальною парою залишків цистеїну. Сімейство С-Х3-С відрізняється від двох інших сімейств на основі потрійного амінокислотного включення між NH-проксимальною парою залишків цистеїну. Хемокіни С-Х-С включають декілька могутніх хемоатрактантів і активаторів нейтрофілів, таких як інтерлейкін-8 (IL-8) і нейтрофіл-активуючий пептид 2 (NAP-2). Хемокіни С-С включають потужні хемоатрактанти моноцитів і лімфоцитів, але не нейтрофілів. Приклади включають хемотакеичні білки людських моноцитів 1-3 (МСР-1, МСР-2 і МСР-3), RANTES (Регульовані при активації, експресовані нормальними Т-клітинами і секретовані), еотаксин і запальні білки макрофагів 1a і 1b (ΜΙΡ-1a і ΜΡ-1b). Хемокін С-Х3-С (відомий також як фракталкін) являє собою могутній хемоатрактант і активатор мікроглії в центральній нервовій системі (ЦНС), а також моноцитів, Т-клітин, НК-клітин і огрядних клітин. Дослідження показали, що дії хемокінів опосередковуються підродинами зв'язаних з G-білком рецепторів, серед яких вказані рецептори означаються CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 і CCR11 (для сімейства С-С); CXCR1, CXCR2, CXCR3, CXCR4 і CXCR5 (для сімейства СХ-С) і CX3CR1 для сімейства С-Х3-С. Вказані рецептори являють собою хороші мішені для розробки лікарських засобів, оскільки агенти, які модулюють дані рецептори, були б придатні для лікування порушень і захворювань, згаданих вище. Даний винахід відноситься до сполук формули (І) і їх фармацевтично прийнятних солей або сольватів: в якій: А являє собою групу формули (а) або (b) R1 являє собою С3-С7 карбоциклічну, C1-C8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, OR4, - NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R10, арильну або гетероарильну групу, кожна з яких може бути необов'язково заміщена одним або більше замісників, незалежно вибраних з атомів галогенів, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR10, -SR10, -SO2R10, SO2NR5R6, -NR8SO2R10, C1-С6 алкільної або трифторметильної груп; R являє собою водень або С3-С7 карбоциклічну групу, С1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи можуть бути необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, SO2NR5R6 aбo NR8SO2R9; R3 являє собою водень або С2-С6 алкіл, необов'язково заміщений одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR10 і –NR11R12; або R2 і R3 являють собою 3-8-членне кільце, що необов'язково містить один або більше атомів, вибраних з О, S, NR і саме необов'язково заміщене C1-С3 алкілом, галогеном або OR4; R4 являє собою водень, C1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR11 і -NR12R13; R5 і R6 незалежно являють собою атом водню або C1-С6 алкільну або фенільну групу, з яких дві останні можуть бути необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR14 і -NR15R16, -GONR15R16, -NR15COR16, -SO2NR15R16, NR15SO2R16 або R5 і R6 разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членну насичену гетероциклічну кільцеву систему, що необов'язково включає додатковий гетероатом, вибраний з атомів кисню і азоту, вказана кільцева система може бути необов'язково заміщена одним або більше замісників, незалежно вибраних з фенілу, -OR14, -COOR14, -NR15R16, -CONR15R16, -NR15COR16, -SO2NR15R16, -NR15SO2R16 або C1-С6 алкілу, необов'язково заміщеного одним або більше замісників, незалежно вибраних з атомів галогену і груп -NR15R16 і -OR17; R10 являє собою C1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR17 і -NR15R16; X являє собою О, S або NR8; Υ являє собою CR18R19; Ζ являє собою CR20, де R20 являє собою C1-С6 алкільну або фенільну групу, кожна з яких може бути необов'язково заміщена одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR21 і –NR22R23, або ацильну групу, вибрану з CO2R21 або CONR22R23; і кожний з R7, Rs, R9, R11, R12, R13, R14, R15, R16, R17, R18, R19, R21, R22 і R23 незалежно являють собою атом водню, C1-С6 алкільну або фенільну групу. У контексті даного опису, якщо не вказане інше, алкільна або алкенільна група, або алкільна або алкенільна частина в замісній групі може бути лінійною або розгалуженою. Арильні групи включають феніл і нафтил. Гетероарил визначений як 5- або 6-членне ароматичне кільце, що необов'язково містить один або більше гетероатомів, вибраних з N, S, О. Приклади включають піридин, піримідин, тіазол, оксазол, пиразол, імідазол, фуран. Визначені сполуки формули (І) здатні існувати в стереоізомерних формах. Потрібно розуміти, що даний винахід охоплює всі геометричні і оптичні ізомери сполук формули (І) і їх суміші, включаючи рацемати. Таутомери і їх суміші також складають об'єкт даного винаходу. Зручно, якщо група R1 являє собою С3-С7 карбоциклічну, C1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи можуть бути необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R10, арильну або гетероарильну групу, кожна з яких може бути необов'язково заміщена одним або більше замісників, незалежно вибраних з атомів галогенів, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR10, -SR10, -SO2R10, SO2NR5R6, -NR8SO2R10, C1-С6 алкільної або трифторметильної груп. Замісники можуть бути присутніми на будь-якому зручному положенні R1, арильної або гетероарильної груп, включаючи атоми азоту гетероарильних груп. Особливими перевагами володіють сполуки формули (І), в яких R1 являє собою необов'язково заміщену бензильну групу. Більш переважно, R1 являє собою бензил або бензил, заміщений одним або більше C1-С6 алкілом, C1-С6 алкокси або атомами галогенів, ще більш переважно, бензил, заміщений двома атомами фтору, і, найбільш переважно, бензил, заміщений двома атомами фтору, які знаходяться в орто- і мета-положенні відносно СН2-групи бензилу. Зручно, якщо R2 являє собою водень або С3-С7 карбоциклічну групу, C1-С8 алкільну, С2-С6 алкенільну або С2-С6 алкінільну групу, останні чотири групи можуть бути необов'язково заміщені одним або більше замісників, незалежно вибраних з атомів галогенів, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6 або -NR8SO2R9, a R3 являє собою водень або С2-С6 алкіл, необов'язково заміщений одним або більше замісників, незалежно вибраних з атомів галогенів, фенілу, -OR10 і -NR11R12; або R2 і R3 являють собою 3-8-членне кільце, що необов'язково містить один або більше атомів, вибраних з О, S, NR8 і саме необов'язково заміщене C1-С3 алкілом, галогеном або OR4; Переважно, один з R2 і R3 являє собою водень, а інший являє собою С3-С4 алкіл, заміщений однією або більш гідроксильними групами. Більш переважно, один з R2 і R3 являє собою водень, а інший являє собою СН(СН3)СН2ОН, CH(Et)CH2OH, С(СН3)2СН2ОН або СН(СН2ОН)2 . Коли один з R2 і R3 являє собою водень, а інший являє собою СН(СН3)СН2ОН або CH(Et)CH2OH, сполуки формули (І), які одержуються, переважно знаходяться у формі (R) ізомеру. Найбільш переважно, один з R2 і R3 являє собою водень, а інший являє собою СН(СН3)СН2ОН. Коли А являє собою групу формули (а), X являє собою О, S або NR8. Коли X являє собою NR8, то R8 переважно являє собою водень або C1-С6 алкіл. Переважно, X являє собою S. Зручно, якщо Υ являє собою CR18R19, переважно, Υ являє собою СН2. Переважно, А являє собою групу формули (b), a Z являє собою CR20, найбільш переважно, Ζ являє собою СН. Особливо переважні сполуки за даним винаходом включають: 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[(фенілметил)тіо]-6Н-піримідо[5,4-b][1,4]тіазин-7(8Н)-он 2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(2,3-дифторфеніл)метил]тio]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон 2-[[(2,3-дифторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон (2R)-2-[[2-[[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4-птеридиніл]аміно]пропанамід 2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-пдтеридинон 2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон 2-[[(3-хлор-2-фторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон 1,1-диметил етиловий ефір (2R)[-2-[[2-[(3-хлор-2-фторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4птеридиніл]аміно]пропіл]карбамінової кислоти моногідрохлорид 4-[[(1R)[-2-аміно-1-метилетил]аміно]-2-[[(3-хлор-2-фторфеніл)метил]тіо]-7(8Н)птеридинону 2-[[(3-хлор-4-метоксифеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон монотрифторацетат 4-[(2-аміноетил)аміно]-2-[[(3-хлор-4-метоксифеніл)метил]тіо]-7(8Н)-птеридинону 2-[[(2-фтор-4-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(2-фтор-3-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(3-фтор-2-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[[4-(дифторметокси)феніл]метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(4-гідроксифеніл)метил]тіо]-7(8Н)-птеридинон 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(3-метилфеніл)метил]тіо]-7(8Н)-птеридинон 2-[(1,3-бензодіоксол-4-ілметил)тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8H)-птеридинон 2-[[(2,4-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(3-хлорфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон 4-[[2-гідрокси-1-(гідроксиметилетил]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(5-метил-2-фураніл)метил]тіо]-7(8Н)-птеридинон 2-[[(2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 4-[[(1R)-2-гідрокси-1-метилетил]аміно]-2-[[(2-тієніл)метил)тіо]-7(8Н)-птеридинон 2-[[(2-фторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гiдроксиметилетил]аміно]-7(8Н)-птеридинон 4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-2-[(2-тієнілметил)тіо]-7(8Н)-птеридинон 2-[[(2-фтор-5-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-етилетил]аміно]-7(8Н)-птеридинон 2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)птервдинон 2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон 4-[(2-аміноетил)аміно]-2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-7(8Н)-птеридинон 2-[[(2,3-дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-метил-7(8Н)-птеридинон етиловий ефір 2-[(2,3-дифторфеніл)[метил]тіо]-7,8-дигідро-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7-оксо-6птеридинкарбонової кислоти 2-[[(2,3-дифторфеніл)метил]тіо]4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-(трифторметил)-7(8Н)-птеридинон натрієва сіль 2-[(2,3-Дифторфеніл)метил]тіо]4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинону 2-[(2,3-дифторбензил)тіо]-4-(етиламіно)-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-(ізопропіламіно)-7(8Н)-птеридинон (+/-)-4-(втор-бутиламіно)-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон 2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)ацетамід (+/-)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон (S)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон (+/-)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон (R)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(3-гідроксипропіл)аміно]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксіетил)(метил)аміно]-7(8Н)-птеридинон 3-[{2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}(метил)аміно]пропаннітрил (R)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон (S)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)прошл]аміно}-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(4-гідроксибутил)аміно]-7(8Н)-птеридинон (+/-)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(2-гідрокси-1,1-диметилетил)аміно]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[етил(2-гідроксіетил)аміно]7(8Н)-птеридинон (+/-)-4-[(3-аміно-2-гідроксипропіл)аміно]-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон (+/-)-2-[(2,3-дифторбензил)тіо]-4-[(1,3-диметилбутил)аміно]-7(8Н)-птеридинон (1R,2R)-2-[(2,3-дифторбензил)тіо]-4-[(2-гідроксициклопентил)аміно]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(5-гідроксипентил)аміно]-7(8Н)-птеридинон (+/-)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)бутил]аміно}-7(8Н)-птеридинон (+/-)-метил-2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)пропаноат 2-[(2,3-дифторбензил)тіо]-4-[(3-гідрокси-2,2-диметилпропіл)аміно]-7(8Н)-птеридинон (1R,2R)-2-[(2,3-дифторбензил)тіо]-4-{[2-гідрокси-1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон 4-[біс(2-гідроксіетил)аміно]-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-{[2-(2-гідроксіетокси)етил]аміно}-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(2,2-диметоксіетил)аміно]-7(8Н)-птеридинон 4-{[2-(диетиламіно)етил]аміно}-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон (S)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон (R)-2-[(2,3-дифторбензил)тіо]-4-{[1-(гідроксиметил)-3-метилбутил]аміно}-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-[(6-гідроксигексил)аміно]-7(8Н)-птеридинон 2-[(2,3-дифторбензил)тіо]-4-{[3-(диметиламіно)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон (S)-етил-2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)-3-гідроксипропаноат і їх фармацевтично прийнятні солі і сольвати. Даний винахід відноситься також до способу одержання сполуки формули (І), який включає: (а) дію на сполуку формули (IIА): де R1 визначений в формулі (І) або являє собою його захищене похідне, a L являє собою групу, що видаляється, аміном HNR2R3, або (b) дію на сполуку формули (ІІВ): де R1 визначений в формулі (І) або являє собою його захищене похідне, a L являє собою групу, що видаляється, аміном HNR2R3, або (c) дію на сполуку формули (ІІС): де R1, R2 і R3 визначені в формулі (І) або являють собою їх захищені похідні, тіолом R1SH, або (d) дію на сполуку формули (IID): де R1 визначений в формулі (І) або являє собою його захищене похідне, а L’ являє собою групу, що видаляється, аміном HNR2R3, і далі, необов'язково, після процесів (а), (b), (с) або (d) і в будь-якому порядку: - видалення будь-яких захисних груп - одержання фармацевтично прийнятної солі. Взаємодію сполук формули (IIА) і (IIВ) з аміном HNR2R3 можна здійснювати в розчиннику, такому як Nметилпіролідинон, при температурі від 0°С до 150°С. Відповідні групи, що видаляються, включають галоген, особливо хлор або бром. Взаємодію сполук (IIС) з тіолом R1SH можна здійснювати в розчиннику, такому як N-метилпіролідинон, з використанням основи, такої як трет-бутоксид калію, при температурі від 0°С до 150°С. Взаємодію сполук формули (IID) з аміном HNR2R3 можна здійснювати з використанням чистого аміну HNR2R3 або в розчиннику, такому як 1-метилімідазол, при температурі від 50°С до 200°С, за допомогою або без допомоги мікрохвильового випромінювання. Сполуки формули (IIА), де R1 визначений в формулі (І), a L являє собою групу, що видаляється, таку як хлор, можна одержати дією на сполуку формули (ІІА), де R1 визначений вище, a L являє собою гідроксильну групу, галогенуючим агентом, таким як оксихлорид фосфору. Реакцію можна здійснювати при кипінні із зворотним холодильником в присутності Ν,Ν-диметиланіліну. Сполуки формули (IIА), де R1 визначений в формулі (І), a L являє собою гідроксильну групу, можна одержати дією кислоти на сполуку формули (III), де R1 і L визначені вище. Відповідні кислоти включають птолуолсульфонову кислоту, а реакцію можна здійснювати в розчиннику, такому як толуол, при кипінні із зворотним холодильником. Сполуки формули (III), де R1 визначений в формулі (І), a L являє собою гідроксильну групу, можна одержати дією на сполуку формули (IV), де R1 і L визначені вище, відновлюючим агентом в присутності етилбромацетату. Реакцію можна здійснювати в розчиннику, такому як етанол, при кімнатній температурі, з використанням відновлюючого агента, такого як боргідрид натрію. Сполуки формули (IV), де R1 визначений в формулі (І), a L являє собою гідроксильну групу, можна одержати дією на сполуку формули (V), де R1 і L визначені вище, тіоціанатом металу в присутності брому. Реакцію можна здійснювати в розчиннику, такому як Ν,Ν-диметилформамід, при температурі від 0°С до 100°С, в присутності піридину, з використанням тіоціанату калію. Сполуки формули (V), де R1 визначений в формулі (І), a L являє собою гідроксильну групу, зручно одержувати взаємодією сполуки формули (VI): зі сполукою формули R1X, де R1 визначений вище, а X являє собою групу, що видаляється, таку як бромід, в присутності основи, такої як гідроксид натрію. Реакцію можна здійснювати у водному NMP при кімнатній температурі. Сполуки формули (VI) є в продажу. Сполуки формули (IIВ), де R1 визначений в формулі (І), a L являє собою групу, що видаляється, таку як бром, можна одержати дією на сполуку формули (IIВ), де R1 визначений вище, a L являє собою NH2, діазотуючим агентом, таким як ізоамілнітрит, в присутності галогенуючого агента, такого як бромоформ. Реакцію можна здійснювати в розчиннику, такому як ДМСО, при температурі від 0°С до 100°C. Сполуки формули (ІІВ), де R1 визначений в формулі (І), a L являє собою NH2, можна одержати: і) дією на сполуку формули (VII) де R1 і L визначені вище, етилгліоксилатом в присутності основи, такої як метоксид натрію, в розчиннику, такому як метанол, при кімнатній температурі, або іі) дією на сполуку формули (VIII): де R1 і L визначені вище, триетилфосфоноацетатом в присутності основи, такої як бутиллітій. Реакцію можна здійснювати в розчиннику, такому як ДМФ, при температурі від 0°С до 100°С. Сполуки формули (VII), де R1 визначений в формулі (І), a L являє собою NH2, можна одержати дією на сполуку формули (VIII), де R1 і L визначені вище, відновлюючим агентом, таким як гідросульфіт натрію. Реакцію можна здійснювати в розчиннику, такому як вода, при кипінні із зворотним холодильником. Сполуки формули (VIII), де R1 визначений в формулі (І), a L являє собою NH2, можна одержати дією на сполуку формули (IX), де R1 і L визначені вище, нітрозуючим агентом, таким як нітрит натрію. Реакцію можна здійснювати в розчиннику, такому як водна оцтова кислота, при температурі від 0°С до 100°С. Сполуки формули (IX), де R1 визначений в формулі (І), a L являє собою NH2, можна одержати дією на сполуку формули (X) сполукою формули R1X, де R1 визначений вище, а X являє собою групу, що видаляється, таку як бромід, в присутності основи, такої як трет-бутоксид калію. Реакцію можна здійснювати в розчиннику, такому як ДМСО, при кімнатній температурі. Сполуки формули (ІІС), де R1, R2 і R3 визначені в формулі (І), можна одержати зі сполук формули (І), де R1, R і R3 визначені в формулі (І), дією надкислоти, такої як надоцтова кислота. Реакцію можна здійснювати в розчиннику, такому як оцтова кислота, при температурі від 0°С до 100°С. Сполуки формули (ІIC), де R1 визначений в формулі (І), a L являє собою алкоксильну групу, можна одержати зі сполук формули (IID), де R1 визначений в формулі (І), a L являє собою тіоалкільну групу, дією відповідного спирту в присутності основи. Відповідні спирти включають ізопропанол, а основою може служити натрій, і реакцію можна здійснювати при температурі від 0°С до 150°С. Сполуки формули (IID), де R1 визначений в формулі (І), a L являє собою тіоалкільну групу, можна одержати зі сполук формули (XI), послідовною дією алкілгалогеніду R1X і етилгліоксалату в присутності основи. Реакцію можна здійснювати в розчиннику, такому як метанол, при температурі від 0°С до 150°С. використовуючи натрій як основу. 2 Сполуки формули (X) і (XI) є в продажу. Фахівці повинні враховувати той факт, що в способах за даним винаходом визначені функціональні групи, такі як гідроксильна або аміногрупи, у вихідних реагентах або проміжних сполуках можуть зажадати захисту захисними групами. Так, одержання сполук формули (І) може включати, на відповідній стадії, видалення однієї або більше захисних груп. Захист і зняття захисту з функціональних груп вичерпно описані у "Protective Groups in Organic Chemistry", видане J.W.F. McOmie, Plenum Press (1973), і в "Protective Groups in Organic Synthesis", 2-е видання, T.W. Greene & P.G.M. Wuts, Wiley-Interscience (1991). Нові проміжні сполуки являють собою ще один об'єкт даного винаходу. Зокрема, сполуки формули (IIА) і (ІІВ) є новими і являють собою об'єкт даного винаходу. Сполуки формули (І), описані вище, можна перетворювати в їх фармацевтично прийнятну сіль або сольват, переважно, основно-адитивну сіль, таку як сіль натрію, калію, кальцію, алюмінію, літію, магнію, цинку, бензатину, хлорпрокаїну, холіну, діетаноламіну, етаноламіну, етилдіаміну, меглуміну, трометаміну або прокаїну, або кислотно-адитивну сіль, таку як гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат або п-толуолсульфонат. Сполуки формули (І) володіють активністю як лікарські засоби, зокрема, як модулятори активності хемокінових рецепторів (особливо CXCR2), і можуть застосовуватися для лікування (терапевтичного або профілактичного) станів/захворювання у людини і тварин, що не є людиною, які загострюються або викликаються надмірним або розрегульованим виробленням хемокінів. Приклади вказаних станів/захворювання включають: (1) (дихальні шляхи) обструктивні захворювання дихальних шляхів, включаючи хронічне обструктивне захворювання легень (ХОЗЛ); астму, таку як бронхіальна, алергічна, спадкова, придбана і пілева астма, особливо хронічна або запущена астма (наприклад, пізня астма і гіперреактивність дихальних шляхів); бронхіт; гострий, алергічний, атрофічний риніт і хронічний риніт, включаючи хронічний риніт з утворенням казеозних мас, гіпертрофічний риніт, гнійний риніт, сухий риніт і медикаментозний риніт; мембранозний риніт, включаючи крупозний, фібринозний і псевдомембранозний риніт і скрофулезний риніт; сезонний риніт, включаючи сінну лихоманку і вазомоторний риніт; саркоїдоз, екзогенний алергічний альвеоліт і споріднені захворювання, пневмосклероз і ідіопатичну інтерстиціальну пневмонію; (2) (кістки і суглоби) ревматоїдний артрит, серонегативні спондилоартропатії (включаючи анкілозуючий спондилоартрит, псоріатичний артрит і хворобу Рейтера), хворобу Бехчета, синдром Шегрена і системну склеродермію; (3) (шкіра) псоріаз, атонічний дерматит, контактний дерматит і інші екзематозні дерматити, себорейну екзему, червоний плоский лишай, пухирчатку, булезну пухирчатку, природжений булезний епідермоліз, кропивницю, запалення шкірних судин, васкуліти, еритеми, шкірну еозинофілію, увеїт, гніздну алопецію і весняний кон'юнктивіт; (4) (шлунково-кишковий тракт) целіакію, проктит, еозинофільний гастроентерит, мастоцитоз, хворобу Крона, виразковий коліт, харчові алергії, які викликають ефекти, віддалені від кишечнику, наприклад, мігрень, риніт і екзема; (5) (центральна і периферична нервова система) нейродегенеративні захворювання і порушення, пов'язані з деменцією, наприклад, хвороба Альцгеймера, бічний аміотрофічний склероз і інші захворювання рухових нейронів, хворобу Крейтцфельда-Якоба і інші пріонні захворювання, ВІЛ-енцефалопатія (комплекс деменції, пов'язаний зі СНІДом), хворобу Хантінгтона, фронтотемпоральну деменцію, деменцію Леві і судинну деменцію; поліневропатії, наприклад, синдром Гійєна-Барре, хронічна запальна демієлінізуюча полірадикулоневропатія, мультифокальна моторна невропатія, плексопатії; демієлінізацію ЦНС, наприклад, розсіяний склероз, гострий розсіяний/геморагічний енцефаломієліт і підгострий склерозуючий лейкоенцефалит; нейром'язові розлади, наприклад, важка псевдопаралітична міастенія і синдром ЛамбертаІтона; спинальні розлади, наприклад, тропічний спастичний парапарез і синдром людини, що не згинається; паранеопластичні синдроми, наприклад, дегенерація мозочка і енцефаломієліт; травму ЦНС; мігрень; і інсульт. (6) (інші тканини і системне захворювання) атеросклероз, синдром набутого імунодефіциту (СНІД), червоний вовчак, системний червоний вовчак, тиреоїдит Хашимото, діабет І типу, нефротичний синдром, еозинофільний фасцит, синдром гіпер-IgE, лепроматозну лепру і ідіопатичну тромбоцитопенічну пурпуру; післяопераційні спайки і сепсис. (7) (відторгнення алотрансплантата) гостре і хронічне відторгнення після трансплантації, наприклад, нирки, серця, печінки, легені, кісткового мозку, шкіри і рогівки; і хронічну хворобу "трансплантат проти хазяїна"; (8) Раки, особливо недрібноклітинний рак легені (NSCLC), злоякісну меланому, рак передміхурової залози і сквамозну саркому, і метастази пухлин; (9) Захворювання, при яких ангіогенез пов'язаний з підвищеними рівнями хемокіну CXCR2 (наприклад, NSCLC, діабетична ретинопатія). (10) Муковісцидоз, реперфузїйне пошкодження серця, головного мозку, периферичних частин кінцівок і інших органів. (11) Опікові рани і хронічні шкіряні виразки (12) Хвороби репродуктивної системи (наприклад, порушення овуляції, менструації і імплантацій, передчасних родів, ендометріоз). Таким чином, даний винахід відноситься до сполуки формули (І) або до її фармацевтично прийнятної солі або сольвату, як визначено раніше в даному описі, для застосування в терапії. Переважно, сполуки за даним винаходом застосовують для лікування захворювань, при яких хемокіновий рецептор належить до підродини СХС хемокінових рецепторів, більш переважно, хемокіновим рецептороммішенню є рецептор CXCR2. Станами, що заслуговують особливої уваги, які можна лікувати сполуками за даним винаходом, є псоріаз, захворювання, при яких ангіогенез пов'язаний з підвищеними рівнями хемокіну CXCR2, і ХОЗЛ. Переважно застосовувати сполуки за даним винаходом для лікування псоріазу. Як ще один об'єкт даного винаходу, визначені сполуки формули (І) можуть бути придатними як антагоністи рецептора CX3CR1. Як очікується, вказані сполуки будуть особливо корисні для лікування порушень центральної і периферичної нервової системи і інших станів, які характеризуються активацією мікроглії і/або інфільтрацією лейкоцитів (наприклад, інсульту/ішемії і травми голови). У ще одному втіленні даний винахід відноситься до застосування сполуки формули (І) або її фармацевтично прийнятної солі або сольвату, які визначені вище в даному описі, у виробництві лікарського засобу для застосування в терапії. У ще одному втіленні даний винахід відноситься до застосування сполуки формули (І) або її фармацевтично прийнятної солі або сольвату, які визначені вище в даному описі, у виробництві лікарського засобу для лікування захворювань або станів людини, при яких сприятливою є модуляція активності хемокінових рецепторів. У контексті даного опису термін "терапія" включає також "профілактику", якщо конкретно не вказане інше. Терміни "терапевтичний" і "терапевтично" повинні тлумачитися відповідно. Даний винахід відноситься також до способу лікування захворювання, опосередкованого хемокінами, при якому хемокін зв'язується з хемокіновим (особливо CXCR2) рецептором, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І)або її фармацевтично прийнятної солі або сольвату, які визначені вище в даному описі. Даний винахід відноситься також до способу лікування запального захворювання, особливо псоріазу, у пацієнта, страждаючого вказаним захворюванням або який входить до групи ризику розвитку вказаного захворювання, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату, які визначені вище в даному описі. Для вказаного вище терапевтичного застосування доза, що вводиться, зрозуміло, буде змінюватися в залежності від сполуки, що використовується, способу введення, необхідного лікування і порушення, з приводу якого здійснюється лікування. Сполуки формули (І) і їх фармацевтично прийнятні солі і сольвати можна використати самі по собі, але звичайно їх вводять у формі фармацевтичної композиції, в якій сполука формули (І)/сіль/сольват (активний інгредієнт) знаходяться в поєднанні з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. В залежності від способу введення фармацевтична композиція буде переважно включати від 0,05 до 99% мас, (процент за мас), більш переважно, від 0,05 до 80% мас, ще більш переважно, від 0,10 до 70% мас, і, ще більш переважно, від 0,10 до 50% мас, активного інгредієнта, всі масові проценти дані від маси всієї композиції. Даний винахід відноситься також до фармацевтичної композиції, що включає сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, які визначені вище в даному описі, в поєднанні з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. Даний винахід відноситься також до способу виготовлення фармацевтичної композиції за даним винаходом, яка включає сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, які визначені вище в даному описі, з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. Вказані фармацевтичні композиції можна вводити місцево (наприклад, в легеню і/або дихальні шляхи або на шкіру) у формі розчинів, суспензій, гептафторалканових аерозолів і композицій у вигляді сухого порошку; або системно, наприклад, пероральним введенням у формі таблеток, капсул, сиропів, порошків або гранул, або парентеральним введенням у формі розчинів або суспензій, або підшкірним введенням або ректальним введенням у формі супозиторіїв або черезшкірно. Переважно, сполуки за даним винаходом вводять перорально. Далі даний винахід буде проілюстрований наступними прикладами. У вказаних прикладах спектри ядерного магнітного резонансу (ЯМР) вимірювали на спектрометрі Varian Unity Inova 300 або 400МГц, а спектри мас-спектрометрії (MS) вимірювали на спектрометрі Finnigan Mat SSQ7000 або Micromass Platform. Якщо це було необхідне, реакції здійснювали в інертній атмосфері азоту або аргону. Хроматографію звичайно здійснювали з використанням гелю Matrex Silica 60Ò (35-70 мікрон) або гелю Prolabo Silica gel 60Ò (35-70 мікрон), відповідними для флеш-хроматографії на силікагелі. Очищення з використанням рідинної хроматографії високого тиску здійснювали з використанням Waters Micromass LCZ з контролером насоса Waters 600, детектора Waters 2487 і колектора фракцій Gilson FC024 або Waters Delta Prep 4000. Абревіатури Т.пл. і ДМСО, які використовуються в прикладах, означають, відповідно, температуру плавлення і диметилсульфоксид. Приклад 1 4-[[(1R)-2-Гідрокси-1-метилетил]аміно]-2-[{фенілметил)тіо]-6Н-піримідо[5,4-b][1,4]тіазин-7(8Н)-он (a) Піримідиніловий ефір 6-аміно-1,4-дигідро~2-[(фенілметил)тіо]-4-окео-5-тіоціанової кислоти 6-Аміно-2-[(фенілметил)тіо]-4-(1Н)-піримідинон (10,5г) [одержання описане у WO9635678] і тіоціанат калію (25г) в Ν,Ν-диметилформаміді (200мл) нагрівали разом до 65°С. Додавали піридин (6,3мл) і розчин охолоджували до 5°С. Повільно додавали бром (2,2мл) і реакційну суміш перемішували протягом 2 годин при 5-10°С. Реакційну суміш виливали в крижану воду, перемішували протягом 1 години і виділяли тверду речовину фільтруванням. Після промивання водою і ефіром одержували чистий зразок після розтирання з гарячим метанолом. MS (АРСІ) 291 (М+Н, 100%). (b) Етиловий ефір [6-аміно-1,4-дигідро-4-оксо-2-[(фенілметил)тіо-5-піримідиніл]тіо]оцтової кислоти До суспензії продукту, одержаного на стадії а) (1,5г), в безводному етанолі (100мл) додавали боргідрид натрію (0,570г) і одержаний розчин залишали при перемішуванні на 15хв. До вказаного розчину додавали етилбромацетат (0,570мл). Суміш нейтралізували концентрованою хлористоводневою кислотою, потім випаровували до суха і очищали (SiO2, етилацетат:дихлорметан 1:1 як елюент) з одержанням вказаної в підзаголовку сполуки у вигляді безбарвної твердої речовини(1,1г). MS (АРСІ) 352 (М+Н, 100%). (c) 2-[(Фенілметил)тіо]-1Н-піримідо[5,4-b][1,4]тіазин-4,7(6Н,8Н)-діон До розчину продукту, одержаного на стадії b) (0,30г), в безводному толуолі (60мл) додавали птолуолсульфонову кислоту (50мг) і розчин кип'ятили із зворотним холодильником протягом 11 годин. Одержану тверду речовину відфільтровували, промивали ефіром і висушували з одержанням вказаної в підзаголовку сполуки у вигляді безбарвної твердої речовини (0,290г). MS (АРСІ) 306 (М+Н, 100%). (d) 4-Хлор-2-[(фенілметил)тіо]-6Н-піримідо[5,4-b][1,4]тіазин-7(8Н)-он Суспензію продукту, одержаного на стадії с) (1/5г), оксихлориду фосфору (10мл) і Ν,Ν-диметиланіліну (1мл) кип'ятили із зворотним холодильником протягом 2 годин. Суміш залишали охолоджуватися до кімнатної температури і обережно виливали в насичений розчин бікарбонату натрію, а потім перемішували протягом 15хв. Сирий продукт екстрагували в етилацетат і очищали (SiO2, дихлорметан як елюент) з одержанням вказаної в підзаголовку сполуки (0,25г). MS (АРСІ) 324 (М+Н, 100%). e) 4-[[(1R)-2-Гідрокси-1-метилетил]аміно]-2-[(фенілметил)тіо]-6Н-піримідо[5,4-b][1,4]тіазин-7(8Н)-он На продукт, одержаний на стадії e) (0,250г) в NMP (5мл), діяли (R)-2-аміно-1-пропанолом (0,116г) і реакційну суміш нагрівали при 110°С протягом 2 годин. Суміш випаровували до суха, а залишок очищали (ВЕРХ, колонка SymmetryÒ C18, ізократне елюювання сумішшю 0,1% водний ацетат амонію:ацетонітрил 75:25) з одержанням вказаної в заголовку сполуки (0,13г). MS (АРСІ) 363 (М+Н). 1 Н ЯМР: d (ДМСО) 10,84 (1H, с), 7,47-7,19 (5Н, м), 6,26 (1H, д), 4,78 (1H, т), 4,36-4,19 (3Н, м), 3,55-3,32 (4Н, м), 1,12 (3Н, д). Приклад 2 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно1-7(8H)-птеридинон (а) 2-[[(2,3-Дифторфеніл)метил]тіо]-4,6-піримідиндіамін 4,6-Діаміно-2-піримідинтіол (7,3г) розчиняли в ДМСО (100мл) при кімнатній температурі в атмосфері азоту. Додавали трет-бутоксид калію (1Μ в ТГФ, 48,3мл), а потім додавали 2,3-дифторбензилбромід (10,0г). Суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш потім розподіляли між етилацетатом і хлоридом амонію. Органічну фазу промивали хлоридом амонію (3х) і насиченим розчином солі, потім висушували над сульфатом магнію і випаровували з одержанням вказаного в підзаголовку продукту у вигляді твердої речовини білого кольору (12,2г). MS (ADCI) (+ve) 269 (M+1) (b) 2-[[(2,3-Дифторфеніл)метил]тіо]-5-нітрозо-4,6-піримідиндіамін Продукт, одержаний на стадії (а) (2,5г), розчиняли в оцтовій кислоті (150мл) і розчин охолоджували до 5°С. Краплями додавали розчин нітриту натрію (625мг) у воді (50мл), після чого з'являлося темно-синє фарбування. Реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин, протягом яких з розчину осаджувалась тверда речовина рожевого кольору. Останню виділяли фільтруванням і промивали водою, а потім висушували при 50°С з одержанням вказаного в підзаголовку продукту у вигляді твердої речовини синього кольору (4,14г). MS: (ADCI) (+ve) 298 (M+1) 1 Н ЯМР: d (ДМСО) 4,44 (с, 2Н), 7,13-7,54 (м, 3Н), 8,13 (с, 1Н), 8,51 (с, 1Н), 9,10 (с, 1Н), 10,18 (с, 1Н). (с) 2-[[(2,3-Дифторфенїл)метил]тіо]-4,5,6-піримідинтриамін До суспензії продукту, одержаного на стадії (b) (2г), в киплячій воді (40мл) частинами додавали Na2S2O4 (5,4г). Суспензію залишали охолоджуватися, а потім повільно додавали 50% сірчану кислоту, а потім суміш охолоджували до 0°С. Тверду речовину виділяли фільтруванням і промивали холодною водою, потім висушували над Р2О5 при 50°С з одержанням вказаного в підзаголовку продукту у вигляді твердої речовини жовтого кольору. MS: (ADCI) (+ve) 284 (M+1) 1 Н ЯМР: d (ДМСО) 4,33 (с, 2Н), 6,42 (шир.с, 3Н), 7,10-7,48 (м, 3Н). d) 4-Аміно-2-[(2,3-дифторфеніл)метил]тіо]-7(8Н)-птеридинон Продукт, одержаний на стадії (с) (100мг), розчиняли в розчині натрію (0,05г) в метанолі (5мл). Розчин залишали при перемішуванні при кімнатній температурі протягом 15хв., потім до суміші додавали етилгліоксалат (134мкл) і залишали при перемішуванні при кімнатній температурі протягом 12год. Додавали воду (5мл), потім повільно додавали концентровану хлористоводневу кислоту для підкислення розчину приблизно до рН 5, після чого випадала в осад тверда речовина, яку виділяли фільтруванням і висушували над Р2О5 при 50°С з одержанням твердої речовини блідо-жовтого кольору (44,5мг). MS: (ADCI) (+ve) 322 (M+1) 1 Н ЯМР: d (ДМСО) 4,18 (с, 2Н), 7,11-7,58 (м, 3Н), 7,84 (с, 1Н), 12,69 (шир.с, 1Н). е) 4-Бром-2-[(2,3-Дифторфеніл)метил]тіо]-7(8Н)-птеридинон Продукт, одержаний на стадії (d) (6,0г), суспендували в ДМСО (90мл) і додавали бромоформ (60мл) і суміш нагрівали до 100°С. Додавали ізопентилнітрит (25мл) і суміш перемішували протягом 5хв. Суміш швидко охолоджували на бані з льодом, потім випаровували з одержанням масла. Останню операцію повторювали тричі. Додавали ацетонітрил (200мл) і тверду речовину, що відділилася, видаляли фільтруванням. Розчинник випаровували, а залишок очищали флеш-хроматографією з елююванням дихлорметаном, а потім 5% етилацетатом в дихлорметані з одержанням твердої речовини жовтого кольору, яку суспендували в ефірі, а потім збирали. Тверду речовину промивали ефіром і висушували з одержанням вказаної в підзаголовку сполуки у вигляді безбарвної твердої речовини (8,74г). MS: (АРСІ) (-ve) 382/4 (М-Н), 382 (100%) 1 Н ЯМР: d (ДМСО) 4,47 (с, 2Н), 7,13-7,55 (м, 3Н), 8,14 (с, 1Н), 13,33 (шир.с, 1Н). f) 2-[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7|8Н)-птеридинон Продукт, одержаний на стадії (е) (8,7г), розчиняли в N-метилпіролідиноні (40 мі) і додавали основу Ханігса (7,9мл), а потім додавали D-аланінол (2,7мл). Суміш перемішували при 100°С протягом 15хв. Охолоджений розчин виливали у ваду і підкисляли розбавленою хлористоводневою кислотою. Тверду речовину, яка відділилася, збирали, промивали водою і висушували на повітрі. Після кристалізації з ацетонітрилу одержували вказану в заголовку сполуку у вигляді твердої речовини блідо-жовтого кольору (7,4г). Т.пл. 215-217°С MS: (АРСІ) (+ve) 3 80 (М+Н, 100%) 1 Н ЯМР: d (ДМСО) 1,14 (д, 3Н), 3,48 (м, 2Н), 4,31 (м, 1Н), 4,45 (дд, 2Н), 4,82 (т, 1Н), 7,15 (м, 1Н), 7,33 (м, 1H), 7,47 (т, 1H), 7,76 (д, 1Н), 7,83 (д, 1H), 12,70 (с, 1H). Альтернативно, сполуку прикладу 2 можна одержати за допомогою наступної методики: g) 2,4-бic(2,3-Дифтopфeнiл)мeтил]тio]-7(8H)-птepидинoн Натрій (3,96г) розчиняли в метанолі (150мл), додавали 5,6-діаміно-2,4-піримідиндитіол (15г), потім повільно додавали 2,3-дифторбензилбромід (30,9г) і реакційну суміш перемішували при кімнатній температурі протягом 10хв. в атмосфері азоту. Потім додавали етилгліоксалат (15мл), а після нього ще раз додавали натрій (2,5г) і реакційну суміш залишали стояти ще протягом 20хв. Реакцію потім гасили оцтовою кислотою (10мл) і реакційну суміш виливали у воду (600мл) при перемішуванні. Одержаний осад фільтрували через целіт і промивали водою. Фільтрат відкидали, а тверду речовину промивали на целіті з використанням ацетону. Потім розчин випаровували до суха і очищали колонковою хроматографією на силікагелі з використанням 10% етилацетату в DCM з одержанням вказаної в підзаголовку сполуки у вигляді твердої речовини кремового кольору (8г). MS: (АРСІ) (+ve) 465 (М+1) h) 2-[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Продукт, одержаний на стадії (g) прикладу 2 (2,3г), і D-аланінол (5г) піддавали мікрохвильовій обробці при 150°С протягом 5хв. Одержаний розчин розподіляли між етилацетатом і водним хлоридом амонію і органічний шар промивали хлоридом амонію (2х50мл). Органічний шар випаровували до суха і двічі очищали хроматографією на силікагелі з використанням спочатку суміші 20:1 ВСМ:метанол, а потім суміші 1:1 ВСМ:етилацетат з одержанням вказаної в заголовку сполуки (220мг). MS: (АРСІ) (+ve) 380 (М+1) Приклад 3 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон (а) 4-Аміно-2-[(2,3-дифторфеніл)метил]тіо]-7(8Н)-птеридинон До розчину триетилфосфоноацетату (15,0г) в тетрагідрофурані (60мл), охолодженому на бані з льодом, додавали бутиллітій (2,5Μ в гексанах, 25,6мл) з такою швидкістю, щоб внутрішня температура підтримувалася на рівні нижче 30°С. До вказаної суміші потім додавали розчин продукту, одержаного в прикладі 2 на стадії (b) (10,0г), в Ν,Ν-диметилформаміді (60мл). Реакційну суміш кип'ятили із зворотним холодильником протягом 1 години, потім охолоджували до кімнатної температури і гасили оцтовою кислотою (6мл). Осаджену таким способом тверду речовину виділяли фільтруванням, промивали водою, етанолом і діетиловим ефіром і висушували над Р 2О5 при 50°С з одержанням вказаного в підзаголовку продукту у вигляді твердої речовини блідо-зеленого кольору (9,3г). MS; (ADCI) (+ve) 322 (M+1) 1 Н ЯМР: d (ДМСО) 4,18 (с, 2Н), 7,11-7,58 (м, 3Н), 7,84 (с, 1H), 12,69 (шир.с, 1H). b) 4-Бром-2-[(2,3-Дифторфеніл)метил]тіо]-7(8Н)-птеридинон Продукт, одержаний на стадії (а) (0,5г), суспендували в ДМСО (10мл) і бромоформі (10мл) і суміш нагрівали до 125°С. Додавали ізоамілнітрит (2мл) і суміш перемішували при 125°С протягом 5 хвилин, після чого охолоджували на бані з льодом. Розчинник видаляли випаровуванням у високому вакуумі, а залишок суспендували в дихлорметані (100мл). Вказану суспензію промивали насиченим водним хлоридом амонію (50мл), а потім фільтрували через пробку з целіту. Фільтрат випаровували і очищали колонковою хроматографією з елююванням 10% етилацетатом в дихлорметані з одержанням вказаної в підзаголовку сполуки у вигляді твердої речовини білого кольору (0,22г). MS: (ADCI) (+ve) 386 (M+1) 1 Н ЯМР: d (ДМСО) 4,47 (с, 2Н), 7,13-7,55 (м, 3Н), 8,14 (с, 1H), 13,33 (шир.с, 1Н). c) 2-[(2,3-Дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (57мг) одержували з продукту, одержаного на стадії (b) (80мг), і 2-аміно-1,3пропандіолу (29мг) за допомогою способу, описаного в прикладі 2, стадія (f). MS:(ADCI)(+ve)396(M+1) 1 Н ЯМР: d (ДМСО) 12,73 (1Н, шир.с), 7,85 (1Н, с), 7,50 (2Н, м), 7,33 (1Н, м), 7,15 (1H, м), 4,80 (2Н, т), 4,45 (2Н, с), 4,23 (1H, м), 3,55 (4Н, м). Приклад 4 2-1[(2,3-Дифторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (52мг) одержували з продукту, одержаного в прикладі 3 на стадії (b) (150мг), і етаноламіну (35мкл) за допомогою способу, описаного в прикладі 2, стадія (f). MS: (ADCI) (+ve) 366 (M+1) 1 Н ЯМР: d (ДМСО) 12,71 (1Η, шир.с), 8,09 (1H, шир.т), 7,84 (1H, с), 7,47 (1Н, м), 7,32 (1H, м), 7,16 (1H, м), 4,78 (1H, т), 4,45 (2H, с), 3,53 (4Н, м). Приклад 5 (2R)-2-[[2-[[2,3-Дифторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4-птеридиніл]аміно]пропанамід Вказану в заголовку сполуку (160мг) одержували з продукту, одержаного в прикладі 3 на стадії (b) (500мг), і гідрохлориду аміду D-аланіну (172мг) за допомогою способу, описаного в прикладі 2, стадія (f). MS: (ADCI) (+ve) 393 (M+1) 1 Н ЯМР: d (ДМСО) 12,77 (1H, шир.с), 7,88 (1H, с), 7,85 (1H, д), 7,55 (1Н, шир.с), 7,47 (1H, т), 7,36 (1H, м), 7,19 (1H, шир.с), 7,16 (1Н, м), 4,60 (1H, кв), 4,46 (2Н,кв), 1,40 (3Н,д). Приклад 6 2-[[(3-Хлор-2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно] -7(8Н)-птеридинон a) 4-Аміно-2-[(фенілметил)тіо]-7(8Н)-птеридинон Вказану в підзаголовку сполуку (16,5г) одержували за допомогою способу, описаного в прикладі 3, стадія (а), з використанням 5-нітрозо-2-[(фенілметил)тю]-4,6-піримідиндіаміну (22,5г). MS (ESI) 286 (М+Н, 100%). b) 4-Аміно-2-[(фенілметил)сульфоніл]-7(8Н)-птеридинон Суспензію продукту, одержаного в прикладі 6, стадія (а) (5,00г), в оцтовій кислоті (500мл) і надоцтовій кислоті (36-40% мас. розчин в оцтовій кислоті, 50мл) перемішували при 50°С протягом 1год. Після гасіння диметилсульфідом (15мл) розчин виливали в крижану воду (5000мл). Суспендовану тверду речовину видаляли фільтруванням і висушували у вакуумі з одержанням вказаної в підзаголовку сполуки у вигляді порошку блідо-жовтого кольору (4,53г). MS(ESI)316(M-H, 100%). с) 3-Хлор-2-фторбензолметантіол 3-Хлор-2-фторбензилбромід (1,00г) і тіосечовину (0,35г) разом нагрівали із зворотним холодильником в етанолі (10мл) протягом 1 години, Розчинник видаляли у вакуумі, а залишок суспендували у 10% водному гідроксиді натрію (10мл) і кип'ятили із зворотним холодильником протягом 3 годин. Потім розчин підкисляли конц. НСl і екстрагували в ефір. Після концентрування органічної фази у вакуумі одержували вказану в підзаголовку сполуку у вигляді масла блідо-жовтого кольору (0,71г). MS (ΕΙ) 176/178 (М+), 143/145 (100%). а) 4-Аміно-2-[(3-хлор-2-фторфеніл)метил]тіо]-7(8Н)-птеридинон Продукт, одержаний в прикладі 6, стадія (с) (0,63г), і 1Μ розчин т-бутоксиду в ХГФ (3,5мл) додавали до суспензії продукту, одержаного в прикладі 6, стадія (b) (1,11г), в ΝΜΡ (20мл). Суміш інтенсивно перемішували протягом 1 години, виливали в 1Μ HCl (15мл) і розбавляли водою. Суспендовану тверду речовину видаляли фільтруванням і висушували у вакуумі з одержанням вказаної в підзаголовку сполуки у вигляді порошку блідожовтого кольору (1,14г). MS (ESI) 338 (М+Н, 100%). e) 4-Бром-2-[(3-хлор-2-фторфеніл)метил]тіо]-7(8Н)-птеридинон Вказану в підзаголовку сполуку (0,318г) одержували за допомогою способу, описаного в прикладі 3, стадія (b), з використанням продукту, одержаного в прикладі 6, стадія (d) (1,10г). MS (ESI) 399/401 (М-Н, 100%). f) 2-[(3-Хлор-2-фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку одержували за допомогою способу, описаного в прикладі 2, стадія (f), з використанням продукту, одержаного в прикладі 6, стадія (e) (75мг). Реакційну суміш виливали у воду і підкисляли конц. HCl. Суспендовану тверду речовину видаляли фільтруванням, висушували на повітрі і перекристалізовували з ацетонітрилу з одержанням твердої речовини жовтого кольору (37мг). Т.ПЛ. 209-211°С MS (АРСІ) 396 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,71 (1H, шир.с), 7,83 (1H, с), 7,76 (1Н, д), 7,64 (1H, т), 7,48 (1H, т), 7,17 (1Н, т), 4,82 (1H, т), 4,39-4,48 (2Н, м), 4,28 (1Н, м), 3,40-3,52 (2Н, м),1,13 (3Н, д). Приклад 7 2-[[(3-Хлор-2-фторфеніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (51мг) одержували за допомогою способу, описаного в прикладі 6, стадія (f), з використанням продукту, одержаного в прикладі 6, стадія (е) (75мг), і етаноламіну (25мкл). Т.пл. 195-196,5°С MS (АРСІ) 382 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,71 (1H, шир.с), 8,08 (1H, шир.м), 7,84 (1H, с), 7,64 (1H, т), 7,49 (1Н, т), 7,17 (1Н, т), 4,79 (1H, шир.м), 4,44 (2Н, с), 3,53 (4Н, шир.м). Приклад 8 2-[[(3-Хлор-2-фторфеніл)метил]тіо]-4-[[2-гідрокси-1-{гідроксиметил) етил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (51мг) одержували за допомогою способу, описаного в прикладі 6, стадія (f), з використанням продукту, одержаного в прикладі 6, стадія (e) (75мг), і 2-аміно-1,3-пропандіолу (37мг). Т.пл. 218,5-220,5°С MS (АРСІ) 412 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,74 (1H, шир.с), 7,85 (1H, с), 7,67 (1H, т), 7,50 (2Н, м), 7,16 (1H, т), 4,81 (2Н, т), 4,44 (2Н, с), 4,24 (1H, м), 3,51-3,62 (4Н, м). Приклад 9 1,1-Диметилетиловий ефір [(2R)-2-[[2-[[(3-хлор-2-фторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4птеридиніл]аміно]пропіл] карбамінової кислоти (а) 9Н-Флуорен-9-ілметиловий ефір [(1H)-2-аміно-1-метил-2-оксоетил]карбамінової кислоти На розчин гідрохлориду D-аланінаміду (3г) в 10% розчині карбонату натрію (50мл) і діоксані (50мл) діяли хлоридом FMOC (6,24г) в діоксані (40мл) і залишали при перемішуванні протягом ночі. Суміш розбавляли водою (500мл) і продукт відфільтровували і висушували у вакуумі з одержанням 9,0г вказаної в підзаголовку сполуки. MS(ESI) BP 311 (+H). (b) 9Н-Флуорен-9-ілметиловий ефір [(1R)-2-аміно-1-метилетил] карбамінової кислоти До розчину, одержаного в прикладі 9, стадія (а) (6,9г), в ТГФ (100мл) додавали боран-метилсульфідний комплекс (4,4мл) і суміш кип'ятили із зворотним холодильником протягом 2 годин. Суміш обережно гасили додаванням метанолу (100мл), випаровували до суха, а залишок вміщували в метанол (100мл) і підкисляли до рН 1-2 концентрованою хлористоводневою кислотою. Кип'ятили із зворотним холодильником протягом 30хв., потім випаровували до суха. Залишок розтирали з ефіром з одержанням твердої речовини, яку відфільтровували, розчиняли у воді і вільну основу осаджували додаванням водного розчину бікарбонату натрію з одержанням вказаної в підзаголовку сполуки (3,1г). MS(ESI) BP 297 (+H) c) 1,1-Диметилетиловий ефір (2R)-[2-(9Н-флуорен-9-ілметоксикарбоніламіно)пропіл]карбамінової кислоти До розчину продукту, що перемішується, одержаного в прикладі 9, стадія (b) (3,0г), в ТГФ (100мл) додавали дитрет-бутилдикарбонат (2,2г) і суміш перемішували при кімнатній температурі протягом 30хв. Суміш випаровували до суха і сирий продукт очищали (SiO2, дихлорметан як елюент) з одержанням вказаної в підзаголовку сполуки (3,8г). 1 Н ЯМР: d (CDCl3) 7,76 (2Н, м), 7,42 (2Н, м), 7,39-26 (4Н, с), 5,01 (1H, с), 4,85 (1Н, с), 4,38 (2Н, д), 4,19 (1H, т), 3,77 (1Н, м), 3,18 (2Н, м), 1,27 (9Н, с). d) 1,1-Диметилетиловий ефір [(2R)-2-амінопропіл]карбамінової кислоти До розчину продукту, одержаного в прикладі 9, стадія (с) (3,8г), в ТГФ (100мл) додавали піперидин (5мл) і суміш залишали стояти при кімнатній температурі протягом 1 години. Суміш випаровували до суха і залишок очищали (SiO2, 5% метанол :дихлорметан як елюент) з одержанням вказаної в підзаголовку сполуки у вигляді безбарвного масла (1,7г). 1 Н ЯМР: d (CDCl3) 4,95 (1H, с), 3,13 (1H, м), 2,99 (1H, м), 2,87 (1Н, м), 1,38 (9Н,с), 1,08 (3Н,д). є) 1,1-Диметилетиловий ефір [(2R)-2-[[2-[(3-хлор-2-фторфеніл)метил]тіо]-7,8-дигідро-7-оксо-4птеридиніл]аміно]пропіл]карбамінової кислоти Вказану в заголовку сполуку (83мг) одержували за допомогою способу, описаного в прикладі 6, стадія (f), з використанням продукту, одержаного в прикладі 6, стадія (е) (75мг), і продукту, одержаного в прикладі 9, стадія (d) (72мг). MS (АРСІ) 495 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 7,95 (1H, шир.д), 7,83 (1H, с), 7,62 (1H, т), 7,48 (1H, т), 7,17 (1H, т), 6,94 (1H, шир.т), 4,34-4,53 (3Н, м), 3,04-3,17 (2Н, м), 1,32 (9Н, с), 1,11 (3Н, д). Приклад 10 Моногідрохлорид 4-[[(1R)-2-аміно-1-метилетил]аміно]-2-[[(3-хлор-2-фторфеніл)метил]тіо]-7(8Н)птеридинону Двофазну суміш продукту, одержаного в прикладі 9 (76мг), в 1,4-діоксані (3мл) і конц. HCl (0,3мл) перемішували протягом 2 годин, потім розбавляли водою (10мл) і ліофілізували. Залишок розчиняли у воді (10мл), промивали етилацетатом (5мл) і ліофілізували з одержанням вказаної в заголовку сполуки у вигляді твердої речовини блідо-жовтого кольору (58мг). MS (АРСІ) 395 (М+Н споріднений амін, 100%). 1 Н ЯМР: d (D2O) 7,86 (1Н, с), 7,35 (1H, шир.т), 7,18 (1H, шир.т), 6,95 (1H, шир.т), 4,62 (1Н, м), 4,20-4,41 (2Н, м), 3,14-3,29 (2Н, м), 1,33 (3Н, шир.д). Приклад 11 2-[[(3-Хлор-4-метоксифеніл)метил]тіо]-4-[[2-гідрокси-1-гідроксиметил)етил]аміно]-7(8Н)-птеридинон а) 4-аміно-2-[(3-хлор-4-метоксифеніл)метил]тіо]-7(8Н)-птеридинон Вказану в підзаголовку сполуку (1,36г) одержували за допомогою способу, описаного в прикладі 6, стадія (d), з використанням продукту, одержаного в прикладі 6, стадія (b) (1,21г), і 3-хлор-4-метоксибензолметантіолу (0,72г). MS (ESI) 350 (M+H, 100%). b) 4-Бром-2-[(3-хлор-4-метоксифеніл)метил]тіо]-7(8Н)-птеридинон Вказану в підзаголовку сполуку (0,28г) одержували за допомогою способу, описаного в прикладі 3, стадія (b), з використанням продукту, одержаного в прикладі 11, стадія (а) (1,25г). MS (ESI) 411/413 (М-Н, 100%). с) 2-[[(3-Хлор-4-метоксифеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (89мг) одержували за допомогою способу, описаного в прикладі 8, з використанням продукту, одержаного в прикладі 11, стадія (b) (0,100г). Т.пл. 209-211°С MS (АРСІ) 424 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,73 (1H, с), 7,85 (1Н, с), 7,54 (1H, д), 7,45 (2Н, м), 7,06 (1Н, д), 4,81 (2Н, шир.), 4,33 (2Н, с), 4,20-4,28 (1H, м), 3,82 (3Н, с), 3,51-3,63 (4Н, М): Приклад 12 Монотріфторацетат 4-[(2-аміноетил)аміно]-2-[[(3-хлор-4-метоксифеніл)метил]тіо]-7(8Н)-птеридинону Вказану в заголовку сполуку (15мг) одержували за допомогою способу, описаного в прикладі 2, стадія (f), з використанням продукту, одержаного в прикладі 11, стадія (b) (50мг), і етилендіаміну (24мкл). Реакційну суміш розбавляли водою (150мл), ліофілізували з одержанням твердої речовини і очищали (ВЕРХ, колонка SymmetryÒ С8, 0,1% водна трифтороцтова кислота: ацетонітрил, ізократне елюювання 75:25). MS (АРСІ) 393 (М+Н споріднений амін, 100%). 1 Н ЯМР: d (D2O) 7,89 (1Н, с), 7,39 (1H, с), 7,28 (1Н, д), 6,92 (1H, д), 4,23 (2Н, с), 3,84 (5Н, м), 3,25 (2Н, шир.т). Приклад 13 2-[[(2-Фтор-4-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон а) 2-[(2,3-Дифторфеніл)метил]сульфоніл]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон (0,38г) перемішували в ацетонітрилі (150мл) і воді (150мл) з аксоном (3,79г) протягом 18год. Ацетонітрил видаляли у вакуумі, після чого залишалася водна суспензія. Тверду речовину збирали і висушували у вакуумі з одержанням вказаної в підзаголовку сполуки (0,30г). MS (АРСІ) 412 (М+Н) (100%). b) 2-Фтор-4-метоксибензолметантіол Вказану в підзаголовку сполуку (0,33г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням 1-(хлорметил)-2-фтор-4-метоксибензолу (0,56г). MS (ΕΙ) 172 (М+), 139 (100%). с) 2-[(2-Фтор-4-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил] аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку одержували за допомогою способу, описаного в прикладі 6, стадія (d), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), продукту, одержаного в прикладі 13, стадія (b) (0,10г), і ДМСО (2мл) замість NMP як розчинник. Реакційну суміш очищали (ВЕРХ, колонка SymmetryÒ С8, 0,1% водний ацетат амонію:ацетонітрил, градієнтне елюювання від 80:20 до 20:80) з одержанням твердої речовини білого кольору (63мг). MS (АРСІ) 392 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,69 (1H, шир.с), 7,83 (1H, с), 7,75 (1H, шир.д), 7,53 (1H, т), 6,83 (1Н, д), 6,72 (1Н, д), 4,83 (1Н, шир.т), 4,34 (3Н, м), 3,75 (3Н, с), 3,41-3,54 (2Н, м), 1,16 (3Н, д). Приклад 14 2-[[(2-Фтор-3-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон а) 2-Фтор-3-метилбензолметантіол Вказану в підзаголовку сполуку (0,36г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням 2-фтор-3-метилбензилброміду (0,55г). MS (ΕΙ) 156 (М+), 123 (100%). b) 2-[(2-Фтор-3-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (56мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г) і продукту, одержаного в прикладі 14, стадія (а) (94мг). MS (АРСІ) 376 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,69 (1H, шир.с), 7,83 (1H, с), 7,76 (1H, д), 7,43 (1H, т), 7,18 (1H, т), 7,02 (1H, т), 4,83 (1Н, т), 4,28-4,43 (3Н, м), 3,41-3,54 (2Н, м), 2,23 (3Н, с),1,15 (3Н, д). Приклад 15 2-[[(3-Фтор-2-метоксифеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон a) 1-(Хлорметил)-3-фтор-2-метоксибензол Розчин 3-фтор-2-метоксибензолметанолу (WO20000419) (0,50г) і тіонілхлориду (0,47мл) в дихлорметані (30мл) перемішували протягом 2 годин, потім концентрували у вакуумі з одержанням вказаної в підзаголовку сполуки, яку безпосередньо використали на наступній стадії. b) 3-Фтор-2-метоксибензолметантіол Вказану в підзаголовку сполуку (0,31г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням продукту, одержаного в прикладі 15, стадія (а). MS (ΕΙ) 172 (М+), 139 (100%). c) 2-[(3-Фтор-2-метоксифеніл)метил]тіо]-4-[[(1H)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (84мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і продукту, одержаного в прикладі 15, стадія (b) (0,10г). MS (АРСІ) 392 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,69 (1Н, шир.с), 7,83 (1Н, с), 7,76 (1Н, д), 7,37 (1H, д), 7,18 (1H, м), 7,03 (1H, м), 4,83 (1Н, шир.т), 4,31-4,42 (3Н, м), 3,91 (3Н, с), 3,42-3,53 (2Н, м),1,16 (3Н, д). Приклад 16 2-[[[(4-Дифторметокси)феніл]метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон a) 4-(Дифторметокси)бензолметантіол Вказану в підзаголовку сполуку (0,20г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням 4-(Дифторметокси) бензилброміду (0,53г). MS (ΕΙ) 190 (М+), 107 (100%). b) 2-[[4-{Дифторметокси)феніл]метил]тіо]-4-[[(1H)-2-гідрокси-1-іцетилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (51мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і продукту, одержаного в прикладі 16, стадія (а) (0,17г). MS (АРСІ) 410 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,67 (1H, шир.с), 7,82 (1H, с), 7,74 (1H, д), 7,53 (2Н, д), 7,19 (1H, т), 7,10 (2Н, д), 4,82 (1H, т), 4,28-4,41 (3Н, м), 3,39-3,52 (2Н, м), 1,15 (3Н, д). Приклад 17 4-[[(1H)-2-Гідрокси-1-метилетил]аміно]-2-[[(4-гідроксифеніл)метил]тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (8мг) одержували як побічний продукт в прикладі 16. MS (АРСІ) 360 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,60 (1H, шир.), 9,35 (1H, с), 7,81 (1H, с), 7,70 (1H, д), 7,24 (2Н, д), 6,68 (2Н, д), 4,83 (1H, т), 4,23-4,36 (3Н, м), 3,44-3,55 (2Н, м), 1,17 (3Н, д). Приклад 18 4-[[(1H)-2-Гідрокси-1-метилетил]аміно]-2-[[(3-метилфеніл)метил]тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (75мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і 3-метилбензолметантіолу (75мг). MS (АРСІ) 358 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,66 (1H, шир.с), 7,82 (1H, с), 7,73 (1H, шир.д), 7,16-7,26 (ЗН, м), 7,05 (1H, шир.д), 4,82 (1H, шир.т), 4,34 (3Н, м), 3,40-3,54 (2Н, м), 2,28 (3Н, с), 1,17(3Н, шир.д). Приклад 19 2-[(1,3-бензодіоксол-4-ілметил)тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон a) 1,3-Бензодіоксол-4-метантіол Вказану в підзаголовку сполуку (0,29г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням 4-(бромметил)-1,3-бензодіоксолу (0,51г). MS (ΕΙ) 168 (М+), 135 (100%). b) 2-[{1,3-Бензодіоксол-4-ілметил)тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (57мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і продукту, одержаного в прикладі 19, стадія (а) (0,10г). MS (АРСІ) 388 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,66 (1Н, шир.с), 7,82 (1Н/з), 7,75 (1Н, шир.д), 6,99 (1Н, д), 6,80 (2Н, м), 6,04 (2Н, с), 4,82 (1H, т), 4,33 (3Н, м), 3,41-3,55 (2Н, м), 1,16 (3Н, д). Приклад 20 2-[[(2,4-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон a) 2,4-Дифторбензолметантіол Вказану в підзаголовку сполуку (0,35г) одержували за допомогою способу, описаного в прикладі 6, стадія (с), з використанням 2,4-дифторбензилброміду (0,55г). MS (ΕΙ) 160 (М+), 127(100%). b) 2-[(2,4-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (77мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і продукту, одержаного в прикладі 20, стадія (а) (87мг). MS (АРСІ) 380 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,70 (1H, шир.), 7,83 (1H, с), 7,67-7,76 (2Н, м), 7,24 (1H, щир.т), 7,03 (1Н, шир.т), 4,82 (1H, шир.), 4,30-4,37 (3Н, м), 3,43-3,49 (2Н, м), 1,15 (3Н, шир.д). Приклад 21 2-[[(3-Хлорфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (66мг) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і 3-хлорбензолметантіолу (92мг). MS (АРСІ) 378 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,70 (1Н, шир.с), 7,82 (1H, с), 7,74 (1Н, шир.д), 7,55 (1Н, с), 7,45 (1H, шир.д), 7,34 (2Н, м), 4,81 (1H, шир.т), 4,31-4,43 (3Н, м), 3,43-3,50 (2Н, м), 1,15(3Н, шир.д). Приклад 22 4-[[(1R)-2-Гідрокси-1-метилетил]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,038г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,10г), і 5-ізоксазолілметилмеркаптану (0,057г). Т.пл. 191-194°С MS (АРСІ) 335 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,71 (1H, шир.с), 8,47 (1H, с), 7,84 (1H, с), 7,80 (1Н, д), 6,51 (1H, с), 4,81 (1Н, т), 4,54 (2Н, кв), 4,26 (1H, м), 3,44 (2Н, м), 1,13 (3Н, д). Приклад 23 4-[[2-Гідрокси-1-(гідроксиметилетил]аміно]-2-[(5-ізоксазолілметил)тіо]-7(8Н)-птеридинон a) 2-[(2,3-Дифторфеніл)метил]сульфоніл]-4-[[2-гідрокси-1-гідроксиметилетил]аміно]-7(8Н)-птеридинон 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-гідроксиметилетил]аміно]-7(8H)-птеридинон (2,25г) перемішували в ацетонітрилі (750мл) і воді (750мл) з оксоном (22,5г) протягом 18год. Ацетонітрил видаляли у вакуумі, після чого залишалася водна суспензія. Суміш екстрагували в етилацетат. Об'єднані екстракти промивали насиченим розчином хлориду натрію, висушували (MgSO4), a розчинник видаляли у вакуумі з одержанням вказаної в підзаголовку сполуки (1,92г). MS (АРСІ) 428 (М+Н) (100%). b) 4-[[2-Гідрокси-1-(гідроксиметилетил]аміно]-2-[(5-ізоксазолілметил)тіо)]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,03г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 23, стадія (а) (0,20г), і 5-ізоксазолілметилмеркаптану (0,1г). Т.пл. 199-203°С MS (АРСІ) 351 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 8,47 (1H, с), 7,86 (1H, с), 7,54 (1Н, д), 6,55 (1Н, с), 4,80 (2Н, т), 4,56 (2Н, с), 4,22 (1H, м), 3,55 (4Н, м). Приклад 24 4-[[(1R)-2-Гідрокси-1-метилетил]аміно]-2-[[(5-метил-2-фураніл)метил]тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,058г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і 5-метил-2фуранілметилмеркаптану (0,15г, чистота 80%). Т.пл. 197-199°С MS (АРСІ) 348 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,65 (1H, шир.с), 7,82 (1H, с), 7,74 (1H, Д), 6,27 (1H, Д), 5,96 (1H, д), 4,83 (1Н, т), 4,37 (2Н, с), 4,32 (1H, м), 3,47 (2Н, м), 2,22 (3Н, с), 1,17 (3Н, д). Приклад 25 2-[[(2-Фторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,089г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і 2-фторбензилмеркаптану (0,083г). Т.пл. 203-205°С MS (АРСІ) 362 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,69 (1H, шир.с), 7,83 (1H, с), 7,75 (1Н, Д), 7,64 (1H, м), 7,32 (1H, м), 7,20 (1H, м), 7,14 (1H, м), 4,82 (1Н, т), 4,41 (2Н, kb), 4,31 (1Н, м), 3,47 (2Н,м), 1,15 (3Н, д). Приклад 26 4-[[(1H)-2-Гідрокси-1-метилетил]аміно]-2-[(2-тієніл)метил)тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,076г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і 2-тієнілметилмеркаптану (0,050г). Т.пл. 209-212°С MS (АРСІ) 350 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,66 (1H, шир.с), 7,83 (1H, с), 7,77 (1H, д), 7,37 (1H, д), 7,12 (1Н, д), 6,93 (1H, дд), 4,82 (1H, т), 4,62 (2Н, кв), 4,36 (1Н, м), 3,46 (2Н, м), 1,17 (3Н, д). Приклад 27 2-[[(2-Фторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,088г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 23, стадія (а) (0,21г), і 2-фторбензилмеркаптану (0,83г). Т.пл. 206-208°С MS (АРСІ) 378 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,67 (1H, шир.с), 7,84 (1Н, с), 7,66 (1Н, т), 7,47 (1H, д), 7,32 (1H, м), 7,16 (2Н, м), 4,80 (2Н, т), 4,41 (2Н, с), 4,25 (1H, м), 3,57 (4Н, м). Приклад 28 4-[[2-Гідрокси-1-(гідроксиметил)етил]аміно]-2-[(2-тієнілметил)тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,075г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 23, стадія (а) (0,21г), і 2-тієнілметилмеркаптану (0,05г). Т.пл. 220-223°С MS (АРСІ) 366 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,67 (1H, шир.с), 7,85 (1H, с), 7,49 (1Н, д), 7,38 (1H, д), 7,15 (1Н, д), 6,93 (1Н, дд), 4,81 (2Н, т), 4,64 (2Н, с), 4,28 (1Н, м), 3,59 (4Н, м). Приклад 29 2-[[(2-Фтор-5-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил] аміно]-7(8Н)-птеридинон a) Ацетат 2-фтор-5-метилбензолметантіолу Діізопропілазодикарбоксилат (2,68мл) додавали до розчину трифенілфосфіну (3,57г) в безводному ТГФ (30мл) при 0°С. Суміш перемішували протягом 1год. Краплями протягом 40хв. додавали розчин 2-фтор-5метилбензолметанолу (0,96мл) в безводному ТГФ (10мл). Суміш перемішували протягом 1год., потім залишали нагріватися до кімнатної температури і перемішували протягом ще 3год. Розчинник випаровували, а залишок суспендували в ефірі і фільтрували. Фільтрат випаровували і очищали колонковою хроматографією з елююванням 3% етилацетатом в ізогексані з одержанням вказаної в підзаголовку сполуки у вигляді масла (1,23г). GC/MS 100% (ЕІ) 198 (М+), 123 (100%). b) 2-Фтор-5-метилбензилметантіол Ацетат 2-фтор-5-метилбензолметантіолу (1,2г) перемішували в метанолі, заздалегідь насиченому аміаком (10мл), при кімнатній температурі протягом 30хв. Розчинник випаровували, а залишок розподіляли між ефіром і водою. Шари розділяли і воду екстрагували ефіром. Об'єднаний ефірний шар промивали водою, висушували і випаровували, після чого залишалося масло (0,9г). GC/MS 971 (ЕІ) 156 (М+), 123 (100%). c) 2-[(2-Фтор-5-метилфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,093г) одержували за допомогою способу, описаного в прикладі 13, стадія (с), з використанням продукту, одержаного в прикладі 13, стадія (а) (0,20г), і продукту, одержаного в прикладі 29, стадія (b). Т.пл. 202-204°С MS (АРСІ) 376 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,68 (1Н, шир.с), 7,82 (1Н, с), 7,74 (1H, д), 7,41 (1Н, д), 7,07 (2Н, м), 4,83 (1H, т), 4,33 (ЗН, м), 3,49 (2Н, м), 2,25 (3Н, с), 1,17 (3Н, д). Приклад 30 2-[[(2-Фтор-3-(трифторметил)феніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон a) 4-(1-Метилетокси)-2-[[[3-(трифторметил)феніл]метил]тіо]-7(8Н)-птеридинон 6-[[[2-Фтор-3-(трифторметил)феніл]метил]тіо]-2-[[[3-(трифторметил)феніл]метил]тіо]-4,5-піримідиндіамін (7,12г) додавали до розчину метоксиду натрію, одержаного з натрію (0,62г) і метанолу (150мл). Додавали етилгліоксалат (6,5мл, 50% в толуолі), і суміш кип'ятили із зворотним холодильником протягом 30хв. Розчинник випаровували і залишок повторно розчиняли в 2-пропанолі. Додавали натрій (1,1г) і суміш кип'ятили із зворотним холодильником протягом 30хв. Розчинник випаровували, а залишок вміщували у воду і підкисляли розбавленою хлористоводневою кислотою. Суміш екстрагували дихлорметаном і екстракти промивали водою, потім висушували (MgSO4) і випаровували. Після очищення флеш-хроматографією з елююванням 10% етилацетатом в дихлорметані одержували Вказану в підзаголовку сполуку у вигляді твердої речовини (2,64г). Т.пл. 205-206°С. MS (АРСІ) 415 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 13,03 (1H, с), 8,06 (1Н, т), 7,97 (1H, с), 7,70 (1Н, т), 7,38 (1Н, т), 5,38 (1Н, м), 4,53 (2Н, с), 1,31 (6Н, д). b) 2-[(2-Фтор-3-(трифторметил)феніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинон Продукт, одержаний в прикладі 30, стадія (а) (0,3г), і D-аланінол (0,6мл) під впливом ультразвуку утворює пасту з N-метилімідазолом (Імл). Вказану пасту нагрівали в мікрохвильовій установці потужністю 300W при 160°С протягом 25хв. Розчинник видаляли відгоном з колби в колбу, а залишок очищали ВЕРХ із зверненою фазою з одержанням вказаної в заголовку сполуки (0,52г). Т.пл. 217-219°С MS (АРСІ) 430 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 8,03 (1H, т), 7,83 (1H, с), 7,76 (1Н, д), 7,68 (1H, т), 7,35 (1H, т), 4,82 (1H, т), 4,47 (2Н, кв), 4,26 (1H, м), 3,45 (2Н, м), 1,12 (3Н, д). Приклад 31 2-[[(2-Фтор-3-(трифторметил)феніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметил)етил]аміно]-7(8Н)птеридинон Вказану в заголовку сполуку (0,049г) одержували за допомогою способу, описаного в прикладі 30, стадія (b), з використанням продукту, одержаного в прикладі 30, стадія (а) (0,30г), і 2-амінопропан-1,3-діолу (0,66г). Т.пл. 244-245°С MS (АРСІ) 446 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 12,76 (1H, с), 8,06 (1Н, т), 7,85 (1H, с), 7,68 (1H, т), 7,52 (1H, д), 7,35 (1H, т), 4,81 (2Н, т), 4,47 (2Н, с), 4,23 (1H, м), 3,55 (4Н, м). Приклад 32 2-[[(2-Фтор-3-(трифторметил)феніл)метил]тіо]-4-[(2-гідроксіетил)аміно]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,072г) одержували за допомогою способу, описаного в прикладі 30, стадія (b), з використанням продукту, одержаного в прикладі 30, стадія (а) (0,30г), і етаноламіну (0,5мл). Т.пл. 221-222°С MS (АРСІ) 416 (М+Н, 100°про). 1 Н ЯМР: d (ДМСО) 12,73 (1H, с), 8,08 (1H, м), 7,03 (1H, т), 7,85 (1Н, с), 7,68 (1H, т), 7,36 (1H, т), 4,78 (1Н, т), 4,47 (2Н, с), 3,52 (4Н, м). Приклад 33 4-[(2-Аміноетил)аміно]-2-[[(2-фтор-3-(трифторметил)феніл)метил]тіо]-7(8Н)-птеридинон Вказану в заголовку сполуку (0,054г) одержували за допомогою способу, описаного в прикладі 30, стадія (b), з використанням продукту, одержаного в прикладі 30, стадія (а) (0,30г), і етилендіаміну (0,5мл). Вказаний продукт очищали кристалізацією з метанолу. MS (АРСІ) 415 (М+Н, 100%). 1 Н ЯМР: d (ДМСО) 8,01 (1H, т), 7,91 (1H, шир.с), 7,67 (1H, м), 7,58 (1H, щир.с), 7,52 (1H, шир.с), 7,35 (1H, т), 7,17 (1H, шир.с), 4,45 (2Н, с), 3,42 (2Н, т), 3,15 (2Н, шир.с), 2,75 (8Н, м). Приклад 34 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[2-гідрокси-1-(гідроксиметнл)-1-метилетил]аміно]-7(8Н)-птеридинон Продукт, одержаний в прикладі 2, стадія (є) (400мг), розчиняли в Ν-метилпіролідиноні (15мл) і додавали основу Ханігса (0,36мл), після чого додавали 2-аміно-2-метил-1,3-пропандіол (0,273г). Суміш перемішували при 110°С протягом 17 годин. Одержану суміш виливали у воду і залишали стояти протягом ночі, щоб дозволити твердій речовині випасти в осад. Вказану тверду речовину відфільтровували, потім очищали препаративною ВЕРХ із зверненою фазою на Symmetry C-8Ò, з використанням ацетонітрилу від 10 до 95% у 0,1% водному ацетаті амонію з витратою 20мл/хв. протягом 10хв., з одержанням вказаної в заголовку сполуки у вигляді голчатих кристалів не зовсім білого кольору (0,113г). MS: (АРСІ) (+ve) 410 (М+Н) 1 Н ЯМР: d (ДМСО) 1,30 (3Н, с), 3,54-3,58 (2Н, м), 3,63-3,67 (2Н, м), 4,45 (2Н, с), 4,98-5,01 (2Н, т), 7,13 (1H, с), 7,15-7,19 (1Н, м), 7,31-7,36 (1Н, м), 7,45-7,49 (1Н, т), 7,84 (1H, с), 12,74 (1H, шир.с). Приклад 35 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-етилетил]аміно]-6-метил-7(8Н)-птеридинон a) 4-Аміно-2-[(2,3-дифторфеніл)метил]тіо]-6-метил-7(8Н)-птеридинон Вказану в підзаголовку сполуку одержували з продукту, одержаного в прикладі 2, стадія (b) (2г), і триетилфосфонопропіонату (3,2г) з використанням способу прикладу 3, стадія (а). MS: АРСІ (+ve) 336 (М+1). 1 Н ЯМР: d (ДМСО) 2,33 (с, 3Н), 4,40 (с, 2Н), 7,09-7,58 (м, 3Н), 12,56 (шир.с, 1H). b) 4-Бром-2-[(2,3-Дифторфеніл)метил]тіо]-6-метил-7(8Н)-птеридинон Вказану в підзаголовку сполуку одержували з продукту, одержаного в прикладі 35, стадія (а) (1,5г), і бромоформу (30мл) з використанням способу прикладу 3, стадія (b). MS: APCI (+ve) 440 (M+1). 1 Н ЯМР: d (ДМСО) 2,39 (с, 3Н), 4,52 (с, 2Н), 7,11-7,55 (м, 3Н), 13,1 (шир.с, 1H). с) 2-[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-метил-7(8Н)-птеридинон Вказану в заголовку сполуку одержували з продукту, одержаного в прикладі 35, стадія (b) (200мг), і Dаланінолу (120мкл), з використанням способу прикладу 2, стадія (f). MS: APCI (+ve) 394 (M+1). 1 Н ЯМР: d (ДМСО) 1,12 (д, 3Н), 2,34 (с, 3Н), 3,45 (м, 2Н), 4,24-4,33 (м, 1H), 4,43 (с, 2Н), 4,85 (шир.с, 1H), 7,10-7,49 (м, 3Н), 12,58 (с, 1Н). Приклад 36 Етиловий ефір 2-[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7-оксо-6птеридинкарбонової кислоти a) Етиловий ефір 4-аміно-2-[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-7-оксо-6-птеридинкарбонової кислоти Продукт, одержаний в прикладі 2, стадія (b) (5г), розчиняли в діетилмалонаті (100мл) і нагрівали до 120°С протягом 10год. при перемішуванні. Реакційну суміш залишали охолоджуватися і тверду речовину, що випала в осад, фільтрували, промивали водою і висушували в сушильному шафі при 50°С з одержанням продукту у вигляді твердої речовини жовтого кольору (3,2г). MS: АРСІ (+ve) 394 (М+1). 1 Н ЯМР: d (ДМСО) 1,29-1,33 (т, 3Н), 4,28-4,35 (кв, 2Н), 4,42 (с, 2Н), 7,11-7,59 (м, 3Н), 7,88 (шир.с, 1H), 8,08 (шир.с, 1Н), 13,05 (с, 1H). b) Етиловий ефір 4-6ром-2-[(2,3-дифторфетл)метил]тіо]-7,8-дигідро-7-оксо-6-птеридинкарбонової кислоти Вказану в підзаголовку сполуку одержували з продукту, одержаного в прикладі 36, стадія (а) (2г), і бромоформу (40мл) з використанням способу прикладу 3, стадія (b). MS: APCI (+ve) 458 (M+1). 1 Н ЯМР: d (ДМСО) 1,31 (т, 3Н), 4,40 (кв, 2Н), 4,52 (с, 2Н), 7,13-7,55 (м, 3Н), 13,05 (с, 1Н). с) Етиловий ефір 2-[(2,3-дифторфеніл)метил]тіо]-7,8-дигідро-4-[[(1R)-2-гвдрокси-1-метилетил]аміно]-7оксо-6-птеридинкарбонової кислоти Вказану в заголовку сполуку одержували з продукту, одержаного в прикладі 36, стадія (b) (300мг), і Dаланінолу (180мкл), з використанням способу прикладу 2, стадія (f). MS: APCI (+ve) 451 (M+1). 1 Н ЯМР: d (ДМСО) 1,12 (д, 3Н), 1,29 (т, 3Н), 3,41-3,53 (м, 2Н), 4,22-4,32 (м, 3Н), 4,51 (с, 2Н), 4,83-4,86 (т, 1Н), 7,07-7,47 (м, 3Н). Приклад 37 2-[[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-етилетил]аміно]-6-(трифторметил)-7(8Н)-птеридинон a) 4-Аміно-2-[(2,3-дифторфеніл)метил]тіо]-6-(трифторметил)-7(8Н)-птеридинон Вказану в підзаголовку сполуку одержували з продукту, одержаного в прикладі 2, стадія (с) (5г), і трифторпірувату (10мл) з використанням способу прикладу 2, стадія (d). MS: APCI (+ve) 390 (M+1). 1 Н ЯМР: d (ДМСО) 4,32 (с, 2Н), 7,10-7,70 (м, 3Н), 7,92-8,23 (2 шир.с, 2Н), 13,23 (шир.с, 1H). b) 4-Бром-2-[(2,3-дифторфеніл)метил]тіо]-6-(трифторметил)-7(8Н)-птеридинон Вказану в підзаголовку сполуку одержували з продукту, одержаного в прикладі 37, стадія (а) (1,5г), і бромоформу (30мл) з використанням способу прикладу 3, стадія (b). MS: АРСІ (+ve) 454 (М+1). c) 2-[(2,3-Дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-6-(грифторметил)-7(8Н)птеридинон Вказану в заголовку сполуку одержували з продукту, одержаного в прикладі 37, стадія (b) (150мг), і Dаланінолу (100мкл) з використанням способу прикладу 2, стадія (f). MS: APCI (+ve) 448 (M+1). 1 Н ЯМР: d (ДМСО) 1,15 (д, 3Н), 3,50 (м, 2Н), 4,37 (м, 1H), 4,47 (с, 2Н), 4,89 (т, 1H), 7,12-7,49 (м, 3Н), 7,79 (д, 1H), 13,25 (шир.с, 1Н). Приклад 38 Натрієва сіль 2-[(2,3-дифторфеніл)метил]тіо]-4-[[(1R)-2-гідрокси-1-метилетил]аміно]-7(8Н)-птеридинону Продукт, одержаний в прикладі 2, стадія (f), суспендували у воді, що містить один еквівалент гідроксиду натрію, після чого додавали малу аліквоту тетрагідрофурану і метанолу для полегшення розчинення. Одержаний розчин потім ліофілізували з одержанням вказаної в заголовку сполуки у вигляді безбарвної твердої речовини. Т.пл. 255-260°С (розклад.) MS: APCI (+ve) 380 (M+1). 1 Н ЯМР: d (ДМСО) 7,42 (1H, м), 7,37 (1H, с), 7,31 (1H, м), 7,13 (1H, м), 6,89 (1H, д), 4,79 (1Н, т), 4,40 (2Н, с), 4,15 (1Н, м), 3,45 (2Н, м), 1,12 (3Н, д). Приклади 39-72 Сполуки прикладів 39-72 одержували нагріванням продукту, одержаного в прикладі 2, стадія (е) (2,5х106 моль) з відповідним аміном (2 еквіваленти) і Ν-етилдіізопропіламіном (6 еквівалентів) в N-метилпіролідиноні (0,25мл) в герметично закупореній посудині при 100°С протягом 1 години. Приклад 39 2-[(2,3-Дифторбензил)тіо]-4-(етиламіно)-7(8Н)-птеридинон MS: (APCI) (+ve) 350 (M+1). Приклад 40 2-[(2,3-Дифторбензил)тіо]-4-(ізопропіламіно)-7(8Н)-птеридинон MS: (APCI) (+ve) 364 (M+1). Приклад 41 (+/-)-4-(втор-Бутиламіно)-2-[(2,3-Дифторбензил)тіо]-7(8Н)-птеридинон MS: APCI (+ve) 378 (M+1). Приклад 42 2-({2-[(2,3-Дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)ацетамід MS: АРСІ (+ve) 379 (M+1). Приклад 43 (+/-)-2-[(2,3-Дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 380 (M+1). Приклад 44 (S)-2-[(2,3-Дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 380 (М+1). Приклад 45 (+/-)-2-[(2,3-Дифторбензил)тіо]-4-[(2-гідрокси-1-метилетил)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 380 (М+1). Приклад 46 (R)-2-[(2,3-Дифторбензил)тіо]-4-[(2-гідроксипропіл)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 380 (М+1). Приклад 47 2-[(2,3-Дифторбензил)тіо]-4-[(3-гідроксипропіл)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 380 (М+1). Приклад 48 2-[(2,3-Дифторбензил)тіо]-4-[(2-гідроксіетил)(метил)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 380 (М+1). Приклад 49 3-[{2-[(2,3-Дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}(метил)аміно]пропаннітрил MS: АРСІ (+ve) 389 (М+1). Приклад 50 (R)-2-[(2,3-Дифторбензил)тіо]-4-{[1-{гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 51 {S)-2-[(2,3-Дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 52 2-[(2,3-Дифторбензил)тіо]-4-[(4-{гідроксибутил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 53 (+/-)-2-[(2,3-Дифторбензил)тіо]-4-{[1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 54 2-[(2,3-Дифторбензил)тіо]-4-[(2-гідрокси-1,1-диметилетил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 55 2-[(2,3-Дифторбензил)тіо]-4-[етил(2-гідроксіетил)аміно]-7{8Н)-птеридинон MS: APCI (+ve) 394 (M+1). Приклад 56 (+/-)-4-[(3-Аміно-2-гідроксипропіл)аміно]-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон MS: APCI (+ve) 395 (M+1). Приклад 57 (+/-)-2-[(2,3-Дифторбензил)тіо]-4-[(1,3-диметилбутил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 406 (M+1). Приклад 58 (1R,2R)-2-[(2,3-Дифторбензил)тіо]-4-[(2-гідроксициклопентил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 406 (M+1). Приклад 59 2-[(2,3-Дифторбензил)тіо]-4-[(5-гідроксипентил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 408 (M+1). Приклад 60 (+/-)-2-[(2,3-Дифторбензил)тіо]-4-{(1-(гідроксиметил)бутил]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 408 (M+1). Приклад 61 (+/-)-Метил 2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-дигідро-4-птеридиніл}аміно)пропаноат MS: APCI (+ve) 408 (M+1). Приклад 62 2-[(2,3-Дифторбензил)тіо]-4-[(3-гідрокси-2,2-диметилпропіл)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 408 (M+1). Приклад 63 (1R,2R)-2-[(2,3-Дифторбензил)тіо]-4-{[2-гідрокси-1-(гідроксиметил)пропіл]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 410 (M+1). Приклад 64 4-[біс(2-Гідроксіетил)аміно]-2-[(2,3-Дифторбензил)тіо]-7(8Н)-птеридинон MS: APCI (+ve) 410 (M+1). Приклад 65 2-[(2,3-Дифторбензил)тіо]-4-{[2-(2-гідроксіетокси)етил]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 410 (M+1). Приклад 66 2-[(2,3-Дифторбензил)тіо]-4-[(2,2-диметоксіетил)аміно]-7(8Н)-птеридинон MS: APCI (+ve) 410 (M+1). Приклад 67 4-{[2-{Діетиламіно)етил]аміно}-2-[(2,3-дифторбензил)тіо]-7(8Н)-птеридинон MS: APCI (+ve) 421 (M+1). Приклад 68 (S)-2-[(2,3-Дифторбензил)тіо]-4-{[1-(гідроксиметил)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон MS: APCI (+ve) 422 (M+1). Приклад 69 (R)-2-[(2,3-Дифторбензил)тіо]-4-{[1-(гідроксиметил)-3-метилбутил]аміно)-7(8Н)-птеридинон MS: АРСІ (+ve) 422 (М+1). Приклад 70 2-[(2,3-Дифторбензил)тіо]-4-[(6-(гідроксигексил)аміно]-7(8Н)-птеридинон MS: АРСІ (+ve) 422 (М+1). Приклад 71 2-[(2,3-Дифторбензил)тіо]-4-{[3-(диметиламіно)-2,2-диметилпропіл]аміно}-7(8Н)-птеридинон MS: АРСІ (+ve) 436 (М+1). Приклад 72 (S)-Етил 2-({2-[(2,3-дифторбензил)тіо]-7-оксо-7,8-Дигідро-4-птеридитл}аміно)-3-гідроксипропаноат MS: АРСІ (+ve) 438 (М+1). Фармакологічні дані Аналіз зв'язування ліганду [125I]IL-8 (людський, рекомбінантний) придбавшій у компанії Amersham, U.K., зі специфічною активністю 2000 Кі/ммоль. Всі інші реагенти були кваліфікації «чистий для аналізу». Високі рівні hrCXCR2 експресували в клітини НЕК 293 (клітини нирки людського ембріона 293 ЕСАСС №85120602) (Lee et al. (1992) J. Biol. Chem. 267 стор.16283-16291). кДНК hrCXCR2 ампліфікували і клонували з мРНК нейтрофілів людини. ДНК клонували в PCRScript (Stratagene) і клони ідентифікували з використанням ДНК. Кодуючу послідовність субклонували в еукаріотичний вектор експресії RcCMV (Invitrogen). Плазмідну ДНК одержували з використанням Quiagen Megaprep 2500 і трансфектували в клітини НЕК 293 з використанням реагенту ліпофектаміну (Gibco BRL). Клітини клону з найбільш високою експресією збирали у фізіологічний розчин з фосфатним буфером, що містить 0,2% (мас/об.) етилендіамінтетраоцтової кислоти (EDTA), і центрифугували (200g, 5хв.). Клітинний осад ресуспендували в крижаному гомогенізаційному буфері [10мМ HEPES (рН 7,4), 1мМ дитіотреїтол, 1мМ EDTA і ряд інгібіторів протеаз (1мМ фенілметилсульфонілфторид, 2мкг/мл інгібітору трипсину з соєвих бобів, 3мМ бензамідин, 0,5мкг/мл лейпептину і 100мкг/мл бацитрацину)] і клітини залишали набухати протягом 10 хвилин. Клітинний препарат руйнували за допомогою скляної ступи/м'яла, що втримується в руці гомогенізатора PTFE, а клітинні мембрани збирали центрифугуванням (45 хвилин, 100000д, 4°С). Мембранний препарат зберігали при -70°С в гомогенізаційному буфері з додаванням сольового розчину Tyrode (137мМ NaCl, 2,7мМ КСl, 0,4мМ NaH2PO4), 0,1% (мас/об.) желатину і 10% (об./об.) гліцерину. Всі аналізи виконували на 96-ямкових фільтраційних планшетах Multiscreen 0,45мкм (Millipore, U.K.). Кожний аналіз містив ~50пМ [125I]IL-8 і мембрани (еквівалентні ~200000 клітин) в буфері для аналізу [сольовий розчин Tyrode з 10мМ HEPES (рН 7,4), 1,8мМ СаСl2, 1мМ MgCl2, 0,125мг/мл бацитрацину і 0,1% (мас./об.) желатину]. Крім цього, сполуки формули (І), згідно з прикладами, заздалегідь розчиняли в ДМСО і додавали для одержання кінцевої концентрації 1% (об./об.) ДМСО. Аналіз починали з додавання мембран і через 1,5 години при кімнатній температурі мембрани збирали фільтруванням з використанням вакуумного фільтраційного пристрою Millipore Multiscreen і двічі промивали буфером для аналізу (без бацитрацину). З планшетного вузла Multiscreen видаляли задні пластини, фільтри висушували при кімнатній температурі, виштовхували поршнем, а потім лічили на γ-лічильнику Cobra. Сполуки формули (І), згідно з прикладами, як було встановлено, мали величини ІС50 менше (
ДивитисяДодаткова інформація
Назва патенту англійськоюPteridine compounds for the treatment of psoriasis
Автори англійськоюBonnert Roger
Назва патенту російськоюПтеридиновые соединения для лечения псориаза
Автори російськоюБоннерт Роджер
МПК / Мітки
МПК: A61P 29/00, A61P 9/10, C07D 513/04, A61P 7/00, A61P 37/02, A61K 31/519, A61K 31/542, A61P 17/06, A61P 11/06, C07D 475/00, A61P 37/08, A61P 19/02, A61P 43/00
Мітки: сполуки, псоріазу, лікування, птеридинові
Код посилання
<a href="https://ua.patents.su/19-72590-pteridinovi-spoluki-dlya-likuvannya-psoriazu.html" target="_blank" rel="follow" title="База патентів України">Птеридинові сполуки для лікування псоріазу</a>
Попередній патент: Спосіб вихрового подрібнення матеріалів і пристрій для його здійснення
Наступний патент: Спосіб примусового наповнення крила параплана (варіанти) та параплан
Випадковий патент: Безредукторний вертикальноосьовий вітроагрегат























