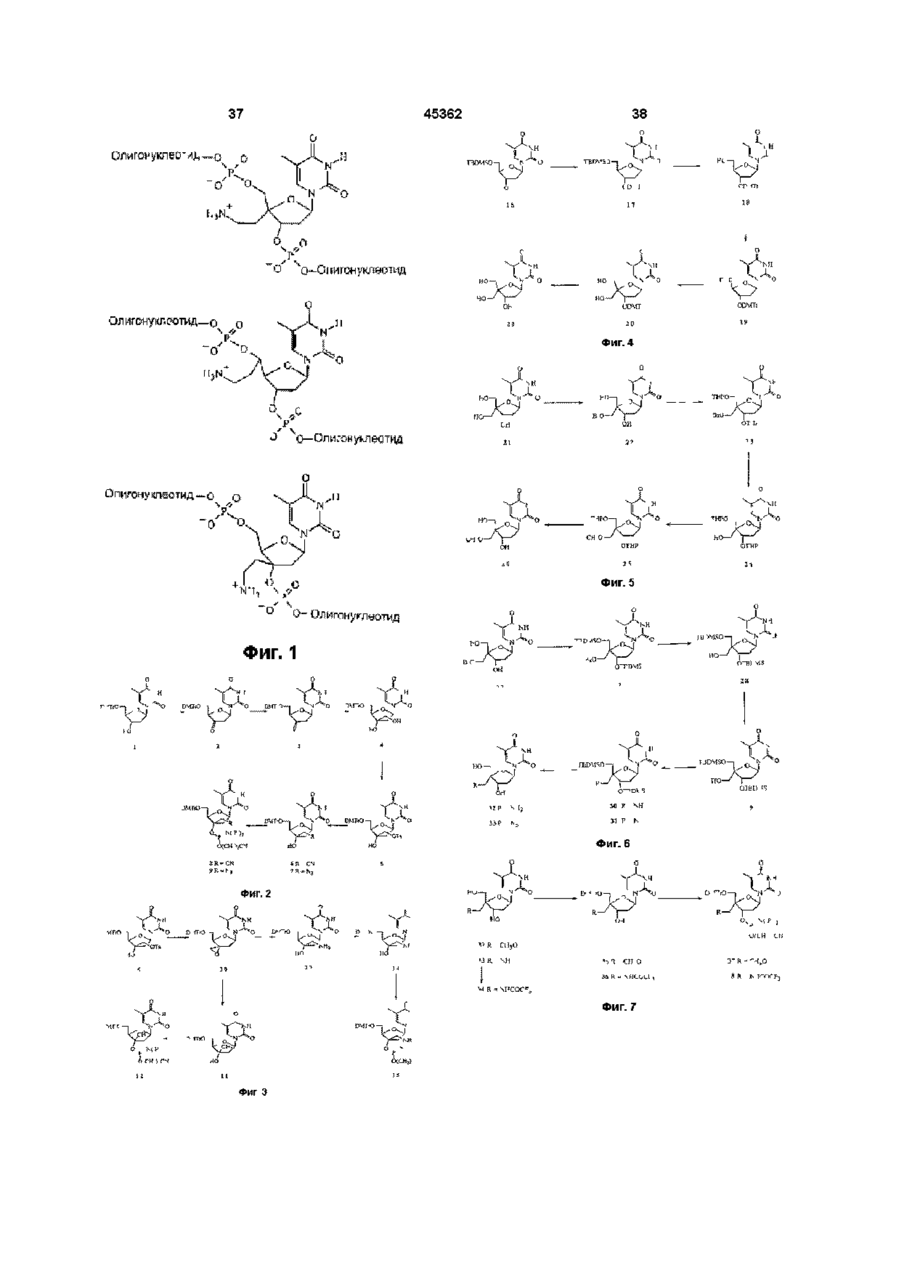
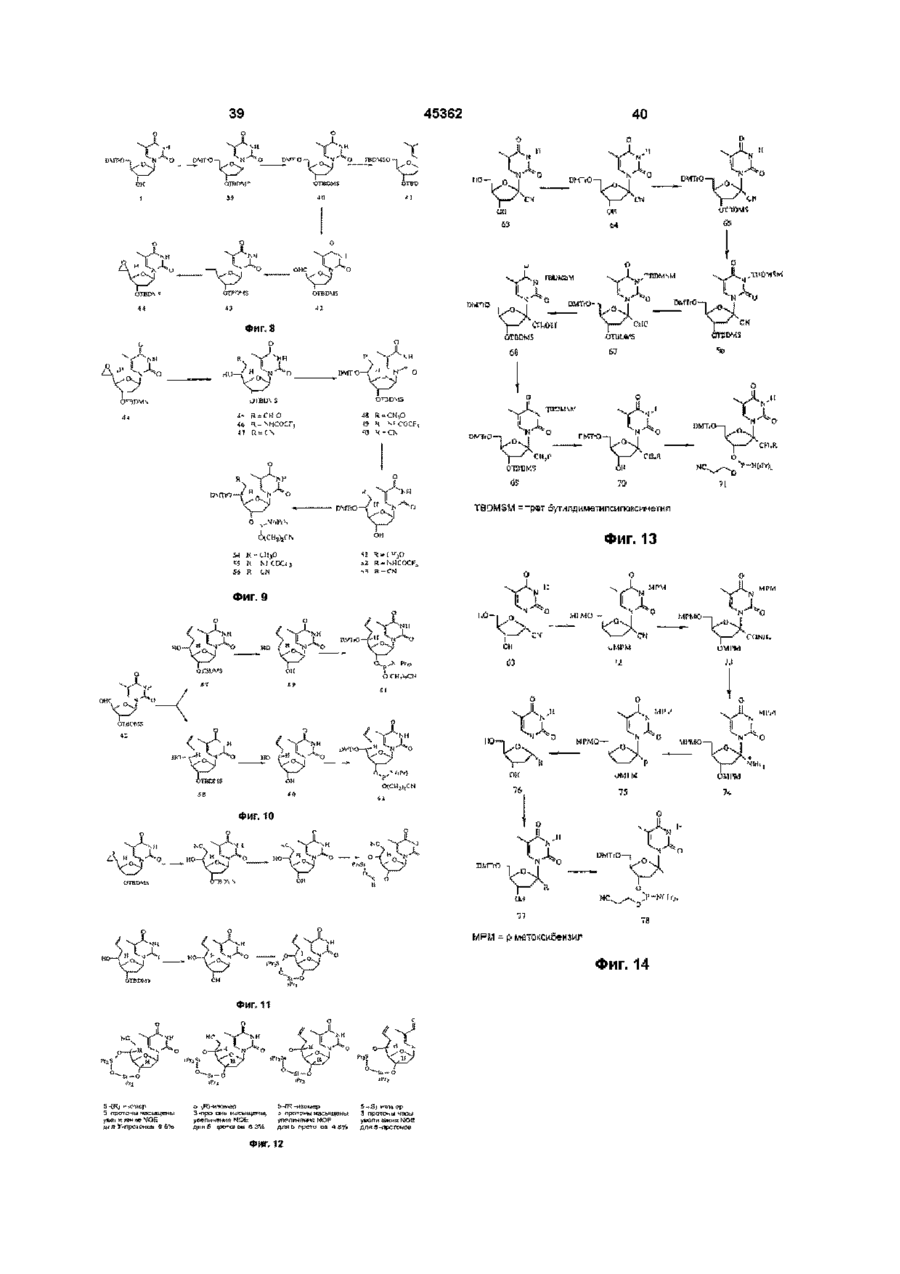
Нуклеозиди з модифікованими цукрами та олігонуклеотиди
Номер патенту: 45362
Опубліковано: 15.04.2002
Автори: Рамасамі Кандасамі, Зайферт Уілфрід, Ванг Гуанжі
Формула / Реферат
1. Нуклеозиды с модифицированными сахарами общей формулы
где В - нуклеозидное основание, такое, как тимин, любая арильная составляющая R'1, R'3, R'4 и R'5 представляет собой фенил, полицикл или гетероцикл;
R2 - Н, X - S, О, СН2,
и, если
(I) R3 и R5 независимо выбраны из группы, состоящей из ОН, 2-цианоэтил-(N, N-диизопропил) фосфорамидитной или гидроксиблокирующей группы, то
(A) Х представляет S, СН2;
R'1, R'3, R'4 и R'5 независимо выбраны из группы, состоящей из Н, CN, N3, N02, СF3, алкила С1-С10, при условии, что R'1, R'3, R'4 и R'5 не могут быть одновременно Н, а алкил может быть замещен одной из групп CN, NH2, ОН, Вr, S03R, COOR, где R - ацетил, СF3СО, тозил;
(Б) где Х представляет О;
R'1 выбирают из группы, состоящей из N3, NO2, СF3, алкила С1-С10, алкил может быть замещен одной из групп NO2, N3, СF3, Вr;
R'1, R'3, R'4 и R'5 все являются Н;
(B) где Х представляет собой О;
R'3 выбран из группы, состоящей из CN, N3, замещенного алкила, где заместителем является CN, N3, NH2, R'1, R'4 и R'5 все являются Н;
(II) где Х представляет О;
один из радикалов R3 и R5 представляет межнуклеотидную связь, а другой выбран из группы, состоящей из ОН, межнуклеотидной связи и гидроксиблокирующей группы, R' - обозначает Н, а два радикала из R'3, R'4 и R'5 обозначают Н, а третий модифицирован, как указано ниже:
(A) R'3 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила С1-С10, арила; замещенного арила, а заместитель у алкила С1-С10 иной, чем ОН;
(Б) R'4 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила, радикала с высокой электроотрицательностью, СF3 или N02 и заместитель у алкила С1-С10 и арила иной, чем ОН, NH2;
(B) когда R5 обозначает межнуклеотидную связь, R'5 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила и заместитель у алкила С1-С10 иной, чем NH2.
2. Соединение по п. 1, отличающееся тем, что оно соответствует группе I(А).
3. Соединение по п. 2, отличающееся тем, что R'3 выбран из группы, состоящей из алкила С1-С10, замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила, а R'1, R'4 и R'5 все являются Н.
4. Соединение по п. 2, отличающееся тем, что R'5 выбран из группы, состоящей из алкила, С1-С10, замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила, а R'1, R'3 и R'4 все являются Н.
5. Олигонуклеотид, содержащий нуклеозид по п. 2.
6. Олигонуклеотид, содержащий нуклеозид по п. З.
7. Олигонуклеотид, содержащий нуклеозид по п. 4.
8. Соединение по п. 1, отличающееся тем, что оно соответствует группе I(Б).
9. Соединение по п. 1, отличающееся тем, что оно соответствует группе (В).
10. Соединение по п. 1, отличающееся тем, что оно соответствует группе II(А).
11. Соединение по п. 10, отличающееся тем, что заместитель по меньшей мере одного замещенного алкила выбран из группы, содержащей NH2
12. Соединение по п. 10, отличающееся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, N3, галогена.
13. Соединение по п. 10, отличающееся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из COOR', CONR'R", где R' и R" - низший алкил.
14. Соединение по п. 1, отличающееся тем, что оно соответствует группе II(Б).
15. Олигонуклеотид по п. 14, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила выбран из группы, состоящей из NHR', NR'R"R'", где R', R", R'" независимо выбраны из группы, состоящей из низшего алкила и низшего алкилкарбонила.
16. Олигонуклеотид по п. 14, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, NO2, галогена.
17. Соединение по п. 1, отличающееся тем, что оно соответствует группе II(В).
18. Олигонуклеотид по п. 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из NHR', где R' - низший алкил.
19. Олигонуклеотид по п. 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, NO2, N3.
20. Олигонуклеотид по п. 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбирают из группы, состоящей из COOR' и CONR'R", где R' и R" - независимо низший алкил.
Текст
1 Нуклеозиды с модифицированными саха рами общей формулы R где В - нуклеозидное основание, такое, кактимин, любая арильная составляющая R'i, R'3, R'4 и R's представляет собой фенил, полицикл или гетероцикл, R 2 -H, X - S , О, СН2, и, если (I) R3 и Rs независимо выбраны из группы, состоящей из ОН, 2-цианоэтил-(^ N-диизопропил) фосфорамидитной или гидроксиблокирующей группы, то (А) X представляет S, СНг, R'i, R'3, R'4 и R'5 независимо выбраны из группы, состоящей из Н, CN, N3, NO2, CF3, алкила С-і-С-ю, при условии, что R'i, R'3, R'4 и R'5 не могут быть одновременно Н, а алкил может быть замещен одной из групп CN, NH2, ОН, Br, S03R, COOR, где R - ацетил, CF3CO, тозил, (Б) где X представляет О, R'i выбирают из группы, состоящей из N3, NO2, CF3, алкила С-і-С-ю, алкил может быть замещен одной из групп NO2, N3, CF3, Br, R'i, R'3, R'4 и R'5 все являются Н, (В) где X представляет собой О, R'3 выбран из группы, состоящей из CN, N3, замещенного алкила, где заместителем является CN, N3, NH2, R'i, R'4 и R'5 все являются Н, (II) где X представляет О, один из радикалов R3 и Rs представляет межнуклеотидную связь, а другой выбран из группы, состоящей из ОН, межнуклеотидной связи и гидроксиблокирующей группы, R' - обозначает Н, а два радикала из R'3, R'4 и R's обозначают Н, а третий модифицирован, как указано ниже (A) R'3 выбран из группы, состоящей из замещенного алкила С-і-С-ю, аралкила С-і-С-ю, арила, замещенного арила, а заместитель у алкила С-і-С-ю иной, чем ОН, (Б) R'4 выбран из группы, состоящей из замещенного алкила С-і-С-ю, аралкила С-і-С-ю, арила, замещенного арила, радикала с высокой электроотрицательностью, CF3 или N02 и заместитель у алкила С-і-С-ю и арила иной, чем ОН, NH2, (B) когда Rs обозначает межнуклеотидную связь, R^ выбран из группы, состоящей из замещенного алкила С-і-С-ю, аралкила С-і-С-ю, арила, замещенного арила и заместитель у алкила С-і-С-ю иной, чем NH2 2 Соединение по п 1, отличающееся тем, что оно соответствует группе І(А) 3 Соединение по п 2, отличающееся тем, что R'3 выбран из группы, состоящей из алкила С-і-С-ю, замещенного алкила С-і-С-ю, аралкила С-і-С-ю, арила, замещенного арила, a R'i, R'4 и R's все являются Н 4 Соединение по п 2, отличающееся тем, что R's выбран из группы, состоящей из алкила, С-і-С-ю, замещенного алкила С-і-С-ю, аралкила С-і-С-ю, арила, замещенного арила, a R'i, R'3 и R\ все являются Н 5 Олигонуклеотид, содержащий нуклеозид по п 2 6 Олигонуклеотид, содержащий нуклеозид по п 3 7 Олигонуклеотид, содержащий нуклеозид по п 4 8 Соединение по п 1, отличающееся тем, что оно соответствует группе І(Б) 9 Соединение по п 1, отличающееся тем, что оно соответствует группе (В) 10 Соединение по п 1, отличающееся тем, что оно соответствует группе И(А) 11 Соединение по п 10, отличающееся тем, что о (О го ю 45362 заместитель по меньшей мере одного замещенного алкила выбран из группы, содержащей Nbb 12 Соединение по п 10, отличающееся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, N3, галогена 13 Соединение по п 10, отличающееся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из COOR', CONR'R", где R' и R" - низший алкил 14 Соединение по п 1, отличающееся тем, что оно соответствует группе И(Б) 15 Олигонуклеотид по п 14, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила выбран из группы, состоящей из NHR', NR'R"R'", где R', R", R'" независимо выбраны из группы, состоящей из низшего алкила и низшего алкилкарбонила Настоящее изобретение относится к аналогам полинуклеотидов, содержащим модифицированные сахара Использование олигонуклеотидов в качестве терапевтических средств - очень важная область деятельности, описанная, например, в [1] Zamecmk, P С and Stephenson, M L Proc Natl Acad Sci U S A 1978, 75, 280, 285, [2] Uhlmann, E and Peyman, A Chemical Reviews, 1990, 90, 543 584, [3] Goodchild, J Bioconjugate chemistry, 1990, 1, 165 - 187, и [4] Crooke, ST and Lebleu, В "Antisense Research and Applications", CRC Press (1993) Специфическое связывание антисмысловых полинуклеотидов с заданными РНК или ДНК может привести к инактивации функций, связанный с ДНК и РНК, таких как репликация, транскрипция или трансляция, тем самым обеспечивая механизм лечения таких заболеваний, как рак или вирусная инфекция Поэтому связывание антисмыслового олигонуклеотида с мишенью может быть использовано для изменения экспрессии генов в различных условиях, например, для нарушения жизненного цикла вирусов или роста раковых клеток (Stem, С А , Cheng, Y С Science, 1993, 261, 1004 - 1012) Кроме этого, некоторые нуклеотиды прочно связываются также с белковыми мишенями, т е действуют как ингибиторы ферментов Воск и др описывают олигонуклеотиды, in vitro ингибирующие образование фибриновых сгустков, катализатором которого служит человеческий тромбин (Bock, L С , Griffin, L С , Latham, J A , Vermaas, Е Н , Toole, J J Nature, 1992, 355, 564 566) Ecker и др описывают ряд олигонуклеотидов, в концентрациях до 1,0мкмоль ингибирующих человеческий вирус простого герпеса Полинуклеотиды, способные ингибировать ферменты, можно легко получить при помощи комбинаторного метода (Ecker, D J , Vickers, T A , Hanecak, R , Driver, V , Anderson, К Nucleic Acids Res 1993, 21, 1853-1856) Сообщалось, что олигонуклеотид, содержащий разветвленный 5'-С-метил нуклеозид, обла 4 16 Олигонуклеотид по п 14, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, NO2, галогена 17 Соединение по п 1, отличающееся тем, что оно соответствует группе И(В) 18 Олигонуклеотид по п 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из NHR', где R' - низший алкил 19 Олигонуклеотид по п 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбран из группы, состоящей из CN, NO2, N3 20 Олигонуклеотид по п 17, отличающийся тем, что заместитель по меньшей мере одного замещенного алкила, замещенного арила выбирают из группы, состоящей из COOR' и CONR'R", где R' и R" - независимо низший алкил дает повышенной устойчивостью по отношению к нуклеазам (Saha, А К et al , стенд на 206-й конференции Американского химического общества, Чикаго, 1993) Сообщали также, что олигонуклеотиды, содержащие 2'-О-метил-нуклеозиды, более устойчивы к воздействию нуклеаз и обладают повышенной аффинностью связывания с РНК (а Inoue, Н , Hayase, Y , Imura, A , Iwai, S , Miura, К, Ohtsuka, E, Nucleic Acids Res 1987, 15, 6131, b Shibahara, S , Mukai, S , Monsawa, H , Nakashima, H , Cobayashi, S , Yamamoto, N Nucleic Acids Res 1989, 17, 239) Отмечалось, что олигонуклеотид, содержащий 1-замещенный нуклеозид, обладает некоторой устойчивостью по отношению к нуклеазам (Ono, A , Dan, A , Matsuda, A Bioconjugate Chemistry, 1993, 4, 499 - 508) Антисмысловые олигонуклеотиды должны не только обладать специфической аффинностью связывания с заданными комплементарными последовательностями в полинуклеотидах, но и соответствовать требованиям терапевтического применения обладать мощным действием, быть биологически доступными, малотоксичными и дешевыми Поскольку олигонуклеотиды с природными фосфодиэфирными скелетами неустойчивы по отношению к нуклеазам и с трудом проникают сквозь клеточные мембраны, исследователи пытались выполнить модификации в скелетах полинуклеотидов, которые увеличили бы устойчивость по отношению к нуклеазам и облегчили бы проникновение в клетку Главный недостаток аналогов олигонуклеотидов, используемых для антисмыслового управления, заключается в том, что модифицированные межнуклеотидные связи препятствуют активации антисмысловыми олигонуклеотидами рибонуклеазы Н, что приводит к деградации нити РНК, с которой связывается аналог олигонуклеотида Поэтому нужно создать аналоги полинуклеотидов с более высокой устойчивостью по отношению к нуклеазам и более сильной способностью проникать в клетку, при этом не лишая их способности активировать рибонуклеазу Н 45362 Настоящим изобретением предложены новые разнообразные нуклеозиды с модифицированными сахарами и соответствующие олигонуклеотиды с модифицированными сахарами, превосходящие по свойствам природные РНК и ДНК при использовании для антисмыслового управления, диагностики и др В число соединений, предложенных настоящим изобретением, входят различные нуклеозиды с замещениями в позициях С1', СЗ', С4' или С5' сахарной группы Другой аспект настоящего изобретения - олигонуклеотиды, содержащие один или несколько нуклеозидов с модифицированными сахарами, предложенных настоящим изобретением Еще один аспект настоящего изобретения конъюгаты к олигонуклеотидам, содержащим один или несколько нуклеозидов с модифицированными сахарами, предложенных настоящим изобретением На фиг 1 представлены варианты олигонуклеотидов, соответствующих настоящему изобретению, в которых компоненты нуклеозидов замещены положительно заряженной группой На фиг 2 приведена схема 1 реакции синтеза З'-С-разветвленного тимидина На фиг 3 приведена схема 2 реакции синтеза З'-С-разветвленного тимидина На фиг 4 приведена схема 3 реакции синтеза 4'-С-разветвленного тимидина На фиг 5 приведены дополнения к схеме 3 реакции синтеза 4'-С-разветвленного тимидина На фиг 6 приведена схема 4 реакции синтеза 4'-С-разветвленного тимидина На фиг 7 приведена схема 5 реакции синтеза 5'-С-разветвленного тимидина На фиг 8 приведена схема 6 реакции синтеза 5'-С-разветвленного тимидина На фиг 9 приведены дополнения к схеме 6 реакции синтеза 5'-С-разветвленноготимидина На фиг 10 приведена схема 7 реакции синтеза 5'-С-разветвленного тимидина На фиг 11 приведена схема 8 реакции синтеза 5'-С-разветвленного тимидина Фиг 12 - это схема, иллюстрирующая стереохимические свойства соединения 44 и других На фиг 13 приведена схема 9 реакции синтеза 1'-С-разветвленного тимидина На фиг 14 приведена схема Юреакции синтеза 1'-С-разветвленного тимидина Сокращения и определения DMTr = 4,4'-диметокситритил СЕРА = 2-цианэтил-(г\1,г\Г-диизопропил)фосфорамид TBDMS = трет-бутилдиметилсилил Ас = ацетил TBDMSM = трет-бутилдиметилсилоксиметил N3 = азидо CF3CO = трифторацетил Tf = трифторметансульфонил ТНР = тетрагидропиранил Ots = тосил Термин "нуклеозид" в настоящем документе обозначает соединение, содержащее пуриновое или пиримидиновое основание (или его производное), ковалентно связанное с циклическим саха ром из 5 атомов углерода (фуранозой), например, рибозой, 2'-дезоксирибозой и 2',3'дидезоксирибозой Термин "нуклеозид" используется в широком смысле и относится также к нуклеозидам с модифицированными сахарами, предложенным настоящим изобретением Термин "полинуклеотид" в настоящем документе обозначает полимеры, состоящие из двух и более нуклеозидных единиц, каждая из которых связана с одной (конечной) или двумя (внутренними) другими нуклеозидными единицами при помощи межнуклеозидных связей, таких как фосфодиэфирные связи, пептидные связи, фосфонатные связи, фосфоротиоатные связи и т п Примерами полинуклеотидов служат РНК и ДНК Термин "полинуклеотид" в настоящем документе используется (если не указано иное) в широком смысле и относится к полинуклеотидам с модифицированными сахарами, предложенным настоящим изобретением Термин "олигонуклеотид" в настоящем документе обозначает сравнительно небольшие полинуклеотиды, т е полинуклеотиды, содержащие от 2 до около 50пар оснований, однако, олигонуклеотид может быть значительно длиннее Термин "гидроксил-блокирующая группа", используемый в настоящем документе, будет понятен среднему специалисту в области органической химии Примеры гидроксил-блокирующих групп и других блокирующих групп можно найти (кроме всего прочего) в Greene and Wuts, Protective Groups in Organic Synthesis" John Wiley & Sons, NY, NY (1991) Термин "основание" и "нуклеозидное основание" в настоящем документе обозначают гетероциклические нуклеотидные основания, содержащиеся в природных нуклеиновых кислотах, такие как аденин, цитозин, гипоксантин, урацил, тимин, гуанин, и их аналоги, в том числе основания, не встречающиеся в природе, которые способны спариваться с природными основаниями К таким не встречающимся в природе гетероциклическим основаниям относятся следующие, но не исключительно следующие аза- и деаза-аналоги пиримидина, аза- и деаза-аналоги пурина, а также другие гетероциклические аналоги оснований, в которых один или несколько атомов углерода и азота пуриновых и пиримидиновых колец замещены гетероатомами, например, атомами кислорода, серы, селена, фосфора и т п Настоящим изобретением предложены новые нуклеозиды и олигонуклеотиды, обладающие свойствами, желательными для использования их в ходе антисмыслового управления, диагностики и в других процессах, где применяются олигонуклеотиды В число соединений, предложенных настоящим изобретением, входят различные нуклеозиды с модификациями-замещениями в позициях С1', СЗ', С4' и С5' сахарной группы нуклеозида Нуклеозиды, предложенные настоящим изобретением, могут содержать одно или несколько замещений, облегчающих у частие нуклеозида в твердофазном синтезе, например, упомянутый нуклеозид может образовать фосфорамидитное производное с 5'-диметокситритилом или другими протекторными группами Настоящее изобретение 8 45362 также обеспечивает создание олигонуклеотидов, нуклеозидов с модифицированными сахарами, содержащих один или несколько нуклеозидов с предложенных настоящим изобретением, предмодифицированными сахарами, соединенных в ставленное в формулах 45, 46, 47, 48, 49, 50, мовиде нити нуклеиновой кислоты жет быть любым гетероциклическим нуклеозидным основанием, природным или синтетическим Помещение подходящего заместителя в позиТак, гетероциклические нуклеозидные основания, цию СЗ' или С5' нуклеозида изменяет среду, окрукоторые могут служить основаниями в нуклеозижающую фосфодиэфирный скелет олигонуклеодах с модифицированными сахарами, предложентида, содержащего эти нуклеозиды с ных настоящим изобретением, могут относиться к модифицированными сахарами В предпочтипуринам (например, аденин, гуанин или ксантин), тельных случаях в позициях СЗ' или С5' испольпиримидинам (например, тимин, урацил, цитозин) зуются громоздкие заместители, чтобы предоти их гетероциклическим аналогам и таутомерам вратить нежелательное взаимодействие с Подходящими гетероциклическими основаниями, ферментами или их активными у частками Эти которые могут служить основаниями в нуклеозидзаместители в позициях СЗ' или С5' делают фосных соединениях, предложенных настоящим изофодиэфирный скелет олигонуклеотидов недосбретением, являются те, которые можно включить тупным для многих ферментов За счет присутств одну из нитей двухнитевого полинуклеотида с вия этих заместителей олигонуклеотиды, возможностью спаривания с природным основасодержащие эти СЗ'- или С5'-разветвленные нукнием в комплементарной нити полинуклеотида леозиды, могут быть более устойчивыми по отноКроме того, основания нуклеозидных соединений, шению к нуклеазам, чем ДНК или РНК Заместипредложенных настоящим изобретением, соедители в позициях С1' и С4' нуклеозидов могут няются с сахарными группами такими своими часдавать те же благоприятные эффекты, что и затями, что соединение не препятствует спариваместители в позициях СЗ' и С5' нию основания, упомянутому выше В тех вариантах осуществления изобретения, в которых олигонуклеотиды содержат сахара, моЕще один вариант осуществления настоящего дифицированные положительно заряженными изобретения - это нуклеотиды, соответствующие аминоалкилами, суммарный отрицательный заряд формуле олигонуклеотидов в физиологических условиях уменьшается, так что двойная спираль, образованная хотя бы одной нитью этих олигонуклеоти(46) дов, может оказаться более устойчивой, чем соответствующий немодифицированный олигонуклеотид (см Фиг 1) Таким образом, в вагде Ri - это алкил, аралкил, арил, замещенриантах осуществления изобретения, в которых ный алкил, замещенный аралкил или замещенный олигонуклеотиды содержат сахара, модифицироарил, а заместители NO2, CN, N3, COOEt, ОН, SH, ванные аминоалкилами или подобными положиCONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, тельно заряженными заместителями, этот полоNMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, BR, I, жительный заряд может способствовать OTs, + NMe 3 , CH=CHR, C=CR, где R - это алкил, R2 повышению аффинности связывания олигонукле-это Н, ОН, алкоксил или арилоксил, R3 - ОН, Оотидов с полинуклеотидами-гибридизационными TBDMS, О-СЕРА, R4 - ОН, СНО или гидроксилмишенями Средний специалист в данной области блокирующая группа, В - это гетероциклическое поймет, что хотя изложенные выше теоретические нуклеозидное основание, X - это О, S, NH или СН2, соображения и служат отправной точкой для раза углерод, присоединенный к Ri и R4, имеет конработки и использования дополнительных варифигурацию R или S антов осуществления настоящего изобретения, Еще один вариант осуществления настоящего они не должны обязательно оправдываться при изобретения - это нуклеозиды, соответствующие его осуществлении формуле Один из вариантов осуществления настоящего изобретения - это нуклеозиды с модифицированными сахарами, соответствующие формуле R (47) Щ (45) R, где Ri - это алкил, аралкил, арил, замещенный алкил, замещенный аралкил или замещенный арил, а заместители NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2CH3, CF3, F, Cl, BR, I, OTs, + NMe 3 , CH=CHR, C=CR, где R - это алкил, R2 - это Н, ОН, алкоксил или арилоксил, R3 - ОН или О-СЕРА, R4 - ОН или гидроксил-блокирующая группа, В - это гетероциклическое нуклеозидное основание, X - это О, S, NH или СН 2 Гетероциклическое нуклеозидное основание В R, где Ri - это алкил, аралкил, арил, замещенный алкил, замещенный аралкил или замещенный арил, а заместители NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, BR, I, OTs, + NMe 3 , CH=CHR, C=CR, где R - это алкил, R2 -это Н, ОН, алкоксил или арилоксил, R3 - ОН, OTBDMS, О-СЕРА, R4 - это ОН или гидроксилблокирующая группа, В - это гетероциклическое нуклеозидное основание, X - это О, S, NH или СН 2 Еще один вариант осуществления настоящего изобретения - это нуклеотиды, соответствующие формуле 45362 10 стоящим изобретением, можно соединить при помощи межнуклеозидных связей таким образом, чтобы получить новые олигонуклеотиды с задан(4В) RJ R ными последовательностями нуклеозидных оснований Межнуклеозидные связи - это связи типа С3'-С5' или С2'-С5' Термин "межнуклеозидные где Ri - это алкил, аралкил, арил, замещенсвязи" в настоящем документе относится не тольный алкил, замещенный аралкил, замещенный ко к фосфодиэфирному скелету, за счет которого арил, а заместители NO2, CN, N3, COOEt, ОН, SH, образуются межнуклеозидные связи в ДНК (дезокCONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, сирибонуклеиновых кислотах) и РНК (рибонуклеиNMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, BR, I, + новых кислотах), но и к ряду других групп, выполOTs, NMe 3 , CH=CHR, C=CR, где R - это алкил, R2 няющих ту же структурную функцию, что и -это Н, ОН, алкоксил или арилоксил, R3 - ОН, Офосфодиэфирные связи в ДНК и РНК Примерами МВп, О-СЕРА, R4 - это ОН или гидроксилдругих межнуклеозидных связей, приемлемых для блокирующая группа, В - это гетероциклическое включения в олигонуклеотиды, соответствующие нуклеозидное основание, X - это О, S, NH или СН 2 настоящему изобретению, могут служить фосфоДругой аспект настоящего изобретения предуротиоаты, метилфосфонаты, фосфородитиоаты, сматривает различные эпоксидные производные борофосфонаты, селенофосфонаты, фосфораот нуклеозидов с модифицированными сахарами, мидаты, ацетамидаты и т п Описание синтеза и предложенных настоящим изобретением, произприменения различных межнуклеозидных связей водные, соответствующие формулам можно найти, помимо других источников, в патенR, те США 5256775, международной публикации W093/24507, международной публикации W092/05186, патенте США 5264562, международной публикации W092/02534, международной публикации W094/06811, международной публикации W093/17717, патенте США 5212295, патенте США 5292875, патенте США 5218103, патенте США (50) 5166387, патенте США 5151516, патенте США 4814448, патенте США 4814451, патенте США где R выбирают из группы, состоящей из 4096210, патенте США 4094873, патенте США СН2ОН, СН2, ODMTr, CHO, COOH, COOEt, a X 4092312, патенте США 4016225, патенте США выбирают из группы, состоящей из О и СН 2 Эпок4007197 сиды могут иметь любую из возможных стереохимических конфигураций Полинуклеотиды, соответствующие настояНуклеозиды с модифицированными сахарами, щему изобретению, с заданной последовательнопредложенные настоящим изобретением, можно стью оснований могут быть получены, при помощи синтезировать в соответствии с примерами, приметодов синтеза полимеров нуклеиновых кислот, веденными в соответствующем разделе этой захорошо известных средним специалистам в обявки Средний специалист в области органической ласти органической химии В предпочтительном химии может, руководствуясь этими примерами, случае полинуклеотиды, соответствующие насинтезировать различные соединения, соответстстоящему изобретению, синтезируют в соответствующие настоящему изобретению, процедуры вии с принципами фосфорамидитной химии для синтеза которых не описаны включения одного или нескольких новых нуклеозидов, предложенных настоящему изобретению, в Олигонуклеотиды, содержащие нуклеозиды с полинуклеотид-аналог Разветвленные заместимодифицированными сахарами тели в позициях СЗ' или С5' нуклеозидов могут Полинуклеотиды, соответствующие настояснизить скорость соединения Этот эффект завищему изобретению, содержат один или несколько сит от размера заместителей Поэтому для нукнуклеозидов с модифицированными сахарами, леозидов с громоздкими заместителями бывает соответствующих настоящему изобретению, принеобходимо увеличить время соединения даже в чем нуклеозид с модифицированным сахаром, Юраз При необходимости для увеличения скоросоответствующий настоящему изобретению, сости реакции соединения можно проводить повторединен либо со вторым нуклеозидом с модифициные реакции со свежими реактивами или испольрованным сахаром, либо с немодифицированным зовать более высокие концентрации реагентов По нуклеозидом, и соединены нуклеозиды межнукокончании синтеза олигонуклеотиды обрабатывалеозидными связями К нуклеозидам с модифициют так же, как стандартные немодифицированные рованными сахарами, пригодным для включения в олигонуклеотиды, т е отщепляют от твердых подолигонуклеотиды, относятся соединения, описанложек при помощи 30% аммиака, удаляют протекные формулами 45, 46, 47 и 48 Полинуклеотидыторные группы в течение 8 часов при 55°С и очианалоги, предложенные настоящим изобретенищают посредством обращенно-фазной ем, не ограничены в смысле числа нуклеозидовжидкостной хроматографии высокого разрешения субъединиц в отдельном полинуклеотиде-аналоге, (ЖХВР) однако, как привило, удобнее синтезировать короткие полинуклеотиды-аналоги, например, полиДля проверки чистоты олигонуклеотидов и нуклеотиды-аналоги, содержащие не более присутствия в них требуемых нуклеозидов с мо50оснований дифицированными сахарами, очищенные олигонуклеотиды можно исследовать путем анализа Отдельные нуклеозиды, предложенные на 11 45362 12 продуктов их переваривания ферментами, напримощи олигонуклеотидов, могут служить гены/РНК, мер, такими как фосфодиэстераза из змеиного кодирующие ферменты, гормоны, сывороточные яда или бактериальная щелочная фосфатаза белки, трансмембранные белки, адгезионные моПродукты деградации можно подвергнуть хромалекулы (LFA-1, GPIIb/llla, ELAM-1, VACM-1, ICAM-1, тографическому (ЖХВР) анализу или проанализиE-selection и т д ) , молекулы рецепторов, в том ровать другим способом и сравнить с образцами числе цитокиновых рецепторов, цитокины (IL-1, ILисходных нуклеозидов Структуру очищенных оли2, IL-3, IL-4, IL-6 и др), онкогены, факторы роста и гонуклеотидов можно определить при помощи интерлейкины Эти гены или РНК могут быть свямасс-спектроскопии, например, с электрораспызаны с любыми патологическими состояниями, лением вызванными воспалением, сердечно-сосудистыми заболеваниями, иммунными реакциями, раком, Другой аспект настоящего изобретения предувирусными инфекциями, бактериальными инфексматривает конъюгаты с олигонуклеотидами, социями, грибковыми инфекциями, паразитарными держащими модифицированные сахара Чтобы инвазиями и др создать площадку для конъюгации требуемой группы с олигонуклеотидом, в позициях С1', СЗ', Олигонуклеотиды, предложенные настоящим С4' и С5' входящих в него нуклеозидов можно приизобретением, пригодны для терапевтического соединить аминные, гидроксильные, тиоловые и применения как in vivo, так и ex vivo К показаниям карбоксиалкиловые линкеры Линкеры, присоедидля применения ex vivo относится необходимость няемые в позициях С1' и СЗ', можно использовать обработки клеток, таких как костный мозг или педля того, чтобы направлять конъюгированную риферийная кровь, при таких состояниях как лейгруппу в малую бороздку двухнитевой нуклеинокоз (хронический миелолейкоз, острый лимфолейвой кислоты, а линкеры, присоединяемые в позикоз) или вирусная инфекция К генам или РНК, ции С4', - чтобы направлять конъюгированную кодируемым этими генами, которые могут служить группу в большую бороздку Линкеры, присоедимишенями при лечении рака, относятся онкогены, няемые в позиции С5', направляют конъюгировантакие как ras, k-ras, bcl-2, c-myb, bcr, c-myc, c-abl, ную группу либо в большую, либо в малую боили сверхсинтезированные последовательности, роздку двухнитевой нуклеиновой кислоты в такие как mdm2, онкостатин М, IL-6 (саркома Казависимости от стереохимии самого линкера в поши), HER-2, и транслокации, такие как bcr-abl позиции С5' При помощи линкеров можно приПодходящими мишенями являются также вируссоединять и размещать в нужных позициях разноные генные последовательности или РНК, закодиобразные функциональные группы, такие как исрованные соответствующими генами, такие как кусственная нуклеаза, перекрестно-связывающие гены полимераз или обратных транскриптаз герагенты, интеркаляторы и репортерные молекулы петических вирусов, таких как цитомегаловирус и вирусы простого герпеса 1 и 2, ретровирусов, таПоскольку олигонуклеотиды, предложенные ких как вирус человеческого Т-клеточного лейкозанастоящим изобретением, обладают значитель1, ВИЧ-1, ВИЧ-2, или других ДНК- или РНКной связывающей активностью по отношению к вирусов, таких как HBV, HPV, VZV, вирус гриппа, одно- и двухнитевым нуклеиновым кислотамаденовирусы, флавивирусы, риновирус и др Спемишеням и образуют устойчивые двойные, тройцифически связывающиеся олигонуклеотиды моные и другие структуры с природными полинукгут быть использованы в сочетании с другими телеотидами и их структурными аналогами, олигорапевтическими средствами К другим областям нуклеотиды, предложенные настоящим терапевтического применения олигонуклеотидов, изобретением, могут быть использованы в больпредложенных настоящим изобретением, отношинстве процессов, в которых используются сятся (1) модуляция воспалительных реакций за обычные олигонуклеотиды Так, олигонуклеотиды, счет модуляции экспрессии генов, таких как гены соответствующие настоящему изобретению, могут рецептора IL-1, IL-1, ICAM или E-Selection, котобыть использованы, например, как зонды гибридирые играют определенную роль в опосредовании зации полинуклеотидов, затравки для полимеразвоспаления (2) модуляция пролиферации клеток в ной цепной реакции и подобных циклических ретаких состояниях как закупорка артерии (рестеноз) акций амплификации, затравки для после ангиопластики за счет модуляции экспрессеквенирования и др Олигонуклеотиды, предлосии (а) факторов роста или деления клеток, таких женные настоящим изобретением, также могут как немышечный миозин, туе, fox, PCNA, PDGF быть использованы для диагностики и лечения или FGF или их рецепторов или (Ь) факторов прозаболеваний Терапевтическое применение олилиферации клеток, таких как c-myb При лечении гонуклеотидов, соответствующих настоящему псориаза и других состояний мишенями могут изобретению, предусматривает специфическое служить другие факторы пролиферации или факподавление экспрессии генов (или подавление торы передачи сигналов, такие как TGFa, IL-6, трансляции последовательностей РНК, закодироgINF, протеин киназа С, тирозин киназы (такие как ванных этими генами), связанных с возникновенир210 и р190) Кроме того, при аутоиммунных забоем и развитием патологических состояний, при леваниях мишенями могут служить аллели главпомощи антисмысловых олигонуклеотидов Олиного комплекса гистосовместимости, TGFa или гонуклеотиды, соответствующие настоящему изорецептора EGF бретению, могут быть использованы для опосредования антисмыслового подавления целого ряда Олигонуклеотиды, предложенные настоящим генных мишеней Примерами генов или РНК, заизобретением, могут с успехом заменить обычные кодированных этими генами, которые могут быть Олигонуклеотиды во многих нетерапевтических мишенями антисмыслового подавления при попроцессах, таких как гибридизация с целью обна 13 45362 14 ружения последовательностей нуклеиновой киосуществления трансфекции, в общем случае мы слоты, полимеразная цепная реакция и т п Эти будем называть "агентом, повышающим пронинетерапевтические процессы хорошо известны кающую способность" Доставка олигонуклеотидов средним специалистам в области молекулярной в клетки может быть осуществлена посредством биологии и описаны, например, у Sambrook et al котрансфекции с другими нуклеиновыми кислотаMolecular Cloning Techniques 2nd Edition Clod ми, такими как (і) экспрессируемые фрагменты Spring Harbor (1989) ДНК, кодирующие белок/белки или фрагмент белка, или (и) транслируемые РНК, кодирующие беЭффективность доставки олигонуклеотидов, лок/белки или фрагменты белка предложенных настоящим изобретением, в клетки можно повысить любым подходящим способом, в Таким образом, олигонуклеотиды, предложентом числе путем трансфекции при помощи фосные настоящим изобретением, могут быть вклюфата кальция, демети л сульфоксид а, глицерина чены в любой подходящий состав, повышающий или декстрана, путем электропорации или при эффективность их доставки в клетки К подходяпомощи катионных, анионных и/или нейтральных щим фармацевтическим составам относятся таклипидных соединений или липосом, как описано в же те, которые обычно используются, когда досмеждународных публикациях № WO 90/14074, WO тавка соединения в клетки или ткани происходит 91/16024, WO 91/17424 и в патенте США 4897355 за счет наружного применения состава В препаОлигонуклеотиды можно вводить в клетки в виде ратах для наружного применения, содержащих комплексов с катионными липидами, такими как олигонуклеотиды, могут быть использованы такие DOTMA (которые могут образовывать липосомы соединения как полиэтиленгликоль, пропиленглиили не образовывать их), введенный комплекс коль, азон, ноноксил-9, олеиновая кислота, димезатем взаимодействует с клеткой В неисчерпытилсульфоксид, полиамины или липополиамины вающий перечень приемлемых катионных липиСинтез З'-С-разветвленных нуклеозидов дов входят І\І-(2,3-ди(9-(2)-октадеценилоксил))Замещение гидроксильной группы в позиции проп-1-ил-г\1,г\1,г\1-триметиламмоний (DOTMA) и его СЗ' нуклеозидов другими функциональными групсоли, 1 -О-олеил-2-О-олеил-Зпами с сохранением водорода в позиции СЗ' описано, помимо других источников, у De Clercq, E , диметиламинопропил-р-гидроксиэтиламмоний и Antiviral Res 1989, 12, 1 - 20 Замещение водороего соли и 2,2-бис-(олеилокси)-3да в позиции СЗ' нуклеозидов другими функцио(триметиламмоний)-пропан и его соли нальными группами описано у Fedorov, I I , Повысить эффективность доставки олигонукKazmma, Е М , Novicov, N А , Gurskaya, G V , леотидов, предложенных настоящим изобретениBochkarev, A V , Jasko, M V , Victorova, L S , ем, можно также при помощи (і) вирусов, таких как Kuhkanova, M К, Balzanni, J , De Clercq, E J Med вирус Сендай (Bartzatt, R, Biotechnol Appl Chem 1992, 35, 4567 - 4575 Настоящим изобреВ і ос hem , 1989, 11, 133 - 135) или аденовирус тением предусмотрены процедуры приготовления (Wagner, E et al, Proc Natl Acad Sci USA, 1992, 89, большого числа разнообразных З'-С6099 - 6013), (и) полиаминных или поликатионных разветвленных нуклеозидов Примеры методик конъюгатов, таких как полилизин, протамин или приготовления З'-С-разветвленных тимидинов Na, Ni2-6nc (ЭТИЛ) спермин (Wagner, E et al, Proc приведены на схемах реакций 1 и 2 (Фиг 2 и 3, Natl Acad Sci USA, 1991, 88, 4255 - 4259, Zenke, соответственно) Эти процедуры можно легко M , et al, Proc Natl Acad Sci USA, 1990, 87, 3655 адаптировать для синтеза других нуклеозидов, 3659, Chank, В К, et al, Biochem Biophys Res соответствующих настоящему изобретению, втом Commun , 1988, 157, 264 - 270, Патент США числе соответствующих тем вариантам осуществ5138045), (MI) липополиаминных комплексов с таления изобретения, в которых нуклеозиды содеркими соединениями, как липоспермин (Behr, J -Р жат основания, отличные от тимина Соединение et al, Proc Natl Acad Sci USA, 1989, 86, 6982 4 было приготовлено изтимидина втри этапа, как 6986, Loeffler, J P , et al, J Neurochem , 1990, 54, описано у Jorgensen, Р N , Thrane, Н , Wengel, J J 1812 - 1815), (iv) анионных, нейтральных или чувAm Chem Soc 1994, 116, 2231 Обработка соствительных к рН липидов, с использованием соединения 4 тосил хлоридом в пиридине дала тоединений, в число которых входят анионные фоссилат, соединение 5 Реакция соединения 5 с фолипиды, такие как фосфатид ил глицерин, цианидом калия в N.N-диметилформамиде дала кардиолипин, фосфатидная кислота или фосфаЗ'-С-цианметилтимидиновое производное, соедитидилэтаноламин (Lee, К-D et al, Biochem Biophys нение 6 Реакция соединения 5 с азидом натрия в ACTA, 1992, 1103, 185 -197, Cheddar, G et al, Arch N.N-диметилформамиде дала З'-СBiochem Biophys, 1992, 294, 188 - 192, Yoshimura, T , et al, Biochem Int, 1990, 20, 697 - 706), (v) конъазидометилтимидиновое производное, соединеюгации с такими соединениями, как трансферрин ние 7 Подобным образом, реакции соединения 5 или биотин, или (vi) конъюгации с белками (в том с различными нуклеофильными реагентами дают числе альбумином или антителами), гликопротеиразнообразные З'-С-разветвленные тимидиновые нами или полимерами (в том числе, полиэтиленгпроизводные, в которых ориентация З'-Сликолем), которые улучшают фармакокинетичегидроксильной группы остается той же, что и в ские свойства олигонуклеотидов, о которых идет тимидине Обработка соединения 6 2-цианэтилречь В настоящем документе под трансфекцией ^^диизопропилхлорфосфорамидитом и диизоподразумевается любой способ, приемлемый для пропилэтиламином в дихлорметане дала фосфодоставки олигонуклеотидов в клетки Любое верамидит, соединение 8 - строительную единицу щество, такое как липид, или любой агент, такой для синтеза олигонуклеотидов Соединение 7 как вирус, который может быть использован для подвергли такой же обработке и получили соеди 16 15 45362 нение 9 Подобным образом можно преобразовать полученных 3'-С-(со-алкенил)-тимидинов дает гиди другие З'-С-разветвленные тимидиновые произроксиалкилтимидины, где гидроксил можно преводные в соответствующие фосфорамидиты Эта образовать в различные функциональные группы, стандартная процедура описана у F Eckstein, такие как Nbh, OR, SR, SH и X, где R - это Н или "Ohgonucleotide Synthesis", Oxford University Press алкил, а X - это F, Cl, Br, I, Ots (1991) Обработка соединения 5 гидридом натрия Синтез 4'-С-разветвленных нуклеозидов в тетрагидрофуране дала эпоксидное производИмеются сообщения о 4'-С-разветвленных ное, соединение 10 Реакция соединения 10 с нуклеозидах O-Yang С , Wu, Н Y , Fraser-Smith, алюмогидридом лития в тетрагидрофуране дала Е В , Walker, К А М Tetrahedron Letts, 1992, 33, 37 З'-С-метилтимидиновое производное, соединение - 40 Настоящим изобретением предусмотрены 11, которое было преобразовано в фосфорамипроцедуры приготовления многих новых 4'-Сдит, соединение 12 Реакция соединения 10 с амразветвленных нуклеозидов Приготовление 4'-Смиаком в метаноле дала З'-Сразветвленных тимидинов показано на схемах аминометилтимидиновое производное, соединереакций 3, 4 и 5 (Фиг 4, 5, 6 и 7, соответственно) ние 13, которое обработали эти лти отри фтора цеЭти процедуры можно легко адаптировать для татом в тетрагидрофуране и получили защищенсинтеза других нуклеозидов, соответствующих ное аминопроизводное, соединение 14 настоящему изобретению, в том числе соответстСоединение 14 преобразовали в фосфорамидит, вующих тем вариантам осуществления изобретесоединение 15 Подобным же образом, реакции ния, в которых нуклеозиды содержат основания, соединения 10с разнообразными нуклеофильныотличные от тимина Соединение 16, приготовми реагентами дают различные З'-Сленное из тимидина, обработали диметокситриразветвленные тимидиновые производные, в котилхлоридом и получили соединение 17 Группу торых ориентация З'-С-гидроксильной группы острет-бутилдиметилсилил (TBDMS) соединения 17 тается той же, что и в тимидине, так как нуклеоудалили посредством обработки TBAF и получили филы атакуют наименее закрытый углерод соединение 18, которое окислили до альдегида, эпоксидного кольца Так, реакции соединения соединение 19, за счет обработки диметилсульЮсо спиртами в присутствии оснований дают алфоксидом, DCC, трифторуксусной кислотой и пикоксиметилтимидины Для приготовления З'-Сридином Соединение 19 преобразовали в соеди(замещенный алкоксиметил)-тимидинов можно нение 20, 4'-С-гидроксиметилтимидиновое использовать спирты с замещениями В неисчерпроизводное, при помощи процедуры, подобной пывающий перечень заместителей входят NO2, описанной у a) O-Yang С , Wu, Н Y , Fraser-Smith, CN, COOEt и защищенные аминогруппы Реакции Е В , Walker, К А М Tetrahedron letts, 1992, 33, 37 соединения 10 с двухатомными спиртами дают 3'40, b) Jones, G H , Tamguchi, M , Tegg, D , Moffatt, С-гидроксиалкоксиметилтимидины, которые можJ G J Org Chem 1979, 44, 1309 - 17) Диметокно легко преобразовать в З'-Сситритиловую группу соединения 20удалили при галогеналкоксиметилтимидины Реакция соединепомощи 80% уксусной кислоты и получили соединия 10 с нитрометаном дает З'-Снение 21, 4'-С-гидроксиметилтимидин Избиранитроэтилтимидин Восстановление З'-Стельное бензоилирование соединения 21 бензонитроалкилтимидинов дает З'-Сильным ангидридом дает соединение 22, 3'- и 5'аминоалкилтимидины Реакции соединения 10с гидроксильные группы которого защитили тетрациан-замещенными кадмий-органическими соедигидропиранилом (ТНР) в ходе реакции соединения нениями дает З'-С-цианалкилтимидины Реакции 22 с дигидропираном в присутствии толуолсульсоединения 10 с этоксикарбонилалкилцинковыми фокислоты в дихлорметане Полученное соединереагентами дают З'-Сние 23 обработали водным гидроксидом натрия и этоксикарбонилалкилтимиды, которые легко гидполучили соединение 24, которое, реагируя с меролизуются в З'-С-карбоксиалкилтимидины в щетил йодидом в присутствии гидроксида натрия при лочной среде 0°С, дало 4'-С-метоксиметилтимидиновое производное, соединение 25 Удаление протекторных групп ТНР соединения 25 дало соединение 26, 4'Для некоторых реакций, в которых у частвуют С-метоксиметилтимидин В некоторых реакциях литиевые медь-органические реагенты, бывает вместо протекторной группы ТНР желательно иснеобходимо защитить амидную группу тимидина пользовать группу TBDMS, так как присутствие В качестве протекторной группы предпочтительгруппы ТНР приводит к образованию диастереоным является трет-бутилдиметилсилоксиметил меров Таким образом, обработка соединения 22 (TBDMSM), так как его можно легко удалить при трет-бутилдиметилхлорсиланом дает 3',5'-О-(биспомощи тетрабутиламмония фторида (TBAF) по TBDMS)-npoH3BOflHoe тимидина, соединение 27 окончании необходимых преобразований Группу Удаление бензоила при помощи этилендиамина N-TBDMSM можно ввести при помощи реакции при 50°С, дало соединение 28, которое, реагируя, 3,5-диацилированного тимидина с третс трифторметансульфоновым ангидридом и пирибутилдиметилсилоксиметил хлоридом в пиридине дином в дихлорметане, дает трифлат (tnflate), соN-TBDMSM тимидин подвергают обработке, опиединение 29 Реакция соединения 29 с аммиаком санной для тимидина, и получают тосилат, произв диоксане дала 4'-С-аминометилтимидиновое водное соединения 5, и эпоксид, производное сопроизводное, соединение 30 Реакция соединения единения 10, соответственно, которые можно 29 с азидом натрия в N.N-диметилформамиде использовать для приготовления З'-Сдала 4'-С-азидометилтимидиновое производное, алкилтимидинов и З'-С-алкенилтимидинов при соединение 31 Удаление протекторных групп помощи реакций с литиевыми реагентами Гидроборирование или окислительное расщепление 17 45362 18 TBDMS соединений 30 и 31 дало соединения 32 и мические свойства соединения 44 и других пред33, 4'-С-аминометилтимидин и 4'-Сставлены на диаграмме 1 (Фиг 12) Реакция соединения 44 с аммиаком в метаноле дала 5'-(S)-Cазидометилтимидин, соответственно Аминогрупаминометилтимидин, который защитили трифторпу соединения 33 защитили трифторацетилом и ацетилом и получили соединение 46 Реакция получили соединение 34 Реакции соединений 32 соединения 44 с цианидом калия в N,Nи 34 с диметокситритилхлоридом в пиридине дали диметилформамиде дала 5'-(S)-Cсоединения 35 и 36, соответственно Соединения 35 и 36 преобразовали в соответствующие фосцианметилтимидин, соединение 47 5'форамитиды, соединения 37 и 38, соответственно, гидроксильные группы соединений 45-47 защитипосредством обработки 2-цианэтил-1\1,1\1ли диметокситритилом при помощи реакций с диметокситритилхлоридом и тр и фтор метан сул ьфодиизопропилхлорфосфорамидитом натом серебра в пиридине Получили соединения Реакции соединения 29 с реактивами Гринья48-50, соответственно Группы TBDMS соединера (Gngnard) дают 4'-С-алкилтимидины и 4'-Сний 48-50удалили при помощи TBAF в тетрагидалкенилтимидины Гидроборирование или окислирофуране и получили соединения 51 - 53, сооттельное расщепление полученных 4'-С-(советственно Соединения 51 - 53 преобразовали в алкенил)-тимидинов дает гидроксиалкилтимидисоответствующие фосфорамидиты, соединения ны, гидроксил которых можно преобразовать в ряд 54 - 56, соответственно Реакция Гриньяра между функциональных групп, таких как NH2, OR, SR, SH соединением 42 и аллилбромидом магния дала и X, где R - это Н или алкил, а X - это F, CI, Вг, I, смесь изомерных 5'-^)-(С)-аллилтимидиновых и Ots Реакции соединения 29 с этоксикарбонилал5'-(3)-С-аллилтимидиновых производных, соедикил цинковыми реагентами дают 4'-Снений 57 и 58, которые были разделены посредэтоксикарбонилалкилтимидины, которые можно ством хроматографии на силикагеле Группы гидролизовать в 4'-С-карбоксиалкилтимидины TBDMS соединений 57 и 58 удалили путем обраРеакции соединения 29 с алкоксидами натрия даботки TBAF в тетрагидрофуране и получили 5'-(R)ют 4'-С-алкоксиметилтимидины Для приготовлеи 5'-(3)-С-аллилтимидины, соединения 59 и 60, ния 4'-С-(замещенный алкоксиметил)тимидинов соответственно Соединения 59 - 60 преобразоваможно использовать спирты и фенолы с замещели в соответствующие фосфорамидиты, соединениями В числе заместителей могут быть NO2, CN, ния 61 - 62, соответственно Подобным образом, COOEt, OAc или защищенные аминогруппы В реакции соединения 42 с различными реактивами готовых 4'-С-разветвленных тимидинах 5'Гриньяра дают различные 5'-(S или R)-Cгидроксильные группы защищают диметокситриалкилтимидины и 5'-(S или R)-Cтилом, а З'-гидроксильные группы преобразуют в алкенилтимидины фосфорамидиты для синтеза олигонуклеотидов, который проводят в соответствии со стандартной Гидроборирование или окислительное расщепроцедурой (F Eckstein, "Ohgonucleotide synthesis" пление полученных 5'-С-(соалкенил)-тимидинов Oxford University Press (1991)) дает гидроксиалкилтимидины, гидроксил которых можно преобразовать в различные функциональСинтез 5'-С-разветвленных нуклеозидов ные группы, такие как NH2, OR, SR, SH и X, где R Настоящее изобретение предусматривает это Н или алкил, а X - это F, CI, Br, I, Ots Реакции процедуры приготовления большого числа 5'-Ссоединения 44 с разнообразными нуклеофильныразветвленных нуклеозидов Примеры методик ми реагентами дают целый ряд 5'-Сприготовления 5'-С-разветвленных тимидинов разветвленных тимидиновых производных Так, представлены на схемах в, 1 и 8 (Фиг 8, 9 и 10, реакции соединения 44 со спиртами в присутствии соответственно) Эти процедуры можно легко основания дают 5'-С-алкоксиметилтимидины Для адаптировать для синтеза других нуклеозидов, приготовления 5'-С-(замещенный алкокси)соответствующих настоящему изобретению, втом тимидинов можно использовать спирты с замещечисле для осуществления тех вариантов изобрениями В неисчерпывающий перечень заместитетения, в которых нуклеозиды содержат основания, лей входят NO2, CN, COOEt и защищенные аминоотличные от тимина Соединение 42 приготовили группы Реакции соединения 44 с двухатомными в три этапа в соответствии с известной процедуспиртами дают 5'-Срой (O-Yang С , Wu, Н Y , Fraser-Smith, E В , Walker, К А М Tetrahedron Letts, 1992, 33, 37 - 40) гидроксиалкоксиметилтимидины, которые можно В соответствии с другой процедурой соединение легко преобразовать в 5'-С42 получили в результате реакции 80% уксусной галогеналкилтимидины Реакция соединения 44 с кислоты с соединением 41, 3',5'-О-(бис-третнитрометаном дает 5'-С-нитроэтил тимидин Восбутилдиметилсилил)-тимидином, приготовленным становление 5'-С-нитроалкилтимидинов дает 5'-Спри помощи реакции тимидина с избытком третаминоалкилтимидины Реакции соединения 44 с бутилдиметилхлорсилана и имидазола в пиридине цианал кил кадмиевыми реагентами дает 5'-СРеакция Виттига между соединением 42 и илидом цианалкил тимидины Реакции соединения 44 с фосфора, приготовленным из метилтрифенилэтоксикарбонилалкилцинковыми реагентами дают фосфония бромида и гидрида натрия в диметил5'-С-этоксикарбонилалкилтимидины, которые легсульфоксиде (ДМСО), дала олефиновое произко гидролизуются в 5'-С-карбоксиалкилтимидины в водное, соединение 43 Эпоксидирование щелочных условиях Все преобразования, выполсоединения 43 m-хлорпероксибензольной кислоняемые с 5'-(3)-изомерами, возможны и для 5'-(R)той в дихлорметане дало 5'-(Э)-эпоксидное произизомеров И, наконец, реакции 5'-Сводное, соединение 44 (основной продукт) и 5'разветвленных тимидинов с диметокситритил (R)-3noKCHflHoe производное (примесь) Стереохихлоридом и трифлатом серебра в пиридине дают 20 19 45362 5'-0-ОМТг-5'-С-разветвленные тимидины, которые азидом натрия дает соответствующие 1 '-Спреобразуют в соответствующие фосфорамидиты цианметил-, 1 '-С-нитрометили 1 '-Спри помощи стандартной процедуры (F Eckstein, азидометилтимидины, соответственно Обработка "Ohgonucleotide synthesis", Oxford University Press соединения 68 нитрометаном дает 1'-С-нитроэтил (1991)) Для определения конфигурации в позиции тимидин Обработка соединения 68 алкоксидом С5' 5'-С-разветвленных тимидинов использовали натрия дает 1'-С-алкоксиметил тимидин Обработувеличение NOE пространственно замкнутых прока соединения 68 литий-медь-органическими реатонов Поскольку жесткая ориентация заместитегентами дает 1'-С-алкил- и 1'-С-алкенилтимидины лей в позиции С5' очень важна для экспериментов Для приготовления 1'-С-(замещенный алкил)- и 1'с NOE, в тимидиновые производные между З'-О- и С-(замещенный алкенил)-тимидинов можно ис5'-О-ввели кольцо TIPDS (схема 8, Фиг 11), где 5'пользовать алкил- или алкенилцинковые или кадпротоны ориентированы либо по направлению к миевые реагенты с замещениями В числе замесЗ'-протонам, либо от них Когда З'-протоны насытителей могут быть COOEt, CN, NO2 щены, можно легко пронаблюдать наличие или Гидроборирование или окислительное расщеплеотсутствие увеличения NOE 5'-протонов (диание полученных 1'-С-(со-алкенил)тимидинов дает грамма 1, Фиг 12) Для 5'-С-аллилтимидинов изогидроксиалкилтимидины, гидроксил которых можмер с увеличением NOE на 4,8% - это определенно преобразовать в различные функциональные но 5'-(Р)-изомер, а другой, без увеличения NOE, группы, такие как NH2, OR, SR, SH и X, где R - это 5'-(3)-изомер Без помощи рентгеновской кристалН или алкил, а X - это F, Cl, Br, I, Ots Для приголографии непосредственное определение стереотовления 1 '-С-алкоксиметили 1 '-Схимии 5'-эпоксидной группы затруднительно Одфеноксиметилтимидинов можно использовать нако, преобразование эпоксидов в продукты спирты и фенолы с замещениями В числе замесразмыкания колец не изменяет хиральность в потителей могут быть NO2, CN, COOEt или Оас 1 '-Сзиции С5' Если стереохимия одной пары таких нитроалкилтимидины можно восстановить до сопродуктов размыкания кольца определена, то ответствующих аминоалкилтимидинов Соединеможно определить и стереохимию эпоксидной ние 69 обрабатывают TBAF и получают незащипары Так, аналогично 5'-С-аллилтимидинам, из щенные соединения 70, которые преобразуют в эпоксидов была приготовлена пара продуктов соответствующие фосфорамидиты, соединения размыкания кольца, 5'-С-цианметилтимидинов, и 71 преобразована в продукты с TIPDS-кольцами При Соединение 63 полностью защищают рнасыщенном состоянии З'-протонов один из изометоксибензилом (МРМ) и получают соединение меров продемонстрировал увеличение NOE на 72 Гидролиз соединения 72 в присутствии пере6,3% Следовательно, это 5'-(Р)-изомер, а другой киси водорода и основания дает соединение 73, 5'-(3)-изомер которое подвергают перегруппировке Гофмана и получают амин, который при помощи метилброСинтез 1'-С-разветвленных нуклеозидов мида можно преобразовать в четвертичное произИмеются сообщения о ряде 1'-Сводное аммония, соединение 74 Триметиламин разветвленных нуклеозидов (a) Uteza, V , Chen, Gможно заменить различными нуклеофилами ОбR , Tuoi, J L Q , Descotes, G , Fenet, В , Grouiller, A работка соединения 74 алкоксидом натрия дает 1'Tetrahedron, 1993, 49, 8579 - 8588, b) Azhayev, A , С-алкокситимидины Обработка соединения 74 Gouzaev, A , Hovmen, J , Azhayeva, E , Lonnberg, H натрия алкилсульфидом дает 1'-СTetrahedron Letts 1993, 34, 6435 - 6438) Настоящим изобретением предусмотрены процедуры алкилтиотимидины При нагревании с бромидом приготовления большого числа 1'-Снатрия соединение 74 преобразуется 1'-Сразветвленных нуклеозидов Приготовление 1'-Сбромтимидин, который обрабатывают азидом наразветвленных нуклеозидов проиллюстрировано трия, нитритом натрия или нитрометаном и полусхемами 9 и 10 (Фиг 13 и 14, соответственно) чают соответствующие 1'-С-замещенные тимидиСоединение 63 получают в соответствии с известны Соединения 75 обрабатывают церия аммония ной процедурой (Uteza, V , Chen, G-R , Tuoi, J L Q , нитратом и получают незащищенные соединения Descotes, G , Fenet, В , Grouiller, A Tetrahedron, 76 5'-гидроксил защищают диметокситритилом, а 1993, 49, 8579 - 8588) 5'-С-гидроксильную группу полученные продукты, соединения 77, преобразусоединения 63 защищают диметокситритилом и ют в соответствующие фосфорамидиты, соединеполучают соединение 64, которое обрабатывают ния 78 трет-бутилдиметилхлорсиланом и получают соОлигонуклеотиды, содержащие нуклеозиды с единение 65 модифицированными сахарами Обработка соединения 65 третНедавно появились сообщения об олигонукбутилдиметилсилоксиметил хлоридом дает солеотидах, содержащих нуклеозиды с модифициединение 66 Обработка соединения 66 триэтокрованными сахарами (A Jorgensen, P N , Stem, сиаллюмогидридом лития в эфире дает альдегид, PC.Wengel, J J Am Chem Soc 1994,116,2231, соединение 67 Восстановление соединения 67 В Fensholdt, J , Thrane, H , Wengel, J Tetrahedron боргидридом натрия с последующей обработкой Letts 1995, 36, 2535, С Thrane, H , Fensholdt, J , трифторметансульфоновым ангидридом дает Regner, M , Wengel, J Tetrahedron, 1995, 51, трифлатное производное, соединение 68 Обра10389, D Saha, А К , Caulfield, T J , Hobbs, С , Upботка соединения 68 различными нуклеофильныson, D A, Waychunas, С , Yawman, A M J Org ми реагентами дает целый ряд новых 1'-СChem 1995, 60, 788, E Azhayev, A, Gouzaev, A, разветвленных тимидинов, соединений 69 Так, Hovmen, J , Azhayeva, E , Lonnberg, H Tetrahedron обработка соединения 68 цианидом, нитритом или Lett 1993, 34, 6435 - 6438, F Ono, A , Dan, A , Ma 22 21 45362 tsuda, A Bioconjugate Chemistry, 1993, 4, 499 - 508, 5'-О-(4,4'-диметокситритил)-3'-СG Inoue, H , Hayase, Y, Imura, A , Iwai, S, Miuta, цианметилтимидина K, Ohtsuka, E, Nucleic Acids Res 1987, 15, 6131, Суспензию 5'-О-(4,4'-диметокситритил)-3'-рH Lesmk, E A , Gumosso, С J , Kawasaki, A M , толуолсульфонилоксиметилтимидина (0,50г, Sasmor, H , Zounes, M , Cummins, L L, Ecker D J , 0,686ммоль) и цианида калия (0,134г, 2,06ммоль) Cook, P О , and Freier, S M Biochemistry, 1993, 32, в безводном N.N-диметилформамиде (DMF) (7мл) 7832) Настоящее изобретение обеспечивает созперемешивали при комнатной температуре в тедание большого числа новых нуклеозидов с мочение ночи Реакционную смесь разбавили ЕЮАс дифицированными сахарами, которые легко мож(60мл) и промыли водой (3 х 75мл), затем 10% но включить в олигонуклеотиды при помощи раствором ЫаНСОз (3 х 75мл) Органический слой фосфорамидитной химии Олигонуклеотиды с высушили над Na2SO4, сконцентрировали, очимодифицированными сахарами содержат хотя бы стили посредством хроматографии на силикагеле по одному нуклеозиду с модифицированным са(ЕЮАс-гексан, 1 1) и получили 0,386г (97%) 5'-Охаром, предложенному настоящим изобретением, (4,4'-диметокситритил)-3'-С-цианметилтимидина в они могут содержать последовательность из невиде бесцветного порошка скольких нуклеозидов с модифицированными саПример 3 харами или только нуклеозиды с модифицированПриготовление ными сахарами, предложенные настоящим 5'-О-(4,4'-диметокситритил)-3'-Сизобретением Олигонуклеотиды с модифицироазидометилтимидина ванными сахарами могут содержать и другие моСуспензию 5'-О-(4,4'-диметокситритил)-3'-рдификации, например, в скелетах, в основаниях и толуол-сульфонилоксиметилтимидина (0,40г, другие модификации в сахарах Очевидно, что 0,55ммоль) и NaN3 (0,11 г, 1,65ммоль) в безводном разветвленные заместители в позициях СЗ' или N.N-диметилформамиде (Змл), нагревали до 50°С С5' нуклеозидов снижают скорость соединения в в течение 3 дней Реакционную смесь охладили зависимости от своего размера Поэтому периоды до комнатной температуры, разбавили ЕЮАс соединения нуклеотидов с некоторыми громозд(30мл) и промыли водой (3 х 40мл), затем 10% кими заместителями были продлены Так, при раствором ЫаНСОз (3 х 40мл) Органический слой синтезе 5'-С-разветвленных олигонуклеотидов и высушили над Na2SO4, сконцентрировали, очи4'-С-разветвленных олигонуклеотидов на соедистили посредством хроматографии на силикагеле нение отводили 2 - 5 минут При синтезе З'-С(ЕЮАс-гексан, 1 1) и получили 0,30г (92%) 5'-Оразветвленных олигонуклеотидов на соединение (4,4'-диметокситритил)-3'-С-азидометилтимидина отводили 45 (3 х 15) минут Повторные соединев виде бесцветного порошка ния со свежими реагентами необходимы только Пример 4 при синтезе З'-С-разветвленных олигонуклеотиПриготовление 5'-О-(4,4'-диметокситритил)-3'дов, так как З'-гидроксил является третичным СоС-цианметилтимидин 3'-(2-цианэтил-г\1,г\1став очищенных олигонуклеотидов с модифицидиизопропилфосфорамидита) рованными сахарами проверяли посредством К перемешиваемому раствору 5'-О-(4,4'анализа продуктов их переваривания фермендиметокситритил)-3'-С-цианметилтимидина (0,20г, тами 0,344ммоль) и диизопропилэтиламина (0,24мл, 1,38ммоль) в безводном дихлорметане (Змл) при Примеры 0°С в атмосфере аргона добавили по каплям расИзобретение, описанное выше, станет более твор 2'-цианэтил-г\1,г\1понятным при обращении к нижеследующим придиизопропилхлорфосфорамидита (170мг, мерам Примеры иллюстрируют настоящее изо0,715ммоль) в дихлорметане Полученную реакбретение, но не ограничивают его объем ционную смесь перемешивали при комнатной Пример 1 температуре в течение 2 часов, охладили до 0°С, Приготовление разбавили холодным СН2СІ2 (20мл), промыли хо5'-О-(4,4'-диметокситритил)-3'-рлодным ЫаНСОз (3 х 40мл) Органический слой тосилоксиметилтимидина высушили над Na2SO4, сконцентрировали ОстаРаствор 5'-О-(4,4'-диметокситритил)-3'ток очистили посредством хроматографии на сигидроксиметилтимидина (2,12г, 3,69ммоль) приголикагеле (Et3N-Et0Ac-CH2CI2, 5 50 45) Получили товили в соответствии с известным способом 177мг (66%) 5'-О-(4,4'-диметокситритил)-3'-С(Jorgensen, Р N , Thrane, Н , Wengel, J J Am цианметилтимидин 3'-(2-цианэтил-г\1,г\1Chem Soc 1994, 116, 2231) Р-толуолсульфонил диизопропилфосфорамидита) в виде пены хлорид (1,76г, 9,23ммоль), ОМАР (0,180г, 1,48ммоль) в безводном пиридине перемешивали Пример 5 при комнатной температуре в течение ночи РеакПриготовление 5'-О-(4,4'-диметокситритил)-3'ционную смесь охладили до 0°С, разбавили ЕЮАс С-азидометилтимидин 3'-(2-цианэтил-г\1,г\1(500мл), промыли 10% раствором ЫаНСОз, высудиизопропилфосфорамидита) шили над Na2SO4 и сконцентрировали Сырой К перемешиваемому раствору 5'-О-(4,4'продукт очистили посредством хроматографии на диметокситритил)-3'-С-азидометилтимидина силикагеле (5% СН3ОН в СН2СІ2) Получили 2,39г (252мг, 0,344ммоль) и диизопропилэтиламина (89%) 5'-О-(4,4'-диметокситритил)-3'-р(0,44мл, 2,51ммоль) в безводном дихлорметане (Змл) при 0°С в атмосфере аргона добавили по тосилоксиметилтимидина в виде бесцветного покаплям раствор 2'-цианэтил-г\1,г\1рошка Пример 2 диизопропилхлорфосфорамидит (296мг, Приготовление 1,25ммоль) в дихлорметане Полученную реакци 24 23 45362 онную смесь перемешивали при комнатной тем117мг (88%) 5'-О-(4,4'-диметокситритил)-3'-Спературе в течение 2 часов, охладили до 0°С, метилтимидин 3'-(2-цианэтил-г\1,г\1разбавили в холодном CH2CI2 (20мл) и промыли диизопропилфосфорамидита) в виде пены холодным ЫаНСОз (3 х 15мл) Органический слой Пример 9 высушили над Na2SO4, сконцентрировали ОстаПриготовление 5'-О-(4,4'-диметокситритил)-3'ток очистили посредством хроматографии на сиС-аминометилтимидина ликагеле (Et3N-Et0Ac-CH2CI2, 5 50 45) Получили К раствору 5'-О-(4,4'-диметокситритил)-3'-С,О128мг (38%) 5'-О-(4,4'-диметокситритил)-3'-Сметилентимидина (901мг, 1,62ммоль) в метаноле азидометилтимидин 3'-(2-азидометил-г\І,г\І(Змл) добавили насыщенный раствор аммиака в метаноле (9мл), и полученный раствор выдержали диизопропилфосфорамида) в виде пены при комнатной температуре в течение 3 дней ИзПример 6 быток аммиака и метанола выпарили, и остаток Приготовление 5'-О-(4,4'-диметокситритил)-3'очистили посредством хроматографии (СНзОНС-метилентимидина гексан-СНСІз 1 1 8) Получили 414мг (45%) 5'-ОК суспензии NaH (60% в минеральном масле, (4,4'-диметокситритил)-3'-С-аминометилтимидина 0,18г, 7,5ммоль) в безводном тетрагидрофуране в виде бесцветного твердого вещества (18мл) при 0°С в атмосфере аргона добавили по каплям раствор 5'-О-(4,4'-диметокситритил)-3'-рПример 10 толуолсульфонилоксиметилтимидина (1,5г, Приготовление 5'-О-(4,4'-диметокситритил)-3'С-трифторацетамидометилтимидина 2,06ммоль) в тетрагидрофуране (10мл) Полученную реакционную смесь перемешивали при комРаствор 5'-О-(4,4'-диметокситритил)-3'-Снатной температуре в течение 2 часов, охладили аминометилтимидина (361мг, 0,628ммоль) и этилдо 0°С и погасили при помощи воды Смесь разтиотрифторацетата (490мг, 3,12ммоль) в безводбавили ЕЮАс (250мл), промыли водой (2 х ном тетрагидрофуране (6мл) перемешивали при 200мл), затем 10% раствором NaHCO3 (2 х комнатной температуре в течение 6 часов Рас200мл), высушили над Na2SO4 и сконцентрироватворитель выпарили, и остаток очистили посредли Остаток очистили посредством хроматографии ством хроматографии на силикагеле (5% СНзОН в на силикагеле (5% СНзОН в СЬЬСЬ) Получили СН2СІ2) Получили 411мг (98%) 5'-О-(4,4'0,97г (85%) 5'-О-(4,4'-диметокситритил)-3'-Сдиметокситритил)-3'-Сметилентимидина в виде пены трифторацетамидометилтимидина в виде бесцветного порошка Пример 7 Приготовление 5'-О-(4,4'-диметокситритил)-3'Пример 11 С-метилтимидина Приготовление 5'-О-(4,4'-диметокситритил)-3'С-трифторацетамидометил-тимидин 3'-(2К перемешиваемой суспензии алюмогидрида лития (58мг, 1,53ммоль) в безводном тетрагидроцианэтил-г\1,1\1-диизопропилфосфорамидита) фуране (10мл) при 0°С в атмосфере аргона добаК перемешиваемому раствору 5'-О-(4,4'вили по каплям раствор 5'-О-(4,4'диметокситритил)-3'-С-метилтимидина (411 мг, диметокситритил)-3'-С,О-метилентимидина 0,614ммоль) и диизопропилэтиламина (0,64мл, (385мг, 0,692ммоль) в тетрагидрофуране (10мл) 3,65ммоль) в безводном дихлорметане (6мл) при Реакционную смесь перемешивали при 0°С в те0°С в атмосфере аргона добавили по каплям расчение 1 часа, и реакцию погасили, медленно дотвор 2'-цианэтил-М,1\1бавляя 10% раствор ЫаНСОз Полученную смесь диизопропилхлорфосфорамидит (410мг, разбавили ЕЮАс (30мл), промыли ЫаНСОз (3 х 1,83ммоль) в безводном дихлорметане Получен20мл), высушили над Na2SO4 и сконцентрировали ную реакционную смесь перемешивали при комОстаток очистили посредством хроматографии на натной температуре в течение 2 часов, охладили силикагеле (5% СН3ОН в CHCI3) Получили 306мг до 0°С, разбавили холодным СН2СІ2 (30мл), про(79%) 5'-О-(4,4'-диметокситритил)-3'-Смыли холодным ЫаНСОз (3 х 20мл) Органический слой высушили над Na2SO4 и сконцентрировали метилтимидина в виде пены Остаток очистили посредством хроматографии на Пример 8 силикагеле (Et3N-Et0Ac-CHCI3, 5 30 65) Получили Приготовление 5'-О-(4,4'-диметокситритил)-3'386мг (72%) 5'-О-(4,4'-диметокситритил)-3'-СС-метилтимидин 3'-(2-цианэтил-г\1,г\1трифторацетамидометил-тимидин 3'-(2-цианэтилдиизопропилфосфорамидита) І\І,г\І-диизопропилфосфорамидита) в виде поК перемешиваемому раствору 5'-О-(4,4'рошка диметокситритил)-3'-С-метилтимидина (98мг, 0,17ммоль) и диизопропилэтиламина (0,13мл, Пример 12 0,742ммоль) в безводном дихлорметане (2мл) при Приготовление 3'-О-(4,4'-диметокситритил)-5'0°С в атмосфере аргона добавляли по каплям формилтимидина раствор 2'-цианэтил-г\1,г\1К перемешиваемому холодному раствору 3'О-(4,4'-диметокситритил)-тимидина (полученному диизопропилхлорфосфорамидита (85мг, из тимидина обычным способом, 40,4г, О.Збммоль) в дихлорметане Полученную реакци0,072ммоль) в безводном ДМСО (DMSO) добавионную смесь перемешивали при комнатной темли раствор дициклогексилкарбодиимида (DCC) пературе в течение 1 часа, охладили до 0°С, раз(45,86г, 0,224мол) в ДМСО (180мл) Полученный бавили холодным CH2CI2 (20мл), промыли раствор перемешивали при 5°С в течение 5 минут, холодным ЫаНСОз (3 х 15мл) Органический слой добавили пиридин (2,94г, 3,0мл, 0,0371 ммоль) и высушили над Na2SO4, сконцентрировали Остапосле перемешивания в течение следующих 5 ток очистили посредством хроматографии на симинут по каплям добавили раствор трифторуксусликагеле (EtaN-ЕЮАс-гексан 5 50 45) Получили 25 45362 26 ной кислоты (2,11г, 1,43мл, 0,0185мол) в ДМСО ного твердого вещества (2мл) Полученную реакционную смесь перемешиПример 16 вали при 5°С в течение Юминут и при комнатной Приготовление 3',5'-О-(бистемпературе в течение 6 часов Воду (20мл) добатетрагидропиранил)-4'-С-гидроксиметилтимидина вили по каплям при охлаждении, и смесь перемеК перемешиваемому раствору 4'-Сшивали при комнатной температуре в течение 1 бензоилоксиметилтимидина (1,65г, 4,39ммоль) и часа Осадки отфильтровали и промыли ДМСО р-толуолсульфокислоты (50мг) в безводном метиОбъединенный раствор ДМСО вылили на дроблеленхлориде (70мл) при 0°С по каплям добавили ный лед (4л) при перемешивании Осадки выдердигидропиран (1,84г, 1,89мл, 21,80ммоль) Полужали в течение часа, отфильтровали и обильно ченный раствор перемешивали при комнатной промыли водой Фильтровальный осадок раствотемпературе в течение 2 часов 2N NaOH (20мл) рили в метиленхлориде (5 00мл), органический добавили при охлаждении Для удаления метислой отделили, высушили над Na2SO4 и сконценленхлорида полученную смесь сконцентрировали, трировали Сырой остаток очистили посредством и добавили диоксан (10мл) Смесь перемешивали хроматографии на силикагеле (3% метанола в при комнатной температуре в течение 3 часов и метиленхлориде) Получили 32,6г (81%) 3'-О-(4,4'экстрагировали метиленхлоридом (3 х 30мл) Ордиметокситритил)-5'-формилтимидина в виде бесганический слой промыли водой (3 х 50мл), высуцветного порошка шили (Na2SO4) и сконцентрировали Остаток очистили посредством фильтрации на колонке с Пример 13 силикагелем Получили 1,50г (77,7%) 3',5'-О-(бисПриготовление 3'-О-(4,4'-диметокситритил)-4'тетрагидропиранил)-4'-С-гидроксиметилтимидина С-гидроксиметилтимидина в виде пены К перемешиваемому раствору 3'-О-(4,4'диметокситритил)-50'-формилтимидина (16,3г, Пример 17 30,07ммоль) в диоксане (120мл) при 0°С добавили Приготовление 4'-С-метоксиметилтимидина по каплям, по очереди, 36% формальдегида К перемешиваемому раствору 3',5'-О-(бис(24мл) и 2N NaOH (60мл) Полученный раствор тетрагидропиранил)-4'-С-гидроксиметилтимидина перемешивали при комнатной температуре в те(660мг, 1,5ммоль) и гидрида натрия (60% в минечение 6 часов Реакционную смесь охладили до ральном масле, 180мг, 4,5ммоль) в безводном 0°С, и по каплям добавляли 10% раствор уксусной тетрагидрофуране (15мл) при 0°С по каплям докислоты в воде, пока не довели рН до 7,5 Смесь бавили иодид метила (1,06г, 0,46мл) Полученную разбавили этилацетатом (1л), промыли 10% солясмесь перемешивали при комнатной температуре ным раствором (500мл, затем 2 х 300мл), высушив течение 1,5 часов По каплям добавили воду ли (Na2SO4) и сконцентрировали Сырой остаток (1мл) при 0°С, и довели рН до 7 при помощи укочистили посредством хроматографии на силикасусной кислоты Смесь разбавили этилацетатом геле (ЕЮАс-гексан, 31) Получили 11,45г (66,3%) (50мл), промыли водой (3 х 30мл), высушили 3'-О-(4,4'-диметокситритил)-4'-С(Na2SO4) и сконцентрировали Остаток растворили гидроксиметилтимидина в виде бесцветного пов кислой смеси (5мл тетрагидрофурана (THF), рошка 10мл СНзСООН и 5мл воды), раствор выдержали при 50°С в течение 3 часов, растворители выпаПример 14 рили, остаток растворили в смеси метанолПриготовление 4'-С-гидроксиметилтимидина толуол, сконцентрировали и все повторили еще Раствор 3'-О-(4,4'-диметокситритил)-4'-Сраз Очистили посредством хроматографии на гидроксиметилтимидина (6,32г, 11,0ммоль) в 80% силикагеле (10% этанол в хлороформе) Получили водном растворе уксусной кислоты (50мл) выдер271 мг (63%) 4'-С-метоксиметилтимидина в виде жали при комнатной температуре в течение 4 чабесцветного твердого вещества сов Растворители удалили при пониженном давлении, и добавили воду (200мл) Полученную Пример 18 непрозрачную смесь промылиэфиром (3 х 80мл), Приготовление 5'-О-(4,4'-диметокситритил)-4'и воду выпарили Остаток растворили в метаноле С-метоксиметилтимидина и толуоле, и полученный раствор сконцентрироРаствор 4'-С-метоксиметилтимидина (173мг, вали Этот процесс повторили дважды 4'-СО.бммоль) и диметокситритилхлорида (287мг, гидроксиметилтимидин (2,72г, 91%) получили в 0,84ммоль) в пиридине выдержали при комнатной виде пены температуре в течение 5 часов Пиридин выпарили, и остаток очистили посредством хроматограПример 15 фии на силикагеле (ЕЮАс-гексан, 2 1) Получили Приготовление 4'-С264мг (74%) 5'-О-(4,4'-диметокситритил)-4'-Сбензоилоксиметилтимидина метоксиметилтимидина в виде пены К перемешиваемому раствору 4'-Сгидроксиметилтимидина (3,72г, 13,67ммоль) в Пример 19 безводном пиридине (10мл) при комнатной темпеПриготовление 5'-О-(4,4'-диметокситритил)-4'ратуре добавили раствор бензангидрида (4,64г, С-метоксиметилтимидин 3'-(2-цианэтил-г\1,г\151ммоль) в пиридине (10мл) Полученный раствор диизопропилфосфорамидита) выдержали при 0°С в течение 1 часа и затем при К перемешиваемому раствору 5'-О-(4,4'комнатной температуре в течение 20 часов Добадиметокситритил)-4'-С-метоксиметилтимидина вили воду (5мл) при 0°С, выпарили пиридин, и (200мг, 0,34ммоль) и диизопропилэтиламина остаток подвергли хроматографии на силикагеле (176мг, 236мкл, 1,36ммоль) в безводном метилен(7% этанол в хлороформе) Получили 2,27г (44%) хлориде (Змл) при 0°С в атмосфере азота доба4 '-С-бензоилоксиметилтимидина в виде бесцветвили по каплям раствор 2'-цианэтил-г\1,г\1 28 27 45362 диизопропилхлорфосфорамидита (161мг, 152мкп, в диоксане перемешивали при комнатной темпе0,68ммоль) в метиленхлориде (1мл) Полученную ратуре в течение 5 часов Растворитель выпариреакционную смесь перемешивали при комнатной ли, и остаток очистили посредством хроматогратемпературе в течение 30 минут, охладили до фии на силикагеле (5% метанола в хлороформе) 0°С, разбавили етилацетатом (30мл) Смесь проПолучили 220мг (71%) 3',5'-(бис-третмыли 10% раствором ЫаНСОз (3 х 20мл), высушибутилдиметилсилил)-4'-Сли (Na2SO4) и сконцентрировали Остаток очиститрифторацетамидометилтимидина в виде белого ли посредством хроматографии на силикагеле твердого вещества (Et3N-ЕЮ Ас-гексан, 5 45 50) Получили 190мг Пример 23 (71%) 5'-О-(4,4'-диметокситритил)-4'-СПриготовление 4'-Сметоксиметилтимидин 3'-(2-цианэтил-г\1,г\1трифторацетамидометилтимидина диизопропилфосфорамидита) в виде пены Раствор 3',5'-(бис-трет-бутилдиметилсилил)4'-С-трифторацетамидометилтимидина (215мг, Пример 20 О.Збммоль) и TBAF (1,0М в тетрагидрофуране, Приготовление 3',5'-(бис-третнейтрализованный уксусной кислотой до рН = 7,5, бутилдиметилсилил)-4'-С-гидроксиметилтимидина 0,72мл) в тетрагидрофуране выдерживали при К холодному перемешиваемому раствору 4'-Скомнатной температуре в течение 20 часов Расбензоилметилтимидина (1,14г, З.ОЗммоль) и имитворитель выпарили, и остаток очистили посреддазола (985мг, 15,15ммоль) в пиридине добавили ством хроматографии на силикагеле (10% метараствор трет-бутилдиметилхлорсилана (1,37г, нола в хлороформе) Получили 118мг (89%) 4'-С9,09ммоль) в пиридине Реакцию выдержали при трифторацетамидометилтимидина в виде бес50°С в течение ночи, разбавили этилацетатом цветного твердого вещества (100мл), промыли водой (Зх 50мл), сконцентрировали Остаток растворили в этаноле (10мл), и доПример 24 бавили смесь этилендиамина и этанола (1 1, Приготовление 5'-О-(4,4'-диметокситритил)-4'20мл) Раствор нагревали до 50°С в течение 2 С-трифторацетамидометилтимидина дней Этанол и этилендиамин выпарили при поРаствор 4'-Сниженном давлении, и остаток растворили в хлотрифторацетамидометилтимидина (110мг, роформе (60мл) Раствор промыли водой (3 х О.Зммоль) и диметокситритилхлорида (152мг, 40мл), высушили (N32804) и сконцентрировали 0,45ммоль) в безводном пиридине (2мл) выдерОстаток очистили посредством хроматографии на живали при комнатной температуре в течение силикагеле (ЕЮАс-гексан, 1 1) Получили 780мг ночи Пиридин выпарили, и остаток очистили по(52%) 3',5'-(бис-трет-бутилдиметилсилил)-4'-Ссредством хроматографии на силикагеле (ЕЮАсгидроксиметилтимидина в виде белого твердого гексан, 2 1) Получили 122мг (61%) 5'-О-(4,4'вещества диметокситритил)-4'-Стрифторацетамидометилтимидина в виде пены Пример 21 Приготовление 3',5'-(бис-третПример 25 бутилдиметилсилил)-4'-С-аминометилтимидина Приготовление 5'-О-(4,4'-диметокситритил)-4'С-трифторацетамидометил-тимидин 3'-(2К перемешиваемому раствору 3',5'-(бис-третбутилдиметилсилил)-4'-С-гидроксиметилтимидина цианэтил-г\1,1\1-диизопропилфосфорамидита) (500мг, 1ммоль) и пиридина (0,4мл) в безводном К перемешиваемому раствору 5'-О-(4,4'метиленхлориде (5мл) при 0°С добавили по капдиметокситритил)-4'-С-трифторацетамидометиллям смесь трифторметансульфонового ангидрида тимидина (110мг, 0,165ммоль) и диизопропилэти(564мг, 332мкл, 2,0ммоль) и пиридина (0,4мл) в ламина (129мг, 174мкл, 1,00ммоль) в безводном метиленхлориде (5мл) Полученную реакционную метиленхлориде (Змл) при 0°С в атмосфере азота смесь перемешивали при 0°С в течение 30 минут, добавили по каплям раствор 2'-цианэтил-г\1,г\1и добавили 0,5мл 10% раствора ЫаНСОз при диизопропилхлорфосфорамидит (78мг, 74мкл, 10°С Смесь разбавили метиленхлоридом (20мл), О.ЗЗммоль) в метиленхлориде (1мл) Полученную промыли холодным 10% ЫаНСОз (2 х 30мл), выреакционную смесь перемешивали при комнатной сушили (Na2SO4), сконцентрировали и сушили в температуре в течение 30 минут, охладили до вакууме в течение 1 часа Сырой остаток раство0°С, разбавили этилацетатом (20мл) Смесь прорили в диоксане (30мл) и подвергли сатурации мыли 10% раствором ЫаНСОз (3 х 15мл), высушигазообразным аммиаком Раствор выдержали при ли (Na2SO4) и сконцентрировали Остаток очистикомнатной температуре в течение ночи и затем ли посредством хроматографии на силикагеле держали нагретым при 50°С в течение 2 дней (Et3N-ЕЮ Ас-гексан, 5 45 50) Получили 137мг Избыток аммиака и диоксана выпарили, и остаток (86%) 5'-О-(4,4'-диметокситритил)-4'-Сочистили посредством хроматографии на силикатрифторацетамидометил-тимидин 3'-(2-цианэтилгеле ( 1 % МеОН и 5% Et3N- в СНСІз) Получили І\І,г\І-диизопропилфосфорамидита) в виде пены 266мг (53%) 3',5'-(бис-трет-бутилдиметилсилил)-4'Пример 26 С-аминометилтимидина в виде белого вещества Приготовление 3',5'-О-(бис-третПример 22 бутилдиметилсилил)-4'-С-азидометилтимидина Приготовление 3',5'-(бис-третК перемешиваемому раствору 3',5'-(бис-третбутилдиметилсилил)-4'-С-гидроксиметилтимидина бутилдиметилсилил)-4'-С(0,95г, 0,19ммоль) и пиридина (0,1мл) в безводном трифторацетамидометилтимидина метиленхлориде (1мл) при 0°С добавили по капРаствор 3',5'-(бис-трет-бутилдиметилсилил)лям смесь трифторметансульфонового ангидрида 4'-С-аминометилтимидина (260мг, 0,52ммоль) и (107мг, бЗмкл, 0,38ммоль) и пиридина (0,2мл) в этилтиотрифторацетата (635мг, 0,52мл, 4,0ммоль) 30 29 45362 метиленхлориде (2,5мл) Реакционную смесь пеи сконцентрировали Остаток очистили ремешивали при 0°С в течение 30 минут, охладипосредством хроматографии на силикагеле ли до -10°С, и добавили 0,5мл 10% раствора (ЕЮАс-гексан, 1 2) Получили неизмененный исЫаНСОз Смесь разбавили холодным метиленходный материал (2,25г, 35,9%), З'-О-третхлоридом (10мл), промыли холодным 10% расбутилдиметилсилил-5'-(3)-С,О-метилентимидин твором ЫаНСОз (2 х 10мл), высушили (ЫагЗСч), (3,2г, 76%) и 3'-О-трет-бутилдиметилсилил-5'-(Р)сконцентрировали и сушили в вакууме в течение С.О-метилентимидин (0,365г, 8%) Юминут Сырой остаток растворили в безводном Пример 30 N.N-диметилформамиде (1мл), и добавили азид Приготовление З'-О-трет-бутилдиметилсилилнатрия (50мг) Раствор держали нагретыми при 5'-С-метоксиметилтимидина 50°С в течение 14 часов, разбавили этилацетатом Раствор 3'-О-трет-бутилдиметилсилил-5'-(Р)(20мл), промыли водой (2 х 10мл), высушили С,О-метилентимидина (1,84г, 5ммоль) и безводно(Na2SO4) и сконцентрировали Остаток очистили го карбоната калия (1,38г, Юммоль) в метаноле посредством хроматографии на силикагеле (10% перемешивали при комнатной температуре в теэтилацетат в метиленхлориде) Получили 42мг чение 90 часов Добавили этилацетат (70мл), и 3',5'-О-(бис-трет-бутилдиметилсилил)-4'-Ссмесь нейтрализовали уксусной кислотой до рН = азидометилтимидина в виде пены 7 Растворители выпарили, и остаток растворили в метиленхлориде (30мл) Осадки отфильтровали, Пример 27 и раствор сконцентрировали Остаток очистили Приготовление 4'-С-азидометилтимидина посредством хроматографии на силикагеле Раствор 3',5'-О-(бис-трет(ЕЮАс-гексан, 1 1) Получили 310мг неизмененнобутилдиметилсилил)-4'-С-азидометилтимидина го исходного материала и 578мг З'-О-трет(25мг) и TBAF (1,0М в тетрагидрофуране, 0,5мл) в бутилдиметилсилил-б'-С-метоксиметилтимидина в тетрагидрофуране (1 мл) выдерживали при комвиде бесцветного твердого вещества натной температуре в течение 30 минут Растворитель выпарили, и остаток очистили посредством Пример 31 хроматографии на силикагеле (6% МеОН в Приготовление З'-О-трет-бутилдиметилсилилСН2СІ2) Получили 11мг 4'-С-азидометилтимидина 5'-С-трифторацетамидометилтимидина в виде бесцветного твердого вещества Раствор 3-О-трет-бутилдиметилсилил-5'-(Р)С,О-метилентимидина (0, 84г, 2,28ммоль) в метаПример 28 ноле перемешивали с раствором метанола, наПриготовление З'-О-трет-бутилдиметилсилилсыщенным аммиаком (10мл) Полученный раствор -5'-дезокси-5'-метилидентимидина выдержали при комнатной температуре в течение Суспензия гидрида натрия (60% в минераль15 часов, и затем избыток аммиака и метанола ном масле, 2,88г, 72ммоль) в безводном ДМСО выпарили Сухой остаток растворили в диоксане (100мл) после перемешивания при 65°С в течение (10мл), и добавили этилтиотрифторацетат (1,80г, 1,5 часа в атмосфере азота превратилась в про11,4ммоль, 1,46мл) Реакционную смесь перемезрачный раствор, который охладили до комнатной шивали при комнатной температуре в течение 6 температуры и перенесли в холодную перемешичасов, и затем растворитель выпарили Остаток ваемую суспензию метилтрифенилфосфония подвергли хроматографии на силикагеле (ЕЮАсбромида (27,Ог, 75,6ммоль) в ДМСО (20мл) в атгексан, 1 1) Получили 895мг (81,8%) З'-О-третмосфере азота Реакционную смесь перемешивабутилдиметилсилил-5'-Сли при комнатной температуре в течение 45 минут, с одновременным охлаждением добавили трифторацетамидометилтимидина в виде бесраствор 3'-О-трет-бутилдиметилсилил-5'-дезоксицветного твердого вещества 5'-формилтимидина (8,50г, 24ммоль) в ДМСО Пример 32 (40мл) Реакционную смесь перемешивали при Приготовление З'-О-трет-бутилдиметилсилилкомнатной температуре в течение 2 часов, разба5'-(3)-С-цианметилтимидина вили этилацетатом (2л), промыли соляным расСмесь 3'-О-трет-бутилдиметилсилил-5'-(Р)твором, высушили (Na2SO4), сконцентрировали С,О-метилентимидина (0,77г, 2,09ммоль) и цианид Сырой остаток очистили посредством хроматокалия (520мг, 8,0ммоль) в N,Nграфии на силикагеле (ЕЮАс-гексан, ЗО 70) Подиметилформамиде (10мл) перемешивали при лучили 6,79г (80,2%) З'-О-треткомнатной температуре в течение 40 часов, разбутилдиметилсилил-5'-дезокси-5'бавили этилацетатом (100мл), промыли соляным метилидентимидина в виде бесцветного твердого раствором (5 х 60мл), высушили (Na2SO4) и сконвещества, точка плавления 122°С (перекристалцентрировали Сырой остаток очистили посредстлизация из этилацетата и гексана) вом хроматографии на силикагеле (ЕЮАс-гексан, 1 1) Получили 3'-О-трет-бутилдиметилсилил-5'Пример 29 (З)-С-цианметилтимидин (580мг, 70%) в виде беПриготовление З'-О-трет-бутилдиметилсилиллого твердого вещества 5'-С,О-метилентимидина Раствор 3'-О-трет-бутилдиметилсилил-5'Пример 33 дезокси-5'-метилидентимидина (6,26г, Приготовление З'-О-трет-бутилдиметилсилил5'-(3)-С-азидометилтимидина 17,78ммоль) и m-хлорнадбензойной кислоты (4,61 г, 26,68ммоль) в метиленхлориде (160мл) Смесь 3'-О-трет-бутилдиметилсилил-5'-(Р)перемешивали при комнатной температуре в теС,О-метилентимидина (3683мг, 1,0ммоль) и циачение ночи, разбавили метиленхлоридом (200мл), нида калия (325мг, 5,0ммоль) в N,Nпромыли 10% раствором ЫаНСОз (2 х 240мл) и диметилформамиде (Змл) выдерживали нагретызатем соляным раствором (160мл), высушили ми при 50°С в течение 16 часов, разбавили этил 31 32 диметокситритил)-5'-(3)-Стрифторацетамидометилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'-(3)-Стрифторацетамидометилтимидина, Пример 36 Приготовление 5'-О-(4,4'-диметокситритил)-5'(З)-С-метоксиметилтимидинов Раствор 3'-О-трет-бутилдиметилсилил-5'-О(4,4'-диметокситритил)-5'-(3)-Сметоксиметилтимидина (825мг, 1,17ммоль) и TBAF (1,0М в тетрагидрофуране, 3,6мл, З.бммоль) в тетрагидрофуране (15мл) выдерживали при комнатной температуре в течение 2 часов Тетрагидрофуран выпарили, и остаток подвергли хроматографии на силикагеле (ЕЮАс-гексан, 3 2) Получили 551мг (80%) 5'-О-(4,4'диметокситритил)-5'-(3)-Сметоксиметилтимидинов Подобным образом были приготовлены следующие вещества 5'-О-(4,4'-диметокситритил)-5'-(3)-Сцианметилтимидин был получен из З'-О-третбутилдиметилсилил-5'-О-(4,4'-диметокситритил)5'-(3)-С-цианметилтимидина, 5'-О-(4,4'-диметокситритил)-5'-(3)-Сазидометилтимидин был получен из З'-О-третбутилдиметилсилил-5'-О-(4,4'-диметокситритил)5'-(3)-С-азидометилтимидина, 5'-О-(4,4'-диметокситритил)-5'-(3)-Саллилметилтимидин был получен из З'-О-третбутилдиметилсилил-5'-О-(4,4'-диметокситритил)5'-(3)-С-аллилметилтимидина, 5'-О-(4,4'-диметокситритил)-5'-(Р)-Саллилметилтимидин был получен из З'-О-третбутилдиметилсилил-5'-О-(4,4'-диметокситритил)5'-(Р)-С-аллилметилтимидина, 5'-О-(4,4'-диметокситритил)-5'-(3)-Стрифторацетамидометилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'-О-(4,4'диметокситритил)-5'-(3)-Стрифторацетамидометилтимидина Пример 37 Приготовление 5'-О-(4,4'-диметокситритил)-5'(З)-С-метоксиметилтимидин 3'-(2-цианэтил-М,Мдиизопропилфосфорамидитов) К раствору 3'-О-трет-бутилдиметилсилил-5'-О(4,4'-диметокситритил)-5'-(3)-Сметоксиметилтимидина (490мг, 0,83ммоль), диизопропилэтиламина (646мг, 0,87мл, 5,0ммоль) в безводном дихлорметане (5мл) при 0°С в атмосфере азота добавили малыми каплями раствор 2-цианэтил-г\1,1\1-диизопропилхлорфосфорамидита (592мг, 2,5ммоль, 558мкл) в дихлорметане (1мл) Раствор перемешали при комнатной температуре в течение 40минут, охладили до 0°С, растворили в дихлорметане (60мл), промыли холодным 5% раствором ЫаНСОз (3 х 40мл), высушили (ЫагЗСч) и сконцентрировали Остаток подвергли хроматографии на силикагеле (Eta N-ЕЮ Ас-гексан, 5 45 50) Получили 584мг (89%) 5'-О-(4,4'диметокситритил)-5'-(3)-С-метоксиметилтимидины 3'-(2-цианэтил-г\1,г\1-диизопропилфосфорамидита) в виде пены 45362 ацетатом (60мл), промыли соляным раствором (5х 40мл), высушили (Na2SO4) и сконцентрировали Сырой остаток очистили посредством хроматографии на силикагеле (ЕЮАс-гексан, 1 1) Получили 53'-О-трет-бутилдиметилсилил-5'-(3)-Сазидометилтимидин (173мг, 42%) в виде белого твердого вещества Пример 34 Приготовление 3'-О-чтрет-бутилдиметилсилил-5'-Саллилтимидинов К суспензии безводного цианида меди (7,57г, 84,7ммоль) в безводном тетрагидрофуране при5°С в атмосфере аргона добавили по каплям аллилбромид магния (2,ОМ в тетрагидрофуране, 46,6мл, 93,2ммоль) Суспензию перемешивали в течение 15минут при-5°С и по каплям добавляли холодный раствор З'-О-трет-бутилдиметилсилил5'-формилтимидина (5,0г, 14,12ммоль) в тетрагидрофуране (200мл) Реакционную смесь перемешивали при комнатной температуре в течение 6 часов, погасили, добавив 10% раствор ЫаНСОз (150мл) при 0°С, и разбавили этилацетатом (200мл) Органический слой промыли 10% раствором МаНСОз (2 х 150мл), высушили (МагЄСч) и сконцентрировали Получили 5,18г сырых З'-Отрет-бутилдиметилсилил-5'-С-аллилтимидинов (содержащих два изомера 5'-(R) и 5'-(S)) Два изомера (соотношение 1 1) были разделены посредством хроматографии на силикагеле (15% ЕЮАс в СНСІз) Пример 35 Приготовление З'-О-трет-бутилдиметилсилил5'-О-(4,4'-диметокситритил)-5'-(3)-Сметоксиметилтимидинов Смесь 3'-О-трет-бутилдиметилсилил-5'-Сметоксиметилтимидина (258мг, 0,645ммоль), диметокситритилхлорида (1,09г, 3,22ммоль) и трифторметансульфонового ангидрида серебра (835мг, 3,22ммоль) в безводном пиридине (Змл) выдержали нагретой при 50°С в течение 18 часов Пиридин выпарили, и остаток подвергли хроматографии на силикагеле (ЕЮАс-гексан, 1 1) Получили 372мг (82%) З'-О-третбутилдиметилсилил-5'-О-(4,4'-диметокситритил)5'-(3)-С-метоксиметилтимидинов в виде белого твердого вещества Подобным образом были приготовлены следующие вещества 3'-О-трет-бутилдиметилсилил-5'-О-(4,4'диметокситритил)-5'-(3)-С-цианметилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'-(3)-Сцианметилтимидина, 3'-О-трет-бутилдиметилсилил-5'-О-(4,4'диметокситритил)-5'-(3)-С-азидометилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'(З)-С-азидометилтимидина, 3'-О-трет-бутилдиметилсилил-5'-О-(4,4'диметокситритил)-5'-(3)-С-аллилметилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'(З)-С-аллилметилтимидина, 3'-О-трет-бутилдиметилсилил-5'-О-(4,4'диметокситритил)-5'-(Р)-С-аллилметилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'(Р)-С-аллилметилтимидина, 3'-О-трет-бутилдиметилсилил-5'-О-(4,4' Подобным образом были приготовлены следующие вещества 5'-О-(4,4'-диметокситритил)-5'-(3)-С 34 33 45362 цианметилтимидин 3'-(2-цианэтил-1\1,1\1Процесс приготовления такой же, как описан в литературе (Radhaknshna, A S , Parham, М Е , диизопропилфосфорамидит) был приготовлен из Riggs, R М and Loudon, G M J Org Chem 1979, 5'-О-(4,4'-диметокситритил)-5'-(3)-С44, 1746) Г-циан-3',5',5цианметилтимидина, 5'-О-(4,4'-диметокситритил)-5'-(3)-Стрис(метоксибензил)тимидин (1,0ммоль) в безазидометилтимидин 3'-(2-цианэтил-г\1,г\1водном тетрагидрофуране добавили к перемешиваемому раствору 1,1-бисдиизопропилфосфорамидит) был приготовлен из (трифторацетоксийодбензола (2,0ммоль) в тетра5'-О-(4,4'-диметокситритил)-5'-(3)-Сгидрофуране при 0°С Реакционную смесь переазидометилтимидина, мешивали при комнатной температуре в течение 5 5'-О-(4,4'-диметокситритил)-5'-(3)-Счасов, разбавили дихлорметаном, промыли 5% аллилметилтимидин 3'-(2-цианэтил-г\1,г\1карбонатом натрия и соляным раствором Сырой диизопропилфосфорамидит) был приготовлен из продукт очистили посредством хроматографии 5'-О-(4,4'-диметокситритил)-5'-(3)-Саллилметилтимидина, Пример 42 5'-О-(4,4'-диметокситритил)-5'-(Р)-СПриготовление триметил-3',5',5-трисаллилметилтимидин 3'-(2-цианэтил-г\1,г\1(метоксибензил)-тимидин-1'-ил аммония бромида диизопропилфосфорамидит) был приготовлен из 1'-амино-3',5',5-трис-(метоксибензил)-тимидин 5'-О-(4,4'-диметокситритил)-5'-(Р)-Сдобавили к перемешиваемому раствору метилаллилметилтимидина, бромида (10 эквивалентов) в тетрагидрофуране при 0°С Реакционную смесь перемешивали при 5'-О-(4,4'-диметокситритил)-5'-(3)-С50°С в течение ночи Растворитель выпарили, и трифторацетамидометилтимидин 3'-(2-цианэтилсырой продукт очистили посредством перекри|\|,г\1-диизопропилфосфорамидит) был приготовлен сталлизации из 5'-О-(4,4'-диметокситритил)-5'-(3)-Стрифторацетамидометилтимидина Пример 43 Пример 38 Приготовление 1'-бром-3',5',5-трисПриготовление 1'-циан-3'-трет(метоксибензил)-тимидина бутилдиметилсилил-5'-(4,4'-диметокситритил)Процесс приготовления такой же, как описан в тимидина литературе (Deady, L W, Korytsky, ОL Tetrahedron Lett 1979, 451) Триметил-3',5',5-трис1'-циан-5'-(4,4'-диметокситритил)-тимидин в (метоксибензил)-тимидин-1-ил аммония бромид безводном пиридине добавили к перемешиваевыдержали нагретым при 150°С в вакууме в течемому раствору трет-бутилдиметилхлорсилана (1,5 ние ночи Сырой продукт непосредственно исэквивалента) и имидазола (3,5 эквивалента) в пользовали в следующей реакции безводном пиридине при 0°С Полученную реакционную смесь перемешивали при комнатной Пример 44 температуре в течение ночи Пиридин выпарили, и Приготовление 1'-этокси-3',5',5-трисостаток растворили в этилацетате, промыли соля(метоксибензил)-тимидина ным раствором Сырой продукт непосредственно 1'-бром-3',5',5-трис-(метоксибензил)-тимидин в использовали в следующей реакции этаноле добавили к перемешиваемому раствору этоксида натрия в этаноле при -10°С Полученную Пример 39 реакционную смесь перемешивали при комнатной Приготовление 3'-трет-бутилдиметилсилил-5'температуре в течение 1 часа, нейтрализовали диметокситритил-1'-формил-5разбавленной соляной кислотой Этанол выпариметоксибензилтимидина ли, и оставшуюся реакционную смесь экстрагиро3'-трет-бутилдиметилсилил-1'-циан-5'вали этилацетатом Сырой остаток очистили подиметокситритил-5-(р-метоксибензил)-тимидин средством хроматографии Получили смесь а и р (1,0ммоль) в тетрагидрофуране добавили к передиастереомеров мешиваемому раствору триэтоксиалюмогидрида лития (2,0ммоль) в тетрагидрофуране при -20°С в Подобным образом были приготовлены слеатмосфере азота Реакционную смесь перемешидующие вещества вали при 5 - 10°С в течение 1 часа, погасили вод1'-(4-нитробутокси)-3',5',5-трисным раствором хлорида аммония Смесь экстра(метоксибензил)-тимидин из 1'-бром-3',5',5-трисгировали этилацетатом, и сырой продукт (метоксибензил)-тимидина и 4-нитрибутанола-1 подвергли хроматографии на силикагеле 1'-этилтио-3',5',5-трис-(метоксибензил)Пример 40 тимидин был приготовлен из 1'-бром-3',5',5-трисПриготовление 1'-амидо-3',5',5-трис(метоксибензил)-тимидина и тиоэтоксида натрия (метоксибензил)-тимидина Пример 45 1'-амидо-3',5',5-трис-(метоксибензил)-тимидин Приготовление 1'-амино-тимидина добавили к перемешиваемому водному раствору Суспензию 1'-амино-3',5',5-трис30% перекиси водорода и карбоната натрия при (метоксибензил)-тимидина и 10% палладирован0°С Реакционную смесь перемешивали при комного угля в этаноле встряхивали в устройстве для натной температуре в течение 2 часов, разбавили гидрогенизации при давлении водорода 344,7кПа водой, нейтрализовали, добавив соляную кислоту, в течение ночи Твердое вещество отфильтроваэкстрагировали дихлорметаном Сырой продукт ли, и фильтрат сконцентрировали Сырой продукт очистили посредством хроматографии очистили посредством перекристаллизации Пример 41 Пример 46 Приготовление 1'-амино-3',5',5-трисПриготовление олигонуклеотидов с модифи(метоксибензил)-тимидина цированными сахарами 35 45362 36 Этот пример иллюстрирует использование соваемых разветвленным заместителем в позиции единения 55 (Фиг 8) в ходе синтеза произвольноС5' тимидина присоединение Т* происходило го олигонуклеотида с такой последовательностью дольше (5минут) По окончании синтеза обработку 5'-d(ATC ТСТ CCG СТТ СТТ* ТТ* С)-3' олигонуклеотида проводили стандартным спосоВ этой последовательности А, С, G и Т обобом Сырой олигонуклеотид очистили на образначают немодифицированные дезоксирибонукщенно-фазной колонке С18 Beckman посредством леозиды, а Т* обозначает 5'-СЖХВР с буфером ТЕАА (рН 7,0) и ацетонитрилом в качестве подвижной фазы Получили очищенаминометилтимидин В этом примере синтез олиный олигонуклеотид, оптическая плотность 62,4 гонуклеотидов проводили в синтезаторе ДНК ABI 394 (Applied Biosystems, модель 394) Все нуклеоПодобным образом были приготовлены слезиды присоединяли по принципам фосфорамидующие произвольные олигонуклеотиды с модидитной химии Присоединение dA, dC, dG и Т фицированными сахарами осуществляли при помощи стандартных для син5'-С-разветвленные олигонуклеотиды с модитеза ДНК реагентов в соответствии со стандартфицированными сахарами ной процедурой Из-за стерических помех, создаС-резветЕленЧые олигенуклеоздмя* с 1. 5'-ЙТСТСТСС5СТТССТТТС 5'~TTCCTGTCTGATGGCTTC-3' 76 5 'і' -ДТСГСТССЗСТГССТТХГ^В' 1 2. 5 -XXCCTGTCTGATGGCTTC-3' 3. 5'-TTCCTGTCXGATGGCTTC-3' 4. 5'-ATCTCTCCGCTTCCTTTC-3' 6. Ъ'-ATCTCTCCSCTTCCTXXC-3' 2Ё b'-ftTCTCTCCGCTTCCXTXC~3' 2Э S'-АЯСТСТССССТТСС-ТТС-З' 30 5. 2" 5 ' -ATCTCXCCGC17'XCCTTTC-3 ' 5'-ATCTCTCCGCTTCCTTXC-S' 31 5•-ETCTC"CCGCTTCC"TYC-3' 5'--ATCTCTCCGClTCCTXXC-3' 32 5'-ATCTCTCCGCTTCCTYXC-3' 7. 5'-ATCTCXCCGCTXCCTTTC-3' 8. 5'-ATCTCTCCGCTTCCTTXC-3' 9. 5'-ЙТСТСТССЄСТТССТУЇС-З' 10. 5'-ATCTCTCCGCTTCCYTYC-3' 11. 5'-AYCTCYCCGCTYCCTTYC-3' 12. 5'-ATCTCTCCGCTTCCTTZC-3' 13. зз 5'-ATCTCTCCGCTTCCTZZC-3' 34 33 5'-ЙТСТСЇССЙСТХССТТТС-З' Ї - і *~С аминомегилфкмиякі' 3 -С-рйззетвгеннне олтогіуклеотияьі 36 5' -ДТСТСТССЄСТТССЇ'ТТС-3' З"1 J ' -RTCTCTcCGCTTcCTTxc-3 * 33 S'-ATCTCTCCGCXTCCTXXC-j' 39 S -ATCTCTCCGCTTCCXTXC-3' 40 S'-ATCTCTCOGCXTCCTTK. 3 ' 42 S•-АТСТСТССЙСЇТССТЇЇС-3" 14. 5'-ATCTCTCCGCTTCCZTZC-3' 15. 5'-ATCTCTCCGCTTCCTTVC-3' 16. 5 • -ATCTCTCCGCTTCCTWC-3 ' 17. 5'-ATCTCTCCGCTTCCVTVC-3' 43. 5'-&TCTCTCCGCTTCCTYXC-3" IB. 5'-ATCTCVCCGCVTCCTTTC-3' 44. 5'-ATCTCTCCGCXTCCTTTC-3' 19. 5' -S.VCTCTCCGCTTCCTTTC-3 ' 45. 5'-ЙЇСТСТССССТТССХТХС-Зт 20. 5'-ATCTCTCCGCTTCCTTWC-3' 46. 5'-АТСТСЇССЄСТЇССТТТС-3' 21. 5'-ATCTCTCCGCTTCCTWKC~3' 47. 5'-ftTCTCTCCGCTTCCTTZC-3' 48 5'-ftTCTCTCCGCTTCCTZZC-3' 49. 5'-ftTCTCTCCGCTTCCZTZC-3' 22. S'~ATCTCTCCGCTTCCWTHC-3' 23. 5'-ATCTCWCCGCWTCCTTTC-3' 24. 5!-AWCTCTCCGCTTCCTTTC-3' Y - 5 - (S) -С-аьмиометслтиьмдин Z 5'-(£)-С-„иа(шетклткмидии, V - 5'-!Б}-С-аялил№Мизин, и И = 5-'Ю-С-аллилтимилин > X = З'-С-аминометилтимидин, Y = З'-С-метилтимидин, Z = З'-С-цианметилтимидин Включение посредством ссылки Все патенты, патентные заявки и публикации, упомянутые в настоящем документе, включаются в него посредством ссылки Эквиваленты Приведенное выше описание считается достаточным, чтобы специалист мог внедрить изобретение в практику Различные модификации описанного выше изобретения, очевидные для специалистов в области органической химии или в родственных областях, включаются в объем формулы изобретения 37 38 45362 N O-OJ иигонуклвонід ГС ,, S О Фиг. 4 • О— Оли;ону*лестид HI—s л Ч О Фиг. 5 Фиг. 1 TlC ~, , • Q ОТ}) М5 Т^"н DMIsO •(1 10 К \H І1Р TJDMSO h Фиг. 6 Фиг. 2 -О—; і. L-'NJ ^ LA. N о, ' R Cl] s O н МІ Фиг. 7 XI" Фиг З \( р г 39 40 45362 л У О CfLOH ФИГ. 8 ™>ч R-CUjO Ч О, TBOMSil - Фиг. 13 Ч « SS В MCDCi (,.4 о ФИГ. 9 OMI'M 7-. Фиг. 10 л* "a p іл Фиг. 14 Фиг. 11 ФИГ. 12 41 45362 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 42
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 31/12, A61P 29/00, C07H 21/00, A61K 31/7064, C12N 15/09, A61K 31/7088, A61K 31/52, A61K 31/7072, C07H 19/10, A61K 31/70, A61K 31/7042, A61K 31/7076, C07D 239/54, C07D 473/00, A61P 31/00, A61P 35/00, A61K 31/7052, A61K 48/00, A61K 31/708, C07H 19/16, C07H 19/06, A61K 31/7068
Мітки: модифікованими, нуклеозиди, олігонуклеотиди, цукрами
Код посилання
<a href="https://ua.patents.su/21-45362-nukleozidi-z-modifikovanimi-cukrami-ta-oligonukleotidi.html" target="_blank" rel="follow" title="База патентів України">Нуклеозиди з модифікованими цукрами та олігонуклеотиди</a>
Попередній патент: Фільтрувальний матеріал
Наступний патент: Пристрій і спосіб для вимірювання гравітаційних полів
Випадковий патент: Пристрій для вимірювання ниткоподачі на основов'язальній машині