Похідні пірол-2,5-дитіону як модулятори х-рецептора печінки
Номер патенту: 82109
Опубліковано: 11.03.2008
Автори: Вестерлунд Крістер, Гольм Патрік, Сандберґ Пернілла, Врікманн Кай, Бострем Йонас, Свансон Маріанне
Формула / Реферат
1. Сполука формули І
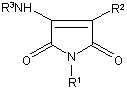 , Формула І
, Формула І
де:
R1 вибирають з групи: феніл(1-4С)алкіл, де феніл, як варіант, заміщено замісником з групи: (1-4С)алкоксикарбоніл або NRaRb, де Ra та Rb незалежно представляють Н або (1-4С)алкіл; гетероарил(1-4С)алкіл, де гетероарил, як варіант, заміщено замісником з групи: (1-4С)алкіл або NRaRb, де Ra та Rb незалежно представляють Н або (1-4С)алкіл; або (1-4С)алкіл, який, як варіант, заміщено одним або більше з групи: флуор, (1-4С)алкоксикарбоніл, (1-3С)алкілтіо або (1-3С)алкоксил, що, як варіант, заміщено одним або більше флуором;
R2 - феніл;
R3 вибирають з групи: феніл, індоліл або бензофураніл, кожний з яких, як варіант, заміщено одним чи більше з групи: (1-3С)алканоїл, (1-3С)алкоксил, що, як варіант, заміщено одним або більше флуором; (1-3С)алкілтіо; або група формули NRaRb, де Ra та Rb незалежно представляють Н, (1-3С)алкіл або (1-3С)алканоїл, або Ra та Rb разом з атомом нітрогену, до котрого вони приєднані, представляють морфоліногрупу;
або її фармацевтично прийнятна сіль чи сольват або сольват такої солі.
2. Сполука за п. 1, де R1 вибирають з групи: 2-метоксіетил, 2-метилтіоетил, 2,2,2-трифлуоретил, 3-метоксипропіл, 3,3,3-трифлуорпропіл, етоксикарбонілметил, 4-N,N-диметиламінобензил, 4-метоксикарбонілбензил, 2-піридилметил, 3-піридилметил, 4-піридилметил, 6-аміно-3-піридилметил, 3-фурилметил або (5-метилізоксазол-3-іл)метил.
3. Сполука за п. 1 або п. 2, де R3 вибирають з групи: феніл, 4-метоксифеніл, 4-метилтіофеніл, 4-морфолінофеніл, 4-ацетиламінофеніл, 4-трифлуорметоксифеніл, 4-дифлуорметоксифеніл або 2-ацетил-5-бензофураніл.
4. Сполука за п. 1, де R1 вибирають з групи: 2-метоксіетил, 2,2,2-трифлуоретил, 3,3,3-трифлуорпропіл, 3-метоксипропіл, етоксикарбонілметил, 2-піридилметил, 3-піридилметил, 4-піридилметил, 6-аміно-3-піридилметил або (5-метилізоксазол-3-іл)метил;
R2-феніл;
R3 вибирають з групи: феніл, 4-метоксифеніл, 4-ацетиламінофеніл, 4-дифлуорметоксифеніл або 4-морфолінофеніл.
5. Сполука за п. 1, де R1 вибирають з групи: 2-метоксіетил, 6-аміно-3-піридилметил, 3-піридилметил або 2,2,2-трифлуоретил;
R2 - феніл; а
R3 вибирають з групи: 4-метоксифеніл, 4-дифлуорметоксифеніл, 4-трифлуорметоксифеніл або 4-морфолінофеніл.
6. Сполука за п. 1, де R1 вибирають з групи: 2,2,2-трифлуоретил, 3-фурилметил, 6-аміно-3-піридилметил або 3-піридилметил;
R2 - феніл; а
R3 вибирають з групи: 4-метоксифеніл, 4-дифлуорметоксифеніл, 4-морфолінофеніл або 2-ацетил-5-бензофураніл.
7. Сполука за п. 1, де R1 вибирають з групи: 6-аміно-3-піридилметил або 2-метоксіетил;
R2 - феніл; а
R3 вибирають з групи: 4-морфолінофеніл, 4-трифлуорметоксифеніл або 4-дифлуорметоксифеніл.
8. Сполука за п. 1, де R1 вибирають з групи: 6-аміно-3-піридилметил, 3-фурилметил, 3-піридилметил, 2,2,2-трифлуоретил або 2-метоксіетил;
R2 - феніл; а
R3 вибирають з групи: 4-морфолінофеніл, 4-метоксифеніл, 4-трифлуорметоксифеніл, 4-дифлуорметоксифеніл або 2-ацетил-5-бензолфураніл.
9. Сполука, вибрана з одної або більше з групи:
1-(2-метоксіетил)-3-[(4-метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон,
3-{[4-(дифлуорметокси)феніл]аміно}-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,5-діон,
N-(4-{[2,5-дигідро-1-(2-метоксіетил)-2,5-діоксо-4-феніл-1Н-пірол-3-іл]аміно}феніл)-ацетамід,
1-(2-метоксіетил)-3-{[4(метилтіо)феніл]аміно}4-феніл-1Н-пірол-2,5-діон,
3-[(2-ацетил-5-бензофураніл)аміно]-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,5-діон,
1-(2-метоксіетил)-3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1Н-пірол-2,5-діон,
3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1-(піридин-3-ілметил]-1Н-пірол-2,5-діон,
3-[(2-ацетил-5-бензофураніл)аміно]-4-феніл-1-(піридин-3-ілметил)-1Н-пірол-2,5-діон,
3-феніл-1-(піридин-3-ілметил)-4-{[4-(трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-3-ілметил)-1Н-пірол-2,5-діон,
3-аніліно-4-феніл-1-(піридин-3-ілметил)-1Н-пірол-2,5-діон,
3-{[4-(дифлуорметокси)феніл]аміно}-4-феніл-1-(піридин-3-ілметил)-1Н-пірол-2,5-діон,
1-[4-(диметиламіно)бензил]-3-[(4-метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-4-ілметил)-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-2-ілметил}-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-1-(3-метоксифеніл)-4-феніл-1Н-пірол-2,5-діон,
метил 4-({3-[(4-метоксифеніл)аміно]-2,5-діоксо-4-феніл-2,5-дигідро-1Н-пірол-1-іл}метил)бензоат,
3-[(4-метоксифеніл)аміно]-1-[2-(метилтіо)етил]-4-феніл-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-4-феніл-1-(3,3,3-трифлуорпропіл)-1Н-пірол-2,5-діон,
1-(3-фурилметил)-3-[(4-метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-4-феніл-1-(2,2,2-трифлуоретил)-1Н-пірол-2,5-діон,
3-[(4-метоксифеніл)аміно]-1-[(5-метилізоксазол-3-іл)метил]-4-феніл-1Н-пірол-2,5-діон,
етил {3-[(4-метоксифеніл)аміно]-2,5-діоксо-4-феніл-2,5-дигідро-1Н-пірол-1-іл}ацетат,
3-феніл-1-(2,2,2-трифлуоретил)-4-{[4-(трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон,
1-[(6-амінопіридин-3-іл)метил]-3-[(4-метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон,
1-[(6-амінопіридин-3-іл)метил]-3-{[4-(дифлуорметокси)феніл]аміно}-4-феніл-1Н-пірол-2,5-діон та
1-[(6-амінопіридин-3-іл)метил]-3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1-Н-пірол-2,5-діон,
та її фармацевтично прийнятна сіль чи сольват або сольват такої солі.
10. Спосіб отримання сполуки за будь-яким з пп. 1-9, деR1, R2 та R3 визначено у п. 1, в якому піддають реакції сполуку формули II
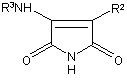 ,(ІІ)
,(ІІ)
де R2 та R3 визначено у п. 1, зі сполукою формули III
R1OH, III
де R1 визначено у п. 1,
у присутності діалкілазодикарбоксилату, наприклад, діетилазодикарбоксилату, та фосфіну, наприклад, трифенілфосфіну, як варіант, у присутності інертної органічної рідини, наприклад, етеру, як-то тетрагідрофуран, при температурі у межах 0°С-200°С.
11. Спосіб отримання сполуки за будь-яким з пп. 1-9, де R1, R2 та R3 визначено у п. 1, в якому піддають реакції сполуку формули IV
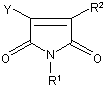 , (ІV)
, (ІV)
де R1 та R2 визначено у п. 1, зі сполукою формули V
R3NH2 , (V)
де R3 визначено у п. 1, як варіант, у присутності інертної органічної рідини, наприклад, диметилформаміду, та, як варіант, у присутності основи, наприклад, карбонату калію, при температурі у межах 0°С-250°С.
12. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-9 у суміші з фармацевтично прийнятними ад'ювантами, розріджувачами та/або носіями.
13. Застосування сполуки за будь-яким з пп. 1-9 у терапії.
14. Застосування сполуки за будь-яким з пп. 1-9 для виробництва медикаменту для модулювання рецепторів ядерних гормонів ХРП ![]() та/або
та/або ![]() .
.
15. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики серцево-судинних хвороб.
16. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики атеросклерозу.
17. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики гіперхолестеринемії.
18. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики станів, асоційованих з необхідністю поліпшення зворотного транспорту холестерину.
19. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики станів, асоційованих з необхідністю зменшення кишкового поглинання холестерину.
20. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики станів, асоційованих з необхідністю збільшення рівнів ЛВГ-холестерину.
21. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики станів, асоційованих з необхідністю зменшення рівнів ЛНГ-холестерину.
22. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики запальних станів.
23. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики хвороби Альцгеймера.
24. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики артеріосклерозу.
25. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики діабету типу 2.
26. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики станів, асоційованих з необхідністю поліпшення функції ЛВГ.
27. Застосування сполуки за будь-яким з пп. 1-9 у виробництві медикаменту для лікування та/або профілактики ліпідних розладів (дисліпідемії), асоційованих чи не асоційованих з резистентністю до інсуліну.
28. Спосіб попередження та/або лікування ліпідних розладів (дисліпідемії), асоційованих чи не асоційованих з резистентністю до інсуліну, який полягає у застосуванні сполуки за будь-яким з пп. 1-9 до ссавця, що потребує такого лікування.
29. Спосіб лікування та/або профілактики серцево-судинних хвороб, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
30. Спосіб попередження та/або лікування атеросклерозу, що полягає у застосуванні ефективної кількості сполуки формули І за будь-яким з пп. 1-9 до ссавця, що потребує такого лікування.
31. Спосіб лікування та/або профілактики гіперхолестеринемії, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
32. Спосіб лікування та/або профілактики станів, асоційованих з необхідністю поліпшення зворотного транспорту холестерину, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
33. Спосіб лікування та/або профілактики станів, асоційованих з необхідністю зменшення кишкового поглинання холестерину, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
34. Спосіб лікування та/або профілактики станів, асоційованих з необхідністю збільшення рівнів ЛВГ-холестерину, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
35. Спосіб лікування та/або профілактики станів, асоційованих з необхідністю зменшення рівнів ЛНГ-холестерину, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
36. Спосіб лікування та/або профілактики запальних станів, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
37. Спосіб лікування та/або профілактики хвороби Альцгеймера, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9,
38. Спосіб лікування та/або профілактики артеріосклерозу, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
39. Спосіб лікування та/або профілактики діабету типу 2, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
40. Спосіб лікування та/або профілактики станів, асоційованих з необхідністю поліпшення функції ЛВГ, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого лікування, ефективної кількості сполуки, визначеної у будь-якому з пп. 1-9.
41. Фармацевтична композиція для застосування у лікуванні або профілактиці станів, асоційованих з необхідністю модулювання рецепторів ядерних гормонів ХРП ![]() та/або
та/або ![]() , що містить сполуку за будь-яким з пп. 1-9 як активний інгредієнт у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
, що містить сполуку за будь-яким з пп. 1-9 як активний інгредієнт у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
42. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-9, поєднану з ще одним терапевтичним засобом, що є корисною у лікуванні станів або розладів, асоційованих з розвитком та прогресуванням атеросклерозу, як-то гіпертензія, дисліпідемії, гіперліпідемії, гіперхолестеринемії, діабет типу 2, запалення, ожиріння, а також станів, асоційованих з необхідністю поліпшення зворотного транспорту холестерину та/або зменшення кишкового поглинання холестерину.
Текст
1. Сполука формули І R3NH R2 2 (19) 1 3 82109 4 етил {3-[(4-метоксифеніл)аміно]-2,5-діоксо-4аміно-3-піридилметил або 3-піридилметил; феніл-2,5-дигідро-1Н-пірол-1-іл}ацетат, R2 - феніл; а 3-феніл-1-(2,2,2-трифлуоретил)-4-{[4R3 вибирають з групи: 4-метоксифеніл, 4(трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон, дифлуорметоксифеніл, 4-морфолінофеніл або 21-[(6-амінопіридин-3-іл)метил]-3-[(4ацетил-5-бензофураніл. метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон, 7. Сполука за п. 1, де R1 вибирають з 1-[(6-амінопіридин-3-іл)метил]-3-{[4групи: 6-аміно-3-піридилметил або 2-метоксіетил; (дифлуорметокси)феніл]аміно}-4-феніл-1Н-піролR2 - феніл; а 2,5-діон та R3 вибирають з групи: 4-морфолінофеніл, 1-[(6-амінопіридин-3-іл)метил]-3-[(4-морфолін-44-трифлуорметоксифеніл або 4ілфеніл)аміно]-4-феніл-1-Н-пірол-2,5-діон, дифлуорметоксифеніл. та її фармацевтично прийнятна сіль чи сольват 8. Сполука за п. 1, де R1 вибирають з або сольват такої солі. групи: 6-аміно-3-піридилметил, 3-фурилметил, 310. Спосіб отримання сполуки за будьпіридилметил, 2,2,2-трифлуоретил або 2яким з пп. 1-9, де R1, R2 та R3 визначено у п. 1, в метоксіетил; якому піддають реакції сполуку формули II R2 - феніл; а R3 вибирають з групи: 4-морфолінофеніл, R3NH R2 4-метоксифеніл, 4-трифлуорметоксифеніл, 4дифлуорметоксифеніл або 2-ацетил-5бензолфураніл. N O O 9. Сполука, вибрана з одної або більше з H ,(ІІ) групи: де R2 та R3 визначено у п. 1, зі сполукою 1-(2-метоксіетил)-3-[(4-метоксифеніл)аміно]-4феніл-1Н-пірол-2,5-діон, формули III 3-{[4-(дифлуорметокси)феніл]аміно}-1-(2R1OH, III метоксіетил)-4-феніл-1Н-пірол-2,5-діон, де R1 визначено у п. 1, N-(4-{[2,5-дигідро-1-(2-метоксіетил)-2,5-діоксо-4у присутності діалкілазодикарбоксилату, наприклад, діетилазодикарбоксилату, та фосфіну, феніл-1Н-пірол-3-іл]аміно}феніл)-ацетамід, 1-(2-метоксіетил)-3-{[4(метилтіо)феніл]аміно}4наприклад, трифенілфосфіну, як варіант, у присутності інертної органічної рідини, наприклад, феніл-1Н-пірол-2,5-діон, 3-[(2-ацетил-5-бензофураніл)аміно]-1-(2етеру, як-то тетрагідрофуран, при температурі у межах 0°С-200°С. метоксіетил)-4-феніл-1Н-пірол-2,5-діон, 1-(2-метоксіетил)-3-[(4-морфолін-4-ілфеніл)аміно]11. Спосіб отримання сполуки за будь4-феніл-1Н-пірол-2,5-діон, яким з пп. 1-9, де R1, R2 та R3 визначено у п. 1, в 3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1якому піддають реакції сполуку формули IV (піридин-3-ілметил]-1Н-пірол-2,5-діон, R2 Y 3-[(2-ацетил-5-бензофураніл)аміно]-4-феніл-1(піридин-3-ілметил)-1Н-пірол-2,5-діон, 3-феніл-1-(піридин-3-ілметил)-4-{[4N O O (трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон, 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-31 R , (ІV) ілметил)-1Н-пірол-2,5-діон, де R1 та R2 визначено у п. 1, зі сполукою 3-аніліно-4-феніл-1-(піридин-3-ілметил)-1Н-піролформули V 2,5-діон, R3NH2 , (V) 3-{[4-(дифлуорметокси)феніл]аміно}-4-феніл-1де R3 визначено у п. 1, як варіант, у (піридин-3-ілметил)-1Н-пірол-2,5-діон, присутності інертної органічної рідини, наприклад, 1-[4-(диметиламіно)бензил]-3-[(4диметилформаміду, та, як варіант, у присутності метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон, основи, наприклад, карбонату калію, при 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-4температурі у межах 0°С-250°С. ілметил)-1Н-пірол-2,5-діон, 12. Фармацевтична композиція, що 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин-2містить сполуку за будь-яким з пп. 1-9 у суміші з ілметил}-1Н-пірол-2,5-діон, фармацевтично прийнятними ад'ювантами, 3-[(4-метоксифеніл)аміно]-1-(3-метоксифеніл)-4розріджувачами та/або носіями. феніл-1Н-пірол-2,5-діон, 13. Застосування сполуки за будь-яким з метил 4-({3-[(4-метоксифеніл)аміно]-2,5-діоксо-4пп. 1-9 у терапії. феніл-2,5-дигідро-1Н-пірол-1-іл}метил)бензоат, 14. Застосування сполуки за будь-яким з 3-[(4-метоксифеніл)аміно]-1-[2-(метилтіо)етил]-4пп. 1-9 для виробництва медикаменту для феніл-1Н-пірол-2,5-діон, модулювання рецепторів ядерних гормонів ХРП a 3-[(4-метоксифеніл)аміно]-4-феніл-1-(3,3,3та/або b . трифлуорпропіл)-1Н-пірол-2,5-діон, 1-(3-фурилметил)-3-[(4-метоксифеніл)аміно]-415. Застосування сполуки за будь-яким з феніл-1Н-пірол-2,5-діон, пп. 1-9 у виробництві медикаменту для лікування 3-[(4-метоксифеніл)аміно]-4-феніл-1-(2,2,2та/або профілактики серцево-судинних хвороб. трифлуоретил)-1Н-пірол-2,5-діон, 16. Застосування сполуки за будь-яким з 3-[(4-метоксифеніл)аміно]-1-[(5-метилізоксазол-3пп. 1-9 у виробництві медикаменту для лікування іл)метил]-4-феніл-1Н-пірол-2,5-діон, та/або профілактики атеросклерозу. 5 82109 6 потребує такого лікування, ефективної кількості 17. Застосування сполуки за будь-яким з сполуки, визначеної у будь-якому з пп. 1-9. пп. 1-9 у виробництві медикаменту для лікування 33. Спосіб лікування та/або профілактики станів, та/або профілактики гіперхолестеринемії. асоційованих з необхідністю зменшення кишкового 18. Застосування сполуки за будь-яким з поглинання холестерину, що полягає у пп. 1-9 у виробництві медикаменту для лікування застосуванні до ссавця, охоплюючи людину, що та/або профілактики станів, асоційованих з потребує такого лікування, ефективної кількості необхідністю поліпшення зворотного транспорту сполуки, визначеної у будь-якому з пп. 1-9. холестерину. 34. Спосіб лікування та/або профілактики станів, 19. Застосування сполуки за будь-яким з асоційованих з необхідністю збільшення рівнів пп. 1-9 у виробництві медикаменту для лікування ЛВГ-холестерину, що полягає у застосуванні до та/або профілактики станів, асоційованих з ссавця, охоплюючи людину, що потребує такого необхідністю зменшення кишкового поглинання лікування, ефективної кількості сполуки, холестерину. визначеної у будь-якому з пп. 1-9. 20. Застосування сполуки за будь-яким з 35. Спосіб лікування та/або профілактики станів, пп. 1-9 у виробництві медикаменту для лікування асоційованих з необхідністю зменшення рівнів та/або профілактики станів, асоційованих з ЛНГ-холестерину, що полягає у застосуванні до необхідністю збільшення рівнів ЛВГ-холестерину. ссавця, охоплюючи людину, що потребує такого 21. Застосування сполуки за будь-яким з лікування, ефективної кількості сполуки, пп. 1-9 у виробництві медикаменту для лікування визначеної у будь-якому з пп. 1-9. та/або профілактики станів, асоційованих з 36. Спосіб лікування та/або профілактики необхідністю зменшення рівнів ЛНГ-холестерину. запальних станів, що полягає у застосуванні до 22. Застосування сполуки за будь-яким з ссавця, охоплюючи людину, що потребує такого пп. 1-9 у виробництві медикаменту для лікування лікування, ефективної кількості сполуки, та/або профілактики запальних станів. визначеної у будь-якому з пп. 1-9. 23. Застосування сполуки за будь-яким з 37. Спосіб лікування та/або профілактики хвороби пп. 1-9 у виробництві медикаменту для лікування Альцгеймера, що полягає у застосуванні до та/або профілактики хвороби Альцгеймера. ссавця, охоплюючи людину, що потребує такого 24. Застосування сполуки за будь-яким з лікування, ефективної кількості сполуки, пп. 1-9 у виробництві медикаменту для лікування визначеної у будь-якому з пп. 1-9, та/або профілактики артеріосклерозу. 38. Спосіб лікування та/або профілактики 25. Застосування сполуки за будь-яким з артеріосклерозу, що полягає у застосуванні до пп. 1-9 у виробництві медикаменту для лікування ссавця, охоплюючи людину, що потребує такого та/або профілактики діабету типу 2. лікування, ефективної кількості сполуки, 26. Застосування сполуки за будь-яким з визначеної у будь-якому з пп. 1-9. пп. 1-9 у виробництві медикаменту для лікування 39. Спосіб лікування та/або профілактики діабету та/або профілактики станів, асоційованих з типу 2, що полягає у застосуванні до ссавця, необхідністю поліпшення функції ЛВГ. охоплюючи людину, що потребує такого лікування, 27. Застосування сполуки за будь-яким з ефективної кількості сполуки, визначеної у будьпп. 1-9 у виробництві медикаменту для лікування якому з пп. 1-9. та/або профілактики ліпідних розладів 40. Спосіб лікування та/або профілактики станів, (дисліпідемії), асоційованих чи не асоційованих з асоційованих з необхідністю поліпшення функції резистентністю до інсуліну. ЛВГ, що полягає у застосуванні до ссавця, 28. Спосіб попередження та/або лікування охоплюючи людину, що потребує такого лікування, ліпідних розладів (дисліпідемії), асоційованих чи ефективної кількості сполуки, визначеної у будьне асоційованих з резистентністю до інсуліну, який якому з пп. 1-9. полягає у застосуванні сполуки за будь-яким з пп. 41. Фармацевтична композиція для застосування у 1-9 до ссавця, що потребує такого лікування. лікуванні або профілактиці станів, асоційованих з 29. Спосіб лікування та/або профілактики серцевонеобхідністю модулювання рецепторів ядерних судинних хвороб, що полягає у застосуванні до ссавця, охоплюючи людину, що потребує такого гормонів ХРП a та/або b , що містить сполуку за лікування, ефективної кількості сполуки, будь-яким з пп. 1-9 як активний інгредієнт у суміші визначеної у будь-якому з пп. 1-9. з фармацевтично прийнятним ад'ювантом, 30. Спосіб попередження та/або лікування розріджувачем або носієм. атеросклерозу, що полягає у застосуванні 42. Фармацевтична композиція, що містить ефективної кількості сполуки формули І за будьсполуку за будь-яким з пп. 1-9, поєднану з ще яким з пп. 1-9 до ссавця, що потребує такого одним терапевтичним засобом, що є корисною у лікування. лікуванні станів або розладів, асоційованих з 31. Спосіб лікування та/або профілактики розвитком та прогресуванням атеросклерозу, як-то гіперхолестеринемії, що полягає у застосуванні до гіпертензія, дисліпідемії, гіперліпідемії, ссавця, охоплюючи людину, що потребує такого гіперхолестеринемії, діабет типу 2, запалення, лікування, ефективної кількості сполуки, ожиріння, а також станів, асоційованих з визначеної у будь-якому з пп. 1-9. необхідністю поліпшення зворотного транспорту 32. Спосіб лікування та/або профілактики станів, холестерину та/або зменшення кишкового асоційованих з необхідністю поліпшення поглинання холестерину. зворотного транспорту холестерину, що полягає у застосуванні до ссавця, охоплюючи людину, що Заявлений винахід стосується деяких нових заміщених нових похідних 1-(заміщених алкіл}-3аміно-4-феніл-1Н-пірол-2,5-діону, способів отримання таких сполук, їх застосування у модулюванні рецепторів ядерних гормонів Хрецептору печінки (ХРП) a (NR1H3) та/або b (NR1H2), та у лікуванні клінічних станів, охоплюючи серцево-судинні хвороби, як-то атеросклероз; запальні хвороби, хворобу Альцгеймера, ліпідні розлади (дисліпідемії) асоційовані чи не асоційовані з резистентністю до інсуліну, діабет типу 2 та інші вияви метаболічного синдрому, способів їх терапевтичного застосування та фармацевтичних композицій, що їх містять. Анормальності гомеостазу холестерину та жирних кислот, що відображують як різноманітні дисліпідемії, є причиною атеросклерозу, а в результаті - серцево-судинних хвороб (ССХ). Ці хвороби є одною з головних проблем здоров'я в індустріальних країнах та поширені серед дорослих у націй, що розвиваються. Більшість досліджень показали, що статини зменшують холестерин ліпопротеїнів низької густини (ЛНГ) на 25-30% та відносний ризик коронарних випадків приблизно на 30%. Незважаючи на те, що цей цілющій ефект є значним, ефективно 70% лікованої групи залишається з незміненим ризиком. Це стимулювало інтенсивні дослідження для ідентифікації інших загальних анормальностей ліпідного метаболізму, що якщо його ефективно лікувати, могло б поліпшувати результати сучасної ССХ-терапії. Рецептори ядерних гормонів ХРП a та b використовують оксистероли як природні ліганди. Вони діють як сенсори холестерину з цільовими генами, що є потрібними для витоку холестерину з макрофагів, типу касетного транспортеру зв'язування АТР АІ (АВСА1) та ароЕ, а також продуктів гена, типу білку трансферази холестеринового естеру (БТХЕ) та білку транспорту фосфоліпіду (БТФЛ), що є потрібними для функції ліпопротеїну високої густини (ЛВГ) у зворотному транспорті холестерину. На додаток, ХРП регулює з підвищенням ліпазу ліпопротеїну у печінці та макрофагах, функцію, що може стимулювати поглинання жирних кислот та корекцію ліпопротеїну дуже низької густини (ЛДНГ)· У печінці ХРП ліганди стосуються стимулювання гепатобіліарної секреції холестерину, шляху обміну, регульованого ABCG5 та ABCG8. Такі ж транспортери холестерину виявляють зменшення поглинання холестерину в ентероцитах, впливаючи тому на загальний баланс холестерину в організмі. Ці ефекти стимулювання ХРП могли б пояснити його помітні анти-атеросклеротичні властивості, що спостерігали у кількох тваринних моделях. Нещодавно було розкрито, що синтетичні ліганди ХРП GW3965 (Glaxo) та Т-G901317 (Tularik) підвищують толерантність до глюкози у гладких мишей, яких харчували жиром, що інтерпретували як результат зменшеного печінкового глюконеогенезу та збільшеного поглинання глюкози у адипоцитах Lafitte ΒΑ et al. [Proc Nat I Acad Sci USA. 2003 Apr 29; 100(9):541924]. Активація ХРП поліпшує толерантність до глюкози узгодженою регуляцією метаболізму глюкози у печінці та жировій тканині. [WO 00/21927] розкриває пірол-2,5-діони, котрі є інгібіторами GSK-3 та заявлені як корисні у лікуванні деменцій, як-то хвороба Альцгеймера, маніакальна депресія та діабет. Нема вказівок, що ці сполуки мають активність як модулятори ХРП. Термін "модулятор ХРП", застосований тут, означає невелику молекулу, що модулює біологічну активність ХРП a та/або ХРП b. Конкретніше, такий модулятор ХРП посилює або інгібує біологічну активність ХРП. Якщо такий модулятор частково або повністю посилює біологічну активність ХРП, він є частковим або повним агоністом ХРП, відповідно. Об'єктом винаходу є модулятори ХРП. Ще одним об'єктом цього винаходу є сполуки модуляторів ХРП, що є агоністами ХРП. Згідно з першим аспектом заявленого винаходу запропоновано сполуку формули І де: R1 вибирають з групи: феніл(1-4С)алкіл, де феніл, як варіант, заміщено замісником з групи: (14С)алкоксикарбоніл або NRaRb, де Ra та Rb незалежно представляють Η або (1-4С)алкіл; гетероарил(1-4С)алкіл, де гетероарил, як варіант, заміщено замісником з групи: (1-4С)алкіл або NRaRb, де Ra та Rb незалежно представляють Η або (1-4С)алкіл; або (1-4С)алкіл, який, як варіант, заміщено одним або більше з наступного: флуор, (1-4С)алкоксикарбоніл, (1-3С)алкілтіо або (13С)алкокси, що, як варіант, заміщені одним або більше флуором; R2 - феніл; R3 вибирають з групи: феніл, індоліл або бензофураніл, кожний з яких, як варіант, заміщено одним чи більше з наступного: (1-3С)алканоїл, (13С)алкокси, що, як варіант, заміщено одним або більше флуором; (1-3С)алкілтіо; або група формули NRaRb, де Ra та Rb незалежно представляють Н, (1-3С)алкіл або (1-3С)алканоїл, або Ra та Rb разом з атомом нітрогену, до котрого вони приєднані, представляють морфоліно; або її фармацевтично прийнятна сіль чи сольват або сольват такої солі Термін гетероарил означає піридил, фурил або ізоксазоліл, кожний з яких, як варіант, заміщено одним або більше з наступного: (14С)алкіл або NRaRb, де Ra та Rb незалежно представляють Η або (1-4С)алкіл. 9 82109 10 Наступні значення R1, R2 та R3 у сполуках 1-(2-метоксіетил)-3-[(4-метоксифеніл)аміно]-4формули І представлено далі. Зрозуміло, що таку феніл-1Н-пірол-2,5-діон значення можуть бути застосованими у згоді з 3-{[4-(Дифлуорметокси)феніл]аміно}-1-(2будь-чим з визначень, пунктів формули винаходу метоксіетил)-4-феніл-1Н-пірол-2,5-діон або втілень, визначених тут раніше або далі. N-(4-{[2,5-Дигідро-1-(2-метокаетил)-2,5-діоксоR1 вибирають з групи: 2-метоксіетил, 24-феніл-1Н-пірол-3-іл]аміно}феніл)-ацетамід метилтіоетил, 2,2,2-трифлуоретил, 31-(2-метоксіетил)-3-{[4(метилтіо)феніл]аміно}метоксипропіл, 3,3,3-трифлуорпропіл, 4-феніл-1Н-пірол-2,5-діон етоксикарбонілметил, 4-N,N-диметиламінобензил, 3-[(2-Ацетил-5-бензофураніл)аміно]-1-(24-метоксикарбонілбензил, 2-піридилметил, 3метоксіетил)-4-феніл-1Н-пірол-2,5-діон піридилметил, 4-піридилметил, 6-аміно-31-(2-метоксіетил)-3-[(4-морфолін-4піридилметил, 3-фурилметил або (5ілфеніл)аміно]-4-феніл-1Н-пірол-2,5-діон метилізоксазол-3іл)метил. 3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1R3 вибирають з групи: феніл, 4-метоксифеніл, (піридин-3-ілметил]-1Н-пірол-2,5-діон 4-метилтіофеніл, 4-морфолінофеніл, 43-[(2-Ацетил-5-бензофураніл)аміно]-4-феніл-1ацетиламінофеніл, 4-трифлуорметоксифеніп, 4(піридин-3-ілметил]-1Н-пірол-2,5-діон дифлуорметоксифеніл, 2-ацетил-5-бензофураніл. 3-Феніл-1-(піридин-3-ілметил)-4-{[4У першій групі сполук формули І (трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон R1 вибирають з групи: 2-метоксіетил, 2,2,23-[(4-метоксифеніл)аміно]-4-феніл-1-(піридинтрифлуоретил, 3,3,3-трифлуорпропіл, 33-ілметил]-1Н-пірол-2,5-діон метоксипропіл, етоксикарбонілметил, 23-аніліно-4-феніл-1-(піридин-3-ілметил)-1Нпіридилметил, 3-піридилметил, 4-піридилметил, 6пірол-2,5-діон аміно-3-піридилметил або (5-метилізоксазол3-{[4-Дифлуорметоксі)феніл]аміно}-4-феніл-13іл)метил; (піридин-3-ілметил]-1Н-пірол-2,5-діон R2 - феніл; 1-[4-(Диметиламіно)бензил]-3-[(4R3 вибирають з групи: феніл, 4-метоксифеніл, метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон 4-ацетиламінофеніл, 4-дифлуорметоксифеніл або 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин4-морфолінофеніл. 4-ілметил)-1Н-пірол-2,5-діон У другій групі сполук формули І 3-[(Фметоксифеніл)аміно]-4-феніл-1-(піридинR1 вибирають з групи: 2-метоксіетил, 6-аміно2-ілметил}-1Н-пірол-2,5-діон З-піридилметил, 3-піридилметил або 2,2,23-[(4-метоксифеніл)аміно]-1-(3-метоксифеніл)трифлуоретил; 4-феніл-1Н-пірол-2,5-діон R2 - феніл; а Метил 4-({3-[(4-метоксифеніл)аміно]-2,5R3 вибирають з групи: 4-метоксифеніл, 4діоксо-4-феніл-2,5-дигідро-1Н-пірол-1дифлуорметоксифеніл, 4-трифлуорметоксифеніл іл}метил)бензоат або 4-морфолінофеніл. 3-[(4-метоксифеніл)аміно]-1-{2-(метилтіо}етил]У третій групі сполук формули І 4-феніл-1Н-пірол-2,5-діон R1 вибирають з групи: 2,2,2-трифлуоретил, 33-[(4-метоксифеніл)аміно]-4-феніл-1-(3,3,3фурилметил, 6-аміно-3-піридилметил або 3трифлуорпропіл)-1Н-пірол-2,5-діон піридилметил; 1-{3-фурилі\летил)-3-[(4-метоксифеніл)аміно]4 R2 - феніл; а 4-феніл-1Н-пірол-2,5-діон R3 вибирають з групи: 4-метоксифеніл, 43-[(4-метоксифеніл)аміно]-4-феніл-1-{2,2,2дифлуорметоксифеніл, 4-морфолінофеніл або 2трифлуоретил)-1Н-пірол-2,5-діон ацетил-5-бензофураніл. 3-[(4-метоксифеніл)аміно]-1-[(5-метилУ четвертій групі сполук формули І ізоксазол-3-іл)метил]-4-феніл-1Н-пірол-2,5-діон R1 вибирають з групи: 6-аміно-3-піридилметил Етил {3-[(4-метоксифеніл)аміно]-2,5-діоксо-4або 2-метоксіетил; феніл-2,5-дигідро-1Н-пірол-1-іл}ацетат R2 - феніл: а 3-Феніл-1-(2,2,2-трифлуоретил)-4-{[4R3 вибирають з групи: 4-морфолінофеніл, 4(трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон трифлуорметоксифеніл або 41-[(6-Амінопіридин-3-іл)метил]-3-[(4дифлуорметоксифеніл метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон У п'ятій групі сполук формули І 1-[(6-Амінопіридин-3-іл)метил]-3-{[4R1 вибирають з групи: 6-аміно-3-піридилметил, (дифлуорметокси)феніл]аміно}-4-феніл-1Н-пірол3-фурилметил, 3-піридилметил, 2,2,22,5-діон татрифлуоретил або 2-метоксіетил. 1-[(6-Амінопіридин-3-іл)метил]-3-[(4-морфолінR2 - феніл: а 4-ілфеніл)аміно]-4-феніл-1-Н-пірол-2,5-діон, R3 вибирають з групи: 4-морфолінофеніл, 4або її фармацевтично прийнятна сіль чи метоксифеніл, 4-трифлуорметоксифеніл, 4сольват або сольват такої солі. дифлуорметоксифеніл або 2-ацетил-5Деякі сполуки заявленого винаходу можуть бензофураніл. існувати як таутомери. Зрозуміло, що заявлений Сполуки формули І мають активність як винахід охоплює усі так таутомери. медикаменти. Зокрема, сполуки формули І є Способи отримання агоністами ХРП. Сполуки винаходу можна отримувати як Конкретні сполуки винаходу є одною або описано нижче. Однак, винахід не обмежено цими більше з наступних: способами. Сполуки можна також отримувати як описано для структурно споріднених сполук у 11 82109 попередньому рівні техніки. Реакції можна проводити звичайними способами, або як описано в експериментальному розділі. Сполуки формули І можна отримувати реакцією сполук формули II 12 де R2 визначено вище, a Y - відщеплювана група, наприклад, галоген, наприклад, СІ, Br або І, зі сполукою формули VIII R1NH2 де R2 та R3 визначені, зі сполукою формули III R1OH III де R1 визначено вище, у присутності діалкіл азодикарбоксилату, наприклад, діетил азодикарбоксилату, та фосфіну, наприклад, трифенілфосфіну, як варіант, у присутності інертної органічної рідини, наприклад, етеру, наприклад, тетрагідрофурану при температурі у межах 0°С-200°С. Сполуки формули І можна також отримувати реакцією сполуки формули IV VIII де R1 визначено вище, як варіант, у присутності органічної рідини, наприклад, льодяної оцтової кислоти при температурі у межах 0°С200°С. Сполуки формули IV можна також отримувати реакцією сполуки формули VI зі сполукою формули XI R1L XI де R1 визначено вище, a L - відщеплювана група, наприклад, галоген, наприклад, бром, у присутності інертної органічної рідини, наприклад, диметилформаміду, та, як варіант, у присутності основи, наприклад, калій карбонату при температурі у межах - 78°С-200°С. Сполуки формули VI можна отримувати реакцією сполуки формули IX де R1 та R2 визначені вище, a Y відщеплювана група, наприклад, галоген, наприклад, СІ, Br або І, зі сполукою формули V R3NH2 V де R3 визначено вище, як варіант, у присутності інертної органічної рідини, наприклад, диметилформаміду, та, як варіант, у присутності основи, наприклад, калій карбонат при температурі у межах 0°С-250°С. Сполуки формули II можна отримувати реакцією сполуки формули VI де R2 визначено вище, a Y - відщеплювана група, наприклад, галоген, наприклад, СІ, Br або І, зі сполукою формули V де R3 визначено вище, як варіант, у присутності інертної органічної рідини, наприклад, диметилформаміду, та, як варіант, у присутності основи, наприклад, триети-ламіну, при температурі у межах 0°С-250°С. Сполуки формули III та V є комерційно доступними або їх можна отримувати способами, відомими фахівцям. Сполуки формули IV можна отримувати реакцією сполуки формули VII де R2 визначено вище, із засобом галогенування, наприклад, оксалілхлоридом, як варіант, у присутності інертної органічної рідини, наприклад, дихлорметану, та, як варіант, у присутності каталітичної кількості диметилформаміду при температурі у межах 0°C200°C. Сполуки формули VII можна отримувати реакцією сполуки формули X де R2 визначено вище, із засобом галогенування, наприклад, тіоніл хлоридом, як варіант, у присутності інертної органічної рідини, наприклад, дихлорметану, та, як варіант, у присутності основи, наприклад, піридину при температурі у межах 0°С-200°С. Сполуки формул VIII, IX, X та XI є комерційно доступними або їх можна отримувати способами, відомими фахівцям. Деякі сполуки формули II та IV є корисними інтермедіатами при отриманні сполук формули І та, можна вважати, є новими, та заявлені тут як корисні інтермедіати при отриманні сполук формули І. 13 82109 14 без обмеження, стани, асоційовані з Сполуки винаходу можна виділити з їх атеросклерозом, артеріосклерозом, реакційної суміші застосуванням звичайних гіперхолестеринемією, та іншими видами способів. дисліпідемій, що збільшують ризик серцевоФахівці зрозуміють, що для отримання сполуки судинних хвороб. Зокрема, сполуки формули 1 є винаходу в альтернативних та деяких випадках корисними у попередженні чи лікуванні серцевобільш зручним способом індивідуальні етапи судинних хвороб, головним чином охоплюючи способу, згадані тут раніше, можна проводити у атеросклероз та гіперхолестеринемію. відмінному порядку, та/або індивідуальні реакції Сполуки формули І також попереджують можна проводити на відмінних етапах загального накопичення ліпідів у тканинних відкладеннях або шляху (тобто хімічні перетворення можна видаляють ліпіди з них, атеросклеротичні бляшки проводити на інтермедіатах, відмінних від тих, що або ксантоми у пацієнта з атеросклеротичною асоційованих тут раніше з окремими реакціями). хворобою виявляються за клінічними ознаками, якВираз "інертна органічна рідина" стосується то стенокардія, кульгавість, шум, пацієнта, що рідини, що не реагує з вихідними матеріалами, потерпів від інфаркту міокарду або тимчасового реагентами, інтермедіатами або продуктами таким ішемічного нападу, або пацієнта, якому діагноз чином, що шкідливо впливає на вихід потрібного поставлено ангіографією, сонографією або BMP продукту. (відображення магнітного резонансу). Фармацевтичні препарати Сполуки формули І також попереджують або Сполуки винаходу звичайно застосовують зменшують ризик розвитку атеросклерозу, а також пероральним, парентеральним, затримують або уповільнюють прогресування внутрішньовенним, внутрішньом'язовим, атеросклеротичної хвороби у клінічному випадку, підшкірним або іншими придатними для ін'єкцій що полягає у застосуванні профілактично або шляхами, букальним, ректальним, вагінальним, терапевтично ефективної відповідної кількості трансдермальним та/або назальним шляхом сполуки формули І до ссавця, охоплюючи людину, та/або інгаляцією, у формі фармацевтичних яка має ризик розвитку атеросклерозу або вже має препаратів, що містять активний інгредієнт як атеросклеротичну хворобу. вільну кислоту, або фармацевтично прийнятну Атеросклероз охоплює судинні хвороби та органічну або неорганічну основно-адитивну сіль у стани, що розпізнає та витлумачує лікар. фармацевтично прийнятній дозованій формі. Атеросклеротичні серцево-судинні хвороби, Залежно від розладу та пацієнта, якого лікують, та охоплюючи рестеноз після реваскуляризації, шляху застосування, композиції можна коронарну хворобу серця (також відому як хвороба застосовувати у змінних дозах. коронарних артерій або ішемічна хвороба серця), Придатні добові дози сполук винаходу у цереброваскулярну хворобу, охоплюючи мультітерапевтичному лікуванні людей складають інфарктну деменцію, та хворобу периферійних приблизно 0,0001-100мг/кг маси тіла, переважно судин, охоплюючи еректильну дисфункцію є усі 0,001-10мг/кг маси тіла. клінічними виявами атеросклерозу, а тому Пероральні композиції є переважними, охоплені термінами "атеросклероз" та особливо таблетки або капсули, котрі можна "атеросклеротична хвороба". формувати способами, відомими фахівцям для Заявлені сполуки формули І є також забезпечення дози активної сполуки у межах корисними для профілактики та/або лікування 0,7мг-700мг, наприклад, 1мг, 3мг, 5мг, 10мг, 25мг, клінічних станів, асоційованих з атеросклерозом, 50мг, 100мг та 250мг. як-то уроджена або індукована Згідно з подальшим аспектом винаходу гіперхолестеринемія а також уроджена або запропоновано відтак фармацевтичну композицію, індукована зменшена чутливість до інсуліну що містить будь-яку сполуку винаходу, або її (синдром резистентності до інсуліну, також фармацевтично прийнятними носіями, відомий як метаболічний синдром) та асоційовані розріджувачами та/або ад'ювантами. метаболічні розлади. Ці клінічні стани охоплюють, Фармакологічні властивості але без обмеження, загальне ожиріння, Сполуки формули І є корисними для абдомінальне ожиріння, артеріальну гіпертензію, нормалізації гомеостазу холестерину, зменшення гіперінсулінемію, гіперглікемію, діабет типу 2 та кишкового поглинання холестерину, поліпшення дисліпідемію, що характеристично виявляється з зворотного транспорту холестерину, поліпшення резистентністю до інсуліну. Ця дисліпідемія, також ЛВГ функціональності, збільшення рівнів ЛВГвідома як атерогенний ліпопротеїновий профіль, холестерину, зменшення рівнів ЛНГ-холестерину, характеризується помірно підвищеними зменшення вмісту холестерину ароВ-вмісних неестерифікованими жирними кислотами, ліпопротеїнів, стимулюючи витік холестерину з підвищеними рівнями частинок ліпопротеїну дуже клітин судин та/або зменшення запальної реакції низької густини (ЛДНГ), збагаченими sклітин судин. Як результат цих властивостей тригліцеридами, високими рівнями Аро В, сполуки формули 1, як можна очікувати, мають низькими рівнями ліпопротеїну високої густини анти-атеросклеротичну дію. (ЛВГ), асоційованими з низькими рівнями частинок Сполуки формули І є корисними у ароАІ та високими рівнями Аро В при наявності попередженні чи лікуванні серцево-судинних невеликих щільних частинок ліпопротеїнів низької хвороб у ссавця, особливо людини. Сполуки густини (ЛНГ) фенотипу В. формули І є корисними у попередженні чи Сполуки формули І, як можна очікувати, є лікуванні атеросклерозу у ссавця, особливо корисними у лікуванні пацієнтів з комбінованими людини. Серцево-судинна хвороба охоплює, але 15 82109 16 або змішаними гіперліпідеміями та дисліпідеміями Заявлений винахід стосується способу з іншими виявами метаболічного синдрому або попередження та/або лікування діабету типу 2, що без них. полягає у застосуванні ефективної кількості Лікування заявленими сполуками, як сполуки формули І до ссавця (особливо людини), очікувано, знижуватиме серцево-судинну який має необхідність у цьому. захворюваність та смертність, асоційовані з Заявлений винахід стосується способу атеросклерозом, внаслідок їх антидисліпідемічних, попередження та/або лікування серцево-судинної а також антизапальних властивостей. Стани хвороби, що полягає у застосуванні ефективної серцево-судинних хвороб охоплюють кількості сполуки формули І до ссавця (особливо макроангіопатії різних внутрішніх органів, що людини), який має необхідність у цьому. викликають інфаркт міокарду, застійну серцеву Заявлений винахід стосується способу нестачу, церебрально-васкулярну хворобу та попередження та/або лікування атеросклерозу, що периферійну артеріальну недостатність нижніх полягає у застосуванні ефективної кількості кінцівок. Внаслідок їх інсулін-сенсибілізуючої дії, як сполуки формули І до ссавця (особливо людини), очікувано, також попереджатимуть або який має необхідність у цьому. затримуватимуть розвиток діабету типу 2 з Заявлений винахід стосується способу метаболічним синдромом та діабету вагітних. попередження та/або лікування Тому розвиток довготермінових ускладнень, гіперхолестеринемії, що полягає у застосуванні асоційованих з хронічною гіперглікемією при ефективної кількості сполуки формули І до ссавця цукровому діабеті, як-то мікро-ангіопатії, що (особливо людини), який має необхідність у цьому. викликають хворобу нирок, пошкодження сітчатки Заявлений винахід стосується способу та хворобу периферійної васкулярної системи попередження та/або лікування станів, нижніх кінцівок, як очікувано, затримуватиметься. асоційованих з необхідністю поліпшення Сполуки формули І можуть також бути зворотного транспорту холестерину, що полягає у корисними для попередження або лікування застосуванні ефективної кількості сполуки запалення та нейродегенеративних хвороб або формули І до ссавця (особливо людини), який має неврологічних розладів. Відповідно, цей винахід необхідність у цьому. також стосується способу попередження або Заявлений винахід стосується способу лікування запалення у ЦНС та спосіб для попередження та/або лікування станів, попередження або лікування асоційованих з необхідністю зменшення кишкового нейродегенеративних хвороб або розладів, що поглинання холестерину, що полягає у характеризуються нейронною дегенерацією, застосуванні ефективної кількості сполуки нейронним пошкодженням або порушеною формули І до ссавця (особливо людини), який має пластичністю або запалення у ЦНС. необхідність у цьому. Нейродегенеративні хвороби або стани, що Заявлений винахід стосується способу характеризуються нейронною дегенерацією та попередження та/або лікування станів, запаленням, охоплюють, але без обмеження, асоційованих з необхідністю збільшення рівнів інсульт, хворобу Альцгеймера, лобно-скроневі ЛВГ-холестерину, що полягає у застосуванні деменції (таупатії), периферійну невропатію, ефективної кількості сполуки формули І до ссавця хворобу Паркінсона, деменцію з тілами Леві, (особливо людини), який має необхідність у цьому. хворобу Гентингтона, бічний аміотрофічний Заявлений винахід стосується способу склероз та розсіяний склероз. Сполуки формули І попередження та/або лікування станів, є корисними у попередженні чи лікуванні асоційованих з необхідністю зменшення рівнів запальних станів або хвороб. Ці хвороби або стани ЛНГ-холестерину, що полягає у застосуванні охоплюють, але без обмеження, атеросклеротичні ефективної кількості сполуки формули І до ссавця хвороби, як-то стенокардію та інфаркт міокарду а (особливо людини), який має необхідність у цьому. також запальні хвороби або стани кишечнику, якЗаявлений винахід стосується способу то хворобу Крона, виразковий коліт та дистальний попередження та/або лікування запальних станів, проктит. Сполуки формули І можна також щополягає у застосуванні ефективної кількості застосовувати при інших запальних станах легень, сполуки формули І до ссавця (особливо людини), охоплюючи астму, респіраторний дистрес-синдром який має необхідність у цьому. дорослих, хронічну обструктивну хворобу легень Заявлений винахід стосується способу та пневмонійний бронхіт. попередження та/або лікування хвороби Крім того сполуки формули І можуть бути Альцгеймера, що полягає у застосуванні корисними у лікуванні різних станів поза серцевоефективної кількості сполуки формули І до ссавця судинною системою, асоційованих чи не (особливо людини), який має необхідність у цьому. асоційованих з резистентністю до інсуліну, типу Заявлений винахід стосується способу синдрому полікістозного яєчнику, ожиріння та раку. попередження та/або лікування артеріосклерозу, Заявлений винахід стосується способу що полягає у застосуванні ефективної кількості попередження та/або лікування дисліпідемій, сполуки формули І до ссавця (особливо людини), синдрому резистентності до інсуліну та/або який має необхідність у цьому. метаболічних розладів (які визначено вище), що Заявлений винахід стосується способу полягає у застосуванні сполуки формули І до попередження та/або лікування станів, ссавця (особливо людини), який має необхідність асоційованих з необхідністю поліпшення функції у цьому. ЛВГ, що полягає у застосуванні ефективної 17 82109 18 лікування та/або профілактики хвороби кількості сполуки формули І до ссавця (особливо Альцгеймера. людини), який має необхідність у цьому. Згідно з наступним аспектом заявленого Заявлений винахід стосується способу винаходу запропоновано застосування сполуки попередження та/або лікування гіперліпідемічних формули І у виробництві медикаменту для станів, що полягає у застосуванні ефективної лікування та/або профілактики артеріосклерозу. кількості сполуки формули І до ссавця (особливо Згідно з наступним аспектом заявленого людини), який має необхідність у цьому. винаходу запропоновано застосування сполуки Згідно з наступним аспектом заявленого формули І у виробництві медикаменту для винаходу запропоновано застосування сполуки лікування та/або профілактики діабету типу 2. формули І як медикаменту. Згідно з наступним аспектом заявленого Згідно з наступним аспектом заявленого винаходу запропоновано застосування сполуки винаходу запропоновано застосування сполуки формули І у виробництві медикаменту для формули І у виробництві медикаменту для лікування та/або профілактики станів, лікування та/або профілактики дисліпідемічних асоційованих з необхідністю поліпшення функції станів. ЛВГ. Згідно з наступним аспектом заявленого Згідно з наступним аспектом заявленого винаходу запропоновано застосування сполуки винаходу запропоновано застосування сполуки формули І у виробництві медикаменту для формули і у виробництві медикаменту для лікування та/або профілактики синдрому лікування та/або профілактики гіперліпідемічних резистентності до інсуліну та/або метаболічних станів. розладів. Комбінована терапія Згідно з наступним аспектом заявленого Сполуки винаходу можна комбінувати з іншим винаходу запропоновано застосування сполуки терапевтичним засобом, що є корисним у лікуванні формули І у виробництві медикаменту для розладів, асоційованих з розвитком та прогресом лікування та/або профілактики серцево-судинних атеросклерозу, як-то гіпертензія, гіперліпідемії, хвороб. дисліпідемії, діабет та ожиріння. Сполуку винаходу Згідно з наступним аспектом заявленого можна комбінувати з іншим терапевтичним винаходу запропоновано застосування сполуки засобом, що зменшує співвідношення ЛНПЛВГ або формули І у виробництві медикаменту для засобом, що викликає зменшення циркуляційних лікування та/або профілактики атеросклерозу. рівнів ЛНГ-холестерину у пацієнтів з цукровим Згідно з наступним аспектом заявленого діабетом. Сполуку винаходу можна також винаходу запропоновано застосування сполуки комбінувати з терапевтичними засобами, формули І у виробництві медикаменту для застосовуваними для лікування ускладнень, лікування та/або профілактики асоційованих з мікро-ангіопатіями. гіперхолестеринемії. Згідно з ще одним аспектом заявленого Згідно з наступним аспектом заявленого винаходу сполуку формули І або її фармацевтично винаходу запропоновано застосування сполуки прийнятні сіль чи сольват або сольват такої солі, формули І у виробництві медикаменту для можна застосовувати в асоціації з інгібіторами лікування та/або профілактики станів, біосинтезу холестерину або їх фармацевтично асоційованих з необхідністю поліпшення прийнятними солями, сольватами, сольватами зворотного транспорту холестерину. таких солей або проліками. Придатні інгібітори Згідно з наступним аспектом заявленого біосинтезу холестерину охоплюють інгібітори HMG винаходу запропоновано застосування сполуки СоА-редуктази, інгібітори синтезу сквалену та формули І у виробництві медикаменту для інгібітор епоксидази сквалену. Придатним лікування та/або профілактики станів, інгібітором синтезу сквалену є сквалестатин 1, а асоційованих з а. необхідністю зменшення придатним інгібітором епоксидази сквалену є NBкишкового поглинання холестерину. 598. Згідно з наступним аспектом заявленого Згідно з цим аспектом винаходу сполуку винаходу запропоновано застосування сполуки формули І або її фармацевтично прийнятну сіль формули І у виробництві медикаменту для чи сольват або сольват такої солі, можна лікування та/або профілактики станів, застосовувати в асоціації з інгібітором HMG СоАасоційованих з необхідністю збільшення рівнів редуктази або його фармацевтично прийнятними ЛВГ-холестерину. солями, сольватами, сольватами таких солей або Згідно з наступним аспектом заявленого проліками. Відповідно інгібітором HMG СоАвинаходу запропоновано застосування сполуки редуктази або його фармацевтично прийнятними формули І у виробництві медикаменту для солями, сольватами, сольватами таких солей або лікування та/або профілактики станів, проліками є статини, добре відомі у рівні техніки. асоційованих з необхідністю зменшення рівнів Конкретні статини вибирають з групи: ЛНГ-холестерину. аторвастатин, флувастатин, пітавастатин, Згідно з наступним аспектом заявленого ловастатин, мевастатин, нікостатин, нівастатин, винаходу запропоновано застосування сполуки правастатин та симвастатин або їх формули І у виробництві медикаменту для фармацевтично прийнятну сіль, головним чином лікування та/або профілактики запальних станів. натрію або кальцію, сольват, сольват такої солі Згідно з наступним аспектом заявленого або проліки. Конкретним статином є аторвастатин винаходу запропоновано застосування сполуки або його фармацевтично прийнятна сіль, сольват, формули І у виробництві медикаменту для 19 82109 20 сольват такої солі, можна застосовувати в сольват такої солі або проліки. Більш конкретним асоціації з антагоністом поглинання холестерину статином є сіль кальцію аторвастатину. Особливо або його фармацевтично прийнятними солями, кращим статином є, однак, розувастатин або його сольватами, сольватами таких солей або фармацевтично прийнятна сіль, сольват, сольват проліками, наприклад, азетиди-нони, як-то езетрол такої солі або проліки. Переважним конкретним (зетіа, езетиміб) та описані у [US 5,767,115], що статином є сіль кальцію розувастатину. уведено тут як посилання. Придатні сполуки, що У цій патентній заявці, термін, "інгібітори виявляють активність антагоністу поглинання біосинтезу холестерину" також охоплює хімічні холестерину, описані, дивись, наприклад, сполуки, модифікації інгібіторів HMG СоА-редуктази, описані у [WO 02/50027, WO 02/66464, WO інгібіторів синтезу сквалену та інгібітору 04/005247, WO 04/000803, WO 04/000804 та WO епоксидази сквалену, як-то естери, проліки та 04/000805], котрі уведені тут як посилання. метаболіти, активні або неактивні. Згідно з ще одним аспектом заявленого Згідно з ще одним аспектом заявленого винаходу, сполуку формули І або її винаходу, сполуку формули І або її фармацевтично прийнятну сіль чи сольват або фармацевтично прийнятну сіль чи сольват або сольват такої солі, можна застосовувати в сольват такої солі, можна застосовувати в асоціації з поглиначем жовчних кислот або його асоціації з інгібітором системи транспорту жовчних фармацевтично прийнятними солями, сольватами, кислот здухвинної кишки (інгібітор СТЖК) або його сольватами таких солей або проліками. Придатні фармацевтично прийнятними солями, сольватами, поглиначі жовчних кислот охоплюють сольватами таких солей або проліками. холестирамін, холестиполі та косевелам Придатні сполуки, що виявляють активність гідрохлорид. інгібітору СТЖК описані, дивись, наприклад, Згідно з ще одним аспектом винаходу, сполуку сполуки, описані у [WO 93/16055, WO 94/18183, формули І або її фармацевтично прийнятну сіль WO 94/18184, WO 96/05188, WO 96/08484, WO чи сольват або сольват такої солі, можна 96/16051, WO 97/33882, WO 98/07449, WO застосовувати в асоціації з модулятором 98/03818, WO 98/38182, WO 99/32478, WO активованих проліфератором пероксизом 99/35135, WO 98/40375, WO 99/35153, WO рецепторів (АППР). Модулятори АППР охоплюють, 99/64409, WO 99/64410, WO 00/01687, WO але без обмеження, АППР альфа та/або гамма 00/47568, WO 00/61568, WO 00/62810, WO та/або дельта агоніст або його фармацевтично 01/68906, DE 19825804, WO 00/38725, WO прийнятні солі, сольвати, сольвати таких солей 00/38726, WO 00/38727, WO 00/38728, WO або про-ліки. Придатні агоністи АППР альфа 00/38729, WO 01/68906, WO 01/66533, WO та/або гамма та/або дельта, їх фармацевтично 02/32428,.WO 02/50051, ЕР 864582, ЕР 489423, ЕР прийнятні солі, сольвати, сольвати таких солей 549967, ЕР 573848, ЕР 624593, ЕР 624594, ЕР або проліки добре відомі у рівні техніки. Вони 624595 та ЕР 624596], вміст цих патентних заявок охоплюють сполуки, описані у [WO 01/12187, WO уведено як посилання. 01712612, WO 99/62870, WO 99/62872, WO Наступні придатні сполуки, що виявляють 99/62871, WO 98/57941, WO 01/40170, WO активність інгібітору СТЖК описані у [WO 04/000790, WO 04/000295, WO 04/000294, WO 94/24087, WO 98/56757, WO 00/20392, WO 03/051822, WO 03/051321, WO 02/096863, WO 00/20393, WO 00/20410, WO 00/20437, WO 03/051826, WO 02/085844, WO 01/40172, J. Med 01,64570, WO 00/35889, WO 01/68637, WO Chem, 1996, 39, 665, Expert Opinion on Therapeutic 02/08211, WO 03/020710, WO 03/022825, WO Patents, 10 (5), 623-634 (зокрема сполуки описані у 03/022830, WO 03/022286, WO 03/091232, WO патентних заявках на cтop.634) та J Med Chern, 03/106482, JP 10072371, US 5070103, ЕР 251315, 2000, 43, 527], котрі уведені тут як посилання. ЕР 417725, ЕР 869121, ЕР 1070703 та ЕР 597107], Особливо АППР-альфа та/або гамма та/або а вміст цих патентних заявок уведено тут як дельта-агоніст охоплює мураглітазар (BMS посилання. 298585), ривоглітазон (CS-011), нетоглітазон Конкретні класи інгібіторів СТЖК, придатних (МСС-555), балаглітазон (DRF-2593, NN-2344), для застосування у заявленому винаході, є клофібрат, фенофібрат, без-афібрат, бензотіазепінами та сполуками, описаними у гемфіброзил, ципрофібрат, піоглітазон, формулі винаходу, особливо [п.1, WO 00/01687, розиглітазон, AVE-0847, AVE-8134, CLX-0921, WO 96/08484 та WO 97/33882], уведених тут як DRF-10945, DRF-4832, LY-518674, LY-818, LYпосилання. Інші придатні класи інгібіторів СТЖК є 929,641597, GW-590735, GW-677954, GW-501516, 1,2-бензотіазепінами, 1,4-бензотіазепінами та 1,5МВХ-102, ONO-5129, KRP-101, R-483 (BM131258), бензотіазепінами. Наступним придатним класом ТАК-559 або ТАК-654. Особливо АППР-альфа інгібіторів СТЖК є 1,2,5-бензотіадіазепіни. та/або гамма та/або дельта-агоніст охоплює Одною конкретною придатною сполукою, що тезаглітазар ((S)-2-етокси-3-[4-(2-{4виявляє активність інгібітору СТЖК є (3R,5R)-3метансульфонілбутил-3-етил-1,1-діоксидо-5-феніл-2,3,4,5оксифеніл}етокси)феніл]пропанова кислота) та тетрагідро-1,4-бензотіазепін-8-іл b-Dйого фармацевтично прийнятні солі. глюкопіранозидуронова кислота [ЕР 864582]. Згідно з ще одним аспектом винаходу, сполуку Наступною придатною сполукою, що виявляє формули І або її фармацевтично прийнятну сіль активність інгібітору СТЖК є S-8921 [ЕР 597107]. або сольват такої солі, можна застосовувати в Згідно з ще одним аспектом заявленого асоціації з інгібітором кінази піруват-дегідрогенази винаходу, сполуку формули І або її (КПД) або його фармацевтично прийнятною сіллю, фармацевтично прийнятну сіль чи сольват або 21 82109 22 охоплюють бігуанідні ліки, наприклад, метформін, сольватом, сольватом такої солі або проліками, фенформін та буформін, інсулін (синтетичні або модуляторами ядерних рецепторів, як-то аналоги інсуліну, амілін) та пероральні рецептор ретиноїду X (RXR), або його антигіперглікемічні засоби (що поділені на обідні фармацевтично прийнятною сіллю, сольватом, регулятори глюкози та інгібітори альфасольватом такої солі або проліками. глюкозидази). Прикладом інгібітору альфаЗгідно з ще одним аспектом винаходу, сполуку глюкозидази є акарбоза або воглібоза чи міглітол. формули І або її фармацевтично прийнятну сіль Прикладом обіднього регулятору глюкози є чи сольват або сольват такої солі, можна репаглінід або натеглінід. застосовувати в асоціації з інгібітором білку Згідно з ще одним аспектом винаходу, сполуку транспорту холестерилового естеру (БТХЕ) або формули І або її фармацевтично прийнятну сіль його фармацевтично прийнятними солями, чи сольват або сольват такої солі, можна сольватами, сольватами таких солей або застосовувати в асоціації із сульфонілсечовиною, проліками, наприклад, описаними у [WO 00/38725 як-то: глімепірид, глібенкламід (глібурид), стор.7 ряд.22 - стор.10 ряд.17], що уведено тут як гліклазид, гліпізид, гліквідон, хлорпропамід, посилання. толбутамід, ацетогексамід, глікопірамід, Згідно з ще одним аспектом винаходу, сполуку карбутамід, глібонурид, глізоксепід, глібутіазол, формули І або її фармацевтично прийнятну сіль глібузол, глігексамід, глімідин, гліпінамід, чи сольват або сольват такої солі, можна фенбутамід, толциламід та толазамід. Переважно застосовувати в асоціації з інгібітором білку сульфонілсечовиною є глімепірид або мікросомального транспорту (БМТ) або його глібенкламід (глібурид). Більш переважно фармацевтично прийнятними солями, сольватами, сульфонілсечовиною є глімепірид. Тому сольватами таких солей або проліками, заявлений винахід стосується застосування наприклад, імпліпатид, та описаними у [WO сполуки заявленого винаходу разом з одною, 03/004020, WO 03/002533, WO 02/083658 та WO двома або більше існуючими терапіями, 00/242291], вміст цих патентних заявок уведено описаними у цьому розділі. Дози для інших тут як посилання, або описаними у [Science, 282, існуючих терапій для лікування діабету типу 2 та 751-54, 1998], що уведено тут як посилання. асоційованих з ним ускладнень відомі у рівні Згідно з ще одним аспектом винаходу, сполуку техніки та затверджені для застосування формули І або її фармацевтично прийнятну сіль регуляторними закладами, наприклад, FDA чи сольват або сольват такої солі, можна (Управління по контролю за продуктами та застосовувати в асоціації з похідним нікотинової ліками), та їх можна знайти в Orange Book, кислоти або його фармацевтично прийнятними опублікованій FDA. Альтернативно як результат солями, сольватами, сольватами таких солей або корисності комбінування можна застосовувати проліками, охоплюючи продукти з уповільненим менші дози. вивільненням та комбіновані продукти, наприклад, Згідно з ще одним аспектом винаходу, сполуку нікотинова кислота (ніацин), аципімокс, формули І або її фармацевтично прийнятну сіль нікофуранозу, NIASPANÒ та та ніцеритрол. чи сольват або сольват такої солі, можна Згідно з ще одним аспектом винаходу, сполуку застосовувати в асоціації з антигіпертензивною формули І або її фармацевтично прийнятну сіль сполуки, наприклад, інгібітором ферменту або сольват такої солі, можна застосовувати в перетворення ангіотензину (ФПА), антагоністом асоціації з ацил-коферментом А: інгібітором Орецептору ангіотензину II, адренергічним ацилтрансферази холестерину (АХАТ) або його блокатором, альфа-адренергічним блокатором, фармацевтично прийнятними солями, сольватами, бета-адренергічним блокатором, наприклад, сольватами таких солей або проліками, метопролол, змішаним альфа/бета-адренергічним наприклад, CS-505, ефлуциміб (F-12511) та SMPблокатором, b-адренергічним стимулятором, 797. блокатором каналу кальцію, блокатором АТ-1, Згідно з ще одним аспектом винаходу, сполуку салуретиком, діуретиком або формули І або її фармацевтично прийнятну сіль судинорозширювачем, або їх фармацевтично або сольват такої солі, можна застосовувати в прийнятними солями, сольватами, сольватами асоціації з модуляторами ядерних рецепторів, яктаких солей або проліками. Конкретн інгібітори то рецептор фарнезоїду X (РФХ) або їх ФПА або їх фармацевтично прийняти солі, фармацевтично прийнятними солями, сольватами, сольвати, сольвати таких солей або проліки, сольватами таких солей або проліками. Згідно з охоплюючи активні метаболіти, котрі можна ще одним аспектом винаходу, сполуку формули І застосовувати у комбінації зі сполукою формули І, або її фармацевтично прийнятну сіль чи сольват охоплюють, але без обмеження, наступні сполуки: або сольват такої солі, можна застосовувати в алацеприл, алалтриоприл, алтіоприл кальцій, асоціації з фітостерольною сполукою або її анковенін, беназеприл, беназеприл гідрохлорид, фармацевтично прийнятними солями, сольватами, беназеприлат, бензоїлкаптоприл, каптоприл, сольватами таких солей або проліками, каптоприл-цистеїн, каптоприл-глутатіон, наприклад, етанолами. церанаприл, цераноприл, церонаприл, Згідно з ще одним аспектом винаходу, сполуку цилазаприл, цилазаприлат, делаприл, делаприлформули І або її фармацевтично прийнятну сіль дикислота, еналаприл, еналаприлат, енаприл, чи сольват або сольват такої солі, можна епікаптоприл, фороксимітин, фосфеноприл, застосовувати в асоціації з іншими терапіями для фосеноприл, фосеноприл натрій, фосиноприл, лікування метаболічного синдрому або діабету фосиноприл натрій, фосиноприлат, типу 2 та ускладнень, асоційованих з цим, вони 23 82109 24 Придатні кишкові анти-запальні засоби фосиноприлова кислота, глікоприл, геморфін-4, охоплюють, але без обмеження, аміносалицилати, ідраприл, імідаприл, індолаприл, індолаприлат, як-то сульфасалазин, месалазин, олсалазин та лібензаприл, лізиноприл, ліціумін А, ліціумін В, балсалазид. міксанприл, моексиприл, моексиприлат, Згідно з ще одним аспектом винаходу, сполуку мовелтиприл, мурацеїн А, мурацеїн В, мурацеїн С, формули І або її фармацевтично прийнятну сіль пентоприл, периндоприл, периндоприлат, чи сольват або сольват такої солі, можна півалоприл, півоприл, квінаприл, квінаприл застосовувати в асоціації з інгібітором гідрохлорид, квінаприлат, раміприл, раміприлат, холінестерази або антагоністом рецептору Nспіраприл, спіраприл гідрохлорид, спіраприлат, метил-D-аспартату (НМДА) або його спіроприл, спіроприл гідрохлорид, темокаприл, фармацевтично прийнятними солями, сольватами, темокаприл гідрохлорид, терпротид, сольватами таких солей або проліками, як-то трандолаприл, трандолаприлат, утибаприл, донепезил, ривастигмін або галантамін або забіциприл, забіциприлат, зофеноприл та мемантин. зофеноприлат. Переважними інгібіторами ФПА Згідно з додатковою особливістю винаходу для застосування у заявленому винаході є запропоновано спосіб лікування та/або раміприл, раміприлат, лізиноприл, еналаприл та профілактики метаболічних розладів у еналаприлат. Більш переважними інгібіторами теплокровної тварини, як-то людини, що потребує ФПА для застосування у заявленому винаході є такого лікування, котрий полягає у застосуванні до раміприл та раміприлат. вказаної тварини ефективної кількості сполуки Переважні антагоністи рецептору ангіотензину формули І або її фармацевтично прийнятної солі II, їх фармацевтично прийнятні солі, сольвати, чи сольвату або сольвату такої солі з одночасним, сольвати таких солей або проліки для послідовним чи роздільним застосуванням з застосування у комбінації зі сполукою винаходу ефективною кількістю одної з інших сполук, охоплюють, але без обмеження, сполуки: описаних у цьому комбінаційному розділі, або її кандесартан, кандесартан цилексетил, лосартан, фармацевтично прийнятних солей, сольватів, валсартан, ірбесартан, тазосартан, телмісартан та сольватів таких солей або проліків. епосартан. Особливо переважними антагоністами Тому згідно з додатковою особливістю ангіотензину II або їх фармацевтично прийнятними винаходу запропоновано спосіб лікування та/або похідними для застосування у заявленому профілактики діабету типу 2 та ускладнень, винаході є кандесартан та кандесартан асоційованих з цим, у теплокровної тварини, як-то цилексетил. людини, що потребує такого лікування, котрий Згідно з ще одним аспектом винаходу, сполуку полягає у застосуванні до вказаної тварини формули І або її фармацевтично прийнятну сіль ефективної кількості сполуки формули І або її чи сольват або сольват такої солі, можна фармацевтично прийнятної солі чи сольвату або застосовувати в асоціації зі сполукою проти сольвату такої солі з одночасним, послідовним чи ожиріння або її фармацевтично прийнятними роздільним застосуванням з ефективною кількістю солями, сольватами, сольватами таких солей або одної з інших сполук, описаних у цьому проліками, наприклад, інгібітором панкреатичної комбінаційному розділі, або її фармацевтично ліпази, наприклад, орлістат [ЕР 129,748] або прийнятних солей, сольватів, сольватів таких регулююча апетит (ситість) речовина, наприклад, солей або проліків. сибутрамін [GB 2,184,122 та US 4,929,629]; Тому згідно з додатковою особливістю антагоністом канабіноїду або інверсивного агоністу винаходу запропоновано спосіб попередження СВ1 або їх фармацевтично прийнятними солями, та/або лікування гіперліпідемічних станів у сольватами, сольватами таких солей або теплокровної тварини, як-то людини, що потребує проліками, наприклад, римонабант [ЕР 656354], та такого лікування, котрий полягає у застосуванні до як описано у [WO 01/70700]; або антагоністом вказаної тварини ефективної кількості сполуки гормону концентрування меланіну (ГКМ) або його формули І або її фармацевтично прийнятної солі фармацевтично прийнятними солями, сольватами, чи сольвату або сольвату такої солі з одночасним, сольватами таких солей або проліками, послідовним чи роздільним застосуванням з наприклад, як описано у [WO 04/004726]. ефективною кількістю одної з інших сполук, Згідно з ще одним аспектом винаходу, сполуку описаних у цьому комбінаційному розділі, або її формули І або її фармацевтично прийнятну сіль фармацевтично прийнятних солей, сольватів, чи сольват або сольват такої солі, можна сольватів таких солей або проліків. застосовувати в асоціації з анти-запальним Згідно з додатковою особливістю винаходу засобом, як-то глюкокотикоїди, нестероїдні запропоновано спосіб лікування та/або антизапальні засоби (НСАЗЗ) або кишкові профілактики дисліпідемії у теплокровної тварини, антизапальні засоби або їх фармацевтично як-то людини, що потребує такого лікування, прийнятними солями, сольватами, сольватами котрий полягає у застосуванні до вказаної тварини таких солей або проліками. Придатні ефективної кількості сполуки формули І або її глюкокотикоїди охоплюють, але без обмеження, прийнятної солі чи сольвату або сольвату такої бетаметазон, дексаметазон, метил преднізолон, солі з одночасним, послідовним чи роздільним преднізолон, преднізон, триамцинолон, застосуванням з ефективною кількістю одної з гідрокортизон, кортизон та будезонід. Придатні інших сполук, описаних у цьому комбінаційному нестероїдні антизапальні засоби охоплюють, але розділі, або її фармацевтично прийнятних солей, без обмеження, індометацин, диклофенак, сольватів, сольватів таких солей або проліків. ібупрофен, а також ацетилсалицилову кислоту. 25 82109 26 Згідно з додатковою особливістю винаходу Згідно з додатковою особливістю винаходу запропоновано спосіб попередження та/або запропоновано спосіб лікування та/або лікування станів, асоційованих з необхідністю профілактики синдрому резистентності до інсуліну зменшення кишкового поглинання холестерину у у теплокровної тварини, як-то людини, що теплокровної тварини, як-то людини, що потребує потребує такого лікування, котрий полягає у такого лікування, котрий полягає у застосуванні до застосуванні до вказаної тварини ефективної вказаної тварини ефективної кількості сполуки кількості сполуки формули І або її фармацевтично формули І або її фармацевтично прийнятної солі прийнятної солі чи сольвату або сольвату такої чи сольвату або сольвату такої солі з одночасним, солі з одночасним, послідовним чи роздільним послідовним чи роздільним застосуванням з застосуванням з ефективною кількістю одної з ефективною кількістю одної з інших сполук, інших сполук, описаних у цьому комбінаційному описаних у цьому комбінаційному розділі, або її розділі, або її фармацевтично прийнятних солей, фармацевтично прийнятних солей, сольватів, сольватів, сольватів таких солей або проліків. сольватів таких солей або проліків. Згідно з додатковою особливістю винаходу Згідно з додатковою особливістю винаходу запропоновано спосіб лікування та/або запропоновано спосіб попередження та/або профілактики серцево-судинних хвороб у лікування станів, асоційованих з необхідністю теплокровної тварини, як-то людини, що потребує збільшення рівнів ЛВГ-холестерину у теплокровної такого лікування, котрий полягає у застосуванні до тварини, як-то людини, що потребує такого вказаної тварини ефективної кількості і сполуки лікування, котрий полягає у застосуванні до формули І або її фармацевтично прийнятна сіль вказаної тварини ефективної кількості сполуки чи сольват або сольват такої солі з одночасним, формули І або її фармацевтично прийнятної солі послідовним чи роздільним застосуванням з чи сольвату або сольвату такої солі з одночасним, ефективною кількістю одної з інших сполук, послідовним чи роздільним застосуванням з описаних у цьому комбінаційному розділі, або її ефективною кількістю одної з інших сполук, фармацевтично прийнятних солей, сольватів, описаних у цьому комбінаційному розділі, або її сольватів таких солей або проліків. фармацевтично прийнятних солей, сольватів, Згідно з додатковою особливістю винаходу сольватів таких солей або проліків. запропоновано спосіб лікування та/або Згідно з додатковою особливістю винаходу профілактики атеросклерозу у теплокровної запропоновано спосіб попередження та/або тварини, як-то людини, що потребує такого лікування станів, асоційованих з необхідністю лікування, котрий полягає у застосуванні до зменшення рівнів ЛНГ-холестерину у теплокровної вказаної тварини ефективної кількості сполуки тварини, як-то людини, що потребує такого формули І або її фармацевтично прийнятної солі лікування, котрий полягає у застосуванні до чи сольвату або сольвату такої солі з одночасним, вказаної тварини ефективної кількості сполуки послідовним чи роздільним застосуванням з формули І або її фармацевтично прийнятної солі ефективною кількістю одної з інших сполук, чи сольвату або сольвату такої солі з одночасним, описаних у цьому комбінаційному розділі або її послідовним чи роздільним застосуванням з фармацевтично прийнятної солі, сольвату, ефективною кількістю одної з інших сполук, сольвату такої солі або проліків. описаних у цьому комбінаційному розділі, або її Згідно з додатковою особливістю винаходу фармацевтично прийнятних солей, сольватів, запропоновано спосіб лікування та/або сольватів таких солей або проліків. профілактики гіперхолестеринемії у теплокровної Згідно з додатковою особливістю винаходу тварини, як-то людини, що потребує такого запропоновано спосіб лікування та/або лікування, котрий полягає у застосуванні до профілактики запальних станів у теплокровної вказаної тварини ефективної кількості сполуки тварини, як-то людини, що потребує такого формули І або її фармацевтично прийнятної солі лікування, котрий полягає у застосуванні до чи сольвату або сольвату такої солі з одночасним, вказаної тварини ефективної кількості сполуки послідовним чи роздільним застосуванням з формули І або її фармацевтично прийнятної солі ефективною кількістю одної з інших сполук, чи сольвату або сольвату такої солі з одночасним, описаних у цьому комбінаційному розділі, або її послідовним чи роздільним застосуванням з фармацевтично прийнятних солей, сольватів, ефективною кількістю одної з інших сполук, сольватів таких солей або проліків. описаних у цьому комбінаційному розділі, або її Згідно з додатковою особливістю винаходу фармацевтично прийнятних солей, сольватів, запропоновано спосіб попередження та/або сольватів таких солей або проліків. лікування станів, асоційованих з необхідністю Згідно з додатковою особливістю винаходу поліпшення зворотного транспорту холестерину у запропоновано спосіб лікування та/або теплокровної тварини, як-то людини, що потребує профілактики хвороби Альцгеймера у такого лікування, котрий полягає у застосуванні до теплокровної тварини, як-то людини, що потребує вказаної тварини ефективної кількості сполуки такого лікування, котрий полягає у застосуванні до формули І або її фармацевтично прийнятної солі вказаної тварини ефективної кількості сполуки чи сольвату або сольвату такої солі з одночасним, формули І або її фармацевтично прийнятної солі послідовним чи роздільним застосуванням з чи сольвату або сольвату такої солі з одночасним, ефективною кількістю одної з інших сполук, послідовним чи роздільним застосуванням з описаних у цьому комбінаційному розділі, або її ефективною кількістю одної з інших сполук, фармацевтично прийнятних солей, сольватів, описаних у цьому комбінаційному розділі або їх сольватів таких солей або проліків. 27 82109 28 прийнятну сіль, сольват, сольват такої солі або фармацевтично прийнятних солей, сольватів, проліки у другій одиничній дозованій формі; та сольватів таких солей або проліків. c) контейнер, що вміщує вказані першу та Згідно з додатковою особливістю винаходу другу дозовані форми. запропоновано спосіб лікування та/або Згідно з ще одною особливістю винаходу профілактики артеріосклерозу теплокровної запропоновано застосування сполуки формули І тварини, як-то людини, що потребує такого або її фармацевтично прийнятної солі чи сольвату лікування, котрий полягає у застосуванні до або сольвату такої солі та одної з інших сполук, вказаної тварини ефективної кількості сполуки описаних у цьому комбінаційному розділі, або її формули І або її фармацевтично прийнятної солі фармацевтично прийнятної солі, сольвату, чи сольвату або сольвату такої солі з одночасним, сольвату такої солі або проліків у виробництві послідовним чи роздільним застосуванням з медикаменту для застосування у лікуванні та/або ефективною кількістю одної з інших сполук, профілактиці метаболічних розладів та описаних у цьому комбінаційному розділі, або її ускладнень, асоційованих з цим, у теплокровної фармацевтично прийнятних солей, сольватів, тварини, як-то людини. сольватів таких солей або проліків. Згідно з ще одною особливістю винаходу Згідно з додатковою особливістю винаходу запропоновано застосування сполуки формули І запропоновано спосіб попередження та/або або її фармацевтично прийнятної солі чи сольвату лікування станів, асоційованих з необхідністю або сольвату такої солі та одної з інших сполук, поліпшення функції ЛВГ у теплокровної тварини, описаних у цьому комбінаційному розділі, або її як-то людини, що потребує такого лікування, фармацевтично прийнятної солі, сольвату, котрий полягає у застосуванні до вказаної тварини сольвату такої солі або проліків у виробництві ефективної кількості сполуки формули І або її медикаменту для застосування у лікуванні та/або фармацевтично прийнятної солі чи сольвату або профілактиці метаболічного синдрому або діабету сольвату такої солі з одночасним, послідовним чи типу 2 та ускладнень, асоційованих з цим, у роздільним застосуванням з ефективною кількістю теплокровної тварини, як-то людини. одної з інших сполук, описаних у цьому Згідно з ще одною особливістю винаходу комбінаційному розділі, або її фармацевтично запропоновано застосування сполуки формули І прийнятних солей, сольватів, сольватів таких або її фармацевтично прийнятної солі чи сольвату солей або проліків. або сольвату такої солі та одної з інших сполук, Згідно з наступним аспектом винаходу описаних у цьому комбінаційному розділі, або її запропоновано фармацевтичну композицію, котра фармацевтично прийнятної солі чи сольвату або містить сполуку формули І або її фармацевтично сольвату такої солі у виробництві медикаменту прийнятну сіль або сольват такої солі та одну з для застосування у лікуванні та/або профілактиці інших сполук, описаних у цьому комбінаційному дисліпідемії у теплокровної тварини, як-то людини. розділі або їх фармацевтично прийнятних солей, Згідно з ще одною особливістю винаходу сольватів, сольватів таких солей або проліків в запропоновано застосування сполуки формули І асоціації з фармацевтично прийнятним або її фармацевтично прийнятної солі чи сольвату розріджувачем або носієм. або сольвату такої солі та одної з інших сполук, Згідно з наступним аспектом заявленого описаних у цьому комбінаційному розділі, або її винаходу запропоновано комплект, що містить фармацевтично прийнятної солі, сольвату, сполуку формули І або її фармацевтично сольвату такої солі або проліків у виробництві прийнятну сіль чи сольват або сольват такої солі медикаменту для застосування у лікуванні та/або та одну з інших сполук, описаних у цьому профілактиці гіперліпідемічних станів у комбінаційному розділ, або її фармацевтично теплокровної тварини, як-то людини. прийнятну сіль, сольват, сольват такої солі або Згідно з ще одною особливістю винаходу проліки. запропоновано застосування сполуки формули І Згідно з наступним аспектом заявленого або її фармацевтично прийнятної солі чи сольвату винаходу запропоновано комплект, що містить: або сольвату такої солі та одної з інших сполук, a) сполуку формули І або її фармацевтично описаних у цьому комбінаційному розділі, або її прийнятну сіль чи сольват або сольват такої солі, фармацевтично прийнятної солі, сольвату, у першій одиничній дозованій формі, сольвату такої солі або проліків у виробництві b) одну з інших сполук, описаних у цьому медикаменту для застосування у лікуванні та/або комбінаційному розділі або її фармацевтично профілактиці серцево-судинних хвороб у прийнятну сіль, сольват, сольват такої солі або теплокровної тварини, як-то людини. проліки у другій одиничній дозованій формі; та Згідно з ще одною особливістю винаходу c) контейнер, що вміщує вказані першу та запропоновано застосування сполуки формули І другу дозовані форми. або її фармацевтично прийнятної солі чи сольвату Згідно з наступним аспектом заявленого або сольвату такої солі та одної з інших сполук, винаходу запропоновано комплект, що містить: описаних у цьому комбінаційному розділі, або її a) сполуку формули І або її фармацевтично фармацевтично прийнятної солі, сольвату, прийнятну сіль чи сольват або сольват такої солі, сольвату такої солі або проліків у виробництві разом з фармацевтично прийнятним медикаменту для застосування у лікуванні та/або розріджувачем або носієм, у першій одиничній профілактиці атеросклерозу у теплокровної дозованій формі; тварини, як-то людини. b) одну з інших сполук, описаних у цьому комбінаційному розділі або її фармацевтично 29 82109 30 або її фармацевтично прийнятної солі чи сольвату Згідно з ще одною особливістю винаходу або сольвату такої солі та одної з інших сполук, запропоновано застосування сполуки формули І описаних у цьому комбінаційному розділі, або її або її фармацевтично прийнятної солі чи сольвату фармацевтично прийнятної солі чи сольвату або або сольвату такої солі та одної з інших сполук, сольвату такої солі у виробництві медикаменту описаних у цьому комбінаційному розділі, або її для застосування у лікуванні та/або профілактиці фармацевтично прийнятної солі чи сольвату або хвороби Альцгеймера у теплокровної тварини, яксольвату такої солі у виробництві медикаменту то людини. для застосування у лікуванні та/або профілактиці Згідно з ще одною особливістю винаходу гіперхолестеринемії у теплокровної тварини, як-то запропоновано застосування сполуки формули І людини. або її фармацевтично прийнятної солі чи сольвату Згідно з ще одною особливістю винаходу або сольвату такої солі та одної з інших сполук, запропоновано застосування сполуки формули І описаних у цьому комбінаційному розділі, або її або її фармацевтично прийнятної солі чи сольвату фармацевтично прийнятної солі чи сольвату або або сольвату такої солі та одної з інших сполук, сольвату такої солі у виробництві медикаменту описаних у цьому комбінаційному розділі, або її для застосування у лікуванні та/або профілактиці фармацевтично прийнятної солі чи сольвату або артеріосклерозу у теплокровної тварини, як-то сольвату такої солі у виробництві медикаменту людини. для застосування у лікуванні та/або профілактиці Згідно з ще одною особливістю винаходу станів, асоційованих з необхідністю поліпшення запропоновано застосування сполуки формули І зворотного транспорту холестерину у або її фармацевтично прийнятної солі чи сольвату теплокровної тварини, як-то людини. або сольвату такої солі та одної з інших сполук, Згідно з ще одною особливістю винаходу описаних у цьому комбінаційному розділі, або її запропоновано застосування сполуки формули І фармацевтично прийнятної солі чи сольвату або або її фармацевтично прийнятної солі чи сольвату сольвату такої солі у виробництві медикаменту або сольвату такої солі та одної з інших сполук, для застосування у лікуванні та/або профілактиці описаних у цьому комбінаційному розділі, або її станів, асоційованих з необхідністю поліпшення фармацевтично прийнятної солі чи сольвату або функції ЛВГ у теплокровної тварини, як-то людини. сольвату такої солі у виробництві медикаменту Згідно з наступним аспектом заявленого для застосування у лікуванні та/або профілактиці винаходу запропоновано комбіноване лікування, станів, асоційованих з необхідністю зменшення що полягає у застосуванні ефективної кількості кишкового поглинання холестерину у теплокровної сполуки формули І або її фармацевтично тварини, як-то людини. прийнятної солі чи сольвату або сольвату такої Згідно з ще одною особливістю винаходу солі, як варіант, разом з фармацевтично запропоновано застосування сполуки формули І прийнятним розріджувачем або носієм, з або її фармацевтично прийнятної солі чи сольвату одночасним, послідовним чи роздільним або сольвату такої солі та одної з інших сполук, застосуванням ефективної кількості одної з інших описаних у цьому комбінаційному розділі, або її сполук, описаних у цьому комбінаційному розділі, фармацевтично прийнятної солі чи сольвату або або її фармацевтично прийнятної солі, сольвату, сольвату такої солі у виробництві медикаменту сольвату такої солі або проліків, як варіант, разом для застосування у лікуванні та/або профілактиці з фармацевтично прийнятним розріджувачем або станів, асоційованих з необхідністю збільшення носієм до теплокровної тварини, як-то людини, що рівнів ЛВГ-холестерину у теплокровної тварини, має необхідність у такому терапевтичному як-то людини. лікуванні. Згідно з ще одною особливістю of винахід Приклади there є provided застосування сполуки формули І Скорочення. або її фармацевтично прийнятної солі чи сольвату ДМФ Ν,Ν-диметилформамід або сольвату такої солі та одної з інших сполук, ДМСО диметилсульфоксид описаних у цьому комбінаційному розділі, або її EtOAc етилацетат фармацевтично прийнятної солі чи сольвату або EtOH етанол сольвату такої солі у виробництві медикаменту ВЕРХ високо-ефективна рідинна для застосування у лікуванні та/або-профілактик хроматографія станів, асоційованих з необхідністю зменшення ЯМР ядерний магнітний резонанс рівнів ЛНГ-холестерину у теплокровної тварини, ТГФ тетрагідрофуран як-то людини. УФ ультрафіолет Згідно з ще одною особливістю винаходу br широкий запропоновано застосування сполуки формули І bs широкий синглет або її фармацевтично прийнятної солі чи сольвату bt широкий триплет або сольвату такої солі та одної з інших сполук, d дублет описаних у цьому комбінаційному розділі, або її dd дублет дублетів фармацевтично прийнятної солі чи сольвату або m мультиплет сольвату такої солі у виробництві медикаменту q квартет для застосування у лікуванні та/або профілактиці s синглет запальних станів у теплокровної тварини, як-то t триплет людини. Загальні експериментальні способи Згідно з ще одною особливістю винаходу запропоновано застосування сполуки формули І 31 82109 32 допомогою ВЕРХ (95% 0,1Μ амоній ацетатний У колонковій флеш-хроматографії застосовували колонку з нормально-фазовим буфер: 5% CH3CN®100% CH3CN). силікагелем 60 (0,040-0,063мм, Merck) або колонку 3-Хлор-4-феніл-1-(піридин-2-ілметил)-1Нз нормально-фазовим силікагелем 1ST пірол-2,5-діон Розчин 3-хлор-4-фенілфуран-2,5-діону lsoluteÒSPE. Очистку проводили на системі (0,20ммоль, 42мг) та 2-амінометил-піридин (0препаративної ВЕРХ Gilson з УФ-керованим 20ммоль, 22мг) у льодяній оцтовій кислоті (1мл) колектором фракцій, оснащеній колонкою АСЕ С8 нагрівали у мікрохвильовому реакторі при 120°С 5мкм 250мм´20мм, або на системі препаративної протягом 2 хвилин. Після охолодження розчинник ВЕРХ Waters, оснащеній колонкою АСЕ CS 5мкм випарювали під зменшеним тиском. Сирий продукт 250мм´50мм, або колонкою АСЕ С8 5мкм застосовували без очистки. 250мм´20мм. Спектри 1Н ЯМР отримували на 3-Хлор-1-(3-метоксипропіл)-4-феніл-1Н-піролVarian Unity Plus, 400МГц, при 9,3 Τ, оснащеній 2,5-діон 5мм переключуваним детектором з внутрішньою Розчин 3-хлор-4-фенілфуран-2,5-діон Х-катушкою, для розчини у CDCI 3 (залишковий (0,20ммоль, 42мг) та 1-аміно-3-метоксипропану СНСІ 3 (d Η 7,23чнм-1) як внутрішній стандарт) або (0,20ммоль, 18мг) у льодяній оцтовій кислоті (1мл) ДМСО-4 (залишковий ДМСО (d Η 2,50чнм-1) як нагрівали у мікрохвильовому реакторі при 120°С внутрішній стандарт) при 300К. Хімічні зсуви протягом 2 хвилин. Після охолодження розчинник надано у чнм-1. Мікрохвильове нагрівання випарювали під зменшеним тиском. Сирий продукт проводили застосуванням одиничного вузла застосовували без очистки. нагрівання у Smith Creator від Personal Chemistry, Метил 4-[(3-хлор-2,5-діоксо-4-феніл-2,5Uppsala, Sweden. дигідро-1Н-пірол-1-іл)метил]бензоат Синтез вихідних матеріалів та інтермедіатів Розчин 3-хлор-4-фенілфуран-2,5-діону 3-Хлор-4-фенілфуран-2,5-діон (0,24ммоль, 50мг) та метил 4До охолодженого льодом розчину (амінометил)бензоату (0,24ммоль, 40мг) у фенілмалеїнового ангідриду (5,74ммоль, 1,0г) у льодяній оцтовій кислоті (1мл) нагрівали у тіонілхлорид (5,0мл) додавали краплями піридин мікрохвильовому реакторі при 120°С протягом 2 (11,4ммоль, 0,9г). Реакційну суміш перемішували хвилин. Після охолодження розчинник випарювали протягом 60 хвилин при 0°С, а потім нагрівали до під зменшеним тиском. Сирий продукт 75°С протягом 20 хвилин. Реакційну суміш застосовували без очистки. охолоджували до кімнатної температури та 3-Хлор-1-[2-(метилтіо)етил]-4-феніл-1Н-піролтіонілхлорид видаляли у вакуумі. Сирий залишок 2,5-діон суспендували у толуолі (10мл), гріли при кипінні Розчин 3-хлор-4-фенілфуран-2,5-діону під зворотним холодильником протягом 10 хвилин, (1,00ммоль, 209мг) та 2-аміноетил метил сульфід супроводжуючи фільтруванням гарячої суміші. (1,00ммоль, 91мг) у льодяній оцтовій кислоті (2мл) Фільтрат концентрували, отримуючи 1,15г (96%) нагрівали у мікрохвильовому реакторі при 120°С заголовної сполуки. 1 протягом 2 хвилин. Після охолодження розчинник Н ЯМР (400МГц, CDCI 3) d 8,05-8,00 (m, 2H), випарювали під зменшеним тиском. Залишок 7,59 - 7,51 (m, 3H). розподіляли між водою та дихлорметаном. 3-Хлор-1-(2-метоксіетил)-4-феніл-1 Н-піролОрганічну фазу випарювали та сирий продукт 2,5-діон очищали за допомогою ВЕРХ (95% 0,1Μ амоній Розчин 3-хлор-4-фенілфуран-2,5-діону ацетатний буфер: 5% CH3CN®100% CH3CN), (0,20ммоль, 42мг) та 2-метоксіетиламіну отримуючи 152мг (54%) заголовної сполуки. (0,20ммоль, 15мг) у льодяній оцтовій кислоті (1мл) 1 Н ЯМР (400МГц, CDCI 3): d 7,97-7,90 (m, 2B), нагрівали у мікрохвильовому реакторі при 120°С 7,53-7,47 (m, 3H), 3,86 (t, J=6,3Гц, 2Н), 2,78 (t, протягом 2 хвилин. Після охолодження розчинник J=6,8Гц, 2H), 2,16 (s, 3H), випарювали під зменшеним тиском. Сирий продукт 3-Гідрокси-4-феніл-1Н-пірол-2,5-діон застосовували без очистки. Отримано літературним способом: [С. S. 3-Хлор-4-феніл-1-(піридин-3-ілметил)-1НRooney, et al.; J. Med. Chem., Vol. 26 (1983) pp.700пірол-2,5-діон 714]. Розчин 3-хлор-4-фенілфуран-2,5-діону 3-Хлор-4-феніл-1Н-пірол-2,5-діон (1,00ммоль, 209мг) та 3-(амінометил)-піридин До суспензії 3-гідрокси-4-феніл-1Н-пірол-2,5(1,00ммоль, 26мг) у льодяній оцтовій кислоті (4мл) діону (25,0г, 0,13моль) у дихлорметані (600мл) в нагрівали у мікрохвильовому реакторі при 120°С атмосфері азоту додавали ДМФ (36мл). Суспензію протягом 2 хвилин. Після охолодження розчинник охолоджували до температури льоду та випарювали під зменшеним тиском. Сирий продукт обробляли оксалілхлоридом (40,0г, 0,32моль). застосовували без очистки. Реакційну суміш далі гріли при кипінні під 3-Хлор-1-[4-(диметиламіно)бензил]-4-фенілзворотним холодильником протягом ночі. Після 1Н-пірол-2,5-діон охолодження до кімнатної температури додавали До розчину 3-хлор-4-фенілфуран-2,5-діону силікагель та реакційну суміш випарювали до (0,20ммоль, 42мг) та 4-диметиламінобензиламін сухого стану та флеш-хроматографували дигідрохлориду (0,20ммоль, 45мг) у льодяній (гексан:EtOAc 30:20), Розтирання з оцтовій кислоті (1мл) додавали триетиламін дихлорметаном, фільтрування та сушка дали 17,6г (0,40ммоль). Суміш нагрівали у мікрохвильовому (64%) заголовної сполуки. реакторі при 120°С протягом 2 хвилин. Після 1 Н ЯМР (400МГц, CDCI 3) d 7,96-7,89 (m, 2H), охолодження розчинник випарювали під 7,88-7,77 (bs, 1H), 7,55-7,45 (m, 311). зменшеним тиском. Реакційну суміш очищали за 33 82109 34 3-[(4-метоксифеніл)аміно]-4-феніл-1Н-піроламоній ацетатний буфер: 5% CH3CN®100% 2,5-діон CH3CN), отримуючи 15мг (21%) заголовної До розчину 3-хлор-4-феніл-1Н-пірол-2,5-діону сполуки. 1 (4,84ммоль, 1,0г) у сухому ДМФ (5мл) додавали 4Н ЯМР (400МГц, CDCI 3) d 7,27 (bs, 1Н), 7,13метоксіамін (4,87ммоль, 600мг) та реакційну суміш 7,04 (m, 3H), 7,00-6,96 (m, 2H), 6,61-6,50 (m, 4Н), піддавали одновузловому мікрохвильовому 3,30 (t, J=5,6Гц, 2Н), 3,67 (s, 3H), 3,62 (t, J=5,6Гц, нагріванню при 150°С, 15 хвилин, а потім 150°С, 2Н), 3,36 (s, 3H). 10 хвилин. Розчинник випарювали, та сиру суміш Приклад 2 розподіляли між дихлорметаном та водою. 3-{[4-(Дифлуорметокси)феніл]аміно}4-(2Органічну фазу сушили безводним натрій метоксіетил)-4-феніл-1Н-пірол-2,5-діон сульфатом, концентрували та залишок очищали 3-Хлор-1-(2-метоксіетил)-4-ілфеніл-1Н-піролна силікагелі (Гептан:EtOAc, 3:1®2:1), отримуючи 2,5-діон (0,13ммоль, 36мг) та 4457мг (32%) заголовної сполуки. дифлуорметоксіанілін (0,28ммоль, 45мг) 1 Н ЯМР (400МГц, ДМСО-d6) d 10,62 (s, 1Н), розчиняли у ДМФ (1мл). Суміш гріли у мікрохвильовому реакторі при 150°С протягом 9,27 (s, 1Н), 7,09-6,99 (m, 3H), 6,87-6,83 (m,2H), 20м. Після охолодження реакційну суміш очищали 6,65-6,60 (m, 2H), 6,52-6,47 (m, 2H), 3,58 (s, 3Н). за допомогою ВЕРХ (95% 0,1Μ амоній ацетатний 3-Феніл-4-{[4-(трифлуорметокси)феніл]аміно}1Н-пірол-2,5-діон буфер 5% CH3CN®100% CH3CN), отримуючи 13мг 3-Хлор-4-феніл-1Н-пірол-2,5-діон (2,00ммоль, (24%) заголовної сполуки. 1 415мг), 4-дифлуорметоксіанілін (2,00ммоль, Н ЯМР (400МГц, CDCI 3): d 7,25 (bs, 1H), 7,19354мг) та триетиламін (2,00ммоль, 202мг) 7,08 (m, 3H), 7,02-6,97 (m, 2H), 6,81-6,75 (m, 2H), розчиняли у ДМФ (5мл). Суміш перемішували при 6,66-6,60 (m, 2H), 6,36 (1, J=74,0Гц, 1H), 3,83 (t, 70°С протягом 20 годин. Після охолодження J=5,7Гц, 2H), 3,63 (t, J=5,7Гц, 2Н), 3,38 (s, 3H) реакційну суміш фільтрували та очищали за Приклад 3 допомогою ВЕРХ (95% 0,1Μ амоній ацетатний N-(4-{[2,5-Дигідро-1(2-метоксіетил)-2,5-діоксобуфер: 5% CH3CN®100% CH3CN; отримуючи 4-феніл-1Н-пірол-3-іл]аміно}феніл)-ацетамід 320мг (46%) заголовної сполуки. 3-Хлор-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,51 діон (0,26ммоль, 70мг) та 4-аміноацетанілід Н ЯМР (400МГц, CDCI 3): d 7,22 (bs, 1H), 7,22(0,53ммоль, 79мг) розчиняли у сухому CH3CN 7,09 (m, 3H), 7,02-6,97 (m, 2H), 6,91-6,85 (m, 2H), (2мл) та реакційну суміш піддавали двічі 6,69-6,63 (m, 2H) одновузловому мікрохвильовому нагріванню при трет-бутил [5-(бромметил)піридин-2140°С протягом 10 хвилин. Воду 0,3мл додавали іл]карбамат та реакційну суміш очищали застосуванням ВЕРХ Отримано літературним способом: [WO (57% 0,1Μ амоній ацетатний буфер 43% 0066557 Linschoten, Μ. et al., Astrazeneca АВ, Nov, 9,2000]. CH3CN®100% CH3CN, 20мл/хвилин), отримуючи трет-бутил {5-[(3-хлор-2,5-діоксо-4-феніл-2,545мг (45%) заголовної сполуки. 1 дигідро-1Н-пірол-1-іл)метил]піридин-2-іл}карбамат Н ЯМР (400МГц, CD3CN) d 8,17 (bs, 1H), 7,78 3-Хлор-4-феніл-1Н-пірол-2,5-діон (1,55г, (bs, 1H), 7,24-7,09 (m, 5H), 7,04-7,00 (m, 2H), 6,737,47ммоль) розчиняли у ДМФ (25мл) в атмосфері 6,68 (m, 2H), 3,73 (t, J=5,7Гц, 2H), 3,59 (t, J=5,7Гц, азоту та охолоджували у льодяній бані. Додавали 2H), 3,33 (s, 3H), 2,01 (s, 3H). трет-бутил [5-(бромметил)піридин-2-іл]карбамат Приклад 4 (2,14г, 7,46ммоль), супроводжуючи безводним 1-(2-метоксіетил)-3-{[4(метилтіо)феніл]аміно}калій карбонатом (1,03г, 7,47ммоль) та суміш 4-феніл-1Н-пірол-2,5-діон перемішували протягом півтори годин, після чого 3-Хлор-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,5баню для охолодження видаляли. Суміш діон (0,26ммоль, 70мг) та 4-(метилтіо)анілін перемішували для ще дві години та тоді (0,53ммоль, 73мг) розчиняли у сухому CH3CN нейтралізували 1% НСІ. Воду (100мл) додавали та (2мл) та реакційну суміш далі піддавали суміш екстрагували дихлорметаном 50мл´3). одновузловому мікрохвильовому нагріванню при Екстракти поєднували, промивали водою 140°С протягом 10 хвилин, 140°С протягом 10 хвилин, та 140°С протягом 20 хвилин. Воду 0,3мл (100мл´2), сушили магній сульфатом, фільтрували додавали та і реакційну суміш очищали та випарювали. Сирий продукт (3,41г) застосуванням ВЕРХ (57% 0,1Μ амоній ацетатний застосовували без подальшої очистки. 1 буфер: 43% CH3CN®100% CH3CN, 20мл/хвилину), Н ЯМР (400МГц, CDCI 3): d 8,32 (d, J=2Гц, 1H), отримуючи 49мг (50%) заголовної сполуки. 7,92-7,89 (m, 3H), 7,83 (bs, 1H), 7,72 (dd, J=9,2Гц, 1 1H), 7,49-7,47 (m, 3H), 4,71 (s, 2H), 1,52 (s, 9H) Н ЯМР (400МГц, CDCI 3) d 7,22 (bs, 1H), 7,19Приклади 7,10 На, 3H), 7,06-7,00 (m, 2H), 6,95-6,90 (m, 2НЕ), Приклад 1 6,58-6,53 (m, 2Н), 3,82 (t, J=5,6Гц, 2H), 3,63 (t, 1-(2-метоксіетил-3-[(4-метоксифеніл)аміно]-4J=5,6Гц, 2H), 3,3S (s, 3H), 2,38 (s, 3H). феніл-1Н-пірол-2,5-діон Приклад 5 3-Хлор-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,53-[(2-Ацетил-5-бензофураніл)аміно]-1-(2діон (0,20ммоль, 53мг) та 4-метоксіанілін метоксіетил}-4-феніл-1Н-пірол-2,5-діон (0,48ммоль, 59мг) розчиняли у ДМФ (1мл). Суміш 3-Хлор-2-(2-метоксіетил)-4-феніл-1Н-пірол-2,5нагрівали у мікрохвильовому реакторі при 150°С діон (0,26ммоль, 70мг) та 1-(5-амінобензофуран-2протягом 5 хвилин. Після охолодження реакційну іл)етан-1-он (0,53ммоль, 92мг) розчиняли у сухому суміш очищали за допомогою ВЕРХ (95% 0,1Μ CH3CN (2мл) та реакційну суміш піддавали 35 82109 36 суміш далі піддавали одновузловому одновузловому мікрохвильовому нагріванню при мікрохвильовому нагріванню при 140°С протягом 150°С протягом 15 хвилин та очищали на SiO2 20 хвилин, 140°С протягом 120 хвилин, та 140°С (EtOAc:гептан, 1:1), отримуючи 18мг (15%) протягом 120 хвилин. Додавали 0,3мл води та заголовної сполуки. 1 реакційну суміш очищали застосуванням ВЕРХ Н ЯМР (400МГц, CDCI 3) d 753 (bs, 1H), 7,40 (d, (57% 0,1Μ амоній ацетатний буфер: 43% 1H), 7,24-7,09 (m, 5H), 7,06 (dd,1H), 6,92 (d, 1H), CH3CN®100% CH3CN, 20мл/хвилин), отримуючи 3,98 (t, J=5,6Гц, 2H), 3,78 (t, J=5,6Гц, 2H), 3,52 (s, 92мг (45%) заголовної сполуки. 3H), 2,69 (s, 3H). 1 Приклад 6 Н ЯМР (400МГц, CD3CN) d 8,63 (d, 1H), 8,52 1-(2-метоксіетил)-3-[(4-морфолін-4(dd, 1H), 7,95 (bs, 1H), 7,80-7,74 (m, 1H), 7,37-7,32 ілфеніл)аміно]-4-феніл-1Н-пірол-2,5-діон (m, 1Н), 7,19-7,08 (m, 3H), 7,01-6-95 (m, 2Н), 6,943-Хлор-1-(2-метоксіетил)-4-феніл-1Н-пірол-2,56,88 (m, 2Н), 6,84-7,78 (а, 2Н), 4,77 (s, 2H). діон (0,26ммоль, 70мг) та 4-морфоліноанілін Приклад 10 (0,53ммоль, 94мг) розчиняли у сухому CH3CN 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин(2мл) та реакційну суміш піддавали 3-ілметил)-1Н-пірол-2,5-діон одновузловому мікрохвильовому нагріванню при До розчину 3-хлор-4-феніл-1-(піридин-3130°С протягом 10 хвилин та очищали на SiO2 ілметил)-1Н-пірол-2,5-діону (050ммоль, 149мг) у (EtOAc:гептан, 1:1), отримуючи 96мг (89%) диметилформаміді (1мл) додавали 4-метоксіанілін заголовної сполуки. (1,10ммоль, 135мг). Суміш нагрівали у 1 Н ЯМР (400МГц, CD3CN) d 7,73 (bs, 1Н), 7,17мікрохвильовому реакторі при 150°С протягом 5 хвилин. Після охолодження реакційну суміш 7,04 (m, 3H), 6,98-6,93 (m, 2H), 6,70- 6,64 (m, 2H), очищали за допомогою ВЕРХ (95% 0,1Μ амоній 6,59-6,54 (m, 2H), 3,75-3,70 (m, 6H), 3,58 (t, J=5,6Гц, 2Н), 3,33 (s, 3H), 2,98-2,95 (m, 4Н). ацетатний буфер: 5% CH3CN®100% CH3CN), Приклад 7 отримуючи 77мг (40%) заголовної сполуки. 1 3-[(4-морфолін-4-ілфеніл)аміно]-4-феніл-1Н ЯМР (400МГц, CDCI 3) d 8,71 (d, J=1,8Гц, (піридин-3-ілметил)-1Н-пірол-2,5-діон 1Н), 8,54 (dd, J1=4,7Гц, J2=1,6Гц, 1H), 7,80-7,75 (m, 4-морфоліноанілін (0,94ммоль, 178мг) 1Н), 7,35 (bs, 1Н), 7,26 (dd, J1=7,8Гц, J2=4,7Гц, 1Н), розчиняли у сухому CH3CN (2мл), додавали до 7,15-7,05 (m, 3H), 6,98-6,94.(m, 2H}, 6-62-6,50 сирого 3-хлор-4-феніл-1-(піридин-3-ілметил)-1Н(m,4H), 4,78 (s,2H), 3,68 (s, 3H). пірол-2,5-діону (0,47ммоль, 140мг) та. Реакційну Приклад 11 суміш піддавали одновузловому мікрохвильовому 3-Аміно-4-феніл-1-(піридин-3-ілметил)-1Ннагріванню при 130аС протягом 10 хвилин. пірол-2,5-діон Додавали 0,3мл води та реакційну суміш очищали До розчину 3-хлор-4-феніл-1-(піридин-3застосуванням ВЕРХ (57% 0,1Μ амоній ацетатний ілметил)-1Н-пірол-2,5-діону (0,25ммоль, 75мг) у буфер 43% CH3CN®100% CH3CN, 20 мл/хвилину), ДМФ (0,5мл) додавали анілін (0,55ммоль, 51мг). отримуючи 56мг (27%) заголовної сполуки. Суміш нагрівали у мікрохвильовому реакторі при 1 150°С протягом 5 хвилин. Після охолодження Н ЯМР (400МГц, CD3CN) d 8,63 (d, 1H), 8,51 реакційну суміш очищали за допомогою ВЕРХ (dd, 1H), 7,81-7,73 (m, 1H), 7,36-7,31 (m, 1H), 7,16(95% 0,1Μ амоній ацетатний буфер: 5% 7,11 (m,1H), 7,10-7,04 (m, 2H), 6,99-6,93 (m, 2H), 6,69-6,64 (m, 2H), 6,59-6,53 (m, 2H), 4,75 (s, 2H), CH3CN®100% CH3CN), отримуючи 38мг (43%) 3,74 (t, J=4,8Гц, 4Н), 2,97 (t, J=4,8Гц, 4Н). заголовної сполуки. 1 Приклад 8 Н ЯМР (400МГц, CDCI 3) d 8,72 (bs, 1H), 8,54 3-[(2-Ацетил-5-бромфураніл)аміно]-4-феніл-1(d, br, 1H), 7,79-7,75 (m, 1H), 7,47 (bs, 1H), 7,29(піридин-3-ілметил)-1Н-пірол-2,5-діон 7,23 (m, 1H), 7,17-7,06 (m, 3H), 7,04-6,93 (m, 5H), 1-(5-Амінобензо[b]фуран-2-іл)етан-1-он 6,66-6,60 (m, 2H), 4,79 (s, 2H). (0,94ммоль, 164мг) розчиняли у сухому CH3CN Приклад 12 (2мл) додавали до сирого 3-хлор-4-феніл-13-{[4-(Дифлуорметокси)феніл]аміно}-4-феніл(піридин-3-ілметил)-1Н-пірол-2,5-діону (0,47ммоль, 1-(піридин-3-ілметил)-1Н-пірол-2,5-діон 140мг) та реакційну суміш піддавали 4-(Дифлуорметокси)амін (0,94ммоль, 149мг) одновузловому мікрохвильовому нагріванню при розчиняли у сухому CH3CN (23мл) додавали до 130°С протягом 10 хвилин. Додавали 0,3мл води сирого 3-хлор-4-феніл-1-(піридин-3-ілметил)-1Нта реакційну суміш очищали застосуванням ВЕРХ пірол-2,5-діону (0,39ммоль, 115мг) та реакційну (57% 0,1Μ амоній ацетатний буфер: 43% суміш піддавали одновузловому мікрохвильовому CH3CN®100% CH3CN, 20мл/хвилину), отримуючи нагріванню при 140°С одну годину. Реакційну 15мг (7%) заголовної сполуки. суміш очищали ВЕРХ (57% 0,1Μ амоній ацетатний 1 Н ЯМР (400МГц, CD3CN) d 8,64 (d, 1H), 8,52 буфер: 43% CH3CN®100% OH3CN, 20мл/хвилину), (dd, 1H), 8,01 (bs, 1H), 7,80-7,75 (m, 1H), 7,35 (dd, отримуючи 122мг (75%) заголовної сполуки. 1 1H), 7,31-7,23 (m,2H), 7,08-6,93 (m,7H), 4,77 Н ЯМР (400МГц, CD3CN) d 8,63 (d, 1Η), 8,51 (s,2H),2,50 (s, 3H). (dd,1H), 7,92 (bs, 1H), 7,79-7,74 (m, 1H), 7,34 (dd, Приклад 9 1H), 7,20-7,07 (m, 3H), 7,00-6,94 (m, 2H), 6,78 (s, 3-Феніл-1-(піридин-3-іл метил)-4-{[44H), 6,59 (t, J=74,1Гц, 1Н), 4,76 (s, 2H). (трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон Приклад 13 4-(Трифлуорметокси)анілін (0,94ммоль, 177мг) 1-[4-(диметиламіно)бензил]-3розчиняли у сухому CH3CN (2мл), додавали до [(метокси)феніл]аміно}-4-феніл-1Н-пірол-2,5-діон сирого 3-хлор-4-феніл-1-(піридин-3-ілметил)-1Нпірол-2,5-діону (0,47ммоль, 140мг) та реакційну 37 82109 38 Метил 4-({3-[(4-метоксифеніл)аміно]-2,53-хлор-1-[4-(диметиламіно)бензил]-4-фенілдіоксо-4-феніл-2,5-дигідро-1Н-пірол-11Н-пірол-2,5-діон (0,20ммоль, 68мг) та 4іл)метил]бензоат метоксіамін (0,48ммоль, 59мг) розчиняли у ДМФ Метил 4-[(3-хлор-2,5-діоксо-4-феніл-2,5(1мл). Суміш нагрівали у мікрохвильовому дигідро-1Н-пірол-1-іл)метил]бензоат (0,24ммоль, реакторі при 150°С протягом 5 хвилин. Після 85мг), 4-метоксіамін (0,26ммоль, 33мг) та охолодження реакційну суміш очищали затриетиламін (0,29ммоль, 29мг) розчиняли у ДМФ допомогою ВЕРХ (95% СОМ амоній ацетатний (1мл). Суміш нагрівали у мікрохвильовому буфер: 5% CH3CN®100% CH3CN), отримуючи реакторі при 150сС протягом 5 хвилин. Після 11мг (13%) заголовної сполуки. 1 охолодження реакційну суміш очищали за Н ЯМР (400МГц, CDCI 3) d 7,38-7,34 (m,2H), допомогою ВЕРХ (95% 0,1Μ амоній ацетатний 7,15 (bs, 1H), 7,13-7,04 (m, 3H), 6,97 (m, 2H), 6,70 буфер: 5% CH3CN®100% CH3CN), отримуючи (d, 2H), 6,60-6,5 l(m,4H), 4,67 (s,2H), 3,69 (s, 3H), 32мг (30%) заголовної сполуки. 2,93 (s, 6H). 1 Н ЯМР (400МГц, CDCI 3) d 8,03-7,99 (m, 2H), Приклад 14 7,52-7,46 (m, 2H), 7,21 (bs, 1H), 7,16-7,05 (m, 3H), 3-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин7,01-6,95 (m, 2H), 6,62-6,52 (m, 4H), 4,31 (s, 2H), 4-ілметил)-1Н-пірол-2,5-діон 3,90 (s, 3H), 3,69 (s, 3H). Суміш 3-[(4-метоксифеніл)аміно]-4-феніл-1НПриклад 18 пірол-2г5-діону (0,50ммоль, 147мг), 43-[(4-метоксифеніл)аміно]-1-[2-(метилтіо)етил]гідроксиметилпіридину (0,75ммоль, 82мг), діетил 4-феніл-1Н-пірол-2,5-діон азодикарбоксилату (0,75ммоль, 131мг) та 3-хлор-1-[2-(метилтіо)етил]-4-феніл-1Н-піролтрифенілфосфіну (0,75ммоль, 197мг) у сухому 2,5-діон (0,40ммоль, 113мг) та 4-метоксіанілін ТГФ (2мл) нагрівали у мікрохвильовому реакторі (0,88ммоль, 109мг) розчиняли у при 120°С протягом 5 хвилин. Після охолодження диметилформаміді (1мл). Суміш нагрівали у реакційну суміш очищали за допомогою ВЕРХ мікрохвильовому реакторі при 150°С протягом 10 (95% 0,1Μ амоній ацетатний буфер 5% хвилин. Після охолодження розчинник випарювали CH3CN®100% CH3CN), отримуючи 56мг (29%) під зменшеним тиском. Залишок розподіляли між заголовної сполуки. 1 водою та СН2СІ 2. Органічну фазу випарювали та Н ЯМР (400МГц, CDCI 3) d 8,59 (bs, 2H), 7,35очищали флеш-хроматографією застосуванням 7,29 (m, br, 2H), 7,25 (s, br, 1HJ, 7,17-7,06 (m, 3H), попередньо упакованої силікагелевої колонки. 7,01-6,96 (m, 2H), 6,63-6,53 (m, 4H), 4,77 (s, 2H), Потрібний продукт елювали сумішшю 3,70 (s, 3H). гептан/EtOAc 2:1. Вихід 118мг (80%). Приклад 15 1 Н ЯМР (400МГц, CDCI 3) d 7,26 (bs, 1H), 7,153-[(4-метоксифеніл)аміно]-4-феніл-1-(піридин7,06 (m, 3H), 7,01-6,96 (m, 2H), 6,63-6,52 (m, 4H), 2-іл метил)-1Н-пірол-2,5-діон 3,83 (t, J=7,0Гц, 2Н), 3,69 (s, 3H), 2,79 (t, J=7,0Гц, 3-хлор-4-феніл-1-(піридин-2-ілметил)-1Н2Н), 2,18 (s, 3H) пірол-2,5-діон (2,39ммоль, 714мг) та 4Приклад 19 метоксіанілін (5,26ммоль, 648мг) розчиняли у ДМФ 3-[(4-метоксифеніл)аміно]-4-феніл-1-(3,3,3(4мл), Суміш нагрівали у мікрохвильовому трифлуорпропіл)-1Н-пірол-2,5-діон реакторі при 150°С протягом 5 хвилин. Після До розчину 3-[(4-метоксифеніл)аміно]-4-фенілохолодження реакційну суміш очищали за 1Н-пірол-2,5-діону (0,17ммоль, 50мг), 3,3,3допомогою ВЕРХ (95% 0,1Μ амоній ацетатний трифлуорпропан-1-олу (0,19ммоль, 21мг), діетил буфер: 5% CH3CN®100% CH3CN), отримуючи азодикарбоксилату (0,19ммоль, 33мг) у сухому 710мг (77%) заголовної сполуки. 1 ТГФ (1мл) додавали трифенілфосфін (0,19ммоль Н ЯМР (400МГц, CDCI 3): 8,60-8,57 (m, 1H), 1,49мг) у сухому ТГФ (1мл). Суміш нагрівали у 7,71-7,65 (m, 1H), 7,36-7,30 (m, 1H), 7,24 (bs, 1Н), мікрохвильовому реакторі при 130°С протягом 6 7,23-7,19 (m, 1Н), 7,13-7,05 (m, 3H), 7,04-6,99 (m, хвилин. Після охолодження реакційну суміш 2H), 6,64-6,53 (m, 4H), 4,95 (s, 2H), 3,70 (s, 3H). очищали за допомогою ВЕРХ (95% 0,1Μ амоній Приклад 16 ацетатний буфер: 5% CH3GN®100% CH3CN), 3-[(4-метоксифеніл)аміно]-3-метоксипропіл)-4отримуючи 51мг (77%) заголовної сполуки. феніл-1Н-пірол-2,5-діон 1 Н ЯМР (400МГц, CDCI 3) d 7,27 {bs, 1H), 7,173-хлор-1-(3-метоксипропіл)-4-феніл-1Н-пірол7,06 (m, 3H), 7,00-6,95 (m, 2H), 6,64-6,55 (m, 4H), 2,5-діон (020ммоль, 56мг) та 4-метоксіанілін 3,89 (t, J=7,3Гц, 2H), 3,70 (s, 3H), 2,61-2,48 (m, 2H). (0,48ммоль, 59мг) розчиняли у ДМФ (1мл). Суміш Приклад 20 нагрівали у мікрохвильовому реакторі при 150°С 1-(3-Фурилметил)-3-[(4-метоксифеніл)аміно]-4протягом 5 хвилин. Після охолодження реакційну феніл-1Н-пірол-2,5-діон суміш очищали за допомогою ВЕРХ (95% 0,1Μ До розчину 3-[(4-метоксифеніл)аміно]-4-феніламоній ацетатний буфер: 5% CH3CN®100% 1Н-пірол-2,5-діону (047ммоль, 50мг), 3CH3CN), отримуючи 11мг (15%) заголовної фуранметанолу (0,19ммоль, 18мг), діетил сполуки. 1 азодикарбоксилату (0,19ммоль, 33мг) у сухому Н ЯМР (400МГц, CDCI 3) d 7,17 (bs, 1H), 7,14ТГФ (1мл) додавали трифенілфосфін (0,19ммоль, 7,05 (m, 3H), 7,01-6,95 (m, 2H), 6,63-6,52 (m, 4H), 49мг) у сухому ТГФ (1мл). Суміш нагрівали у 3,71 (t, J=7,0Гц, 2H), 3,70 (s, 3H), 3,45 (t, J=6,2Гц, мікрохвильовому реакторі при 130°С протягом 6 2H), 3,34 (s, 3H), 1,94 (m, 2H). хвилин. Після охолодження реакційну суміш Приклад 17 очищали за допомогою ВЕРХ (95% 0,1Μ амоній 39 82109 40 1 Н ЯМР (400МГц, CDCI 3) d 7,22- 7,17 (bs, 1H), ацетатний буфер: 5% CH3CN®100% CH3CN), 7,15-7,05 (m, 3H), 7,01-6,96 (m, 2H), 6,63-6,52 (m, отримуючи 17мг (27%) заголовної сполуки. 1 4H). 4,36 (s, 2H), 4,24 (q, J=7,1Гц, 2Н), 3,69 (s, 3H), Н ЯМР (400МГц, CDCI 3) d 7,61 (bs, 1H), 7,35 1,30 (t, J=7,1Гц, 3H). (bs, 1H), 7,16 (bs, 1H), 7,15-7,05 (m, 3H), 7,00-6,95 Приклад 24 (m, 2H), 6,62-6,51 (m, 4H), 6,48 (bs, 1H), 4,63 (s, 3-феніл-1-(2,2,2-трифлуоретил)-{[42H), 3,69 (s, 3H). (трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діон Приклад 21 Суміш 3-феніл-4-{[43-[(4-метоксифеніл)аміно]-4-феніл-1-(2,2,2{трифлуорметокси)феніл]аміно}-1Н-пірол-2,5-діону трифлуоретил)-1Н-пірол-2,5-діон (0,63ммоль, 220мг), діетил азодикарбоксилату Розчин 3-[(4-метоксифеніл)аміно]-4-феніл-1Н(0,70ммоль, 121мг) та трифенілфосфіну пірол-2,5-діону (2,11ммоль,620мг), діетил (0,70ммоль, 182мг) у сухому ТГФ (4мл) азодикарбоксилату (2,11ммоль, 367мг) та отримували у герметичній реакційній посудині. трифенілфосфіну (211ммоль, 553мг) у сухому ТГФ 2,2,2-трифлуоретанол (0,70ммоль, 70мг) (2мл) отримували у герметичній реакційній додавали. Суміш спершу перемішували при посудині. 2,2,2-трифлуоретанол (2,11ммоль, кімнатній температурі, протягом 3 діб, тоді при 211мг) додавали. Суміш перемішували при 40°С 40°С протягом 2 годин та кінцево при 100°С протягом 19 годин. Ацетонітрил додавали, доки не протягом 30мм. у мікрохвильовому реакторі. осаджувалося трохи трифенілфосфін оксиду. Реакційну суміш фільтрували та очищали за Реакційну суміш фільтрували та очищали за допомогою ВЕРХ (95% 0,1Μ амоній ацетатний допомогою ВЕРХ (95% 0,1Μ амоній ацетатний буфер: 5% GH3CN®100% CH3CN), отримуючи 7мг буфер 5% CH3CN®100% CH3CN), отримуючи (3%) заголовної сполуки. 260мг (33%) заголовної сполуки. 1 1 Н ЯМР (400МГц, CDCI 3) d 7,45 (s, br, 1H), Н ЯМР (400МГц, CDCI 3) d 7,30 (bs, 1H), 7,187,22-7,09 (m, 3H), 7,02-6,97 (m,2H), 6,92-6,84 (m, 7,06 (m, 3H), 7,01-6,96 (m, 2H), 6-64-6,52 (m, 4H), 2H), 6,70-6,65 (m, 2H), 4,24 (q, J=8,6Гц, 2Н). 4,23 (q, J=8,3Гц, 2Н)3 3,70 (s, 3H). Приклад 25 Приклад 22 1-[(6-Амінопіридин-3-іл)метил]-3-[(43-[(4-метоксифеніл)аміно]-1-[(5 метоксифеніл)аміно]-4-феніл-1Н-пірол-2,5-діон метилізоксазол-3-іл)метил-4-феніл-1Н-пірол-2,5До розчину трет-бутил {5-[(3-хлор-2,5-діоксо-4діон феніл-2,5-дигідро-1Н-пірол-1-іл)метил]піридин-2До розчину 3-(4-метоксифеніл)аміно]-4-феніліл}карбамату (0,86ммоль, 357мг) у сухому ДМФ 1Н-пірол-2,5-діон (0,17ммоль, 50мг), 5(1,0мл) додавали 4-метоксіанілін (0,96ммоль, метилізоксазол-3-метанолу (0,19ммоль, 21мг) та 118мг) та безводний калій карбонат (0,96ммоль, діетил азодикарбоксилату (0,19ммоль, 33мг) у 133мг) та реакційну суміш піддавали сухому ТГФ (1мл) додавали трифенілфосфін одновузловому мікрохвильовому нагріванню при (0,19ммоль, 49мг) у сухому ТГФ (1мл). Суміш 150°С протягом 15 хвилин. Реакційну суміш нагрівали у мікрохвильовому реакторі при 130°С очищали застосуванням ВЕРХ (95% 0,1Μ амоній протягом 6 хвилин. Після охолодження реакційну ацетатний буфер: 5% CH3CN®5% 0,1Μ амоній суміш очищали за допомогою ВЕРХ (95% 0,1Μ ацетатний буфер: 95% CH3CN, 10 хвилин., амоній ацетатний буфер: 5% CH3CN®100% 25мл/хвилин.), отримуючи 102мг (29%) заголовної CH3CN), отримуючи 14мг (21%) заголовної сполуки. сполуки. 1 1 Н ЯМР (400МГц, CDCI 3) d 8,03 (s, 1Н), 7,62 Н ЯМР (400МГц, CDCI 3) d 7,23 (bs, 1H), 7,16(dd, J=8,6Гц, 1=2,3Гц, 1Н), 7,21 (bs, 1Н), 7,15-7,04 7,06 (m, 3H), 7,01-6,96 (m, 2H), 6,63-6,53 (m, 4H), (m, 3H), 5,98-6,93 (m, 2Н), 6,62-6,49 (m, 5Н), 4,62 6,03 (d, J=0,7Гц, 1H), 4,82 (s, 2H), 3,70 (s, 3H), 2,39 (s, 2H), 3,69 (s, 3H). (d, J=6,7Гц, 3H). Приклад 26 Приклад 23 1-[(6-Aмiнoпipидин-3-iл)мeτил-3-{[4Етил {3-[(4-метоксифеніл)аміно]-2,5-діоксо-4(дифлyopмeτoкcи)dpeнiл]aмiнo}-4-фeнiл-1H-пipoлфеніл-2,5-дигідро-1Н-пірол-1-іл}ацетат 2,5-діон До розчину 3-[(4-метоксифеніл)аміно]-4-фенілСуміш трет-бутил {5-[(3-хлор-2,5-діоксо-41Н-пірол-2,5-діону (0,34ммоль, 100мг) у сухому феніл-2,5-дигідро-1Н-пірол-1-іл)метил]піридин-2ТГФ (1,0мл) в атмосфері азоту при кімнатній іл} карбамату (0,70г, 1,7ммоль) та 4температурі додавали етил гліколят (0,34ммоль, {дифлуорметокси)-аніліну (0,54г, 3,4ммоль) у ДМФ 35мг). Реакційну суміш охолоджували до 0°С та (4мл) нагрівали у мікрохвильовому реакторі при додавали трибутилфосфін (0,17ммоль, 34мг), а 150°С протягом 8 хвилин. Розчинник випарювали потім 1,1'-(азодикарбоніл)дипіперидин (036ммоль, та залишок очищали на колонці (IsoluteÒ SI, 84мг). Після перемішування при 0°С протягом 10 10г/70мл), застосуванням СН2СІ 2, а тоді хвилин., реакційну суміш доводили до кімнатної СН3ОН/СН2СІ 2 (1:99, 2:98 та тоді 5:95) як елюенту, температури та перемішування продовжували отримуючи 0,4г (54%) заголовної сполуки. протягом 26 годин. Реакційну суміш розбавляли 1 сумішшю СН3СN:вода 1:1 (2мл) та очищали Н ЯМР (400МГц, CDCI 3) d 7,99 (bs, 1H), 7,67застосуванням ВЕРХ (95% 0,1Μ амоній ацетатний 7-62 (m, 2H), 7,14-7,04 (m, 3H), 6,91 (d, J =8Гц, 2Н), буфер: 5% CH3CN®100% CH3CN, 38,5мм, 6,78 (d, J=8Гц, 1Н), 6,72 (d, J=9Гц, 2Н), 6,63 (d, J=9Гц, 2Н), 6,33 (t, J=74Гц, 1H), 4,60 (s, 2H). 25мл/хвилину), отримуючи 53мг (41%) заголовної Приклад 27. сполуки. 1-[(6-Амінопіридин-3-іл)метил]-3-[(4-морфолін4-ілфеніл)аміно]-4-феніл-1Н-пірол-1-2,5-діон 41 82109 42 застосовували в експериментах котрансфекції Суміш трет-бутил {5-[(3-хлор-2,5-діоксо-4разом з репортерною люциферазною плазмідою феніл-2,5-дигідро-1Н-пірол-1-іл)метил]піридин-2pGL3, що містить мінімальний промотер SV40 та іл}карбамату (0,85г, 2,06ммоль) та 4п'ять копій сайтів розпізнавання UAS GAL4. 2,5мкг морфоліноаміну (0,73г, 4,12ммоль) у ДМФ (4мл) pSGGAL-ХРПальфа або бета були змішані з 25мкг нагрівали у мікрохвильовому реакторі при 150°С pGL3 5xUAS та 22,5мкг pBluscript у 0,95мл протягом 10 хвилин. Препаративна ВЕРХ (С18, охолодженого PBS, що вмістить приблизно 4-9 milj 50´250мм, 60% 0,1Μ амоній ацетатний буфер: клітин остеосаркоми U2/OS. Після п'яти хвилин 40% CH3CN®100% CH3CN) дала 039г (42%) інкубації на льоді суміш клітини/ДНК було заголовної сполуки. 1 електропоровано у кюветі 0,4см при 960мкФ. 230 V Н ЯМР (400МГц, CDCI 3) d 8,14 (bs, 1Н),7,55 застосуванням електропоратора BioRad та (dd, J=S, 2Гц, 1H), 7,28-7,23 (m, 1H), 7,13-7,04 (m, розбавлено до 0,32 milj клітин/мл у повному 3H), 6,95 (dd, J=8,2Гц, 2H), 6,57-6,51 (m, 4H), 6,44 середовищі МДСІ (модифіковане Дульбекко (d, J=8Гц, 1Н), 4,62 (s, 2H), 4,62-4,53 (br, 2H), 3,81середовище Ігла) (Glbco 31966-021), Клітини від 3,79 (m,4H), 3,01-2,98 (m, 4H). принаймні двох електропорацій об'єднували для Біологічна активність запобігання варіацій між різними Аналіз коактиваторного поповнення електропораціями, 25мкл розбавлених Домен зв'язування ліганду (ДЗЛ) ХРПальфа електропорованих клітин засівали на 384-коміркові (амінокислоти 205-447) та ХРПбета (амінокислот планшети (0,8´104 клітини/комірку) та клітинам 216-461) людини отримували рекомбінантними давали прилипати протягом 2 годин при 37°С, 5% способами у Ε coli. Фрагмент коактиватору-1 СО2 в інкубаторі культивування клітин. Планшети стероїдного рецептору людини (КСР-1) для розбавлення зі сполуками у ДМСО далі отримували як синтетичний пептид. Анти-6Ніsрозбавляли МДСІ без фенол-червоного (Gibco антитіло, сполучене з європієм (Еu3+), 11880-028), з вмістом 10% СЗТ (сироватка зародка застосовували для розпізнавання His-закінчення теляти), 1% ПЕСТ (Пеніцилін-Стрептоміцин), 20мМ на ХРП-ДЗЛ та алофікоціанін (АФЦ), сполучений зі Гепес, 2мМ L-Глутамін та 0,36% Глюкоза (2,5мклстрептавідином, застосовували для розпізнавання 97,5мкл) для зменшення концентрації ДМСО. 7мкл біотинілованого КСР-1. Агоніст зв'язування з цього додавали до електропорованих клітин у 384ХРПальфа або ХРПбета посилює афінитет ХРП коміркових планшетах та інкубацію продовжували стосовно КСР-1 та тим приводить Еu3+ та АФЦ у протягом 48 годин в інкубаторі культивування сполучення. Еu3+ збуджується при 337нм та клітини, після чого клітини лізували додаванням випромінює світло при 620нм. Ця емісія при 32мкл/комірку субстрату люциферази LacLite. сполученні, збуджує АФЦ для випромінювання Люциферазну активність вимірювали світла при 665нм. застосуванням протоколу "Luminescence 384 Планшети для розбавлення зі сполуками у protocol" у зчитувачі Wallac Victor після 15 хвилин, ДМСО далі розбавляли у буфері {20мМ інкубації при кімнатній температурі. ХРП ліганд, [Трис(гідроксиметил)амінометан] рН 7,5, 0,125% TularikT0901317, при 1мкМ застосовували як 100% CHAPS {3-[(3-холамідопропіл)диметиламіноніо]-1контроль. пропансульфонат}, 2мМ ДТТ (Дитіотреїтол) та Сполуки формули І мають ЕК50 менше 0,05% BSA (альбумін бичачої сироватки)} для мкмоль/л для ХРПальфа та/або бета у аналізах зменшення концентрації ДМСО з 0,5мкл до коактиваторного поповнення та/або аналізах 13,5мкл. До цього додавали 6мкл суміші для репортерних генів, наприклад, сполуки з прикладів аналізу та планшети (384-коміркові V-жолобкові 13 та 22 мали ЕК50 0,15мкмоль/л та 0,11мкмоль/л планшети) інкубували при кімнатній температурі в аналізах коактиваторного поповнення, протягом 60-80 хвилин. Суміш для аналізу має відповідно. наступні кінцеві концентрації: суміш ХРПальфа: На додаток, сполуки заявленого винаходу 0,06мкг/мл міченого Eu анти-6xHis-Ab, 1,15мкг/мл виявляють поліпшені фізичні та/або хімічні та/або Стрептавідин АФЦ, 30нМ пептид КСР-1 та властивості МЛФК (метаболізм ліків та 0,9мкг/мл ХРПальфа у буфері, та суміш ХРПбета: фармакокінетика), наприклад, вони виявляють 0,06мкг/мл міченого Eu анти-6хНіs-Аb, 1,15мкг/мл поліпшену метаболічну стабільність in vitro, та/або Стрептавідин АФЦ, 90нМ пептид КСР-1 та виявляють сприятливу фармакологічну дію in vivo. 0,2мкг/мл ХРПбета у буфері. Розділені у часі Сполуки також мають багатообіцяючий зчитування флуоресценції були надані у зчитувачі токсикологічний профіль. Wallac Victor при 665нм, а потім зчитування при 615нм. ХРП ліганд, 22-R Гідроксихолестерин при 50мкМ застосовували як 100% контроль. Аналіз трансактивації Експресійні вектори отримували вставкою домену зв'язування ліганду кДНК (комплементарна ДНК) ХРПальфа (амінокислота 205-447) та ХРПбета (амінокислота 216-461) людини у рамці з, 3' стосовно GAI-4-домену зв'язування фактору транскрипції ДНК дріжджів та ядерного сигналу локалізації від Т-антигену вірусу поліоми в евкаріотному експресійному векторі pSG5 (Stratagene). Утворені експресійні вектори pSGGAL-ХРПальфа та pSGGAL-ХРПбета
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrole-2, 5-dione derivatives as liver x receptor modulators
Автори англійськоюBrickmann Kay, Holm Patrik, Sandberg Pernilla, Swanson Marianne, WESTERLUND CHRISTER
Назва патенту російськоюПроизводные пиррол-2,5-дитиона как модуляторы х-рецептора печени
Автори російськоюВрикманн Кай, Голм Патрик, Сандберг Пернилла, Свансон Марианне, Вестерлунд Кристер
МПК / Мітки
МПК: A61P 25/28, C07D 401/06, A61K 31/4025, A61P 3/10, A61K 31/4439, C07D 207/416, C07D 405/06
Мітки: х-рецептора, похідні, пірол-2,5-дитіону, печінки, модулятори
Код посилання
<a href="https://ua.patents.su/21-82109-pokhidni-pirol-25-ditionu-yak-modulyatori-kh-receptora-pechinki.html" target="_blank" rel="follow" title="База патентів України">Похідні пірол-2,5-дитіону як модулятори х-рецептора печінки</a>
Попередній патент: Похідні пірол-2,5-дитіону як модулятори х-рецептора печінки
Наступний патент: Спосіб одержання каталізаторів на підкладці
Випадковий патент: Виливниця для виливання чушок












