Похідні хінуклідинаміду
Формула / Реферат
1. Сполука, яка є похідною хінуклідинаміду формули (І)
 , (I)
, (I)
де R1 означає водень або необов'язково заміщену (нижч.)алкільну групу з прямим
або розгалуженим ланцюгом, R2 означає групу формули i) або ii)
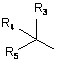 , i)
, i)
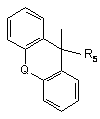 , ii)
, ii)
де
R3 означає групу, вибрану з ряду феніл, 2-фурил, 3-фурил, 2-тієніл або 3-тієніл,
R4 означає групу, вибрану з ряду необов'язково заміщений (нижч.)алкіл, необов'язково заміщений (нижч.)алкеніл, необов'язково заміщений (нижч.)алкініл, циклоалкіл, циклоалкілметил, феніл, бензил, фенетил, 2-фурил, 3-фурил, 2-тієніл або 3-тієніл,
а R5 означає водень або гідрокси, метил або –СН2ОН групу,
бензольні цикли у формулі ii) і циклічні групи R3 і R4 кожна незалежно і необов'язково заміщені одним, двома або трьома замісниками, вибраними з групи, яка включає галоген, необов'язково заміщений (нижч.)алкіл з прямим або розгалуженим ланцюгом, гідрокси, необов'язково заміщений (нижч.)алкокси з прямим або розгалуженим ланцюгом, нітрогрупу, ціаногрупу, -CO2R' або -NR'R", де R' і R" кожен незалежно означає водень або необов'язково заміщений (нижч.)алкіл з прямим або розгалуженим ланцюгом, або R' і R" разом з атомом, до якого вони приєднані, утворюють циклічну групу,
Q означає простий зв'язок або –СН2-, -СН2-СН2-, -O-, -О-СН2-, -S-, -S-CH2- або групу -СН=СН-,
p дорівнює 1 або 2, а амідна група розташована в положеннях 2, 3 або 4
азабіциклічного циклу,
або фармацевтично прийнятні солі вказаної сполуки, у тому числі солі четвертинного амонію,
і всі її індивідуальні стереоізомери і їх суміші,
за умови, що, якщо р дорівнює 2, амідна група розташована в положенні 3 хінуклідинового циклу, R1 означає водень, а R3 і R4 обидва означають незаміщений феніл, то
- якщо вказана сполука не означає фармацевтично прийнятну сіль або означає гідрохлорид, то R5 не означає водень або гідрокси, і
- якщо вказана сполука означає сіль четвертинного амонію, який містить метильну групу, приєднану до атома азоту хінуклідинового циклу, то R5 не означає гідрокси.
2. Сполука за п. 1, яка є сіллю четвертинного амонію формули (II)
 , (II)
, (II)
де R1, R2 і р мають значення, вказані в п. 1,
m означає ціле число від 0 до 8,
n означає ціле число від 0 до 4,
А означає групу, вибрану з ряду -CH2, -CH=CR'-, -CR'=CH-, -CR'R"-, -C(O)-, -O-, -S-, -S(O)-, -S(O)2- і -NR'-, де R' і R" мають значення, вказані в п. 1, R6 означає водень або групу, вибрану з ряду необов'язково заміщений
(нижч.)алкіл з прямим або розгалуженим ланцюгом, гідрокси, необов'язково заміщений (нижч.)алкокси з прямим або розгалуженим ланцюгом, ціаногрупу, нітрогрупу, -CH=CR'R", -C(O)OR', -OC(O)R' -SC(O)R', -C(O)NR'R", -NR'C(O)OR", -NR'C(O)NR", циклоалкіл, феніл, нафталініл, 5,6,7,8-тетрагідронафталініл, бензо[1,3]діоксоліл, гетероарил або гетероцикліл; R' і R" мають значення, вказані в п. 1; і де циклічні групи R6 незалежно заміщені одним, двома або трьома замісниками, вибраними з групи, яка включає галоген, гідрокси, необов'язково заміщений (нижч.)алкіл з прямим або розгалуженим ланцюгом, феніл, -OR', -SR', -NR'R", -NHCOR', -CONR'R", -CN, -NO2 і -COOR'; R' і R" мають значення, вказані в п. 1,
X- означає фармацевтично прийнятний аніон моно- або полівалентної кислоти, і всі індивідуальні стереоізомери і їх суміші,
за умови, що, якщо р дорівнює 2, амідна група розташована в положенні 3 хінуклідинового циклу, R1 означає водень, а R3 і R4 обидва означають незаміщений феніл, R5 означає гідрокси, то в сполуках формули (II) фрагмент R6-(СН2)n-А-(СН2)m- не означає метильну групу.
3. Сполука за п. 1 або 2, де R1означає водень, метил або етил.
4. Сполука за п. 3, де R1 означає водень.
5. Сполука за будь-яким з пп. 1-4, де R2 означає групу формули i), де R3 означає групу, вибрану з ряду феніл, 2-тієніл, 3-тієніл або 2-фурил, необов'язково заміщену одним або більше атомами галогену.
6. Сполука за п. 5, де R2 означає групу формули i), де R3 означає феніл, 2-тієніл або 2-фурил, необов'язково заміщену одним або більше атомами галогену.
7. Сполука за будь-яким з пп. 5-6, де R2 означає групу формули i), де R3 означає феніл або 2-тієніл.
8. Сполука за будь-яким з пп. 1-7, де R4 означає групу з прямим ланцюгом, вибрану з ряду етил, н-бутил, вініл, аліл, 1-пропеніл і 1-пропініл, або групу, вибрану з ряду циклопентил, циклогексил, феніл, бензил, фенетил, 2-тієніл і 3-фурил, необов'язково заміщену одним або більше атомами галогену, метильними або метоксигрупами.
9. Сполука за п. 8, де R4 означає групу з прямим ланцюгом, вибрану з ряду етил, н-бутил, вініл, аліл і 1-пропініл, або групу, вибрану з ряду циклопентил, феніл, бензил, фенетил і 2-тієніл, необов'язково заміщену одним або більше атомами галогену, метильними або метоксигрупами.
10. Сполука за будь-яким з пп. 8-9, де R4 означає групу, вибрану з ряду етил, н-бутил, вініл, аліл, циклопентил, феніл, бензил або 2-тієніл.
11. Сполука за будь-яким з пп. 1-4, де R2 означає групу формули ii), де Q означає простий зв'язок або атом кисню.
12. Сполука за будь-яким з вищевказаних пунктів, де R5 означає водень або гідрокси.
13. Сполука за будь-яким з вищевказаних пунктів, де р дорівнює 2, а амідна група розташована в положеннях 3 або 4 азабіциклічного циклу.
14. Сполука за п. 13, де амідна група розташована в положенні 3 азабіциклічного циклу.
15. Сполука формули (II) за будь-яким з пп. 2-14, де m означає ціле число від 0 до 6, а n означає ціле число від 0 до 4; А означає групу, вибрану з ряду -СН2-, -СН=СН-, -O-, -С(O)-, -NR'- і -S-; a R6; означає водень, ціаногрупу, нітрогрупу, -C(O)OR', -OC(O)R', -SC(O)R', -CH=CH2, -CH=CR'R", C(O)NR'R", С1-С4алкільну групу з прямим або розгалуженим ланцюгом, необов'язково заміщену одним або більше атомами галогену, С1-С4алкоксигрупу з прямим ланцюгом, необов'язково заміщену одним або більше атомами або галогену гідроксигрупами, або циклічну групу, необов'язково заміщену одним або більше замісниками, вибраними з атомів галогену, груп формули -C(O)NR'R" і метильних, гідрокси, нітро і фенільних груп, причому циклічну групу вибирають з ряду циклогексил, феніл, 5,6,7,8-тетрагідронафталініл, 2-тієніл, 1-піролідиніл, 1-піроліл, бензо[1,3]діоксоліл, 2-бензотіазоліл, нафталініл і діоксоліл.
16. Сполука за п. 15, де m означає ціле число від 0 до 5, а n означає ціле число від 0 до 2; А означає групу, вибрану з ряду -СН2-, -СН=СН-, -O-, -С(O)-, -NR' і -S-; а R6 означає водень, ціаногрупу, -C(O)OR', -OC(O)R', -SC(O)R', -СН=СН2, -C(O)NR'R", С1-С4алкільну групу з прямим або розгалуженим ланцюгом, трифторметил, або циклічну групу, вибрану з ряду циклогексил, 5,6,7,8-тетрагідронафталініл, 2-тієніл, 1-піроліл, бензо[1,3]діоксоліл, 2-бензотіазоліл, нафталініл, діоксоліл і феніл, який необов'язково заміщений одним або більше замісниками, вибраними з групи, яка включає галоген, групи формули -C(O)NR'R", метильних, гідрокси і фенільних груп.
17. Сполука за будь-яким з п. 15 і 16, де m означає ціле число від 0 до 5, а n означає ціле число від 0 до 2; А означає групу, вибрану з ряду –СН2-, -СН=СН-, -O-, a R6 вибирають з ряду водень, С1-С4алкіл із прямим ланцюгом, -СН=СН2, циклогексил, феніл, незаміщений або заміщений одним або двома замісниками, вибраними з ряду метил, гідрокси, 5,6,7,8-тетрагідронафталініл і 2-тієніл.
18. Сполука за п. 17, де фрагмент R6-(СН2)n-А-(СН2)m- означає метил, 3-феноксипропіл, 3-(3-гідроксифенокси)пропіл, аліл, гептал, 3-фенілпропіл, 3-фенілаліл, 2-феноксіетил, 2-бензилоксіетил, циклогексилметил, 3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл, 5-(2,6-диметилфенокси)пентил, 3-тієн-2-ілпропіл або 3-циклогексилпропіл, а X- означає бромід або трифторацетат.
19. Сполука за будь-яким з вищевказаних пунктів, яка означає індивідуальний ізомер.
20. Сполука за п. 1 або 2, вибрана з наступних сполук:
N-(1-азабіцикло[2.2.2]окт-3-ил)-2-гідрокси-2,2-дитієн-2-ілацетамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2,2-дитієн-2-ілацетамід,
N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2,2-дитієн-2-ілацетамід,
N- [(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2,2-дитієн-2-ілацетамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-циклопентил-2-гідрокси-2-тієн-2-ілацетамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2-тієн-2-ілпент-4-енамід,
(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2-тієн-2-ілбутанамід (діастереомер 1),
(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2-тієн-2-ілбутанамід (діастереомер 2),
(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2-тієн-2-ілбут-3-
енамід (діастереомер 1),
(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2-тієн-2-ілбут-3-
енамід (діастереомер 2),
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2,3-дифенілпропанамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-циклопентил-2-гідрокси-2-
фенілацетамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-фенілгексанамід,
N-(1-азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9-карбоксамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9-карбоксамід,
N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9-карбоксамід,
N-(1-азабіцикло[2.2.2]окт-3-ил)-9-гідрокси-9Н-флуорен-9-карбоксамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-N-метил-9Н-ксантен-9-карбоксамід,
(2S)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-циклопентил-2-гідрокси-2-тієн-
2-ілацетамід,
бромід 3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-метил-1-азонійбіцикло[2.2.2]октану,
бромід 3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-метил-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-1-аліл-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-1-гептил-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(3-фенілпропіл)-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-((Е)-3-фенілаліл)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(2-феноксіетил)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-[3-(3-гідроксифенокси)пропіл]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3R)-1-(2-бензилоксіетил)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-азонійбіцикло [2.2.2]октану,
бромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(3-тієн-2-ілпропіл)-1-азонійбіцикло[2.2.2] октану,
бромід (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1-(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-(2,2-дитієн-2-ілацетиламіно)-1-(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану,
бромід 1-метил-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
бромід 1-(3-феноксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-1-(3-феноксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-аліл-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-гептил-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-циклогексилметил-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-(3-циклогексилпропіл)-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
бромід (3S)-1-(3-феноксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-[3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
трифторацетат (3S)-1-[5-(2,6-диметилфенокси)пентил]-3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
бромід 3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-метил-1-азонійбіцикло[2.2.2]октану,
бромід 3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-1-[3-(2-карбамоїлфенокси)пропіл]-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-1-[4-(4-фторфеніл)-4-оксобутил]-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-азонійбіцикло[2.2.2]октану,
хлорид (3R)-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-[3-(метилфеніламіно)пропіл]-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1-(3-фенілсульфанілпропіл)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-[метил-(9Н-ксантен-9-ілкарбоніл)аміно]-1-(3-пірол-1-ілпропіл)-1-азонійбіцикло[2.2.2]октану,
хлорид (3R)-1-[3-(дифеніл-4-ілокси)пропіл]-3-[метил-(9Н-ксантен-9-карбоніл)аміно]-1-азонійбіцикло[2.2.2]октану,
хлорид (3R)-3-(2-фур-2-ил-2-гідроксипент-3-иноїламіно)-1-[3-(нафталін-1-ілокси)пропіл]-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-3-(2-фур-2-ил-2-гідроксипент-3-иноїламіно)-1-азонійбіцикло[2.2.2]октану,
хлорид (3R)-1-[3-(бензотіазол-2-ілокси)пропіл]-3-(2-фур-2-ил-2-гідроксипент-3-иноїламіно)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетил]аміно}-1-(2-гідроксіетил)-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетил]аміно}-1-(2-етоксіетил)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетил]аміно}-1-(4,4,4-трифторбутил)-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-1-(4-ацетоксибутил)-3-[2-(5-бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2-гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-3-[2-(5-бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2-гідроксіацетиламіно]-1-(4-етоксикарбонілбутил)-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-1-(3-ацетилсульфанілпропіл)-3-[2-(5-бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2-гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-1-(3-ціанопропіл)-3-[2-фур-2-ил-2-гідрокси-4-(4-метоксифеніл)бутириламіно]-1-азонійбіцикло[2.2.2]октану,
форміат (3R)-1-(2-карбамоїлетил)-3-[2-фур-2-ил-2-гідрокси-4-(4-метоксифеніл)бутириламіно]-1-азонійбіцикло[2.2.2]октану,
бромід (3R)-1-(2-[1,3]діоксолан-2-ілетил)-3-[2-фур-2-ил-2-гідрокси-4-(4-метоксифеніл)бутириламіно]-1-азонійбіцикло[2.2.2]октану.
21. Спосіб одержання сполуки формули (І) за п. 1, де R2 означає групу формули i), a R5 означає гідроксигрупу, за яким проводять взаємодію сполуки формули (V)
 , (V)
, (V)
де R1 і R3 мають значення, вказані в п. 1, з відповідною металоорганічною сполукою R4-[Mg,Li], де R4 має значення, вказані в п. 1.
22. Сполука формули (V), вибрана з ряду
N-1-азабіцикло[2.2.2]окт-3-ил-2-оксо-2-тієн-2-ілацетамід,
N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-2-ілацетамід,
N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-2-ілацетамід.
23. Спосіб одержання сполуки формули (II) за п. 2, за яким проводять взаємодію сполуки формули (І) за п. 1 з алкілувальним агентом формули R6-(CH2)n-A-(CH2)m-W, де R6, n, А і m мають значення, вказані в п. 2, a W означає будь-яку придатну групу, яка вилучається.
24. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-20, у суміші з фармацевтично прийнятним носієм або розріджувачем.
25. Сполука за будь-яким з пп. 1-20 для лікування патологічного стану або захворювання, інтенсивність симптомів якого знижується завдяки антагоністичному впливу на мускаринові рецептори МЗ.
26. Застосування сполуки за будь-яким з пп. 1-20 для одержання лікарського засобу, призначеного для лікування патологічного стану або захворювання, інтенсивність симптомів якого знижується завдяки антагоністичному впливу на мускаринові рецептори МЗ.
27. Застосування за п. 26, де патологічний стан означає респіраторне, урологічне або шлунково-кишкове захворювання або порушення.
28. Спосіб лікування суб'єкта, який страждає від патологічного стану або захворювання, що є чутливими до покращення шляхом антагонізму мускаринових рецепторів МЗ, при якому вказаному суб’єкту вводять ефективну кількість сполуки за будь-яким з пунктів 1-20.
29. Спосіб за п. 28, де патологічний стан означає респіраторне, урологічне або шлунково-кишкове захворювання або порушення.
30. Комбінований продукт, який містить (1) сполуку за будь-яким з пп. 1-20 і (2) іншу сполуку, ефективну при лікуванні респіраторного, урологічного або шлунково-кишкового захворювання або порушення при одночасному, окремому або послідовному застосуванні.
31. Комбінований продукт за п. 30, який містить (1) сполуку за будь-яким з пп. 1-20 і (2) агоніст ![]() ; стероїд, антиалергічний засіб, інгібітор фосфодіестерази IV і/або антагоніст лейкотриєну D4 (LTD4) при одночасному, окремому або послідовному застосуванні при лікуванні респіраторного захворювання.
; стероїд, антиалергічний засіб, інгібітор фосфодіестерази IV і/або антагоніст лейкотриєну D4 (LTD4) при одночасному, окремому або послідовному застосуванні при лікуванні респіраторного захворювання.
Текст
1. Сполука, яка є похідною хінуклідинаміду формули (І) R1 2 (19) 1 3 80832 4 гідрохлорид, то R5 не означає водень або гідрокси, феніл, бензил, фенетил, 2-тієніл і 3-фурил, і необов'язково заміщену одним або більше якщо вказана сполука означає сіль атомами галогену, метильними або четвертинного амонію, який містить метильну метоксигрупами. групу, приєднану до атома азоту хінуклідинового 9. Сполука за п. 8, де R4 означає групу з прямим циклу, то R5 не означає гідрокси. ланцюгом, вибрану з ряду етил, н-бутил, вініл, аліл 2. Сполука за п. 1, яка є сіллю четвертинного і 1-пропініл, або групу, вибрану з ряду амонію формули (II) циклопентил, феніл, бензил, фенетил і 2-тієніл, необов'язково заміщену одним або більше R1 атомами галогену, метильними або X N R2 метоксигрупами. + 10. Сполука за будь-яким з пп. 8-9, де R4 означає (CH2)n A (CH2 )m N R6 групу, вибрану з ряду етил, н-бутил, вініл, аліл, (CH2)p O циклопентил, феніл, бензил або 2-тієніл. 11. Сполука за будь-яким з пп. 1-4, де R2 означає , (II) групу формули ii), де Q означає простий зв'язок де R1, R2 і р мають значення, вказані в п. 1, або атом кисню. m означає ціле число від 0 до 8, 12. Сполука за будь-яким з вищевказаних пунктів, n означає ціле число від 0 до 4, де R5 означає водень або гідрокси. А означає групу, вибрану з ряду -CH2, -CH=CR'-, 13. Сполука за будь-яким з вищевказаних пунктів, CR'=CH-, -CR'R"-, -C(O)-, -O-, -S-, -S(O)-, -S(O)2- і де р дорівнює 2, а амідна група розташована в NR'-, де R' і R" мають значення, вказані в п. 1, R6 положеннях 3 або 4 азабіциклічного циклу. означає водень або групу, вибрану з ряду 14. Сполука за п. 13, де амідна група розташована необов'язково заміщений в положенні 3 азабіциклічного циклу. (нижч.)алкіл з прямим або розгалуженим 15. Сполука формули (II) за будь-яким з пп. 2-14, ланцюгом, гідрокси, необов'язково заміщений де m означає ціле число від 0 до 6, а n означає (нижч.)алкокси з прямим або розгалуженим ціле число від 0 до 4; А означає групу, вибрану з ланцюгом, ціаногрупу, нітрогрупу, -CH=CR'R", ряду -СН2-, -СН=СН -, -O-, -С(O)-, -NR'- і -S-; a R6; C(O)OR', -OC(O)R' -SC(O)R', -C(O)NR'R", означає водень, ціаногрупу, нітрогрупу, -C(O)OR', NR'C(O)OR", -NR'C(O)NR", циклоалкіл, феніл, OC(O)R', -SC(O)R', -CH=CH2, -CH=CR'R", нафталініл, 5,6,7,8-тетрагідронафталініл, C(O)NR'R", С1-С4алкільну групу з прямим або бензо[1,3]діоксоліл, гетероарил або гетероцикліл; розгалуженим ланцюгом, необов'язково заміщену R' і R" мають значення, вказані в п. 1; і де циклічні одним або більше атомами галогену, С1групи R6 незалежно заміщені одним, двома або С4алкоксигрупу з прямим ланцюгом, необов'язково трьома замісниками, вибраними з групи, яка заміщену одним або більше атомами або галогену включає галоген, гідрокси, необов'язково гідроксигрупами, або циклічну групу, необов'язково заміщений (нижч.)алкіл з прямим або заміщену одним або більше замісниками, розгалуженим ланцюгом, феніл, -OR', -SR', -NR'R", вибраними з атомів галогену, груп формули -NHCOR', -CONR'R", -CN, -NO2 і -COOR'; R' і R" C(O)NR'R" і метильних, гідрокси, нітро і фенільних мають значення, вказані в п. 1, груп, причому циклічну групу вибирають з ряду X- означає фармацевтично прийнятний аніон циклогексил, феніл, 5,6,7,8-тетрагідронафталініл, моноабо полівалентної кислоти, і всі 2-тієніл, 1-піролідиніл, 1-піроліл, індивідуальні стереоізомери і їх суміші, бензо[1,3]діоксоліл, 2-бензотіазоліл, нафталініл і за умови, що, якщо р дорівнює 2, амідна група діоксоліл. розташована в положенні 3 хінуклідинового циклу, 16. Сполука за п. 15, де m означає ціле число від 0 R1 означає водень, а R3 і R4 обидва означають до 5, а n означає ціле число від 0 до 2; А означає незаміщений феніл, R5 означає гідрокси, то в групу, вибрану з ряду -СН2-, -СН=СН-, -O-, -С(O)-, сполуках формули (II) фрагмент R6-(СН2)n-АNR' і -S-; а R6 означає водень, ціаногрупу, (СН2)m- не означає метильну групу. C(O)OR', -OC(O)R', -SC(O)R', -СНН 2, С = 3. Сполука за п. 1 або 2, де R1означає водень, C(O)NR'R", С1-С4алкільну групу з прямим або метил або етил. розгалуженим ланцюгом, трифторметил, або 4. Сполука за п. 3, де R1 означає водень. циклічну групу, вибрану з ряду циклогексил, 5. Сполука за будь-яким з пп. 1-4, де R2 означає 5,6,7,8-тетрагідронафталініл, 2-тієніл, 1-піроліл, групу формули i), де R3 означає групу, вибрану з бензо[1,3]діоксоліл, 2-бензотіазоліл, нафталініл, ряду феніл, 2-тієніл, 3-тієніл або 2-фурил, діоксоліл і феніл, який необов'язково заміщений необов'язково заміщену одним або більше одним або більше замісниками, вибраними з атомами галогену. групи, яка включає галоген, групи формули 6. Сполука за п. 5, де R2 означає групу формули i), C(O)NR'R", метильних, гідрокси і фенільних груп. де R3 означає феніл, 2-тієніл або 2-фурил, 17. Сполука за будь-яким з п. 15 і 16, де m означає необов'язково заміщену одним або більше ціле число від 0 до 5, а n означає ціле число від 0 атомами галогену. до 2; А означає групу, вибрану з ряду –СН2-, 7. Сполука за будь-яким з пп. 5-6, де R2 означає СН = СН-, -O-, a R6 вибирають з ряду водень, С1групу формули i), де R3 означає феніл або 2-тієніл. С4алкіл із прямим ланцюгом, -СНН 2, С = 8. Сполука за будь-яким з пп. 1-7, де R4 означає циклогексил, феніл, незаміщений або заміщений групу з прямим ланцюгом, вибрану з ряду етил, нодним або двома замісниками, вибраними з ряду бутил, вініл, аліл, 1-пропеніл і 1-пропініл, або групу, вибрану з ряду циклопентил, циклогексил, 5 80832 6 трифторацетат (3R)-1-аліл-3-(2-гідрокси-2,2метил, гідрокси, 5,6,7,8-тетрагідронафталініл і 2дитієн-2-ілацетиламіно)-1тієніл. азонійбіцикло[2.2.2]октану, 18. Сполука за п. 17, де фрагмент R6-(СН2)n-Атрифторацетат (3R)-1-гептил-3-(2-гідрокси-2,2(СН2)m- означає метил, 3-феноксипропіл, 3-(3дитієн-2-ілацетиламіно)-1гідроксифенокси)пропіл, аліл, гептал, 3азонійбіцикло[2.2.2]октану, фенілпропіл, 3-фенілаліл, 2-феноксіетил, 2бромід (3R)-3-(2-гідрокси-2,2-дитієн-2бензилоксіетил, циклогексилметил, 3-(5,6,7,8ілацетиламіно)-1-(3-фенілпропіл)-1тетрагідронафталін-2-ілокси)пропіл, 5-(2,6азонійбіцикло[2.2.2]октану, диметилфенокси)пентил, 3-тієн-2-ілпропіл або 3трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2циклогексилпропіл, а X- означає бромід або ілацетиламіно)-1-((Е)-3-фенілаліл)-1трифторацетат. азонійбіцикло[2.2.2]октану, 19. Сполука за будь-яким з вищевказаних пунктів, бромід (3R)-3-(2-гідрокси-2,2-дитієн-2яка означає індивідуальний ізомер. ілацетиламіно)-1-(2-феноксіетил)-120. Сполука за п. 1 або 2, вибрана з наступних азонійбіцикло[2.2.2]октану, сполук: бромід (3R)-3-(2-гідрокси-2,2-дитієн-2N-(1-азабіцикло[2.2.2]окт-3-ил)-2-гідрокси-2,2ілацетиламіно)-1-(3-феноксипропіл)-1дитієн-2-ілацетамід, азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2,2трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2дитієн-2-ілацетамід, ілацетиламіно)-1-[3-(3-гідроксифенокси)пропіл]-1N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2,2азонійбіцикло[2.2.2]октану, дитієн-2-ілацетамід, трифторацетат (3R)-1-(2-бензилоксіетил)-3-(2N- [(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2,2-дитієн-2гідрокси-2,2-дитієн-2-ілацетиламіно)-1ілацетамід, азонійбіцикло [2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2бромід (3R)-3-(2-гідрокси-2,2-дитієн-2циклопентил-2-гідрокси-2-тієн-2-ілацетамід, ілацетиламіно)-1-(3-тієн-2-ілпропіл)-1N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2азонійбіцикло[2.2.2] октану, тієн-2-ілпент-4-енамід, бромід (3S)-3-(2-гідрокси-2,2-дитієн-2(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксиілацетиламіно)-1-(3-феноксипропіл)-12-тієн-2-ілбутанамід (діастереомер 1), азонійбіцикло[2.2.2]октану, (2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксибромід (3R)-3-(2,2-дитієн-2-ілацетиламіно)-1-(32-тієн-2-ілбутанамід (діастереомер 2), феноксипропіл)-1-азонійбіцикло[2.2.2]октану, (2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксибромід 1-метил-3-[(9Н-ксантен-9-ілкарбоніл)аміно]2-тієн-2-ілбут-31-азонійбіцикло[2.2.2]октану, енамід (діастереомер 1), бромід 1-(3-феноксипропіл)-3-[(9Н-ксантен-9(2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксиілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, 2-тієн-2-ілбут-3бромід (3R)-1-(3-феноксипропіл)-3-[(9Н-ксантен-9енамід (діастереомер 2), ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2,3трифторацетат (3S)-1-аліл-3-[(9Н-ксантен-9дифенілпропанамід, ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2трифторацетат (3S)-1-гептил-3-[(9Н-ксантен-9циклопентил-2-гідрокси-2ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, фенілацетамід, трифторацетат (3S)-1-циклогексилметил-3-[(9НN-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2ксантен-9-ілкарбоніл)аміно]-1фенілгексанамід, азонійбіцикло[2.2.2]октану, N-(1-азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9трифторацетат (3S)-1-(3-циклогексилпропіл)-3карбоксамід, [(9Н-ксантен-9-ілкарбоніл)аміно]-1N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9азонійбіцикло[2.2.2]октану, карбоксамід, бромід (3S)-1-(3-феноксипропіл)-3-[(9Н-ксантен-9N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, карбоксамід, трифторацетат (3S)-1-[3-(5,6,7,8N-(1-азабіцикло[2.2.2]окт-3-ил)-9-гідрокси-9Нтетрагідронафталін-2-ілокси)пропіл]-3-[(9Нфлуорен-9-карбоксамід, ксантен-9-ілкарбоніл)аміно]-1N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-N-метил-9Назонійбіцикло[2.2.2]октану, ксантен-9-карбоксамід, трифторацетат (3S)-1-[5-(2,6(2S)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2диметилфенокси)пентил]-3-[(9Н-ксантен-9циклопентил-2-гідрокси-2-тієнілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, 2-ілацетамід, бромід 3-{[(9-гідрокси-9Н-флуорен-9бромід 3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1іл)карбоніл]аміно}-1-метил-1метил-1-азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, бромід 3-(2-гідрокси-2,2-дитієн-2-ілацетиламіно)-1бромід 3-{[(9-гідрокси-9Н-флуорен-9(3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану, іл)карбоніл]аміно}-1-(3-феноксипропіл)-1трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2азонійбіцикло[2.2.2]октану, ілацетиламіно)-1-метил-1форміат (3R)-1-[3-(2-карбамоїлфенокси)пропіл]-3азонійбіцикло[2.2.2]октану, {[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1азонійбіцикло[2.2.2]октану, 7 80832 8 форміат (3R)-1-[4-(4-фторфеніл)-4-оксобутил]-3де R1 і R3 мають значення, вказані в п. 1, з {[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]аміно}-1відповідною металоорганічною сполукою R4азонійбіцикло[2.2.2]октану, [Mg,Li], де R4 має значення, вказані в п. 1. хлорид (3R)-3-{[(9-гідрокси-9Н-флуорен-922. Сполука формули (V), вибрана з ряду іл)карбоніл]аміно}-1-[3-(метилфеніламіно)пропіл]N-1-азабіцикло[2.2.2]окт-3-ил-2-оксо-2-тієн-21-азонійбіцикло[2.2.2]октану, ілацетамід, форміат (3R)-3-{[(9-гідрокси-9Н-флуорен-9N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-2іл)карбоніл]аміно}-1-(3-фенілсульфанілпропіл)-1ілацетамід, азонійбіцикло[2.2.2]октану, N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-2бромід (3R)-3-[метил-(9Н-ксантен-9ілацетамід. ілкарбоніл)аміно]-1-(3-пірол-1-ілпропіл)-123. Спосіб одержання сполуки формули (II) за п. 2, азонійбіцикло[2.2.2]октану, за яким проводять взаємодію сполуки формули (І) хлорид (3R)-1-[3-(дифеніл-4-ілокси)пропіл]-3за п. 1 з алкілувальним агентом формули R6[метил-(9Н-ксантен-9-карбоніл)аміно]-1(CH2)n-A-(CH2)m-W, де R6, n, А і m мають значення, азонійбіцикло[2.2.2]октану, вказані в п. 2, a W означає будь-яку придатну хлорид (3R)-3-(2-фур-2-ил-2-гідроксипент-3групу, яка вилучається. иноїламіно)-1-[3-(нафталін-1-ілокси)пропіл]-124. Фармацевтична композиція, яка містить азонійбіцикло[2.2.2]октану, сполуку за будь-яким з пп. 1-20, у суміші з бромід (3R)-1-[3-(бензо[1,3]діоксол-5фармацевтично прийнятним носієм або ілокси)пропіл]-3-(2-фур-2-ил-2-гідроксипент-3розріджувачем. иноїламіно)-1-азонійбіцикло[2.2.2]октану, 25. Сполука за будь-яким з пп. 1-20 для лікування хлорид (3R)-1-[3-(бензотіазол-2-ілокси)пропіл]-3патологічного стану або захворювання, (2-фур-2-ил-2-гідроксипент-3-иноїламіно)-1інтенсивність симптомів якого знижується завдяки азонійбіцикло[2.2.2]октану, антагоністичному впливу на мускаринові бромід (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2рецептори МЗ. тієн-2-ілацетил]аміно}-1-(2-гідроксіетил)-126. Застосування сполуки за будь-яким з пп. 1-20 азонійбіцикло[2.2.2]октану, для одержання лікарського засобу, призначеного форміат (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2для лікування патологічного стану або тієн-2-ілацетил]аміно}-1-(2-етоксіетил)-1захворювання, інтенсивність симптомів якого азонійбіцикло[2.2.2]октану, знижується завдяки антагоністичному впливу на бромід (3R)-3-{[(2S)-2-циклопентил-2-гідрокси-2мускаринові рецептори МЗ. тієн-2-ілацетил]аміно}-1-(4,4,4-трифторбутил)-127. Застосування за п. 26, де патологічний стан азонійбіцикло[2.2.2]октану, означає респіраторне, урологічне або шлунковобромід (3R)-1-(4-ацетоксибутил)-3-[2-(5-бромтієнкишкове захворювання або порушення. 2-іл)-2-(4-фтор-3-метилфеніл)-228. Спосіб лікування суб'єкта, який страждає від гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану, патологічного стану або захворювання, що є бромід (3R)-3-[2-(5-бромтієн-2-іл)-2-(4-фтор-3чутливими до покращення шляхом антагонізму метилфеніл)-2-гідроксіацетиламіно]-1-(4мускаринових рецепторів МЗ, при якому вказаному етоксикарбонілбутил)-1-азонійбіцикло[2.2.2]октану, суб’єкту вводять ефективну кількість сполуки за форміат (3R)-1-(3-ацетилсульфанілпропіл)-3-[2-(5будь-яким з пунктів 1-20. бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-229. Спосіб за п. 28, де патологічний стан означає гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану, респіраторне, урологічне або шлунково-кишкове бромід (3R)-1-(3-ціанопропіл)-3-[2-фур-2-ил-2захворювання або порушення. гідрокси-4-(4-метоксифеніл)бутириламіно]-130. Комбінований продукт, який містить (1) сполуку азонійбіцикло[2.2.2]октану, за будь-яким з пп. 1-20 і (2) іншу сполуку, форміат (3R)-1-(2-карбамоїлетил)-3-[2-фур-2-ил-2ефективну при лікуванні респіраторного, гідрокси-4-(4-метоксифеніл)бутириламіно]-1урологічного або шлунково-кишкового азонійбіцикло[2.2.2]октану, захворювання або порушення при одночасному, бромід (3R)-1-(2-[1,3]діоксолан-2-ілетил)-3-[2-фурокремому або послідовному застосуванні. 2-ил-2-гідрокси-4-(4-метоксифеніл)бутириламіно]31. Комбінований продукт за п. 30, який містить (1) 1-азонійбіцикло[2.2.2]октану. сполуку за будь-яким з пп. 1-20 і (2) агоніст b 2 ; 21. Спосіб одержання сполуки формули (І) за п. 1, стероїд, антиалергічний засіб, інгібітор де R2 означає групу формули i), a R5 означає фосфодіестерази IV і/або антагоніст лейкотриєну гідроксигрупу, за яким проводять взаємодію D4 (LTD4) при одночасному, окремому або сполуки формули (V) послідовному застосуванні при лікуванні R1 O респіраторного захворювання. N N (CH2)p R3 O , (V) Даний винахід стосується нових терапевтично ефективних похідних хінуклідинаміду, деяких способів їх одержання і фармацевтичних композицій, які включають вказані сполуки. Нові сполуки за винаходом є антимускариновими агентами із сильнодіючою і тривалою дією. Сполуки насамперед мають високу спорідненість до мускаринових рецепторів М3. Цей підвид мускаринового рецептора присутній у залозах і гладеньких м'язах і опосередковує збуджуючі дії парасимпатичної системи на залозисту секрецію і на скорочення вісцерального гладенького м'яза [Н.Р. Rang і ін., Pharmacology, гл.6: Cholinergic Transmission, Churchill Livingstone, New York (1995)]. У такий спосіб встановлено, що антагоністи М3 застосовуються для лікування захворювань, асоційованих з підвищеним тонусом парасимпатичної системи, надлишковою залозистою секрецією або із скороченням гладенького м'яза [R.M. Eglen і S.S. Hegde, Drug News Perspect, 10(8), 462-469 (1997)]. Прикладами подібних захворювань є респіраторні порушення, такі, як хронічне обструктивне захворювання легень (COPD), бронхіт, бронхіальна підвищена реактивність, астма, кашель, риніт; урологічні порушення, такі, як нетримання сечі, полакіурія, нейрогенний або нестабільний сечовий міхур, цистоспазматичний і хронічний цистит; шлунково-кишкові порушення, такі, як синдром подразненої товстої кишки, спастичний коліт, дивертикуліт і шлункова виразка; і серцево-судинні захворювання, такі, як синусна брадикардія, індукована блукаючим нервом [Goodman і Gilman, гл.7: Muscarinic Receptor Agonists and Antagonists, The Pharmacological Basis of Therapeutics, 10th edition, McGraw Hill, New York (2001)]. Сполуки за винаходом можна використовувати окремо або в сполученні з іншими лікарськими засобами, ефективними при лікуванні вказаних захворювань. Наприклад, сполуки можна вводити в комбінації з b 2-агоністами, стероїдами, антиалергічними засобами, інгібіторами фосфодіестерази IV і/або антагоністами лейкотриєну D4 (LTD4) при одночасному, окремому або послідовному застосуванні при лікуванні респіраторного порушення. Нові похідні хінуклідинаміду за винаходом характеризуються формулою (І) де R3 означає групу, вибрану з ряду феніл, 2фурил, 3-фурил, 2-тієніл або 3-тієніл, R4 означає групу, вибрану з ряду необов'язково заміщений (нижч.)алкіл, необов'язково заміщений (нижч.)алкеніл, необов'язково заміщений (нижч.)алкініл, циклоалкіл, циклоалкілметил, феніл, бензил, фенетил, 2-фурил, 3-фурил, 2-тієніл або 3-тієніл, a R5 означає водень або гідрокси, метил або СН2ОН групу; бензольні цикли у формулі II) і циклічні групи R3 і R4 кожна незалежно і необов'язково заміщені одним, двома або трьома замісниками, вибраними з групи, яка включає галоген, необов'язково заміщений (нижч.)алкіл з прямим або розгалуженим ланцюгом, гідрокси, необов'язково заміщений (нижч.)алкокси з прямим або розгалуженим ланцюгом, нітрогрупу, ціаногрупу, CO2R' або -NR'R'', де R' і R'' кожен незалежно означає водень або необов'язково заміщений (нижч.)алкіл з прямим або розгалуженим ланцюгом, або R' і R'' разом з атомом, до якого вони приєднані, утворюють циклічну групу, Q означає простий зв'язок або -СН2-, -СН2СН2-, -О-, -О-СН2 -, -S-, -S-CH2- або групу -СН=СН-, p дорівнює 1 або 2, а амідна група розташована в положеннях 2, 3 або 4 азабіциклічного циклу, і включають фармацевтично прийнятні солі вказаних сполук, у тому числі солі четвертинного амонію, або їх індивідуальні стереоізомери і їх суміші, за умови, що, якщо p дорівнює 2, амідна група розташована в положенні 3 хінуклідинового циклу, R1 означає водень, a R3 і R4 обидва означають незаміщений феніл, то - якщо вказана сполука не означає фармацевтично прийнятну сіль або означає гідрохлорид, то R5 не означає водень або гідрокси, і - якщо вказана сполука означає сіль четвертинного амонію, який містить метальну групу, приєднану до атома азоту хінуклідинового циклу, то R5 не означає гідрокси. Сполуки за винаходом включають солі четвертинного амонію формули (II) де R1 означає водень або необов'язково заміщену (нижч.)алкільну групу з прямим або розгалуженим ланцюгом, R2 означає групу формули І) або II) де R1, R2 і p мають значення, вказані вище, m означає ціле число від 0 до 8, n означає ціле число від 0 до 4, 11 80832 12 ланцюгом, звичайно (нижч.)алкінільну групу або А означає групу, вибрану з ряду -СН2 -, залишок. (Нижч.)алкінільна група або залишок CH=CR'-, -CR'=CH-, -CR'R''-, -С(О)-, -О-, -S-, -S(O)-, містить від 2 до 8, переважно від 2 до 6, найбільш -S(O)2- і -NR'-, де R' і R'' мають значення, вказані переважно від 2 до 4 атомів вуглецю. Переважні вище, (нижч.)алкенільні групи або залишки включають 3R6 означає водень або групу, вибрану з ряду бутиніл або 1-пропініл. необов'язково заміщений (нижч.)алкіл з прямим Вказані вище необов'язково заміщені або розгалуженим ланцюгом, гідрокси, (нижч.)алкільна, алкенільна або алкінільна групи необов'язково заміщений (нижч.)алкокси з прямим включають (нижч.)алкільну, алкенільну або або розгалуженим ланцюгом, ціаногрупу, алкінільну групу з прямим або розгалуженим нітрогрупу, -CH=CR'R'', -C(O)OR', -OC(O)R', ланцюгом, вказаним вище, незаміщену або SC(O)R', -C(O)NR'R'', NR'C(O)OR'', -NR'C(O)NR'', заміщену в будь-якому положенні одним або циклоалкіл, феніл, нафталініл, 5,6,7,8більше замісниками, наприклад, одним, двома або тетрагідронафталініл, бензо[1,3]діоксоліл, трьома замісниками. При наявності двох або гетероарил або гетероцикліл, причому R' і R'' більше замісників вони можуть бути однаковими мають значення, вказані вище; і де циклічні групи або різними. Типовими замісниками є атоми R6 незалежно заміщені одним, двома або трьома галогену, переважно атоми фтору, гідрокси- або замісниками, вибраними з групи, яка включає алкоксигрупи. галоген, гідрокси, необов'язково заміщений Вказані алкоксигрупи звичайно означають (нижч.)алкіл з прямим або розгалуженим (нижч.)алкоксигрупи з прямим або розгалуженим ланцюгом, феніл, -OR', -SR', -NR'R'', -NHCOR', вуглеводневим ланцюгом, які містять від 1 до 8, CONR'R'', -CN, -NO2 і -COOR', причому R' і R'' переважно від 1 до 6, найбільш переважно від 1 до мають значення, вказані вище, 4 атомів вуглецю, і необов'язково заміщені в будьX- означає фармацевтично прийнятний аніон якому положенні одним або більше замісниками, моноабо полівалентної кислоти, і всі наприклад, одним, двома або трьома замісниками. індивідуальні стереоізомери і їх суміші, При наявності двох або більше замісників вони за умови, що, якщо p дорівнює 2, амідна група можуть бути однаковими або різними. Типовими розташована в положенні 3 хінуклідинового циклу, замісниками є атоми галогену, переважно атоми R1 означає водень, a R3 і R4 обидва означають фтору, і гідроксигрупи. Переважні необов'язково незаміщений феніл, R5 означає гідрокси, то в заміщені алкоксигрупи включають метокси, етокси, сполуках формули (II) фрагмент R6-(CH2)n-Aн-пропокси, ізопропокси, н-бутокси, втор-бутокси, (CH2)m- не означає метальну групу. трет-бутокси, трифторметокси і дифторметокси, Іншими об'єктами даного винаходу є способи гідроксиметокси, гідроксіетокси або 2одержання вказаних сполук, фармацевтичні гідроксипропокси. композиції, які включають ефективну кількість Вказані вище циклічні групи включають вказаних сполук, застосування сполук для карбоциклічні і гетероциклічні групи. Циклічні групи одержання лікарського засобу, призначеного для можуть містити один або більше циклів. лікування захворювань, чутливих до антагоністів Карбоциклічні групи є ароматичними або мускаринових рецепторів М3, і способи лікування аліциклічними, наприклад, циклоалкільними захворювань, симптоми яких поліпшуються групами. Гетероциклічні групи включають також завдяки антагоністам мускаринових рецепторів гетероарильні групи. Якщо не вказано інше, М3, причому способи включають введення сполук вказані вище циклоалкільні групи й аліциклічні за винаходом суб'єкту, який має потребу в такому групи звичайно містять від 3 до 7 атомів вуглецю. лікуванні. Циклоалкільні групи й аліциклічні цикли, які містять Деякі похідні хінуклідинаміду, які включені в від 3 до 7 атомів вуглецю, включають циклопропіл, обсяг даного винаходу, заявлені в [JP 09328469 і циклобутан, циклопентил, циклогексил і WO 9316048]. циклогептил. Алкільна група або алкільний залишок означає Ароматична група, вказана в тексті заявки, групу з прямим або розгалуженим ланцюгом, звичайно містить від 5 до 14, переважно від 5 до звичайно (нижч.)алкільну групу або залишок. 10 атомів вуглецю. Приклади ароматичних груп (Нижч.)алкільна група або залишок містить від 1 включають феніл або нафталініл. до 8, переважно від 1 до 6, найбільш переважно Вказана вище гетероциклічна або від 1 до 4 атомів вуглецю. Переважні гетероароматична група звичайно містить від 5 до (нижч.)алкільні групи або залишки включають 10 атомів, наприклад, 5, 6 або 7 атомів, і включає метил, етил, пропіл, включаючи ізопропіл, або один або більше гетероатомів, вибраних з N, S і О. бутил, включаючи н-бутил, втор-бутил і третЗвичайно гетероциклічна група містить 1, 2, 3 або бутил. 4 гетероатоми, переважно 1 або 2 гетероатоми. Алкенільна група або алкенільний залишок Гетероциклічна або гетероароматична група може означає групу з прямим або розгалуженим включати один, два або більше конденсовані ланцюгом, звичайно (нижч.)алкенільну групу або цикли, де принаймні один цикл містить залишок. (Нижч.)алкенільна група або залишок гетероатом. Приклади гетероциклічних груп містить від 2 до 8, переважно від 2 до 6, найбільш включають піперидил, піролідил, піперазиніл, переважно від 2 до 4 атомів вуглецю. Переважні морфолініл, тіоморфолініл, піроліл, імідазоліл, (нижч.)алкенільні групи або залишки включають імідазолідиніл, піразолініл, індолініл, ізоіндолініл, вініл, аліл або 1-пропеніл. піридил, піразиніл, піримідиніл, піридазиніл, Алкінільна група або алкінільний залишок індолізиніл, ізоіндоліл, індоліл, індазоліл, пуриніл, означає групу з прямим або розгалуженим 13 80832 14 метальними або метоксигрупами. Більш хінолізиніл, ізохіноліл, хіноліл, фталазиніл, переважними сполуками, які містять групу нафтиридиніл, хіноксалініл, хіназолініл, формули І), є сполуки, де R4 означає групу з циннолініл, птеридиніл, хінуклідиніл, триазоліл, прямим ланцюгом, вибрану з ряду етил, н-бутил, піразоліл, тетразоліл, тієніл і діоксоліл. Приклади вініл, аліл і 1-пропініл, або групу, вибрану з ряду гетероароматичних груп включають піридил, циклопентил, феніл, бензил, фенетил і 2-тієніл, тієніл, фурил, піроліл, імідазоліл, бензотіазоліл, необов'язково заміщену одним або більше піридиніл, піразоліл, піразиніл, піримідиніл, атомами галогену, метальними або піридазиніл, індоліл, індазоліл, піриніл, хіноліл, метоксигрупами. Найбільш переважно R4 означає ізохіноліл, фталазиніл, нафтиридиніл, хіноксалініл, етил, н-бутил, вініл, аліл, циклопентил, феніл, хіназоліл, циннолініл, триазоліл і піразоліл. бензил або 2-тієніл. Атоми галогену включають фтор, хлор, бром В інших переважних варіантах винаходу R2 або йод, звичайно фтор, хлор або бром. означає групу формули II), де Q означає простий Фармацевтично прийнятна сіль сполуки зв'язок або атом кисню. означає сіль фармацевтично прийнятної кислоти У найбільш переважних варіантах винаходу R5 або основи. Фармацевтично прийнятні солі у групах І) або II) означає водень або гідрокси. включають солі неорганічних кислот, наприклад, Переважно в сполуках формули (І) або (ll) p хлористоводневої, сірчаної, фосфорної, дорівнює 2, а амідна група розташована в дифосфорної, бромистоводневої і азотної кислоти, положеннях 3 або 4 азабіцилічного циклу, і солі органічних кислот, наприклад, лимонної, найбільш переважно в положенні 3. фумарової, мурашиної, малеїнової, яблучної, Переважні насамперед сполуки формули (II), у аскорбінової, янтарної, винної, бензойної, оцтової, яких m означає ціле число від 0 до 6, а n означає метансульфонової, етансульфонової, ціле число від 0 до 4; найбільш переважно m бензолсульфонової або пара-толуолсульфонової дорівнює від 0 до 5, а n дорівнює від 0 до 2; А кислоти. Фармацевтично прийнятні основи означає групу, вибрану з ряду -СН2-, -СН=СН-, -О-, включають гідроксиди лужних металів (наприклад, -С(О)-, -NR'- і -S-; найбільш переважно А означає калію або натрію), лужноземельних металів СН2-, -СН Н -, -О-; a R6 означає водень, С = (наприклад, кальцію або магнію) і органічних ціаногрупу, нітрогрупу, -C(O)OR', -OC(O)R', основ, наприклад, алкіламінів, аралкіламінів і SC(O)R', -СН=СН 2, -CH=CR'R'', C(O)NR'R'', С1гетероциклічних амінів. Переважними солями С4алкільну групу з прямим або розгалуженим сполук формули (І) є солі, утворені атомом азоту ланцюгом, необов'язково заміщену одним або азабіциклічного циклу і неорганічною або більше галогенами, С1-С4алкоксигрупу з прямим органічною кислотою. Іншими переважними ланцюгом, необов'язково заміщену одним або солями за винаходом є солі четвертинного амонію більше галогенами або гідроксигрупами, або формули (II), де еквівалент аніона (X-) циклічну групу, необов'язково заміщену одним або асоційований з позитивним зарядом атома азоту. більше замісниками, вибраними з ряду галоген, X- означає аніон різних неорганічних кислот, групи формули -C(O)NR'R'' або метил, гідрокси, такий, як хлорид, бромід, йодид, сульфат, нітрат, нітро або феніл, причому циклічну групу фосфат, або аніон органічної кислоти, такий вибирають з ряду циклогексил, феніл, 5,6,7,8наприклад, як ацетат, форміат, малеат, фумарат, тетрагідронафталініл, 2-тієніл, 1-піролідиніл, 1цитрат, оксалат, сукцинат, тартрат, малат, піроліл, бензо[1,3]діоксоліл, 2-бензотіазоліл, манделат, трифторацетат, метансульфонат і нафталініл і діоксоліл. Більш переважні сполуки пара-толуолсульфонат. Переважно X- означає формули (II), у яких m дорівнює цілому числу від 0 аніон, вибраний з ряду хлорид, бромід, йодид, до 5, а n дорівнює цілому числу від 0 до 2; А сульфат, нітрат, ацетат, малеат, оксалат, сукцинат означає групу, вибрану з ряду -СН2-, -СН=СН-, -О-, або трифторацетат. Більш переважно X- означає -С(О)-, -NR'- і -S-; a R6 означає водень, ціаногрупу, хлорид, бромід, трифторацетат або -C(O)OR', -OC(O)R', -SC(O)R', -CH=CH2, метансульфонат. C(O)NR'R'', С1-С4алкільну групу з прямим або Переважні сполуки формули (І) або (II), де R1 розгалуженим ланцюгом, трифторметил або означає водень, метил або етил, найбільш циклічну групу, вибрану з ряду циклогексил, переважно водень. 5,6,7,8-тетрагідронафталініл, 2-тієніл, 1-піроліл, У деяких переважних варіантах здійснення бензо[1,3]діоксоліл, 2-бензотіазоліл, нафталініл, винаходу R2 означає групу формули І), де R3 діоксоліл і феніл, який необов'язково заміщений означає групу, вибрану з ряду феніл, 2-тієніл, 3одним або більше замісниками, вибраними з тієніл або 2-фурил і необов'язково заміщену одним групи, яка включає атоми галогену, групи формули або більше атомами галогену. Більш переважно -C(O)NR'R'', метил, гідрокси і феніл. Найбільш R2 означає групу формули І), де R3 означає групу переважно R6 вибирають із групи, яка включає феніл, 2-тієніл або 2-фурил, необов'язково водень, С1-С4алкіл із прямим ланцюгом, -СН=СН2, заміщену одним або більше галогенами. Найбільш циклогексил, феніл, незаміщений або заміщений переважно R3 означає феніл або 2-тієніл. одним або двома замісниками, вибраними з ряду Крім того, переважними сполуками, які містять метил, гідрокси, 5,6,7,8-тетрагідронафталініл і 2групу формули І), є сполуки, де R4 означає групу з тієніл. прямим ланцюгом, вибрану з ряду етил, н-бутил, Найбільш переважні сполуки формули (II), де вініл, аліл, 1-пропеніл і 1-пропініл, або групу, фрагмент R6-(CH2)n-A-(CH2)m- означає метил, 3вибрану з ряду циклопентил, циклогексил, феніл, феноксипропіл, 3-(3-гідроксифенокси)пропіл, аліл, бензил, фенетил, 2-тієніл і 3-фурил, необов'язково гептил, 3-фенілпропіл, 3-фенілаліл, 2-феноксіетил, заміщену одним або більше атомами галогену, 15 80832 16 N-[(3R)-1-азабіциюіо[2.2.2]окт-3-ил]-2-фур-22-бензилоксіетил, циклогексилметил, 3-(5,6,7,8ил-2-гідрокси-4-(4-метоксифеніл)бутанамід, тетрагідронафталін-2-ілокси)пропіл, 5-(2,6N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-фур-3диметилфенокси)пентил, 3-тієн-2-ілпропіл або 3ил-2-гідрокси-2-тієн-2-ілацетамід, циклогексилпропіл, а X- означає бромід або N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2трифторацетат. циклогексил-2-гідрокси-2-тієн-3-илацетамід, Сполуки за даним винаходом формули (І) або N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-9-гідрокси(II), вказані вище, можуть містити один або більше 9Н-флуорен-9-карбоксамід, асиметричних центрів, наприклад, атом вуглецю в N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-N-мeтилположенні 3 хінуклідинового циклу; атом вуглецю, 9H-кcaнтeн-9-кapбoкcaмiд, заміщений групами R3, R4 і R5 у сполуках, де R2 (2S)-N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2означає групу формули І); або атом вуглецю, циклoпeнтил-2-гiдpoкcи-2-тiєн-2-ілацетамід. приєднаний до карбонільної групи в сполуках, де ((*) Конфігурація не встановлена; можна R2 означає групу формули II). Кожний із вказаних одержати або (2R)-, або (2S)-ізомери асиметричних атомів може знаходитися в R або S вищевказаних сполук). конфігурації. Індивідуальні ізомери і суміші Переважні індивідуальні сполуки формули (II) ізомерів включені в обсяг даного винаходу. включають Переважні індивідуальні сполуки формули (І) бромід 3-(2-гідрокси-2,2-дитієн-2включають ілацетиламіно)-1-метил-1N-(1-азабіцикло[2.2.2]окт-3-ил)-2-гідрокси-2,2азонійбіцикло[2.2.2]октану, дитієн-2-ілацетамід, бромід 3-(2-гідрокси-2,2-дитієн-2N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2-riдpoкcиілацетиламіно)-1-(3-феноксипропіл)-12,2-дитiєн-2-iлaцeтaмiд, азонійбіцикло[2.2.2]октану, N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокситрифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-22,2-дитієн-2-ілацетамід, ілацетиламіно)-1-метил-1N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2,2-дитієназонійбіцикло[2.2.2]октану, 2-ілацетамід, трифторацетат (3R)-1-аліл-3-(2-гідрокси-2,2N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2дитієн-2-ілацетиламіно)-1циклoпeнтил-2-гiдpoкcи-2-тiєн-2-ілацетамід, азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідрокситрифторацетат (3R)-1-гептил-3 -(2-гідрокси2-тієн-2-ілпент-4-енамід, 2,2-дитієн-2-ілацетиламіно)-1(2*)-N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2азонійбіцикло[2.2.2]октану, гiдpoкcи-2-тiєн-2-iлбyтaнaмiд (діастереомер 1), бромід (3R)-3-(2-гiдpoкcи-2,2-дитiєн-2(2*)-N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2iлaцeтилaмiнo)-1-(3-фeнiлпpoпiл)-1гiдpoкcи-2-тiєн-2-iлбyтaнaмiд (діастереомер 2), азонійбіцикло[2.2.2]октану, (2*)-N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2трифторацетат (3R)-3-(2-гiдpoкcи-2,2-дитiєн-2гiдpoкcи-2-тiєн-2-iлбyт-3-енамід (діастереомер 1), iлaцeтилaмiнo)-1-((Е)-3-фенілаліл)-1(2*)-N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2азонійбіцикло[2.2.2]октану, гiдpoкcи-2-тiєн-2-iлбyт-3-енамід (діастереомер 2), бромід (3R)-3-(2-гідрокси-2,2-дитієн-2N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2,3ілацетиламіно)-1-(2-феноксіетил)-1дифeнiлпpoпaнaмiд, азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2бромід (3R)-3-(2-гідрокси-2,2-дитієн-2циклoпeнтил-2-гiдpoкcи-2-фенілацетамід, ілацетиламіно)-1-(3-феноксипропіл)-1N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2азонійбіцикло[2.2.2]октану, фeнiлгeкcaнaмiд, трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2N-(1-азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9ілацетиламіно)-1-[3-(3-гідроксифенокси)пропіл]-1карбоксамід, азонійбіцикло[2.2.2]октану, N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-9Нтрифторацетат (3R)-1-(2-бензилоксіетил)-3-(2ксантен-9-карбоксамід, гідрокси-2,2-дитієн-2-ілацетиламіно)-1N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-9Назонійбіцикло[2.2.2]октану, ксантен-9-карбоксамoд, бромід (3R)-3-(2-riдpoкcи-2,2-дитiєн-2N-(1-азабіцикло[2.2.2]окт-3-ил)-9-гідрокси-9Нiлaцeтилaмiнo)-1-(3-тієн-2-ілпропіл)-1флуорен-9-карбоксамід, азонійбіцикло[2.2.2]октану, N-1-азабіцикло[2.2.2]окт-3-ил-N-метил-9Нбромід (3S)-3-(2-гідрокси-2,2-дитієн-2ксантен-9-карбоксамід, ілацетиламіно)-1-(3-феноксипропіл)-1N-1-азабіцикло[2.2.2]окт-3-ил-N-етил-9Назонійбіцикло[2.2.2]октану, ксантен-9-карбоксамід, бромід (3R)-3-(2,2-дитiєн-2-iлaцeтилaмiнo)-1N-1-азабіцикло[2.2.2]окт-4-ил-2-циклопентил-2(3-фeнoкcипpoпiл)-1-азонійбіцикло[2.2.2]октану, гідрокси-2-тієн-2-ілацетамід, бромід 1-метил-3-[(9Н-ксантен-9N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2-гiдpoкcиілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, 2-фeнiл-2-тiєн-2-ілацетамід, бромід 1-(3-феноксипропіл)-3-[(9Н-ксантен-9N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-(5ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2бромід (3R)-1-(3-феноксипропіл)-3-[(9Нгідроксіацетамід, ксантен-9-ілкарбоніл)аміно]-1N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-фур-2азонійбіцикло[2.2.2]октану, ил-2-гідроксипент-3-инамiд, 17 80832 18 трифторацетат (3S)-1-аліл-3-[(9Н-ксантен-9трифторацетат (3R)-3-(2-циклопентил-2ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, гідрокси-2-тієн-2-ілацетиламіно)-1-(2-етоксіетил)-1трифторацетат (3S)-1-гептил-3-[(9Н-ксантен-9азонійбіцикло[2.2.2]октану, ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, трифторацетат (3R)-3-(2-циклопентил-2трифторацетат (3S)-1-циклогексилметил-3гідрокси-2-тієн-2-ілацетиламіно)-1-{2-[2-(2[(9Н-ксантен-9-iлкарбоніл)аміно]-1гідроксіетокси)етокси]етил}-1азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, трифторацетат(3S)-1-(3-циклогексилпропіл)-3трифторацетат (3R)-3-(2-циклопентил-2[(9Н-ксантен-9-ілкарбоніл)аміно]-1гідрокси-2-тієн-2-ілацетиламіно)-1-(4,4,4азонійбіцикло[2.2.2]октану, трифторбутил)-1-азонійбіцикло[2.2.2]октану, бромід (3S)-1-(3-феноксипропіл)-3-[(9Нтрифторацетат (3R)-1-(4-ацетоксибутил)-3-[2ксантен-9-ілкарбоніл)аміно]-1(5-бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2азонійбіцикло[2.2.2]октану, гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану, трифторацетат (3S)-1-[3-(5,6,7,8трифторацетат (3R)-3-[2-(5-бpoмтiєн-2-iл)-2-(4тетрагідронафталін-2-ілокси)пропіл]-3-[(9Нфтop-3-мeтилфeнiл)-2-гідроксіацетиламіно]-1-(4ксантен-9-ілкарбоніл)аміно]-1етоксикарбонілбутил)-1-азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, трифторацетат (3R)-1-(3трифторацетат (3S)-1-[5-(2,6aцeтилcyльфaнiлпpoпiл)-3-[2-(5-бpoмтiєн-2-iл)-2диметилфенокси)пентил]-3-[(9Н-ксантен-9(4-фтор-3-метилфеніл)-2-гідроксіацетиламіно]-1ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, бромід 3-{[(9-гідрокси-9Н-флуорен-9трифторацетат (3R)-1-(3-ціанопропіл)-3-(2іл)карбоніл]аміно}-1-метил-1гідрокси-2-феніл-2-тієн-2-ілацетиламіно)-1азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, бромід 3-{[(9-гідрокси-9Н-флуорен-9трифторацетат (3R)-1-(2-карбамоїлетил)-3-(2іл)карбоніл]аміно}-1-(3-феноксипропіл)-1гідрокси-2-тієн-2-ілпент-4-еноїламіно)-1азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, трифторацетат (3R)-1-[3-(2трифторацетат (3R)-1-(2-[1,3]діоксолан-2карбамоїлфенокси)пропіл]-3-{[(9-гідрокси-9Hілетил)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїламіно)флуорен-9-іл)карбоніл]аміно}-11-азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, трифторацетат 4-(2-циклопентил-2-гідрокси-2трифторацетат (3R)-1-[4-(4-фтopфeнiл)-4тієн-2-ілацетиламіно)-1-(4-метилпент-3-еніл)-1oкcoбyтил]-3-{[(9-гiдpoкcи-9H-флуорен-9азонійбіцикло[2.2.2] октану, іл)карбоніл]аміно}-1-азонійбіцикло[2.2.2]октану, форміат (3R)-1-[3-(2трифторацетат (3R)-3-{[(9-гідрокси-9Нкарбамоїлфенокси)пропіл]-3-{[(9-гідрокси-9Нфлуорен-9-іл)карбоніл]аміно}-1-(4-оксо-4-тієн-2флуорен-9-іл)карбоніл]аміно}-1ілбутил)-1-азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, трифторацетат (3R)-3-{[(9-гідрокси-9Нформіат (3R)-1-[4-(4-фтopфеніл)-4-oкcoбyтил]флуорен-9-іл)карбоніл]аміно}-1-[33-{[(9-riдpoкcи-9H-флyopeн-9-іл)карбоніл]аміно}-1(метилфеніламіно)пропіл]-1азонійбіцикло[2.2.2]октану, азонійбіцикло[2.2.2]октану, хлорид (3R)-3-{[(9-гідрокси-9Н-флуорен-9трифторацетат (3R)-3-{[(9-гiдpoкcи-9Hіл)карбоніл]аміно}-1-[3-(метилфеніламіно)пропіл]флyopeн-9-iл)кapбoнiл]aмiнo}-1-(31-азонійбіцикло[2.2.2]октану, фенілсульфанілпропіл)-1форміат (3R)-3-{[(9-гідрокси-9Н-флуорен-9азонійбіцикло[2.2.2]октану, іл)карбоніл]аміно)-1-(3-фенілсульфанілпропіл)-1трифторацетат 3-[метил-(9Н-ксантен-9азонійбіцикло[2.2.2]октану, ілкарбоніл)аміно]-1-(3-пірол-1-ілпропіл)-1бромід (3R)-3-[метил-(9Н-ксантен-9азонійбіцикло[2.2.2]октану, ілкарбоніл)аміно]-1-(3-пірол-1-ілпропіл)-1трифторацетат 1-[3-(дифеніл-4-ілокси)пропіл]азонійбіцикло[2.2.2]октану, 3-[етил-(9Н-ксантен-9-ілкарбоніл)аміно]-1хлорид (3R)-1-[3-(дифeнiл-4-iлoкcи)пpoпiл]-3азонійбіцикло[2.2.2]октану, [мeтил-(9H-кcaнтeн-9-карбоніл)аміно]-1трифторацетат (3R)-1-[3-(бeнзo[1,3]дioкcoл-5азонійбіцикло[2.2.2]октану, iлoкcи)пpoпiл]-3-(2-гiдpoкcи-2-феніл-2-тієн-2хлорид (3R)-3-(2-фyp-2-ил-2-гiдpoкcипeнт-3ілацетиламіно)-1-азонійбіцикло[2.2.2]октану, инoїлaмiнo)-1-[3-(нaфталiн-1-ілокси)пропіл]-1трифторацетат (3R)-1-[3-(бензотіазол-2азонійбіцикло[2.2.2]октану, ілокси)пропіл]-3-(2-гідрокси-2-феніл-2-тієн-2бромід (3R)-1-[3-(бензо[1,3]діоксол-5ілацетиламіно)-1-азонійбіцикло[2.2.2]октану, ілокси)пропіл]-3-(2-фур-2-ил-2-гідроксипент-3трифторацетат (3R)-3-(2-фyp-2-ил-2иноїламіно)-1-азонійбіцикло[2.2.2]октану, гідроксипент-3-иноїламіно)-1-[3-(нафталін-1хлорид (3R)-1-[3-(бензотіазол-2-ілокси)пропіл]ілокси)пропіл]-1-азонійбіцикло[2.2.2]октану, 3-(2-фур-2-ил-2-гідроксипент-3-иноїламіно)-1трифторацетат (3R)-3-[2-фyp-2-ил-2-гідроксиазонійбіцикло[2.2.2]октану, (4-метоксифеніл)бутириламіно]-1-[6-(4бромід (3R)-3-{[(2S)-2-циклопентил-2-гідроксифенілбутокси)гексил]-1-азонійбіцикло[2.2.2]октану, 2-тієн-2-ілацетил]аміно}-1-(2-гідроксіетил)-1трифторацетат (3R)-3-(2-циклопентил-2азонійбіцикло[2.2.2]октану, гідрокси-2-тієн-2-ілацетиламіно)-1-(2-гідроксіетил)форміат (3R)-3-{[(2S)-2-циклопентил-21-азонійбіцикло[2.2.2]октану, гідрокси-2-тієн-2-ілацетил]аміно}-1-(2-етоксіетил)1-азонійбіцикло[2.2.2]октану, 19 80832 20 бромід (3R)-3-{[(2S)-2-циклoпeнтил-2-гiдpoкcиДеякі сполуки формули (V) є новими і включені 2-тiєн-2-iлaцeтил]aмiнo}-1-(4,4,4-трифторбутил)-1в обсяг даного винаходу, наприклад, такі сполуки, азонійбіцикло[2.2.2]октану, як бромід (3R)-1-(4-aцeтoкcибyтил)-3-[2-(5N-1-азабіцикло[2.2.2]окт-3-ил-2-оксо-2-тієн-2бpoмтiєн-2-iл)-2-(4-фтop-3-метилфеніл)-2ілацетамід, гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану, N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2-oкco-2бромід (3R)-3-[2-(5-бромтієн-2-іл)-2-(4-фтop-3тiєн-2-iлaцeтaмiд, метилфеніл)-2-гідроксіацетиламіно]-1-(4N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2етоксикарбонілбутил)-1-азонійбіцикло[2.2.2]октану, тієн-2-ілацетамід. форміат (3R)-1-(3-aцeтилcyльфaнiлпpomл)-3Як показано на наступній схемі, похідні [2-(5-бpoмтiєн-2-iл)-2-(4-фтор-3-метилфеніл)-2четвертинного амонію формули (II) одержують за гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану, реакцією сполук формули (І) з алкілувальним бромід (3R)-1-(3-ціанопропіл)-3-[2-фур-2-ил-2агентом формули (VI) методами (г) або (д), гідрокси-4-(4-метоксифеніл)бутириламіно]-1докладно описаними в експериментальній частині. азонійбіцикло[2.2.2]октану, Метод (д) включає застосування методів форміат (3R)-1-(2-карбамоїлетил)-3-[2-фур-2твердофазної екстракції, які дозволяють ил-2-гідрокси-4-(4-метоксифеніл)бутириламіно]-1одночасно одержувати декілька сполук. азонійбіцикло[2.2.2]октану, бромід (3R)-1-(2-[1,3]діоксолан-2-ілетил)-3-[2фур-2-ил-2-гідрокси-4-(4метоксифеніл)бутириламіно]-1азонійбіцикло[2.2.2]октану. В іншому варіанті даний винахід включає способи одержання нових похідних хінуклідинаміду формули (І) і (II). Сполуки формули (І) можна одержати з відповідної карбонової кислоти формули (III) при наступному використанні двох різних методів (а) і (б), показаних на наступній схемі. Деякі сполуки формули (IV) є комерційними препаратами, наприклад, 3-амінохінуклідин (фірма Aldrich, дигідрохлорид), (3R)-амінохінуклідин (фірма Aldrich, Finorga, дигідрохлорид) і (3S)амінохінуклідин (фірма Aldrich, дигідрохлорид). (3R)-N-Метилхінуклідин-3-амін одержували, як описано в експериментальній частині. Сполуки формули (І), у яких R2 означає групу формули І), a R5 означає гідроксигрупу, можна також одержати зі сполук формули (V) за реакцією з відповідною металоорганічною сполукою. Сполуки формули (V) одержують з відповідних гліоксилових кислот, а потім методами, аналогічними до методів (а) і (б), показаним на схемі 1. У формулі (VI) W означає будь-яку придатну групу, яка вилучається, переважно групу X-, вказану вище для сполук формули (II). Якщо W є іншою групою, яка вилучається, (відмінною від X-), то сіль четвертинного амонію формули (II) одержують із продукту, отриманого за способом (г) або (д), за стандартною реакцією іонного обміну з заміною аніона W - на необхідний аніон X-. Сполуки загальної формули (VI), які не є комерційними препаратами, одержують стандартними методами. Наприклад, сполуки, де n дорівнює 0, а А означає -О-, -S-, NR', одержують за реакцією похідного відповідного спирту, тіолу або аміну, або відповідної натрієвої або калієвої солі, з алкілувальним агентом загальної формули Y-(CH2)m-W, де W має значення, вказані вище; найбільш переважно W означає галоген, і Υ означає галоген або сульфонатний ефір. В інших прикладах, сполуки загальної формули (VI), де n означає принаймні 1, синтезують з відповідного похідного спирту загальної формули (VII) відомими методами. R6-(CH2)n-A-(CH2)m-OH (VII) Сполуки за даним винаходом формули (І) або (II) можуть містити один або більше асиметричних атомів вуглецю. Усі можливі стереоізомери, індивідуальні ізомери і суміші ізомерів також включені в обсяг даного винаходу. Діастереомери сполук розділяють звичайними методами, наприклад, хроматографією або кристалізацією. 21 80832 22 фазу екстрагували СНСI 3. Органічні фази Будову сполук підтверджували спектроскопією об'єднували, промивали насиченим розчином ядерного магнітного резонансу (1Н-ЯМР) і масКгСО3 і водою, сушили над Na2SO4, фільтрували і спектрометрією (МС). Спектри ЯМР знімали на концентрували досуха. Отриманий залишок спектрометрі Varian 300МГц або Bruker DPX-250. очищали хроматографією на колонці із Хімічні зсуви виражали в мільйонних долях (d, силікагелем (елюент: градієнт від CHCI 3/NH4OH, част./млн) по відношенню до внутрішнього 99:1, до CHCl3/MeOH/NH4OH, 98:2:1), при цьому стандарту (тетраметилсилану). Ступінь очищення одержували 900мг (50%) вказаної в заголовку сполук визначали методом обернено-фазовою сполуки. МС: 349 [М+1]+. РХВР на хроматографі Waters. Молекулярні іони 1 H-ЯМР (400МГц, 60°С, CDCI 3): d 7,26-7,19 (m, одержували методом іонізації 4Н), 7,10-7,01 (m, 4Н), 5.51 (s, 1Н), 4,18 (ушир.m, електророзпиленням на мас-спектрометрі Hewlett 1H), 2,92 (s, 3Н), 2,85-2,40 (m, 6H), 1,85-1,20 (m, Packard. 5H). Метод (а) Одержання (3R)-N-метилхінуклідин -3-аміну Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3(проміжна сполука 1-4) ил]-2-фенілгексанаміду 1г (0,0079моля) (3R)-Амінохінуклідинy (Приклад 27) розчиняли в 20мл СН2Сl2 і додавали 1,22мл 2-Фенілгексанову кислоту одержували (0,0087моля) триетиламіну. Отриманий розчин алкілуванням фенілоцтової кислоти 1охолоджували до 0°С, додавали ClCO2Et (0,835мл, хлорбутаном стандартним способом. Потім до 0,0087моля) і суміш перемішували при кімнатній розчину 1,62г 2-фенілгексанової кислоти температурі протягом 15год. Потім розчинники (0,0084моля) і диметилформаміду (ДМФА, одна випарювали у вакуумі, залишок розчиняли в СНСl3 крапля) у 25мл СНСI 3 (який не містить етанолу) і отриманий розчин промивали насиченим при 0°С додавали оксалілхлорид (0,88мл, розчином K2СО3 і водою. Органічну фазу сушили 0,0101моля) і суміш примішували при нагріванні до над Na2SO4, фільтрували і концентрували досуха. кімнатної температури. Через 1год розчинники Отриманий залишок використовували без випарювали, залишок розчиняли в СНСІ 3 і додаткового очищення, як описано нижче. розчинник випарювали. Вказану процедуру Продукт розчиняли в 15мл ТГФ, розчин повторювали двічі. Отримане масло розчиняли в охолоджували до 0°С і декількома порціями СНСI 3, охолоджували до 0°С, додавали розчин додавали 0,601г (0,016моля) LiАlН4. Реакційну (3R)-амінохінуклідинy (1,28г, 0,0101моля) у СНСI 3 і суміш кип'ятили зі зворотним холодильником суміш перемішували при нагріванні до кімнатної протягом 4год, потім охолоджували до 0°С і температури. Через 1год реакційну суміш надлишок гідриду розкладали, обережно додаючи розбавляли СНСI 3, промивали 10% розчином по краплях при перемішуванні 0,6мл Н2О, 0,6мл карбонату калію, водою, сушили над Na2SO4 і 10% розчину NaOH і 1,8мл Н2О. Після упарювали, при цьому одержували 3,57г масла, розкладання гідриду реакційну суміш фільтрували, яке очищали хроматографією на колонці із залишок на фільтрі промивали ТГФ і СНСI 3, силікагелем (елюент: CHCl3/MeOH/NH4OH, органічні фракції об'єднували і концентрували 90:10:1). Відповідні фракції об'єднували й досуха, при цьому одержували 830мг (75%) упарювали, при цьому одержували 2,42г твердої вказаного в заголовку продукту; структуру речовини. Після обробки отриманого продукгу отриманої сполуки підтверджували спектрами 1 Hізопропіловим ефіром одержували 1,59г (63,1%) ЯМР і 13С-ЯМР. вказаної в заголовку сполуки у вигляді суміші 13 діастереомерів. tпл. 136°С. МС: 301 [М+1]+. С-ЯМР (CDCI 3): d 57,0 (СН), 56,5 (СН2), 47,5 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів. (СН2), 46,9 (СН2), 34,3 (СН3), 26,1 (СН2), 24,6 (СН), 19,9 (СН2). 50:50) d 0,84 (t, 3Н), 1,10-1,60 (m, 9Н), 1,70 (ш, 1Н), Наступні сполуки формули (І) одержували з 1,90 (m, 1Н), 2,25-2,50 (m, 1Н), 2,50-2,80 (m, 4Н), відповідної карбонової кислоти як описано в 2,94 і 3,05 (m, 1Н), 3,50 (m, 1Н), 3,65 (m, 1Н), 7,15методі (а): 7,40 (m, 5Н), 8,04 (m, 1Н, NH). N-[(3R)-1-азабіцикло[2.2.2]oкт-3-ил]-2,3Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3дифeнілпpoпaнaмiд (з 2,3-дифенілпропіонової ил]-N-метил-9H-ксантен-9-карбоксаміду (приклад кислоти, приклад 25), 47) N-(1-азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9До розчину 9Н-ксантен-9-карбонової кислоти карбоксамід (приклад 28), (1,16г, 0,0051моля) і диметилформаміду (2 краплі) N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил)-9Ну 20мл СНСI 3 (який не містить етанолу) при 0°С ксантен-9-карбоксамід (приклад 31), додавали оксалілхлорид (0,540мл, 0,0062моля) і N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-9Нсуміш перемішували при нагріванні до кімнатної ксантен-9-карбоксамiд (приклад 33). температури. Через 1год реакційну суміш Останні три сполуки одержували з 9Н-ксантенконцентрували у вакуумі досуха, залишок 9-карбонової кислоти. розчиняли в СНСI 3 (15мл) і концентрували. Метод (б) Вказану процедуру повторювалидвічі. Отриману Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3суміш розчиняли в СНСI 3, розчин охолоджували ил]-2,2-дитиєн-2-ілацетаміду (приклад 17) до 0°С, додавали розчин 0,865г (0,0062моля) (3R)2,2-дитієн-2-ілоцтову кислоту одержували N-метилхінуклідин-3-аміну (проміжна сполука 1-4) гідролізом метилового ефіру 2,2-дитієн-2-ілоцтової у 10мл СНСI 3 і суміш перемішували при нагріванні кислоти, попередньо отриманого, як описано [F. до кімнатної температури. Через 4год у реакційну Leonard і І. Ehranthal, J. Am. Chem. Soc, 73, 2216 суміш додавали насичений розчин K2СО3 і водну 23 80832 24 фільтрували і концентрували у вакуумі, при цьому (1951)]. 1,2г (0,0054моля) 2,2-дитієн-2-ілоцтової одержували 650мг (44% у розрахунку на вихідну кислоти розчиняли в 25мл ТГФ. До отриманого кислоту) вказаної в заголовку сполуки. Структуру розчину додавали 0,96г (0,00594моля) 1,1'сполуки підтверджували спектром 1Н-ЯМР і МС. карбонілдіімідазолу і суміш кип'ятили зі зворотним МС:335 [М+1]+. холодильником протягом 1год. Реакцію 1 контролювали методом ТШХ за утворенням H-ЯМР (CDCI 3): d 7,24 (m, 1Н), 7,08 (m, 1Н), імідазолу. Після завершення реакції до суміші 6,97 (m, 1H), 6,64 (d, NH, 1H), 3,91-3,81 (m, 1H), додавали 0,75г (0,00594моля) (3R)3,33-3,23 (m, 1H), 2,88-2,69 (m, 5H), 2,42-2,33 (m, амінохінуклідину, реакційну суміш кип'ятили зі 1H), 1,87 (m, 1H), 1,69-1,36 (m, 12H). зворотним холодильником протягом 16год, (2S)-2-циклопентил-2-гідрокси-2-тієн-2охолоджували, розбавляли ефіром і промивали ілоцтову кислоту одержували як описано в [WO водою. Органічний шар екстрагували 2н. НСl, /02053564]. водний шар підлуговували додаванням K2СО3 і Наступні сполуки формули (І) одержували з екстрагували СНСI 3. Органічний шар сушили над відповідної карбонової кислоти за методом (б): Na2SO4 і випарювали розчинник, при цьому N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2одержували 0,60г масла, яке очищали циклопентил-2-гідрокси-2-тієн-2-ілацетамід хроматографією на колонці із силікагелем (приклад 19) одержували з 2-циклопентил-2(елюент: CHCl3/MeOH/NH4OH, 90:10:1). Фракції, гідрокси-2-тієн-2-ілоцтової кислоти, яку що містять продукт реакції, об'єднували й одержували гідролізом метилового ефіру 2упарювали, при цьому одержували 0,31г (17,3%) циклопентил-2-гідрокси-2-тієн-2-ілоцтової кислоти, вказаної в заголовку сполуки. tпл. 165°С. МС: 333 описаного [Е. Atkinson і ін., J. Med. Chem., 20, №12, [М+1]+. 1612-1617 (1977) і WO 02/053564], 1 N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-2H-ЯМР (CDCI 3): d 1,43 (m, 2Н), 1,63 (m, 2Н), циклoпeнтил-2-гiдpoкcи-2-фенілацетамід (приклад 1,92 (m, 1Н), 2,4 (m, 1Н), 2,65-2,85 (m, 4Н), 3,31 (m, 26) одержували з 2-циклопентил-2-гідрокси-21Н), 3,97 (m, 1H), 5,37 (s, 1H), 5,98 (d, 1H, NH), 7,0 фенілоцтової кислоти, (m, 4H), 7,28 (m, 2H). N-(1-азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9Одержання N-3(3R)-1-азабіцикло[2.2.2]окт-3карбоксамід (приклад 28) одержували з 9Нил]-9-гідрокси-9H-флуорен-9-кабоксаміду (приклад ксантен-9-карбонової кислоти, 44) N-(1-азабіцикло[2.2.2]окт-3-ил)-9-гідрокси-9НУ 50мл сухого ДМФА розчиняли 5г (0,022моля) флуорен-9-карбоксамід (приклад 41) одержували з 9-гідрокси-9Н-флуорен-9-карбонової кислоти, 9-гідрокси-9Н-флуорен-9-карбонової кислоти. додавали 4,2г (0,026 оля) 1,1'-карбонілдіімідазолу і Метод (в) суміш перемішували при кімнатній температурі Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3протягом 1год. Потім додавали 3,26г (0,026моля) ил]-2-оксо-2-тієн-2-ілацетаміду (проміжна сполука (3R)-амінохінуклідину і 0,324г (0,0027моля) ДМАП І-1) (4-(диметиламіно)піридину) і реакційну суміш До розчину 6,68г (0,0428моля) 2-оксо-2-тієн-2перемішували при кімнатній температурі протягом ілоцтової кислоти і ДМФА (декілька крапель) у 14год. Потім суміш концентрували у вакуумі для 100мл СНСI 3 (що не містить етанолу) при 0°С видалення ДМФА, а залишок розчиняли в AcOEt. додавали оксалілхлорид (4,5мл, 0,0516моля) і Органічний шар промивали насиченим розчином суміш перемішували при нагріванні до кімнатної NaHCO3 і водою, сушили над Na2SO4 і випарювали температури. Через 2год розчинники випарювали, розчинник. Отриманий продукт очищали залишок розчиняли в СНСI 3 і розчин упарювали. хроматографією на колонці із силікагелем Вказану процедуру повторювали двічі. Отримане (елюент: градієнт від СНСI 3/NH4OH, 100:1, до масло розчиняли в СНСI 3, розчин охолоджували CHCl3/MeOH/NH4OH, 80:20:1). Відповідні фракції до 0°С, додавали розчин (3R)-амінохінуклідину об'єднували й упарювали, при цьому одержували (5,91г, 0,0468моля) у 50мл СНСI3 і суміш 304мг (4%) вказаної в заголовку сполуки. МС: 335 перемішували при нагріванні до кімнатної [М+1]+. 1 температури. Через 18год реакційну суміш H-ЯМР (CDCI 3): d 7,67-7,62 (m, 2N), 7,42-7,36 промивали розчином K2СО3 і лужний водний (m, 4H), 7,32-7,25 (m, 2H), 6,08-5,93 (m, NH, 1H), розчин екстрагували СНСI 3. Органічні шари 3,74 (m, 1H), 3,00-2,87 (m, 1H), 2,52-2,27 (m, 4H), об'єднували, промивали водою, сушили над 2,02-1,92 (m, 1H), 1,80-1,76 (m, 1H), 1,51-1,44 (m, Na2SO4 і упарювали, при цьому одержували 11,34г 2H), 1,26-1,17 (m, 2H). вказаної в заголовку сполуки. МС: 265 [М+1]+. Одержання (2S)-N-[(3R)-1-азабіцикло[2.2.2]окт1 H-ЯМР (CDCI 3): d 1,40-1,85 (m, 4Н), 2,0 (m, 3-ил]-2-циклопентил-2-гідрокси-2-тієн-2ілацетаміду (приклад 49) 1Н), 2,60 (m, 1H), 2,70-3,0 (m, 4H), 3,4 (m, 1H), 4,0 Вказану в заголовку сполуку одержували з (m, 1H), 7,20 (m, 1H), 7,50 (d, 1H, ΝH), 7,85 (m, 1H), (2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілоцтової 8,40 (m, 1H). кислоти, як описано в прикладі 44. Отриманий Наступні проміжні сполуки одержували продукт очищали хроматографією на колонці із аналогічно до того, як описано вище: силікагелем (елюент: градієнт N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2CHCl3/MeOH/NH4OH, від 99:1:1 до 97:3:1), при тієн-2-ілацетамід (проміжна сполука 1-2), цьому одержували 800мг вказаної в заголовку N-[1-азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-2сполуки з домішкою імідазолу. Отриманий продукт ілацетамід (проміжна сполука 1-3). розчиняли в СНСI 3 і розчин тричі промивали Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3водою. Органічну фазу сушили над Na2SO4, ил]-2-гідрокси-2,2-дитієн-2-ілацетаміду (приклад 4) 25 80832 26 Розчин 15,4г (0,094моля) 2-бромтіофену в Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3150мл ТГФ обробляли 2,27г (0,094моля) магнію, ил]-2-(5-бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2при цьому одержували розчин броміду 2гідроксіацетаміду (приклад 48) тієнілмагнію. Отриманий розчин додавали до До суспензії 2-(5-бромтієн-2-іл)-2-оксооцтової розчину 11,34г (0,043моля) N-[(3R)-1кислоти (2,6г, 0,011моля) і двох крапель ДМФА в азабіцикло[2.2.2]окт-3-ил]-2-оксо-2-тієн-230мл СНСI 3 (який не містить етанолу) при 0°С ілацетаміду (проміжна сполука І-1) у 120мл ТГФ, додавали оксалілхлорид (1,16мл, 0,013моля) і суміш перемішували при кімнатній температурі суміш перемішували при нагріванні до кімнатної протягом 1год, кип'ятили зі зворотним температури протягом 1,5год. Потім реакційну холодильником протягом 1год, охолоджували й суміш концентрували у вакуумі досуха, отриманий обробляли насиченим розчином хлориду амонію. залишок розчиняли в СНСI 3 (15мл) і Отриманий розчин підлуговували додаванням концентрували. Вказану процедуру повторювали розчину K2СО3 і екстрагували СН2Сl2. Органічний двічі. Отриманий залишок розчиняли в СНСI 3 (30мл), розчин охолоджували до 0°С і додавали шар промивали водою і сольовим розчином, 1,67г (0,013моля) (3R)-амінохінуклідину і суміш сушили над Na2SO4, обробляли активованим нагрівали до кімнатної температури і вугіллям, фільтрували через целіт і випарювали перемішували протягом 3год. Потім реакційну розчинник, при цьому одержували тверду суміш обробляли насиченим розчином K2СО3 і речовину, яку обробляли ефіром і відокремлювали водний шар екстрагували СН2Сl2. Органічні шари фільтруванням, при цьому одержували 8,77г об'єднували, промивали водою, сушили над (56,5%) вказаного в заголовку продукту. tпл. 169°С. Na2SO4, фільтрували й упарювали. Отриманий МС: 349 [М+1]+. 1 продукт (N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-(5H-ЯМР (ДМСО-d6): d 1,30 (m, 1Н), 1,42-1,75 бромтієн-2-iл)-2-оксоацетамід) використовували (m, 3Н), 1,77 (m, 1Н), 2,50-2,75 (m, 4Н), 2,83 (m, без додаткового очищення, як описано нижче. 1Н), 3,05 (m, 1Н), 3,74 (m, 1H), 6,95 (m, 2H), 7,03 Отриманий продукт розчиняли в сухому ТГФ (m, 1H), 7,09 (m, 1H), 7,43 (m, 2H), 7,54 (s, 1H, OH), (45мл), розчин охолоджували до -80°С, додавали 7,97 (d, 1H, NH). 14,4мл 1Μ розчину 4-фтор-3Наступні сполуки формули (І) одержували при метилфенілмагнійброміду (0,014моля) у ТГФ і взаємодії N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2суміш перемішували при зниженій температурі оксо-2-тієн-2-ілацетаміду (проміжна сполука l-1) і протягом 3год. Потім реакційну суміш обробляли реактиву Гриньяра за методом (в): насиченим розчином NH4Cд і екстрагували AcOEt. N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксиОрганічний шар сушили над Na2SO4, фільтрували і 2-тієн-2-ілпент-4-енамід (приклад 20), розчинник випарювали. Отриманий продукт (2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2очищали хроматографією на колонці із гідрокси-2-тієн-2-ілбутанамід (діастереомер 1, силікагелем (елюент: градієнт приклад 21) і CHCl3/MeOH/NH4OH, від 99:1:1 до 96:4:1), при (2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2цьому одержували 2,1г вказаної в заголовку гідрокси-2-тієн-2-ілбутанамід (діастереомер 2, сполуки (42% у розрахунку на вихідну кислоту) у приклад 22), вигляді суміші діастереомерів. МС: 453,455 [М+1]+. вказані діастереомери розділяли 1 H-ЯМР (CDCI 3): (суміш діастереомерів) d хроматографією на колонці із силікагелем 7,35-7,20 (m, 2Н), 7,08-6,89 (m, ЗН), 6,80 (dd, 1Н), (елюент: СНСI 3/МеОН/NH4ОН, 90:10:1), у першій 3,93-3,84 (m, 1Н), 3,18-3,07 (m, 1H), 2,69-2,58 (m, фракції одержували діастереомер 1, у другій 4H), 2,33-2,22 (m, 4H), 1,92-1,87 (m, 1H), 1,63-1,42 фракції одержували діастереомер 2; (m, 4H). (2*)-N-[(3R)-1-aзaбiциклo[2.2.2]oкт-3-ил]-22-(5-бромтієн-2-іл)-2-оксооцтову кислоту гiдpoкcи-2-илбyт-3-eнaмiд (діастереомер 1, одержували гідролізом етилового ефіру 2-(5приклад 23) і бромтієн-2-іл)-2-оксооцтової кислоти в (2*)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2стандартних умовах (EtOH, 2н. NaOH, 60°С, гідрокси-2-илбут-3-енамiд (діастереомер 2, 1,5год). приклад 24), Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-3вказані діастереомери розділяли ил]-2-фур-2-ил-2-гідроксипент-3-инаміду (приклад хроматографією на колонці із силікагелем 45) (елюент: CHCl3/MeOH/NH4OH, 90:10:1), у першій До суспензії 1,72г (0,012моля) 2-фур-2-ил-2фракції одержували діастереомер 1, у другій оксооцтової кислоти і двох крапель ДМФА в 40мл фракції одержували діастереомер 2. СНСI 3 (який не містить етанолу) при 0°С додавали (*) Конфігурація не визначена. оксалілхлорид (1,17мл, 0,013моля) і отриману Наступні сполуки формули (І) також суміш перемішували при нагріванні до кімнатної одержували за методом (в): температури протягом 1год. Потім суміш N-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-2-гідроксиконцентрували у вакуумі досуха, отриманий 2,2-дитієн-2-ілацетамід (приклад 15) одержували з залишок розчиняли в СНСI 3 (20мл) і знову проміжної сполуки I-2 і 2-тієніллітію (комерційний концентрували. Вказану процедуру повторювали препарат), двічі. Отриманий продукт розчиняли в СНСI 3 N-(1-азабіцикло[2.2.2]окт-3-ил)-2-гідрокси-2,2(50мл), розчин охолоджували до 0°С, додавали дитієн-2-ілацетамід (приклад 1) одержували з 1,7г (0,013моля) (3R)-амінохінуклідину і суміш проміжної сполуки I-3 і 2-тієніллітію. нагрівали до кімнатної температури і перемішували протягом 16год. Потім реакційну 27 80832 28 суміш обробляли насиченим розчином K2СО3 і 3,82 (m, 1Н), 4,05 (t, 2H), 4,10 (m, 1Н), 5,05 (s, 1Н), водний шар екстрагували СН2Сl2. Органічні шари 6,90-7,0 (m, 3Н), 7,05-7,20 (m, 4Н), 7,25-7,42 (m, об'єднували, промивали водою, сушили над 6Н), 9,01 (d, 1Н, NH). Na2SO4, фільтрували й упарювали. Отриманий Одержання броміду 3-{[(9-гідрокси-9Нпродукт N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-(2флуорен-9-іл)карбоніл]аміно}-1-метил-1фурил)-2-оксоацетамід) використовували без азонійбіцикло[2.2.2]октану (приклад 42) додаткового очищення, як описано нижче. 0,245г (0,00073моля) N-(1-азабіцикло[2.2.2]октВказаний продукт розчиняли в сухому ТГФ 3-ил)-9-гідрокси-9Н-флуорен-9-карбоксаміду (50мл), отриманий розчин охолоджували до -80°С, (приклад 41) розчиняли в 4мл ацетонітрилу і 6 мл додавали 28мл 0,5Μ розчину 1СНСI 3, до отриманого розчину додавали 5,46мл пропінілмагнійброміду (0,014моля) у ТГФ і суміш 1Μ розчину бромистого метилу в ацетонітрилі і перемішували при нагріванні до кімнатної суміш перемішували при кімнатній температурі в температури протягом 3год. Потім реакційну суміш атмосфері Ν2 протягом 96год. Потім розчинники обробляли насиченим розчином NH4Cl і випарювали і залишок тричі упарювали в суміші з екстрагували AcOEt і СН2Сl2. Органічні шари ефіром. До залишку додавали ефір і суміш об'єднували, сушили над Na2SO4, фільтрували і перемішували. Отриману тверду речовину розчинник випарювали. Отриманий продукт відокремлювали фільтруванням і декілька разів очищали хроматографією на колонці із промивали ефіром, при цьому одержували 0,26г силікагелем (елюент: градієнт (83,8%) вказаної в заголовку сполуки. tпл. 197,5CHCl3/MeOH/NH4OH, від 97:3:1 до 94:6:1), при 203,6°С. МС: 349 [М-Вr]+. 1 цьому одержували 1,38г вказаної в заголовку H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,10сполуки (39% у розрахунку на вихідну кислоту) у 2,25 (m, 2Н), 2,96 (s, 3Н), 3,35-3,70 (m, 5Н), 3,78 вигляді суміші діастереомерів. МС: 289 [М+1]+. (m, 1Н), 4,15 (m, 1Н), 6,82 (s, 1H, OH), 7,30 (m, 2H), 1 H-ЯМР (CDCI 3): (суміш діастереомерів) d 7,43 (m, 4H), 7,79 (m, 2H), 8,81 (d, 1H, NH). Метод (д) 7,36-7,35 (m, 1Н), 6,87-6,76 (m, NH, 1H), 6,54-6,52 Одержання трифторацетату (3S)-1(m, 1H), 6,34-6,32 (m, 1H), 3,92 (m, 1H), 3,29-3,17 циклогексилметил-3-[(9Н-ксантен-9(m, 1H), 2,78-2,64 (m, 4H), 2,47-2,35 (m, 1H), 2,00ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану 1,90 (m, 1H), 1,92 (s, 3H), 1,70-1,39 (m, 4H). (приклад 36) Одержання N-[(3R)-1-азабіцикло[2.2.2]окт-328,15мг (0,0842ммоля) N-[(3S)-1ил]-2-фур-2-гідрокси-4-(4азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9метоксифеніл)бутанаміду (приклад 46) карбоксаміду (приклад 33) розчиняли в 0,5мл Вказаний продукт одержували за методикою, ДМСО, додавали розчин 74,37мг (0,421ммоля) описаної в прикладі 45. При цьому 2г (0,014моля) (бромметил)циклогексану в 0,5мл ДМСО і суміш 2-фур-2-ил-2-оксооцтової кислоту обробляли 4перемішували при кімнатній температурі протягом метоксифенетилмагнійхлоридом (0,021моля, 43мл ночі. Суміш очищали на картриджі з катіонітом 0,5Μ розчину в ТГФ) як реактив Гриньяра. Mega Bond Elut для твердофазної екстракції, який Отриманий продукт очищали хроматографією на попередньо промивали 0,1Μ Na2PO4 (рН 7,5). колонці із силікагелем (елюент: градієнт Реакційну суміш наносили на картридж, який CHCl3/MeOH/NH4OH від 99:1:1 до 97:3:1), при промивали 2мл ДМСО, а потім тричі порціями по цьому одержували 2,4г вказаної в заголовку 5мл ацетонітрилом, при цьому елюювали усі сполуки (44% у розрахунку на вихідну кислоту) у вихідні матеріали. Похідне амонію елюювали 5мл вигляді суміші діастереомерів. МС: 385 [М+1]+. 1 0,03Μ розчину ТФО в CH3CN/CHCI 3, 2:1. Елюат H-ЯМР (CDCI 3): (суміш діастереомерів) d нейтралізували додаванням 300мг полі(47,39-7,38 (m, 1Н), 7,09 (d, 2H), 6,82 (d, 2Н), 6,70вінілпіридину), фільтрували й упарювали досуха, 6,67 (m, NH, 1Н), 6,41-6,35 (m, 2H), 3,92 (m, 1Н), при цьому одержували 12,4мг (27,0%) вказаної в 3,78 (s, 3H), 3,33-3,24 (m, 1H), 2,82-2,19 (m, 9H), заголовку сполуки. МС: 431 [M-CF3COO]+. 1,96-1,87 (m, 1H), 1,67-1,40 (m, 4H). Одержання трифторацетату (3R)-3-(2-гідроксиМетод (г) 2.2-дитієн-2-ілацетиламіно)-1-[3-(3Одержання броміду (3R)-1-(3-феноксипропіл)гідроксифенокси)пропіл]-13-[(9Н-ксантен-9-ілкарбоніл)аміно]-1азонійбіцикло[2.2.2]октану (приклад 12) азонійбіцикло[2.2.2]октану (приклад 32) Вказану в заголовку сполуку одержували 0,3г (0,00089моля) N-[(3R)-1(12,7мг, 24%), як описано в прикладі 36 при Азабіцикло[2.2.2]окт-3-ил]-9Н-ксантен-9взаємодії 30мг (0,0861ммоля) N-[(3R)-1карбоксаміду (приклад 31) розчиняли в 6мл ТГФ і азабіцикло[2.2.2]окт-3-ил]-2-гідрокси-2,2-дитієн-2до отриманого розчину додавали 0,21мл (0,287г, ілацетаміду (приклад 4) (розчиненого в 0,5мл 0,001335моля) (3-бромпропокси)бензолу. Суміш ДМСО) і 78мг (0,418ммоля) 3-(3кип'ятили зі зворотним холодильником протягом хлорпропокси)фенолу (розчиненого у 0,5мл 4год, а потім перемішували при кімнатній ДМСО). МС: 499 [M-CF3COO]+. температурі протягом 17год. Реакційну суміш Крім того, в обсяг даного винаходу включені фільтрували, отриману тверду речовину фармацевтичні композиції, які як активний промивали декілька разів ефіром і висушували, інгредієнт містять принаймні одне похідне при цьому одержували 0,48г (98%) вказаної в хінуклідинаміду формули (І) або (II) у суміші з заголовку сполуки. tпл. 278,5-279,2°С. МС: 469 [Мфармацевтично прийнятним носієм або Вr]+. 1 розріджувачем. Переважно композицію одержують H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,05у формі, придатній для перорального введення. 2,30 (m, 4Н), 3,15-3,25 (m, 1Н), 3,30-3.65 (ш, 6Н), 29 80832 30 Фармацевтично прийнятний носій або описані в прикладах 1, 3, 4, 8, 10, 11, 19, 30 і 32, розріджувачі, які змішують з активною сполукою описаних нижче, ІС50 становить менше 60нМ. або сполуками з утворенням композиції за даним Дослідження на моделі бронхоспазму в винаходом, відомі в даній галузі техніки, а вибір морських свинок фактично використовуваних ексципієнтів залежить Дослідження проводили, як описано [H.Konzett від передбачуваного способу введення композиції. і F.Rossler, Arch. Exp. Path. Pharmacol., 195, 71-74 Композиції за даним винаходом переважно (1940)]. Водні розчини аналізованих сполук призначені для перорального введення. вводили інгаляцією при розпиленні анестезованим Композиції для перорального введення одержують самцям морських свинок, які знаходиться на у формі таблеток, таблеток з покриттям, рідкої штучному диханні (Dunkin-Hartley). До і після лікарської форми для інгаляції, порошкоподібної введення лікарського засобу визначали лікарської форми для інгаляції або лікарської бронхіальну реакцію-відповідь на внутрішньовенне форми у вигляді аерозолю, причому всі вказані введення ацетилхоліну і реєстрували зміну форми містять одну або більше сполук за опірності легень через певні проміжки часу (у винаходом. Такі препарати одержують відомими відсотках пригнічення бронхоспазму). способами. Сполуки за даним винаходом інгібували Розріджувачі, які використовуються при реакцію-відповідь у вигляді бронхоспазму на одержанні композицій, включають рідкі і тверді ацетилхолін з високою і тривалою дією. розріджувачі, які сумісні з активним інгредієнтом, На основі отриманих результатів для фахівця при необхідності в суміші з барвниками й в даній галузі є очевидним, що сполуки за даним ароматизаторами. Таблетки і таблетки з винаходом мають надзвичайно високу покриттям звичайно містять від 1 до 500мг, антимускаринову М3 активність і, отже, можуть переважно від 5 до 300мг активного інгредієнта. застосовуватися для лікування захворювань, Композиції для інгаляції можуть містити від 1мкг до асоційованих з мускариновим рецептором M3, 1000мкг, переважно від 10мкг до 800мкг активного включаючи респіраторні порушення, такі, як інгредієнта. Доза сполуки формули (І) або (II) хронічне обструктивне захворювання легень залежить від необхідної дії і тривалості лікування, (COPD), бронхіт, бронхіальна підвищена при введенні дорослому пацієнту доза звичайно реактивність, астма, кашель, риніт; урологічні становить від 3мг до 300мг у добу у випадку порушення, такі, як нетримання сечі, полакіурія, прийому таблетки, і від 10мкг до 800мкг у добу при нейрогенний або нестабільний сечовий міхур, введенні інгаляцією. цистоспазматичний і хронічний цистит; шлунковоФармакологічна дія кишкові порушення, такі, як синдром подразненої Нижче описаний аналіз зв'язування з товстої кишки, спастичний коліт, дивертикуліт і мускариновими рецепторами людини й шлункова виразка; і серцево-судинні дослідження на моделі бронхоспазму в морських захворювання, такі, як синусна брадикардія, свинок. індукована блукаючим нервом. Дослідження зв'язування з мускариновим Крім того, у даному винаході пропонується рецептором людини сполука формули (І) або (II) або фармацевтично Зв'язування [3 H]-NMS з мускариновими прийнятна композиція, яка включає сполуку рецепторами людини визначали, як описано формули (І) або (II), для застосування в способі [Waelbroeck і ін., МоI. Pharmacol., 38, 267-273 лікування людини або тварини, насамперед для (1990)]. Аналіз проводили при 25°С. лікування респіраторного, урологічного або Використовували мембранні препарати, отримані шлунково-кишкового захворювання або зі стабільно трансфектованих клітин яєчника порушення. китайського хом'ячка К-1 (СНО), які експресують Крім того, у даному винаході пропонується гени мускаринових рецепторів М3 людини. застосування сполуки формули (І) або (II) або Для визначення ІС50 мембранні препарати фармацевтично прийнятної композиції, яка суспендували в DPBS при кінцевій концентрації включає сполуку формули (І) або (II), для підвиду М3 89мкг/мл. Суспензію мембран одержання лікарського засобу, призначеного для інкубували зі сполукою, міченою тритієм, протягом лікування респіраторного, урологічного або 60хв. Після інкубації мембранну фракцію шлунково-кишкового захворювання або відокремлювали фільтруванням і визначали порушення. зв'язану радіоактивну мітку. Неспецифічне Крім того, сполуки формули (І) або (II) і зв'язування визначали при додаванні 10 -4Μ фармацевтичні композиції, які включають сполуку атропіну. При побудові індивідуальних кривих формули (І) або (II), можна використовувати в конкурентного зв'язування аналіз проводили з способі лікування респіраторного, урологічного використанням принаймні шести концентрацій з або шлунково-кишкового захворювання або подвійним повтором. порушення, причому вказаний спосіб включає Отримані результати свідчать про те, що введення людині або тварині, які мають потребу в сполуки за даним винаходом мають високу такому лікуванні, ефективної і нетоксичної спорідненість до мускаринових рецепторів М3, кількості сполуки формули (І) або (II) або переважно мускаринових рецепторів людини. фармацевтичної композиції, яка включає сполуку Таким чином, у переважних сполук за винаходом формули (І) або (II). величина ІС50 становить менше 100нМ. У Крім того, сполуки формули (І) або (II) і найбільш переважних сполук, таких, як сполуки, фармацевтичні композиції, які включають сполуку формули (І) або (II), можна використовувати в 31 80832 32 Трифторацетат (3R)-1-аліл-3-(2-гідрокси-2,2комбінації з іншими лікарськими засобами, дитієн-2-ілацетиламіно)-1ефективними при лікуванні вказаних захворювань. азонійбіцикло[2.2.2]октану Наприклад, з b2 агоністами, стероїдами, Вказану в заголовку сполуку синтезували за антиалергічними засобами, інгібіторами методами в та д. Вихід на кінцевій стадії 0,010г, фосфодіестерази IV або інгібіторами лейкотриєну 23,1%. МС: 389 [M-CF3COO]+. D4 (LTD4), при одночасному, окремому або Приклад 7 послідовному застосуванні при лікуванні Трифторацетат (3R)-1-гептил-3 -(2-гідроксиреспіраторного захворювання. 2,2-дитієн-2-ілацетиламіно)-1Даний винахід ілюструється наступними азонійбіцикло[2.2.2]октану прикладами, які не обмежують його обсяг. Вказану в заголовку сполуку синтезували за Приклад 1 методами в та д. Вихід на кінцевій стадії 0,0118г, N-(1-Азабіцикло[2.2.2]окт-3-ил)-2-гідрокси-2,224,4%. МС: 447 [M-CF3COO]+. дитієн-2-ілацетамід Приклад 8 Вказану в заголовку сполуку синтезували за Бромід (3R)-3-(2-гiдpoкcи-2,2-дитiєн-2методом в. Вихід 0,67г, 15,2%. tпл. 185°С. МС: 349 iлaцeтилaмiнo)-1-(3-фeнiлпpoпiл)-1[М+1]+. 1 азонійбіцикло[2.2.2]октану H-ЯМР (ДМСО-d6): d 1,30 (m, 1Н), 1,40-1,75 Вказану в заголовку сполуку синтезували за (m, 3Н), 1,77 (m, 1Н), 2,50-2,75 (m, 4H), 2,83 (m, методами в та г. Вихід на кінцевій стадії 0,49г, 1Н), 3,05 (m, 1H), 3,74 (m, 1H), 6,94 (m, 2H), 7,04 78%. tпл. 117,3-118,9°С. МС: 467 [M-Br]+. (m, 1H), 7,10 (m, 1H), 7,43 (m, 2H), 7,53 (s, 1H, OH), 1 H-ЯМР (ДМСО-d6): d 1,75 (m, 1Н), 1,80-2,05 7,95 (d, 1H, NH). (m, 5H), 2,09 (m, 1H), 2,60 (m, 2H), 3,16 (m, 2H), Приклад 2 3,25-3,60 (m, 5H), 3,68 (m, 1H), 4,21 (m, 1H), 6,96 Бромід 3-(2-гідрокси-2,2-дитієн-2(m, 2H), 7,04 (m, 1H), 7,11 (m, 1H), 7,20-7,40 (m, ілацетиламіно)-1-метил-15H), 7,45 (m, 2H), 7,62 (s, 1H, OH), 8,70 (d, 1H, NH). азонійбіцикло[2.2.2]октану Приклад 9 Вказану в заголовку сполуку синтезували за Трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2методами в та г. Вихід на кінцевій стадії 0,16г, ілацетиламіно)-1-((Е)-3-фенілаліл)-168%. МС: 363 [M-Br]+. 1 азонійбіцикло[2.2.21октану H-ЯМР (ДМСО-d6): d 1,76 (m, 1Н), 1,85-2,08 Вказану в заголовку сполуку синтезували за (m, 3Н), 2,14 (m, 1H), 2,92 (s, 3H), 3,30-3,60 (m, 5H), методами в та д. Вихід на кінцевій стадії 0,0032г, 3,75 (m, 1H), 4,20 (s, 1H), 7,0 (m, 2H), 7,06 (m, 1H), 6,4%. МС: 465 [M-CF3COO]+. 7,12 (m, 1H), 7,46 (m, 2H), 7,65 (s, 1H, OH), 8,64 (d, Приклад 10 1H, NH). Бромід (3R)-3 -(2-гідрокси-2,2-дитієн-2Приклад 3 ілацетиламіно)-1-(2-феноксіетил)-1Бромід 3-(2-гідрокси-2,2-дитієн-2азонійбіцикло[2.2.2]октану ілацетиламіно)-1-(3-феноксипропіл)-1Вказану в заголовку сполуку синтезували за азонійбіцикло[2.2.2]октану методами в та г. Вихід на кінцевій стадії 0,470г, Вказану в заголовку сполуку синтезували за 74%. tпл. 112,6-113,9°С. МС: 469 [M-Br]+. методами в та г. Вихід на кінцевій стадії 0,24г, 1 + H-ЯМР (ДМСО-d6): d 1,77 (m, 1Н), 1,90-2,15 82,7%. tпл. 180,6-188,3°С. МС: 483 [M-Br] . 1 (m, 4H), 3,40-3,80 (m, 7H), 3,86 (m, 1Н), 4,24 (m, Н-ЯМР (ДМСО-d6): d 1,78 (m, 1Н), 1,90-2,25 1Н), 4,43 (m, 2H), 6,95-7,0 (m, 5H), 7,04 (m, 1H), (m, 6H), 3,30-3,65 (m, 7H), 3,67-3,80 (m, 1Н), 4,05 (t, 7,11 (m, 1H), 7,35 (m, 2H), 7,46 (m, 2H), 7,66 (s, 1H, 2H), 4,24 (m, 1Н), 6,94-7,0 (m, 5H), 7,07 (m, 1H), OH), 8,72 (d, 1H, NH). 7,13 (m, 1H), 7,31 (m, 2H), 7,47 (m, 2H), 7,66 (s, 1H, Приклад 11 OH), 8,74 (d, 1H, NH). Бромід (3R)-3-(2-гідрокси-2,2-дитієн-2Приклад 4 ілацетиламіно)-1-(3-феноксипропіл)-1N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2-гідроксиазонійбіцикло[2.2.2]октану 2,2-дитієн-2-ілацетамід Вказану в заголовку сполуку синтезували за Вказану в заголовку сполуку синтезували за методами в та г. Вихід на кінцевій стадії 0,65г, методом в. Вихід 8,77г, 58,5%. V 169°С. МС: 349 80%. tпл. 182°С. МС: 483[M-Br]+. [М+1]+. 1 1 H-ЯМР (ДМСО-d6): d 1,76 (m, 1Н), 1,85-2,25 H-ЯМР (ДМСО-d6): d 1,30 (m, 1Н), 1,42-1,75 (m, 6H), 3,25-3,65 (m, 7H), 3,65-3,82 (m, 1Н), 4,05 (t, (m, ЗН), 1,77 (m, 1Н), 2,50-2,75 (m, 4H), 2,83 (m, 2H), 4,23 (m, 1H), 6,90-7,0 (m, 5H), 7,04 (m, 1H), 1Н), 3,05 (m, 1Н), 3,74 (m, 1H), 6,95 (m, 2H), 7,03 7,11 (m, 1H), 7,31 (m, 2H), 7,45 (m, 2H), 7,65 (s, 1H, (m, 1H), 7,09 (m, 1H), 7,43 (m, 2H), 7,54 (s, 1H, OH), OH), 8,73 (d, 1H, NH). 7,97 (d, 1H, NH). Приклад 12 Приклад 5 Трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2Трифторацетат (3R)-3-(2-гідрокси-2,2-дитієн-2ілацетиламіно)-1-[3-(3-гідроксифенокси)пропіл]-1ілацетиламіно)-1-метил-1азонійбіцикло[2.2.2]октану азонійбіцикло[2.2.2]октану Вказану в заголовку сполуку синтезували за Вказану в заголовку сполуку синтезували за методами в та д. Вихід на кінцевій стадії 0,0127г, методами в та д. Вихід на кінцевій стадії 0,0124г, 24,0%. МС: 499 [M-CF3COO]+. 30,2%. МС: 363 [M-CF3COO]+. Приклад 13 Приклад 6 33 80832 34 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів Трифторацетат (3R)-1-(2-бензилоксіетил)-3-(2гідрокси-2,2-дитієн-2-ілацетиламіно)-150:50) d 1,20-1,80 (m, 13H), 2,50-2,90 (m, 6Н), 3,04 азонійбіцикло[2.2.2]октану (m, 1Н), 3,69 (m, 1Н), 5,98 і 6,01 (s, 1H, OH), 6,93 Вказану в заголовку сполуку синтезували за (m, 1H), 7,08 (m, 1H), 7,35 (m, 1H), 7,59 (m, 1H, методами в та д. Вихід на кінцевій стадії 0,0146г, NH). 28,4%. МС: 483 [M-CF3COO]+. Приклад 20 Приклад 14 N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2-гідроксиБромід (3R)-3-(2-гідрокси-2,2-дитієн-22-тієн-2-ілпент-4-енамід ілацетиламіно)-1-(3-тієн-2-ілпропіл)-1Вказану в заголовку сполуку синтезували у азонійбіцикло[2.2.2]октану вигляді суміші діастереомерів за методом в. Вихід Вказану в заголовку сполуку синтезували за 1,92г, 82,4%. tпл. 54,4-58,3°С. МС: 307 [М+1]+. 1 методами в та г. Вихід на кінцевій стадії 0,49г, H-ЯМР (ДМСО-d6): (суміш діастереомерів) d 77%. tпл. 111,1-113,2°С. МС: 473 [M-Br]+. 1,25 (m, 1Н), 1,40-1,75 (m, 4H), 2,45-2,70 (m, 5Н), 1 H-ЯМР (ДМСО-d6): d 1,75 (m, 1Н), 1,85-2,15 2,70-3,10 (m, 3Н), 3,65 (m, 1Н), 5,0-5,10 (m, 2H), (m, 6H), 2,84 (t, 2H), 3,17 (m, 2H), 3,25-3,45 (m, 3Н), 5,60-5,80 (m, 1H), 6,50 і 6,52 (s, 1H, OH), 6,95 (m, 3,45-3,62 (m, 2Н), 3,70 (m, 1Н), 4,21 (m, 1Н), 6,901H), 7,05 (m, 1H), 7,38 (m, 1H), 7,60 (d, 1H, NH). 7,0 (m, 4H), 7,05 (m, 1H), 7,11 (m, 1H), 7,38 (m, 1H), Приклад 21 7,45 (m, 2H), 7,65 (s, 1H, OH), 8,71 (d, 1H, NH). (2*)-N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2Приклад 15 гiдpoкcи-2-тiєн-2-iлбутaнaмiд (діастереомер N-[(3S)-1-Азабіцикло[2.2.2]окт-3-ил]-2-гідрокси1.70:30) 2,2-дитієн-2-ілацетамід Вказану в заголовку сполуку синтезували за Вказану в заголовку сполуку синтезували за методом в. Вихід 0,19г, 34% (у розрахунку на один методом в. Вихід 0,44г, 7,67%. МС: 349 [М+1]+. ізомер). tпл. 139,0-140,7°С. МС: 295 [М+1]+. 1 1 H-ЯМР (CDCI 3): d 1,40-1,70 (m, 4Н), 1,98 (m, H-ЯМР (ДМСО-d6): (діастереомер 1, 70:30) d 1Н), 2,40-2,47 (m, 1H), 2,60-2,85 (m, 4H), 3,24 (m, 0,80 (t, 3Н), 1,27 (m, 1Н), 1,40-1,80 (m, 4H), 1,83 (m, 1H), 3,97 (m, 1H), 6,91 (d, 1H), 7,01 (m, 2H), 7,15 1Н), 2,16 (m, 1H), 2,45-2,70 (m, 4H), 2,79 (m, 1H), (га, 2Н), 7,33 (m, 2H). 2,90-3,10 (m, 1H), 3,67 (m, 1H), 6,28 і 6,31 (s, 1H, Приклад 16 OH), 6,94 (m, 1H), 7,03 (m, 1H), 7,36 (m, 1H), 7,62 Бромід (3S)-3-(2-гідрокси-2,2-дитієн-2(d, 1H, NH). ілацетиламіно)-1-(3-феноксипропіл)-1(*): Конфігурація не встановлена. азонійбіцикло[2.2.2]октану Приклад 22 Вказану в заголовку сполуку синтезували за (2*)-N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2методами в та г. Вихід на кінцевій стадії 0,36г, гiдpoкcи-2-тiєн-2-iлбутaнaмiд (діастереомер 2, 70,6%. tпл. 172,8-173,9°С. МС: 483 [M-Br]+. 27:73) 1 H-ЯМР (ДМСО-d6): δ 1,78 (m, 1Н), 1,85-2,25 Вказану в заголовку сполуку синтезували за (m, 6H), 3,25-3,65 (m, 7H), 3,70-3,82 (m, 1Н), 4,04 (t, методом в. Вихід 0,42г, 75% (у розрахунку на один 2Н), 4,24 (m, 1Н), 6,90-7,0 (m, 5H), 7,06 (m, 1H), ізомер). tпл. 68,9-70,2°С. МС: 295 [М+1]+. 1 7,12 (m, 1H), 7,31 (m, 2H), 7,45 (m, 2H), 7,65 (s, 1H, H-ЯМР (ДМСО-d6): (діастереомер 2, 27:73) d OH), 8,74 (d, 1Н, NH). 0,82 (t, 3Н), 1,26 (m, 1Н), 1,40-1,80 (m, 4H), 1,86 (m, Приклад 17 1Н), 2,17 (m, 1H), 2,45-2,70 (m, 4H), 2,78 (m, 1H), N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2,2-дитієн2,90-3,10 (m, 1H), 3,67 (m, 1H), 6,29 і 6,32 (s, 1H, 2-ілацетамід OH), 6,93 (m, 1H), 7,03 (m, 1H), 7,36 (m, 1H), 7,62 Вказану в заголовку сполуку синтезували за (d, 1H, NH). методом б. Вихід 0,31г, 17,3%. tпл. 165°С. МС: 333 (*): Конфігурація не встановлена. + [М+1] . Приклад 23 1 H-ЯМР (CDCI 3): d 1,43 (m, 2Н), 1,63 (m, 2Н), (2*)-N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-21,92 (m, 1Н), 2,4 (m, 1Н), 2,65-2,85 (m, 4Н), 3,31 (m, гідрокси-2-тієн-2-ілбут-3-енамід (діастереомер 1) 1Н), 3,97 (m, 1Н), 5,37 (s, 1H), 5,98 (d, 1H, NH), 7,0 Вказану в заголовку сполуку синтезували за (m, 4H), 7,28 (m, 2H). методом в. Вихід 0,21г, 18,9% (у розрахунку на Приклад 18 один ізомер). tпл. 171,7-173,2°С. МС: 293 [М+1]+. 1 Бромід (3R)-3-(2.2-дитієн-2-ілацетиламіно)-1H-ЯМР (ДМСО-d6): (діастереомер 1) d 1,27 (m, (3-феноксипропіл)-1-азонійбіцикло[2.2.2]октану 1Н), 1,40-1,75 (m, 4H), 2,50-2,70 (m, 4Н), 2,77 (m, Вказану в заголовку сполуку синтезували за 1Н), 3,0 (m, 1Н), 3,66 (m, 1H), 5,18 (d, 1H), 5,38 (d, методами б та г. Вихід на кінцевій стадії 0,21г, 1H), 6,41 (dd, 1H), 6,71 (s, 1H, OH), 6,95 (m, 1H), + 79,8%. tпл. 135,6-137,1°С. МС: 467 [M-Br] . 7,02 (m, 1H), 7,41 (m, 1H), 7,70 (d, 1H, NH). 1 H-ЯМР ДМСО-d6): d 1,83 (m, 1Н), 1,94 (m, 2H), (*): Конфігурація не встановлена. 2,0-2,25 (m, 4H), 3,19 (m, 1Н), 3,30-3,55 (m, 6H), Приклад 24 3,86 (m, 1H), 4,03 (t, 2H), 4,18 (m, 1H), 5,65 (s, 1H), (2*)-N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-26,93-6,98 (m, 5H), 7,01-7,06 (m, 2H), 7,31 (m, 2H), гідрокси-2-тієн-2-ілбут-3-енамід (діастереомер 2) 7,42 (m, 2H), 9,10 (d, 1H, NH). Вказану в заголовку сполуку синтезували за Приклад 19 методом в. Вихід 0,21г, 18,9% (у розрахунку на N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2один ізомер). tпл. 53,8-55,0°С. МС: 293 [М+1]+. 1 циклопентил-2-гідрокси-2-тієн-2-ілацетамід H-ЯМР (ДМСО-d6): (діастереомер 2) d 1,27 (m, Вказану в заголовку сполуку синтезували у 1Н), 1,40-1,75 (m, 4H), 2,50-2,70 (m, 4Н), 2,81 (m, вигляді суміші діастереомерів за методом б. Вихід 1Н), 3,03 (m, 1Н), 3,69 (m, 1H), 5,21 (d, 1H), 5,40 (d, 0,12г, 27,9%. МС: 335 [М+1]+. 35 80832 36 1 1H), 6,45 (dd, 1H), 6,74 (s, 1H, OH), 6,96 (m, 1H), H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,057,01 (m, 1H), 7,41 (m, 1H), 7,72 (d, 1H, NH). 2,30 (m, 4H), 3,25-3,70 (m, 7H), 3,82 (m, 1Н), 4,05 (t, (*): Конфігурація не встановлена. 2H), 4,10 (m, 1H), 5,15 (s, 1H), 6,90-7,0 (m, 3H), Приклад 25 7,05-7,20 (m, 4H), 7,25-7,42 (m, 6H), 9,16 (d, 1H, N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2,3NH). дифенілпропанамід Приклад 31 Вказану в заголовку сполуку синтезували у N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-9Hвигляді суміші діастереомерів за методом а. Вихід ксантен-9-карбоксамід 1,21г, 82,3%. tпл. 142°С. МС: 335 [М+1]+. Вказану в заголовку сполуку синтезували за 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів) d методом а. Вихід 1,03г, 43,4%. tпл. 239,7-241,4°С. МС: 335 [М+1]+. 0,95-1,30 (m, 2H), 1,35-1,50 (m, 2Н), 1,52 (m, 1Н), 1 2,14-2,27 (m, 1Н), 2,50-2,65 (m, 4H), 2,81-2,96 (m, H-ЯМР (ДМСО-d6): d 1,25-1,60 (m, 3Н), 1,66 2H), 3,24-3,32 (m, 1H), 3,56 (m, 1H), 3,78-3,89 (m, (m, 1Н), 1,82 (m, 1Н), 2,42-2,50 (m, 1Н), 2,55-2,75 1H), 7,10-7,45 (m, 10H), 8,13 (m, 1H, NH). (m, 3Н), 2,85 (m, 1Н), 3,05 (m, 1Н), 3,60 (m, 1H), 5,0 Приклад 26 (s, 1H), 7,05-7,15 (m, 4H), 7,25-7,35 (m, 4H), 8,52 (d, N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-21H, NH). циклопентил-2-гідрокси-2-фенілацетамід Приклад 32 Вказану в заголовку сполуку синтезували у Бромід (3R)-1-(3-феноксипропіл)-3-[(9Нвигляді суміші діастереомерів за методом б. Вихід ксантен-9-ілкарбоніл)аміно]-10,25г, 28,4%. tпл. 69,8-73,3°С. МС: 329 [М+1]+. азонійбіцикло[2.2,2]октану 1 Вказану в заголовку сполуку синтезували за H-ЯМР (ДМСО-d6): (суміш діастереомерів) d методами а і г. Вихід на кінцевій стадії 0,48г, 98%. 1,25 (m, 3Н), 1,35-1,75 (m, 10Н), 2,40-2,70 (m, 4Н), tпл. 278,5-279,2°С. МС: 469 [M-Br]+. 2,76 (m, 1Н), 2,90-3,10 (m, 2H), 3,62 (m, 1Н), 5,60 і 1 5,62 (s, 1Н, ОН), 7,20-7,23 (m, 1H), 7,27-7,33 (m, H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,052H), 7,52-7,61 (m, 3H). 2,30 (m, 4H), 3,15-3,25 (m, 1H), 3,30-3,65 (m, 6H), Приклад 27 3,82 (m, 1H), 4,05 (t, 2H), 4,10 (m, 1H), 5,05 (s, 1H), N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-26,90-7,0 (m, 3H), 7,05-7,20 (m, 4H), 7,25-7,42 (m, фенілгексанамід 6H), 9,01 (d, 1H, NH). Вказану в заголовку сполуку синтезували у Приклад 33 вигляді суміші діастереомерів за методом а. Вихід N-[(3S)-1-Азабіцикло[2.2.2]окт-3-ил]-9Н1,59г, 63,1%. tпл. 136°С. МС: 301 [М+1]+. ксантен-9-карбоксамід 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів Вказану в заголовку сполуку синтезували за 50:50) d 0,84 (t, 3Н), 1,10-1,60 (m, 9Н), 1,70 (m, 1Н), методом а. Вихід 1,1г, 60%. tпл. 244,2-244,9°C. MC: 335 [М+1]+. 1,90 (m, 1Н), 2,25-2,50 (m, 1Н), 2,50-2,80 (m, 4H), 1 2,94 і 3,05 (m, 1H), 3,50 (m, 1H), 3,65 (m, 1H), 7,15H-ЯМР (ДМСО-d6): d 1,25-1,60 (m, 3Н), 1,66 7,40 (m, 5H), 8,04 (m, 1H, NH). (m, 1Н), 1,82 (m, 1Н), 2,42-2,50 (m, 1Н), 2,55-2,75 Приклад 28 (m, 3H), 2,83 (m, 1H), 3,05 (m, 1H), 3,60 (m, 1H), 5,0 N-(1-Азабіцикло[2.2.2]окт-3-ил)-9Н-ксантен-9(s, 1H), 7,05-7,15 (m, 4H), 7,25-7,35 (m, 4H), 8,53 (d, карбоксамід 1H, NH). Вказану в заголовку сполуку синтезували за Приклад 34 методом б. Вихід 0,28г, 19%. tпл. 251°C. MC: 335 Трифторацетат (3S)-1-аліл-3-[(9Н-ксантен-9[M+1]+. ілкарбоніл)аміно]-1-азонійбіцикло[2.2,2]октану 1 H-ЯМР (ДМСО-d6): d 1,25-1,60 (m, 3Н), 1,67 Вказану в заголовку сполуку синтезували за методами а і д. Вихід на кінцевій стадії 0,0091г, (m, 1Н), 1,82 (m, 1Н), 2,40-2,50 (m, 1Н), 2,55-2,75 22,1%. МС: 375 [M-CF3COO]+. (m, 3Н), 2,82 (m, 1H), 3,06 (m, 1H), 3,62 (m, 1H), 5,0 Приклад 35 (s, 1H), 7,05-7,15 (m, 4H), 7,25-7,35 (m, 4H), 8,51 (d, Трифторацетат (3S)-1-гептил-3-[(9Н-ксантен-91H, NH). ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану Вказану в заголовку сполуку синтезували Вказану в заголовку сполуку синтезували за також за методом а. Вихід 2,11г, 52,6%. методами а і д. Вихід на кінцевій стадії 0,0097г, Приклад 29 21,0%. МС: 433 [M-CF3COO]+. Бромід 1-метил-3-[(9Н-ксантен-9Приклад 36 ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану Трифторацетат (3S)-1-циклогексилметил-3Вказану в заголовку сполуку синтезували за [(9Н-ксантен-9-ілкарбоніл)аміно]-1методами а і г. Вихід на кінцевій стадії 0,25г, азонійбіцикло[2.2.2]октану 77,6%. tпл. 318°С. МС: 349 [M-Br]+. 1 Вказану в заголовку сполуку синтезували за H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,10 (m, методами а і д. Вихід на кінцевій стадії 0,0124г, 1Н), 2,22 (m, 1Н), 2,95 (s, 3Н), 3,10-3,20 (m, 1Н), 27,0%. МС: 431 [M-CF3COO]+. 3,30-3,50 (m, 4H), 3,80 (m, 1H), 4,05 (m, 1H), 5,06 Приклад 37 (s, 1H), 7,08-7,16 (m, 4H), 7,28-7,35 (m, 4H), 8,98 (d, Трифторацетат (3S)-1-(3 -циклогексилпропіл)1H, NH). 3-[(9Н-ксантен-9-ілкарбоніл)аміно]-1Приклад 30 азонійбіцикло[2.2.2]октану Бромід 1-(3-феноксипропіл)-3-[(9Н-ксантен-9Вказану в заголовку сполуку синтезували за ілкарбоніл)аміно]-1-азонійбіцикло[2.2.2]октану методами а і д. Вихід на кінцевій стадії 0,0045г, Вказану в заголовку сполуку синтезували за 9,3%. МС: 459 [M-CF3COO]+. методами а і г. Вихід на кінцевій стадії 0,44г, 100%. Приклад 38 tпл. 242°С. МС: 469 [M-Br]+. 37 80832 38 1 Бромід (3S)-1-(3-феноксипропіл)-3-[(9НН-ЯМР (CDCI 3): d 7,67-7,62 (m, 2H), 7,42-7,36 ксантен-9-ілкарбоніл)аміно]-1(m, 4H), 7,32-7,25 (m, 2H), 6,08-5,93 (m, NH, 1Н), азонійбіцикло[2.2.2]октану 3,74 (m, 1Н), 3,00-2,87 (m, 1Н), 2,52-2,27 (m, 4H), Вказану в заголовку сполуку синтезували за 2,02-1,92 (m, 1Н), 1,80-1,76 (m, 1H), 1,51-1,44 (m, методами а і г. Вихід на кінцевій стадії 0,28г, 85%. 2H), 1,26-1,17 (m, 2H). tпл. 279,0-280,4°С. МС: 469 [M-Br]+. Приклад 45 1 N-[(3R)-1-Aзaбiциклo[2.2.2]oкт-3-ил]-2-фyp-2H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,05ил-2-гiдpoкcипeнт-3-илaмiд 2,30 (m, 4Н), 3,20-3,30 (m, 1Н), 3,30-3,65 (m, 6H), Вказану в заголовку сполуку синтезували у 3,82 (m, 1Н), 4,05 (t, 2H), 4,11 (m, 1H), 5,10 (s, 1H), вигляді суміші діастереомерів за методом в. Вихід 6,90-7,0 (m, 3H), 7,05-7,20 (m, 4H), 7,25-7,42 (m, 1,38г, 39%. МС: 289 [М+1]+. 6H), 9,10 (d, 1H, NH). 1 Приклад 39 H-ЯМР (CDCI 3): (суміш діастереомерів) d Трифторацетат (3S)-1-[3-(5,6,7,87,36-7,35 (m, 1Н), 6,87-6,76 (m, NH, 1Н), 6,54-6,52 тетрагідронафталін-2-ілокси)пропіл]-3-[(9Н(m, 1H), 6,34-6,32 (m, 1H), 3,92 (m, 1H), 3,29-3,17 ксантен-9-ілкарбоніл)аміно]-1(m, 1H), 2,78-2,64 (m, 4H), 2,47-2,35 (m, 1H), 2,00азонійбіцикло[2.2.2]октану 1,90 (m, 1H), 1,92 (s, 3H), 1,70-1,39 (m, 4H). Вказану в заголовку сполуку синтезували за Приклад 46 методами а і д. Вихід на кінцевій стадії 0,0114г, N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-2-фур-221,2%. МС: 523 [M-CF3COO]+. ил-2-гідрокси-4-(4-метоксифеніл)бутанамід Приклад 40 Вказану в заголовку сполуку синтезували у Трифторацетат (3S)-1-[5-(2,6вигляді суміші діастереомерів за методом в. Вихід диметилфенокси)пентил]-3-[(9Н-ксантен-92,4г, 44%. МС: 385 [М+1]+. 1 ілкарбоніл)аміно]-1-азонійбіцикло[2.2.21октану H-ЯМР (CDCI 3): (суміш діастереомерів) d Вказану в заголовку сполуку синтезували за 7,39-7,38 (m, 1Н), 7,09 (d, 2H), 6,82 (d, 2H), 6,70методами а і д. Вихід на кінцевій стадії 0,0101г, 6,67 (m, NH, 1H), 6,41-6,35 (m, 2H), 3,92 (m, 1H), 18,7%. МС: 525 [M-CF3COO]+. 3,78 (s, 3H), 3,33-3,24 (m, 1H), 2,82-2,19 (m, 9H), Приклад 41 1,96-1,87 (m, 1H), 1,67-1,40 (m, 4H). N-(1-Азабіцикло[2.2.21окт-3-ил)-9-гідрокси-9НПриклад 47 флуорен-9-карбоксамід N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-N-метилВказану в заголовку сполуку синтезували за 9Н-ксантен-9-карбоксамід методом б. Вихід 1,06г, 17,6%. W230°C. МС: 335 Вказану в заголовку сполуку синтезували за [М+1]+. методом а. Вихід 0,9г, 50%. МС: 349 [М+1]+. 1 1 H-ЯМР (CDCI 3): d 1,0-1,30 (m, 2Н), 1,52 (m, H-ЯМР (400МГц, 60°С, CDCI 3): d 7,26-7,19 (m, 2Н), 1,79 (m, 1Н), 2,04 (m, 1H), 2,36 (m, 1H), 2,57 4Н), 7,10-7,01 (m, 4Н), 5,51 (s, 1Н), 4,18 (ушир, ш, (m, 3H), 3,05 (m, 1H), 3,77 (m, 1H), 5,45 (ушир, s, 1Н), 2,92 (s, 3Н), 2,85-2,40 (m, 6Н), 1,85-1,20 (m, 1H), 5,71 (d, 1H, NH), 7,20-7,50 (m, 6H), 7,55-7,70 5Н). (m, 2H). Приклад 48 Приклад 42 N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2-(5Бромід 3-{[(9-гідрокси-9Н-флуорен-9бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2іл)карбоніл]аміно]-1-метил-1гідроксіацетамід азонійбіцикло[2.2.2]октану Вказану в заголовку сполуку синтезували у Вказану в заголовку сполуку синтезували за вигляді суміші діастереомерів за методом в. Вихід методами б та г. Вихід на кінцевій стадії 0,26г, 2,1г, 42%. МС: 453,455 [М+1]+. 1 83,8%. tпл. 197,5-203,6°С. МС: 349 [M-Br]+. H-ЯМР (CDCI 3): (суміш діастереомерів) d 1 H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,107,35-7,20 (m, 2Н), 7,08-6,89 (m, 3Н), 6,80 (dd, 1Н), 2,25 (m, 2Н), 2,96 (s, 3Н), 3,35-3,70 (m, 5Н), 3,78 3,93-3,84 (m, 1H), 3,18-3,07 (m, 1H), 2,69-2,58 (m, (m, 1Н), 4,15 (m, 1H), 6,82 (s, 1H, OH), 7,30 (m, 2H), 4H), 2,33-2,22 (m, 4H), 1,92-1,87 (m, 1H), 1,63-1,42 7,43 (m, 4H), 7,79 (m, 2H), 8,81 (d, 1H, NH). (m, 4H). Приклад 43 Приклад 49 Бромід 3-{[(9-гідрокси-9Н-флуорен-9(2S)-N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-2іл)карбоніл]аміно}-1-(3-феноксипропіл)-1циклопентил-2-гідрокси-2-тієн-2-ілацетамід азонійбіцикло[2.2.2]октану Вказану в заголовку сполуку синтезували за Вказану в заголовку сполуку синтезували за методом б. Вихід 0,650г, 44%. МС: 335 [М+1]+. 1 методами б та г. Вихід на кінцевій стадії 0,35г, H-ЯМР (CDCI 3): d 7,24 (m, 1Н), 7,08 (m, 1Н), + 87,5%. tпл. 264°С. МС: 469 [M-Br] . 6,97 (m, 1Н), 6,64 (d, NH, 1H), 3,91-3,81 (m, 1H), 1 H-ЯМР (ДМСО-d6): d 1,80-2,0 (m, 3Н), 2,103,33-3,23 (m, 1H), 2,88-2,69 (m, 5H), 2,42-2,33 (m, 2,30 (m, 4H), 3,30-3,55 (m, 5H), 3,67 (m, 2Н), 3,79 1H), 1,87 (m, 1H), 1,69-1,36 (m, 12H). (m, 1Н), 4,08 (t, 2H), 4,20 (m, 1Н), 6,82 (s, 1H, OH), Приклад 50 6,97 (m, 3H), 7,32 (m, 4H), 7,43 (m, 4H), 7,79 (m, Хлорид (3R)-1-[3-(бeнзoтiaзoл-2-iлoкcи)пропіл]2H), 8,88 (d, 1H, NH). 3-(2-фyp-2-ил-2-гідроксипент-3-иноїламіно)-1Приклад 44 азонійбіцикло[2.2.2]октану N-[(3R)-1-Азабіцикло[2.2.2]окт-3-ил]-9-гідроксиВказану в заголовку сполуку синтезували у 9Н-флуорен-9-карбоксамід вигляді суміші діастереомерів за методами в та г. Вказану в заголовку сполуку синтезували за На кінцевій стадії час реакції становив 7 діб методом б. Вихід 0,304г, 4%. МС: 335 [М+1]+. (умови: ТГФ, кип'ятіння зі зворотним холодильником). Отриманий продукт очищали 39 80832 40 Вказану в заголовку сполуку синтезували за декількома промиваннями ефіром. Вихід 0,337г, методом г із сполуки, описаної в прикладі 49. 75%. МС: 480 [М-С1]+. РХВР: суміш Час реакції становив 5 діб (умови: ТГФ, діастереомерів: 49:51. 1 кип'ятіння зі зворотним холодильником). H-ЯМР (ДМСО-d6): (суміш діастереомерів) d Отриманий продукт очищали декількома 8,53-8,49 (m, NH, 1Н), 7,69 (m, 1H), 7,58 (m, 1H), промиваннями ефіром. Вихід 0,174г, 84%. МС: 379 7,53-7,39 (m, 2H), 7,26-7,19 (m, 2H), 6,43-6,38 (m, [M-Br]+. 2H), 4,20-4,14 (m, 1H), 4,05-3,99 (m, 2H), 3,76-3,65 1 H-ЯМР (ДМСО-d6): d 8,24 (d, NH, 1Н), 7,37 (dd, (m, 1H), 3,60-3,20 (m, 7H), 2,20-1,65 (m, 7H), 1,87 1Н), 7,08 (dd, 1H), 6,94 (dd, 1H), 6,10 (s, OH, 1H), (s, 3H). 5,27 (t, OH, 1H), 5,20-5,10 (m, 1H), 4,15 (m, 1H), Приклад 51 3,85-3,75 (m, 2H), 3,75-3,20 (m, 5H), 2,83-2,77 (m, Хлорид (3R)-3-(2-фур-2-ил-2-гідроксипент-31H), 2,00-1,85 (m, 4H), 1,77-1,66 (m, 1H), 1,53-1,41 иноїламіно)-1-[3-(нафталін-1-ілокси)пропіл]-1(m, 8H). азонійбіцикло[2.2.2]октану Приклад 55 Вказану в заголовку сполуку синтезували у Бромід (3R)-1-(4-ацетоксибутил)-3-[2-(5вигляді суміші діастереомерів за методами в та г. бромтієн-2-іл)-2-(4-фтор-3-метилфеніл)-2На кінцевій стадії час реакції становив 7 діб гідроксіацетиламіно]-1-азонійбіцикло[2.2.2]октану (умови: ТГФ, кип'ятіння зі зворотним Вказану в заголовку сполуку синтезували у холодильником). Отриманий продукт очищали вигляді суміші діастереомерів за методами в та г. декількома промиваннями ефіром. Вихід 0,252г, На кінцевій стадії час реакції становив 41год 57%. МС: 473 [М-С1]+. РХВР: суміш діастереомерів (умови: ТГФ, кип'ятіння зі зворотним 48:52. 1 холодильником). Отриманий продукт очищали H-ЯМР (ДМСО-d6): (суміш діастереомерів) d декількома промиваннями ефіром. Вихід 0,190г, 8,62-8,58 (m, NH, 1Н), 8,23 (m, 1H), 7,90-7,86 (m, 88%. МС: 569, 567 [M-Br]+. 1H), 7,61-7,40 (m, 5H), 7,25 (m, 1H), 6,99 (m, 1H), 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів) d 6,46-6,39 (m, 2H), 4,30-4,20 (m, 3H), 3,95-3,30 (m, 8,72 (d, NH, 1Н), 7,45 (d, 1H), 7,36-7,18 (m, 2H), 8H), 2,42-2,25 (m, 2H), 2,20-1,70 (m, 5H), 1,89 7,13-7,06 (m, 2H), 6,91 (t, 1H), 4,25-4,18 (m, 1H), (s,3H). 4,06-4,00 (m, 2H), 3,72-3,26 (m, 6H), 3,19-3,11 (m, Приклад 52 2H), 2,20 (s, 3H), 2,21-1,84 (m, 1H), 2,02 (s, 3H), Бромід (3R)-1-[3-(бензо[1,3]діоксол-51,95-1,54 (m, 8H). ілокси)пропіл]-3-(2-фур-2-ил-2-гідроксипент-3Приклад 56 иноїламіно)-1-азонійбіцикло[2.2.2]октану Бромід (3R)-3-[2-(5-бpoмтiєн-2-iл)-2-(4-фтop-3Вказану в заголовку сполуку синтезували у мeтилфeнiл)-2-гідроксіацетиламіно]-1-(4вигляді суміші діастереомерів за методами в та г. етоксикарбонілбутил)-1-азонійбіцикло[2.2.2]октану На кінцевій стадії час реакції становив 2 доби Вказану в заголовку сполуку синтезували у (умови: ТГФ, кип'ятіння зі зворотним вигляді суміші діастереомерів за методами в та г. холодильником). Отриманий продукт очищали На кінцевій стадії час реакції становив 46год декількома промиваннями ефіром. Вихід 0,320г, (умови: ТГФ, кип'ятіння зі зворотним 78%. МС: 467 [M-Br]+. РХВР: суміш діастереомерів, холодильником). Отриманий продукт очищали 52:48. 1 декількома промиваннями ефіром. Вихід 0,201г, H-ЯМР (ДМСО-d6): (суміш діастереомерів) d 92%. МС: 583, 581 [M-Br]+. 8,54-8,49 (m, ΝH, 1Н), 7,60 (s, 1H), 7,21 (d, 1H), 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів) d 6,82 (d, 1H), 6,65 (m, 1H), 6,45-6,36 (m, 3H), 5,96 (s, 8,72 (d, NH, 1Н), 7,45 (d, 1Н), 7,36-7,18 (m, 2H), 2H), 4,26-4,15 (m, 1H), 4,00-3,95 (m, 2H), 3,82-3,70 7,13-7,06 (m, 2H), 6,91 (t, 1H), 4,26-4,16 (m, 1H), (m, 1H), 3,61-3,28 (m, 7H), 2,15-1,74 (m, 7H), 1,89 4,06 (q, 2H), 3,65-3,30 (m, 6H), 3,18-3,09 (m, 2H), (s,3H). 2,40-2,32 (m, 2H), 2,20 (s, 3H), 2,08-1,48 (m, 9H), Приклад 53 1,18 (t,3H). Бромід (3R)-3-{[(2S)-2-циклопентил-2-гідроксиПриклад 57 2-тієн-2-ілацетил]аміно}-1-(4,4,4-трифторбутил)-1Бромід (3R)-1-(3-ціанопропіл)-3-[2-фур-2-ил-2азонійбіцикло[2.2.2]октану гідрокси-4-(4-метоксифеніл)бутириламіно]-1Вказану в заголовку сполуку синтезували за азонійбіцикло[2.2.2]октану методом г із сполуки, описаної в прикладі 49. Вказану в заголовку сполуку синтезували у Час реакції становив 3 доби (умови: ТГФ, вигляді суміші діастереомерів за методами в та г. кип'ятіння зі зворотним холодильником). На кінцевій стадії час реакції становив 3 доби Отриманий продукт очищали декількома (умови: ТГФ, кип'ятіння зі зворотним промиваннями ефіром. Вихід 0,183г, 77%. МС: 445 холодильником). Отриманий продукт очищали [M-Br]+. 1 декількома промиваннями ефіром. Вихід 0,113г, H-ЯМР (ДМСО-d6): d 8,28 (d, NH, 1Н), 7,38 (dd, 65%. МС: 452 [M-Br]+. 1H), 7,09 (dd, 1H), 6,94 (dd, 1H), 6,11 (s, OH, 1H), 1 H-ЯМР (ДМСО-d6): (суміш діастереомерів) d 4,21-4,12 (m, 1H), 3,72 (m, 1H), 3,59-3,30 (m, 5H), 8,49-8,40 (m, NH, 1Н), 7,58 (s, 1H), 7,09 (d, 2H), 3,25-3,17 (m, 2H), 2,80 (m, 1H), 2,41-2,25 (m, 2H), 6,84 (d, 2H), 6,41-6,35 (m, 2H), 6,33 (d, 1H), 4,272,05-1,80 (m, 6H), 1,80-1,62 (m, 1H), 1,62-1,30 (m, 4,19 (m, 1H), 3,80-3,65 (m, 1H), 3,71 (s, 3H), 3,638H). 3,36 (m, 5H), 3,23-3,17 (m, 2H), 2,68-2,60 (m, 3H), Приклад 54 2,40-1,73 (m, 10H). Бромід (3R)-3-{[(2S)-2-циклопентил-2-гідроксиПриклад 58 2-тієн-2-ілацетил]аміно}-1-(2-гідроксіетил)-1азонійбіцикло[2.2.2]октану 41 80832 42 Лактоза 113,6мг Бромід (3R)-1-(2-[1,3]діоксолан-2-ілетил)-3-[2Мікрокристалічна целюлоза 28,4мг фур-2-ил-2-гідрокси-4-(4Пухкий кремнієвий ангідрид 1,5мг метоксифеніл)бутириламіно]-1Стеарат магнію 1,5мг азонійбіцикло[2.2.2]октану 15г Сполуки за даним винаходом Вказану в заголовку сполуку синтезували у перемішували з використанням змішувача з 340,8г вигляді суміші діастереомерів за методами в та г. лактози і 85,2г мікрокристалічної целюлози. Суміш На кінцевій стадії час реакції становив 3 доби піддавали формуванню під тиском з (умови: ТГФ, кип'ятіння зі зворотним використанням валкового преса з утворенням холодильником). Отриманий продукт очищали пластівчастого спресованого матеріалу. декількома промиваннями ефіром. Вихід 0,128г, Пластівчастий спресований матеріал 70%. МС: 485 [M-Br]+. 1 подрібнювали на молотковому млині і H-ЯМР (ДМСО-d6): (суміш діастереомерів) d порошкоподібний матеріал просіювали через сито 8,47-8,37 (m, NH, 1Н), 7,58 (s, 1H), 7,09 (d, 2H), 20меш. Потім до просіяного матеріалу додавали 6,84 (d, 2H), 6,40-6,35 (m, 2H), 6,32 (d, 1H), 4,944,5г пухкого, кремнієвого ангідриду і 4,5г стеарату 4,90 (m, 1H), 4,21 (m, 1H), 3,96-3,77 (m, 4H), 3,71 магнію і суміш перемішували. Суміш пресували на (s, 3H), 3,59-3,21 (m, 7H), 2,72-2,61 (m, 1H), 2,41таблетувальній машині, обладнаній формою 1,74 (m, 10H). діаметром 7,5мм, при цьому одержували 3000 Приклад 59 таблеток, кожна масою 150мг. Хлорид (3R)-3-{[(9-гідрокси-9Н-флуорен-9Приклад 63 іл)карбоніл]аміно}-1-[3-(метилфеніламіно)пропіл]Одержання фармацевтичної композиції у 1-азонійбіцикло[2.2.2]октану вигляді таблеток з покриттям Вказану в заголовку сполуку синтезували за Склад: методами б та г. На кінцевій стадії час реакції Сполука за даним винаходом 5,0мг становив 20 діб (умови: ТГФ/СНСl3, 1:1, кип'ятіння Лактоза 95,2мг зі зворотним холодильником). Отриманий продукт Кукурудзяний крохмаль 40,8мг очищали промиванням гарячим СНСI 3 і ефіром. Полівінілпіролідон К25 7,5мг Вихід 0,052г, 33%. МС: 482 [М-С1]+. 1 Стеарат магнію 1,5мг H-ЯМР (ДМСО-d6): d 8,86 (d, NH, 1Н), 7,78 (d, Гідроксипропілцелюлоза 2,3мг 2H), 7,45-7,16 (m, 8H), 6,81-6,62 (m, 4H), 4,23-4,14 Поліетиленгліколь 6000 0,4мг (m, 1H), 3,76-3,53 (m, 2H), 3,43-3,17 (m, 8H), 2,91 Діоксид титану 1,1мг (s, 3H), 2,23-1,77 (m, 7H). Очищений тальк 0,7мг Приклад 60 15г Сполуки за даним винаходом змішували в Бромід (3R)-3-[метил-(9H-ксантен-9змішувачі для гранулювання в киплячому шарі з ілкарбоніл)аміно]-1-(3-пірол-1-ілпропіл)-1285,6г лактози і 122,4г кукурудзяного крохмалю. В азонійбіцикло[2.2.2]октану окремій посудині 22,5г полівінілпіролідону Вказану в заголовку сполуку синтезували за розчиняли в 127,5г води для одержання методами а і г. На кінцевій стадії час реакції сполучного розчину. На вказану суміш у машині становив 2 доби (умови: ТГФ, кип'ятіння зі для гранулювання наносили сполучний розчин з зворотним холодильником). Отриманий продукт утворенням гранул. До отриманих гранул очищали декількома промиваннями ТГФ і ефіром. додавали 4,5г стеарату магнію і суміш Вихід 0,257г, 83%. МС: 456 [M-Br]+. 1 перемішували. Отриману суміш пресували на H-ЯМР (ДМСО-d6): d 7,34-7,06 (m, 8Н), 6,78 таблетувальній машині, обладнаною двоввігнутою (m, 2Н), 6,01 (m, 2Н), 5,75 (s, 1Н), 4,47 (m, 1H), формою діаметром 6,5мм, при цьому одержували 3,94-3,88 (m, 2H), 3,72-3,25 (m, 6H), 3,39 (s, 3H), 3000 таблеток, кожна масою 150мг. 3,20-3,05 (m, 2H), 2,22-1,88 (m, 7H). В окремій посудині одержували розчин Приклад 61 покриття, для цього в 72,6г води змішували 6,9г Хлорид (3R)-1-[3-(дифеніл-4-ілокси)пропіл]-3гідроксипропілметилцелюлози 2910, 1,2г [метил-(9Н-ксантен-9-карбоніл)аміно]-1поліетиленгліколю 6000, 3,3г діоксиду титану і 2,1г азонійбіцикло[2.2.2]октану очищеного тальку. Отриманим розчином Вказану в заголовку сполуку синтезували за покривали 3000 таблеток, отриманих вище, при методами а і г. На кінцевій стадії час реакції цьому одержували таблетки з плівковим становив 11 діб (умови: ТГФ, кип'ятіння зі покриттям, кожна масою 154,5мг. зворотним холодильником). Отриманий продукт Приклад 64 очищали декількома промиваннями ТГФ і ефіром. + Одержання фармацевтичної композиції у Вихід 0,195г, 57%. МС: 559 [М-С1] . 1 вигляді рідкої лікарської форми для інгаляції H-ЯМР (ДМСО-d6): d 7,62 (d, 4Н), 7,47-7,02 (m, Склад: 13Н), 5,77 (s, 1Н), 4,50 (m, 1Н), 4,13-4,06 (m, 2Н), Сполука за даним винаходом 400мкг 3,82-3,31 (m, 8Н), 3,42 (s, ЗН), 2,25-1,91 (m, 7H). Фізіологічний розчин 1мл Фармацевтичні композиції за даним 40мг Сполуки за даним винаходом розчиняли винаходом і способи їх одержання ілюструються в 90мл фізіологічного розчину і доводили до наступними прикладами. загального об'єму 100мл додаванням Приклад 62 фізіологічного розчину. Отриманий розчин Одержання фармацевтичної композиції у фасували по 1мл в ампули об'ємом 1мл, а потім вигляді таблеток стерилізували при 115°С впродовж 30хв з Склад: утворенням рідкої лікарської форми для інгаляції. Сполука за даним винаходом 5,0мг 43 80832 Приклад 65 Одержання фармацевтичної композиції у вигляді порошкоподібної лікарської форми для інгаляції Склад: Сполука за даним винаходом 200мкг Лактоза 4000мкг 20г Сполуки за даним винаходом рівномірно змішували з 400г лактози й отриманою сумішшю порціями по 200мг заповнювали інгалятор для ексклюзивного застосування у вигляді порошкоподібної лікарської форми для інгаляції. Приклад 66 Одержання фармацевтичної композиції у вигляді лікарської форми для інгаляції аерозолем Склад: Сполука за даним винаходом 200мкг Дигідратований (абсолютний) етанол USP 8400мкг 1,1,1,2-Тетрафторетан (HFC-134A) 46810мкг Концентрат активного інгредієнта одержували при розчиненні 0,0480г сполуки за даним винаходом в 2,0160г етилового спирту. Концентрат поміщали у відповідний апарат для наповнення контейнерів. Потім концентратом активного інгредієнта заповнювали контейнер, вільний простір над розчином продували азотом або парами HFC-134A (інгредієнти для продування повинні містити не більше 1млн. частини кисню) і закривали клапаном. Потім закритий контейнер заповнювали під тиском 11,2344г газу-витискувача HFC-134A. 44
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinuclidine amide derivatives
Автори англійськоюPrat Quinones, Maria
Назва патенту російськоюПроизводные хинуклидинамида
Автори російськоюПрат Киньонес Мария
МПК / Мітки
МПК: C07D 453/00, A61K 45/00, C07D 487/08, A61P 13/00, A61P 11/00, A61P 1/00, A61K 31/439, A61P 25/02
Мітки: похідні, хінуклідинаміду
Код посилання
<a href="https://ua.patents.su/22-80832-pokhidni-khinuklidinamidu.html" target="_blank" rel="follow" title="База патентів України">Похідні хінуклідинаміду</a>
Попередній патент: Фармацевтична композиція відстроченого вивільнення у формі таблетки, що містить сіль праміпексолу, та спосіб лікування пацієнта
Наступний патент: Спосіб і пристрій, що використовуються для виготовлення шаруватих виробів
Випадковий патент: Спосіб самозбудження резонансного інвертора з діодами зустрічного струму


























