Аналоги азацитидину та їх застосування
Формула / Реферат
1. Сполука Формули (І)
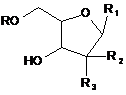 , (I)
, (I)
де
R являє собою Н або R5C(O);
R1 являє собою
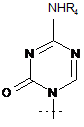 або
або 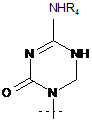 ,
,
де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І);
R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН;
R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і
R5 являє собою С3-С26алкеніл,
або фармацевтична сіль зазначеної сполуки.
2. Сполука за п. 1, де R5 являє собою С9-С26алкеніл.
3. Сполука за п. 1, де R являє собою R5C(O), R1 являє собою
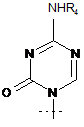 ,
,
R2 являє собою Н, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН-(СН2)7-.
4. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтичний наповнювач, розріджувач та/або носій.
5. Спосіб лікування неопластичного стану в пацієнта, що включає:
відбір пацієнта з неопластичним станом і
введення зазначеному пацієнтові сполуки формули:
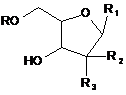 , (I)
, (I)
де
R являє собою Н або R5C(O);
R1 являє собою
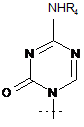 або
або  ,
,
де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І);
R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН;
R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і
R5 являє собою С3-С26алкеніл,
або фармацевтичної солі зазначеної сполуки в умовах, ефективних для лікування зазначеного неопластичного стану в пацієнта.
6. Спосіб за п. 5, де R5 являє собою С9-С26алкеніл.
7. Спосіб за п. 5, де зазначений неопластичний стан являє собою ракове захворювання.
8. Спосіб за п. 7, де ракове захворювання являє собою солідну пухлину або гематологічний рак, або злоякісне утворення.
9. Спосіб за п. 7, де зазначене ракове захворювання являє собою лейкемію, лімфому, множинну лімфому або мієлодиспластичний синдром.
10. Спосіб за п. 8, де солідна пухлина являє собою рак тканини, вибраної із групи тканин, що складається з: тканини молочної залози, яєчника, простати, мозку, сечового міхура й легенів.
11. Спосіб за п. 7, де R являє собою R5C(O), R1 являє собою
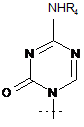 ,
,
R2 являє собою Н, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН-(СН2)7-.
12. Спосіб лікування запального стану у пацієнта, що включає:
відбір пацієнта із запальним станом і
введення зазначеному пацієнтові сполуки формули:
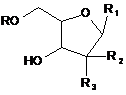 , (I)
, (I)
де
R являє собою Н або R5C(O);
R1 являє собою
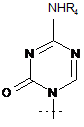 або
або  ,
,
де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І);
R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН;
R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і
R5 являє собою С3-С26алкеніл,
або фармацевтичної солі зазначеної сполуки в умовах, ефективних для лікування зазначеного запального стану.
13. Спосіб за п. 12, де R5 являє собою С9-С26алкеніл.
14. Спосіб за п. 12, де зазначений запальний стан представляє запальний стан легенів, сполучної тканини, шлунково-кишкового тракту або судинної системи.
15. Спосіб за п. 12, де R являє собою R5C(O), R1 являє собою
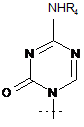 ,
,
R2 являє собою H, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН-(СН2)7-.
Текст
Реферат: Даний винахід направлений на сполуки наступної Формули (І): O RO R1 R2 HO R3 , (I) дe R являє собою H, R5C(O); R1 являє собою NHR4 N O NHR4 N N O N або NH N , UA 99836 C2 (12) UA 99836 C2 де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І); R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН; R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і R5 являє собою С3-С26алкеніл, або фармацевтичні солі зазначених сполук. Також запропоновані способи одержання й застосування цих сполук. UA 99836 C2 5 10 [0001] Даною заявкою заявлений пріоритет на основі попередньої заявки на патент США № 60/975437, що подана в патентне відомство США 26 вересня 2007 р., зміст якої повністю включений в даний опис за допомогою посилання. ГАЛУЗЬ ТЕХНІКИ [0002] Даний винахід відноситься до аналогів азацитидину та їхньому застосуванню. РІВЕНЬ ТЕХНІКИ [0003] Аналоги нуклеозидів, похідні природних нуклеозидів, що зустрічаються як будівельні блоки ДНК і РНК, є ефективними в клінічному лікуванні раку або вірусних захворювань у людини, хоча раніше подібні сполуки розглядали як протитуберкульозні агенти. Такі сполуки зареєстровані на ринку вже протягом більше 40 років, і в даний час приблизно 35 продуктів застосовуються щодня. Природні нуклеозиди, що нижче наведені в Табл. 1, складаються з азотистих основ двох класів, а саме пуринів (представлені аденіном і гуаніном) і піримідинів (представлені тиміном, урацилом і цитозином), а також з моносахариду рибози або дезоксирибози. 15 Таблиця 1 Пурини Гуанін Аденін Піримідини Тимін Урацил Цитозин Моносахариди Рибоза 2-Дезоксирибоза [0004] Всі природні нуклеозиди існують у так званій β-D конфігурації, як показано нижче у Формулі А. Азотиста основа і гідроксиметильний бічний ланцюг у циклі цукру перебувають по одну й ту ж саму сторону (цис) від площини кільця цукру. 20 HO Base O OH (OH,H) 1 UA 99836 C2 Формула A 5 10 15 20 25 30 35 40 45 50 55 60 [0005] З метою одержання нуклеозидних похідних із протираковою або противірусною активністю були зроблені хімічні модифікації в азотистій основі та/або моносахариді. Наприклад, введення в азотисту основу атомів галогену або інших функціональних груп, введення додаткових атомів азоту, або ж стереохімічна заміна кільця моносахариду з рибози на арабінозу або видалення гідроксильної групи з одержанням дезоксирибози може призводити до утворення продуктів, які мають терапевтичний потенціал. У багатьох продуктах моносахаридне кільце зберігається, тоді як в інших кільце цукру може бути трансформоване в ланцюг. Аналоги нуклеозидів являють собою невеликі молекули, що мають чудову розчинність у воді. [0006] Численні зусилля, спрямовані на дослідження й розробки в галузі аналогів нуклеозидів, що обумовлені всесвітньою епідемією СНІДу, сприяли нагромадженню фундаментальної бази знань і розумінню механізму дії, змін у профілі активності завдяки хімічній модифікації і. т.п., відносяться також і до галузі лікування раку. [0007] Загальним недоліком багатьох ліків, включаючи аналоги нуклеозидів, є низька активність і низька специфічність при лікуванні конкретного розглянутого захворювання. Деякі з цих проблем можна віднести до активності, властивої самій лікарській речовині, деякі можна віднести до деяких механізмів стійкості (як вроджених, так і придбаних у ході лікування, наприклад множинна лікарська стійкість (MDR) при лікуванні раку). Деякі проблеми можна віднести до уповільненого транспорту або клітинного захвату та механізмів активації. Деякі проблеми можна віднести до швидкої інактивації та/або екскреції ліків. [0008] Ефективність аналогів нуклеозидів залежить у чималому ступені від їхньої здатності мімікрувати під природні нуклеозиди, і, таким чином, взаємодіяти з вірусними та/або клітинними ферментами, а також перешкоджати протіканню ключових процесів у метаболізмі нуклеїнових кислот (або інгібувати їх). Для того щоб привести в дію їх противірусну або протиракову активність, аналоги нуклеозидів варто трансформувати через їх моно- і дифосфати у відповідні трифосфати під дією вірусних та/або клітинних кіназ. У загальному випадку, активним агентом є трифосфат, але для деяких продуктів, наприклад для гемцитабіну, навіть вплив дифосфату може бути клінічно значимим. [0009] Для того щоб досягти уражених захворюванням, ракових або інфікованих вірусом клітин або тканин після ентерального або парентерального введення, аналоги нуклеозидів повинні мати підходящі фармакокінетичні характеристики. Крім швидкої екскреції введених ліків, багато аналогів нуклеозидів можуть бути деактивовані як у кровотоку, так і у тканинах. Наприклад, похідні цитозину, навіть на рівні монофосфату, можуть бути швидко деаміновані під дією класу ферментів, названих деаміназами, до неактивного аналога урацилу. Клітинний захват і, таким чином, висока терапевтична ефективність багатьох аналогів нуклеозидів сильно залежить від мембранних білків, які здійснюють транспорт нуклеозидів (названих концентруючими й урівноважуючими нуклеозидними переносниками). Отже, об'єктом пошуку є сполуки, яким не потрібен такий специфічний механізм захвату. Ще один фактор, що обмежує активність, особливо в сфері лікування раку, являє собою механізми клітинного відновлення. Коли монофосфат протиракового нуклеозидного аналога вбудовується в клітинну ДНК, він не видаляється з ДНК ракової клітини під дією ендонуклеази, пов'язаної з білком p53. Проте, видалення нуклеозидного аналога із ДНК здорової клітини є бажаним для того, щоб обмежити побічні ефекти ліків. [0010] Протягом довгих років було розроблено багато нуклеозидних аналогів, які значною мірою переборюють деякі або багато факторів, що обмежують активність. Як приклад, що ілюструє сполуку, яка має високу специфічність, можна привести ацикловір (ACV). ACVмонофосфат може утворюватися тільки під дією вірусних кіназ, і це означає, що ACV не може бути активований у неінфікованих клітинах. Незважаючи на цей факт, ACV не є винятково активним продуктом. Для того щоб обійти розповсюджену швидкість-лімітуючу стадію в активації нуклеозидного аналога, тобто внутрішньоклітинне утворення монофосфата нуклеозидного аналога, було розроблено декілька фосфонатів, таких як цидофовір, або навіть монофосфатні продукти. Для забезпечення можливості перорального прийому або бажаної диспозиції ліків в організмі, були одержані конкретні проліки, такі як Hepsera. [0011] На додаток до структурних змін, зроблених у нуклеозидних аналогах для досягнення підвищеної клінічної застосовності, були здійснені подальші модифікації для покращення активності. Існує декілька прикладів модифікованих нуклеозидних аналогів, одержуваних у результаті приєднання ліпідної частини (патенти США №№ 6 153 594, 6 548 486, 6 316 425 й 6 384 019; заявки на Європейський патент №№ EP-A-56265 й EP-A-393920; і WO 99/26958). Приєднання ліпідної частини можна досягти шляхом приєднання жирних кислот, наприклад, за 2 UA 99836 C2 5 10 15 20 25 30 35 40 45 допомогою складноефірного, амідного, карбонатного або карбаматного зв'язку. Можна одержати більш досконалі продукти, такі як фосфоліпідні похідні аналогів нуклеозидів. Див. Eur J Pharm Sci 11b Suppl 2: 15-27 (2000); Європейський патент № 545966; Канадський патент № 2468099; і патенти США №№ 6 372 725 й 6 670 341. У зазначених документах описується, що такі аналоги мають противірусну активність, яка особливо підходить для лікування й профілактики інфекцій, викликаних ДНК, РНК або ретровірусами. Вони також підходять для лікування злоякісних пухлин. Ліпідні похідні аналогів нуклеозидів можуть служити декільком цілям. Їх можна розглядати як проліки, що не є субстратом для деаміназ, охороняючи таким чином нуклеозидні аналоги від деактивації під час транспорту в кровотоку. Ліпідні похідні також можуть бути більш ефективно транспортовані через клітинну мембрану, що призведе до підвищеної внутрішньоклітинної концентрації нуклеозидного аналога. Ліпідні препарати можуть бути також більш підходящими для застосування в дермальних препаратах, пероральних продуктах (див. патент США № 6 576 636 й WO 01/18013), або конкретних композиціях, таких як ліпосоми (див. патент США №5 223 263), розроблених для впливу на пухлини. [0012] Було показано, що у випадку нуклеозидних аналогів зі збереженою β-D конфігурацією моносахаридного кільця або нуклеозидних аналогів з нециклічним бічним ланцюгом противірусна або протиракова активність може бути найбільш ефективно покращена шляхом одержання похідних мононенасичених ω-9 C18 й C20 жирних кислот. Див. Antimicrobial Agents and Chemotherapy, Vol., 53-61 (1999); Cancer Research 59: 2944-2949 (1999); Gene Therapy, 5: 419-426 (1998); Antiviral Research, 45: 157-167 (2000); і Biochemical Pharmacology, 67: 503-511 (2004). Бажано, щоб мононенасичені похідні були не тільки більш активними, ніж поліненасичені аналоги, але й щоб вони легше піддавалися кристалізації й були більш стійкими до окислювання ліпідного ланцюга. Таким чином, зазначені похідні є більш переважними сполуками з погляду хімічного й фармацевтичного виробництва. Було також показано, що мононенасичені жирні кислоти ω-9 C18 й C20 підходять для покращення терапевтичної активності великого числа біологічно активних речовин ненуклеозидної природи (див. Європейський патент № 0977725). [0013] Порівняно новою підгрупою нуклеозидних аналогів є так названі аза-C похідні. У сполук цього класу CH-група в положенні 5 у піримідиновій основі замінена атомом азоту, як показано нижче у формулі B. Формула B [0014] Потенційними мішенями для реактивації за допомогою нових хіміотерапевтичних агентів є гени-супресори пухлин, які були виключені внаслідок аберантного метилування ДНК. Похідні аза-цитидину й 5-аза-2'-дезоксицитидину (5-аза-C, 5-аза-CdR, Децитабін), які є сильними інгібіторами метилування ДНК і протилейкемічними агентами, можуть реактивувати виключений ген-супресор пухлин. При високих концентраціях ці сполуки цитотоксичні, але при більш низьких концентраціях гіпометилування призводить до диференціювання клітинних ліній. Ці сполуки вимагають метаболічної активації за допомогою дезоксицитидинкінази й здійснюють інгібування ДНК-метилтрансферази. Однією з перешкод для їхньої лікувальної дії є їх швидка in vivo інактивація за участю цитидиндеамінази (CD). Нестійкість у водних розчинах, а також сукупність побічних ефектів обмежують клінічну активність зазначених сполук. [0015] Даний винахід направлений на подолання цих та інших недоліків у даній галузі техніки. КОРОТКИЙ ОПИС ВИНАХОДУ [0016] Один з аспектів даного винаходу направлений на сполуку відповідно щодо Формули (I) 3 UA 99836 C2 O RO R1 (I) R2 HO R3 де R - являє собою H, R5C(O); R1 - являє собою NHR4 NHR4 N O 5 10 15 20 25 30 35 40 N N N O NH N або , де перетинаюча пунктирна лінія зображує зв'язок, що утворився, що приєднує R 1 до молекули Формули (I), R2 і R3 - незалежно являють собою OH або H, за умови, що R2 і R3 не є одночасно OH, R4 - являє собою H або R5C(O), за умови, що R і R4 не є одночасно H, R5 - являє собою алкеніл C3-C26; або фармацевтичну сіль зазначеної сполуки. [0017] Інший аспект даного винаходу направлений на фармацевтичну композицію, яка містить сполуку Формули (I) і фармацевтичний ексципієнт, розріджувач та/або носій. [0018] Ще один аспект даного винаходу направлений на спосіб лікування неопластичного синдрому у пацієнтів. Даний спосіб включає відбір пацієнта з неопластичним синдромом і введення йому сполуки Формули (I), як описано вище, або фармацевтичної солі цієї сполуки, в умовах, ефективних для лікування неопластичного синдрому у пацієнта. [0019] Ще один аспект даного винаходу направлений на спосіб лікування запального синдрому у пацієнтів. Даний спосіб включає відбір пацієнта із запальним синдромом і введення йому сполуки Формули (I), як описано вище, або фармацевтичної солі цієї сполуки, в умовах, ефективних для лікування запального синдрому у пацієнта. [0020] Нестійкість Аза-C у буферному розчині й плазмі крові добре відома (див. Israili et al., Cancer Research 36, 1453-1461 (1976); Rudek et al., J Clin Oncol, 23:17, 3906-3911(2005); Rustum et al., J Chromat, 421:12, 387-91 (1987); Zhao et al., J Chromat B, 813, 81-88 (2004), повністю включені в дану заявку за допомогою посилання). Повідомлялася середня величина кінцевого періоду напіввиведення для Аза-C, складова 1,50±2,30 годин у клінічних зразках плазми крові (див. Rudek et al., J Clin Oncol, 23:17, 3906-3911(2005), дане джерело повністю включене в дану заявку за допомогою посилання). У дослідженнях in vitro була відзначена втрата 20 % Aза-C навіть при -60 °C після 4,5 днів зберігання, і втрата 10 % протягом 0,5 години при зберіганні при кімнатній температурі (див. Zhao et al., J Chromat B, 813, 81-88 (2004), дане джерело повністю включене в дану заявку за допомогою посилання). Припускають, що первинна нестійкість Aза-C обумовлена швидким (перша стадія є оборотною) розкриттям циклу 5-Аза-піримідинового кільця з наступним розпадом мурашиної кислоти (див. Chan et al., J Pharma Sci, 68;7, 807-12 (1979), дане джерело повністю включене в дану заявку за допомогою посилання). Передбачається, що інші шляхи розпаду обумовлені деамінуванням аміногрупи в 4 положенні й гідролізом глікозидного зв'язку з утворенням D-рибози й 5-азацитозину. Було несподівано виявлено, що переважні ліпідні похідні Aза-C мають значно кращий профіль стійкості в плазмі у порівнянні із самим Aза-C. Сполуки є стабільними (частка залишеного від вихідного ≥ 94 %) у контрольній матриці людської плазми при кімнатній температурі протягом щонайменше 4 годин в експериментальних умовах, і в післяекстракційному супернатанті після осадження плазменних білків не було виявлено значимих продуктів деградації. Стійкість у плазмі переважних ліпідних сполук була вивчена далі в умовах зберігання при 37 °C. Було показано, що можливість розкриття кільця Аза-фрагмента або іншого розпаду сполуки істотно знижується, якщо до Aза-C приєднаний ліпідний бічний ланцюг. 4 UA 99836 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0021] Швидкий розпад Aза-C є перешкодою для клінічного застосування Аза-С. Підвищена стійкість у плазмі крові ліпідних похідних у порівнянні із самим Аза-С може забезпечити високий і стійкий рівень ліпідного похідного в плазмі пацієнта. Це може призвести до кращого розподілу в тканині/органі/пухлині й схильності клітини до дії ліків, а також засвоєнню ліків, ніж для самого Аза-С, з одного боку, і, отже, до кращої схильності ДНК пухлинних клітин до дії Аза-С після внутрішньоклітинного гідролізу Аза-C-5'-складноефірного зв'язку. [0022] У варіантах реалізації даного винаходу за допомогою модифікації азацитидину й дезоксицитидину (наприклад, 5-аза-2'-дезоксицитидину) запропоновані нові молекули із властивостями, які несподівано відрізняються від властивостей азацитидину й дезоксицитидину (наприклад, 5-аза-2'-дезоксицитидину). Це забезпечує серію сполук, що мають активність значно більшу, ніж протиракова активність азацитидину й дезоксицитидину (наприклад, 5-аза-2'дезоксицитидину), яка обмежена гематологічними злоякісними утвореннями. Ці нові сполуки мають протиракову дію, спрямовану проти широкого спектра солідних пухлин, включаючи рак молочної залози й шийки матки. Ці сполуки проявляють також несподівану активність проти тих видів раку, які стійкі до лікування, і, таким чином, вони можуть бути корисні в терапії солідних пухлин у тих випадках, коли поточний вибір терапевтичних засобів обмежений. Варіанти реалізації даного винаходу терапевтично застосовані при лікуванні раку в тих випадках, коли варіанти й ефективність лікування обмежені, і зазначені варіанти реалізації заповнюють незадоволену потребу. [0023] Запропоновані сполуки демонструють більш раннє проявлення активності після обмеженого часу впливу, і тому ефективне лише короткострокове лікування з їхнім використанням у клінічній ситуації. Це призводить до більш короткого, менш частого терапевтичного впливу й зниженню пов'язаних з ліками токсичних ефектів, у порівнянні з вихідним лікарським засобом. Таким чином, забезпечується підвищений терапевтичний індекс. [0024] При зміні структури за рахунок введення ліпідного (включаючи як складні ефіри, так і аміди) компонента зберігається азольне цитидинове кільце і, отже, вплив молекули на епігенетичні механізми. Епігенетична модуляція надає важливий механізм зміни експресії генів при раку та запаленні. Зазначені нові сполуки є активними при менших концентраціях, ніж азиридин і, таким чином, є більш активними. Ці сполуки зі зміненим спектром активності можуть модулювати епігенетичні мішені в солідних пухлинах і при запальних захворюваннях. [0025] Епігенетичні механізми важливі в протизапальних станах, які включають, але не обмежуються ними, запальні стани легенів, сполучних тканин, шлунково-кишкового тракту й судинної системи. Дані сполуки шляхом впливу на епігенетичні механізми можуть знижувати або обертати розвиток запальних процесів, що відповідають за ці захворювання. КОРОТКИЙ ОПИС КРЕСЛЕНЬ [0026] На Фіг. 1A-B зображені діаграми порівняльної цитотоксичної активності 5-азацитидин5'-елаідат (CP) і 5-АзаС на лейкемічних і солідно-пухлинних клітинних лініях. Цитотоксичність визначали в ході аналізу WST-1. Розраховували IC50 у програмному середовищі CalcySyn. Клітини обробляли протягом 24 годин (Фіг. 1A) або клітини обробляли протягом 24, 48 й 72 годин (Фіг. 1B). [0027] На Фіг. 2 A-B показані діаграми індукції апоптозу під дією 5-азацитидин 5'-елаідат у лейкемічних клітинах. На Фіг. 2A клітини HL60, K562 й U937 не піддавалися обробці або оброблялися за допомогою 5-азацитидин 5'-елаідат (CP) (0,5-4 мкм) протягом 24 годин. Відсоток апоптотичних клітин визначали за допомогою флуоресцентного мікроскопа після фарбування за допомогою акридин оранжа й етидіумброміду. На Фіг. 2B як HL60, так і K562 не піддавалися обробці або оброблялися за допомогою 5-азацитидин 5'-елаідат (1, 2 або 4 мкм) протягом 24 годин. Відсоток апоптотичних клітин визначали за допомогою проточної цитометрії із застосуванням фарбування Анексином -V і PI. [0028] На Фіг. 3 показані графіки ефекту обробки 5-азацитидин 5'-елаідатом (CP) на клітинний цикл. Клітини культивували протягом однакового періоду часу перед тим, як аналізувати зміст ДНК за допомогою проточної цитометрії. Чисельні значення на графіку представляють популяцію регульованих клітин, які мають суб- G1 ДНК області. [0029] На Фіг. 4 показані графіки диференціювання, що включають дію 5-азацитидин 5'елаідат й 5-АзаС. K562 і U937 піддавали впливу 5-азацитидин 5'-елаідат (CP) або 5-АзаС (0,125-1 мкм) протягом 14 днів. Після початкової обробки в день 0, клітини піддавали впливу нової порції ліків у день 4, день 7 і день 10. Диференціювання оцінювали за допомогою фарбування NBT (U937) (Фіг. 4A) або бензидином (K562) (Фіг. 4B). [0030] Фіг. 5 являє собою діаграму, що відображає стимульовану ліпополісахаридом (LPS) NFκB люциферазну активність, виміряну в клітинах U937, які піддавали впливу складного ефіру кислоти і Аза-C або 5'-аза-C-5'-елаідік. 5 UA 99836 C2 ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ [0031] Один з аспектів даного винаходу направлений на сполуку відповідно до Формули (I) O RO R1 (I) R2 HO R3 де R - являє собою H, R5C(O); R1 - являє собою NHR4 NHR4 5 N O 10 O N NH N або , [0032] перетинаюча пунктирна лінія зображує зв'язок, що утворився, яка приєднує R1 до молекули Формули (I), R2 і R3 - незалежно являють собою OH або H, за умови що R2 і R3 не є одночасно OH, R4 - являє собою H або R5C(O), за умови що R і R4 не є одночасно H, R5 - являє собою алкеніл C3-C26; або його фармацевтичну сіль. [0033] В конкретному варіанті реалізації R5 може являти алкеніл C9-C26. [0034] У переважному варіанті реалізації R - являє собою R5C(O), R1 - являє собою NHR4 N O 15 N N N N , R2 - являє собою H, R3 - являє собою OH, R4 - являє собою H, і R5 - являє собою CH3-(CH2)7-CH=CH-(CH2)7-. [0035] У більш широкому аспекті даний винахід направлений на сполуку відповідно до Формули (I)´ O RO R1 (I)′ R2 HO R3 де R - являє собою H, R5C(O), R5CH2OC(O) або R5CH2NHC(O), R1 - являє собою 6 UA 99836 C2 NHR4 NHR4 N O 5 20 25 30 35 NH N або , де перетинаюча пунктирна лінія зображує зв'язок, що утворився, який приєднує R1 до молекули Формули (I)´, R 2 і R3 - незалежно являють собою OH або H, за умови що R2 і R3 не є одночасно OH, R4 - являє собою H, R5C(O), R5CH2OC(O) або R5CH2NHC(O), за умови що R і R4 не є одночасно H, і R5 - являє собою алкеніл C3-C26; або його фармацевтичну сіль. [0036] В переважному варіанті реалізації сполуки відповідно до Формули (I)′, k дорівнює 7, а n дорівнює 7. У деяких варіантах реалізації R1 - являє собою NHR4 O 15 O N N 10 N N N N , де перетинаюча пунктирна лінія зображує зв'язок, що утворився, який приєднує R 1 до молекули Формули (I)´. У деяких варіантах реалізації R - являє собою R5C(O), k дорівнює 7, m дорівнює 0, n дорівнює 7, R2 - являє собою H, а R3 - являє собою OH. У деяких варіантах реалізації R5 - являє собою алкеніл C9-C26. [0037] Інший аспект даного винаходу направлений на фармацевтичну композицію, що включає сполуку Формули (I), а також фармацевтичний ексципієнт, розріджувач та/або носій. [0038] Агенти згідно із даним винаходом можна вводити перорально, парентерально, наприклад, підшкірно, внутрівенно, внутрім'язово, інтраперитонеально, шляхом закапування в ніс або за допомогою прикладання до слизових оболонок, наприклад, до слизових носа, горла й бронхіол. Їх можна вводити окремо або ж разом з фармацевтичними носіями, і вони можуть бути у твердій або рідкій формі, наприклад, у формі таблеток, капсул, порошків, розчинів, суспензій або емульсій. [0039] Активні агенти згідно із даним винаходом можна вводити перорально, наприклад, разом з інертним розріджувачем або разом із засвоюваним їстівним носієм, або ж їх можна укласти в капсули, що мають тверду або м'яку оболонку, або їх можна пресувати в таблетки, або їх можна вводити безпосередньо з їжею відповідно до режиму харчування. У випадку перорального терапевтичного введення ці активні речовини можна вводити разом з ексципієнтом і застосовувати у формі таблеток, капсул, еліксирів, суспензій, сиропів тощо. Подібні композиції й препарати повинні містити щонайменше 0,1 % активного агента. Частка агента в цих композиціях може, звичайно, варіюватися і може переважно перебувати в межах від приблизно 2 % до приблизно 60 % від ваги дозованої форми. Кількість діючої речовини в подібних терапевтично застосовних композиціях є такою, щоб складати підходящу дозу. Переважні композиції згідно із даним винаходом готують таким чином, щоб одинична дозована форма для перорального прийому містила від приблизно 1 до 250 мг діючої речовини. [0040] Таблетки, капсули і т.п. можуть містити також зв'язуючу речовину, наприклад трагакантову камедь, гуміарабік, кукурудзяний крохмаль або желатин; ексципієнти, такі як фосфат дикальцію; розпушувач, наприклад кукурудзяний крохмаль, картопляний крохмаль, альгінову кислоту; речовину для змазування, наприклад, стеарат магнію; і підсолоджувач, наприклад, сахарозу, лактозу або сахарин. Якщо одиничною дозованою формою є капсула, то на додаток до вищевказаних типів матеріалів вона може містити рідкий носій, наприклад, жирні олії. 7 UA 99836 C2 5 10 15 20 25 30 35 40 45 50 55 [0041] Як оболонки або для модифікації фізичної форми одиничної дозованої форми можуть бути присутніми багато інших матеріалів. Наприклад, таблетки можуть бути покриті шелаком, цукром або тим та іншим. Сироп може містити, на додаток до активного інгредієнта, сахарозу як підсолоджувач, метил і пропілпарабени як консерванти, барвник та ароматизатор, наприклад, зі смаком вишні або апельсина. [0042] Зазначені активні агенти можна також уводити парентерально. Розчини або суспензії цих активних агентів можна приготувати у воді, відповідним чином змішавши з поверхневоактивною речовиною, такою як гідроксипропілцелюлоза. Суспензії також можуть бути приготовані в гліцерині, рідких пропіленгліколях і також у їх олійних сумішах. Прикладами олій можуть служити олії нафтового, тваринного, рослинного, синтетичного походження, наприклад, арахісова олія, соєва олія або мінеральна олія. У загальному випадку, переважними рідкими носіями, зокрема, у випадку розчинів для ін'єкцій, є вода, сольовий розчин, водний розчин декстрози і родинних цукрів, а також гліцерини, такі як пропіленгліколь або поліетиленгліколь. При звичайних умовах зберігання й застосування такі препарати містять консервант для запобігання росту мікроорганізмів. [0043] Фармацевтичні форми, що підходять для застосування для ін'єкцій, включають стерильні водні розчини або суспензії, а також стерильні порошки для приготування стерильних розчинів або суспензій для ін'єкцій для негайного використання. У всіх випадках форма повинна бути стерильною й мати текучість у такій мірі, щоб її легко можна було вводити шприцом. Вона повинна бути стабільною в умовах виробництва й зберігання і повинна бути захищена від забруднюючої дії мікроорганізмів, таких як бактерії та гриби. Носій може являти собою розчинник або дисперсійне середовище, яке містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь і рідкий поліетиленгліколь), підходящу суміш із цих компонентів або рослинні олії. [0044] Речовини згідно із даним винаходом можна також уводити безпосередньо в дихальні шляхи у формі аерозолю. Для застосування у виді аерозолю речовини згідно із даним винаходом в розчині або суспензії можуть бути упаковані в герметизований аерозольний контейнер разом з підходящими газами-витисниками, наприклад, вуглеводневими газамивитисниками, такими як пропан, бутан або ізобутан, разом з підходящими ад'ювантами. Речовини згідно із даним винаходом можна також вводити в негерметизованій формі, наприклад, за допомогою розпилювача або пульверизатора. [0045] Наступний аспект даного винаходу направлений на спосіб лікування неопластичного синдрому у пацієнта. Даний спосіб включає відбір пацієнта з неопластичним синдромом і введення зазначеному пацієнтові сполуки Формули (I), як описано вище, або її фармацевтичної солі в умовах, ефективних для лікування неопластичного синдрому у пацієнта. [0046] У деяких варіантах реалізації неопластичний синдром являє собою рак. Ракове захворювання може являти собою солідну пухлину або гематологічний рак, або злоякісну пухлину. Ракове захворювання може бути лейкемією, лімфомою, множинною мієломою або мієлодиспластичним синдромом. [0047] У деяких варіантах реалізації солідна пухлина може являти собою рак тканини, наприклад, тканин грудей, яєчника, простати, мозку, сечового міхура і легенів. [0048] Наступний аспект даного винаходу направлений на спосіб лікування запального синдрому у пацієнта. Даний спосіб включає відбір пацієнта із запальним синдромом і введення зазначеному пацієнтові сполуки Формули (I), як описано вище, або її фармацевтичної солі в умовах, ефективних для лікування запального синдрому у пацієнта. [0049] У деяких варіантах реалізації запальний синдром являє запальний стан легенів, сполучної тканини, шлунково-кишкового тракту або судинної системи. [0050] У матеріалах даної заявки, якщо не визначене інше, наукові й технічні терміни, що використовуються у зв'язку з даною заявкою, мають свої звичайні значення, добре відомі середньому фахівцеві в даній галузі техніки. Далі, якщо в контексті не зазначене інше, терміни в однині включають їх множинну форму, і терміни в множині включають їх форму в однині. ПРИКЛАДИ Приклад 1 - реагенти, клітинні лінії й клітинна культура [0051] 5-азацитидин 5'-елаідат (CP або CP-4200) був одержаний від компанії Clavis Pharma AS, реагент для клітинної проліферації WST-1 був одержаний від Roche Applied Science (Манхайм, Німеччина), PI і набір для визначення апоптозу Annexin V-FITC apoptosis kit був замовлений в BD Biosciences, Пало-Альто, CA, 5-азацитидин (5-АзаС), етидіумбромід (EB), акридиновий жовтогарячий (AO), нітросиній тетразолій (NBT), форбол 12-міристат 13-ацетат (TPA) були замовлені в Sigma Chemical Co (Сент-Луїс, MO). 8 UA 99836 C2 5 10 15 20 25 30 35 40 45 50 55 [0052] Лінії людських промієлоцитних лейкемічних клітин HL60, людської гістоцитної лімфоми U937, людської хронічної мієлогенної лейкемії K562, T-клітини лінії Jurkat людини, аденокарциноми молочної залози MCF-7, карциноми сечового міхура 5637, карциноми простати DU-145 були замовлені в American Type Culture Collection. Всі клітинні лінії, за винятком Jurkat, містилися в середовищі RPMI 1640 (Gibco, Глазго, Сполучене Королівство), що включає також 10 % інактивованої нагріванням фетальної сироватки корови (FCS), 100 Од/мл пеніциліну 100 мг/мл стрептоміцину в атмосфері 5 % CO2 при 37 °C. Клітини лінії Jurkat культивували в середовищі RPMI 1640, що включає також 1,5 г/л бікарбонату натрію, 4,5 г/л глюкози, 10 мМ піруват натрію й 10 % FCS, 100 Од/мл пеніциліну і 100 мг/мл стрептоміцину. Приклад 2 - аналіз цитотоксичності [0053] Цитотоксичність ліпіду 5-азацитидину визначали в ході колориметричного аналізу, основаного на розщепленні солі тетразолію WST-1 (4-[3-(4-лодофеніл)-2-(4-нітрофеніл)-2H-5тетразоліо]-1,3-бензолдисульфонат) мітохондріальними дегідрогеназами в життєздатних 6 5 клітинах. Клітини висівали при вихідній концентрації 1 × 10 /мл (клітини HL60) або 1,25 × 10 /мл (U937, K562 й Jurkat) у середовищі, що не містить або містить різні концентрації ліпіду 5азацитидину в 96-лункових плоскодонних мікропланшетах і культивували протягом від 24 до 72 4 годин. Клітини MCF-7, DU-145 і 5637 (1 × 10 /мл) висівали в чашки й залишали для адгезії та росту на 24 години. Додавали різні концентрації ліпіду 5-азацитидину, після чого культури підтримували ще протягом від 24 до 72 годин. Культури інкубували з реагентом WST-1 протягом 1 години. Утворення формазану вимірювали за допомогою рідера мікропланшетів (Bio-Tek Instruments, Elx 800) при 450 нм із довжиною хвилі порівняння 650 нм. Інгібування росту визначали шляхом порівняння з неопрацьованими клітинами (%). Значення IC50 визначали за допомогою програми CalcuSyn (Biosoft). Приклад 3 - Кількісна оцінка апоптотичних клітин [0054] Апоптотичні клітини визначали за допомогою морфологічних критеріїв і флуоресцентно-активованого клітинного сортінгу після фарбування Анексином V-FITC. Для морфологічного аналізу додавали 1 мкл готового розчину, який містить 100 мкг/мл AO і 100 мкг/мл EB до 25 мкл клітинної суспензії. Апоптотичні клітини і апоптотичні тільця аналізували за допомогою флуоресцентної мікроскопії. Відсоток апоптотичних клітин визначали після того, як 5 нараховували загальне число всіх клітин, яке дорівнює 300. Для аналізу FACS, від 2 × 10 до 5 × 6 10 клітин промивали за допомогою PBS, а потім мітили за допомогою Анексину V-FICS і пропідіумйодиду (PI) у зв'язуючому середовище реагенті, відповідно до інструкцій, прикладених виробником до набору для визначення апоптозу Annexin V-FITC apoptosis detection kit. Флуоресцентні сигнали FITC і PI детектували, відповідно, при 518 нм і 620 нм на FACSCAN (Becton Dickinson, Сан-Хосе, Каліфорнія). Запис значень флуоресценції Анексину V-FITC відображався на осі X, а запис значень флуоресценції PI відображався на осі Y. Дані обробляли за допомогою програми CellQuest (Becton Dickinson). Для кожного аналізу був зроблений запис 10000 клітинних результатів. Приклад 4 - Клітинний Цикл [0055] Клітини осаджували в ході центрифугування й промивали двічі за допомогою PBS, фіксували за допомогою 70 % (об'єм/об'єм) холодного спирту (-20 °C) і зберігали при 4 °C протягом щонайменше 24 годин. Клітини промивали за допомогою PBS. Згусток клітин фарбували за допомогою розчину для фарбування PI/RNase. Клітинну суспензію інкубували в темряві при кімнатній температурі протягом 30 хв. Вміст ДНК визначали за допомогою проточної цитометрії FACSCalibur (Becton Dickinson, Mount View, CA). Процентний вміст клітин у стадіях Sub-G1, G1, S й G2/M клітинного циклу визначали за допомогою програми, що вичерчує діаграми ДНК (Becton Dickinson). Записували мінімум 10 000 подій на зразок. Приклад 5 - Синтез складного ефіру Аза-C-5’-олеїнової кислоти [0056] Олеїнову кислоту (1,77 ммоль, 500 мг) розчиняли в толуолі (3 мл). Додавали спочатку DMF (10 мкл), а потім оксалілхлорид (3,6 ммоль, 457 мг) протягом 10 хв. при кімнатній температурі. Через 3 години видаляли толуол in vacuo. [0057] Аза-C (1,75 ммоль, 427 мг) суспендували в DMA (6 мл), додавали HCl (1 M в Et 2O, 2,0 ммоль, 2,0 мл), і через 5 хв. при кімнатній температурі видаляли Et 2O in vacuo. Одержуваний мутний розчин охолоджували на водно-крижаній бані, і додавали хлорид кислоти, розчинений в DMA (2 мл), протягом 2 год. Реакційну суміш перемішували протягом ночі, поки температура не досягала повільно кімнатної температури, а потім її нагрівали при 30 °C протягом 2 год. Після охолодження до кімнатної температури реакційну суміш ділили між насиченим водним NaHCO 3 і EtOAc (25 мл кожного). Водну фазу екстрагували за допомогою додаткових 3 × 25 мл EtOAc. Органічні фази поєднували, промивали за допомогою соляного розчину і сушили (MgSO 4). Після 9 UA 99836 C2 5 10 15 20 видалення розчинників in vacuo, неочищений олійний продукт очищали за допомогою флешхроматографії (Si2, CH2Cl2 з 2,5, 5 й 10 % MeOH). Вихід: 110 мг (13 %). Приклад 6 - синтез складного ефіру 5-азацитидин 5’-елаідинової кислоти [0058] 5-азацитидин (4,1 ммоль, 1,00 г) суспендували в сухому DMA (15 мл), і повільно додавали розчин HCl у діетиловому ефірі (4,9 ммоль, 1 M, 4,9 мл) при кімнатній температурі, з утворенням прозорого розчину. Ефір далі видаляли in vacuo, що призводило до утворення трохи мутного розчину. Розчин елаідилхлориду (4,8 ммоль, 1,44 г) у сухому DMA (8 мл) додавали протягом 1 год. при кімнатній температурі. Реакційну суміш далі нагрівали протягом ночі при 30 °C, охолоджували до кімнатної температури й гасили за допомогою метанолу (0,05 мл). Після закінчення щонайменше 1 год., реакційну суміш концентрували при ca. 10-2 мбар, а залишок ділили між насиченим водним NaHCO 3 і етилацетатом. Водну фазу екстрагували етилацетатом. Органічні фази далі поєднували, промивали (сольовим розчином), сушили (Na2SO4) і концентрували in vacuo. Після очищення за допомогою флеш-хроматографії (Si2, CH2Cl2 з 0-10 % метанолом) було одержано 0,9 г (43 %) продукту. Приклад 7 - In Vitro Ефект 5-азацитидин 5’-елаідату на пухлинні клітини [0059] Порівнювали цитотоксичну активність 5-азацитидин 5'-елаідату і 5-АзаС стосовно ліній лейкемічних клітин та клітин солідних пухлин. У порівнянні з 5-АзаС, цитотоксичний ефект 5-азацитидин 5'-елаідату був вище у всіх вивчених клітинних лініях. У порівнянні із солідними пухлинами, лейкемічні клітинні лінії були більш чутливі як до 5-азацитидин 5'-елаідату (CP), так і до 5-АзаС, див. Табл. 2 (нижче) і Фіг. 1A-B. Таблиця 2 Порівняльна цитотоксична активність 5-азацитидин 5'-елаідату (CP) і 5-АзаС стосовно ліній лейкемічних клітин і клітин солідних пухлин. (Значення IC50). Клітини обробляли протягом 24, 48 й 72 годин, і визначали цитотоксичність у ході аналізу WST-1. IC50 розраховували за допомогою програми CalcuSyn. U937 CP 5-АзаС 0,44 1,63 48 годин (мкМ) 0,60 2,37 K562 CP 5-АзаС 1,26 8,27 0,92 15,51 0,42 5,83 HL60 CP 5-АзаС 3,19 7,28 3,60 4,92 2,68 4,71 Jurkat CP 5-АзаС 1,19 9,5 0,88 5,32 0,84 4,77 MCF-7 CP 5-АзаС 19,1 >160 9,32 93,7 9,99 53,00 DU145 CP 5-АзаС 6,79 20,94 6,31 7,11 5,88 7,20 5637 CP 5-АзаС 9,39 24,56 5,95 6,72 3,52 5,21 24 години (мкМ) 25 30 72 години (мкМ) 0,87 4,77 Разючим результатом є ранній прояв активності у випадку 5-азацитидин 5'-елаідату, чого не спостерігалося для азацитидину. Приклад 8 - Індукція Апоптозу в Лейкемічних Клітинах [0060] Клітини HL60, K562 і U937 не обробляли або обробляли 5-азацитидин 5'-елаідатом (0,5-4 мкм) протягом 24 годин. Процентний вміст апоптотичних клітин визначали за допомогою флуоресцентного мікроскопа після фарбування за допомогою акридинового жовтогарячого і етидіумброміду (див. Фіг. 2A). В іншій серії експериментів HL60 і K562 не обробляли або 10 UA 99836 C2 5 10 15 обробляли 5-азацитидин 5'-елаідатом (1, 2 або 4 мкМ) протягом 24 годин. Процентний вміст апоптотичних клітин визначали за допомогою проточної цитометрії із застосуванням фарбування Анексином-V і PI. Обидва способи продемонстрували, що 5-азацитидин 5'-елаідат індукував концентраційно-залежне збільшення числа апоптотичних клітин (См. Фіг. 2A й 2B) Приклад 9 - Протікання Клітинного Циклу [0061] Вивчали ефект від впливу 5-азацитидин 5'-елаідату на клітинний цикл. Клітини культивували протягом зазначеного періоду часу, після чого їх аналізували на склад ДНК за допомогою проточної цитометрії. Чисельні значення на графіку представляють популяцію клітин, що дають сигнал вище граничного значення із вмістом суб-G1 ДНК. Найбільш значні зміни спостерігалися через 24 години обробки. У порівнянні з контролем (8,3 %), процентний вміст у Суб-G1 фазі (апоптотичні клітини) зростав аж до 33,6 % у клітинах, оброблених 2 мкМ 5азацитидин 5'-елаідатом, і зменшувалося в G1, S й G2/M фазі. Результати узагальнені на Фіг. 3 та у Табл. 3, нижче. Ці результати підтвердили індукцію апоптозу під дією 5-азацитидин 5'елаідату і продемонстрували, що дія 5-азацитидин 5'-елаідату на клітинний цикл мала концентраційно-залежний характер. Таблиця 3. Процентний вміст клітин. Таблиця 3 Ефект від впливу 5-азацитидина 5'-елаідату (CP) на клітинний цикл. Клітини культивували протягом зазначеного періоду часу, після чого їх аналізували на склад ДНК за допомогою проточної цитометрії. Зазначені числа являють процентне відношення клітин у різних фазах. 24 години 1 2 3 4 48 годин 1 2 3 4 72 години 1 2 3 4 20 25 30 35 Доза (мкМ) 0 0,5 1 2 Sub G1 8,26 9,41 21,02 33,59 G1 38,61 43,66 36,17 23,45 S 33,35 28,15 18,98 9,14 G2/M 12,7 11,05 8,82 2,64 контроль cp 0 0,5 1 2 4,8 15,14 14,34 24,34 41,1 34,79 28,07 22,51 31,14 42,96 30,06 15,62 18,34 2,53 17,91 7,78 контроль cp 0 0,5 1 2 9,28 10,88 10,54 10,75 47,72 40,14 38,72 40,67 27,39 28,13 29,18 28,77 14,64 18,25 18,82 18,26 контроль cp Приклад 10 - Індукція Диференціювання [0062] Вивчали диференціацію на основі морфології. Оскільки одиночний вплив (96 годин) не мав ефекту, клітини піддавалися впливу 5-азацитидин 5'-елаідату або 5-АзаС протягом 11 (клітини HL60) або 14 (клітини U937 s K562) днів. Після початкової обробки в день 0, клітини піддавалися впливу нових порцій ліків на день 4, 7 і 10. Диференціацію оцінювали за допомогою дослідження зміни нітросинього тетразолію (U937 і HL60) або за допомогою фарбування бензидином (K562). Незважаючи на те, що 5-азацитидин 5'-елаідат був дещо більш ефективний, обидва реагенти не викликали істотної диференціації. Див. Фіг. 4A-B. Приклад 11 - Метаболічна Стабільність Складного Ефіру 5-Аза-5'-Елаідинової Кислоти В Пулі Людської Плазми [0063] Складний ефір 5-Аза-C-5’-елаідинової кислоти поміщали в пуловану людську плазму при п'яти рівнях концентрації (0,1; 1; 3; 10; і 30 мкМ, відповідно). Суміш інкубували на водяній бані із шейкером при 37 °C. Відбиралися потрійні (n=3) аліквоти (100 мкл) інкубуючого розчину через відповідні періоди інкубації (0, 15, 30, 60 й 120 хвилин), і негайно осаджували плазмений білок за допомогою ацетонітрилу, який містить 0,1 % мурашину кислоту (300 мкл). Негативні контролі готували із тестуємою сполукою і Аза-C у буфері для аналізу (PBS, pН 7,4) при одній концентрації інкубації (1 мкМ). Після центрифугування супернатант безпосередньо вводили для аналізу LC-MS-MS. Див. Табл. 4. Таблиця 4. 11 UA 99836 C2 Таблиця 4 Метаболічна стабільність складного ефіру 5-Аза-5'-елаідинової кислоти в пулі людської плазми % що залишився від вихідного (середнє ± ст. від., n=3) Концентрація (мкМ) 10 15 15 min 30 min 60 min 120 min 0,1 1 3 10 30 5 0 min 100 100 100 100 100 95,8±3,0 93,3±1,1 99,0±3,5 96,0±2,0 97,7±3,5 95,0±2,0 88,9±1,1 96,0±3,0 93,1±0,0 90,4±2,6 92,1±3,4 79,8±2,6 85,4±3,4 77,1±3,1 78,5±1,7 59,0±1,6 52,5±3,1 56,6±1,6 39,1±1,7 47,4±1,1 Час напівжиття (min) 161 130 141 86 109 Приклад 12 - Цитотоксичність Аза-C s 5-Аза-C-5'-Елаідинової кислоти [0064] Цитотоксичність Аза-C і 5-Аза-C-5’-елаідинової кислоти визначали в лінії ракових клітин молочної залози MT-3 в адріабластин-резистентній лінії клітин MT-3/ADR. Для MT-3/ADR характерна надлишкова експресія MDR-1/p-глікопротеїну. Клітини висівали на 96-лункових 3 планшетах по 5 × 10 клітин на лунку, у середовищі RPMI 1640 з 2 мМ глутаміном й 10 % FBS. Клітини інкубували протягом 24 годин. Досліджувані сполуки розчиняли в ДМСО і далі розводили середовищем безпосередньо перед використанням. Для аналізу однієї концентрації використовували шість лунок. Клітини інкубували з досліджуваною сполукою протягом 24 годин. Додавали по 20 мкл свіжоприготованого розчину MTT у кожну лунку та інкубували 4 години. Величини IC50 визначали з кривих росту, представлених графічно на основі 8 різних концентрацій у діапазоні від 0,01мкМ до 100 мкМ. Результати представлені в Табл. 5. Однакові активності були одержані для Аза-C і 5-аза-C-5'-елаідинової кислоти на лінії ракових клітин молочної залози MT-3, але у випадку резистентної лінії клітин MT-3/ADR активність Аза-C зникала. Активність не спостерігалася в тестованому інтервалі концентрацій аж до 100 мкМ, у той час як 5-аза-C-5'-елаідинова кислота була активна з однаковим значенням IC50 як у резистентній лінії клітин, так і у нерезистентній лінії MT-3. Це може бути дуже важливим у лікуванні резистентного раку. Див. Табл. 5. 20 Таблиця 5 Цитотоксичний ефект 5-Аза-C і 5-Аза-C-5’-елаідинової кислоти на лінії клітин карциноми молочної залози MT-3, що мають або не мають мультилікарську резистентність. Аза-C IC50 (мкМ) MT-3 карцинома молочної залози MT-3/ADR резистентна карцинома молочної залози 25 30 35 5-Аза-C-5'-елаідинова кислота IC50(мкМ) 12,62±2,35 17,03±15,75 >100 14,82±12,76 Приклад 13 - Вплив Інгібування Нуклеозидного Переносника Аза-C і 5-Аза-C-5'-Елаідинової кислоти [0065] Оцінювали вплив інгібування нуклеозидного переносника на цитотоксичну активність у мутантних клітинах карциноми шийки матки Hela для 5-Аза-C і 5-Аза-C-5’-елаідинової кислоти. Використовували дипіридамол як інгібітор врівноважуючих (equilibrative) нуклеозидних переносників hENT1 і hENT2. Клітини висівали на 96-лункових планшетах по 5 × 103 клітин на лунку, у середовищі RPMI 1640 з 2 мМ глутаміном і 10 % FBS. Клітини преінкубували протягом 24 годин. Додавали дипіридамол (10 мкМ) до клітин за 30 хвилин перед додаванням досліджуваних сполук. Досліджувані сполуки розчиняли в ДМСО і далі розводили середовищем безпосередньо перед використанням. Для аналізу однієї концентрації використовували шість лунок. Клітини інкубували з досліджуваною сполукою протягом 72 годин. Додавали по 20 мкл свіжоприготованого розчину MTT у кожну лунку та інкубували 4 години. Величини IC50 визначали із кривих росту, представлених графічно на основі 8 різних концентрацій у діапазоні від 0,01 мкМ до 100 мкМ. Результати представлені в Табл. 6. Активність Аза-C знизилася у 3 рази в результаті додавання інгібітору нуклеозидного транспорту дипіридамолу, вказуючи на те, 12 UA 99836 C2 5 що приплив й відтік Аза-C частково залежать від нуклеозидних переносників hENT1 і hENT2. Цитотоксична активність 5-Аза-C-5'-елаідинової кислоти не тільки збереглася, але й зросла в 50 разів, коли нуклеозидні переносники hENT1 й hENT2 були блоковані за допомогою дипіридамолу. Збільшення активності в клітинах, де нуклеозидні переносники блоковані за допомогою дипіридамолу, є несподіваним і може означати ще більшу активність у пацієнтів з резистентністю до терапії, викликаної дефіцитом нуклеозидних переносників. Див. Табл. 6. Таблиця 6 Цитотоксична активність 5-Аза-C й 5-Аза-C-5’-елаідинової кислоти в мутантних клітинах карциноми шийки матки Hela з додаванням (або без нього) інгібітору нуклеозидного транспорту. Азацитидин Hela Hela з дипіридамолом 10 15 20 25 30 35 40 45 IC50 (мкМ) 4,32 12,77 5-Аза-C-5'-елаідинова кислота IC50 (мкМ) 12,00 0,23 Таблиця 6. Приклад 14 - Активація Ядерного Фактора Транскрипції -κB (NFκB) [0066] Визначали активацію ядерного фактора транскрипції -κB (NFκB) для оцінки впливу на запалення. NFκB бере участь у регуляції великого числа як імунних, так і запальних реакцій, процесів розвитку, клітинного росту і апоптозу. [0067] Використовували гени-репортери NFκB-люциферази для визначення впливу 5-Аза-C і 5-Аза-C-5'-елаідинової кислоти на NFκB-індуковану люциферазну активність у лінії клітин моноцитів людини U937, стійко трансфекованих репортером люциферази, який містить три NFκB-зв'язуючих сайти. Індукцію NFκB проводили із застосуванням ліпополісахарида (LPS) з концентрацією 1 мкг/мл протягом 30 хвилин перед додаванням до середовища 5-Аза-C або 5Аза-C-5'-елаідинової кислоти в концентрації 10 нМ. Клітини культивували в середовищі RPMI1640, яке містить 10 % фетальну сироватку корови. Перед стимуляцією за допомогою LPS клітини переносили в середовище, що містить тільки 2 % фетальну сироватку корови. Люциферазну активність вимірювали за допомогою відображення в Системі відображення IVIS (imaging System) 100 (Xenogen Corp., USA) через 1,3 або 6 годин. LPS-стимуляція зростала згодом протягом 6 годин, що спостерігалося для контрольних клітин, оброблених DMSO. Вплив 10 нМ Аза-C ще більше збільшувало LPS-індуковану активацію NFκB, у порівнянні з обробленим DMSO контролем. 5-Аза-C-5'-елаідат не відрізнявся від контролю DMSO у плані LPS-стимульованої активності NFκB. Як правило, позитивна стимуляція NFκB, що спостерігалася для азацитидину, не є позитивною, але добре, що стимуляція LPS не зростає далі під впливом 5-Аза-C-5'-елаідинової кислоти. Див. Фіг. 5. Приклад 15 - Експресія Гена Рецептора Естрогену β (ERβ) в лінії ракових клітин молочної залози після обробки за допомогою Азацитидину або 5-Азацитидин 5'-елаідату [0068] Експресію гена (визначену за рівнем РНК) рецептора естрогену бета визначали за допомогою кількісної ПЛР у реальному часі (TaqMan). Клітини карциноми молочної залози MCF7 вирощували в середовищі з нестачею естрогену (не містить фенолове червоне середовище RPMI з 2 % глутаміном і 10 % фетальною сироваткою корови, обробленою навантаженим 2 декстраном вугільним пилом). Клітини висівали в колбі 25 см і залишали для адгезії на 24 години перед обробкою за допомогою 1 мкМ азацитидину або 5-Азацитидин 5’-елаідату. Один необроблений зразок був включений як контроль. Клітини були зібрані через 5 днів від початку впливу сполук; їх збирали шляхом трипсинізації, промивали й піддавали ударному заморожуванню в рідкому азоті. 6 [0069] Загальну РНК екстрагували з приблизно 10 клітин MCF-7, які піддавали ударному заморожуванню. Визначали концентрацію й чистоту РНК, і транскрибували РНК у кДНК за допомогою реагентів зворотної транскрипції (N808-0234). Проводили кількісну оцінку в реальному часі за стандартними протоколами з використанням стандартних заздалегідь перемішаних реагентів для ПЛР. Суміші праймер-зонд, ER β (ID Hs00230957_m1) і гідроксиметилбілан-синтазу гену "домашнього господарства" HMBS (ID Hs00609297_m1) замовляли в Applied Biosystems. Генну експресію розраховували за допомогою порівняльного дельта-дельта Ct методу. Індукція експресії ER β була 5,26-кратною після впливу 5-Азацитидин 5'-елаідату, у порівнянні лише з 2,51-кратною після впливу азацитидину. Див. Табл. 7. Це може 13 UA 99836 C2 бути дуже істотним для гормон-рефракторної пухлини, при якій можна відновити чутливість до гормону. Див. Табл. 7. Таблиця 7 Дельта Дельта x-кратна індукція гена ERβ 7,06 -2,40 5,26 8,13 -1,32 2,51 Ct ER β дельта 35,36 25,91 9,45 32,97 25,92 34,31 Необроблені 1 мкМ 5’Аза-C-5’елаідинова 1 мкМ аза-C Ct HMBS 26,18 5 [0070] Незважаючи на те, що в даній заявці наведені й детально обговорюються переважні варіанти реалізації, для фахівця в даній галузі техніки очевидно, що можливі різні модифікації, доповнення, заміни і т.п. також знаходяться у рамках даного винаходу, охарактеризованого в пунктах нижченаведеної формули винаходу. 10 ФОРМУЛА ВИНАХОДУ 1. Сполука Формули (І) O RO R1 R2 HO R3 15 , (I) де R являє собою Н або R5C(O); R1 являє собою NHR4 N O 20 25 NHR4 N N O N NH N або , де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І); R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН; R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і R5 являє собою С3-С26алкеніл, або фармацевтична сіль зазначеної сполуки. 2. Сполука за п. 1, де R5 являє собою С9-С26алкеніл. 3. Сполука за п. 1, де R являє собою R5C(O), R1 являє собою NHR4 N O 30 N N , R2 являє собою Н, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН(СН2)7-. 4. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтичний наповнювач, розріджувач та/або носій. 5. Спосіб лікування неопластичного стану в пацієнта, що включає: відбір пацієнта з неопластичним станом і 14 UA 99836 C2 введення зазначеному пацієнтові сполуки формули: O RO R1 R2 HO R3 5 , (I) де R являє собою Н або R5C(O); R1 являє собою NHR4 N O 10 15 20 NHR4 N N O N NH N або , де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І); R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН; R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і R5 являє собою С3-С26алкеніл, або фармацевтичної солі зазначеної сполуки в умовах, ефективних для лікування зазначеного неопластичного стану в пацієнта. 6. Спосіб за п. 5, де R5 являє собою С9-С26алкеніл. 7. Спосіб за п. 5, де зазначений неопластичний стан являє собою ракове захворювання. 8. Спосіб за п. 7, де ракове захворювання являє собою солідну пухлину або гематологічний рак, або злоякісне утворення. 9. Спосіб за п. 7, де зазначене ракове захворювання являє собою лейкемію, лімфому, множинну лімфому або мієлодиспластичний синдром. 10. Спосіб за п. 8, де солідна пухлина являє собою рак тканини, вибраної із групи тканин, що складається з: тканини молочної залози, яєчника, простати, мозку, сечового міхура й легенів. 11. Спосіб за п. 7, де R являє собою R5C(O), R1 являє собою NHR4 N O 25 N N , R2 являє собою Н, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН(СН2)7-. 12. Спосіб лікування запального стану у пацієнта, що включає: відбір пацієнта із запальним станом і введення зазначеному пацієнтові сполуки формули: O RO R1 R2 HO R3 30 , (I) де R являє собою Н або R5C(O); R1 являє собою 15 UA 99836 C2 NHR4 N O 5 10 NHR4 N N O N NH N або , де перетинаюча пунктирна лінія означає зв'язок, що утворився, який приєднує R1 до молекули Формули (І); R2 і R3 незалежно являють собою ОН або Н, за умови, що R2 і R3 не є одночасно ОН; R4 являє собою Н або R5C(O), за умови, що R і R4 не є одночасно Н; і R5 являє собою С3-С26алкеніл, або фармацевтичної солі зазначеної сполуки в умовах, ефективних для лікування зазначеного запального стану. 13. Спосіб за п. 12, де R5 являє собою С9-С26алкеніл. 14. Спосіб за п. 12, де зазначений запальний стан представляє запальний стан легенів, сполучної тканини, шлунково-кишкового тракту або судинної системи. 15. Спосіб за п. 12, де R являє собою R5C(O), R1 являє собою NHR4 N O 15 N N , R2 являє собою H, R3 являє собою ОН, R4 являє собою Н, і R5 являє собою СН3-(СН2)7-СН=СН(СН2)7-. 16 UA 99836 C2 17 UA 99836 C2 18 UA 99836 C2 19 UA 99836 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюAzacytidine analogue and using thereof
Автори англійськоюSilverman, Lewis, Holland, James
Назва патенту російськоюАналоги азацитидина и их применение
Автори російськоюСилверман Льюис, Холланд Джеймс
МПК / Мітки
МПК: A01N 43/04
Мітки: застосування, аналоги, азацитидину
Код посилання
<a href="https://ua.patents.su/22-99836-analogi-azacitidinu-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Аналоги азацитидину та їх застосування</a>
Попередній патент: Спосіб виготовлення накопичувачів електричної енергії і пристрій для його здійснення
Наступний патент: Похідні n-(піразол-3-іл)-бензаміду як активатори глюкокінази
Випадковий патент: Спосіб прогнозування ускладнень перебігу вагітності та пологів у жінок із безсимптомними та стертими формами нbv-інфекції












